aislamiento y diagnostico de campylobacter fe`tus ssp
Anuncio

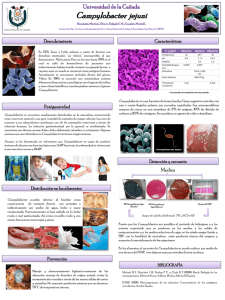
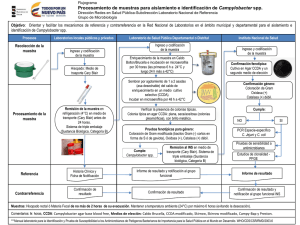
Rev. Méd. Hosp. Nal. Niños Costa Rica 18 (1): 1 - AISLAMIENTO Y DIAGNOSTICO DE CAMPYLOBACTER FETU~ 19,1983. SSP JEJUNI Dr. Francisco Hernández*, Dra. Patricia Rivera** Dr. Marco L. Herrera** y Dra. Rosa Rodríguez** INTRODUCCION El género CIDllP'y1obacter se ubica taxonómicamente en la familia §p-irillaceae y está subdividido en tres especies: ~ fecalis, ~ fetus y C.Jp-utorum, con cinco subespe· cies (Cuadro 1). Unicamente las subespecies C. fetus intestinalis y ~ fetus j~~ se han incriminado con infecciones en humanos. La primera se asocia con septicemias y la segunda con diarreas y esporádicamente también con septicemias (16). Posiblemente la primera infección en humanos causada por c..ww>ylQbacter fue descrita en 1913 (6). Sübsecuentemente se informó de otros casos de septicemias cau· sadas por ese agente, que era conocido entonces como Vibrio fetus y el cuadro clínico que provocaba se denominó "vibriosis". Entre 1944 y 1967 se habían descrito 20 casos de vibriosis, en los cuales el agente se había aislado en hemocultivos (8,20 32 Y 33). No obstante, esta bacteria era más importante en medicina veterinaria que en humana, ya que causante de abortos y septicemias en bovinos (17). Sin em· bargo, el interés médico por este agente aumentó progresivamente a partir de 1972, cuando se informó por primera vez del aislamiento de esta bacteria a partir de heces provenientes de pacientes con diarrea (9). Actualmente el C,fetus ssp_~j~juni es uno de los principales agentes bacterianos causantes de diarrea (10). Los primeros aislamientos fecales se hicieron inoculando los medios de cultivo con filtrados de heces, que se hacían a través de filtros Millipore con porosidad de 0,65 um de diámetro, los cuales retenían gran parte de la flora fecal y permitían el paso del Campylobacter, de manera que se eliminaban microorganismos que posiblemen· te inhibían su crecimiento por competición (9). Posteriormente se simplificaron los métodos para el aislamiento de este agente, cuando se desarrollaron medios de cultivo selectivos a base de antibióticos, como el descrito por Bützler (5) y el de Skirrow (26), los que permiten el aislamiento de la bacteria directamente a partir de heces. En este informe se describen los métodos bacteriológicos, medios de cultivo e implementos de laboratorio necesarios para el aislamiento e identificación del CAmp.Y.:. lobacter fetus ssp j~juni. El objetivo ha sido recopilar la información mínima nec\:· saria, para establecer la metodología de trabajo, tendiente a diagnosticar rutinaria· mente este agente. AISLAMIENTO MEDIOS DE CULTIVO: la Organización Mundial de la Salud recomienda el medio de Bützler, como el más apropiado para el aislamiento del Campv.lobacter (36). Este medio tiene una base * Unidad de Microscopía Electrónica, Universidad de Costa Rica. San José, Costa Rica. ** Hospital Nacional de Niños "Dr. Carlos Sáenz Herrera" San José, Costa Rica. 1 2 REVISTA MEDICA HOSPITAL NACIONAL DE NIl'lOS DR. CARLOS SAENZ HERRERA de tioglicolato y se le adiciona agar el 1,5 % , sangre de carnero o humana en un 5 a 10 % , extracto de levadura en 1 % Y las siguientes cantidades de antibióticos por litro: bacitracina 250 mg, novobiocina 5 mg. antidiona 50 mg, colicistina 10.000 UI y cefoxitina 15 mg (36). Unicamente el aislamiento primario de Campyloba~ requiere el empleo de medios selectivos, ya que posteriormente puede cultivarse en medios como agar sangre o tioglicolato. Para el aislamiento primario las heces se inoculan directamente sobre el medio de Bützler, esparciéndolas con asa bacteriológica para aislar colonias. En el Laboratorio Clínico del Hospital Nacional de Niños (HNNl, uno de los autores (MLH) ha logrado buena recuperación del Campylobacter a partir de tubos con tetrationato·iodo (15) siguiendo la metodolOQT'a empleada en el aislamiento de enterobacterias. Los tubos con tetrationato se inoculan con una torunda impregnada en heces y se incuban a 37 oC durante 24 horas. Luego se homogenizan y se saca una asada que se raya en un plato de agar Bützler, tal como se hace con un<l muestra de heces. Hasta el momento este método ha permitido el aislamiento del 95,5 % de las cepas con respecto a la inoculación directa de las heces en Bützler, incluso en algunas ocasiones la bacteria sólo se aisló del tetrationato. CONDICIONES DE CULTIVO: El ~ fetus ssp j~juni es capaz de crecer a temperaturas entre 37 y 42 oC, sin embargo, la temperatura recomendada para su aislamiento es de 42 OC, ya que inhibe a otras bacterias y a la vez permite diferenciarla de ~ fetus intestinalis que sólo crece a 37°C (Cuadro 2) (16). La atmósfera de incubación debe ser microaerofílica que contenga aproximadamente 90-95 % de mezcla de nitrógeno - anhidrido carbónico y un 5 a 10 % de oxígeno (7, 16, 18,27). Esta condición puede lograrse con un sobre generador tipo "Gas Pack" en una jarra de anaerobiosis sín catalizador. O bien, de una manera más económica empleando el sistema de evacuación y reemplazo, que consiste en ex· traer el aire de una jarra de anaerobiosis con válvula (tipo BBL 60465), mediante una bomba de vacio, hasta alcanzar una presión de 8 torro Luego la atmósfera de la jarra se reemplaza por una mezcla de N 2- CO2 , hasta recuperar la presión normal. Esta mezcla de gases también se utiliza cuando la bacteria se inocula en tubos, tal como se ilustra en la Figura 1 (16). Cuando se requieren almacenar cepas de Campylobacter, éstas se inoculan en tubos con tioglicolato-agar al 0,16 % en microaerobiosis, se incuban a 37 oC durante 24 horas y luego se guardan a ·70 OC. Cuando se van a reutilizar se descongelan lenta· mente a temperatura ambiente y se rayan en platos de agar sangre para evaluar la pureza del cultivo. MORFOLOGIA DE LA COLONIA: Es posible distinguir dos tipos morfológicos de colonias de acuerdo con el grado de humedad de los medios de cultivo (4). Así, en medios frescos (húmedos) las colonías son no hemolíticas, planas, con bordes irregulares, de color blanco grisáceo y superficie brillante, que se esparcen siguiendo las estrías del asa, llegando a hacerse confluentes. Las colonias separadas semejan gotas de agua derramadas sobre la superficie del agar (Figura 2a). Hernández, F. et al: AISLAMIENTO Y DIAGNOSTICO DE CAMPYLOBACTER 3 En medios secos, por ejemplo cuando se incuban a 37 OC durante 48 horas antes de inocularlos, las colonias son: no hemolíticas, convexas, con borde liso de color blanco grisáceo y superficie brillante (Figura 2b). Además, es posible encontrar tipos de colonias intermedios entre los descritos anteriormente. IDENTlFICACION: El primer paso en la identificación de las posibles cepas de Campylobacter es la tinción de Gram; sin embargo, esta bacteria no se tiñe bien con la safranina, por la que ésta se sustituye por fucsina fenicada. Con esta tinción se observan bacilos pequeños, curvados en forma de C o de S, monotricos bipolares (Figura 3). En segundo término se estudia la movilidad de la bacteria en gota pendiente, usando caldo de tripticasa; este agente presenta un movimiento característico, muy rápido en forma de dardo. También, en algunas ocasiones las bacterias pueden quedar ancladas por uno de sus flagelos, presentando entonces un movimiento de rotación muy rápido. Estas observaciones pueden hacerse al microscopio de campo claro, pero se facilitan cuando se emplea un microscopio de·contraste de fase o de campo oscuro. En tercer lugar, deben realizarse las pruebas de oxidasa y cata lasa, ya que las tres especies son oxidasa positivas y con excepción de ~. 1P.utorum las otras son catalasa positivas. La identificación de C. fetus. ssp jgjuni puede confirmarse por otras pruebas, por ejemplo: no reduce nitratos, es capaz de crecer en soluciones tanto de glicina como de bilis al 1 %, pero no en NaCI al 3 % Y es H 2S negativo. Además, crece a tempe· raturas entre 35 y 42 oC, es sensible al ácido nalidíxico (30 ug/disco) y es resistente a la cefalotina (30 ug/disco). Estas pruebas sencillas permiten diferenciar el género Campylobacter hasta subespecie, como se resume en el Cuadro 2. También es posible hacer un diagnóstico presuntivo, mediante un frotis de heces teñido con Giensa o Gram, en el que se buscan bacterias morfológicamente similares al Campylobacter, o bien, examinando las heces en un microscopio de campo oscuro en busca de bacterias con movimiento característico en dardo. Se ha informado que este diagnóstico presuntivo suele confirmarse con el cultivo en el 57% de los casos (22). SUSCEPTIBILIDAD A LOS ANTIMICROBIANOS y TRATAMIENTO Las pruebas de susceptibilidad a los antimicrobianos pueden realizarse por el método de dilución en agar, como se describe a continuación: para la preparación del inóculo se cultiva la bacteria en tioglicolato con agar al 0,16 % Y se incuba a 37 Oc en microaerobiosis, durante 12 a 24 horas hasta lograr una turbidez semejante a la del tubo No. 2 del nefelómetro de McFarland. De estos cultivos se hace una dilución 1:100 en amortiguador de fosfatos el pH 7,4 Y se inoculan alícuotas de 50 ul en los platos con las diluciones del antibiótico e incuban a 37 OC, durante 48 horas. El medio base para las diluciones del antibiótico es tioglicolato complementado con agar al 1,5 %, sangre humana al 10 %, extracto de levadura al 1 % (Figura 4). Empleando esta metodología se encontró en el HNN que las condiciones mínimas inhibitorias para eritromicina y gentamicina eran de 1,6 ug/ml y para ampicilina 1,2 ug/ml. A pesar de que un 10% de las cepas fueron resistentes a la eritromicina 4 REVISTA MEDICA HOSPITAL NACIONAL DE NIÑOS DR. CARLOS SAEN2 HERRERA y ninguna a la gentamicina, el primer antibiótico se sigue recomendando como tra- tamiento de elección, en tanto la gentamicina, debido a su alta toxicidad se deja para casos más graves, como por ejemplo las septicemias causadas por CampyJobacter. El tratamiento que se recomienda en las diarreas por este agente es la rehidratación vía oral y en los casos crónicos (evolución entre 2 y 3 semanasl se debe implantar una terapia antimicrobiana para erradicar la bacteria, ya que es posible la excreción prolongada de este agente, aún durante períodos mayores de un año (24). Sin embargo debe tenerse cuidado con el uso indiscriminado de antibióticos, pues ya se ha demostrado la presencia de un plásmido en ~ylobacter que le brinda resistencia a la tetraciclina; aunque tal plásmido no pudo ser transmitido a cepas de Escherichia coli (29). debe tenerse presente la posibilidad de conjugación y transmisión de plásmidos de resistencia múltiple (21). MORFOlOGIA y UlTRAESTRUCTURA DEL CAMPYlOBACTER Para proporcionar mayor información respecto a la morfología del ~pylobacter fetus ssp iID\!.!!1 se hizo un estudio al microscopio electrónico (14), que permitió observar cuatro tipos morfológicos: Formas esferoides o cocoides, que presentan un cráter o agujero central y un solo flagelo. 11) Formas curvadas en e con un flagelo polar en cada extremo. ,,1) Formas bi o tricurvadas monotricas bipolares. 1V) Formas filamentosas multicurvadas, monotricas monopolares o bipolares de hasta 8 um de largo (Figura 5), 1) Posiblemente las formas normales son los tipos 11 y 111. El tipo" (monocurvadas) posiblemente corresponde a células jóvenes de reciente división (Figura 6), en tanto las formas bi y tricurvadas serían células maduras. Por otra parte, las formas cocoides pueden corresponder a células en degeneración, ya que se observan con más frecuencia en los cultivos viejos y las formas filamentosas pueden deberse a alteraciones metabólicas, tal como se ha propuesto que podría ocurrir en Legionella p'neumop'hila (12), o bien, se deben a alteraciones inducidas por antibióticos beta lactámicos. Así, cuando se cultiva el Campylobacter en presencia de ampicilina frecw:mtemente se observan formas filamentosas, tal como se encontró en un estudio que se está realizando para evaluar las alteraciones morfológicas inducidas por antibióticos. En la Figura 7 se observa un Campylobacter cultivado en tioglicolato con 30 ug/ml de ampicilina. las formas bi y tricurvadas miden como promedio 1,9 .t 0,1 um de largo y su diámetro promedio es de 0,49 ±. 0,1 um. los flagelos pueden medir hasta 15 um de largo y salen de sendos poros caliciformes localizados en los extremos de la bacteria. la pared muestra una serie de surcos que le brindan un aspecto cerebriforme (Figura 8a). Además, la bacteria presenta una microcápsula (Figura 8b) (14). CUADRO ClINICO En patología humana el Campylobacter se ha asociado fundamentalmente con la etiología de las diarreas, pero también se le ha incriminado con la causalidad de septicemias e infecciones perinatales. DIARREA: Afecta principalmente a niños menores de dos años de edad, y su prevalencia oscila entre un 5 y 14 '~;, (36). ~1ernández, F. et al: AISLAMIENTO Y DIAGNOSTICO DE CAMPYLOBACTER 5 El período de incubación es de 48 horas y entre los signos y síntomas destacan la fiebre mayor de 38 oC, diarreas, dolor periumbilical severo, vómitos, leucocitos con presencia de bandas y puede presentarse deshidratación en más del 50 % de los casos. Las heces son acuosas con moco y en ocasiones pueden ser sanguinolentas con leucocitos (2, 17, 23) y el número de deposiciones diario puede ser hasta de 20 (34). SEPTICEMIA: Afecta principalmente a adultos y la subespecie involucrada más frecuentemente es C. fetus intestinalis. El cuadro es poco frecuente y está asociado con enfermedades crónicas como diabetes, cirrosis, cuadros cardiopulmonares y neoplasia, o bien con tratamientos inmunosupresores. Clínicamente el cuadro es pleomórfico presentando: fiebre, escalofríos, sudoración especialmente nocturna, vómitos, dolor abdominal y también puede presentarse hepatosplenomegalia, ictericia y diarrea (17). Cuando la septicemia afecta a madres en el período de embarazo puede ocurrir una infección perinatal, cuya letalidad es de cerca del 80 'X,. Clínicamente hay fiebre, tos, vómitos, dificultad respiratoria, cianosis e ictericia (17,30). EPIDEMIOLOGIA El Campylobacter fetus ssp j~uni es un agente distribuido ampliamente, descrito como una importante causa de diarrea tanto en países desarrollados como en desarrollo, el cual se aisla también de otros mamíferos aparte del hombre (28) y de aves que conviven con éste (11, 31) por lo tanto la infección se da como una zoonosis. Sin embargo, es posible que uno de los principales mecanismos de transmisión sea la contaminación fecal entre humanos (2, 3). Se ha informado que la prevalencia de este agente en casos de diarrea oscila entre un 5 y 14 %; no obstante, en un estudio realizado en el HNN (25) se encontró que en algunos meses este agente se aislaba del 25 % de los casos, presentando una curva de prevalencia ascendente, cuyo máximo valor se presenta a finales del año_ En estudios realizados anteriormente, se había observado este incremento de diarreas hacia final del año y se había encontrado que los agentes etiológicos más importantes en esas diarreas eran los rotavirus (13, 19); estos datos nos indican que en esos casos de final de año hay involucrados por lo menos dos agentes importantes: rotavirus y CampylQbactel'c Por otra parte, al comparar la etiología bacteriana de las diarreas entre enero y julio de 1983, se observó que el principal agente era ~. fetus ssp j~1l!!.L aislándose gene· ralmente en mayor proporción que Shigella y Salmonella (25). Estos datos, junto con los de etiología de diarrea en niños no hospitalizados del área rural (35), colocan al fetus ssp ~juni como uno de los principales agentes bacterianos causantes de diarrea. c.. CONCLUSION Este informe resume los principales métodos de aislamiento y diagnóstico del CamI!}'lobacter fetus ssp ~juni. A pesar de que a primera vista la metodología parece un tanto compleja, es relativamente simple. Los equipos e implementos necesarios para su aislamiento en resumen son: a) Incubadora a 42°C. 6 REVISTA MEDICA HOSPITAL NACIONAL DE NII'lOS DR. CARLOS SAENZ HERRERA b) Jarra de anaerobíosis tipo Gas Pack con válvula (incluso a las jarras corrientes puede adaptársele una válvula tal como se hizo en el HNNl. e) Una bomba de vacío, que puede sustituirse por una trampa de agua. d) Cilindro de N z y COz e) Medios de cultivo: cuya base es tioglicolato, adicionado de agar, sangre huma· na, extracto de levadura y antibióticos. Por lo tanto, es factible montar esta metodología en cualquier laboratorio el ínico donde se trabaje en bacteriología. El aislamiento e identificación del Campylobacter a partir de casos de diarrea es importante, tanto desde el punto de vista epidemiológico, como clínico. La importan· cia radica en el esquema de tratamiento, que incluye además de la rehidratación, antibióticoterapia, al menos en los casos que evolucionan crónicamente. Epidemiológicamente, el diagnóstico es importante, ya que se ha propuesto que algunos pa· cientes pueden continuar excretando la bacteria intermitentemente durante pe· ríodos mayores de un año, con lo cual se convierten en reservarías. CUADRO 1 CLASIFICACION DEL GENERO CAMPYLOBACTER Familia Spirillaceae Género Carnpy!obacter Especies y subespecies C. fetus ssp fetus C. fetus ssp intestinalis C. fetus ssp jejUnJ (**) t * 1<) C. sputorurn ssp sputorum_ C. sputorum ssp bubulus C. sputorum sSIl mucosal!s C. recalis --------._-_. (*) Modificación de Kaplan, R. L. 1980. (**) Involucrado con patología en humanos. (16) (*) + + + + + C. fetus SSp fetus C. fetus SSp intestinalis C. fetus ssp jeju ni C. sputorum ssp sputorum C. sputorum ssp bubulus Tomado de Kaplan, R. L., 1980 + C. fecalis --- OXIOASA (6) -- - + + + + CATALASA S + + R - AC. NALlDIXICO R S - + H R S CEFALOTINA + + + + + r- 1% - -GLICINA ANTIMICROBIANOS (30U9/discO) DIFERENCIACION BIOQUIMICA DE CAMPYLOBACTER CUADRO 2 + V 3,5% NaCL V + + - + 42°C - OC + + + - 25 CRECIMIENTO lO I VI ....,¡ -i 1'1 ::ti () }> CD O r ~ "ll ~ }> () 1'1 O O () -i Z O }> (j) O ~ O -i Z 1'1 s: }> r VI }> ~ lO -.. :'" .... lO :::l Q. ....:; 8 REVISTA MEDICA HOSPITAL NACIONAL DE NIÑOS DR. CARLOS SAENZ HERRERA c~" ........ ----- l)OMtSA OE VACIO FIGURA 1. Sistema de eV(jcuación y reemplazo necesario para lograr ulla atmós fer" microaerofílica en Jarras para al1i:lerobiosis y aplicación de este sistema para cambiar la atmósfera a las dp, tubos de cultivo, paso que es fundamental piJra lograr' un buen crecimiento de Campylobacter, aún en caldo de tlogliealido, El esquerna del dispositivo para conectar los cilindros de gas, la bomba de vacío y la J"t'Ui, fUI:' construido según indican Afien V Siders (1), Hernández, F. et al: AISLAMIENTO Y DIAGNOSTICO DE CAMPYLOBACTER 9 FIGURA 2: Morfología dé las colonias de Campylobacter en agar de Bützler A. en medio fresco (húmedo) B. en medio seco (incubado a 37 oC durante 48 horas antes de inocular la bacteria). 10 REVISTA MEDICA HOSPITAL NACIONAL DE NIÑOS DR. CARLOS SAENZ HERRERA FIGURA 3: Tinción de Gram de un frotis de Campylobacter obtenido de un cultivo en agar de Bützler. La safranina fue sustituida por fucsina. Obsérvese la forma curvada característica de esta bacteria. Hernandez, F. el al: AISLAMIENTO y DIAGNOSTICO DE CAMPYLOBACTER T10GLlCOLATO 0,16 % agar AGAR-SANGRE mic roaerobiósi s -70°C TIOGLlCOLATO 24 - 48h 37 oC ~··::9~ TIOGLlCOLATO 1,5 O/o agar 10 % sangre antibióticos FIGURA 4: 11 INOCULADOR PARA DILUCION EN PLATO Iml amortiguador de fosfatos Diagrama de la metodología empleada para estudiar la sensibilidad a los antibióticos por el método de dilución en agar, aplicada al estudio de Campylobacter. 12 REVISTA MEDICA HOSPITAL NACIONAL DE N I 1'1 OS DR. CARLOS SAENZ HERRERA. FIGU RA 5: Microfotografías electrónicas de transmisión de una preparación de Campylobacter, procesada mediante la técnica de réplicas de platino. Se presentan cuatro tipos morfológicos (números romanos) descritos en el texto. Barras - 1um. w -' ~ -i 11'1 » n III O r < 'U ~ » n rT1 o o n -i z o VI el » o < o -i Z rT1 ¡: :lo r VI :lo .." "TI .N " Q. :l :l ~ ..." I 14 REVISTA MEDICA HOSPITAL NACIONAL DE NIÑOS DR. CARLOS SAENZ HERRERA FIGURA 6: A. Réplica de platino de un Campylobacter en división, obsérvese el estrechamiento de la célula en el sitio de división que originaría dos células hijas curvadas en C (tipo morfológico 11). En la figura B, se observa otro Campylobacter en división, pero en una preparación teñida con ácido fosfotúngstico (tinción negativa). Barra = 1 um. Hernández, F. el al: AISLAMIENTO Y DIAGNOSTICO DE CAMPYLOBACTER 15 FIGURA 7: Microfotografía electrónica de una preparación de Campylobacter teñida con ácido fosfotúngstico (tinción negativa). Se observa una forma alargada, semejante al tipo morfológico IV; éstas son las formas que predominan cuando la bacteria se inocula en tioQlicolato con 30 u!l/ml de amoicilina. E' arra = 1 um. 16 REVISTA MEDICA HOSPITAL NACIONAL DE NIÑOS DR. CARLOS SAENZ HERRERA b FIGURA 8: A. Microfotografía electrónica de transmisión del extremo de un CampyJ.Qbacter en el que se aprecia el poro polar del cual sale el flagelo. Además, se observa el aspecto ccrebri forme de la pared bacteriana. Barra = 0.25 um. B. Mi::rofotografía electrónica de transmisión de '.In Campylobacter teñido con ácido fosfotúngstico (tinc;ón negativa). Se observa la microcápslJfa que envuelvp. el cuerpo de la bacteria (flecha\. Barra = 1 um. Hernández, F. et al: AISLAMIENTO V DIAGNOSTICO OE CAMPVLOBACTER 17 RESUMEN Se describen los métodos bacteriológicos, medios de cultivo e implementos de laboratorio necesarios para el aislamiento, identificación y estudio de sensibilidad a los antibióticos del Campylobacter fetus ssp jgj\!!!i. Además, se hace una sinopsis histórica respecto al conocimiento de la patología en humanos causada por esta bacteria, que recientemente se está considerando como uno de los principales agentes causantes de diarrea. Etiológicamente esta bacteria resultó tan importante o más, que Shig~ y Salmonella en casos de diarrea en niños menores de dos años de edad, atendidos en el Hospital Nacional de Niños entre enero y julio en 1983. SUMMARY We described the bacteriological methods, culture medium and laboratory implements for isolation, identification and antibiotic sensibility tests ofCamp'y'lobacter fetus ssp j~uni. We also reviewed the historic sinopsis about the knowledge of Campylobacter in human pathology. Recently this bacteria has been considered as an important etiologic agent of children's diarrhea, as much as Shigella and Salmonella in hospitalized cases studied at the National Children.s Hospital, Costa Rica, from Janllary and JlIly, 1983. BIBlIOGRAFIA 1. Allen S O & Siders J. Procedures of isolation and characterization of anaerobic bacteria. En: Manual of Clinical Microbiology. Lennette E, Balows A, Hauster W L & Truant J P. (editores) 3 o ed. Washington, O.C. American Society for Microbiolgy, p 397,1980. 2. Blaser M J, Berkowitz I.et al. Campvlobacter enteritis: Clinical and epidemialogic features. Ann. Internal. Med. 91: 179, 1979. 3. Blaser M J, LaForce F et al. Reservoirs for human campylobacteriosis. J. Infect. Ois. 141: 665, 1980. 4. Buck G E & Kelly M T. Effect of moisture content of the medium on colony morphology of Campylobacter fetus subsp jejuni. J. Clin. Microbiol. 14: 584, 1981. ---- 5. Bützler J P & Skirrow M. Campylobacter enteritis. Clin. Gastroenterol. 8: 737, 1979. - 6. Cortir A H. Motilis curved anaerobic bacilus in uterine descharges. J. Infect. Ois. 12: 165,1913. 7. Chan F. & Mackenzie A. Enrichment medium and control system for isolation of Campylobacter fetus subsp ~juni from stools. J. Clin. Microbio!. 15: 12, 1982. 8. Oarrel J. Farrell B & Mulligan A. Case of human vibriosis. Brit. Med. J. 2:287, 1967. 9. Oekeyser O, Gossvin-Oetrain M et al. Acute enteritis due to a related vibrio: First positive stool cultures. J. infecto Ois. 125: 390, 1972. 18 REVISTA MEDICA HOSPITAL NACIONAL DE NINOS DR. CARLOS SAENZ HERRERA 10. Editorial. Campylobacter enteritis. lancet 2: 1437, 1982. 11. Grant " Richardson N & Bokkenheusen J D. Broiler chickens as potential source of ~p"ylobacter ¡nfection in humans. J. Clin. Microbio!. 11: 50S, 19S0. 12. Hernández F, Kirby B & Stanlev T. Legionnaires'disease. Post morten pathologic findings of 20 cases Amer. J. Clin. Pathol. 73: 488, 1980. 13. Hernández F, Mata l et al. Prevalencia de rotavirus y descripción de un brote de diarrea por este agente en Costa Rica. Acta Méd. Costarricense 20: 297, 1977. 14. Hernández F, Cipagauta l et al. Ultraestructura de Campylobacter fetus ssp j,g: ¡uni Enviado a Rev. Latinoamer. Microbio!., 1983. 15. Herrera M L, Salas J & Guevara J. Utilización del tetrationato - iodo en el aislamiento de Campylobacter. Rev. Med. Hosp. Nal. Niños Costa Rica. En prensa. 16. Kaplan R L. Campylobacter En: Manual of Clinical Microbiolo9Y. lennette E, Balows A, Hauster W l & Truant J P (editores), 3a. ed. Washington D.C. American Society for Microbiology, p. 235, 1980. 17. Karmali M A & Fleming P C. Campylobacter enteritis in children J. Pediat. 94: 527, 1979. 18. Luechtefeld N W, Reller L et al. Comparison of atmospheres of incubation for primary isolation of Campylobacter fetus subsp j~juni from animal specimens: 5 % oxigen versus candle jar. J. Clin. Microbiol, 15: 53, 1982. 19. Mata l, Simhon A et al. Diarrhoea associated with rotaviruses, enterotoxigenic Escheríchia coli, Campylobacter, and other agents in Costa Rica children, 1976 1981. Amer. J. Trop. Med. Hyg. 32: 146,1983. 20. Middelkamp J N & Wolf H. An infection due to a "related" vibrio. J. Pediat. 59: 318,1961. 21. Peñaranda ME & Mata L. Plásmidos de virulencia. Rev. Med. Hosp. Nal. Niños Costa Rica 13: 22, 1978. 22. Paisley J W, Mirrett S et al. Dark-field microscopy of human feces for pre· sumptive diagnosis of CamR.ylobacter fetus subsp wju.ni enteritis. J. Clin. I\¡iicrobiol. 15: 61, 1932. 23. Rettig P l. Campvlobacter infection in human beings. J. Pediat. 94: 1919. 955, 24. Richardson N J, Koornhof H et al. Long-term infections with Campylobacter fetus subsp ~juni. J. Cli". Microbiol.. 13: 846, 1981. 25. Rivera P, Herrera M l et al. Epidemiología de las diarreas por Campylobacter. En prensa Rev. Med. Hosp. Nal. Niños Costa Rica. 26. Skirrow M B. Campylobacter enteritis: 1917. A "new" disease Brit. Med. J. 2: 9, Hernánclez, F. et al: 19 AISLAMIENTO Y DIAGNOSTICO DE CAMPYLOBACTER 27. Smibert R. M. The genus Campylobacter. 1978. Ann. Rev. Microbio!. 32: 673, 28. Smith M V & Muldoon P. Campylobacter fetus subsp ~iuni (vibrio fetus) from commercially processed polultry. Appl. Microbiol. 27: 995,1974. 29. Taylor O E, De Grandis S et al. Transmissible plasmids from Campy[Qbacter junio Antimicrob. Agents Chemother., 19: 831, 1981. ~­ 30. Torphy W & Bond W. Campylobacter fetus infections in children Pediatrics, 64: 898, 1979. 31. Vanhoof R, Goossens H et al. Susceptibility pattern of Campylobac~r~juni from human an animal origins to different antimicrobial agents. Antimicrob. Agents Chemother, 21: 990, 1982. 32. Wheeler W E & Bonchers J. Vibrionic enteritis in infants. Amer. J. Ois Child. 101: 60, 1961. 33. White W O. Human vibriosis: 2: 283, 1967. indegenous cases In England. Brit. Med. J. 34. Winoughby C P, Piris L & Truelove S. Cillnpylobacter colitis. J. Clin. Pathol. 32: 986, 1980. 35. Vives M, Mata L et al. Estudio de Puriscal V: Infección entérica en niños me· nores de dos años. Rev. Med. Hosp. Nal. Niños Costa Rica 17: 57,1982. 36. World Health Organization Enteric infections due to Campylobacter, Yersinia, Salmonella and Shigella. Control of Oiarrhoeal Disease Scientific Working Group. Reports. 1978-1980.