“Herramientas moleculares para la investigación y el diagnóstico de
Anuncio

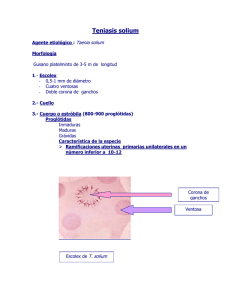
Inscripción: Información: Actividades: El curso comprende actividades teóricas (30%) y prácticas (70%). Las actividades prácticas serán realizadas en paralelo a las actividades teóricas y estarán destinadas a la consolidación de los conceptos previamente revisados Duración del Curso: El curso tendrá una intensidad horaria de 6 horas/diarias, para un total de 60 horas (2 semanas) del 18 de Febrero al 1 de Marzo del 2013. Departamento de Ciencias Celulares y Moleculares - Facultad de Ciencias y Filosofía – Universidad Peruana Cayetano Heredia. Laboratorio de Bioinformática y Biología Molecular – Tercer Piso (306 - 307) del Laboratorios de Investigación y Desarrollo (LID) Av. Honorio Delgado 430. Urb. Ingeniería – SMP Teléfonos: 319-0000 anexos 2604 Celulares: 945199277 Caja UPCH: 03133001-Cursos Cortos Horario: Teoría: Lunes a Jueves – 10 – 12 am Práctica: Lunes a Jueves – 2- 6 pm y los Viernes UNIVERSIDAD PERUANA CAYETANO HEREDIA LABORATORIO DE BIOINFORMÁTICA Y BIOLOGÍA MOLECULAR CURSO: Teórico – Práctico “Herramientas moleculares para la investigación y el diagnóstico de enfermedades infecciosas” Depósito en Banco de Crédito del Perú Cta N° 1931170686 – 009 a nombre de Universidad Peruana Cayetano Heredia. Email: Curso.corto@hotmail.com Coordinador: PhD Patricia Sheen Organizador: MSc. Juan Carlos Gaspar Ponentes: Costo: Teoría Práctica Teoría y Práctica Estudiantes S/. 200 S/. 600 S/. 800 Profesionales S/. 200 S/. 800 S/. 1000 Vacantes Limitadas 30 Valor Crédito: 3 Horas Crédito PhD Patricia Sheen Cortavarría PhD. Daniel Rueda Dra. Maritza Calderón MSc. Juan Carlos Gaspar MSc (c) Antonio Flores Tumba http://www.facebook.com/events/510 429408988045/ Del 18 de Febrero al 1 de Marzo del 2013 Presentación: Programa de clases: Programa de clases: Las continuas implementaciones de las técnicas moleculares en investigación y en el diagnóstico de enfermedades infecciosas, la estandarización de protocolos experimentales y la necesidad de que estos conocimientos lleguen a una mayor población de investigadores, profesionales de la salud y estudiantes, nos han conducido a ofrecer a la comunidad este curso teórico práctico, que permitirá a los participantes, conocer en detalle las herramientas moleculares para el diagnostico de enfermedades infecciosas y su uso en la investigación. Lunes 18.- Genética molecular Requisitos funcionales y estructurales del material genético: codificación, replicación y expresión. Práctica: Extracción ADN genómico mediante proteinasa K de Mycobacterium tuberculosis inactivado. Martes 19.- Tuberculosis Resistente Definiciones e historia de la TB resistente, epidemiología molecular de la TB en el Perú: TB MDR, mecanismos moleculares de resistencia. Práctica: Extracción de ARN mediante Trizol de Mycobacterium tuberculosis inactivado. Miércoles 20.- Tipos de PCR Fundamento teórico de la reacción en cadena de la polimerasa (PCR). Tipos de PCR, RT-PCR. Práctica: Retrotranscripción del ARN del Mycobacteiun tuberculosis. Electroforesis del cDNA Jueves 21.- Enfermedad de Chagas Historia de la Enfermedad de Chagas, aportes de los investigadores, avances, epidemiología nacional, regional e internacional. Práctica: PCR convensional y PCR en Tiempo Real con Sybr Green – Evaluación del cambio de expresión del gen de pirazinamidasa Viernes 22: Análisis e interpretación de resultados: PCR en Tiempo Real con sondas TaqMan para el diagnostico de M. tuberculosis Lunes 25.- Taenia solium Historia de la Enfermedad, desarrollo, evolución, aportes de los investigadores. Práctica: Electroforesis en geles de acrilamida de las proteínas de Taenia solium. Transferencia a una membrana de Nitrocelulosa Martes 26.- Otras Herramientas moleculares Técnicas de Hibridación, Blotting: Southern blot, Northern blot e inmuno ensayos con Western blot y ELISAS. Práctica: Western Blot para la detección de antígenos de Taenia solium. Miércoles 27.- Marcadores moleculares Marcadores moleculares: marcadores de ADN obtenidos por hibridación, marcadores de ADN obtenidos por PCR. Práctica: Preparación de ADNg de Taenia solium para su genotipificación. Jueves 28.- Trabajos de Investigación Comprender el mecanismo de resistencia de Mycobacterium tuerculosis a pirazinamida. Práctica: Genotipificación de Taenia solium por microsatelites Viernes 1: Ensayo por inmunoabsorción ligado a enzimas (ELISA) para la detección de antígenos de Taenia solium. Interpretación de resultados de la genotipificación de M. tuberculosis. Clausura del curso Objetivos: Capacitar a los participantes en pruebas moleculares para el diagnóstico de enfermedades infecciosas y su uso en la investigación. Conocer las diferentes herramientas en biología molecular y su s aplicaciones en el diagnostico de las enfermedades infecciosas.