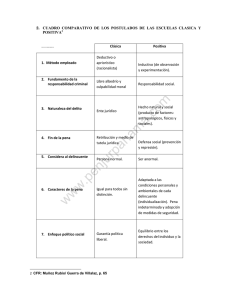
Tesis previa a la obtención del Título de
Anuncio

UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA “Bioactividad antifungal de extractos alcohólicos de 30 plantas del bosque de Mazán contra levaduras” Tesis previa a la obtención del Título de: Doctora en Bioquímica y Farmacia. AUTORAS: Betty Janneth Arévalo López. Merci Mariela Capa Capa. DIRECTORA: Dra. Adelina Astudillo Machuca. ASESORA: Dra. Carmen Lucía López Cisneros. CUENCA - ECUADOR 2004 34 INDICE Agradecimiento………...…………………………………………….. Dedicatoria……………………………....... ........................................ Índice……...………………………………………………………….. Introducción…………...…………….………………………………... I II III VI Página CAPÍTULO I HONGOS LEVADURIFORMES ……………………………….. 1 1.1 Definición…………………….……………………………. 2 1.2 Morfología…...……………………………………………... 3 1.3 Fisiología…………………………………..……………….. 3 1.4 Ciclo celular……………...………………………………… 4 1.5 Reproducción………………………………………………. 8 1.6 Características del cultivo...………………………………... 10 1.7 Patología…………………………………………………… 11 1.8 Importancia……………………………………………….... 12 1.9 Características morfológicas y fisiológicas claves de las levaduras …………………………………………………... 13 1.10 Características bioquímicas de las levaduras……………..... 14 1.11 Saccharomyces cerevisiae…………………...……………... 14 1.12 Rhodotorula glutinis……………..…………………………. 24 1.13 Candidiasis……..…………………………………………... 26 1.13.1 Candida albicans……………..…………………………….. 28 1.13.2 Candida krusei ……………………………………………. 32 CAPÍTULO II PLANTAS DEL BOSQUE DE MAZÁN ………………………… 2.1 Características del bosque de Mazan ……………………... 2.2 Descripción de las plantas del bosque de Mazán …………. AGUACHENTO ………………………………………………… ALISO …………………………………………………………… CANELO ………………………..……………………………….. CENTROPOGON ……………………………………………….. CHILCA NEGRA ……...………………………………………... CHUL CHUL …..………………………………………………... CHUQUIRAGUA ……………………………………………….. DUMBRIR ………………………………………..……………... FLORIPONDIO ………………..………………………………... GAÑAL …………………….……………………………………. GYNOXYS …….………………………………………………... HUAHUAL ………………..…………………………………….. JOYAPA …………………………………………………………. LAUREL DE CERA ................………………………………….. MARAR……………………………………………………..……. MOTE CASHA……………………………………….….……….. PACARCAR………………………………………………..…….. PENA PENA …………………………………………………….. 35 35 36 36 37 38 39 40 41 42 44 44 46 47 48 49 50 51 52 53 54 35 PURURUG COLORADO ……………………………………….. QUILLUYUGYUG ……………………………………………… QUINUA ………………………………………………………… RAÑAS ………………………………………………………….. SALVIA REAL………………………………………………….. SARAR …………………………………………………………... SHIÑAN …………………………………………………………. SURO ……………………………………………………………. TILILIN ………………………………………………………….. TRINITARIA ……………………………………………………. YANAMOTE ……………………………………………………. ZARCILLO SACHA …………………………………………….. Características de las familias de las plantas utilizadas para nuestra investigación…..………………………………………….. 55 56 57 58 59 60 61 62 62 63 65 65 68 CAPÍTULO III BIOACTIVIDAD …………………………………………...…….. Bioactividad ………………………………………………. Metabolitos presentes en las plantas ……………………... Carbohidratos ……………………………...……………… Aminoácidos ……………………………………………… Taninos ……………………..…………………………….. Cumarinas …………………………………………………. Resinas ……..……………………………………………... Alcaloides ……………..…………………………………... Flavonoides ………………...……………………………... Saponinas …………………………………………..……... Quinonas …………………………………………………... Aceites esenciales …………………………………………. 74 74 75 76 77 79 81 82 83 84 85 86 87 CAPÍTULO IV METODOLOGÍA……………..………..………………………….. 4.1 Objetivo general……………..……………………………... 4.2 Objetivos específicos...……………………………………... 4.3 Plan general de trabajo ……………………………………. 4.3.1 Selección de las especies ………………………………….. 4.3.2 Recolección de las plantas ………….…………………….. 4.3.3 Secado de las plantas ...……………………………………. 4.3.4 Trituración y tamizado ..…………………………………... 4.3.5 Determinación de la humedad ...…………………………... 4.3.6 Obtención del extracto alcohólico…...……………………... 4.3.7 Obtención del residuo seco.................................................... 4.3.8 Resuspensión del residuo seco en DMSO……...…………... 4.3.9 Reactivación de las cepas de levaduras ………...…………. 4.3.10 Preparación del inóculo ….………………………………... 4.3.11 Ensayo de la bioactividad antifungal .…………………….. 4.3.12 Ensayo fitoquímico de las plantas que resultaron positivas 90 90 90 90 91 91 93 94 95 96 101 101 103 106 110 117 36 CAPÍTULO V DATOS, RESULTADOS Y CONCLUSIONES ..……………….. 5.1 Humedad ………….………………………………………. 5.2 Obtención de los extractos alcohólicos…...………………... 5.3 Evaporación de los extractos alcohólicos .………………… 5.4 Peso y resuspensión de los extractos alcohólicos …………. 5.5 Bioactividad ……………...……………………………….. 5.5.1 Bioactividad antifungal frente a Candida krusei .…………. 5.5.2 Bioactividad antifungal frente a Rhodotorula glutinis ……. 5.5.3 Bioactividad antifungal frente a Candida albicans ………. 5.5.4 Bioactividad antifungal frente a Saccharomyces cerevisiae 5.6 Análisis Fitoquímico …………………………….………... 5.6.1 Determinación de Alcaloides …………………………….. 5.6.2 Determinación de Fenoles y taninos ……………………… 5.6.3 Determinación de Flavonoides ……………...…………..... 5.6.4 Determinación de Antocianidinas ...………………………. 5.6.5 Determinación de Azúcares reductores …………………… 5.6.6 Determinación de Saponinas ……………………………… 5.6.7 Determinación de Resinas …………………...……………. 5.6.8 Determinación de Triterpenos y esteroides ……………….. 5.6.9 Determinación de Aminoácidos …………………...……… 5.6.10 Determinación de Quinonas …………………...………….. 5.6.11 Determinación de Catequinas ……………………………... 5.6.12 Determinación de Lactosas y cumarinas ………………….. 5.6.13 Determinación de Glicósidos cardiotónicos ………………. CONCLUSIONES………………………………………..…………..… RECOMENDACIONES……………………………………………...... BIBLIOGRAFÍA…………………………………………………......… ANEXOS…. . …………………………………………..……………… 129 130 132 134 137 139 141 143 145 146 150 150 153 154 155 156 157 158 159 160 161 162 163 164 165 184 186 193 INTRODUCCIÓN Las plantas o vegetales son seres que se conocen desde la antigüedad, se distinguen varios tipos de plantas, entre ellas: musgos, helechos, plantas herbáceas y leñosas, arbustos, trepadoras, árboles y muchas más; reunidas llegan alrededor de 260.000 especies; de las mencionadas unas se adaptan a vivir sobre la tierra y otras sobre el agua. Dentro de este amplio reino se pueden encontrar plantas con utilidad económica, propiedades medicinales, venenosa, parásita y otras. A través de la información etnomédica se conoce que desde hace mucho tiempo atrás hasta nuestros días el hombre acude a la medicina tradicional buscando en las plantas la curación de sus enfermedades causadas por diferentes factores como contaminación del medio ambiente; o por presencia de microorganismos patógenos. 37 La biodiversidad que encontramos en nuestro país, favorece a las investigaciones de plantas; con el fin de definir si poseen actividad frente a microorganismos causantes de trastornos en la salud o para la aplicación en otro campo. Las plantas en menor o mayor proporción poseen, metabolitos primarios cuya función elemental es la de reserva y metabolitos secundarios (alcaloides, taninos, aceites esenciales, flavonoides y otros) que solos o en combinación entre ellos o reunidos a los primarios ejercen mecanismos específicos como el de defensa al ataque de patógenos. En la presente tesis en un screening primario, se realiza la investigación de la actividad antifungal de extractos alcohólicos de 30 plantas seleccionadas del área de reserva del Bosque de Mazán, que forma parte del Parque Nacional Cajas, fente a los microorganismos: Candida krusei, Rhodotorula glutinis, Candida albicans y Saccharomyces cerevisiae. Las micosis oportunistas son infecciones que afectan a niños o adultos que presentan una disminución en las defensas local o general, por ejemplo en las personas que padecen de SIDA (Síndrome de Inmuno deficiencia Adquirida). Una de las más frecuentes es la Candidiasis, el género responsable es Candida, por su patogenicidad se han tomado en cuenta para nuestro trabajo Candida albicans y Candida krusei. Se seleccionó también a R. glutinis que es capaz de producir fungemia y a S. cerevisiae la cual se la considera como modelo de laboratorio y, se ha secuenciado el genoma. Además tiene un amplio uso en la industria alimentaria. Se describe el bioensayo que nos permiten determinar la actividad antifungal en las plantas seleccionadas y el análisis fitoquímico a través del cual determinamos la presencia de los metabolitos en extracto alcohólico. Finalmente se indican los resultados de la investigación de las 30 plantas del bosque de Mazán, las cuales presentan un potencial invariable de metabolitos que pueden tener aplicación en un futuro en farmacia. 38 39 CAPITULO I HONGOS LEVADURIFORMES CAPITULO # 1 HONGOS LEVADURIFORMES 40 1.1 Definición: Las levaduras son, por lo general, un grupo de hongos unicelulares, carentes de micelio, que provocan la fermentación de los sustratos orgánicos sobre los que viven. (30). Son microorganismos eucariotas, cuya característica más significativa es la de poseer un núcleo envuelto por una membrana nuclear. Imagen 1-1. Célula de Levadura vista al microscopio electrónico Las levaduras no contienen clorofila, por lo que no pueden sintetizar macromoléculas a partir de dióxido de carbono ni de la energía procedente de la luz, por consiguiente, dependen de las plantas superiores y de los animales para obtener su energía, la cual pueden conseguir por desamilación oxidativa aerobia o por fermentación anaerobia. Las levaduras están muy difundidas en la naturaleza. Se encuentran en las frutas, los granos y otras materias nutritivas que contienen azúcar; en el suelo (especialmente en los viñedos y huertos), en el aire, en la piel y en el intestino de los animales. Algunas son saprofitas (microorganismo que viven sobre materia orgánica muerta o en descomposición) y otras son parásitas (microorganismos que viven sobre o en el interior de un huésped, del que obtienen beneficios sin corresponder a cambio con unas contribuciones útiles; además, en el caso de los patógenos, la relación resulta perjudicial para el huésped). (18)Pág.211 1.2 Morfología: Las diversas especies de levaduras tienen formas muy variadas desde las esféricas, ovoides, elipsoides, a las cilíndricas, que pueden ser muy alargadas y aún filamentosas. Imagen 1-1 http://www2.biomed.cas.cz/~benada/lem117/images/yeast_rg.jpg 41 El tamaño varía mucho en las levaduras, pueden medir entre 1 a 5 um de ancho por 5 a 30 um, o más, de longitud. Aún en los cultivos más puros, las células individuales ofrecen notable variedad en el tamaño y la forma, según la edad y el medio. Las levaduras no poseen flagelos ni otros órganos de locomoción. 1.3 Fisiología: Las levaduras pueden fermentar monosacáridos (preferentemente glucosa), disacáridos como sacarosa (hidrolizándola a monómeros con invertasa), y polímeros como el almidón (empleando amilasas), o incluso azúcares mucho más complejos como los derivados de la celulosa. (9)Pág. 34. La temperatura óptima para el crecimiento de la mayor parte de levaduras es de 20º a 30 ºC; las variedades patógenas crecen bien entre los 30º a 37 ºC. La tolerancia ácida varía según las especies de levaduras entre pH 2,2 y 8,0. La degradación de los azúcares como la glucosa, se realiza por procesos anaerobios (fermentación) o aerobios (respiración). El proceso más característico es la desamilación anaerobia, que se conoce comúnmente como fermentación alcohólica. Los productos finales son el alcohol etílico y el dióxido de carbono. Fermentación 1 glucosa = Anaerobia: 2CO2 + 2 etanol 54 kcal de energía libre 42 En la respiración la oxidación completa de la glucosa produce dióxido de carbono y agua, mientras que la oxidación incompleta va acompañada por acumulación de ácidos y otros productos intermedios. Crecimiento Aerobio: 1 glucosa + 6O2 = 6CO2 + 6H2O 686 kcal de energía libre Las reacciones de fermentación son anaerobias; y si los cultivos se exponen a la acción del aire durante el crecimiento, el proceso de fermentación se suprime a favor de trayectorias oxidantes. (18) Pág.213, 217, 220, 222. 1.4 Ciclo celular: El crecimiento y desarrollo de los organismos vivos depende del crecimiento y multiplicación de sus células. En los organismos unicelulares la división celular implica una verdadera reproducción ya que por este proceso se producen dos células hijas. (41). Por tanto generar dos células por división capaces de volver a repetir el proceso sucesivamente requiere que las células hijas hereden toda la información genética, y ese proceso de herencia se basa en la posibilidad de copiar dos moléculas de ADN idénticas que se reparten a cada célula con absoluta precisión mediante la maquinaria mitótica en las eucariotas. De esta forma, el ciclo de división celular gira en torno al ciclo del ADN. (9)Pág.103. Las células eucariotas que están en proliferación exhiben una serie de cambios morfológicos que se repiten cíclicamente, siguiendo un patrón bien definido, que constituye el ciclo celular. (11)Pág. 539. El ciclo de división de la levadura (célula eucariota) está constituido por un período de tiempo destinado a duplicar la información genética (fase S, de síntesis de ADN). Una 43 vez terminada la fase S, la célula entra en mitosis, o fase M, en la que el DNA duplicado se empaqueta en cromosomas y se reparte por igual en dos células hijas. Antes de que la célula entre de nuevo en fase S, existe un “Gap” o tiempo necesario para preparar la maquinaria enzimática que se requerirá durante la síntesis de ADN, y que se denomina G1. Del mismo modo existe un “Gap” Imagen 1-2. Ciclo celular antes de la fase M, conocida como G2, en el que la célula se prepara para la mitosis. De esta manera, el ciclo es una sucesión continua de las fases G1, S, G2 y M. Cuando por las señales del medio extracelular se detectan deficiencias nutricionales o condiciones estresantes, la división celular se detiene normalmente en G1 y si la proliferación se interrumpe prolongadamente, entonces la célula abandona el ciclo celular y entra en lo que se denomina fase G0. A veces la célula interrumpe el ciclo en G2 en lugar de G1 y, si este bloqueo en G2 se prolonga, la célula puede entrar también en un estado quiescente parecido a G0, que se denomina G3. De la misma forma cuando las levaduras estacionadas detectan la existencia de condiciones favorables, reactivan el ciclo celular entrando en G1 si se encontraban en G0 o en G2 si estaban en G3. 1.4.1 Crecimiento: El crecimiento de las levaduras manejadas en nuestro proyecto, se realizó en cultivos asincrónicos, así el crecimiento se determina midiendo el incremento de la densidad óptica del cultivo (células creciendo en un matraz) en intervalos de tiempo. Imagen 1-2: http://www.whfreeman.com/life/update/ 44 En un cultivo recién inoculado, las células tienen una fase de latencia antes de proliferar, y una vez superada, crecen exponencialmente hasta que agotan los nutrientes, entrando entonces en una fase estacionaria donde las células paran el ciclo en G1 o en G2, y si se mantiene prolongada en esta situación, entran en un estado quiescente de G0 o G3 respectivamente. 1.4.2 Control de la proliferación: En condiciones favorables las levaduras proliferan continuamente y doblan su número cada tiempo de generación. En estas condiciones, la levadura mantiene un ciclo continuo de división donde cada célula aumenta su masa, duplica su información genética y la reparte equitativamente para generar dos células. Así, los mecanismos de control de la proliferación están desarrollados para generar una respuesta de la célula a los cambios ambientales y se basan en la posibilidad de conocer las señales extracelulares con el mecanismo de control que regula las fases G1 y G2 del ciclo celular. El estado nutricional del medio es uno de los más decisivos en este control. Las levaduras alternan la proliferación vegetativa con un ciclo sexual, debido a la presencia de una hormona sexual (feromona), la cual, bloquea el ciclo celular en G1 y dispara en la levadura un proceso de fusión de las células para generar diploides de manera que, además de las condiciones de nutrición y medio ambiente, existe una respuesta fisiológica a una señal hormonal capaz de detener la proliferación celular por un mecanismo de control que opera en G1, en un punto clásico conocido como start, ya que en este punto del ciclo celular es donde se decide la alternativa entre el ciclo sexual o el de comenzar un nuevo ciclo de división entrando en síntesis de ADN.(9). 1.4.3 Control del ciclo celular: 45 En condiciones no estresantes, con abundantes nutrientes y en ausencia de hormonas sexuales, cada célula de levadura sigue un ciclo en el que se alternan las fases de duplicación y separación del material genético, precedidas de las fases G1 y G2 respectivamente. Estas cuatro fases (G1, S, G2 y M) se suceden de forma continua y ordenada, sujetas a un estricto control molecular. Así, cuando la división no se interrumpe por señales externas, las células tienen un mecanismo de control de la división con dos objetivos principales: a) Destinado a establecer un estricto orden temporal, en el que una célula sólo entra en mitosis una vez terminada completamente la fase de síntesis (y viceversa). b) Determina que, una vez se vaya a iniciar la síntesis o la mitosis, las proteínas requeridas para realizar cada una de las fases críticas trabajen acorde, sincronizadas en el momento que se requieren, es decir, para la fase S se necesita que simultáneamente existan DNA polimerazas, ligasas, topoisomerasas, telomerasas y toda la maquinaria necesaria para la síntesis del ADN; del mismo modo, en la mitosis participan un gran número de proteínas que deben actuar coordinadamente para realizar con éxito la separación del ADN duplicado. Los procesos de duplicación del ADN durante la fase de síntesis y reparto equitativo en dos durante la mitosis son procesos irreversibles; de esta forma el control del ciclo celular se realiza realmente en la fases previas de G1 y G2 respectivamente, fases en las que la célula debe decidir si parar el ciclo por detectar condiciones adversas o una señal sexual, o por el contrario continuar realizando la transmisión irreversible G1-S o G2-M; de continuarlo es también en esta fase donde la célula coordina todo el ciclo, asegurando el orden temporal de las fases, detectando situaciones de alarma (ADN dañado o poca masa), y sincronizando todos los procesos que participan a la vez en cada una de estas fases críticas como son la síntesis de ADN (organizada desde G1) y la mitosis (organizada desde G2). (9)Pág. 103-109. 46 1.5 Reproducción: La reproducción de las levaduras puede ser asexual (por gemación y fisión) y sexual (por esporulación), la modalidad más común es la gemación. La gemación es un proceso asexual, se inicia por la lisis localizada de la pared celular en un punto específico. La presión interna en esta área de la pared celular debilitada hace que la pared celular se abombe hacia afuera. Esta parte tumefacta aumenta de tamaño, el núcleo se divide por mitosis y un núcleo hijo migra hacia el brote neoformado. El brote o yema naciente puede continuar aumentando de tamaño. La pared celular crece en el punto estrecho de adherencia, finalmente el brote se separa de la célula madre y el ciclo de multiplicación está terminado y listo para Imagen 1-3. repetirse. Célula de Levadura en gemación Las levaduras de gemación conservan una cicatriz característica sobre la pared de la célula madre donde alguna vez estuvo adherido un brote. (28)Pág.1428. El número de cicatrices sirve para conocer la vejez de la célula en levaduras de gemación. (9)Pág.104. En su forma típica algunas especies producen múltiples brotes antes de que ocurra el desprendimiento. Si los brotes no se separan, se forman cadenas de levaduras esféricas. Algunas especies producen brotes que de manera característica no se desprenden y se vuelven largos; la continuación del proceso de brotación produce una cadena de células elongadas que se parecen a las hifas y que se denominan seudohifas. Las células que componen un conjunto de seudohifas tienen una constricción característica en el sitio donde se adhieren entre sí. (28) Pág.1429. Imagen 1-3. http://www.joseacortes.com/practicas/levadura 47 Si bien la reproducción de las levaduras es normalmente asexual, mediante la formación de yemas en la superficie celular, se puede además inducir la reproducción sexual en condiciones especiales. En el ciclo sexual, una célula diploide normal (una célula con dos conjuntos de cromosomas y por consiguiente con dos dotaciones de genes) da lugar a dos ascas o células esporógenas, que contienen cuatro ascosporas haploides (células con una sola dotación cromosómica y de genes). Las ascosporas son de dos tipos sexuales: a y alpha. Cada tipo puede desarrollar células haploides por gemación. La unión de una célula haploide "a" con otra "alpha" da lugar a una célula normal diploide a/alpha. Las células haploides del mismo sexo pueden también unirse ocasionalmente, formando células diploides anormales (a/a o alpha / alpha) que sólo pueden reproducirse asexualmente por gemación. (48). 1.6 Características del cultivo: Después de la proliferación en un medio con agar durante 1 a 3 días las levaduras producen colonias pálidas y opacas que en general alcanzan un diámetro de 0.5 a 3 mm. Unas pocas especies tienen pigmentos característicos, pero la mayoría son de color crema. Las colonias de levaduras en los medios de cultivo apropiados tienen diversas formas, contextura y bordes. Algunas son lisas, otras rugosas; unas planas, otras elevadas; con el margen entero, irregular o velloso. La consistencia de las colonias es ligeramente pastosa, pero al envejecer se hacen más espesas y secas. 1.7 Patología: 48 Las infecciones provocadas por levaduras casi todas son oportunistas, se presentan como resultado de rotura de alguna barrera o en pacientes con inmunodeficiencia, desequilibrio fisiológico o desorganización de la flora fungal residente y de la flora bacteriana. Las invasiones causadas por destrucción de las barreras protectoras constituyen el tipo más común de factores predisponentes en este tipo de infección por levaduras. Estas infecciones humanas por levaduras pueden adoptar la forma de enfermedades de la piel (dermatofitosis), o de infecciones de los aparatos respiratorios o intestinales. La colonización por levaduras, en catéteres introducidos, aparatos de venoclisis, unidades de hemodiálisis y otros dispositivos provoca septicemia por el microorganismo colonizador. Con frecuencia estas infecciones se resuelven de manera espontánea con la extracción del catéter. Los microorganismos por sí mismos poseen un potencial de virulencia muy bajo y se encuentran en la segunda o tercera línea de oportunistas, por lo que requieren de una alteración un poco más grave en las defensas del huésped, antes que se produzca enfermedad invasiva. Sin embargo, cuando participan en un proceso de invasión en un paciente gravemente expuesto, puede producir infecciones fulminantes mortales. Las levaduras son una parte constante y común de la flora normal, del hombre por lo que no es de sorprenderse que haya una gran cantidad de informes acerca de asociaciones con enfermedades en los últimos años. (21)Pág.660. 1.8 Importancia: A pesar de producir las levaduras enfermedades potencialmente peligrosas para el ser humano, éstas son también beneficiosas para el mismo. 49 Así, el uso de las levaduras resulta muy provechoso: para la producción de antibióticos, ácidos orgánicos, hormonas esteroides y productos de fermentación (Por ejm: las bebidas alcohólicas y la salsa de soja), como fuente de vitaminas del complejo B y de tiamina, como alimento para animales y seres humanos. El dióxido de carbono producido por la levadura panadera hace que suba la masa en la fabricación del pan; así mismo, las diversas cetonas, aldehídos y ácidos orgánicos que aparecen como consecuencia de las actividades metabólicas de las levaduras en la leche cuajada y en el zumo de uva, nos proporciona los exquisitos quesos y vinos que se pueden disfrutar. Además, las levaduras sirven también como modelos científicos para estudiar la genética, la bioquímica y las relaciones entre parásitos y huéspedes. (17)Pág.66 1.9 Características morfológicas y fisiológicas claves de las levaduras. Cuadro Nº 1 Grupos taxonómicos Seudoh Prolife- ifas o Clamid Tubos Fermenración hifas osGermi- tación de Ureasa a 37 ºC verda- poras nales glucosa deras Ascosporas Utilización de KNO3 + + + + + - - - + + - - + +* - - + - - - - + - + Candida albicans Candida krusei Rhodotorula 50 glutinis Saccharomyces + -* - + + - + - cerevisiae Fuente: Cuadro tomado del libro (28) Pág. 1513, 1514 Donde: *. Variación de cepa. +. Características presentes. -. Características ausentes. 1.10 Características bioquímicas de las levaduras. Cuadro Nº 2 Especies Maltosa Sacarosa Lactosa Galactosa Melibiosa Celobiosa Inositol Xilosa Rafinosa Trehalosa Dulcitol Glucosa Maltosa Sacarosa Lactosa Galactosa Trehalosa Fermentación Glucosa Asimilación C. albicans + + + - + - - - + - + - F F - - F F C. krusei + - - - - - - - - - - - F - - - - - R. glutinis + + + - +* - + - + + + - - - - - - - S. cerevisiae + + + - + - - - - + +* - F F F - F F* 51 Fuente: Cuadro tomado del libro (12) Pág. 527 Donde: *. Variación de cepa. F. Fermentación con producción de gas. +. Crecimiento mayor que en el control negativo. -. Ningún crecimiento mayor que el control ni fermentación. 1.11 SACCHAROMYCES CEREVISIAE 1.11.1 Clasificación: La S. cerevisiae pertenece al Reino de los hongos perfectos. Clase: Ascomicetos. Familia: Saccharomycetaceae. Género: Saccharomyces. Especie: cerevisiae. (12)Pág.835 La familia Saccharomycetaceae comprende todas las denominadas levaduras verdaderas (18) Pág.213 las cuales, en condiciones adecuadas de nutrición, de temperatura y apareamiento sexual, producen ascosporas. (21)Pág.141 1.11.2 Historia: Las levaduras se han utilizado desde la antigüedad en la elaboración del pan y del vino, pero los fundamentos científicos de su cultivo y uso en grandes cantidades fueron descubiertos por el microbiólogo francés Louis Pasteur en el siglo XIX. (42). Luis Pasteur descubrió que en el mosto en fermentación había microorganismos. El principal (más abundante) de ellos era idéntico al que se utilizaba para hacer cerveza y pan: la levadura. La masa de levadura que se usa para el pan es en realidad un conjunto de trillones de células idénticas muy parecidas en su organización a las células que componen un organismo como el nuestro, pero de vida independiente. Esta levadura recibió el nombre 52 científico de Saccharomyces cerevisiae y hoy se puede asegurar que ha sido históricamente el primer microorganismo utilizado por el hombre (aunque de forma inconciente casi siempre), el más importante desde el punto de vista industrial o cultural y el que ha producido la mayor parte del alcohol consumido por la humanidad en toda su historia. (43). 1.11.3 Importancia en la industria: El uso de Saccharomyces tiene grandes beneficios, ya que la levadura en si, proporciona vitaminas del complejo B, minerales, es una buena fuente de proteína y de aminoácidos. Aproximadamente el 40% del peso de la levadura seca constituye proteína. La calidad de la proteína de la levadura es excelente, tratándose de una proteína de origen vegetal, y su calidad es equivalente a la soya, pues ambas son ricas en lisina. 1.11.4 Metabolismo y fisiología: El metabolismo energético de S. cerevisiae se basa principalmente en la glicólisis: emplea una importante diversidad de azúcar como sustrato de esta vía fermentativa que transforma azúcar en etanol y desprende CO2. (44). Glucosa + 2 ADP + 2 Pi 2 etanol + 2 CO2 + 2 ATP La producción de CO2 por la levadura “panadera” es la base de la fermentación de la masa del pan, y la producción de alcohol en zumos de frutas, el principio de la producción de vinos y de cervezas (por levaduras vínicas y cerveceras respectivamente), alimentos básicos asociados al origen de la civilización. Estas son las dos propiedades principales que han hecho de este organismo uno de los más fieles microorganismos asociados al desarrollo biotecnológico del hombre. La vía glicolítica que transforma el azúcar en etanol no es de las más rentables, pero para la cepas de Saccharomyces esta vía supone una importante estrategia de competencia ecológica. 53 Estas levaduras son uno de los organismos más tolerantes al alcohol etílico que existe en la naturaleza, y llega a producir en exceso de azúcar más de un 17% v/v de este alcohol, concentración que resulta totalmente inhibitoria para el crecimiento de cualquier otro microorganismo; esta vía por lo tanto es muy eficaz en el desplazamiento ecológico de otras poblaciones. En la fermentación por la vía glicolítica no hay consumo de oxígeno, pero las levaduras, aunque fermentan, mantienen una respiración basal en la que una fracción de glicerol que se produce por fermentación no se transforma en etanol, sino que se respira. Por tanto, la respiración vía Ciclo de Krebs de los productos de la glicólisis, aunque en baja proporción durante la fermentación, forman una parte importante de su metabolismo. Cuando todos los sustratos fermentables se han fermentado (transformados en etanol) y la competencia microbiana ya ha sido desplazada, la levadura puede entonces sobrevivir consumiendo el etanol producido mediante metabolismo de oxidación. 1.11.5 Orgánulos y estructura de la célula de levadura. Imagen 1-4. Estructura de una célula de levadura. Imagen 1-4. http://www.molineriaypanaderia.com/tecnica/fermenta/levadur1.html 54 1.11.5.1 Pared celular: La célula de levadura está protegida de los cambios y otras agresiones medioambientales por una rígida pared celular, principalmente compuesta por mananos y glucanos. Esta pared no es barrera para el trasiego de metabolitos, e incluso permite el paso de macromoléculas como el propio ADN, como lo demuestra el hecho de que puedan transformarse células intactas con ADN exógeno; sin embargo, la pared puede restringir la salida de algunas enzimas al medio, concentrándolas en el espacio que hay entre la pared y la membrana plasmática (periplasma). 1.11.5.2 Membrana plasmática: La membrana plasmática funciona como una barrera de permeabilidad, está constituida por la presencia de esteroles, los cuales son moléculas importantes en la elasticidad y permeabilidad de las membranas que los contienen. Estas moléculas dan mayor rigidez y hacen a las membranas menos permeables. La composición de la membrana respecto a estos esteroles, ácidos grasos, proteínas y otros componentes, varía significativamente según la tasa de crecimiento de la célula y las condiciones ambientales. Existe un grupo de antimicóticos que interaccionan muy selectivamente con los esteroles. La nistatina es uno de ellos; ésta droga inhibe muy eficazmente el crecimiento de las levaduras pero no tiene efecto alguno en bacterias. La membrana plasmática tiene en las células de Saccharomyces (y otras levaduras) un papel elemental en el transporte de metabolitos primarios, como iones, azúcares y aminoácidos. Este transporte está normalmente aclopado a protones, bien por cotransporte (symport), o bien por intercambio (antiport), y en ambos casos se 55 emplea la fuerza que genera un gradiente de protones entre el exterior y el interior de la célula a ambos lados de la membrana. Este gradiente lo crea la propia levadura; cuando a una suspensión de levaduras se añade glucosa, parte de la energía que se produce durante la fermentación (ATP) se emplea en bombear protones al exterior con la ayuda de una ATPasa ubicada en la membrana plasmática. El bombeo activo de protones es capaz de producir en poco tiempo una fuerte acidificación externa. Muchas permeasas de azúcares y aminoácidos acoplan la entrada de estos metabolitos con la de los protones, y hacen que entren rápidamente en la célula. Así, la tasa de salida activa y de entrada pasiva se equilibran, y se mantiene. La acidificación activa de la levadura también es muy útil en términos de competencia microbiana, puesto que muchas bacterias son sensibles a pHs muy ácidos. La acidificación se destruye instantáneamente añadiendo trazas de nistatina, resaltando el papel esencial que el ergosterol tiene en la funcionalidad de esta membrana. 1.11.5.3 Mitocondrias: Estos orgánulos están destinados al metabolismo oxidativo, poseen su propia información genética en una molécula de ADN circular que codifica información para algunas funciones propias de respiración y para la síntesis de algunas de sus propias proteínas. Existen drogas que afectan exclusivamente a estas funciones y la obtención de cepas resistentes a ellas ha permitido asignar marcadores genéticos específicos del genoma mitocondrial que han resultado de gran utilidad para estudiar los patrones de herencia no mendeliana que sigue este genoma. 56 La secuencia completa del ADN mitocondrial (mitADN) se obtuvo ya hace años para S. cerevisiae. Desde el punto de vista genético, esta secuencia aporta una importante información en cuanto a la totalidad de las fases abiertas de lectura que se encuentran en ella (algunas de función aún desconocidas) y respecto a la propia composición de bases. En este sentido es interesante destacar el enorme sesgo composicional que presenta este genoma dado que es especialmente rico en pares AT. Esta riqueza en AT es atípica en el genoma nuclear, lo que hace, junto a la gran cantidad de copias de este genoma que tiene cada célula (de 20-50 copias/célula), una simple digestión con una restrictasa que reconozca pares de GC en su diana permite separar y analizar molecularmente el mitADN. En las cepas de Saccharomyces con frecuencia (más del 1% de las células) son mutantes espontáneos que pierden la capacidad de respirar. Sorprendentemente estos mutantes carecen totalmente de mitADN. 1.11.6 Genoma nuclear: En las levaduras, el genoma nuclear está organizado en cromosomas lineales. Para S. cerevisiae se identifican en las cepas de laboratorio 16 cromosomas distintos cuyos tamaños en kilopares de bases (kb) se expresan en el siguiente cuadro: Cuadro Nº 3. Cromosoma Tamaño (kb) Cromosoma Tamaño (kb) 57 I 240 IX 440 II 840 X 755 III 350 XI 680 IV 1 640 XII 2 195 V 590 XIII 950 VI 280 XIV 810 VII 1 120 XV 1 130 VIII 590 XVI 980 Fuente: Cuadro tomado del libro (9) Pág.42 Los cromosomas de levaduras sufren un ciclo de condensación en mitosis (fase M) y de descondensación en interfase (fase S) como el de todos los eucariotes, con una estructura semejante, pero su tamaño es tan pequeño que las herramientas citogenéticas convencionales que se aplican a eucariotes superiores no son útiles en ellos. Desde un punto de vista bioquímico el tamaño de la molécula de ADN de cada uno de estos cromosomas es tan grande que no puede resolverse por electroforesis normales, pero la electroforesis de campo pulsante ha permitido resolver el ADN lineal de cada uno de ellos. Esta técnica demostró por primera vez un organismo que el número de cromosomas deducido por ligamento mediante análisis genético coincide con el número de bandas de ADN (cromosomas) identificadas en un gel de electroforesis. La electroforesis de campo pulsado constituye actualmente la principal herramienta para determinar el cariotipo “molecular” de estos eucariotes unicelulares. La organización de cromosomas en forma lineal exige la presencia de elementos especiales para un funcionamiento, como son los centrómeros los telómeros y los orígenes de replicación, éstos actúan en cis sobre la molécula en la que están ubicadas. 58 Tanto centrómeros como telómeros resuelven problemas muy específicos de cromosomas lineales y están por tanto ausentes en el genoma bacteriano, en el de mitocondrias o en el de cloroplastos. 1.11.7 Ciclo de vida: La división por gemación, representa una forma vegetativa de proliferación en el que, salvo por mutación espontánea, conversión genética o recombinación mitótica, no existe cambios significativos en la información genética de una célula a sus descendientes. Imagen 1-5. Célula de Levadura en gemación Como alternativa a este ciclo básico de procreación, existe la posibilidad de intercambiar información genética entre dos cepas de sexo contrario con la esperanza de que una nueva combinación entre los alelos presentes en una y otra origine descendientes con nuevos matices fenotípicos que amplíen el espectro adaptativo de la especie. Así, en términos evolutivos, la reproducción sexual de los organismos permite ensayar en unas pocas generaciones nuevos fenotipos con una mejora en la aptitud genética, algo muy útil para sobrellevar cambios de importancia evolutiva que puede ocurrir con una tasa mucho mayor que la mutación. La ventaja que supone para los seres vivos la reproducción sexual es tan alta que se mantiene desde los eucariotes más simples a los más complejos. En las levaduras como la S. cerevisiae se conoce dos tipos de cepas según su comportamiento sexual, las denominada de tipo” a” y “alpha”. Las levaduras haploides del sexo “alpha” expresan continuamente un péptido, conocido como feromona “alpha”, que bloquea el ciclo celular de las levaduras tipo a en G1 e induce en ellas la producción de feromona “a”, que a su vez bloquea en G1 el ciclo de la célula “alpha”. Así, la proximidad física de dos células de sexo contrario permite la Imagen 1-5. http://www-micro.msb.le.ac.uk/video/Scerevisiae.html 59 sincronización en G1 de sus ciclos celulares por la acción de las feromonas. Una vez sincronizadas ambas células se funden dando lugar a un cigoto diploide que en sucesivas mitosis genera células diploides. Las células diploides no expresan feromonas y se pueden dividir vegetativamente de forma indefinida hasta que una falta de nitrógeno, o unas pésimas condiciones ambientales, induce a la meiosis produciendo un asca con 4 esporas haploides. (9)Pág.36-38, 41-43, 4546. Cada uno de estos núcleos hijos se encierran en una cubierta que está compuesta por sustancias nutritivas de reserva, constituyendo las ascosporas. Las ascosporas son muy resistentes al estrés ambiental, por lo que también suponen una forma de resistencia. En condiciones favorables, la espora germina y se comporta como si fuera una célula haploide, reproduciéndose por gemación. En conclusión el ciclo de vida de S. cerevisiae alterna fases vegetativas haploides y diploides durante su ciclo de vida. (18)Pág.220 1.11.8 Morfología: Las células son ovoides o esféricas, miden de 3 a 5 um. (12)Pág.538. 1.11.9 Patogenia: Las levaduras ascosporógenas, como la S. cervisiae pueden ser una pequeña parte de la flora normal de la garganta y del tubo alimentario. En Europa, la S. cerevisiae ha sido implicada en varios casos de enfermedad pulmonar, sobre todo entre los cerveceros, en los cuales se observó que el microorganismo colonizó el parénquima pulmonar y, en repetidas ocasiones, se aisló del esputo. (21) Pág.666. Además, es responsable de causar micosis del estomago y producir vulvovaginitis en pacientes diabéticos. (12). 60 1.12. RHODOTORULA GLUTINIS Es un contaminante transportado por el aire; en forma común se encuentra en la piel, pulmones, orina, y heces. Las características principales del género es la presencia de pigmentos carotenoides. (21)Pág.660. 1.12.1 Clasificación: R. glutinis pertenece al reino de los hongos imperfectos (Deuteromicetos). Clase: Blastomycetes. (28)Pág.1439. Familia: Cryptococaceae. Subfamilia: Rhodotoruloideae Género: Rhodotorula. Especie: glutinis (12) Pág.538 1.12.2 Morfología: Las células son ovoides, pequeñas alargadas, individuales o en cadenas cortas, o en racimos; su diámetro es de 2 a 6.5 um. Las células de R. glutinis crecen con facilidad en casi todos los medios de cultivo y sus colonias mucoides de color rojo coral son características. 1.12.2 Patología: La causa más frecuente de fungemia por Rhodotorula son: catéteres colonizados, soluciones intravenosas contaminadas, aparatos de banco de sangre, de diálisis y de corazónpulmón contaminados. Los pacientes contaminados presentan además de los síntomas de choque endotóxico, cultivo de sangre positivo. 61 Por lo regular, al quitar la fuente de contaminación se eliminan los síntomas; en algunos casos es necesaria la terapéutica (Ej.: con Anfotericina B) durante breves periodos. (21)Pág.661. Por R. glutinis se han reportado rara vez casos de septicemia, meningitis y infecciones crónicas de la piel. (12)Pág.538 1.13 CANDIDIASIS La candidiasis es una micosis aguda o subaguda capaz de comprometer cualquier tejido del organismo; es provocada por hongos levaduriformes del género Candida en especial Candida albicans. A diferencia de otros hongos cuya fuente es el ambiente, el reservorio del género Candida es por lo general la propia flora endógena del paciente. (45). Historia: En el año de 1.839 Langenbeck descubrió el microorganismo del muguet (C. albicas), observándolas en forma de placas en las membranas mucosas de la boca y otros órganos en cadáveres al momento de las autopsias. Gruby en 1842 confirmó esta observación denominándola Oidium albicans, aislándolo en las rodajas de papas que eran frotadas en la cabeza de un niño que padecía de la enfermedad. Para el año 1923 Burkhout la denominó Candida; terminología utilizada actualmente. (46) Distribución: Es ubicua y se encuentra principalmente en la mucosa de la boca, tracto gastrointestinal y genital formando parte de la flora normal. Este microorganismo coloniza las superficies mucosas de todos los seres humanos al nacer durante el parto o poco después. 62 Su crecimiento está controlado por las defensas del cuerpo y por los demás miembros de la flora, pero evidentemente, el riesgo de la infección endógena está siempre presente. (48). Características de su cultivo: En la mayor parte de los medios de cultivo las especies del género Candida no pueden diferenciarse sobre las base del aspecto de sus colonias. En 24 a 48 horas producen colonias sobreelevadas, de color crema y opacas, de aproximadamente 1 a 2 mm de diámetro. Después de varios días en un medio con agar es posible observar hifas que penetran en el agar. (28)Pág.1512. Aspectos microscópicos: Las especies del género Candida producen levaduras elipsoides o esféricas con brotes que miden alrededor de 3 a 6 μm. De manera habitual se forman múltiples brotes y seudohifas en los medios deficientes de sustratos fácilmente metabolizables. (28)Pág.1512. Etiología: Candida es un saprofito habitual de la piel, las mucosas y el hombre es el principal reservorio. Se torna patógena cuando las defensas locales (lesión cutánea o mucosas) o generalmente del huésped se debilitan (infecciones oportunistas): enfermedades nutricionales o metabólicas, en particular diabetes, hemopatías malignas, neutropenia, en la administración de ciertos medicamentos (como: antibióticos, corticoides, estroprogestágenos o inmunosupresores), o en caso de SIDA. Las formas generalizadas (diseminación por vía hematógena) puede provenir de lesiones de las mucosas, inyecciones no estériles (toxicomanías), sondas contaminadas (infusiones I.V. o sondas urinarias). (6)Pág.463 Síndromes clínicos: 63 El espectro de infecciones producidas por los microorganismos del género Candida incluyen enfermedades localizadas de la piel y las uñas; enfermedades que afectan las superficies mucosas de la boca, la vagina, el esófago y el árbol bronquial; y enfermedades que se diseminan y afectan muchos órganos y sistemas. Las enfermedades por Candida que afectan piel y uñas suelen ser similares a las infecciones por dermatofitos. (17)Pág.644 1.13.1 CANDIDA ALBICANS Muchas de las infecciones por levadura en el hombre son causadas por C. albicans, siendo reconocido como de serotipo A y de actividad de tipo endotoxina. (46). Como parte de la flora normal C. albicans prolifera como levadura oval en gemación (3 a 6 μm); las hifas solo se producen durante la invasión tisular. (23) Pág.1512. 1.13.1.1 Clasificación: La C. albicans pertenece al Reino de los hongos imperfectos (Deuteromicetos). Clase: Blastomices Orden: Cryptococales Familia: Cryptococaceae. Género: Candida Especie: albicans. (46) 1.13.1.2 Morfología y Fisiología: C. albicans es una levadura grampositiva, son organismos aerobios, levaduriformes, capaces de desarrollar seudofilamentos y producir clamidosporas (tipo de espora asexual). Esta es capaz de producir hifas verdaderas de un ancho uniforme que crecen por elongación apical y forman tabiques en ángulos rectos con poros revestidos de membrana. Las 64 seudohifas son formadas por las células con brotes que se elongan y continúan conectadas, siendo estas más anchas que las hifas verdaderas, teniendo constricciones en los sitios de unión. Su diámetro varía entre 3-6 μm, de forma oval y paredes delgadas. Se observa células con brotes de células hijas, las cuales son cortas denominadas seudohifas, a veces se observan largas formas con grupos celulares (blastosporas) en las constricciones. Las hifas tan solo se producen en el momento deImagen la invasión 1-6. a los tejidos, Candida existiendo albicans: Blastosporas, seudohifas y clamidosporas cultivo a 20 ºC. numerosos estímulos ambientales que desencadenan en o bloquean la conversión in vitro de la levadura a hifas, desconociéndose la regulación de la morfogénesis de C. albicans. La C. albicans presenta su actividad a la respuesta inmunomoduladora y de adherencia al tejido. Un estímulo incuestionable es el suero humano ya que en 90 minutos a 37°C, esta comienza a formar hifas; esta reacción se manifiesta por la aparición de un tubo germinal, un apéndice elongado que crece hacia afuera y que tiene aproximadamente la mitad del ancho y el doble de largo de la célula de la levadura. (28) Pág. 1512-1513. Es importante la bioenergética de este género ya que en ese proceso se fermenta glucosa y maltosa con producción de gas, en forma parcial de la sacarosa y no ataca a la lactosa. Estas fermentaciones de los carbohidratos junto a las características morfológicas distinguen a C. albicans de las otras especies de Candida. (46). 1.13.1.3 Dimorfismo: Imagen 1-6. http://arachosia.univ-lille2.fr/labos/parasito/Candida.html 65 La C. albicans es dimórfica; además de las levaduras y las seudohifas, también puede producir hifas verdaderas. Muchas especies de hongos proliferan como levaduras o como mohos, pero algunas especies son dimórficas y capaces de proliferar en más de una forma en diferentes condiciones ambientales. Algunos hongos patógenos como C. albicans Imagen 1-6.Morfogénesis de Candida albicans presentan dimorfismo térmico; crecen como levaduras a 37ºC y como mohos a temperaturas más bajas, como 25 a 30ºC. (28)Pág.142. 1.13.1.4 Determinantes de la patogenicidad: La producción de hifas y la resistencia a la destrucción fagocítica se asocia con la virulencia. Los extractos de C. albicans tienen actividad de tipo endotoxina, pero esta actividad no es un aspecto sobresaliente de la patogenicidad del microorganismo. Las células de C. albicans son capaces de adherirse a la membrana de las células epiteliales por medio de una interacción ligando-receptor específica y los tubos germinales presentan mayor adherencia que las levaduras. El microorganismo se adhiere a las células mucosas gastrointestinales, vaginales y bucales, a los corneocitos, a las células endoteliales vasculares y a las matrices de fibrina y plaquetas. Esta adherencia a las células del huésped y la penetración en ellas se asocian con la patogenicidad. La adhesina de las levaduras parece ser un manano o una glicoproteína. También este tipo de levadura se adhiere a los catéteres y a las prótesis; esta adherencia se basa en las fuerzas hidrófobas y electrostáticas que reproducen entre la levadura y la superficie del plástico. Imagen 1-6. (28) Pág. 1512. 66 Casi todas las cepas de C. albicans secretan proteasas inducibles capaces de digerir las inmunoglobulinas y otros sustratos del huésped. (28)Pág.1514-1515. 1.13.1.5 Patogenia y patología: La candidiasis superficial (cutánea o mucosa) se establece a consecuencia de un incremento en la población local de cándida y del daño a la piel o el epitelio que permite la invasión local por la levadura y las seudohifas. La histología local de las lesiones cutáneas o mucocutáneas se caracterizan por reacción inflamatoria que varía desde abscesos piógenos hasta granulomas crónicos. Las lesiones contienen abundantes yemas de levaduras y seudohifas. La candidiasis sistémica se presenta cuando la cándida penetra al torrente sanguíneo y la defensas fagocíticas del huésped son inadecuadas para contener su crecimiento y diseminación. Desde la circulación la cándida puede afectar los riñones, fijarse a las prótesis valvulares cardiacas o producir infección candidiásica casi en cualquier parte, en especial riñon, piel (lesiones maculonodulares), ojos corazón y meninges. La candidiasis sistémica casi siempre se correlaciona con la administración crónica de corticosteroides o de otros agentes inmunodepresores, con enfermedad hematológica como leucemia, linfoma y anemia aplásica, o con enfermedad granulomatosa crónica. Las infecciones del riñón comúnmente son una manifestación sistémica, en tanto que las infecciones del aparato urinario en general se relacionan con una sonda de Foley, diabetes, embarazo o antibióticos. (8) Pág. 684-685. 1.13.2 1.13.2.1 CANDIDA KRUSEI Clasificación: La C. krusei pertenece al Reino de los hongos imperfectos (Deuteromicetos). 67 Clase: Blastomices. Orden: Cryptococales. Familia: Cryptococaceae. Genero: Candida Especie: krusei. (46) 1.13.2.2 Morfología: Son colonias de color blanco a crema, lisas, pequeñas, elongadas a ovoides; miden de 2.0-5.5x4.0-15.0 μm. 1.13.2.3 Significado Clínico: Candida krusei se asocia regularmente con algunas formas de diarrea infantil y ocasionalmente con enfermedades sistémicas. Se han reportado casos de que C. krusei ha sido responsable de colonizar el tracto gastrointestinal, respiratorio y urinario en pacientes con granulocitopenia. El aislamiento del medio ambiente se realiza de la cerveza, productos lácteos, piel, etc. (46) Fermentación de carbohidratos de pora Lactosa Maltosa Ureasa Galactosa 37°C Clamidos- Sacarosa 25°C Prueba Glucosa Levaduras diferentes temperaturas C .albicans + + + - + + + - + C. krusei + + + + - + + - - Fuente: Cuadro tomado de (49) 68 CAPITULO II PLANTAS DEL BOSQUE DE MAZÁN CAPITULO # 2 69 PLANTAS DEL BOSQUE DE MAZÁN 2.1. CARACTERÍSTICAS DEL BOSQUE DE MAZÁN. El Bosque de Mazán, es una reserva ubicada a 10 Km al oeste de la ciudad de Cuenca en la vía Cuenca-Molleturo-Naranjal, perteneciente a la provincia del Azuay. Este tiene una superficie de 7200 ha; al norte y sur dos barreras forman un callejón por donde atraviesa el río Mazán. El punto más alto de la microcuenca es de 4137 msnm y el más bajo a 2800 m justo en la desembocadura del río Mazán en el río Tomebamba. La erosión de suelos, deforestación, degradación de aguas dulces, degradación de la pesquería y hábitats costeros, urbanización de tierras agrícolas, perdida de biodiversidad, polución del aire, desastres naturales y abusos de pesticidas son los principales problemas ambientales. (23)Pág.6. Por los problemas mencionados es necesario contar con reservas naturales las cuales gracias a sus beneficios ayudan a disminuir o controlar los mismos. El río de Mazán, que se forma de una cadena de lagunas entre las más importantes la Totoracocha, Tintacocha y por numerosas quebradas de aguas cristalinas en todo su recorrido, constituye el 20% del caudal del río Tomebamba, principal afluente que abastece de agua potable a la ciudad de Cuenca. El relieve es accidentado en el cual las gramíneas forman una alfombra que mantienen la humedad del suelo y así contribuyen también la regulación del agua. El Bosque de Mazán es uno de los últimos remanentes de vegetación original altoandina que queda en la provincia del Azuay. En el se hallan aproximadamente 300 especies de plantas superiores; de ellas 80 son leñosas y de estas últimas, la mitad son forestales (23) Pág.10. Entre las hábitats se distinguen, el bosque primario, bosque secundario, páramo arbustivo o subpáramo, pastizal, páramo (en su mayor extensión) y riscos. Es importante nombrar el bosque primario por su característica de la vegetación original que no ha sufrido alteraciones en su composición y estructura por la actividad humana. 2.2. DESCRIPCIÓN DE LAS PLANTAS DEL BOSQUE DE MAZÁN 70 AGUACHENTO Género: Pilea Especie: sp. Familia: URTICACEAE Otros nombres comunes: “Chinisacha”, “Ortiguilla” DESCRIPCIÓN BOTÁNICA Planta de 1 a 2 m de altura, de tallos fibrosos, desprovistos de pelos urticantes, huecos y nudosos. Las hojas son opuestas, elípticas, de base aguda, borde dentado y con tres venas principales. Inflorescencias cimosas dispuestas en agrupaciones axilares. Flores unisexuales, las masculinas de 4 sépalos libres y 4 estambres; las Aguachento femeninas de 3 sépalos y un ovario súpero. El fruto es un diaquenio. (23). USOS En el campo se utiliza para alimentación de cobayos; también se la debe considerar a Pilea sp. como posible banco de proteínas. ALISO Género: Agnus Especie: acuminata Familia: BETULACEAE Otros nombres comunes: “Rambrán” o “Ranrán”, “Jaul”, “Cerezo”. DESCRIPCIÓN BOTÁNICA 71 El aliso es un árbol de tronco circular y copa aparasolada, que llega a medir hasta 20 m de altura; su corteza es de color gris a diferencia del color de la madera que es amarillenta. Las hojas son simples, alternas, pecioladas, de limbo oval y de margen doblemente dentado; el haz es de color verde intenso y el envés más claro. Las inflorescencias masculinas miden de 5 a 12 cm de largo, estos amentos colgantes terminales “caen enteros después de la floración”. Las inflorescencias femeninas son “amentos pistilados leñosos”, situados en las axilas de las hojas, sin perianto, de color verde cuando jóvenes. El fruto es una piña dehiscente. (23). Aliso USOS El aliso es usado como combustible, materia prima en la elaboración de herramientas para la agricultura, utensilios de cocina, construcciones y para elaboración de diferentes objetos en mueblería y artesanías. También posee propiedades curativas. En la medicina indígena las hojas se calientan y se “preparan emplastos que se usan sobre granos”, supuraciones y zonas afectadas por reumatismo (CESA, 1992). Se le atribuye también propiedades “astringentes, tónicas, antiinflamatorias, eméticas, hemostáticas, antigripales, desinfectantes y emenagogas” (CESA 1993). (23)Pág.20-21. CANELO Género: Ocotea Especie: infrafoveolata Familia: LAURACEAE Otros nombres comunes: “Facte”, “Tulapo”, “Yalte negro” 72 DESCRIPCIÓN BOTÁNICA Árbol de 20 m de altura, de tronco cilíndrico, ramificación alterna; corteza lisa de color grisáceo, resinosa que presenta exudado claro. Las hojas son alternas, elípticas, lanceoladas, coriáceas, de borde entero, pecíolo corto, ápice acuminado y base ahusada. El haz es verde oscuro, el que es atravesado por una nervadura central amarillenta y el Canelo* envés es de color café rojizo, tomentoso, con nervadura destacada. Las inflorescencias son racimosas, verde amarillentas y agrupan a flores completas. El cáliz es deciduo, hexámero, tomentoso y dialisépalo; la corola es actinomorfa, que protege de 9 a 11 estambres. El ovario es ínfero y el estigma es capitado. El fruto es un glande. (23). USOS La madera del “Canelo” es usada en la industria de la mueblería y para leña. CENTROPOGON Género: Centropogon Especie: sp. Familia: LOBELIACEAE DESCRIPCIÓN BOTÁNICA Arbusto pequeño de 1 a 2 m de altura, de tronco semileñoso, cubierto por una capa vellosa, simpódico, verde amarillento. Hojas simples, oblongas, rugosas, de base aguda y ápice acuminado; el haz es de color verde oscuro y el envés tomentoso café amarillento. Caracterizado por flores solitarias, axilares de sépalos triangulares, persistentes; corola zigomorfa, gamopétala, tubular, Imagen 2-1. SERRANO, Felipe. 1996. Pág. 58 Centropogon 73 curvada, tomentosa, de color rojo anaranjada, limbo amarillo brillante. Los estambres son pubescentes y el ovario es ínfero y bilocular. El fruto es una baya carnosa, globosa, que almacena varias semillas. (23). USOS El “Centropogon” es útil para la recuperación de hábitats y para la avifauna. CHILCA NEGRA Género: Baccharis Especie: latifolia Familia: ASTERACEAE o COMPOSITAE Otros nombres comunes: “Chilca larga” DESCRIPCIÓN BOTÁNICA Arbusto de 2-4 m de altura, de tallos cilíndricos, ramificación y follaje abundante. Las hojas son simples, alternas, esparcidas, semicoriáceas, pecioladas, de lámina lanceolada, ápice agudo a ligeramente acuminado, base cortamente cuneiforme y borde aserrado: el haz presenta un color verde brillante y el envés verde claro con 3 nervios principales. Las inflorescencias son en panículas compuestas, que agrupan a flores dispuestas en capítulos o cabezuelas homógamas discoides. La especie es dioica. Cabezuelas masculinas portando entre 20-30 flores. Flores masculinas de unos 5 mm de longitud; corola tubular de 3.8 mm de largo, limbo profundamente 5-lobulado, lóbulos reflexos. 5 estambres con las anteras soldadas formando un tubo que rodea parte del estilo, filamentos delgados insertos en la base de los lóbulos de la corola, estilo con dos ramas cortas subuladas, exsertas del tubo de las anteras; vilano compuesto por pelos irregulares ralos. Cabezuelas femeninas con 30 a 40 flores. Flores femeninas de unos 4 mm de longitud, corola de 2 mm de largo, filiforme con el limbo truncado provisto de diminutos dientes apicales; estilo alargado con 2 ramas cortas lineares, vilano uniseriado de pocos pelos blanquecinos; ovario ínfero 0,9 - 1 m de longitud. (15) Pág.110. El fruto es un aquenio pequeño. USOS 74 Es una planta muy usada y una de las más importantes en la actividad agroforestal. En medicina tradicional indígena y campesina, también presenta múltiples usos: por ejemplo, en emplastos y fomentos con sus hojas para golpes, fracturas, heridas e hinchazones; para el reumatismo en emplastos, fomentos e infusión con las hojas; para el denominado “mal de orina”, afecciones al pecho, diarrea, problemas del hígado, cólicos y borrachera, mediante la infusión con sus hojas y flores y finalmente para sarpullidos y afecciones a la piel de los niños, se realiza fomentos y emplastos con sus hojas a veces mezcladas con licor o aguardiente. (15)Pág.111-112 También la usan para curar el “espanto” y “el mal aire”. CHUL CHUL Género: Vallea Especie: stipularis Familia: ELAEOCARPACEAE Otros nombres comunes: “Sacha capulí”, “Pichul”, “Pera caspi”, “Rosas”, “Chaimulán”. DESCRIPCIÓN BOTÁNICA Árbol que alcanza de 8 a 10 m de altura, de tronco cilíndrico, copa redonda y corteza externa café. Las hojas del Chul Chul son simples, ovadas, alternas, de borde entero, base truncada, ápice acuminado; haz de color verde amarillento y envés verde claro. La inflorescencia es una panícula, que contiene de 9 a 14 flores completas de color rosado. Las flores tienen cáliz caduco y pentámero, al igual que la corola; estambres en número de 32 y ovario súpero, con estilo simple y estigma compuesto. (23). Chulchul El fruto es una cápsula globosa negruzca cuando esta madura, que contiene de 2 a 5 semillas. USOS 75 Este árbol se utiliza para conformar cortinas rompevientos, la madera del mismo para construcciones y elaboración de herramientas; el follaje para la alimentación de animales. Sus flores se utilizan en la medicina indígena, en infusión como sedante o calmante. (23). CHUQUIRAHUA Género: Chuquiraga Especie: jussieui Familia: ASTERACEAE o COMPOSITAE Otros nombres comunes: “Chuquiragua”, “Flor del andinista”. DESCRIPCIÓN BOTÁNICA Arbusto pequeño que puede medir de 0.8 a 1.2 m de altura, con ramificación densa y rígida, abundante follaje; las ramitas terminales son robustas, lignificadas, nudosas de color café. Presenta hojas simples, alternas, imbricadas, subsésiles, coriáceas, limbo ovado, borde entero, ápice agudo prolongado en una espina de 1mm de longitud; haz glabro verde lustroso y envés con un nervio central protuberante. Las flores se agrupan en cabezuelas terminales, de forma acampanada, solitarias con brácteas espinicentes imbricadas anaranjadas. Cada flor es tubular perfecta en un promedio de 20 a 26 por cabezuela, papus plumoso, corola tubular anaranjada o amarillo naranja; androceo con 5 estambres y gineceo con un ovario ínfero y estilo de color tomate. (15). USOS Es una planta ampliamente conocida y utilizada en medicina tradicional. Los campesinos del sector mencionan que sus flores y hojas en infusión, sirven para curar gripes y resfríos. Además posee efectos medicinales tales como: diurética, febrífuga, tónica, reconstituyente (Cordero, 1984; Acosta Solís, 1992; CESA, 1993a). Anti-reumática, anti-inflamatoria y anti-palúdica (CESA, 1993a). También sirven para curar problemas del hígado, riñones, sangre, de la piel (sarpullidos) y molestias menstruales (CESA, 1993a). El zumo de su tallo aplicado sobre las heridas, tiene efectos cicatrizantes (CESA, 1993a; CESA, 1993b). (15) Pág.136. DUMBRIR Género: Palicourea Especie: aragmatophylla 76 Familia: RUBIACEAE Otros nombres comunes: “Cascarilla”, “Aya rambrám”, “Tugnashi amarillo” DESCRIPCIÓN BOTÁNICA Arbusto de 4 a 5 m de altura, de tronco grueso, cilíndrico, irregular y corteza externa rojiza. Las hojas son simples, opuestas, de ápice apiculado, borde entero; haz verde con una nervadura amarillenta en el centro. P. aragmatophylla presenta inflorescencias en forma de panícula, de pedicelos amarillo brillante. Las inflorescencias se disponen de flores completas; el cáliz al igual que la Dumbrir corola son pentámero y pétalos verdes; el ovario es súpero bilocular y el estigma sobresaliente y capitado. El fruto es una baya. USOS La madera de este arbusto es usada para construcciones por ser resistente al agua. El género Palicourea contiene poli-indoleninas. (23). FLORIPONDIO Género: Brugmansia Especie: sanguinea Familia: SOLANACEAE Otros nombres comunes: “Guándug”, “Guanto”. DESCRIPCIÓN BOTÁNICA B. sanguinea es un arbusto de 5 a 10 m de altura, de corteza externa café verdosa y ramificación alterna. Las hojas son simples, alternas, pecioladas, de lámina lanceolada, ápice acuminado-agudo, base oblicua a obtusa, haz pubescente, borde entero sinuado. 77 Las flores se caracterizan por tubulares, solitarias, péndulas, de pedicelos redondos, glabros y flexibles; cáliz de color verde, corola tubular infundibuliforme de 20 a 22 cm de largo, glabra, roja hacia el ápice y amarilla verdosa hacia la base, fragante, posee 5 lóbulos dentados. El androceo se compone de 5 estambres, anteras basifijas linear- Floripondio oblongas; gineceo constituido por un pistilo central, ovario bilocular que contiene dentro varios óvulos y estigma bilobulado. El fruto es una baya que contiene varias semillas. (15). USOS El “Guándug” o “Floripondio rojo” es una planta medicinal muy conocida en toda la Sierra ecuatoriana; los campesinos del sector la usan fundamentalmente para realizar las denominadas “Limpias” de Espanto y Mal aire o “Antimonio” para contrarrestar los hechizos y eliminar la envidia. También es usada como planta alucinógena; así, antiguamente, con la corteza de sus raíces y el endocarpo de sus frutos preparaba un tósigo denominado “Guarguar” que tenía efecto alucinógeno en los individuos a quienes se les daba de beber. Sus hojas en forma de emplastos se aplican sobre heridas y zonas afectadas por el reumatismo, también para curar golpes y reducir hinchazones. En infusión para aliviar la gripe y, como bebida o cocimiento disminuye los síntomas del reumatismo y ayuda en la recuperación de fracturas. (15)Pág.29. GAÑAL Género: Oreocallis Especie: grandiflora Familia: PROTEACEAE Otros nombres comunes: “Galuay”, “Cucharilla”, “Galvay”, “Chapka”. 78 DESCRIPCIÓN BOTÁNICA Árbol que llega a medir de 6 a 10 m de altura; de tronco cilíndrico y corteza lisa de color café. Las hojas son simples, enteras, pecioladas, ovaladas, de borde entero, base redondeada, sin estípulas, consistencia semicoriácea y dispuestas en espiral; el haz es de color verde oscuro y el envés verde claro. Gañal Las inflorescencias son racimos terminales de color blanco o ligeramente amarillento. Los frutos se originan a partir de las inflorescencias en un número de 6 a 10; consisten en una pequeña cápsula que lleva aproximadamente unas 30 semillas. (23). USOS O. grandiflora es utilizada para la elaboración de diferentes herramientas para la agricultura, utensilios de cocina, para leña y para la industria de la mueblería. En la medicina tradicional el “Gañal (flores)” es utilizado para la preparación de la “agua de frescos” y para el tratamiento de tos, asma, enfermedades renales y enfermedades hepáticas. (23). GYNOXYS Género: Gynoxys Especie: buxifolia Familia: ASTERACEAE o COMPOSITAE Otros nombres comunes: “Gomango”, “Piquil”, “Capote”, “Mola-renri”. DESCRIPCIÓN BOTÁNICA 79 Planta que puede llegar a medir hasta 5 m de altura, de copa irregular, ramificación opuesta, tronco cilíndrico, la corteza es de color ploma con puntuaciones negruzcas. Las hojas son simples, opuestas, ovadas, sin estípulas, ápice agudo o redondeado, base redondeada, borde entero, haz verde oscuro lustroso con manchas negruzcas y envés blanquecino puberulento. Las inflorescencias son de color amarillo intenso del tipo paniculado-corimbosas. Cabezuelas heterógamas, cada una contiene usualmente 18 flores. El fruto es un aquenio de color café oscuro. (15). USOS Gynoxys Es utilizada para construcciones rústicas, leña; las hojas sirven para forraje de ovejas y cuyes. Gynoxys mediante emplastos es usada para curar molestias producidas por enfriamientos. (15) HUAHUAL Género: Myrcianthes Especie: rhopaloides Familia: MYRTACEAE Otros nombres comunes: “Arrayán” DESCRIPCIÓN BOTÁNICA M. rhopaloides es un árbol de 15 m de altura, de tronco cilíndrico, copa irregular; corteza exterior rojiza, escamosa, resinosa y se desprende fácilmente. Las hojas son simples, opuestas, de consistencia coriácea, limbo ovalado, borde entero y base redondeada, se unen al tallo por un pecíolo corto lignificado. El haz es verde oscuro, lustroso, glabro y el envés es verde amarillento con la nervadura central prominente. En lo que refiere a las flores estas son hermafroditas, completas y estaminoideas. Poseen cáliz dialisépalo verde, corola 80 Huahual blanca tetrámera, de pétalos redondos y libres. Los estambres son numerosos y oscilan entre 9 y 10 cm de largo; el ovario es ínfero, el estilo largo y el estigma capitado. El fruto del “Arrayán” es una drupa carnosa, de color rojo oscuro de maduro, que contiene en su interior solo una semilla. (23). USOS La madera de este árbol se ha utilizado para la elaboración de diferentes objetos como herramientas, marcos, vigas y leña. Los campesinos usan las aromáticas hojas de algunas especies para mejorar la salud dental y proteger las encías. También se les atribuye la característica de ser útil para el tratamiento de enfermedades pulmonares, reumáticas y en hemorragias. De varias especies de la familia MYRTACEAE se derivan productos farmacéuticos con propiedades: carminativos, antisépticos, analgésicos dentales y expectorantes. Sus especies son ricas en taninos, aceites volátiles y saponinas. (23). También se utilizan ampliamente en la industria de la perfumería, cosmetología y de la madera. JOYAPA Género: Macleania Especie: rupestris Familia: ERICACEAE Otros nombres comunes: “Joyapita”, “Hualicón”, “Chaqui lulo”, “Yurac-joyapa”. DESCRIPCIÓN BOTÁNICA Arbusto de 0.6 a 2 m de altura, terrestre o epífito, con ramas lianoides muy largas; tallos viejos rastreros, recubiertos de corteza café o blanquecina desprendible. Las hojas son simples, coriáceas, opuestas, pecioladas; lámina oblonga-elíptica a ovada-elíptica, ápice obtuso, borde entero, base redondeada, nervación pinnada, levemente perceptible en el haz y en el envés. 81 Inflorescencias racemosas simples y axilares que reúnen flores provistas de pedicelo y brácteas caducas, glabras, ovadas; hipanto ciclíndrico; cáliz recto de 5 lóbulos de color rojo púrpura; corola carnosa subcilíndrica, de color rojo encendido, provista de 5 lóbulos triangulares de color blanco. El androceo consta de 10 estambres, filamentos planos, anteras dehiscentes y el gineceo de un ovario ínfero, con 5 lóculos, estilo filiforme y estigma capitado. El fruto es una baya. (15). USOS Los frutos de M. rupestris son comestibles, su madera es útil para leña y su forraje para el ganado. Joyapa Medicinalmente sus frutos frescos sirven para aliviar afecciones del pulmón y en decocción para los nervios y las hojas en cataplasma para los golpes. (15) Pág.165. También se la considera para cercos vivos y huertos; conservación de suelos. LAUREL DE CERA Género: Myrica Especie: parvifolia Benth Familia: MYRICACEAE Otros nombres comunes: “Laurel de cerro” DESCRIPCIÓN BOTÁNICA Arbusto que crece hasta 2 m de altura, de yemas apicales y crecimientos jóvenes amarillentos; los tallos son retorcidos, nudosos y de color gris. Las hojas son simples, alternas, oblanceolada, de borde notablemente entero, ápice agudo, consistencia coriácea y olor muy aromático. Las flores unisexuales están agrupadas en amentos axilares; los femeninos de mayor tamaño que los masculinos, las flores masculinas producen abundante polen amarillo que cubre las hojas. El fruto es una pequeña drupa de Laurel de cera* Pacarcar* 82 color verde. (23). USOS M. parvifolia es una planta con propiedades astringentes, antigripales, antidiarreicas y estimulantes; estos efectos se consiguen utilizando la raíz, la corteza del tallo, las hojas y la cera del fruto. Esta planta tiene aceites esenciales lo que le da la característica de aromática. Otro de los usos que le dan a los tallos y ramas secas del laurel de cera es para leña, carbón y elaboración de artesanías. También puede ser usada para ornamentación por su follaje. Por ser planta fijadora de nitrógeno conviene utilizar para la recuperación de suelos y mejora de pastos. MARAR Género: Symplocos Especie: quitenses Familia: SYMPLOCACEAE Otros nombres comunes: “Higuera de la sierra”, “Higo de pava” DESCRIPCIÓN BOTÁNICA Árbol de 10-15 m de altura, de tronco cilíndrico, copa irregular, ramificación alterna, corteza externa de color plomiza clara. Hojas simples, alternas, de limbo ovado, ápice redondeado, borde dentado y base atenuada; haz de color verde aceituna brillante y envés con nervación pinnada. Se caracteriza por presentar inflorescencias en racimos axilares. Cada racimo tiene de 3 a 5 flores perfectas, heteroclamídeas, cáliz tubular, corola rosada-pálida o blanquecina, simpétala; con 25 a 35 estambres y ovario ínfero con tres lóculos. El fruto es una drupa. (15). Marar USOS Imagen 2-2. SERRANO, Felipe 1996. Pág. 118. 83 La madera de S. quitenses es utilizada para la industria de la mueblería y en el campo para leña. MOTE CASHA Género: Duranta Especie: mutissi Familia: VERBENACEAE Otros nombres comunes: “Muti cachi”, “Chivo casha”, “Udur”. DESCRIPCIÓN BOTÁNICA Arbusto que llega hasta 4 m de altura, se caracteriza por ser espinudo. Tallos ralos y erectos cuando jóvenes e inclinados cuando viejos. Las hojas son simples, provistas de una espina en la parte inmediata superior al punto de inserción, limbo elíptico, ápice obtuso, base atenuado y borde entero; haz verde oscuro brillante, envés verde claro glabro. Las inflorescencias son racimos terminales y axilares. Las flores son conspicuas bisexuales, de cáliz morado, tubular, limbo truncado; corola gamopétala pentámera, azul violeta o blanquecina. El androceo se compone de 4 estambres, anteras sagitadas y el gineceo de un ovario súpero con 4 lóculos, estilo corto y estigma capitado. El fruto se caracteriza por ser una drupa carnosa, amarilla, compuesta por 4 pirenos y estos por 2 semillas. (15). USOS Esta planta es utilizada para construcción de cercas vivas y linderos, protección de cultivos, leña y ornamentación. PACARCAR Género: Hesperomeles Especie: ferruginea Familia: ROSACEAE Otros nombres comunes: “Manzana Caspi”, “Manzanilla”, “Halo”, “Quique”. DESCRIPCIÓN BOTÁNICA 84 El “Pacarcar” es un árbol que mide de 8 a 12 m de altura, su tallo es circular y sus ramas alternas. Las hojas son simples, pecioladas, de borde aserrado, consistencia coriácea; el haz es verde oscuro y el envés café amarillento tomentoso. Las inflorescencias de esta especie abarcan de 18 a 20 flores las mismas que se agrupan en “racimos de umbelas”. Las flores presentan cáliz verde, de 5 sépalos, persistente; corola caduca de color crema. El androceo posee 20 estambres y el gineceo 5 estilos, el ovario es ínfero y pentalocular. El fruto es un pomo pequeño, rojo, que posee generalmente 5 Pacarcar* semillas. (23) Pág.40. USOS La madera es utilizada para construcciones, elaboración de artesanías, juguetes y herramientas a mano y para la producción de carbón y leña. PENA PENA Género: Fuchsia Especie: loxensis H.B.K Familia: ONAGRACEAE Otros nombres comunes: “Pena pena”, “Zarcillo sacha”, “Arete”. DESCRIPCIÓN BOTÁNICA Planta subarbustiva que crece hasta los 2 m de altura, de tallos arqueados, ramificación opuesta y ramas nudosas. Las hojas son opuestas, dispuestas en verticilos de 34 hojas; sostenidas por un pecíolo acanalado, que a veces presenta una coloración rojiza; el limbo, de forma elíptica, borde dentado, ápice mucronado y base aguda; glabras en el haz y puberulentas en el envés. Imagen 2-3. SERRANO, Felipe 1996. Pág. 41 85 Las flores son solitarias, bisexuales, de color rojo escarlata, sostenidas por un pedúnculo más o menos largo; hipantio presente; cáliz con cuatro sépalos persistentes; corola provista de cuatro pétalos. El androceo posee 8 estambres, algunas veces dos de ellos fusionados, de tecas adnadas y mesifijas. Gineceo provisto de un largo estilo, ovario ínfero y estigma lobulado. Pena – pena El fruto es una baya de color púrpura. (23) Pág.109. USOS Dentro de las prácticas medicinales tradicionales, se utiliza la infusión de sus flores para obtener efectos sedativos, cardiotónicos (White, 1976), febrífugos y para aliviar las molestias de la insolación (CESA, 1992). (23) Pág.110. PURURUG COLORADO Género: Hedyosmun Especie: luteynii Todzia Familia: CHLORANTACEAE Otros nombres comunes: “Borracho”, “Tarqui”, “Cashco”. DESCRIPCIÓN BOTÁNICA Árbol que llega hasta 16 m de altura y 50 cm de diámetro, le caracteriza el tronco cilíndrico. Las hojas son opuestas, aromáticas, simples, de limbo elíptico u oblanceolado, tienen borde aserrado, ápice acuminado y base aguda. Las hojas muestran pecíolos púrpuras que nacen de “abultadas vainas”; haz verde lustroso y envés verde pálido, áspero, pubescente en las nervaduras. Los amentos masculinos del Pururug colorado, son terminales o axilares sostenidos por un corto pedúnculo, cada uno contiene 200 estambres y las inflorescencias femeninas están 86 Pururug* compuestas de 1 a 3 címulas acompañadas de brácteas pequeñas, enteras o dentadas. (23). Los frutos de éste árbol son las címulas fertilizadas púrpuras de 1 a 1,5 cm de diámetro, olor aromático, y consistencia carnosa. Las semillas tienen 4 a 5 cm de longitud, son de color café. USOS El árbol en mención se caracteriza por tener una madera muy suave no idónea para construcciones, sino solamente para leña. Dentro de los usos medicinales que se le atribuye a las hojas de H. luteynii es el de diurético. QUILLUYUGYUG Género: Miconia Especie: crocea Familia: MELASTOMATACEAE Otros nombres comunes: “Quilluyuyu”, “Colca”. DESCRIPCIÓN BOTÁNICA Árbol pequeño de 8 m de altura, tronco cónico, ramificación opuesta. Las hojas son simples, opuestas, blandas, elípticas, de base aguda, margen aserrado, ápice acuminado; poseen 5 nervios prominentes que se une al tallo por ápices de 1 a 2 cm de largo. Inflorescencias en panículas terminales, de color blanco. La corola posee de 5 a 8 pétalos, el cáliz es tubular. Quilluyugyug Los estambres son dimorfos en tamaño, con tecas de 4 celdas; el ovario es ínfero y posee de 3 a 6 lóculos. El fruto es una baya, carnosa, dulce de color pardo amarillenta. (23). * Imagen 2-4. SERRANO, Felipe. 1996 Pág. 36. 87 USOS La madera de M. crocea se usa para fabricar piezas torneadas y para carbón y leña. En investigaciones de CESA (1993), M. crocea figura por su acción antigripal, antiséptica, tónica y astringente dentro de los usos medicinales tradicionales. (23)Pág.48 QUINUA Género: Polylepis Especie: reticulata Familia: ROSACEAE Otros nombres comunes: “Palo colorado”, Árbol de papel”, “Yagual”, “Pantza”, “Quiñual”, “Queñua”. DESCRIPCIÓN BOTÁNICA Árbol que alcanza hasta 8 m de altura, de tronco irregular que a veces es helicoide. La corteza es escamosa de color rojizo que se desprende con facilidad. Las hojas son compuestas, alternas, imparipinnadas, de borde entero, con 5 foliolos ovales, la base es oblicua y el ápice bífido. Las flores se agrupan en racimos que abarcan de 3 a 7 flores hapoclamídeas, de cáliz dialisépalo, trímero o tetrámero, piloso y persistente. Poseen de 6 a 17 estambres y ovario ínfero. El fruto es un aquenio. (23). 88 USOS La madera de P. reticulata es utilizada para la elaboración de herramientas, para formar cortinas rompevientos. A las hojas de quinua se le atribuye las propiedades de antigripales, tónicas y analgésicas. RAÑAS Género: Viburnum Especie: triphyllum Familia: CAPRIFOLIACEAE Otros nombres comunes: “ Danas”, “Juanico”, “Dañas”, “Pinanarín”. DESCRIPCIÓN BOTÁNICA Arbusto de 2 a 4 m de altura, de corteza color café y ramas que se disponen en un mismo punto del eje principal. Las hojas se insertan en los nudos en grupos de tres opuestas; son simples, elípticas, de bordes enteros y haz verde lustroso. Las inflorescencias son de tipo umbela compuesta que contiene un promedio de 94 flores; cada flor de cáliz pentámero verde, corola de Rañas 4 a 6 pétalos blancos. El fruto es una drupa de color negro o púrpura que tiene una semilla. (23). USOS La madera de V. triphyllum es empleada para construcciones rústicas, elaboración de husos para hilar y como combustible. En la medicina tradicional se usan las hojas para preparar emplastos, con efectos antigripales, los mismos que se colocan calientes en la frente y en el pecho. 89 SALVIA REAL Género: Salvia Especie: corrugata Familia: LABIATAE o LAMIACEAE Otros nombres comunes: “Salvia real”, “Caballo chilca”, Azul chilca”, “Salvia”, Suti” DESCRIPCIÓN BOTÁNICA Arbusto de 2 a 3 m de altura de abundante follaje, ramificación opuesta, tallos leñosos; hojas simples, opuestas, ásperas, rugosas, lanceoladas, borde dentado, haz color verde y envés café claro. Inflorescencias verticiladas, de color azul violeta. Salvia real Flores bisexuales, zigomorfas bilabiadas de cáliz persistente y corola pentámera; androceo con dos estambres y gineceo con un ovario supero. Los frutos consisten en nueces pequeñas. (23). USOS Se la utiliza para ornamentación como setos vivos, linderos y cortinas rompevientos. SARAR Género: Weinmannia Especie: fagaroides Familia: CUNONIACEAE Otros nombres comunes: “Sara fino”, “Cashco”, “Encino”, “Matache”. DESCRIPCIÓN BOTÁNICA El árbol de “Sarar” puede medir hasta 25 m de altura, se caracteriza por tener copa irregular y corteza de color parda. 90 Sarar Las hojas son compuestas, imparipinnadas, con raquis alado; tienen 9 a 15 foliolos ovados, de ápice redondo, borde aserrado y base redondeada. Las inflorescencias son racimos terminales, que agrupan a flores blancas o amarillentas. Las flores son completas, heteroclamídeas, de cáliz persistente de color verde; corola blanca, caduca, y tetrámera. Referente a los estambres estos tienen dehiscencia longitudinal y el ovario es súpero. El fruto es una cápsula café que contiene dos semillas. (23). USOS El árbol de “Sarar” proporciona madera de la mejor calidad, que es usada para construcciones de viviendas y muebles, herramientas para la agricultura, etc. También a este se lo utiliza en la agroforestería y sistemas silvopastoriles. SHIÑAN Género: Barnadesia Especie: arborea Familia: ASTERACEAE o COMPOSITAE Otros nombres comunes: “Puca casha”, “Espino”. DESCRIPCIÓN BOTÁNICA Arbusto de 4 m de altura, de tallos leñosos ramificados desde la base y dotados de espinos, la corteza es lisa y gris; con ramas jóvenes tomentosas. Caracterizado por las hojas simples, sésiles, coriáceas, dispuestas en verticilos alternos, con espinas axilares; el limbo tiene forma elíptica, el borde es entero y el ápice aguijoneaado. Las flores se agrupan en cabezuelas rosadas, terminales y solitarias. Cada flor es tubular de pétalos unidos, con 4 dientes, 5 estambres y un ovario ínfero. Los frutos son aquenios. (23). Shiñan USOS El “Shiñan” se utiliza para construcción de cercas, recuperación de hábitats y como combustible. Según CESA (1993), los campesinos usan sus hojas y sus tallos en forma de emplastos e infusiones, para obtener efectos diaforéticos, diuréticos, febrífugos, antiespasmódicos y cicatrizantes. (23). Pág.94. 91 SURO Género: Chusquea Especie: sp. Familia: GRAMINEAE o POACEAE Otros nombres comunes: “Shibur” DESCRIPCIÓN BOTÁNICA Bambú leñoso de 2 a 3 m de altura, de tallo arqueado y nudoso que recibe el nombre de “culmo”; la raíz es subterránea, ensanchada, tiene la particularidad de almacenar los nutrientes y se denomina rizoma. Las agrupaciones foliares que cubren al culmo contienen hojas paralelinervadas, delgadas, lanceoladas y de borde áspero. Las inflorescencias se reúnen en racimo de espigas; las que agrupan a su vez flores bisexuales imperfectas, con cuatro brácteas. El androceo se forma de 4 estambres y el gineceo de un ovario y dos estigmas. El fruto es un “cariópside” que tiene una semilla pequeña. (23). Suro USOS Chusquea sp. es utilizada en la construcción de casas, elaboración de artesanías, alimentación del ganado y como combustible. TILILIN Género: Piper Especie: andreanum Familia: PIPERACEAE Otros nombres comunes: “Matico de Monte”, “Mucuchaclla”. DESCRIPCIÓN BOTÁNICA 92 Árbol pequeño de 4 a 7 m de altura con ramas nudosas, de copa irregular, tronco cilíndrico y corteza externa verdusca. Las hojas son simples, opuestas, de consistencia áspera, ápice apiculado, limbo elíptico, de base asimétrica; el haz es de color verde amarillento y el envés de olor verde claro. Posee inflorescencias del tipo de amentos terminales de color gris o blanco que contienen flores microscópicas, sin sépalos ni pétalos, las que tienen 4 estambres y un ovario súpero. Tililin El fruto es una drupa carnosa de color café que contiene una sola semilla. (23) USOS Esta planta tiene importancia química por su composición aceites volátiles y alcaloides piperídicos. La madera ha sido utilizada para la construcción de casas rústicas, cercas y como combustible. TRINITARIA Género: Otholobium Especie: mexicanum Familia: LEGUMINOSAE / Subf. Papilionoideae Otros nombres comunes: “Culén”, “Culín”, “Huallua”, “Chinitaria”, “Albaquilla” DESCRIPCIÓN BOTÁNICA La Trinitaria es un arbusto de 1 a 3 m de altura, de ramas alternas y corteza lisa. Posee hojas compuestas, trifoliadas, alternas, con peciólulos cortos y estípulas. Los foliolos tienen forma lanceolada, borde entero, ápice Trinitaria93 acuminado. El haz es verde oscuro y el envés verde claro, el primero es glabro. Las flores se agrupan en espigas terminales o axilares, bisexuales, zigomorfas, de color violeta. Cáliz con 5 sépalos, corola irregular de 5 pétalos; androceo con 10 estambres y gineceo formado por un ovario. El fruto es una legumbre pequeña con una sola semilla. USOS O. mexicanum es un arbusto al cual le atribuyen propiedades medicinales. La infusión de hojas de “Trinitaria” se usa para aliviar problemas estomacales, atribuyéndole también una acción laxante leve(White,1976). Otras de las propiedades medicinales que le dan los campesinos a esta planta, son la de “antidiabética, astringente, balsámica, hemostática, carminativa, emenagoga y vulneraria” (CESA, 1993). Químicamente, este arbusto posee una furanocumarina llamada “Psoraleno”, compuesto fototóxico que suele provocar problemas dérmicos. (23) Pág.126. Esta se la debe considerar para: Recuperación de suelos Preforestación Agrosilvicultura. (23). YANAMOTE Género: Gaultheria Especie: erecta Familia: ERICACEAE Otros nombres comunes: “Mote pelado”. DESCRIPCIÓN BOTÁNICA 94 Subarbusto de 1 a 2 m de altura, de tallos delgados, corteza escamosa de color café rojizo. Caracterizado por hojas simples, alternas, pecioladas, coriáceas de limbo acorazonado y serrulado; el haz presenta color verde oscuro y el envés verde claro. Las inflorescencias son en racimos, agrupan a flores urceoladas, pentámeras, de color rojo o rosado, de cáliz persistente; los estambres son numerosos y el ovario es súpero, pentalocular. El fruto es una pseudobaya que tiene abundantes semillas y se origina a partir de los sépalos. (23). Yanamote USOS Los tallos del “Yanamote” son empleados para leña y sus frutos son comestibles. ZARCILLO SACHA Género: Brachyotum Especie: confertum Familia: MELASTOMATACEAE Otros nombres comunes: “Pichana”, “Puca- chagasha”, “Zarsa”. DESCRIPCIÓN BOTÁNICA Arbusto de 0.6 a 2.5 m de altura, de tallos leñosos en los que presenta tejidos muertos que forman parte exterior de la corteza que se resquebrajan y desprenden; las ramas terminales son flexible-alargadas y cubiertas de pelos. Las hojas son trinervadas, lanceolado-ovadas a oblongo-ovadas, de ápice agudo a redondeado, base aguda a obtusa, el haz es verde oscuro con tricomas ralos estrigosos, envés con tricomas estrigosos a hirsutoides. Las flores se caracterizan por solitarias, pentámeras, serradas, con 2-4 pares de brácteas, de color rojo pálido y densamente cubierto de pelos; hipanto seríceo-estrigoso; cáliz con 5 sépalos amarillos verdosos; corola con 5 pétalos púrpuras oscuros, libres e imbricados que forman un tubo campanulado. Los estambres son isomorfos y se encuentran en número de 10; el ovario es súpero con 5 lóculos pubescente, estilo largo libre de la corola y persistente. El fruto es una cápsula con muchas semillas. (15). USOS Zarcillo sacha Las ramas de esta planta son utilizadas para curar el espanto, barrer y teñir fibras. 95 NOTA: Las fotografías que no indican fuente corresponden a las autoras. 96 2.3. CARACTERÍSTICAS DE LAS FAMILIAS DE LAS PLANTAS UTILIZADAS PARA NUESTRA INVESTIGACIÓN. FAMILIA Géneros Esp existentes en exis la familia. fam Magnoliopsida Urticales URTICACEAE 52 Sob espe MAGNOLIOPHYTA Magnoliopsida Fagales BETULACEAE 6 Más MAGNOLIOPHYTA Magnoliopsida Laurales LAURACEAE 47 Sob 2.50 MAGNOLIOPHYTA Magnoliopsida Campanulale s LOBELIACEAE 10 148 Reino Filo Clase Orden FAMILIA Géneros Esp existentes en exis la familia. fam Plantae MAGNOLIOPHYTA Magnoliopsida Asterales ASTERACEAE 1000 Más Plantae MAGNOLIOPHYTA Magnoliopsida Malvales ELAEOCARPACEAE 7 + Plantae MAGNOLIOPHYTA Magnoliopsida Rubiales RUBIACEAE 630 Alre 10.4 Plantae MAGNOLIOPHYTA Magnoliopsida Solanales SOLANACEAE 90 Entr 3.00 Reino Filo Clase Plantae MAGNOLIOPHYTA Plantae Plantae Plantae Orden 34 FAMILIA Géneros Esp existentes en exis la familia. fam Magnoliopsida Proteales PROTEACEAE 69 Alre 150 MAGNOLIOPHYTA Magnoliopsida Myrtales MYRTACEAE 120 Cer Plantae MAGNOLIOPHYTA Magnoliopsida Myricales MYRICACEAE 3 Una Plantae MAGNOLIOPHYTA Magnoliopsida Ericales ERICACEAE 115 Cer Plantae MAGNOLIOPHYTA Magnoliopsida Ebenales SYMPLOCACEAE 1 250 Plantae MAGNOLIOPHYTA Magnoliopsida Lamiales VERBENACEAE 75 Alre 300 Reino Filo Clase FAMILIA Géneros Esp existentes en exis la familia. fam Plantae MAGNOLIOPHYTA Magnoliopsida Rosales ROSACEAE 100 Más espe Plantae Plantae MAGNOLIOPHYTA MAGNOLIOPHYTA Magnoliopsida Myrtales Magnoliopsida Piperales ONAGRACEAE CHLORANTACEAE 17 + 675 + Plantae MAGNOLIOPHYTA Magnoliopsida Myrtales MELASTOMATACE AE 250 4.00 Plantae MAGNOLIOPHYTA Magnoliopsida Dipsacales CAPRIFOLIACEAE 12 a 15 400 Plantae MAGNOLIOPHYTA Magnoliopsida Lamiales LAMIACEAE o 200 3.20 Reino Filo Clase Plantae MAGNOLIOPHYTA Plantae Orden Orden 35 LABIATAE FAMILIA Géneros Esp existentes en exis la familia. fam Magnoliopsida Rosales CUNONIACEAE 30 250 MAGNOLIOPHYTA Liliopsida POACEAE o GRAMINEAE 500 8.00 Plantae MAGNOLIOPHYTA Magnoliopsida Piperales PIPERACEAE 5-10 2.00 Plantae MAGNOLIOPHYTA Magnoliopsida Fabales LEGUMINOSAE 400 14.0 Reino Filo Clase Plantae MAGNOLIOPHYTA Plantae Orden Cyperales (+) = Información no disponible. Cuadro realizado por las autoras anotando como referencia a:(24), (9), (23), (29), (3), (55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75). 36 37 CAPITULO II PLANTAS DEL BOSQUE DE MAZÁN CAPITULO # 2 PLANTAS DEL BOSQUE DE MAZÁN 38 2.1. CARACTERÍSTICAS DEL BOSQUE DE MAZÁN. El Bosque de Mazán, es una reserva ubicada a 10 Km al oeste de la ciudad de Cuenca en la vía Cuenca-Molleturo-Naranjal, perteneciente a la provincia del Azuay. Este tiene una superficie de 7200 ha; al norte y sur dos barreras forman un callejón por donde atraviesa el río Mazán. El punto más alto de la microcuenca es de 4137 msnm y el más bajo a 2800 m justo en la desembocadura del río Mazán en el río Tomebamba. La erosión de suelos, deforestación, degradación de aguas dulces, degradación de la pesquería y hábitats costeros, urbanización de tierras agrícolas, perdida de biodiversidad, polución del aire, desastres naturales y abusos de pesticidas son los principales problemas ambientales. (23)Pág.6. Por los problemas mencionados es necesario contar con reservas naturales las cuales gracias a sus beneficios ayudan a disminuir o controlar los mismos. El río de Mazán, que se forma de una cadena de lagunas entre las más importantes la Totoracocha, Tintacocha y por numerosas quebradas de aguas cristalinas en todo su recorrido, constituye el 20% del caudal del río Tomebamba, principal afluente que abastece de agua potable a la ciudad de Cuenca. El relieve es accidentado en el cual las gramíneas forman una alfombra que mantienen la humedad del suelo y así contribuyen también la regulación del agua. El Bosque de Mazán es uno de los últimos remanentes de vegetación original altoandina que queda en la provincia del Azuay. En el se hallan aproximadamente 300 especies de plantas superiores; de ellas 80 son leñosas y de estas últimas, la mitad son forestales (23) Pág.10. Entre las hábitats se distinguen, el bosque primario, bosque secundario, páramo arbustivo o subpáramo, pastizal, páramo (en su mayor extensión) y riscos. Es importante nombrar el bosque primario por su característica de la vegetación original que no ha sufrido alteraciones en su composición y estructura por la actividad humana. 2.2. DESCRIPCIÓN DE LAS PLANTAS DEL BOSQUE DE MAZÁN AGUACHENTO Género: Pilea 39 Especie: sp. Familia: URTICACEAE Otros nombres comunes: “Chinisacha”, “Ortiguilla” DESCRIPCIÓN BOTÁNICA Planta de 1 a 2 m de altura, de tallos fibrosos, desprovistos de pelos urticantes, huecos y nudosos. Las hojas son opuestas, elípticas, de base aguda, borde dentado y con tres venas principales. Inflorescencias cimosas dispuestas en agrupaciones axilares. Flores unisexuales, las masculinas de 4 sépalos libres y 4 estambres; las Aguachento femeninas de 3 sépalos y un ovario súpero. El fruto es un diaquenio. (23). USOS En el campo se utiliza para alimentación de cobayos; también se la debe considerar a Pilea sp. como posible banco de proteínas. ALISO Género: Agnus Especie: acuminata Familia: BETULACEAE Otros nombres comunes: “Rambrán” o “Ranrán”, “Jaul”, “Cerezo”. DESCRIPCIÓN BOTÁNICA El aliso es un árbol de tronco circular y copa aparasolada, que llega a medir hasta 20 m de altura; su corteza es de color gris a diferencia del color de la madera que es amarillenta. 40 Las hojas son simples, alternas, pecioladas, de limbo oval y de margen doblemente dentado; el haz es de color verde intenso y el envés más claro. Las inflorescencias masculinas miden de 5 a 12 cm de largo, estos amentos colgantes terminales “caen enteros después de la floración”. Las inflorescencias femeninas son “amentos pistilados leñosos”, situados en las axilas de las hojas, sin perianto, de color verde cuando jóvenes. El fruto es una piña dehiscente. (23). Aliso USOS El aliso es usado como combustible, materia prima en la elaboración de herramientas para la agricultura, utensilios de cocina, construcciones y para elaboración de diferentes objetos en mueblería y artesanías. También posee propiedades curativas. En la medicina indígena las hojas se calientan y se “preparan emplastos que se usan sobre granos”, supuraciones y zonas afectadas por reumatismo (CESA, 1992). Se le atribuye también propiedades “astringentes, tónicas, antiinflamatorias, eméticas, hemostáticas, antigripales, desinfectantes y emenagogas” (CESA 1993). (23)Pág.20-21. CANELO Género: Ocotea Especie: infrafoveolata Familia: LAURACEAE Otros nombres comunes: “Facte”, “Tulapo”, “Yalte negro” DESCRIPCIÓN BOTÁNICA 41 Árbol de 20 m de altura, de tronco cilíndrico, ramificación alterna; corteza lisa de color grisáceo, resinosa que presenta exudado claro. Las hojas son alternas, elípticas, lanceoladas, coriáceas, de borde entero, pecíolo corto, ápice acuminado y base ahusada. El haz es verde oscuro, el que es atravesado por una nervadura central amarillenta y el Canelo* envés es de color café rojizo, tomentoso, con nervadura destacada. Las inflorescencias son racimosas, verde amarillentas y agrupan a flores completas. El cáliz es deciduo, hexámero, tomentoso y dialisépalo; la corola es actinomorfa, que protege de 9 a 11 estambres. El ovario es ínfero y el estigma es capitado. El fruto es un glande. (23). USOS La madera del “Canelo” es usada en la industria de la mueblería y para leña. CENTROPOGON Género: Centropogon Especie: sp. Familia: LOBELIACEAE DESCRIPCIÓN BOTÁNICA Arbusto pequeño de 1 a 2 m de altura, de tronco semileñoso, cubierto por una capa vellosa, simpódico, verde amarillento. Hojas simples, oblongas, rugosas, de base aguda y ápice acuminado; el haz es de color verde oscuro y el envés tomentoso café amarillento. Caracterizado por flores solitarias, axilares de sépalos triangulares, persistentes; corola zigomorfa, gamopétala, tubular, curvada, tomentosa, de color rojo anaranjada, limbo amarillo brillante. Los estambres son pubescentes y el ovario es ínfero y Centropogon Imagen 2-1. SERRANO, Felipe. 1996. Pág. 58 42 bilocular. El fruto es una baya carnosa, globosa, que almacena varias semillas. (23). USOS El “Centropogon” es útil para la recuperación de hábitats y para la avifauna. CHILCA NEGRA Género: Baccharis Especie: latifolia Familia: ASTERACEAE o COMPOSITAE Otros nombres comunes: “Chilca larga” DESCRIPCIÓN BOTÁNICA Arbusto de 2-4 m de altura, de tallos cilíndricos, ramificación y follaje abundante. Las hojas son simples, alternas, esparcidas, semicoriáceas, pecioladas, de lámina lanceolada, ápice agudo a ligeramente acuminado, base cortamente cuneiforme y borde aserrado: el haz presenta un color verde brillante y el envés verde claro con 3 nervios principales. Las inflorescencias son en panículas compuestas, que agrupan a flores dispuestas en capítulos o cabezuelas homógamas discoides. La especie es dioica. Cabezuelas masculinas portando entre 20-30 flores. Flores masculinas de unos 5 mm de longitud; corola tubular de 3.8 mm de largo, limbo profundamente 5-lobulado, lóbulos reflexos. 5 estambres con las anteras soldadas formando un tubo que rodea parte del estilo, filamentos delgados insertos en la base de los lóbulos de la corola, estilo con dos ramas cortas subuladas, exsertas del tubo de las anteras; vilano compuesto por pelos irregulares ralos. Cabezuelas femeninas con 30 a 40 flores. Flores femeninas de unos 4 mm de longitud, corola de 2 mm de largo, filiforme con el limbo truncado provisto de diminutos dientes apicales; estilo alargado con 2 ramas cortas lineares, vilano uniseriado de pocos pelos blanquecinos; ovario ínfero 0,9 - 1 m de longitud. (15) Pág.110. El fruto es un aquenio pequeño. USOS Es una planta muy usada y una de las más importantes en la actividad agroforestal. 43 En medicina tradicional indígena y campesina, también presenta múltiples usos: por ejemplo, en emplastos y fomentos con sus hojas para golpes, fracturas, heridas e hinchazones; para el reumatismo en emplastos, fomentos e infusión con las hojas; para el denominado “mal de orina”, afecciones al pecho, diarrea, problemas del hígado, cólicos y borrachera, mediante la infusión con sus hojas y flores y finalmente para sarpullidos y afecciones a la piel de los niños, se realiza fomentos y emplastos con sus hojas a veces mezcladas con licor o aguardiente. (15)Pág.111-112 También la usan para curar el “espanto” y “el mal aire”. CHUL CHUL Género: Vallea Especie: stipularis Familia: ELAEOCARPACEAE Otros nombres comunes: “Sacha capulí”, “Pichul”, “Pera caspi”, “Rosas”, “Chaimulán”. DESCRIPCIÓN BOTÁNICA Árbol que alcanza de 8 a 10 m de altura, de tronco cilíndrico, copa redonda y corteza externa café. Las hojas del Chul Chul son simples, ovadas, alternas, de borde entero, base truncada, ápice acuminado; haz de color verde amarillento y envés verde claro. La inflorescencia es una panícula, que contiene de 9 a 14 flores completas de color rosado. Las flores tienen cáliz caduco y pentámero, al igual que la corola; estambres en número de 32 y ovario súpero, con estilo simple y estigma compuesto. (23). Chul-chul El fruto es una cápsula globosa negruzca cuando esta madura, que contiene de 2 a 5 semillas. USOS 44 Este árbol se utiliza para conformar cortinas rompevientos, la madera del mismo para construcciones y elaboración de herramientas; el follaje para la alimentación de animales. Sus flores se utilizan en la medicina indígena, en infusión como sedante o calmante. (23). CHUQUIRAHUA Género: Chuquiraga Especie: jussieui Familia: ASTERACEAE o COMPOSITAE Otros nombres comunes: “Chuquiragua”, “Flor del andinista”. DESCRIPCIÓN BOTÁNICA Arbusto pequeño que puede medir de 0.8 a 1.2 m de altura, con ramificación densa y rígida, abundante follaje; las ramitas terminales son robustas, lignificadas, nudosas de color café. Presenta hojas simples, alternas, imbricadas, subsésiles, coriáceas, limbo ovado, borde entero, ápice agudo prolongado en una espina de 1mm de longitud; haz glabro verde lustroso y envés con un nervio central protuberante. Las flores se agrupan en cabezuelas terminales, de forma acampanada, solitarias con brácteas espinicentes imbricadas anaranjadas. Cada flor es tubular perfecta en un promedio de 20 a 26 por cabezuela, papus plumoso, corola tubular anaranjada o amarillo naranja; androceo con 5 estambres y gineceo con un ovario ínfero y estilo de color tomate. (15). USOS Es una planta ampliamente conocida y utilizada en medicina tradicional. Los campesinos del sector mencionan que sus flores y hojas en infusión, sirven para curar gripes y resfríos. Además posee efectos medicinales tales como: diurética, febrífuga, tónica, reconstituyente (Cordero, 1984; Acosta Solís, 1992; CESA, 1993a). Anti-reumática, anti-inflamatoria y anti-palúdica (CESA, 1993a). También sirven para curar problemas del hígado, riñones, sangre, de la piel (sarpullidos) y molestias menstruales (CESA, 1993a). El zumo de su tallo aplicado sobre las heridas, tiene efectos cicatrizantes (CESA, 1993a; CESA, 1993b). (15) Pág.136. DUMBRIR Género: Palicourea Especie: aragmatophylla Familia: RUBIACEAE 45 Otros nombres comunes: “Cascarilla”, “Aya rambrám”, “Tugnashi amarillo” DESCRIPCIÓN BOTÁNICA Arbusto de 4 a 5 m de altura, de tronco grueso, cilíndrico, irregular y corteza externa rojiza. Las hojas son simples, opuestas, de ápice apiculado, borde entero; haz verde con una nervadura amarillenta en el centro. P. aragmatophylla presenta inflorescencias en forma de panícula, de pedicelos amarillo brillante. Las inflorescencias se disponen de flores completas; el cáliz al igual que la Dumbrir corola son pentámero y pétalos verdes; el ovario es súpero bilocular y el estigma sobresaliente y capitado. El fruto es una baya. USOS La madera de este arbusto es usada para construcciones por ser resistente al agua. El género Palicourea contiene poli-indoleninas. (23). FLORIPONDIO Género: Brugmansia Especie: sanguinea Familia: SOLANACEAE Otros nombres comunes: “Guándug”, “Guanto”. DESCRIPCIÓN BOTÁNICA B. sanguinea es un arbusto de 5 a 10 m de altura, de corteza externa café verdosa y ramificación alterna. Las hojas son simples, alternas, pecioladas, de lámina lanceolada, ápice acuminado-agudo, base oblicua a obtusa, haz pubescente, borde entero sinuado. Las flores se caracterizan por tubulares, solitarias, péndulas, de pedicelos redondos, glabros y flexibles; cáliz de color verde, corola 46 Floripondio tubular infundibuliforme de 20 a 22 cm de largo, glabra, roja hacia el ápice y amarilla verdosa hacia la base, fragante, posee 5 lóbulos dentados. El androceo se compone de 5 estambres, anteras basifijas linear-oblongas; gineceo constituido por un pistilo central, ovario bilocular que contiene dentro varios óvulos y estigma bilobulado. El fruto es una baya que contiene varias semillas. (15). USOS El “Guándug” o “Floripondio rojo” es una planta medicinal muy conocida en toda la Sierra ecuatoriana; los campesinos del sector la usan fundamentalmente para realizar las denominadas “Limpias” de Espanto y Mal aire o “Antimonio” para contrarrestar los hechizos y eliminar la envidia. También es usada como planta alucinógena; así, antiguamente, con la corteza de sus raíces y el endocarpo de sus frutos preparaba un tósigo denominado “Guarguar” que tenía efecto alucinógeno en los individuos a quienes se les daba de beber. Sus hojas en forma de emplastos se aplican sobre heridas y zonas afectadas por el reumatismo, también para curar golpes y reducir hinchazones. En infusión para aliviar la gripe y, como bebida o cocimiento disminuye los síntomas del reumatismo y ayuda en la recuperación de fracturas. (15)Pág.29. GAÑAL Género: Oreocallis Especie: grandiflora Familia: PROTEACEAE Otros nombres comunes: “Galuay”, “Cucharilla”, “Galvay”, “Chapka”. DESCRIPCIÓN BOTÁNICA 47 Árbol que llega a medir de 6 a 10 m de altura; de tronco cilíndrico y corteza lisa de color café. Las hojas son simples, enteras, pecioladas, ovaladas, de borde entero, base redondeada, sin estípulas, consistencia semicoriácea y dispuestas en espiral; el haz es de color verde oscuro y el envés verde claro. Gañal Las inflorescencias son racimos terminales de color blanco o ligeramente amarillento. Los frutos se originan a partir de las inflorescencias en un número de 6 a 10; consisten en una pequeña cápsula que lleva aproximadamente unas 30 semillas. (23). USOS O. grandiflora es utilizada para la elaboración de diferentes herramientas para la agricultura, utensilios de cocina, para leña y para la industria de la mueblería. En la medicina tradicional el “Gañal (flores)” es utilizado para la preparación de la “agua de frescos” y para el tratamiento de tos, asma, enfermedades renales y enfermedades hepáticas. (23). GYNOXYS Género: Gynoxys Especie: buxifolia Familia: ASTERACEAE o COMPOSITAE Otros nombres comunes: “Gomango”, “Piquil”, “Capote”, “Mola-renri”. DESCRIPCIÓN BOTÁNICA Planta que puede llegar a medir hasta 5 m de altura, de copa irregular, ramificación opuesta, tronco cilíndrico, la corteza es de color ploma con puntuaciones negruzcas. Las hojas son simples, opuestas, ovadas, sin estípulas, ápice agudo o redondeado, base redondeada, borde entero, haz verde oscuro lustroso con manchas negruzcas y envés blanquecino puberulento. 48 Las inflorescencias son de color amarillo intenso del tipo paniculado-corimbosas. Cabezuelas heterógamas, cada una contiene usualmente 18 flores. El fruto es un aquenio de color café oscuro. (15). USOS Gynoxys Es utilizada para construcciones rústicas, leña; las hojas sirven para forraje de ovejas y cuyes. Gynoxys mediante emplastos es usada para curar molestias producidas por enfriamientos. (15) HUAHUAL Género: Myrcianthes Especie: rhopaloides Familia: MYRTACEAE Otros nombres comunes: “Arrayán” DESCRIPCIÓN BOTÁNICA M. rhopaloides es un árbol de 15 m de altura, de tronco cilíndrico, copa irregular; corteza exterior rojiza, escamosa, resinosa y se desprende fácilmente. Las hojas son simples, opuestas, de consistencia coriácea, limbo ovalado, borde entero y base redondeada, se unen al tallo por un pecíolo corto lignificado. El haz es verde oscuro, lustroso, glabro y el envés es verde amarillento con la nervadura central prominente. En lo que refiere a las flores estas son hermafroditas, completas y estaminoideas. Poseen cáliz dialisépalo verde, corola blanca tetrámera, de pétalos redondos y libres. Los estambres son numerosos y oscilan entre 9 y 10 cm de largo; el ovario es ínfero, el estilo largo y el estigma capitado. Huahual 49 El fruto del “Arrayán” es una drupa carnosa, de color rojo oscuro de maduro, que contiene en su interior solo una semilla. (23). USOS La madera de este árbol se ha utilizado para la elaboración de diferentes objetos como herramientas, marcos, vigas y leña. Los campesinos usan las aromáticas hojas de algunas especies para mejorar la salud dental y proteger las encías. También se les atribuye la característica de ser útil para el tratamiento de enfermedades pulmonares, reumáticas y en hemorragias. De varias especies de la familia MYRTACEAE se derivan productos farmacéuticos con propiedades: carminativos, antisépticos, analgésicos dentales y expectorantes. Sus especies son ricas en taninos, aceites volátiles y saponinas. (23). También se utilizan ampliamente en la industria de la perfumería, cosmetología y de la madera. JOYAPA Género: Macleania Especie: rupestris Familia: ERICACEAE Otros nombres comunes: “Joyapita”, “Hualicón”, “Chaqui lulo”, “Yurac-joyapa”. DESCRIPCIÓN BOTÁNICA Arbusto de 0.6 a 2 m de altura, terrestre o epífito, con ramas lianoides muy largas; tallos viejos rastreros, recubiertos de corteza café o blanquecina desprendible. Las hojas son simples, coriáceas, opuestas, pecioladas; lámina oblonga-elíptica a ovada-elíptica, ápice obtuso, borde entero, base redondeada, nervación pinnada, levemente perceptible en el haz y en el envés. Inflorescencias racemosas simples y axilares que reúnen flores provistas de pedicelo y brácteas caducas, glabras, ovadas; hipanto ciclíndrico; cáliz recto de 5 lóbulos de color rojo púrpura; corola carnosa subcilíndrica, de color rojo 50 Joyapa encendido, provista de 5 lóbulos triangulares de color blanco. El androceo consta de 10 estambres, filamentos planos, anteras dehiscentes y el gineceo de un ovario ínfero, con 5 lóculos, estilo filiforme y estigma capitado. El fruto es una baya. (15). USOS Los frutos de M. rupestris son comestibles, su madera es útil para leña y su forraje para el ganado. Medicinalmente sus frutos frescos sirven para aliviar afecciones del pulmón y en decocción para los nervios y las hojas en cataplasma para los golpes. (15) Pág.165. También se la considera para cercos vivos y huertos; conservación de suelos. LAUREL DE CERA Género: Myrica Especie: parvifolia Benth Familia: MYRICACEAE Otros nombres comunes: “Laurel de cerro” DESCRIPCIÓN BOTÁNICA Arbusto que crece hasta 2 m de altura, de yemas apicales y crecimientos jóvenes amarillentos; los tallos son retorcidos, nudosos y de color gris. Las hojas son simples, alternas, oblanceolada, de borde notablemente entero, ápice agudo, consistencia coriácea y olor muy aromático. Las flores unisexuales están agrupadas en amentos axilares; los femeninos de mayor tamaño que los masculinos, las flores masculinas producen abundante polen amarillo que cubre las hojas. El fruto es una pequeña drupa de Laurel de cera* Pacarcar* color verde. (23). USOS Imagen 2-2. SERRANO, Felipe 1996. Pág. 118. 51 M. parvifolia es una planta con propiedades astringentes, antigripales, antidiarreicas y estimulantes; estos efectos se consiguen utilizando la raíz, la corteza del tallo, las hojas y la cera del fruto. Esta planta tiene aceites esenciales lo que le da la característica de aromática. Otro de los usos que le dan a los tallos y ramas secas del laurel de cera es para leña, carbón y elaboración de artesanías. También puede ser usada para ornamentación por su follaje. Por ser planta fijadora de nitrógeno conviene utilizar para la recuperación de suelos y mejora de pastos. MARAR Género: Symplocos Especie: quitenses Familia: SYMPLOCACEAE Otros nombres comunes: “Higuera de la sierra”, “Higo de pava” DESCRIPCIÓN BOTÁNICA Árbol de 10-15 m de altura, de tronco cilíndrico, copa irregular, ramificación alterna, corteza externa de color plomiza clara. Hojas simples, alternas, de limbo ovado, ápice redondeado, borde dentado y base atenuada; haz de color verde aceituna brillante y envés con nervación pinnada. Se caracteriza por presentar inflorescencias en racimos axilares. Cada racimo tiene de 3 a 5 flores perfectas, heteroclamídeas, cáliz tubular, corola rosada-pálida o blanquecina, simpétala; con 25 a 35 estambres y ovario ínfero con tres lóculos. El fruto es una drupa. (15). Marar USOS La madera de S. quitenses es utilizada para la industria de la mueblería y en el campo para leña. MOTE CASHA Género: Duranta 52 Especie: mutissi Familia: VERBENACEAE Otros nombres comunes: “Muti cachi”, “Chivo casha”, “Udur”. DESCRIPCIÓN BOTÁNICA Arbusto que llega hasta 4 m de altura, se caracteriza por ser espinudo. Tallos ralos y erectos cuando jóvenes e inclinados cuando viejos. Las hojas son simples, provistas de una espina en la parte inmediata superior al punto de inserción, limbo elíptico, ápice obtuso, base atenuado y borde entero; haz verde oscuro brillante, envés verde claro glabro. Las inflorescencias son racimos terminales y axilares. Las flores son conspicuas bisexuales, de cáliz morado, tubular, limbo truncado; corola gamopétala pentámera, azul violeta o blanquecina. El androceo se compone de 4 estambres, anteras sagitadas y el gineceo de un ovario súpero con 4 lóculos, estilo corto y estigma capitado. El fruto se caracteriza por ser una drupa carnosa, amarilla, compuesta por 4 pirenos y estos por 2 semillas. (15). USOS Esta planta es utilizada para construcción de cercas vivas y linderos, protección de cultivos, leña y ornamentación. PACARCAR Género: Hesperomeles Especie: ferruginea Familia: ROSACEAE Otros nombres comunes: “Manzana Caspi”, “Manzanilla”, “Halo”, “Quique”. DESCRIPCIÓN BOTÁNICA El “Pacarcar” es un árbol que mide de 8 a 12 m de altura, su tallo es circular y sus ramas alternas. 53 Las hojas son simples, pecioladas, de borde aserrado, consistencia coriácea; el haz es verde oscuro y el envés café amarillento tomentoso. Las inflorescencias de esta especie abarcan de 18 a 20 flores las mismas que se agrupan en “racimos de umbelas”. Las flores presentan cáliz verde, de 5 sépalos, persistente; corola caduca de color crema. El androceo posee 20 estambres y el gineceo 5 estilos, el ovario es ínfero y pentalocular. El fruto es un pomo pequeño, rojo, que posee generalmente 5 Pacarcar* semillas. (23) Pág.40. USOS La madera es utilizada para construcciones, elaboración de artesanías, juguetes y herramientas a mano y para la producción de carbón y leña. PENA PENA Género: Fuchsia Especie: loxensis H.B.K Familia: ONAGRACEAE Otros nombres comunes: “Pena pena”, “Zarcillo sacha”, “Arete”. DESCRIPCIÓN BOTÁNICA Planta subarbustiva que crece hasta los 2 m de altura, de tallos arqueados, ramificación opuesta y ramas nudosas. Las hojas son opuestas, dispuestas en verticilos de 34 hojas; sostenidas por un pecíolo acanalado, que a veces presenta una coloración rojiza; el limbo, de forma elíptica, borde dentado, ápice mucronado y base aguda; glabras en el haz y puberulentas en el envés. Las flores son solitarias, bisexuales, de color rojo escarlata, sostenidas por un pedúnculo más o menos largo; hipantio presente; cáliz con cuatro sépalos persistentes; corola provista de cuatro Imagen 2-3. SERRANO, Felipe 1996. Pág. 41 Pena – pena 54 pétalos. El androceo posee 8 estambres, algunas veces dos de ellos fusionados, de tecas adnadas y mesifijas. Gineceo provisto de un largo estilo, ovario ínfero y estigma lobulado. El fruto es una baya de color púrpura. (23) Pág.109. USOS Dentro de las prácticas medicinales tradicionales, se utiliza la infusión de sus flores para obtener efectos sedativos, cardiotónicos (White, 1976), febrífugos y para aliviar las molestias de la insolación (CESA, 1992). (23) Pág.110. PURURUG COLORADO Género: Hedyosmun Especie: luteynii Todzia Familia: CHLORANTACEAE Otros nombres comunes: “Borracho”, “Tarqui”, “Cashco”. DESCRIPCIÓN BOTÁNICA Árbol que llega hasta 16 m de altura y 50 cm de diámetro, le caracteriza el tronco cilíndrico. Las hojas son opuestas, aromáticas, simples, de limbo elíptico u oblanceolado, tienen borde aserrado, ápice acuminado y base aguda. Las hojas muestran pecíolos púrpuras que nacen de “abultadas vainas”; haz verde lustroso y envés verde pálido, áspero, pubescente en las nervaduras. Los amentos masculinos del Pururug colorado, son terminales o axilares sostenidos por un corto pedúnculo, cada uno contiene 200 estambres y las inflorescencias femeninas están compuestas de 1 a 3 címulas acompañadas de brácteas pequeñas, enteras o dentadas. (23). Pururug* * Imagen 2-4. SERRANO, Felipe. 1996 Pág. 36. 55 Los frutos de éste árbol son las címulas fertilizadas púrpuras de 1 a 1,5 cm de diámetro, olor aromático, y consistencia carnosa. Las semillas tienen 4 a 5 cm de longitud, son de color café. USOS El árbol en mención se caracteriza por tener una madera muy suave no idónea para construcciones, sino solamente para leña. Dentro de los usos medicinales que se le atribuye a las hojas de H. luteynii es el de diurético. QUILLUYUGYUG Género: Miconia Especie: crocea Familia: MELASTOMATACEAE Otros nombres comunes: “Quilluyuyu”, “Colca”. DESCRIPCIÓN BOTÁNICA Árbol pequeño de 8 m de altura, tronco cónico, ramificación opuesta. Las hojas son simples, opuestas, blandas, elípticas, de base aguda, margen aserrado, ápice acuminado; poseen 5 nervios prominentes que se une al tallo por ápices de 1 a 2 cm de largo. Inflorescencias en panículas terminales, de color blanco. La corola posee de 5 a 8 pétalos, el cáliz es tubular. Los estambres Quilluyugyug son dimorfos en tamaño, con tecas de 4 celdas; el ovario es ínfero y posee de 3 a 6 lóculos. El fruto es una baya, carnosa, dulce de color pardo amarillenta. (23). USOS La madera de M. crocea se usa para fabricar piezas torneadas y para carbón y leña. 56 En investigaciones de CESA (1993), M. crocea figura por su acción antigripal, antiséptica, tónica y astringente dentro de los usos medicinales tradicionales. (23)Pág.48 QUINUA Género: Polylepis Especie: reticulata Familia: ROSACEAE Otros nombres comunes: “Palo colorado”, Árbol de papel”, “Yagual”, “Pantza”, “Quiñual”, “Queñua”. DESCRIPCIÓN BOTÁNICA Árbol que alcanza hasta 8 m de altura, de tronco irregular que a veces es helicoide. La corteza es escamosa de color rojizo que se desprende con facilidad. Las hojas son compuestas, alternas, imparipinnadas, de borde entero, con 5 foliolos ovales, la base es oblicua y el ápice bífido. Las flores se agrupan en racimos que abarcan de 3 a 7 flores hapoclamídeas, de cáliz dialisépalo, trímero o tetrámero, piloso y persistente. Poseen de 6 a 17 estambres y ovario ínfero. El fruto es un aquenio. (23). USOS La madera de P. ulata es utilizada para la elaboración de herramientas, para formar cortinas rompevientos. A las hojas de quinua se le atribuye las propiedades de antigripales, tónicas y analgésicas. RAÑAS Género: Viburnum Especie: triphyllum Familia: CAPRIFOLIACEAE 57 Otros nombres comunes: “ Danas”, “Juanico”, “Dañas”, “Pinanarín”. DESCRIPCIÓN BOTÁNICA Arbusto de 2 a 4 m de altura, de corteza color café y ramas que se disponen en un mismo punto del eje principal. Las hojas se insertan en los nudos en grupos de tres opuestas; son simples, elípticas, de bordes enteros y haz verde lustroso. Las inflorescencias son de tipo umbela compuesta que contiene un promedio de 94 flores; cada flor de cáliz pentámero verde, corola de Rañas 4 a 6 pétalos blancos. El fruto es una drupa de color negro o púrpura que tiene una semilla. (23). USOS La madera de V. triphyllum es empleada para construcciones rústicas, elaboración de husos para hilar y como combustible. En la medicina tradicional se usan las hojas para preparar emplastos, con efectos antigripales, los mismos que se colocan calientes en la frente y en el pecho. SALVIA REAL Género: Salvia Especie: corrugata Familia: LABIATAE o LAMIACEAE Otros nombres comunes: “Salvia real”, “Caballo chilca”, Azul chilca”, “Salvia”, Suti” DESCRIPCIÓN BOTÁNICA Arbusto de 2 a 3 m de altura de abundante follaje, ramificación opuesta, tallos leñosos; hojas simples, opuestas, 58 Salvia real ásperas, rugosas, lanceoladas, borde dentado, haz color verde y envés café claro. Inflorescencias verticiladas, de color azul violeta. Flores bisexuales, zigomorfas bilabiadas de cáliz persistente y corola pentámera; androceo con dos estambres y gineceo con un ovario supero. Los frutos consisten en nueces pequeñas. (23). USOS Se la utiliza para ornamentación como setos vivos, linderos y cortinas rompevientos. SARAR Género: Weinmannia Especie: fagaroides Familia: CUNONIACEAE Otros nombres comunes: “Sara fino”, “Cashco”, “Encino”, “Matache”. DESCRIPCIÓN BOTÁNICA El árbol de “Sarar” puede medir hasta 25 m de altura, se caracteriza por tener copa irregular y corteza de color parda. Las hojas son compuestas, imparipinnadas, con raquis alado; tienen 9 a 15 foliolos ovados, de ápice redondo, borde aserrado y base redondeada. Las inflorescencias son racimos terminales, que agrupan a flores blancas o amarillentas. Las flores son completas, heteroclamídeas, de cáliz persistente de color verde; corola blanca, caduca, y tetrámera. Referente a los estambres estos tienen dehiscencia longitudinal y el ovario es súpero. Sarar El fruto es una cápsula café que contiene dos semillas. (23). USOS El árbol de “Sarar” proporciona madera de la mejor calidad, que es usada para construcciones de viviendas y muebles, herramientas para la agricultura, etc. También a este se lo utiliza en la agroforestería y sistemas silvopastoriles. 59 SHIÑAN Género: Barnadesia Especie: arborea Familia: ASTERACEAE o COMPOSITAE Otros nombres comunes: “Puca casha”, “Espino”. DESCRIPCIÓN BOTÁNICA Arbusto de 4 m de altura, de tallos leñosos ramificados desde la base y dotados de espinos, la corteza es lisa y gris; con ramas jóvenes tomentosas. Caracterizado por las hojas simples, sésiles, coriáceas, dispuestas en verticilos alternos, con espinas axilares; el limbo tiene forma elíptica, el borde es entero y el ápice aguijoneaado. Las flores se agrupan en cabezuelas rosadas, terminales y solitarias. Cada flor es tubular de pétalos unidos, con 4 dientes, 5 estambres y un ovario ínfero. Los frutos son aquenios. (23). Shiñan USOS El “Shiñan” se utiliza para construcción de cercas, recuperación de hábitats y como combustible. Según CESA (1993), los campesinos usan sus hojas y sus tallos en forma de emplastos e infusiones, para obtener efectos diaforéticos, diuréticos, febrífugos, antiespasmódicos y cicatrizantes. (23). Pág.94. SURO Género: Chusquea Especie: sp. Familia: GRAMINEAE o POACEAE Otros nombres comunes: “Shibur” DESCRIPCIÓN BOTÁNICA Bambú leñoso de 2 a 3 m de altura, de tallo arqueado y nudoso que recibe el nombre de “culmo”; la raíz es subterránea, ensanchada, tiene la particularidad de almacenar los nutrientes y se denomina rizoma. 60 Las agrupaciones foliares que cubren al culmo contienen hojas paralelinervadas, delgadas, lanceoladas y de borde áspero. Las inflorescencias se reúnen en racimo de espigas; las que agrupan a su vez flores bisexuales imperfectas, con cuatro brácteas. El androceo se forma de 4 estambres y el gineceo de un ovario y dos estigmas. El fruto es un “cariópside” que tiene una semilla pequeña. (23). Suro USOS Chusquea sp. es utilizada en la construcción de casas, elaboración de artesanías, alimentación del ganado y como combustible. TILILIN Género: Piper Especie: andreanum Familia: PIPERACEAE Otros nombres comunes: “Matico de Monte”, “Mucuchaclla”. DESCRIPCIÓN BOTÁNICA Árbol pequeño de 4 a 7 m de altura con ramas nudosas, de copa irregular, tronco cilíndrico y corteza externa verdusca. Las hojas son simples, opuestas, de consistencia áspera, ápice apiculado, limbo elíptico, de base asimétrica; el haz es de color verde amarillento y el envés de olor verde claro. Posee inflorescencias del tipo de amentos terminales de color gris o blanco que contienen flores microscópicas, sin sépalos ni pétalos, las que tienen 4 estambres y un ovario súpero. Tililin El fruto es una drupa carnosa de color café que contiene una sola semilla. (23) 61 USOS Esta planta tiene importancia química por su composición aceites volátiles y alcaloides piperídicos. La madera ha sido utilizada para la construcción de casas rústicas, cercas y como combustible. TRINITARIA Género: Otholobium Especie: mexicanum Familia: LEGUMINOSAE / Subf. Papilionoideae Otros nombres comunes: “Culén”, “Culín”, “Huallua”, “Chinitaria”, “Albaquilla” DESCRIPCIÓN BOTÁNICA La Trinitaria es un arbusto de 1 a 3 m de altura, de ramas alternas y corteza lisa. Posee hojas compuestas, trifoliadas, alternas, con peciólulos cortos y estípulas. Los foliolos tienen forma lanceolada, borde entero, ápice acuminado. El haz es verde oscuro y el envés verde claro, el primero es glabro. Trinitaria Las flores se agrupan en espigas terminales o axilares, bisexuales, zigomorfas, de color violeta. Cáliz con 5 sépalos, corola irregular de 5 pétalos; androceo con 10 estambres y gineceo formado por un ovario. El fruto es una legumbre pequeña con una sola semilla. USOS O. mexicanum es un arbusto al cual le atribuyen propiedades medicinales. 62 La infusión de hojas de “Trinitaria” se usa para aliviar problemas estomacales, atribuyéndole también una acción laxante leve(White,1976). Otras de las propiedades medicinales que le dan los campesinos a esta planta, son la de “antidiabética, astringente, balsámica, hemostática, carminativa, emenagoga y vulneraria” (CESA, 1993). Químicamente, este arbusto posee una furanocumarina llamada “Psoraleno”, compuesto fototóxico que suele provocar problemas dérmicos. (23) Pág.126. Esta se la debe considerar para: Recuperación de suelos Preforestación Agrosilvicultura. (23). YANAMOTE Género: Gaultheria Especie: erecta Familia: ERICACEAE Otros nombres comunes: “Mote pelado”. DESCRIPCIÓN BOTÁNICA Subarbusto de 1 a 2 m de altura, de tallos delgados, corteza escamosa de color café rojizo. Caracterizado por hojas simples, alternas, pecioladas, coriáceas de limbo acorazonado y serrulado; el haz presenta color verde oscuro y el envés verde claro. Las inflorescencias son en racimos, agrupan a flores urceoladas, pentámeras, de color rojo o rosado, de cáliz persistente; los estambres son numerosos y el ovario es súpero, pentalocular. El fruto es una pseudobaya que tiene abundantes semillas y se origina a partir de los sépalos. (23). Yanamote USOS Los tallos del “Yanamote” son empleados para leña y sus frutos son comestibles. ZARCILLO SACHA Género: Brachyotum 63 Especie: confertum Familia: MELASTOMATACEAE Otros nombres comunes: “Pichana”, “Puca- chagasha”, “Zarsa”. DESCRIPCIÓN BOTÁNICA Arbusto de 0.6 a 2.5 m de altura, de tallos leñosos en los que presenta tejidos muertos que forman parte exterior de la corteza que se resquebrajan y desprenden; las ramas terminales son flexible-alargadas y cubiertas de pelos. Las hojas son trinervadas, lanceolado-ovadas a oblongo-ovadas, de ápice agudo a redondeado, base aguda a obtusa, el haz es verde oscuro con tricomas ralos estrigosos, envés con tricomas estrigosos a hirsutoides. Las flores se caracterizan por solitarias, pentámeras, serradas, con 2-4 pares de brácteas, de color rojo pálido y densamente cubierto de pelos; hipanto seríceo-estrigoso; cáliz con 5 sépalos amarillos verdosos; corola con 5 pétalos púrpuras oscuros, libres e imbricados que forman un tubo campanulado. Los estambres son isomorfos y se encuentran en número de 10; el ovario es súpero con 5 lóculos pubescente, estilo largo libre de la corola y persistente. El fruto es una cápsula con muchas semillas. (15). USOS Zarcillo sacha Las ramas de esta planta son utilizadas para curar el espanto, barrer y teñir fibras. NOTA: Las fotografías que no indican fuente corresponden a las autoras. 64 2.4. CARACTERÍSTICAS DE LAS FAMILIAS DE LAS PLANTAS UTILIZADAS PARA NUESTRA INVESTIGACIÓN. Reino Filo Clase Orden FAMILIA Géneros existentes en la familia. Plantae MAGNOLIOPHYTA Magnoliopsida Urticales URTICACEAE 52 Sobre 1.000 especies Plantae MAGNOLIOPHYTA Magnoliopsida Fagales BETULACEAE 6 Más de Plantae MAGNOLIOPHYTA Magnoliopsida Laurales LAURACEAE 47 Sobre 2. y 2.500 MAGNOLIOPHYTA Magnoliopsida Campanulales LOBELIACEAE 10 148 Especie existent en familia Plantae Especie existent en familia Reino Filo Clase Orden FAMILIA Géneros existentes en la familia. Plantae MAGNOLIOPHYTA Magnoliopsida Asterales ASTERACEAE 1000 Más 20.000 Plantae MAGNOLIOPHYTA Magnoliopsida Malvales ELAEOCARPACEAE 7 + Plantae MAGNOLIOPHYTA Magnoliopsida Rubiales RUBIACEAE 630 Alreded de 10.40 Plantae MAGNOLIOPHYTA Magnoliopsida Solanales SOLANACEAE 90 Entre 2 149 y 3.000. Reino Filo Clase Orden FAMILIA Géneros existentes en la familia. Especie existent en familia Plantae MAGNOLIOPHYTA Magnoliopsida Proteales PROTEACEAE 69 Alreded de 1500 Plantae MAGNOLIOPHYTA Magnoliopsida Myrtales MYRTACEAE 120 Cerca 3.000 Plantae MAGNOLIOPHYTA Magnoliopsida Myricales MYRICACEAE 3 Unas 35 Plantae MAGNOLIOPHYTA Magnoliopsida Ericales ERICACEAE 115 Cerca 3.350 Plantae MAGNOLIOPHYTA Magnoliopsida Ebenales SYMPLOCACEAE 1 250 – sp Plantae MAGNOLIOPHYTA Magnoliopsida Lamiales VERBENACEAE 75 Alreded de 3000 Especie existent en familia Reino Filo Clase Orden FAMILIA Géneros existentes en la familia. Plantae MAGNOLIOPHYTA Magnoliopsida Rosales ROSACEAE 100 Más 3.000 especies Plantae Plantae MAGNOLIOPHYTA MAGNOLIOPHYTA Magnoliopsida Magnoliopsida Myrtales Piperales ONAGRACEAE CHLORANTACEAE 17 + 675 + Plantae MAGNOLIOPHYTA Magnoliopsida Myrtales MELASTOMATACEAE 250 4.000 1130 Plantae MAGNOLIOPHYTA Magnoliopsida Dipsacales CAPRIFOLIACEAE 12 a 15 400-500 Plantae MAGNOLIOPHYTA Magnoliopsida Lamiales LAMIACEAE o LABIATAE 200 3.200 Especie existent en familia Reino Filo Clase Orden FAMILIA Géneros existentes en la familia. Plantae MAGNOLIOPHYTA Magnoliopsida Rosales CUNONIACEAE 30 250 Plantae MAGNOLIOPHYTA Liliopsida Cyperales POACEAE o GRAMINEAE 500 8.000 Plantae MAGNOLIOPHYTA Magnoliopsida Piperales PIPERACEAE 5-10 2.000 Plantae MAGNOLIOPHYTA Magnoliopsida Fabales LEGUMINOSAE 400 14.000 especies (+) = Información no disponible. Cuadro realizado por las autoras anotando como referencia a:(24), (9), (23), (29), (3), (55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75). 1131 1132 CAPITULO III BIOACTIVIDAD CAPÍTULO # 3 BIOACTIVIDAD 1133 La biodiversidad con que cuenta nuestro país, nos permite tener una visión de la riqueza natural y estudiar todas las plantas que pueden ser útiles para la elaboración de fitofármacos gracias a sus componentes (metabolitos primarios y secundarios) por lo tanto a través de bioensayos y sucesivas investigaciones se puede identificar las especies hábiles para la mencionada utilidad. Por ello resulta interesante estudiar el metabolismo secundario asociado a grupos taxonómicos que han desarrollado estrategias químicas o bioquímicas para interaccionar con otros organismos. Esta interacción involucra la presencia de compuestos bioactivos que incluyen desde potentes componentes tóxicos hasta moléculas altamente especializadas utilizadas para interactuar con otros organismos. Se sabe que las plantas tienen la capacidad de biogenerar una larga variedad de compuestos orgánicos volátiles (COV) que desempeñan diversos papeles fisiológicos y de transmisión de señales. Algunos de estos compuestos orgánicos son emitidos en cantidades suficientemente grandes como para producir un impacto en el medio ambiente. Por ejemplo, algunos monoterpenos inducen la producción de ozono, el geraniol es un atrayente de polinizadores, ciertos aldehídos actúan como defensas químicas contra el ataque de microorganismos y otros señalan sitios de alimentación. (51). Los elementos que se toman en cuenta para la bioactividad son: las plantas y los microorganismos que en nuestro caso son las levaduras. Para la realización de la bioactividad es importante distinguir las fases a seguir: 1. Selección de la parte de la planta con la que se realizará el ensayo. 2. Seleccionar las cepas de levaduras con las que se realizará el bioensayo. 3. Ensayo de difusión en agar (bioensayo). 4. Screening fitoquímico de los positivos. Estos parámetros se describirán en el capítulo de metodología. METABOLITOS PRESENTES EN LAS PLANTAS A continuación se describirán de manera general algunos metabolitos presentes en las plantas y que pueden ser los responsables de la bioactividad antifungal contra levaduras. 1134 Las plantas verdes son organismos con clorofila, capaces de elaborar sustancias comunes a todas ellas, como: carbohidratos, aminoácidos, ciertos ácidos carboxílicos, vitaminas, reguladores del crecimiento y compuestos que participan en la fotosíntesis; estos reciben el nombre de metabolitos primarios los mismos que se sintetizan a partir de agua, anhídrido carbónico y minerales. Los alcaloides, flavonoides, esteroides, cumarinas, taninos, aceites esenciales y algunos más se denominan metabolitos secundarios y tienen la característica de no ser comunes a todas las plantas. Los metabolitos secundarios tienen gran interés por su actividad biológica y desde este punto de vista se pueden distinguir dos grupos. a) Constituyentes de las plantas con acción tóxica. El conocimiento de estas sustancias puede servir para lograr el tratamiento de envenenamientos humanos. b) Los metabolitos secundarios como medicamentos, para los cuales se vienen realizando estudios. (27) Pág.122-123. CARBOHIDRATOS Los carbohidratos son alcoholes aldehídicos o cetónicos que contienen carbono, hidrógeno y oxígeno en una proporción Cn(H2O)n. Constituyen las reservas energéticas de las células vegetales (almidón) y animales (glucógeno). Los vegetales sintetizan gran variedad de glúcidos en el proceso conocido como fotosíntesis, en el cual absorben el dióxido de carbono del aire y, por acción de la energía solar, transforman en energía química, originando así glucosa y otros compuestos químicos necesarios para que los organismos sobrevivan y crezcan. 1135 Los glúcidos se dividen en tres clases: Monosacáridos o azucares simples, contienen un grupo aldehído o cetona, son dulces, solubles en agua, y pueden cristalizarse, el más importante es la glucosa también pertenecen a este grupo la fructosa o azúcar de las frutas y otros. Disacáridos, se forman de dos monosacáridos unidos por un átomo de oxígeno con la eliminación de una molécula de agua, entre los más importantes tenemos: maltosa, lactosa, sacarosa. Polisacáridos son enormes moléculas formadas de monosacáridos unidos entre sí en largas cadenas, pueden o no tener el mismo tipo de monosacárido como eslabón en esas cadenas. No cristalizan y no pasan a través de las membranas los principales son: almidón, celulosa y glucógeno. El almidón es un la forma principal de almacenamiento de glucosa en la mayoría de las plantas. Es fabricado por las plantas verdes durante la fotosíntesis. Forma parte de las paredes celulares de las plantas y de las fibras de las plantas rígidas. A su vez sirve de almacén de energía en las plantas, liberando energía durante el proceso de oxidación en dióxido de carbono y agua. Los gránulos de almidón de las plantas presentan un tamaño, forma y características específicos del tipo de planta en que se ha formado el almidón. (52) Medicinalmente el almidón es emoliente y energético. La acción emoliente aporta una acción suavizante y antiinflamatoria sobre la piel y mucosas. La acción energética se produce durante los procesos digestivos; las enzimas de la digestión rompen el almidón y liberan glucosa, que es una fuente de energía muy importante para las células. (52). La celulosa es el polisacárido más abundante en los vegetales, formado por moléculas de glucosa unidas entre si por enlaces glucosídicos, junto con la hemicelulosa son los principales componentes de la pared celular de los vegetales. Otros carbohidratos que se encuentran en los vegetales son: pectinas, gomas y mucílagos, inulina, pentosas ( xilano, ribosa). AMINOÁCIDOS 1136 Los aminoácidos son un importante grupo de compuestos orgánicos que contienen un grupo amino (― NH2) y un grupo carboxilo (―COOH). Veinte de estos compuestos son los constituyentes de las proteínas. Se los conoce como alfaaminoácidos (a-aminoácidos) y son los siguientes: alanina, arginina, asparagina, ácido aspártico, cisteína, ácido glutámico, glutamina, glicina, histidina, isoleucina, leucina, lisina, metionina, fenilalanina, prolina, serina, treonina, triptófano, tirosina y valina. Todos ellos responden a la siguiente fórmula general: Como muestra dicha fórmula, los grupos amino y carboxilo se encuentran unidos al mismo átomo de carbono, llamado átomo de carbono alfa. Ligado a él se encuentra un grupo variable (R). Es en dichos grupos R donde las moléculas de los veinte alfaaminoácidos se diferencian unas de otras. En la glicina, el más simple de los ácidos, el grupo R se compone de un único átomo de hidrógeno. En otros aminoácidos el grupo R es más complejo, conteniendo carbono e hidrógeno, así como oxígeno, nitrógeno y azufre. Cuando una célula viva sintetiza proteínas, el grupo carboxilo de un aminoácido reacciona con el grupo amino de otro, formando un enlace peptídico. El grupo carboxilo del segundo aminoácido reacciona de modo similar con el grupo amino del tercero, y así sucesivamente hasta formar una larga cadena. Esta molécula en cadena, que puede contener de 50 a varios cientos de aminoácidos, se denomina polipéptido. Una proteína puede estar formada por una sola cadena o por varias de ellas unidas por enlaces moleculares débiles. Cada proteína se forma siguiendo las instrucciones contenidas en el ácido nucleico, el material genético de la célula. A partir de las veinte subunidades pueden formarse una gran variedad de proteínas. Las plantas son capaces de producir sus aminoácidos a partir de nitrógeno, dióxido de carbono y otros compuestos por medio de la fotosíntesis. Los α -aminoácidos sirven de materia prima en la 1137 obtención de otros productos celulares, como hormonas y pigmentos. Además, varios de estos aminoácidos son intermediarios fundamentales en el metabolismo celular. Aparte de los aminoácidos de las proteínas, se han encontrado en la naturaleza más de 150 tipos diferentes de aminoácidos, incluidos algunos que contienen los grupos amino y carboxilo ligados a átomos de carbono separados. Estos aminoácidos de estructura poco usual se encuentran sobre todo en hongos y plantas superiores. (29). TANINOS Los taninos, son compuestos fenólicos amorfos o cristalinos que se localizan en algunas células especiales de los parénquimas de varias plantas, en especial en los tallos, las hojas y frutos. La composición química de los taninos es variable pero poseen una característica común, la de ser amargos, astringentes y precipitar los alcaloides, albúminas y metales pesados. Son polvos amorfos que tienen un ligero olor característico, el color va desde el amarillo al castaño oscuro, de aspecto grasiento, poco denso, solubles en agua y alcohol, e insolubles en éter, benceno y cloroformo; cuando se calientan a 210 ºC se descomponen produciendo dióxido de carbono y pirogalol. En la industria se utilizan para la fabricación de tintas y el curtido de pieles, gracias a la capacidad de los taninos para trasformar las proteínas en productos resistentes a la descomposición. En este proceso se emplean determinados taninos, los más utilizados son los procedentes de la acacia, el castaño, la encina, el pino o la bastarda. (53). Se emplean en la industria textil por su capacidad de reaccionar con las sales férricas, los cuales dan lugar a productos negro-azulados adecuados para tintes. Igualmente son utilizados como mordientes para la aplicación de tintes en tejidos, coagulantes de gomas, o aprestos para papeles o sedas. (53). 1138 En alimentación, los taninos originan el característico sabor astringente a los vinos tintos (de cuyo bouquet son, en parte, responsables), al té, al café o al cacao. Las propiedades de precipitación de los taninos son utilizadas para limpiar o clarear vinos o cerveza. (53) En medicina se prescriben por su acción astringente, hemostática, tonificante y antiséptica (53). Los taninos tienen una acción bactericida y bacteriostática. También ejercen un efecto antifúngico. (10) La propiedad ya comentada de coagular las albúminas de las mucosas y de los tejidos, crean una capa seca, aislante y protectora que reduce la irritación y el dolor sobre la piel. (53). Tienen acción cicatrizante. La mayor parte de las propiedades biológicas de los taninos se debe al poder que posee de formar complejos con macromoléculas especialmente con proteínas (enzimas digestivas y otras proteínas fúngicas). (4) Pág. 382. Externamente, los preparados a base de drogas ricas en taninos, como las decocciones, se emplean para detener pequeñas hemorragias locales; en inflamaciones de la cavidad bucal, catarros, bronquitis, quemaduras, hemorroides, etc. Internamente, son útiles contra la diarrea, enfriamiento intestinal y afecciones vesiculares, aunque pueden producir alguna intolerancia en personas con estómago delicado, por ello es conveniente administrar en forma de tisanas maceradas, con objeto de extraer también de la planta otras sustancias activas. Los taninos también son útiles como antídoto en caso de intoxicación por metales o por alcaloides vegetales. No es aconsejable consumir plantas con alto contenido en taninos durante un periodo prolongado de tiempo, ya que inhiben la absorción por el organismo de determinadas vitaminas y minerales, tales como el calcio y el hierro (53) por esta razón se les atribuye la característica de antinutrientes. Los taninos también poseen acción: hipocolesterolémica, antioxidante. Además se les considera también como protectores titulares, venosos y capilares. (10). CUMARINAS 1139 Las cumarinas son compuestos orgánicos ampliamente distribuidos en las plantas, se las encuentra desde la raíz a flores y frutos siendo más abundantes en estos últimos. Se caracterizan por ser derivadas del sistema benzo--pirona y su carácter lactónico hace que sean solubilizadas por soluciones alcalinas con la aparición de color amarillo en la solución. Muchas de ellas son fenólicas por lo que se incluyen dentro de los derivados fenólicos. (27) Las cumarinas aisladas actualmente tienen un amplio rango de actividad biológica, antibacteriales, antibióticos, hepatotóxicos, carcinogénicos, estrogénicos, insecticidas entre otras. (27)Pág.152-153. Además a las cumarinas se les atribuye las siguientes acciones farmacológocas: Acción vitamínica P: disminuyen la permeabilidad capilar y refuerzan los capilares. Tónicos venosos (venotónicos). Fotosensibilizadores (furanocumarinas). Aniinflamatorios Antiespasmódicos Vasodilatadores coronarios Ligero efecto hipnótico Sedantes Anticoagulantes (dicumarol). (10) Pág.102 RESINAS Se conoce con el nombre de resinas a compuestos naturales amorfos, segregados por muchas plantas, comprenden una mezcla compleja de glúcidos, ácidos orgánicos, ésteres, alcoholes y esencias terpénicas. Se presentan en su mayoría duras, transparentes o translúcidas a temperatura ambiente pero al someter a calentamiento se ablandan y funden formando masas viscosas. 1140 Las resinas son insolubles en agua y solubles en alcohol, éter y otros disolventes orgánicos. Estas aparecen como producto final del metabolismo vegetal o cuando se ha hecho un corte en la superficie externa de la planta. Naturalmente, forman una capa que protege a la planta de organismos patógenos y de una pérdida excesiva de savia a través del corte. (27) Las resinas naturales se encuentran en la naturaleza combinadas con otras sustancias, atendiendo a esta característica se clasifican en: 1. Oleorresinas: son mezclas de aceites esenciales y resinas. 2. Gomorresinas: son mezclas de gomas y resinas. 3. Oleogomorresinas: son mezclas de aceites esenciales, gomas y resinas. 4. Glucorresinas: son resinas en cuya composición intervienen glúcidos unidos mediante enlaces heterósidos. (10) Pág. 163. Por su parte, las resinas poseen variadas propiedades medicinales, aunque sólo la resina de unas pocas plantas son realmente útiles para esta función; se distinguen propiedades antiespasmódicas (como la asafétida), antisépticas del aparato urinario (como la copaiba), antirreumáticas y rubefacientes (como la colofonia del pino), purgantes (como la mandrágora), y en usos externos contra las verrugas (como el podófilo.(54). ALCALOIDES Los alcaloides son sustancias orgánicas nitrogenadas con carácter básico y mayoritariamente de origen vegetal. Poseen una estructura generalmente compleja y ejercen acciones fisiológicas diversas incluso a dosis muy bajas. Son tóxicos y capaces de precipitar con ciertos reactivos característicos. (10) Pág.167. 1141 Se distinguen varios tipos de acuerdo a sus esqueletos moleculares básicos: piridínicos, piperidínicos, quinólicos, isoquinólicos, tropanos, indólicos, imidazólicos, purínicos, etc. (27) Pág.124. En los vegetales, los alcaloides suelen estar localizados en tejidos periféricos: corteza, raíz, hojas, frutos y semillas. Pueden encontrarse libres, en forma de sal o unidos a taninos o ácidos orgánicos. Aproximadamente 30 de los alcaloides conocidos se usan en medicina. Por ejemplo, la atropina, que se obtiene de la belladona, dilata las pupilas; la morfina es un calmante; la quinina es un remedio específico para la malaria; la nicotina es un insecticida potente y la reserpina un tranquilizador. (27). FLAVONOIDES Los Flavonoides son pigmentos hidrosolubles ampliamente distribuidos entre los vegetales superiores, sobre todo en las partes aéreas hojas, flores yfrutos. Se encuentran tanto en el citoplasma como en las vacuolas de las células vegetales. Algunos flavonoides son los responsables de los colores intensos de las flores y frutas. La mayor parte de los flavonoides son derivados de la cromona (1,4-benzopirona). La estructura básica de un flavonoide consiste en dos anillos bencénicos unidos por un enlace de tres carbonos que forma un anillo pirónico con un oxígeno. Existen diferentes tipos de flavonoides, entre otros las flavonas, flavonoles, flavanonas, antocianidinas y catequinas. Estas sustancias difieren sólo en el estado de oxidación de los enlaces entre los tres átomos de carbono, y los compuestos que pertenecen a cada tipo de flavonoides difieren entre sí en el número y orientación de los grupos sustituyentes en los anillos bencénicos. La mayoría de los flavonoides se encuentra en las plantas como glucósidos en los que uno o más de los grupos hidróxido están unidos a azúcares. 1142 Las flavonas, como la crisina y la apigenina, forman parte de gran número de los pigmentos amarillos de las plantas, mientras que las antocianidinas forman parte de los azules y rojos de las flores y los frutos como glucósidos conocidos como antocianos. (29) Los flavonoides, poseen acciones farmacológicas variadas tales como: acción vitamina P (factor antiescorbútico), antihemorrágicos, antiarrítmicos, protectores de la pared vascular o capilar, antiinflamatorios, antirradicales libres, antihepatotóxicos, antibacterianos, antivíricos y antifúngicos. Ejercen acción antiespasmódica sobre el tracto digestivo; además son diuréticos, antiurémicos y potentes inhibidores de algunos sistemas enzimáticos, ayudan a la polinización por los colores que imparten a las flores y por último los flavonoides amargos sirven como repelentes contra gusanos que se alimentan de las hojas. (27) (10). SAPONINAS Las saponinas son heterósidos (azúcar+aglicón) que se caracterizan por su capacidad para producir espuma cuando se agita una solución acuosa que las contiene. Se forma espuma debido a que las saponinas disminuyen la tensión superficial del agua. Son por lo tanto tensoactivos naturales. Se distinguen dos clases de saponinas dependiendo de la estructura del aglicón: saponinas esteroides y saponinas triterpenoides. Las saponinas son solubles en agua y alcohol, amargas y están casi exentas de toxicidad por ingestión para los animales de sangre caliente. Sin embargo, inyectadas directamente en sangre son muy dañinas, pues disuelven con rapidez los eritrocitos. Al realizar una hidrólisis ácida o enzimática de las saponinas se obtiene un azúcar (con frecuencia, glucosa) y una sapogenina, que puede ser un triterpeno o un esteroide. (29) Las saponinas se utilizan como agentes limpiadores, espumantes y algunas son materia prima para la elaboración de hormonas esteroidales. (29). 1143 Otras aplicaciones y usos que se les atribuye a las drogas con saponinas son: acción irritante de las células, efecto antiedematoso y antiinflamatorio, acción antihemorroidal y cicatrizante, estimulante, tonificante y antiestrés; efecto antimicrobiano, antivírico, antimicótico y molusquicida. (10) QUINONAS Son compuestos aromáticos con dos grupos cetona, frecuentemente en para (1,4) y en muy pocos casos en orto (1,2), dicetonas insaturadas que por reducción se convierten en polifenoles. (10); pigmentos orgánicos caracterizados por ciertas semejanzas estructurales que les proporcionan su color brillante, normalmente rojo, amarillo o anaranjado. Las quinonas existen de forma natural en plantas, hongos y bacterias, e incluso algunas se encuentran en los animales, como la vitamina K, que participa en la coagulación sanguínea. (29). Entre los compuestos que presentan estructura quinónica se destacan los siguientes: ▪ Benzoquinonas: con una estructura derivada del benceno. Tienen importancia las plastoquinonas, situadas en los cloroplastos donde intervienen el la fotosíntesis de las plantas, y las ubiquinonas, localizadas en las mitocondrias donde intervienen en los procesos de respuesta del vegetal. ▪ Naftoquinonas: con una estructura derivada del naftaleno. Estos compuestos tienen interés en farmacia debido básicamente a su poder antiséptico (tanto antibacteriano como antifúngico). (10). ▪ Antraquinonas: con una estructura derivada del antraceno. Se inciden por sus propiedades laxantes. ▪ Fenantraquinonas: con una estructura derivada del fenantreno. ▪ Antraciclinonas: con una estructura derivada del naftaceno. Entre las acciones farmacológicas que presentan las quinonas se destaca su poder laxante, efecto colagogo, y a concentraciones elevadas y según el estado de los principios activos, tiene un efecto purgante. (10) 1144 Las quinonas se utilizan en tintes, reveladores fotográficos, fungicidas y otros productos. La mayoría son tóxicas. (29). ACEITES ESENCIALES Los aceites esenciales son productos químicos que proceden de flores, frutos, hojas, raíces, semillas y corteza de los vegetales; se consideran unos de los compuestos más ampliamente distribuidos en la naturaleza y como subproducto del metabolismo secundario de determinadas plantas. Se originan en las partes verdes del vegetal de donde se transportan a otros tejidos especialmente a los brotes en flor. Los aceites esenciales son líquidos volátiles, en su mayoría insolubles en agua, pero fácilmente solubles en alcohol, éter y aceites vegetales y minerales. Por lo general no son oleosos al tacto. Pueden agruparse en cinco clases, dependiendo de su estructura química: alcoholes, ésteres, aldehídos, cetonas, lactonas y óxidos. (52) Los aceites volátiles se forman por la unión virtual de unidades de isopreno e isopentano. Los vegetales los sintetizan a partir del isopreno el cual nunca ha sido aislado como producto natural. En algunas especies vegetales, se ha determinado actividades biológicas, entre las principales: actividad antiherbivoria, actividad antimicrobiana, actividad citotóxica, citostática y antitumoral y actividad moluscicida. (27)Pág.127. Antisépticos: frente a microorganismos Gram positivos y Gram negativos e incluso frente a hongos productores de micosis y ciertas levaduras (Candica sp.). El poder antiséptico es variable según las características estructurales de los componentes de aceite esencial, el cual puede tener: elevado poder antiséptico, poder antiséptico medio y bajo poder antiséptico. (10). 1145 Los aceites esenciales aplicados por vía interna tienen los siguientes usos: antiinflamatorios, expectorantes, carminativos, coleréticos, estomacales, antidiarreicos, antiespasmódicos y tonificantes, diuréticos; además se anotan las propiedades sedantes y estimulantes cardíacos. (27) (10). Se utilizan ampliamente en la industria para dar sabor y aroma a productos como té, vinos y bebidas alcohólicas. También tienen aplicación en la fabricación de perfumes, jabones, desinfectantes y productos similares. 1146 CAPITULO IV METODOLOGÍA CAPITULO # 4 METODOLOGÍA 4.1 OBJETIVO GENERAL: Determinar en extracto alcohólico, compuestos químicos con bioactividad antifungal contra cuatro hongos levaduriformes: Candida albicans, Candida krusei, Rhodotorula glutinis y Saccharomyces cerevisiae. 4.2 OBJETIVOS ESPECÍFICOS: Determinar el porcentaje de bioactividad antifungal, de 30 plantas seleccionadas del Bosque de Mazán, contra hongos levaduriformes. Determinar el porcentaje de plantas con bioactividad contra dos hongos levaduriformes. Determinar el porcentaje de plantas con bioactividad contra tres hongos levaduriformes. Determinar el porcentaje de plantas con bioactividad contra cuatro hongos levaduriformes ensayados. Determinar los metabolitos presentes en las plantas que den bioactividad antifungal positiva. 1147 4.3 PLAN GENERAL DE TRABAJO: 4.3.1 Selección de las especies. 4.3.2 Recolección de las plantas. 4.3.3 Secado de las plantas. 4.3.4 Trituración y tamizado. 4.3.5 Determinación de la humedad. 4.3.6 Obtención del extracto alcohólico. 4.3.7 Obtención del residuo seco. 4.3.8 Resuspensión del residuo seco en DMSO (Dimetilsulfóxido). 4.3.9 Reactivación de las cepas de levaduras. 4.3.10 Preparación del inóculo. 4.3.11 Ensayo de la bioactividad antifungal. 4.3.12 Ensayo fitoquímico de las plantas que resultaron positivas. 4.3.13 Análisis de resultados. 4.3.14 Conclusiones. 4.3.1 SELECCIÓN DE LAS ESPECIES. Para este estudio de bioactividad antifungal, de 84 plantas identificadas por Serrano y Minga, se seleccionaron al azar 30 plantas de las cuales 14 son árboles y 16 son arbustos, cuya característica común principal entre ellas es la de pertenecer al Bosque protegido de Mazán, que forma parte del Parque Nacional Cajas; anotando que sobre estas plantas no se ha realizado ningún estudio previo respecto a esta bioactividad. (15, 23). 4.3.2 RECOLECCIÓN DE LAS PLANTAS. Se procedió a recolectar en primer lugar las hojas por cuanto se considera que son los órganos más importantes de la planta, debido a que en ellas se encuentran los orgánulos en los cuales se realizan procesos metabólicos primordiales, como por ejemplo, los plastidios que son capaces de 1148 sintetizar y almacenar sustancias(1) y porque además siempre están presentes en las plantas; mientras que las flores y frutos se recolectan de aquellas plantas que florecen y fructifican en el primer semestre del año. 4.3.2.1 Las fechas de recolección fueron las siguientes: 4.3.2.1.1 Primera recolección 05 de marzo del 2004. 09 de marzo del 2004. 24 de marzo del 2004. 4.3.2.1.2 Segunda recolección solo de las plantas que dieron bioactividad positiva. 06 de abril del 2004. 13 de abril del 2004. 4.3.2.1.3 Tercera recolección solo de las plantas que dieron bioactividad positiva. 04 de mayo del 2004. 14 de mayo del 2004. 4.3.2.2 Materiales necesarios para la recolección: o Tijeras de poda. o Fundas plásticas. o Papel periódico. o Cinta para marcar. o Marcadores. En la ficha que se muestra en el Anexo #3 se indican a manera de ejemplo los datos que se obtuvieron en cada recolección. 4.3.3 SECADO DE LAS PLANTAS. 1149 De las plantas recolectadas se eligieron: hojas, flores y frutos idóneos con el propósito de eliminar partes dañadas, mohos y otros contaminantes. Las partes seleccionadas de las plantas se secarán con el fin de eliminar la cantidad suficiente de humedad que permita conservar la calidad de la droga. Este procedimiento permite fijar los constituyentes, prevenir el enmohecimiento, la acción de las enzimas como también de las bacterias, y posibles alteraciones químicas; además facilita la trituración y la molienda. (16)(26). Para evitar el deterioro enzimático causante de la pérdida de principios activos de las plantas y, en suma, de sus propiedades medicinales, se recomienda someter a las plantas a un método de secado adecuado, ya que con una humedad baja se inhiben las reacciones enzimáticas y se produce una estabilización del vegetal. (3). ▪ En el procedimiento de secado se tomó en cuenta los siguientes aspectos: a. Una vez realizada la recolección de las plantas, se descargó lo antes posible e inmediatamente se procedió a la separación de hojas, flores y frutos como se indicó en párrafos anteriores. b. Las partes seleccionadas de las plantas se esparce uniformemente en los bastidores y luego se coloca en el interior del túnel. c. Bastidores y en general el material utilizado para el secado estuvieron limpios y fueron revisados regularmente. 4.3.3.1 MÉTODO DE SECADO UTILIZADO: Secado a temperatura artificial en túnel. El secado a temperatura artificial, es un método que nos sirve para obtener materia prima vegetal libre de contaminación la misma que podría presentarse en el método de secado a temperatura ambiente. Este método nos permite trabajar con una temperatura controlada (no mayor a 40 ºC) 1150 manteniendo así los aceites u otras sustancias susceptibles a la evaporación y disminuye el tiempo requerido para secar las plantas. 4.3.3.2 Materiales utilizados: En la práctica se empleó un túnel de secado a temperatura de 37 ºC, por 12 horas continuas. 4.3.4 TRITURACIÓN Y TAMIZADO. La ley de Fick expresa que mientras mayor es el grado de división de la droga, mayor será la difusión a través de la membrana porosa, sin embargo, una división muy grande del vegetal puede romper las células y esto puede aportar a la extracción de sustancias indeseables. (26) Para asegurar que el proceso de extracción cumpla con los requisitos de calidad, se recomienda que el tamaño de las partículas de las drogas a extraer sea no mayor a 5 mm. 4.3.4.1 Materiales utilizados: El molido de las plantas investigadas se realizó en un molino cortante marca corona, obteniéndose partículas de 0.5 a 1 cm de diámetro. Una vez molida, la droga se tamizó con el objetivo de homogeneizarla utilizando para esto una malla #3 con el objetivo de homogeneizar la muestra y luego se guardó en fundas de papel de despacho bien etiquetadas. 4.3.5 DETERMINACIÓN DE LA HUMEDAD. Se realizó por el método gravimétrico, que se fundamenta en la desecación de la muestra en una estufa hasta eliminar completamente la materia volátil, y se determina la humedad a partir de la diferencia de pesos. Según la Farmacopea de los Estados Unidos Mexicanos se recomienda que las humedades obtenidas sean de 8 – 12%.(7) 1151 4.3.5.1 Procedimiento: La determinación debe efectuarse por duplicado. Se coloca una cápsula de porcelana en una estufa a 105ºC por 3 horas y luego se tara. Se pesan 2g de muestra pulverizada (con un error máximo de 0.5 mg), transferir a la cápsula, se deseca por 3 horas a 105ºC en una estufa, se enfría en un desecador hasta temperatura ambiente y se pesa. Regresar la cápsula que contiene la muestra a la estufa por una hora, y luego se pesa. Repetir el calentamiento por períodos de 30 minutos, enfriando y pesando hasta que la diferencia entre dos pesadas consecutivas no sea mayor de 2 mg. 4.3.5.2 Cálculos: H = M2 – M1 x 100 M H = humedad (%) M 2 = Masa de la cápsula con la muestra de ensayo (g) M1 = Masa de la cápsula con la muestra desecada (g) M = masa de la muestra de ensayo Se informa el promedio de las determinaciones. La humedad debe encontrarse en %. 4.3.5.3 Materiales utilizados: - Estufa: Marca : NEW LINE Temperatura: 105ºC - Desecador - Pinzas - Balanza analítica: Modelo : 790C Marca : Mettler Sensibilidad: 0,1mg Capacidad : 160g Modelo 4.3.6 : H31AR OBTENCIÓN DEL EXTRACTO ALCOHÓLICO. 1152 En esta investigación se utilizó el alcohol por que generalmente es más eficaz para recuperar la mayoría de los metabolitos secundarios. (13)Pág.24. Después de revisar varias publicaciones, respecto a los trabajos que se han realizado con extractos de plantas para pruebas de bioactividad, se ha encontrado que no hay una estandarización respecto a la concentración del extracto para la realización de la prueba. Por ejemplo: en el artículo “Actividad antimicrobiana de los extractos etanólico, acetónico y acuoso de Baccharis nitida (Ruiz et Pavon) Pers” escrito por RANGEL, D. et al., en material métodos, obtención de los extractos: El material vegetal seco y molido, fue extraído con etanol, mediante maceración a temperatura ambiente durante una noche con agitación, filtraron al vacío y concentraron a presión reducida a una temperatura no mayor de 40ºC. (37)Pág.44. En el árticulo “Bio-active Compounds from Phychotria camponutans” (SOLIS, Pablo N., et al.), Materials and Methods, Extraction and isolation: Pesan 600g de raíces secas y pulverizadas de P. camponutans agregan metanol y el extracto obtenido es filtrado y evaporado al vacío obteniéndose 60g de residuo. (39). En el artículo “Antimicrobial activity of extracts of eastern North American hardwood trees and relation to traditional medicine.” Escrito por OMAR, S., et al., proceden de la siguiente manera: Extract preparation The bark and wood were separated and ground into a fine powder (sawdust) by using a Wiley mill. The powdered material was soaked in ethanol (5:1 w/w) for 48h. The mixture was filtered, and the solvent evaporated to near dryness and then freeze-dried. (36). Pág.162 En el artículo, “Leishmanicidad and trypanocidad activities of Bolivian medicinal plants”. de FOURHET, Alain., et al., proceden de la siguiente forma: Extraction and isolation. The air-dried 1153 leaves (720g) were powdered and extracted with petroleum ether. The solvent was evaporated under reduced pressure to yield a greenish extract (61g). (34) Pág. 112. En varias investigaciones en las que se han utilizado extractos para determinar bioactividad, ya sea antiparasitaria, antibacteriana y antifungal, en todos ellos se obtuvieron extractos de manera general de la siguiente manera: - Pesado de la droga seca - Agregar el solvente orgánico - Dejar en contacto por un tiempo entre 12 y 24 horas, con agitación - Filtrar - Evaporar el solvente a sequedad - Resuspender de acuerdo a la necesidad de cada investigación Se revisó: (5), (31), (32), (33), (35), (40). PROCEDIMIENTO: (Ver recomendaciones 1, 2, 3 y 4). En nuestra investigación se procedió de la siguiente manera: A. Es un sistema cerrado en el cual se pone en contacto las células vegetales con el solvente. (16). Pesar 50g de droga (seca, triturada, tamizada, humedad entre 8-12%), colocar en un recipiente ámbar, agregar etanol de 95º GL hasta saturar la droga, el volumen varia dependiendo del grado de absorción de cada planta; dejar en contacto durante 24 horas a temperatura ambiente con agitación permanente. Según la ley de Fick la gradiente de concentración se da hasta llegar al equilibrio entre la concentración de metabolitos presentes en las células vegetales y los metabolitos extraídos por el solvente. (*) Para asegurar que se ha llegado a un equilibrio de concentraciones se ha alargado el tiempo de contacto entre la droga 1154 y el solvente de 12 horas que dice el CYTED a 24 horas que es nuestra modificación. La agitación favorece la extracción de los principios activos presentes en la planta; este procedimiento se consiguió agitando la droga a 210 r.p.m en un shaeker (Marca: New Brunswick Scientific, Temperatura: 23 + 2 ºC). De acuerdo a la ley de la difusión y para evitar el aumento de la viscosidad por un aumento de la concentración de la capa límite entre la célula del tejido vegetal y el menstruo, y con el objetivo de aumentar la velocidad de transporte del menstruo, la agitación hace más efectivo el proceso. (16)Pág.50 B. El contenido de los frascos ámbar (droga más menstruo) obtenido como se indica en A. colocamos en un frasco cónico de vidrio, abierto en sus dos extremos, el mismo que en su abertura inferior de 3.5 cm. de diámetro posee un equipo de venoclisis (adaptado con la ayuda de un corcho) a través del cual se deja fluir el extracto en forma descendente a una velocidad de XX gotas por minuto, descartando las XV primeras gotas; en este extremo se coloca también una capa fina de algodón humedecida con el menstruo (a través de esta se retiene a la droga); finalmente se recoge el 75% del volumen de alcohol que se añadió de acuerdo al proceso A.. En la abertura superior de 7.5 cm. de diámetro colocamos una tapa de cristal grueso. Se recoge el extracto, filtra y guarda en frascos ámbar, estériles, y se procede a evaporar para obtener el residuo seco como se explicará más adelante. Los extractos se conservan en refrigeración (4 ºC). Se trata de un proceso de paso, si bien hay una maceración previa el disolvente se renueva de modo continuo y debido a ello mantiene el gradiente de concentración lo más alto posible, el disolvente corre de arriba a abajo a través de la capa de droga, el disolvente puro desplaza al que contiene la sustancia extraída sin ser necesario aplicar presión. La calidad del extracto 1155 depende del grado de finura de la droga, la velocidad de difusión de las sustancias activas desde la droga al disolvente y en la velocidad de pasaje del disolvente.* 4.3.6.1. Materiales utilizados. - Envases ámbar de vidrio. - Gasa - Frascos de vidrio ( Con aberturas en los dos extremos) - Equipo de venoclisis - Algodón - Canicas de vidrio - Papel de aluminio - Probeta - Corchos - Etanol de 95º GL - Embudos - Papel filtro - Marcador permanente - Cinta adhesiva - Shaeker: Marca: New Brunswick Scientific. Temperatura: 23 + 2 ºC r.p.m 4.3.7 : 210 OBTENCIÓN DEL RESIDUO SECO. 4.3.7.1 Procedimiento: * OSORIO D, Edison Xavier. “Curso de Farmacognosia y Fitoquímica”. Facultad de Química y Farmacia. Universidad de Antioquia. Febrero 2004. 1156 Pesar vasos de precipitación vacíos previamente lavados y sanitizados. Adicionar a los vasos 25ml de extracto alcohólico obtenido como se indica en 4.3.6 (A. y B). Evaporar a sequedad, en baño de María a una temperatura de 37 °C. Pesar los vasos de precipitación que contienen el residuo seco. Por diferencia de pesos entre los vasos de precipitación que contienen el residuo seco y los vasos de precipitación vacíos se calcula los gramos de extracto seco obtenido. 4.3.7.2 Materiales empleados: - Baño Maria: Marca : New Line. Temperatura: 37 ºC. - Balanza: Marca : OHAUS® Capacidad : 200 x 0,01g Código : SC2020 Span calibration weight: 200g - 4.3.8 Vasos de precipitación. RESUSPENSIÓN DEL RESIDUO SECO EN SOLUCIÓN DE DIMETILSULFÓXIDO (DMSO) al 10% EN AGUA. 4.3.8.1 Preparación de la solución de dimetilsulfóxido al 10% en agua. El Dimetilsulfóxido (DMSO) es un compuesto orgánico, que permite solubilizar los metabolitos secundarios presentes en el residuo seco, se caracteriza por ser inocuo para los microorganismos utilizados en los ensayos de bioactivdad. (27, 5). La solución de DMSO se prepara al 10% en agua destilada y luego se esteriliza en autoclave (15 minutos a 121 ºC). Conservar en refrigeración. 4.3.8.2 Procedimiento: Pesar 2mg de residuo seco en un microtubo de 1.5 ml de capacidad (Eppendorf) estéril. 1157 A este tubo añadir solución acuosa de DMSO al 10% hasta resuspender el residuo seco; esto se consigue añadiendo entre 200 y 400μl de la solución antes indicada. 4.3.8.2 Materiales empleados: - Residuo seco. - Microtubos de 1.5 ml (Eppendorf). - Balanza: Marca : OHAUS® Capacidad : 200 x 0,01g Código : SC2020 Span calibration weight: 200g 4.3.8.3 Reactivo empleado: - Dimetilsulfóxido (DMSO): Marca: Sigma Lote: 99F001 Código: D-5879. 4.3.9 REACTIVACIÓN DE LAS CEPAS DE LEVADURAS. 4.3.9.1 Especificación de las levaduras: Las CEPA CÓDIGO Saccharomyces cerevisiae YNN 295 MAT Rhodotorula glutinis CECT 10143 Candida krusei CECT 10688 Candida albicans CECT 3153 A cepas de levaduras fueron donadas por el laboratorio Andaluz de Biología de la Universidad Pablo de Olavide de Sevilla –España de la colección Española. La biomasa se realiza a partir de cepas puras: C. albicans, C. krusei, S. cerevisiae y R. glutinis, se toma una asada y se siembra en forma de estría en cajas de petri que contiene 15ml de YE 1158 sólido (C. albicans, C. krusei, R. glutinis) y 15ml de YELU sólido (S. cerevisiae). Se deja incubar en una estufa a 25ºC por 24h. 4.3.9.2 Objetivo: Conseguir un cultivo fresco y abundante de células para obtener un cultivo en fase exponencial de crecimiento antes del bioensayo. 4.3.9.3 Materiales empleados: - Asa. - Lámpara de alcohol. - Guantes estériles. - Cajas de petri: Material : Plástico. Diámetro : 8cm. Altura - Estufa: Marca : 1cm. : Fanenn Temperatura: 25ºC Modelo 4.3.9.4 : 002CB MEDIOS DE CULTIVO UTILIZADOS PARA LA BIOACTIVIDAD. AGAR YE٭ Extracto de levadura……………………………..5g Glucosa…………………………………………30g Agar bacteriológico…………………………….20g Agua destilada…………………….……c.s.p.1000ml YE LÍQUIDO٭ Extracto de levadura……………………………..5g Glucosa…………………………………………30g 1159 Agua destilada…………………….……c.s.p.1000ml ( ) ٭Estos medios son utilizados para las cepas de: Candida krusei, Rhodotorula glutinis y Candida albicans. AGAR YELU▪ Extracto de levadura……………….……………..5g Glucosa……………………………….…………30g Agar bacteriológico……………….…………….20g Leucina…………………………………………1,5g Uracilo...…..……………………………………1,5g Agua destilada………………..…………c.s.p 1000ml YELU LÍQUIDO▪ Extracto de levadura……………….……………..5g Glucosa……………………………….…………30g Leucina…………………………………………1,5g Uracilo...…..……………………………………1,5g Agua destilada………………..…………c.s.p 1000ml (▪) Se trabajó con estos medios solo para la cepa de: Saccaromyces cerevisiae. Especificaciones de los medios de cultivo: - Extracto de levadura: Marca: Pronadisa Lote : 0344460 - Glucosa: Marca: Mallinckrodt Lote : 4912Y10H06 - Agar bacteriológico: Marca : Acumedia Lote : 9704-158 1160 Código: 7178 - Uracilo: Marca : Sigma Lote : 072K3488 Código: U-0750 - Leucina: Marca : Sigma Lote : 033k0380 Código: L-8000 Preparación de los medios de cultivo: Pesar las sustancias, según la cantidad que indica la fórmula para cada medio de cultivo. Colocar en un erlenmeyer. Agregar agua destilada en c.s.p. preparar un litro de medio de cultivo. Los agares YE y YELU se calientan hasta obtener el punto de solidificación del agar. Para los caldos YE y YELU se disuelve las sustancias con la ayuda de un agitador. Esterilizar en autoclave (15 minutos a 121 ºC). Dejar enfriar a 45 -50ºC el agar, verter en las cajas de petri (este proceso en nuestra investigación se realizó en una cámara de flujo laminar esterilizada con luz UV). Los caldos autoclaveados se dejan enfriar y se conserva en refrigeración. 4.3.10 Preparación del inóculo. Fundamento de la técnica: Las células que están creciendo en un cultivo discontinuo (en un matraz en agitación) normalmente experimentan cuatro diferentes estadios de crecimiento: una fase de latencia, una fase de crecimiento exponencial, una fase de crecimiento estacionario y una fase de muerte. 1161 Las células en fase de latencia, que proceden de una alícuota de un cultivo anterior que han sido transferidas a un medio nuevo, no crecen en seguida. Primero tienen que adaptarse al nuevo medio antes de comenzar a crecer a aun ritmo rápido. La duración de esta fase de latencia depende de numerosos factores: la edad y genotipo del inóculo, de la temperatura, de la concentración en nutrientes del cultivo viejo y nuevo, de la aireación, y de la concentración de toxinas que pueden haberse formado en el cultivo viejo. Una vez que la célula empieza a crecer rápidamente, se dice que han entrado en una fase de crecimiento logarítmica o exponencial. En este estadio las células crecen rápidamente, y a diferencia de las células de las fases de latencia y estacionaria, la mayoría de las células se hallan en el mismo estadio fisiológico reproduciéndose), la velocidad de crecimiento durante la fase exponencial depende del nivel de nutrientes y de la aireación del cultivo. Frecuentemente, el oxígeno es el factor limitante de los cultivos de levaduras, por ello los cultivos deben agitarse a gran velocidad para disolver una cantidad suficiente de oxígeno. Conforme se consuma los nutrientes en un crecimiento discontinuo y acumulando se va productos inhibitorios, la velocidad crecimiento disminuyendo, de va hasta detenerse el cultivo en la llegar a Imagen 4-1. Curva de crecimiento de las levaduras fase estacionaria. En la fase estacionaria las células no están todas en el mismo estado fisiológico; algunas todavía se están dividiendo mientras que otras ya han comenzado a morirse. Pero la población total todavía se mantiene constante. Conforme se agota la mayoría de los nutrientes, el número de células que mueren sobrepasa al número de células que se producen, y el cultivo entra en fase de muerte. (2) Pág. 197-198. Imagen 4 -1. Fuente: (9). 1162 4.3.10.1 Procedimiento: a. Cultivo madre: Tomar una asada de biomasa (explicado en Pág. 112). Sembrar en un erlenmeyer que contenga 25 ml de YE líquido ( C. albicans, C. krusei, R. glutinis) o 25 ml de YELU líquido (S. cerevisiae). Incubar a 25 ºC por 24 horas con agitación a 210 r.p.m., éste corresponde al cultivo madre. Luego de ese tiempo, comprobar la pureza de la cepa al microscopio con lente de 40x. Realizar la lectura de la densidad óptica en el espectrofotómetro, a una longitud de onda de 595nm. La lectura debe ser > 0.9 porque esta indica que las levaduras están en fase estacionaria. b. Cultivo exponencial: De este cultivo madre tomar 2ml y sembrar en un erlenmeyer que contenga 25 ml de YE líquido (C. albicans, C. krusei, R. glutinis) o 25ml de YELU líquido (S. cerevisiae). Incubar a 25ºC por 6 a 8 horas. Obteniéndose el cultivo exponencial Luego de este tiempo comprobar la pureza de la cepa, al microscopio con lente de 40x. Realizar la lectura de la densidad óptica en el espectrofotómetro, a una longitud de onda de 595nm. La lectura debe estar entre un rango de 0.4-0.9, lo que indica que las cepas se encuentran en fase exponencial. De esta manera obtenemos el cultivo de levadura listo para el bioensayo. Es necesario que las cepas utilizadas para el ensayo de la bioactividad antifungal estén en fase exponencial, es decir, que la mayoría de las células se encuentren en un mismo estado fisiológico de reproducción, para enfrentarlas siempre en iguales condiciones a las concentraciones conocidas del extracto, de tal forma que los resultados sean comparables. .4.3.10.2 Materiales empleados: 1163 - Balanza: Marca : OHAUS® Capacidad : 200x0,01g Código : SC2020 Span calibration weight: 200g - Espectrofotómetro: Marca : UNICO Modelo No.: 1100 - Microscopio: Marca : Nikon Modelo : Labophot - Shaeker: Marca : New Brunswick Scientific. Temperatura : 25ºC r.p.m. - Estufa: Marca : 210 : Fanen Temperatura : 25ºC Modelo : 002C 4.3.10.3 Medios empleados: (Ver Páginas 104,105). 4.3.11 ENSAYO DE LA BIOACTIVIDAD ANTIFUNGAL: 4.3.11.1 Generalidades: La actividad antifungal de plantas es un bioensayo que mide la capacidad antifúngica y/o fungistático de los extractos de dichas plantas frente a hongos levaduriformes que causan enfermedades en el hombre. La actividad antifungal se evalúa tomando en cuenta la inhibición del crecimiento de las levaduras frente a la concentración determinada del extracto vegetal que se emplea para el estudio. 4.3.11.2 Método de los discos de papel Fundamento: 1164 Con esta técnica se busca detectar el efecto antimicótico o antifúngico en forma cualitativa sobre algunas cepas de hongos patógenos, existiendo la posibilidad de determinar las concentraciones mínimas inhibitorias de los productos activos. (5) Pág. 71. Las cepas de hongos que se pueden utilizar son: Candida albicans, Aspergillus fumigatus, Acremonium falciforme y Fusarium solanii. Se utiliza como medio de cultivo Mueller-Hinton en forma de caldo y placa de agar y discos de papel de 0,4 cm de diámetro que se impregnan con los extractos de productos naturales. La técnica de Bauer y Kirby se fundamenta en la impregnación de los discos con una cantidad determinada de extracto vegetal de concentración conocida, alrededor de la cual se establece un gradiente que va disminuyendo conforme se aleja del centro y se va difundiendo en el agar. Se sigue la técnica descrita por Bauer y Kirby. Es una técnica sencilla donde se ensayan diferentes dosis de extractos(o de productos puros aislados previamente) sobre distintas bacterias y se observa la presencia o ausencia de los halos de inhibición. La técnica se puede resumir del siguiente modo: Diámetro de los discos: 5 mm Medio de cultivo: Agar de Mueller-Hinton Espesor de agar: 4 mm Tiempo de incubación: 18-24 horas Temperatura de incubación: 37ºC Evaporación del disolvente del extracto a 60ºC, media hora. Cantidad de extracto en cada disco: 50 μL por aplicación sucesiva de 20, 15 y 15 μL, deja ndo secar después de cada aplicación. A los 5 minutos de haber ajustado la densidad del inóculo, se sumerge en el cultivo en escobillón estéril y se procede a la siembra en placa de Agar de Mueller-Hinton perfectamente seca y estéril. 1165 Se aplican los discos con las distintas dosis de antimicrobianos sobre la placa sembrada presionando con suavidad sobre la superficie del agar con una pinza estéril. Se invierten las placas y se incuban a 37 ºC durante 18-24 horas. Pasado este tiempo se miden los diámetros de los halos de inhibición producidos. En todos los casos las placas son llevadas media hora antes de su incubación a una cámara fría para facilitar la difusión del antimicrobiano. (5)Pág. 69 4.3.11.3 Bioensayo. (Técnica USP) Esta prueba se diseña para la aplicación en material natural o artificial utilizando una variedad de formas. La capa de agar actúa como un amortiguador para proteger las células del daño mecánico, mientras permite la difusión de compuestos químicos de las muestras contenidas en el papel filtro hacia el agar. Los extractos de las muestras para el estudio serán aplicados a un pedazo de papel filtro. Utilizar extractos directamente preparados o usar porciones de las muestras de la prueba en una superficie plana, que no tenga menos de 100 mm2 en área de superficie. Preparar el agar en cajas de 60 mm de diámetro usando 7 ml de un cultivo preparado de células. Aspirare el medio de cultivo del agar y reemplácelo con suplemento de suero de un medio de cultivo que contenga no más del 2% de agar. Emplear la superficie plana del agar para la preparación de la muestra, para proveer de un control negativo la USP indica que se puede usar un control de plástico RS (Reference Standards), y cualquier sólido RS (Reference Standards) con bioreacción positiva para proveer un control positivo, los cultivos deben realizarse por duplicado y deben estar contacto con la superficie del agar. Incubar todos los cultivos no menos de 24 horas a 37 + 1ºC , preferiblemente en una incubadora que contenga humedad de 5 + 1% de dióxido de carbono. Revisar alrededor de cada muestra, control positivo y control negativo con la ayuda de un microscopio observando las manchas o inhibiciones producidas. (19)Pág.1496 1166 Adaptación de la técnica. 4.3.11 4 Procedimiento: Los ensayos se realizan por duplicado. En cajas de petri que contienen medios de YE sólido (C.albicans, C.krusei, R. glutinis) o YELU sólido (S. cerevisiae), colocar bolitas de cristal estériles. Tomar 100 μl del cultivo exponencial de las levaduras y depositar en las cajas de petri, realizar una siembra confluente; la cual se consigue moviéndoles de izquierda a derecha por cinco minutos y haciéndoles girar para que sea homogénea la siembra. NOTA: Realizar. - Control positivo de Nistatina. - Control de disco. - Control de DMSO al 10% en agua. (ver Pág. 110,11). - Control del medio de cultivo (sólido y líquido). Invertir las cajas para que las bolitas de cristal se sitúen el la tapas. Retirar las bolitas de cristal en un recipiente que contenga cloro. Esperar 15 minutos; colocar los discos. Impregnar los discos con 15μl de residuo seco resuspendido en solución de DMSO al 10%. Sellar las cajas con plástico adhesivo para evitar deshidratación del medio, y para asegurar las tapas de las cajas. Incubar a 25 ºC por 24 a 48 horas. Observar los halos de inhibición formados y comparar con el control de nistatina. Medir el diámetro de los halos en cuatro direcciones diferentes y sacar la media aritmética. Calcular el porcentaje de inhibición. 1167 Para calcular el porcentaje de inhibición de los extractos respecto a los controles positivos se realiza utilizando la siguiente fórmula: PIR = X diámetro del halo de inhibición del extracto X diámetro del halo de inhibición del control positivo (CP) x 100 Donde: X = Media aritmética (PIR): Porcentaje de inhibición relativa Asumiendo que el máximo efecto inhibitorio es el halo producido por el control positivo (CP): Se determina el porcentaje de efecto de inhibición del crecimiento del microorganismo de cada extracto, relativo al CP. (22) 4.3.11.4 Lectura: El diámetro de la zona de inhibición del crecimiento del microorganismo se mide en milímetros (mm). La lectura se realiza desde la línea que define la media luna de inhibición hacia un lado al borde del disco y posteriormente se calcula el porcentaje de inhibición relativo (PIR). Se toma en cuenta como positivo a todos los halos que presentan inhibición (independientemente de los mm que presente) y como negativo a aquellos ensayos que presentan crecimiento alrededor del disco. (19), (5), (22). De los residuos secos obtenidos a partir de los extractos alcohólicos de las plantas antes mencionadas se realizó el ensayo de bioactividad, utilizando el método de impregnación en discos de papel, probando así la bioactividad antifungal de las mismas frente a cuatro especies de hongos levaduriformes, utilizando como controles Nistatina (ver Páginas 115-116), DMSO (ver Pág. 101102) y disco. Las bioactividades positivas se evidenciaron por la formación de un halo de inhibición del crecimiento de los microorganismos alrededor del disco medido en milímetros. 1168 CONTROL DE NISTATINA NISTATINA Mecanismo de acción: es un macrólido poliénico que se fija al ergosterol de la membrana celular del hongo, formando poros a través de los cuales se pierden constituyentes celulares. Esto da lugar a alteraciones que resultan fatales para el hongo. El efecto tóxico que produce este fármaco es selectivo, debido a que en las células humanas el esterol más importante es el colesterol, no el ergosterol. (25) Pág. 204. Preparación del control de nistatina Triturar un comprimido de nistatina y pesar 0.25g; suspender en 0.5 ml de agua destilada estéril. La concentración de la nistatina para nuestro ensayo es de 50% P/V. Para el control de nistatina se impregna 15 μl de esta suspensión en un disco de papel que se encuentra en una caja de petri la cual ha sido previamente inoculada como se indica en 4.3.11.4. El control de nistatina a la concentración indicada fue un ensayo desarrollado y puesto a punto por las Dras. Adelina Astudillo y Carmen Lucía López, durante la pasantía realizada en el laboratorio Andaluz de Biología de la Universidad Pablo de Olavide de Sevilla-España, en el desarrollo del Doctorado en Biología Experimental. 4.3.11.6 Materiales empleados: - Cajas de petri: Material: plástico. Diámetro: 8cm. Altura - : 1cm. Tipo de papel: Papel filtro corrugado de celulosa S-933 de 0,6mm de diámetro; estéril. - Estufa: Marca : Fanenn Temperatura: 25ºC Modelo : 002CB 1169 - Bolitas de Cristal 4.3.11. 7 Medios empleados: (Ver Páginas 104-105). 4.3.11.8 Controles empleados: - -Dimetilsulfóxido (DMSO): Marca : Sigma Lote : 99F001 Código : D-5879 - 4.3.12 Nistatina: Comprimido de 500.000UI Ensayo fitoquímico de las plantas que resultaron positivas. 4.3.12.1 Partes de las plantas con las que se realizó la fitoquímica: Planta Aliso Chul chul Hual hual Marar Pena pena Quilluyugyug Quinua Yanamote Zarcillo sacha Parte Hoja Fruto Hoja Flor Hoja Hoja Flor Hoja Flor Hoja Hoja Hoja Hoja Flor 1170 4.3.12.2 Ensayos a realizarse en los extractos: (16). Compuesto Ensayo Dragendorff Mayer Wagner Confirmatorias reactivo de: con Tanino Alcaloides Acido Pícrico Ac. Fosfowolfrámico Ac. Fosfomolíbdico Marmé Extracto alcohólico Fenoles y Taninos Cloruro Férrico Flavonoides Shidona Azúcares Reductores Fehling Saponinas Espuma Resinas Resinas Triterpenos y esteroides Lieberman-Burchard Aminoácidos Ninhidrina Quinonas Bornträger Catequinas Catequinas Lactonas y Coumarinas Baljet Glicósidos Cardiotónicos Kedde Antocianidinas Antocianidinas 1171 4.3.12.3 TÉCNICAS PARA DETERMINACIÓN DE PRINCIPIOS ACTIVOS UTILIZADAS EN EL PRESENTE TRABAJO: 4.3.12.3.1 Determinación de Alcaloides. Los ensayos de Dragendorff, Mayer y Wagner permiten determinar la presencia de alcaloides en el extracto. Ensayo de Dragendorff : Procedimiento: En un tubo de ensayo colocar 1ml de extracto alcohólico, evaporar a sequedad. Añadir 1ml de HCl al 1% en agua y III gotas de reactivo de Dragendorff. Resultado: Opalescencia (+) Turbidez definida (++) Precipitado rojo ladrillo (+++) Ensayo de Mayer : Procedimiento: En un tubo de ensayo colocar 1ml de extracto alcohólico, evaporar a sequedad. Añadir 1ml de HCl al 1% en agua y III gotas de reactivo de Mayer Resultado: Opalescencia (+) Turbidez definida (++) Precipitado amarillo o blanco coposo (+++) 1172 Ensayo de Wagner: Procedimiento: En un tubo de ensayo colocar 1ml de extracto alcohólico, evaporar a sequedad. Añadir 1ml de HCl al 1% en agua y III gotas de reactivo Wagner. Resultado: Opalescencia (+) Turbidez definida (++) Precipitado carmelita 4.3.12.3.1.1 (+++) Pruebas confirmatorias de alcaloides: Ensayo con solución de tanino: Procedimiento: Evaporar una alícuota de extracto y acidificar con 1ml de ácido clorhídrico al 1%, colocar II a III gotas de reactivo de Tanino. Resultado: Opalescencia (+) Turbidez definida (++) Precipitado coposo (+++) Ensayo con solución de ácido fosfowolfrámico: Procedimiento: Evaporar una alícuota de extracto y acidificar con 1ml de ácido clorhídrico al 1%, colocar II a III gotas de reactivo. Resultado: Opalescencia (+) 1173 Turbidez definida (++) Precipitado coposo (+++) Ensayo con solución de ácido fosfomolíbdico : Procedimiento: Evaporar una alícuota de extracto y acidificar con 1ml de ácido clorhídrico al 1%, colocar II a III gotas de reactivo. Resultado: Opalescencia (+) Turbidez definida (++) Precipitado coposo (+++) Ensayo con solución de ácido pícrico : Evaporar una alícuota de extracto y acidificar con 1ml de ácido clorhídrico al 1%, colocar II a III gotas de reactivo. Resultado: Opalescencia (+) Turbidez definida (++) Precipitado coposo (+++) Ensayo con reactivo de Marmé : Evaporar una alícuota de extracto y acidificar con 1ml de ácido clorhídrico al 1%, colocar II a III gotas de reactivo. Resultado: Opalescencia (+) Turbidez definida (++) Precipitado coposo (+++) 1174 4.3.12.3.2 Determinación de Lactonas y Coumarinas. Ensayo de Baljet: Permite reconocer la presencia de compuestos láctonicos en general y particularmente Coumarinas. Procedimiento: En un tubo de ensayo colocar 1ml de extracto alcohólico, adicionar 1ml de reactivo. Resultado: 4.3.12.3.3 Aparición de coloración roja (++) Precipitado rojo (+++) Determinación de Triterpenos y Esteroides. Ensayo de Lieberman-Burchard: A través de este ensayo se identifica compuestos como triterpenos y esteroides que poseen un núcleo del androstano. Procedimiento: Colocar 1ml de extracto alcohólico en un tubo de ensayo, evaporar a sequedad. Redisolver con 1ml de cloroformo, adicionar 1ml de anhídrido acético y mezclar. Por las paredes del tubo dejar caer II a III gotas de ácido sulfúrico (H2SO4) concentrado sin agitar. Resultado: Un resultado positivo se tiene por un cambio rápido de color. ▪ Rosado-azul muy rápido (en ocasiones puede quedar en dos fases). ▪ Verde intenso visible aunque rápido. ▪ Verde oscuro-negro, final de la reacción (ocurre cuando hay grandes cantidades de estos compuestos). 1175 4.3.12.3.4 Determinación de Catequinas: Procedimiento: Utilizando un capilar colocar I gota de extracto alcohólico sobre un papel filtro, esperar que éste se seque y sobre la mancha aplicar solución de carbonato de sodio (Na2CO3), una vez seco el papel observar al UV. Resultado: La aparición de una mancha verde carmelita a la luz UV indica ensayo positivo. 4.3.12.3.5 Determinación de Saponinas. Ensayo de la Espuma: Mediante este ensayo se puede identificar saponinas tanto del tipo esteroidal como triterpénica, en un extracto. Procedimiento: En un tubo de ensayo colocar 1ml de extracto alcohólico, añadir 5ml de agua. Agitar fuertemente durante 5 a 10 minutos y dejar reposar. Resultado: La aparición de espuma jabonosa de más de 2mm de altura que persiste por más de 2 minutos indica un ensayo positivo. 4.3.12.3.6 Determinación de Resinas. Procedimiento: A 2ml de extracto alcohólico adicionar 10ml de agua destilada y agitar. 1176 Resultado: El ensayo es positivo si aparece un precipitado. 4.3.12.3.7 Determinación de Hidratos de Carbono. Ensayo de Fehling: Permite investigar en el extracto la presencia de azúcares reductores. Procedimiento: Evaporar 1ml de extracto alcohólico, redisolver el residuo en 1-2ml de agua. Adicionar 2ml de reactivo y calentar en un baño de agua durante 5 a 10 minutos. Resultado: El ensayo es positivo si la solución se colorea de rojo-naranja o aparece un precipitado rojonaranja. 4.3.12.3.8 Determinación de Fenoles y Taninos. Ensayo del Cloruro Férrico: Permite investigar la presencia de compuestos fenólicos y/o taninos en un extracto vegetal. Procedimiento: Añadir a una alícuota de extracto III gotas de solución de cloruro férrico al 5% en solución salina (ClNa al 0.9 % en agua). Resultado: Coloración rojo-vino: compuestos fenólicos en general. Coloración verde intensa: taninos del tipo pirocatecólicos. 1177 Coloración azul: taninos del tipo pirogalactánico. 4.3.12.3.9 Determinación de quinonas Ensayo de Bornträger: Se utiliza para la identificación de quinonas en un extracto. Procedimiento: Evaporar a sequedad 1-2ml de extracto alcohólico, redisolver el residuo con 1ml de cloroformo. Adicionar 1-2ml de hidróxido de sodio (NaOH), potasio (KOH) o amonio (NH4OH) al 5% en agua. Se agita mezclando las fases y se deja en reposo hasta su separación. Resultado: Se considera el ensayo positivo si la fase acuosa (superior) se colorea de rosado (++) o rojo (+++). 4.3.13.2.10 Determinación de Flavonoides. Ensayo de Shinoda: Permite investigar la presencia de flavonoides en un extracto vegetal. Procedimiento: Colocar en un tubo de ensayo 1ml de extracto alcohólico adicionar 1ml de HCl (ácido clorhídrico) concentrado, agregar unas virutas (pedacito) de cinta de magnesio metálico. Se espera 5 minutos después de la reacción y se agita con un 1ml de alcohol amílico finalmente dejar que se separen las fases. Resultado: El ensayo es positivo cuando el alcohol amílico se colorea de amarillo, naranja, carmelita o rojo intenso. 1178 4.3.12.3.11 Determinación de Aminoácidos. Ensayo de la Ninhidrina: Permite reconocer la presencia de aminoácidos libres o de aminas en general en los extractos vegetales. Procedimiento: Evaporar a sequedad 1ml de extracto alcohólico, adicionar al residuo III gotas de solución de Ninhidrina al 0,2% en etanol. Calentar en baño de María por 5-10 minutos. Resultado: El ensayo es positivo si se desarrolla una coloración azul-violácea. 4.3.12.3.12 Determinación de Glicósidos Cardiotónicos. Ensayo de Kedde: Permite investigar la presencia de glicósidos cardiotónicos. Procedimiento: A 1ml de extracto alcohólico adicionar V gotas de reactivo recién preparado, dejar reposar durante 5-10 minutos. Resultado: Una coloración violácea persistente durante 1-2horas indica un resultado positivo. 4.3.12.3.13 Determinación de Antocianidinas: Procedimiento: 1179 Se calienta 2ml de extracto alcohólico por 10 minutos con 1ml de ácido clorhídrico concentrado. Se deja enfriar y se adiciona 1ml de agua destilada y 2ml de alcohol amílico. Se agita y se deja reposar hasta separación de las dos fases. Resultado: El ensayo es positivo si aparece una coloración roja o marrón en la fase amílica. (16) Los puntos 4.3.13 Análisis de resultados y 4.3.14 Conclusiones se explican en el capítulo # 5. CAPITULO V DATOS RESULTADOS CONCLUSIONES 1180 CAPÍTULO # 5 DATOS RESULTADOS Y CONCLUSIONES 5. 1. HUMEDAD PRIMERA RECOLECCIÓN Nombre de la % de Humedad planta Hojas 1º 2º X 9.6 7.4 8.5 Aguachento 10.3 9.7 10 Aliso 10 12 11 Canelo Centropogon 5.3 5.1 5.2 6.4 6.7 Chilca negra 7 7.5 7.1 7.3 Chul chul Chuquirahua 8.9 9.3 9.1 8.7 9.5 9.1 Dumbrir 7.8 8 7.9 Floripondio 12 11.9 12 Gañal 7.9 8.3 8.1 Gynoxys 7 7.8 7.4 Huahual 8.5 7.6 8 Joyapa 10 9 Laurel de cera 8 Flor 1º 8.6 7.9 7.7 6.9 4.3 9.6 9.8 6.3 10.5 - Fruto 2º X 1º 2º 8 8.3 8.6 7.4 8.1 8 7.1 7.4 7.5 7.2 3.5 3.9 9 9.3 10 9.9 6.5 6.4 11.9 11.2 - Nombre de la PRIMERA RECOLECCIÓN planta X 8 - SEGUNDA RECOLECCIÓN TERCERA RECOLECCIÓN % Humedad (Plantas con bioactividad positiva). Hojas Flor Fruto 1º 2º X 1º 2º X 1º 2º X % Humedad positiva). Hojas 1º 2º X 9.5 8.5 9* - - - 8.2 7.8 8* 9 (Plantas con bioactividad Flor 1º 2º 10 9.5* - 8.1 7.9 8* 7.1 6.9 7* - - - 8.6 7 8 - - - 7.4 7.6 7.5* - 8 8* - - - SEGUNDA RECOLECCIÓN - Fruto X 1º 2º X - 8.4 8 7.8* 8.8 7.2 8* - - - - 8.2* - - - - TERCERA RECOLECCIÓN 130 % de Humedad Hojas 1º 2º 10 10.4 Marar 12 11.9 Mote casha 8.9 9.1 Pacarcar 10 9.4 Pena Pena 8.0 7.2 Pururug Quilluyugyug 4.0 3.2 6.0 6.01 Quinua 6.1 6.7 Rañas 5.8 5.4 Salvia real 8.0 7.6 Sarar 9.8 10 Shiñan 4.0 4.4 Suro 7.4 7.6 Tililin 7.7 9.11 Trinitaria 9.0 10.4 Yanamote 10 11.4 Zarcillo sacha X 10.2 12 9 9.7 7.6 3.6 6 6.4 5.6 7.8 9.9 4.2 7.5 8.4 9.7 10.7 Flor 1º 2º 5.5 4.5 11 11.4 6.5 6.9 6 6.6 8 8.8 9.5 8.7 9 11 10 12.4 6.2 5.8 X 5 11.2 6.7 6.3 8.4 9.1 10 11.2 6 Fruto 1º 2º 7.5 6.5 7 6.8 9.4 10 - X 7 6.9 9.7 - % Humedad (Plantas con bioactividad antifungal positiva). Hojas Flor Fruto 1º 2º X 1º 2º X 1º 2º X 10.2 9.8 10* 5 6 5.5* - - - % Humedad (Plantas con bioactividad antifungal positiva). Hojas Flor Fruto 1º 2º X 1º 2º X 1º 2º X 10.5 10.4 10.5 5.5 6.5 6 - - - 9.1 8.9 9* 10.4 11.6 11* - - - 7.5 8.5 8* 4.5 6.9 3.5 7.1 4* 7* - - - 3.6 6.3 4.2 6.7 3.9* 6.5* - 11 9.8 10 10.5* 10.2 10* 6.6 - - - 6 ● ● 6.3* - - ● 10.4 9.6 - 10.7 9.7 10 11 10.5* - - 10* 10.2 6.3 5.9 6.1 - - - - - ● ● ● - - - (*) Plantas que tienen bioactividad antifungal positiva frente a las cepas de Candida krusei, Rhodotorula glutinis, Candida albicans y Saccharomyces cerevisiae. Ensayos realizados con nueva planta. (-) Flores y frutos de las plantas que no fue posible la recolección y con las cuales NO se cuenta para los ensayos. (●) Parte de la planta que dio resultados negativos, por lo que no se le toma en cuenta para la comprobación. En el cuadro se observa que las plantas tienen diferente porcentaje de humedad, entre ellas las de mayor % de humedad son Gañal y Mote casha (hojas), de las flores la Joyapa, Pena pena y Trinitaria, de los frutos el Yanamote. Entre las plantas de menor % de humedad tenemos a Quilluyugyug (hojas), Chuquiragua (flores) y Pururug (frutos). 131 5.2. OBTENCION DE LOS EXTRACTOS ALCOHÓLICOS 5.2.1 Tabla con datos de las 30 plantas ensayadas (Primera recolección). Obtención de los extractos alcohólicos Nombre de la planta Aguachento Aliso Canelo Centropogon Chilca negra Chul chul Chuquirahua Dumbrir Floripondio Gañal Gynoxys Huahual Joyapa Laurel de cera Marar Mote casha Pacarcar Pena pena Pururug Quilluyugyug Quinua Rañas Salvia real Sarar Shiñan Suro Tililin Trinitaria Yanamote Zarcillo sacha Peso de planta seca (g) Volumen total de Volumen total de alcohol añadidos (ml) alcohol obtenido en B. Pág. 99 (ml) Hojas Flor Fruto Hojas Flor Fruto Hojas Flor Fruto 50 50 200 300 140 160 50 50 150 175 130 150 50 200 112 50 50 400 350 282 246 50 50 250 300 225 230 50 50 250 250 200 232 50 50 300 300 184 230 50 50 150 200 112 164 50 50 300 240 180 145 50 50 150 250 112 213 50 150 112 50 200 157 50 50 150 150 120 112 50 150 112 50 50 200 300 165 210 50 50 150 150 112 100 50 150 112 50 50 150 210 130 160 50 50 150 200 112 175 50 175 113 50 150 115 50 50 150 250 112 150 50 50 300 300 230 226 50 50 250 300 100 160 50 50 200 300 97 188 50 350 270 50 50 200 150 98 130 50 50 200 200 150 160 50 50 200 300 185 250 50 50 225 250 171 194 - Para la obtención de extracto alcohólico de las plantas se añadió alcohol en diferentes proporciones como se observa en la tabla, dependiendo del grado de absorción y en función de la humedad. Los mililitros del filtrado obtenidos varían de acuerdo a las características de cada planta. 5.2.2 Datos correspondientes a la obtención de extractos alcohólicos de las plantas con bioactividad antifungal positiva (Segunda recolección) 132 Obtención de los extractos alcohólicos Nombre de la planta Aliso Chul chul Huahual Marar Pena pena Quilluyugyug Quinua Yanamote Zarcillo sacha 5.2.3 Peso de planta seca (g) Volumen total de Volumen total de alcohol añadidos (ml) alcohol obtenido en B. Pág. 99 (ml) Hojas Flor Fruto Hojas Flor Fruto Hojas Flor Fruto 50 50 150 175 130 150 50 50 250 250 200 232 50 200 157 50 50 200 300 165 210 50 50 150 210 130 160 50 175 115 50 150 115 50 ● 200 ● 185 ● 50 50 225 250 171 194 - Datos correspondientes a la obtención de extractos alcohólicos de las plantas con bioactividad antifungal positiva (Tercera recolección) Obtención de los extractos alcohólicos Nombre de la planta Aliso Chul chul Huahual Marar Pena pena Quilluyugyug Quinua Yanamote Zarcillo sacha Peso de planta seca (g) Volumen total de Volumen total de alcohol añadidos (ml) alcohol obtenido en B. Pág. 99. (ml) Hojas Flor Fruto Hojas Flor Fruto Hojas Flor Fruto 50 50 150 175 130 150 50 50 250 250 200 230 50 200 155 50 50 200 300 160 210 50 50 150 210 130 160 50 175 115 50 150 115 50 ● 200 ● 180 ● 50 50 225 250 170 190 - (●) Parte de la planta que dio resultados negativos, por lo que no se le toma en cuenta para la comprobación. (-) Flores y frutos de las plantas que no fue posible la recolección y con las cuales NO se cuenta para los ensayos. 5.3. EVAPORACIÓN DE LOS EXTRACTOS ALCOHÓLICOS 5.3.1 Datos correspondientes a la evaporación de extractos alcohólicos de las 30 plantas ensayadas (Primera recolección) Hojas Flor Fruto 133 de Tiempo Total evaporación (h) extracto Peso del evaporado (g) Volumen de extracto a evaporar (ml) de Tiempo Total evaporación (h) extracto Peso del evaporado (g) Volumen de extracto a evaporar (ml) de Tiempo Total evaporación (h) extracto Peso del evaporado (g) la planta Volumen de extracto a evaporar (ml) Nombre de 25 1.65 110 25 0.53 110 Aguachento 25 0.28 16 25 0.9 24 Aliso 25 0.4 72 Canelo 25 0.25 155 25 0.72 155 Centropogon 25 0.54 155 25 0.61 155 Chilca negra 25 0.60 28 25 1.29 48 Chul chul 25 0.68 155 25 0.64 155 Chuquirahua 25 0.30 155 25 0.40 155 Dumbrir 25 0.28 155 25 0.72 155 Floripondio 25 0.39 115 25 0.25 132 Gañal 25 0.36 96 Gynoxys 25 0.97 15 Huahual 25 1.11 102 25 1.33 132 Joyapa 25 0.26 48 Laurel de cera 25 0.44 24 25 0.6 18 Marar 25 0.45 72 25 0.35 78 Mote casha 25 0.28 24 Pacarcar 25 0.26 72 25 0.82 72 Pena pena 25 0.25 48 25 0.86 91 Pururug 25 0.66 48 Quilluyugyug 25 0.38 17 Quinua 25 0.5 48 25 1.45 123 Rañas 25 0.46 48 25 0.45 96 Salvia real 25 1.4 154 25 0.26 155 Sarar 25 0.32 155 25 0.21 155 Shiñan 25 0.38 178 Suro 25 0.58 132 25 0.52 155 Tililin 25 1.07 155 25 0.32 132 Trinitaria 25 0.83 72 25 0.68 70 Yanamote 25 0.55 72 25 0.42 22 Zarcillo sacha En la evaporación de los extractos se observa que Aguachento (hojas), Rañas (flor) y Aliso (fruto) son las muestras de las cuales se ha obtenido mayor residuo seco. En relación con Pururug (Hojas), Shiñan (Flor) y Mote casha (Fruto) de las que se obtuvo pocos gramos de extracto seco. 5.3.2 Datos correspondientes a la evaporación de los extractos de las plantas con bioactividad antifungal positiva (Segunda recolección). Hojas Flor Fruto 134 Peso del evaporado (g) Tiempo Total evaporación (h) de Volumen de extracto a evaporar (ml) extracto Tiempo Total evaporación (h) de Peso del evaporado (g) 0.28 0.58 0.97 0.46 0.26 0.66 0.38 0.83 0.54 16 28 15 24 72 48 17 72 72 25 25 25 25 1.29 0.6 0.82 0.42 48 18 72 22 25 ● - 0.91 ● - 24 ● - Datos correspondientes a la evaporación de extractos alcohólicos de las plantas con bioactividad antifungal positiva (Tercera recolección). Volumen de extracto a evaporar (ml) Peso del evaporado (g) Tiempo Total evaporación (h) de Tiempo Total evaporación (h) 0.28 0.58 0.97 0.46 0.26 0.66 0.38 0.83 0.54 16 28 15 24 72 48 17 72 72 25 25 25 25 1.29 0.6 0.82 0.42 48 18 72 22 25 ● - 0.91 ● - 24 ● - extracto Peso del evaporado (g) de Volumen de extracto a evaporar (ml) 25 25 25 25 25 25 25 25 25 extracto Tiempo Total evaporación (h) Aliso Chul chul Huahual Marar Pena pena Quilluyugyug Quinua Yanamote Zarcillo sacha Peso del evaporado (g) la planta Fruto Volumen de extracto a evaporar (ml) Nombre de Flor de Hojas 5.3.4 extracto Volumen de extracto a evaporar (ml) de extracto 25 25 25 25 25 25 25 25 25 extracto 5.3.3 Tiempo Total evaporación (h) Aliso Chul chul Huahual Marar Pena pena Quilluyugyug Quinua Yanamote Zarcillo sacha Peso del evaporado (g) la planta Volumen de extracto a evaporar (ml) Nombre de Datos de los residuos secos obtenidos de evaporar extractos alcohólicos. 135 Nombre de la planta Aguachento Aliso Canelo Centropogon Chilca negra Chul chul Chuquirahua Dumbrir Floripondio Gañal Gynoxys Huahual Joyapa Laurel de cera Marar Mote casha Pacarcar Pena pena Pururug Quilluyugyug Quinua Rañas Salvia real Sarar Shiñan Suro Tililin Trinitaria Yanamote Zarcillo sacha Volumen (ml) de extracto alcohólico obtenido en 5.2.1. Pág. 146. Peso del residuo seco Porcentaje P/V de los obtenido de la extractos evaporación de los alcohólicos(g/100ml) extractos (g) Hojas 140 130 112 282 225 200 184 112 180 112 112 157 120 112 165 112 112 130 112 113 115 112 230 100 97 270 98 150 185 171 Hojas 9.24 1.45 1.79 2.82 4.86 4.80 5.0 1.34 2 1.74 1.61 6.0 5.32 1.16 2.9 2.0 1.25 1.35 1.12 2.98 1.74 2.24 4.23 5.6 1.24 4.1 2.27 6.42 6.24 3.76 Flor 160 246 230 232 230 164 145 213 112 210 160 150 226 160 188 130 160 194 Fruto 150 100 175 250 - Flor 3.39 7.08 5.61 11.9 5.88 2.62 4.17 2.13 5.95 5.04 5.24 8.7 4.06 1.66 1.57 2.7 2.04 3.25 Fruto 5.4 1.4 6.2 6.8 - Hojas 6.6 1.0 1.5 1.0 2.1 2.4 2.7 1.2 1.1 1.5 1.4 3.8 4.4 1.0 1.7 1.7 1.1 1.0 1.0 2.6 1.51 2.0 1.8 5.6 1.3 1.5 2.0 4.3 3.3 2.1 Flor 2.1 2.8 2.4 5.1 2.5 1.6 2.9 1 5.3 2.4 3.3 5.8 1.8 1.0 0.8 2.0 1.2 1.6 Fruto 3.6 1.4 3.4 2.7 - Los gramos de residuo seco que se obtienen por evaporación de los extractos alcohólicos son diferentes para cada planta y aún para cada parte de la misma planta, como se observa en la tabla 5.3.4; se puede decir que depende de las características propias de cada una de ellas. Para la comprobación (segunda y tercera recolección) se procede en las mismas condiciones obteniéndose las mismas concentraciones. 5.4. PESO Y RESUSPENSIÓN DE LOS EXTRACTOS ALCOHÓLICOS 5.4.1 Datos correspondientes al peso y resuspensión del residuo seco de las 30 plantas ensayadas (Primera recolección). 136 Nombre de la Extracto seco pesado planta (g) Hojas Flor Fruto Aguachento Aliso Canelo Centropogon Chilca negra Chul chul Chuquirahua Dumbrir Floripondio Gañal Gynoxys Huahual Joyaza Laurel de cera Marar Mote casha Pacarcar Pena Pena Pururug Quilluyugyug Quinua Rañas Salvia real Sarar Shiñan Suro Tililin Trinitaria Yanamote Zarcillo sacha 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 - % P/V (mg / 100µl) Hojas Flor Fruto 100 100 100 66 100 100 100 50 66 50 50 50 40 66 50 66 66 100 66 66 50 100 50 66 100 100 100 66 100 50 66 100 100 100 66 66 100 100 100 50 100 100 100 100 50 100 100 100 100 100 100 - En el punto 5.4 se nota que los extractos secos tienen diferente concentración, la misma que varia entre 50 y 100%, esto se debe a las consistencia de los extractos ya que para solubilizar los mismos se recurrió a volúmenes de 200 y 400ul de DMSO al 10% en agua, en las plantas con bioactividad positiva para la comprobación (segunda y tercera recolección) se repiten con la misma concentración. 5.4.2 Datos correspondientes al peso y resuspensión del residuo seco de las plantas con bioactividad antifungal positiva (Segunda recolección). Nombre de la Extracto seco pesado planta (g) % P/V (mg / 100µl) 137 Aliso Chul chul Huahual Marar Pena Pena Quilluyugyug Quinua Yanamote Zarcillo sacha Hojas Flor Fruto Hojas Flor Fruto 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 ● - 100 100 50 50 100 66 50 100 50 100 50 100 ● 100 100 ● - ● Parte de la planta que dio resultados negativos por lo que no se le toma en cuenta para la comprobación 5.4.3 Datos correspondientes al peso y resuspensión del residuo seco de las plantas con bioactividad antifungal positiva (Tercera recolección) Nombre de la Extracto seco pesado planta (g) Hojas Flor Fruto Aliso Chul chul Huahual Marar Pena Pena Quilluyugyug Quinua Yanamote Zarcillo sacha 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 ● - % P/V (mg / 100µl) Hojas Flor Fruto 100 100 50 50 100 66 50 100 50 100 50 100 ● 100 100 ● - (-) Flores y frutos de las plantas que no fue posible la recolección y con las cuales NO se cuenta para los ensayos. (●) Parte de la planta que dio resultados negativos, por lo que no se le toma en cuenta para la comprobación. 138 5.5. BIOACTIVIDAD Características de las cepas y cultivos usados en el ensayo de bioactividad (ver Anexo # 1). Cepa Biomasa Ck Rg Ca Sc Ck Rg Ca Sc Ck Rg Ca Sc Densidad Óptica del cultivo madre 1.190 1.035 0.248 0.185 1.408 1.312 0.100 0.063 1.283 1.089 0.213 0.136 Observación al microscopio COC COC Escasas Escasas COC COC Escasas Escasas COC COC Escasas Escasas Observaciones Hacer cultivo exponencial Hacer cultivo exponencial Reincubar Reincubar Hacer cultivo exponencial Hacer cultivo exponencial Reincubar Reincubar Hacer cultivo exponencial Hacer cultivo exponencial Reincubar Reincubar Densidad Óptica del cultivo exponencial 0.451 0.445 0.900 0.472 0.989 0.878 0.407 0.489 0.614 0.549 0.628 0.453 # de recolección Primera recolección Segunda recolección Tercera recolección Verificar siempre los cultivos al microscopio. Cuando se ha alcanzado la densidad óptica entre 0.5 y 0.9 se siembran 100 µl. COC = cultivo en óptimas condiciones. Ck = Candida krusei Rg = Rhodotorula glutinis Ca = Candida albicans Sc = Saccharomyces cerevisiae 139 Fórmula para calcular el porcentaje de inhibición relativa (PIR) X del Ф del halo de inhibición de la muestra x 100 PIR = X del Ф del halo de inhibición del control Donde: PIR = Porcentaje de inhibición relativa. X = Media aritmética. Ф = Diámetro del halo de inhibición. Análisis de proporciones De los resultados obtenidos se ha realizado el método de Análisis de proporciones, en el cual, se calcula diferentes parámetros, se emplean las siguientes fórmulas: Ls = p + Z /2 * es(p) Li = p - Z /2 * es(p) Ls: límite superior Li: límite inferior p: probabilidad de que ocurra (casos + o -) Z: para 95% de confianza = 1,96 Z α/2 = 1.96 es(p): error del estimador es(p) = raíz (p*q/n) *raíz [(N-n)/(N-1)] Donde: q = probabilidad de que no ocurra N = total de casos 140 n = total de casos + o – según el caso Si p esta dentro de los límites superior e inferior entonces si es un valor representativo y debe ser tomado en cuenta. n p = N q =1-p En el caso de que los casos (n) sean = N (la muestra) el error es = 0 y basta con hacer: (14 y 20). L= p +/- Z /2 5.5.1 BIOACTIVIDAD ANTIFUNGAL frente a Candida krusei. Ver Anexo #1 LEVADURA Control de NISTATINA Ф mm Control de DISCO Ф mm Control de DMSO٭ Ф mm Candida krusei % Inhibición 21 100 0 0 0 0 ٭DMSO = Dimetilsulfóxido al 10% en agua. 141 a. NOMBRE de la planta Aliso RESULTADOS DE LAS PLANTAS CON BIOACTIVIDAD ANTIFUNGAL POSITIVA FRENTE A Candida krusei. PRIMERA RECOLECCIÓN Parte de la Primero Duplicado planta PIR X Ф Car. Ф Car. mm del mm del halo halo Ф mm Hojas 10 Bhd 11 Bhd 10.5 50.0000 Fruto 20 Bhd 20 Bhd 20.0 95.2380 Hojas Flor Hojas Huahual Hojas Marar Flor Hojas Pena Pena Flor Quilluyugyug Hojas Hojas Quinua Hojas Yanamote Zarcillo sacha Hojas Flor Chul chul 0 9 18 10 12 15 20 20 12 15 0 20 Bhd Bhd Bhd Hd Bhd Bhd Bhd Bhd Hd Bhd 0 8 18 10 12 20 15 20 13 15 0 20 TERCERA RECOLECCIÓN Primero Primero Duplicado Ф Car. Ф Car. mm del mm del halo halo X Ф PIR mm Duplicado XФ mm PIR Ф Car. Ф Car. mm del mm del halo halo X Ф X mm PIR total 12 20 Bhd Bhd 12 20 Bhd Bhd 12.0 57.1428 10 20.0 95.2380 19 Bhd Bhd 10 20 Bhd Bhd 10.0 47.6190 10.8 51.5873 19.5 92.8571 19.8 94.4444 Bhd Bhd Bhd Hd Bhd Bhd Bhd Bhd Hd 8.5 18.0 10.0 12.0 17.5 17.5 20.0 12.5 15.0 13 20 12 11 20 20 20 15 15 Bhd Bhd Bhd Hd Bhd Bhd Bhd Bhd Hd 13 20 12 12 20 20 20 15 15 Bhd Bhd Bhd Hd Bhd Bhd Bhd Bhd Hd 13.0 20.0 12.0 11.5 20.0 20.0 20.0 15.0 15.0 13 20 12 12 20 20 20 12 15 Bhd Bhd Bhd Hd Bhd Bhd Bhd Bhd Hd 12 20 10 12 20 20 20 12 15 Bhd Bhd Bhd Hd Bhd Bhd Bhd Bhd Hd 12.5 20.0 11.0 12.0 20.0 20.0 20.0 12.0 15 59.5238 95.2380 52.3809 57.1428 95.2380 95.2380 95.2380 57.1428 71.4285 Bhd 20.0 95.2380 20 Bhd 20 Bhd 20.0 95.2380 20 Bhd 20 Bhd 20 95.2380 20.0 95.2380 Bhd = Borde del halo difuso Hd = Halo difuso Car. Del halo = Características del halo mm = milímetros 40.4761 85.7142 47.6190 57.1428 83.3333 83.3333 95.2380 59.5238 71.4285 SEGUNDA RECOLECCIÓN 61.9047 95.2380 57.1428 54.7619 95.2380 95.2380 95.2380 71.4285 71.4285 11.3 19.3 11.0 11.8 19.1 19.1 20.0 13.1 15.0 53.9682 92.0634 52.3809 56.3492 91.2698 91.2698 95.2380 62.6984 71.4285 PIR = Porcentaje de inhibición relativa. Ф = Diámetro del halo X = Media Aritmética En el cuadro de bioactividad frente a C. krusei se observa que las plantas tienen halos entre 10.8cm y 20cm de diámetro; la Pena pena tiene bioactividad (Hojas y flores), Aliso (hojas y fruto). De las plantas Chul chul (hojas) y Zarcillo sacha (hojas) no demuestran bioactividad. 142 b. Análisis de proporciones Bioactividad frente Candida krusei Análisis a de n proporciones N p q es(p) Ls Li Esta dentro de los límites Nombre de la planta 2 (20) 2 3 0.66 0.34 0.23 1 (19.5) 1 3 0.33 0.67 0.47 1 (10.5) 1 3 0.33 0.66 0.26 1 (12) 1 3 0.33 0.66 0.26 Aliso (Hojas) 1 (10) 1 3 0.33 0.66 0.26 1 (8.5) 1 3 0.33 0.66 0.26 1 (13) 1 3 0.33 0.66 0.26 Chul Chul (Flor) 1 (12.5) 1 3 0.33 0.66 0.26 1 (18) 1 3 0.33 0.67 0.47 Huahual (Hojas) 2 (20) 2 3 0.66 0.34 0.23 2 (12) 2 3 0.66 0.34 0.23 Marar (Flor) 1 (11.5) 1 3 0.33 0.67 0.47 1 (10) 1 3 0.33 0.66 0.26 1 (12) 1 3 0.33 0.66 0.26 Marar (Hojas) 1 (11) 1 3 0.33 0.66 0.26 1 (17.5) 1 3 0.33 0.67 0.47 Pena Pena (Flor) 2 (20) 2 3 0.66 0.34 0.23 1 (17.5) 1 3 0.33 0.67 0.47 Pena Pena (hojas) 2 (20) 2 3 0.66 0.34 0.23 3 (20) 3 3 1 0 0 Quilluyugyug (Hojas) 1 (12.5) 1 3 0.33 0.66 0.26 1 (15) 1 3 0.33 0.66 0.26 Quinua (Hojas) 1 (12) 1 3 0.33 0.66 0.26 3 (15) 3 3 1 0 0 Yanamote (Hojas) 3 (20) 3 3 1 0 0 Zarcillo sacha (Flor) Significado de la nomenclatura utilizada revisar las páginas: 154-155. Aliso (Fruto) 5.5.2 -0.20 -0.59 -0.98 -0.98 -0.98 -0.98 -0.98 -0.98 -0.59 -0.20 -0.20 -0.59 -0.98 -0.98 -0.98 -0.59 -0.20 -0.59 -0.20 -0.96 -0.98 -0.98 -0.98 -0.96 -0.96 si si si Si si si si si si si si si si si si si si si si si si si si si si BIOACTIVIDAD ANTIFUNGAL frente a Rhodotorula glutinis. Ver Anexo #1. LEVADURA Control de NISTATINA Ф mm Control de DISCO Ф mm Control de DMSO٭ Ф mm ٭ 1.12 1.25 0.85 0.85 0.85 0.85 0.85 0.85 1.25 1.12 1.12 1.25 0.85 0.85 0.85 1.25 1.12 1.25 1.12 2.96 0.85 0.85 0.85 2.96 2.96 DMSO = Rhodotorula glutinis % Inhibición 22 100 0 0 0 0 Dimetilsulfóxido al 10% en agua. 143 a. RESULTADOS DE LAS PLANTAS CON BIOACTIVIDAD ANTIFUNGAL POSITIVA FRENTE A Rhodotorula glutinis NOMBRE de la planta Parte PRIMERA RECOLECCIÓN de la planta Primero Duplicado SEGUNDA RECOLECCIÓN TERCERA RECOLECCIÓN Primero Primero Duplicado PIR Ф Car. Ф Car. mm del mm del halo halo X Ф Car. Ф Car. mm del mm del halo halo X Ф PIR mm Duplicado Ф Car. Ф Car. mm del mm del halo halo X Ф PIR mm X Ф X mm PIR total Hojas Fruto 15 0 Bhd 10 0 Bhd Ф mm 12.5 56.8181 12 Hojas Flor Hojas Huahual Hojas Pena Pena Flor Quilluyugyug Hojas Hojas Quinua Hojas Yanamote Zarcillo sacha Hojas Flor 10 0 20 20 18 17 11 9 0 15 Bhd 10 0 18 18 20 20 12 9 0 15 Bhd 10 45.4545 12 Bhd 12 Bhd 12 54.5454 10 Bhd 10 Bhd 10 45.4545 10.6 48.4848 Bhd Bhd Bhd Bhd Bhd Bhd 19 19 19 18.5 11.5 9 86.3636 86.3636 86.3636 84.0909 52.2727 40.9090 20 20 18 20 11 9 Bhd Bhd Bhd Bhd Bhd Bhd 20 20 19 20 11 9 Bhd Bhd Bhd Bhd Bhd Bhd 20 20 18.5 20 11 9 90.9090 90.9090 84.0909 90.9090 50.0000 40.9090 20 20 20 20 10 9 Bhd Bhd Bhd Bhd Bhd Bhd 20 20 20 20 10 9 Bhd Bhd Bhd Bhd Bhd Bhd 20 20 20 20 10 9 90.9090 90.9090 90.9090 90.9090 45.4545 40.9090 Bhd 15 68.1818 12 Bhd 12 Bhd 12 54.5454 15 Bhd 15 Bhd 15 68.1818 14.0 63.6363 Aliso Chul chul Bhd Bhd Bhd Bhd Bhd Bhd Bhd Bhd = Borde del halo difuso Hd = Halo difuso Car. Del halo = Características del halo mm = milímetros Bhd 12 Bhd 12 54.5454 15 Bhd 15 Bhd 15 68.1818 13.1 59.8484 19.6 19.6 19.1 19.5 10.8 9.0 89.3939 89.3939 87.1212 88.6363 49.2424 40.9090 PIR = Porcentaje de inhibición relativa Ф = Diámetro del halo X = Media Aritmética En la tabla a. de R. glutinis se analiza que las plantas tienen una bioactividad máxima de 19.6 (Hua hual, Pena pena) y una mínima de 9 mm (Yanamote) de diámetro. Y se observa que el Aliso (fruto), Chul chul (flor) y Zarcillo sacha (hojas) no presentan bioactividad. 144 b. Análisis de proporciones Bioactividad frente Rhodotorula glutinis Análisis a de n proporciones N p 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 0.33 0.33 0.33 0.66 0.33 0.66 0.33 0.33 0.33 0.33 0.33 0.66 0.33 0.66 0.33 0.33 0.33 1 0.66 0.33 q es(p) Ls Li 0.85 0.85 0.85 1.12 1.25 1.12 1.25 0.85 0.85 0.85 1.25 1.12 1.25 1.12 0.85 0.85 0.85 2.96 1.12 1.25 -0.98 -0.98 -0.98 -0.20 -0.59 -0.20 -0.59 -0.98 -0.98 -0.98 -0.59 -0.20 -0.59 -0.20 -0.98 -0.98 -0.98 -0.96 -0.20 -0.59 Esta dentro de los límites Nombre de la planta Aliso (Hojas) Chul Chul (Flor) Huahual (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) 1 (12.5) 1 (12) 1 (15) 2 (10) 1 (12) 2 (20) 1 (19) 1 (19) 1 (18.5) 1 (20) 1 (19) 2 (20) 1 (18.5) 2 (20) 1 (11.5) 1 (11) 1 (10) 3 (9) 2 (15) 1 (12) 1 1 1 2 1 2 1 1 1 1 1 2 1 2 1 1 1 3 2 1 0.66 0.66 0.66 0.34 0.67 0.34 0.67 0.66 0.66 0.66 0.67 0.34 0.67 0.34 0.66 0.66 0.66 0 0.34 0.67 0.26 0.26 0.26 0.23 0.47 0.23 0.47 0.26 0.26 0.26 0.47 0.23 0.47 0.23 0.26 0.26 0.26 0 0.23 0.47 si Si si si si si si si si si si si si si si si si si si si Significado de la nomenclatura utilizada revisar las páginas: 154-155. 5.5.3 BIOACTIVIDAD ANTIFUNGAL frente a Candida albicans. Ver Anexo #1. LEVADURA Candida albicans % Inhibición Control de NISTATINA Ф mm 21.8 100 Control de DISCO Ф mm 0 0 Control de DMSO ٭Ф mm 0 0 ٭DMSO = Dimetilsulfóxido al 10% en agua. 145 a. RESULTADOS DE LAS PLANTAS CON BIOACTIVIDAD ANTIFUNGAL POSITIVA FRENTE A Candida albicans. NOMBRE de la planta Parte PRIMERA RECOLECCIÓN de la planta Primero Duplicado SEGUNDA RECOLECCIÓN TERCERA RECOLECCIÓN Primero Primero Duplicado PIR Ф Car. Ф Car. mm del mm del halo halo Pena Pena Quilluyugyug Hojas Flor Hojas 11 15 12 Bhd Bhd Bhd 11 15 12 Bhd Bhd Bhd Bhd = Borde del halo difuso Hd = Halo difuso Car. Del halo = Características del halo mm = milímetros X Ф Car. Ф Car. mm del mm del halo halo Ф mm 11 50.0000 11 15 68.1818 15 12 54.5454 13 Bhd Bhd Bhd 11 14 13 Bhd Bhd Bhd X Ф PIR mm Duplicado XФ mm PIR X Ф mm X total PIR Ф Car. Ф Car. mm del mm del halo halo 11 50.0000 12 14.5 65.9090 15 13 59.0909 13 Bhd Bhd Bhd 12 15 12 Bhd Bhd Bhd 12 54.5454 11.3 51.5151 15 68.1818 14.8 67.4242 12.5 56.8181 12.5 56.8181 PIR = Porcentaje de inhibición relativa. Ф = Diámetro del halo X = Media Aritmética Para C. albicans como se demuestra en la tabla solo dos plantas poseen bioactividad y los halos son pequeños en comparación a los halos que dan las mismas plantas con las otras cepas de levaduras. 146 b. Análisis de proporciones. Bioactividad frente Candida albicans Análisis a de n proporciones N p q es(p) Ls Li 3 3 3 3 3 3 3 0.66 0.33 0.66 0.33 0.33 0.33 0.33 0.34 0.67 0.34 0.67 0.66 0.66 0.66 0.23 0.47 0.23 0.47 0.26 0.26 0.26 -0.20 -0.59 -0.20 -0.59 -0.98 -0.98 -0.98 Esta dentro de los límites Nombre de la planta Pena pena (Flor) Pena pena (hojas) Quilluyugyug (Hojas) 2 (15) 1 (14.5) 2 (11) 1 (10.5) 1 (12) 1 (13) 1 (12.5) 2 1 2 1 1 1 1 1.12 1.25 1.12 1.25 0.85 0.85 0.85 si si si si si si si Significado de la nomenclatura utilizada revisar las páginas: 154-155. 5.5.4 BIOACTIVIDAD ANTIFUNGAL frente a Anexo # 1. Saccharomyces cerevisiae. Ver LEVADURA Saccharomyces cerevisiae % Inhibición Control de NISTATINA Ф mm 22 100 Control de DISCO Ф mm 0 0 Control de DMSO ٭Ф mm 0 0 ٭DMSO = Dimetilsulfóxido AL 10% en agua. 146 a. RESULTADOS DE LAS PLANTAS CON BIOACTIVIDAD ANTIFUNGAL POSITIVA FRENTE A Saccharomyces cerevisiae. NOMBRE de la planta Parte PRIMERA RECOLECCIÓN de la planta Primero Duplicado SEGUNDA RECOLECCIÓN TERCERA RECOLECCIÓN Primero Primero Duplicado PIR Ф Car. Ф Car. mm Del mm Del halo halo Pena Pena Quilluyugyug Hojas Flor Hojas 10 10 14 Bhd Bhd Bhd 9 10 13 Bhd Bhd Bhd Bhd = Borde del halo difuso . Hd = Halo difuso. Car. Del halo = Características del halo. X Ф Car. Ф Car. mm Del mm Del halo halo Ф mm 9.5 43.5779 9 10 45.8715 12 13.5 61.9266 14 Bhd Bhd Bhd 10 10 14 Bhd Bhd Bhd X Ф PIR mm 9.5 11 14 Duplicado X Ф PIR Ф Car. Ф Car. mm mm Del mm Del halo halo 43.5779 10 50.4587 15 64.2201 13 Bhd Bhd Bhd 10 15 13 Bhd Bhd Bhd 10 15 13 X Ф X mm PIR total 45.8715 9.6 44.3425 68.8073 12.0 55.0458 59.6330 13.5 61.9266 PIR = Porcentaje de inhibición relativa. Ф = Diámetro del halo. X = Media Aritmética. Para S. cerevisiae tres extractos tienen bioactividad positiva, Quilluyugyug (hojas) tiene el porcentaje más alto, seguido por el arbusto de Pena pena cuyas flores tienen mayor bioactividad que las hojas del mismo. 148 b. Análisis de proporciones Bioactividad frente a Saccharomyces cerevisiae. Análisis de n proporciones N p q es(p) Ls Li 3 3 3 3 3 3 3 3 0.66 0.33 0.33 0.33 0.33 0.33 0.33 0.33 0.34 0.67 0.66 0.66 0.66 0.66 0.66 0.66 0.23 0.47 0.26 0.26 0.26 0.26 0.26 0.26 -0.20 -0.59 -0.98 -0.98 -0.98 -0.98 -0.98 -0.98 Esta dentro de los límites Nombre de la planta Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) 2 (9.5) 1 (10) 1 (10) 1 (11) 1 (15) 1 (13.5) 1 (14) 1 (13) 2 1 1 1 1 1 1 1 1.12 1.25 0.85 0.85 0.85 0.85 0.85 0.85 si si si si si si si si Significado de la nomenclatura utilizada en esta tabla, revisar las páginas: 154-155. 5.6 RESULTADOS DEL ANÁLISIS FITOQUÍMICO DE LOS EXTRACTOS ALCOHÓLICOS DE LAS PLANTAS CON BIOACTIVIDAD ANTIFUNGAL POSITIVA. 5.6.1 DETERMINACIÓN DE ALCALOIDES Nombre de la planta Ensayo Dragendorff de Ensayo de Mayer Ensayo Wagner de 149 Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) Ensayo de: DRAGENDORFF Nombre de la planta 1º +++ +++ - 2º +++ +++ - Análisis de propor- n ciones 3º +++ +++ - N 1º - p 2º - q 3(-) 3 3 1 Aliso (Fruto) 3(-) 3 3 1 Aliso (Hojas) 3(-) 3 3 1 Chul Chul (Flor) 3(-) 3 3 1 Chul Chul (Hojas) 3(+++) 3 3 1 Huahual (Hojas) 3(-) 3 3 1 Marar (Flor) 3(-) 3 3 1 Marar (Hojas) 3(-) 3 3 1 Pena Pena (Flor) 3(-) 3 3 1 Pena Pena (hojas) 3(-) 3 3 1 Quilluyugyug (Hojas) 3(-) 3 3 1 Quinua (Hojas) 3(+++) 3 3 1 Yanamote (Hojas) 3(-) 3 3 1 Zarcillo sacha (Flor) 3(-) 3 3 1 Zarcillo sacha (Hojas) Significado de la nomenclatura utilizada revisar las páginas: 154-155. Nombre de la planta Análisis de propor- n ciones Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) Ensayo de: MAYER 3 3 3 3 3 3 3 3 3 3 3 N p 3 3 3 3 3 3 3 3 3 3 3 1 1 1 1 1 1 1 1 1 1 1 q 3º - 1º +++ +++ - 2º +++ +++ - es(p) Ls Li 0 0 0 0 0 0 0 0 0 0 0 0 0 0 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 es(p) Ls Li 0 0 0 0 0 0 0 0 0 0 0 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 3º +++ +++ - Esta dentro de los límites si si si si si si si si si si si si si si Esta dentro de los límites si si si si si si si si si si si - 150 - Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) 3(-) 3(-) 3(-) 3 3 3 Ensayo de: WAGNER Nombre de la planta Análisis de propor- n ciones Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) 3(-) 3(-) 3(-) 3(-) 3(+++) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(+++) 3(-) 3(-) 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 1 1 1 N p 3 3 3 3 3 3 3 3 3 3 3 3 3 3 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 0 0 q 2.96 -0.96 2.96 -0.96 2.96 -0.96 es(p) Ls Li 0 0 0 0 0 0 0 0 0 0 0 0 0 0 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 si si si Esta dentro de los límites si si si si si si si si si si si si si si Significado de la nomenclatura utilizada revisar las páginas: 154-155. Pruebas confirmatorias para alcaloides Nombre de Reactivo la planta Tanino Huahual (Hojas) Yanamote (Hojas) 1º ++ 2º ++ 3º ++ 1º +++ 2º +++ 3º +++ R. ácido fosfowolfrámico 1º 2º 3º ++ ++ ++ + + + ++ ++ ++ ++ Reacciones Planta Tanino Huahual (Hojas) de R. ácido Pícrico Análisis de proporciones 3(++) n N p 3 3 1 ++ ++ q R. ácido fosfomolíbdico 1º +++ 2º +++ 3º +++ Reactivo de Marmé 1º 2º 3º + + + ++ ++ ++ + es(p) Ls Li 0 2.96 -0.96 + + Esta dentro de los límites Si - 151 - Ácido pícrico Ácido Fosfowolfrámico Ácido Fosfomolibdico Reactivo de Marmé Yanamote (Hojas) Huahual (Hojas) Yanamote (Hojas) Huahual (Hojas) Yanamote (Hojas) Huahual (Hojas) Yanamote (Hojas) Huahual (Hojas) Yanamote (Hojas) 3(+) 3 3 1 0 2.96 -0.96 Si 3(+++) 3 3 1 0 2.96 -0.96 Si 3(++) 3 3 1 0 2.96 -0.96 Si 3(++) 3 3 1 0 2.96 -0.96 Si 3(++) 3 3 1 0 2.96 -0.96 Si 3(+++) 3 3 1 0 2.96 -0.96 Si 3(++) 3 3 1 0 2.96 -0.96 Si 3(+) 3 3 1 0 2.96 -0.96 Si 3(+) 3 3 1 0 2.96 -0.96 Si Significado de la nomenclatura utilizada revisar las páginas: 154-155. 5.6.2 DETERMINACIÓN DE FENOLES Y TANINOS Nombre de la planta Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) Ensayo Férrico 1º + +++ ++ ++ ++ + + + + + + + ++ : 2º + +++ ++ ++ ++ + + + + + + + ++ Cloruro 3º + +++ ++ ++ + + + + + + + + ++ - 152 - Ensayo de: CLORURO FÉRRICO Nombre de la planta Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) Análisis de proporciones 3(+) 3(+++) 3(++) 3(++) 2(++) 1(+) 3(+) 3(+) 3(+) 3(+) 3(+) 3(+) 3(-) 3(+) 3(++) n N p q es(p) Ls 3 3 3 3 2 1 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 1 1 1 1 0.66 0.33 1 1 1 1 1 1 1 1 1 0 0 0 0 0.33 0.23 0.67 0.46 0 0 0 0 0 0 0 0 0 2.96 2.96 2.96 2.96 1.11 1.24 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 Li -0.96 -0.96 -0.96 -0.96 0.20 -0.58 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 Esta dentro de los límites si si si si si si si si si si si si si si si Significado de la nomenclatura utilizada revisar las páginas: 154-155. 5.6.3 DETERMINACIÓN DE FLAVONOIDES Ensayo : Shinoda Nombre de la planta 1º + + + ++ ++ - Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) Ensayo de: SHINODA Nombre de la planta Análisis de propor- n ciones N p 2º + + + ++ ++ - q 3º + + + ++ ++ - es(p) Ls Li Esta dentro de los límites - 153 - Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) 3(+) 3(-) 3(+) 3(-) 3(-) 3(+) 3(-) 3(++) 3(-) 3(-) 3(-) 3(-) 3(++) 3(-) 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 si si si si si si si si si si si si si si Significado de la nomenclatura utilizada revisar las páginas: 154-155. 5.6.4 DETERMINACIÓN DE ANTOCIANIDINAS Ensayo Antocianidina 1º 2º + + + + + + + + + + + + - Nombre de la planta Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) Ensayo de: ANTOCIANIDINA Nombre de la planta Análisis de propor- n ciones N p q : 3º + + + + + + - es(p) Ls Li Esta dentro de los límites - 154 - Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) 3(+) 3(-) 3(+) 3(-) 3(-) 3(+) 3(-) 3(+) 3(-) 3(-) 3(+) 3(-) 3(+) 3(-) 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 si si si si si si si si si si si si si si Significado de la nomenclatura utilizada revisar las páginas: 154-155. 5.6.5 DETERMINACIÓN DE AZÚCARES REDUCTORES Ensayo : Fehling Nombre de la planta 1º + + ++ + + + +++ ++ ++ + ++ + + + Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) Ensayo de: FEHLING Nombre de la planta Análisis de propor- n ciones N p 2º + ++ ++ + + + +++ ++ ++ + ++ + + + q 3º + ++ ++ + + + +++ ++ ++ + ++ + + + es(p) Ls Li Esta dentro de los límites - 155 - Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) 3(+) 1(+) 2(++) 3(++) 3(+) 3(+) 3(+) 3(+++) 3(++) 3(++) 3(+) 3(++) 3(+) 3(+) 3(+) 3 1 2 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 1 0.33 0.66 1 1 1 1 1 1 1 1 1 1 1 1 0 0.67 0.46 0.34 0.23 0 0 0 0 0 0 0 0 0 0 0 0 2.96 1.24 1.11 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 -0.96 -0.58 0.20 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 si si si si si si si si si si si si si si si Significado de la nomenclatura utilizada en esta tabla revisar las páginas: 154-155. 5.6.6 DETERMINACIÓN DE SAPONINAS Ensayo : Espuma Nombre de la planta 1º + +++ +++ ++ Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) Ensayo de: ESPUMA Nombre de la planta Análisis de propor- n ciones N p 2º + +++ +++ ++ q 3º + +++ +++ ++ es(p) Ls Li Esta dentro de los límites - 156 - Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) 3(-) 3(+) 3(-) 3(-) 3(+++) 3(-) 3(-) 3(-) 3(-) 3(-) 3(+++) 3(-) 3(-) 3(++) 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 si si si si si si si si si si si si si si Significado de la nomenclatura utilizada revisar las páginas: 154-155. 5.6.7 DETERMINACIÓN DE RESINAS Ensayo : Resinas Nombre de la planta 1º +++ +++ + +++ + ++ +++ Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) Ensayo de: RESINAS Nombre de la planta Análisis de propor- n ciones N p 2º +++ +++ + ++ + ++ +++ q 3º ++ +++ + +++ + ++ +++ es(p) Ls Li Esta dentro de los límites - 157 - Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) 2(+++) 1(++) 3(-) 3(-) 3(-) 3(+++) 3(+) 2(+++) 1(++) 3(-) 3(-) 3(-) 3(+) 3(++) 3(-) 3(+++) 2 1 3 3 3 3 3 2 1 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 0.66 0.33 1 1 1 1 1 0.66 0.33 1 1 1 1 1 1 1 0.33 0.23 0.67 0.46 0 0 0 0 0 0.33 0.23 0.67 0.46 0 0 0 0 0 0 0 1.11 1.24 2.96 2.96 2.96 2.96 2.96 1.11 1.24 2.96 2.96 2.96 2.96 2.96 2.96 2.96 0.20 -0.58 -0.96 -0.96 -0.96 -0.96 -0.96 0.20 -0.58 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 si si si si si si si si si si si si si si si si Significado de la nomenclatura utilizada revisar las páginas: 154-155. 5.6.8 DETERMINACIÓN DE TRITERPENOS Y ESTEROIDES Ensayo : Lieberman-Burchard 1º 2º 3º + + + + + + + + + + + + + + + + + + + + + + + + ++ ++ ++ + + + + + + + + + + + Nombre de la planta Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) Ensayo de: LIEBERMANBURCHARD Nombre de la planta Análisis de propor- n ciones N p q es(p) Ls Li Esta dentro de los límites - 158 - Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) 3(+) 3(+) 3(+) 3(+) 3(+) 3(+) 3(+) 3(+) 3(++) 3(+) 3(-) 3(+) 2(+) 1(-) 3(+) 3 3 3 3 3 3 3 3 3 3 3 3 2 1 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 1 1 1 1 1 1 1 1 1 1 1 1 0.66 0.33 1 0 0 0 0 0 0 0 0 0 0 0 0 0.33 0.23 0.67 0.46 0 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 1.11 1.24 2.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 0.20 -0.58 -0.96 si si si si si si si si si si si si si si si Significado de la nomenclatura utilizada revisar las páginas: 154-155. 5.6.9 DETERMINACIÓN DE AMINOÁCIDOS Ensayo : Ninhidrina 1º 2º - Nombre de la planta Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) Ensayo de: NINHIDRINA Análisis de n proporciones N p q 3º - es(p) Ls Li Esta dentro de los límites Nombre de la planta - 159 - Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 si si si si si si si si si si si si si si Significado de la nomenclatura utilizada revisar las páginas: 154-155. 5.6.10 DETERMINACIÓN DE QUINONAS Nombre de la planta Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) Ensayo de: BORNTRÄNGER Análisis de n proporciones Ensayo : Borntränger 1º 2º ++ ++ - 3º ++ - + + ++ + + + + ++ + - N p 3 3 3 3 3 1 1 1 1 1 + + ++ + + q es(p) Ls Li 0 0 0 0 0 -0.96 -0.96 -0.96 -0.96 -0.96 Esta dentro de los límites Nombre de la planta Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) 3(-) 3(-) 3(-) 3(-) 3(++) 3 3 3 3 3 2.96 2.96 2.96 2.96 2.96 si si si si si - 160 - Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) 3(-) 3(-) 3(-) 3(-) 3(+) 3(+) 3(++) 3(+) 2(+) 1(-) 3 3 3 3 3 3 3 3 2 1 3 3 3 3 3 3 3 3 3 3 1 1 1 1 1 1 1 1 0.66 0.33 0 0 0 0 0 0 0 0 0.33 0.23 0.67 0.46 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 1.11 1.24 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 0.20 -0.58 si si si si si si si si si si Significado de la nomenclatura utilizada revisar las páginas: 154-155. 5.6.11 DETERMINACIÓN DE CATEQUINAS Ensayo : Catequinas 1º 2º + + + + + + - Nombre de la planta Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) Nombre de la planta Análisis de propor- n ciones Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) 3(-) 3(-) 3(-) 3(-) 3(+) 3(-) 3(-) 3(-) 3(-) 3(-) CATEQUINAS 3 3 3 3 3 3 3 3 3 3 N p 3 3 3 3 3 3 3 3 3 3 1 1 1 1 1 1 1 1 1 1 q 3º + + + - es(p) Ls Li 0 0 0 0 0 0 0 0 0 0 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 Esta dentro de los límites si si si si si si si si si si - 161 - Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) 3(-) 3(+) 3(+) 3(-) 3 3 3 3 3 3 3 3 1 1 1 1 0 0 0 0 2.96 2.96 2.96 2.96 -0.96 -0.96 -0.96 -0.96 si si si si Significado de la nomenclatura utilizada revisar las páginas: 154-155. 5.6.12 DETERMINACIÓN DE LACTONAS Y COUMARINAS Ensayo : Baljet 1º 2º ++ ++ +++ +++ ++ ++ - Nombre de la planta Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) Nombre de la planta Análisis de propor- n ciones Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) 3(++) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(-) 3(+++) 3(-) 3(-) 3(++) 3(-) Ensayo de: BALJET 3 3 3 3 3 3 3 3 3 3 3 3 3 3 N p 3 3 3 3 3 3 3 3 3 3 3 3 3 3 1 1 1 1 1 1 1 1 1 1 1 1 1 1 q 3º ++ +++ ++ - es(p) Ls Li 0 0 0 0 0 0 0 0 0 0 0 0 0 0 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 Esta dentro de los límites si si si si si si si si si si si si si si - 162 - Significado de la nomenclatura utilizada revisar las páginas: 154-155. 5.6.13 DETERMINACIÓN DE GLICÓSIDOS CARDIOTÓNICOS Ensayo : Kedde 1º 2º + + - Nombre de la planta Aliso (Fruto) Aliso (Hojas) Chul Chul (Flor) Chul Chul (Hojas) Huahual (Hojas) Marar (Flor) Marar (Hojas) Pena Pena (Flor) Pena Pena (hojas) Quilluyugyug (Hojas) Quinua (Hojas) Yanamote (Hojas) Zarcillo sacha (Flor) Zarcillo sacha (Hojas) Ensayo de: KEDDE Nombre de la planta Análisis de propor- n ciones N p 3(+) 3 3 1 Aliso (Fruto) 3(-) 3 3 1 Aliso (Hojas) 3(-) 3 3 1 Chul Chul (Flor) 3(-) 3 3 1 Chul Chul (Hojas) 3(-) 3 3 1 Huahual (Hojas) 3(-) 3 3 1 Marar (Flor) 3(-) 3 3 1 Marar (Hojas) 3(-) 3 3 1 Pena Pena (Flor) 3(-) 3 3 1 Pena Pena (hojas) 3(-) 3 3 1 Quilluyugyug (Hojas) 3(-) 3 3 1 Quinua (Hojas) 3(-) 3 3 1 Yanamote (Hojas) 3(+) 3 3 1 Zarcillo sacha (Flor) 3(-) 3 3 1 Zarcillo sacha (Hojas) Significado de la nomenclatura utilizada revisar las páginas: 154-155. q 3º + - es(p) Ls Li 0 0 0 0 0 0 0 0 0 0 0 0 0 0 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 -0.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 2.96 Esta dentro de los límites si si si si si si si si si si si si si si - 163 - NOTA: En las tablas de Análisis de proporciones donde “q” no tiene valor es porque no se debe calcular según lo indicado en las páginas: 154-155 CONCLUSIONES Después de haber realizado la investigación sobre la bioactividad antifungal de las plantas del bosque de Mazán, hemos llegado a las siguientes conclusiones: De las 30 plantas seleccionadas del bosque de Mazán, objeto de nuestro estudio, se observó que el 30 % de ellas poseen bioactividad antifungal contra hongos levaduriformes utilizados en la investigación. Para Candida krusei el número de plantas con bioactividad antifungal es de 9 (nueve) correspondiente al 30% del total y el porcentaje de inhibición relativa (PIR) oscila entre un min. de 51.6 % y un máx. de 95.24 %. Como se indica en 5.5.1 (a.). Pág. 156 Para Rhodotorula glutinis el número de plantas con bioactividad antifungal es de 8 (ocho) correspondiente al 26.66% del total y el porcentaje de inhibición relativa (PIR) oscila entre un min. de 40.91 % y un máx. de 89.39%. Como se indica en 5.5.2 (a.). Pág. 158. Para Candida albicans el número de plantas con bioactividad antifungal es de 2 (dos) correspondiente al 6.66% del total y el porcentaje de inhibición relativa (PIR) oscila entre un min. de 51.51% y un máx. de 67.42%. Según 5.5.3 (a.). Pág. 159. Para Saccharomyces cerevisiae el número de plantas con bioactividad antifungal es de 2 (dos) correspondiente al 6.66% del total y el porcentaje de inhibición relativa (PIR) oscila entre un min. de 44.34% y un máx. de 61.92%. Como se indica en 5.5.4 (a.). Pág. 161. Las plantas con bioactividad antifungal frente a los hongos levaduriformes son las siguientes: - 164 - Para Candida krusei: Aliso (Hojas y fruto), Chul chul (Flor), Hua-hual (Hojas), Marar (Hojas y flor), Pena pena (Hojas y flor), Quilluyugyug (Hojas), Quinua (Hojas), Yanamote (Hojas), Zarcillo sacha (Flor). Para Rhodotorula glutinis: Aliso (Hojas), Chul chul (Hojas), Hua-hual (Hojas), Pena Pena (Hojas y flor), Quilluyugyug (Hojas), Quinua (Hojas), Yanamote (Hojas), Zarcillo sacha (Flor). Para Candida albicans: Pena Pena (Hojas y flor), Quilluyugyug (Hojas). Para Saccharomyces cereviceae: Pena Pena (Hojas y flor), Quilluyugyug (Hojas). Los extractos con bioactividad positiva frente a dos levaduras son: Para Candida krusei y Rhodotorula glutinis, las plantas con bioactividad antifungal son: Aliso (Hojas), Hua hual (Hojas), Pena pena (Hojas y flor), Quilluyugyug (Hojas), Quinua (Hojas), Yanamote (Hojas), Zarcillo sacha (Flor). El Chul chul (Hojas) para R. glutinis y (Flor) para C. krusei. Para Candida krusei y Candida albicans, las plantas con bioactividad antifungal son: Pena pena (Hojas y flor), Quilluyugyug (Hojas). Para Candida krusei y Saccharomyces cerevisiae, las plantas con bioactividad antifungal son: Pena pena (Hojas y flor), Quilluyugyug (Hojas). Para Rhodotolura glutinis y Candida albicans, las plantas con bioactividad antifungal son: Pena pena (Hojas y flor), Quilluyugyug (Hojas). Para Rhodotolura glutinis y Saccharomyces cerevisiae, las plantas con bioactividad antifungal son: Pena pena (Hojas y flor), Quilluyugyug (Hojas). - 165 - Para Candida albicans y Saccharomyces cerevisiae, las plantas con bioactividad antifungal son: Pena pena (Hojas y flor), Quilluyugyug (Hojas). Para Candida krusei, Rhodotorula glutinis y Candida albicans, las plantas con bioactividad antifungal son: Pena pena (Hojas y flor), Quilluyugyug (Hojas). Para Candida krusei, Rhodotorula glutinis y Saccharomyces cerevisiae, las plantas con bioactividad antifungal son: Pena pena (Hojas y flor), Quilluyugyug (Hojas). Para Candida albicans, Rhodotorula glutinis y Saccharomyces cerevisiae, las plantas con bioactividad antifungal son: Pena pena (Hojas y flor), Quilluyugyug (Hojas). Las plantas que tienen bioactividad antifungal frente a los cuatro hongos levaduriformes (Candida krusei, Rhodotorula glutinis, Candida albicans y Saccharomyces cerevisiae) son: Pena pena (Hojas y flor), Quilluyugyug (Hojas). De las 30 plantas utilizadas para la investigación 21 no presentaron bioactividad contra los cuatro hongos levaduriformes correspondiendo a un 70%. De los 52 extractos alcohólicos obtenidos, los que presentaron un mayor porcentaje de inhibición relativa fueron Quilluyugyug (Hojas) y Zarcillo sacha (Flor) frente a C. krusei. Frente a R. glutinis fueron Hua hual (Hojas) y Pena pena (Hojas). Para C. albicans Pena pena (Flor) y para S. cerevisiae fue Quilluyugyug (Hojas). En el análisis fitoquímico de las plantas con bioactividad antifungal se determinó los siguientes compuestos químicos: Aliso (Hojas): Saponinas, carbohidratos, triterpenos, esteroides, fenoles y taninos. Aliso (Fruto): Lactonas, coumarinas, resinas, Flavonoides, antocianidinas, carbohidratos, triterpenos, esteoides, fenoles y taninos. - 166 - Chul chul (Hojas): carbohidratos, triterpenos, esteroides, fenoles y taninos. Chul chul (Flor): Flavonoides, antocianidinas, carbohidratos, triterpenos, esteroides, fenoles y taninos. Hua hual (Hojas): resinas, saponinas, carbohidratos, triterpenos, esteroides, quinonas, catequinas, alcaloides, fenoles y taninos. Marar (Hojas): Resinas, carbohidratos, triterpenos, esteroides, fenoles y taninos. Marar (Flor): Resinas, Flavonoides, antocianidinas, carbohidratos, triterpenos, esteroides, fenoles y taninos. Pena pena (Hojas): Carbohidratos, triterpenos, esteroides, fenoles y taninos. Pena pena (Flor). Flavonoides, antocianidinas, carbohidratos, triterpenos, esteroides, fenoles y taninos. Quilluyugyug (Hojas): Lactonas, coumarinas, carbohidratos, triterpenos, esteroides, quinonas, fenoles y taninos. Quinua (Hojas): Saponinas, resinas, antocianidinas, carbohidratos, quinonas, fenoles y taninos. Yanamote (Hojas): Resinas, carbohidratos, triterpenos, esteoides, quinonas, catequinas y alcaloides. Zarcillo sacha (Hojas): Resinas, saponinas, carbohidratos, triterpenos, esteroides, fenoles y taninos. Zarcillo sacha (Flor): Lactonas, coumarinas, glicósidos cardíacos, Flavonoides, antocianidinas, carbohidratos, triterpenos, esteroides, quinonas, catequinas, fenoles y taninos. Se ha dado un aporte con los resultados del análisis fitoquímico de las plantas con bioactividad positiva ya antes no se han realizado ningún estudio en la mismas. Metabolitos como taninos, flavonoides, alcaloides, quinonas, resinas se les considera como probables responsables de la bioactividad antifungal ya que estos tienen la acción antiséptica. - 167 - Se observa que plantas que pertenecen a la misma familia no todas tienen bioactividad positiva, como en el caso de Joyapa y Yanamote pertenecen a la familia ERICACEAE, la primera no posee bioactividad a diferencia de la segunda que surte un halo difuso para C. krusei. En el caso de Quilluyugyug(Hojas) y Zarcillo sacha(Flor) pertenecientes a la familia MELASTOMATACEAE, las dos presentan bioactividad positiva. Para una cepa de levadura, una misma planta puede tener bioactividad positiva y negativa dependiendo de sus órganos, como en la Chul chul frente a C. krusei las hojas no posee bioactividad a diferencia de las flores de la misma; la Zarcillo sacha, cuyas flores poseen bioactividad positiva y las hojas no. De una misma planta frente a una cepa de levadura sus partes pueden generar halos de inhibición de diferentes mm. de diámetro. RECOMENDACIONES 1. La técnica de percolación empleada, no es la oficial y los extractos secos obtenidos no corresponden al concepto de extracto seco, que es “aquel que posee una concentración de principios activos mayor a la de la droga, poseen menos de un 3% de menstruo”, (FAULI 200) (SELLES FLORES, 1995)., (LE HIR, 1995), (AULTON, 2004). 2. VALIDAR el tiempo de maceración por 24 horas de la técnica modificada utilizada para obtención de los extractos alcohólicos. 3. El tamaño de la muestra debe ser estadísticamente representativa. 4. Agotar la droga CONCENTRAR los extractos con el objetivo de extraer una mayor cantidad de metabolitos por agotamiento. - 168 - Después de haber realizado el screening primario sobre la bioactividad antifungal de 30 plantas del bosque de Mazán se recomienda: Hacer la bioactividad antifungal de las otras partes de las plantas que dieron positivas. De las plantas con resultados negativos se recomienda hacer la bioactividad de las partes que no se recolectaron para esta tesis. Un estudio de cada planta con bioactividad positiva donde se consiga la purificación de metabolitos los cuales después de investigaciones en un futuro tengan aplicación en la elaboración de fitofármacos. Trabajar con droga proveniente de la planta recién recolectada, para lograr aprovechar al máximo los componentes de las plantas. Utilizar medios que contengan aminoácidos para que facilite el crecimiento de Saccharomyces cerevisiae. La biomasa se debe mantener pura y en óptimas condiciones, hacer nuevos cultivos frecuentemente. El dimetilsulfóxido se recomienda utilizar para resuspender los residuos secos, porque este es inocuo para las cepas y mantiene estable los metabolitos en el extracto como se ha comprobado en nuestra investigación. Se recomienda estandarizar la técnica para obtención de extractos alcohólicos para ensayos de bioactividad. Por tratarse de un Screening primario, se recolectó una muestra de cada planta en la primera vez, para la comprobación se hizo una segunda y tercera recolección. Los ensayos se realizaron por duplicado. - 169 - BIBLIOGRAFÍA (1) ALBERTS B, et al. “Biología Molecular de la Célula”. 3º Edición. Editorial Omega S.A., Barcelona-España, 1996. (2) BECKER, Jeffrey M. “Biotecnología: Curso de Prácticas de Laboratorio”. Editorial Acribia, S.S. España, 1999. (3) BERDONCES, Joseph Lluis. “Gran Enciclopedia de las Plantas Medicinales” Editorial Tikal. Barcelona-España. s.a. (4) BRUNETON, Jean. “Farmacognosia: Fitoquímica de Plantas medicinales” Editorial Acribia. España, 2001. (5) CYTED, (Programa Iberoamericano de Ciencia y Tecnología para el desarrollo). “Manual de Técnicas de Investigación”. 1995. (6) FACTTORUSO, V. RITTER, O. “Vademécum Clínico del Diagnóstico al Tratamiento”. Editorial El Ateneo. Buenos Aires, 2001. (7) FARMACOPEA DE LOS ESTADOS UNIDOS MEXICANOS. 5ª Edición. 1988. (8) JAWETZ, MELNICK y ADELBERG. “Microbiología Médica”.17ª Edición Editorial El Manual Moderno. México, 2002. (9) JIMÉNEZ S, Alfonso. JIMÉNEZ M, Juan. “Genética Microbiana”. 2ª Edición. Editorial El Síntesis. Madrid, 1998. (10) KUKLINSKI, Claudia. “Farmacognosia” Ediciones Omega, S. A., s.e. Barcelona-España, 2000. (11) LAGUNA, José. PIÑA, Enrique. “Bioquímica”. 5ª Edición. Editorial El Manual Moderno. México, 2002. (12) LENNETTE, BALOWS, HAUSLER, SHADOMY. “Manual of Clinical Microbiology”. 4ª Edition. Editorial American Society for Microbiology. Washington, D.C, 1985. - 170 - (13) MARCANO, Deana De. HASEGAWA, Masahisa. “Fitoquímica orgánica”. Universidad central de Venezuela. Caracas, 1991 (14) MARTINEZ, Ciro. “Estadística Comercial” Editorial Norma, Colombia Bogotá. 1994. (15) MINGA, Danilo. “Árboles y arbustos del bosque de Mazán”. Tomo II Editorial Grafisum. Ecuador, 2000. (16) MIRANDA MARTÍNEZ, Migdalia. “Método de Análisis de Drogas y Extractos”. La Habana. Cuba, 1996. (17) MURRAY, Patrick. “Microbiología Médica”. 4º Edición. Editorial El Servier Science .Madrid, 2002. (18) PECLZAR, Michael J. “Microbiología”.4º Edición. Editorial Mograw Hill. New York, 1966. (19) PHARMACOPEIA NATIONAL FORMULARY “USP XXII”. Estados Unidos, 1990. (20) PORTUS, Lincoyan. “Curso Práctico de Estadística” Editorial Mack Graw Hill. Colombia, 2001. (21) RIPPON, John. “Tratado de Microbiología Médica”. 3ª Edición. Editorial Interamericana. México, 2002. (22) RIVERO L., Miguel. ALVAREZ G, Manuel.LÓPEZ A,Tania.y GONZÁLEZ C, Juana. “Actividad antifúngica in vitro del Pinus caribaea(pino macho)” Facultad de Ciencias Médicas. sancti spíritus Revista Cubana de Plant Med 1997. (23) SERRANO, Felipe: “Árboles y arbustos del bosque de Mazán” Tomo I. Editorial Edibosco. Ecuador, 1996. (24) SOEJARTO, D. “Taxonomia y Base Química de Drogas” Escuela Superior Politécnica del Chimborazo. Riobamba-Ecuador, 1995. (25) TAYLOR, Magali. REIDE, Reide. “Farmacología” 1ª Edición. Editorial - 171 - Harcourt, S. A. Madrid-España, 2001. (26) TYLER, LYNN, JAMES. “Farmacognosia”. Editorial El Ateneo. 2ª Edición. Buenos Aires.1979. (27) VILLACRÉS, Victor Dr.: “Bioactividad de Plantas Amazónicas”. 1ª Edición. Ediciones Abya-yala. Ecuador, 1995 (28) ZINSSER. “Microbiología”. 20ª Edición. Editorial Médica Panamericana. Buenos Aires-Argentina, 1997. (29) Enciclopedia de Consulta “Microsoft Encarta”. 2005 (30) Diccionario Enciclopédico Ilustrado “Océano Uno”.Edición 2000.Editorial Carvajal S.A. (31) CRUZ VEGA, DE, et al., “Actividad Antimicrobiana de extractos de hoja, tallo y raíz de Carlowrightia cordifolia. Revista Salud Pública y Nutrición. Edición especial Nº 5. México, 2002. (31) DEHARO, E. et al., “Active Antipaludique du N-hentriacontanol Isole de Cuatresia sp (SOLANACEAE). Revista Ann Parasitol. Hum. Comp., Publicado 9 julio 1992. Pág. 126-127 (32) FOURHET, Alain., et al., “Leishmanicidad and trypanocidad activities of Bolivian medicinal plants”. Journal of ETHNOPHARMACOLOGY. Nº 41. Bolivia, 1992. Pág. 19-37. Publicada en1994. (33) FOURHET, Alain. et al., “Antiprotozoal Activity of Dehydrozaluzanin C, a Sesquiterpene Lactone Isolated from Munnozia maronni (ASTERACEAE)” Journal of ETHNOPHARMACOLOGY. Publicada 1 de junio de 1992. (34) KHAN, M.R., et al., “Antimicrobial activity of Symplocos cochinensis.” FITOTERAPIA.Vol.72. 2001. Pág.825-828. Publicada en 4 de mayo de 2001. (35) OMAR, S., et al., “Antimicrobial activity of extracts of eastern North American hardwood trees and relation to traditional medicine.” - 172 - Journal of ETHNOPHARMACOLOGY. Vol. 73. 2000. Publicado 6 de junio de 2002. Pág. 161-170. (37) RANGEL, D. et al., “Actividad antimicrobiana de los extractos etanólico, acetónico y acuoso de Baccharis nitida (Ruiz et Pavon) pers”. Revista de la Facultad de la Farmacia.Vol.42.Venezuela, 2001. Pág. 44 (38) SILVA, Belmares, et al., “Fraccciones con Actividad Antimicrobiana de los extractos Jatropha dioica, Ricinus communis y Schinus molle.” Revista Salud Pública y Nutrición. Segunda Edición. México, 2003. Pág.1-2. Aceptado para la publicación 3 de febrero de 2003. (39) SOLIS, Pablo N., et al., “Bio-active Compounds from Phychotria camponutans” Planta Med. Vol. 61. New York, 1995. (40) TEQUIDA-MENESES M, et al., “Efecto de extractos alcohólicos de plantas silvestres sobre la inhibición de crecimiento de Aspergillus flavus, Aspergillus niger, Penicillium chysogenum, Penicillium expansum, Fusarium moniliforme y Fusarium poae.” Revista Iberoamericana de Micología. Aceptado para la publicación 15 Marzo de 2002. 19:84-88. Internet: El buscador para las siguientes páginas web es Google y Yahoo. (41) http:fai.unne.edu.ar/biología/cel-euca/index.htm 27-05-04 (42) http:tq.educ.ar/tq02035/anato.htm 26-03-04 (43) http://www.verema.com/opinamos/tribuna/articulos/levaduras02.htm 14-05-04 (44) http://www.unavarra.es/genmic/metabolismo/glucolisis.htm 14-05-04 (45) http://personales.ya.com/erfac/micosis.htm 03-05-04 (46) http://www.odontologia-online.com/casos/part/LST/LST04/lst04html 14-05-04 (48) http://medynet.com/usuarios/nnuneza/ginecología/levaduras4.jpg 23-03-04 (47) http://www.cerveceroscaseros.com.ar/infolevad.htm 27-03-04. (49) www.cat.cc.md.us/courses/bio141/ labmanua/lab9/chlamydo.html 14-05-04 (50) http://www.med.uchile.cl/otros/dra_ancic/capitulo22.html 14-05-04 (51) www.hemerodigital.unam.mx/ANUIES/ipn/avanpers/ene97/vol1612/vol612.html 21-06-04 (52) http://fai.unne.edu.ar/biologia/macromoleculas/azucar.htm#inicio 21-06-04 - 173 - (53) http://www.iespana.es/natureduca/med_sustanc_taninos.htm 21-06-04 (54) http://www.iespana.es/natureduca/med_sustanc_esencias.htm 21-06-04 (55) http://mazinger.sisib.uchile.cl/repositorio/lb/ciencias_quimicas_y_farmaceuticas (56) http://www.efloras.org/florataxon.aspx?flora_id=201&taxon_id=10152 (57) http://www.arbolesornamentales.com/Urticaceae.htm (58) http://www.arbolesornamentales.com/Betulaceae.htm (59) http://www.arbolesornamentales.com/Lauraceae.htm (60) http://www.inbio.ac.cr/bims/k03/p13/c045/o0233/f01522.htm (61) http://www.inbio.ac.cr/bims/k03/p13/c045/o0250/f01571.htm (62) http://mazinger.sisib.uchile.cl/repositorio/lb/ciencias_quimicas_y_farmaceuticas/nav (63) http://www.dipbot.unict.it/sistematica_es/Aste_fam.html (64) http://www.arbolesornamentales.com/Rubiaceae.htm (65) http://www.arbolesornamentales.com/Proteaceae.htm (66) http://www.arbolesornamentales.com/Myrtaceae.htm (67) http://www.arbolesornamentales.com/Ericaceae.htm (68) http://www.inbio.ac.cr/bims/k03/p13/c045/o0257/f01597.htm (69) http://sloth.ots.ac.cr/local/florula2/families/symplocaceae.htm (70) http://www.arbolesornamentales.com/Verbenaceae.htm (71) http://www.arbolesornamentales.com/Rosaceae.htm (72) http://www.arbolesornamentales.com/Caprifoliaceae.htm (73) http://www.inbio.ac.cr/bims/k03/p13/c045/o0264/f01619.htm (74) http://www.inbio.ac.cr/bims/k03/p13/c046/o0159/f01382.htm (75) http://www.inbio.ac.cr/bims/k03/p13/c045/o0234/f01525.htm Nota: La fecha que se adjunta a las direcciones es la fecha de consulta y para (55) a (75) la fecha es 24 y 25 de noviembre de 2004). - 174 -