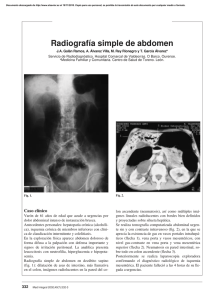
Anales de México
Anuncio
Anales de RADIOLOGÍA México Vol. 14 Núm 1 / enero-marzo 2015 Vol. 14 Núm 1 / enero-marzo 2015 ISSN 1665-2118 EDITORIAL 1 Desafíos de la especialidad de radiología en las siguientes décadas ARTÍCULOS ORIGINALES 11 Método para incrementar la sensibilidad diagnóstica del gammagrama óseo 20 El divertículo de Meckel en adultos 31 Evaluación radiológica, con criterios RECIST, de la respuesta al tratamiento del cáncer pulmonar no microcítico. Seguimiento de rutina 43 Diagnóstico por imagen seccional de la colitis seudomembranosa 66 Isquemia mesentérica aguda: urgencia que exige un abordaje diagnóstico integral ARTÍCULOS DE REVISIÓN Anales de Radiología México 89 Anatomía del codo por resonancia magnética hecha fácil 99 Objetivos para un Programa de Protección Radiológica para el Paciente en servicios de tomografía computada en México CASOS CLÍNICOS 108 Tumores del estroma gastrointestinal; a propósito de un caso en el yeyuno 117 Tumor del estroma gastrointestinal rectal: diagnóstico con biopsia guiada por ecografía endovaginal 123 Perforación de la vesícula biliar asociada con hydrops vesicular como manifestación atípica de la enfermedad de Kawasaki. Informe de un caso PERSONAJE 129 Anales de Radiología México 2015;14:1-131. Guillermo Santín García: una semblanza Disponible en línea: www.nietoeditores.com.mx ÓRGANO OFICIAL DE LA SOCIEDAD MEXICANA DE RADIOLOGÍA E IMAGEN, A.C. Vol. 14 Núm. 1 / enero-marzo 2015 SOCIEDAD MEXICANA DE RADIOLOGÍA E IMAGEN, A.C. Mesa directiva Dr. Armando López Ortíz / Presidente Dr. Gerardo Villegas López / Presidente electo Dr. Miguel A. Palacios Montesinos / Secretario general Dra. Nora Eugenia Rodríguez Pedraza / Tesorero Dra. Araceli Cabanillas Segura / Secretario de actas Dr. Jorge Bisteni Bustani / Director administrativo Editor Dr. Oscar Quiroz Castro Editores honorarios Dra. Guadalupe Guerrero Avendaño Dr. Gonzalo Salgado Salgado Editor asociado Dra. Iriabeth Villanueva López Índice Artemisa a partir de la 13ª edición Índice LILACS 2005 EBSCO, MedicLatina, Academic Search Complete, Google Academics www.smri.org.mx smrianales@servimed.com.mx ISSN 1665-2118 Comité editorial Dr. Luis Felipe Alva López Dr. Raúl Barreda Escalante Dra. Paulina Bezaury Rivas Dr. Bernardo Boleaga Durán Dr. José Manuel Cardoso Ramón Dr. Arturo Castillo Lima Dr. José Luis Criales Cortés Dr. Sergio Criales Vera Dra. Susana Elizalde Velásquez Dr. Rodolfo Franco Castellanos Dr. Juan González de la Cruz Dr. Kenji Kimura Fujikami Dra. Ma. del Carmen Lara Tamburrino Dr. Carlos Manzano Sierra Dr. Ernesto Fernando Martín Biasotti Dr. Gaspar Alberto Motta Ramírez Dr. Héctor Murrieta González Dra. Julita Orozco Vázquez Dra. Hilda Palafox Vázquez Dr. José A. Pérez Mendizábal Dr. Gerardo M. Perdigón Castañeda Dr. Luis Ramos Méndez Padilla Dr. Julián Sánchez Cortázar Dr. Miguel Stoopen Rometti Dra. Yuri Tsutsumi Hoshiko Dra. Alma Vázquez Gutiérrez Dr. Jorge Vázquez Lamadrid Comité internacional Dr. Francisco Arredondo Dr. William Bradley Dr. Carlos R. Giménez Dr. Enrique Palacios Dr. Francisco Quiroz y Ferrari Dr. Rafael Rojas Jasso Dr. Pablo R. Ros Dr. Eric Stern Órgano Oficial de la Sociedad Mexicana de Radiología e Imagen, A.C. Toda correspondencia: Coahuila No. 35, 06700, México, D.F. Tel.: 5574-52-50. Publicación Trimestral. Registro de Correspondencia de 2a. Clase No. De Registro 0740792. Caract. 220251118 en la Dirección General de Correos. Certificado de licitud de título 12113 y Certificado de licitud de contenido 87613. Suscripción anual $770 pesos (Servicio suscripción a domicilio + 25%). Extranjero U.S. 85.00 Dls. Números atrasados $80 (pesos). Publicación realizada por Edición y Farmacia SA de CV. José Martí 55, colonia Escandón, 01180 Ciudad de México (www.nietoeditores.com.mx). Impresa en Grupo Art Graph SA de CV. Av. Peñuelas 15-D, Col. San Pedrito Peñuelas, 76148 Querétaro, Qro (www.artgraph.com.mx). Diagramación: LDG. Elidé Morales del Río. Colegio Nacional de Médicos Especialistas en Radiología e Imagen, A.C. ¿Sabes qué es el Colegio Nacional de Médicos Especialistas en Radiología e Imagen? ¿Sabes cuál es su propósito? ¿Sabes qué se requiere para formar parte del CNMERI? Es una asociación civil (no lucrativa) formada por médicos radiólogos, la mayoría con sede en la Ciudad de México y área metropolitana. El Colegio es una instancia de opinión crítica en busca de garantía de calidad. Es el organismo idóneo para emitir dictámenes y es el responsable de promover acciones en beneficio de la población. Coadyuvar a la vigilancia y superación del ejercicio profesional, para proteger a la sociedad de malas prácticas profesionales. Incluir en sus actividades la consultoría, la actualización profesional y la vinculación con el sector educativo. Considerar a la vigilancia una actividad integral que garantice el compromiso con la profesión. La vinculación de los colegios con las instituciones de educación superior es benéfica para ambas instancias, y ofrece actualizar y adecuar planes y programas de estudio, realizar el servicio social, crear nuevas carreras según las necesidades actuales y desarrollar nuevas líneas de investigación. Ser médico radiólogo con cédula de especialidad, independientemente de la ciudad de residencia donde radiques. Para mayor información favor de enviar esta forma a: Coahuila 35 06700 México, D.F. Tel.: 5264-3268 Fax: 5574-2434 E-mail: cnmeri@smri.org.mx Nombre Apellido paterno Apellido materno Nombre(s) Dirección Calle y número C.P. Teléfono E-mail Exterior Población Fax Número Interior Estado Colonia Vol. 14 Núm 1 / enero-marzo 2015 CONTENIDO CONTENTS EDITORIAL EDITORIAL 1 1 Desafíos de la especialidad de radiología en las siguientes décadas Ramírez-Arias JL ARTÍCULOS ORIGINALES 11 20 31 43 66 Método para incrementar la sensibilidad diagnóstica del gammagrama óseo Jaramillo-Núñez A, Gómez-Conde JC El divertículo de Meckel en adultos Motta-Ramírez GA, Reyes-Méndez E, Campos-Torres J, García-Ruiz A, Rivera-Méndez VM, García-Castellanos JA, Aragón-Flores M Evaluación radiológica, con criterios RECIST, de la respuesta al tratamiento del cáncer pulmonar no microcítico. Seguimiento de rutina Cuituny-Romero AK, Onofre-Castillo J Diagnóstico por imagen seccional de la colitis seudomembranosa Motta-Ramírez GA, Torres-Montoya JM, Martínez-Utrera MJ, Rebollo-Hurtado V, Guizar-López GU Isquemia mesentérica aguda: urgencia que exige un abordaje diagnóstico integral Motta-Ramírez GA, Sánchez-García JC, OntiverosRodríguez A, López-Ramírez MA, Rebollo-Hurtado V, García-Ruiz A, Noyola-Villalobos H ARTÍCULOS DE REVISIÓN 89 99 Anatomía del codo por resonancia magnética hecha fácil Alonso-Que HT, Castillo-Uribe L, Rodríguez-Delgado NA, Motta-Ramírez GA Objetivos para un Programa de Protección Radiológica para el Paciente en servicios de tomografía computada en México Montoya-Mendoza N, Franco-Cabrera MC 11 20 31 43 66 89 99 Anatomy of the elbow by magnetic resonance made simple Alonso-Que HT, Castillo-Uribe L, Rodríguez-Delgado NA, Motta-Ramírez GA Objectives for a Patient Radiological Protection Program in computed tomography services in Mexico Montoya-Mendoza N, Franco-Cabrera MC CLINICAL CASES 108 www.nietoeditores.com.mx Method to increase diagnostic sensitivity of bone scans Jaramillo-Núñez A, Gómez-Conde JC Meckel’s diverticulum in adults Motta-Ramírez GA, Reyes-Méndez E, Campos-Torres J, García-Ruiz A, Rivera-Méndez VM, García-Castellanos JA, Aragón-Flores M Radiological evaluation, with RECIST criteria, of response to treatment of non-microcytic lung cancer. Routine follow-up Cuituny-Romero AK, Onofre-Castillo J Diagnosis by cross-sectional imaging of pseudomembranous colitis Motta-Ramírez GA, Torres-Montoya JM, Martínez-Utrera MJ, Rebollo-Hurtado V, Guizar-López GU Acute mesenteric ischemia: an emergency which requires a comprehensive diagnostic approach Motta-Ramírez GA, Sánchez-García JC, OntiverosRodríguez A, López-Ramírez MA, Rebollo-Hurtado V, García-Ruiz A, Noyola-Villalobos H REVIEW ARTICLES 108 Challenges for radiology in the coming decades Ramírez-Arias JL ORIGINAL ARTICLES CASOS CLÍNICOS Tumores del estroma gastrointestinal; a propósito de un caso en el yeyuno Alanis-Lara J, Castro-Villamour AR, Bravo-Ontiveros F, Arroyo-Hernández G, Klug-Falicoff M ISSN 1665-2118 Gastrointestinal stromal tumors; discussion of a case in the jejunum Alanis-Lara J, Castro-Villamour AR, Bravo-Ontiveros F, Arroyo-Hernández G, Klug-Falicoff M Contenido 117 123 Tumor del estroma gastrointestinal rectal: diagnóstico con biopsia guiada por ecografía endovaginal Marco-Doménech SF, Sáez-Valero E, Lorenzo-Gorriz A, Fernández-García P, Navarro-Ballester A Perforación de la vesícula biliar asociada con hydrops vesicular como manifestación atípica de la enfermedad de Kawasaki. Informe de un caso Colomo-Padilla AL, Solórzano-Morales SA, MoraTizcareño MA, Sorcia-Ramírez G, Garrido-García LM 117 123 Rectal gastrointestinal stromal tumor: diagnosis with transvaginal ultrasound-guided biopsy Marco-Doménech SF, Sáez-Valero E, Lorenzo-Gorriz A, Fernández-García P, Navarro-Ballester A Perforation of the gallbladder associated with gallbladder hydrops as an atypical manifestation of Kawasaki disease. A case report Colomo-Padilla AL, Solórzano-Morales SA, MoraTizcareño MA, Sorcia-Ramírez G, Garrido-García LM PERSONAJE PERSONALITY 129 129 Guillermo Santín García: una semblanza Ramírez-Arias JL Guillermo Santin Garcia: a biographical sketch Ramírez-Arias JL www.nietoeditores.com.mx Editorial Anales de Radiología México 2015;14:1-10. Desafíos de la especialidad de radiología en las siguientes décadas Challenges for radiology in the coming decades Dedico este trabajo al decano de la radiología mexicana, el Dr. Guillermo Santín García, con motivo de la celebración del centenario de su nacimiento En este trabajo se hace una revisión de la práctica de la radiología en México y se analizan los puntos o temas más importantes con las que está involucrada, como los científicos, tecnológicos, académicos, económicos, regulatorios, de organización e inclusive se hacen comentarios sobre algunos de ética médica; se revisa además su desarrollo, el estado actual y se hacen consideraciones para evaluar el futuro. El desafío se fundamenta en varios aspectos, entre los más importantes está la vinculación de la radiología con la alta tecnología y con el conocimiento y la investigación biomédica que han conducido a notables descubrimientos, inventos e innovaciones científicas, entre las más importantes están la medicina molecular y la medicina genómica. La industria relacionada con la radiología produce ahora nuevos aparatos que por su alta resolución permiten demostrar cambios anató- micos y morfológicos en etapas tempranas de muchas enfermedades y, además, es posible detectar con ellos alteraciones celulares, metabólicas y funcionales; lo que ha dado lugar, inclusive, a una nueva subespecialidad llamada imagen molecular. También han influido para el desarrollo los enormes avances en bioinformática que lograron establecer muchos protocolos y sistemas electrónicos de trabajo, entre los más importantes el DICOM (Digital Communication in Medicine) que facilitó unificar el lenguaje electrónico de los diferentes equipos de imagen y el PACS (Picture Archiving Communication Systems) que permite recibir y adquirir de los equipos digitales las imágenes, distribuirlas, archivarlas e inclusive enviarlas por medio de telerradiología.1 Los medios de contraste y los radioisótopos son resultado de extensas y complejas investigaciones biomédicas, estos productos farmacéuticos y los de radiofarmacia también han contribuido a la evolución sorprendente de la radiología; por ejemplo, los medios de contraste no iónicos, al ser mejor tolerados y además más seguros, se utilizan con más frecuencia, en especial en tomografía computada y en intervencionismo diagnóstico y terapéutico.2 En la actualidad también existen moléculas que se utilizan como medios de contraste útiles en ultrasonido y en resonancia magnética. Nuevos agentes moleculares producidos en radiofarmacias tienen propósitos diagnósticos y terapéuticos, son sustancias que pueden ser dirigidas o introducidas a tejidos y órganos afectados por diferentes enfermedades; por ejemplo, con gases inertes e hiperpolarizados inhalados se pueden detectar lesiones pulmonares en resonancia magnética3 y con fluorodesoxiglucosa (FDG) y otros radionúclidos se pueden demostrar alteraciones metabólicas y funcionales en lesiones tempranas de diferentes neoplasias. 1 Anales de Radiología México En nuestra especialidad ya también se utiliza la nanotecnología con la que es posible, por ejemplo, la introducción de microesferas radioactivas por vía intravascular que han demostrado ser útiles para el tratamiento de algunos tumores renales. 4,5 Así mismo, se utilizan lisosomas marcados con radioisótopos como vehículos que permiten liberar agentes citotóxicos o que contrarrestan la angiogénesis y han sido útiles para diversos tratamientos.6 Una indicación más para el uso de radioisótopos en oncología es la posibilidad de diferenciar la apoptosis o muerte celular programada de la anoxia por células dañadas por tumor o la de “iluminar” ganglios muy pequeños y demostrar metástasis tempranas prácticamente a escala celular. Los mismos agentes moleculares utilizados como contraste en algunos casos pueden tener acción terapéutica; por esta dualidad se les llama agentes teragnósticos1,7 y muchos son sustancias utilizadas en quimioterapia. Estos avances se han realizado en conjunto con la especialidad de medicina nuclear, la que desde hace varios años está vinculada estrechamente con la imagenología moderna; en sus equipos se producen imágenes funcionales más que anatómicas y, en la actualidad, ya existen aparatos de medicina nuclear acoplados a equipos de tomografía computada y de resonancia magnética que en conjunto combinan imágenes anatómicas y funcionales. Los estudios que se realizan con ellos son una combinación de tomografía por emisión de positrones con tomografía convencional (PETCT) y con resonancia magnética (PET-RM). Estos aparatos y los conocimientos adquiridos con ellos han contribuido en forma importante al desarrollo de la imagen molecular que se fundamenta, entre otras cosas, en investigaciones relacionadas con el genoma humano.1,8 La información y los conocimientos que existen en la radiología moderna son extraordinariamen- 2 Volumen 14, Núm. 1, enero-marzo 2015 te amplios y complejos, por lo que los radiólogos han tenido la necesidad de ampliar y fortalecer sus conocimientos, en especial los de biología molecular y los de tecnología avanzada de la información, esta necesidad ha conducido a una mayor tendencia de los radiólogos a subespecializarse9 en neuroimagen, en cabeza y cuello, en radiología mamaria, pediátrica o intervencionista, por mencionar sólo algunas. Eso facilita que se integren más estrechamente en las actividades de atención médica y que se amplíe su comunicación con los médicos tratantes. No se considera que los radiólogos generales puedan desaparecer pero sí que deben tener amplios conocimientos que justifiquen su presencia en los modernos departamentos de radiología.10 Desde hace varios años muchos especialistas no radiólogos manejan sus propios equipos de imagen, entre otros los ginecólogos el ultrasonido, los cardiólogos los de hemodinamia y ecocardiografía y los neurólogos y los neurocirujanos los de resonancia magnética. Esto ha dado lugar a una competencia entre radiólogos y otros especialistas que se ha descrito como una guerra de territorios (turf wars),11 el objetivo de esta forma de trabajo no debería ser financiero sino el de unir esfuerzos para dar una atención radiológica más especializada y de más calidad; para ello lo idóneo es el trabajo conjunto entre clínicos y radiólogos, lo que redundaría en mayores beneficios para los pacientes. Las imágenes digitales de los diferentes equipos, por su alta definición y resolución permiten obtener mucha información; sin embargo, se requiere mucha experiencia para evaluar los hallazgos y evitar errores al interpretarlos. Por ejemplo, muchas imágenes normales se confunden con frecuencia con variantes anatómicas que son normales pero que simulan enfermedades.12 Las estaciones de trabajo con PACS facilitan al radiólogo la revisión e interpretación de estudios en un sitio y, con la aplicación de la telerradiología, Editorial enviar las imágenes a otros monitores dentro del hospital o a estaciones remotas; esta ventaja se aprovecha con frecuencia en departamentos de radiología en horas y días no hábiles en los que por lo general hay menos radiólogos, se utiliza también para interconsultar a radiólogos subespecializados. Debido a la alta tecnología con la que está involucrado el radiólogo enfoca y ocupa mucho del tiempo de sus actividades en las estaciones de trabajo, ahí revisa, procesa e interpreta estudios, con mucha frecuencia no ve al paciente, solamente las imágenes que, después de ser interpretadas, quedan disponibles para su consulta. Esta situación ha conducido a considerar al radiólogo como un especialista invisible.13 Es necesario contrarrestar esta invisibilidad porque despersonaliza y con ello contraviene el principio de la relación médico-paciente. El radiólogo debe interactuar más con los pacientes, sus familiares y con los médicos tratantes para conocer más sobre la enfermedad de los pacientes que atiende y para que se integre en forma más estrecha con la atención médica; no debe ser considerado únicamente como un experto en interpretar imágenes.14 También es necesario que el radiólogo se involucre en actividades institucionales como las sesiones académicas y los comités hospitalarios. La radiología se ha transformado de su objetivo inicial que era el diagnóstico, actualmente también tiene amplias implicaciones terapéuticas, lo que explica el desarrollo tan importante que ha tenido la radiología intervencionista. Lo anterior se debe en parte a los nuevos aparatos de diagnóstico por imagen, al diseño de nuevo instrumental y de catéteres, los que ahora son muy flexibles, delgados, maniobrables y, además, fáciles de colocar por vía vascular o endoluminal; facilitan la introducción de medios de contraste y además productos citostáticos para quimioterapia o material embolígeno para cohibir hemorragias o la circulación de tumores malignos, también se usan para la colocación de endoprótesis (stents). Los radiólogos intervencionistas participan en muchos procedimientos que antes requerían cirugía; ahora, con catéteres con globo, realizan angioplastias de vasos con estenosis que comprometen a diferentes órganos. Adicionalmente, por vía percutánea es posible hacer drenajes, derivaciones y procedimientos de termoablación. Debe considerarse que en el futuro esta especialidad será de mayor utilidad, en la era de la medicina genómica y molecular, ya que muchos tratamientos consistirán en la introducción de sustancias dirigidas, por vía endoluminal o endovascular, directamente al órgano o tejido afectados. La radiología en México tiene antecedentes históricos de más de 100 años, ha tenido una evolución que ha permitido constituir sociedades y colegios en casi todos los estados de la República. Desde 1971 estas instituciones se unieron en la Federación Mexicana de Radiología e Imagen. En ese mismo año se constituyó el Consejo Mexicano de Radiología e Imagen que, desde entonces, certifica los conocimientos y la calidad profesional de los radiólogos. Muchas de las sociedades organizan espléndidos programas de educación médica continua en donde participan profesores nacionales y muchas veces extranjeros; en ellos se imparten temas de actualidad que apoyan a los radiólogos mexicanos a tener vigencia en sus conocimientos. A estos eventos asisten siempre un buen número de residentes. Muchos radiólogos en esas sociedades han contribuido y apoyado a las autoridades sanitarias, por ejemplo a elaborar las normas oficiales mexicanas de protección radiológica y las correspondientes al funcionamiento de los departamentos de radiología que, en conjunto, garantizan la calidad de los servicios y la segu- 3 Anales de Radiología México ridad tanto para el personal ocupacionalmente expuesto como para los pacientes. Los departamentos de radiología, en especial los que tienen una infraestructura de alta tecnología, por el alto costo de adquisición, de mantenimiento y de los recursos humanos para operarlos, solamente existen en instituciones hospitalarias públicas o privadas de alta complejidad, que también con frecuencia son las que están vinculadas con actividades académicas y de investigación. La práctica de la radiología se ha transformado, progresivamente, en una actividad empresarial en la que las inversiones se deben recuperar en el menor tiempo posible; esto ha conducido a nuestra especialidad hacia lo que se llama la comoditización de los servicios: este término financiero se refiere a ofrecer servicios (en este caso de radiología e imagen) al menor costo posible.15 Esta situación es preocupante porque puede comprometer la calidad de los servicios y, más grave aún, acentúa la despersonalización de la atención médica de los radiólogos, situación que también contraviene la relación médico-paciente, lo que en cierta forma vulnera los principios de ética y de profesionalismo.16,17 La formación de radiólogos ha tenido una evolución favorable en México, ahora los programas de posgrado incluyen conocimientos más amplios, en especial los de física, anatomía patológica, anatomía seccional, estructural, fisiología, fisiopatología e informática médica; dentro de las destrezas necesarias se han establecido amplios programas de radiología intervencionista. En varios centros ahora también se imparten los fundamentos de la medicina molecular, lo que permite que los residentes puedan estudiar y evaluar imágenes anatómicas y funcionales. De tal importancia es lo mencionado que el programa vigente de Imagenología Diagnóstica y Terapéutica de la Facultad de Medicina de la 4 Volumen 14, Núm. 1, enero-marzo 2015 UNAM fue revisado en el año 2009 y ya incluye conocimientos de medicina nuclear y de imagen molecular.18 Por otra parte, en varias universidades ya existen sedes que ofrecen cursos de alta especialidad que permiten a los radiólogos subespecializarse, las que tienen mayor demanda son las de neuroimagen, radiología pediátrica, de cabeza y cuello, de mama y la intervencionista. En los últimos años cada vez más radiólogos se interesan en los programas que incluyen imagen molecular, los que únicamente se pueden ofrecer en las instituciones que incluyen en su infraestructura departamentos de medicina nuclear y de tomografía por emisión de positrones combinada con tomografía convencional. Debemos reconocer que en México aún persiste una disparidad y falta de homogeneidad en los programas de posgrado; influyen la infraestructura instalada, los campos clínicos y la preparación del radiólogo como docente. Actualmente muchos de los radiólogos que son profesores titulares o adjuntos están a cargo de los programas de posgrado pero carecen de formación docente. Una dura realidad que debemos afrontar es la falta de radiólogos interesados en la docencia, lo que debe considerarse como un verdadero reto a resolver en las próximas décadas; el presente y el futuro inmediato obligan a tener radiólogos docentes de alto nivel académico. Hasta aquí se ha resumido cómo es y cómo ha evolucionado la práctica de nuestra especialidad en las últimas décadas. La radiología moderna requiere ahora, y con mayor razón en el futuro próximo, de tecnología de avanzada y de radiólogos con formación de alto nivel, muchas habilidades y que además tengan un muy claro sentido del profesionalismo médico. Existen ya muchas publicaciones en donde se describen los retos en el futuro para mantener a la radiología Editorial como una especialidad que contribuya en la atención médica de alta calidad.1,19 En materia educación las facultades de medicina públicas y privadas deberán revisar y actualizar los programas de posgrado para que los radiólogos, al terminar sus estudios, tengan los conocimientos y habilidades suficientes que garanticen una práctica radiológica moderna, ampliamente participativa y eficiente. La responsabilidad y compromiso de los radiólogos será enorme en la medicina integrada. Es necesario aumentar el número de programas de posgrado de radiología registrados en las universidades; en el Consejo Mexicano de Radiología e Imagen hasta la fecha solamente se tienen registrados cincuenta programas de posgrado, muchos cuyas sedes tienen infraestructura deficiente. Es necesario, además, ampliar estos programas y las sedes en donde se imparten, junto con cursos de alta especialidad que permitan formar subespecialistas, los que cada vez se requerirán en mayor número para cumplir con los requerimientos y las expectativas epidemiológicas del país, que cada vez tendrá mayor número de instituciones médicas de alto nivel.1,20,21 Será fundamental promover y sensibilizar a los radiólogos, en especial a los recién egresados, a interesarse y a participar en actividades docentes; se les deberá permitir que asistan a programas formales de pedagogía, lo que les facilitará comprender y aplicar la educación moderna que incluye los nuevos conceptos de educación de por vida y la educación del adulto (life long and adult learning)19,22 que contemplan la utilización de tecnología y herramientas electrónicas que faciliten al alumno una formación sólida y concordante con la medicina moderna, debe incluir conocimientos básicos y otros como bioinformática, medicina celular, molecular y genómica. Se ha demostrado en los países altamente industrializados cómo la investigación ha sido esencial para el desarrollo de la especialidad de radiología e imagen; el concepto de medicina traslacional cada vez tiene más presencia ya que permite que los resultados de la investigación biomédica y preclínica puedan ser trasladados hacia la práctica de la radiología clínica moderna;23 por ello también es fundamental fortalecer la investigación biomédica en la especialidad de radiología e imagen que en México actualmente es escasa. Hace varios años el entonces director de los institutos de salud de Estados Unidos, el radiólogo Zerhouini,24 consideraba que la investigación haría que en el futuro próximo la medicina fuera predictiva, preventiva, personalizada y participativa, la denominó medicina P4. Medicina predictiva porque existen importantes diferencias entre los individuos que los hacen tener distinta sensibilidad a desarrollar enfermedades; por ejemplo, es bien conocido que fumar puede hacer daño, sin embargo la mayoría de los fumadores no desarrollarán enfisema ni cáncer pulmonar; lo mismo puede decirse de individuos con niveles altos de colesterol, cifras que han demostrado ser un factor de riesgo para enfermedad cardiovascular severa, sin embargo, muchos pacientes que lo tienen alto no sufren un infarto, seguramente lo anterior será previsible por pruebas diagnósticas de genética, en donde la imagen molecular tendrá una amplia participación. Medicina preventiva. En este sentido tenemos el ejemplo de la mamografía de escrutinio que ha influido de forma importante en la detección temprana del cáncer mamario, pero también otros métodos de imagen contribuyen en la medicina preventiva, muchos son de revisión médica (check up), por ejemplo radiografías de tórax, ultrasonido de próstata o de órganos genitales femeninos. 5 Anales de Radiología México Medicina personalizada. Es un nuevo concepto que se fundamenta también en las diferencias genéticas del individuo. Se ha estudiado que la manifestación de una enfermedad puede variar de persona a persona y se ha podido demostrar que algunos tipos de cáncer de mama, en algunas pacientes, no progresan a una etapa agresiva; inclusive han sido llamadas seudoenfermedades.25 En cambio, en otras, los tumores se activan y evolucionan en forma muy rápida a estadios avanzados, por ello será de mucha importancia el conocer los códigos genéticos que apoyarán el diagnóstico temprano de la enfermedad y además permitirán prever la evolución que tendrá. Medicina participativa. La globalización y el acceso a numerosas fuentes médicas escritas y electrónicas como el internet han demostrado que el paciente tiene más conocimiento de sus enfermedades, sus formas de diagnóstico y de sus tratamientos, pero también de los riesgos que pueden tener y de alternativas que existen para el manejo de su padecimiento, por ello se interesan y demandan una mayor participación en las decisiones médicas. La medicina P4 se fundamenta en la demostración de cambios estructurales, celulares o subcelulares, así como de alteraciones de procesos fisiológicos dentro de la llamada imagen molecular. Los estudios de imagen permiten ahora (y con mayor razón en el futuro) guiar procedimientos intervencionistas para tratamientos complejos que muchas veces deben hacerse por vía intraluminal o intravascular. La imagen será espacial en 5 dimensiones, además de las 3 dimensiones conocidas se agregarán tiempo y función. Programas muy sofisticados de tipo CAD (Computed Aided Diagnosis) facilitarán al radiólogo demostrar imágenes pequeñas y difíciles de ver. Otra innovación que ya tiene amplia investigación es el tratamiento de lesiones por medio del 6 Volumen 14, Núm. 1, enero-marzo 2015 ultrasonido focalizado de alta densidad (Highintensity focused ultrasound, HIFU) utilizado especialmente para la destrucción de neoplasias focales. Los agentes teragnósticos ya mencionados han sido motivo de amplias investigaciones, son sustancias que tienen doble función: por una parte se utilizan como agentes de contraste útiles para el diagnóstico pero también tienen la cualidad de ser utilizados también como agentes terapéuticos; por lo general son introducidos como nanopartículas dirigidas a un blanco biológico en donde se van a anclar o alojar y, al activarse por ciertos tipos de energía emitidos por aparatos, primero se activan como agentes de contraste y después se transforman (por otro tipo de energía dirigida) en agentes terapéuticos, como por ejemplo partículas de óxido de hierro superparamagnético (SPIO).7,19,23 También está en desarrollo la llamada imagen óptica, capaz de medir la actividad metabólica en células cancerosas de neoplasias malignas superficiales de mama; con ella, es incluso posible demostrar subtipos celulares. Esta tecnología se basa en la observación de las alteraciones de la actividad metabólica que pueden indicar cáncer, la utilización de coenzimas marcadas que emanan fluorescencia a la exposición de ciertas formas de luz permite distinguir o diferenciar células cancerosas. También se puede demostrar de manera muy temprana la respuesta a los tratamientos.26 La radiología se está transformando progresivamente en una especialidad empresarial o corporativa debido a que es imposible financiarla en forma individual,27,28 solamente las instituciones públicas y privadas estarán en posibilidad de sufragar los altos costos de inversión y de operación; sin embargo, es necesario reconocer que estas empresas requieren de la asesoría de radiólogos competentes que puedan apoyar Editorial en que se cumplan las regulaciones sanitarias y en especial el aseguramiento de la calidad y la seguridad del departamento. Los conocimientos del radiólogo serán esenciales para la formación de otros radiólogos y para promover la investigación en la especialidad, también serán consultores de la administración para las adquisiciones más convenientes de equipo e instrumental radiológico. Las regulaciones sanitarias vigentes obligan a que las instituciones de salud públicas y privadas estén certificadas por el Consejo de Salubridad General, quien a su vez requiere que los médicos que laboran en ellas tengan la certificación correspondiente. En nuestra especialidad el Consejo Mexicano de Radiología e Imagen debe continuar como la institución responsable de certificar a los radiólogos generales, pero también a los subespecializados asegurando, con rigurosos exámenes, que tengan los conocimientos y habilidades adecuadas, para esto el consejo debe estar vinculado con los departamentos de posgrado de universidades públicas y privadas, retroalimentándose de la información necesaria para que los programas permitan formar mejores radiólogos. Los objetivos de todos los consejos (y por lo tanto los del nuestro) deben ser cumplidos con radiólogos de reconocida integridad, vinculados con la docencia y con conocimientos amplios de didáctica educativa; deben ser de preferencia profesores titulares o adjuntos. Para lo anterior es necesario que el consejo de la especialidad esté distante de los intereses personales o de que se pretenda politizarlo al asociarlo con otras instituciones con objetivos diferentes. El consejo debe estar integrado por radiólogos de reconocida integridad, vinculados con la docencia, de preferencia como profesores de cursos de posgrado o de programas de alta especialidad con reconocimiento universitario. Desde hace dos años la Secretaría de Salud, la Secretaría de Educación Pública y el Consejo Nacional de Ciencia y Tecnología establecieron el Programa Nacional de Posgrado de Calidad que permite que las especialidades médicas que cumplan con rigurosos lineamientos, se registren en este programa que asegura una mucho mayor calidad de los especialistas que egresan, es necesario que este estándar se generalice a todos los programas. La medicina corporativa o empresarial también puede ser un factor muy importante que contribuya a despersonalizar a la medicina en general y a la radiología en particular. Los médicos tratantes, ante la nueva tecnología, esperan ver la información clínica, los exámenes de laboratorio, las imágenes de endoscopia, de cirugía y las provenientes de los departamentos de radiología directamente en sus consultorios, en los monitores situados adyacentes a la cama del paciente, en sus tabletas electrónicas o computadoras portátiles.19 Es fácil comprender que esto conduce a una comunicación endeble entre radiólogos y clínicos. Para contrarrestar esta situación es necesario que los radiólogos busquen mecanismos para no perder la relación con los pacientes y con sus familiares (cuando el caso lo amerite) pero también con los médicos tratantes ya que en conjunto se otorga una medicina más integrada y beneficiosa para el paciente. El radiólogo debe tratar de conocer los datos clínicos más importantes del paciente que estudia y si es necesario analizar con el médico tratante opciones para un estudio idóneo que contribuya al diagnóstico e inclusive recomendar alternativas de tratamiento realizados, cuando sea conveniente, por el radiólogo intervencionista. Lo complejo de la medicina moderna así lo requiere y con mayor razón la del futuro. Esta comunicación entre médicos está contemplada como uno de los preceptos fundamentales del profesionalismo médico que establece que, entre otros puntos, la amplia comunicación entre médicos, pacientes y familiares permitirá una atención médica eficiente, segura y humana.29,30 7 Volumen 14, Núm. 1, enero-marzo 2015 Anales de Radiología México Este principio ha sido analizado junto con otros conceptos con mucho interés por radiólogos de reconocido prestigio, por instituciones de nuestra especialidad. En el 2012 la Sociedad de Radiología de Norteamérica (RSNA) y la Sociedad Europea de Radiología (ESR) difundieron un programa denominado Radiology Cares en el que recomiendan a los radiólogos tener una mayor interrelación con los pacientes, con los familiares, con los médicos tratantes y con el equipo de salud que atiende al paciente, recomiendan en general una atención más personalizada.30,31 El futuro de la radiología es motivo de preocupación, ya existen muchas publicaciones que lo analizan y que consideran que su práctica será un verdadero reto que involucra aspectos científicos, tecnológicos, de educación, económicos, administrativos, éticos y investigación biomédica; será un verdadero desafío lograr que los radiólogos adquieran profundos y amplios conocimientos, competencias y destrezas, todo enmarcado en una práctica médica ética, con alto sentido de profesionalismo y humanismo.17,22,29,31 Los doctores Bruce J. Hillman y Jeff C. Goldsmith, en su libro The Sorcerer’s Apprentice,19 en el capítulo del Futuro de la Imagen Médica, hacen el siguiente relato, que está resumido en esa publicación y que da una visión de lo que será nuestra especialidad en un par de décadas más: 8 Es el año 2036 una paciente aparentemente sana, de 46 años de edad, entra al Departamento de Radiología para su revisión anual. El personal a cargo de un sofisticado equipo de imagen que se llama Omniscient le aplica una mascarilla a través de la cual le suministra un gas inerte e inodoro, un agente de contraste molecular que permite evaluar el riesgo genómico de la paciente. El agente inhalado pasa al torrente sanguíneo y se adhiere a secuencias genéticas de algunos núcleos de células del cuerpo de la paciente e identifica una lesión que predispone a un tipo de cáncer de páncreas muy agresivo. Al terminar esta fase que dura alrededor de quince minutos se logra demostrar el riesgo genético de la paciente, el gas introducido se metaboliza y se excreta por la respiración. Poco después se le administra a la paciente un segundo gas que se dirige, específicamente, a la superficie de receptores de células metabólicamente hiperactivas, las imágenes que se empiezan a registrar permiten ver una lesión submilimétrica en la cola del páncreas; esta demostración se apoya por medio de un programa de un sistema muy avanzado de CAD (Computed Aided Diagnosis). El aparato Omniscient emite una serie de pulsos de radiofrecuencia dirigidos al páncreas que permiten que la lesión puntiforme sea demostrada en color rojo muy brillante que representa al tumor en una fase muy temprana. El aparato, ahora con otro tipo de energía, trasmite una energía diferente, pulsada, que es dirigida exactamente a la anormalidad demostrada; el agente de contraste molecular adherido a las células cancerosas se transforma entonces en una molécula de efecto terapéutico. A estas moléculas duales: diagnósticas y terapéuticas, se les denomina teragnósticas. La molécula desencadena la apoptosis, muerte celular programada que va a destruir específicamente las células marcadas, el tejido restante normal no es afectado. Al terminar el estudio la paciente sale curada de una enfermedad que treinta años antes se consideraba, invariablemente, fatal. Aunque esta narración es de ciencia ficción (por ahora) mucho de lo mencionado tiene sentido ya que actualmente en muchos centros con Editorial gran infraestructura tecnológica y con amplios programas de investigación en desarrollo, los radiólogos especializados ya trabajan en ese sentido. Por todo lo descrito nace una pregunta: ¿estamos seguros de que en México, en las próximas décadas, estaremos en posibilidad de afrontar estos desafíos? La respuesta es compleja, depende de muchos factores, algunos son externos como el relacionado con el desarrollo del país, pero otros son absolutamente dependientes de los radiólogos, de sus conocimientos, de su participación en la investigación, de sus destrezas y de su profesionalismo. Es necesario que en forma propositiva se vinculen los intereses y objetivos de las instituciones de radiología que existen en el país, sociedades y colegios estatales, la Sociedad Mexicana de Radiología, la Federación Mexicana de Radiología e Imagen, el Consejo Mexicano de Radiología e Imagen y también el Colegio Nacional de Médicos Especialistas en Radiología e Imagen, una radiología unida es esencial para que con altos estándares de profesionalismo y humanismo se puedan afrontar los desafíos descritos en un mundo globalizado y con una medicina con tendencias a ser empresarial. REFERENCIAS 1. McCall Iain. The future role of radiology in healthcare. European Society of Radiology. Insights into Imaging, Enero 2010. 2. Dena Espinoza EJ, Rodríguez Nava P y cols. Capítulo: Imagen Molecular. Medios de Contraste e Imagen Molecular, Ciudad de México: Trillas 2012. 3. Rupert K et al. Exploring lung function with hyperpolarized 129-Xe magnetic resonance. Magn Reson Med J 2004;51:676-686. 4. 5. Hamoui N. Gates Lb, González J. Radioembolization of renal cell carcinoma using Ytrium 90 microespheras. J of Vascular and Interv. Radiology 2013;24:298-300. Paño BB, Sebastia CC. Metastatic Renal cell carcinoma: radiologic findings and assessment of response to targeted antiangiogenic therapy using multidetector CT. Radiographics 2013;33:1691-1716. 6. Fabien Emmetiere, Chistopher Irwin, Thomas Reiner. FLabeled-Bioorthogonal Liposomes for in vivo targeting. Bioconjugate Chem 2013;24:1784-1789. 7. Islam T. Joseph S. Current state and future applications of active targeting in malignancies using super paramagnetics ion oxide nanoparticles. Cancer Blomark 2009;5:99107. 8. John M. Hoffman and Sanjiv S. Gambhir. Molecular Imaging: The vision and opportunity for radiology in the future. Radiology 2007;244:39-47. 9. Smith GS, Thrall JH. Subespecialization in radiology and radiooncology. J Am Colleg 2009;23:203-211. 10. Liebscher L, Sheram C. The General Radiologist in the 21st Century. J Am Coll Radiol 2012;9:554-559. 11. Levin GD. Turf wars in radiology: updated evidence on the relationship between self-referral and the over utilization of imaging. J Am Coll of Radiol 2008;5(7):806-810. 12. Keats TE, Anderson MW. Atlas of Normal Variants that may simulate disease. Ed. Mosby 9th Edition. Saunders 2013. 13. Gary M. Glazer, Julie A. Ruiz-Wibbelsmann. The invisible radiologist. Radiology 2011;258:18-22. 14. Douglas Maynard. Radiologists: Physicians or expert image interpreters? Radiology 2008;248:(2)333-336. 15. Krestin A. Commoditization in Radiology: threat or opportunity. Radiology 2008;248:333-336. 16. Ramírez-Arias, JL, Ocampo Lujano, R, Rodríguez Weber, F. Profesionalismo en medicina. Acta Médica Grupo Ángeles 2008;6:133-137. 17. Bruce J. Hillman. Ethical Radiologic Practice. J Am Coll Rad 2011;8(12):818. 18. Programa Único de Especialidades Médicas de Imagenología Diagnóstica y Terapéutica 2009. División de Postrado, Facultad de Medicina. UNAM. 19. Hillman J. Bruce Goldsmith CJ. The Sorcerer’s Apprentice. How Medical Imaging is Changing Healthcare. Ed. Oxford 2011:197-229. 20. Ronald Arenson, N. Reed Dunnick. Training a Better Radiologist. Journal of the American College Radiology 2006;3(5)389-393. 21. Laret MR. Academic Medicine in the 21st Century. J Am Intern Med 2013;173(18):1739-1741. 22. Collins J. Education Techniques for Life long learning. Radiographics 2004;24:1483-1489. 23. Hillman BJ, Neiman HL. Translating molecular imaging research into radiological practice-proceedings. Am College of Radiol. Colloquium. Radiology 2002;222:19-24. 24. Zerhouni EA. Major trends in the imaging sciences. 2007 Eugene P Pendergrass. New Horizons Lecture. Radiology 2008;249:403-409. 25. Wegwarth O. Giserenzer G. Overdiagnosis and overtreatment. Disponible en: www.diagnosticimaging.com/ practice/management/patientsaware of overdiagnosis. 9 Anales de Radiología México 26. Herranz M, Ruibal A. Optical imaging in breast cancer diagnosis. The next evolution. J of Oncology 2012; Art. ID 863 747. 27. Otero HJ, Rybicki EJ. Twenty years of cost effectiveness analysis in medical imaging, are we improving? Radiology 2008;249:917-924. 28. Hoffman JM. Regulatory and reinbursement challenges of molecular imaging. Radiology 2007;245:645-660. 29. Brant-Zawadzki MN. Radiologists Urged to Make Service Personal and Patient-Centered. Disponible en: http://www. 10 Volumen 14, Núm. 1, enero-marzo 2015 rsna.org/Publications/rsnanews/March-2008/urged_feature.cfm 30. Brant-Zawadzki MN. Patient centered Radiology, use it or lose it. Academic Radiology 2009;16(5):521-523. 31. Saurabh Jha, William Boonn. Patient-Centered Imaging: Opportunities and Challenges. J Am Coll Rad 2012;9(3):157-159. Ramírez Arias JL Director Médico Hospital Ángeles Pedregal. Artículo original Anales de Radiología México 2015;14:11-19. Método para incrementar la sensibilidad diagnóstica del gammagrama óseo RESUMEN Jaramillo-Núñez A1 Gómez-Conde JC2 1 Investigador adscrito a la Coordinación de Óptica en el Instituto Nacional de Astrofísica, Óptica y Electrónica. 2 Estudiante de doctorado adscrito a la Fac. de Ciencias Físico-Matemáticas (posgrado en Física aplicada) de la Benemérita Universidad Autónoma de Puebla. Introducción: cuando se interpretan gammagramas óseos a veces es difícil dar un diagnóstico acertado, principalmente cuando se trata de diferenciar si la acumulación de marcador se debe a una inflamación, una infección o una metástasis ósea en etapa temprana. En este trabajo se muestra cómo, mediante programas informáticos, se mejora sustancialmente la visualización de los gammagramas óseos; de tal manera que es posible observar zonas de acumulación de marcador que no corresponden a metástasis. Objetivo: ayudar a disminuir el número de falsos positivos que se producen al analizar gammagramas óseos e incrementar su sensibilidad diagnóstica. Material y métodos: se analizaron 11 gammagramas óseos obtenidos de igual número de hombres con problemas de cáncer de próstata, con edades de entre 23 y 87 años. Para visualizar mejor los gammagramas digitalizados se les aplicó un filtro Gaussiano, antes de realizar el análisis, que redujo sustancialmente el ruido de la imagen. Posteriormente se analizaron los tonos de gris de los huesos, en los gammagramas tanto anteriores como posteriores, y con los valores obtenidos se construyeron unas tablas. En particular se analizaron detalladamente los valores obtenidos para el cráneo. Discusión: los resultados obtenidos sugieren que sí es posible diferenciar la metástasis de otras enfermedades óseas; sin embargo, para que la técnica sea eficiente en la búsqueda de cambios degenerativos, infecciones y fracturas, es necesario implementar un programa que realice las tareas requeridas automáticamente pues, tal y como realizamos este trabajo, se consume mucho tiempo. Conclusión: el valor de los tonos de gris de la imagen son función del estado de salud del hueso: valores del orden de 15 corresponden a un hueso sano para los casos analizados, mientras que valores mayores a 20 indican que el paciente padece alguna enfermedad ósea. Consideramos que tanto el valor máximo y mínimo de los tonos de gris, así como la distribución de los pixeles con los tonos incrementados, son indispensables para determinar el tipo de enfermedad ósea que se observa en el gammagrama. Palabras clave: gammagrama óseo, neoplasias, metástasis. Recibido: 14 de marzo, 2014 Aceptado: 4 de noviembre, 2014 Method to increase diagnostic sensitivity of bone scans ABSTRACT Introduction: When interpreting bone scans, at times it can be difficult to reach an accurate diagnosis, mainly when seeking to distinguish www.nietoeditores.com.mx Correspondencia: Alberto Jaramillo-Núñez ajaramil@inaoep.mx Este artículo debe citarse como Jaramillo-Núñez A, Gómez-Conde JC. Método para incrementar la sensibilidad diagnóstica del gammagrama óseo. Anales de Radiología México 2015;14:11-19. 11 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 marker accumulation is due to inflammation, infection, or early stage bone metastasis. This article shows how using computer programs substantially improves viewing of bone scans, allowing us to observe areas of marker accumulation which do not correspond to metastasis. Objective: Help reduce the number of false positives obtained when analyzing bone scans and increase their diagnostic sensitivity. Material and methods: We analyzed 11 bone scans taken from an equal number of men with problems of prostate cancer, between 23 and 87 years of age. To better view the digitalized bone scans, a Gaussian filter was applied before the analysis, which substantially reduced image noise. Then shades of gray in the bones were analyzed, in both anterior and posterior bone scans, and tables were constructed with the values obtained. In particular the values obtained for the skull were analyzed in detail. Discussion: The results obtained suggest that it is possible to differentiate metastasis from other bone disease; however, for the technique to be efficient in searching for degenerative changes, infections, and fractures, a program needs to be implemented which performs the required tasks automatically given that, as currently performed, the process is very time consuming. Conclusion: The value of the shades of gray in the image are a function of the state of bone health: values on the order of 15 correspond to healthy bone for the cases analyzed, whereas values above 20 indicate that the patient has bone disease. We consider both the maximum and minimum values of shades of gray and the distribution of pixels with enhanced shades indispensable to determine the type of bone disease observed in a scan. Key words: Bone gammagraphy, neoplasms, metastasis. INTRODUCCIÓN La gammagrafía ósea es la modalidad de imagen más común empleada para evaluar la dispersión metastásica del cáncer a hueso. Para cáncer de mama los datos publicados han variado en términos de sensibilidad y especificidad. La sensibilidad ha sido reportada en el rango de 62 a 100% y la especificidad de 72 a 100%.1,2 Cambios degenerativos, infecciones y fracturas pueden producir un falso positivo, lo que disminuye la eficiencia de este tipo de diagnóstico. Una manera de salvar el problema es empleando la técnica de gammagrafía de orificio3 (pinhole scintigraphy) con la que se tiene una mayor resolución. 12 Generalmente, los tonos de gris de la imagen del gammagrama son bajos, lo que origina que el contraste sea inadecuado para su análisis visual. Esto se debe principalmente a que los tonos de gris más altos corresponden a la zona de la vejiga o al lugar donde se inyecto el marcador, llegando incluso a tener el valor 1 000. Este inconveniente y la actividad osteoblástica que se puede dar debido no precisamente a una metástasis hacen que, en ocasiones, sea difícil diferenciar cuándo se trata de una metástasis y cuándo de alguna otra anormalidad. En este trabajo se muestra una técnica que consiste principalmente en analizar los valores de Jaramillo-Núñez A y Gómez-Conde JC. Sensibilidad diagnóstica del gammagrama óseo los tonos de gris de la imagen del gammagrama óseo digitalizado y que ayuda a incrementar la eficiencia del mismo. Para hallar otras anomalías óseas diferentes a la metástasis se recurre al análisis de la imagen por zonas, de tal manera que es posible observarlas. La técnica está basada en la suposición de que en un sistema óseo sano no hay absorción del marcador radioactivo y por consiguiente todo el sistema óseo deberá tener aproximadamente el mismo valor de tono de gris (el cual llamaremos tono de gris máximo ideal). Ya que lo que capta la cámara gamma es la presencia de marcador en los huesos al no haberlo todo el sistema óseo debería mostrar la misma intensidad o valor de píxel. Cualquier incremento apreciable, por pequeño que sea, respecto al tono de gris máximo ideal, será indicativo de que algo anda mal. A B MATERIALES Y MÉTODOS Se analizaron 11 gammagramas óseos obtenidos de igual número de hombres con problemas de cáncer de próstata, con edades entre 23 y 87 años (promedio 55 años). Para visualizar mejor los gammagramas digitalizados lo primero que se hizo fue aplicarles un filtro gaussiano,4,5 lo que redujo el ruido (Figura 1a-b). Posteriormente se analizaron los tonos de gris de los 11 gammagramas digitalizados, tanto anteriores como posteriores, y con los valores obtenidos se construyeron unas tablas que son las que se analizan. En particular se analizan detalladamente los valores obtenidos para el cráneo. El conocimiento de los tonos de gris es útil, entre otras cosas, para dar seguimiento al avance de una metástasis. Sin embargo, el objetivo principal de este trabajo es mostrar un método que sirva para hallar anormalidades en el sistema óseo, diferentes a una metástasis, y no para dar seguimiento al avance de una metástasis o la eficiencia de la aplicación de una terapia o fármaco. Para ello se despliegan las imágenes Figura 1. Comparación de imágenes: A) antes de aplicar el filtro y B) después de aplicar el filtro. usando el siguiente criterio: se elige un par de huesos, por ejemplo el fémur, y mediante un programa de cómputo se van “apagando” los píxeles de la imagen; es decir, se van poniendo a cero los pixeles de la imagen que estén abajo de un cierto umbral, elegido con base en el tono de gris diferente de cero más bajo hallado en la imagen. Después, el umbral se va incrementando en una unidad hasta que ambos huesos se apagan casi simultáneamente en caso de estar sanos. Si uno de los huesos se apaga antes que el otro, indicara que hay una anormalidad que deberá ser determinada con ayuda de registros clínicos, otros exámenes o la experiencia de 13 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 quien interpreta el gammagrama. A este método lo hemos llamado método de comparación. RESULTADOS Los valores que se muestran en el Cuadro 1 corresponden a los datos generales de los once casos analizados. En la primera columna se encuentra el número de paciente cuyo gammagrama se analiza y que será el mismo para todos los cuadros. En la segunda columna se encuentra la edad del paciente. En la tercera está el valor máximo del tono de gris hallado en el gammagrama anterior y, en la última, se encuentra el valor máximo hallado en el gammagrama posterior. Nótese que en este caso los valores de las dos últimas columnas coinciden. En el Cuadro 2 están los valores máximos hallados en la parte sana del hueso que se menciona en el primer renglón de cada columna y que corresponden al gammagrama anterior. Para el caso en que se tenía un hueso con cierta anormalidad, el área que la contiene no es considerada para buscar el máximo. En todas las columnas hay un valor menor o igual a veinte, con excepción de la columna titulada pelvis. Calculando el promedio de los tonos más bajos de cada columna Cuadro 1. Datos generales de los once casos a analizar Número de Edad paciente 1 2 3 4 5 6 7 8 9 10 11 14 87 57 60 58 47 41 23 79 66 83 62 Valor máximo del gammagrama anterior Valor máximo del gammagrama posterior 447 157 1000 271 152 376 1000 151 1000 1000 183 447 157 1000 271 152 376 1000 151 1000 1000 183 (no se considera la repetición) encontramos que obtenemos 15. Este número podría ser un buen candidato para ser considerado, en este trabajo, como el valor inicial para el umbral en el caso de que el hueso esté sano. En el Cuadro 3 se enlistan los valores obtenidos para el gammagrama posterior. Nuevamente todas las columnas tienen al menos un valor mínimo menor o igual a 20, excepto la columna de la pelvis, tal como ocurrió en el Cuadro 2. El promedio de los valores mínimos da 14.5, casi el mismo que el del Cuadro 2. Nótese ahora que son muy pocos los valores que se repiten por columna en ambos cuadros. De los datos mostrados en los dos cuadros anteriores el sentido común nos diría que para las columnas con los mismos nombres los valores deberían ser los mismos o casi iguales. Sin embargo no es así, y lo más que podemos ver es que para columnas iguales sus valores oscilan alrededor de cierto rango de tonos de gris. Por ejemplo, en el caso del húmero los valores oscilan entre 11 y 34 en el Cuadro 2 con un valor promedio de 18 y de 9 a 28 en el Cuadro 3, con valor promedio de 17.5. La pregunta de por qué los valores son diferentes no se puede contestar analizando los datos de los cuadros tal y como están. Para ello se elegirá un caso particular que corresponde a la columna del cráneo. En el Cuadro 4 las columnas 2 y 4 contienen los mismos valores de las columnas tituladas “cráneo” de los Cuadros 2 y 3, respectivamente. En las columnas 1 y 3 están los valores mínimos hallados únicamente dentro de la imagen del cráneo para los casos de los gammagramas anterior y posterior. Se ha agregado otra columna titulada “Observaciones” donde se menciona de manera breve lo que se hallo en la imagen. Cómo se puede observar, los valores mínimos y máximos aumentan según sea el estado de salud del cráneo, haciendo que no sean iguales. Jaramillo-Núñez A y Gómez-Conde JC. Sensibilidad diagnóstica del gammagrama óseo Cuadro 2. Valores de los tonos de gris de los huesos del gammagrama anterior Paciente pié tibia rodilla fémur pelvis costillas húmero hombro cráneo 1 2 3 4 5 6 7 8 9 10 11 24 19 52 31 28 24 65 23 30 43 52 21 23 25 13 13 23 23 33 26 37 43 30 33 53 21 15 56 48 38 40 52 52 19 27 19 11 13 25 17 29 38 40 38 40 32 41 23 27 60 44 52 70 60 41 27 23 23 18 19 50 33 40 65 57 42 17 16 15 12 11 27 17 24 34 32 25 35 27 31 20 20 35 45 43 44 60 50 16 21 26 28 23 40 40 41 55 57 57 Cuadro 3. Valores de los tonos de gris de los huesos del gammagrama posterior Paciente pié tibia rodilla fémur pelvis costillas húmero hombro cráneo 1 2 3 4 5 6 7 8 9 10 11 22 20 43 46 22 22 70 23 27 38 49 16 19 18 22 22 27 27 28 15 16 16 14 26 26 24 13 45 34 27 36 42 42 12 19 16 29 32 29 31 13 17 12 13 9 21 14 18 28 27 22 25 29 20 25 10 16 14 24 23 28 27 45 28 30 25 33 50 39 36 60 65 40 14 23 23 27 22 40 33 40 55 51 57 Cuadro 4. Valores mínimos y máximos de los tonos de gris y diagnósticos clínicos hallados dentro del cráneo de los gammagramas anterior y posterior Paciente 1 1 2 3 4 5 6 7 8 9 10 11 5 9 9 7 6 14 17 21 23 26 25 2 3 4 Observaciones 16 21 26 28 23 40 40 41 55 57 57 6 9 9 7 9 12 15 13 23 26 28 14 23 23 27 22 40 33 40 55 51 57 Sano Una metástasis temprana Una metástasis temprana Una metástasis temprana Dos metástasis tempranas Dos metástasis Dos metástasis Tres metástasis Más de tres metástasis Una anormalidad Una metástasis y una anormalidad 18 19 42 30 38 70 55 45 16 35 34 33 40 55 50 Para el caso de las anormalidades no fue posible dar un diagnóstico debido a falta de información clínica (Figura 2). Por ejemplo, podemos ver en la Figura 2 que la mayor parte del cráneo se ha apagado, mientras que en la parte superior hay una zona “prendida” que no corresponde propiamente a una metástasis ya que en caso de que lo fuera los tonos de gris estarían concentrados en una zona más pequeña. La columna 2 del Cuadro 4 tiene sus tonos de gris en el rango 16-57 y esto es ocasionado por el estado de salud del hueso. Esto mismo es lo que sucede con los valores de las demás columnas de los cuadros 2 y 3. Es decir, los valores mostra- 15 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 del umbral sucede que los píxeles de la imagen se van apagando, es decir, se van poniendo a cero de una manera casi homogénea, entonces diremos que tenemos el caso en el que ambos huesos están sanos, tal como se muestra en la Figura 4. En el caso mostrado la imagen se apagó completamente al usar el valor 15. Figura 2. Imagen que muestra lo que consideramos una anormalidad. dos en las columnas dependen fuertemente del estado de salud del hueso y como sólo uno fue considerado como es por eso fluctúan. La Figura 3 muestra una sección de un gammagrama anterior que corresponde a la tibia. Se elige un valor umbral, por ejemplo el valor 15 que es el valor ideal que se halló. Si la imagen se pone toda negra el valor se disminuye en una unidad pero si no pasa nada entonces se incrementa una unidad. Si al ir incrementando el valor Figura 3. Huesos fémur de ambas piernas considerados sanos. 16 Ahora analicemos el caso de la Figura 5 donde se muestra una sección de un gammagrama anterior y supongamos que empezamos con un umbral igual a 25. Al ir incrementando el umbral en una unidad llegaremos a cierto valor tal que se obtiene la imagen mostrada en la Figura 6 donde una de las extremidades casi se ha apagado mientras que la otra aún tiene píxeles iluminados. Este sería un ejemplo clásico donde se tiene una anormalidad ósea, ya que la distribución que mantienen los píxeles iluminados no corresponde con la de una metástasis. El mismo comportamiento se observa en las Figuras 7 y 8, sólo que ahora es para el caso de las rodillas. Figura 4. Cuando el hueso está sano los píxeles se van apagando casi de manera homogénea a medida que se incrementa el valor umbral. Jaramillo-Núñez A y Gómez-Conde JC. Sensibilidad diagnóstica del gammagrama óseo Si los casos mostrados en las Figuras 5 y 7 se trataran de analizar observando el gammagrama completo seguramente sería difícil hallar las diferencias que se están mostrando en las Figuras 6 y 8 pues la diferencia en tonos de gris es de 15 y 3 unidades, respectivamente. Hay que resaltar el caso de la Figura 8 donde la forma de la distribución nos muestra la forma de la zona enferma. En el caso de observar el gammagrama completo, y suponiendo que su máximo es 500, una diferencia de 3 tonos, como es el caso mostrado en las Figuras 7 y 8, pasaría desapercibida para el ojo humano ya que cuando la información se despliega en un monitor ambas rodillas se iluminan con el mismo tono de gris, de ahí que la lesión sea casi imperceptible. Figura 5. Gammagrama anterior que muestra la tibia del paciente 11 del Cuadro 1. DISCUSIÓN En el cáncer, las metástasis óseas son una complicación común y severa de la enfermedad avanzada y pueden ser de tipo osteolítico, osteoblástico o una combinación de ambos.6,7 Figura 6. Imagen 5 después de apagar los píxeles de la pierna izquierda. Nuevamente, los píxeles correspondientes a la rodilla derecha están casi todos apagados mientras que el lado izquierdo aún tiene algunos píxeles prendidos. Figura 7. Gammagrama anterior que muestra unas rodillas. 17 Anales de Radiología México Figura 8. Imagen 7 después de apagar los píxeles de la pierna derecha. Una de las modalidades de imagen más común empleada para evaluar la dispersión metastásica del cáncer a hueso es la gammagrafía ósea. Aunque su sensibilidad y su especificidad son bastante altas, en ocasiones su eficiencia puede disminuir, en particular cuando se trata de diferenciar anormalidades como cambios degenerativos, infecciones y fracturas. Con la llegada de la gammagrafía de orificio3 el problema quedó resuelto ya que con esta modalidad se obtiene una mayor resolución; el único problema es que es necesario hallar antes la zona que se desea analizar empleando otro método. Esta técnica no es la única que puede ayudar a resolver el problema, se pueden usar otras modalidades como tomografía simple, por emisión de positrones, resonancia magnética7 o combinaciones de ellas. Debido a que los tonos de gris de la imagen digital del gammagrama son bajos en ocasiones es difícil analizarlos visualmente, en particular cuando se trata de diagnosticar enfermedades diferentes a una metástasis, pues el contraste es 18 Volumen 14, Núm. 1, enero-marzo 2015 inadecuado. Una manera de mejorar la imagen es usando técnicas de procesado digital de imágenes.4,5 Durante el desarrollo del trabajo se uso una técnica cuyo resultado es equivalente a una de las técnicas de procesado digital de imágenes empleadas con mucho éxito en el área médica8,9 y que es el método de sustracción de imágenes.10 En nuestro caso, aún cuando no se realizó prácticamente la resta de dos imágenes, tal como lo especifica el método, los resultados son equivalentes. Esto se debe a que en el método de comparación se van apagando los píxeles cuyo valor es igual o menor al umbral, lo cual es equivalente a realizar una resta de imágenes tono a tono y no píxel a píxel, como se hace en el método de sustracción de imágenes, hasta que quedan los píxeles que tienen un valor diferente respecto al otro hueso que se compara. En la literatura se puede hallar un método con resultados similares a los aquí reportados, sólo que para ello es necesario usar dos gammagramas obtenidos con dos marcadores radioactivos diferentes11 y posteriormente realizar la resta de imágenes, lo que de cierta manera es perjudicial para la salud del paciente y además encarece el estudio. Aún cuando los resultados del método son alentadores en la búsqueda de enfermedades diferentes a la metástasis, estamos lejos de obtener resultados comparables con la gamagrafía de orificio ya que en nuestro caso no mejoramos la resolución sino, únicamente, la visualización de la imagen. Pero la ventaja del método consiste en que se usa un gammagrama tradicional que es más barato y no se requiere de un examen adicional para hallar la zona a analizar sino invertir más tiempo en el análisis del gammagrama. CONCLUSIONES El resultado más interesante del análisis es que los tonos de gris mínimo y máximo correspondientes a un cráneo sano se incrementan lentamente a medida que su estado de salud se Jaramillo-Núñez A y Gómez-Conde JC. Sensibilidad diagnóstica del gammagrama óseo deteriora. Se requiere evaluar más gammagramas de casos sanos para determinar el tono de gris mínimo ideal; consideramos en este momento que es 5 y el máximo ideal del orden de 15. Es posible que éstos valores dependan del tipo de máquina donde se realicen los gammagramas por lo que la búsqueda debe ser individual, es decir, por cámara gamma. Para que el método sea eficiente en la búsqueda de cambios degenerativos, infecciones y fracturas, es necesario realizar tanto la búsqueda de los tonos de gris mínimos y máximos de la zona a analizar cómo el método de comparación (proceso de ir apagando los píxeles). Para ello es necesario implementar un programa que realice la búsqueda de los tonos de gris por hueso, tal como se hizo con el cráneo, ya que como vimos los tonos están relacionados principalmente con la salud del hueso más que con la edad del paciente o el máximo del gammagrama, el cual está relacionado directamente con la cantidad de marcador administrado al paciente o el tiempo de exposición de la cámara gamma. La distribución de los píxeles prendidos obtenida después de aplicar el método de comparación, así como los tonos de gris mínimo y máximo de la imagen, son esenciales para determinar el tipo de enfermedad ósea observada, incrementando así la eficiencia del gammagrama. Para incrementar la sensibilidad y especificidad del gammagrama es recomendable, además de realizar la observación visual, realizar un escaneo por secciones de la imagen empleando el programa que normalmente traen las cámaras gamma dónde se realizan este tipo de estudios, ya que como se mostró esta técnica puede ayudar en la búsqueda de otras enfermedades óseas. Como complemento se sugiere analizar también los valores de los tonos de gris de las secciones elegidas de la imagen, ya que con esto se podría llegar incluso a hallar una metástasis en etapa temprana, aunque esto no se confirmará hasta que no se realice un análisis exhaustivo con una muestra mayor de pacientes. La búsqueda en modo manual consume tiempo, alrededor de 10 minutos, lo cual constituye una desventaja por el momento pero si se emplea un programa que realice la búsqueda automáticamente este problema quedará resuelto. REFERENCIAS 1. Baert AL, Encyclopedia of diagnostic imaging, First ed. Berlin: Springer-Verlag, 2008. 2. Canon CL, Radiology, First ed. New York: Mc Graw Hill Medical, 2010. 3. Yong-Whee B. Combined scintigraphy and radiographic diagnosis of bone and joint diseases, Fourth ed. Berlin: Springer-Verlag, 2013. 4. Gonzalez RC, Woods RE, Eddins SL. Digital Image Processing Using Matlab, Sec. ed, Gatesmark: Tata McGraw-Hill, 2010. 5. Gonzalez RC, Woods RE. Digital image processing. First ed. Wilmington: Addison-Wesley, 1992. 6. Singh A, Rabani SA. Bone metastasis: experimental and clinical therapeutics, First ed. New Jersey: Humana Press, 2004. 7. Heymann D. Bone Cancer: progression and therapeutic approaches. First ed. London: Academic Press, 2010. 8. Brunotte F, Prieur G, Hueber A, Hennequin L, Walker PM, Gilgenkrantz JM. Improved subtraction technique in intravenous ventriculography: comparison with radionuclide studies. International Journal of cardiology 1990;28(2):237243. 9. Harvey L, Moses WJ, J Fisher, I Tamari, JS Borer. Diagnostic accuracy of coronary angiography utilizing computer-based digital subtraction methods. Chest 1986;90(6):793-797. 10. Schalkoff RJ. Digital image processing and computer visión. First ed. New York: John Wiley and Sons, 1989. 11. Weissman B. Imaging of arthritis and metabolic bone disease. First ed., USA, Elsevier, 2009. 19 Artículo original Anales de Radiología México 2015;14:20-30. El divertículo de Meckel en adultos RESUMEN Antecedente: el divertículo de Meckel es la anomalía congénita más común del tracto gastrointestinal. Es un verdadero divertículo ya que contiene todas las capas de la pared intestinal. Por lo general es asintomático y se detecta de manera incidental en pruebas de diagnóstico por imagen. Tiene riesgo de 2 a 40% de complicaciones y las más comunes son hemorragia, obstrucción intestinal y diverticulitis. Objetivo: mostrar las diferentes formas de presentación clínica del divertículo de Meckel a partir de nuestra experiencia basada en casos evaluados con ultrasonido y tomografía computada, con énfasis en la utilidad de las reconstrucciones multiplanares. Material y métodos: presentamos una serie de casos, del Hospital Central Militar, con síndrome doloroso abdominal agudo además de síndrome de obstrucción intestinal. Resultados: en los 7 pacientes estudiados, identificados con divertículo de Meckel, hubo una clara predominancia del sexo masculino: 5 casos (72%) del sexo masculino y sólo 2 (28%) del sexo femenino. En 4 (57%) casos se identificó diverticulitis de Meckel por tomografía computada y en 1 (14%) invaginación intestinal del divertículo de Meckel. En nuestro universo, pacientes con más de 40 años de edad, el riesgo de que el divertículo de Meckel originara una complicación fue de 57%. Motta-Ramírez GA1 Reyes-Méndez E2 Campos-Torres J2 García-Ruiz A3 Rivera-Méndez VM4 García-Castellanos JA5 Aragón-Flores M6 Médico Radiólogo, adscrito a la subsección de Tomografía Computada del Departamento de Radiación Ionizante. 2 Médico residente de tercer año del curso de Especialización y Residencia en Radiodiagnóstico, Escuela Militar de Graduados de Sanidad. 3 Médico Cirujano del Departamento de Cirugía General. 4 Médico residente de tercer año del curso de Especialización y Residencia en Cirugía General, Escuela Militar de Graduados de Sanidad. 5 Médico residente de segundo año del curso de Especialización y Residencia en Cirugía General, Escuela Militar de Graduados de Sanidad. 6 Médico Anatomopatólogo, Jefe del Depto. de Anatomía Patológica. Hospital Central Militar, Secretaría de la Defensa Nacional, Blvd. Manuel Ávila Camacho S/N Lomas de Sotelo, Miguel Hidalgo, 11200 Ciudad de México, Distrito Federal. 55573100, extensiones 1406 y 1928; 53951778. 1 Conclusiones: dada la baja incidencia en la población general y ante el hecho de que esta condición puede ser enmascarada por signos y síntomas de otras situaciones más comunes, a pesar de un buen índice de sospecha y a pesar del avance en los métodos diagnósticos, el aforismo expresado por el doctor Mayo en 1933 sigue siendo vigente: “El divertículo de Meckel es frecuentemente sospechado, casi siempre buscado y raramente encontrado”. Esta condición nos hace reconocer la necesidad de tener siempre una mente abierta, centrada en el diagnóstico diferencial y sin olvidar entidades como la que nos ocupa con sus complicaciones asociadas. Palabras clave: divertículo de Meckel, tomografía computada, obstrucción intestinal. Recibido: 24 de septiembre, 2014 Meckel’s diverticulum in adults Aceptado: 11 de noviembre, 2014 ABSTRACT Correspondencia: Gaspar Alberto Motta Ramírez radbody2013@yahoo.com.mx Background: Meckel’s diverticulum is the most common congenital anomaly of the gastrointestinal tract. It is a true diverticulum because it comprises all the layers of the intestinal wall. It is usually asymptomatic and is detected incidentally in image diagnostic tests. It has a 2 to 40% risk of complications, the most common of which are bleeding, intestinal blockage, and diverticulitis. 20 Este artículo debe citarse como Motta-Ramírez GA, Reyes-Méndez E, Campos-Torres J, García-Ruiz A, Rivera-Méndez VM, García-Castellanos JA et al. El divertículo de Meckel en adultos. Anales de Radiología México 2015;14:20-30. www.nietoeditores.com.mx Motta-Ramírez GA et al. Divertículo de Meckel en adultos Objective: Show the different forms of clinical manifestation of Meckel’s diverticulum from our experience based on cases evaluated with ultrasound and computed tomography, with emphasis on the usefulness of multiplane reconstructions. Material and methods: we present a series of cases, from Hospital Central Militar, with acute abdominal pain syndrome in addition to intestinal blockage syndrome. Results: in the 7 patients studied, identified with Meckel’s diverticulum, there was a clear predominance of males, with 5 cases (72%) of males and only 2 (28%) of females. Meckel’s diverticulitis was identified by computed tomography in 4 (57%) cases, with intestinal invagination of Meckel’s diverticulum in 1 (14%). In our universe, in patients over 40 years of age, the risk of Meckel’s diverticulum giving rise to complications was 57%. Conclusions: Given the low incidence in the general population and the fact that this condition may be masked by signs of symptoms of other, more common conditions, despite a high degree of suspicion and advances in diagnostic methods, the aphorism expressed by Doctor Mayo in 1933 still applied today: “Meckel’s diverticulum is often suspected, almost always looked for, and rarely found”. This condition leads us to recognize the need to always keep an open mind, focus on differential diagnosis, and not overlook entities like that under consideration with their associated complications. Key words: Meckel’s diverticulum, computed tomography, intestinal blockage. INTRODUCCIÓN El divertículo de Meckel es la anomalía congénita más frecuente del tracto gastrointestinal; afecta hasta 2% de la población.1 Es un resto del primitivo conducto onfalomesentérico que en el embrión comunica al intestino con el saco vitelino.1 El divertículo de Meckel posee un riesgo de complicación que fluctúa de 4 a 6% y es más frecuente en niños que en adultos (26 a 53%). Los hombres son los más afectados con una relación de 3:1-2. La probabilidad de que un divertículo asintomático se torne sintomático y tenga complicaciones es de 4% en los menores de 20 años, disminuye a 2% a los 40 años y en pacientes de edad avanzada no hay complicaciones.2 Las características especiales que distinguen al divertículo de Meckel han llevado a algunos autores a exponer una regla que puede orientar al diagnóstico. Se trata de la “Regla del 2”: su incidencia es 2%, se localiza a 2 pies (60 cm) de la válvula íleocecal, tiene 2 (5 cm) pulgadas de largo, tiene 2 cm de diámetro, se vuelve sintomático antes de los 2 años de edad, contiene comúnmente 2 tipos de tejidos heterotópicos sobre todo (gástrico y pancreático) y es 2 veces más común en hombres que en mujeres.3 Aproximadamente en 50% de los casos contiene mucosa heterotópica, comúnmente gástrica (60%), pudiendo encontrarse tejido pancreático, mucosa yeyunal, duodenal y otros tejidos. 21 Anales de Radiología México Recuerdo anatómico4 El conducto onfalomesentérico es una estructura embrionaria que comunica al intestino medio primitivo con el saco vitelino hasta la séptima semana de vida intrauterina; luego se convierte en una delgada banda fibrosa que se desintegra en la décima semana. La resolución incompleta del conducto onfalomesentérico resulta en una variedad de anomalías como: a) fístula umbilicoileal; b) seno del conducto onfalomesentérico (umbilical); c) quiste del conducto onfalomesentérico; d) cordón fibroso y e) divertículo de Meckel, que representa 98% de todas las anormalidades del conducto onfalomesentérico.5 El primer cirujano que clasificó las diferentes variedades de divertículos intestinales fue Johann Friedrich Meckel, en 1809 describió una obliteración incompleta del conducto onfalomesentérico por lo que este divertículo lleva su nombre. El divertículo de Meckel se origina cuando el extremo ileal permanece permeable y el extremo umbilical se atrofia. Está formado por las tres capas de la pared intestinal y por lo tanto es un divertículo verdadero. No hay consenso en cuanto a la forma y el tamaño, aunque algunos autores aseguran que puede tener una longitud aproximada de 5 cm (con una variación que fluctúa de 1-10 cm) y un diámetro de 2 centímetros; hay informes en la literatura de divertículos de Meckel gigantes (≥ 5 cm) que son raros6,7 y que se asocian con formas más severas de complicación como la obstrucción. Suele localizarse en la región pélvica y en el cuadrante inferior derecho, pero también puede tener una disposición periumbilical. Su aporte sanguíneo generalmente viene dado por la arteria onfalomesentérica (un remanente de la arteria vitelina primitiva, rama ileal de la arteria mesentérica superior),8,9 por la arteria mesentérica superior o, menos frecuentemente, por la arteria ileocólica. Se localiza en el margen antimesentérico del íleon, encontrándose a 4-10 cm de la válvula 22 Volumen 14, Núm. 1, enero-marzo 2015 ileocecal, mide de 5 a 10 cm de longitud. La hemorragia es la forma de presentación más frecuente en niños menores de 2 años, ocurre por el tejido gástrico heterotópico que se ulcera y provoca sangrado. En adultos la presentación más frecuente es la obstrucción intestinal y la diverticulitis.4 Objetivo Mostrar las diferentes formas de presentación clínica del divertículo de Meckel a partir de nuestra experiencia basada en casos evaluados con ultrasonido y tomografía computada, con énfasis en la utilidad de las reconstrucciones multiplanares. MATERIAL Y MÉTODOS Con el objetivo de conocer la forma de presentación más frecuente y sus complicaciones se realizó un estudio de tipo observacional, retrospectivo y descriptivo, en el cual se revisaron los expedientes de pacientes adultos en los que se estableció el diagnóstico por imagen (en el Departamento de Radiación Ionizante, subsección de tomografía computada del Hospital) y posquirúrgico de divertículo de Meckel (en el Departamento de Cirugía General del Hospital), confirmados también por los reportes histopatológicos obtenidos por el Departamento de Anatomía Patológica del Hospital y a los que se les realizaron estudios de imagen, tomografía computada, en un período de 7 años comprendidos del 1 de enero del 2007 hasta el 1 de agosto del 2014. Criterios de inclusión: pacientes de 16 años o mayores que tuvieran como diagnóstico divertículo de Meckel, bien como sospecha clínica, con evaluación por tomografía computada y hallazgo intraoperatorio incidental con confirmación por histopatología. Se utilizaron como variables la edad, el género y el síntoma predominante. Motta-Ramírez GA et al. Divertículo de Meckel en adultos También se identificaron las complicaciones generadas por el divertículo de Meckel. intraabdominal: colección, absceso intraabdominal o ambos. RESULTADOS Todos los pacientes fueron evaluados con tomografía computada. En 2 (28%) se señaló la sospecha clínica de divertículo de Meckel que se identificó por tomografía computada pero sin correlación quirúrgica. Caso número 6 (Figuras 1a-c): en 5 de ellos (71%) se reconoció al divertículo de Meckel en la cirugía con reconocimiento retrospectivo del divertículo de Meckel y su complicación por tomografía computada, con la subsiguiente confirmación histopatológica. Se revisaron 7 expedientes clínicos de pacientes con sospecha clínica, con evaluación por tomografía computada y hallazgo intraoperatorio incidental con confirmación por histopatología de divertículo de Meckel, casos reportados del 1 de enero del 2007 hasta el 1 de agosto del 2014. Cuadro 1. Hubo un claro predominio del sexo masculino con 5 (72%) varones y sólo 2 (28%) mujeres. El rango de edad vario de 16 a 25 años en 43% (3 pacientes masculinos); de 26 a 40 años 14% (1 paciente masculino) y de entre 41 y 61 años 43% (3 pacientes, 1 hombre y 2 mujeres). De los 7 pacientes con divertículo de Meckel 5 (71%) ingresaron a urgencias por cuadro clínico de síndrome doloroso abdominal agudo, 3 (43%) de ellos, además, con síndrome de obstrucción intestinal, en 1 había sospecha de apendicitis aguda y en otro (14%) sospecha de afección De los 3 pacientes con síndrome de obstrucción intestinal, en el caso número 7 (Figuras 2a-e) se identificó invaginación intestinal del divertículo de Meckel que, consecuentemente, condicionó el síndrome de obstrucción intestinal; en este caso, en el informe de histopatología, se observaron focos de mucosa gástrica antral heterotópica. En el caso número 3, con sospecha clínica de síndrome doloroso abdominal agudo secundario a apendicitis aguda y síndrome de obstrucción intestinal, se demostró normalidad apendicu- Cuadro 1. Divertículo de Meckel Número de paciente Sexo Edad Datos clínicos Identificación por tomografía Complicación Comprobación quirúrgica 1 H 22 SxDAA, sospecha de divertículo de Meckel Sí 2 H 54 Afección intraabdominal colección/absceso Sí Diverticulitis Sí 3 H 25 Sospecha de apendicitis aguda y SOI Sí Diverticulitis Sí 4 M 48 SxDAA, SOI Sí Diverticulitis perforada Sí 5 M 61 SxDAA Sí Diverticulitis con peritonitis Sí 6 H 16 SxDAA, sospecha de divertículo de Meckel Sí 7 H 37 SxDAA, SOI Sí No No Invaginación intestinal Sí H: hombre; M: mujer; SOI: síndrome de obstrucción intestinal; SxDAA: síndrome doloroso abdominal agudo. 23 Anales de Radiología México A Volumen 14, Núm. 1, enero-marzo 2015 B C Figura 1. A-C) Caso número 6, varón de 16 años de edad con síndrome doloroso abdominal; se le realizó tomografía computada abdominopélvica que demostró líquido libre intraabdominal e imagen tubular pélvica derecha que condicionó la sospecha de divertículo de Meckel. A B D C E Figura 2. A-C) Caso número 7, hombre de 37 años de edad con síndrome doloroso abdominal y síndrome de obstrucción intestinal. Se efectuó tomografía computada abdominopélvica que corroboró la obstrucción intestinal e identificó el sitio de transición y la invaginación intestinal del divertículo de Meckel. D) Caso número 7, reconstrucción multiplanar sagital que corroboro la obstrucción intestinal e identifico el sitio de transición e invaginación intestinal del divertículo de Meckel. E) Caso número 7, pieza de resección intestinal que demuestra divertículo de Meckel, mide 5 por 2.5 cm y tiene extensa ulceración y necrosis coagulativa y licuefactiva transmural; focos de mucosa gástrica antral heterotópica. 24 Motta-Ramírez GA et al. Divertículo de Meckel en adultos lar y se identifico diverticulitis del divertículo de Meckel como el agente causal de ambos síndromes; en el tercer paciente, caso número 4 (Figuras 3a-3d), se identificó por tomografía computada diverticulitis de Meckel perforada. En el paciente número 5 (Figuras 4a-d), con síndrome doloroso abdominal agudo, se demostró A B normalidad apendicular y se identificó diverticulitis del divertículo de Meckel con peritonitis. Así, en 4 (57%) de los casos se identificó diverticulitis de Meckel por tomografía computada y en 1 (14%) invaginación intestinal del divertículo de Meckel. La probabilidad de que un divertículo asintomático se torne sintomático y tenga complicaciones es de 4% en los menores de 20 años, C D Figura 3. A-B) Caso número 4, mujer de 48 años con síndrome de obstrucción intestinal. Se efectuó tomografía computada abdominopélvica que demostró obstrucción intestinal mecánica con asas de intestino delgado a nivel del hueco pélvico, líquido libre intraabdominal e identificación de estructura tubular con nivel hidroaéreo en el hueco pélvico en estrecha relación con el sitio de transición que condicionan la sospecha de diverticulitis de Meckel. C-D) Caso número 4, tomografía computada abdominopélvica con reconstrucción multiplanar sagital que demuestra obstrucción intestinal mecánica con asas de intestino delgado a nivel del hueco pélvico, líquido libre intraabdominal e identificación de estructura tubular con nivel hidroaéreo en el hueco pélvico en estrecha relación con el sitio de transición que condicionan la sospecha de diverticulitis de Meckel. Fue sometida a laparotomía exploradora con resección intestinal que demostró, en la cara antimesentérica, divertículo de Meckel de 8 cm de longitud y de 1.5-3 cm de diámetro con diverticulitis aguda fibrinosa purulenta severa, perforada. A B C D Figura 4. A-B) Caso número 5, mujer de 61 años con síndrome doloroso abdominal. Se efectuó tomografía computada abdominopélvica que demostró al apéndice con distensión aérea sin anormalidades que consignar, con líquido libre en el hueco pélvico e imagen tubular con distensión aérea y cambios en la grasa locorregional que condicionaron la sospecha de diverticulitis de Meckel. C) Caso número 5, reconstrucción multiplanar coronal que muestra al apéndice con distensión aérea sin anormalidades, con líquido libre en el hueco pélvico e imagen tubular con distensión aérea y cambios en la grasa locorregional que condicionaron la sospecha de diverticulitis de Meckel. D) Caso número 5, laparoscopia exploradora con resección intestinal que demuestra diverticulitis de Meckel con peritonitis. 25 Anales de Radiología México disminuye a 2% a los 40 años y en pacientes de edad avanzada no hay complicaciones.2 En nuestro universo de pacientes el rango de edad vario de 16 a 25 años, 43%; 3 pacientes masculinos, 2 de ellos sin comprobación quirúrgica y que después del manejo médico del cuadro doloroso abdominal se decidió su egreso hospitalario; el caso restante (caso número 3) un hombre de 25 años tuvo a diverticulitis del divertículo de Meckel (33%). En los rangos de edad restantes, 26 a 40 años 14% (1 paciente masculino) y 41 a 61 años 43% (3 pacientes, 1 masculino, 2 femeninos) todos tuvieron complicaciones. Contrario a lo que se señala en la literatura especializada2 en pacientes de edad por arriba de los 40 años el riesgo de que el divertículo de Meckel origine una complicación en nuestro universo resulto de 57%. DISCUSIÓN Aunque la mayoría de los casos con divertículo de Meckel son asintomáticos, éste puede condicionar múltiples complicaciones. El divertículo de Meckel se presenta clínicamente con la triada de síntomas complejos como el síndrome de obstrucción intestinal, el sangrado gastrointestinal y signos clínicos de inflamación. Sin embargo diferentes manifestaciones, que entre sí se semejan varias enfermedades intraabdominales, necesitan ser consideradas durante la evaluación clínica.10 La mayoría de los pacientes con divertículo de Meckel son clínicamente silentes, asintomáticos con una prevalencia entre 1 y 3% de la población. La presentación clínica, las pruebas de laboratorio y el examen físico son inespecíficos. En menos de 10% de los casos se hace diagnóstico preoperatorio.4 La tasa de complicaciones varían según diversas series y oscilan entre 2 y 40%.1,2,9,11,12 Sin embargo, Park y Wolff12 demostraron en un estudio de 1 476 pacientes, con diagnóstico intraoperatorio 26 Volumen 14, Núm. 1, enero-marzo 2015 de divertículo de Meckel, que 16% presentaba alguna de las complicaciones que se señalan a continuación; además concluyeron que la mayoría de ellas se presentaban en hombres menores de 50 años.12 Aproximadamente 19% de los pacientes con divertículo de Meckel tiene complicaciones como la formación de litos,9,13 hernia interna al atraparse un asa intestinal normal entre el mesenterio y el mesodiverticular,14 hernia inguinal o femoral (de Littre), obstrucción15 por adherencias, obstrucción secundaria a la formación de un asa que “liderea”, como punto de obstrucción,16 obstrucción por Bezoar,17 asiento de parásitos con complicaciones como obstrucción intestinal,18 invaginación intestinal,19,20 perforación,13 hemorragia gastrointestinal,21 así como afección inflamatoria denominada ileítis del divertículo de Meckel,22 neoplasias intradiverticulares con una incidencia de 0.5 a 3.2%,23 ulceración e inflamación aguda con o sin perforación y diverticulitis. Según la literatura, la complicación más frecuente en los adultos es la obstrucción intestinal (34-53%). La obstrucción intestinal puede ser causada por los siguientes mecanismos: a) diverticulitis ocasionada por un cuerpo extraño o enterolito, b) rotación intestinal con la consiguiente obstrucción, c) persistencia de una banda fibrosa onfalomesentérica que provoca un vólvulo, d) invaginación intestinal o encarcelamiento en una hernia.4 En teoría, el rápido pasaje del contenido del intestino delgado por la zona en la que se encuentra la abertura del divertículo crea un vacío parcial dentro de éste. Al haber un proceso inflamatorio se produce un engrosamiento de las paredes y la formación de un seudopólipo, lo cual aumentaría el peristaltismo de las paredes del divertículo y empujaría gradualmente la mucosa del intestino y luego la serosa al interior del lumen intestinal. En adultos cualquier lesión en la pared intestinal que altere el peristaltismo es capaz de iniciar la invagina- Motta-Ramírez GA et al. Divertículo de Meckel en adultos ción intestinal. El peristaltismo da lugar a que un segmento proximal del intestino se introduzca en el segmento distal relajado. Cuando esto ocurre el mesenterio resulta atrapado y lleva a un ciclo de compresión vascular, edema y eventualmente necrosis isquémica de la pared intestinal.20 con tecnecio 99 en los casos de hemorragia es la técnica idónea para reconocerlos, pero es menos útil en adultos.1 Estudios de imagen Ultrasonido y tomografía computada Otra complicación de las más frecuentes es la diverticulitis de Meckel (13-31%)1 que puede producir perforación y peritonitis de forma similar a la apendicitis aguda, con la cual se confunde con frecuencia.1,11,24-26 La diverticulitis de Meckel puede originarse por el efecto del ácido producido por la mucosa gástrica ectópica sobre la mucosa intestinal adyacente; puede también deberse a obstrucción del divertículo por enterolitos que se forman en su interior, de forma similar a lo que ocurre en la apendicitis aguda. En cuanto a la etiopatogenia de los enterolitos se ha postulado que el divertículo de Meckel sin mucosa gástrica tiende a evolucionar silente durante más tiempo, lo cual da lugar a que se depositen sales cálcicas y otros minerales, favorecidas además por un entorno al contribuir a la estasis del contenido diverticular y a la formación de enterolitos. Ello explicaría por qué la detección de enterolitos es más frecuente en los adultos que en los niños. Aunque la formación de enterolitos en los divertículos de Meckel ha sido considerada una complicación rara, la bibliografía la describe desde anecdótica hasta presente en 10% de los casos. Los enterolitos suelen ser triangulares y planos y suelen tener un centro radiolucente. El ultrasonido y la tomografía computada pueden detectar los enterolitos y son más sensibles que las radiografías simples. En nuestra serie no observamos enterolitos. Otra complicación posible del divertículo de Meckel es la hemorragia. Ésta ocurre con más frecuencia en niños debido a la mayor prevalencia de mucosa gástrica ectópica. La gammagrafía Dado que la inflamación del divertículo de Meckel puede ser confundida con otros procesos inflamatorios abdominales y pélvicos, conviene conocer los hallazgos por ultrasonido y tomografía computada multidetectores27 que son útiles para realizar un diagnóstico preoperatorio. La utilización cada vez más frecuente de las técnicas de imagen (ultrasonido y tomografía computada) para la valoración del síndrome doloroso abdominal agudo en los servicios de urgencias hace indispensable el conocimiento de los hallazgos en ultrasonido o en tomografía computada de la diverticulitis de Meckel. La identificación de estos hallazgos nos hace factible el diagnóstico preoperatorio de esta rara entidad.1,27 El ultrasonido y la tomografía computada han sido considerados poco útiles para la identificación de un divertículo de Meckel no complicado debido a la dificultad para diferenciarlo del resto de asas intestinales. El divertículo de Meckel no complicado o con diverticulitis leve puede observarse como masa quística de morfología oval, tubular o en lágrima. En ocasiones pueden reconocerse capas en la pared que sugieren un origen intestinal de la masa, por lo que el diagnóstico diferencial debe hacerse con el mucocele apendicular y los quistes de duplicación. Cuando la pared no tiene capas el diagnóstico diferencial es más amplio, incluyendo también al quiste mesentérico y las masas quísticas tuboováricas. Los casos de diverticulitis, según el grado de inflamación de la pared, pueden mostrar una estructura tubular ciega, en fondo de saco con 27 Anales de Radiología México capas concéntricas que generalmente contiene líquido, aire, o material con partículas, con una pared fina (si hay poca inflamación parietal) en relación al íleon distal y según el grado de inflamación de la pared, y próxima a la pared abdominal anterior al ombligo. Si por el contrario hay inflamación de la pared, el divertículo puede aparecer como una masa con patrón de atenuación de partes blandas adyacente a un asa intestinal, con paredes engrosadas que refuerzan tras la administración de contraste intravenoso. Según el grado de inflamación de la pared, también se acompaña de afección de la grasa mesentérica como signo de peritonitis localizada.1,27 En los casos de invaginación intestinal puede visualizarse una imagen en diana. Si el divertículo está obstruido se puede ver una estructura distendida con contenido líquido conectada al ombligo.4 La administración de contraste oral en la tomografía computada, o bien con la técnica de enterografía por tomografía computada,28 facilita la identificación de la dependencia de la estructura diverticular, del divertículo de Meckel de un asa de íleon, sobre todo en los casos en que no haya obstrucción de su luz. Algunos autores desaconsejan el contraste oral porque puede entorpecer la detección de enterolitos, lo que nosotros consideramos incorrecto porque aún con el contraste oral es factible definirlos. La utilización de equipos de tomografía computada permite realizar reconstrucciones multiplanares que nos ayudan a identificar su dependencia de un asa ileal, como muestran las Figuras 2-4, y con ello realizar un diagnóstico preoperatorio de esta entidad. En la población geriátrica se identifica al divertículo de Meckel como responsable de muchas complicaciones. Ocurre frecuentemente que no se identifique en este grupo de pacientes por lo inespecífico de la sintomatología, la falta de reconocimiento de que esta anomalía puede 28 Volumen 14, Núm. 1, enero-marzo 2015 presentarse en este grupo de pacientes así como también por la sensibilidad en los exámenes diagnósticos que dependerá del protocolo utilizado.11,27 El médico radiólogo debe reconocer esta entidad, común en pacientes pediátricos, y considerar su posibilidad cuando evalúa pacientes adultos con dolor abdominal agudo o intermitente, sin causa aparente, náusea y vómito, sangrado rectal, peritonitis u obstrucción intestinal.29 Cuando el apéndice es de características normales se debe explorar toda la cavidad abdominal para excluir otros procesos inflamatorios, entre ellos la diverticulitis de Meckel.11,19,26 Si bien se señala que la diverticulitis de Meckel es la segunda complicación después la obstrucción intestinal en población adulta,19,29 en nuestra opinión (que coincide con la de Jeng-Jung Chen y sus colaboradores)30 la afección inflamatoria del divertículo de Meckel es común en adultos masculinos e indistinguible de un cuadro de apendicitis aguda que en nuestro universo de pacientes representó 57% de los casos y en los que se identificó diverticulitis de Meckel por tomografía computada. El síndrome de obstrucción intestinal es más común en mujeres que en hombres, en nuestro universo de pacientes se observó en 1 paciente (14%) y correspondió a invaginación intestinal del divertículo de Meckel. En la actualidad se considera que, en la mayoría de los casos, el hallazgo del divertículo de Meckel no siempre indica su resección a menos que existan una o más de las siguientes condiciones:5,31,32 a) cuello diverticular estrecho; b) dolor abdominal inexplicable; c) sangrado bajo en pasado reciente; d) masa palpable dentro del divertículo; e) banda fibrosa que comunique con el divertículo; f) divertículo con vaso vitelino propio y sin mesenterio que predisponga a la encarcelación. Motta-Ramírez GA et al. Divertículo de Meckel en adultos CONCLUSIONES La diverticulitis de Meckel debe ser considerada en el diagnóstico diferencial del síndrome doloroso abdominal agudo, tanto en pacientes pediátricos como en pacientes adultos. Si se identifica un proceso inflamatorio (por tomografía computada) en el abdomen inferior o en la pelvis, particularmente sobre la línea media, y si hay evidencia de obstrucción distal, es recomendable realizar una evaluación cuidadosa en la búsqueda del divertículo de Meckel. Si se identifica al apéndice normal la probabilidad del diagnóstico se incrementa. La opacificación del intestino delgado con medio de contraste oral facilita la identificación del divertículo de Meckel. Al igual que en la apendicitis aguda el divertículo inflamado muestra reforzamiento mural posterior al contraste intravenoso, a menos de que ocurran cambios por necrosis gangrenosa que modifican el patrón de reforzamiento y con ello permiten definir la anormalidad que orientara a la identificación del divertículo de Meckel y al diagnóstico de su complicación. El uso del medio de contraste oral e intravenoso ayuda a reconocer y establecer el diagnóstico de diverticulitis Meckel; siempre que sea posible deberá utilizarse en los pacientes a los que se someterá a estudio de tomografía computada por síndrome doloroso abdominal agudo. Dada su baja incidencia entre la población general y que puede ser enmascarada por signos y síntomas de otras afecciones más comunes a pesar de un buen Índice de sospecha y a pesar del avance en los métodos diagnósticos, el aforismo expresado por el doctor Mayo en 1933 sigue siendo vigente: “El divertículo de Meckel es frecuentemente sospechado, casi siempre buscado y raramente encontrado.”33 Esta entidad médica nos hace reconocer la necesidad de tener siempre una mente abierta, centrada en un diagnóstico diferencial, sin olvidar entidades como la que nos ocupa con sus complicaciones asociadas. REFERENCIAS 1. Costa S, Martínez MJ, repolles T y Delgado F. Diverticulitis de Meckel: Hallazgos en ecografia y TC. Radiología 2004;46(2):101-106. 2. Levy AD, Hobbs CM. Meckel diverticulum: Radiologic features with pathologic correlation. Radiographics 2004;24:565-587. 3. Álvarez PC, Mederos O, Trujillo ME. Morbilidad por divertículo de Meckel en adultos. Rev Cubana Cir 1987;26:199205. 4. García NR, Castrillón ME, Videla R, Cámara H, Canga C, Bustos HF. Diverticulitis de Meckel. RAR 2004;68:333-379. 5. Jenkins DD and Sylvester KG. Meckel’s Diverticulum. Operative Techniques in General Surgery 2004;6(4):307-316. 6. Miller DL, Melvin H. Becker MH, and Eng K. Giant Meckel’s diverticulum. A cause of intestinal obstruction. RadIology 1981;140:93-94. 7. Akbulut S, Yagmur Y. Giant Meckel’s diverticulum: An exceptional cause of intestinal obstruction. World J Gastrointest Surg 2014;6(3):47-50. 8. Elsayes KM, Menias CO, Harvin HJ, Francis IR. Imaging manifestations of Meckel’s diverticulum. AJR 2007;189(1):81-88. 9. Corrales Pinzón R, Grisales Loaiza LF, Santos Mónton C, González de la Huebra-Labrador T. Obstrucción intestinal secundaria a diverticulitis de Meckel por enterolito: descripción de un caso. Rev Méd Risaralda 2014;20(1):50-52. 10. Brown CK, Olshaker JS. Meckel’s Diverticulum. Am J Emerg Med 1988;6:157-164. 11. Bennett GL, Birnbaum BA, Balthazar EJ. CT of Meckel’s Diverticulitis in 11 patients. AJR 2004;182:625–629. 12. Park JJ, Wolff BG, Tollefson MK, Walsh EE, Larson DR. Meckel diverticulum: the Mayo Clinic experience with 1476 patients (1950-2002). Ann Surg 2005;241(3):529-533. 13. Mathuram TU, Ponnuswamy A, Bagul A, and Ponnuswamy P. Perforated Meckel’s diverticulum lithiasis: an unusual cause of peritonitis. Case Reports in Surgery Volume 2013, Article ID 825628, 3 pages http://dx.doi. org/10.1155/2013/825628 14. Estrella RM, Bernal RJ, Fuenzalida CL. Hernia interna de divertículo de Meckel como causa de obstrucción intestinal en un senescente. Rev Chil Cir 2009;61(2):187-190. 15. Santos Maia D, Ferreira Júnior M, Gomes Viegas R, Charris Silva EE, de Tarso Vaz de Oliveira P, Corgozinho A. da Silva R, et al. Bowel obstruction in Meckel diverticulum. Letter to the Editor. Arq Bras Cir Dig 2013;26(3):244-245. 29 Anales de Radiología México 16. Singh Gupta S, Singh O. Loop formation of Meckel’s diverticulum causing small bowel obstruction in adults: report of two cases. Turkish Journal of Trauma & Emergency Surgery 2011;17(6):567-569. 17. Fagenholz PJ, de Moya MA. Laparoscopic treatment of bowel obstruction due to a bezoar in a Meckel’s diverticulum. JSLS 2011;15:562–564. 18. Wani I, Šnábel V, Naikoo G, Wani S, Wani M, Amin A, et al. Encountering Meckel’s diverticulum in emergency surgery for ascaridial intestinal obstruction. World Journal of Emergency Surgery 2010;5:15. 19. Soria-Céspedes D, Leuchter-Ibarra J, Ventura-Molina V y Mora-Constantino J. Intususcepción ileocólica en un adulto causado por divertículo de Meckel invertido. Revista de Gastroenterología de México 2012;77(4):220-223. 20. Lilayú VD, Franjola VP, Meza AR, Lilayú CG. Intususcepción intestinal por divertículo de Meckel invertido en un adolescente: Reporte de un caso. Cuad Cir 2010;24:17-20. 21. Thurleya PD, Hallidaya KE, Somersa JM, Al-Darajib WI, Ilyasb M, Brodericka NJ. Radiological features of Meckel’s diverticulum and its complications. Clinical Radiology 2009;64:109-118. 22. Levesque BG, Chua HK, Kane SV. Meckel’s Ileitis: Not all regional enteritis is Crohn’s disease. Inflamm Bowel Dis 2011;17(6):E45. 23. Johnston AT, Khan AL, Bleakney R, and RA Keenan. Stromal tumour within a Meckel’s diverticulum: CT and ultrasound findings. BJR 2001;74:1142–1144. 24. Zani A, Eaton S, Rees CM y Pierro A. Incidentally detected meckel diverticulum: To resect or not to resect? Ann Surg 2008;247:276-281. 30 Volumen 14, Núm. 1, enero-marzo 2015 25. Motta-Ramírez GA, Rodríguez-Treviño C, Ramírez-Arias JL. Diverticulitis de Meckel. Acta Médica Grupo Ángeles 2010;8(2):109-110. 26. Ruiz-Tovar J, Morales-Castiñeiras V, Martínez-Molina E. Diverticulitis de Meckel. Presentación de 10 casos. Cir Ciruj 2009;77:141-144. 27. Motta-Ramírez GA, Arroyo-Hernández G, Quiroz-Castro O y Ramírez-Arias JL. Impacto de la tomografía computada de multidetectores abdominal en la practica médica. Evaluación retrospectiva de solicitudes y diagnósticos. Acta Médica 2008;6(2):55-63. 28. Jae Min Lee, Chan Dong Jeen, Seung Han Kim, Jong Soo Lee, Seung Joo Nam, Hyuk Soon Choi et al. Meckel’s diverticulum detected by computed tomographic enterography: Report of 3 cases and review of the literature. Turk J Gastroenterol 2014;25:212-215. 29. Feller AA, Movson J, Shah SA. Meckel Diverticulum. A geriatric disease masquerading as common gastrointestinal tract disorders. Arch Intern Med 2003;163:2093-2096. 30. Jeng-Jung Chen, Hung-Chang Lee, Chun-Yan Yeung, Wai-Tao Chan,Chuen-Bin Jiang, Jin-Cherng Sheu, et al. Meckel’s Diverticulum: Factors associated with clinical manifestations. ISRN Gastroenterology Volume 2014, Article ID 390869, 5 pages http://dx.doi.org/10.1155/2014/390869. 31. Thompson WM y Paulson EK. Radiographic appearance of Meckel diverticulum. CDR 2006;29(10):1-6. 32. Platon A, Gervaz P, Becker CD, Morel P, Poletti PA. Computed tomography of complicated Meckel’s diverticulum in adults: a pictorial review. Insights Imaging 2010;1:53–61. 33. Mayo CW. Meckel’s diverticulum. Mayo Cin Proc 1933:8:230-232. Artículo original Anales de Radiología México 2015;14:31-42. Evaluación radiológica, con criterios RECIST, de la respuesta al tratamiento del cáncer pulmonar no microcítico. Seguimiento de rutina Cuituny-Romero AK1 Onofre-Castillo J2 1 Residente de segundo año de Imagenología diagnóstica y terapéutica. 2 Profesor titular de la especialidad en Imagenología diagnóstica y terapéutica. Departamento de Radiología e Imagen del Hospital Christus Muguerza Alta Especialidad, Universidad de Monterrey, Miguel Hidalgo 2525, Col. Obispado, 64060, Monterrey, Nuevo León. RESUMEN Antecedente: el cáncer pulmonar no microcítico ha aumentado 25% su incidencia en los últimos años; la supervivencia a 5 años es de 10%, por lo que es preciso evaluar la respuesta al tratamiento utilizando los criterios de respuesta al tratamiento de tumoraciones sólidas (Response Evaluation Criteria In Solid Tumors, RECIST), los métodos de medición tridimensional, o ambos. Objetivo: estadificar la respuesta al tratamiento con los criterios RECIST y comparar estas mediciones con las del método radiológico tridimensional y de volumen. Material y método: se estudiaron 11 pacientes con diagnóstico histológico de carcinoma pulmonar (exceptuando el de células pequeñas) en el periodo de enero a septiembre del 2013. Resultados: se observó un solo de caso de concordancia entre las medidas radiológicas convencionales tridimensionales y los criterios RECIST; en el resto de la población estudiada hubo rangos de diferencia entre ambas medidas de 5 a 43%. Discusión: en los pacientes estudiados se encontró: en 5 progresión de la enfermedad, en 3 estabilidad, en 2 respuesta parcial y solo en uno respuesta completa según los criterios RECIST y el método tridimensional. Esto demuestra que para el seguimiento del paciente con cáncer de pulmón se requiere un protocolo uniforme, ya sea mediante la evaluación por medidas en tres dimensiones, RECIST, o ambas. Conclusión: debe considerarse la utilización de los criterios RECIST para clasificar la respuesta en todos los pacientes con tumoraciones pulmonares, independientemente del subtipo histológico y del estadio de la enfermedad, para estandarizar el seguimiento y evaluación no sólo de la lesión o lesiones diana sino de todas las lesiones presentes (metástasis) para un control óptimo del tratamiento. Palabras clave: neoplasias pulmonares, radiología, evaluación, estudios de seguimiento. Recibido: 8 de octubre, 2014 Radiological evaluation, with RECIST criteria, of response to treatment of nonmicrocytic lung cancer. Routine follow-up ABSTRACT Background: The incidence of non-microcytic lung cancer has increased 25% in recent years; with 10% survival at 5 years, we need www.nietoeditores.com.mx Aceptado: 18 de diciembre, 2014 Correspondencia: Alma Karime Cuituny Romero cuituny@gmail.com Este artículo debe citarse como Cuituny-Romero AK, Onofre-Castillo J. Evaluación radiológica, con criterios RECIST, de la respuesta al tratamiento del cáncer pulmonar no microcítico. Seguimiento de rutina. Anales de Radiología México 2015;14:31-42. 31 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 to evaluate response to treatment using the Response Evaluation Criteria In Solid Tumors (RECIST), three-dimensional measurement methods, or both. Objective: Stage response to treatment with RECIST and compare such measurements with those of the three- dimensional and volume radiological methods. Material and method: We studied 11 patients with histological diagnosis of pulmonary carcinoma (except small cell carcinoma) in the period January to September 2013. Results: We observed only one case of concordance between conventional three-dimensional radiological measurements and RECIST criteria; in the rest of the population studied there was a 5 to 43% range of difference between the two measurements. Discussion: In the patients studied we found: in 5 progression of disease, in 3 stability, in 2 partial response, and in only 1 complete response based on RECIST criteria and the three-dimensional method. This shows that uniform protocol is needed to monitor patients with lung cancer, using evaluation by three-dimensional measurements, RECIST, or both. Conclusion: Use of RECIST to classify response in all patients with pulmonary tumors should be considered, regardless of histological subtype and stage of disease, to standardize monitoring and evaluation not only of the target lesion or lesions but of all lesions present (metastasis) for optimum control of treatment. Key words: pulmonary neoplasms, radiology, evaluation, follow-up studies. Key Words: Neoplasms, Lung, Radiology, Evaluation, Follow Up Studies. INTRODUCCIÓN Se define como “respuesta” al “efecto que se pretende conseguir con una acción”. En el ámbito de la oncología y de la radiología se trata de medir la respuesta a los tratamientos con biomarcadores de imagen, para mantener un tratamiento o suspenderlo para evitar posibles toxicidades y gastos innecesarios. La respuesta al tratamiento de los tumores sólidos se basa en los cambios de tamaño, elemento base de los criterios de evaluación de la respuesta en tumores sólidos: Response Evaluation Criteria In Solid Tumors, RECIST.1 32 Para aplicar los criterios RECIST primero hay que definir, en el estudio inicial, las lesiones diana representativas y reproducibles durante el seguimiento; debe tenerse en cuenta que su gran variabilidad (confluencia, fragmentación, mala definición, técnica de imagen, apreciación) así como la dificultad para medirlas, como ocurre en los órganos móviles, originan discrepancias intraobservador e interobservador. La valoración de la respuesta se realizará con la misma técnica empleada en el estudio inicial, constatando la duración de la respuesta. La suma de las lesiones diana del estudio basal se usará para seguir y valorar objetivamente la respuesta. Cuando una Cuituny-Romero AK y Onofre-Castillo J. Evaluación del tratamiento del cáncer pulmonar no microcítico lesión diana se fragmente durante el tratamiento se medirán sus partes, se sumarán y se considerarán como una única lesión.1 Los criterios RECIST son una serie de reglas publicadas para definir cuando los pacientes con cáncer mejoran (“responden”), se mantienen igual (“estables”) o empeoran (“progresión de la enfermedad”) durante los tratamientos.2 El cáncer de pulmón es el tipo más común de cáncer y es la principal causa de muertes por cáncer en Estados Unidos, tanto en hombres como en mujeres. En 2004 se estimaron 173 770 nuevos casos y 164 440 muertes. Pese a todos los esfuerzos la tasa de supervivencia a 5 años, en pacientes con cáncer pulmonar, es de 14% para todos los estadios (estadificación clínica): 61% para el estadio IA, 38% para el IB, 34% para el IIA, 24% para IIB, 13% el IIIA, 5% IIIB y 1% para el IV.3 La estadificación del cáncer pulmonar no microcítico se realiza de acuerdo con el Sistema Internacional de Estadificación para Cáncer Pulmonar. Este sistema describe la extensión del cáncer pulmonar no microcítico en términos de tamaño, localización y extensión del tumor primario (calificativo T), la presencia y localización de los nódulos linfáticos afectados (calificativo N) y la ausencia de metástasis a distancia (calificativo M). La resección, radioterapia, quimioterapia o la combinación de estas modalidades y la imagen radiológica juegan un papel importante en la evaluación de la estadificación.3 Los criterios de evaluación de la respuesta en tumores sólidos, RECIST por sus siglas en inglés, fueron introducidos en el año 2000 por un grupo internacional de trabajo para estandarizar y simplificar los criterios de respuesta de los tumores. Las características clave de los criterios originales RECIST (versión 1.0) incluyen definiciones del tamaño mínimo de las lesiones medibles por tomografía computada, instrucciones sobre el número de lesiones a seguir (arriba de 10 con un máximo de 5 por órgano) y el uso de medidas unidimensionales por tomografía para la evaluación de la carga tumoral. Los criterios RECIST sustituyeron la evaluación del tamaño bidimensional del tumor que había sido usada comúnmente.4 A finales de la década de los 90 del siglo pasado la Organización Mundial de la Salud unificó la evaluación de la respuesta, de la recidiva y del intervalo libre de enfermedad; estableció también una graduación de la toxicidad del tratamiento. En el año 2000 aparecieron los criterios RECIST como modificación de dichos criterios y se actualizaron en el 2009 incluyendo a la resonancia magnética y a la tomografía por emisión de positrones con 18F-FDG como modalidades de imagen aceptadas para evaluar la respuesta.1 Los criterios RECIST, se emplean para la evaluación de la respuesta al tratamiento en tumores sólidos. Son criterios internacionalmente aceptados, usados para evaluar la respuesta al tratamiento; para comprobar si una terapia funciona y definir si el paciente con cáncer está respondiendo adecuadamente al tratamiento.5 Los criterios RECIST han sido ampliamente aceptados como medida estandarizada de la respuesta tumoral, especialmente en ensayos clínicos donde los criterios primarios son la respuesta objetiva o el tiempo de progresión.4 A continuación se describen dichos criterios: I. Lesiones medibles/no medibles Lesión medible. El diámetro en su eje máximo es de 10 mm o mayor, si la adquisición se hace en la tomografía helicoidal con reconstrucción de 5 mm de espesor en imágenes axiales.5 Lesión no medible. Incluyen las lesiones de tamaño pequeño (diámetro máximo menor de 33 Anales de Radiología México 10 mm) así como las realmente no medibles (derrame pleural o pericárdico, linfangitis carcinomatosa cutánea o pulmonar).5 Adenopatías. En las adenopatías metastásicas la colonización tumoral en sí no se visualiza; lo que identificamos es un incremento de tamaño del ganglio (puesto que son estructuras anatómicas visibles por imagen aún sin ser patológicas). El crecimiento de un ganglio es lo que se utiliza como indicador de afectación metastásica. Para medir el tamaño se debe utilizar el eje corto ya que es el mejor factor de predicción de la metástasis (las adenopatías habitualmente crecen y disminuyen principalmente a expensas de su diámetro menor). En el caso de las adenopatías, para considerar el aumento de tamaño patológico y ser por tanto lesiones medibles, deben medir 15 mm o más de eje corto. El resto de adenopatías patológicas, de eje corto entre 10 y 15 mm, se consideran lesiones “no medibles”. Aquellos ganglios de eje corto menor de 10 mm se consideran no patológicos y por tanto no requieren ningún tipo de evaluación.5 34 Metástasis óseas. Las metástasis óseas líticas o mixtas (lítica y blástica) con componente de partes blandas se consideran lesiones medibles siempre y cuando el componente de partes blandas cumpla la definición anterior de lesión medible. Las metástasis blásticas y líticas son lesiones no medibles.5 Lesiones quísticas o necróticas. Las lesiones que cumplen radiológicamente los criterios de quistes simples no se consideran lesiones malignas (no se consideran medibles o no medibles).5 Las metástasis quísticas (lesiones necróticas) se consideran medibles siempre que cumplan la definición anterior de lesión medible. De todas formas, siempre que existan otras lesiones “no quísticas” en el mismo paciente serán preferibles para seleccionarlas como lesiones diana. Volumen 14, Núm. 1, enero-marzo 2015 Lesiones con tratamiento local previo. Las lesiones localizadas sobre áreas previamente irradiadas o sometidas a cualquier otro tratamiento locorregional, habitualmente se consideran no medibles, a menos que se demuestre una clara progresión de la lesión.5 II. Lesiones diana/no diana Lesiones diana. Son las lesiones medibles, hasta un máximo de cinco (y no más de dos por órgano), representativas de todos los órganos implicados (por ejemplo, en pacientes con un sólo órgano implicado se seleccionaran un máximo de dos lesiones diana y, en el caso de dos órganos, implicados seleccionaremos hasta un máximo de cuatro). Las lesiones diana son las que seleccionaremos y mediremos en el estudio de base y posteriormente en la evaluación de los controles sucesivos. Para su selección nos basamos en su tamaño (las de mayor tamaño) y facilidad para reproducir su medición en controles sucesivos.5 Lesiones no diana. Incluyen tanto las lesiones no medibles como las medibles; de las lesiones medibles incluimos aquellas que excedan las dos por órgano o el total de cinco. (Estas no necesitan medirse en los estudios de seguimiento pero debe notificarse cualquier cambio en ellas).5 III. Evaluación de las lesiones diana/no diana Lesiones diana. En RECIST sólo se requiere las medidas del diámetro mayor de las lesiones diana seleccionadas en el plano en el que se adquirieron las imágenes. En el caso de la tomografía en el plano axial (sólo cuando se hayan realizado reconstrucciones isotrópicas de las imágenes fuente podremos medir en las reconstrucciones de los otros planos). Sólo mediremos el diámetro menor (eje corto) en el caso de las adenopatías seleccionadas como lesiones diana. La suma de los diámetros de todas las lesiones diana (diámetro Cuituny-Romero AK y Onofre-Castillo J. Evaluación del tratamiento del cáncer pulmonar no microcítico mayor de las lesiones y el menor si seleccionamos adenopatías) debe ser calculada y documentada como suma total de los diámetros en el estudio basal. Esta suma de diámetros en el estudio basal es la que se usará para el seguimiento y evaluación objetiva de la respuesta tumoral en términos de enfermedad medible.5 Lesiones no diana. Todas las demás lesiones no incluidas en la suma de “lesiones diana” se consideran “lesiones no diana”. No se requiere su medición pero sí deben ser documentadas en el estudio basal. En el caso de múltiples “lesiones no diana” afectando a un mismo órgano se documentarán como: múltiples adenopatías patológicas, múltiples metástasis hepáticas.5 IV. Tipos de respuesta Lesiones diana. Se considera respuesta completa (RC) a la desaparición de la enfermedad medible y evaluable, sin que aparezcan nuevas lesiones, ausencia de síntomas y normalización de marcadores durante al menos 4 semanas. Hablamos de respuesta parcial (RP) cuando la suma de los diámetros de las lesiones diana se reduce al menos 30%. Hay progresión de la enfermedad (PE) cuando aumenta 20%, se produce un incremento absoluto de al menos 5 mm (en la suma de los diámetros de las lesiones diana) o aparecen nuevas metástasis o progresan las lesiones no diana. La enfermedad estable (EE) significa que no hay suficiente reducción o suficiente incremento para considerar o una respuesta completa o una progresión de la enfermedad. Se define como respuesta global (RG) a la mejor respuesta después de iniciado el tratamiento antes de que recidive o progrese la enfermedad.1 Lesiones no diana. Respuesta completa (RC): desaparición de la totalidad de las lesiones no diana y normalización del nivel de marcador tumoral (en el caso de los ganglios deben ser del tamaño no patológico, menores de 10 mm). No remisión completa/no progresión de la enfermedad (No-RC/No-PE): persistencia de una o más lesiones no diana y/o niveles del marcador tumoral por encima de los límites normales. Progresión de la enfermedad (PE) o progresión inequívoca de enfermedad no diana: si el aumento en la carga tumoral basado en el cambio de las lesiones no diana es comparable en magnitud al incremento que sería necesario para considerar progresión de la enfermedad en caso de enfermedad medible (ej. cambio de mínimo derrame pleural a masivo, o de carcinomatosis localizada a expansión generalizada).5 La categorización final de la respuesta debe fundamentarse en la evaluación de los cambios tanto de las lesiones diana como de las lesiones no diana, así como en la notificación de la presencia o ausencia de nuevas lesiones. A continuación se describe el esquema a seguir para la categorización de la respuesta final.5 Lesiones de nueva aparición. Una vez que aparece una lesión nueva el tumor es clasificado como progresión de la enfermedad.5 La medición del tumor por tomografía y la evaluación de la respuesta al tratamiento en el cáncer pulmonar no microcítico tratado con terapia dirigida es críticamente importante para determinar el tiempo de ajuste del régimen terapéutico para prolongar la supervivencia.4 Cáncer pulmonar no microcítico. El cáncer pulmonar representa el diagnóstico que más eventos de muertes causa. El cáncer pulmonar de células no pequeñas se ha incrementado en los últimos años con cerca de 25% de nuevos casos a escala mundial y sin mejora de la supervivencia a 5 años (10%). Es una enfermedad multifactorial pero el tabaquismo representa el factor de riesgo más importante.6 El cáncer pulmonar de células no pequeñas es un crecimiento incontrolado y progresivo de dichas células. Este término se utiliza para referirse a todos los carcinomas pulmonares, excepto el de células no pequeñas.6 35 Anales de Radiología México La tomografía de tórax con ventana pulmonar y mediastinal, con medio de contraste, incluyendo al hígado y a las glándulas suprarrenales tiene sensibilidad de 80% y especificidad de 70% para la detección de cánceres pequeños (nódulo).6 El objetivo de este trabajo fue evaluar, con los criterios RECIST, la respuesta al tratamiento y documentar las similitudes del seguimiento radiológico de rutina utilizando las aplicaciones de reformateo de imágenes como parte de la evaluación, rastreo y categorización de las tumoraciones pulmonares sólidas. Los objetivos específicos fueron documentar la respuesta al tratamiento mediante la estadificación de la respuesta a la terapia de acuerdo con los criterios RECIST y clasificar a los pacientes de acuerdo con su evolución en las categorías de respuesta al tratamiento total, parcial, estabilidad y/ o progresión de la enfermedad. Los métodos radiológicos convencionales basados en la medición bidimensional de las tumoraciones sólidas de pulmón se han utilizado según la Organización Mundial de la Salud6 y se propone que el uso de la medición unidimensional usada en los criterios RECIST es otra alternativa para el seguimiento de la respuesta al tratamiento, como parte de la estandarización internacional para la evaluación de los pacientes con tumores de pulmón no microcíticos. MATERIAL Y MÉTODOS Previa autorización por el Departamento de Educación e Investigación en Salud del Grupo y con una técnica observacional de las imágenes del sistema Picture Archiving and Communication System, PACS (sistema de archivado y transmisión de imágenes) se llevó a cabo un estudio retrospectivo, observacional y descriptivo. El tamaño de la muestra se determinó mediante un muestreo no probabilístico consecutivo. Se 36 Volumen 14, Núm. 1, enero-marzo 2015 estudiaron pacientes con diagnóstico confirmado de carcinoma de pulmón no microcítico que contaban con tomografía anterior y posterior al tratamiento con radioterapia. El tamaño de muestra para la serie fue a dos colas: 59 pacientes con un intervalo de confianza de 95% y un poder estadístico de 80%. Criterios de inclusión: pacientes adultos en rango de edad de los 18 años en adelante; diagnóstico confirmado por anatomopatología; sin antecedentes radioterapia previa y/o cirugía y sin otros antecedentes oncológicos. Criterios de exclusión: pacientes pediátricos, con diagnóstico no confirmado, antecedentes de radioterapia y/o cirugía; enfermedad avanzada con metástasis a distancia. Se seleccionaron los pacientes con diagnóstico confirmado, por patología, de cáncer pulmonar de células no pequeñas y con estudios de tomografía previos y posteriores al tratamiento clínico. Este estudio se realizó en el hospital y se seleccionarán sólo los pacientes que cumplían con los criterios de inclusión. Posteriormente se tomaron mediciones de las lesiones diana y no diana de acuerdo con los criterios RECIST en las tomografías computadas previas a la terapia y posteriores a ella para clasificar a los pacientes según su respuesta (Figuras 1 y 2). Además se realizaron mediciones con el método radiológico convencional bidimensional (Figura 3) así como tridimensional (Figura 4) para comparar ambos grupos. El equipo utilizado fue un tomógrafo multicorte7 marca General Electric. Se efectuó evaluación de las imágenes en secuencias axial, coronal y sagital. Las imágenes fueron revisadas por un residente de radiología de segundo año y por un radiólogo certificado. Consideraciones técnicas de los métodos de imagen5 La nueva guía RECIST 1.1 incorpora el anexo II con especificaciones acerca de las técnicas de imagen. Se habla de los protocolos para la Cuituny-Romero AK y Onofre-Castillo J. Evaluación del tratamiento del cáncer pulmonar no microcítico Figura 1. Corte axial, tomografía computada de pulmón fase venosa. Medición de la lesión diana en su diámetro mayor de acuerdo con los criterios RECIST. Figura 3. Corte axial, tomografía computada de pulmón con ventana para mediastino en fase simple, medición bidimensional. Figura 2. Corte axial, tomografía computada de pulmón con contraste, IV fase venosa. Ganglio mediastinal medido en su eje corto de acuerdo con los criterios RECIST. adquisición de imágenes en tomografía axial computada recomendados para los pacientes incluidos en ensayos clínicos donde los criterios RECIST van a ser empleados. Su finalidad es conseguir la estandarización tanto de los requerimientos de imagen como de los parámetros de adquisición de las imágenes, permitiendo una comparación óptima entre sujetos dentro de un mismo estudio así como resultados entre diferentes estudios.6 La técnica de imagen empleada para evaluar las lesiones (y la ventana o secuencia empleada) deberá ser siempre la misma para caracterizar cada una de las lesiones identificadas y documentadas en el estudio basal y durante el seguimiento. Figura 4. Reconstrucción 3D nódulo pulmonar. Guardar las mediciones realizadas en un sistema métrico es de gran ayuda para los próximos controles, tarea fácil hoy en día con los nuevos programas informáticos con los que se trabaja en los servicios de radiodiagnóstico.5 Cobertura anatómica. La cobertura óptima en la mayoría de tumores sólidos consiste en incluir el 37 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 estudio de tórax, abdomen y pelvis. Si bien en cada caso se deberán abarcar las localizaciones donde exista predilección de la metástasis se deben incluir también localizaciones que pudieran estar afectadas con base en los signos y síntomas individuales de cada paciente. Puesto que la detección de una lesión en una parte del cuerpo no escaneada en el estudio basal debe considerarse como lesión de nueva aparición y por tanto representa una progresión de la enfermedad, se debe ser muy cuidadoso en cuanto a la elección de la extensión de las coberturas de los estudios tanto basal como de seguimiento.5 Administración de contraste intravenoso. El realce con material de contraste intravenoso es el método preferido en los criterios RECIST para la óptima visualización y la medición de las metástasis en los tumores sólidos. Por tanto, será necesaria su administración en este tipo de estudios, si bien no se especifican las fases vasculares en las que debe ser adquirido el estudio. Lo imprescindible es que el estudio se realice siempre en la misma fase vascular, tanto en el estudio basal como durante el seguimiento, para conseguir la mayor reproductibilidad en el realce de las lesiones que nos permita la correcta comparación de lesiones conocidas y la detección de nuevas lesiones.1 (Figuras 5 y 6). Se estudiaron las variables: nominal, género, cuantitativa, edad, continuas. Medidas de las tumoraciones sólidas del pulmón con base en los criterios RECIST, cualitativas, clasificación en los criterios RECIST, presencia o no de respuesta a la terapia. Para el consentimiento informado se usó la carta del Comité de Bioética del Hospital para utilizar las imágenes guardadas en el programa PACS. 38 Figura 5. Corte axial, tomografía computada de pulmón, fase simple. Lesión nodular con densidad de tejidos blandos. RESULTADOS Figura 6. Corte axial, tomografía computada de pulmón con contraste, IV fase arterial. Realce de la lesión nodular. Se analizaron 11 pacientes que tenían estudios de tomografía de tórax como estudio basal y de control posterior al tratamiento. Respecto a la edad de los pacientes se encontró una media de 53 años. El género predominante fue el masculino, 5 (55%) y femenino 4 (45%). Diagnósticos Cuituny-Romero AK y Onofre-Castillo J. Evaluación del tratamiento del cáncer pulmonar no microcítico por patología: 5 pacientes sin subtipo histológico, 3 pacientes con subtipo bronquioalveolar, 1 con adenocarcinoma, 1 con espinocelular y 1 adenoideo. Posteriormente se efectuó una comparación de las medidas convencionales en estudio basal y posterior al tratamiento como se observa en los Cuadros 1 y 2. Se muestran también la comparación con las medidas RECIST en el Cuadro 3 posterior a tratamiento. En el Cuadro 4 se muestra la correlación de ambas medidas. Finalmente se definió la respuesta al tratamiento de cada paciente estudiado. Cuadro 1. Respuesta al tratamiento. Tomada del Módulo SERAM5 Lesiones diana Lesiones no Lesiones de nuediana va aparición RC RC RC No RC No PE RC NE RP No PE o NE EE No PE o NE NE No PE PE Cualquiera Cualquiera PE Cualquiera Cualquiera Respuesta final No No No No No No Sí o No Sí o No Sí RC RP RP RP EE NE PE PE PE EE: enfermedad estable; NE: no evaluable; PE: progresión de la enfermedad; RC: respuesta completa; RP: respuesta parcial. Cuadro 5. Se encontraron diferencias entre la medición mediante el método radiológico convencional tridimensional y las medidas unidimensionales de los criterios RECIST. Cuadro 6. DISCUSIÓN En los pacientes estudiados se encontró que 5 presentaron progresión de la enfermedad, 3 enfermedad estable, 2 respuesta parcial y solo uno respuesta completa. Se observó un solo caso de concordancia entre las medidas radiológicas convencionales tridimensionales y la medida unidimensional de RECIST; en el resto de la población estudiada hubo rangos de diferencia entre ambas medidas desde 5 hasta 43%. Lo anterior demuestra que para el seguimiento del paciente con cáncer de pulmón se requiere un protocolo uniforme, ya sea mediante la evaluación por medidas en tres dimensiones o RECIST. La edad media fue de 53 años con predominio del género masculino (55%).6 El diagnóstico histológico más común fue el carcinoma bronquioalveolar; 3 sin embargo, se encontró la limitante de que 5 pacientes no contaban con reporte de histopatología del centro hospitalario en donde se realizó este estudio. En el resto de Cuadro 2. Comparación estudio basal/postratamiento, medidas convencionales Número de caso Estudio basal medidas convencionales Estudio postratamiento medidas convencionales Promedio medidas convencionales % estudio basal/ postratamiento eje corto eje largo volumen eje corto eje largo volumen estudio basal/postrata- medidas convencionales (mm) (mm) (cm3) (mm) (mm) (cm3) miento (cm3) (%) 1 2 3 4 5 6 7 8 9 10 11 21 39 53 40 28 9 2.6 80 78 15 12 22 43 58 69 48 6 2.8 76 39 16 11 9.1 24.3 56.8 71.7 18.8 3.1 11.6 70.8 77.57 1.3 0.66 21 20 53 0 20 9.5 2.4 35 84 16 14 28 39 48 0 26 8.7 2.5 45 51 19 15 10.9 7 38.6 0 5.2 4.3 7.8 5.2 109 2.5 1.7 1.8 3.9 18.2 0 13.6 1.2 3.8 65.4 31.4 5 1.04 17 36 32 100 72 28 33 93 29 52 39 39 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 Cuadro 3. Comparación basal/postratamiento, medidas RECIST Estudio basal (medidas RECIST) Postratamiento (medidas RECIST) Caso # lesiones Lesion # de Lesiones # lesiones diana es diana lesiones no diana diana (mm) no diana (mm) 1 2 3 4 5 6 7 8 9 10 11 1 1 1 1 1 1 1 3 1 1 1 22 47 75 73 47 9.1 7.06 103 85 16 15 1 0 1 0 0 3 1 1 6 0 0 13 0 39 0 0 9.5 1.7 26 122 0 0 1 1 1 0 1 1 1 3 1 1 1 Cuadro 4. Correlación promedio basal/postratamiento: medidas convencionales vs. RECIST Medida lesiones diana (mm) 28 39 67 0 33 15 57 52 87 30 22 Promedio medidas RECIST % estudio basal/ postratamiento # lesio- Medida Estudio basal/ nes no lesiones postratamiento diana no diana (mm) (mm) 1 0 1 0 0 3 1 1 3 0 0 10 0 30 0 0 0 17 13 117 0 0 Promedio RECIST 8 8 8 0 14 5.9 1.3 26 2 14 7 22 17 11 100 30 40 19 50 3 47 31 Cuadro 5. Respuesta RECIST Respuesta RECIST Número de caso % estudio basal/ postratamiento. Medidas convencionales % estudio basal/ postratamiento. Promedio RECIST 1 2 3 4 5 6 7 8 9 10 11 17 36 32 100 72 28 33 93 29 52 39 22 17 11 100 30 40 19 50 3 47 31 los pacientes3 hubo un caso para carcinoma adenoideo, otro para carcinoma espinocelular y uno para adenocarcinoma. De acuerdo con la literatura especializada el subtipo histológico más común es el adenocarcinoma, encontrado en 40% de los casos. Actualmente se hace énfasis en la separación por 40 Número Lesiones Lesiones de caso diana no diana 1 2 3 4 5 6 7 8 9 10 11 4 3 3 1 2 4 3 2 4 4 4 7 5 7 5 5 6 7 7 7 5 5 Lesiones de nueva aparicion Respuesta final RECIST 0 0 0 0 0 0 0 0 0 0 0 4 3 3 1 2 4 3 2 4 4 4 tipos histológicos para determinar su pronóstico y las opciones terapéuticas.7 Se tomaron las mediciones en el estudio basal para el eje corto, largo y ancho de las lesiones, para obtener el volumen y posteriormente se repitieron las medidas en el estudio postratamiento. Se encontró aumento respecto a las Cuituny-Romero AK y Onofre-Castillo J. Evaluación del tratamiento del cáncer pulmonar no microcítico Cuadro 6. Diferencias medidas convencionales y RECIST Caso Medidas convencionales % Promedio RECIST % Medida convencional/RECIST 1 2 3 4 5 6 7 8 9 10 11 17 36 32 100 72 28 33 93 29 52 39 22 17 11 100 30 40 19 50 3 47 31 5 19 21 0 42 12 14 43 26 5 8 medidas volumétricas en 5 casos (aumento promedio de 33%, 8.6 cm3) y con criterios para definir progresión de la enfermedad pese al tratamiento. La enfermedad estable en tres pacientes mostró diferencias en cuanto al porcentaje de respuesta ya que mediante medidas convencionales, al comparar el estudio basal y el posterior al tratamiento, se encontró un promedio de 33.6% de respuesta. De acuerdo con los criterios RECIST al identificar las lesiones diana según su tamaño (diámetro mayor) se les toman mediciones consecutivas en los estudios de control para el cálculo de la suma de los diámetros mayores para determinar la respuesta al tratamiento Cuadro 1.8 La diferencia de la evaluación por método RECIST en comparación con métodos 2D o 3D es que se realizan las mediciones en plano axial, no sagital ni coronal como en los métodos ya mencionados.9 Las mediciones mediante RECIST en estudios basales y posteriores al tratamiento mostraron un porcentaje de respuesta de 15.6%. Debido a estos valores por el método RECIST el paciente no tiene un porcentaje de respuesta suficiente para catalogarlo como respuesta parcial (≥ 30); sin embargo, por medidas convencionales si lo alcanza. La media de disminución fue de 5.7 mm por medidas RECIST y una media de reducción de volumen de 8.6 cm3 para estos pacientes.10,11 Los dos pacientes que presentaron respuesta parcial (≥ 30) de igual manera presentaron diferencias marcadas en cuanto a la respuesta mediante medidas convencionales que fue de 82.5% con una reducción del volumen, en promedio, de 39.5 cm3; por RECIST el porcentaje de respuesta fue de 40% con una media de reducción de 20 mm. Como ya se mencionó sólo uno de los pacientes tuvo respuesta completa para ambas mediciones. En relación con la lesiones no diana se encontraron 5 pacientes con no remisión completa, 5 pacientes sin lesiones no diana y uno con respuesta completa. Ninguno de los pacientes presentó lesiones nuevas en estudios de control postratamiento. En la correlación de Pearson para ambas medidas (convencionales vs. RECIST) no se encontró una relación lineal ni positiva perfecta (r = 0.0012). RECIST es ahora el método preferido para evaluar la respuesta al tratamiento, definida ya como respuesta completa (sin evidencia tumoral), respuesta al tratamiento (disminución del tamaño del tumor 30% en RECIST 1.0 y 25% en RECIST 1.1), enfermedad estable (sin cambios en el tamaño) y progresión de la enfermedad (incremento del tamaño tumoral de al menos 20%). Cabe señalar que enfermedad metastásica nueva es indicativa de progresión de la enfermedad. Esta valoración es puramente en relación con el tamaño tumoral y no es funcional.10,11 Se consideran como limitaciones de este estudio lo pequeño de la población, que se desconoce el tipo de tratamiento médico y farmacológico recibido por los pacientes ya que no hay contacto entre el cuerpo médico a cargo del paciente (oncología) y el departamento de radiología 41 Anales de Radiología México para el seguimiento de la respuesta; así como la realización de estudios de tomografía torácica sin uso de medio de contraste intravenoso en los estudios de basales o de seguimiento. CONCLUSIÓN Vigilar la respuesta al tratamiento de los tumores es una función integral que ha incrementado su importancia para los radiólogos que se dedican a la evaluación por imagen en el área de oncología. Los estudios de imagen tiene un papel esencial y objetivo para cuantificar la respuesta tumoral a gran una variedad de tratamientos físicos, quirúrgicos y farmacéuticos.11 Los criterios RECIST permiten la evaluación estandarizada de los pacientes con neoplasias sólidas desde su diagnóstico, evolución y para estadificar la respuesta al tratamiento. Son superiores a los métodos radiológicos convencionales bidimensional y tridimensional en los siguientes puntos: 1. Medida unidimensional que se realiza tomando el eje largo de la lesión diana. Esto ayuda a un menor rango de error en las mediciones subsecuentes. 2. Toman en consideración lesiones diana, no diana y de nueva aparición. 3. Clasifican la respuesta al tratamiento de acuerdo con parámetros ya establecidos y aceptados internacionalmente. Recuérdese que para la respuesta parcial, en el la versión RECIST 1.1, se considera una disminución igual o mayor a 30% de la suma total de los diámetros máximos y para la respuesta completa que desaparezcan todas las lesiones en un periodo de 4 semanas para ambas y para la progresión un aumento mayor a 20%. Debe considerarse la utilización de los criterios RECIST para clasificar la respuesta en todos 42 Volumen 14, Núm. 1, enero-marzo 2015 los pacientes con tumoraciones pulmonares, independientemente del subtipo histológico y del estadio de la enfermedad; esto, para estandarizar el seguimiento y la evaluación no sólo de la lesión o lesiones diana sino considerar a todas las lesiones presentes (metástasis) para un control óptimo del tratamiento. Esto conllevará a un conocimiento mejor y más amplio de los tipos de respuesta, así como de las terapias que están dando tasas de éxito, fracaso o estabilidad de la enfermedad. REFERENCIAS 1. Cervera Deval J. RECIST y el radiólogo. Radiología 2012;59(3):193:205. 2. RECIST (Response Evaluation Criteria In Solid Tumors). http://www.recist.com 12-12-14 3. Munden RF et al. Imaging of the patient with non-small cell lung cáncer. Radiology 2005;237(3):803-18. 4. Nishino M et al. New response evaluation criteria in solid tumor (RECIST) guidelines for advanced non-small cell lung cancer: Comparision with original RECIST and impact on assessment of tumor response to targeted therapy. Am J Roentgenology 2010;195(3):221-8. 5. Pelechano P, Barrios M, Marhuenda A, Martín I, Santos J, Cervera J. Nuevos criterios RECIST (versión 1.1). Manual para radiólogos. Fundación Instituto Valenciano de Oncología. Sociedad Española de Radiología Médica. http:// www.seram2010.com 12-12-14 6. Guía de Práctica clínica para la detección, diagnóstico y tratamiento del cáncer pulmonar., México: Secretaria de Salud; 2009. www.cenetec.salud.gob.mx/descargas/ gpc/.../IMSS_030_08_EyR.pdf12-12-14 7. Bhure UN et al. Accuracy of CT parameters for assesment of tumor size and agressiveness in lung adenocarcinoma with broncoalveolar elements. Brit J Radiol 2010;83:8419. 8. Nishino M et al. Revised RECIST guideline version 1.1: What oncologists want to know and what radiologist need to know. Am J Roentgenolgy 2010;195:281-9. 9. Suzuki M. Radiologic Measurements of tumor response to treatment practical approaches and limitations. Radiographics 2008;28:329-44. 10. Munden RF et al. Imaging of the patient with non-small cell lung cancer. Radiology 2005;237:803-18. 11. Padhani AR et al. The RECIST criteria: implications for diagnostic radiologist. The Brit J Radiol 2001;74:983-6. Artículo original Anales de Radiología México 2015;14:43-65. Diagnóstico por imagen seccional de la colitis seudomembranosa RESUMEN Introducción: la colitis seudomembranosa es una colitis infecciosa, potencialmente letal, causada por la liberación de una o varias toxinas producidas por la proliferación sin oposición de la bacteria Clostridium difficile. La colitis seudomembranosa es una infección, predominantemente nosocomial, secundaria a la complicación del tratamiento antibiótico; se asocia también con la cirugía abdominal y con enfermedades debilitantes tales como el linfoma o el sida. Objetivo: reconocer la clave diagnóstica para identificar y diferenciar a la colitis seudomembranosa, de los distintos tipos de colitis, mediante tomografía analizando la distribución, los signos del acordeón, del doble halo y del signo en diana, la morfología de la pared del colon, la mucosa, la grasa pericólica, adenopatías o ascitis y algunos otros hallazgos intraabdominales extracolónicos específicos. Relacionaremos los diferentes patrones de estos puntos con el tipo de colitis correspondiente, centrándonos en la colitis seudomembranosa. Motta-Ramírez GA1 Torres-Montoya JM2 Martínez-Utrera MJ3 Rebollo-Hurtado V4 Guizar-López GU5 1 Médico Radiólogo con posgrado en Imagen Seccional del Cuerpo, adscrito al Departamento de Radiación Ionizante, subsección de Tomografía Computada. 2 Médico Cirujano, residente de primer año del curso de especialización y residencia en Radiología e Imagen de la Escuela Militar de Graduados de Sanidad. 3 Médico Cirujano, residente de tercer año del curso de especialización y residencia en Radiología e Imagen de la Escuela Militar de Graduados de Sanidad. 4 Médico Radiólogo con posgrado en Imagen Seccional del Cuerpo, adscrito al Departamento de Radiación Ionizante, Jefe de la subsección de Tomografía Computada. 5 Médico Cirujano, Jefe del Departamento de Patología Clínica. Hospital Central Militar, Blvd. Manuel Ávila Camacho S/N, Lomas de Sotelo, Miguel Hidalgo, 11200 Ciudad de México, Distrito Federal. 55573100, extensiones 1406 y 1928. Material y métodos: se realizó un estudio descriptivo, observacional, transversal, retrospectivo y unicéntrico que incluyó pacientes que ingresaron al Hospital Central Militar con diversos diagnósticos clínicos, en un periodo de 3 años (1 de enero del 2012 al 31 de diciembre del 2014) y en los que, con base en antecedentes de colitis seudomembranosa o en los hallazgos por tomografía, se señaló la posibilidad de colitis seudomembranosa. Resultados: nuestro universo incluyó a 53 pacientes (45% hombres y 55% mujeres) en las solicitudes de estudios que condicionaron la realización del estudio de tomografía computada; en ninguna de ellas se señaló el uso de antibióticos, el tipo, el tiempo o el número. En relación con el antecedente de uso de antibióticos asociados con colitis seudomembranosa se identificaron 50 pacientes, 94%. En 4% no se identificó el uso de antibiótico con la identificación de la colitis seudomembranosa por tomografía computada. Sólo 2% estuvo bajo tratamiento con antibiótico oral no especificado. Conclusión: las colitis forman parte de la patología abdominal urgente de alta frecuencia. Los hallazgos por tomografía, en el diagnóstico etiológico de las mismas, no son patognomónicos; no obstante, conocerlos permite realizar una correcta aproximación diagnóstica. Las imágenes de tomografía no son patognomónicas pero, junto con la epidemiología y la clínica, pueden alcanzar si no un diagnóstico de certeza sí de alta probabilidad. Para llegar al diagnóstico correcto de colitis seudomembranosa hay que analizar cuidadosamente los puntos que hemos desarrollado en este trabajo: distribución, signo del acordeón, del halo, morfología de la pared, mucosa, grasa, adenopatías, ascitis y los hallazgos característicos. Palabras clave: colitis, enterocolitis seudomembranosa, tomografía computada, diagnóstico. www.nietoeditores.com.mx Recibido: 8 de enero, 2015 Aceptado: 16 de enero, 2015 Correspondencia: Gaspar Alberto Motta Ramírez radbody2013@yahoo.com.mx Este artículo debe citarse como Motta-Ramírez GA, Torres-Montoya JM, MartínezUtrera MJ, Rebollo-Hurtado V, Guizar-López GU. Diagnóstico por imagen seccional de la colitis seudomembranosa. Anales de Radiología México 2015;14:43-65. 43 Anales de Radiología México Diagnosis by cross-sectional imaging of pseudomembranous colitis ABSTRACT Introduction: Pseudomembranous colitis is an infectious, potentially lethal colitis, caused by the release of one or more toxins produced by the unopposed proliferation of the bacterium Clostridium difficile. Pseudomembranous colitis is a predominantly hospital-acquired infection, secondary to complications from antibiotic treatment; it is also associated with abdominal surgery and with debilitating diseases such as lymphoma or AIDS. Objective: Recognize the diagnostic code to identify and differentiate pseudomembranous colitis from other types of colitis by means of tomography, analyzing distribution, signs of accordion, double, and bull’s-eye sign; morphology of colon wall, mucosa, and pericolic fat; adenopathies or ascites; and some other specific extracolonic intra-abdominal findings. We relate the different patterns of these points with the corresponding types of colitis, focusing on pseudomembranous colitis. Material and methods: We conducted a descriptive, observational, cross-section, retrospective, single-site study which included patients admitted to Hospital Central Militar with various clinical diagnoses, over a 3-year period (January 1, 2012, through December 31, 2014) and in whom the possibility of pseudomembranous colitis was identified based on history of pseudomembranous colitis or tomography findings. Results: Our universe included 53 patients (45% men and 55% women) in orders for studies which required computed tomography; in none of them was use of antibiotics, type, time, or number specified. In relation to history of use of antibiotics associated with pseudomembranous colitis, 50 patients (94%) were identified. In 4% use of antibiotics was not associated with identification of pseudomembranous colitis by computed tomography. Only 2% were on treatment with unspecified oral antibiotics. Conclusion: The colitides are part of highly common emergency abdominal pathology. Tomography findings, in their etiological diagnosis, are not pathognomonic; however, knowing them helps establish a correct diagnostic approach. Tomographic images are not pathognomonic but, combined with epidemiology and clinical findings, can support a diagnosis of strong probability, if not certainty. To arrive at a correct diagnosis of pseudomembranous colitis, we need to carefully analyze the points we have discussed in this article: distribution, sign of accordion or halo, colon wall morphology, mucosa, fat, adenopathies, ascites, and characteristic findings. Key words: colitis, pseudomembranous enterocolitis, computed tomography, diagnosis. 44 Volumen 14, Núm. 1, enero-marzo 2015 Motta-Ramírez GA et al. Diagnóstico de la colitis seudomembranosa introducción La colitis seudomembranosa es una colitis infecciosa potencialmente letal causada por la liberación de una o varias toxinas producidas por la proliferación sin oposición del Clostridium difficile.1 El C. difficile es un bacilo grampositivo, anaerobio de crecimiento lento en medios convencionales que produce, mediante la acción de dos enterotoxinas (toxinas A y B) un cuadro clínico con un espectro variable desde estadio de portador asintomático, síndrome diarreico autolimitado hasta colitis fulminante con megacolon tóxico y datos de letargia, taquicardia o perforación colónica; pasando por la situación más común de diarrea profusa, acuosa, síndrome doloroso abdominal y síndrome febril. Hay estudios recientes que parecen confirmar que un número limitado de casos pudiese deberse a cepas enterotoxigénicas de Staphylococcus aureus. La colitis seudomembranosa es una infección predominantemente nosocomial secundaria a la complicación del tratamiento antibiótico que se asocia también con cirugía abdominal y con enfermedades debilitantes como el linfoma o el sida.1 Cuadro 1. Entre 5 y 20% de los pacientes tienen un cuadro diarreico tras haber tomado antibióticos. Más de 20% y de las colitis seudomembranosas son producidas por C. difficile. El factor de riesgo más importante es el uso de antibióticos y, de entre ellos, especialmente la clindamicina y las cefalosporinas de segunda y tercera generaciones, clindamicina y fluoroquinolonas. Otros factores como la edad avanzada, la desnutrición o determinadas cepas del germen pueden contribuir a aumentar el riesgo.2 Los antibióticos pueden alterar la microbiota intestinal y reducir la resistencia del tubo digestivo a la colonización por patógenos. Entre 3 y 29% de los pacientes hospitalizados que reciben Cuadro 1. Factores de riesgo para la colitis seudomembranosa Ingesta previa de antibióticos de amplio espectro Edad superior a 65 años Hospitalizaciones prolongadas Inmunodepresión Patología severa asociada Episodios previos de colitis seudomembranosa Intervenciones gastrointestinales prolongadas Consumo habitual de inhibidores de la bomba de protones Periparto Trasplantados de corazón tratamiento antibiótico desarrollarán diarrea. El C. difficile es la causa más frecuente de diarrea infecciosa adquirida en un hospital en el mundo desarrollado y en los últimos años se asocia cada vez con mayores morbilidad y mortalidad.2 Aunque el C. difficile puede estar en las heces de 3% de los adultos sanos es el agente causal de 10-25% de las diarreas por antibióticos, de 50 a 75% de las colitis postratamiento antibiótico y de 90 a 100% de los casos de colitis seudomembranosa. Entre 16 y 35% de los pacientes hospitalizados puede ser portadores, con tasas proporcionales a la duración de la hospitalización y al uso de antibióticos.2 En una proporción de 20 a 50% de estos pacientes se encuentra, en la endoscopia o la histología, seudomembranas características que dan nombre al cuadro de colitis (o enteritis) seudomembranosa, placas elevadas amarillentas que se originan en sitios de ulceración superficial. La fisiopatogenia de la enfermedad contribuye al aspecto por imagen de la misma: el engrosamiento polipoide mucoso contribuye al aspecto “en empedrado” o “de dedo”, el edema mucoso y submucoso que condiciona el atrapamiento de medio de contraste intraluminal, el “signo del acordeón” y el reforzamiento poscontraste “en diana”, la heterogeneidad de la grasa pericolónica que se traduce en afección inflamatoria de la grasa, inflamación y ascitis.3 El diagnóstico definitivo se establece con la identificación de las toxinas en las heces o la visualización de las seudo- 45 Anales de Radiología México membranas en la colonoscopia. Su tratamiento consiste en la administración de metronidazol y vancomicina por vía oral; menos de 1% de los afectados requerirá cirugía.4 No hay una prueba diagnóstica ideal, así que la sospecha clínica es clave para establecer el diagnóstico, debiendo establecerse tratamiento empírico cuando el cuadro clínico es compatible aún cuando los resultados de laboratorio no sean concluyentes. La colitis seudomembranosa debe sospecharse especialmente en pacientes que comienzan con diarrea (a menudo asociada con dolor o malestar abdominal, fiebre y leucocitosis) después de un tratamiento antibiótico. La presentación clínica de la infección por C. difficile es muy variable y puede variar desde portador asintomático hasta la enfermedad cólica muy grave. Puede haber diarrea leve, una colitis sin seudomembranas, una colitis seudomembranosa o una colitis fulminante con riesgo para la vida del paciente. Las formas leves suelen acompañarse de síndrome doloroso abdominal del tipo cólico pero puede no haber síntomas sistémicos ni hallazgos relevantes en la exploración física. La colitis moderada-grave suele manifestarse como diarrea profusa, dolor y distensión abdominal y, en algunos casos, hemorragia digestiva oculta. También pueden aparecer síntomas de enfermedad sistémica como síndrome febril, náuseas, anorexia y malestar general. Los pacientes con afectación predominante del ciego y el colon derecho pueden tener leucocitosis y síndrome doloroso abdominal sin diarrea; ésta también puede no presentarse en pacientes con colitis seudomembranosa grave que desarrollan megacolon tóxico e íleo paralítico. En la cuenta blanca analítica suele haber leucocitosis (a veces muy llamativa), elevación de la proteína C reactiva y disminución de la albúmina sérica. Puede visualizarse dilatación del colon en las proyecciones simples de abdomen y en la tomografía abdominopélvica. En 1-3% de los pacientes puede haber colitis fulminante con íleo, megacolon 46 Volumen 14, Núm. 1, enero-marzo 2015 tóxico e incluso perforación. Otras complicaciones posibles de la infección con C. difficile son: diarrea crónica, hipoalbuminemia con anasarca y artritis reactiva poliarticular.5 En la Cuadro 2 se enlistan los hallazgos por imagen.6 Aunque en muchos casos los hallazgos endoscópicos son inespecíficos y se limitan a edema, eritema y friabilidad de la mucosa, la identificación de placas amarillentas sobreelevadas adheridas a la mucosa, pero que se pueden desprender, es patognomónica de la colitis seudomembranosa. Las seudomembranas son más pronunciadas en recto y sigmoides. Si la enfermedad es grave puede producirse adelgazamiento de la pared del colon que también puede valorarse mediante la tomografía computada. El “signo del acordeón” es indicativo de inflamación o edema severo de la mucosa colónica. La mucosa refuerza con el contraste endovenoso, con atrapamiento o no del contraste oral5 (contraste oral de alta atenuación en el lumen colónico alternante con pliegues mucosos colónicos de baja atenuación que implican afección inflamatoria mucosa) y el engrosamiento mucoso produce haustración de los pliegues alternando con puentes mucosos transversos llamados el “signo del acordeón” ya que recuerda al instrumento musical. Estos hallazgos son consistentes con colitis que afecta la totalidad del colon (pancolitis). El diagnóstico diferencial de la colitis seudomembranosa incluye la colitis ulcerosa y la colitis isquémica. El “signo del acordeón” comúnmente se asocia con la colitis seudomembranosa pero hay que tener en cuenta que hay otras causas de inflamación de la mucosa. El cuadro clínico y la extensión de las asas que afecta aportan datos fundamentales para arribar a un diagnóstico correcto.6 La tomografía constituye un método diagnóstico altamente sensible y específico para el diagnós- Motta-Ramírez GA et al. Diagnóstico de la colitis seudomembranosa Cuadro 2. Evaluación de los signos tomográficos en el diagnóstico de la colitis seudomembranosa Signo Engrosamiento de la pared colónica > 0.4 cm ≥ 1.0 cm Sensibilidad (%) Especificidad (%) Sensibilidad (%) Especificidad (%) Engrosamiento de la pared Heterogeneidad de la grasa pericolónica 76 57 78 95 46 37 96 98 Ascitis Pared nodulada (incluye al signo del acordeón) 43 19 98 100 31 13 100 100 Heterogeneidad de la grasa pericolónica y ascitis 31 100 24 100 Heterogeneidad de la grasa pericolónica y pared nodulada 17 100 13 100 Heterogeneidad de la grasa pericolónica, ascitis y pared nodulada 11 100 11 100 Cualquier otra combinación de heterogeneidad de la grasa pericolónica, ascitis o pared nodulada 70 93 46 98 Nota: la combinación de la pared nodulada y ascitis sin heterogeneidad de la grasa pericolónica no fue identificada. tico de los procesos inflamatorios colónicos. La correcta identificación, por tomografía, de los hallazgos vinculados con enfermedad inflamatoria colónica es fundamental pues permite eliminar la posibilidad diagnóstica de un proceso maligno subyacente y, por lo tanto, facilitar la toma de decisiones para un tratamiento adecuado.7 signo en diana” (diferentes grados de atenuación mucosa evidentes después del contraste yodado intravenoso causados por inflamación submucosa e hiperemia).8 La tomografía delimita el engrosamiento mural con la identificación del “signo del acordeón”, con heterogeneidad de la grasa pericolónica y ascitis. En general, el engrosamiento mural observado en la tomografía es más significativo que el visualizado en otras enfermedades inflamatorias infecciosas del colon, con excepción de la enfermedad de Crohn. La diferencia con respecto a esta última es que el engrosamiento es más irregular.7 La tomografía es útil para la identificación de las complicaciones asociadas con la colitis seudomembranosa como la neumatosis o la perforación.8 Las paredes del colon y del intestino delgado son sitios frecuentes de afecciones agudas, como la diverticulitis o isquemia intestinal, y crónicas como la enfermedad inflamatoria intestinal o las neoplasias. Ante la sospecha de estas enfermedades la tomografía computada es cada vez más empleada, como lo es también en la evaluación de cuadros de síndrome doloroso abdominal caracterizado clínicamente como inespecífico. La tomografía abdominopélvica es utilizada ampliamente para establecer el diagnóstico de colitis seudomembranosa. Los hallazgos que permiten caracterizarla son la heterogeneidad de la grasa pericolónica, la identificación de los signos “del acordeón, del doble halo y el El engrosamiento de la pared intestinal, por sí solo, es un signo inespecífico y como hallazgo aislado tiene un valor limitado para su análisis. Es por esto que la morfología y el reforzamiento de la pared pueden ser útiles para un acercamiento al diagnóstico más probable.9,10 47 Anales de Radiología México El objetivo de este trabajo es reconocer la clave diagnóstica para identificar y diferenciar a la colitis seudomembranosa de los distintos tipos de colitis mediante tomografía; analizando la distribución, los signos del acordeón, del doble halo y el signo en diana, la morfología de la pared del colon, la mucosa, la grasa pericólica, adenopatías o ascitis y algunos otros hallazgos intraabdominales extracolónicos específicos. Relacionaremos los diferentes patrones de estos puntos con el tipo de colitis correspondiente, centrándonos en la colitis seudomembranosa. MATERIAL Y MÉTODOS Estudio descriptivo, observacional, transversal, retrospectivo y unicéntrico realizado en el Hospital Central Militar. El universo de pacientes incluyó a los que ingresaron a nuestra institución, con diversos diagnósticos clínicos (en el periodo de 3 años comprendido entre el 1 de enero del 2012 y el 31 de diciembre del 2014) en los que, con base en antecedentes de colitis seudomembranosa o hallazgos en tomografía, se señaló la posibilidad de colitis seudomembranosa bajo los siguientes criterios de inclusión: pacientes con síndrome doloroso abdominal, con o sin sospecha de origen colónico, en los que se identificó afección de la mucosa colónica, pacientes con síndrome diarreico en estudio, con antecedente o sospecha de lesión neoplásica primaria o deposito secundario en tracto gastrointestinal, pacientes con valores de creatinina sérica menores a 2 mg/dL y pacientes sin antecedentes de reacción a los compuestos yodados. Criterios de exclusión: pacientes con valores de creatinina sérica mayores de 2 mg/ dL y pacientes con antecedentes de reacción a los compuestos yodados, así como aquellos sin antecedentes que presentaron reacción durante la realización del estudio; pacientes en los cuales se realizaron estudios incompletos o con una técnica inadecuada en relación con el protocolo establecido de tomografía abdominopélvica. Cri- 48 Volumen 14, Núm. 1, enero-marzo 2015 terio de eliminación: pacientes que no cumplían con los criterios de selección de la población. Recolección de la información: antes de la realización del estudio es de suma importancia conocer si en fecha reciente se han realizado otros estudios en el Departamento de Radiación ionizante, en especial si en alguno de ellos se utilizó medio de contraste yodado intravenoso (riesgo de nefrotoxicidad). El médico tratante que refiere al paciente, o en su caso el médico radiólogo, deberá preguntarle específicamente antecedentes de: enfermedad renal, cirugía renal, proteinuria, diabetes mellitus, hipertensión, gota, toma reciente de medicamentos nefrotóxicos; estos datos deberán ser referidos en la solicitud del estudio o informados al Departamento de Radiación Ionizante, subsección de tomografía computada. Al momento del estudio el paciente debe cumplir con un ayuno de más de 6 horas. Si el paciente toleraba la vía oral y no tenía contraindicaciones para la ingesta de líquidos se le solicitó que ingiera 1 litro y medio de contraste oral neutro (agua) entre 15 y 30 minutos antes del estudio para distender al tracto gastrointestinal. Los estudios se realizaron en equipo de tomografía computada de 16 y 64 detectores, con protocolo abdominopélvico en fase simple y con contrastes oral e intravenoso (fase venosa portal). Métodos para el análisis de los resultados: un número importante de pacientes con patología inflamatoria o infecciosa del colon clínicamente se reconocen con síndrome doloroso abdominal inespecífico y la tomografía es utilizada como herramienta diagnóstica complementaria. Aunque el diagnóstico final está basado en resultados de laboratorio, colonoscopia y biopsia, la tomografía computada es un método útil para reconocer la posibilidad de colitis seudomembranosa, evaluar la afectación intramural, su extensión, así como las alteraciones y compli- Motta-Ramírez GA et al. Diagnóstico de la colitis seudomembranosa caciones asociadas. El médico radiólogo debe basarse y apoyarse en las imágenes axiales en todas sus fases y, después del procesamiento, en las reconstrucciones multiplanares y tridimensionales. Todo ello para la obtención del mejor diagnóstico y así proporcionar la mayor información posible al médico clínico tratante. El listado que contiene el formato del análisis e interpretación de los distintos tipos de colitis mediante tomografía computada, establece abordaje y características generales por imagen.9 (Cuadros 3-7). Para establecer una adecuada aproximación diagnóstica hemos de tener en cuenta fundamentalmente tres hallazgos mediante tomografía: 1. Morfología de la pared del colon, engrosamiento parietal, en el cual debemos analizar: a) Grado de engrosamiento b) Simetría/asimetría c) Extensión 2. Atenuación mural 3. Alteraciones asociadas: Cuadro 3. Diagnóstico de colitis seudomembranosa por imagen seccional: factores de riesgo, antecedentes y hallazgos de laboratorio y endoscopia (continúa en la siguiente página) Número de Edad Sexo paciente Factores de riesgo (antibiótico) Laboratorio Endoscopia no realizado realizado (+) no realizado no realizado realizado (+) unión rectosigmoidea realizado (+) realizado (+) realizado (+) realizado (+) realizado (+) realizado (+) realizado (+) 1 53 F 2 3 61 41 M F Cefalotina/clindamicina/ ciprofloxacina Clindamicina Ceftriaxona 4 5 6 7 8 9 10 68 67 46 79 53 69 63 M M F M F M F Ertapenem/ceftriaxona Clindamicina/levofloxacina Ceftriaxona Levofloxacina Ceftriaxona Ceftriaxona Ceftriaxona 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 72 44 64 79 63 39 78 26 42 26 54 93 70 55 64 77 83 64 F F F F F M M M M F F M M M M F F F Levofloxacina Ceftriaxona Ceftriaxona/clindamicina Ceftriaxona/clindamicina Ceftriaxona/clindamicina Ceftriaxona/clindamicina Ceftriaxona Ceftriaxona Ceftriaxona/clindamicina Ceftriaxona Ceftriaxona Ceftriaxona Piperacilina/tazobactam Ceftriaxona Ceftriaxona/levofloxacina Ceftriaxona Ceftriaxona Ceftriaxona/levofloxacina Antecedentes Cáncer pulmonar Cáncer mama no realizado no realizado no realizado no realizado no realizado no realizado C. difficile positivo no realizado no realizado no realizado realizado (+) no realizado realizado (+) no realizado Realizado, normal no realizado realizado (+) no realizado realizado (+) no realizado realizado (+) no realizado no realizado no realizado realizado (+) no realizado realizado (+) no realizado realizado (+) no realizado realizado (+) no realizado no realizado no realizado no realizado no realizado no realizado no realizado realizado (+) no realizado no realizado no realizado no realizado 49 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 Cuadro 3. Diagnóstico de colitis seudomembranosa por imagen seccional: factores de riesgo, antecedentes y hallazgos de laboratorio y endoscopia (continuación) Número de Edad Sexo paciente Factores de riesgo (antibiótico) Laboratorio Endoscopia Antecedentes no realizado C. difficile positivo no realizado no realizado no realizado no realizado no realizado no realizado no realizado no realizado no realizado no realizado realizado (+) no realizado Cáncer de endometrio realizado no realizado realizado (+) no realizado 29 30 47 56 M F Ceftriaxona Ceftriaxona 31 32 33 34 35 36 37 38 39 40 73 72 80 66 65 82 59 71 30 62 F M F F F F F F F M 41 42 81 76 M M No antibiótico Ceftriaxona/clindamicina Ceftriaxona/levofloxacina Ceftriaxona Ceftriaxona Ceftriaxona Ceftriaxona Ceftriaxona Ceftriaxona Ceftriaxona/clindamicina/ ciprofloxacina Ceftriaxona/levofloxacina No antibiótico 43 44 45 46 47 48 55 37 92 66 94 68 M F F M M F Ceftriaxona Ceftriaxona Ceftriaxona Ceftriaxona Cefalotina Ceftriaxona/ciprofloxacina no realizado no realizado no realizado no realizado no realizado no realizado realizado (+) no realizado no realizado realizado (-) no realizado no realizado 49 50 51 52 53 86 31 68 80 68 M M M F F Ceftriaxona No antibiótico Ceftriaxona Antibiótico no precisado Ceftriaxona no realizado no realizado no realizado no realizado no realizado realizado (+) no realizado realizado (-) no realizado no realizado realizado (+) realizado (+) realizado (+) realizado (+) realizado (+) realizado (+) no realizado no realizado realizado (+) realizado (+) Cáncer de endometrio Linfoma no Hodgkin Adenocarcinoma ampolla de Vater Cuadro 4. Diagnóstico de colitis seudomembranosa por imagen seccional que muestra el motivo del estudio de tomografía (continúa en la siguiente página) Número de paciente 1 2 3 4 5 6 7 8 9 50 Motivo del estudio Politraumatizada con estancia prolongada, SRIS Distension abdominal, fiebre, diarrea Ca mama, SxDAA, falla renal, descartar AVM No comentado DM2, HTAS, gastropatía atrofica, probable tumor ciego. Sospecha NEO PO de valvuloplastia, diarrea subita con moco, antibioticoterapia amplio espectro, descartar CPM Leucocitosis 22 000, antecedente de ingesta de multiples medicamentos Rectopexia, SxDAA y distension, leucocitosis, se solicita para identificar perforacion DM2, HTAS, ERCT diálisis peritoneal; choque mixto, leucocitosis Motta-Ramírez GA et al. Diagnóstico de la colitis seudomembranosa Cuadro 4. Diagnóstico de colitis seudomembranosa por imagen seccional que muestra el motivo del estudio de tomografía (continúa en la siguiente página) Número de paciente Motivo del estudio 10 11 12 13 14 15 16 17 18 19 20 21 22 23 Antecedentes de colitis seudomembranosa, se solicita para identificar complicaciones IVU complicado con colitis seudomembranosa, descartar AVM, VS, colon tóxico PO de osteosintesis, dolor abdominal, PCR 450 No comentado Gastroenteritis, descartar AVM PO lumbectomia izquierda, descartar colección residuales Traumatismo con múltiples fármacos; distensión abdominal, evacuaciones diarreicas, leucocitosis Antecedentes de colitis seudomembranosa, descartar megacolon tóxico; nefrópata ERCT, síndrome febril, sospecha de colecciones Antecedentes de colitis seudomembranosa, sospecha de perforacion intestinal Osteomielitis, estancia prolongada, SxDAA, leucocitosis, identificar colitis seudomembranosa PO de transplante renal, síndrome febril, descartar colecciones Colitis neutropénica, sospecha de megacolon tóxico NAC, diarrea moco y sangre, tratamiento con cefalosporinas EH, SxDAA, se solicita estudio por sospecha de perforación intestinal 24 DM, HTAS, nefropata, leucocitosis 40 000, evacuaciones diarreicas, se solicita para identificar colitis seudomembranosa. Estatus posembolizacion arteria gastroduodenal. Excrecion vicariante 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 Nefrópata con retiro de catéter de DP, se solicita para descatar peritonitis o absceso de pared abdominal Síndrome diarreico de 1 año de evolución, pérdida de peso de 5 kg en último mes, masa flanco izquierdo DM, HTAS, Sx DAA Evacuaciones diarreicas, multitratado con antibióticos, leucocitos 20 000, sospecha de AVM SxDAA, intolerancia via oral, fiebre, sospecha de AVM Ca de endometrio, epigastralgia Hepatopatia crónica, hipertensión y taquicardia, se solicita para descartar sangrado No comentado en solicitud Distensión abdominal, dolor, se sospecha bloqueo intestinal ERC/nefrectomía simple izquierda Cáncer de endometrio, PO de cistostomía por reflujo vesicoureteral derecho Colitis seudomembranosa, leucocitosis, descartar megacolon tóxico Gastroenterocolitis 7 dias, SxDAA y distensión abdominal SxDAA, hemiabdomen izquierdo, hematoquecia con sospecha de diverticulitis. Dialisis peritoneal Sospecha de colecciones, secundario a colecistectomia y CPRE, leucocitosis de 30 000 Sangrado de tubo digestivo alto, complicación de colitis seudomembranosa. Sospecha de megacolon tóxico ED complicada vs. colitis seudomembranosa ERCT, DP, pobre tolerancia a la vía oral DM, ERCT, SxDAA Antecedentes de aracnoditis, SxDAA, descartar apendicitis aguda 45 46 47 48 49 50 51 Neumonía de focos múltiples, descartar proceso infeccioso residual Antecedente de colitis postCPRE, búsqueda de colecciones Asintomático, PO artroplastía cadera derecha, hematuria Sospecha de sangrado abdominal activo SxDAA, pancreatitis vs. coledocolitiasis SxDAA, pancreatitis aguda DM, HTAS. Estudio para definir pancreatitis aguda Lipasa 1028 51 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 Cuadro 4. Diagnóstico de colitis seudomembranosa por imagen seccional que muestra el motivo del estudio de tomografía (continuación) Número de paciente Motivo del estudio 52 53 SxDAA, hidrocolecisto DM2, SxDAA, infecciones de vías urinarias recurrentes, litiasis renal bilateral y catéter doble J. Colitis seudomembranosa, leucocitosis, descartar megacolon tóxico AVM: accidente vascular mesentérico; CA: cáncer; CPRE: colangiopancreatografía retrógrada; DM2: diabetes mellitus 2; DP: diálisis peritoneal; ERC: enfermedad renal crónica; ERCT: enfermedad renal crónica terminal; HTAS: hipertensión arterial sistémica; IVU: infección de vías urinarias; NAC: neumonía adquirida en la comunidad; PO: posoperatorio; SRIS: síndrome de respuesta inflamatoria sistémica; SxDAA: síndrome doloroso abdominal agudo. I. Engrosamiento parietal a. Grado de engrosamiento. El espesor parietal normal no suele sobrepasar los 0.3 cm. Este dato varía en relación con la distensión luminal; cuando el lumen se encuentre distendido el grosor puede ser de 0.1-0.2 cm; por el contrario, cuando se encuentre colapsado puede alcanzar hasta 0.4 cm. Por ello el engrosamiento de la pared colónica se considera a partir de los 0.4 cm y se demostrará mejor en las zonas en las que el colon esté distendido por aire o agua. Las colitis que presentan mayor grado de engrosamiento son la enfermedad de Crohn (1.1 ± 0.5 cm) y la colitis seudomembranosa. b.Simetría/asimetría. Habitualmente el engrosamiento concéntrico (simétrico) de la pared del colon se relaciona con procesos no neoplásicos: infección, inflamación, edema, isquemia. Aunque hay dos excepciones a esta “norma”: el linfoma y el carcinoma escirro. Por otro lado, un engrosamiento asimétrico es más sugestivo de etiología tumoral exceptuando la enfermedad de Crohn. c. Extensión. El análisis en la distribución y la extensión de la afectación colónica: focal, segmentaria, difusa y este otro hallazgo en la tomografía que 52 hemos de analizar ya que nos auxilia a establecer y acotar un diagnóstico diferencial. II. Atenuación mural. Mediante la tomografía es factible evaluar las alteraciones de la pared intestinal mediante una caracterización de los cambios de la atenuación mural que se agrupan en diferentes patrones: blanco, gris, halo de agua, halo de grasa y negro. La identificación de los signos del acordeón, del doble halo y del signo en diana.9 III.Alteraciones asociadas. La identificación de anomalías asociadas (adenopatías, alteración de la grasa pericólica, calcificaciones, afección a órganos sólidos, ascitis; algunos otros hallazgos intraabdominales colónicos11 como el megacolon tóxico y extracolónicos específicos o fístulasabscesos) pueden ser clave a la hora de establecer un diagnóstico de sospecha. A pesar de todo, con base en los hallazgos anteriormente descritos, el diagnóstico de las colitis sigue siendo complejo debido a que algunas de estas características se solapan entre algunos tipos haciendo difícil su diferenciación. En la atención de los casos graves es crítico identificar a los pacientes lo antes posible e iniciar el tratamiento tan pronto como se sospeche el diag- Motta-Ramírez GA et al. Diagnóstico de la colitis seudomembranosa Cuadro 5. Diagnóstico de colitis seudomembranosa por imagen seccional: fecha del estudio solicitado y realizado (continúa en la siguiente columna) Cuadro 5. Diagnóstico de colitis seudomembranosa por imagen seccional: fecha del estudio solicitado y realizado (continuación) Número de paciente Fecha del estudio Estudio de imagen solicitado Número de paciente 1 22 IV 2014 TC abdomen contrastado oral yodado e IV 34 26 VII 2014, 7 TC abdomen contrastado IV VIII 2014 2 3 07 IV 2014 20 IV 2014 TC abdomen contrastado IV Angiotomografía de aorta abdominal 35 36 4 08 V 2014 TC abdomen contrastado oral yodado 5 6 7 8 21 V 2014 07 V 2014 14 V 2014 25 V 2014 TC abdomen contrastado IV TC abdomen contrastado IV TC abdomen contrastado TC abdomen contrastado transrectal e IV 26 VII 20014 TC abdomen simple 21, 26 VII TC abdomen 20014 contrastado IV progresión 9 IX 2014 TC abdomen contrastado IV 2 X 2014 TC abdomen simple 12 IX 2014 TC toracoabdominopélvica contrastada 9 14 VI, 16 y 24 VI 2014 TC abdomen FS 14 VI y contrastado 16 VI 2014 10 11 12 13 16 VI 2014 06 VII 2014 18 II 2014 20 III 2014 TC abdomen contrastado IV TC abdomen contrastado IV TC abdomen contrastado IV TC abdomen contrastado oral e IV 14 31 III 2014 Angiotomografía de aorta abdominal 15 16 11 IV 2014 12 , 17 IV 2014 TC abdomen simple TC abdomen contrastado IV 17 18 19 20 29 IV, 2 V 2014 TC abdomen contrastado IV progresión 29 IV y 2 V 2014 29 I 2014 01 VII 2014 07 VII 2014 TC abdomen simple TC abdomen contrastado IV TC abdomen contrastado oral, IV y transrectal 21 22 23 24 25 26 20 V 2014 TC abdomen contrastado IV 04 VII 2014 TC abdomen contrastado IV 12 VII 2013 TC abdomen contrastado IV 7 VIII 2012 TC abdomen contrastado IV 30 I 2014 TC abdomen contrastado 24 IV, 2 V 2014 TC abdomen progresión contrastado IV 27 28 29 30 31 32 33 12 IV 2013 TC abdomen simple 8 VII 2013 TC abdomen contrastado IV 09 VIII 2012 TC abdominopelvica 3 fases 30 V 2014 TC abdomen contrastado IV 19 VII 2013 TC abdomen contrastado IV 23 VII 2014 TC abdomen contrastado IV 26 VII 2014 TC abdomen contrastado IV 37 38 39 Fecha del estudio Estudio de imagen solicitado 40 41 42 43 44 22 IX 2014 1 VIII 2014 7 VIII 2014 10 I 2014 7 IX 2014 TC abdomen contrastado IV TC abdomen contrastado IV TC abdomen contrastado IV TC abdomen contrastado Angiotomografía de aorta toracoabdominal 45 27 XI 2013 TC toracoabdominopélvica contrastada 46 2 I 2014 TC toracoabdominopélvica contrastada 47 48 49 50 51 52 53 3 XI 2014 11 IX 2011 24 IX 2012 6 V 2011 6 XI 2014 18 XII 2014 26 XII 2014 Urotomografía TC abdomen contrastado IV TC abdomen contrastado IV TC abdomen contrastado IV TC dinámica páncreas TC abdomen simple TC abdomen contrastado IV FS: fase simple; IV: intravenoso; TC: tomografía computada. nóstico. Los marcadores de enfermedad grave incluyen síndrome doloroso abdominal intenso o distensión aérea colónica, seudomembranas en la mucosa rectosigmoidea, engrosamiento de la pared colónica en la tomografía computada, ascitis, inestabilidad hemodinámica, leucocitosis, creatinina elevada, decremento de la albúmina sérica y alteración del estado mental.12 Bioética. Normas técnicas 313, 314, 315. Ley General de Salud en su apartado de investigación en humanos (Art. 100). Por no haber ninguna 53 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 Cuadro 6. Diagnóstico de colitis seudomembranosa por imagen seccional: hallazgos por tomografía (continúa en la siguiente página) Atenuación mural Morfología de la pared del colon, engrosamiento parietal Núm. de paciente Grado de engrosamiento Simetría/ asimetría Extensión Distensión aérea colónica 1 Pancolitis 1.9 Simetría Pancolitis Distensión aérea colónica Sí 2 Pancolitis 2.30 Simetría Pancolitis Nula distensión colónica Sí 3 Pancolitis 1.3 Simetría Pancolitis Sí 4 1.2 Asimetría 5 1.6 Asimetría Distensión líquida colónica Colon Nula distensión derecho y colónica sigmoides Ciego Distensión colónica por residuo intraluminal 1.3 Simetría Pancolitis Sí Sí 7 0.7 Asimetría Distensión líquida colónica Sigmoides Nula distensión colónica 8 1.1 Asimetría Sigmoides y colon izquierdo Pancolitis Sí Sí 6 Pancolitis Distensión colónica positiva Simetría 10 Pancolitis 1.1 Simetría Pancolitis Nula distensión colónica Sí 11 Pancolitis 1.80 Simetría Pancolitis Distensión líquida y con residuo intraluminal colónica Sí 12 13 Pancolitis Pancolitis 0.90 1.50 Simetría Simetría Pancolitis Pancolitis Distensión aérea colónica Sí Asimetría Transverso y rectosigmoides Ciego y colon derecho 1.60 Asimetría 16 1.50 Asimetría 17 1.10 Asimetría Colon izquierdo y sigmoides Ciego, colon derecho y sigmoides Sí Sí Pancolitis 1.1, visible 15 Signo en diana Sí 9 14 54 Reforza- Signo del Signo miento acordeón del halo mucoso acuoso Sí Distensión líquida colónica Sí Sí Sí Sí Sí Sí Sí Distensión líquida colónica Sí Sí Distensión aérea colónica Sí Sí Sí Motta-Ramírez GA et al. Diagnóstico de la colitis seudomembranosa Cuadro 6. Diagnóstico de colitis seudomembranosa por imagen seccional: hallazgos por tomografía (continúa en la siguiente página) Atenuación mural Morfología de la pared del colon, engrosamiento parietal Núm. de paciente Grado de engrosamiento 18 19 Pancolitis Pancolitis 1.10 20 21 Pancolitis 1.00 22 23 Simetría/ asimetría Simetría Simetría Simetría Asimetría Asimetría Pancolitis 24 1.30 1.00 Asimetría 25 Pancolitis 1.20 26 Pancolitis 0.90 Asimetría 27 28 Pancolitis Pancolitis 1.00 Simetría Simetría 29 Pancolitis 0.9 30 31 Pancolitis 32 Extensión Distensión aérea colónica Reforza- Signo del Signo miento acordeón del halo mucoso acuoso Distensión líquida y con residuo intraluminal colónica Sí Distensión líquida colónica Sí Sí Signo en diana Sí Colon derecho Sigmoides Ciego, co- Nula distensión lon derecho colónica Nula distensión colónica Sí Sí Sí Ciego, co- Nula distensión lon derecho colónica Sí Sí Nula distensión colónica Sí Sí Sí Simetría Nula distensión colónica Sí Sí Sí 1.2 Asimetría Ciego, coDistensión lon derecho líquida y con y sigmoides residuo intraluminal colónico Sí Sí 0.9 Simetría Nula distensión colónica Sí Sí 2.0 Asimetría Sigmoides Nula distensión colónica Sí Sí 33 34 35 36 37 Pancolitis Pancolitis Pancolitis Pancolitis Pancolitis 1.7 1.0 Simetría Distensión líquida colónica 38 Pancolitis 1.3 Simetría Nula distensión colónica 39 Pancolitis 0.8 Simetría Distensión líquida colónica Sí 1.8 Sí Sí Sí Sí Sí 55 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 Cuadro 6. Diagnóstico de colitis seudomembranosa por imagen seccional: hallazgos por tomografía (continuación) Morfología de la pared del colon, engrosamiento parietal Núm. de paciente Grado de engrosamiento Simetría/ asimetría Extensión Atenuación mural Distensión aérea colónica Reforza- Signo del Signo miento acordeón del halo mucoso acuoso 40 Pancolitis 1.3 Simetría Distensión líquida colónica Sí Sí 41 Pancolitis 1.1 Simetría Distensión líquida colónica Sí Sí 0.9 Asimetría Ciego, coDistensión lon derecho líquida y con residuo intraluminal colónico Sí Sí 42 43 44 Pancolitis Pancolitis 0.8 Simetría Distensión líquida colónica Sí Sí 45 46 47 Pancolitis Pancolitis 1.40 Simetría Nula distensión colónica Sí Sí Distensión líquida colónica Sí 48 49 50 Pancolitis Pancolitis 51 52 53 Pancolitis Pancolitis Pancolitis Asimetría 0.90 Signo en diana Sí Ciego, colon derecho Simetría intervención en el estado del individuo el estudio se considera de riesgo mínimo. La firma de hoja de consentimiento informado se obtuvo en todos los pacientes antes de la realización de la tomografía computada abdominopélvica. Los datos y resultados contenidos en el estudio se utilizarán exclusivamente con fines académicos por lo que se resguarda el anonimato y confidencialidad de los participantes. Sí pacientes menores de 65 años y 35 (66%) mayores de 65 años. El rango de edad varió de 26 a 92 años (masculinos y femeninos); de 20 a 29 años 2 pacientes (4%); de 30 a 39 años 4 pacientes (8%); de 40 a 49 años 5 pacientes (9%); de 50 a 59 años 7 pacientes (13%); de 60 a 69 años 16 pacientes (30%); de 70 a 79 años 10 pacientes (19%); de 80 a 89 años 6 pacientes (11%) y de 90 a 99 años 3 pacientes (6%). Cuadros 3-7, Figuras 1-8. RESULTADOS Nuestro universo incluyó a 53 pacientes: 24 hombres (45%) y 28 mujeres (55%); 18 (34%) 56 Los rangos de mayor incidencia fueron el de 60 a 69 años con 16 pacientes (30%) y el de 70 a 79 años con 10 pacientes; ambos suman 26; Motta-Ramírez GA et al. Diagnóstico de la colitis seudomembranosa Cuadro 7. Diagnóstico de colitis seudomembranosa por imagen seccional: alteraciones y padecimientos asociados (continúa en la siguiente columna) Número de paciente Alteración de la grasa pericólica Ascitis 1 2 3 4 5 6 7 8 9 Sí por ascitis Sí por ascitis Sí por ascitis Sí escaso LL Sí pericecal Sí por ascitis Sí escaso LL Sí escaso LL Sí por ascitis Sí Sí Sí Sí 10 11 Sí por ascitis Sí por ascitis Sí Sí 12 Neumoperitoneo masivo, nefrópata Derrame pleural bilateral, foco neumónico bilateral Sí, escaso pero presente Sí, escaso pero presente 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 Sí Sí Sí Sí Adenopatías, calcificaciones, afección a órganos sólidos; otros hallazgos intraabdominales extracolónicos específicos o fístulasabscesos Sí por ascitis Sí escaso LL Sí escaso LL Sí por ascitis Anasarca Sí Sí Nefrópata Cuadro 7. Diagnóstico de colitis seudomembranosa por imagen seccional: alteraciones y padecimientos asociados (continuación) Número de paciente Alteración de la grasa pericólica 33 34 35 36 37 38 39 Sí por ascitis 40 41 42 43 44 45 46 47 48 49 50 51 52 53 Sí por LL Sí por LL Sí por LL Ascitis Adenopatías, calcificaciones, afección a órganos sólidos; otros hallazgos intraabdominales extracolónicos específicos o fístulasabscesos Hepatópata Nefrópata Si por ascitis Sí por ascitis Sí por LL Nefrópata Estatus posoperatorio Nefrópata Sí por LL Sí por LL Sí por ascitis LL: líquido libre. es decir, 50% de los pacientes del universo en estudio. No Sí por ascitis Sí por ascitis No Sí escaso LL Sí por ascitis Cardiópata Sí por ascitis Hepatópata Nefrópata, absceso perirrenal izquierdo En las solicitudes que condicionaron la realización del estudio de tomografía se señaló la sospecha de colitis seudomembranosa, ya fuera por identificación en estudio previo o por sospecha clínica en 11 (20%) pacientes y sin sospecha clínica y sin diagnóstico previo en 42 (80%). En las solicitudes de tomografía se señaló en 12 casos (22%) síndrome doloroso abdominal agudo; en 6 pacientes (11%) diversos antecedentes qui- 57 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 A B Figura 1. Paciente número 2, selección de imagen axial: colon derecho, signo del acordeón. Nótese el líquido libre intraabdominal. Figura 3. A-B) Paciente número 8, selección de imagen axial con medio de contraste transrectal: distensión colónica con engrosamiento mucoso colónico y el signo del acordeón. recha); 7 pacientes (12%) con diabetes mellitus y complicaciones asociadas. Figura 2. Paciente número 3, reconstrucción multiplanar coronal: reforzamiento mucoso del colon con distensión liquida. rúrgicos (estatus posoperatorio de valvuloplastia, por rectopexia, por osteosíntesis, lumbectomía, trasplante renal y por artroplastia de cadera de- 58 El abordaje por imagen se hizo en 7 casos (13%) con tomografía computada simple; en 2 (4%) con tomografía computada con medio de contraste oral; en 3 (5%) con tomografía computada toracoabdominopelvica con medio de contraste intravenoso; en 2 (4%) con tomografía computada contrastada oral e intravenosa; en 31 (57%) con tomografía computada con medio de contraste intravenoso; en 1 (2%) con tomografía computada con Motta-Ramírez GA et al. Diagnóstico de la colitis seudomembranosa Figura 4. Paciente número 13, selección de imagen axial: engrosamiento mucoso colónico con el signo del acordeón y distensión hidroaérea colónica. Nótese el líquido libre intraabdominal. Figura 6. Paciente número 17, selección de imagen axial: región cecal con el signo del acordeón. Nótese la distensión liquida intraluminal y el engrosamiento mucoso posterior al contraste intravenoso. urotomografía y en 1 (2%) con pancreatomografía computada. En las solicitudes de tomografías no se señaló, en ninguna, el uso de antibióticos, su tipo, tiempo o número. En relación con el antecedente de uso de antibióticos asociados con la colitis seudomembranosa se identificaron 50 pacientes (94%). En 2 (4%) pacientes no se identificó el uso de antibiótico con el diagnóstico de colitis seudomembranosa por tomografía computada. Sólo hubo 1 paciente (2%) bajo tratamiento con antibiótico oral no especificado. Figura 5. Paciente número 17, selección de imagen axial: región cecal con el signo del acordeón. Nótese la distensión liquida intraluminal y el engrosamiento mucoso posterior al contraste intravenoso. medios de contraste intravenoso y transrectal; 1 (2%) con tomografía computada con medios de contraste oral, intravenoso y transrectal; en 3 (6%) con angiotomografía computada angiotomografía computada para evaluación de aorta toracoabdominal; en 1 (2%) tomografía computada trifásica, en 1 (2%) con técnica de Se encontraron 29 pacientes (54%) bajo tratamiento con ceftriaxona, 1 (2%) con cefalotina, 2 (4%) con levofloxacina, 1 (2%) con clindamicina; 17 (31%) con 2 o más antibióticos en combinaciones: ceftriaxona/clindamicina (6, 11%), ceftriaxona/levofloxacina (5, 7%), ertapenem/ceftriaxona (1, 2%), clindamicina/ levofloxacina (1, 2%), ceftriaxona/ciprofloxacina (1, 2%), piperacilina/tazobactam (1, 2%) y cefalotina/clindamicina/ciprofloxacina (2, 4%). Sólo 1 paciente (2%) bajo tratamiento con antibiótico oral no especificado. Cuadro 3. 59 Anales de Radiología México A B Figura 7. A) Paciente número 28, selección de imagen axial: signo del halo acuoso en la mucosa colónica, tanto del colon derecho como del izquierdo, y engrosamiento mucoso posterior al contraste intravenoso. B) Signo del halo acuoso en la mucosa colónica del sigmoides y engrosamiento mucoso posterior al contraste intravenoso. En 2 pacientes (4%) se realizó prueba de laboratorio que resultó positiva para C. difficile. Cuadro 3. A 18 pacientes (34%) no se les realizó estudio colonoscópico. A 35 pacientes (66%) se les realizó estudio colonoscópico con resultado positivo en 32 (60%); en 2 pacientes (4%) el resultado fue negativo y en 1 (2%) se reporto el estudio como normal. Desde el punto de vista de la tomografía multidetector los hallazgos fueron sugerentes de colitis seudomembranosa con pancolitis evidenciada en 37 pacientes (70%) con 16 pacientes (30%) en los que se 60 Volumen 14, Núm. 1, enero-marzo 2015 A B Figura 8. A) Paciente número 29, selección de imagen axial: signo en diana y halo acuoso en la mucosa del colon derecho, así como engrosamiento mucoso posterior al contraste intravenoso. B) Reconstrucción multiplanar coronal: signo del acordeón y halo acuoso en la mucosa colónica del colon transverso; engrosamiento mucoso posterior al contraste intravenoso. Nótese el líquido perivesicular. definió afección segmentaria, asimétrica, focal. Cuadro 3. En los 2 pacientes (4%) con resultado de estudio colonoscópico negativo, la afección por tomografía se caracterizó como pancolitis y en el paciente en el que se reporto el estudio como normal la afección por tomografía se Motta-Ramírez GA et al. Diagnóstico de la colitis seudomembranosa caracterizó como asimétrica. La colitis se define como el engrosamiento mural del intestino grueso (grosor de pared del colon mayor de 0.3-0.4 cm) segmentario o difuso. No hay más hallazgos radiológicos específicos, por lo que para diagnosticarla hay que descartar otras causas de engrosamiento mural colónico como las diverticulitis o las neoplasias. El reforzamiento mucoso se identificó en 28 pacientes (53%). El engrosamiento mural suele ser importante, asimétrico, irregular y de aspecto polipoideo que da lugar al signo del acordeón, el más específico de colitis seudomembranosa que se produce al quedar el contraste oral o rectal (alta densidad) atrapado entre las haustras edematosas y engrosadas (baja densidad); aunque también puede verse sin contraste oral o rectal. A pesar de la especificidad de este signo puede haber otras afecciones que lo produzcan como la colitis isquémica o la infecciosa. El signo del acordeón se identificó en 23 pacientes (43%). El signo en diana en 11 pacientes (21%). También es posible observar el signo del halo de agua por el edema submucoso que se identificó en 4 pacientes (8%). La mucosa muestra reforzamiento irregular y puede asociarse con ascitis, que se identificó en 30 pacientes (56%). En los pacientes con ascitis el antecedente de cardiopatía se definió en 1 paciente (2%), el antecedente de hepatopatía se definió en 2 pacientes (4%) y de nefropatía en 6 (11%). En los pacientes con ascitis el antecedente cirugía reciente se definió en 1 paciente (2%). En 6 pacientes (11%) había el antecedente de primario maligno: en 4 de ellos con cáncer pulmonar, mamario, del ampolla de Vater, linfoma no Hodgkin y en 2 de ellos con cáncer de endometrio. Además, y como condicionante del origen del presente trabajo, se notó que en los años 2011, 2012 y 2013 se identificaron tan solo 2, 3 y 5 pacientes, (4, 6 y 9%, respectivamente) y en el año 2014 se identificaron 43 pacientes, lo que representó 81% de nuestro universo y motivó el análisis retrospectivo de casos y la búsqueda intencionada de su relación con la antibioticoterapia o cualesquiera otra causa; la principal fue la relacionada con el uso de antibióticos, condicionante de la colitis seudomembranosa hasta en 50 pacientes (94%); donde con un solo antibiótico 33 (62%) y 17 pacientes (31%) bajo tratamiento con 2 o más antibióticos, con combinaciones. Sólo hubo 1 (2%) paciente bajo tratamiento con antibiótico oral no especificado. DISCUSIÓN La colitis seudomembranosa es una complicación grave de la diarrea asociada con C. difficile que puede llegar a ser mortal. La diarrea asociada con C. difficile es más frecuente en el hospital y se produce tras la toma de antibióticos en pacientes con factores de riesgo asociados. Desde la década de los 90 la incidencia de esta enfermedad en la comunidad ha aumentado.13 El C. difficile puede llegar a producir desde colitis de intensidad variable hasta afectación de órganos extraintestinales.13 En los últimos 20 años la infección por C. difficile se ha convertido en un problema de salud creciente. Constituye la causa más frecuente de diarrea nosocomial; está presente en 15-20% de las diarreas asociadas con el consumo de antibióticos y en 96– 100% de las colitis seudomembranosas.13 La diarrea relacionada con el clostridio, que ahora se conoce como infección por C. difficile, es aún motivo de alarma por el sorprendente incremento de su frecuencia y como causa importante de morbilidad y mortalidad. En la actualidad se reconoce como la infección más común en pacientes hospitalizados con cifras de mortalidad que oscilan entre 5 y 12%. En Estados 61 Anales de Radiología México Unidos se ha reportado un incremento de tres veces de la frecuencia, del año 2000 al 2005, y de cuatro veces en la mortalidad de 1999 al 2004. En Europa también se ha registrado este aumento. En Corea del Sur, Sun y sus colaboradores estudiaron la incidencia de infección por C. difficile en 17 hospitales y encontraron 17.2 casos/10 000 en 2004, con aumento a 27.4/10 000 en 2008 con un total de 1 357 casos ese año, de los cuales una proporción de 20.5% presentó colitis seudomembranosa.12 La diarrea asociada con la infección por C. difficile debe sospecharse en cualquier paciente que desarrolla un cuadro diarreico durante un curso de terapia antibiótica o tras finalizar el mismo. La identificación de sangre macroscópica en la evacuación diarreica no es un hallazgo característico de la enfermedad, aunque las pruebas utilizadas para la detección de sangre oculta sí pueden ser positivas. El que se demuestren leucocitos en heces no siempre es indicativo de colitis y, por el contrario, su determinación puede resultar negativa en pacientes en los que se ha demostrado la positividad de la toxina en heces. El hallazgo más frecuente (aunque inespecífico) es un importante engrosamiento de la pared del colon (de hasta 3.2 cm según las series) con frecuencia generalizada (pancolitis), aunque puede ser más segmentaria afectando especialmente al recto-sigmoides. Además de este engrosamiento el colon se encuentra con frecuencia dilatado y puede existir afectación inflamatoria de la grasa pericólica, desproporcionadamente leve con respecto a la alteración parietal. El atrapamiento del contraste oral entre las haustras engrosadas hace que el colon muestre una apariencia de “acordeón” muy sugestiva de esta entidad pero sensible, ya que sólo aparece en casos severos. Figuras 1-8. Puede aparecer líquido libre hasta en un 35% de los casos y en nuestro estudio se identificó hasta en 56%. 62 Volumen 14, Núm. 1, enero-marzo 2015 La diarrea asociada con antibióticos es un problema común que causa una morbilidad significativa en los pacientes.14 Aunque muchos casos no tienen una causa infecciosa determinada y remiten espontáneamente, un gran número son debidos al C. difficile, anaerobio grampositivo. La colitis por C. difficile es una circunstancia en la que una agresión a la flora intestinal normal, habitualmente producida por antibióticos o agentes quimioterapéuticos, permite la colonización del colon por estos organismos y la producción de toxinas características. Estas toxinas producen una variedad de síntomas clínicos que incluyen diarrea, dolor abdominal, fiebre, leucocitosis, sepsis y perforación. Las seudomembranas características compuestas de fibrina, células inflamatorias y desechos celulares se observan en el examen anatomopatológico macroscópico y dan a esta enfermedad el nombre de “colitis seudomembranosa”. El procedimiento de elección para el diagnóstico es el examen microbiológico de heces para C. difficile. La exploración endoscópica del colon con biopsia puede también usarse para realizar el diagnóstico, pero este método es menos sensible y la manipulación mecánica del colon enfermo puede ser arriesgada. Un estudio radiológico simple abdominal puede mostrar dilatación del intestino delgado o grueso con engrosamiento austral y “huellas de pulgar” que indican edema de la pared intestinal. El enema de bario está contraindicado en la enfermedad aguda o cuando el colon está dilatado. Los hallazgos inespecíficos incluyen ulceración, destrucción mucosa y seudopoliposis inflamatoria. La tomografía es muy útil en el diagnóstico de la colitis seudomembranosa, especialmente cuando la enfermedad no se sospecha clínicamente. Aunque el abordaje por imagen del universo que nos ocupa mostró lo múltiple y diverso de los diferentes tipos de estudios en los que se identificó a la colitis seudomembranosa consideramos de Motta-Ramírez GA et al. Diagnóstico de la colitis seudomembranosa importancia el señalar que es indispensable el uso de contraste intravenoso, que fue utilizado en 44 pacientes (83%), lo que permitió definir el reforzamiento mucoso colónico. El contraste oral positivo fue utilizado en 5 (9%) y contraste oral neutro en 6 (11%); el contraste transrectal en 2 (4%) casos. En 2 pacientes (4%) se utilizó únicamente medio de contraste oral. Los hallazgos frecuentes en tomografía son engrosamiento de la pared, engrosamiento mural con escasa atenuación correspondiente a edema mucoso y submucoso, “signo del acordeón”, “signo de la diana” o “signo del doble halo”, estrías pericólicas y ascitis. Figuras nums.18. El hallazgo más común con tomografía en pacientes con colitis seudomembranosa es el engrosamiento de la pared, que habitualmente va de 0.3 a 3.2 cm de diámetro. El engrosamiento mural puede ser circunferencial, excéntrico, liso o polipoideo. La inflamación mucosa y de la pared del colon puede aumentar notablemente después de la administración de contraste intravenoso. El “signo de la diana“, que consiste en dos o tres anillos concéntricos de diferente atenuación, fue originalmente descrito en la colitis ulcerosa y la enfermedad de Crohn, pero también se describe en la colitis seudomembranosa. Este signo indica edema mucoso, submucoso e inflamación. El “signo del acordeón” se observa cuando el contraste administrado por vía oral queda atrapado entre pliegues australes muy engrosados, dando la apariencia de bandas alternantes de gran atenuación (material de contraste) y baja atenuación (edema haustral). El signo del acordeón es altamente sugestivo de colitis seudomembranosa, aunque normalmente se ve sólo en casos avanzados. Su aspecto puede variar dependiendo del grado de edema de los pliegues australes y de la cantidad de contraste atrapado entre los pliegues. Aunque el signo del acordeón es muy sugestivo de colitis seudomembranosa otros hallazgos, como el engrosamiento de la pared, las estrías pericólicas y la ascitis, no son muy específicos y pueden observarse en una gran variedad de enfermedades inflamatorias e infecciosas del colon. La heterogeneidad de la grasa pericólica puede identificarse, pero habitualmente tal cambio es escaso, reflejando la naturaleza mucosa y submucosa de la colitis seudomembranosa. Figuras 1-8. La escasez relativa de la heterogeneidad de la grasa pericólica y la inflamación en la colitis seudomembranosa, en combinación con el engrosamiento marcado de la pared colónica, ayudan a diferenciar esta afección de otros tipos de colitis. La ascitis tiende a producirse en casos severos de colitis seudomembranosa. Debido a que la ascitis es poco común en otras enfermedades inflamatorias intestinales puede ser un hallazgo clínico muy útil. De cualquier forma, la ascitis puede ser descrita también en otros tipos de colitis. Los hallazgos en los estudios de diagnóstico por imagen de la colitis seudomembranosa no son específicos y pueden ser simulados por otras alteraciones que causen también engrosamiento focal o difuso de la pared intestinal. La colitis seudomembranosa puede confundirse con la fase aguda de la colitis ulcerativa y granulosa, la colitis isquémica y la colitis inflamatoria. Las afecciones que causan engrosamiento del colon sin relación con colitis, como infiltración leucémica, linfangectasia colónica y hemorragia pueden ser consideradas como elementos del diagnóstico diferencial. Debido a que la enfermedad puede progresar rápidamente y llegar a ser fatal, el radiólogo debe contemplar la posibilidad de colitis seudomembranosa basándose en los hallazgos de la tomografía.15 El tratamiento anticlostridio apropiado debe instituirse después de obtener confirmación bacteriológica.14,16 Figuras 1-8. Diagnóstico temprano5 La aparición de un cuadro diarreico en un paciente sin otras causas aparentes (incluida 63 Anales de Radiología México la farmacológica), con el antecedente de tratamiento antibiótico en los 2 meses previos, debe ir seguida de la solicitud temprana de una determinación de toxinas de C. difficile en heces (que puede repetirse, si la sospecha clínica es elevada, en 24 horas) así como de coprocultivos. En caso de duda la colonoscopia con toma de muestras para estudio microbiológico e histológico es el procedimiento de referencia. En las solicitudes de estudios que condicionaron la realización del estudio de tomografía se señaló, en la solicitud, la sospecha de colitis seudomembranosa, ya por estudio previo que la había identificado o por la sospecha clínica, en tan solo 20% del universo de pacientes; y sin sospecha clínica y sin diagnóstico previo en 80%. En relación con el antecedente de uso de antibióticos asociados con la colitis seudomembranosa se identificó en 50 pacientes (94%). La utilidad clínica de la tomografía, para la detección de la colitis seudomembranosa, muestra su ya reconocida sensibilidad y especificidad para considerar a la colitis seudomembranosa aún sin la información clínica remitida en la solicitud del estudio. Provocó que el médico tratante cambiase su abordaje, y por lo tanto su consideración diagnóstica, reorientando el estudio del paciente. Seguimiento clínico5 Hasta 20% de los pacientes sufre recaída en los meses siguientes; sin diferencias en función del antibiótico utilizado y el riesgo de un tercer episodio asciende a 50-60%. La mayor parte de las veces la recaída se produce entre 1 y 5 semanas después de finalizar del cuadro clínico. La forma de presentación de este tipo de colitis es variada, desde un cuadro de diarrea que remite espontáneamente, colitis tóxica, hasta el desarrollo de un cuadro de megacolon tóxico o enterocolitis necrosante con perforación colónica. El megacolon tóxico es una complicación 64 Volumen 14, Núm. 1, enero-marzo 2015 grave de la enfermedad inflamatoria intestinal, en su patogénesis está involucrada la producción de óxido nítrico por parte de macrófagos y células musculares del colon inflamado, cursa con parálisis y dilatación del mismo.11 Los criterios para el diagnóstico de megacolon tóxico son: dilatación aguda del colon con diámetro mayor de 6 cm y toxicidad sistémica asociada mínimo con tres de los siguientes aspectos: a) síndrome febril > 38º C, b) frecuencia cardiaca > 120/min, c) leucocitosis con neutrofilia > 10.500 mm3 y d) anemia. En nuestro universo de pacientes ningún tuvo la complicación de megacolon tóxico. Además de los anteriores, al menos con uno de los siguientes: a) deshidratación, b) alteración de conciencia, c) alteración electrolítica y d) hipotensión. 20 a 25% de las colitis seudomembranosas se resuelve de manera espontánea, con medidas generales y suspensión del antibiótico precipitante. De no ser posible debe intentarse el cambio a antibióticos con baja asociación con colitis seudomembranosa. Debe evitarse el uso de antiperistálticos. El metronidazol es el tratamiento de primera elección y tiene un porcentaje de éxito de entre 80 y 100%, similar a la vancomicina pero con menor costo. Se utilizan durante diez días, vía oral, 500 mg cada 8 horas. El tratamiento quirúrgico, asociado con mortalidad de 25 a 67%, está indicado en situaciones de megacolon tóxico, colitis fulminante refractaria al tratamiento médico y ante evidencias o sospecha de perforación colónica (2% en series más numerosas). Con frecuencia, el momento de la indicación de cirugía es una decisión difícil ya que, si es tardía (megacolon tóxico o perforación), tiene mayor mortalidad. A la inversa, la sobreindicación quirúrgica aumenta la morbilidad y la mortalidad de los pacientes (la mayoría de las veces) en estado crítico y con múltiples enfermedades asociadas.15 Motta-Ramírez GA et al. Diagnóstico de la colitis seudomembranosa CONCLUSIÓN Las colitis forman parte de la patología abdominal urgente de alta frecuencia; los hallazgos por tomografía en el diagnóstico etiológico de las mismas no son patognomónicos; no obstante, conocerlos permite realizar una correcta aproximación diagnóstica. Las imágenes de tomografía no son patognomónicas pero, junto con la epidemiología y la clínica, es posible alcanzar si no un diagnóstico de certeza sí de alta probabilidad. Para llegar al diagnóstico correcto de la colitis seudomembranosa hay que analizar cuidadosamente los puntos que hemos desarrollado en este trabajo (distribución, signo del acordeón, del halo, morfología de la pared, mucosa, grasa, adenopatías, ascitis y los hallazgos característicos), la identificación de los hallazgos por tomografía multidetector y su relación estrecha con el uso de antibióticos. En el tratamiento de la colitis seudomembranosa el diagnóstico temprano es esencial para la supervivencia del paciente. También debe considerarse como grave la colitis por C. difficile que aparezca en pacientes de edad avanzada (≥ 65 años), con comorbilidades importantes, ingresados en la unidad de vigilancia intensiva o con inmunodeficiencias, aunque no presenten ninguno de los signos o síntomas anteriores. REFERENCIAS 1. Thoeni RF, Cello JP. CT imaging of colitis. Radiology 2006;240:623 -638. 2. Bouza Santiago E, Peláez García T y Catalán Alonso P. Enfermedad asociada a Clostridium difficile. Medicine 1998;7(74):3422-3426. 3. Ash L, Baker ME, O’Malley CM, Gordon SM, Delaney CP y Obuchowski NA. Colonic abnormalities on CT in adult hospitalized patients with clostridium difficile colitis: Prevalence and significance of findings. AJR 2006;186:1393-400. 4. Trudel JL. Clostridium difficile colitis. Clin Colon Rectal Surg 2007;20:13-17. 5. Disponible en: http://www.elsevierinstituciones.com/ ficheros/booktemplate/9788475927220/files/Capitulo19. pdf 6. Macari M, Balthazar EJ, Megibow AJ. The accordion sign at CT: A nonspecific finding in patients with colonic edema. Radiology 1999;211:743-6. 7. Ahualli J, Méndez Uriburu L, Cikman P, Carpinella JJ. Tomografía computada en las lesiones inflamatorias del colon. RAR 2006;70(4):297-306. 8. Eaton SR, Mazuski JE. Overview of severe clostridium difficile infection. Crit Care Clin 2013;29:827–39. 9. Motta-Ramirez GA, Ruiz Arteaga JD, González Sánchez CB. Abordaje diagnóstico por tomografía computada del engrosamiento de la pared colónica y su correlación endoscópica en pacientes del Hospital Ángeles del Pedregal. Endoscopia 2010;22(Suplemento 1):14-25. 10. Csendes GP, Salas ZA, Herquiñigo RD, Sanhueza SA, Aldana VH. Semiología del intestino en Tomografía Computada: del blanco al negro. Rev Chilena de Cirugía 2008;60(1);22-8. 11. Garma Martínez AG, Ricardez García JA, Blas Azotla R, Sandoval García JP, Gutiérrez del Río FJ, Vicencio Tovar A. Megacolon tóxico por colitis pseudomembranosa. Acta Médica Grupo Ángeles. 2011;9(4):217-20. 12. de Ariño Suárez M. Colitis pseudomembranosa: ¿nuevas toxinas? Revista de Gastroenterología de México 2010;Supl.1(75):120-3. 13. Canales-Simón MR, Gil de Gómez-Barragán MJ y A.M. Vázquez-Medrano AM. Colitis pseudomembranosa en atención primaria. Semergen. 2010;36(10):593–6. 14. Disponible en: http://www.eurorad.org/eurorad/case. php?id=1368&lang=es 15. Kirkpatrick ID, Greenberg HM. Evaluating the CT diagnosis of Clostridium difficile colitis: should CT guide therapy? AJR 2001;176(3):635-9. 16. Boland GW, Lee MJ, Cats AM, Ferraro MJ, Matthia AR, Mueller PR. Clostridium difficile colitis: correlation of CT findings with severity of clinical disease. Clin Radiol. 1995;50(3):153-6. 65 Artículo original Anales de Radiología México 2015;14:66-88. Isquemia mesentérica aguda: urgencia que exige un abordaje diagnóstico integral RESUMEN Antecedente: la isquemia mesentérica aguda es una urgencia vascular con una mortalidad mayor a 60% que requiere un tratamiento oportuno. Sin embargo, debido a la heterogeneidad de su fisiopatología y a las diferencias en el grado y extensión del daño isquémico, las manifestaciones clínicas y radiológicas son diversas y con frecuencia inespecíficas; por ello se recomienda un análisis adecuado de los antecedentes, estudios de laboratorio, hallazgos clínicos y radiológicos a fin de establecer el diagnóstico oportuno. Objetivo: identificar los hallazgos más frecuentes, directos e indirectos, por tomografía computada y señalar posibilidades baja, intermedia y alta de que un paciente padezca isquemia mesentérica aguda mediante factores de riesgo, hallazgos clínicos, bioquímicos y radiológicos. Motta-Ramírez GA1 Sánchez-García JC2 Ontiveros-Rodríguez A3 López-Ramírez MA4 Rebollo-Hurtado V5 García-Ruiz A6 Noyola-Villalobos H7 1 Médico Radiólogo con posgrado en Imagen Seccional del Cuerpo, adscrito al Departamento de Radiación Ionizante, subsección de tomografía computada. 2 Médico Cirujano, residente de tercer año del curso de especialización y residencia en Radiología e Imagen de la Escuela Militar de Graduados de Sanidad. 3 Médico Cirujano, residente de tercer año del curso de especialización y residencia en Cirugía General de la Escuela Militar de Graduados de Sanidad. 4 Médico Cirujano, residente de cuarto año del curso de especialización y residencia en Cirugía General de la Escuela Militar de Graduados de Sanidad. 5 Médico Radiólogo con posgrado en Imagen Seccional del Cuerpo, adscrito al Departamento de Radiación Ionizante, Jefe de la subsección de tomografía computada. 6 Médico Cirujano con posgrado en Cirugía laparoscópica avanzada, adscrito al Departamento de Cirugía General. 7 Médico Cirujano con posgrado en Cirugía de trasplante avanzada, Jefe del Departamento de Cirugía General. Hospital Central Militar, Blvd. Manuel Ávila Camacho s/n Lomas de Sotelo, Miguel Hidalgo, 11200 México, D. F. 55573100, extensiones 1406 y 1928. Material y métodos: se realizó un estudio retrospectivo, observacional y transversal, con análisis de imágenes de los hallazgos por tomografía computada, de una serie de casos de pacientes con diagnóstico de isquemia mesentérica aguda en un periodo de 9 años 3 meses más revisión de la literatura. La finalidad fue analizar los factores de riesgo y los datos clínicos y bioquímicos más frecuentemente asociados con la isquemia mesentérica aguda. Resultados: nuestro universo incluyo estudios de tomografía de 27 casos de isquemia mesentérica aguda, donde la edad promedio fue de 60.8 años. El dato clínico más frecuente fue el síndrome doloroso abdominal agudo en 19 pacientes (70%), los antecedentes más frecuentemente asociados fueron la diabetes mellitus tipo 2 y la hipertensión arterial sistémica en 7 (26%) pacientes cada una; 13 pacientes (48%), según nota clínica, contaban con estudios de laboratorio de los cuales 11 (85%) tenían leucocitos de 9 200 a 68 000; los hallazgos más frecuentemente identificados fueron: defecto de llenado arterial 48%, neumatosis intestinal 29%, defecto de llenado venoso 22%, síndrome de obstrucción intestinal 22% e identificación de líquido libre 22%. Conclusión: es recomendable realizar un análisis cuantitativo dando un valor específico a los diferentes hallazgos, incluidos factores de riesgo, exploración física, estudios de laboratorio y hallazgos de imagen para poder determinar el riesgo que tiene un paciente con síndrome doloroso abdominal agudo de padecer isquemia mesentérica aguda. La angiotomografía es el estudio con mayor precisión diagnóstica. Palabras clave: oclusión vascular mesentérica, arteria mesentérica superior, tomografía computada. 66 Recibido: 8 de enero, 2015 Aceptado: 20 de enero, 2015 Correspondencia: Gaspar Alberto Motta-Ramírez radbody2013@yahoo.com.mx Este artículo debe citarse como Motta-Ramírez GA, Sánchez-García JC, OntiverosRodríguez A, López-Ramírez MA, Rebollo-Hurtado V, García-Ruiz A et al. Isquemia mesentérica aguda: urgencia que exige un abordaje diagnóstico integral. Anales de Radiología México 2015;14:66-88. www.nietoeditores.com.mx Motta-Ramírez GA et al. Isquemia mesentérica aguda Acute mesenteric ischemia: an emergency which requires a comprehensive diagnostic approach ABSTRACT Background: Acute mesenteric ischemia is a vascular emergency with mortality above 60%, which requires opportune treatment. However, due to its heterogeneous pathophysiology and differences in degree and extent of ischemic damage, the clinical and radiological manifestations are varied and often nonspecific; consequently, a thorough analysis of antecedents, laboratory studies, and clinical and radiological findings is recommended in order to establish a timely diagnosis. Objective: Identify the most common findings, direct and indirect, by computed tomography and determine low, intermediate, and high probability of a patient’s suffering from acute mesenteric ischemia on the basis of risk factors and clinical, biochemical, and radiological findings. Material and methods: We performed a retrospective, observational, cross-sectional study, with analysis of findings from computed tomography images, of a series of cases of patients with diagnosis of acute mesenteric ischemia in a period of 9 years, 3 months and literature review. The purpose was to analyze the risk factors and clinical and biochemical data most commonly associated with acute mesenteric ischemia. Results: Our universe included tomographic studies of 27 cases of acute mesenteric ischemia, with average age of 60.8 years. The most common clinical datum was acute abdominal pain syndrome in 19 patients (70%); the most commonly associated antecedents were type 2 diabetes mellitus and systemic high blood pressure in 7 (26%) patients each; 13 patients (48%), per clinical notes, had laboratory studies, of whom 11 (85%) had leukocyte values of 9,200 to 68,000; the most commonly identified findings were: arterial filling defect 48%, intestinal pneumatosis 29%, venous filling defect 22%, bowel obstruction syndrome 22%, and identification of free fluid 22%. Conclusion: It is recommendable to conduct a quantitative analysis giving a specific value to the different findings, including risk factors, physical exploration, laboratory studies, and image findings, to determine the risk of acute mesenteric ischemia in a patient with acute abdominal pain syndrome. Angiotomography is the study with the greatest diagnostic precision. Key words: mesenteric vascular occlusion, superior mesenteric artery, computed tomography. INTRODUCCIÓN La isquemia mesentérica aguda no es una entidad clínica aislada, representa un complejo grupo de anormalidades que incluyen trombosis embolica arterial mesentérica, trombosis mesentérica venosa e isquemia mesentérica no oclusiva.1 Cuadro 12 y Figuras 1 y 2. 67 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 Cuadro 1. Tres causas de isquemia mesentérica aguda Tipos de isquemia mesentérica Patología Manifestaciones clínicas Tempranas Tardías Estudio diagnóstico Tratamiento Todos los tipos de soporte hemodinámico, correción de la acidosis, antibióticos, descompresión gástrica Embolismo arterial mesentérico agudo Trombosis arterial mesentérica aguda Trombosis venosa mesentérica Fibrilación atrial, infarto de miocardio, enfermedad valvular, aneurisma ventricular izquierdo Enfermedad ateroesclerótica, traumatismo, infección Estado hipercoagulable, truamatismo cerrado, infección, hipertensión portal, pancreatitis, lesión focal hepática maligna Aparición súbita del dolor abdominal, hallazgos físicos irrelevantes Dolor posprandial gradual, naúsea, cambios intestinales, hallazgos físicos irrelevantes Inicio subagudo del dolor abdominal, hallazgos físicos irrelevantes Incremento del dolor abdominal, distensión, ruidos intestinales ausentes, alteraciones en el estado mental, signos peritoneales, sépsis Angiografía Embolectomía mesentérica superior, anticoagulación crónica Infarto intestinal La isquemia mesentérica aguda es un padecimiento que afecta principalmente a los pacientes mayores de 60 años, con predominio del sexo masculino que ocurre en 1 de cada 1 000 ingresos hospitalarios; algunas series reportan hasta 5% de mortalidad hospitalaria.3 Entre los múltiples factores responsables del incremento en su incidencia está su diagnóstico más frecuentemente por la creciente población de adultos mayores así como el incremento del número de pacientes en estado crítico. A pesar de los avances en el conocimiento de la fisiopatología, el diagnóstico por laboratorio y las técnicas de imagen, la isquemia mesentérica aguda representa una urgencia vascular potencialmente letal, asociada con mortalidad superior a 60%1,4-6 si el diagnóstico se demora más de 12 horas y por arriba de 90% si se demora más de 24 horas;7 su abordaje diagnóstico es un reto clínico.8 El reto es establecer un diagnóstico oportuno y confiable, para lograr una intervención rápida que permita restaurar el flujo sanguíneo mesentérico, previniendo de esta forma la necrosis 68 Revascularización quirúrgica Terapia con anticoagulantes (heparina) Cirugía intestinal. Debido a la heterogeneidad en su fisiopatología y a las diferencias en el grado y la extensión del daño isquémico, las manifestaciones clínicas y radiológicas son diversas y con frecuencia inespecíficas. Las claves para un manejo eficiente de este síndrome son de tres principios: 1) elevado índice de sospecha clínica; 2) adecuada selección de las técnicas de imagen disponibles para establecer el diagnóstico; 3) conocimiento de los factores que aumenta la eficacia de la cirugía cuando está indicada. Este enfoque debe prevalecer para alcanzar un mejor resultado en la atención de esta patología.3 Fisiopatología La isquemia mesentérica aguda representa un estado inadecuado de perfusión tisular que impide satisfacer las demandas metabólicas en uno o más de los órganos incluidos en la circulación mesentérica. Se estima que la principal causa de isquemia mesentérica aguda es la oclusión arterial por un émbolo, en aproximadamente 50% de los casos.1,6,8,9 La mayoría de los ém- Motta-Ramírez GA et al. Isquemia mesentérica aguda Las placas de ateroma típicamente se ubican dentro de las primeras 2.5 cm de la emergencia de la arteria mesentérica superior Arteria pancreático-duodenal inferior Arteria cólica media Ramas yeyunales Arteria cólica derecha Los émbolos casi siempre se impactan en los sitios de ramificación mayor mural o de lesiones valvulares. Estos trombos a menudo se asocian con arritmias cardiacas como la fibrilación auricular o regiones hipocinéticas producidas por un infarto de miocardio previo. Alrededor de 15% de los émbolos se impactan en el origen de la arteria mesentérica superior (Figuras 1 y 2, Cuadro 210) mientras que el resto se pueden alojar 3 a 10 cm distales al origen de la arteria cólica media. Hasta en 20% de los casos la embolia que origina la arteria mesentérica superior se asocia con émbolos concurrentes en algún otro lecho vascular.10,11 Cuadro 2 modificado.10 Es importante considerar que la isquemia intestinal debida a un émbolo se puede acompañar de vasoconstricción mesentérica reactiva reduciendo el flujo colateral con exacerbación del daño isquémico. Factores de riesgo Arteria íleo-cólica Vasos rectos Figura 1. Anatomía vascular de la isquemia mesentérica aguda. Modificado de la referencia 36. Figura 2. Fisiopatología de la isquemia mesentérica aguda. Modificado de la referencia 30. bolos se origina en la aurícula o el ventrículo izquierdo por desprendimiento de un trombo Los factores de riesgo que con mayor frecuencia se han asociado, en diferentes series de casos, con esta afección son aterosclerosis (90%), enfermedad cardiaca (85%), hipertensión arterial sistémica (85%), fibrilación auricular (75%), tabaquismo (50%), uso de digitálicos (50%) y obesidad (40%).1,2,6,9 Presentación clínica La isquemia mesentérica aguda representa un complejo grupo de anormalidades que incluyen la trombosis embolica arterial mesentérica, la trombosis mesentérica venosa y la isquemia mesentérica no oclusiva.1 El cuadro clínico es inespecífico. Cuadros 1 y 312 y Figuras 1 y 2. Algunos autores lo han denominado como “síndrome arterial mesentérico agudo”13 y en nuestro hospital se utiliza el término accidente vascular mesentérico que en el presente manuscrito intentamos englobar y reconocer como isquemia mesentérica aguda, la cual hace referencia a los síntomas que con mayor frecuencia se asocian con esta afección: 69 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 Cuadro 2. Regiones intestinales, irrigación y conexiones colaterales Región Irrigación Intestino anterior Esófago distal hasta el ámpula de Vater Conexiones colaterales Arteria celíaca Arterias pancreatoduodenales y distalmente el arco de Buhler Intestino medio Región duodenal del ámpula de Vater hasta la flexura esplénica del colon Arteria mesénterica superior Arterias pancreatoduodenales y proximalmente el arco de Buhler, arteria marginal de Drummond y el arco de Riolano Intestino posterior Flexura esplénica a la porción distal del sigmoides Arteria mesénterica inferior Arteria marginal de Drummond y el arco de Riolano proximal. Distalmente arterias superior y medias hemorroidarias Proximalmente las arterias hemorroidarias superior y media Origen cloacal Ramas de la arteria hipogástrica inferior Cuadro 3. Características clínicas y los hallazgos por tomografía en isquemia mesentérica aguda Características Oclusión arterial Oclusión venosa No oclusiva Incidencia Presentación Factores de riesgo 60-70% de IMA Agudo Arritmia, infarto al miocardio, enfermedad valvular, ateroesclerosis, hipertensión prolongada 5-10% de IMA Subagudo Hipertensión portal, hipercoagulopatía venosa, falla cardiaca derecha 20% IMA Agudo o subagudo Hipovolemia, bajo gasto cardiaco, digoxina, hipotensión, agonista alfaadrenérgico Pared abdominal Delgada, sin cambios o engrosada con reperfusión Engrosada Sin cambios o engrosada con reperfusión Atenuación de la pared abdominal en fase simple No característico Baja con edema; alta con hemorragia No característico Reforzamiento de la pared abdominal en fase contrastada Dilatación intestinal Vasos mesentéricos Disminuido, ausente, en dia- Disminuido, ausente, en na o alta con reperfusión diana o incrementado Disminuido, ausente, de distribución heterogénea No evidente Defecto o defectos en las arterias, oclusión arterial, diámetro de AMS > VMS Homogéneo hasta que ocurre el infarto Moderado a prominente Defecto o defectos en las venas, venas congestivas No evidente Sin defectos, constricción arterial Heterogéneo con ascitis Homogéneo hasta que ocurre el infarto Mesenterio AMS: arteria mesentérica superior; IMA: isquemia mesentérica aguda; VMS: vena mesentérica superior. 1. En su fase inicial el hiperperistaltismo, caracterizado por tránsito intestinal rápido, con síndrome doloroso abdominal intenso y que no tiene correlación clínica con otras enfermedades del abdomen, difuso, cuya localización puede tener relación con el sitio de la isquemia; por 70 ejemplo, si ocurre en el intestino anterior: periumbilical; intestino medio: infraumbilical; intestino posterior: pélvico; el dolor no se incrementa con la palpación y no se asocia con rigidez abdominal. Se acompaña de náuseas, vómito (75%) y distensión abdominal (25%).8,13-16 Motta-Ramírez GA et al. Isquemia mesentérica aguda 2. Todo ello dificulta el diagnóstico temprano por la similitud con otros procesos inflamatorios intraabdominales. Estudios de laboratorio Pueden ser útiles en el diagnóstico de la isquemia mesentérica aguda, pero sólo en su etapa tardía. Son útiles los valores totales de leucocitos por arriba de 20 mil, con sensibilidad de 80% y especificidad de 50%, acidosis metabólica (sensibilidad de 38%, especificidad de 84%) y el dímero D elevado (sensibilidad de 40%, especificidad de 89%).5 También se ha demostrado que las concentraciones bajas de lactato pueden auxiliar al eliminar como posibilidad el diagnóstico de isquemia mesentérica aguda y evitar laparotomías innecesarias, especialmente en pacientes adultos mayores. Enzimas como la creatina-cinasa, la lactato-deshidrogenasa (LDH) y la fosfatasa alcalina pueden ser útiles en el diagnóstico de infarto transmural, pero son poco sensibles en etapas tempranas de la isquemia mesentérica aguda.2,5 Hoy por hoy el papel de los marcadores de laboratorio en la isquemia mesentérica aguda es limitado.5 Cuadro 3.12 La lactato-deshidrogenasa ha sido señalada como un marcador sugerente de isquemia mesentérica aguda;17 se origina de bacterias como la Escherichia coli en la luz intestinal. Se ha establecido la hipótesis de que su concentración se incrementa durante la isquemia mesentérica aguda debido a la translocación bacteriana y al sobrecrecimiento bacteriano secundario a la lesión de la mucosa intestinal. Sin embargo, en una revisión reciente se demostraron sensibilidad y especificidad de la lactato-deshidrogenasa de tan solo 0.82 y 0.48, respectivamente.17 Cuadro 4.18 Estudios de imagen La radiografía simple puede ser normal hasta en 25% de los casos5-7 con hallazgos inespecíficos en 50% y, en el 25% restante, es factible iden- tificar 12 horas después de iniciada la isquemia mesentérica aguda impresiones digitales murales resultantes de edema o hemorragia, neumatosis, neumobilia y gas en la vena porta. La evaluación con medio de contraste oral positivo (bario) está contraindicada.1,2,5,9 El ultrasonido posee un papel limitado en la evaluación de la isquemia mesentérica aguda debido a que un número importante de los pacientes tienen distensión área y dilatación de asas intestinales que hacen que este método de imagen sea técnicamente difícil o imposible. Puede ser más útil en la evaluación no invasiva de pacientes con síntomas de isquemia mesentérica aguda crónica.19 El ultrasonido Doppler puede demostrar el área de estenosis, las oclusiones en el tronco celíaco o en la arteria mesentérica superior con sensibilidad de 92-100% y especificidad de 70-89%. El ultrasonido Doppler no es un estudio recomendado en pacientes con alta sospecha de isquemia mesentérica aguda.14,15 La tomografía computada con contraste intravenoso, denominada angiotomografía, facilita el diagnóstico de isquemia mesentérica aguda primaria con sensibilidad de 93.3% y especificidad de 95.5%,1,4,5 es considerada el método de elección para relizar1,5,7-9 este diagnóstico:1 es un estudio no invasivo, con valor predictivo positivo de 100% y valor predictivo negativo de 94%.14,20 Figura 3.11 Las imágenes se obtienen desde las bases pulmonares hasta la sínfisis del pubis con una colimación de 0.5 a 2.5 mm y un pitch de 1.0-2.0. Para las reconstrucciones deben emplearse las imágenes con un espesor de corte de 0.7 cm. Los cortes más delgados de 1-2 mm, en fase arterial, serán utilizados en las reconstrucciones multiplanares para evaluar el origen de las arterias mesentéricas y sus variantes. Para la fase arterial se administran, vía intravenosa, 100-150 mL de contraste no iónico a una velocidad de 2-3.5 mL/s, el escaneo se inicia con tiempos de retardo de 30 y 60 segundos.21-23 El 71 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 Cuadro 4. Sensibilidad, especificidad y razón de probabilidad para hallazgos en estudios de laboratorio asociados clásicamente con la isquemia mesentérica aguda Marcador Cuenta leucocitaria pH Dímero-D Lactato Sensibilidad Especificidad 0.80 0.38 0.89 0.86 0.50 0.84 0.40 0.44 Razón de probabilidad Razón de probabilidad positiva (95% IC) negativa (95% IC) 1.57 (1.97, 2.27) 2.49 (0.82, 7.51) 1.48 (1.28, 1.71) 1.67 (1.37, 2.05) 0.41 (0.20, 0.83) 0.71 (0.45, 1.14) 1.48 (1.28, 1.71) 0.20 (0.01, 2.86) Sospecha de isquemia mesentérica aguda No peritonitis Peritonitis Laparotomía Remanente intestinal demasiado corto Remanente intestinal suficiente No resección Resección Tomografía/angiotomografía Central Radiología invasiva Embolectomía y lisis transcateter, posibilidad de endoprótesis Cirugía Embolectomía Periférica Sospecha de IMNO Radiología invasiva Radiología invasiva Lisis Vasodilatación Vasodilatación (tambien) posterior a la resección posquirúrgica) IMNO: isquemia mesentérica no oclusiva Figura 3. Flujograma de abordaje diagnóstico y terapéutico en la isquemia mesentérica aguda. 72 estudio debe ser multifásico ya que es necesario reconocer hallazgos indirectos desde la fase simple, tales como sitios de calcificación vascular, hiperdensidad vascular por coagulación y hemorragia intramural, hallazgos que no son posibles de caracterizar en fase contrastada.20-24 El estudio vascular comprende imágenes en los planos axiales, sagitales y coronales y es importante examinar planos en tercera dimensión (3D) y realizar reconstrucciones volumétricas.3 reversible del lecho esplácnico, que en la angiotomografía computada se manifiesta como un aumento de la atenuación de la pared de las asas intestinales, visible tanto en la fase arterial como en la venosa.3 Si la obstrucción persiste puede producirse una vasoconstricción que en la angiotomografía computada condicionará una disminución del reforzamiento de las asas, engrosamiento de la pared intestinal, edema mural, disminución del peristaltismo y distensión con dilatación de las asas.3 Cuando la causa del cuadro clínico es la obstrucción arterial la respuesta inicial es la vasodilatación Si la isquemia mesentérica aguda es ocasionada por una obstrucción venosa se traduce en un Motta-Ramírez GA et al. Isquemia mesentérica aguda engrosamiento mural más marcado de la pared del asa afectada2 con aspecto de “diana” por el edema submucoso. En la fase contrastada intencionadamente se identifican defectos de llenado intraluminales, característicos de trombos en las arterias y venas mesentéricas, émbolos e infarto de otros órganos, además del reforzamiento anormal de la pared del intestino ya que la isquemia mesentérica aguda condiciona diversos patrones de atenuación de la pared intestinal.25 De los casos de isquemia mesentérica aguda 40 a 50% son de origen arterial, de origen embolígeno que provoca un defecto de llenado en la arteria mesentérica superior, secundario a un fragmento desprendido de trombo mural auricular o ventricular izquierdo.26 Otras causas incluyen: trombosis en el seno de una placa de ateroma en la arteria mesentérica no oclusiva y trombosis venosa mesentérica. La trombosis de la vena mesentérica superior es la causa de la isquemia intestinal en menos de 15% de los casos. La demostración del trombo en la vena mesentérica superior es mucho menos grave que la oclusión arterial.26 El manejo no operatorio de los pacientes con isquemia mesentérica aguda debe ser considero como el primer paso del tratamiento y la corrección de los factores de riesgo que con mayor frecuencia se han asociado en diferentes series de casos con esta afección: aterosclerosis, enfermedad cardiaca, hipertensión arterial sistémica, fibrilación auricular, tabaquismo, el uso de digitálicos y la obesidad.1,2,6,9 Cuando hay complicaciones agudas como perforación, peritonitis y necrosis intestinal, el abordaje quirúrgico está indicado.2 El infarto esplénico, hepático o renal representa un hallazgo de muy mal pronóstico en los pacientes con isquemia intestinal aunque no haya afección vascular intestinal.26 Estas variaciones dependen de la patogénesis de la isquemia intestinal, su duración, sitio y extensión, la circulación colateral, las infecciones agregadas y si está o no perforada. La isquemia mesentérica aguda condiciona diversos patrones de atenuación de la pared intestinal, además del reforzamiento anormal de la pared del intestino.25 El engrosamiento de la pared intestinal puede deberse a diferentes afecciones y no está correlacionada con la gravedad de la isquemia intestinal.21-22,26-28 Un hallazgo muy común de la isquemia mesentérica aguda es la pared intestinal engrosada.26 La pared intestinal tiene un grosor normal de 0.3 a 0.5 cm, dependiendo del grado de distensión, por lo que el engrosamiento de la pared no es un hallazgo especifico. Sin embargo, en algunas series es el más frecuentemente identificado y es causado por el edema mural, la hemorragia o la infección agregada de la pared del intestino isquémico. Inicialmente la pared intestinal se hace más delgada en lugar de más gruesa porque no hay flujo arterial, no hay edema mural ni hemorragia.28 El adelgazamiento de la pared intestinal es causado por la pérdida de volumen de los vasos en la pared del intestino y por la pérdida de tono muscular intestinal. Más de 0.3 cm es anormal y ello debe ser evaluado en asas con distensión máxima. La distensión anormal, de más de 3.0 cm, también es común en la isquemia intestinal aguda. Sin embargo ambos hallazgos son inespecíficos.26 Ascitis y edema mesentérico pueden ser identificados en la isquemia mesentérica aguda.26 En general, por lo menos uno de los signos mesentéricos está presente en el paciente con isquemia mesentérica aguda. En todos los pacientes con isquemia mesentérica aguda secundaria a la oclusión arterial y en 68% de los que padecen isquemia mesentérica no oclusiva el número de vasos arteriales está disminuido (p = 0.067). La neumatosis en los vasos me- 73 Anales de Radiología México sentéricos y la reducción del número de vasos venosos están asociados con elevada mortalidad (p = 0.027 y p = 0.042, respectivamente). Los signos de reperfusión están asociados con una reducción en la mortalidad (28.7 vs. 65.5%).29 Dados los hallazgos característicos y el valor pronóstico, la evaluación meticulosa del mesenterio aportará información adicional en el estudio y diagnóstico por tomografía en la isquemia mesentérica aguda.29 La neumatosis portal o el gas venoso mesentérico no siempre son de origen intestinal. En la mayoría de los casos el gas se origina del gas intraluminal que cruza la mucosa dañada al espacio intramural.27 La integridad de la mucosa, el gas y la presión intraluminal intestinales, así como la flora bacteriana, interactúan entre sí en la formación de la neumatosis intestinal. La neumatosis intestinal es altamente sugerente de isquemia mesentérica aguda en pacientes sintomáticos con una sensibilidad que varía de 22 a 72%.26,27 La neumatosis intestinal no es un diagnóstico, es un hallazgo radiológico que resulta de un proceso patológico subyacente. La importancia de la neumatosis intestinal dependerá de su naturaleza y de la severidad del padecimiento que la condiciona. Por lo tanto, la neumatosis intestinal representa a un espectro muy amplio de enfermedades que van desde causas benignas hasta la sepsis abdominal y la muerte.30 La identificación de neumatosis intestinal caracterizada por bandas de aire y la combinación con gas venoso portomesentérico en el estudio de angiotomografía está asociada con infarto intestinal transmural. Por otra parte, la identificación aislada de neumatosis intestinal caracterizada principalmente por burbujas o del gas venoso portomesentérico en el estudio de angiotomografía puede estar relacionada con un evento isquémico mural intestinal parcial y ello ocurre en 1/3 de los casos. Además, aunque en 74 Volumen 14, Núm. 1, enero-marzo 2015 la isquemia mesentérica aguda la identificación de gas venoso portomesentérico en el estudio de angiotomografía está asociada con una mortalidad de 56%, esta asociación es presumiblemente indirecta. Por lo tanto, el carácter ominoso del hallazgo en la angiotomografía parece estar justificado sólo en los pacientes con infarto intestinal transmural extenso y su devenir clínico dependerá, principalmente, de la severidad y de la extensión de la patología subyacente. El hallazgo, por angiotomografía, de neumatosis intestinal y del gas venoso portomesentérico secundario a la isquemia intestinal generalmente no permite predecir el infarto transmural porque pueden demostrarse también en pacientes con daño parcial de la pared intestinal y aquí también su devenir clínico dependerá, principalmente, de la severidad y la extensión de la afección subyacente.31 El hallazgo de neumatosis intestinal por tomografía no siempre implica infarto transmural intestinal en la isquemia mesentérica aguda. En aquellos pacientes con neumatosis intestinal y gas venoso portomesentérico es más probable el que ocurra el infarto transmural que en aquellos sólo con neumatosis intestinal.32 Aunque la identificación de gas venoso portomesentérico usualmente conduce a la sospecha de isquemia mesentérica aguda o a necrosis intestinal, este hallazgo por tomografía puede estar relacionado con una amplia variedad de causas y patogénesis no isquémicas. El conocimiento de estas condiciones evitará consideraciones erróneas ante el hallazgo por tomografía, evitará diagnósticos y certezas inapropiadas así como cirugías innecesarias, en algunos casos.33 En los servicios de urgencias la evaluación de los pacientes debe ser rápida y eficiente. Desde nuestra perspectiva ello no ocurre con frecuencia por múltiples factores. Ese hecho motivó el presente proyecto. Es bien sabido que un número Motta-Ramírez GA et al. Isquemia mesentérica aguda elevado de pacientes con síndrome doloroso abdominal agudo son referidos al servicio de radiología e imagen para que se le realicen diferentes estudios con la sospecha diagnóstica, justamente, de isquemia mesentérica aguda, con poca correlación clínica y con resultados negativos en la mayoría de las ocasiones. Cuando un paciente refiere síndrome doloroso abdominal agudo, severo, desproporcionado con respecto a los hallazgos clínicos y con los factores de riesgo, deberá considerarse como diagnóstico a la isquemia mesentérica aguda.3 Es necesario orientar ordenadamente los estudios de imagen en pacientes con síndrome doloroso abdominal agudo y con la sospecha clínica de probable isquemia mesentérica aguda, de acuerdo con los antecedentes clínicos, los estudios de laboratorio y los hallazgos por imagen que permitirán establecer el diagnóstico con precisión. El objetivo del estudio fue identificar los hallazgos directos e indirectos más frecuentes por angiotomografía y mediante los factores de riesgo, los hallazgos clínicos, los resultados bioquímicos y radiológicos e imagen precisar baja, intermedia y alta posibilidad de que un paciente padezca isquemia mesentérica aguda. MATERIAL Y MÉTODOS Diseño del estudio: estudio observacional, transversal, descriptivo y ambispectivo. Se analizaron los datos clínicos, radiológicos y tomográficos de todos los pacientes hospitalizados con diagnóstico de isquemia mesentérica aguda a quienes se les realizó tomografía computada al momento del ingreso. Tiempo del estudio: del 1 agosto del 2005 al 31 de diciembre del 2014 (9 años 4 meses). Universo: se revisaron los expedientes clínicos y radiográficos de los pacientes durante el periodo señalado. Lugar del estudio: Hospital Central Militar. El hospital es un hospital de tercer nivel (hospital docente-institucional, dotado de aproximadamente 680 camas básicas y 25 camas de alta complejidad). El informe de la angiotomografía se categorizó según la identificación de signos de compromiso isquémico intestinal, isquemia mesentérica aguda, correlacionándose posteriormente con isquemia intestinal definitiva y la necesidad de cirugía. Dos radiólogos certificados de esta institución realizaron la interpretación de los diferentes estudios, asignando y estableciendo la posibilidad diagnóstica de isquemia mesentérica aguda, así como la identificación de signos de compromiso isquémico intestinal con análisis de imágenes por angiotomografía, en una serie de casos de pacientes con diagnóstico clínico de isquemia mesentérica aguda, en un periodo de 9 años 4 meses, con revisión de la literatura especializada con la finalidad de analizar los factores de riesgo y los datos clínicos y bioquímicos más frecuentemente asociados con la isquemia mesentérica aguda. Ambos radiólogos revisaron conjunta o separadamente los casos con la interpretación preliminar realizada por médicos residentes del curso en especialización y residencia en radiodiagnóstico de la Escuela Militar de Graduados de Sanidad, con la aportación y corrección de los hallazgos pertinentes a cada caso, logrando un informe final coherente y oportuno y en trabajo conjunto clínico con médicos residentes del curso en especialización y residencia en cirugía general de la Escuela Militar de Graduados de Sanidad. Los hallazgos a mencionar y a evaluar fueron: el hallazgo directo de la identificación del defecto de llenado vascular arterial y/o venoso. Los hallazgos indirectos tales como engrosamiento parietal, mural más marcado de la pared del asa afectada con aspecto de “diana”, dilatación de asas y/o niveles hidroaéreos, au- 75 Anales de Radiología México mento de la atenuación y heterogeneidad de la grasa del mesenterio, ascitis, disminución en el reforzamiento con hipoatenuación de la pared del asa intestinal, aumento en el reforzamiento del asa intestinal, neumatosis intestinal, gas portomesentérico, gas libre, oclusión de la arteria mesentérica superior total o parcial y oclusión de la vena mesentérica superior total o parcial. Los grados de obstrucción intestinal se establecieron de la siguiente manera: grado alto: distensión de asas intestinales mayor o igual a 2.5 cm; grado moderado: combinación de distensión de asas líquida, el signo de la fecalización del contenido intestinal, pero sin colapso distal; grado bajo: distensión de asas intestinales sin cambio abrupto de calibre, sin seudoheces y con asas intestinales distales de calibre normal. Se señalan los hallazgos directos e indirectos más frecuentes por angiotomografía y mediante los factores de riesgo, los hallazgos clínicos, los resultados bioquímicos y radiológicos e imagen, precisar baja, intermedia y alta posibilidad de que un paciente tenga isquemia mesentérica aguda. Cuadros 3 y 5. Criterios de inclusión: todos los pacientes que tuvieron expediente clínico y radiológico completo, con sospecha clínica de isquemia mesentérica aguda a los que se les realizó estudio de angiotomografía con diagnóstico de isquemia mesentérica aguda; aquellos con estudios de angiotomografía con diagnóstico de isquemia mesentérica aguda y cirugía. Volumen 14, Núm. 1, enero-marzo 2015 Criterios de exclusión: pacientes con expedientes radiológico o de imágenes incompletos; pacientes con estudio de angiotomografía incompleto, no disponible en el sistema de archivado y transmisión de imágenes (PACS). Materiales: tomógrafos con 64 detectores marca Philips® y con 16 detectores marca Siemens® con inyectores para la realización de la angiotomografía; equipo de cómputo para la elaboración, registro y análisis del proyecto. humanos: personal médico radiólogo con posgrado en imagen seccional, responsables de la interpretación de estudios de tomografía/angiotomografía; médicos residentes de la especialidad del curso de especialización y residencia en Radiología e Imagen y de Cirugía General de la Escuela Militar de Graduados de Sanidad, Hospital Central Militar; personal de enfermería y personal técnico radiólogo con adiestramiento en tomografía. Análisis estadístico: para el presente estudio se utilizaron gráficas, tablas y porcentajes. RESULTADOS Se identificaron, durante el periodo de estudio, 27 (100%) pacientes ingresados al Hospital Central Militar, con estudios solicitados a la subsección de tomografía por sospecha clínica diagnóstica de isquemia mesentérica aguda, lo que representó 1 paciente con isquemia mesentérica aguda cada 126 días o cada 4 meses. Cuadro 5. Hallazgos por tomografía en pacientes con isquemia mesentérica aguda (N = 27) Trombo arterial Trombo venoso 13 (48%) 6 (22%) 76 Neumatosis portal NeuNeu- Gas en matosis matosis congástrica intestinal fluencia portoesplénica Gas en Neumo- Síndro- Infarto vasos bilia me de esplénimesentéobstruc- co ricos ción intestinal 4 (15%) 1 (3.7%) 10 (37%) 1 (3.7%) 5 (19%) 2 (7.4%) 6 (22%) 4 (15%) Líquido libre Reforzamiento anormal, disminuido, engrosamiento mucoso 6 (22%) 5 19%) Motta-Ramírez GA et al. Isquemia mesentérica aguda Los 27 (100%) pacientes, ingresados al Hospital Central Militar, se caracterizaron clínicamente por síndrome doloroso abdominal agudo en 19 casos (70%) y en 1, además, rectorragia que a la postre correspondió con un cuadro de colitis isquémica. 7 pacientes (26%) tenían diabetes mellitus, 5 de ellos con síndrome doloroso abdominal agudo. 7 pacientes (26%) tenían hipertensión arterial de larga evolución, 4 de ellos con diabetes mellitus y 1 de ellos con colitis seudomembranosa; 4 pacientes (14%) tenían enfermedad renal crónica terminal, 2 de ellos con hipertensión arterial de larga evolución y otro con hipertensión arterial de larga evolución y trombofilia hereditaria secundaria a deficiencia de antitrombina III y proteína C en anticoagulación. 2 pacientes (8%) cardiópatas y uno de ellos con bajo gasto, según nota clínica. Cuadro 5, Figuras 4-11) Durante el periodo de estudio 13 pacientes (48%), según nota clínica, contaban con estudios de laboratorio y resultados tales como: en 11 (85%) leucocitos 9 200 a 68 000, en 6 (46%) A lactato 2.3 a 10.9 mmol/L y tan solo en 1 (8%) de ellos dímero D de 2 490; en 2 (15%) pacientes se refirió acidosis metabólica. Durante el periodo de estudio 1 (4%), con estudio solicitado a la subsección de tomografía con sospecha clínica diagnóstica de isquemia mesentérica aguda, tenía el antecedente de isquemia mesentérica aguda previa que había ameritado manejo quirúrgico con resección intestinal y estatus posbloqueo intestinal. Del total, 14 (51%) eran del sexo femenino y 13 (49%) eran del sexo masculino, con una media de edad de 60.8 años (rango 26-90 años); a 2 (8%) se les habían practicado cirugías abdominales. Durante su hospitalización 11 pacientes (41%) requirieron cirugía, lo que incluyó a los 2 pacientes con cirugía previa; de los cuales 2 fallecieron a pesar de la intervención (18%) y 1 (9%) falleció antes del procedimiento quirúrgico; a 4 (15%) se les realizo un procedimiento de radiología invasiva y de éstos fallecieron 3 (75% de los intervenidos con esta técnica). B C Figura 4. A-B) Caso número 7, mujer de 26 años, estatus posoperatorio por hernia interna, en malas condiciones generales a la que se le realizó estudio por síndrome doloroso abdominal agudo; se efectuó tomografía en fase venosa, imagen axial con los hallazgos secundarios a isquemia mesentérica aguda: distensión de asas del intestino delgado por líquido, ascitis y neumatosis intestinal, sobre todo en el yeyuno proximal y patrón heterogéneo de reforzamiento de la pared intestinal. C) Correlación quirúrgica que muestra los cambios de coloración rojiza de las asas al compararlas con otros segmentos y con la grasa de la raíz mesentérica. 77 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 A B Figura 5. A) Caso número 8, mujer de 63 años con síndrome doloroso abdominal agudo a la que se le realizó angiotomografía, imagen axial: defecto de llenado en el origen de la arteria mesentérica superior. B) Correlación quirúrgica que muestra la coloración azulosa de las asas del intestino delgado. A B C D Figura 6. A) Caso número 16, mujer de 62 años, con síndrome doloroso abdominal agudo a la que se le realizó angiotomografía, imagen axial con los hallazgos secundarios a isquemia mesentérica aguda: defecto de llenado total obstructivo en el origen de la arteria mesentérica superior. B) Reconstrucción multiplanar coronal en fase arterial: defecto de llenado de la arteria mesentérica superior de hasta 2.5 cm y defecto parcialmente obstructivo en el tronco celíaco. C) Angiografía abdominal: no se opacifica la arteria mesentérica superior. D) Correlación quirúrgica que define la transición anormal entre la coloración normal y la coloración rojiza disminuida, anormal de las asas del intestino delgado por compromiso vascular en isquemia mesentérica aguda. De los 27 pacientes a los que se les realizaron estudios solicitados en el Departamento de Radiación Ionizante del Hospital Central Militar, a 3 (11%), además de la tomografía, se les realizaron estudios radiológicos simples que incluyeron estudios radiológicos de tórax y de abdomen; a 3 (11%) se les realizo estudio de ultrasonido abdominopélvico; a 2 (8%) se les realizaron estudios radiológicos simples, ultrasonido abdominopélvico y tomografía, 1 fue en fase simple y el otro angiotomografía. 78 Se analizaron los estudios solicitados y se encontró que sólo 27 habían sido realizados por sospecha clínica diagnóstica de isquemia mesentérica aguda; 6 (22%) estudios fueron realizados en fase simple debido a falla en la función renal, 8 (29%) fueron realizados en fase simple y venosa únicamente y a 13 (48%) se les realizó estudio de angiotomografía al ingreso. De los 27 pacientes a los que se les realizaron estudios, solicitados al departamento de Radiación Ionizante del Hospital Motta-Ramírez GA et al. Isquemia mesentérica aguda A B C D Figura 7. A) Caso número 26, varón de 57 años con síndrome doloroso abdominal agudo al que se le realizó angiotomografía, imagen axial con los hallazgos secundarios a isquemia mesentérica aguda: defecto de llenado parcialmente obstructivo venoso en la vena porta. B) Defecto de llenado venoso parcialmente obstructivo en la confluencia de la vena portoesplénica. C) Defecto de llenado venoso parcialmente obstructivo en la vena mesentérica superior. D) Correlación quirúrgica que define la transición anormal entre la coloración normal y la coloración rojiza disminuida, anormal de las asas del intestino delgado por compromiso vascular venoso trombótico condicionante de la isquemia mesentérica aguda. A B Figura 8. A) Caso número 20, varón de 62 años con síndrome doloroso abdominal agudo al que se le realizó tomografía, fase venosa, imagen axial: hallazgo secundario de neumatosis portal. B) Imágenes axiales con ventana para evaluar abdomen y ventana pulmonar con el hallazgo secundario de gas intraluminal en la arteria mesentérica superior, así como neumatosis intestinal y gas en vasculatura mesentérica. Central Militar, del 1 agosto de 2005 al 31 de diciembre de 2014 se incluyeron 2 del 2005, 3 del 2006, 3 del 2007, 3 del 2008, ninguno del 2009, 1 del 2010, 1 del 2011, 2 del 2012, 4 del 2013 y 7 del 2014. Los estudios contrastados (21, 78%) permitieron definir a la isquemia mesentérica aguda. Los estudios en fase simple (6, 21%) permitieron definir los hallazgos indirectos, secundarios a la isquemia mesentérica aguda. En nuestro universo de pacientes en 19 (90% de los estudios contrastados) se identificaron los hallazgos directos como defectos de llenado, arteriales o venosos trombóticos; de los 14 estudios realizados en fase simple y venosa se demostraron en 6 79 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 trombóticos, y de 13 pacientes (62%) a los que se les realizó estudio de angiotomografía a su ingreso en 12 pacientes (92% de los realizados con esa técnica) se demostraron los defectos de llenado, arteriales o venosos trombóticos. Figura 9. Caso número 27, hombre de 71 años con síndrome doloroso abdominal agudo al que se le realizó angiotomografía, imagen axial: hallazgo primario de isquemia mesentérica aguda caracterizado por defecto de llenado parcialmente obstructivo en la arteria mesentérica superior con ascitis. Los hallazgos directos o indirectos identificados por tomografía en orden de frecuencia fueron: defecto de llenado arterial 13 (48%, de los cuales 7 fueron parciales, 3 totales y 2 arteriales y venosos), defecto de llenado venoso 6 (22%), neumatosis intestinal 8 (29%), síndrome de obstrucción intestinal 6 (22% todos de alto grado), líquido libre 6 (22%), reforzamiento anormal, disminuido o engrosamiento mucoso 5 (19%), neumatosis portal 4 (15%), infarto esplénico 4 (15%), neumobilia 2 (7%), neumatosis gástrica 1 (4%), gas portoesplénico 1 (4%), infarto hepático 1 (4%) y tromboembolia pulmonar 1 (4%). En el seguimiento durante el ingreso a urgencias y hospitalización fallecieron 8 pacientes (30% del total de pacientes), en 7 (88%) de ellos se identificaron defectos de llenado trombóticos arteriales y venosos, de los cuales en 5 (64%) se identificaron defectos de llenado trombóticos arteriales; en 1 (13%) defecto de llenado trombótico venoso y en 1 (13%) defecto de llenado trombótico venoso y arterial. Figura 10. Caso número 18, mujer de 86 años con síndrome doloroso abdominal agudo a la que se le realizó angiotomografía computada, imagen axial, hallazgo primario de la isquemia mesentérica aguda: defecto de llenado parcialmente obstructivo en la arteria mesentérica superior y hallazgos secundarios: ascitis, neumatosis portal y gástrica, infarto hepático e infarto esplénico. pacientes (43% de los realizados con esa técnica) los defectos de llenado, arteriales o venosos 80 El dato clínico más frecuente fue el síndrome doloroso abdominal agudo en 70%, los antecedentes más frecuentemente asociados fueron diabetes mellitus tipo 2 e hipertensión arterial sistémica en 26%. Contaba con estudios de laboratorio 48%, según nota clínica, de los cuales 85% tenía leucocitos de 9 200 a 68 000. La posibilidad de que un paciente tenga isquemia mesentérica aguda es baja si padece síndrome doloroso abdominal con síndrome de obstrucción intestinal de grado bajo, que cede con hidratación y reposo. La posibilidad de que Motta-Ramírez GA et al. Isquemia mesentérica aguda A B C Figura 11. A) Caso número 9, mujer de 74 años, con síndrome doloroso abdominal agudo a la que se le realizó angiotomografía, imagen axial: defecto de llenado parcialmente obstructivo en una rama arterial pulmonar segmentaria derecha en relación a tromboembolia pulmonar aguda. B) Hallazgo primario de la isquemia mesentérica aguda caracterizado por defecto de llenado parcialmente obstructivo en el tronco celiaco. C) Hallazgo primario de la isquemia mesentérica aguda caracterizado por defecto de llenado obstructivo en la arteria mesentérica superior. un paciente tenga isquemia mesentérica aguda es intermedia si es diabético, hipertenso, con síndromes doloroso abdominal y de obstrucción intestinal de grado moderado, sin descompensación hemodinámica. La posibilidad de que un paciente tenga isquemia mesentérica aguda es alta si es diabético, hipertenso, con cardiopatía o arritmia, con síndromes doloroso abdominal y de obstrucción intestinal de grado alto, con descompensación hemodinámica, con anormalidades de laboratorio que incluyen leucocitosis, con extensa aortoesclerosis y antecedente de isquemia mesentérica aguda. Los hallazgos más frecuentes por angiotomografía fueron directos (defecto de llenado arterial en 48%) e indirectos (neumatosis intestinal 29%, defecto de llenado venoso 22%, síndrome de obstrucción intestinal en 22% e identificación de líquido libre 22%. No se reconoció en ningún caso la hiperdensidad vascular por coagulación o hemorragia intramural. Otros hallazgos inespecíficos fueron sitios de calcificación vascular). DISCUSIÓN En esta serie de pacientes se observó con mayor frecuencia defecto de llenado arterial, defecto de llenado venoso, neumatosis intestinal, síndrome de obstrucción abdominal e identificación de líquido libre, siendo los estudios contrastados en fase arterial los que aportaron mayor información diagnóstica. De ahí pues la importancia de realizar estudios en fase contrastada que incluyan tanto la fase arterial como la venosa. Los estudios de laboratorio aún no tienen un papel preponderante en el diagnóstico, sin embargo se debe realizar un análisis con todos los datos obtenidos para obtener un diagnóstico preciso y oportuno. La isquemia mesentérica aguda es una entidad clínica multicausal producida por la interrupción brusca del aporte sanguíneo a un determinado segmento intestinal, lesionándolo al principio de forma reversible pero que, si se mantiene el tiempo suficiente, hace que deje de ser viable y evolucione hacia la necrosis completa de su pared. Se trata de un proceso con elevada mortalidad, que en nuestra serie fue de 30% y en el cual es vital la sospecha clínica temprana, ya que la supervivencia depende directamente de la rapidez con que se aplique el tratamiento. La mortalidad en pacientes tratados con cirugía es de 18% y de 75% en pacientes tratados con radiología invasiva. 81 Anales de Radiología México Clasificación etiológica: distinguimos cuatro tipos de isquemia mesentérica aguda, según el aspecto desencadenante.34,35 Cuadros 1 y 3, Figuras 3-11. Oclusión arterial Trombosis venosa mesentérica: ha de afectarse de forma muy severa el eje porto-esplénico-mesentérico e incluso en estos casos es excepcional que una trombosis venosa produzca un infarto intestinal agudo. Antecedente habitual de hipercoagulación o trombosis venosa profunda. La arteria más frecuentemente implicada es la mesentérica superior. El tronco celíaco y la mesentérica inferior también pueden ocluirse pero, gracias a la circulación colateral, no suelen producir lesión isquémica aguda a menos que se afecte a la vez la arteria mesentérica superior. Isquemia no oclusiva Embolia arterial: es la causa más frecuente de isquemia mesentérica aguda (50%). Su origen en 90% de los casos es una cardiopatía embolígena y puede existir historia de embolias previas a otros niveles. La zona más frecuente de es la arteria mesentérica superior, distalmente a la salida de la arteria cólica media afectando al colon derecho y el área íleocecal. La isquemia que se produce es muy grave por la brusquedad con que se instaura y por la no existencia de colaterales. Insuficiencia mesentérica no oclusiva: genera 20% de la isquemia mesentérica aguda. Son pacientes con el flujo esplácnico de base disminuido por la ateroesclerosis generalizada o el consumo de fármacos vasoactivos como la digital y que ante una disminución de perfusión generalizada, desencadenada por un proceso agudo, no pueden mantener el aporte sanguíneo necesario en el territorio intestinal. Los precipitantes de la insuficiencia mesentérica no oclusiva van desde el choque cardiogénico hasta una deshidratación que desencadene hipovolemia. Excepcionalmente el consumo de tóxicos con actividad simpática como la cocaína o los ergotamínicos puede producir vasoconstricción visceral aislada y desencadenar insuficiencia mesentérica no oclusiva.31 Trombosis arterial: implica 25% de las isquemias mesentéricas agudas. Son pacientes con antecedentes vasculares (es característica la historia previa de isquemia mesentérica crónica) cuyas arterias tienen disminuido el flujo y han desarrollado circulación colateral. La trombosis de la arteria mesentérica superior suele producirse en su origen o en sus 3 primeros centímetros y la mortalidad es muy alta porque, a pesar de que la circulación colateral es capaz de mantener cierto flujo, el territorio afectado es muy extenso. Oclusión venosa La imposibilidad de retorno venoso produce edema y aumento de presión venosa que, cuando se iguala a la arterial, produce isquemia e infarto hemorrágico. 82 Volumen 14, Núm. 1, enero-marzo 2015 El bajo gasto, la hipotensión o la vasoconstricción local mantenidos pueden impedir el aporte sanguíneo mínimo necesario para la viabilidad intestinal. La isquemia mesentérica aguda 10,36-40 es un trastorno agudo de la circulación del intestino que, de no ser reconocida a tiempo y tratada en forma eficaz, condiciona al infarto intestinal y a la eventual muerte del paciente. La isquemia mesentérica aguda puede ser causada por diversas enfermedades que comprometen la circulación visceral, sea en forma focal o difusa, a niveles arterial, capilar o venoso. El principal desafío para el médico es detectar la isquemia mesentérica aguda antes de que se instituya la necrosis intestinal que se manifiesta como abdomen agudo. Motta-Ramírez GA et al. Isquemia mesentérica aguda La causa más frecuente de isquemia mesentérica aguda es la obstrucción embólica. La oclusión súbita de la arteria mesentérica superior se acompaña de síndrome doloroso abdominal, generalmente de carácter cólico, localizado en las regiones peri- o supraumbilical. El paciente refiere náuseas y la hipertonicidad intestinal desencadena vómitos profusos y diarrea. Paradójicamente, en el examen físico, el abdomen sólo revela aumento de los ruidos intestinales. La deshidratación producto de vómitos y diarreas agrava la isquemia. A las pocas horas, por la atonía intestinal, hay alivio transitorio del dolor, hasta que por daño transmural aparecen los signos de irritación peritoneal y el dolor se hace permanente. De las embolias periféricas 6.3% afecta a la arteria mesentérica superior. La embolia debe sospecharse en todo paciente con síndrome doloroso abdominal de iniciación brusca, vómitos y diarrea profusos, que tiene historia de cardiopatía o arritmias en el examen físico, más aún si refiere antecedentes de embolias o un cuadro de embolia concomitante en otro territorio. El que no se identifique la arritmia al momento del examen no descarta la embolia (puede ser portador de fibrilación auricular paroxística, trombo intracavitario posinfarto de miocardio, tumor intracardiaco, etcétera.). El cuadro clínico puede ser confundido con gastroenteritis, íleo mecánico, pancreatitis o cualquier otra causa de síndrome doloroso abdominal agudo. La trombosis de la arteria mesentérica superior 10,36-40 casi siempre ocurre sobre una placa de ateroma ubicada en su origen, también por disección aórtica y otras causas menos frecuentes. Si la obstrucción ha dado tiempo al crecimiento de la circulación colateral la oclusión puede ser asintomática, como vemos en algunos casos de arteritis de Takayasu. El 50% de los pacientes que presenta trombosis de la arteria mesentérica superior tiene historia previa de angina mesen- térica, pérdida de peso importante y estigmas de enfermedad arterial en otros territorios vasculares. La trombosis venosa mesentérica ocurre en más o menos 10% de las isquemias mesentéricas agudas, es generalmente segmentaria, produce edema de la mucosa, congestión hemorrágica tanto de la pared como del mesenterio y sangrado luminal. La presentación clínica se caracteriza por síndrome febril, síndrome doloroso abdominal intermitente (a veces tipo cólico), de varios días de duración con conservación del tránsito intestinal. Los vómitos, la diarrea y el sangrado aparecen tardíamente. Al examen hay distensión abdominal, y en el alguno de los casos hay irritación peritoneal. Más de 80% de los pacientes tiene un factor predisponente o asociado entre los que destacan: cirugía abdominal reciente, enfermedad inflamatoria visceral, hipertensión portal, estados de hipercoagulabilidad, neoplasias y uso estrógenos. La isquemia mesentérica aguda10,36-40 no oclusiva es la necrosis intestinal sin obstrucción vascular mecánica. Por lo general se presenta por gasto cardiaco bajo en pacientes cardiópatas o posoperados críticos. Cualquier trastorno que condicione redistribución del gasto cardíaco puede inducir vasoconstricción esplácnica y, al prolongarse, puede desencadenar isquemia mesentérica aguda no oclusiva. La angiotomografía es muy útil para el diagnóstico diferencial y es muy sensible para detectar signos indirectos de isquemia mesentérica aguda e infarto intestinal: neumatosis intestinal, dilatación de asas, edema de pared. En muchos casos nos orienta al diagnóstico etiológico sin tener que recurrir a la arteriografía. 1. Oclusión embólica o trombótica arterial: detecta hasta 78% de las oclusiones de la arteria mesentérica superior, aunque si la 83 Anales de Radiología México oclusión es muy distal la arteriografía sigue siendo superior. 2. Trombosis venosa mesentérica: hoy día es procedimiento de elección. Se aprecia un retraso del paso de contraste al sistema venoso, una pared engrosada y la nula opacificación de la vena porta. 3. Insuficiencia mesentérica no oclusiva: descarta otros posibles diagnósticos y detecta el infarto intestinal avanzado pero no es útil para ver el espasmo arteriolar. Tan pronto como el diagnóstico de isquemia mesentérica aguda se sospecha, de inmediato se iniciará el tratamiento ya que deberá ser tratada como una urgencia vascular, comparable con un infarto agudo de miocardio. Las afecciones vasculares mesentéricas originan el síndrome doloroso abdominal y morbilidad y mortalidad significativas si no se diagnostican y se tratan de inmediato. Como la viabilidad intestinal depende de la permeabilidad de la vasculatura mesentérica el diagnóstico oportuno es esencial. La angiotomografía provee un método no invasivo, rápido y disponible que permite evaluar las arterias y venas mesentéricas y a las vísceras intraabdominales y pélvicas. Debido al valor que tiene hoy por hoy la angiotomografía en el diagnóstico de la enfermedad vascular es importante que el médico radiólogo entienda los aspectos técnicos y los hallazgos de imagen de la isquemia mesentérica aguda. Por lo tanto, un diagnóstico exitoso depende la familiaridad con la angiotomografía con extensión a sus capacidades de reconstrucción multiplanar y volumétrica.41 Es factible abreviar tiempo del diagnóstico de isquemia mesentérica aguda al establecerlo, de inmediato, como una acción de tiro al blanco: en aquellos casos donde se sospeche isquemia mesentérica oclusiva, ya sea arterial o venosa, la angiotomografía debe realizarse. 84 Volumen 14, Núm. 1, enero-marzo 2015 Un diagnóstico temprano y la decisión terapéutica pronta lograrán mejoras en la supervivencia. Figura 311 En pacientes con morbilidades múltiples el uso expedito de la radiología invasiva representa una opción para recanalizar las estructuras vasculares de inmediato. En los casos de peritonitis las porciones intestinales con daño irreversible deberán ser resecadas con vascularización quirúrgica. La trombosis venosa es tratada con lisis a través de un catéter yugular transhepático.11 La isquemia mesentérica aguda es originada principalmente por la oclusión mesentérica superior trombótica o embolica, la trombosis venosa mesentérica o la isquemia mesentérica no oclusiva. El tratamiento quirúrgico urgente es la elección terapéutica de la isquemia mesentérica aguda en la oclusión arterial trombótica o embólica. El tratamiento no quirúrgico es la elección terapéutica de la isquemia mesentérica aguda en la trombosis venosa y en la isquemia mesentérica no oclusiva. Como se mostró en los resultados de los estudios solicitados a la subsección de tomografía del Hospital Central Militar, con sospecha clínica diagnóstica de isquemia mesentérica aguda, 6 (23%) estudios fueron realizados en fase simple debido a falla en la función renal, 8 (30%) estudios fueron realizados en fase simple y venosa únicamente y a 12 (62%) se les realizó estudio de angiotomografía al ingreso. Los estudios contrastados 20 (77%) permitieron definir a la isquemia mesentérica aguda. Los 6 (23%) estudios en fase simple permitieron definir los hallazgos indirectos, secundarios a la isquemia mesentérica aguda. La técnica de angiotomografía al realizar el mapeo vascular total facilita la detección de anormalidades vasculares tales como los defectos de llenado, obstructivos o no, así como la estenosis.42-44 Motta-Ramírez GA et al. Isquemia mesentérica aguda En nuestro universo de pacientes en 15 (58%) se identificaron los defectos de llenado, arteriales o venosos trombóticos: 8 (30%) de los estudios realizados en fase simple y venosa demostraron en 4 pacientes (50% de los realizados con esa técnica) los defectos de llenado, arteriales o venosos trombóticos y a 12 pacientes (62%) a los que se les realizo estudio de angiotomografía a su ingreso demostraron en 11 (92% de los realizados con esa técnica) los defectos de llenado, arteriales o venosos trombóticos. Al momento de la identificación de los defectos de llenado, arteriales o venosos trombóticos, ambas técnicas son útiles.42-44 El número de pacientes incluidos y la información clínica son limitados para demostrar de forma fehaciente la utilidad de esta graduación en baja, intermedia y alta. Sin embargo, consideramos que es un preámbulo para estudios posteriores con mayor número de pacientes y con una información clínica completa, integral y adecuada al diseño del estudio ambispectivo, que condiciona errores en la revisión retrospectiva de estudios así como de la nomenclatura utilizada en nuestro hospital al referirse a la isquemia mesentérica aguda, conocida más comúnmente como accidente vascular mesentérico y que, a pesar del contar con sistema PACS/RIS/ HIS, ante la búsqueda de palabras claves en el texto del informe radiológico que se obtuvo del 2011 al 2014 arrojo tan solo a 51 pacientes, sin acceso a las imágenes. Es nuestro primer estudio institucional que incluye a este grupo de pacientes, con estudios realizados como son solicitados y su correlación clinicopatológica. La utilización de equipos de tomografía multidetector y el uso de inyectores para la técnica de angiotomografía ha mejorado nuestra capacidad de detección de la isquemia mesentérica aguda y por lo tanto del manejo quirúrgico inherente, lo que se refleja en el nú- mero de estudios realizados en 2013 y 2014, 10 pacientes (39% del universo total de pacientes), todos ellos estudiados con angiotomografía y en quienes, con las facilidades técnicas y administrativas con las que se cuenta en la actualidad, el estudio pudo ser lleve a cabo aún en fines de semana o en el turno nocturno, los 365 días del año, las 24 horas del día. CONCLUSIÓN En el presente estudio se recomienda realizar un análisis cuantitativo dando un valor especifico a los diferentes hallazgos, ya sean factores de riesgo, exploración física, estudios de laboratorio y hallazgos de imagen para poder determinar el riesgo que tiene un paciente con síndrome doloroso abdominal de padecer isquemia mesentérica aguda. El número de pacientes y la información clínica son limitados para demostrar de forma fehaciente la utilidad de esta escala; sin embargo, consideramos que éste es un preámbulo para estudios posteriores con mayor número de pacientes y con una información clínica completa, integral y adecuada. La isquemia mesentérica aguda representa un reto diagnóstico, conlleva un alto índice de sospecha clínica dado el hecho de que, si bien los pacientes tienen el síndrome doloroso abdominal severo con una exploración física pobre, con escasez de signos, dicha sospecha debe sopesarse con los factores de riesgo: arritmia cardiaca, historia de eventos trombóticos, tabaquismo intenso y bajo medicación antitrombótica. El diagnóstico pronto y el manejo agresivo en esta situación son requisitos indispensables. Si hay la sospecha clínica, diagnóstica y hay signos de peritonitis o bien la sospecha de cualesquier condición urgente abdominal, la laparotomía está indicada. Si esos signos 85 Anales de Radiología México abdominales no están presentes entonces el abordaje diagnóstico por imagen puede apoyar en la identificación del problema antes de que ocurran cambios irreversibles. Es nuestra intención que las siguientes recomendaciones ayuden en la toma de decisiones para el tratamiento exitoso de los pacientes, aunque debemos reconocer que en la mayoría de los pacientes el diagnóstico se establecerá tardíamente, ya sin oportunidad para una decisión terapéutica exitosa: 1. La posibilidad de que un paciente tenga isquemia mesentérica aguda es alta si es diabético, hipertenso, con cardiopatía o arritmia, con síndrome doloroso abdominal intenso, con vómito o diarrea, en quien la exploración física aporta muy pocos signos, con síndrome de obstrucción intestinal de grado alto, descompensación hemodinámica, anormalidades de laboratorio que incluyan leucocitosis, extensa aortoesclerosis, con antecedente previo de isquemia mesentérica aguda y en quien se sospeche isquemia mesentérica aguda (los ruidos intestinales pueden estar presentes en estadios iniciales, tempranos). 2. Cuando la isquemia mesentérica aguda es considerada como la causante de los síntomas abdominales hágase, con carácter de urgente, angiotomografía o angiograma. 3. Si se realiza un angiograma y este confirma el diagnóstico deberá de hacerse una reconstrucción vascular. Es recomendable inmiscuir a un cirujano vascular. 4. Si se realiza una corrección vascular (embolectomía o derivación) seguramente habrá intestino no viable que deberá ser resecado y la necesidad de ileostomía. Las asas del intestino con dudosa vitalidad deberán ser revaloradas en una segunda revisión a las 24 horas. 86 Volumen 14, Núm. 1, enero-marzo 2015 5. Si la angiotomografía o el angiograma revelan una trombosis venosa o isquemia mesentérica no oclusiva considerar el uso terapéutico de anticoagulantes o vasodilatadores. Recordar siempre que la isquemia mesentérica aguda no es común y que el retraso diagnóstico es lo habitual; que siempre se acompañará de comorbilidades y elevadas morbilidad y mortalidad. Un diagnóstico certero y rápido requiere de una atención cuidadosa a la historia clínica y al examen físico, con un elevado índice de sospecha y de la realización temprana de angiotomografía. El dato clínico más frecuente fue síndrome doloroso abdominal agudo en 70%, los antecedentes más frecuentemente asociados fueron diabetes mellitus tipo 2 e hipertensión arterial sistémica en 26% de los pacientes. Los hallazgos por angiotomografía fueron directos (defecto de llenado arterial en 48%) e indirectos (neumatosis intestinal 29%, defecto de llenado venoso 22%, síndrome de obstrucción intestinal en 22%, y la identificación de líquido libre 22%. No se reconoció en ningún caso la hiperdensidad vascular por coagulación o la hemorragia intramural. Otros hallazgos inespecíficos fueron sitios de calcificación vascular) y en conjunción con los factores de riesgo, los hallazgos clínicos, los resultados bioquímicos, radiológicos y de imagen permitirán precisar la posibilidad baja, intermedia o alta de que un paciente padezca isquemia mesentérica aguda. REFERENCIAS 1. Motta-Ramírez GA, Peralta-Aceves LL, Pérez del Ángel I. Trombosis de la arteria mesentérica superior. Acta Medica Grupo Ángeles. 2013;11(2):104-6. 2. Ravipati M, Katragadda S, Go B, Zarling EJ. Acute mesenteric ischemia: A diagnostic challengein clinical practice. Practical Gastroenterology 2011;38:35-43. 3. Guía de Práctica Clínica Tratamiento Quirúrgico del Infarto e Isquemia Intestinal en el Segundo y Tercer Nivel de Atención. Disponible en: http://www.cenetec.salud. Motta-Ramírez GA et al. Isquemia mesentérica aguda gob.mx/descargas/gpc/CatalogoMaestro/358-10_Isquemia_Intestinal/ISSSTE-358-10_Infarto_e_Isquema_Intestinal_-_GRR_xCorregidax.pdf 22. Taourel PG, Deneuville M, Pradel JA, Régent D, Bruel JM. Acute mesenteric ischemia: diagnosis with contrastenhanced CT. Radiology 1996;199:632–6. 4. Menke J. Diagnostic accuracy of multidetector CT in acute mesenteric ischemia: Systematic review and meta-analysis. Radiology 2010;256:93–101. 5. van den Heijkant TC, Aerts BAC, Teijink JA, Buurman WA, Luyer MDP. Challenges in diagnosing mesenteric ischemia. World J Gastroenterol. 2013;19(9):1338-41. 23. C Mesinã, Vasile I, Calotã F, Avram J, Mesinã-Botoran M, Pasalega M et al. Difficulties in diagnosis and treatment of acute mesenteric ischemia. Journal of Experimental Medical & Surgical Research 2008;XV(3)110-7. 6. Assar AN, Zarins CK. Acute mesenteric ischaemia: facts and perspectives. Br J of Hosp Med 2008;69(12):634-40. 7. Oldenburg WA, Lau LL,Rodenberg TJ, Edmonds HJ, Burger CD. Acute mesenteric ischemia. Arch Intern Med. Arch Intern Med 2004;164:1054-62. 8. Florian A, Jurcut R, Lupescu I, Grasu M,Croitoru M, Ginghină C. Mesenteric ischemia – a complex disease requiring an interdisciplinary approach. A Review of the current literature. Rom J Intern Med 2010;48(3):207–22. 9. Byard RW. Acute mesenteric ischaemia and unexpected death. J Forensic Leg Med 2012;19(4):185-90. 10. Sise MJ. Mesenteric ischemia: the whole spectrum. Scand J Surg 2010;99(2):106-10. 11. Klar E, Rahmanian PB, Bücker A, Hauenstein K, Jauch KW, Luther B. Acute mesenteric ischemia: a vascular emergency. Dtsch Arztebl Int 2012;109(14): 249-56. 12. Furukawa A, Kanasaki S, Kono N, Wakamiya M, Tanaka T, Takahas M et al. CT diagnosis of acute mesenteric ischemia from various causes. AJR 2009;192:408–16. 13. Yasuhara H. Acute mesenteric ischemia: The challenge of gastroenterology. Surg Today 2005; 35:185–95. 14. Menon NJ, Amin AM, Mohammed A, Hamilton G. Acute mesenteric ischaemia. Acta Chir Belg 2005;105:344-54. 15. Kassahun WT, Schultz T, Richter O, Hauss J. Unchanged high mortality rates from acute occlusive intestinal ischemia: six year review. Langenbecks Arch Surg 2008;393:163-71. 16. Aschoff AJ, Stuber G, Becker BW. Evaluation of acute mesenteric ischemia: accuracy of biphasic mesenteric multidetector CT angiography. Abdom Imaging 2009;34:345–57. 17. Jakob SM, Merasto-Minkkinen M, Tenhunen J, Heino A, Alhava E, Takala J. Prevention of systemic hyperlactatemia during splanchnic ischemia. Shock 2000;14:123-7. 18. Evennett NJ, Petrov MS, Mittal A, Windsor JA. Systematic review and pooled estimates for the diagnostic accuracy of serological markers for intestinal ischemia. World J Surg 2009;33:1374-83. 19. Sheeran SR. Acute mesenteric ischemia: recent advances in diagnosis and endovascular therapy. Emerg Radiol 2000;7:231-6. 20. Horton KM, Fishman EK. Multi-Detector Row CT of Mesenteric Ischemia: Can It Be Done? Radiographics 2001;21:1463–73. 21. Chou CK, Mark CW, Tzeng WS, Chang JM. CT of small bowel ischemia. Abdom Imaging 2004;29(1):18-22. 24. Brandt LJ, Boley SJ. AGA technical review on intestinal ischemia. American Gastrointestinal Association. Gastroenterology. 2000;118(5):954-68. 25. Motta Ramírez GA, Ruiz Arteaga JD, González-Sánchez CB. Abordaje diagnóstico por tomografía computada del engrosamiento de la pared colónica y su correlación endoscópica en pacientes del Hospital Ángeles del Pedregal. Endoscopia 2010;22(Suplemento 1):14-25. 26. Singer A, Handler BJ, Simmons MZ, Baker SR. Acute small bowel ischemia: Spectrum of computed tomographic findings. Emerg Radiol 2000;7:302-7. 27. St. Peter SD, Abbas MA, Kelly KA. The spectrum of pneumatosis intestinalis. Arch Surg 2003;138:68-75. 28. Wiesner W, Khurana B, Ji H, Ros PR. CT of acute bowel ischemia. Radiology 2003;226:635–50. 29. Mazzei MA, Mazzei FG, Marrelli D, Imbriaco G, Guerrini S, Vindigni C et al. Computed tomographic evaluation of mesentery: Diagnostic value in acute mesenteric ischemia. JCAT 2012;36:1-7. 30. Schofield N, Webb ST, Varcada M, Macfie A. Acute mesenteric ischaemia. JICS 2014;15(3):226-30. 31. Wiesner W, Mortelé KJ, Glickman JN, JI H, Ros PR. Pneumatosis intestinalis and portomesenteric venous gas in intestinal ischemia: Correlation of CT findings with severity of ischemia and clinical outcome. AJR 2001;177:1319–23. 32. Kernagis LY, Levine MS, Jacobs JE. Pneumatosis intestinalis in patients with ischemia: Correlation of CT findings with viability of the bowel. AJR 2003;180:733–6. 33. Wiesner W, Mortelé KJ, Glickman JN, JI H, Ros PR. Portalvenous gas unrelated to mesenteric ischemia. Eur Radiol 2002;12:1432–7. 34. Lee SS, Ha HK, Park SH, Choi EK, Kim AY, Kim JC, et al. Usefulness of computed tomography in differentiating transmural infarction from nontransmural ischemia of the small intestine in patients with acute mesenteric venous thrombosis. JCAT 2008; 32:730-7. 35. Chehab BM, Wehbe E, Nassif II. Non-occlusive mesenteric ischemia. Kansas Journal of Medicine 2008;1(3):49-53. 36. Sise MJ. Acute Mesenteric Ischemia. Surg Clin N Am 2014;94:165-81. 37. Valdés F. Isquemia mesentérica aguda. Rev Chil Cir 1989;42:98-112. 38. McKinsey JF, Gewertz BL. Acute mesenteric ischemia. Surg Clin NA 1997;77(2):307-18. 39. Cangemi JR, Picco MF. Intestinal ischemia in the elderly. Gastroenterol Clin NA 2009;38(3):527-40. 87 Anales de Radiología México 40. Bobadilla JL. Mesenteric ischemia. Surg Clin NA 2013;93(4);925-40. 41. Heller MT, Shah A, Furlan A. MDCT of acute conditions affecting the mesenteric vasculature. Clin Radiol 2014;69:765-72. 42. Costa AF, Chidambaram V, Lee JJ, Asquith J, Skaff ER, Thipphavong S. Multidetector computed tomography of mesenteric ischaemia. Insights Imaging 2014;5(6):657-66. 88 Volumen 14, Núm. 1, enero-marzo 2015 43. Sherid M, Samo S, Sulaiman S, Husein H, Sethuraman SN, Vainder JA. Is CT angiogram of the abdominal vessels needed following the diagnosis of ischemic colitis? A multicenter community study. ISRN Gastroenterol 2014;2014:756926. 44. Moschetta M, Telegrafo M, Rella L, Stabile-Ianora AA, Angelelli G. Multi-detector CT features of acute intestinal ischemia and their prognostic correlations. World J Radiol 2014;6(5):130-8. Artículo de revisión Anales de Radiología México 2015;14:89-98. Anatomía del codo por resonancia magnética hecha fácil Alonso-Que HT1 Castillo-Uribe L2 Rodríguez-Delgado NA3 Motta-Ramírez GA4 Adscrito al Servicio de Resonancia Magnética, subespecialidad en Imagen Seccional del Cuerpo y Resonancia Magnética. 2 Adscrito al Servicio de Tomografía, subespecialidad en Imagen Seccional del cuerpo e Imagen Musculoesquelética. 3 Jefa del Servicio de Imagen. 4 Adscrito al servicio de Tomografía. Laboratorio Médico Polanco, Av. San Jerónimo No. 630, Local HO 13 y 14, Col. La otra banda, 10900, México, D.F. 1 RESUMEN Las lesiones traumáticas del codo implican aproximadamente 15% de las consultas anuales de urgencias. Las complicaciones más frecuentes son la rigidez y la inestabilidad. Las causas más comunes de dolor son las lesiones de los tejidos blandos y entre éstas se incluyen: tendinitis, tendinopatías, roturas tendinosas, lesiones ligamentosas y trastornos de compresión nerviosa difíciles de evaluar clínicamente. La experiencia clínica ha confirmado la utilidad de la resonancia magnética en la detección y caracterización de las afecciones del codo de manera no invasiva. El conocimiento de la anatomía permite un informe radiológico con significado clínico, proporcionando con más eficacia la información de las implicaciones que permitan definir y planear un tratamiento oportuno y correcto para prevenir complicaciones. Palabras clave: anatomía del codo, articulación radio-humeral, articulación cúbito-humeral, articulación radio-cubital proximal, estabilizador medial, estabilizador lateral, grupo muscular, nervios. Anatomy of the elbow by magnetic resonance made simple ABSTRACT Traumatic elbow injuries account for approximately 15% of annual emergency consultations. The most common complications are stiffness and instability. The most common causes of pain are soft tissue injuries, which may include: tendinitis, tendinopathies, tendon ruptures, ligamentous injuries, and nerve compression disorders which can be difficult to evaluate clinically. Clinical experience has confirmed the usefulness of magnetic resonance in non-invasive detection and characterization of elbow conditions. A knowledge of anatomy permits a radiological report with clinical relevance, more effectively providing information on implications which help define and plan opportune and correct treatment to prevent complications. Key words: elbow anatomy, humeroradial joint, humeroulnar joint, proximal radio-cubital joint, medial stabilizer, lateral stabilizer, muscle group, nerves. www.nietoeditores.com.mx Recibido: 24 de septiembre 2014 Aceptado: 13 de diciembre 2014 Correspondencia: Heber Trinidad Alonso Que alonsoque_80@hotmail.com Este artículo debe citarse como Alonso-Que HT, Castillo-Uribe L, Rodríguez-Delgado NA, Motta-Ramírez GA. Anatomía del codo por resonancia magnética hecha fácil. Anales de Radiología México 2015;14:89-98. 89 Anales de Radiología México INTRODUCCIÓN Las lesiones traumáticas del codo constituyen aproximadamente 15% de las consultas en urgencias anualmente. Es la articulación que más frecuentemente se luxa después del hombro. Las luxaciones representan entre 11 y 28% de todos los traumatismos sobre esta articulación, con una incidencia anual de 6 por cada 100 000 habitantes; afecta a la población joven con una edad media de 30 años. Las complicaciones más frecuentes son la rigidez y la inestabilidad. Diversos estudios muestran que hay síntomas de inestabilidad entre 15 y 35% de los enfermos, pero la mayoría no se puede demostrar en la exploración física.1 Asimismo, las causas más comunes de dolor son las lesiones de los tejidos blandos, entre estas se incluyen: tendinitis y tendinopatías, rupturas tendinosas, lesiones ligamentosas y trastornos de compresión nerviosa que son difíciles de evaluar clínicamente.2 Volumen 14, Núm. 1, enero-marzo 2015 La articulación del codo La articulación del codo depende de tres articulaciones independientes: la articulación cúbito-humeral que es de tipo bisagra; la articulación radio-humeral que es de tipo bisagra uniaxial y la articulación radio-cubital que es una articulación tipo pivote uniaxial; estas dos últimas permiten la rotación del antebrazo, es decir, en pronación y supinación y todas permiten los movimientos libres de flexión y extensión. (Figuras 1-3). La resonancia magnética se ha consolidado como la herramienta clave para la evaluación del codo. Los continuos avances en la tecnología, diseños de bobinas de superficie y secuencias de pulsos más recientes han dado lugar a una adquisición más rápida y de alta resolución. La experiencia clínica ha confirmado la utilidad de la resonancia en la detección y caracterización de trastornos del codo de una manera no invasiva y aunque la artroscopia tiene un papel bien definido, estudios artroscópicos han aportado poco a la comprensión de la anatomía y patología del codo.3,4 Objetivo En este artículo presentamos una revisión comprensible, sistemática, actualizada y completa de la anatomía del codo, con interés clínico. Los esquemas, así como la recopilación bibliográfica enriquecerán nuestro conocimiento, aumentarán la capacidad de análisis de las imágenes y mejorarán las interpretaciones en un campo que para muchos es árido, por no decir casi evitable. 90 Figura 1. Vista anterior de la articulación del codo. Representación de las estructuras anatómicas morfológicas más sobresalientes en forma esquemática y por resonancia magnética en densidad de protones con saturación grasa en el plano coronal. Alonso-Que HT et al. Anatomía del codo por resonancia magnética Figura 2. Vista posterior de la articulación del codo. Representación de las estructuras morfológicamente relevantes de forma esquemática y por resonancia magnética en densidad de protones con saturación en el plano coronal. En conjunto la cápsula articular, las estructuras óseas y los ligamentos colaterales, limitan el desplazamiento en varo y valgo. La capacidad de distensión de la cápsula articular es de 24 a 30 mL. Se pueden observar plicas sinoviales que son restos embrionarios de septos del desarrollo articular normal. La plica sinovial más común es la radio-humeral que se encuentra en 86 a 100% de los especímenes cadavéricos, tiene cuatro pliegues según la ubicación: anterior (67%), lateral (5-20%), posterolateral y lateral del olécranon (28-33%); sus funciones son desconocidas aunque algunos refieren que son estabilizadoras, protectoras y otros afirman que dada la rica inervación juegan un papel el la nocicepción, propiocepción y coordinación de los movimiento, o bien se ha referido que pueden ayudar a distribuir el líquido sinovial. Su importancia clínica radica en que pueden condicionar el síndrome de la plica, que pudiera confundirse con epicondilitis y el engrosamiento pueden llevar a una condromalacia temprana. Es importante mencionar también las bursas ya que juegan un papel importante en procesos inflamatorios e infecciosos; se han descrito en la región posterior la bursa subcutánea del olécranon y la bursa subtendinosa del olécranon, en la región anterior la bursa bicipitorradial y en la región lateral la bursa radiocubital. Estabilizador medial (complejo ligamentoso colateral medial o interno) Figura 3. Representación esquemática de las superficies articulares de las articulaciones cúbito-humeral, radio-humeral y radio-cubital. Consiste básicamente en tres bandas o haces: 1) banda posterior que se extiende desde el margen inferior o posteroinferior del epicóndilo medial al margen o área medial del olécranon, es la más importante para los movimientos de mayor grado de flexión; 2) banda transversa que se extiende desde el olécranon hasta el proceso coronoides, es la que menos contribuye a la estabilidad medial y, por último, 3) 91 Anales de Radiología México banda anterior que inicia en el margen inferior o anteroinferior del epicóndilo medial hasta el tubérculo sutil del margen medial de la coronoides, es el principal estabilizador del estrés en valgo. (Figuras 4 y 5). Volumen 14, Núm. 1, enero-marzo 2015 Estabilizador lateral (complejo ligamentoso externo) Es un poco más complejo; está compuesto por: 1) ligamento anular que es una banda que rodea la cabeza del radio y la sostiene contra el cúbito, por lo que estabiliza la articulación radio-cubital proximal; 2) ligamento colateral radial que se extiende desde el segmento lateral o anteroinferior del epicóndilo lateral hasta insertarse de forma difusa sobre el ligamento anular; 3) ligamento colateral cubital lateral, inicia en el segmento posterior del epicóndilo lateral con un curso oblicuo al margen posterior de la cabeza radial hasta insertarse en el segmento posterior del cúbito o hacia la cresta del supinador; es el principal responsable de prevenir la inestabilidad rotatoria posterolateral y la subluxación o dislocación de la cabeza humeral; 4) ligamento colateral lateral accesorio que se forma en el ligamento anular extendiéndose hasta la cara posterior del cúbito. (Figuras 6 y 7)5-9 Figura 4. Representación esquemática del complejo ligamentoso colateral medial o interno constituido por las bandas anterior, transversa y anterior. Figura 5. Secuencia T1 en el plano coronal que muestra la banda anterior (flecha gruesa) y la banda posterior (flecha delgada) del complejo ligamentoso colateral medial o interno. 92 Figura 6. Representación esquemática del complejo ligamentoso colateral lateral constituido por el ligamento anular, ligamento colateral radial, ligamento colateral lateral accesorio y el ligamento colateral cubital lateral. Alonso-Que HT et al. Anatomía del codo por resonancia magnética A Figura 7. Secuencia T1 en el plano coronal: ligamento colateral radial (flecha gruesa) y, parcialmente, ligamento cubital lateral (flecha delgada). B Figura 8. Secuencia DP (densidad de protones) con Fat Sat A) en el plano sagital y B) en el plano axial; se muestra la inserción del tendón común de tríceps en el olécranon (flechas). La musculatura proximal del codo puede dividirse, para mejor comprensión, en grupos musculares que incluyen: a) grupo muscular dorsal; b) grupo muscular ventral; c) grupo muscular lateral (radial); d) grupo muscular medial (cubital). Grupo muscular dorsal Tríceps: deriva de tres cabezas: la cabeza (porción) larga que se origina en el tubérculo infraglenoideo de la escápula, la cabeza (porción) medial del segmento medio-distal posterior del húmero y la cabeza (porción) lateral inicia del segmento proximal posterolateral del húmero, forman un tendón común que se inserta en el olécranon. (Figura 8). Ancóneo: surge del margen o segmento posterior del epicóndilo lateral y se inserta en el segmento radial (margen lateral) del olécranon. (Figura 9). Ancóneo epitroclear: músculo anómalo que se encuentra en 10 a 11% de la población, causa el síndrome del túnel cubital. Se origina del epicóndilo medial, pasa superficial al nervio cubital y se inserta en el olécranon. Figura 9. Secuencia T1 en el plano axial: localización, inserción y trayecto del músculo ancóneo (circunscrito). Grupo muscular anterior Bíceps braquial: se origina de una cabeza larga (tendón largo) que surge del tubérculo supraglenoideo de la escápula y de una cabeza corta (tendón corto) que se origina de la apófisis coracoides. El tendón del bíceps distal se forma a partir de los dos vientres musculares y termina 93 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 insertándose en la tuberosidad radial. La aponeurosis bicipital o lacerto fibroso inicia en el tendón distal del bíceps y pasa medialmente para unirse con la fascia que cubre la masa flexopronadora. (Figura 10). Braquial: se origina del segmento anterior del húmero distal (tercio inferior) y se inserta en la coronoides y tuberosidad del cúbito. (Figura 11). Grupo muscular lateral (radial) Se forma principalmente de tres componentes: grupo superficial, extensores comunes y supinador. Grupo superficial Figura 11. Secuencia T1 axial: músculo braquial (flecha) que forma parte del grupo muscular anterior. Braquiorradial: se origina de la cresta supracondílea y termina en el segmento lateral del proceso estiloides radial. (Figura 12). Extensor radial largo del carpo: Se inserta en la cresta supracondílea distal al braquiorradial y se inserta en la base del 2do metacarpiano. Figura 12. Secuencia T1 axial: músculo braquiorradial (circunscrito) que forma parte del grupo muscular lateral. Grupo extensor común Figura 10. Secuencia T1 axial: tendón distal del bíceps y lacerto fibroso delgado que se fusionan con la fascia que cubre la masa flexo/pronador. 94 Está compuesto por cuatro músculos: 1) extensor radial corto del carpo; 2) extensor común de los dedos; 3) extensor del meñique; 4) extensor cubital del carpo. (Figuras 13 y 14). Se origina en el epicóndilo lateral a través del tendón extensor Alonso-Que HT et al. Anatomía del codo por resonancia magnética A B Figura 13. Secuencia T1: A) axial y B) coronal. Tendón extensor común que se origina en el epicóndilo lateral (flechas). Figura 15. Secuencia T1 axial: el músculo supinador (flecha) es el más profundo del grupo muscular lateral, en el movimiento de pronación envuelve completamente al radio. Grupo muscular medial Figura 14. Representación esquemática de los músculos que conforman el tendón extensor común. común, se encuentra a lo largo del segmento posterolateral del codo uniéndose al grupo muscular superficial. Presentan una bursa radiohumeral que es profunda al extensor radial corto del carpo y puede distenderse en caso de epicondilitis. El extensor radial corto del carpo es el sitio principal de las anomalías del codo del tenista y, dada la proximidad con el ligamento colateral cubital lateral, casi siempre está involucrado. Supinador Es el más profundo del grupo muscular lateral, se origina del segmento lateral del olécranon, que también se conoce como cresta del supinador, y del epicóndilo lateral; termina en el segmento anterior y lateral del radio envolviéndolo en gran parte. (Figura 15). Incluye al pronador redondo y cuatro flexores superficiales. Pronador redondo: forma la mayor parte de la masa muscular anteromedial del codo. Se origina de dos cabezas: la mayor, conocida como cabeza humeral, se inserta en el epicóndilo medial y la cabeza menor, referida por algunos como cabeza cubital, se origina en el segmento o cara medial de la apófisis coronoides y termina en el segmento o cara lateral de la diáfisis del radio. (Figura 16). Grupo flexor común: incluye cuatro músculos: 1) flexor radial del carpo; 2) palmar largo; 3) flexor cubital del carpo; 5) flexor superficial de los dedos. (Figuras 17 y 18). El tendón flexor común se inserta en el epicóndilo medial. El palmar largo puede estar ausente hasta en 13% de los casos. El flexor superficial de los dedos se deriva de dos cabezas, una cabeza 95 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 humerocubital derivada del tendón flexor común y una cabeza radial derivada del radio anterior; donde se unen forman un arco fibroso por donde pasa la rama interósea anterior del nervio mediano. El flexor cubital del carpo también surge de dos cabezas cerca del túnel del cubital. La primera cabeza es la porción más medial del tendón flexor común y la segunda cabeza viene desde la cara medial del olécranon. Entre las dos cabezas se forma un arco fibroso que forma el techo del túnel cubital y se ha denominado la banda arqueada del ligamento de Osborne y el retináculo del túnel cubital. Figura 16. Secuencia T1 axial: el músculo pronador redondo (circunscrito) forma la mayor parte de la masa muscular anteromedial. A B Figura 17. Secuencia T1: A) axial y B) coronal: tendón flexor común que se origina en el epicóndilo medial (flechas). Los flexores profundos incluyen el flexor digital profundo y el flexor largo del pulgar, pero este grupo se origina en el cúbito proximal. En 45% de los individuos se puede encontrar el músculo Gantzer que es una derivación accesoria del flexor largo del pulgar. Conociendo la anatomía morfológica seccional es importante saber que la estabilidad funcional es proporcionada por tres componentes primarios que involucra la articulación cúbito-humeral, la banda anterior del ligamento colateral medial y el ligamento colateral cubital lateral y cuatro componentes estructurales secundarios que son la articulación radio-humeral, el tendón flexor común/pronador, el tendón extensor común y la cápsula articular.10-14 Los nervios Nervio radial Figura 18. Representación esquemática de los músculos que conforman el tendón flexor común. 96 Es una continuación del fascículo posterior del plexo braquial compuesto de C5 a C8 y raíces de T1. Después de salir de la región axilar se desplaza por el eje posterolateral del húmero y desciende dorsalmente por el surco entre la cabeza lateral y medial del músculo del tríceps, entra al compartimiento anterior después de perforar el septo intermuscular lateral a 10 cm Alonso-Que HT et al. Anatomía del codo por resonancia magnética del epicóndilo lateral y viaja entre el músculo braquial y braquiorradial, se divide en ramos superficial y profundo. Sitios de atrapamiento o compresión: cabeza lateral del tríceps, en las bandas fibrosas que forman el techo proximal del túnel, en la corredera de Henry, en la arcada de Frosher (arco fibroso del músculo supinador) y en el músculo extensor radial corto del carpo.15 Nervio cubital Está formado por el fascículo medial del plexo braquial. Sigue el curso distal medial de las arterias axilar y braquial, interpuesto entre la arteria y la vena, a nivel del tercio medio del brazo perfora el tabique intermuscular y entra al compartimiento posterior anterior a la cabeza o porción medial del tríceps; puede pasar por debajo de la arcada de Struthers en 70% de los individuos, que se encuentra aproximadamente a 8 cm del epicóndilo medial, continuando por un surco de la cabeza o porción medial del tríceps, llegando al túnel cubital. Este intervalo fibroóseo está formado anteriormente por el epicóndilo medial, lateralmente por el olécranon, el piso por la banda posterior del ligamento colateral cubital y el ligamento arqueado de Osborne forma el techo; distalmente ocupa una posición entre la cabeza humeral y cubital del músculo flexor cubital del carpo, perfora la aponeurosis del flexor pronador profundo y entra al compartimiento anterior viajando entre el flexor cubital del carpo y el flexor profundo de los dedos. Los sitios de compresión pueden ser: arcada de Struthers, tabique intermuscular medial, epicóndilo medial del húmero, ligamento arqueado de Osborne, túnel del cubital, entre las dos cabezas o porciones del músculo flexor cubital del carpo, músculo ancóneo epitroclear y aponeurosis del músculo pronador flexor.16 Nervio mediano Esta formado por ramas del cordón medial y lateral del plexo braquial. Cursa distalmente en el brazo medial al músculo del bíceps y anterior a la arteria braquial. A nivel del codo se encuentra por debajo del lacerto fibroso a lo largo de la cara medial del músculo braquial y entra en el antebrazo entre las dos porciones o cabezas del músculo pronador redondo; sale de la fosa cubital que pasa profundo al arco fibroso formado por las dos porciones o cabezas del origen del flexor superficial de los dedos. Aproximadamente a 5 cm del epicóndilo medial da origen al nervio interóseo anterior (nervio motor) que viaja a lo largo de la membrana interósea. En el trayecto distal del antebrazo mantiene una posición entre el flexor superficial y el flexor digital profundo. Puede haber una comunicación anómala entre el nervio mediano o el nervio interóseo anterior y el nervio cubital conocida como anastomosis Martin-Gruber y puede existir hasta en 40% de los individuos. Los sitios de compresión pueden ser: cresta supracondílea, ligamento Struthers, aponeurosis bicipital, zona entre la cabeza o porciones humeral y cubital del músculo pronador redondo y el arco fibroso del músculo flexor superficial de los dedos. La compresión del nervio interóseo anterior se denomina síndrome de Nevin Kiloh, que puede simular un síndrome del pronador. (Figura 19).17 CONCLUSIÓN Las lesiones del codo son comunes y la resonancia magnética es el estudio ideal no invasivo para su exploración; permite no solamente identificar las lesiones principales que requieren intervención inmediata sino también aquellas más sutiles que pueden conducir a inestabilidad o resultados funcionales pobres. El conocimiento de la anatomía permite un informe radiológico 97 Anales de Radiología México Figura 19. Secuencia T1 axial: trayectos de los nervios cubital (verde), mediano (rojo) y radial (amarillo). con un significado clínico que proporciona, con más eficacia, la información de las implicaciones que permitan definir y planear un tratamiento oportuno y correcto para prevenir complicaciones. Sin duda alguna el conocimiento anatómico conduce a tratamientos o reparaciones quirúrgicas exitosas. REFERENCIAS 3. Stoller DW. Magnetic resonance imaging in orthopaedics and sports medicine. 3rd ed Baltimore: Wolters Kluwer/ Lippincott Williams & Wilkins; 2007. 4. Morrison WB, Sanders TG. Problem solving in musculoskeletal imaging. 1st ed. Philadelphia: Mosby Elseveir; 2008. 5. Daniels DL, Mallisee TA, Erickson SJ, et al. Radiologic-anatomic correlations. The elbow joint: osseus and ligamentous structures. RadioGraphics 1998;18:229-236. 6. Sheehan SE, Dyer GS, Sodickson AD, et al. Traumatic elbow injures: What the orthopedic surgeon. Wants to know. RadioGraphics 2013;33:869-888. 7. Dodds SD, Fisler T. Terrible triad of the elbow. Orthop Clin N Am 2013;44:47-58. 8. Cereza L, Rodriguez-Sammartino M, Canga A. et al. Elbow synovial fold syndrome. AJR 2013;201:88-96. 9. Husarlk DB, Saupe N, Pfirmann CW, et al. Ligaments and plicae of the elbow: normal MR imaging variability in 60 asymtomatic subjects. Radiology 2010;257:185-194. 10. Manaster BJ, Andrews CL, Crim J, et al, Diagnostic and surgical. Imaging anatomy musculoskeletal.1st ed. Canadá: Amirsys. 2007. 11. Pandey T, Slaughter AJ, Reynolds KA, et al. Clinical orthopedic examination findings in the upper extremity: correlation with imaging studies and diagnostic efficacy. Radiographics 2014;34:24-40. 12. Wenzke DR, MR Imaging of the elbow in the injured athlete. Radiol Clin N Am 2013;51:195-213. 13. Walz DM, Newman JS, Konin GP, et al, Epicondylitis: Pathogenesis, imaging, and treatment. RadioGraphics 2010;30:167-184. 14. Chew ML, Giuffré BM. Disorders of the distal bíceps brachii tendon. RadioGraphics 2005;25:1227-1237. 15. Naam NH, Nemani S. Radial tunnel syndrome. Orthop Clin N Am 2012;43;529-236. Antuña SA, O¨Driscoll SW. Elbow instability: causes, diagnosis and treatment. Rev Orthop Traumatol 2000;1:67-77. 16. Kroonen LT. Cubital tunnel syndrome. Orthop Clin N Am 2012;43;475-486. 2. Chung CB, Steinbach LS. MRI of the upper extremity: shoulder, elbow, wrist and hand. 1st ed. Philadelphia,PA: Lippincott Williams & Wikins; 2010. 17. Linda DD, Harish S, Stewart BG, et al, Multimodality imaging of peripheral neuropathies of the upper limb and brachial plexus. Radiographics 2010;30:1373-1400. 1. 98 Volumen 14, Núm. 1, enero-marzo 2015 Artículo de revisión Anales de Radiología México 2015;14:99-107. Objetivos para un Programa de Protección Radiológica para el Paciente en servicios de tomografía computada en México Montoya-Mendoza N1 Franco-Cabrera MC2 1 Residente del cuarto año de la Especialidad de Radiología e Imagen. 2 Médico Físico del Departamento de Radiología. Hospital San José-Tec Salud, Av. Morones Prieto Pte. #3000, Col. Los Doctores, 64710 Monterrey, Nuevo León. Teléfono: 044 811 965 8415. RESUMEN Antecedentes: en años recientes se ha identificado que la tomografía computada es el estudio de imagen que más contribuye a la dosis poblacional. Los servicios de radiología tienen la responsabilidad de implementar acciones para limitar los riesgos y maximizar los beneficios de estos estudios. Objetivo: describir los objetivos de un Programa de Protección Radiológica para el Paciente, en los servicios de tomografía, con base en las recomendaciones de instituciones expertas y soportados en el marco regulatorio de la radiología en México. Metodología: se realizó una revisión de la literatura para identificar las recomendaciones de entidades científicas y académicas con autoridad en seguridad radiológica. Se hizo un análisis de la normativa en México para identificar cómo se relaciona con las recomendaciones internacionales. Resultados: la Comisión Internacional de Protección Radiológica y el Organismo Internacional de Energía Atómica (OIEA) son entidades de referencia que estudian los riesgos por exposiciones médicas a la radiación y promueven su regulación. Los Principios Fundamentales de Seguridad son una de las declaraciones básicas del OIEA que deben incluirse en un Programa de Protección Radiológica para pacientes. La mayoría de esos principios tienen traducción en la normativa mexicana y otros requieren acciones específicas por parte de los responsables de los servicios de tomografía. Conclusión: un Programa de Protección Radiológica para el Paciente, en los servicios de tomografía, debe contener acciones sistemáticas en cuanto a justificación, optimización, registro y análisis de dosis, limitación de riesgos y prevención. La participación de la alta administración, radiólogos, residentes, técnicos y físicos es esencial. Palabras clave: protección radiológica, pacientes, tomografía. Recibido: 13 de febrero, 2014 Objectives for a Patient Radiological Protection Program in computed tomography services in Mexico ABSTRACT Background: In recent years it has been confirmed that computed tomography is the image study that contributes the most to the population www.nietoeditores.com.mx Aceptado: 4 de noviembre, 2014 Correspondencia: Natalia Montoya Mendoza dra.natalia.montoya@gmail.com Este artículo debe citarse como Montoya-Mendoza N, Franco-Cabrera MC. Objetivos para un Programa de Protección Radiológica para el Paciente en servicios de tomografía computada en México. Anales de Radiología México 2015;14:99107. 99 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 dose. Radiology services have a responsibility to implement actions to limit the risks and maximize the benefits of such studies. Objective: Describe the objectives of a Patient Radiological Protection Program in tomography services, based on recommendations of expert organizations and supported by the regulatory framework for radiology in Mexico. Methodology: We conducted a literature review to identify recommendations by scientific and academic entities with authority in matters of radiological safety. We analyzed the regulatory framework in Mexico to identify how it correlates with international recommendations. Results: The International Commission Radiological Protection and the International Atomic Energy Agency (IAEA) are reference organizations which study the risks of medical exposure to radiation and promote its regulation. The Fundamental Safety Principles are one of the IAEA’s basic declarations which should be included in any Radiological Protection Program for patients. Most of these principles have corollaries in Mexican regulations and others require specific actions by the persons responsible for tomography services. Conclusion: A Patient Radiological Protection Program in tomography services should include systematic actions relating to rationale, optimization, recording, and analysis of dose and risk mitigation and prevention. The involvement of senior management, radiologists, residents, technicians, and physicists is essential. Key words: radiological protection, patients, tomography. INTRODUCCIÓN En los últimos años se ha acrecentado la conciencia sobre la dosis de radiación ionizante que recibe la población sometida a estudios para diagnóstico. Por la magnitud de su contribución a la dosis poblacional la tomografía es una de las tecnologías que más atención ha recibido al respecto.1,2 En algunos países de Europa y en Estados Unidos la preocupación y las acciones emprendidas por la comunidad científica y profesional de la radiología, así como la presión ejercida por el público, han derivado en políticas de salud para controlar los riesgos radiológicos en tomografía. No hay motivos para pensar que los hallazgos y señalamientos surgidos en otros países, sobre 100 la importancia de vigilar la dosis de radiación, no aplican a la práctica de la radiología en México. Aunque hoy en día nuestro país cuenta con un marco regulatorio que fomenta el uso responsable de los rayos X para diagnóstico médico, las normas y reglamentos en sí mismos no garantizan la protección radiológica de las personas. Un componente esencial para lograrlo es la implementación de programas planificados y organizados para garantizar un ejercicio efectivo y sistemático de la protección radiológica del paciente. El objetivo de este artículo es proponer los objetivos generales y específicos en los que debiera fundamentarse un Programa de Protección Radiológica del Paciente a ser implementado en Servicios de Tomografía Computarizada de nues- Montoya-Mendoza N y Franco-Cabrera MC. Programa de Protección Radiológica tro país. Para llegar a esta propuesta haremos una revisión de las experiencias y recomendaciones de organizaciones reconocidas, con autoridad en materia de protección radiológica, y describiremos su relación con el marco normativo de la radiología en México. Así, este trabajo tiene como intención contribuir a la difusión de ideas que promuevan la seguridad como uno de los aspectos de responsabilidad profesional esenciales de la radiología actual. MATERIAL Y MÉTODOS Para realizar este trabajo se recurrió a la revisión de la literatura para conocer: 1) el origen de la preocupación internacional sobre la seguridad radiológica del paciente en tomografía y las acciones en las que derivó y 2) cuáles son las entidades científicas y académicas de mayor autoridad en la materia y sus recomendaciones más recientes. Así mismo, se realizó una revisión de la normativa de la seguridad radiológica en México para identificar cómo se relaciona con las recomendaciones de las autoridades internacionales. Esta información permitió establecer los principios, objetivos y responsabilidades que deben ser contemplados en un programa de protección radiológica para el paciente en nuestro país. RESULTADOS El reporte número 87 de la Comisión Internacional de Protección Radiológica (ICRP por sus siglas en inglés), titulado “Manejo de la dosis al paciente en tomografía computada”, fue publicado en el año 2000. Este es el primer documento de dicha organización surgido en respuesta a la observación de sus expertos sobre el riesgo de que los servicios de tomografía estuvieran entregando dosis altas a los pacientes de manera inadvertida.1 Siete años más tarde, ante el acelerado desarrollo de la tecnología multicorte, la ICRP publicó el reporte número 102: “Manejo de la dosis al paciente en tomografía computada multidetector”.2,3 En 2009 el Consejo Nacional de Protección y Mediciones Radiológicas (NCRP, por sus siglas en inglés) de Estados Unidos publicó su reporte 160 en el que señalaba que la población de ese país recibió 7 veces más radiación ionizante por exposiciones médicas en 2006, que lo que recibió en el mismo periodo a principios de la década de los ochenta. La mayor contribución a este incremento en la dosis efectiva poblacional se debió a los estudios de tomografía que aportaron casi la mitad de las exposiciones médicas recibidas. Este incremento se explica por el notable aumento en el número de estudios tomográficos realizados por año, que pasó de 3 millones en los años 80 a 67 millones en 2006.4 Dicho reporte causó inquietud en Estados Unidos y en el mundo debido a la conocida relación entre el riesgo de cáncer y la exposición a la radiación ionizante. Entre 2007 y 2009 diversas organizaciones profesionales y académicas como el Colegio Americano de Radiología, la Asociación Americana de Físicos en Medicina y el Colegio Europeo de Radiología, entre otros, emitieron declaraciones para exhortar a los profesionales de la salud a promover activamente el uso racional y justificado de los estudios radiológicos, enfatizando las modalidades de imagen cuyo acelerado desarrollo tecnológico y difusión las coloca como las de mayor capacidad de entrega de dosis: la tomografía y el intervencionismo vascular.4-7 La Comisión Europea (European Commission, Directorate General for Energy) ordenó y patrocinó un proyecto para crear la red médica europea ALARA (European Medical ALARA Network o EMAN) que reúne a asociaciones profesionales y académicas, representantes de las autoridades reguladoras en Europa y representantes de la industria y que tiene como misión contribuir a la optimización de la protección radiológica de 101 Anales de Radiología México los trabajadores de la salud y de los pacientes en Europa y propagar una cultura efectiva de seguridad en el sector médico.8 Entre los temas que aborda su reporte final, presentado a la Comisión Europea en 2012, se destaca la importancia de la optimización en tomografía.9,10 Las organizaciones certificadoras de servicios de salud también han reaccionado actualizando sus estándares de calidad en protección radiológica. El Consejo de Salubridad General (CSG) y la Joint Commission International (JCI) son dos organizaciones certificadoras en calidad y seguridad que operan en nuestro país y abordan el tema. El Consejo de Salubridad General establece en sus estándares de certificación de hospitales el requisito de que cuenten con un programa de seguridad radiológica consistente con los riesgos y peligros identificados y que incluya mecanismos para poner en marcha las prácticas de protección y medidas de prevención para personal y pacientes.11 La Joint Commission International, por su parte, emitió en 2011 una alerta para hacer que las organizaciones de salud atiendan y apliquen medidas para reducir el riesgo de daño a largo plazo y el riesgo acumulativo en los pacientes que requieren someterse a estudios diagnósticos de control con rayos-X. En 2012 esa comisión clasificó las auditorías de los servicios de radiología como “de segunda generación”, que significa que por ser considerados de alto riesgo requieren auditorías detalladas de sus procesos para asegurar que exista un sistema implementado que asegure que los pacientes se someten al estudio correcto, con la cantidad de dosis apropiada y con personal competente que opere y de mantenimiento a los equipos; el área de tomografía se incluye en este apartado.12,13 La revisión de la literatura sobre las referencias internacionales en protección radiológica mostró a la Comisión Internacional de Protección Radiológica y al Organismo Internacional de Energía Atómica (OIEA) como las fuentes principales 102 Volumen 14, Núm. 1, enero-marzo 2015 de estándares y recomendaciones en la materia. La Comisión Internacional de Protección Radiológica es una organización internacional independiente y de carácter científico que ha elaborado, mantenido y desarrollado lo que hoy conocemos como el Sistema Internacional de Protección Radiológica. Este sistema sirve como base común, a escala internacional, para el establecimiento de estándares, legislación, guías, programas y prácticas en seguridad radiológica.14 El Organismo Internacional de Energía Atómica, por otro lado, es una institución intergubernamental independiente que pertenece a la Organización de las Naciones Unidas; realiza su mandato con y para los estados miembros con la participación de múltiples colaboradores en el mundo para promover el uso seguro de la tecnología nuclear con fines pacíficos, incluyendo sus usos médicos. Es una institución con influencia sobre las políticas de salud pública internacional en cuanto a los usos médicos de la radiación.15 El conocimiento que se reúne a través de la investigación científica sobre los efectos biológicos de la radiación es analizado por los expertos de la Comisión Internacional de Protección Radiológica y deriva en recomendaciones que se reportan en las publicaciones oficiales de dicha organización. Estas recomendaciones son recogidas por el Organismo Internacional de Energía Atómica y por otras organizaciones con objetivos relacionados con el uso de la radiación. El Organismo Internacional de Energía Atómica, en particular, emite Estándares Internacionales de Seguridad fundamentados en las recomendaciones de la Comisión Internacional de Protección Radiológica y nutridos con la experiencia de sus colaboradores en diferentes naciones.14 Los Estándares Internacionales de Seguridad del Organismo Internacional de Energía Atómica quedan a disposición de los estados miembros de la Organización de las Naciones Unidas para servir como una referencia armonizada, para Montoya-Mendoza N y Franco-Cabrera MC. Programa de Protección Radiológica que elaboren e implementen su propio marco regulatorio o para que, en ausencia de éste, sirvan de guía para el uso seguro de la radiación. Así es como el Organismo Internacional de Energía Atómica contribuye a asegurar que las radiaciones se utilicen de manera segura y a facilitar la cooperación técnica internacional en la materia.16 El estándar de seguridad más básico, aquél del que se derivan los requisitos y guías de seguridad del Organismo Internacional de Energía Atómica para los diversos usos de la radiación, se encuentra en la publicación de 2006 “Principios Fundamentales de Seguridad”.17 Ese documento establece que “el objetivo fundamental de la seguridad es proteger a las personas y al ambiente de los efectos dañinos de la radiación ionizante”. Esta protección debe alcanzarse sin limitar indebidamente la operación de los servicios y las actividades que realizan pues ello iría en detrimento del beneficio que las personas reciben del uso de la radiación. El Cuadro 1 presenta la definición de los diez principios fundamentales de seguridad del Organismo Internacional de Energía Atómica.17 En esta sección haremos una revisión de la normativa mexicana en cuanto a protección radiológica y explicaremos cómo ésta se relaciona con los objetivos fundamentales de seguridad. En 1996 la Secretaría de Salud en México emprendió un Programa Nacional de Protección Radiológica en el Diagnóstico Médico con Rayos-X con el objeto de “garantizar la existencia de programas de Seguridad Radiológica y aseguramiento de la calidad en la utilización y operación de fuentes generadoras de radiación ionizante de uso médico-diagnóstico con rayosX”.18 Ese programa ya dejó de existir pero logró consolidar un marco normativo para la práctica de la radiología en el país. Los ordenamientos de la NOM-229-SSA1-2002, publicada en 2006 y vigentes hasta la fecha, tienen el fin de “garantizar la protección a pacientes, personal ocupacionalmente expuesto y público en general”.19 El primer principio fundamental establece que: “La responsabilidad primordial de la seguridad recae en la persona u organización responsable de las instalaciones o actividades que originan el riesgo por exposición a la radiación”. Este principio está expresado en la NOM-229 a través de las figuras de responsabilidad que define en los servicios de radiología: titular (representante legal de la instalación), responsable de operación y funcionamiento (médico radiólogo reconocido por la autoridad reguladora como responsable, junto con el titular de la seguridad radiológica, del cumplimiento de los ordenamientos legales), médicos radiólogos del establecimiento, técnicos radiólogos del establecimiento y el asesor especializado en seguridad radiológica (persona física o moral que apoya a las instalaciones en el cumplimiento de los ordenamientos legales abarcando aquellas funciones y actividades que pueden rebasar la competencia profesional del personal médico y técnico de la instalación).19 La existencia de un marco regulatorio es uno de los aspectos centrales para la implementación práctica del segundo principio fundamental de seguridad, que es el de la función del gobierno. A este respecto México cuenta con un órgano regulador independiente, desconcentrado de la Secretaría de Salud: la Comisión Federal para la Protección Contra Riesgos Sanitarios (COFEPRIS). Entre las atribuciones de esta comisión se encuentra la regulación y vigilancia de los establecimientos de salud, incluyendo a las instalaciones de diagnóstico médico con rayos-X.20 El tercer principio fundamental es el de Liderazgo y Gestión por la Seguridad, que apunta a la importancia de planificar las acciones por la seguridad radiológica de una manera efectiva, 103 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 Cuadro 1. Principios fundamentales de seguridad de acuerdo con la Organización Internacional de Energía Atómica 1. Responsabilidad 2. Función del gobierno La responsabilidad primordial de la seguridad recae en la persona u organización responsable de las instalaciones o actividades que originan el riesgo por exposición a la radiación Los gobiernos deben establecer y mantener un marco jurídico efectivo sobre la seguridad radiológica, incluyendo a un organismo regulador independiente 3. Liderazgo y gestión por la seguridad Debe establecerse liderazgo y gestión efectiva de la seguridad dentro de las organizaciones donde se realizan actividades que originan riesgos radiológicos 4. Justificación de las instalaciones y actividades Las instalaciones y actividades que generan riesgos asociados con las radiaciones deben reportar un beneficio general 5. Optimización de la protección La protección debe optimizarse para proporcionar el nivel de seguridad más alto que razonablemente sea posible 6. Limitación de los riesgos para las personas Las medidas de control de los riesgos asociados con las radiaciones deben garantizar que ninguna persona se vea expuesta a algún riesgo de daños inaceptable 7. Protección de las generaciones presen- Deben protegerse contra los riesgos asociados con las radiaciones las personas tes y futuras y el medio ambiente del presente y del futuro 8. Prevención de accidentes Deben desplegarse todos los esfuerzos posibles para prevenir los accidentes nucleares o radiológicos y para mitigar sus consecuencias 9. Preparación y respuesta en casos de emergencia Deben adoptarse disposiciones de preparación y respuesta para casos de incidentes nucleares o radiológicos 10. Medidas protectoras para reducir los Las medidas de protección para reducir los riesgos a las radiaciones existentes riesgos a radiaciones no reglamentadas o no reglamentados deben justificarse y optimizarse congruente y sustentable; capaz de hacerse parte de la cultura del trabajo con radiación. Aunque este principio no está declarado explícitamente en la NOM-229 las responsabilidades normativas de titular, radiólogo responsable de operación y funcionamiento y del asesor especializado en seguridad radiológica son un apoyo sobre el cual esas personalidades pueden cimentar un liderazgo y justificar una planificación de seguridad radiológica apropiada a las condiciones de cada establecimiento. Los cuarto, quinto y sexto principios fundamentales son: la justificación de las exposiciones, su optimización (el principio ALARA) y la limitación de los riesgos a las personas; son tres conceptos con los que todo profesional de la radiología debería estar familiarizado. La NOM-229 los aborda puntualmente en sus capítulos dedicados a protección del personal ocupacionalmente expuesto, del público y del paciente, así como en los requisitos de funcionamiento de los equipos de rayos-x. 104 El séptimo de los principios fundamentales señala la necesidad de tomar acciones específicas para proteger a generaciones presentes y futuras. Este aspecto está expresado en nuestra normativa a través de los requerimientos con los que se trata de evitar la irradiación inadvertida de un embrión o feto, la irradiación de gónadas, así como en las medidas de protección y límites de dosis para el personal ocupacionalmente expuesto. Las probabilidades de accidentes radiológicos y situaciones de emergencia en radiología diagnóstica es muy baja y la NOM-229 no las aborda explícitamente. Es aquí donde hay que destacar que las tecnologías de imagen en las que hoy reconocemos un riesgo mayor por su alta capacidad de entrega de dosis, como la tomografía y la radioscopia intervencionista, requieren medidas de prevención que exceden el alcance de la NOM-229. De esta revisión concluimos que los principios fundamentales de seguridad proveen lineamien- Montoya-Mendoza N y Franco-Cabrera MC. Programa de Protección Radiológica tos básicos exhaustivos para el uso seguro de fuentes de radiación en general. La mayoría de esos principios están expresados para el contexto del Diagnóstico Médico con Rayos-X en la NOM-229 y ésta representa, por su contenido y carácter obligatorio, un marco de referencia inicial para la implementación de programas de garantía de calidad y protección radiológica del paciente. DISCUSIÓN Con base en el marco de referencia que nos dan los Principios Fundamentales de Seguridad del Organismo Internacional de Energía Atómica y la normativa de la Radiología Diagnóstica en México, definimos que un Programa de Protección Radiológica para Pacientes de Tomografía Computada debe tener el objetivo fundamental de: proteger a los pacientes del servicio de tomografía de los efectos potencialmente dañinos de la exposición a los rayos-X. Esto debe lograrse mediante un conjunto de acciones planificadas y sistemáticas dirigidas a cumplir los siguientes objetivos específicos: • Justificación: los estudios de tomografía que se realizan están justificados. • Optimización: el procedimiento técnico con el que se realizan produce la información diagnóstica requerida con la cantidad de radiación más baja que, razonablemente, sea posible para responder la pregunta diagnóstica del estudio. • Registro y análisis de la dosis: la dosis de radiación que reciben los pacientes se documenta, se compara con niveles de referencia apropiados y se toman acciones acordes con los hallazgos. • Limitación de riesgos y prevención: en la atención de pacientes pediátricos, por tener mayor vulnerabilidad a los efectos potencialmente dañinos de la radiación, se toman medidas específicas de pro- tección. Los procedimientos que por la naturaleza de la pregunta diagnóstica que responden demandan dosis altas y localizadas (en una sola región anatómica) están identificados y se toman medidas para evitar que produzcan lesiones en los pacientes. La responsabilidad de declarar la existencia de este programa es del nivel administrativo superior del Servicio de Radiología, que es el titular (representante legal) del Establecimiento de Diagnóstico Médico con Rayos-X. En esta persona recae, como lo indica el artículo 7.2.3 de la NOM-229, la obligación de establecer y aplicar las disposiciones técnicas, operativas y administrativas necesarias para asegurar la disponibilidad de los recursos indispensables para la aplicación adecuada de las medidas de protección y seguridad radiológica aplicables a su establecimiento.19 Por otro lado la responsabilidad del diseño e implementación de un programa de protección radiológica para el paciente sometido a tomografía recae en el titular de la instalación y en el responsable de operación y funcionamiento. Como médico radiólogo el responsable de operación y funcionamiento es la figura de responsabilidad normativa que tiene los conocimientos y competencias profesionales necesarias para ejercer el papel de liderazgo en el servicio para implementar el Programa. Como lo prevé la NOM-229, el titular y el responsable de operación y funcionamiento pueden optar por los servicios de un asesor especializado en seguridad radiológica en el proceso de diseñar, implementar y mantener el programa. Por último, los médicos radiólogos y los técnicos radiólogos del servicio de tomografía tienen la responsabilidad (como también lo establece la NOM-229) de aportar su experiencia y conocimientos al proceso de diseño de los procedimientos operacionales del programa y 105 Anales de Radiología México de llevarlos a cabo durante la atención a los pacientes. Tradicionalmente, en la práctica radiológica se tienen presentes tres principios básicos de seguridad: justificación, optimización y limitación de la dosis. La revisión de la literatura realizada en este trabajo permitió conocer que esos principios fueron revisados por el Organismo Internacional de Energía Atómica y ampliados a 10 Principios Fundamentales de Seguridad. En el ámbito de la radiología esta ampliación parece una respuesta apropiada al reconocimiento de los riesgos de ciertas tecnologías de imagen como la tomografía y la radioscopia en intervencionismo. Para aterrizar las recomendaciones internacionales al contexto local nos pareció importante respaldar las acciones de protección radiológica en las normas y reglamentos, así como en la autoridad administrativa de las instituciones. Esta es una consideración importante porque, en la revisión de la literatura especializada, no parece haber precedentes formalmente documentados de programas de protección a pacientes de tomografía en instituciones mexicanas. Es de suma importancia reconocer que se requiere un esfuerzo integral por parte de las instituciones de salud que deseen implementar un Programa de Protección Radiológica para los pacientes de tomografía con los componentes y objetivos que recomiendan las autoridades de referencia que identificamos en este trabajo. Cada institución deberá establecer los niveles de responsabilidad para el programa describiendo los departamentos o personas encargadas de definir, implementar y poner en práctica cada uno de los objetivos específicos. Consideramos que el objetivo de justificación de los estudios de tomografía es uno de los que requiere un mayor esfuerzo debido a que demanda un trabajo multidisciplinario entre los médicos, 106 Volumen 14, Núm. 1, enero-marzo 2015 técnicos radiólogos y médicos solicitantes para, por ejemplo, adoptar guías y criterios para la indicación apropiada de los estudios de tomografía. Por otro lado, creemos que el principio de optimización es una gran oportunidad debido a que la responsabilidad de su desarrollo recae enteramente en residentes, médicos y técnicos radiólogos; de lograrse, tendría impacto directo e inmediato en la reducción de las dosis a los pacientes. En relación con el registro y análisis de la dosis a los pacientes las instituciones deben aprovechar al máximo los recursos tecnológicos que se tengan a la mano, de tal forma que se faciliten las tareas de revisión de dosis relacionadas con proyectos de optimización. En este trabajo hemos propuesto los objetivos y responsabilidades de un Programa de Protección Radiológica para Pacientes de tomografía. La normativa mexicana para diagnóstico médico con rayos-X provee un marco de referencia útil, pero no suficiente. Para conseguir una implementación exitosa es fundamental que el programa esté avalado por las estructuras administrativas departamental y hospitalaria. Es igualmente esencial generar y sostener un trabajo colaborativo en el que participen médicos radiólogos, residentes, técnicos radiólogos y físicos. La revisión que hemos realizado constituye el punto de partida del diseño e implementación inicial de un Programa de Protección Radiológica para el Paciente en Tomografía Computada en nuestra institución. Creemos que el reporte formal de la metodología y los resultados alcanzados en la implementación de este tipo de esfuerzos en instituciones nacionales sería una aportación valiosa para la práctica de la radiología en el país. Agradecimientos A los residentes y médicos radiólogos que se comprometieron con este proyecto, así como a Montoya-Mendoza N y Franco-Cabrera MC. Programa de Protección Radiológica todo el personal de los servicios de tomografía de nuestra institución. REFERENCIAS 1. International Commission on Radiological Protection. Managing Patient Dose in Computed Tomography - ICRP Publication 87. Ann ICRP. 2000. 2. International Commission on Radiological Protection. Managing Patient Dose in Multi-Detector Computed Tomography (MDCT) – ICRP Publication 102. Ann ICRP. 2007. 3. Rehani MM. ICRP and IAEA actions on radiation protection in computed tomography. Ann ICRP. 2012. 4. Schauer DA y Linton OW. National Council on Radiation Protection and Measurements Report Shows Substantial Medical Exposure Increase. Radiology 2009;253(2):293-6. 5. Amis ES, Butler PF, Applegate KE, Birnbaum SB, Brateman LF, et al. American College of Radiology White Paper on Radiation Dose in Medicine. J Am Coll Radiol 2007;4:272-84. 6. Geleijns JK, Kalender W, Krispijn W, Schneider K and Shrimpton P. European Commission – Nuclear Science and Technology. Safety and Efficacy of Computed Tomography: A broad Perspective (CT Safety and Efficacy). 2008. 7. United Nations. Report of the United Nations Scientific Committee on the Effects of Atomic Radiation 2010. 2011. 8. European Medical ALARA Network (EMAN). Objectives [Versión electrónica]. Actualizado en Marzo 2013. Disponible en: http://www.eman-network.eu/spip. php?article195.29.08.13 9. European Medical ALARA Network (EMAN). Optimisation of Patient Exposures in CT Procedures – WP1 Final Report. 2012. 10. Pauwels EK y Bourguignon M. Cancer induction caused by the radiation due to computed tomography: A critical note. Acta Radiologica 2011;52:767-73. 11. Consejo de Salubridad General. Manual del Proceso para la Certificación de hospitales. 2012. 12. Commission on Accreditation of Healthcare Organizations. New alert warns of risks from diagnostic imaging [Versión electrónica]. 2011. Joint Commission Perspectives 2011;31(11):8-11. 13. The Joint Commission. Tracer 101 Methodology: Second Generation Tracer–Diagnostic Imaging. The Source 2012;10(4):8-10. 14. Clarke RH y Valentin J. The History of ICRP and the Evolution of its Policies. Ann ICRP 2009;39(1):75-110. 15. International Atomic Energy Agency. About the IAEA - The IAEA Mission Statement [Versión electrónica]. Disponible en: http://www.iaea.org/About/mission.html.29.08.13 16. International Atomic Energy Agency. Publications - IAEA Safety Standards. [Versión electrónica]. Disponible en: http://www-ns.iaea.org/standards/default. asp?s=11&l=90&w=1 29.08.13 17. International Atomic Energy Agency–Safety Standards. Fundamental Safety Principles for Protecting People and the Environment. Safety Fundamentals. Viena. 2006. 18. Verdejo SM y Ramírez GR. Programa Nacional de Protección Radiológica en el Diagnóstico Médico con Rayos X en México. Secretaría de Salud, Organización Panamericana de la Salud. 2000. México. 19. Secretaría de Salud. Diario Oficial de la Federación. Norma Oficial Mexicana 229-SSA1-2002, Salud Ambiental. Requisitos Técnicos Para las Instalaciones, Responsabilidades Sanitarias, Especificaciones Técnicas para los Equipos y Protección Radiológica en Establecimientos de Diagnóstico Médico con Rayos-X. Diario Oficial de la Federación. 2006. México, D.F. 33-73. 20. Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS). Atribuciones, Funciones y Características de la COFEPRIS: http://www.cofepris.gob.mx/ cofepris/Paginas/AtribucionesFuncionesYCaracteristicas. aspx29.08.13 107 Caso clínico Anales de Radiología México 2015;14:108-116. Tumores del estroma gastrointestinal; a propósito de un caso en el yeyuno RESUMEN Objetivos: presentación de un caso clínico de tumor del estroma en el yeyuno, descripción de sus características radiológicas y revisión bibliográfica del tema. Material y métodos: se expone el caso de un paciente que ingresó a urgencias con síntomas de hemorragia digestiva baja en el cual se diagnosticó posteriormente, en el procedimiento quirúrgico, un tumor de mesenterio con invasión del yeyuno. Finalmente, por anatomía patológica se identificó como un tumor del estroma gastrointestinal en el yeyuno. Alanis-Lara J1 Castro-Villamour AR2 Bravo-Ontiveros F3 Arroyo-Hernández G3 Klug-Falicoff M4 1 Jefe Médico Radiólogo del Departamento de Imagenología. 2 Médico Cirujano en el Departamento de Cirugía General. 3 Médico Radiólogo en el Departamento de Imagenología. 4 Médico Interno de Pregrado en el Departamento de Enseñanza. Dalinde Centro Médico, Tuxpan 25 Colonia Roma, CP 06760 México, D.F. Teléfono: 5265 2800 ext. 2303 Resultados: tumor del estroma gastrointestinal, de alto grado, en el yeyuno. Conclusión: la presentación de este caso tiene por objeto conocer un tipo de tumoración poco frecuente dentro de las neoplasias que pueden afectar al yeyuno; aunque no tenga una presentación única y patognomónica por imagen es importante tenerla en consideración como una opción más entre la variabilidad de tumores que afectan al intestino delgado. Palabras clave: tumor del estroma gastrointestinal, yeyuno, tomografía con contraste. Gastrointestinal stromal tumors; discussion of a case in the jejunum ABSTRACT Objectives: Presentation of a clinical case of stromal tumor in the jejunum, description of its radiological characteristics, and bibliographic review of the topic. Material and methods: We present the case of a patient admitted to the emergency ward with symptoms of lower digestive tract bleeding who was subsequently diagnosed, during surgery, with a mesenteric tumor with invasion of the jejunum. Finally, pathological anatomy identified it as a gastrointestinal stromal tumor in the jejunum. Results: High grade gastrointestinal stromal tumor in the jejunum. Conclusion: The presentation of this case is intended to discuss a type of tumor uncommon among neoplasms which may affect the jejunum; although it does not have a unique, pathognomonic presentation by imaging, it is important to take into consideration an another option among the variety of tumors which affect the small intestine. Key words: gastrointestinal stromal tumor, jejunum, contrast tomography. 108 Recibido: 4 de julio, 2014 Aceptado: 30 de octubre, 2014 Correspondencia: Jonathan Alanis Lara radiointervencionista@hotmail.com Este artículo debe citarse como Alanis-Lara J, Castro-Villamour AR, Bravo-Ontiveros F, Arroyo-Hernández G, Klug-Falicoff M. Tumores del estroma gastrointestinal; a propósito de un caso en el yeyuno. Anales de Radiología México 2015;14:108-116. www.nietoeditores.com.mx Alanis-Lara J et al. Tumor del estroma en el yeyuno INTRODUCCIÓN Los tumores de intestino delgado representan entre 1 y 2% de todos los tumores del tracto digestivo; de ellos 12% corresponde a tumores estromales gastrointestinales.1 El objetivo de este artículo es presentar un caso clínico de tumor del estroma yeyunal, describir las características radiológicas del mismo y hacer una revisión bibliográfica del tema. CASO CLÍNICO Paciente masculino, de 43 años de edad, con antecedentes de ulcera duodenal (7 años antes) manejada con tratamiento endoscópico y hemorragia digestiva alta (hace 7 meses) estudiada en el Hospital General de México como únicos datos de importancia. Niega alcoholismo, tabaquismo o toxicomanías. Inicia su padecimiento actual 7 días antes de su ingreso con dolor abdominal localizado en epigastrio, sin irradiaciones, asociado con distensión abdominal y evacuaciones negruzcas fétidas. Acudió a su médico de cabecera que le solicitó análisis de laboratorio y diagnosticó infección urinaria que manejó de dicha manera. Sin embargo, no obtuvo mejoría y aumentó el número evacuaciones con hematoquecia y algunas con sangre fresca, dolor abdominal en epigastrio, difuso e incapacitante. Se agregó astenia, adinamia, mareos y diaforesis, motivos por los cuales decidió acudir al hospital. Ingresó a urgencias con hipotensión 90/50, taquicárdico 128 latidos/min, taquipneico: 26 rpm, temperatura de 37°C, anémico con palidez generalizada de mucosas y tegumentos y con deshidratación severa. Al examen físico presentó como datos positivos soplo funcional holosistólico plurifocal, dolor abdominal a la palpación media y profunda en epigastrio y marco colónico, EVA 7/10 sin rebote ni signos de irritación peritoneal con peristaltismo disminuido y distensión abdo- minal. Al tacto rectal se observó sangrado de tipo hematoquécico sin hemorroides, fisuras ni tumoraciones. Se solicitaron estudios de laboratorio de rutina con datos patológicos: Hb de 7.75 g/ dL, eritrocitos 2.1 × 1012/L, Hto 23.41%, leucocitosis 12 900/µl con neutrofilia 75%, plaquetas 675 900/µl, glucosa 134 mg/dL, BUN 20.7 mg/ dL, proteínas totales 3.38 mg/dL, albúmina sérica 2.1 mg/dL. Se solicitaron radiografías de abdomen de pie y decúbito donde se observaron niveles hidroaéreos de predominio izquierdo (Figuras 1 y 2). Posteriormente se realizaron panendoscopia y colonoscopia, sin hallazgos en relación estrecha con el grado de anemia (pólipos duodenales, gastritis erosiva leve, pólipos colónicos y fisura anal sin evidencia de sangrado activo). Luego de la colonoscopia presentó nuevo sangrado digestivo de 500 mL, aproximadamente, justificando la Figura 1. Radiografía convencional de abdomen estando de pie: acumulación de gas en la unión yeyuno–íleon; el resto de la distribución del gas y de los órganos abdominales no muestra datos de alteración. 109 Anales de Radiología México Figura 2. Radiografía convencional de abdomen en decúbito: acumulación de gas en la unión yeyuno–íleon, el resto de la distribución del gas y de los órganos abdominales no muestra datos de alteración. solicitud de una tomografía abdominal en la que se encontraron datos de trombosis parcial de la arteria mesentérica superior y de proceso inflamatorio de las asas del yeyuno; además de tumor irregular dependiente de yeyuno con componente intraluminal y exofítico (Figuras 3-5). Debido a estos hallazgos, y ante la persistencia de hemorragia digestiva baja y dolor abdominal, se decidió intervención quirúrgica previa transfusión de dos concentrados eritrocitarios. Se realizó laparoscopia diagnóstica en la que se encontró un tumor en la raíz del mesenterio, de 13 cm de diámetro aproximadamente, de aspecto cerebroide y altamente vascularizado, comunicado o fistulizado con rama segmentaria de la arteria mesentérica superior, con invasión al yeyuno de 5 a 15 cm del ligamento de Treitz. Se decidió la realización de 110 Volumen 14, Núm. 1, enero-marzo 2015 Figura 3. Tomografía computada de abdomen en fase contrastada: tumor irregular dependiente de yeyuno con componentes intraluminal y exofítico. El corte transversal muestra un realce parietal importante y una leve acumulación de gas intraluminal del asa comprometida. una laparotomía exploradora definiendo los límites del tumor y posteriormente se procedió con la resección en bloque junto con resección intestinal y enteroenteroanastomosis terminoterminal en dos planos final. En el proceso quirúrgico hubo sangrado de 700 mL, aproximadamente, debido a la vascularidad y friabilidad del tumor, por ello se utilizó sello de fibrina con resultado efectivo. Finalmente se colocó drenaje tipo Penrose y se concluyó el acto quirúrgico sin complicaciones, enviando muestras a patología para su evaluación. El paciente pasó a la Unidad de Cuidados Intensivos durante 24-48 horas y después a terapia intermedia donde se le colocó catéter central y se inició nutrición parenteral total debido a su afección de base asociada con desnutrición diagnosticada bioquímicamente con proteínas totales de 3.7 mg/dL y albúmina de 2.2 mg/ Alanis-Lara J et al. Tumor del estroma en el yeyuno dL. Evolucionó satisfactoriamente pero ameritó transfusión de dos paquetes globulares más (cuatro en total). Al quinto día se le retiró la sonda nasogástrica y se inició la alimentación vía oral con líquidos claros, previo estudio de contraste de trago hidrosoluble que descartó la posibilidad de fuga anastomótica intestinal con tránsito adecuado. Encontrándose el paciente asintomático, tolerando la vía oral, afebril, con diuresis y evacuaciones al corriente, sin moco ni sangre en las mismas, con Hb de 10.2 g/dL, se decidió su egreso con dieta rica en hierro y se solicitó interconsulta con un oncólogo. Figura 4. Tomografía computada de abdomen en fase contrastada: tumor irregular dependiente de yeyuno con componentes intraluminal y exofítico. El corte transversal muestra un realce parietal importante y leve acumulación de gas intraluminal del asa comprometida. Figura 5. Tomografía computada de abdomen en fase contrastada: tumor irregular dependiente de yeyuno con componentes intraluminal y exofítico. El corte coronal define la relación con el segmento proximal del yeyuno. El informe de patología reveló un segmento de intestino delgado con tumor del estroma gastrointestinal (GIST) de 8.3 cm de eje mayor (sin tumor en bordes quirúrgicos). (Figuras 6 y 7). La neoplasia no mostró mitosis pero, debido a su tamaño y a las extensas zonas de necrosis, se consideró una neoplasia de alto riesgo. Se realizó un estudio de inmunohistoquímica que fue positivo para CD117, CD34, DOG1 y AML; negativo para PS100 (Figuras 8 y 9), se confirmó el diagnóstico de tumor del estroma yeyunal de alto grado, anteriormente clasificado como leiomiosarcoma. Figura 6. El intestino mide 18.8 cm de longitud y 4.3 cm de circunferencia. La serosa es rosa, lisa y opaca con tumor de 8.3 × 4.6 cm, es nodular, blanco con áreas violáceas, de aspecto carnoso y friable, se localiza a 2.6 cm de uno de los bordes. Los fragmentos de tejido acompañantes miden en conjunto 7.2 × 5.4 cm, tienen las características antes descritas del tumor. 111 Anales de Radiología México Figura 7. Al corte la mucosa es café con pliegues conservados y con solución de continuidad a nivel del tumor de 1.5 cm. 8 9 Figuras 8 y 9. Fascículos de células fusiformes con núcleos alargados hipercromáticos con moderada cantidad de citoplasma, hay extensas zonas de necrosis, hemorragia, infiltrado inflamatorio leucocitario y vasos sanguíneos congestivos. DISCUSIÓN La incidencia de los tumores del estroma gastrointestinal es muy baja: 2 por cada 1 000 000 de habitantes. Estos tumores son extremadamente raros en el yeyuno: 0.1 a 3% de todos los tumores gastrointestinales.2 Epidemiológicamente son más frecuentes en el hombre que en la mujer (54 vs. 46%)3 y la edad media de presentación son los 59 años.4 Se originan de las células intersticiales de Cajal y la mayoría expresan siempre el receptor del factor de crecimiento específico tipo tirosina- 112 Volumen 14, Núm. 1, enero-marzo 2015 cinasa conocido como c-KIT (CD117) que ayuda a diferenciar los de verdaderos leiomiomas.5 Otros marcadores tumorales a menudo positivos son DOG1 (98%), CD34 (60-70%), actina del músculo liso (15-60%), S100 (10%), y desmina (raro); además, de muy esporádica expresión, también pueden ser positivos a neuron-specific enolase, neurofilamentos, cromogranina y queratinas 8 y 18.6 El tamaño de un tumor del estroma gastrointestinal puede variar de 1 a 40 cm de diámetro.7 De todos los tumores estromales del intestino delgado 40 a 50% son malignos, esto se debe seguramente a la presentación y diagnóstico tardío de este tipo de tumores, cuando ya son muy grandes y frecuentemente complicados. Los tumores primarios del estroma gastrointestinal generalmente son lesiones bien circunscritas y muy vascularizadas que se originan en cualquier segmento del tracto gastrointestinal y crecen por dentro o por fuera del lumen; sin embargo, la mayoría son predominantemente exofíticos. La cápsula del tumor puede presentar márgenes suaves, lobulados, irregulares o invasivos; aún así, la mayoría de los tumores del estroma gastrointestinal son pequeños y presentan una cápsula bien delimitada con márgenes suaves o lobulares. Los tumores estromales malignos pueden presentarse con invasión de los órganos adyacentes o del mesenterio. Por lo general no comprometen los grandes vasos sanguíneos abdominales ni tampoco se diseminan por vía linfática, por lo que en la tomografía no se identifican nódulos linfáticos patológicos. Los tumores pequeños tienen una apariencia homogénea mientras que los grandes son heterogéneos, tienen una configuración quística, con bordes de grosor variable y áreas centrales irregulares que contienen líquido, aire, necrosis o cavitaciones que pueden comunicarse con el lumen intestinal.8 La presentación de los tumores estromales yeyunales es errática dependiendo del tamaño tumoral (a mayor tamaño, mayores síntomas): 70% son sintomáticos, 20% son asintomáticos (hallazgos incidentales imagenológicos, endos- Alanis-Lara J et al. Tumor del estroma en el yeyuno cópicos o intraquirúrgicos) y 10% se detectan en autopsias. Las presentaciones más comunes incluyen dolor abdominal, masa palpable, hemorragia gastrointestinal baja, fiebre, anorexia, pérdida de peso, anemia, malestar y fatiga. La perforación del tumor yeyunal con peritonitis asociada es muy rara y única. La obstrucción intestinal por compresión externa (dado que la proliferación del tumor estromal es más frecuentemente exofítica) también es muy rara debiendo ser el tumor excesivamente grande.9 Los síntomas más comunes de los tumores del estroma gastrointestinal son vagos e inespecíficos, como dolor abdominal y malestar. La hemorragia digestiva baja es el segundo síntoma más frecuente, luego de dolor abdominal, y se produce por la necrosis por presión y ulceración de la mucosa digestiva con laceración de los vasos subyacentes. Esta hemorragia produce anemia y fatiga, síntomas predominantes con los que se presentó nuestro paciente. Al examen físico los hallazgos también son muy inespecíficos: sangre oculta en materia fecal, síntomas asociados con hemorragia digestiva baja, masa abdominal palpable, síntomas de obstrucción intestinal o síntomas de perforación intestinal. La tomografía contrastada es el estudio diagnóstico de imagen por elección ya que caracteriza la masa abdominal, evalúa su extensión y la presencia o no de abscesos o metástasis. Para el estudio deben ser administrados tanto contraste vía oral como endovenoso para delimitar los márgenes intestinales: la apariencia usual de un tumor estromal en la tomografía es la de una masa sólida de contorno suave que refuerza con el contraste intravenoso. Los tumores muy grandes (>15 cm) pueden parecer más complejos debido a la necrosis, hemorragia o cambios degenerativos que presentan. Muchas veces suele ser difícil identificar el origen de un tumor primario de gran tamaño debido a su crecimiento exofítico característico. Este mismo crecimiento es el que hace que la tomografía sea de mayor utilidad que la endoscopia y la serie gastroin- testinal con bario para evaluar la extensión y el tamaño del tumor.10 Las metástasis, si existen, serán en hígado o peritoneo. Las adenopatías tumorales no son características de un tumor del estroma gastrointestinal. El diagnóstico diferencial con otras neoplasias primarias malignas puede ser hecho con base en los siguientes hallazgos específicos: a) Los linfomas tienden a causar engrosamiento mural circunferencial con refuerzo por contraste homogéneo y adenomegalias. b) Los carcinoides se encuentran principalmente en íleon terminal y causan una reacción desmoplásica local sin infiltración local. c) Las metástasis intestinales son normalmente multifocales, a diferencia de los tumores del estroma gastrointestinal, y vienen con una historia de patología maligna primaria.11 Los diagnósticos diferenciales más difíciles de distinguir radiográfica y patológicamente son con otros tumores del tejido intersticial, incluyendo leiomiosarcoma, fibromatosis intraabdominal de la pared intestinal y tumores malignos de origen nervioso (schwannoma) o vascular (hemangioendotelioma epitelioide). De todas formas, aunque la biopsia transabdominal pueda ayudar al diagnóstico no es recomendable en casos potencialmente resecables debido al riesgo de diseminación tumoral hacia los tejidos superficiales.12 En la actualidad la angiotomografía es el método de elección para acceder al diagnóstico preciso cuando existe sangrado activo ya que es capaz de identificar la masa y el sitio de sangrado.13 Una tomografía por emisión de positrones puede ser útil para detectar el tumor maligno primario o para resolver ambigüedades entre la tomografía simple y la clínica del paciente.14 113 Anales de Radiología México Entre los factores de pronóstico considerados en esta enfermedad el tamaño tumoral, el índice mitótico, la extensión extragastrointestinal, la invasión mucosa, el aumento de la celularidad y la presencia de necrosis son los más aceptados.15 Los factores de pronóstico más importantes para definir el potencial maligno de un tumor estromal son el tamaño tumoral y el índice mitótico en 50 campos de gran aumento. Con base en estos dos factores los tumores del estroma gastrointestinal pueden clasificarse en cuatro categorías de acuerdo con el riesgo de comportamiento agresivo o diseminación metastásica: de muy bajo riesgo (tamaño < 2 cm y menos de 5 figuras mitóticas); de bajo riesgo (tamaño de 2-5 cm y menos de 5 figuras mitóticas), de riesgo intermedio (tamaño < 5 cm y 6-10 figuras mitóticas) y de alto riesgo (tamaño >5 cm y más de 5 figuras mitóticas o tamaño >10 cm; cualquier número de figuras mitóticas o cualquier tamaño tumoral y más de 10 figuras mitóticas).16 Los tumores de riesgo alto presentan más de 50% de recidivas y los de riesgo bajo una supervivencia similar a la población normal una vez realizada una resección completa.17 El tratamiento es fundamentalmente quirúrgico mediante la extirpación completa del tumor con un margen amplio, adecuado de tejido sano, y no requiere linfadenectomía ya que las metástasis son peritoneales y hematógenas (hígado y pulmón) pero rarísima vez linfáticas (< 4%). La realización de una resección intestinal por vía laparoscópica, de forma completa o combinada, con una laparotomía reducida parece adecuada para tumores de riesgo muy bajo o bajo,18 si bien la rotura del tumor durante una resección laparoscópica se asocia con mayor frecuencia de implantes peritoneales y debe ser causa de reconversión a cirugía abierta.17 A pesar de un tratamiento quirúrgico exitoso la supervivencia a 5 años es menor a 60% con riesgo de recidiva incluso después de 10 años 114 Volumen 14, Núm. 1, enero-marzo 2015 de seguimiento. Cuando la resección ha sido incompleta o el paciente presenta metástasis la supervivencia desciende por debajo de 35% a los 5 años.15 Cuando la enfermedad está avanzada los pacientes deben recibir tratamiento con un inhibidor de la tirosina-cinasa como el mesilato de imatinib. El tratamiento adyuvante en dosis de 400-800 mg por al menos 36 meses está indicado en tumores estromales de alto riesgo (riesgo de recurrencia >33%): tumor >10 cm, índice mitótico >10 o tumor >5 cm con índice mitótico >519. El tratamiento neoadyuvante con imatinib es adecuado en caso de: tumor primario irresecable o borderline, tumor potencialmente resecable que requiere una disrupción orgánica extensa, recurrencia local de enfermedad localmente avanzada o cantidad limitada de lesiones metastásicas potencialmente extirpables por cirugía. En todos los casos el objetivo es la reducción del tamaño tumoral que facilite la resección quirúrgica y la consiguiente preservación de los órganos. Se utilizan dosis preoperatorias de 600 mg diarios por 8-10 semanas.20 Para el seguimiento postratamiento las guías de la National Comprehensive Cancer Network (NCCN) sugieren lo siguiente: • Para un tumor del estroma gastrointestinal completamente resecado: anamnesis, examen físico y tomografía abdominopélvica cada 3-6 meses por 5 años y luego anualmente. • Para pacientes con enfermedad localmente avanzada o con presencia de metástasis que están recibiendo tratamiento con imatinib: anamnesis, examen físico y tomografía abdominopélvica cada 3-6 meses por tiempo indeterminado. Una buena respuesta al tratamiento es caracterizada en la tomografía como un cambio Alanis-Lara J et al. Tumor del estroma en el yeyuno de una lesión heterogénea hiperdensa a una más homogénea hipodensa, con descenso de refuerzo poscontraste de los nódulos tumorales y vascularidad tumoral disminuida.21 El tamaño tumoral puede aumentar durante el tratamiento, lo que no significa necesariamente progresión de la enfermedad (puede tratarse de hemorragia intratumoral, edema o degeneración mixoide) mientras el tumor disminuya en su intensidad. CONCLUSIÓN La presentación de este caso tiene por objeto conocer un tipo de tumor poco frecuente dentro de las neoplasias que pueden afectar al yeyuno. Aunque no tenga una presentación única y patognomónica por imagen es importante tenerla en consideración como una opción más en la variabilidad de tumores que afectan al intestino delgado. La tomografía con medio de contraste es un estudio orientativo y siempre un paso crucial para definir la opción de tratamiento, determinando la mayoría de las veces el manejo quirúrgico como el único requerido por el paciente. Asimismo, también puede ser de utilidad para el seguimiento de tratamientos adyuvantes y para descartar complicaciones inherentes a la cirugía o al propio tumor, como son hemorragia, edema o degeneración. REFERENCIAS 1. Bannura G, Cornejo V. Hemorragia digestiva baja recurrente secundaria a GIST de yeyuno. Rev Chil Cir 2011;63(6):631634. 2. Kramer K, Siech M, Sträter J, Aschoff A, Henne-Bruns D. GI hemorrhage with fulminant shock induced by jejunal gastrointestinal stromal tumor (GIST) coincident with duodenal neuroendocrine carcinoma (NET) + neurofibromatosis (NF)-Case report and review of the literature. Z Gastroenterol 2005;43(3):281-288. 3. Tran T, Davila JA, El-Serag HB. The epidemiology of malignant gastrointestinal stromal tumors: an analysis of 1,458 cases from 1992 to 2000. Am J Gastroenterol 2005;100(1):162-8. 4. Miettinen M, Makhlouf H, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the jejunum and ileum: a clinicopathologic, immunohistochemical, and molecular genetic study of 906 cases before imatinib with long-term follow-up. Am J Surg Pathol 2006;30(4):477-89. 5. Horwitz B.M., Zamora G.E., Gallegos M.P. Best cases from the AFIP. Gastrointestinal Stromal Tumor of the Small Bowel. Radiographics 2011;31:429-434. 6. Beatriz Eizaguirre Zarza, Juan José Burgos Bretones. Tumores GIST. Revisión de la literatura. Rev Esp Patol 2006;39(4):209-218. 7. Miettinen M, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol 2005;29(1):52-68. 8. Beltrán M, Tapia R, Cortés V, et al. Tumores primarios del estroma gastrointestinal (GIST) localizados en yeyuno e íleon: reporte de un caso. Rev Gastroenterol latinoam 2012;23(1):17-21. 9. Somsubhra D, Dawood K, Krishna K. Spontaneous perforation of jejunal gastrointestinal stromal tumour (gist): Case report and review of literature. World J Emerg Surg 2012;7:37. 10. Sandrasegaran K, Rajesh A, Rushing DA, Rydberg J, Akisik FM, Henley JD. Gastrointestinal stromal tumors: CT and MRI findings. Eur Radiol 2005;15:1407-1414. 11. Shojaku H, Futatsuya R, Seto H, Tajika S, Matsunou H. Malignant gastrointestinal stromal tumor of the small intestine: radiologic- pathologic correlation. Radiat Med 1997;15:189-192. 12. Burkill G, Badran M, Al-Muderis O, et al. Malignant Gastrointestinal Stromal Tumor: Distribution, Imaging Features, and Pattern of Metastatic Spread. Radiology 2003;226(2):527-532. 13. Oyanedel R, O’Brien A, Pizarro A, Zamora E, Menias C. Tumor estromal gastrointestinal (GIST): formas de presentación. Rev Chil Radiol 2005;11:13-8. 14. Demetri GD, Benjamin RS, Blanke CD, et al. NCCN task force report: optimal management of patients with gastrointestinal stromal tumor (GIST)- Update of NCCN Clinical Practice Guidelines. J Natl Comp Cancer Net 2007;5(2):S-1. 15. Dominguez Jimenez JL, Cerezo Ruiz A, Guiote Malpartida S, et al. Caso atípico de hemorragia digestiva masiva. Gastroenterol Hepatol 2007;30(1):22-4. 16. Jass JR. Tumors of the small and large intestines (including the anal region). In: Fletcher CDM, ed. Diagnostic histopathology of tumors. 3rd ed. Philadelphia, Pa: Churchill Livingstone Elsevier, 2007;381-383. 115 Anales de Radiología México 17. Poveda A, Maurel J, Martin J, et al. Guía de práctica clínica en los tumores estromales gastrointestinales. Grupo Español de Investigacion en Sarcomas. Clin Transl Oncol 2005;7(2):1-14. 18. Pei K, Zemon H, Venbrux A, Brody F. Laparoendoscopic techniques for occult gastrointestinal bleeding. J Laparoendosc Adv Surg Tech A 2005;15:615-9. 19. Joensuu H, Eriksson M, Sundby Hall K, et al. One vs three years of adjuvant imatinib for operable gastrointestinal stromal tumor: a randomized trial. JAMA 2012;307:1265. 116 Volumen 14, Núm. 1, enero-marzo 2015 20. Eisenberg BL, Harris J, Blanke CD, et al. Phase II trial of neoadjuvant/adjuvant imatinib mesylate (IM) for advanced primary and metastatic/recurrent operable gastrointestinal stromal tumor (GIST): early results of RTOG 0132/ACRIN 6665. J Surg Oncol 2009;99:42. 21. Hong X, Choi H, Loyer EM, Benjamin RS, Trent JC, Charnsangavej C. Gastrointestinal stromal tumor: role of CT in diagnosis and in response evaluation and surveillance after treatment with imatinib. RadioGraphics 2006;26(2):481495. Caso clínico Anales de Radiología México 2015;14:117-122. Tumor del estroma gastrointestinal rectal: diagnóstico con biopsia guiada por ecografía endovaginal RESUMEN Presentamos el que creemos es el segundo caso de tumor del estroma rectal, diagnosticado por biopsia con aguja gruesa guiada por ecografía endovaginal, después del primer caso presentado por Takano y sus colaboradores. Queremos confirmar la utilidad de esta vía de acceso para realizar la biopsia tanto del tumor del estroma rectal como de otras lesiones rectales o pélvicas. Se trata del caso de una mujer de 58 años con un tumor de 3.5 cm de eje máximo, dependiente de la pared rectal anterior que producía dispareunia. Dadas las características radiológicas incluimos al tumor del estroma gastrointestinal como diagnóstico diferencial. La biopsia de la lesión se hizo con aguja gruesa y guía ecográfica endovaginal. Obtuvimos dos cilindros de la lesión cuyo resultado anatomopatológico fue tumor del estroma gastrointestinal. En el estudio de la pieza se confirmó el diagnóstico preoperatorio. Concluimos que, si la lesión puede verse con ecografía endovaginal, la biopsia preoperatoria vía endovaginal es una técnica segura y sencilla; es una alternativa válida para el diagnóstico de tumor del estroma rectal y de lesiones a las que no se les pueda realizar biopsia con endoscopia. Marco-Doménech SF1,2 Sáez-Valero E1 Lorenzo-Gorriz A1 Fernández-García P1 Navarro-Ballester A1 Servicio de Radiología Diagnóstica y Terapéutica, Hospital Universitario General de Castellón, Avda. Benicasim, s/n, 12.004, Castellón, España. 2 Departamento de Medicina, Universidad Jaume I, Avda. Vicent Sos Baynat, s/n. 12.071. Castellón, España. 1 Palabras clave: tumor del estroma gastrointestinal, biopsia, ecografía endovaginal, cirugía. Rectal gastrointestinal stromal tumor: diagnosis with transvaginal ultrasoundguided biopsy ABSTRACT We present what we believe to be the second case of a rectal gastrointestinal stromal tumor, diagnosed by thick needle transvaginal ultrasound-guided biopsy, after the first case presented by Takano et al. We want to confirm the usefulness of this access pathway to obtain biopsies of both the rectal gastrointestinal stromal tumor and other rectal or pelvic lesions. The case presented is a woman 58 years of age with a tumor measuring 3.5 cm on its longest axis depending from the anterior rectal wall, which produced dyspareunia. Given the radiological characteristics we included the gastrointestinal stromal tumor as differential diagnosis. The biopsy of the lesion was taken with a thick needle and transvaginal ultrasound guidance. We obtained two cylinders from the lesion, for which the anatomopathological result was gastrointestinal stromal tumor. Study of the piece confirmed the preoperative diagnosis. We conclude that, if the lesion can be seen www.nietoeditores.com.mx Recibido: 5 de marzo 2014 Aceptado: 12 de julio 2014 Correspondencia: Santiago F. Marco Doménech smarco@comcas.es Este artículo debe citarse como Marco-Doménech SF, Sáez-Valero E, Lorenzo-Gorriz A, Fernández-García P, Navarro-Ballester A. Tumor del estroma gastrointestinal rectal: diagnóstico con biopsia guiada por ecografía endovaginal. Anales de Radiología México 2015;14:117-122. 117 Volumen 14, Núm. 1, enero-marzo 2015 Anales de Radiología México with transvaginal ultrasound, preoperative transvaginal biopsy is a safe and simple technique; it is a valid alternative to diagnose rectal gastrointestinal stromal tumor and lesions from which biopsies cannot be taken by endoscopy. Key words: gastrointestinal stromal tumor, biopsy, transvaginal ultrasound, surgery. INTRODUCCIÓN Los tumores del estroma gastrointestinal son tumores mesenquimales, derivados de las células intersticiales de Cajal, que pueden aparecer en cualquier parte de tracto gastrointestinal. El rasgo mejor definido de estos tumores es la expresión del c-kit (CD-117), un receptor del factor de crecimiento tirosina-cinasa.1 El mejor conocimiento de la fisiopatología ha permitido el desarrollo de tratamiento molecular específico con mesilato de imatinib,2 un inhibidor de la tirosina-cinasa útil para el tratamiento neoadyuvante, en cuyo caso la biopsia preoperatoria es necesaria. El diagnóstico histológico de las lesiones del tubo digestivo se realiza fundamentalmente con la toma de muestras durante una endoscopia. Sin embargo, cuando la lesión se sitúa entre el ángulo de Treitz y la válvula ileocecal, o bien cuando es submucosa como en el caso que mostramos, el alcance endoscópico no siempre es posible. Es entonces cuando la biopsia puede hacerse percutáneamente con guía ecográfica, por laparoscopia o cirugía abierta.3 Si la lesión está situada en el recto puede usarse la ecografía transrectal o la endovaginal para ver la lesión. Sin embargo, aunque hemos encontrado casos de tumores pélvicos4 o de tumores del estroma gastrointestinal biopsiados con ecografía transrectal5 o con ecoendoscopia6,7 sólo hemos encontrado otro caso guiado con ecografía endovaginal.8 118 CASO Mujer de 58 años con antecedentes de histerectomía y salpingooforectomía bilateral por miomas y metrorragias que solicitó consulta por dispareunia. A la exploración física presentaba tumor en el tercio medio del tabique rectovaginal, redondeado, elástico, de 3.5 × 2.5 × 2 cm, con mucosa vaginal y rectal íntegras. Se efectuó ecografía endovaginal que confirmó la existencia de un tumor sólido, bien delimitado, en probable relación con la pared rectal (Figura 1). En la resonancia magnética pélvica se obtuvieron secuencias STIR, SE T1, DP, T2, Figura 1. Ecografía endovaginal: lesión nodular, bien delimitada, hipoecoica y homogénea en contacto con la pared vaginal. Marco-Doménech SF et al. Tumor del estroma gastrointestinal rectal secuencias de alta resolución, secuencias con y sin saturación grasa y tras la administración de contraste paramagnético. La lesión nodular se localizó en la pared anterior del recto a 4 cm del margen anal externo y tenía contornos bien definidos, una intensidad de señal homogénea e hiperintensa en STIR, isohiperintensa en T2 e hipointensa en T1. Después de la administración de gadolinio mostró realce homogéneo. La lesión condicionaba el canal vaginal pero no había afectación del plano graso rectovaginal. No se evidenciaron adenopatías en los territorios linfáticos pélvicos, ni líquido libre intraabdominal (Figura 2). Con el diagnóstico de sospecha de tumor del estroma rectal se decidió realizar biopsia con aguja gruesa para confirmar el diagnóstico y evaluar su agresividad. En nuestro centro no es posible realizar biopsia con aguja gruesa guiada por ecoendoscopia y se eligió la vía transvaginal, en lugar de la transrectal, para obtener la biopsia debido a que el cirujano se decantó por esa vía transvaginal dadas las facilidades técnicas aportaba comparada con la vía transrectal. La biopsia fue realizada por dos radiólogos, uno manejaba el transductor endovaginal buscando el camino más corto y seguro a la lesión mientras A B que el otro manipulaba las agujas. Utilizamos un ecógrafo Toshiba modelo Xario con la sonda endocavitaria modelo PVT-661VT de 6 MHz con dispositivo para dirigir la biopsia. La paciente fue colocada en posición ginecológica con una vía intravenosa de seguridad y con las medidas de asepsia habituales, sin administración profiláctica de antibióticos. Una vez decidida la vía de acceso a la lesión, con ecografía endovaginal, se infiltró todo el trayecto que teóricamente iba a seguir la aguja de biopsia con 10 mL de lidocaína 1%; se utilizó una aguja tipo Chiba de 22G y 20 cm de longitud a través del aditamento de la biopsia. Se infiltró todo el trayecto hasta la periferia de la lesión, sin entrar en ella y procurando hacer un buen habón submucoso en la pared vaginal. Después se efectuaron dos pases con una aguja automática de 18G, tipo ASAP (Boston scientific, USA). Colocamos la punta de la aguja unos 5 mm dentro de la lesión y a continuación disparamos la aguja de biopsia hacia el centro, con lo que obtuvimos dos cilindros del centro de la lesión (Figura 3). El resultado anatomopatológico fue tumor del estroma gastrointestinal con 12 mitosis en 50 C D Figura 2. A) Resonancia magnética pélvica. Imagen coronal potenciada en T1: imagen nodular bien delimitada con intensidad de señal homogénea e hipointensa. B) Imagen axial de alta resolución potenciada en T2: lesión que parece depender de la cara anterior del recto, isohiperintensa. C) Imagen sagital potenciada en T2: imagen ovoidea correspondiente a la lesión que depende de la pared del recto sin afectación del plano graso rectovaginal. D) Imagen coronal potenciada en T1 con saturación grasa tras la administración de contraste: la lesión realza de una manera homogénea. 119 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 La localización anatómica fue propuesta como factor pronóstico independiente del tamaño tumoral o del índice mitótico ya que los tumores de estómago tienen mejor pronóstico que los de intestino delgado y la mayoría de los tumores estromales de esófago, colon y anorrectales son malignos.1 No obstante, la localización del tumor no se considera un marcador fiable para predecir el comportamiento individual de cada caso. Figura 3. Ecografía endovaginal: aguja de biopsia en el interior de la lesión nodular de la que se obtuvieron dos cilindros para estudio anatomopatológico. campos de gran aumento con positividad intensa para c-kit, CD 34 y vimentina. Después del diagnóstico histológico se procedió a la resección de la tumoración por vía vaginal. El tumor dependía de la capa muscular del recto y no estaba adherido a la pared posterior de la vagina. Fue extirpado en bloque, con una pequeña porción de capa muscular rectal, preservando la mucosa del recto. DISCUSIÓN El tratamiento de la enfermedad localizada es la resección quirúrgica que debe conseguir márgenes libres de tumor, la linfadenectomía no es necesaria debido a lo infrecuente del compromiso ganglionar. En los casos de enfermedad avanzada la mejor comprensión de la fisiopatología del tumor estromal ha llevado al desarrollo de una nueva clase de drogas antirreceptoras de los inhibidores de la tirosina-cinasa como el mesilato de imatinib.2 Los tumores del estroma gastrointestinal son una entidad clínica e histopatológica propia, caracterizada por la expresión del receptor ckit. Esto ha erradicado su confusión con otros tumores mesenquimales.1 El tamaño del tumor primario (>5 cm) y el grado de actividad mitótica (>5 mitosis por 50 campos de gran aumento) son los parámetros más aceptados para la predicción del riesgo de comportamiento maligno.9 Algunos autores creen que la biopsia no debería hacerse en los casos de tumor del estroma gastrointestinal por el riesgo de diseminación y que sólo estaría indicado cuando el resultado de la biopsia pueda alterar el manejo del paciente o para confirmar la enfermedad metastásica antes del tratamiento con imatinib.2 La punción con aspiración con aguja fina y la biopsia con aguja gruesa tipo Trucut, usando como guía la ecogra- El estudio histológico de la pieza quirúrgica confirmó el diagnóstico preoperatorio así como que los márgenes de la pieza quirúrgica estaban libres de tumor. 120 Los tumores del estroma gastrointestinal frecuentemente cursan de forma asintomática, especialmente en etapas tempranas de la enfermedad, constituyendo a menudo un hallazgo endoscópico o radiológico casual. En los casos sintomáticos, como el nuestro, las manifestaciones clínicas se relacionan con la localización del tumor. En el recto la presentación más frecuente es un tumor mural que expande el tabique rectal, por lo que el hallazgo más común en tomografía es una masa mural focal bien circunscrita. El hallazgo menos usual es una masa focal intraluminal polipoide.10 Marco-Doménech SF et al. Tumor del estroma gastrointestinal rectal fía endoscópica obtiene diagnósticos, entre 80 y 90% de los casos, de tumores submucosos del tracto gastrointesinal.11,12 Además, el desarrollo de nuevos mecanismos de disparo de las agujas gruesas de ecoendoscopia permite obtener el diagnóstico histológico en un gran porcentaje de casos.13 En nuestra práctica clínica habitual, en las biopsias percutáneas de cualquier órgano, siempre realizamos punción con aspiración con aguja fina de 20-22G para el estudio citológico y obtenemos al menos un cilindro con aguja automática de 18G. En este caso sólo hicimos dos pases con aguja gruesa. Esto fue debido a que en la serie de Marco-Doménech y sus colaboradores,3 de biopsias percutáneas de tubo digestivo guiadas por ecografía, sólo se obtuvo diagnóstico en 45.7% de las punciones con aspiración con aguja fina frente a 95.2% de diagnósticos con punción con aguja gruesa; nosotros sólo hacemos biopsia con aguja gruesa para obtener al menos un cilindro para estudio histológico en las biopsias percutáneas del tubo digestivo. En este caso, debido a que no disponíamos de ecoendoscopia y que la lesión de la pared rectal no se veía en la ecografía abdominal, que es la única limitación para no hacer la biopsia percutánea del tubo digestivo guiada por ecografía,3 decidimos buscar una vía de acceso alternativa para alcanzar la lesión. Ante la disyuntiva de utilizar la vía transrectal o la endovaginal nos decantamos por la segunda porque era la vía de acceso que iba a utilizar el cirujano para su exéresis, intentando llevarse en el mismo acto quirúrgico el trayecto de la aguja de la biopsia; la vía vaginal es, además, una vía más limpia que la rectal que disminuye las probabilidades de bacteriemia. Lo inusual de este caso es que presentamos un tumor del estroma rectal, una localización infrecuente ya que en el recto asientan sólo 5% de los tumores estromales y éstos representan sólo 0.1% de todos los tumores rectales;14 además efectuamos la biopsia bajo guía ecográfica con sonda endovaginal a pesar de tratarse de un tumor del tubo digestivo, lo cual también es infrecuente ya que sólo hemos encontrado en la literatura especializada otro caso de tumor del estroma rectal biopsiado con guía ecográfica endovaginal.8 Creemos que debido al desarrollo de nuevos tratamientos neoadyuvantes la biopsia preoperatoria es necesaria y el abordaje transvaginal es una alternativa para las lesiones dependientes del recto. No obstante, habría que considerar el uso de la biopsia con aguja gruesa guiada por ecoendoscopia en casos situados más allá de 15 cm del margen anal, o muy cerca del mismo, y en lesiones situadas tras una estenosis, donde un endoscopio flexible llegaría con más facilidad que un transductor rígido.6 En conclusión, a pesar de su baja frecuencia, ante un tumor pélvico adyacente al recto, redondeado, bien delimitado y con captación de contraste, deberíamos pensar en un tumor del estroma rectal. Si la lesión puede verse con ecografía endovaginal podemos usar esta técnica de imagen para guiar la biopsia y obtener su diagnóstico histológico. Ya que la ecografía endovaginal es una técnica segura y sencilla es una alternativa válida para las lesiones en las que, por alguna razón, no sea posible realizar una biopsia con endoscopia. REFERENCIAS 1. Miettinen M, MaaritSarlomo R. Gastrointestinal stromal tumors: value of CD in their identification and separation from true leioimyomas and schwanomas. Am J SurgPathol 1995;19:207-16. 2. Jamali F, Darwiche S, El-kinge A, Tawil A, Sowed A. Disease progression following imatinib failure in gastrointestinal stromal tumors: Role of surgical therapy. Oncologist 2007;12:438-442. 3. Marco-Doménech SF, Gil-Sánchez S, Fernandez-García P, et al. Sonographically guided percutaneous biopsy of gastrointestinal tract lesions. AJR 2001;176:147-51. 121 Volumen 14, Núm. 1, enero-marzo 2015 Anales de Radiología México 122 4. Giede C, Toi A, Chapman W, Rosen B. The use of transrectal ultrasound to biopsy pelvic masses in women. GynecolOncol 2004;95:552-56. 9. 5. Panzironi G, Mannganaro L, Ricci F, Casale A, Macciucca M. A case of rectal GIST: findings of MR-spiral CT imaging and transrectal ultrasound guided biopsy. European Journal of Radiology 2003;47:66-69. 10. Levy AD, Remotti HE, Thompson WM, Miettinen MM. Gastrointestinal stromaltumors: Radiologic features with pathologic correlation. Radiographics 2003;23:283-304. 6. Boo SJ, Byeon JS, Park do H et al. EUS-guided fine needle aspiration and trucut needle biopsy for examination of rectal and perirectal lesions. Scandinavian Journal of Gastroenterology 2011;46:1510-1518. 7. De Witt J, Emerson RE, Sherman S et al. Endoscopic ultrasound-guided Trucut biopsy of gastrointestinal mesenchymal tumor. Surg Endosc 2011;25:2192-2202. 8. Takano M, Saito K, Kita T, Furuya K, Aida S, Kikuchi Y. Preoperative needle biopsy and inmunohistochemical analysis for gastrointestinal stromal tumor of the rectum mimicking vaginal leiomyoma. Int J Gynecol Cancer 2006;16:927-30. Fletcher CD, Berman JJ, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum Pathol 2002;33:459-65. 11. Arantes V, Logroño R, Faruqi S, Ahmed I, Waxman I, Bhutani MS. Endoscopic sonographically guided fine-needle aspiration yield in submucosaltumors of the gastrointestinal tract. J Ultrasound Med 2004;23:1141-50. 12. Maleki Z, Erozan Y, Geddes S, Kay Li Q. Endorectal UltrasoundGuided Fine-Needle Aspiration: A Useful Diagnostic Tool for Perirectal and Intraluminal Lesions. Acta Cytol 2013;57:9-18. 13. Iglesias-Garcia J, Poley JW, Larghi A et al. Feasibility and yield of a new EUS histology needle: results from a multicente, pooled, cohorte study. Gastrointest Endosc 2011;73:1189-96. 14. Hellan M, Maker V K. Transvaginal excision of a large rectal stromal tumor: an alternative. Am J Surg 2006;191:121-23. Caso clínico Anales de Radiología México 2015;14:123-128. Perforación de la vesícula biliar asociada con hydrops vesicular como manifestación atípica de la enfermedad de Kawasaki. Informe de un caso RESUMEN Antecedente: la enfermedad de Kawasaki es una vasculitis de pequeños y medianos vasos, de etiología no bien definida. Actualmente es la causa más frecuente de cardiopatía adquirida en Japón y Estados Unidos; en México no se conoce su incidencia. El hydrops vesicular se presenta en 5 a 13% de los pacientes como una manifestación atípica, aunque el número de casos reportados se ha ido incrementando. Su asociación con perforación es extremadamente rara. Colomo-Padilla AL1 Solórzano-Morales SA2 Mora-Tizcareño MA3 Sorcia-Ramírez G4 Garrido-García LM5 1 Radióloga. Médico residente de alta especialidad en Radiología Pediátrica. 2 Radióloga Pediatra. Responsable del Servicio de Ultrasonido. 3 Radióloga Pediatra. Jefa del Servicio de Radiología Pediátrica. 4 Médico Pediatra. Residente de la subespecialidad de Inmunología. 5 Cardiólogo Pediatra. Jefe del Departamento de Pre y Posgrado. Instituto Nacional de Pediatría. Av. Insurgentes Sur 3700-C, CP 04530 México, D.F. Teléfono: 10840900 Ext. 1248 Caso clínico: niño de siete años que inicio su padecimiento once días antes de su internamiento con fiebre elevada que no mejoraba con tratamiento farmacológico y dolor abdominal en hipocondrio derecho; se sospechaba el diagnóstico de hepatitis. Se le realizó un ultrasonido extrainstitucional que mostró hallazgos compatibles con hydrops vesicular. A su ingreso al servicio de urgencias del Instituto Nacional de Pediatría tenía fiebre, dolor abdominal, queilitis, conjuntivitis, fotofobia e hiperemia conjuntival. Se efectuó un nuevo ultrasonido evidenciando solución de continuidad de la pared del fondo vesicular que se comunicaba con una colección en el espacio de Morrison y el espacio pararrenal anterior, hallazgos corroborados por tomografía computada y resonancia magnética. Fue intervenido quirúrgicamente con buena evolución y dado de alta en buenas condiciones. Conclusiones: la presentación del hydrops vesicular en la enfermedad de Kawasaki antes de la aparición de los criterios esenciales, así como su asociación con perforación es muy rara, motivo por el cual se presenta este caso, para recordar esta forma inusual de presentación y las posibles complicaciones que ponen en riesgo la vida del paciente. Palabras clave: enfermedad de Kawasaki, hydrops vesicular, perforación vesicular. Recibido: 24 de agosto, 2014 Perforation of the gallbladder associated with gallbladder hydrops as an atypical manifestation of Kawasaki disease. A case report ABSTRACT Background: Kawasaki disease is a vasculitis of small and medium size blood vessels, of poorly defined etiology. Today it is the most common www.nietoeditores.com.mx Aceptado: 23 de septiembre, 2014 Correspondencia: Ana Liz Colomo Padilla analizcolomo@hotmail.com Este artículo debe ser citado como Colomo-Padilla AL, Solórzano-Morales SA, MoraTizcareño MA, Sorcia-Ramírez G, Garrido-García LM. Perforación de la vesícula biliar asociada a hydrops vesicular como manifestación atípica de la enfermedad de Kawasaki. Informe de un caso. Anales de Radiología México 2015;14:123-128. 123 Volumen 14, Núm. 1, enero-marzo 2015 Anales de Radiología México cause of acquired heart disease in Japan and the United States; its incidence in Mexico is unknown. Gallbladder hydrops occurs in 5 to 13% of patients as an atypical manifestation, although the number of cases reported has increased. Its association with perforation is extremely rare. Clinical case: Boy age seven years in whom symptoms appeared eleven days before hospitalization with high fever which did not improve with drug therapy and abdominal pain in the right upper quadrant; a diagnosis of hepatitis was suspected. An extra-institutional ultrasound showed findings compatible with gallbladder hydrops. On admission to the Instituto Nacional de Pediatría emergency ward he presented fever, abdominal pain, cheilitis, conjunctivitis, photophobia, and conjunctival hyperemia. Another ultrasound was taken evidencing solution of continuity of the wall of the gallbladder fundus communicating with a collection in the hepatorenal recess and the anterior pararenal space, findings corroborated by computed tomography and magnetic resonance. The patient underwent surgery with good evolution and was discharged in good conditions. Conclusions: The presentation of gallbladder hydrops in Kawasaki disease prior to the appearance of the essential criteria, and its association with perforation, is very rare, for which reason we present this case, to revisit this unusual form of presentation and potential life-threatening complications for the patient. Key words: Kawasaki disease, gallbladder hydrops, gallbladder perforation. INTRODUCCIÓN La enfermedad de Kawasaki es una vasculitis sistémica aguda, limitada a los vasos pequeños y medianos, de etiología no bien definida que aparece preponderante mente en la infancia. Fue descrita por primera vez en 1967 en una población pediátrica japonesa por el doctor Tomisaku Kawasaki. Originalmente esta enfermedad fue llamada síndrome mucocutáneo del nódulo linfático. Su relación con complicaciones cardiacas fue reportada en 1968 por Takiro Yamamoto. Los casos estudiados por Kawasaki fueron reportados en 1974, desde entonces se ha convertido en una enfermedad muy estudiada a escala 124 mundial debido a su frecuente presentación en la edad pediátrica.1 En México no se conoce la incidencia de la enfermedad; sin embargo, el número de casos reportados se ha incrementado en los últimos años. Se han establecido criterios diagnósticos para esta enfermedad pero muchas veces la presentación clínica y los síntomas iniciales pueden no ser característicos, generando confusión y retraso en el diagnóstico. Algunos niños pueden iniciar el cuadro con una combinación de manifestaciones neurológicas, renales y abdominales, entre las cuales destaca el dolor abdominal agudo por hydrops vesicular. Es importante tener en cuenta estas inusuales manifestaciones de presentación Colomo-Padilla AL et al. Perforación de la vesícula biliar en enfermedad de Kawasaki para realizar un abordaje diagnóstico oportuno para no poner en riesgo la vida del paciente. CASO Niño de siete años de edad sin antecedentes personales patológicos de importancia. Inició su cuadro clínico once días antes de su ingreso al Instituto Nacional de Pediatría con fiebre de 38.5°C; se le diagnosticó probable amigdalitis y 48 horas después tuvo diarrea y vómito. Recibió tratamiento con metronidazol (500 mg) y ampicilina (500 mg/8 horas) por sospecha de amebiasis o salmonelosis. Los síntomas persistieron 72 horas y se agregaron rechazo a la vía oral y dolor en hipocondrio derecho, por lo cual fue referido al Instituto Nacional de Pediatría con sospecha de apendicitis. Se efectuó ultrasonido hepático extrainstitucional que demostró incremento de tamaño de la vesícula biliar con paredes delgadas, contenido anecoico, asociado con líquido perivesicular, hallazgos compatibles con hidrocolecisto. (Figura 1). Se solicitó perfil hepático que se encontró alterado y se emitió el diagnóstico de hepa- Figura 1. Ultrasonido en modo B: incremento en el tamaño de la vesícula biliar, paredes regulares y líquido libre perivesicular. titis infecciosa. El paciente fue egresado con recomendaciones generales y tratamiento con ibuprofeno. Tres días después el paciente regresó al servicio de urgencias con ataxia y somnolencia asociados con queilitis, hiperemia e inyección conjuntival y fotofobia. Los estudios de laboratorio mostraron, principalmente, elevación de las enzimas hepáticas y de los reactantes de fase aguda (Cuadro 1). Durante su estancia en el servicio de urgencias se solicitó interconsulta al servicio de neurología que encontró datos compatibles con encefalopatía, ataxia troncal y alteración del estado de alerta, por lo que se quizo descartar encefalitis viral y se efectuó punción lumbar que resultó normal. El paciente fue evaluado por el servicio de inmunología que frente a los datos de queilitis, Cuadro 1. Resultados de los estudios realizados Hemoglobina g/dL Hematócrito % Leucocitos Neutrófilos totales Plaquetas x 103/UL VSG mm/h PCR mm/dL Sodio mg/dL TGP U/L TGO U/L FA U/L GGT U/L DHL U/L Amilasa U/L Lipasa U/L Albumina g/dL Colesterol mg/dL Bilirrubina total mg/dL Bilirrubina indirecta mg/dL Bilirrubina directa mg/dL Ingreso H Posquirúrgico 10.6 31.3 5900 3900 256 45 11 127 65 211 199 79 432 168 2.2 115 1.41 1.15 0.26 10 29 5300 3700 310 58 10.9 136 38 74 117 40 210 172 59 2.6 0.98 1 0.17 12 37 5900 2500 411 50 0.89 136 765 636 223 84 458 3.4 0.13 0.44 0.13 DHL: colesterol de alta densidad; FA: fosfatasa alcalina; GGT: gammaglutaril transpeptidasa; H: hospitalización; PCR: proteína C reactiva; TGO: transaminasa glutámico oxalacética; TGP: transaminasa glutámico pirúvica; VSG: velocidad de sedimentación globular. Fuente: elaboración interna. 125 Anales de Radiología México inyección conjuntival, piuria estéril, hidrocolecisto y meningitis aséptica emitieron el diagnóstico de enfermedad de Kawasaki atípica. Se inicio tratamiento con inmunoglobulina endovenosa (2 g/kg de peso), pulso de esteroide, dosis de esteroide convencional (metilprednisolona intravenosa 14 mg/8 horas) y ASA; los síntomas remitieron en 48 horas. Un ecocardiograma no evidenció datos de dilatación de las arterias coronarias ni datos de miocarditis, pericarditis o compromiso de la función cardiaca. Volumen 14, Núm. 1, enero-marzo 2015 Se efectuaron tomografía computada, simple y contrastada, y resonancia magnética que corroboraron los hallazgos del ultrasonido, concluyendo en una perforación vesicular (Figuras 3-5). Después de obtener los resultados de los exámenes de gabinete el paciente fue intervenido quirúrgicamente por vía laparoscópica; Cuatro días después de la administración de inmunoglobulina humana y esteroides persistían el dolor abdominal en hipocondrio derecho y la intolerancia a la vía oral. Se efectuó nuevo ultrasonido (siete días después del primero) en nuestra institución con un equipo General Electric® Logiq 9 con transductor convexo multifrecuencia en tiempo real, en modo B y con aplicación del modo Doppler color, evidenciando solución de continuidad en la pared del fondo vesicular que se comunicaba con una colección retroperitoneal limitada al espacio pararrenal anterior y al espacio de Morrison (Figura 2). Figura 2. Ultrasonido en modo B: solución de continuidad en la pared posterior de la vesícula por la cual se evidencia extravasación de bilis hacia la cavidad abdominal. 126 Figura 3. Tomografía, reconstrucción tridimensional volumétrica en corte coronal: vesícula biliar alargada con defecto en la pared en el fondo que se continúa con colección de bilis. Colomo-Padilla AL et al. Perforación de la vesícula biliar en enfermedad de Kawasaki Figura 4. Colangiorresonancia: solución de continuidad del fondo de la vesícula y paso de bilis intraperitoneal, así como dilatación de la vía biliar intrahepática y colédoco. se encontró perforación del fondo vesicular y colección líquida intraperitoneal. Fue egresado con mejoría clínica, afebril, con signos vitales normales, tolerando la dieta al cien por ciento, con tratamiento con ASA y sin complicaciones. Evolucionó satisfactoriamente y fue dado de alta sin complicaciones, con cita a los servicios de Inmunología y Cirugía General. Figura 5. Reconstrucción tridimensional volumétrica de la imagen de la figura 4. DISCUSIÓN Y CONCLUSIONES El diagnóstico de la enfermedad de Kawasaki se fundamenta en fiebre (normalmente muy elevada, hasta 40°C) durante cinco o más días y cuatro de cinco criterios clásicos descritos desde 1967 por Tomisaku Kawasaki: hiperemia conjuntival no purulenta, lesiones orales que incluyen glositis y estomatitis, adenopatía cervical (generalmente unilateral, mayor de 1.5 cm), exantema inespecífico y cambios en las extremidades que incluyen edema e hiperemia de palmas y plantas en la fase aguda y descamación de palmas y plantas en la fase subaguda.2 Muchas veces, durante la presentación de la enfermedad, no existen todos los criterios men- cionados, a esto se le denomina como forma incompleta de la enfermedad; en otras ocasiones hay signos o síntomas poco comunes, lo cual se conoce como presentación atípica.3 Dentro de esta variedad las manifestaciones abdominales son las más comunes, entre ellas la alteración en la función hepática y el hydrops vesicular. El hydrops vesicular ocurre en 5 a 13% de los pacientes con enfermedad de Kawasaki, usualmente durante las primeras dos semanas después del diagnóstico. El hydrops vesicular antes de la aparición de los criterios esenciales es muy rara. Esta manifestación atípica de la enfermedad fue descrita hace muchos años, existen datos de publicaciones de asociación del hydrops vesicular 127 Volumen 14, Núm. 1, enero-marzo 2015 Anales de Radiología México con la enfermedad de Kawasaki desde 1987; algunos casos, en 1989, fueron sometidos a una intervención quirúrgica antes de las manifestaciones clásicas de Kawasaki.4 Aún no se conoce el mecanismo de producción; sin embargo se han postulado varias hipótesis. La primera de ellas cita que el hydrops vesicular ocurre después de un proceso de vasculitis en la pared de la vesícula biliar, lo cual ha sido demostrado por el hallazgo de vasculitis en el hígado de la autopsia de 6 de 37 pacientes; también se describió la infiltración de las células inflamatorias, principalmente leucocitos polimorfonucleares y eosinófilos, en los sinusoides y en el áreas portal, por lo general de localización en el lumen de los conductos biliares. La segunda hipótesis postula que la distensión se produce por la presencia de ganglios linfáticos circundantes, que potencialmente pueden producir obstrucción del conducto cístico.5 En los estudios de imagen probablemente los hallazgos más frecuentes del hydrops vesicular están caracterizados por distensión de la vesícula biliar, sin imágenes de cálculos en su interior y con paredes finas o discretamente engrosadas, sensible a la palpación local con el transductor (signo de Murphy ultrasonográfico [+]).6 El tratamiento de la enfermedad de Kawasaki con gammaglobulinas intravenosas está encaminado a disminuir la inflamación, con lo que se resuelve también la inflamación vesicular. En el Instituto Nacional de Pediatría, hasta marzo del 2014, se han presentado 314 casos de enfermedad de Kawasaki, no se conoce el número de pacientes con hydrops vesicular pero es el primer caso reportado con rotura vesicular. La perforación de la vesícula biliar en los casos de hydrops asociado con enfermedad de Kawasaki es extremadamente rara, hemos encontrado sólo un caso reportado en la literatura que 128 data de 1983; John R. Sty y sus colaboradores reportaron el caso de una niña de 2 años y medio con un cuadro clínico caracterizado por dolor abdominal localizado en el hipocondrio derecho, asociado con un tumor palpable de 6 × 6 cm aproximadamente, asociado con fiebre y manifestaciones cutáneas como parte de la presentación de la enfermedad de Kawasaki. Se le practicó un ultrasonido abdominal que evidenció vesícula distendida asociada con una colección loculada adyacente, también encontraron líquido libre intraperitoneal.7 Esta publicación busca enfatizar la importancia de realizar un diagnóstico clínico oportuno de la enfermedad de Kawasaki atípica con dolor abdominal en el hipocondrio derecho causado por hydrops vesicular. El ultrasonido es el método de imagen más accesible y adecuado para establecer el diagnóstico y para tomar acciones pertinentes y rápidas frente al dolor abdominal causado por el hydrops vesicular y para evitar complicaciones como la perforación vesicular descrita en nuestro paciente. REFERENCIAS 1. Kawasaki T, Kosaki F, Okawa S. et al. A new infantile acute febrile mucocutaneous lymph node síndrome prevailing in Japan. Pediatrics 1974;54:271-6. 2. Rosie Scuccimarri, MD. Kawasaki Disease. Pediatr Clin N Am 2012;59:425-445. 3. Judith Sánchez-Manubens et al. Diagnosis and classification of Kawasaki disease. Journal of Autoimmunity 2014;4849:113-117. 4. Suddleson EA, Woolley MM. Takahasi M. Hydrops of the gallbladder associated with Kawasaki syndrome. J Pediatr 1987;22:956-9 En: Gallblader hydrops – A rare initial presentation of Kawasaki disease. Sheila Samanta mathai et al. J Pediatr 2013;80(7):616-617. 5. Mohammed ElAdawy et al. Pediatr Infect Dis 2011;30 (2):141-144. 6. López C. Ignacio et al. Caso clínico radiológico. Rev Chil Pediatr (online) 2007;78:73-75. 7. John R. Sty et al. Gallblader perforation in a case of Kawasaki disease: Image correlation. J Clin Ultrasound 1983;11:381-384. Personaje Anales de Radiología México 2015;14:129-131. Guillermo Santín García: una semblanza Guillermo Santin Garcia: a biographical sketch El currículum vítae del doctor Guillermo Santín García demuestra la trayectoria de un médico mexicano con un alto sentido de profesionalismo, dedicación a la especialidad, entrega completa a la docencia y además de la integridad de un radiólogo que es considerado como el decano de la radiología mexicana. El doctor Santín García es Maestro en Ciencias (Roentgenología), la maestría la obtuvo en la Universidad de Ann Arbor, Michigan, durante su residencia, al terminarla se certificó por el American Board of Radiology, fue el primer radiólogo mexicano en lograrlo. Al regresar de Estados Unidos tenía interés en formar verdaderos radiólogos, los que existían entonces eran en su mayoría empíricos. Es reconocido como el fundador de la primera residencia formal de radiología que se establecía en el país, la sede fue el Hospital Francés, institución donde llevó a cabo una gran parte de sus actividades profesionales. El doctor Salvador Zubirán, siendo rector de la UNAM lo nombró profesor de radiología e inició así su carrera docente en la Facultad de Medicina, la que hace pocos años le entregó, en una emotiva ceremonia, un reconocimiento por 60 años dedicados a la docencia. En 1973 se formó el Consejo Mexicano de Radiología, en parte por gestiones que él había realizado dentro de una comisión que presidía en la Sociedad Mexicana de Radiología, veía con claridad la necesidad de evaluar por pares a los radiólogos que egresaban de diferentes universidades, con base en lo anterior, se elaboraron los lineamientos correspondientes de ese consejo que a la fecha ha certificado a cerca de cuatro mil radiólogos. El doctor Santín fue su primer presidente. Hace casi 50 años ingresó a la Academia Nacional de Medicina y debemos reconocer que era uno de los miembros que asistía regularmente a las sesiones semanales, hacía siempre comentarios inteligentes de las presentaciones, aún cuando no fueran de su especialidad. El doctor Santín también es miembro de la Academia Mexicana de Cirugía, en donde tuvo diferentes cargos en diferentes mesas directivas, recientemente fue nombrado miembro honorario de esa corporación. Fue además uno de los primeros radiólogos miembros de la Sociedad Mexicana de Radiología y la presidió en 1959. El doctor Santín organizó el Primer Congreso Nacional de Radiología, con lo que se inició la unión de los radiólogos mexicanos nacionales, los que ahora están constituidos en la Federación Mexicana de Radiología e Imagen. El congreso se continúa llevando a cabo en 129 Anales de Radiología México Volumen 14, Núm. 1, enero-marzo 2015 acceso a estudios radiológicos clasificados y ordenados, ya de edad avanzada aprendió computación y él mismo digitalizó los casos de manera que ahora se pueden revisar por vía electrónica. A Guillermo le gustaba decir que esta instalación era un hospital-radioteca. El director anterior de nuestra Facultad, el doctor José Narro Robles, ahora rector de la UNAM, promovió que la radioteca llevara su nombre, en reconocimiento a sus valiosas aportaciones en apoyo a la docencia. Figura 1. Familia del doctor Guillermo Santín García. forma bianual y en varios de ellos se le ha reconocido por su destacada trayectoria profesional y docente. No se exagera al considerar al doctor Santín como un humanista en el real sentido de la palabra. Fue de los primeros radiólogos que se interesó en promover en México la medición de las dosis de radiación que recibían pacientes y personal de salud expuesto, lo que propició que se establecieran las primeras regulaciones de protección radiológica y que muchos compañeros, radiólogos y técnicos radiólogos no sufrieran sus consecuencias. No termina ahí su interés en esta materia, debido a sus publicaciones y comunicaciones, la industria relojera debió modificar y eliminar los relojes de pulso que tenían carátulas fluorescentes y que emitían dosis bajas de radiación. Los radiólogos mexicanos se dirigen a él como el maestro Santín y es que Guillermo, como me ha permitido tutearlo, desde hace muchos años es un verdadero maestro, ejemplo en nuestra especialidad, ya que hasta los 97 años de edad en que se jubiló de la UNAM cotidianamente asistía a la radioteca que él formó, con la idea de que los jóvenes estudiantes tuvieran 130 El doctor Santín nació en la Ciudad de México, sus padres fueron el doctor Adalberto Santín y Jacobita García en Estados Unidos, contrajo matrimonio en México, ya terminada su residencia, con Lorna Ann Hodges, hija de un prestigiado radiólogo norteamericano, el doctor Paul C. Hodges, Chairman en la Universidad de Chicago. Tuvieron a Guillermo, Lorna, Alejandro, Antonio, Beatriz, Cinthya y a Magdalena, todos ellos Santín Hodges; Magdalena es esposa del distinguido oftalmólogo Jaime Lozano Alcázar, Guillermo es ingeniero en electrónica y Antonio es cirujano plástico que ejerce en Montana, Estados Unidos. Figura 2. El doctor Santín en la radioteca de la UNAM que lleva su nombre. Personaje Su esposa falleció y el doctor Santín nuevamente se casó con Margarita Santamarina, quien también ya falleció. El doctor Guillermo Santín nació el 1 de marzo de 1915, cumple por ello, este año, 100 años de edad. Felicidades para él, debe sentirse orgulloso de su trayectoria personal, familiar y profesional, pero en especial por ser un ejemplo para las demás generaciones. Dedico el editorial de este número de la revista “Desafíos de la especialidad de radiología en las siguientes décadas” al doctor Guillermo Santín García con motivo de la celebración del centenario de su natalicio. Dr. José Luis Ramírez Arias Director Médico Hospital Ángeles Pedregal Figura 3. El decano de la radiología mexicana, doctor Guillermo Santín García. 131 Lineamientos para los autores Cuadros (cada uno en página separada) Pies de figura El autor enviará original y dos copias impresas en papel y un CD-Rom. Estos lineamientos concuerdan con los requisitos estandarizados para manuscritos enviados a revistas biomédicas del Comité internacional de Editores de Revistas Médicas (ICMJE). Anales de Radiología México es el órgano oficial de la Sociedad Mexicana de Radiología e Imagen, A.C. Publica todos los trabajos científicos relacionados con la especialidad, o de interés general, de todos los médicos que lo soliciten siempre y cuando sean originales, inéditos de publicación exclusiva y después de ser aprobados por el Consejo Editorial. Los autores deben tomar nota de que estos lineamientos deben seguirse en forma precisa y que están de acuerdo con los Requerimientos Estandarizados para Manuscritos sometidos a Revistas Biomédicas (An Rad Mex 1998;52:179-187). Anales de Radiología México se reserva, sin embargo, el derecho de efectuar cualquier cambio para uniformar la presentación de los manuscritos conforme a las normas particulares de la Revista. ASPECTOS LEGALES Los manuscritos deberán ser inéditos y no haber sido enviados a medio alguno para su publicación. Los autores deberán poseer los derechos de autor sobre todo el material incluido o, en su defecto, agregar copias escritas de las autorizaciones de publicación respectivas. PREPARACIÓN DEL MANUSCRITO La extensión máxima de un manuscrito será de 20 cuartiIlas, escritas a máquina a doble espacio, con márgenes de 3 cm. Las secciones del manuscrito deben presentarse cada una en páginas separadas en el siguiente orden: Página del título Resumen en español Resumen en idioma ingles (Abstract) Agradecimientos Referencias PÁGINA DEL TÍTULO En esta página consignará el título completo del artículo. Los nombres y apellidos completos de los autores, enlistados en columna. El nombre completo y la dirección de la Institución en la que se llevó a cabo el trabajo, incluyendo el código postal. La dirección, el teléfono del autor principal y la dirección de su correo electrónico. PÁGINA DEL RESUMEN EI resumen tendrá una extensión máxima de 250 palabras en trabajos oríginales y 150 palabras para informes de casos aislados. El resumen y el abstract deberán contener las secciones del articulo: Antecedentes, Objetivo, Material y método, Resultados, Discusión, Conclusión ypalabras clave. DESARROLLO DEL TEXTO Los trabajos originales y de experimentación se dividirán en secciones con los siguientes encabezados: Antecedentes Material y métodos Resultados Discusión Conclusiones Anote claramente en los Antecedentes el propósito del estudio y consigne solo las referencias pertinentes sin hacer una revisión exhaustiva del problema en esta sección. Describa Ios métodos utilizados, los instrumentos y procedimentos con el detalle suficiente para que otro autor pueda reproducir los resultados. Exponga los métodos de análisis estadísticos. Los resultados deben exponerse en secuencia lógica. Cuando utilice cuadros no repita en el texto todo su contenido. En la discusión no repita en detalle los resultados, destaque lo más importante, su significado y limitaciones. Relación con los resultados obtenidos por otros autores. Establezca la relación entre los resultados obtenidos y los propósitos del estudio. Termine señalando conclusiones derivadas del contenido del artículo. ABREVIATURAS Y UNIDADES Es recomendable utilizar las unidades del Sistema Internacional de unidades y los simbolos aceptados. No utilice abreviaturas excepto que en un mismo parrafo o un enunciado se repita más de tres veces. REFERENCIAS Deben estar siempre en el texto, enumeradas en forma consecutiva, en el orden en que se citan. Los nombres de las revistas se deben abreviar corforme al estilo del Index Medicus. Anote los apellidos y las iniciales de los nombres de todos los autores cuando sean seis o menos. Cuando sean más de siete puede anotar los tres primeros y agregar et al. Ejemplo de referencias de revistas Hughes LA, Hartnell GC, Fínn JP, et al. Time – of-flight MR angiography of the portal venous system: value compared with other imaging procedures. AJR 1996;166:375-378. Ejemplo de referencia de capítulo de libro Bierman EL. Athrosclerosis and other forms of arteriosclerosis, In: Isselbacher KJ, Martin JB Braun Wald E, y col, eds. Harrison principles of intenal medicine. 13th ed New York, NY: Mc Graw Hill. 1994;1:106-116 . Ejemplo de referencia de libro Gray H. Williams PL, Warwick R, y col. Anatomy of the human body. 37th ed New York,NY, Churchil-Livingstone. 1989:1389. ILUSTRACIONES Las imágenes deben ser enviadas en CD-Rom y estar digitalizadas, la resolución deberá ser de 300 dpi en formato .tif o bien .jpg. Para una mejor exactitud en Ia orientación de las imágenes deberán estar impresas señalando con una flecha donde indique la parte superior de Ia fotografía. LEYENDAS DE LAS ILUSTRACIONES Cada esquema y fotografía debe tener una leyenda, llamada pie de la figura. Los pies de figura se presentarán en una hoja, en párrafos separados correspondientes cada uno al número de la figura que debe anotarse en el margen izquierdo. CUADROS Y GRÁFICAS Los cuadros deberán numerarse en forma progresiva con números romanos. Cada uno debe tener un titulo explicativo. Las gráficas deben ser de calidad profesional. El número de cuadros y gráficas debe ser congruente con la extensión del texto para poder distribuirlos en forma adecuada. ENVÍO DEL MANUSCRITO Es recomendable utilizar sobres gruesos, con protecciones internas para evitar el maltrato de las ilustraciones durante su transporte. El manuscrito deberá enviarse en sobre cerrado al Editor de Anales de Radiología, México. Dr. Oscar Quiroz Castro. Coahuila No. 35, 06700, México, D.F, Tel. 5574-5250. HOJA DE CESIÓN DE DERECHOS Es requisito indispensable para la aceptación de un trabajo que esté compañado de una HOJA DE CESIÓN DE DERECHOS debidamente firmada. RESPONSABILIDAD Los Editores y el Consejo Editorial de Anales de Radiología México, no aceptan responsabilidad por el contenido del texto o las ilustraciones. Ésta es exclusiva de los autores. Cesión de derechos Dr. Oscar Quiroz Castro Editor de Anales de Radiología México Presente Los que suscribimos este documento, autor y coautores del trabajo titulado 1. Declaramos que hemos leído el manuscrito y aprobamos el contenido del texto y los cuadros que entregamos a Anales de Radiología México. 2. En caso de ser aceptado para su publicación transferimos a la Sociedad Mexicana de Radiología e Imagen A.C., todos los derechos de autor que conlleva el título del trabajo, el derecho de reimprimir en forma total, parcial o bajo la forma de sobretiros, en cualquier otra publicación de la Sociedad y renunciamos a toda posible utilidad. 3. Conservamos el derecho para utilizar el material en forma personal para su presentación en conferencias, reuniones médicas y/o exposiciones científicas. 4. Certificamos que el trabajo o su contenido no han sido publicados o enviados para su publicación por nosotros ni por otros autores a ninguna revista mexicana o extranjera y que no está sujeta a derechos de autor. 5. Declaramos poseer los derechos de autor sobre todo el material incluido en el manuscrito o, en su defecto, agregar copia escrita de las autorizaciones para publicación respectivas. Nombre y firma de autores 1 2 3 4 LISTA DE VERIFICACIÓN Si cambió de domicilio Antes de enviar el manuscrito verifique los siguientes puntos: Manuscrito original y dos copias a doble espacio CD-Rom Figuras y cuadros completos y bien identificados, con pies apropiados Resumen y Abstract: 250 palabras para artículos y 150 palabras para casos clínicos Referencias bibliográficas completas y ESTRICTAMENTE APEGADAS a las señaladas en la hoja de Lineamientos para los autores Hoja de Cesión de derechos firmada por todos los autores Dirección postal y electrónica y teléfono del primer autor INDISPENSABLE REVISAR ESTA LISTA Desprenda la etiqueta del sobre de la Revista y péguela en este espacio. Envíela a la Oficina de la Sociedad Mexicana de Radiología e Imagen, A.C. Coahuila 35, Col. Roma, 06700, México, D.F. ESTA HOJA DEBIDAMENTE FIRMADA DEBE ACOMPAÑAR A CADA ARTÍCULO QUE SE DESEE PUBLICAR EN ANALES DE RADIOLOGÍA MÉXICO Si desea publicar en Anales de Radiología México envíe su artículo a: smrianales@servimed.com.mx incluída la cesión de derechos firmada por todos los autores. Forma de suscripción SUSCRÍBASE PARA MANTENERSE AL DÍA DATOS DEL SUSCRIPTOR FECHA: NOMBRE: _____________________________________________________________________________________________ APELLIDO PATERNO MATERNO NOMBRE DESEA QUE LA REVISTA LE LLEGUE A: CASA ( ) CONSULTORIO ( ) OTROS ( ) DIRECCIÓN: __________________________________________________________________________________________ CALLE No. EXT. No. INT. COLONIA ______________________________________________________________________________________________________ CÓDIGO POSTAL POBLACIÓN ESTADO PAÍS TELÉFONO FACTURA A NOMBRE DE: ______________________________________________________________________________ DIRECCIÓN: __________________________________________________________________________________________ CALLE No. EXT. No. INT. COLONIA ____________________________________________________________________________________ CÓDIGO POSTAL POBLACIÓN ESTADO PAÍS TELÉFONO COSTO DE LA SUSCRIPCIÓN ANUAL: MÉXICO $770.00 EXTRANJERO 85.00 USD PERIODO ______________ A ________________ Forma de pago: Efectivo: ( ) Exclusivamente en forma personal en la sociedad mexicana de radiología e imagen, A.C. Cheque: ( ) A nombre de la sociedad mexicana de radiología e imagen, A.C. Tarjeta: ( ) Llenando cupón pagaré anexo FORMA DE PAGO Marque en el espacio correspondiente con una X Cheque a nombre de la Sociedad Mexicana de Radiología e Imagen, A.C. por Cheque No. Cargo a su tarjeta de crédito por Emisor de la tarjeta: Banamex $ Banco Bancomer Carnet $ American Express Visa Master Card No. de tarjeta Válido desde mes Válido hasta año mes año Código American Express Número de 4 dígitos que aparece en la parte central derecha de su tarjeta American Express Nombre como aparece en la tarjeta Por este pagaré me obligo a pagar a la orden del emisor de mi tarjeta, el importe de este título. Este pagaré procede del contrato de apertura de crédito en cuenta corriente para el uso de tarjeta de crédito que el emisor y el tarjetahabiente tienen celebrado y representa las disposiciones que del crédito concedido hace el suscriptor. Tanto la restitución de la suma dispuesta, como los intereses que causará dicha suma se determinarán y calcularán en la forma, términos y condiciones convenidos en el contrato referido. Este pagaré es negociable únicamente con instituciones de crédito. Fecha: ____________________________________ Firma del tarjetahabiente: _____________________________________ Para cualquier aclaración comunicarse a la Sociedad Mexicana de Radiología e Imagen, A.C. al tel.: 5584-7715, 5264-3268; Fax. 5574-2434;e-mail: smrianales@servimed.com.mx