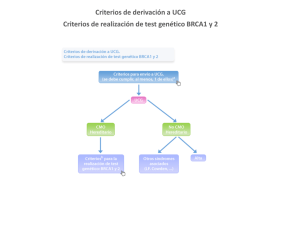
serie informes públicos de avaliación inf04/02
Anuncio

SERIE INFORMES PUBLICOS DE EVALUACIÓN. INF2002/03 Susceptibilidad al cáncer de mama y ovario asociada a los genes BRCA1 y BRCA2. Ventajas y limitaciones relacionadas con su detección. Santiago de Compostela, septiembre de 2002 Axencia de Avaliación de Tecnoloxías Sanitarias de Galicia (avalia-t) XUNTA DE GALICIA El presente informe es propiedad de la Axencia de Avaliación de Tecnoloxías Sanitarias de Galicia, quedando prohibida su reproducción, almacenamiento o transmisión sin el permiso de esta Agencia. NOTA: Parte de este informe se ha confeccionado adaptando la información presentada en los siguientes documentos: Noorani HZ McGahan L. Predictive genetic testing for breast and prostate cancer. Ottawa, Canadian Coordinating Office for Health Technology Assessment (CCOHTA) 1999. National Cancer Institute (USA). Genetics of Breast and Ovarian Cancer. 2002. Department of Health. New York State. Genetic susceptibility to breast and ovarian cancer: assessment, counseling and testing guidelines. 1999. Axencia de Avaliación de Tecnoloxías Sanitarias de Galicia Subdirección Xeral de Planificación Sanitaria e Aseguramento Servicio Galego de Saúde C/ San Lázaro s/n 15781- Santiago de Compostela Teléfono:981 541831 Fax: 981 542854 Correo electrónico: avalia-t@sergas.es Autor: Alberto Ruano Raviña. Dirección y coordinación: Rafael Mateo Rodríguez. Antonio V. Rodríguez Calvo. Este informe ha sido sometido a un proceso de revisión externa. La Agencia de Avaliación de Tecnoloxías Sanitarias de Galicia agradece a la Dra Ana Vega Glienmo, de la Unidad de Medicina Molecular del Instituto Gallego de Oftalmología y a la Dra Teresa Cerdá Mota, del Servicio de Programas Poblacionales de Cribado de la Dirección General de Salud Pública su colaboración desinteresada y los comentarios aportados. Para citar este informe: Ruano Raviña A. Susceptibilidad al cáncer de mama y ovario asociada a los genes BRCA1 y BRCA2. Santiago de Compostela: Servicio Galego de Saúde. Axencia de Avaliación de Tecnoloxías Sanitarias de Galicia, avaliat; 2002. Informes de evaluación: INF 2002/03. Índice 1. RESUMEN 3 2. INTRODUCCIÓN 5 2.1. EPIDEMIOLOGÍA 2.1.1. Epidemiología del cáncer de mama. 2.1.2. Epidemiología del cáncer de ovario 2.2. CONCEPTO DE SUSCEPTIBILIDAD GENÉTICA Y ANÁLISIS GENÉTICO. 2.3. ALTERACIONES EN LOS GENES BRCA1 Y BRCA2. 2.4. DETECCIÓN PRECOZ DEL CÁNCER DE MAMA. 3. OBJETIVOS 4. MÉTODO 5 5 5 6 6 8 9 11 4.1. BÚSQUEDA BIBLIOGRÁFICA. 5.1. RESULTADOS DE LA BÚSQUEDA. 5.2. BRCA1 Y BRCA2. 5.2.1. Estudios realizados en España. 5.3. MÉTODOS DE DETECCIÓN Y CAPACIDAD PREDICTIVA. 5.3.1. Detección de las mutaciones. 5.4. MEDIDA DEL RIESGO. 5.5. CONSEJO GENÉTICO. 5.5.1. Consejo pretest. 5.5.2. Test genético. 5.5.3 Consejo postest. 5.6. COSTE 5.7. ALTERNATIVAS AL ANÁLISIS GENÉTICO. 5.8. OTROS ASPECTOS. 6. DISCUSIÓN. 11 13 13 14 15 15 17 18 19 21 22 25 26 27 29 6.1. DISCUSIÓN DE LA BÚSQUEDA. 6.2 DISCUSIÓN DE LOS RESULTADOS. 6.2.1. Análisis genético. 6.3. LIMITACIÓN DE LAS INTERVENCIONES. 6.4. IMPLICACIONES PSICOLÓGICAS DEL TEST. 6.5. EDUCACIÓN PRETEST Y CONSEJO GENÉTICO. 6.6. MEDIDAS PROFILÁCTICAS EN LAS PORTADORAS DE MUTACIONES. 6.7. DEMANDA ESPERADA DE ANÁLISIS GENÉTICO DE LOS GENES BRCA1 Y BRCA2. 6.8. IMPLICACIÓN PARA OTROS CÁNCERES. 6.9. CONTEXTUALIZACIÓN. 29 29 31 32 32 34 35 36 37 38 5. CONCLUSIONES 41 6. RECOMENDACIONES 43 7. BIBLIOGRAFÍA 45 8. GLOSARIO 49 1 avalia-t Lista de abreviaturas BRCA1: Breast Cancer Gene 1. BRCA2: Breast Cancer Gene 2. IARC: International Agency for Research on Cancer. SSCP: Single Strand Conformational Polymorphisms (Polimorfismos de conformación de cadena única). 2 Resumen 1. RESUMEN 1. Introducción Del 5 al 10% de todos los cánceres de mama y ovario se atribuyen a la herencia familiar, particularmente a mutaciones heredadas en los genes BRCA1 y BRCA2. La detección de estas mutaciones en grupos de riesgo podría permitir una actuación preventiva en esas poblaciones. 2. Objetivos a) Describir las ventajas y limitaciones del análisis genético de los genes BRCA1 y BRCA2 en los cánceres de mama y ovario y determinar su relevancia clínica. b) Indicar las limitaciones e implicaciones psicosociales relacionadas con el análisis genético. c) Contextualizar la realización de estos tests genéticos en Galicia. 3. Métodos Se buscaron informes y revisiones sistemáticas sobre la detección de ambos genes y sus implicaciones en aquellos grupos de riesgo. También se buscó manualmente en revistas disponibles y la literatura española existente al respecto, además de consultar con expertos. 4. Resultados Se encontraron tres informes muy completos y diversa literatura que analizaba tanto los aspectos técnicos en la detección de ambos genes como las implicaciones psicológicas para las pacientes y sus familiares. La detección de mutaciones es un proceso costoso y laborioso que consume bastante tiempo. Antes de realizar el análisis hay que permitir que los pacientes tomen una decisión informada valorando los beneficios y riesgos del test, iniciando por tanto el complejo proceso del consejo genético. En aquellos pacientes con mutaciones en alguno de los genes se recomienda sobre todo un seguimiento intensivo para detectar precozmente la aparición del cáncer, y en algunos casos se ha llegado a recomendar cirugía profiláctica. 3 avalia-t 5. Discusión Todos los autores coinciden en que la detección de mutaciones en los genes BRCA1 y BRCA2 y su manejo clínico es un proceso enormemente complejo que plantea diversas limitaciones. Una de ellas es la deteción de mutaciones cuya significación clínica se desconoce. Otra limitación, y quizá la más importante, es la inexistencia de medidas completamente satisfactorias en el caso de que exista una mutación. El seguimiento intensivo se puede efectuar sin la necesidad de conocer si la mutación está presente (en caso de pertenecer a una familia de riesgo) y la cirugía profiláctica tiene serias limitaciones como, a) la eliminación de un tejido completamente sano sin la certeza de que el cáncer se vaya a desarrollar, b) aún con cirugía profiláctica no se elimina la posibilidad de cáncer, pues es inevitable que permanezca tejido susceptible de desarrollar la enfermedad y, c) tiene importantes implicaciones psicológicas en las mujeres, al ver su imagen alterada. 6. Conclusiones Hay importantes aspectos éticos y psicológicos en la determinación de la susceptibilidad al cáncer de mama y ovario asociada a los genes BRCA1 y BRCA2. Se necesita un entrenamiento muy específico para proporcionar el consejo genético. El facultativo no debe solicitar el análisis genético de ambos genes sin antes haber determinado si el paciente cumple los criterios de pertenencia a un grupo de riesgo y sin haber explicado detenidamente los riesgos y limitaciones de este análisis. 7. Recomendaciones Es importante determinar el perfil mutacional de las diversas poblaciones y la implicación clínica de las mutaciones encontradas. Se podría realizar un estudio piloto que implicase a diversos facultativos entrenados en consejo genético que serviría también para observar cómo responderían las pacientes y sus familias a la posibilidad de realización del test. 4 Introducción 2. INTRODUCCIÓN 2.1. Epidemiología 2.1.1. Epidemiología del cáncer de mama. El cáncer de mama es el más frecuente entre las mujeres de la Unión Europea, donde en 1995 se diagnosticaron 199.091 nuevos casos, lo que representa el 28% de todos los cánceres en la mujer. Las tasas de incidencia más altas se sitúan en el Norte de Europa y las más bajas en el Sur. España no es una excepción y el cáncer de mama es el de más incidencia entre las mujeres. Según datos del IARC (International Agency for Research on Cancer), la estimación para el año 2000 de la tasa ajustada de incidencia (a la población mundial) en España es de 47,87 casos/100.000 mujeres, y la tasa ajustada de mortalidad es de 18,07 casos/100.000 mujeres (1). Según datos provisionales de la Dirección Xeral de Saúde Pública, en Galicia, la tasa ajustada de incidencia (a la población mundial) fue de 46,08 casos/100.000 habitantes en el año 2000. El 21% de los casos de cáncer de mama en Galicia ocurren en mujeres menores de 50 años, el 39% ocurre en mujeres de 50 a 64 años y el 40% en mujeres de 65 y más años. Se ha indicado que una de cada nueve mujeres desarrollará cáncer de mama durante su vida y que una de cada 25 morirá de cáncer de mama. El cáncer de mama es también la principal causa de años potenciales de vida perdidos (2). 2.1.2. Epidemiología del cáncer de ovario El cáncer de ovario es el más mortífero de los cánceres ginecológicos. Es el sexto tumor maligno más frecuente y la primera causa de muerte por cáncer ginecológico en mujeres de la Unión Europea.(3) El 1-2% de las mujeres europeas presentarán cáncer de ovario a lo largo de su vida. Actualmente, el 50% de las mujeres diagnosticadas de cáncer de ovario mueren a los cinco años y la supervivencia no ha mejorado de forma significativa en los últimos años pese a la introducción de nuevos tratamientos. Este cáncer responde bastante bien al tratamiento si es detectado en una fase temprana, pero la gran mayoría de las mujeres no 5 avalia-t son diagnosticadas hasta que el cáncer se ha extendido fuera de los ovarios. Cuando el cáncer de ovario se detecta antes de que se haya extendido fuera de los ovarios, más del 90% de las mujeres sobreviven más de 5 años. En Estados Unidos sólo el 25% de los casos de cáncer de ovario son diagnosticados en las fases iniciales. Cuando se diagnostica en las fases avanzadas, la probabilidad de supervivencia a los cinco años es del 25%. El cáncer de ovario tiene una incidencia en España de 8,29 casos/100.000 mujeres (tasa ajustada a la población mundial), ocupando la séptima posición y una tasa de mortalidad de 4,40 casos por cada 100.000 mujeres (tasa ajustada), ocupando la quinta posición en cuanto a mortalidad por tipo de cáncer (1). 2.2. Concepto de susceptibilidad genética y análisis genético. La susceptibilidad se define como la cualidad de ser más vulnerable de lo normal a una enfermedad o trastorno, si es genética, esta vulnerabilidad se atribuye a uno o varios genes. Los tests genéticos incluyen muchos tipos diferentes de análisis de laboratorio utilizados para diagnosticar o predecir una condición genética o la susceptibilidad a una enfermedad. El screening genético implica la utilización de varios tests genéticos a grupos de individuos, independientemente de una historia familiar de un desorden. El test genético, en cambio, utiliza ensayos específicos para determinar el estado genético de los individuos en los que ya se sospecha un alto riesgo para una condición particular heredada debido a una historia familiar. 2.3. Alteraciones en los genes BRCA1 y BRCA2. En comparación con los factores ambientales, los factores genéticos confieren un mayor riesgo de cáncer de mama para aquellas mujeres cuyos parientes en primer grado (madre, hermana o hija) están afectados por la enfermedad. Aproximadamente el 5-10% de los cánceres de mama en la población general se han asociado con la herencia de mutaciones que confieren un elevado riesgo de desarrollar la enfermedad. Se han aislado dos genes, 6 Introducción BRCA1 y BRCA2, y se han desarrollado varias pruebas para detectar mutaciones heredadas. Las estimaciones iniciales del riesgo vienen de estudios realizados en familias con un gran número de miembros afectados. Según los estudios basados en estas familias, una mutación en los genes BRCA1 o BRCA2 confiere un riesgo de hasta el 85% de desarrollar un cáncer de mama y de un 50% para el cáncer de ovario a los 70 años (particularmente para el gen BRCA1). También hay riesgos significativos para los cánceres de colon, próstata y quizá otros. Cuando se identifica una mutación conocida en una familia, el hallazgo de un resultado negativo puede significar una reestadificación del paciente analizado. Un hallazgo positivo puede significar un seguimiento intensivo. Se han identificado más de 900 mutaciones en ambos genes. Los dos son de gran tamaño y tienen una compleja estructura genética. El gen BRCA1 comprende 5.592 nucleótidos a lo largo de unas 100 kilobases de DNA genómico. Tiene 22 exones que producen una proteína de 1.863 aminoácidos. El gen BRCA2 comprende 11.385 nucleótidos con 27 exones que producen una proteína de 3.418 aminoácidos.(4) Cánceres esporádicos, familiares y hereditarios. El cáncer de mama hereditario es clínicamente diferente de los cánceres esporádicos. En los cánceres hereditarios la edad de comienzo es significativamente menor, la prevalencia de desarrollo bilateral es mayor y hay una gran presencia de tumores asociados en los individuos afectados. Por el contrario, los cánceres esporádicos ocurren tardíamente y como tumor individual. La histología, morfología, modelo metastásico y supervivencia son similares independientemente de si el caso es esporádico o heredado. Según el modelo mendeliano de herencia autosómica dominante, se define el cáncer de mama heredado cuando la mujer tiene dos o más parientes en primer grado (madre, hija o hermana) que son diagnosticadas de cáncer de mama. El cáncer de mama hereditario se caracteriza por una aparición a edades tempranas (del orden de 5 a 15 años antes que los casos esporádicos), bilateralidad, transmisión vertical a través de la línea materna o paterna y asociación familiar con tumores de otros órganos, particularmente ovario y próstata. La mayoría de los cánceres de mama heredados pueden ser atribuidos a mutaciones en la línea germinal de los genes BRCA1 y BRCA2. El resto de los casos son atribuidos a sobreexpresión de oncogenes y otras aberraciones genéticas. Las mutaciones en el gen BRCA1 tienen mayor prevalencia en aquellas familias en las que hay presencia tanto de cáncer 7 avalia-t de mama como de ovario. Los cánceres de mama asociados al gen BRCA1 son a menudo de grado más elevado, sobreexpresan con frecuencia la proteína supresora de tumores p53 y son receptores de estrógenos negativos. El gen BRCA2 se ha asociado con menos casos incidentes de cáncer de ovario y muchos casos de cáncer de mama en varones. También se han encontrado grupos étnicos con una mayor prevalencia de alteraciones en estos genes. 2.4. Detección precoz del cáncer de mama. La vigilancia del cáncer de mama utiliza tres métodos estándar: autoexamen, examen clínico y mamografía. En la población general, la evidencia sobre el valor del autoexamen es limitado. Hay poca evidencia prospectiva sobre el autoexamen en portadoras de una mutación de alto riesgo en los genes BRCA1 o BRCA2. Se ha indicado que las mujeres con parientes en primer grado con cáncer de mama tienen mayor grado de competencia en su autoexamen que aquellas sin parientes con cáncer. Tampoco existe evidencia sobre el examen clínico de la mama en portadoras de mutaciones. Se ha recomendado que las portadoras de mutaciones se hagan un examen clínico anual o cada seis meses a partir de los 25-35 años.(5) No existen datos sobre los beneficios o los riesgos relativos de la mamografía de screening en las portadoras de mutaciones en los genes BRCA1 y BRCA2. Se ha recomendado para estas mujeres una mamografía anual a partir de los 25-35 años.(5) 8 Objetivos 3. OBJETIVOS a) Describir las ventajas y limitaciones del análisis genético de los genes BRCA1 y BRCA2 en los cánceres de mama y ovario y determinar su relevancia clínica. b) Indicar las limitaciones e implicaciones psicosociales relacionadas con el análisis genético. c) Contextualizar la realización de estos tests genéticos en Galicia. 9 Resultados 4. MÉTODO 4.1. Búsqueda bibliográfica. Se buscó la existencia de informes de evaluación o revisiones en el Centre for Review and Dissemination, de la Universidad de York, que incluye las bases de datos DARE (Database of Abstracts of Reviews of Effectiveness), NHS EED (National Health Service Economic Evaluation Database) y HTA (Health Technology Assessment). La secuencia de búsqueda fue: a) “BRCA*“ b) “Genetic testing” También se buscó en la Librería Cochrane, con la misma secuencia de búsqueda. La base de datos de tesis doctorales realizadas en España (TESEO) también fue consultada. Se encontraron dos informes de evaluación, uno realizado por la Canadian Coordinating Office for Health Technology Assessment titulado “Predictive Genetic Testing for Breast and Prostate Cancer” y otro realizado por el Departamento de Salud del Estado de Nueva York titulado “Genetic susceptibility to breast and ovarian cancer: assessment, counseling and testing guidelines”. Este último se localizó utilizando el motor de búsqueda Google. Ambos informes fueron publicados en 1999 (6), (7). También se localizó otro informe en la página web del Instituto Nacional del Cáncer de Estados Unidos titulado “Genetics of Breast and Ovarian Cancer”, actualizado en Junio de 2002 (8). Se buscaron en la base de datos Medline artículos realizados en España sobre el análisis genético de los genes BRCA1 y BRCA2, con la estrategia BRCA* AND Spain. 11 avalia-t También se localizó información a través de búsqueda manual en las revistas Cancer Epidemiology, Biomarkers & Prevention y The Breast, que se encuentran en la biblioteca del Servicio Galego de Saúde. Se consultó con una experto de la Unidad de Medicina Molecular, perteneciente al Instituto Gallego de Oftalmología sobre los diversos aspectos del test genético. 12 Resultados Resultados. 5.1. Resultados de la búsqueda. Se localizaron tres informes de evaluación realizados en Canadá y Estados Unidos. Hay también diversos trabajos publicados en España por grupos de investigación de diferentes autonomías. La mayoría de los artículos han sido publicados recientemente. Se encontraron tres tesis doctorales realizadas en nuestro país, aunque las características recogidas en la base TESEO no permitieron tener en cuenta sus resultados debido a la poca información proporcionada. Los informes trataban de un modo bastante amplio aspectos éticos y legales, mientras que los artículos abordaban en profundidad temas de investigación molecular. 5.2. BRCA1 y BRCA2. Los genes BRCA1 y BRCA2 están mutados en un rango de 1-6 personas de cada mil e indican un riesgo de desarrollar cáncer de mama mayor del 80% a lo largo de la vida, con un riesgo del 40% antes de los 50 años. Se ha estimado que una de cada 150 mujeres porta una predisposición al cáncer de mama hereditario.(7) Se ha indicado que, de las familias que tienen cáncer de mama heredado, en el 52% es debido al gen BRCA1, en el 32% al BRCA2 y el 16% no se atribuye a ninguno de estos genes. La mayoría de los cánceres de mama y ovario familiares se atribuyen al gen BRCA1 (81%) y el resto (14%) al BRCA2.(7) También se ha indicado un mayor riesgo de desarrollar cáncer de mama secundario ipsilateral o contralateral en las mujeres con mutaciones en alguno de los dos genes (9). Aproximadamente 1 de cada 500 mujeres porta una mutación en el gen BRCA1. A los 70 años, estas mujeres tienen un riesgo del 56-87% de desarrollar cáncer de mama y del 16-44% de posibilidades de desarrollar cáncer de ovario (8). La alteración en el gen BRCA1 provoca la producción de una proteína no funcional que conduce a una desregulación de la proliferación celular. Se ha observado que las mutaciones en este gen aparecen en toda su longitud. Diversas poblaciones tienen un espectro mutacional más o 13 avalia-t menos característico, por ejemplo suecos, holandeses o judíos askenazíes (10). El gen BRCA2 está asociado con cáncer de mama y de ovario, además de con el cáncer de mama en varones. Se ha estimado que el riesgo acumulado a lo largo de la vida es del 60% a los 50 años y del 80% a los 70 años, mientras que para los hombres es del 6,3% a los 70 años. Se ha indicado que la edad media de diagnóstico de cáncer de mama en mujeres de familias predispuestas con mutaciones en el gen BRCA1 o en el BRCA2 es de 40 años (11). 5.2.1. Estudios realizados en España. Se han realizado algunos estudios en familias españolas para determinar las mutaciones en los genes BRCA1 y BRCA2. De la Hoya y colaboradores, en un análisis de 102 familias detectaron mutaciones en el 30% de las personas analizadas (12). La prevalencia de las mutaciones en el gen BRCA1 era tres veces mayor a la de las mutaciones en el gen BRCA2. La prevalencia de mutaciones observada es similar a la encontrada en otras poblaciones. También indican que el 54% de las familias con mutaciones en el gen BRCA2 incluían casos de cáncer de ovario y que cuando no hay casos presentes de cáncer de mama en varones se debería analizar en primer lugar el gen BRCA1, independientemente de si estas son familias de cáncer de mama o de ovario/mama. Por el contrario, si en la familia hay varones con cáncer de mama, el gen BRCA2 debería ser el primero en analizarse. Un estudio analizó las mutaciones en el gen BRCA1 en 87 familias clasificadas como de alto riesgo o riesgo moderado (13). De riesgo elevado eran aquellas familias con tres o más miembros afectados con cáncer de mama y/o ovario con al menos un caso diagnosticado antes de los 50 años o al menos un varón con cáncer de mama. Las familias de riesgo moderado eran aquellas con dos mujeres afectadas con cáncer de mama y/o ovario con al menos una de ellas diagnosticada antes de los 50 años. Había 55 familias en el grupo de alto riesgo y 32 en el de riesgo moderado. Se analizó un caso índice de cada familia buscando mutaciones en las seis regiones del gen BRCA1 que tienen mutaciones con más frecuencia. Sólo se encontraron mutaciones en 4 de las 87 familias, tres en las familias de alto riesgo y una en las de riesgo moderado. Concluyen que el espectro mutacional está influido por variaciones étnicas y geográficas en las poblaciones estudiadas. Apuntan que se 14 Resultados debe excluir el análisis de estas seis mutaciones para el primer screening de familias de riesgo. Otro trabajo analizó las mutaciones en el gen BRCA1 en 83 familias (14). El análisis se realizó con SSCP y test de truncamiento de proteínas. Se identificaron 5 mutaciones de truncamiento y 3 mutaciones sin sentido. También observaron 10 polimorfismos y variantes extrañas. Los autores indican que los resultados observados resaltan la influencia del origen étnico y geográfico de la población estudiada e indican que el desarrollo de estrategias de screening basadas en un número limitado de mutaciones no es posible en España. Detectaron 2 mutaciones que no habían sido descritas con anterioridad. La frecuencia de mutaciones encontrada fue menor que en otras investigaciones. Un estudio realizado en 30 pacientes gallegas procedentes de familias de alto riesgo encontró 8 mutaciones, todas ellas localizadas en el gen BRCA1. Cuatro de ellas fueron idénticas y encontraron una mutación que no había sido descrita anteriormente. Los autores indican que el patrón de mutaciones en Galicia podría ser diferente al de otras regiones españolas (4). 5.3. Métodos de detección y capacidad predictiva. Desde el momento de obtención de la sangre, la realización de un análisis genético completo puede llevar desde tres meses a dos años dependiendo de la naturaleza y del número de genes que se van a examinar. Se puede reducir el tiempo necesario si es posible identificar, con cierta probabilidad de acierto, qué gen (entre más de un gen candidato) es más probable que tenga una mutación basándonos en la historia familiar. Por ejemplo, una familia que tiene muchos casos de cáncer de mama y ovario con ausencia de cáncer de mama en varones nos haría sospechar de una mutación en el gen BRCA1 más que en el BRCA2. Si hay casos de ambos sexos con muchos miembros afectados, el gen BRCA2 puede estar implicado. También pueden surgir problemas si una familia tiene un gran número de individuos con cáncer de mama sin otro tipo de cánceres, en cuyo caso ambos genes deben ser examinados. 5.3.1. Detección de las mutaciones. Se ha descrito un menor número de mutaciones en el gen BRCA2 comparado con el BRCA1 (aproximadamente 450 frente a 600). Este gen 15 avalia-t fue clonado más tarde que el BRCA1, es mayor y es más difícil de analizar. Como en el BRCA1, la mayoría de las mutaciones encontradas hasta la fecha en el gen BRCA2 consisten en deleciones, inserciones o mutaciones sin sentido que conducen a un truncamiento prematuro en la transcripción de la proteína (15). La detección de las mutaciones es complicada por diversos motivos. Uno de ellos es el gran tamaño de estos genes. El análisis de secuencia limitado a los exones y a las regiones intrónicas adyacentes implica la determinación de la secuencia de unos 5.000 pares de bases para el BRCA1 y de 10.000 para el BRCA2. Incluso con este esfuerzo técnico, las mutaciones en las regiones intrónicas y las deleciones totales del gen no son detectadas. Con otros métodos de detección hay una sensibilidad más baja cuando se compara con la secuenciación. La secuenciación es cara para ambos genes. Una vez que se detecta una mutación en una familia, es razonable analizar a los parientes en busca de esta mutación, lo que es un proceso más simple y barato. Otra complicación es la interpretación de una alteración en el gen, una vez que se ha encontrado. Algunas alteraciones que cambian la secuencia de aminoácidos del producto son, sin embargo, polimorfismos inocuos, es decir, que no se traducen en un efecto clínico. Hay también mutaciones en otros genes que confieren un mayor riesgo de cáncer de mama y de ovario (genes asociados con el síndrome de Li Fraumeni, ataxia-telangiectasia, etc). El análisis innecesario de estos dos grandes genes es costoso en términos de recursos humanos y económicos, por tanto, la historia familiar debe ser bien analizada para determinar cual es el gen con más probabilidades de tener una mutación. Sin embargo, no hay certeza de que el test genético vaya a identificar una mutación específica en alguno de los genes, incluso con una historia muy característica de cáncer de mama. Hay disponibles tres tipos diferentes de análisis molecular del DNA: análisis indirecto del DNA, detección directa de las mutaciones y ensayos funcionales basados en el RNA. El tipo de test utilizado puede afectar a los resultados porque tienen diferente sensibilidad y especificidad, requieren mayor o menor cooperación de la familia y más o menos tiempo y dinero. La secuenciación directa es la técnica disponible más sensible y específica. Actualmente, la secuenciación a gran escala de fragmentos grandes de DNA es laboriosa y costosa. El análisis de heterodúplex o el de polimorfismos conformacionales de cadena única (SSCP) puede reducir el número de muestras necesario para la secuenciación, pero la sensibilidad 16 Resultados de estos ensayos es variable. Los ensayos como la hibridación de oligonucleótidos alelo-específica o el test de truncamiento de proteínas tienen la limitación de detectar sólo tipos específicos de mutaciones. El análisis de truncamiento de proteínas es más rápido y menos costoso que la secuenciación del gen completo. Sin embargo, para los genes BRCA1 y BRCA2 este método sólo es capaz de identificar el 70-90% de las mutaciones, por lo que un individuo puede tener un mayor riesgo de desarrollar el cáncer incluso si el test es negativo. También puede ocurrir que el cáncer familiar se deba a otros genes no descubiertos o analizados. Las mutaciones detectadas por este método tienen una inmediata relevancia clínica (6). 5.4. Medida del riesgo. La medida del riesgo debería comenzar estimando la probabilidad de desarrollar cáncer de mama u ovario a través de una historia personal y familiar completa. La historia familiar debería incluir a todos los pacientes en primer grado (padres, hijos y hermanos) y en segundo grado (abuelos, nietos, tíos y tías, hermanastros, sobrinos y sobrinas) y cubrir al menos tres generaciones. Debería incluir todos los tipos de cáncer y la edad aproximada al diagnóstico de cada uno de los pacientes afectados. Donde sea posible se recomienda la documentación a través de la historia clínica e incluso de la autopsia. Es esencial que tanto la rama materna como paterna de la familia sean investigadas, ya que el riesgo de cáncer puede transmitirse a través del padre o de la madre. La probabilidad de tener una mutación en un gen de susceptibilidad (BRCA1 o BRCA2) debería ser comprobada según el número de miembros de la familia con cáncer de mama u ovario, el grado de parentesco con el paciente, la edad al diagnóstico y otros factores como por ejemplo la pertenencia de la paciente a un grupo étnico de riesgo o si ha habido otros cánceres relacionados en la familia. Hay un riesgo elevado de encontrar una mutación en uno de estos genes si: - Hay tres o más parientes en primer o segundo grado afectados en la misma rama de la familia, independientemente de la edad al diagnóstico. - Hay menos de tres parientes afectados, pero se cumple alguna de las siguientes condiciones: 17 avalia-t o El paciente fue diagnosticado a los 45 años o menos. o Un miembro de la familia tiene una mutación. o Hay uno o más cánceres de ovario a cualquier edad. o Hay un cáncer de mama en un varón. o El paciente pertenece a un grupo de riesgo específico (étnico). o Cánceres múltiples o bilaterales en un individuo. o Personas de las que se sospecha que tengan un síndrome o desorden genético asociado a un gen implicado en el cáncer de mama. 5.5. Consejo genético. El consejo genético es el proceso de comunicación por el cual a los individuos y sus familiares se les da información sobre la naturaleza, riesgo de recurrencia, riesgos y beneficios del test y su significado, así como consejo y apoyo sobre las implicaciones de dicha información genética. Como indica la definición anterior, los tests de susceptibilidad genética proporcionan un tipo muy concreto de información, ya que sus resultados tienen implicaciones para las familias y, por tanto, difieren de otras pruebas médicas. Los resultados del test genético para el cáncer de mama y ovario son probabilísticos y no indican que los portadores de una alteración tengan obligatoriamente que desarrollar la enfermedad. Es por ello muy importante proporcionar una adecuada educación pretest y postest, así como un correcto consejo genético además de un seguimiento en el tiempo. Proceso de decisión informada: El término “decisión informada”, además del consentimiento informado, se usa para subrayar que el médico ofrece la posibilidad del análisis, más que recomendarlo. Al decidir la realización del análisis genético, los pacientes pueden saber si el riesgo estimado, basado en su historia familiar, puede aumentar o disminuir como resultado del test. También debe quedar claro que el paciente podría no recibir ninguna información útil de los resultados del test (7). 18 Resultados Cuando se identifica un riesgo elevado para una susceptibilidad heredada a través de una historia individual o familiar, el clínico debería iniciar la discusión o dar al paciente la información concerniente al test genético y sus potenciales beneficios y riesgos. El clínico que opte por esta posibilidad debe proporcionar la profundidad de contenidos y el tiempo necesario para que cada paciente pueda tomar una decisión informada. Antes del test, los adultos a los que se les haya informado sobre un mayor riesgo deben tener un proceso de educación (educación pretest) para que puedan tomar una decisión informada, esto es, decidir por sí mismos si los potenciales beneficios del test sobrepasan los riesgos. Los elementos de la educación pretest incluyen información relativa a : - Estado del paciente con un riesgo elevado. - Posibles resultados del test (positivos, negativos o inciertos). - Existencia de datos limitados sobre la eficacia de los métodos de detección y prevención temprana. - Posible impacto psicológico y social del test. - Alternativas al test genético. Las principales razones señaladas por los pacientes y sus familiares para hacerse un test genético para un cáncer hereditario son: obtener certeza, realizar acciones preventivas y estimar el riesgo de su descendencia. 5.5.1. Consejo pretest. Previamente al análisis genético es necesario documentar adecuadamente la historia familiar de cáncer. Esta información debería comprender: la edad de aparición del cáncer, el modelo de los diversos cánceres primarios (bilateralidad), extensión de esta información a los parientes en primer y segundo grado cuando sea posible y exposición a agentes carcinogénicos. Como los síndromes de cáncer hereditario se pueden transmitir a través de los varones de la familia, la historia debe incluir la línea paterna. Toda esta información es utilizada para crear un árbol familiar o pedigrí. A la vista del pedigrí, el genetista puede saber si la historia familiar es indicativa de la presencia de una alteración genética y 19 avalia-t explicar los beneficios, riesgos y limitaciones de la capacidad predictiva del test. Para el cáncer de mama, las familias de alto riesgo son aquellas con cáncer de mama a lo largo de tres generaciones, con diagnóstico anterior a los 50 años. En las familias en las que hay menos casos de cáncer de mama, el diagnóstico después de la menopausia y la no incidencia de cáncer de ovario se clasifica como riesgo moderado. En ocasiones el estudio de las familias se confunde por la ocurrencia esporádica frecuente del cáncer de mama en miembros de la familia que no son portadores de una mutación específica. Es probable que en estos casos los tumores ocurran más tarde y que sean unilaterales. Las participantes en el test genético tienen ciertos conocimientos sobre su riesgo de cáncer. Se puede evitar mucho miedo y ansiedad si se presenta la información de modo adecuado a la comprensión del paciente a través de explicaciones sencillas de la terminología médica. El ofrecer la posibilidad del análisis genético implica la responsabilidad de una adecuada educación pretest, el proceso de decisión informada y un adecuado consejo post-test. Antes de analizar a un miembro de la familia no afectado, debería ser analizado un miembro afectado si es posible. Si no se encuentra un resultado positivo en el pariente afectado, un resultado negativo en el pariente no afectado podría estar falsamente redirigiendo el riesgo del paciente. La educación pretest incluye los siguientes puntos: - El test de susceptibilidad genética al cáncer no detecta el cáncer en sí mismo, sino sólo un riesgo más elevado de desarrollar cáncer. - Un resultado positivo no significa que el cáncer se vaya a producir, pero por ejemplo una mujer con una mutación en BRCA1 tiene una probabilidad del 71-87% de desarrollar cáncer de mama a los 70 años y de cáncer de ovario del 42-63%. - Un resultado positivo no garantiza una mejora de la prevención, detección, tratamiento o supervivencia. - Un test negativo no significa que el cáncer no se vaya a desarrollar. El test negativo puede ser concluyente o no concluyente. 20 Resultados - Un test negativo no elimina la posibilidad de que en el gen analizado exista una mutación ya que el test no tiene una sensibilidad perfecta. - Independientemente de las medidas de detección tempranas (mamografía), el test genético en un gen determinado sólo tiene que hacerse una vez (a menos que la tecnología mejore). 5.5.2. Test genético. - Si el paciente no ha tenido cáncer de mama u ovario, si fuese posible debería ser analizado previamente un familiar cercano que lo haya tenido. Si no hay un paciente vivo, puede analizarse un tejido conservado del paciente fallecido, aunque surge aquí el problema sobre quien da el consentimiento. Un resultado negativo en ese paciente es más informativo cuando se ha identificado con anterioridad una mutación familiar. - Siguiendo la educación pretest, se le debería dar al paciente el tiempo suficiente para evaluar esta información antes de decidir acerca de la realización del test. Se recomiendan por tanto visitas separadas para la educación pretest y para los resultados del test. Comunicación de los resultados. Hay 4 tipos de resultados: resultado positivo (mutación maligna), se detecta una mutación causante de cáncer en la familia. Resultado negativo concluyente, en el paciente no existe la mutación que se ha encontrado previamente en la familia. Resultado negativo no concluyente, no se ha detectado la mutación en los familiares. Resultado no concluyente, se detecta una mutación de significación incierta (por ejemplo una mutación sin sentido). Mutación maligna. Su detección requiere: soporte psicológico, consideración de estrategias para la detección temprana o la prevención y ofrecer a los parientes la posibilidad de realizar el test. Alteración de significación incierta. En este caso es importante determinar si algunos o todos los miembros de la familia con cáncer de mama u ovario comparten esta mutación. Si es así, probablemente la mutación presente una alteración maligna. Si no, el riesgo necesita ser reconsiderado. 21 avalia-t No se detecta alteración. Si a un pariente se le ha detectado una mutación maligna y al paciente analizado no, se le puede decir que aparentemente no tiene la causa de un riesgo familiar más elevado y que su riesgo es probablemente similar al de la población general. Si ningún pariente afectado ha sido analizado sólo se le podría reestadificar parcialmente ya que puede tener una mutación en una región del gen no analizada o en otro gen. 5.5.3 Consejo postest. - Al individuo al que se le haya encontrado una mutación maligna debe proporcionársele: a) una completa explicación e interpretación del resultado del test basado en el conocimiento científico del momento, b) soporte psicológico, c) alternativas dirigidas a una detección temprana y/o prevención y, d) información respecto al análisis de parientes cercanos adultos. - En el caso de que los resultados del test indiquen una alteración de significación desconocida, es fundamental analizar a otros miembros de la familia con y sin cáncer de mama u ovario para medir la significación de esa alteración, así como buscar la mutación en bases de datos (como el BIC Breast Cancer Information Core para http://www.nhgri.nih.gov/Intramural_research/Lab_transfer/Bic) conocer si dicha mutación ha sido descrita y se conoce su patogenia. - Si el test indica que el paciente no tiene la mutación que ha sido identificada en un pariente, el individuo debe ser avisado de que aún tiene el riesgo de cáncer de mama u ovario de la población general, y de que las medidas habituales de seguimiento deben continuar (resultado negativo concluyente). - Si ningún miembro de la familia ha sido analizado y no se ha detectado mutación en la persona en riesgo, el individuo analizado debe ser advertido de que su riesgo no se ha eliminado y de que debería mantener un seguimiento más intenso (resultado negativo no concluyente). El medio más adecuado para comunicar los resultados del test es personalmente. Es importante dejar un tiempo para reflexionar y procesar la información proporcionada. En el caso de que se obtenga un resultado positivo, las estrategias recomendadas para la detección temprana son el examen clínico de la mama y el screening de la mama por mamografía. El principal problema 22 Resultados que encuentran tanto los médicos como los pacientes es acerca de la intervención que puede ofrecerse para evitar la aparición de la enfermedad. Los beneficios pueden originarse tanto si el test revela una mutación como si no. En caso de detectarse una mutación, los beneficios pueden ser: - Reducción de la incerteza y de la “ansiedad de no saber”. - El potencial de reducir la mortalidad y la morbilidad debido a una intensificación del seguimiento o a medidas quimiopreventivas como quimioprofilaxis o cirugía profiláctica. - Oportunidad de avisar a los pacientes de sus riesgos potenciales y de los servicios disponibles. - También se ha indicado que podría ser una ventaja la posibilidad de participar en ensayos clínicos y en investigaciones relacionadas. Si no se detecta mutación, en caso de que a un pariente sí se le haya detectado, los beneficios pueden ser: - Variación del riesgo y reducción de la ansiedad. - Evitar estrategias profilácticas. de monitorización intensiva y medidas Las posibles consecuencias en caso de detectarse una mutación son: - Ansiedad. - Depresión. - Reducción de la autoestima. - Frustración causada por la efectividad no probada de las intervenciones disponibles. 23 avalia-t - Riesgos y costes del seguimiento intensivo o profilaxis. - Alteración de las relaciones con la pareja o los parientes. - Culpabilidad por la posible transmisión a los hijos. - Estigmatización. - Posible discriminación por parte de compañías de seguros o empresas. - Incluso puede aparecer el riesgo de que las mujeres jóvenes a las que se les encuentre una mutación limiten sus propias aspiraciones en la vida debido a su creencia de sucumbir a un cáncer. - La ansiedad excesiva sobre el desarrollo de cáncer de mama puede reducir la adherencia a las recomendaciones del seguimiento y reducir la calidad de vida. Las posibles consecuencias en caso de no detectar una mutación son: - Posibilidad de un seguimiento descuidado debido a la falsa creencia de que no hay riesgo en ausencia de mutación. - “Culpa del superviviente”, sentimiento de culpabilidad si hay otros miembros de la familia con la mutación y sufren por ello. Los riesgos de un resultado incierto son: - Cuando el resultado es negativo y no concluyente, existe la necesidad de evaluar a otros familiares para determinar la significación de la mutación encontrada. Casi el 30% de las mutaciones encontradas en la secuenciación del DNA son mutaciones sin sentido de significación desconocida. Hasta que la significación sea determinada, el paciente puede experimentar ansiedad o frustración, pero puede continuar la terapia intensiva 24 Resultados - Necesidad de aumentar el seguimiento hasta que se conozca la significación de la mutación genética. - Ansiedad y frustración asociadas con la incerteza. A causa de la complejidad del proceso de educación pretest, es improbable que muchos individuos puedan procesar la información y tomar la decisión de hacer o no el test en la misma visita. Por ello se recomienda que la decisión se tome en una visita o visitas sucesivas, pues debe darse tiempo para valorar la información. Aquellos a los que se les encuentre una mutación perjudicial necesitarán soporte psicológico adicional a través de varias vías, incluyendo la referencia a un psiquiatra o a una asociación de ayuda. Se debería iniciar la educación, el análisis y el consejo sobre el análisis genético a los parientes adultos en riesgo. El paciente debería ser ayudado en el proceso de informar a los parientes proporcionándole folletos y cartas manuscritas para miembros de su familia. Si el test ha resultado de significación incierta (se ha encontrado una mutación de la que no se conoce la patogenia) es importante que, dentro de lo posible, todos los miembros de la familia con cánceres relacionados sean considerados para realizarles el análisis genético. Este resultado no es raro si el análisis del DNA se realiza con la secuenciación del gen. De este modo, la significación de la alteración puede estimarse mejor. Cuando hay una mutación específica en la familia y el test del paciente es negativo, es esencial que el paciente sepa que aún tiene el riesgo de cáncer de mama u ovario de la población general. Si no hay mutación en la familia y el paciente es negativo, aún puede existir una predisposición hereditaria y se debe intensificar el seguimiento en base a la historia familiar y a sus factores de riesgo. El paciente debería continuar en el programa de seguimiento de familias de alto riesgo. 5.6. Coste El proceso del test genético conlleva un coste relativamente elevado. Además del propio coste del análisis de laboratorio, el tiempo empleado por los profesionales en el consejo genético también implica un gasto. Se 25 avalia-t ha indicado que, del coste total, la mayor parte se la lleva la secuenciación de los genes, con el 84% de los costes totales. El 16% restante es el coste del consejo pretest y postest. El coste total se ha estimado en 2057 dólares (una cantidad equivalente en Euros) (16). Expertos consultados han indicado un coste de unos 3000 euros para la detección de mutaciones en ambos genes por el método de secuenciación completa (el más sensible y específico). 5.7. Alternativas al análisis genético. Muchas pacientes con riesgo de cáncer de mama u ovario elevado optarán por no realizarse el test genético. Hay otras alternativas, como un seguimiento intensivo, participación en investigación clínica y uso de medicamentos. Algunos expertos recomiendan que las mujeres con un pariente en primer grado con cáncer de mama o parientes con esta enfermedad comiencen con mamografía anual a una edad 10 años antes que la de aparición del cáncer en la familia. Sin embargo, a pesar de que esta proposición pueda parecer razonable no hay datos que la sustenten. Estos métodos podrían permitir al paciente evitar algunas de las potenciales cargas psicosociales asociadas con el test genético. Otras alternativas podrían incluir retrasar el test o almacenar muestras de DNA para que se beneficien los descendientes. Alternativas a la detección de la mutación. Pueden ser: a) no realizar el test y adoptar medidas de seguimiento intensivo como aquellas que se tomarían si hubiese mutación, b) retrasar el test a una fecha posterior y, c) preparar y almacenar muestras del paciente y de sus parientes para posibles tests futuros si hay interés de los descendientes u otros parientes. Como se ha dicho, la detección de una mutación en los genes BRCA1 o BRCA2 no significa que el individuo vaya a desarrollar cáncer. Tampoco significa que, si aparece el cáncer, será detectado o tratado de un modo más efectivo. Aunque se pueda argumentar que la detección de la mutación motivará un seguimiento consciente, este seguimiento también se puede realizar sin el test genético. Opciones convencionales de screening. Con el examen clínico de la mama, la detección de una masa de menos de 1cm puede ser difícil. Es importante que la persona que realiza el examen clínico de la mama tenga experiencia. Los profesionales que 26 Resultados realizan el examen clínico con frecuencia tienen el mejor entrenamiento para detectar las alteraciones. 5.8. Otros aspectos. Los avances en el campo de la investigación genética han provocado la necesidad de tratar los aspectos relativos a la confidencialidad, privacidad y derechos de propiedad sobre las cuestiones referentes al material genético. Estos aspectos serían objeto de otro informe. Los principios de un adecuado consejo genético serían: privacidad y confidencialidad, justicia, autonomía (respeto a las personas) y beneficencia/no maleficencia. Los resultados de las pruebas deben ser confidenciales. No se debe poner a la persona en riesgo de discriminación laboral ó a la hora de contratar un seguro de enfermedad o de vida. 27 Discusión 6. DISCUSIÓN. 6.1. Discusión de la búsqueda. Los tres informes encontrados (uno canadiense y dos estadounidenses) (7),(6),(8) eran muy completos, ya que tocaban todos los aspectos referentes al análisis de los genes BRCA1 y BRCA2, tanto en la influencia de los resultados en el desarrollo del cáncer como en el estado psicológico de los sujetos y en la relación con sus familiares. No se consideró por tanto necesario ampliar la búsqueda en otras bases de datos automatizadas. Se decidió realizar una búsqueda restringida a trabajos realizados en España para conocer el estado de la detección de estas mutaciones en nuestro país y averiguar la posible existencia de un patrón diferencial de mutaciones en ambos genes respecto a otras localizaciones geográficas. 6.2 Discusión de los resultados. Las limitaciones inherentes de los resultados del test genético para predecir el desarrollo de la enfermedad se ven complicadas por aspectos médicos y éticos que afectan a la información relacionada con los pacientes en riesgo. Como con la mayoría de las condiciones médicas, las condiciones genéticas rara vez son homogéneas en términos de manifestación de la enfermedad entre los individuos afectados. Algunas condiciones genéticas, como el cáncer de mama o de ovario hereditarios se atribuyen no sólo a uno, sino a varios genes, cuya combinación tiene el potencial de producir resultados clínicos más complejos. Incluso el portador de un gen mutado que le predisponga a desarrollar la enfermedad en una familia de riesgo puede estar relativamente protegido por elementos dietéticos o farmacológicos. Por eso, antes de que los hallazgos en familias de alto riesgo puedan ser extrapolados a la población general, se deben realizar estudios epidemiológicos que analicen la interacción gen-ambiente. La identificación de una mutación en los genes BRCA1 o BRCA2 sería beneficiosa en el sentido de que animaría a los portadores y a los miembros en riesgo de la familia a adoptar medidas para mejorar las estrategias de seguimiento, tomar decisiones informadas sobre su reproducción o adoptar medidas profilácticas. Sin embargo, la penetrancia incompleta de estos genes limita el análisis y la interpretación 29 avalia-t de los resultados. La eficacia incompleta de la mamografía, del examen clínico, de la cirugía profiláctica o de la terapia génica experimental limitan los beneficios en los sujetos portadores de mutaciones. El profesional de la salud que ofrece el test de DNA para la susceptibilidad a los cánceres de mama y ovario debe asegurarse que el paciente participa en un proceso multietápico, incluyendo una estimación del riesgo, educación pre-test y consejo post-test. Desafortunadamente, los datos científicos que se necesitan en cada punto del proceso de la toma de decisión no son completos y los métodos actuales para la detección temprana y su tratamiento no son perfectos. No se conocen los riesgos de cáncer para cada edad ni para cada una de los cientos de mutaciones detectadas en los genes BRCA1 y BRCA2. No hay datos sobre el éxito y los riesgos asociados con la prevención individual. Sin esta información no se pueden realizar cálculos exactos del riesgo ni se pueden predecir resultados concretos. A pesar de estas graves limitaciones, es necesario establecer recomendaciones o criterios para evitar el uso inapropiado de los tests genéticos y para prevenir ansiedades y costes innecesarios para los pacientes, sus familias y los servicios de salud. Los individuos que no tienen un riesgo más elevado de heredar una mutación en los genes BRCA1 y BRCA2 deben ser informados de que su riesgo es comparable al de la población general. Sólo se debería considerar el test cuando existe un riesgo significativamente elevado, a menos que la ansiedad del paciente u otros aspectos indiquen la necesidad de una discusión más profunda. La medida del riesgo de un paciente que podría tener una mutación es muy compleja. Muchos pacientes, cuando se les pregunta por la historia familiar de cáncer, tendrán un pariente con un diagnóstico de cáncer de mama tardío. Estos individuos no caen en una categoría de riesgo y debería indicárseles que su riesgo es el de la población general. Otro problema es la detección de una mutación que no ha sido descrita anteriormente y cuya significación clínica se desconoce. Actualmente se está trabajando para determinar el riesgo asociado a cada una de las mutaciones encontradas en ambos genes (17). El médico utilizará la historia personal y familiar para delimitar el riesgo y averiguar si el paciente tiene un riesgo más elevado. Aquellos que tienen un riesgo más elevado no forman una categoría clara y definida, sino que más bien se sitúan al final de una distribución continua, de modo que puede ser difícil establecer el punto de corte para poner el umbral de riesgo. Algunos sujetos pueden situarse claramente en el nivel de riesgo elevado y otros pueden tener sólo un riesgo ligeramente más elevado que el de la población general. Por ejemplo, una mujer con dos parientes con 30 Discusión cáncer de mama a los 50-60 años en el mismo lado de la familia o una mujer que, por casualidad, tenga pocos parientes femeninos y una de ellas tiene cáncer de mama. En estos casos una medida del riesgo más intensiva, un consejo apropiado y una enumeración completa de los beneficios y riesgos del test será de gran ayuda. Dados los riesgos asociados y sus complicaciones, el test genético no está indicado cuando el paciente no reúne las características que le harían tener un riesgo más elevado. Tampoco, excepto circunstancias excepcionales, se recomienda que los menores de 18 años sean analizados, ya que no hay intervenciones recomendadas para menores de esa edad. Se debería animar a todos los individuos que tengan un riesgo más elevado, elijan realizarse el test genético o no, a participar en las investigaciones clínicas. Este seguimiento permitiría profundizar en el conocimiento de la enfermedad, la historia natural asociada con estas mutaciones y la eficacia de las diversas intervenciones. Las secuelas psicológicas de los pacientes que elijan las diferentes opciones también deberían ser estudiadas. Debe indicársele al paciente que considere cómo puede cambiar su comportamiento en función de los resultados del test. En estos casos y en otros, la interacción entre los profesionales de genética y primaria puede ser muy importante. 6.2.1. Análisis genético. Hay diversos tipos de análisis para la detección de mutaciones en los genes BRCA1 y BRCA2. Los diversos estudios coinciden en que el análisis genético es costoso y laborioso en función de la técnica utilizada. La secuenciación completa del gen es el método más largo y costoso, pero también el que permite detectar si realmente existe una mutación. Hay otras alternativas consistentes en analizar aquellos fragmentos del gen (no se debe olvidar que ambos genes son muy grandes) que presentan mayor cantidad de mutaciones o aquellas mutaciones que aparecen con más frecuencia. Este tipo de análisis es más rápido y menos costoso, pero sólo es recomendable en aquellas poblaciones endogámicas con mutaciones características (por ejemplo judíos askenazíes). En los estudios realizados en España, unos realizan la secuenciación completa del gen(4), otros utilizan el test de truncamiento de proteínas(12, 14, 18) y otros secuenciación de regiones concretas del gen(13, 19). 31 avalia-t 6.3. Limitación de las intervenciones. Actualmente hay información limitada sobre la historia natural asociada con mutaciones en los genes BRCA1 y BRCA2 y sobre la efectividad de las medidas preventivas en caso de que la mutación exista. Por ello, el profesional debería evitar recomendar sistemáticamente el test genético y ofrecer información, educación y consejo para que el paciente valore los beneficios y riesgos del mismo. Un aspecto fundamental es que ninguna de las estrategias de detección temprana o prevención del cáncer de mama u ovario es claramente satisfactoria. La mamografía ha mostrado reducir la morbilidad y la mortalidad en mujeres mayores de 50 años. La mastectomía profiláctica y la ooferectomía no eliminan el riesgo por completo. Los beneficios de la quimioprevención en mujeres de alto riesgo son evidentes, pero aún no se sabe si la quimioprofilaxis es efectiva en portadoras de estas mutaciones. Los pacientes deben entender que las limitaciones del conocimiento actual son un prerrequisito que se debe considerar a la hora de tomar la decisión de hacer el test genético. Las pacientes que consideren realizarse un test genético deben saber que un resultado positivo no significa que el cáncer se vaya a desarrollar, pero tienen muchas más probabilidades, y que un resultado negativo no significa que el cáncer no vaya a ocurrir, sino que tienen el mismo riesgo que la población general. A aquellas en los que se detecte una mutación no se les garantiza una mejora en la detección, prevención, tratamiento o supervivencia. También puede ocurrir que en mujeres con alto riesgo de cáncer de mama u ovario no se detecte una mutación en ninguno de los genes. Sin embargo, en estos casos se debe sospechar de una predisposición genética debido a otro u otros genes y se debe realizar un seguimiento intensivo del paciente. 6.4. Implicaciones psicológicas del test. Las personas que tienen cáncer o los miembros de una familia con un número elevado de cánceres son los que más se beneficiarán del test genético. Por ejemplo, aquellos individuos con una mutación podrían entrar en un seguimiento más frecuente e intensivo, aumentando la probabilidad de detección temprana, tratamiento menos radical y, 32 Discusión finalmente, mejores resultados. Los individuos portadores de una mutación pueden optar por medidas preventivas como la ooferectomía o la mastectomía profiláctica. La quimioprevención con medicación como el tamoxifeno u otros agentes preventivos podrían ser ofrecidos a los pacientes una vez que su eficacia se haya establecido. Algunos pacientes podrían modificar su estilo de vida y tomar decisiones que afecten a su trabajo o a su reproducción en base a los resultados del test. También el test genético podría servir para clarificar el riesgo para los pacientes que creen tener un riesgo mayor del que realmente tienen, reduciendo así el estrés psicológico para ellos y sus familias. Por tanto, se debe ser muy cuidadoso a la hora de ofrecer la posibilidad de realización de un test genético. Así lo recomiendan el Consejo Nacional de Investigación del Genoma Humano (USA), la Sociedad Americana de Genética Humana, la Sociedad Americana de Oncología Clínica, el Comité de Genética del Colegio Americano de Obstetras y Ginecólogos y el Comité Asesor de la Oficina para la Investigación de la Salud de la Mujer del Instituto Nacional de la Salud de EEUU. También lo indica la Sociedad Europea de Genética Humana. Mientras que la mayoría de análisis en individuos sin cáncer se realiza después de que se identifica una mutación en un individuo afectado, las consecuencias para el miembro de la familia afectado pueden ser diferentes que para el pariente no afectado. Cuando el individuo afectado sabe que tiene una mutación, puede haber cierta preocupación de vivir con incerteza. También puede preguntarse ¿por qué yo?. El paciente puede entonces elegir un seguimiento adecuado a la vista de la posibilidad de recurrencia. Además, tiene la responsabilidad de conocer unos resultados que afectan a otros miembros de su familia y que quizá debería comunicarles. Las posibles respuestas psicológicas y los aspectos que se deben considerar cuando se detecta una mutación en un individuo no afectado (resultado positivo) incluyen la ansiedad generada por la confirmación de un riesgo más elevado y la necesidad de un mayor seguimiento, sentimiento de culpa por la posible transmisión de la mutación a la descendencia y cierta preocupación relacionada con los aspectos de privacidad y posible discriminación laboral. Además, el individuo debe reconocer y analizar el impacto de esta información en sus relaciones. Podría haber beneficios psicológicos asociados con la información de su riesgo y de la disponibilidad del test a los miembros de la familia (se comparte la ansiedad y la sensación de culpa), conduciendo a una mayor profundidad y mejora de las relaciones familiares. 33 avalia-t 6.5. Educación pretest y consejo genético. El médico debe trabajar con el paciente ayudándole a considerar los siguientes aspectos como parte del proceso de la toma de decisiones. Hay una serie de preguntas que se le deben indicar al paciente para que reflexione antes de realizarse el test genético, como por ejemplo: + ¿Quiero saber más sobre mi riesgo de desarrollar cáncer de mama u ovario? + Si es así, ¿como asimilaré que tengo (o no tengo) una mutación en el gen BRCA1 o BRCA2 que me puede afectar? + Si se detecta una mutación, ¿cómo me enfrentaré al hecho de tener mayor riesgo de desarrollar cáncer de mama u ovario? + ¿Cambiaré mi seguimiento de la enfermedad si sé que tengo una mutación en uno de estos genes? + ¿Consideraré la posibilidad de cirugía profiláctica sabiendo que la prevención total no es posible? + Si tengo una mutación, ¿cómo me sentiré al compartir esta información con el resto de los miembros de la familia que pueden estar en riesgo? + Si yo no tengo una mutación en los genes BRCA1 o BRCA2 y tampoco los miembros de mi familia, ¿cómo me sentiré al no tener más información de la que tenía antes? + ¿Qué significará para mí vivir con esta incertidumbre? + ¿Qué planes haré a la vista de los resultados positivos o negativos? + ¿Cómo me afectará el realizar el test? ¿Y a mi familia cercana?¿Y al resto de la familia? + ¿Quiero hacerme el test? ¿Ahora?, ¿Quizá en el futuro? Ya hay estudios que indican el impacto negativo del diagnóstico genético en las pacientes con cáncer. Esto incluye reacciones de preocupación y dificultades para transmitir sus resultados a sus parientes (20). 34 Discusión Como mucha gente cambia de opinión sobre la realización del test genético, es aconsejable un período de espera después de la educación pretest (antes de proporcionar la muestra). Muchas mujeres utilizan este tiempo para leer información que tengan sobre el análisis genético y discutir el asunto con sus familiares (21). 6.6. Medidas profilácticas en las portadoras de mutaciones. Se ha indicado que pueden existir varias estrategias en aquellas mujeres con una mutación en el gen BRCA1 o BRCA2 que les haga tener una mayor susceptibilidad a desarrollar cáncer de mama u ovario. Una de ellas es intensificar el seguimiento a través de una mayor frecuencia en la autoexploración, el examen clínico y en la mamografía. Otra posible alternativa, postulada sobre todo por autores norteamericanos, es la mastectomía y/o la salpingo-ooferectomía preventivas. La profilaxis quirúrgica entraña diversas dificultades. Puede haber efectos psicológicos en las pacientes ya que: a) pierden la función reproductiva y/o, b) alteran su imagen. La intervención quirúrgica tiene sus riesgos (complicaciones postoperatorias, infecciones...). En aquellas mujeres intervenidas no se garantiza que el cáncer de mama u ovario no se vaya a desarrollar, ya que siempre permanece algo de tejido en el que se puede desarrollar el cáncer. En Mayo de 2002 se publicaron dos artículos y un editorial en el New England Journal of Medicine (22, 23) apoyando la realización de ooferectomía y salpingo-ooferectomía profilácticas en aquellas mujeres que fuesen portadoras de una mutación en el gen BRCA1 o BRCA2. Durante un período de tres años se desarrolló cáncer de mama en 8 de 63 portadoras de mutaciones que habían decidido seguimiento clínico, frente a ninguna de las 76 portadoras que habían decidido someterse a cirugía profiláctica. En un estudio multicéntrico (24) con 551 mujeres portadoras de mutaciones en el gen BRCA1 o BRCA2. Se observó que, entre las 292 mujeres que decidieron realizar el seguimiento intensivo apareció cáncer de ovario en 58 de ellas, con un seguimiento medio de cerca de 9 años. En las 259 mujeres con ooferectomía bilateral se identificó un tumor de ovario en 6 mujeres. A pesar de algunos buenos resultados, la mastectomía profiláctica es controvertida por tres razones: la preocupación sobre los efectos personales de una cirugía tan drástica, el hecho de que el cáncer de mama no se desarrolle en todas las portadoras de estas mutaciones, y a que el cáncer de mama, detectado con seguimiento intensivo, puede ser 35 avalia-t tratado de un modo efectivo. Aunque el riesgo de cáncer de ovario en las portadoras de mutaciones es considerablemente más bajo que el riesgo de cáncer de mama, la ausencia de métodos adecuados de detección temprana y la letalidad del cáncer de ovario avanzado han impulsado a muchos oncólogos a recomendar la ooferectomía bilateral después de haber completado el período de maternidad. Aunque una mastectomía preventiva podría reducir el riesgo, no existe la certeza de que este procedimiento protege frente al cáncer de mama, al igual que la ooferectomía preventiva no evita por completo el desarrollo de cáncer de ovario y de mama. 6.7. Demanda esperada de análisis genético de los genes BRCA1 y BRCA2. Encuestas realizadas en individuos de familias con cánceres de mama y ovario mostraron que el 75-79% de los sujetos deseaban ser analizados y que alrededor del 16-20% desearían que se les analizase el gen BRCA1. Las mujeres eran las que más deseaban ser analizadas. Las mujeres estaban más dispuestas a aceptar el test genético para la susceptibilidad al cáncer de mama si eran examinadas regularmente por un médico, si creían que la mamografía detectaba de un modo efectivo el cáncer en su estado inicial y si creían que el cáncer en fases iniciales es curable (8). Se ha indicado que del 43 al 57% de los miembros de familias con cáncer de ovario/mama invitados a participar en programas de análisis genético ha mostrado su deseo de participar (21, 25). Una entrevista telefónica realizada en 1013 norteamericanos (26) indicó que a más de la mitad de los individuos les interesaba mucho someterse a una prueba genética que diese información sobre su riesgo de desarrollar algún tipo de enfermedad. Otro 25% declaró estar “algo interesado”. En caso de existir tratamiento para la enfermedad, el 56% se declaraba muy interesado y en caso de no existir tratamiento el porcentaje de muy interesados caía al 25%. Otro estudio en 353 mujeres americanas indicaba que aproximadamente dos tercios decidirían realizarse el análisis después de habérseles hecho el consejo genético (27). Se ha indicado que las personas más predispuestas a realizarse un análisis genético tienen más años de educación, trabajan a tiempo completo y perciben un riesgo elevado de padecer cáncer(21, 25). Otro estudio indicaba que las mujeres que deseaban hacerse el análisis genético tenían alrededor de 50 años, historia familiar de cáncer y un nivel educativo elevado (28). 36 Discusión Todos los datos anteriores, obtenidos en población americana podrían ser diferentes de las decisiones que tomaría la población gallega, que tiene una idiosincrasia diferente que puede hacer que sus conocimientos, actitudes y expectativas sean diferentes a los de otras poblaciones. Datos provisionales de la Dirección Xeral de Saúde Pública (2) indican que en Galicia se diagnostican unos 1.000-1.100 casos anuales de cáncer de mama. Como se ha indicado, del 5 al 10% de los casos son hereditarios, lo que indicaría que unos 50-110 casos serían susceptibles de portar una mutación en el gen BRCA1 o BRCA2. Se ha comentado anteriormente que no todos los sujetos a los que se les hace un consejo genético adecuado, de modo que les permita tomar una decisión informada y responsable sobre la realización del test, deciden realizarse el test genético. Las cifras se sitúan alrededor del 50%, lo que nos dejaría una horquilla de 25-55 personas. Sin embargo, si estas mujeres deciden realizarse el análisis, cabe la posibilidad de que informen de los resultados a sus parientes en primer grado consanguíneos, que de este modo deberían ser invitados a realizarse el test, lo que ampliaría el número de personas a analizar (hermanos, hijos y quizá madres). Algunas de estas personas también podrían no querer hacerse el test. Por hacer una estimación, quizá algo aventurada, y suponiendo correctas las anteriores suposiciones (basadas en datos de población americana), quizá alrededor de unas 150 personas podrían querer hacerse el test en Galicia (unos 450.000 euros-75 millones de pesetas). A esta cifra habría que añadir los costes de un seguimiento intensivo en las pacientes a las que se les haya detectado una mutación (mayor número de mamografías, exámenes clínicos y visitas al especialista). 6.8. Implicación para otros cánceres. El análisis genético que indique una predisposición a desarrollar un cáncer cada vez se emplea de un modo más amplio. En este período de transición, los profesionales de la salud de muchas disciplinas se verán forzados a integrar estas tecnologías actualmente en desarrollo y extender el conocimiento de las bases genéticas del cáncer a los pacientes a su cuidado. Muchos grupos profesionales creen que la disponibilidad del análisis de predisposición fuera de la investigación puede ser prematura. Muchos aspectos clínicos claves aún no han sido contestados, los clínicos aún no tienen la suficiente formación y las características de los tests no han sido suficientemente definidas (29). 37 avalia-t El test genético puede ser una importante herramienta terapéutica en los próximos años, sobre todo debido a su capacidad predictiva, que puede significar el inicio de estrategias preventivas más adecuadas. Aunque muy minoritarios respecto a los cánceres esporádicos, existen casos de predisposición congénita al desarrollo de ciertos cánceres. Existen dos causas: a) alteración en los genes de reparación del DNA o, b) mutaciones en oncogenes y/o genes supresores que aparecen en las células germinales, espermatozoides y óvulos y que son transmitidas de una generación a otra. El resultado de heredar una copia mutada de alguno de estos genes es la reducción del tiempo necesario para la aparición de un cáncer determinado y por ello implica un aumento en la probabilidad de padecerlo. La discusión acerca del efecto psicológico de su detección sobre los individuos y sus familias también podría aplicarse a estos cánceres, al igual que la discusión sobre la población diana susceptible de analizar y los beneficios que se pudieran obtener en base a la existencia de acciones preventivas efectivas. Se ha indicado por ejemplo que una mutación en el protooncogen RET predispone a desarrollar cáncer medular de tiroides, hiperparatiroidismo y/o feocromocitoma. La detección de esta mutación es suficiente para indicar al paciente una conducta preventiva. Algo parecido ocurre con las mutaciones detectadas en el gen APC, que predisponen a un mayor riesgo de desarrollar adenopoliposis colónica familiar, que si no se controla puede ocasionar cáncer de colon. 6.9. Contextualización. Se ha indicado que la baja frecuencia de mutaciones en mujeres españolas(30) en ambos genes con cáncer de mama antes de los 41 años pone en duda la idoneidad de la realización de un screening sistemático de DNA en este tipo de pacientes, considerando el coste en tiempo y dinero de los actuales métodos de laboratorio. Por el contrario, entre las mujeres diagnosticadas antes de los 41 años, un pariente en primer grado (o un varón con cáncer de mama en la familia) es un buen predictor de la existencia de una mutación en uno de los genes y estos pacientes podrían beneficiarse del test genético. El cáncer de mama en Galicia es el cáncer con mayor incidencia en mujeres. Alrededor del 10% de estos cánceres son hereditarios, siendo el resto esporádicos. El gran tamaño de los genes BRCA1 y BRCA2, unido al 38 Discusión hecho de que la aparición de mutaciones varía en función de las diferentes zonas geográficas, hacen que el análisis genético en busca de una mutación o mutaciones concretas sean complicadas en nuestra comunidad. Es necesario pues realizar estudios piloto (ya existe alguno) (4) que permitan establecer el perfil mutacional de esos genes en la población gallega, lo que permitiría hacer el análisis genético en un tiempo y a un coste razonables. 39 Conclusiones 5. CONCLUSIONES La mayoría de los cánceres de mama hereditarios pueden atribuirse a mutaciones en la línea germinal de los genes BRCA1 y BRCA2. El resto de los casos familiares se atribuyen a la sobreexpresión de oncogenes u otras aberraciones genéticas. Las mutaciones en el gen BRCA1 han mostrado tener una gran prevalencia en familias en las que hay presencia de cánceres de mama y ovario. El gen BRCA2 se ha asociado con un menor número de cánceres de ovario y muchos casos de cánceres de mama masculinos. Hay importantes aspectos éticos que surgen de la determinación de la susceptibilidad al cáncer de mama u ovario, por ejemplo: privacidad, confidencialidad, implicaciones familiares. Importantes factores psicosociales serían estigmatización, descenso de la autoestima y ansiedad, tanto en los portadores como en los no portadores de mutaciones. Como mucha gente cambia de opinión sobre la realización del test genético, es aconsejable un período de espera después de la educación pretest (antes de proporcionar la muestra). El médico no debe solicitar un análisis genético de ninguno de estos genes si antes no ha explicado al paciente todos los riesgos y limitaciones de los resultados del análisis. El médico debe haber realizado el árbol familiar de la paciente y haber identificado si reúne las características necesarias que indiquen una posible mutación en el gen BRCA1 o BRCA2. Es responsabilidad del médico solicitante comunicar personalmente al paciente los resultados del test y explicarle las alternativas e implicaciones existentes en función de los resultados obtenidos Se necesita un entrenamiento específico para los profesionales que van a proporcionar el consejo genético. Son necesarios más estudios para identificar y medir de un modo más exacto los factores genéticos de los cánceres de mama y ovario. Estos estudios deberían tener como objetivo el valor predictivo positivo, exactitud, reproducibilidad, sensibilidad y coste-utilidad del test genético comparado con las alternativas convencionales de análisis. 41 avalia-t Serán necesarias técnicas sencillas, rápidas y eficientes para reducir la carga diagnóstica, especialmente si hay una demanda para un test genético predictivo. Como una gran proporción de mutaciones en los genes BRCA1 y BRCA2 resultan en un truncamiento de la proteína, el test de truncamiento de proteínas es un método atractivo para identificar las mutaciones, aunque no se debe olvidar que la secuenciación del gen es el método más sensible y específico. 42 Recomendaciones 6. RECOMENDACIONES Actualmente las técnicas de biología molecular están experimentando un gran avance. En muy poco tiempo es previsible que se desarrollen métodos más rápidos y baratos de los que se emplean en la actualidad para la detección de mutaciones (como los chips de ADN). También se está trabajando en el desarrollo de programas informáticos como el BRCAPRO que permitan calcular el riesgo de desarrollar cáncer de mama u ovario hereditario en función del número de pacientes afectados y su grado de parentesco, así como otras características de los pacientes (31). Sin embargo, antes es necesario conocer el perfil mutacional en las diversas poblaciones y la implicación clínica de algunas alteraciones encontradas que se desconocen en la actualidad. Es importante que exista una buena relación médico-paciente y también buena relación entre los diversos especialistas, para que el acto del consejo genético (consejo pretest, postest y el consejo propiamente dicho) se dé en las mejores condiciones posibles. Sería interesante establecer qué profesionales deben dar el consejo genético sobre estos genes y quiénes pueden solicitar las pruebas genéticas. Es imprescindible que el test genético no se realice directamente en mujeres en riesgo sin haber antes realizado la detección de mutaciones en un pariente con cáncer de mama u ovario. Un protocolo viable sería que las unidades de mama de los hospitales fuesen las encargadas de detectar a las pacientes con alto riesgo y que a su vez el caso fuese remitido al comité de mama hospitalario (multidisciplinar), que decidiría la realización del test genético para cada caso clínico. Las unidades de mama se encargarían del seguimiento y consejo genético a los pacientes y recomendarían la participación de las pacientes de alto riesgo en ensayos clínicos. Una vez que la paciente en riesgo ha decidido hacerse el análisis genético sería importante que comunicase los resultados del test a sus familiares, para tranquilizarles o para que se hagan el análisis y puedan tomar las medidas oportunas. En Galicia, se podría hacer algún estudio piloto, implicando a diversos facultativos entrenados en consejo genético, para observar como responderían las pacientes y sus familias a la posibilidad de realización del test. 43 Bibliografía 7. BIBLIOGRAFÍA 1. IARC. GLOBOCAN 2000. Cancer incidence, mortality and prevalence worldwide, version 1.0. IARC Cancer base N 5. Lyon. IARCPress 2001. 2. Programa galego de detección precoz do cancro de mama (PGDPCM). Dirección Xeral de Saúde Pública. Consellería de Sanidade. Xunta de Galicia. 2000. 3. González P, Jiménez MT, López-Abente G, Pollán M, Ardanaz E, Viñes JJ. Tendencia temporal de la incidencia de cáncer de ovario en Navarra (1973-1995): efecto de la edad, cohorte de nacimiento y período de diagnóstico. Anales del sistema sanitario de Navarra 2001. 4. Vega A, Torres M, Martinez JI, Ruiz-Ponte C, Barros F, Carracedo A. Analysis of BRCA1 and BRCA2 in breast and breast/ovarian cancer families shows population substructure in the Iberian peninsula. Ann Hum Genet 2002. (66): 29-36. 5. Burke W, Daly M, et al. for the Cancer Genetics Studies Consortium. Recommendations for follow-up care of individuals with an inherited predisposition to cancer, II: BRCA1 and BRCA2. JAMA 1997. 277 (12): 9971003. 6. Noorani HZ, McGahan L. Predictive genetic testing for breast and prostate cancer. Ottawa, Canadian Coordinating Office for Health Technology Assessment (CCOHTA) 1999. 7. Health New York State Department of. Genetic susceptibility to breast and ovarian cancer: assessment, counseling and testing guidelines. 1999. 8. National Cancer Institute. USA. Genetics of Breast and Ovarian Cancer. 2002. 45 avalia-t 9. Haffty BG, Harrold E, Khan AJ, Pathare P, Smith TE, Turner BC, Glazer PM. Ward B, Carter D, Matloff E, Bale AE, Alverez-Franco M. Outcome of conservatively managed early-onset breast cancer by BRCA1/2 status. Lancet 2002. 359: 1471-1477. 10. Satagopan JM, Offit K, Foulkes W, Robson ME, Wacholder S, Eng CM, Karp SE, Begg CB. The lifetime risks of breast cancer in Ashkenazi Jewish carriers of BRCA1 and BRCA2 mutations. Cancer Epidemiology, Biomarkers & Prevention 2001. 10: 467-473. 11. Ford D, Easton DF, Stratton M, et al. Genetic heterogeneity and penetrance analysis of the BRCA1 and BRCA2 genes in Breast cancer families. Am J Human Genetics 1998. 62 (3): 676-689. 12. De la Hoya, M Osorio A, Godino J, Sulleiro S, Tosar A, Perez Segura P, Fernandez C, Rodriguez R, Diaz-Rubio E, Benitez J, Devilee O, Caldes T. Association between BRCA1 and BRCA2 mutations and cancer phenotype in Spanish breast/ovarian cancer families: implications for genetic testing. Int J Cancer 2002. 97 (4): 466-71. 13. Osorio A, Robledo M, Albertos J, Diez O, Alonso C, Baiget M, Benitez J. Molecular analysis of the six most recurrent mutations in the BRCA1 gene in 87 Spanish breast/ovarian cancer families. Cancer Lett 1998. 123 (2): 15358. 14. Diez O, Cortes J, Domenech M, Brunet J, del Río E, Pericay C, Sanz J, Alonso C, Baiget M. BRCA1 mutation analysis in 83 Spanish breast and breast/ovarian cancer families. Int J Cancer 1999. 83(4): 465-9. 15. Couch FJ, Hartmann LC. BRCA1 testing: advances and retreats. JAMA 1998. 279(12): 955-957. 16. Lawence WF, Peshkin BN, Liang W, Isaacs C, Lerman C, Mandelblatt JS. Cost of genetic counseling and testing for BRCA1 and BRCA2 breast cancer susceptibility mutations. Cancer Epidemiology, Biomarkers & Prevention 2001. 10: 475-81. 17. Thompson D, Easton D, and the Breast Cancer Linkage Consortium. Variation in BRCA1 cancer risks by mutation position. Cancer Epidemiology, Biomarkers & Prevention. 2002. 11: 329-336. 18. Díez Gibert O, del Río E, Doménech, M, Cortés J, Sanz J, Brunet J, Alonso MC, Baiget M. Identificación de una nueva mutación en el gen 46 Bibliografía BRCA2 mediante análisis de la proteína truncada en una familia española con cáncer hereditario. Med Clin (Barc) 1999. 112(5): 179-181. 19. Díez Gibert O, del Río E, Doménech, M, Hernández EM, Sanz J, Brunet J, Alonso MC, Baiget M. Mutaciones en el gen BRCA1 en mujeres españolas jóvenes con cáncer de mama. Med Clin (Barc) 1999. 112 (2):4154. 20. Bonadona V, Saltel P, Desseigne F, Mignotte H, Saurin JC, Wang Q, Sinilnikova O, Giraud S, Freyer G, Plauchu H, Puisieux A, Lasset C. Cancer patients who experienced diagnostic genetic testing for cancer susceptibility: reactions and behavior after te disclosure of a positive test result. Cancer Epidemiology, Biomarkers & Prevention 2002. 11: 97-104. 21. Geller G, Doksum T, Bernhardt BA, Metz SA. Participation in breast cancer susceptibility testing protocols: influence of recruitment source, altruism, and family involvement on women's decisions. Cancer Epidemiology, Biomarkers & Prevention 1999. 8: 377-383. 22. Haber D. Prophylactic oopherectomy to reduce the risk of ovarian and breast cancer in carriers of BRCA mutations. N Engl J Med 2002. 346 (21): 1660-1662. 23. Kauff ND, Satagopan JM, Robson ME, Scheuer L, Hensley M, Hudis CA, Ellis NA, Boyd J, Borgen PI, Barakat RR, Norton L, Offit K. Risk-reducing salpingo-oopherectomy in women with a BRCA1 or BRCA2 Mutation. N Engl J Med 2002. 346 (21): 1609-1615. 24. Rebbeck TR, Lynch HT, Neuhausen SL, Narod SA, Van't Veer L, Garber JE, Evans G, Isaacs C, Daly MB, Matloff E, Olopade OI, Weber BL, for the Prevention and Observation of Surgical End Points Study Group. Prophylactic oopherectomy in carriers of BRCA1 or BRCA2 mutations. New Eng J Med 2002. 346: 1616-1622. 25. Lerman C, Narod S, Schulman K, Hughes C, Gomez-Caminero A, Bonney G, Gold K, Trock B, Main S, Lynch J, Fulmore C, Snyder C Lemon SJ, Conway T, Tonin P, Lenoir G, Lunch H. BRCA1 testing in families with hereditary breast-ovarian cancer. JAMA 1996. 275 (24): 1885-1892. 26. Poll The Harris. http://www.harrisinteractive.com/harris_poll/indes.asp?PID=304 acceso el 25 de Junio de 2002. 2001. 47 avalia-t 27. Armstrong K, Calzone K, Stopfer J, Fitzgerald G, Coyne J, Weber B. Factors associated with decisions about clinical BRCA1/2 testing. Cancer Epidemiology, Biomarkers & Prevention 2000 (9): 1251-1254. 28. Bottorf JL, Ratner PA, Balneaves LG, Richardson CG, McCullum M, Hack T, Chamers K, Buxton J. Women's interest in genetic testing for breast cancer risk: the influence of sociodemographics and knowledge. Cancer, Epidemiology, Biomarkers & Prevention 2002. 11: 89-95. 29. Garber JE, Schrag D. Testing for inherited cancer susceptibility. JAMA 1996. 275 (24): 1928-1929. 30. Martinez-Ferrandis, Vega A, Chirivella I, Martin-Garcia P, Insa A, Lluch A, Carracedo A, Chaves FJ, Garcia-Conde J, Cervantes A, Armengod ME. Prevalence of BRCA1 and BRCA2 gene mutations in mediterranean spanish women with early-onset of breast cancer. Artículo en revisión. 31. Euhus DM, Smith KC, Robinson L, Stucky A, Olopade OI, Cummings S, Garber JE, Chittenden A, Mills GB, Rieger P, Esserman L, Crawford B, Hughes KS, Roche CA, Ganz PA, Seldon J, Fabian CJ, Klemp J, Tomlinson G. Pretest prediction of BRCA1 or BRCA2 mutation by risk counselors and the computer model BRCAPRO. Journal of the National Cancer Institute 2002. 94 (11): 844-51. 48 Glosario 8. GLOSARIO Penetrancia: porcentaje de individuos portadores de una mutación que desarrollarán la enfermedad a la que esa mutación les predispone. 49