Taller 4 - Pedeciba
Anuncio

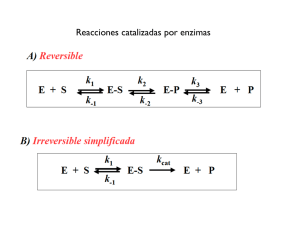
Curso de Bioquímica y Biología Molecular Maestría en Bioinformática PROBLEMAS- UNIDAD 4 1- La célula como un sistema termodinámico: Sistema, entorno y universo. Primera y segunda ley de la termodinámica. La energía libre como energía capaz de efectuar trabajo (G =H - TS). Relación entre el equilibrio y la energía libre estándar (Go = RTlnKeq). 2- Termodinámica de las reacciones catalizadas por enzimas. Energía libre de activación y efecto de catalizadores, G de activación. Ley de acción de masas, orden de una reacción. Teoría del estado de transición. 3- Cinética enzimática. Cinética química. Definición de enzima. Formación del complejo enzima-sustrato. Ecuación de Michaelis-Menten. Significado de Vm, Km, Ks y constante catalítica. Efecto del pH y la temperatura sobre la actividad enzimática. Gráfico de doble recíprocas: determinación de Vm y Km. Inhibidores. 4- Control de la Actividad Enzimática: Modulación alostérica, covalente y mediada por proteólisis. Enzimas alostéricas: velocidad en función de concentración de sustrato, efecto homotrópico y heterotrópico. 5-Metabolismo intermediario: Rutas centrales del metabolismo energético celular. Anabolismo y catabolismo. Estructura y propiedades del ATP. Topografía del metabolismo: principales organelos y compartimientos celulares, asociación de estructuras y funciones celulares. . Problemas 1. 1. Si el ΔG para una reacción es cero, indique cual de las siguientes afirmaciones es correcta: a) ΔS=0 b) ΔH=0 c) Keq=1 d) La reacción esta en equilibrio e) [reactivos]=[productos]=1M f) Defina los siguientes términos: termodinámica, endergónico, entalpia, energía libre, entropía [1]. 2. El ARN en solución, a pH neutro y baja temperatura forma una estructura helicoidal. A 35°C se produce una transición conformacional con un ΔH=8.0 kcal/mol y ΔG=-2.78 kcal/mol. Calcule ΔS del proceso e indique el grado de ordenamiento de las estructuras inicial y final. 3. Equilibrar la siguiente reacción y calcular el ΔH, [1] C 17H 35COOH + O2 CO2 + H 2O Siendo los valores de ΔH: C 17H 35COOH (-211,4) O2 (0) CO2 (-94) H 2O (-68,4) 4. Indique verdadero o falso a) Las enzimas catalizan las reacciones porque bajan la energía de activación, pero no alteran la posición del equilibrio b) La velocidad inicial de una reacción catalizada enzimáticamente es independiente de la concentración de sustrato c) La velocidad inicial aumenta proporcionalmente a la concentración de enzima d) La KM equivale a la concentración de sustrato a la cual la velocidad es la mitad de la máxima. e) La KM varia con la concentración de la enzima 5. Dada la siguiente reacción: k1 k2 E + S ES E + P k-1 Siendo k1 = 1 x 107 M-1s-1, k-1 = 1 x 102 s-1 y k2 = 3 x 102 s-1 Calcular: a) Ks b) Km c) ¿Cuándo Ks se aproxima al valor de Km? 6. Los siguientes resultados fueron obtenidos a partir de una reacción catalizada enzimáticamente: [S] (mM) 0.50 0.75 1.00 1.50 2.00 v (mol/l/min) 8.0 10.0 11.4 13.0 15.0 a) Estimar gráficamente Vmax y Km b) Estimar k2 (kcat) si la concentración de enzima fue de 8 nM c)¿Cuál sería la velocidad de reacción a [S] = 600 M y a [S] = 1200 M? d) Estas velocidades de reacción fueron obtenidas en presencia de una concentración 8 x 10-9 M de la enzima. ¿Cuál sería la velocidad de reacción para [S] = 10 mM si la concentración de enzima hubiese sido 1 x 10-8 M ? Justifique su respuesta. 7. Para una enzima con KM=4.7x10-5M y VMAX=22µmoles/L.min a) Cuánto vale la velocidad en presencia de 2x10-4M de sustrato? b) Cuánto valen la velocidad y el grado de inhibición si se agrega 5x10-4 M de un inhibidor competitivo con K1=3x10-4M? c) Y si el inhibidor es no competitivo? d) Y si es competitivo? Problemas de membranas biológicas 1) ¿Cuáles son los componentes de la membrana biológica y cuál es su función en dicha estructura? 2) Los glicolípidos son lípidos no iónicos que pueden orientarse en la membrana plasmática como los fosfolípidos a pesar de no tener grupos iónicos. Sugiera una razón que explique este hecho [1]. 3) ¿Qué quiere decir que una molécula sea hidrofóbica, hidrofílica, anfipática? Cite ejemplos. ¿qué tipo de moléculas pueden formar micelas? 4) La tirosina es un aminoácido. ¿Cuáles átomos de esta molécula pueden formar enlaces de hidrógeno? [1] 1- Extraído de Biochemistry. The molecular basis of life. McKee. Oxford. Fourth Edition.