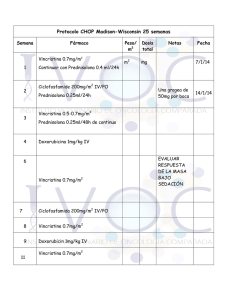
VINCRISTINE 1mg/1mL
Anuncio

VINCRISTINE 1mg/1mL 1. Identificación del Medicamento Nombre Comercial Vincristine 1mg/mL Nombre Genérico Vincristina Sulfato Concentración 1mg/mL Denominación Común Internacional Vincristina N° Registro Sanitario 2006M-005355-R1 Código ATC Vigencia del Registro Sanitario L01CA02 14 de Julio de 2016 Código de Barras Forma Farmacéutica 7707184310255 Solución Inyectable Código CUM Vía de Administración 000202645 - 01 Intravenosa (IV) Grupo Anatómico Vida Útil Agentes Antineoplásicos Inmunomoduladores 24 meses Presentación Comercial Caja por 1 vial de Vidrio Tipo I Volumen del Vial 1mL e Indicaciones de Uso Vincristine puede ser usada sola o en combinación con otros agentes citostáticos para el tratamiento de: Leucemia Linfocítica Aguda, Linfoma de Hodgkin y Linfoma No Hodgkin, tumores Sólidos, incluyendo Carcinoma de Seno y FT-GTR-049-01 A partir de 01-10-15 Página 1 de 7 Carcinoma de Pulmón de Células Pequeñas, Sarcoma de Ewing, Rabdomiosarcoma Embrional, Tumor de Wilms, Neuroblastoma, Retinoblastona, Trombocitopenia Púrpura Idiopática. condiciones pueden constituir una contraindicación: enfermedad neuromuscular, reducción severa de la función hepática, constipación y señales de íleo (particularmente en niños). Usos Aprobados en Colombia Fabricante Coadyuvante en el Tratamiento de Leucemia Aguda , Enfermedad de Hodgkin y Otros Linfomas, Incluyendo el Linfoma de Burkitt, Tumor de Wilms, Neuroblastoma, Retinoblastona y Sarcomas, Cacinoma Pulmonar y Mamario. Pharmachemie B.V – Holanda, Países Bajos Contraindicaciones Importador Vincristina no debe ser administrada durante el embarazo. Las siguientes Al Pharma S.A - Colombia Titular Pharmachemie B.V – Holanda, Países Bajos 2. Características Farmacológicas y Farmacocinéticas Acción Farmacológica Vincristina entra en la célula a través de un mecanismo de transporte activo y se enlaza con las proteínas tubulares inhibiendo así la polimerización de tubulina a microtúbulos. Como resultado de esto, las células son retenidas en la metafase. Debido a la persistente presencia intracelular de la Vincristina, hay un riesgo de efecto citotóxico durante el ciclo total de la célula. Este efecto, sin embargo, no se manifiesta por sí mismo hasta que la célula ha alcanzado la fase de mitosis y es retenida en la metafase. Aspectos Farmacocinéticos Absorción: Después de la administración intravenosa, la concentración plasmática más alta es aproximadamente 300ng/mL. La eliminación plasmática se puede describir como una reducción en tres fases, la vida media representativa es de 2min, 20 min y 23 horas respectivamente. Distribución: Después de 15-30 minutos después de la administración intravenosa, más del 90% de la Vincristina ha sido distribuida a los tejidos. La vida media terminal puede aumentar a varios días. El volumen del compartimiento central y el del estado estable son de 4,1L y 168L por 1,73m2 respectivamente. La depuración plasmática es de 142 mg/min/1,73 m2. El volumen de distribución es de 8.4 +/- 3.2 L/kg. FT-GTR-049-01 A partir de 01-10-15 Página 2 de 7 Metabolismo: La Vincristina se metaboliza principalmente en del hígado. Cerca del 45% de la dosis administrada se convierte en metabolitos y productos de descomposición. Eliminación: Después de 48 horas, el cuerpo ha retenido más del 50% de la dosis. 72 horas después de la administración de Vincristina que ha sido marcada radioactivamente, se detecta entre 5-12% de la marca detectada en la orina, la mitad de esta cantidad, como Vincristina intacta. Cerca del 69% fue detectado en las heces: 29% sin cambio y 40% metabolizado o descompuesto. La excreción vía biliar es la ruta principal: la concentración de Vincristina en bilis es 20 veces más alta en plasma luego de 72 horas. 3. Uso Durante el Embarazo y la Lactancia La Vincristina está contraindicada durante el periodo de embarazo y lactancia. Clasificación del Riesgo en el embarazo: D Es necesario tener precaución con la administración de todas las drogas oncológicas durante el embarazo. La información del uso de Vincristina durante el embarazo humano es muy limitada. Los estudios con animales sugieren que pudieran presentarse efectos teratogénicos y embriocidas. Es necesario, tanto los hombres como las mujeres deben utilizar métodos anticonceptivos durante el tratamiento y hasta tres meses después de haberlo suspendido. 4. Atributos del Medicamento Fácil cálculo de dosificación y ajuste de la dosis de acuerdo a la presentación Tapón con memoria para evitar cualquier fuga luego de la punción. 5. Reacciones Adversas Reacciones Hematológicas Leucopenia. Por lo general, se observa una recuperación después de una semana. Pueden presentarse leves síntomas de trombocitopenia y de anemia. Usualmente, se ha observado trombocitosis temporal. Reacciones Neurológicas La neurotoxicidad es el efecto colateral más frecuente de la Vincristina. Los síntomas están relacionados con desórdenes del sistema nervioso periférico y autónomo. La toxicidad neurológica también tiene relación con la dosis y la edad. Se observó con 379 FT-GTR-049-01 A partir de 01-10-15 Página 3 de 7 pacientes: reflejos reducidos (algunas veces los reflejos profundos de tendón 100%), parestesias (46-57%), constipación (33-46%), dolores neurálgicos (por ejemplo, dolor en la mandíbula y los testículos) (6-8%), debilidad muscular (23-34%), debilidad muscular y marcha atáxica (5-22%), íleo (3-12%) y desórdenes del nervio craneal (1-32%). Se han observado casos de secreción anormal de la hormona antidiurética con o sin hiponatremia, síndrome convulsivo y coma, daño cerebral focal, síndrome de Pseudo Parkinson, complicaciones oftalmológicas, retención de orina, hipotensión, confusión mental, depresión, nerviosismo, insomnio, alucinaciones y sicosis. Reacciones Gastrointestinales La constipación ya mencionada impactar la parte alta del colon mientras que el recto puede encontrarse vacío. Pueden presentarse dolores tipo cólico abdominal. Nauseas, vómito, pérdida del apetito, diarrea y ulceraciones orales. En niños pequeños se puede presentar íleo paralítico. Otros Reacciones Se ha observado regularmente: alopecia (5 - 20%). Se puede presentar flebitis después de una irritación venosa o una extravasación durante el procedimiento de administración de la droga. En muy pocas ocasiones se han reportado pérdida de peso, fiebre, dolores de cabeza, toxicidad pulmonar e infarto agudo de miocardio. Al igual que con otras drogas citostáticas, se puede presentar nefropatía aguda del ácido úrico. A pesar de que después del tratamiento con Vincristina se han observado embarazos normales, la droga puede tener un efecto teratogénico u otros efectos adversos sobre el feto. La Vincristina también puede tener efectos sobre la fertilidad de los pacientes. 6. Dosificación y Administración Dosis en Adultos La dosis que se debe aplicar a los adultos es de 1,4 mg/m2 (dosis máxima: 2 mg/m2) semanal. Dosis en Niños Los niños toleran una dosis mayor: 1,5 - 2,0 mg/m2 semanal. Después de su dilución con Cloruro de Sodio 0.9%, la concentración de Vincristina puede variar entre 0,01 - 1 mg/mL. Ajuste de la Dosis En caso de que la función hepática sea anormal durante el primer día de tratamiento, la dosis de Vincristina debe ser de 100% si la concentración de bilirrubina es menor a 25 mmol/L, de 50% si la concentración de bilirrubina está entre 25-50 mmol/L y de 25% si la concentración de bilirrubina es mayor a 50 mmol/L. En caso de que se perciban manifestaciones de FT-GTR-049-01 A partir de 01-10-15 Página 4 de 7 neurotoxicidad severa (particularmente señales de paresis), no se debe aplicar Vincristina. Se puede reiniciar el tratamiento con 50% de la dosis cuando la neurotoxicidad se haya reducido. Sobredosis Una sobredosis aguda con Vincristina desencadena la aparición severa de los efectos adversos y puede ser fatal. En caso de que se presenten síntomas de parestesia o paresis, se debe suspender el tratamiento con Vincristina. Durante una administración prolongada de Vincristina, los efectos adversos pueden ser más severos. La recuperación puede demorarse meses o años. Se recomienda un tratamiento sintomático. Si es necesario, se deben tomar ciertas medidas de apoyo y se deben realizar transfusiones de sangre. Condiciones Especiales de Preparación y Manipulación Este medicamento debe ser manejado por personal entrenado en el manejo de medicamentos citostáticos. Vincristina se debe administrar a través de una pequeña infusión intravenosa o por medio de una inyección en bolo durante por lo menos 1 minuto a través de una venoclisis que contenga una infusión. Para evitar irritación, se aconseja dejar correr la infusión para así limpiar la vena, después de la administración de Vincristina. 7. Precauciones Durante la Administración Vincristina debe ser prescrita después de consultar con un médico oncólogo. La administración intratecal de Vincristina resulta en neurotoxicidad fatal. Se debe evitar la extravasación. Es necesario que el personal médico esté presente durante la administración de Vincristina. Se debe tener cuidado especial con los pacientes que tengan historial neurológico o con problemas hepáticos. Es imperativo tener precaución en el uso de Vincristina en combinación con otros agentes que pueden causar toxicidad neuromuscular. Es necesario realizar exámenes de sangre periódicamente. Se deben tomar medidas profilácticas, tales como una dieta especial y terapia laxativa, para evitar la constipación. 8. Interacciones Medicamentosas Adriamicina: La Vincristina puede aumentar el riesgo de inducción de cardiomiopatía producido por la Adriamicina. Isoniazida y Asparaginasa: Pueden llevar a un incremento en la neurotoxicidad de la Vincristina. Metotrexate: La Vincristina puede promover el aumento celular del methotrexate Palifermina: La Palifermina incrementa la toxicidad de la Vincristina. La Palifermina debe ser administrada 24 horas ó 24 horas después de la administración de Vincristina. Mitomicina: La Mitomicina incrementa la toxicidad de la Vincristina por un mecanismo desconocido FT-GTR-049-01 A partir de 01-10-15 Página 5 de 7 9. Reconstitución y/o Dilución El medicamento una vez diluido con Cloruro de Sodio 0.9% o Dextrosa 5% es estable durante 48 horas si se almacena a una temperatura entre 2-8°C y 24 horas si se almacena a una temperatura entre 15-30°C. 10. Condiciones de Almacenamiento Almacénese entre 2 y 8°C, en su envase y empaque original, fuera del alcance de los niños. 11. Riesgos Ocupacionales Se recomienda mantener los procedimientos para manejo seguro y desecho de medicamentos de alto riesgo Evitar el contacto con ojos, piel y ropa. Usar elementos de protección personal adecuados para la manipulación de medicamentos riesgosos. Prevenir la exposición ocupacional y las emisiones al medio ambiente. No debe ser manipulado por una mujer embarazada. Disposición Final Tipo de Disposición: INCINERACIÓN 12. Documentación Soporte DOCUMENTO SI Registro Sanitario Invima X Ficha Técnica X Certificado BPM X Hoja de Seguridad X Uso en Otras Instituciones X Aprobación FDA - EMEA Estudios de Evidencia Clínica NO OBSERVACIONES X X FT-GTR-049-01 A partir de 01-10-15 Página 6 de 7 13. Clasificación Tarifaria CARACTERISTICA SI Medicamento POS X NO Medicamento de Libertada Vigilada Medicamento de Control Directo FT-GTR-049-01 A partir de 01-10-15 Página 7 de 7