Semana 11 Conociendo las Propiedades Coligativas
Anuncio

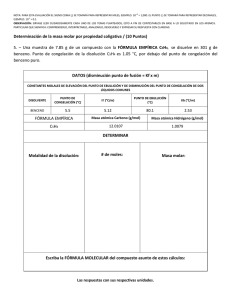
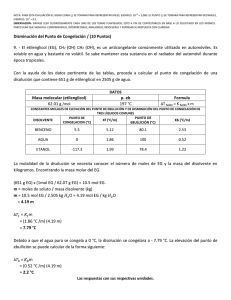
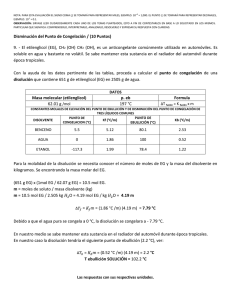
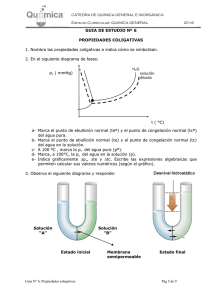
Semana 11 Conociendo las Propiedades Coligativas Semana 11 Conociendo las Propiedades Coligativas ¡Empecemos! Durante esta semana exploraremos los fenómenos físicos que se producen por la modificación de la composición de las soluciones y su influencia en los procesos biológicos en la naturaleza. Para ello, comenzaremos el estudio de las propiedades coligativas de las soluciones, específicamente los puntos de congelación y de ebullición de una solución. ¿Qué sabes de...? Las sustancias poseen propiedades físicas particulares que suelen modificarse cuando dichas soluciones se combinan. A las nuevas propiedades formadas producto de la combinación de un soluto más un solvente es lo que denominamos propiedades coligativas. ¿Podrías mencionar cuáles son las propiedades coligativas y cómo varían dichas propiedades? El reto es... El abuelo Floripondio puso a calentar una olla con agua a fin de preparar una pasta para el almuerzo de Sulfuro. En eso, su señora le dice que le añada el aceite y la sal al agua. Él le dice que lo hará cuando el agua esté hirviendo. ¿Sabes por qué el abuelo Floripondio no quiere añadir la sal y el aceite antes de que hierva el agua? Vamos al grano 376 Cuando hablamos de las propiedades coligativas de las soluciones, hacemos referencia al cambio que sufren las propiedades físicas del agua. Por tal Conociendo las Propiedades Coligativas Semana 11 motivo, empecemos por recordar dos propiedades físicas del agua, como son el punto de congelación y el punto de ebullición. El punto de congelación se refiere a la temperatura en la cual el agua pasa de estado líquido a sólido, teniendo para el agua pura un valor de 0°C. El punto de ebullición se refiere a la temperatura en la cual el agua pasa de estado líquido a gaseoso, que para el agua pura tiene un valor de 100°C. Es importante recordar que estas dos propiedades son intrínsecas para el agua y sirven para la identificarla como sustancia. El punto de ebullición del agua se define como la temperatura en la cual la presión de vapor del agua se iguala a la presión atmosférica; sin embargo, cuando se añade un soluto no electrolito al agua, la temperatura de ebullición resultante aumenta. Esto se ha demostrado experimentalmente cuando el incremento del punto de ebullición es proporcional a la concentración molal del soluto. Matemáticamente se expresaría así: PtoEbSolución= PtoEbH2O + ΔEb Donde ΔEb significa el incremento de la temperatura de ebullición de la solución, y se calcula de la siguiente manera: ΔEb= (Ke) x (M) Donde Ke significa constante ebulloscópica molal y se expresa como: 0,52 (°CxKg)/mol; y m es la concentración de soluto en molal. moles (sto) m = Kg (ste) El punto de congelación del agua se define como la temperatura a la cual la presión de vapor del líquido y del sólido se iguala; pero, cuando se añade un soluto no electrolito al agua, la temperatura de congelación de la solución desciende. Matemáticamente se expresa de la siguiente manera: PtoCgSolución= PtoCgH20 - ΔCg 377 Semana 11 Conociendo las Propiedades Coligativas Donde ΔCg significa el descenso de la temperatura de congelación de la solución y se calcula de la siguiente manera: ΔCg= (Kc) x (m) Donde Kc significa constante crioscópica molal y se expresa como 1,86 (°CxKg)/mol; y m es la concentración de soluto en molal. moles (sto) m = Kg (ste) Veamos un ejemplo: Calcula el punto de ebullición y el punto de congelación para 20g de glucosa (C6H12O6) en 200ml de agua. 1. Calculamos la masa molecular de la glucosa: PMC6H1206= ∑ (PAC) x 6 + (PAH) x12 + (PAO) x6 = ∑(12,01g/mol)x6+(1,0 g/mol)x12+(15,99 g/mol)x6 = ∑72,06 g/mol+12,00g/mol+95,94g/mol= 180g/mol 2. Luego convertimos los gramos de solvente en kilogramos. Recordemos que la densidad del agua es igual a 1g/ml, por lo tanto su volumen (200ml) es igual a su masa (200g). 1Kg ____________ 1000 g X ____________ 200 g Por lo tanto X = 200 g x 1 Kg 1000 g = 0,2 kg 3. Calculamos la concentración en molalidad. m= masa(sto) PM x Kg (ste) m= 20 g = 20 g 180 g/mol x 0,2 Kg 36,0 g x Kg/mol = 0,55 mol/Kg = 0,5 molal 4. Calculamos la variación de ebullición ΔEb y posteriormente el punto de ebullición de la solución: °CxKg mol ΔEb = (Ke)x(m) sustituyendo ΔEb = 0,52 x 0,5 = 0,28 °C mol Kg 378 PtoEbSolución=PtoEbH2O+ΔEb sustituyendo EbSol=100°C+0,28°C=100,28°C Semana 11 Conociendo las Propiedades Coligativas 5. Calculamos la variación de congelación ΔCg y posteriormente el punto de congelación de la solución. °CxKg mol ΔEb = (Kc)x(m) sustituyendo ΔCg = 1,86 x 0,5 = 1,02 °C mol Kg PtoCgSolución=PtoCgH2O+ΔCg sustituyendo PtoCgSol = 0°C-1,02°C= -1,02°C Por lo tanto, para una solución de glucosa que contiene 20g del azúcar en 200ml de agua, el punto de ebullición de la solución ascenderá a 100,28°C y el punto de congelación descenderá a -1,02°C. Para saber más… Si deseas saber más sobre las propiedades coligativas, te invitamos a consultar las siguientes direcciones web: http://www.ecured.cu/index.php/Propiedades_coligativas http://quimica2medio.blogspot.com/p/propiedades-coligativas.html http://fqexperimental.blogspot.com/2010/11/propiedades-coligativas.html http://educacionquintanormal.files.wordpress.com/2011/08/guc3adanc2ba-7-de-propiedades-coligativas-2c2ba-medio.pdf Aplica tus saberes Cuando añadimos aceite o sal en la preparación de unos espaguetis, lo que hacemos es disminuir la cantidad de agua disponible en la superficie, por lo que las moléculas de agua no pueden pasar de su estado líquido a gas. Para que esto ocurra, es necesario que se incremente la temperatura y así las moléculas de agua tienen la suficiente energía para separarse del soluto y pasar a su fase gaseosa. Aplicando la misma analogía, explica por qué una solución requiere disminuir la temperatura de congelación con respecto a la temperatura de congelación del agua pura; puedes experimentarlo colocando dos moldes, uno con agua sola y otro con jugo de fresa. Observa la temperatura a la cual se congelan las sustancias. 379 Semana 11 Conociendo las Propiedades Coligativas Comprobemos y demostremos que… Existen otras propiedades coligativas de las soluciones como, por ejemplo, la presión de vapor de una solución, la cual desciende proporcionalmente a la fracción molar de un soluto no electrolito y la presión osmótica, la cual es directamente proporcional a la cantidad de soluto presente en la solución. Te invitamos a investigar qué les pasa a las moléculas de agua cuando medimos la presión de vapor de una solución de glucosa. Las propiedades coligativas se cumplen cuando el soluto presente en la solución es considerado un soluto no electrolítico, como por ejemplo: la urea, glucosa, proteínas, sacarosa, o cualquier soluto que sea incapaz de conducir la corriente eléctrica en su fase acuosa. 380