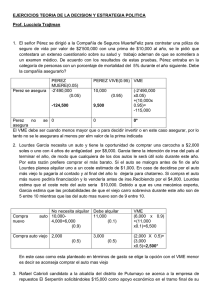
Hacia una nueva generación de vacunas multivalentes basadas en
Anuncio

CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ INSTITUTO FINLAY VICEPRESIDENCIA DE PRODUCCIÓN UNIVERSIDAD DE LA HABANA INSTITUTO DE FARMACIA Y ALIMENTOS DEPARTAMENTO DE TECNOLOGÍA Y CONTROL DE MEDICAMENTOS Hacia una nueva generación de vacunas multivalentes basadas en vesículas de membrana externa de Neisseria meningitidis serogrupo B Tesis presentada en opción al grado científico de Doctor en Ciencias Farmacéuticas Autor: Lic. Ramón Barberá Morales Tutores: Dr. Gustavo Sierra González Dr. Antonio Iraizoz Colarte Asesora: Dra. Isabel Martínez Motas La Habana 2008 CONFIDENCIAL Versión: 3 “A todos los que hicieron suyo el proyecto MenB bivalente” Página ____ Ejemplar No. _____ CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ AGRADECIMIENTOS A todos los trabajadores del Instituto Finlay que dieron su aporte decisivo al proyecto de desarrollo de la vacuna MenB bivalente entre 1999 y 2003. A mis tutores Gustavo Sierra y Antonio Iraizoz por todas las enseñanzas en la preparación del documento. A mi asesora Isabel Martínez por la revisión paciente y detallada de las versiones del documento. A Conchita por su confianza y asesoría. A Domingo González por su participación destacada en todas las etapas del proyecto y por el apoyo brindado en la preparación y edición del material. A Aleida Mandariote por su participación en las etapas fundamentales y su disposición de analizar cualquier detalle con la objetividad de siempre. A Daniel Cardoso por poner toda su experiencia en la introducción rápida de los sistemas de filtración tangencial y sus valiosos consejos en el diseño y preparación del documento. A Lisset Pérez por su participación destacada en la programación y control de las operaciones de Planta III durante el desarrollo, así como cubrir mis períodos cortos de ausencias para la preparación del material. A Lilia Alfalla, Esther Maria Fajardo y Elizabeth Pérez, por garantizar los resultados analíticos y la realización de los estudios de estabilidad. A Sosa, Sandelis, Loreta, Carcache, Leonardo Sánchez y tantos otros que garantizaron la disponibilidad de la instalación y los nuevos requerimientos del mejoramiento del proceso. Al grupo técnico de Planta III que garantizó la organización, ejecución y control de los procesos, en especial a Raul Boué, Liliam Nápoles, Sum-Lai Lozada, Kenia Reyes, Isbel González, Mónica Obaya, Raúl Abreu, Zulma Cepero, Roselyn Martínez, Mario Vieyto y Maria Elsa Tápanes. Al grupo de dirección del proyecto Finlay – GSK, Conchita, Gustavo, Ricardo, Lily, Franklin y Panchín por sus recomendaciones oportunas en el desarrollo del producto. A Pierre Desmons, Jean Smal y Jan Poolman de la firma Glaxo-Smith Kline por su participación en el diseño de los experimentos y análisis de los resultados A Liliam Uli, Lázaro Betancourt y Lila Castellanos por la introducción de las técnicas proteómicas en el análisis del componente proteico de las VME. A Mayelin Mirabal por su colaboración en los análisis estadísticos. A Maria Victoria por su apoyo en las actualizaciones biblográficas. CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ A Dilene por su asistencia eficiente en las ediciones del documento sin escatimar tiempo. A todos los que me brindaron su cooperación en esta etapa final y en especial a Yossel, Sussel, Elizabeth Pérez, Nadia Costa, Yolexis Tamayo, Rosario Dieguez, Matilde Cuevas e Imilsis. A Dulce por su amor e incondicionalidad de siempre y su comprensión para que lograra este viejo empeño. A mis hijos por darle valor a todas mis cosas y en especial a Ariana, que por su especialidad afín me sacó de apuros muchas veces. A Judith y Juan Carlos por estar siempre dispuestos a cooperar. A mis padres por la formación recibida. A la Revolución cubana por brindarme las posibilidades de formación científica, desarrollo integral y desempeño en la rama de la Biotecnología. CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ SÍNTESIS Este trabajo se realizó con el objetivo de obtener un nuevo candidato vacunal bivalente de vesículas de membrana externa (VME) de Neisseria meningitidis serogrupo B con un perfil antigénico más amplio, mediante el perfeccionamiento de la tecnología existente en el Instituto Finlay. Además, se incorporó una nueva cepa, tomando en consideración la situación epidemiológica y regulaciones farmacéuticas existentes en Europa. Se introdujo la microfiltración tangencial, proceso que aumentó más de dos veces los rendimientos de proteínas. El empleo de la electroforesis bidimensional y técnicas proteómicas evidenció la consistencia del componente proteico en los lotes de VME, identificándose 26 nuevas proteínas, la mayoría minoritarias, algunas de las cuales pudiera contribuir a la inducción de respuesta inmune protectora. El uso de la sacarosa en la purificación y conservación de las VME redujo como mínimo 10 veces la pirogenicidad intrínseca de las mismas, sin afectar su inmunogenicidad al adsorberlas previamente en Hidróxido de Aluminio. Se incorporó la cepa (NZ 98/228) como vacunal y con el mismo proceso de la cubana (CU 385/83), se obtuvieron VME que presentaron un comportamiento similar respecto a la identidad proteica, niveles de contaminantes, pirogenicidad, actividad endotóxica e inmunogenicidad. Se obtuvo una nueva vacuna bivalente mediante combinación de las cepas CU 385/83 con actividad heteróloga demostrada y la NZ 98/228, representante del clon epidémico prevalente en Europa. La vacuna y sus componentes no mostraron interferencias inmunológicas, cumplieron las especificaciones de calidad establecidas y fueron estables en los estudios de vida de estante y estrés. Se realizaron estudios de equivalencia para demostrar la no afectación de los cambios en el proceso y el producto en relación a los tradicionales. El proceso perfeccionado redujo el equipamiento y facilitó el cumplimiento de las Buenas Prácticas de Fabricación. CONFIDENCIAL Versión: 3 TABLA DE CONTENIDO Página ____ Ejemplar No. _____ pag. INTRODUCCIÓN ................................................................................................................. 1 1. REVISIÓN BIBLIOGRÁFICA .............................................................................................. 5 1.1 Características generales de la enfermedad meningocócica..........................................5 1.2 Estructura antigénica de N. meningitidis..........................................................................6 1.3 Clasificación serológica de N. meningitidis......................................................................6 1.4 Identificación genotípica de N. meningitidis.....................................................................9 1.5 Epidemiología de la enfermedad meningocócica ..........................................................10 1.6 Vacunas de polisacáridos capsulares............................................................................11 1.7 Vacunas basadas en PME contra N. meningitidis serogrupo B ....................................13 1.8 La epidemia de enfermedad meningocócica en Cuba y su control...............................14 1.9 Evaluaciones del post-licenciamiento de VA-MENGOC-BC en otros países................14 1.10 Metodologías para la obtención de vacunas contra el serogrupo B a partir de VME .16 1.10.1 Selección de las cepas vacunales y aplicación del sistema de lotes de siembra ........ 16 1.10.2 Medios de cultivo ......................................................................................................... 16 1.10.3 Condiciones de cultivos ............................................................................................... 17 1.10.4 Criterios de cosecha e inactivación ............................................................................. 18 1.10.5 Métodos de separación de biomasa ............................................................................ 19 1.10.6 Extracción de VME ...................................................................................................... 19 1.10.7 Purificación de las VME............................................................................................... 20 1.10.8 Diseño y formulación de las vacunas .......................................................................... 21 1.11 Controles de calidad de las vacunas de VME .............................................................22 1.12 Caracterización de las VME.........................................................................................23 1.13 Regulaciones Farmacéuticas.......................................................................................24 1.14 Tendencias en el desarrollo de vacunas contra el meningococo serogrupo B ...........26 2. MATERIALES Y MÉTODOS ............................................................................................ 30 2.1 Metodología analítica .....................................................................................................30 2.1.1 Determinación de la densidad óptica de los cultivos ..................................................... 30 2.1.2 Determinación de la pureza microbiana ........................................................................ 30 2.1.2.1 Determinación por observación microscópica ..................................................................... 30 2.1.2.2 Determinación por siembra en medios de cultivo ................................................................ 30 2.1.3 Determinación de las proteínas ..................................................................................... 30 2.1.4 Electroforesis en geles de poliacrilamida con SDS y ß-mercaptoetanol........................ 30 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 2.1.5 Determinación del peso seco......................................................................................... 31 2.1.6 Determinación del LPS .................................................................................................. 31 2.1.7 Determinación del polisacárido...................................................................................... 31 2.1.8 Determinación del ácido nucleico .................................................................................. 32 2.1.9 Microscopía electrónica de las VME.............................................................................. 32 2.1.10 Identificación de las proteínas por Western-blot .......................................................... 32 2.1.11 Determinación de la antigenicidad de las VME in vitro por ELISA de inhibición .......... 32 2.1.12 Determinación de la actividad de los anticuerpos IgG antiserogrupo B por ELISA...... 33 2.1.13 Determinación de la actividad bactericida del suero.................................................... 34 2.1.14 Determinación del contenido de endotoxina por LAL .................................................. 35 2.1.15 Electroforesis bidimensional ........................................................................................ 36 2.1.15.1 Geles analíticos de rango pI 3 – 10 ................................................................................... 36 2.1.15.2 Geles analíticos de rango pI 4 – 7 .................................................................................... 36 2.1.15.3 Geles preparativos de rangos de pI 4-7 y 6-11.................................................................. 36 2.1.15.4 Análisis de las imágenes.................................................................................................... 37 2.1.15.5 Digestión proteolítica y extracción de los péptidos ............................................................ 37 2.1.15.6 Análisis de proteínas por espectrometría de masas .......................................................... 37 2.1.15.7 Identificación de las proteínas............................................................................................ 38 2.1.16 Determinación de pirógenos en conejos...................................................................... 38 2.1.17 Determinación del polisacárido capsular serogrupo B................................................. 39 2.1.18 Determinación de ADN ................................................................................................ 39 2.1.19 Determinación de la sacarosa ..................................................................................... 40 2.1.20 Determinación de DOC................................................................................................ 40 2.1.21 Determinación de la osmolalidad................................................................................. 41 2.2 Metodologías generales empleadas en los procesos de obtención de VME................41 2.2.1 Cepas ............................................................................................................................ 41 2.2.2 Medios de cultivo........................................................................................................... 41 2.2.3 Obtención del inóculo .................................................................................................... 42 2.2.4 Cultivo de semilla........................................................................................................... 42 2.2.5 Cultivo a escala industrial .............................................................................................. 42 2.2.6 Separación celular por centrifugación............................................................................ 43 2.2.7 Separación celular por microfiltración tangencial........................................................... 43 2.2.8 Extracción de las VME con DOC ................................................................................... 43 2.2.9 Purificación de las VME hasta la fracción cromatográfica ............................................. 43 2.2.10 Obtención del IFA por precipitación alcohólica ............................................................ 44 2.2.11 Obtención del IFA por diafiltración con sacarosa......................................................... 44 2.3 Evaluación de la MFT en la separación celular de la cepa CU 385/83 .........................45 2.3.1 Comportamiento hidrodinámico del proceso y recobrados celulares............................. 45 2.3.2 Evaluación del impacto de la MFT en las etapas de extracción y purificación de VME. 45 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 2.3.3 Evaluación del impacto de la MFT en las VME purificadas como IFA ........................... 46 2.4 Análisis de las proteínas presentes en las VME mediante electroforesis bidimensional y una plataforma de proteómica...........................................................................................46 2.5 Valoración del efecto de la sacarosa en la etapa de purificación y conservación de las VME......................................................................................................................................47 2.5.1 Comportamiento hidrodinámico del proceso de diafiltración de VME y recobrado ........ 47 2.5.2 Evaluación del impacto de la diafiltración con sacarosa en las características de las VME ............................................................................................................................................... 48 2.6 Evaluación de las cepas epidémicas de N. meningitidis ...............................................49 2.6.1 Metodologías empleadas a escala piloto....................................................................... 49 2.6.2 Metodologías empleadas a escala industrial ................................................................. 49 2.7 Obtención del nuevo candidato vacunal bivalente a partir de las VME de N. meningitidis serogrupo B......................................................................................................51 2.7.1 Formulación de los monograneles y de la vacuna MenB bivalente ............................... 51 2.7.2 Controles de calidad de las VME en sacarosa, monograneles y la vacuna MenB bivalente ................................................................................................................................. 52 2.7.3 Comparación de la respuesta inmune de los monograneles, MenB bivalente y VAMENGOC-BC® ....................................................................................................................... 52 2.7.4 Estudios de estabilidad de los monograneles y de la vacuna MenB bivalente a granel 53 2.8 Análisis estadístico.........................................................................................................53 3. RESULTADOS Y DISCUSIÓN .......................................................................................... 54 3.1 Perfeccionamiento del proceso de separación celular mediante el empleo de la microfiltración tangencial......................................................................................................54 3.1.1 Comportamiento hidrodinámico del sistema de MFT y recobrados del proceso............ 54 3.1.2 Impacto en el proceso de purificación de las VME ........................................................ 57 3.1.2.1 Contenido e identidad de las proteínas por etapas, rendimiento y recobrado del proceso.. 57 3.1.2.2 Eliminación de los contaminantes en los pasos de purificación de las VME ....................... 58 3.1.3 Cumplimiento de las especificaciones de calidad de las fracciones cromatográficas.... 60 3.1.4 Cumplimiento de las especificaciones de calidad del IFA y evaluaciones complementarias de antigenicidad, inmunogenicidad y actividad endotóxica ........................ 63 3.1.5 Ventajas de la introducción de la MFT en el proceso de obtención de VME ................. 68 3.1.6 Conclusiones parciales del perfeccionamiento del proceso de separación celular........ 68 3.2 Análisis de los componentes proteicos de las VME purificadas mediante la electroforesis bidimensional y una plataforma de proteómica.............................................69 3.2.1 Análisis de los componentes proteicos de las VME por electroforesis bidimensional ... 69 3.2.2 Identificación de las proteínas por espectrometría de masas........................................ 72 3.2.3 Conclusiones parciales del análisis de los componentes proteicos en las VME........... 76 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 3.3 Valoración del efecto de la sacarosa en la etapa de purificación y conservación de las VME......................................................................................................................................76 3.3.1 Comportamiento hidrodinámico del sistema de UFT y recobrados ............................... 76 3.3.2 Impacto de la sacarosa en las características de las VME y su pre-estabilidad ............ 77 3.3.2.1 Comportamiento del pH ....................................................................................................... 77 3.3.2.2 Identidad del CPME ............................................................................................................. 79 3.3.2.3 Estructura vesicular ............................................................................................................. 79 3.3.2.4 Contenido de LPS y pirogenicidad....................................................................................... 79 3.3.2.5 Contenido de endotoxinas ................................................................................................... 82 3.3.2.6 Inmunogenicidad.................................................................................................................. 83 3.3.3 Comportamiento general del efecto de la sacarosa en el proceso y conservación de las VME........................................................................................................................................ 84 3.3.4 Pre-estabilidad de las VME en sacarosa adsorbida en gel de hidróxido de aluminio .... 85 3.3.4.1 Comportamiento del pH ....................................................................................................... 85 3.3.4.2 Actividad endotóxica ............................................................................................................ 85 3.3.4.3 Inmunogenicidad.................................................................................................................. 86 3.3.4.4 Comportamiento general de la conservación de las VME en sacarosa adsorbida en HA como monograneles ........................................................................................................................ 86 3.3.5 Conclusiones parciales de la introducción de la sacarosa en la etapa de purificación y conservación de las VME ....................................................................................................... 88 3.4 Evaluación de las cepas epidémicas en el proceso de obtención de las VME.............89 3.4.1 Evaluación de las cepas a escala piloto ........................................................................ 89 3.4.2 Evaluación de las cepas NZ 98/124 y NZ 98/228 por la tecnología tradicional a escala industrial ................................................................................................................................. 92 3.4.3 Evaluación de la cepa NZ 98/228 .................................................................................. 92 3.4.3.1 Cinética de crecimiento........................................................................................................ 92 3.4.3.2 Comportamiento hidrodinámico en la etapa de concentración y lavado celular .................. 93 3.4.3.3 Rendimiento de biomasa y proteína vesicular purificada..................................................... 95 3.4.3.4 Comportamiento de las proteínas en las etapas de la purificación...................................... 95 3.4.3.5 Eliminación de contaminantes en las etapas de purificación de las VME............................ 97 3.4.3.6 Recobrado de proteínas en el paso de la diafiltración con sacarosa................................... 97 3.4.3.7 Identidad de los CPME en las VME purificadas................................................................... 97 3.4.3.8 Estructura vesicular y pirogenicidad .................................................................................... 97 3.4.4 Estudio de pre-estabilidad de las VME purificadas conservadas como monograneles100 3.4.4.1 Comportamiento del pH ..................................................................................................... 100 3.4.4.2 Actividad endotóxica .......................................................................................................... 100 3.4.4.3 Inmunogenicidad................................................................................................................ 100 3.4.5 Conclusiones parciales de la introducción de la cepa NZ 98/228 al proceso de obtención de VME................................................................................................................................. 102 3.5 Obtención de un nuevo candidato vacunal bivalente contra N. meningitidis serogrupo B a partir de VME ..................................................................................................................102 3.5.1 Antecedentes y beneficios esperados de una nueva generación de vacunas multivalente de VME................................................................................................................................. 102 3.5.2 Bases para el diseño y la composición de un candidato vacunal bivalente................. 105 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 3.5.3 Aspectos regulatorios incorporados al proceso de obtención del IFA que facilitan el cumplimiento de las BPF ...................................................................................................... 107 3.5.4 Inmunogenicidad de los monograneles, Men B bivalente y VA-MENGOC-BC® .......... 108 3.5.5 Comportamiento de los controles de calidad de lotes de VME purificados, monograneles y vacuna Men B bivalente..................................................................................................... 108 3.5.5.1 Establecimiento y comportamiento de las especificaciones de calidad y caracterización de las VME purificadas .................................................................................................................. 110 3.5.5.2 Establecimiento y comportamiento de las especificaciones de calidad y ensayos internos y de caracterización de los monograneles..................................................................................... 111 3.5.5.3 Establecimiento y comportamiento de las especificaciones de calidad, ensayos internos y de caracterización de la vacuna MenB bivalente........................................................................... 114 3.5.7 Estabilidad de vida de estante y estrés de monograneles de VME de las cepas CU 385/83 y NZ 98/228 ....................................................................................................................... 120 3.5.8 Estabilidad de vida de estante y estrés de la vacuna Men B bivalente a granel ........... 123 3.5.9 Conclusiones parciales de la obtención de un nuevo candidato vacunal bivalente contra cepas de N. meningitidis serogrupo B: .......................................................................................... 124 CONCLUSIONES ............................................................................................................ 125 RECOMENDACIONES ...................................................................................................... 126 REFERENCIAS BIBLIOGRÁFICAS .......................................................................................... I ANEXOS ............................................................................................................................ I CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Abreviaturas y Acrónimos 1D-E: Electroforesis unidimensional 2D-E: Electroforesis bidimensional ABS: Actividad bactericida del suero M/2: MC.6: MCC: AC: Anticuerpo (s) MCV4: AcM: ACN: AMH: AN: BC: BCA: BPF: CDC: Anticuerpo (s) monoclonal (es) Acetonitilo Agar Müller Hinton Ácido nucléico Bandas características Bicarbonato de Amonio Buenas Prácticas de Fabricación Centro de Control de Enfermedades de los Estados Unidos Cromatografía gaseosa Centro de Ingeniería Genética y Biotecnología Complejo de proteínas de membrana externa Dietanolamina Densidad óptica Desoxicolato de Sodio Dioetriol ME: Men B: MFM: MFT: MG: MLST: Mm: MS: Relación masa/carga Medio Catlin modificado Vacuna antimeningocócica serogrupo C conjugada Vacuna antimeningocócica conjugada contra los serogrupos A, C, Y y W135 Microscopia electrónica Meningitis B Medio Frantz modificado Microfiltración tangencial Monogranel (es) Tipos secuenciales de multilocus Masa molecular Espectrometría de masas NT: NST: No tipables No subtipables NIPH: Instituto Nacional de Salud Pública de Noruega Proteína (s) de membrana externa Organización Mundial de la Salud Polisacárido (s) capsular (s) Polisacárido (s) capsular (es) serogrupo B Polisacárido (s) capsular (es) serogrupo C Punto isoeléctrico Proteína (s) de membrana externa Huella de la (s) masa (s) de péptido CG: CIGB: CPME: DEA: DO: DOC: DTT: EDDA: EDTA EEM: ELISA: Ácido etilendiamino-dihidroxifenil acético Ácido etilendiamino tetracético Elctroforesis de enzima multilocus Ensayo inmunoenzimático EM: Enfermedad meningocócica ESI: ET: FC: Ionización por electronebulización Tipo (s) electroforético (s) Fracción (es) cromatográfica (s) HA: IFA: Hidróxido de aluminio Ingrediente (s) Farmacéutico (s) Activo (s) Gradiente inmovilizado de proteínas 2ceto octanato Limulus amoebocyte lysate Lipooligosacáridos (s) Lipopolisacárido (s) IPG: KDO: LAL: LOS: LPS: OMP: OMS: PC: PC-B: PC-C: PI: PME: PMF: (s) PNO: Procedimiento (s) Normalizados (s) de Operación PRH: Proteínas reguladas por el hierro RV: Región (es) variable (s) SDS-PAGE: Electroforesis en geles de poliacrilamida-duodecil sulfato de sodio ST: Tipos secuenciales Tris: Tris (hidroximetil) amino metano UE: UFT: VME: WB: Unidades endotóxicas Ultrafiltración tangencial Vesícula (s) de membrana externa Western blot INTRODUCCIÓN CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ INTRODUCCIÓN Neisseria meningitidis es el agente causal de la enfermedad meningocócica (EM), entidad clínica que constituye aún un importante problema de salud para diversas regiones del mundo, debido a su elevada tasa de morbimortalidad, sobre todo en la población infantil (Rosentein y col, 2001). Actualmente, ocurren alrededor de 1,2 millones de casos anuales con un estimado de 135 000 muertes (The Jordan Report, 2006). A pesar de que la incidencia de la EM es relativamente baja en comparación con otros procesos infecciosos de la infancia y de que existen tratamientos antimicrobianos efectivos contra la misma, esta entidad se caracteriza por su elevada mortalidad (10-20%) y las terribles secuelas permanentes que producen entre los sobrevivientes: amputación de los miembros, sordera y retraso mental, entre otras. (Duke y col, 2003; Offit y Peter, 2003). El meningococo es un diplococo gramnegativo aerobio, que posee una cápsula polisacarídica. La superficie del microorganismo está constituida por membranas (internas y externas) y entre ellas se sitúa una capa de peptidoglicano (Pollard y Frasch, 2001). La externa contiene fosfolípidos, lipopolisacáridos (LPS) y proteínas (PME). Los LPS y las PME son estructuras de una elevada complejidad antigénica que, al igual que los polisacáridos capsulares (PC), están involucradas en la patogenia e inmunidad de la EM. (Bröker, 2003; Perret y Pollard, 2005). Las características inmunoquímicas de los PC permiten dividir a los meningococos en 13 serogrupos. Los serogrupos A, B, C, Y y W135, ocasionan más del 90% de los casos notificados en el mundo. La enfermedad causada por los serogrupos A, C, Y y W135 se controla por vacunas de PC (Rosentein y col, 2001). Sin embargo, este tipo de vacuna contra el serogrupo B no produce una inmunidad adecuada, debido a la homología estructural que existe entre el PC del serogrupo B (PC-B) con los gangliósidos y las glicoproteínas fetales humanas (Jennings y col, 1986; Zollinger, 1998), situación que condujo a la evaluación de antígenos de superficie no capsulares capaces de estimular la respuesta bactericida específica, demostrándose que, cuando las PME se obtienen en forma de vesículas de membrana externa (VME) y se solubilizan con un PC las vacunas son inmunógenas (Zollinger y col, 1979, Helting y col, 1981; Frasch y col, 1982,) A partir de las VME se desarrolla en Cuba una vacuna contra el meningococo del serogrupo B, preparado vacunal que muestra una eficacia del 83% en los ensayos clínicos realizados en este país (Sierra y col, 1991). La aplicación masiva de este inmunógeno a toda la población comprendida entre los tres meses hasta los 24 años de edad durante el período de 1989 a 1991, fue capaz de controlar la epidemia de EM que afectó a Cuba en la década de los años 80 (Rico y col, 1994). Esta 1 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ vacuna conocida comercialmente como VA-MENGOC-BC® ha sido utilizada con buenos resultados para el control de brotes epidémicos ocurridos en Brasil, Colombia, Argentina y Uruguay. Hasta el presente, la aplicación de casi 60 millones de dosis permitieron el ingreso a Cuba de alrededor de 450 millones de USD. En el transcurso de las dos décadas posteriores a la introducción de VA-MENGOC-BC®, esta vacuna se mantiene como la de mayor eficacia luego de su amplia aplicación en América Latina. En la actualidad no existe ningún candidato vacunal que supere los resultados alcanzados con la misma, a pesar de los múltiples esfuerzos que realizan diferentes investigadores por obtener nuevas generaciones vacunales para uso universal, fundamentalmente, aquellas basadas en los procesos de recombinación genética (Danzig, 2004; Segal y Pollard, 2005; Perret y Pollard, 2005). No obstante, los resultados obtenidos con la aplicación de VA-MENGOC-BC®, el actual escenario epidemiológico y regulatorio internacional conducen al perfeccionamiento de la tecnología de producción establecida y a la búsqueda de una nueva generación de vacunas a partir de las VME debido a los siguientes aspectos: ¾ La disponibilidad del equipamiento tecnológico en el mercado, que facilita la realización de procesos productivos más eficientes y el cumplimiento de las Buenas Prácticas de Fabricación. ¾ El incremento de las exigencias regulatorias relacionadas con el conocimiento y la caracterización de las etapas del proceso y el producto, así como un estricto control para la introducción de cambios en los mismos. ¾ La situación epidemiológica internacional, luego de la introducción en Europa de una nueva generación de vacunas antimeningocócicas conjugadas contra el serogrupo C, hecho que condujo al incremento de la incidencia de EM por el serogrupo B. ¾ La necesidad de nuevas generaciones de vacunas contra el serogrupo B de perfil antigénico más amplio dada la aparición de nuevos clones epidémicos. Sobre la base de los antecedentes y problemática descrita anteriormente se postula la siguiente HIPÓTESIS: Mediante el perfeccionamiento de la tecnología de obtención de vesículas de membrana externa y la incorporación de nuevas cepas, es posible obtener candidatos vacunales contra el meningococo del serogrupo B, con perfiles antigénicos más amplios, acorde a la situación epidemiológica y regulatoria internacional. Introducción 2 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Para confirmar esta hipótesis; se trazaron los siguientes objetivos: OBJETIVO GENERAL: ¾ Obtener un nuevo candidato vacunal bivalente contra el meningococo del serogrupo B mediante el perfeccionamiento de la tecnología existente en el Instituto Finlay. OBJETIVOS ESPECÍFICOS: ¾ Perfeccionar la etapa de separación celular para aumentar la eficiencia del proceso y facilitar el cumplimiento de las Buenas Prácticas de Fabricación. ¾ Analizar los componentes proteicos de las VME purificadas mediante la electroforesis bidimensional y una plataforma de proteómica. ¾ Valorar el efecto de la sacarosa en la etapa de purificación y conservación de las VME. ¾ Seleccionar una cepa epidémica (B:4:P1.7-2,4) representativa del actual clon predominante en Europa que posibilite desarrollar el proceso de obtención de VME. ¾ Obtener un candidato vacunal a partir de la combinación de VME de la cepa de N. meningitidis cubana (B:4:P1.19,15) de reactividad cruzada demostrada y la cepa B:4:P1.7-2,4. El presente trabajo contiene el siguiente VALOR TEÓRICO – PRÁCTICO: ¾ La evaluación de los cambios al proceso y la demostración de equivalencia de las VME obtenidas con relación a la tecnología tradicional constituyó el ejercicio de comparabilidad más integral realizado en el Instituto Finlay, lo cual sirvió de base para establecer una política institucional en este sentido. ¾ El desarrollo y la aplicación de una metodología analítica de alta resolución como la electroforesis bidimensional y la combinación con la espectrometría de masas resultó la investigación mas profunda realizada en Cuba y el mundo para el análisis y la identificación de los componentes proteicos de las VME utilizadas como antígenos vacunales. ¾ La propiedad intelectual del concepto de una nueva generación de vacunas multivalentes contra el serogrupo B, basado en la utilización de VME, al menos una con actividad heteróloga como las obtenidas a partir de la cepa cubana CU 385/83 y otras VME de cepas prevalentes en epidemias de EM fueron reconocidas internacionalmente a través del otorgamiento de patentes en Europa y otros países. El presente trabajo contiene el siguiente VALOR ECONÓMICO Y SOCIAL: ¾ Los cambios introducidos en el proceso de obtención de VME posibilitaron la reducción del costo material en divisas de las VME empleadas como ingrediente farmacéutico activo (IFA) en un Introducción 3 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 48% y la disminución del presupuesto estimado para la remodelación de las instalaciones para la producción de la vacuna MenB bivalente en 750 000 USD. ¾ El desarrollo de la vacuna MenB bivalente y su aprobación para ensayos clínicos por las autoridades regulatorias europeas, posibilitó la primera introducción de un producto de la Biotecnología cubana en ese continente. ¾ Se estimó que una aplicación masiva de la vacuna MenB bivalente en Europa a los grupos susceptibles reduciría como mínimo un 70% de la incidencia de la EM por el serogrupo B. En el caso del Reino Unido se evitarían alrededor de 910 casos anuales. ¾ La futura introducción de la vacuna MenB en Europa traería un balance económico favorable al país, debido al relativamente bajo costo en divisas de los componentes empleados y el alto valor agregado de este tipo de producto. El presente trabajo contiene los siguientes aspectos que constituyen NOVEDAD CIENTÍFICA: ¾ Se desarrolló un nuevo y apropiado sistema de caracterización para la evaluación de las etapas principales del proceso de producción y el control de los cambios de mejoramiento, demostrándose que no hubo afectación en las características definitorias de las VME. ¾ Se presentó, por primera vez en el mundo, un análisis detallado de las proteínas presentes en las VME de N. meningitis del serogrupo B, mediante el uso de técnicas proteómicas. ¾ Se introdujo el concepto de conservación de las VME en sacarosa como monogranel adsorbido en Hidróxido de Aluminio (HA) concentrado para garantizar la estabilidad inmunogénica del IFA. ¾ Se desarrolló una metodología novedosa para la evaluación y caracterización de cepas epidémicas del serogrupo B, útil para la selección de nuevos candidatos vacunales, y se determinó sus posibilidades de introducción en los procesos de obtención de las VME ya establecidos. ¾ Se introdujo por primera vez en el mundo, el concepto de una nueva generación de vacunas basadas en VME de perfil antigénico más amplio, a partir de la combinación de una cepa epidémica de interés para un país o región con otra de actividad bactericida heteróloga demostrada, como la cepa vacunal cubana. Introducción 4 REVISIÓN BIBLIOGRÁFICA CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 1. REVISIÓN BIBLIOGRÁFICA 1.1 Características generales de la enfermedad meningocócica N. meningitidis, denominada también como meningococo, es el agente causal de la EM, proceso infeccioso que, por afectar principalmente a los niños pequeños, por la gravedad de su cuadro clínico, evolución severa, así como la elevada morbimortalidad que produce (Rosentein y col, 2001; Kvalsvig y col, 2003), constituye aún un problema de salud en diversas regiones del mundo. Se notifican alrededor de 1,2 millones de casos anuales y un promedio de 135 000 muertes (The Jordan Report, 2006). A pesar de que la incidencia de EM es relativamente baja cuando se compara con otras enfermedades infecciosas de la infancia, esta entidad clínica se caracteriza por su elevada mortalidad (10 – 20%) y el número considerable de individuos que pueden quedar con secuelas invalidantes: amputación de miembros, sordera, apoplejía, retraso mental, entre otras (Duke y col, 2003; Offit y Peter, 2003). La patogenia de la EM está muy relacionada con la colonización de la nasofaringe humana por el meningococo, situación que conduce al estado de portador asintomático y ocasionalmente, estos portadores pueden desarrollar un proceso clínico invasivo. Cuando N. meningitidis invade al huésped, atraviesa la mucosa de la nasofaringe y penetra al torrente sanguíneo, lugar donde se multiplica y disemina, por todo el organismo, originando una septicemia o meningococemia. Posteriormente, este microorganismo interactúa con las células endoteliales de los microvasos cerebrales, cruza la barrera hematoencefálica y ocasiona una meningitis o meningoencefalitis (Nassif y col, 2002; Taha y col, 2002). Sin embargo, a pesar de existir actualmente tratamientos efectivos con diversos agentes antimicrobianos para contrarrestar la gravedad clínica de los casos invasivos, en ocasiones, no es posible impedir la evolución fatal de algunos casos ni las temibles secuelas propias de la EM (Rosenstein y col, 2001). Las características de la EM obligan a tomar medidas coordinadas para evitar y controlar la diseminación de brotes y epidemias. Para lograr lo anteriormente expuesto es importante disponer, en primer lugar, de una rápida y certera capacidad diagnóstica sobre la base de una identificación primaria del agente causal, medidas que permitirán tomar acciones inmediatas y en segundo lugar, y con la misma prioridad, la caracterización de las cepas de N. meningitidis sobre la base de sus marcadores epidemiológicos es imprescindible para trazar una política adecuada de prevención, donde la vacunación ocupa un lugar predominante (Pollard y Frasch, 2001; Vázquez, 2002). 5 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 1.2 Estructura antigénica de N. meningitidis N. meningitidis es un diplococo gramnegativo, aerobio y con cápsula polisacarídica. Su superficie está constituida por dos membranas (interna y externa) y una capa de péptidoglicano (Pollard y Frasch, 2001) (anexo 1). El PC protege al meningococo de la acción del complemento e interfiere también la opsonización, mecanismos que evitan la fagocitosis y la lisis mediada por el complemento. La membrana externa cuenta entre sus componentes con fosfolípidos, LPS y PME. Las estructuras superficiales de N. meningitidis son decisivas en los mecanismos de adhesión, colonización, invasión y patogenia de la EM. Algunas de estas estructuras muestran una gran variabilidad de fases y permiten al meningococo no ser detectado por el sistema inmune del hospedero (Segal y Pollard, 2004). Durante su crecimiento, N. meningitidis libera fracciones intactas de su estructura superficial en forma de VME, éstas juegan un papel importante en la patogenia de la EM, son responsables de la variación de fase y de la mímica antigénica, así como se unen a los anticuerpos e intervienen en la inducción de la endotoxina mediadora de schock séptico (Poolman y col, 1995). Todas estas estructuras superficiales son inmunogénicas y constituyen la base para la selección de los antígenos vacunales (Bröker, 2003; Perret y Pollard, 2005) 1.3 Clasificación serológica de N. meningitidis Tomando en cuenta las características inmunoquímicas y antigénicas de sus PC, N. meningitidis se clasifica en 13 serogrupos. Los serogrupos se denominan con letra mayúscula (A, B, C, D, 29E, H, I, K, L, W135, X, Y y Z) y pueden identificarse por la técnica de aglutinación en lámina portaobjetos con antisueros serogrupos específicos (Joklik y col, 1998). Los serogrupos A, B, C, Y y W135 son los responsables de más del 90% de los casos de EM invasiva que se notifican en el mundo (Rosenstein y col, 2001). La diversidad antigénica de las PME de clase 2/3 (PorB) permiten la identificación de los serotipos. Estas proteínas tienen pesos moleculares de 40– 42 kDa y de 37– 39 kDa, respectivamente, son codificadas por el gen porB y están fuertemente representadas en la membrana externa, tienen función de porinas y se encuentran en todas las cepas de N. meningitidis donde son mutuamente excluyentes. Las PorB expresan 8 lazos variables que se exponen en la superficie celular y algunos se involucran en la formación de epítopes. Los lazos II y III son prácticamente invariables y la diversidad epitópica se encuentra en los lazos I y del IV al VIII (Poolman y col, 1995). Revisión Bibliográfica 6 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Los serotipos se identifican mediante un ensayo inmunoenzimático (ELISA) con anticuerpos monoclonales (AcM), designándose con un número arábigo. Las cepas que no reaccionan con los AcM disponibles en los paneles comerciales se denominan “no tipables” (NT) (Joklik y col, 1998). Hasta la fecha, se describen alrededor de 22 serotipos diferentes, entre los que se encuentran el 2, 4 y 15, serotipos vinculados principalmente con brotes y epidemias de EM (Caugant y col, 1998; Jensen y col, 2003). Se detectan anticuerpos contra las proteínas de clase 3 en pacientes y convalecientes de meningitis meningocócica, anticuerpos que alcanzan concentraciones máximas a las dos semanas del inicio de la infección y que luego declinan rápidamente (Guttormsen y col, 1993). La diversidad antigénica de la proteína de clase 1 (PorA), permite la clasificación de N. meningitidis en subtipos. Esta proteína es codificada por el gen porA y tienen pesos moleculares entre 43–47 kDa. La secuenciación genética de PorA brinda la información necesaria para establecer su modelo de organización dentro de la membrana externa. El modelo propone que esta proteína presenta una serie de plegamientos ß-anfipáticos que atraviesan la membrana externa y generan ocho lazos hidrofílicos expuestos en la superficie bacteriana. Las PorA presentan dos regiones variables (RV1) y (RV2), ubicadas en los lazos superficiales 1 y 4 del modelo propuesto (Poolman y col, 1995; Peeters y col. 1999). Cada región variable determina un subtipo, definido por reacciones específicas mediante ELISA con AcM y se designan también con un número arábigo, aunque precedido por el prefijo P1. Los serotipos más frecuentes en brotes y epidemias son los siguientes: P1.4, P1.16, P1.15 y P1.2 (Mastroniano y col, 2003). Estos epítopes inducen la producción de anticuerpos bactericidas en los humanos (Martin y col, 2000) y prevalecen en la respuesta inmune frente a las vacunas obtenidas a partir de VME (Zollinger, 1998). Es por esto que, vacunas que se encuentran en desarrollo y otras ya establecidas, incluyen a PorA como uno de sus componentes fundamentales (Sierra y col, 1991; Jodar y col, 2002). El panel de los AcM empleados para la sero/subtipificación es insuficiente y frecuentemente, las PorA no pueden ser identificadas y un número creciente de las mismas se clasifican como no subtipables (NST), ya sea porque esa variante no es reconocida, o porque no expresa PorA. Este grupo heterogéneo de aislamientos puede ser caracterizado tomando como base las secuencias aminoacídicas de las RV1 y RV2, por lo que se propone incluir en la nomenclatura del meningococo no sólo el resultado de la reacción de epítopes con AcM, sino también la secuenciación de las RV de PorA, resultado que puede compartirse entre todos los laboratorios a través de la página web para Revisión Bibliográfica 7 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Neisseria. Este método proporciona una información más confiable para el diseño de las vacunas basadas en las secuencias de PorA, que los análisis apoyados en las reacciones con AcM. Existen varias nomenclaturas propuestas que mantienen la designación convencional de la familia seguida de una identificación correspondiente a la nueva secuencia nucleotídica encontrada (por ejemplo: PorA RV2 P1.7-2 se describe en la literatura de manera variable como P1.7h y P1.7b) ( Suker y col, 1994;Sacchi y col, 1998; Maiden y col, 1999; Russell y col, 2004). La variabilidad antigénica de los LPS constituye la base del inmunotipaje. Se ha podido determinar que los LPS muestran un grupo de epítopes conservados con reactividad cruzada; mientras que otros son variables desde el punto de vista antigénico. Estos epítopes pueden variar en dependencia de las condiciones del cultivo, la expresión cuantitativa y cualitativa, no sólo entre cepas, sino también entre las diferentes bacterias de un mismo cultivo (Poolman y col, 1995). Los inmunotipos se designan con un número arábigo precedido por el prefijo L. Cada cepa de N. meningitidis expresa más de un epítope inmunotipo específico en su lipooligosacárido (LOS). Existen 13 determinantes diferentes de inmunotipo, estructuras que radican en la parte oligosacarídica de la molécula. Los determinantes de LOS identificados como L1,8,10 se expresan más en las cepas de portadores, mientras que la combinación L3,7,9 se detecta principalmente en los aislamientos de casos clínicos (Jennings y col, 1999). Los anticuerpos contra LOS son bactericidas, capaces de causar lisis celular y median la protección en las ratas durante los modelos experimentales de infección (Estabrook y col, 2004). Basado en las diferencias antigénicas de las estructuras superficiales (PC, PME y LOS) de N. meningitidis se utilizó un sistema de nomenclatura uniforme, semejante al esquema O:K:H empleado para Escherichia coli, donde el PC identifica a los serogrupos, las PME clase 2/3 a los serotipos, las PME clase 1 a los subtipos y los LOS a los inmunotipos. Un ejemplo de esta nomenclatura es la del fenotipo B:4:P1.19,15:L3,7,9 (Frasch y col, 1985). Durante muchos años las investigaciones epidemiológicas se basan sólo en la caracterización serológica como marcadores fenotípicos (Frasch, 2005), sin embargo a pesar de la ventaja de poder tipificar los microorganismos aislados, este método de clasificación muestra inconvenientes debido al gran número de cepas NT y la alta diversidad de PorA y PorB existentes, así como por las limitaciones con el panel de ACM disponibles (Feavers y col, 1999). Otra dificultad encontrada es la fuerte selección supuestamente impuesta por la respuesta inmune del huésped y la posibilidad de intercambio del ADN por la transformación de N. meningitidis (Maiden y Frosch, 2001). Estos factores suponen que la Revisión Bibliográfica 8 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ caracterización serológica es un indicador poco confiable de las relaciones genéticas (Caugant, 2002), por lo que a los marcadores fenotípicos deben incluírseles también el análisis del ADN (Vázquez y Berron, 2004). 1.4 Identificación genotípica de N. meningitidis Con el transcurso de los años, un clon de meningococo puede cambiar de serotipo o subtipo como consecuencia del frecuente intercambio genético entre ellos. La existencia de estas recombinaciones lleva a definir el concepto de complejos clonales, éstos representan grupos de clones distintos, aunque lo suficientemente próximos genéticamente para permitir el reconocimiento de un origen común. La tipificación de cepas de N. meningitidis por métodos moleculares es imprescindible en los estudios epidemiológicos de la EM (Caugant y col, 1987; Maiden, 1998; Jolley y col, 2002). Para la identificación genotípica se utilizan diferentes métodos y entre los más empleados se encuentran la “electroforesis de enzima multilocus” (EEM), técnica que reconoce los diferentes tipos electroforéticos (ET) sobre la base de una matriz completa de relaciones entre la diferente movilidad electroforética de un grupo de enzimas citoplasmáticas que se relacionan de manera directa con la variación de sus respectivos genes estructurales (Caugant y col, 1986) y la técnica de “multilocus sequence types” (MLST) (Maiden y col, 1998), método donde las variaciones en los diferentes locus se detectan de forma directa, por la secuenciación del ADN en los fragmentos de los genes seleccionados, permitiendo la identificación de los grupos de microorganismos con genotipos idénticos (clones) o altamente relacionados (líneas clonales), denominados tipos secuenciales (ST). El MLST muestra una alta correlación con los resultados obtenidos por la EEM, aunque presenta un mayor poder de discriminación. Estudios poblacionales, empleando la EEM y el MLST identifican grupos equivalentes de genotipos relacionados con un complejo clonal (Maiden y col, 1998), denominándoseles con las siglas ET o ST, respectivamente. Cada complejo clonal incluye todos los aislamientos que comparten los ET o alelos idénticos para cuatro o más locus MLST. Colecciones de cepas de N. meningitidis aisladas de portadores asintomáticos muestran una gran diversidad genética, mientras que, la mayoría de los meningococos asociados con los casos invasivos de EM, pertenecen a un limitado número de complejos clonales conocidos como linajes hiperinvasivos (Caugant y col, 1998; Maiden y col, 1998; Jolley y col, 2002). Los principales clones vinculados con casos de EM se clasifican como: complejo ST-1, complejo ST-4, complejo ST-5, complejo ST-8, complejo ST-11, complejo ST-32 y complejo Revisión Bibliográfica 9 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ ST-41/44 (Urwin y col, 2004). Este conocimiento pudiera simplificar el número de los antígenos requeridos para la obtención de una vacuna que brinde una protección cruzada contra todos los linajes hiperinvasivos (Perret y Pollard, 2005). La combinación de estas técnicas genómicas brinda información para un mejor entendimiento de la estructura poblacional y la epidemiología del meningococo del serogrupo B, así como para el desarrollo de vacunas con un perfil de protección cruzada más amplio (Perret y Pollard, 2005) 1.5 Epidemiología de la enfermedad meningocócica La EM se describe por Vieusseux en 1805, después de una epidemia que ocurre en Ginebra, Suiza. Sin embargo, no es hasta 1887, que Anton Weichselbaum observa los típicos diplococos gramnegativos de N. meningitidis en el fluido cerebroespinal de los casos clínicos y los designa como “Diplococcus intracellularis”. Posteriormente, en todos los continentes se notifican numerosas epidemias durante los últimos 200 años (Pollard y Maiden, 2004). La incidencia de EM varía de acuerdo con las diferentes regiones geográficas. Las mayores epidemias se presentan en el llamado “cinturón de la meningitis” del África subsahariana, zona donde prevalece el serogrupo A y el número de enfermos sobrepasa la cifra de 1 000/100 000 habitantes (Pollard y col, 2003). La EM tiene un comportamiento endémico en la mayoría de los países desarrollados con una prevalencia de los serogrupos B y C, mostrando una incidencia entre 1—5/100 000 habitantes. No obstante, en los países en vías de desarrollo, el número de casos notificados aumenta (10-25/100 000 habitantes), debido a la naturaleza endémica de la EM, donde ha existido una amplia variabilidad de la incidencia en el tiempo y en las diferentes regiones geográficas (Pollard y Maiden, 2004). El serogrupo A, principal agente etiológico de EM en Europa y Estados Unidos a principios del siglo XX se asocia con picos epidémicos ocurridos durante la I y II Guerra Mundial, pero después del año 1945, desaparece prácticamente de esas regiones (Rosenstein y col, 2001). Sin embargo, ocasiona la mayoría de los casos de EM de Asia y África, aunque, recientemente, en la región subsahariana se incrementan los casos producidos por N. meningitidis W135 (Pollard y col, 2003). Mientras que, el serogrupo Y asciende en Estados Unidos (9 al 34%) en la segunda mitad de la década de los años 90 (Rosenstein y col, 2001; Balmer y col, 2002) y en estos momentos, los serogrupos B y C se notifican principalmente en regiones de Europa, América y Oceanía (Balmer y col, 2002) (tabla 1). Revisión Bibliográfica 10 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Tabla 1. Distribución de los serogrupos aislados de casos de EM en algunas regiones del mundo, a finales de la década de los años 90. Región Inglaterra y Wales Nueva Zelanda Canadá Estados Unidos B (%) 54 87 48 33 C (%) 38 11 30 28 Serogrupos Y (%) 2 1 11 34 W135 (%) 3 0 4 2 Otros (%) 3 1 7 3 Se conoce que, según el agente etiológico de una epidemia de EM, su tiempo de duración varía. Las epidemias causadas por los serogrupos A y C se mantienen en una determinada región entre uno a tres años, pero las producidas por meningococos del serogrupo B, persisten entre cinco a 10 años o más. Al igual que sucede con otros serogrupos son los niños y adultos jóvenes la población más afectada durante las epidemias por N. meningitidis serogrupo B. En las últimas décadas se notifican epidemias por este serogrupo en Cuba, Noruega, Holanda, Irlanda, Reino Unido, Nueva Zelanda, Chile, Brasil y Uruguay (Perret y Pollard, 2005). Los datos epidemiológicos sugieren que la ecología natural de la EM trae aparejado variaciones en su incidencia a través del mundo, diferencias en la distribución de los serogrupos entre las regiones geográficas, así como cambios en la distribución de los mismos con el tiempo (Pollard y col, 2003). 1.6 Vacunas de polisacáridos capsulares La era moderna en el desarrollo de las vacunas antimeningocócicas se inicia a finales de los años 60, etapa donde los intentos para lograr vacunas de PC efectivas habían fallado porque esta estructura era depolimerizada durante los largos periodos de cultivo y de concentración de los caldos durante el proceso de purificación. Este fallo se resuelve con la incorporación de un detergente catiónico (cetrimida), compuesto que precipita rápidamente al polisacárido polianiónico en los caldos de cultivo de 12 a 15 h. de fermentación. Está bien documentado que las vacunas de PC de N. meningitidis de los serogrupos A y C, confieren protección contra la EM y se asocian con una inmunidad humoral, específicamente vinculada con la presencia de anticuerpos bactericidas presentes en el suero (Gotschlich y col, 1969). En la década de los años 80 estas vacunas se utilizan en todo el mundo, sobre todo en la esfera militar, mostrando su efectividad para el control de los brotes y epidemias. Posteriormente, se demuestra que los PC de los serogrupos Y y W135 son inmunológicamente similares a los Revisión Bibliográfica 11 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ serogrupos A y C (Cadoz, 1985). Sin embargo, el PC de N. meningitidis serogrupo B es pobre desde el punto de vista inmunogénico, por ser un polímero con enlace alfa 2-8 del ácido N-acetil neuroamínico (ácido siálico), tiene una marcada similitud con estructuras presentes en las células neuronales (N-CAM) de los tejidos cerebrales fetales y en los tejidos de los adultos, aunque en una menor cantidad (Jennings y col, 1986; Zollinger, 1998). Los polisacáridos bacterianos son antígenos timo independiente que producen su respuesta inmune a través de la estimulación de los linfocitos B maduros, propiedad que provoca una baja respuesta inmunológica entre los niños menores de dos años, ausencia de una respuesta de memoria, no confiere inmunidad duradera después de las vacunaciones sucesivas y no reduce el estado de portador nasofaríngeo en la población inmunizada (Ruggeberg y Pollard, 2004). Las vacunas que ofrecen una potente respuesta inmune en los niños pequeños son las compuestas por antígenos proteicos, inmunógenos capaces de inducir una respuesta timo dependiente (Baltimore, 2006). Los PC unidos de manera covalente con proteínas portadoras originan una nueva generación de vacunas, conocidas como “vacunas conjugadas”. La unión de ambas estructuras proporciona una respuesta inmune timo dependiente, ocasionando así una mejor respuesta primaria y anamnésica después de las sucesivas aplicaciones del antígeno (Baltimore, 2006). Además, por la inmunidad de rebaño que producen, disminuyen la colonización nasofaríngea por N. meningitidis (Segal y Pollard, 2004; Snape y Pollard, 2005; Baltimore, 2006; Keyserling, 2006) En el Reino Unido se licencia la primera vacuna conjugada de N. meningitidis preparada a partir del PC del serogrupo C (MCC). Este inmunógeno induce la producción de anticuerpos bactericidas que se correlacionan con los niveles de protección alcanzados en la población vacunada (Borrows y col, 2001; Andrews y col 2003). La MCC disminuye la proporción de portadores de N. meningitidis serogrupo C; posibilitando así una inmunidad de rebaño. La vacuna se aplica también en otros países de Europa y muestra similares resultados (Segal y Pollard, 2004; Trotter y col, 2004). Su aplicación cambió la situación presentada anteriormente en la tabla 1 y en la actualidad, la incidencia de EM ocasionada por N. meningitidis B es del 86% (Pollard, 2007). En el 2005, la FDA aprueba en los Estados Unidos, una vacuna antimeningocócica que incluye los PC de los serogrupos A, C, Y y W135 conjugados al toxoide diftérico. Este preparado vacunal se recomienda y emplea en la inmunización activa de los adolescentes y adultos de 11 a 55 años de edad (Pichichero, 2005; Kimmel, 2005; Baltimore, 2006). Revisión Bibliográfica 12 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Una vacuna de PC conjugado y adsorbido en HA contra el serogrupo B y que mostró una respuesta inmunogénica elevada en ratones (Fusco, 1997), no evidenció una adecuada inmunogenicidad en humanos (adultos). La respuesta se midió a través de anticuerpos funcionales (actividad bactericida, opsonofagocitosis y protección pasiva en animales) (Bruge y col, 2004). Además, por el temor que se desarrolle una posible autoinmunidad debido a la similitud del PC del serogrupo B con las estructuras presentes en las células humanas, es poco probable que las autoridades regulatorias autoricen la realización de ensayos clínicos en los adolescentes y niños pequeños, grupos poblacionales más afectados por la EM (Perret y Pollard, 2005) 1.7 Vacunas basadas en PME contra N. meningitidis serogrupo B Se demuestra que en los convalecientes de las infecciones causadas por N. meningitidis serogrupo B se producen anticuerpos contra los antígenos de superficie no capsulares, principalmente contra las PME, en especial hacia PorA. Este comportamiento hizo pensar que las vacunas basadas en estos antígenos de superficie, capaces de estimular una actividad bactericida, podrían ser inmunógenos efectivos en el control de la EM causada por el serogrupo B (Frasch y Chapman, 1973; Jones y Eldrige, 1979). Los primeros intentos de obtener preparados inmunogénicos a partir de PME fallaron, comportamiento atribuido a la presentación de los antígenos en forma particulada debido a la agregación de las PME. Cuando las PME se obtienen en forma de VME y se solubilizan con un PC de meningococo, las vacunas son inmunogénicas en humanos y provocan el incremento de la respuesta inmune luego de aplicar la segunda dosis, transcurridas seis a ocho semanas después de aplicar la primera (Zollinger y col, 1979; Helting y col, 1981; Frasch y Peppler, 1982). La adsorción del complejo de VME-PC del serogrupo C con el Hidróxido o Fosfato de Aluminio, incrementa de manera significativa la respuesta bactericida de los ratones contra las PME (Hang y Frasch, 1984). En la segunda mitad de la década de los años 80, se desarrolla en Cuba una tecnología de producción basada en los principios mencionados anteriormente. La vacuna antimeningocócica cubana se prepara a partir de VME de una cepa de N. meningitidis serogrupo B, clasificada fenotípicamente como B:4:P1.19,15, cepa que predomina y constituye el principal agente etiológico de la epidemia de EM de Cuba ocurrida en la década del 80. Las VME purificadas se solubilizan con PC del serogrupo C (PC-C) y el complejo así obtenido, se adsorbe en un gel de HA. Cada dosis de 0,5 mL contiene: 50 μg de proteínas de VME, 50 μg de PC-C y 2 mg de HA. Este candidato vacunal Revisión Bibliográfica 13 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ se administra en un ensayo clínico Fase 3 a los escolares con edades comprendidas entre 10 y 14 años. La vacuna fue segura y alcanzó 83% de eficacia (Sierra y col, 1991). Se demuestra por primera vez en el mundo, que los anticuerpos inducidos por antígenos de superficie (no capsulares) protegen contra la EM (Frasch, 1995). Paralelamente al ensayo cubano se valoran otros candidatos en Chile y Noruega, pero a partir de VME obtenidas de las cepas epidémicas de esas regiones. Sin embargo, los resultados alcanzados en esos países fueron inferiores a los obtenidos en Cuba (Zollinger, 1991; Bjune, 1991). 1.8 La epidemia de enfermedad meningocócica en Cuba y su control La epidemia de EM que afecta a Cuba durante la década de los años 80 se inicia en 1976, situación epidemiológica que se convierte en el principal problema de salud durante esa década y alcanza su pico máximo de incidencia (14,4/100 000 habitantes) en el año 1983 a expensa del serogrupo B (Valcárcel, 1991). El comportamiento fenotípico predominante de la epidemia de Cuba estuvo integrado por los siguientes marcadores epidemiológicos: serogrupo B (96,8%); serotipo 4 (85,7%); subtipo 19,15 (78,5%) y el inmunotipo 3,7,9 (85,7%) (Martínez, 2004). La cepa predominante se asocia con los complejos hipervirulentos ET-5 y ST-32 (Urwin y col, 2003, Urwin y col, 2004). La situación epidémica del país se controla por la campaña de inmunización masiva con la vacuna antimeningocócica cubana (VA-MENGOC-BC®), campaña realizada entre 1989 – 1991 en toda la población con edades comprendidas entre los tres meses y 24 años. En los estudios realizados a los niños con edades entre los tres meses y cinco años se constata una efectividad del 90% (Rico y col, 1992). Posteriormente, en 1991 VA-MENGOC-BC® se incorpora al Programa Nacional de Inmunizaciones y se logra reducir en unos pocos años la incidencia de EM, notificándose cifras inferiores a las descritas en la etapa pre-epidémica (Pérez y col, 2003). 1.9 Evaluaciones del post-licenciamiento de VA-MENGOC-BC en otros países La vacuna contra N. meningitidis serogrupo B, registrada con la marca VA-MENGOC-BC® es el producto líder de la Biotecnología de Cuba. Cuenta con Registro Médico Sanitario en 15 países y hasta la fecha, se han aplicado casi 60 millones de dosis, proporcionando al país ingresos superiores a los 450 millones de USD. Después de su licenciamiento en Cuba se utiliza para el control de brotes de EM en Brasil, Colombia, Argentina y Uruguay. También se ha sometido a diferentes estudios de seguridad, eficacia e inmunogenicidad con la participación del Centro de Revisión Bibliográfica 14 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Control de Enfermedades de los Estados Unidos (CDC) y la Organización Mundial de la Salud (OMS). VA-MENGOC-BC® es segura y bien tolerada. Los efectos adversos que se presentan después de su aplicación no son graves y los síntomas locales más frecuentes son: dolor, eritema e induración (Sierra y col, 1991; Perkins y col, 1998; Tappero y col, 1999). Los estudios clínicos demuestran que VA-MENGOC-BC® es efectiva para el control de brotes y epidemias de EM ocasionados por cepas homólogas y heterólogas. En Colombia, luego de su aplicación para controlar un brote epidémico por una cepa B:4:P1.19,15, se señala una efectividad del 95%, (Galeano, 1995) y en Brasil se demuestra igual eficacia contra cepas de N. meningitidis homólogas y heterólogas, aunque los resultados estuvieron relacionados con la edad, obteniéndose una mejor respuesta en los niños con más de cuatro años (De Moraes y col, 1992). Está bien documentado que VA-MENGOC-BC® induce una respuesta inmune protectora y que los anticuerpos bactericidas están dirigidos principalmente contra PorA, porina responsable de una inmunidad específica, pero por los resultados obtenidos en diferentes estudios se infiere que en esa protección participan también anticuerpos dirigidos contra otros antígenos presentes en las VME (diferentes PME no identificadas y LPS) (Milagres y col, 1994; Zollinger, 1998). Diferentes ensayos clínicos demuestran que en todas las edades de las poblaciones inmunizadas con dos dosis, VAMENGOC-BC® es inmunogénica y que la aplicación de una tercera dosis potencializa la respuesta inmune contra cepas homólogas. Frente a las diferentes cepas epidémicas heterólogas se observa un comportamiento similar en los niños y adultos, no así entre los lactantes (Tappero y col, 1999). En esos estudios, la inmunidad se evalúa a través de la actividad bactericida del suero (ABS) y se basan en los valores de corte establecidos (≥ 4) para las vacunas polisacarídicas. Sin embargo, en el caso de las vacunas de VME no está aún definido el nivel de corte, situación quizás relacionada con la no disponibilidad de un método estandarizado para medir la ABS (Holst y col, 2003), así como por la complejidad de las VME como antígeno multicomponente, la respuesta inmune dependiente de la edad y la situación epidemiológica del lugar donde se realiza el ensayo clínico (Balmer y col, 2004; Borrow y col, 2005), por todos esos inconvenientes, se considera como un sujeto respondedor, a todo individuo que incremente su título de ABS cuatro veces antes y después de la vacunación (Borrow y col, 2005). Otros métodos como la opsonofagocitosis y los modelos animales están en estudio con el objetivo de proponer posibles correlatos de protección (Perret y Pollard, 2005). Revisión Bibliográfica 15 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 1.10 Metodologías para la obtención de vacunas contra el serogrupo B a partir de VME 1.10.1 Selección de las cepas vacunales y aplicación del sistema de lotes de siembra Dada las características inmunogénicas de las vacunas de VME, en su producción se deben utilizar cepas de N. meningitidis aisladas de epidemias, denominadas como “tipo salvaje”. Entre las cepas predominantes se seleccionan alrededor de cinco y todas deben tener los mismos marcadores epidemiológicos de serotipo y serosubtipo del clon epidémico predominante, evaluándose su potencialidad de crecimiento y capacidad para la expresión de los antígenos de interés tales como: PorA, PorB y la PME de clase 5 (Opc), proteínas de alto peso molecular reguladas por hierro y LPS (L-3,7,9). Cuando se cuenta con una tecnología de producción establecida, lo ideal sería seleccionar al microorganismo que mejor se adapte a las condiciones del proceso (Frasch y col, 2001). En la producción de vacunas es importante mantener las características genéticas de la cepa para garantizar la consistencia de expresión de los antígenos de interés, en este sentido se establece la aplicación del sistema de lotes de siembra; procedimiento donde los cultivos de producción mantienen las mismas características de la cepa de origen, cepa que se emplea para el lote de siembra de referencia y a partir del mismo, se obtiene el lote de siembra de trabajo, utilizado para iniciar cada proceso. Este sistema garantiza un número de pases fijos entre el lote de referencia y los cultivos de producción (EC, 2007). 1.10.2 Medios de cultivo N. meningitidis es exigente en sus requerimientos nutricionales y requiere de medios de cultivo enriquecidos (Joklik y col, 1998). Para las vacunas de polisacáridos meningocócicos se recomienda el medio Agar Müller-Hinton (AMH) como el medio sólido a emplear en los primeros pasos de la producción (WHO Technical Reports Series, 1976). Otros autores refieren también el uso del Caldo Triptona Soya enriquecido con Extracto de Levadura (Frasch, 1990). Como medio líquido para la producción de inóculos y la fermentación de N. meningitidis, se recomienda el medio Frantz suplementado con un 2% de Extracto de Levadura dializado (WHO Technical Reports Series, 1976). Este medio se emplea por el Instituto Nacional de Salud Pública de Noruega en la producción de alrededor de 360 000 dosis de vacunas para los ensayos clínicos y el Instituto Finlay ha producido más de 60 millones de dosis. Revisión Bibliográfica 16 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Posteriormente, científicos de la firma Merck proponen el medio Catlin modificado (MC.6) para producir las VME empleadas como proteínas portadoras en la producción de la vacuna conjugada contra Haemophilus influenzae tipo b (Fu y col, 1995). El medio Catlin modificado tiene la ventaja de ser químicamente definido, diferenciándose así del medio Frantz, medio que por su origen biológico (contiene Extracto de Levadura), puede presentar algunas variaciones entre los lotes, sobre todo en cuanto a la potencialidad del crecimiento de N. meningitidis (Fu y col, 1995). El medio MC.6 es adecuado para el crecimiento de las diferentes cepas de meningococos y sus concentraciones de hierro pueden ajustarse para la expresión de las proteínas reguladas por el hierro (PRH) (Fu y col, 1995). Los meningococos requieren pequeñas cantidades de hierro para crecer, proporciones que pueden encontrarse en los medios de cultivo procedentes del agua y trazas presentes en algunos de los componentes de los mismos (Frasch y col, 2001). Debido a que las PRH constituyen antígenos de interés vacunal, se evalúa el Desferral y el ácido etilendiamino-dihidroxi-fenil acético (EDDA) como agentes quelantes del hierro soluble en los medios de cultivos, sustancias que favorecen su expresión. Sin embargo, en el caso del Desferral, se observa que este compuesto afecta el crecimiento normal de N. meningitidis. Su uso implica primero hacer crecer al meningococo en un medio con hierro y posteriormente dar un pase a medios desferrados, cultivos donde no se produce un crecimiento bacteriano detectable, pero se logra la expresión de las PRH (Brandileone y col, 1994). Los estudios mencionados se realizan a escala del laboratorio y en zarandas orbitales, desconociéndose hasta el presente, la factibilidad de su uso en los procesos a gran escala. Algunos autores demuestran que los cambios en la composición de las PME pueden ocurrir por modificaciones en los medios de cultivo. Así en el medio Frantz modificado, donde se substituye el ácido L glutámico y la L cisteína por el D glutámico y la D cisteína, respectivamente, se obtiene una mayor expresión de la proteína de 28 kDa con respecto a la de 41 kDa, proteína que se expresa en el medio original (Frasch y col, 1976). 1.10.3 Condiciones de cultivos Existen pocas referencias sobre las condiciones de crecimiento del meningococo serogrupo B en la obtención de los cultivos con fines vacunales. No obstante, la literatura especializada refiere que N. meningitidis se cultiva dentro de limites estrechos de temperatura (35 – 37 ºC) y pH (7,2 – 7,4). Revisión Bibliográfica 17 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Los cultivos en medio sólido precisan de una humedad elevada y una concentración de CO2 entre un 5 – 10% (Guibourdenche y Riou, 1997). Estudios preliminares realizados a escala de laboratorio comprueban que los cambios en la composición de las PME son cepa específica, aún dentro del mismo serotipo. Aunque, una misma cepa en diferentes condiciones de cultivo puede presentar variaciones en la composición de algunos de sus componentes de membrana (Frasch y col, 1972). Se señala que cuando en una misma cepa se emplea una alta aeración, el tiempo de duplicación es inferior y se incrementan ligeramente los rendimientos de la biomasa. Los cultivos con alta oxigenación producen una disminución menos brusca del pH, que aquellos que se cultivan con baja aeración, evidenciándose las diferentes rutas metabólicas involucradas en la degradación de la glucosa. Por otra parte, en los cultivos con una oxigenación elevada se favorece la expresión de las proteínas de 28 – 29 kDa, mientras que, en los cultivos con concentraciones bajas de oxígeno predominan las de 37 kDa (Frasch y col, 1976). En general, las condiciones óptimas del cultivo y la expresión de las PME son diferentes para cada cepa y deben determinarse experimentalmente (Frasch y col, 2001). Para los cultivos de N. meningitidis se recomiendan valores del 25% de oxígeno disuelto (Fu y col, 1995; Frasch y col, 2001). 1.10.4 Criterios de cosecha e inactivación Existe un criterio generalizado de realizar las cosechas del cultivo de N. meningitidis al final de la fase logarítmica del crecimiento o al inicio de la fase estacionaria (Campa y col, 1989; Fredriksen y col, 1991; Frasch y col, 2001). Con este criterio se logra una mayor uniformidad en los componentes de la membrana, pues en este estadío fisiológico, la mayoría de las células son viables. Las cosechas en los estadíos más avanzados de la fase estacionaria favorecerían la lisis celular y dificultarían la extracción de las VME, así como los posteriores procesos de purificación (Campa y col, 1989). De igual forma a la inactivación de otros meningococos, en el caso del serogrupo B se propone la inactivación a 56 ºC durante 30 minutos al final del cultivo y antes de realizar la extracción de las VME (Poolman, 1990; Frasch y col, 2001). Este criterio no es utilizado de manera uniforme, otros autores consideran más beneficioso realizar la cosecha y extracción de las VME a partir de los microorganismos vivos, preservando así la conformación nativa de los componentes de la membrana externa (Campa y col, 1989; Rosenqvist y col, 2001). En este caso se necesita demostrar Revisión Bibliográfica 18 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ que la inactivación de los cultivos se produce durante la etapa de extracción de las VME con Desoxicolato de Sodio (DOC) al 0,5% y se asegura que el producto esté inactivado antes de comenzar la etapa de purificación. 1.10.5 Métodos de separación de biomasa En la etapa de la cosecha de N. meningitidis serogrupo B y durante el desarrollo de las vacunas de VME, se emplea la centrifugación (Campa y col, 1989; Fredriksen y col, 1991), método que introduce el Instituto Finlay en la producción industrial de las vacunas. La centrifugación permite procesar grandes volúmenes de cultivo, aunque tiene la tendencia de formar espuma y atrapar aire, generando gran cantidad de aerosoles, situación que resulta peligrosa cuando se trabaja con materiales infecciosos. En la última década, la MFT se hace cada vez más atractiva para la separación sólido-líquido. Los procesos de MFT se basan en la constante recirculación de una suspensión celular a través de una membrana porosa, el filtrado pasa por los poros del filtro, dando como resultado neto, la concentración del material celular y la eliminación de los componentes solubles del medio (Carreré y col, 1996). En estos momentos, esta tecnología se convierte en una importante herramienta para la separación de las suspensiones biológicas y por las ventajas que presenta, desplaza a los métodos de separación convencional, destacándose entre los beneficios que aporta, la posibilidad de realizar operaciones asépticas sin la generación de aerosoles a través de un método validable desde el punto de vista de limpieza y proceso (PDA, 1992). 1.10.6 Extracción de VME N. meningitidis, al igual que otras bacterias gramnegativas, tiene la capacidad de liberar VME durante su crecimiento en los medios de cultivo, importante observación en el desarrollo de las vacunas, puesto que las VME pueden separarse de los caldos de cultivos y servir como material de partida para la obtención de los antígenos vacunales. Por otra parte, las VME pueden extraerse de la membrana externa con el uso de detergentes, maniobra que se facilita por la naturaleza débil de los enlaces presentes en la unión de las membranas (Frasch y col, 2001). Las cepas epidémicas evaluadas en el desarrollo de las vacunas contienen generalmente PC de alto peso molecular y alrededor de 500 μg de LPS por mg de PME. Con el objetivo de obtener vacunas, el contenido de LPS debe disminuirse para reducir la actividad endotóxica de los mismos, condición que puede lograrse mediante el tratamiento con detergentes, aunque para mantener la conformación Revisión Bibliográfica 19 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ bicapa de la membrana, tiene que retenerse en la misma, una cantidad mínima de LPS. Estas estructuras cuando se enlazan con la membrana son 100 veces menos tóxicas que los LPS libres. Su cantidad en la membrana puede reducirse hasta aproximadamente el 5% relativo a la proteína, sin afectar la estructura vesicular mediante la solubilización con el detergente DOC y aunque se podrían emplear otros detergentes, el DOC constituye una buena opción, por su efectividad y origen natural (obtenido del metabolismo de la bilis) (Frasch y col, 2001). El proceso de extracción de las VME debe realizarse con valores de pH cercanos a ocho, valores superiores muestran tendencia a la agregación. Por otra parte, si el pH baja a 7,5 ocurre una transición de forma y el número de agregados se incrementa rápidamente, formándose una gelificación durante la extracción. El tampón utilizado debe tener un pH que garantice elevar el de la suspensión celular desde los valores ligeramente ácidos a un pH entre 8,1 y 8,3 (Rosenqvist y col, 2001). Con este objetivo se recomienda un tampón Tris – EDTA para realizar la extracción con DOC al 0,5% en una relación 5:1 (V/P) (Helting y col, 1981). Luego de la extracción de las VME, los restos celulares se eliminan por la centrifugación. 1.10.7 Purificación de las VME Los métodos empleados para la purificación de las VME son la ultracentrifugación, la cromatografía y si el proceso lo requiere, se utilizan también enzimas (neuroaminidasa, benzonasa, DNAasa y RNAasa). Previamente se recomienda concentrar y diafiltrar el extracto para facilitar los pasos de la purificación (Campa y col, 1989; Frasch y col, 2001). En Cuba se utiliza la ultracentrifugación y la cromatografía de forma consecutiva, obteniendo VME purificadas con las características deseadas respecto a los contaminantes y su conformación vesicular (Campa y col, 1989). Mientras que, en Noruega, se utiliza la doble ultracentrifugación sobre un lecho de sacarosa al 20% (Fredriksen y col, 1991). Otros recomiendan utilizar el lecho de sacarosa al 60% (Poolman, 1990), método que se justifica para evitar las agregaciones de las VME durante este paso (Frasch y col, 2001). Luego del proceso de ultracentrifugación, las VME deben dispersarse nuevamente en un tampón apropiado. En el caso de la cromatografía se recomienda la exclusión molecular con una matriz de Sephacryl de los tipos S 300 Y S 400 (Campa y col, 1989; Frasch y col, 2001) Finalmente, en el proceso de purificación se debe eliminar el detergente y aunque, al inicio se utiliza la precipitación alcohólica de las VME en diferentes etapas del proceso, en la actualidad se teme que este método pueda desnaturalizar y afectar la conformación de las proteínas, sugiriéndose el Revisión Bibliográfica 20 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ cambio del tampón que contiene DOC, por sacarosa al 3% mediante un sistema de ultrafiltración tangencial (Frasch y col, 2001), método descrito por el NIPH de Noruega (Fredriksen y col, 1991). Durante el proceso de purificación es importante evitar la agregación para facilitar la filtración final de las VME (Campa y col, 1989; Frasch y col, 2001). 1.10.8 Diseño y formulación de las vacunas Hasta estos momentos, todas las vacunas de VME obtenidas y evaluadas en los principales ensayos clínicos contra N. meningitidis serogrupo B contienen HA (Sierra y col, 1991; Fredriksen y col, 1991), compuesto que se emplea como adyuvante de vacunas, por su demostrada seguridad en los humanos. La FDA de Estados Unidos acepta una cantidad máxima de hasta 0,85 mg de Aluminio/dosis. Las VME son buenas como inmunógenos e inducen la formación de anticuerpos bactericidas. Cuando estas VME se adsorben, se observa en los humanos un pequeño aumento de la inmunogenicidad. En la variante adsorbida con HA, la respuesta pirogénica de los conejos disminuye entre cuatro a 10 veces y también desciende la actividad endotóxica medida a través del “Limulus amoebocyte lysate” (LAL). Sin embargo, con la variante adsorbida se observan mayores efectos locales en los humanos, principalmente la sensibilización en el sitio de la inyección (Rosenqvist y col, 1998). La forma de HA que se utiliza como adyuvante es un gel compuesto por pequeñas partículas de un material microcristalino conocido como bohemita y que tiene una fórmula empírica de Al(O)(OH) (Hem y White, 1984). El adyuvante de HA tiene un punto isoeléctrico de 11,6, mostrando una carga positiva bajo condiciones fisiológicas y como las VME tienen carga negativa se adsorben satisfactoriamente al HA (Frasch y col, 2001). Las vacunas de uso parenteral empleadas en los ensayos clínicos contienen 25 ó 50 μg de proteína por dosis. La obtenida en Noruega (Folkehelsa) tienen una composición diferente a la de VA-MENGOC-BC®, diferencia que estriba principalmente en que no tiene PC y las VME se estabilizan en la formulación con sacarosa al 3% (Fredriksen, 1991). Mientras que, la concentración de HA es de 4 mg.mL-1 para VA-MENGOC-BC® y 3,33 mg.mL-1 para Folkehelsa (Campa y col, 1991; Fredriksen y col, 1991). Ambas vacunas utilizan una preparación comercial de HA (Alhydrogel Superfos, Biosector, Dinamarca), recomendada para minimizar las variaciones y evitar la ausencia de reproducibilidad de las diferentes preparaciones. El HA se puede esterilizar en autoclave, sin afectar su estabilidad (Burell y col, 1999). Revisión Bibliográfica 21 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 1.11 Controles de calidad de las vacunas de VME La compleja naturaleza de las vacunas de VME hace difícil el control de calidad de las mismas (Frasch y col, 2001). Hasta estos momentos, están caracterizados los antígenos mayoritarios que conforman las vacunas de VME más conocidas (Frasch y col, 2001; Martínez, 2002). No existen requisitos oficiales que establezcan las especificaciones de estas vacunas, pero el conocimiento brindado por el estudio de algunas, así como el consenso de una reunión de estandarización de vacunas de VME de N. meningitidis serogrupo B (OMS, 2000), permiten establecer criterios generales para facilitar la demostración de la consistencia productiva (Frasch, y col., 2001). Durante la etapa de fermentación, el cultivo se sigue a través de la densidad óptica (DO) u otra medida del crecimiento bacteriano. Debe también monitorearse la saturación del oxígeno (pO2) y el pH. Además, al final del crecimiento hay que chequear la pureza microbiana en los medios de cultivo enriquecidos y la composición antigénica a través del perfil electroforético de las PME por SDSPAGE e inmuno-blotting con el uso de monoclonales relevantes. Mientras que, en la etapa de inactivación se valida la eficacia del método utilizado, por siembra en los medios sólidos enriquecidos, con el objetivo de garantizar la ausencia de viables durante la purificación (Frasch, y col, 2001). Al final de la purificación se almacenan los sub-lotes y se realizan algunos métodos de control, indicativos de la eficiencia del proceso, tales como: la concentración de proteína y el patrón antigénico, así como el contenido relativo de LPS y PC (Campa y col., 1989; Fredriksen y col., 1991; Frasch y col., 2001). A partir de la mezcla de los sub-lotes se elimina el detergente y se obtiene el lote del IFA, generalmente precipitado en alcohol (Campa y col, 1989; Frasch y col, 1990) o estabilizado en sacarosa al 3% (Fredriksen y col, 1991). En dependencia del método utilizado en el paso final de la purificación, ciertos controles indicativos de las características definitorias de calidad de las VME del IFA son comunes (concentración de proteínas y su perfil electroforético, el patrón antigénico por inmunoblot, el contenido relativo de LPS, PC, ácidos nucleicos (AN) y (DOC). Además, se realizan métodos específicos que estarán en dependencia de la tecnología de producción empleada (concentración de sacarosa, esterilidad, y otros), según proceda. A la vacuna adsorbida en HA se le determinará el contenido de proteína, el porcentaje de adsorción y aluminio, así como el patrón antigénico, la inmunogenicidad, pH, esterilidad y la potencia (Frasch y col, 2001). Revisión Bibliográfica 22 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ El lote final se ensayará referente a la concentración de proteínas, perfil electroforético y patrón antigénico de las proteínas, contenido de endotoxinas, esterilidad, toxicidad inespecífica, pH y osmolalidad (Frasch y col, 2001). Al final, cada productor establecerá sus especificaciones de calidad, los controles de los procesos y los productos intermediarios acorde con las características de calidad diseñadas y evaluadas para su producto en los ensayos clínicos correspondientes (OMS, 2000). 1.12 Caracterización de las VME Debido a la complejidad de las VME respecto a su composición proteica se necesita ampliar la caracterización del producto con vistas a profundizar en el conocimiento de la consistencia productiva y en la respuesta inmune de estas vacunas, por las características de los antígenos multicomponentes que la conforman (Balmer y col, 2004; Borrow y col, 2005); donde además de las respuestas inmunoespecíficas a las proteínas mayoritarias que caracterizan la respuesta inmune a las mismas, se evidencian también respuestas heterólogas, que se incrementan cuando se emplean dosis repetidas del producto, aspecto relacionado con la presencia de componentes minoritarios no identificados hasta el presente, por los métodos convencionales utilizados en el control de las vacunas (Perkins y col, 1998; Tappero y col, 1999). En la última década, el rápido desarrollo de la Genómica facilita una mejor información sobre varias secuencias genómicas de N. meningitidis (Tettlein y col, 2000; Parkhill y col, 2000; Tettlein y col, 2004), recientemente, la aplicación de la electroforesis bidimensional (2DE) y la espectrometría de masas (MS) dan a conocer los proteomas de N. meningitidis de los serogrupos A y B (Bernardine y col, 2004; Mignogna y col, l2005). El mejoramiento de la solubilidad de las proteínas permite conocer los proteomas de la membrana de varias especies bacterianas, tales como: Staphylococcus aureus (Nandakunar, 2005), Leptospira interrogans (Nally y col, 2005), Helicobacter pylori (Baik y col, 2004), Synechocystis (Huang y col, 2004), Acinetobacter radioresistents (Pessione y col, 2003), Caulobacter crescentus (Molloy y col, 2002), E. coli (Molloy y col, 2001) y N. meningitidis (Sánchez y col, 2005). Los trabajos referidos anteriormente demuestran que existen herramientas disponibles para caracterizar los componentes proteicos de las VME. Revisión Bibliográfica 23 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ La microscopía electrónica (ME) de transmisión es una técnica empleada para corroborar la presencia de las VME durante los procesos del desarrollo y producción de una vacuna (Campa y col., 1989; Frasch y col., 1990; Fredriksen, 1991). 1.13 Regulaciones Farmacéuticas Dentro de las regulaciones farmacéuticas, las Buenas Prácticas de Fabricación (BPF) establecen un conjunto de lineamientos que garantizan las características de la calidad, seguridad y eficacia de los productos farmacéuticos (WHO Technical Report Series, 2003; CECMED, 2006). Asimismo, en la producción de biológicos, dada su variabilidad intrínseca, cada etapa del proceso estará bien caracterizada y se establecerán también los controles rutinarios para cada una de ellas, sobre todo los de los pasos críticos, éstos permitirán evidenciar que los procesos establecidos son reproducibles y consistentes, en tal sentido los parámetros de las operaciones críticas serán monitoreados. Por otra parte, los trabajos de calificación y validación demostrarán que los aspectos críticos de las operaciones de producción cumplen con las especificaciones de diseño (CECMED, 2006; EC, 2007). En la esfera de producción de los medicamentos pueden concebirse cambios en su fabricación con el propósito de mejorar la calidad, el rendimiento y elevar la eficiencia del mismo. Sin embargo, estos cambios pueden incidir en la calidad, seguridad y eficacia del producto (CECMED, 2003; EMEA, 2006a). Cuando se evalúa un cambio en una etapa del proceso, éste se debe comparar con el establecido durante la fabricación del producto, así como con las diferencias observadas en los atributos de calidad causadas por el cambio y su relación con la seguridad y la potencia, evaluación que se conoce como “ejercicio de comparabilidad”. La demostración de este ejercicio no significa que los atributos de calidad sean idénticos, pero sí que deben ser muy similares para asegurar que cualquier diferencia ocurrida no impacte negativamente en la seguridad y eficacia del producto. La comparabilidad debe realizarse en el IFA y en el producto terminado, a través de los atributos de calidad, análisis de los estadíos intermedios y los estudios de estabilidad de vida de estante, estrés y acelerada (EMEA, 2006a). Hasta hace poco tiempo, un cambio importante en la fabricación de un producto biológico requería invariablemente la realización de ensayos clínicos extensos para determinar que el mismo mantenía los atributos de seguridad y eficacia característicos (CECMED, 2003). Actualmente, se considera la Revisión Bibliográfica 24 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ realización de ensayos clínicos cuando en los estudios de comparabilidad no queda claro que se mantuvieron las características de seguridad y eficacia del producto (EMEA, 2006a). En la evaluación de los cambios se empleará un producto de referencia, denominado como “innovador o líder”. Este producto fue el primero en autorizarse para su comercialización (generalmente como producto patentado) sobre la base de los estudios de eficacia, seguridad y calidad (CECMED, 2003). Para confirmar la calidad de los IFA y el producto terminado se establecen especificaciones de calidad, detalles que se focalizan en las características moleculares y biológicas encontradas y que resulten útiles para certificar la seguridad y eficacia del producto. La racionalidad usada para establecer los rangos de especificación se debe escribir y los ensayos empleados son un producto específico. Los criterios de aceptación se establecen y justifican de acuerdo con en los datos obtenidos en los lotes usados en los ensayos preclínicos o clínicos, así como en los datos de los lotes de consistencia, los estudios de estabilidad y otros datos relevantes del desarrollo. En las especificaciones se deben incluir criterios tales como: apariencia, descripción, identidad, pureza e impurezas, potencia y cantidad. Generalmente, algunos métodos referidos en las farmacopeas son aplicables como: esterilidad, endotoxina y volumen del contenido (EMEA, 1999). Hasta hace poco tiempo el tema de la estabilidad de las vacunas sólo estaba contenido dentro de las regulaciones establecidas para los productos Biológicos/Biotecnológicos. En tal sentido, la información que avala el tiempo y las condiciones de almacenamiento debe partir de estudios de estabilidad realizados a largo plazo y con las condiciones reales. Se deben realizar estudios de estabilidad a tres lotes de IFA y a igual número del producto en su envase final, sobre la base de un perfil indicativo de la estabilidad, que brinde la seguridad de que los cambios en la identidad, pureza y potencia serán detectados. Se recomienda la realización de ensayos acelerados y de estrés ya que los primeros aportan una valiosa información en la evaluación preliminar de cambios en la producción, la formulación, el escalado y los perfiles de degradación; por otra parte los ensayos de estrés brindan información del comportamiento del producto ante períodos cortos fuera de las condiciones de almacenamiento establecidas, lo que ayudaría a la predicción de sus afectaciones ante fallos durante la transportación (ICH, 1995; CECMED, 2000). Recientemente la OMS publica una guía sobre la evaluación de la estabilidad de vacunas y en ella se consideraron las ya existentes para la evaluación de la estabilidad de productos biológicos, guías generadas por la Conferencia Internacional de Armonización (ICH), así como otros documentos de la Revisión Bibliográfica 25 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ OMS en este campo. El documento no intenta establecer conflictos con algunos de las regulaciones existentes, sino que las complementa con las consideraciones específicas pero dirigidas a las vacunas (WHO, 2006). La nueva guía OMS crea expectaciones regulatorias para conducir los estudios de estabilidad de las vacunas en las diferentes etapas de desarrollo tales como: aprobación de ensayos clínicos, licenciamiento, liberación de lotes y monitoreo post-licenciamiento. El documento posibilita a los productores utilizar el método tradicional basado en el cumplimiento de los criterios de aceptación de las especificaciones en un estudio de estabilidad de vida de estante en condiciones reales que avale el tiempo y las condiciones de almacenamiento, proponiendo un nuevo método a través de las evaluaciones estadísticas para definir un tiempo de expiración a través de la extrapolación de datos. El productor es alentado analizar con las autoridades regulatorias desde los inicios del proceso de desarrollo de la vacuna, el diseño y los datos para el análisis que más se ajuste al producto en cuestión, para avalar la estabilidad de la vacuna (WHO, 2006). Los productos en desarrollo para poder utilizarse en los ensayos clínicos deben producirse de acuerdo a los principios y las guías detalladas de BPF de medicamentos, donde se tenga en consideración una justificación de que el producto es seguro de acuerdo con el uso previsto (EMEA, 2006b). 1.14 Tendencias en el desarrollo de vacunas contra el meningococo serogrupo B Las vacunas de N. meningitidis serogrupo B basadas en las VME, contienen muchos componentes de la membrana externa tales como: PorA (clase 1), PorB (clase 3), RmpM (PME clase 4), Opc (PME clase 5), Opa (proteína de opacidad), FetA (FrpB, proteína regulada por hierro) y LPS (Campa y col, 1989; Martínez, 2002; Holst y col, 2005), cada uno de estos antígenos necesita estudiarse con profundidad, puesto que, dentro de ellos existen diferentes grados de variabilidad antigénica y se hace difícil una comprensión adecuada de sus diferentes mecanismos de protección (Frasch y col, 2001). Está bien demostrado que las vacunas de VME muestran mejores resultados que las obtenidas por ingeniería genética, al parecer, este comportamiento está vinculado con el mantenimiento de la estructura conformacional nativa de las PME (Danzig, 2004; Segal y Pollard, 2005; Perret y Pollard, 2005). Revisión Bibliográfica 26 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Vacunas recombinantes basadas en seis y nueve subtipos de PorA, presentada en forma de VME y obtenidas a partir de dos o tres cepas de N. meningitidis serogrupo B, compuesto donde se eliminaron los genes porB y rmpm, muestran una inmunogenicidad débil y variable a los diferentes subtipos que conforman las vacunas en los ensayos clínicos realizados después de la aplicación de tres dosis con refuerzo en el segundo año de vida (Bröker, 2003; Perret y Pollard, 2005). Otras PME menos variables que PorA y PorB, la lipoproteína de unión a la transferrina B (tbpB) y la conocida como la proteína A de la superficie de Neisseria (NspA), con función desconocida, han sido también estudiadas. Estas PME se expresan de forma minoritaria durante el crecimiento del meningococo serogrupo B pero se han obtenido por ingeniería genética y se han evaluado en modelos animales y ensayos clínicos en humanos. Los resultados de estos ensayos evidencian que la tbpB recombinante logra inducir anticuerpos bactericidas en los modelos animales, pero al evaluarse en humanos, muestra una respuesta débil de anticuerpos (Danzig, 2004; Perret y Pollard., 2005). La NspA recombinante, por su parte, produjo anticuerpos en animales, aunque éstos fueron bactericidas contra sólo el 50% de las cepas de meningococo serogrupo B, tan diversos genéticamente (Danzig, 2004). Estudios clínicos de la proteína recombinante notificados recientemente, no señalan anticuerpos bactericidas en los vacunados (Halpering y col, 2007). La variabilidad en las proteínas de superficie de N. meningitidis, resultante de su alta recombinación espontánea, la velocidad de mutación y la presión inmunológica sobre los epítopes expuestos, hace pensar que una sola proteína purificada no es capaz de inducir una vacuna con reactividad cruzada (Segal y Pollard, 2005). N. lactámica, una especie comensal de la familia Neisseriaceae y perteneciente al género Neisseria, se asocia con una inmunidad natural contra la EM. Actualmente, existe la hipótesis que sus antígenos son útiles para el desarrollo de vacunas contra N. meningitidis serogrupo B y con este criterio se evalúan candidatos vacunales en los animales (Li y col, 2006). Una nueva vacuna desarrollada a partir de las VME de una cepa del serogrupo B (B:4:P1.7-2,4), aislada en Nueva Zelanda, se aplica para controlar una epidemia de carácter clonal que existe en ese país, región donde predomina el fenotipo B:4:P1.7-2,4. La vacuna demuestra inmunogenicidad en los lactantes, niños y adultos jóvenes (Wong y col, 2007; Oster y col, 2007) y se espera que ofrezca una protección cruzada limitada, aunque no existen evidencias que apoyen el uso de esta vacuna en otras regiones (Segal y Pollard, 2005). Revisión Bibliográfica 27 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Existe un nuevo enfoque para obtener una vacuna universal contra todos los serogrupos de N. meningitidis basado en las VME que contengan las estructuras antigénicas de PorA, PorB y FetA, proteínas observadas con mayor frecuencia en los linajes hipervirulentos causantes de epidemias. Se describe un trabajo de diseño con una combinación de VME procedentes de cepas con seis PorA y cinco FetA diferentes, antígenos que podrían generar una respuesta inmune homóloga frente a 78 aislamientos examinados (Urwin y col, 2004), aunque no existen aún reportes experimentales de este posible candidato. También se trabaja para introducir en FetA, por ingeniería genética epítopes conservados con actividad bactericida (Kortekaas, 2007). En estos momentos se explora también la obtención de vacunas basadas en el genoma, sitio donde, determinando las secuencias genómicas del microorganismo, se identifican las secuencias de proteínas candidatas como antígenos vacunales, método que se conoce como vacunología inversa (Poolman y Berthetty, 2001; Pizza y col, 2007). Aunque, muchas nuevas proteínas se describen desde un enfoque genómico, no está claro todavía cuáles de las identificadas por esta vía, provocarían una ventaja significativa sobre las proteínas descritas con la aplicación de los métodos convencionales y obtenidas en la década de los años 80 (Danzig, 2004; Perret y Pollard, 2005). Luego de analizar la situación actual del desarrollo de vacunas contra N. meningitidis serogrupo B, se puede concluir que, a corto y mediano plazo no se vislumbra el antígeno universal para el control de la EM causada por este serogrupo. Después de la obtención de las vacunas de VME, éstas continúan como la única opción disponible para los controlar brotes y epidemias de EM ocasionadas por el N. meningitidis serogrupo B. Sin embargo, en los próximos años se espera que una nueva generación de vacunas de VME mejoradas continúen evaluándose en los estudios clínicos de Fase II ó III (Perret y Pollard, 2005). Dentro de estas vacunas, VA-MENGOC-BC® es la única utilizada ampliamente en el control de varios brotes epidémicos, mostrando una respuesta inmune heteróloga superior a la vacuna de Noruega (Folkehelsa) (Perkins y col, 1998; Tappero y col, 1999). La adecuación de la vacuna cubana a las condiciones epidemiológicas y regulatorias internacionales, podría ampliar su uso global. La filosofía de diseño explicada anteriormente, no está en contra del criterio de otros autores, quienes piensan que dado el carácter clonal prolongado de las epidemias, las vacunas que contengan VME procedentes de una o dos cepas, pueden brindar una amplia cobertura para una Revisión Bibliográfica 28 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ región y momento determinado, pero como estos clones cambian en el tiempo y las regiones, se considera oportuno que los procesos de producción sean lo suficientemente robustos para ser usados por varias cepas epidémicas del serogrupo B, con el objetivo de convencer a las autoridades regulatorias de licenciar un proceso en general, no para una cepa específica. Este concepto es análogo al de la vacuna del virus de la influenza, donde la cepa de producción puede cambiarse todos los años, en dependencia de la situación epidemiológica (Frasch y col, 2001). Luego de la inmunización masiva con las vacunas conjugadas del serogrupo C en Europa y la ACYW135, en Estados Unidos con la consiguiente disminución de los portadores, existe la preocupación de que el meningococo serogrupo B ocupe los nichos ecológicos dejados por los otros serogrupos (Segal y Pollard, 2004). Se conoce que los meningococos intercambian alelos y pueden cambiar de serogrupos. Se describe que, posterior a una campaña de vacunación contra el serogrupo C, donde se administró una vacuna plana de PC en una epidemia de MenC por el clon ST-11, se constató el efecto “switch” capsular de las cepas, y a partir de esa aplicación comienza una mayor circulación de cepas pertenecientes al serogrupo B (Segal y Pollard, 2004). Estas dos observaciones hacen aún más evidente la necesidad de contar con vacunas que puedan combatir las nuevas epidemias. Revisión Bibliográfica 29 MATERIALES Y MÉTODOS CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 2. MATERIALES Y MÉTODOS 2.1 Metodología analítica 2.1.1 Determinación de la densidad óptica de los cultivos La DO de los cultivos se midió a una longitud de onda de 530 nm Las muestras se diluyeron hasta lograr valores menores o iguales a 0,3. 2.1.2 Determinación de la pureza microbiana 2.1.2.1 Determinación por observación microscópica La pureza de los cultivos se determinó por extensiones de los mismos en láminas portaobjetos coloreadas por la tinción de Gram, utilizando Safranina al 1% como colorante de contraste. Posteriormente, las láminas se observaron al microscopio óptico y N. meningitidis se presentó en forma de diplococos arriñonados gramnegativos. Se observaron como mínimo, 100 campos por muestra. 2.1.2.2 Determinación por siembra en medios de cultivo Se realizó por siembra del cultivo por duplicado en el medio Agar Triptona Soya incubándose a 32 ± 2 ºC y 23 ± 2 ºC por un período de 72 horas. 2.1.3 Determinación de las proteínas La concentración de las proteínas se determinó por el método espectrofotométrico de Lowry (1951) acorde a los Procedimientos Normalizados de Operación (PNO) 12-004 y 12-223, a una longitud de onda de 750 nm La curva patrón se realizó a partir de una solución de albúmina de suero bovino (BSA) 0,2 mg.mL-1. 2.1.4 Electroforesis en geles de poliacrilamida con SDS y ß-mercaptoetanol El procedimiento se realizó según lo sugerido por Laemmli (1970), y aplicado para la identificación del CPME de N. meningitidis por Tsai y Frasch (1980) acorde a los PNO 12-114 y 12-225. Se utilizó un sistema de geles discontinuo con un gel separador al 12,5% y un gel concentrador al 5,0%. Antes de aplicarse, las muestras se ajustaron a una concentración cercana a 1mg.mL-1 y posteriormente se trataron con un agente reductor (ß-mercaptoetanol), compuesto que provocó la disociación de las proteínas en subunidades polipeptídicas. La solución de tratamiento contenía: Tris-HCl 0,1 mol.L-1 (pH = 6,8), ß-mercaptoetanol (1%), SDS (2%), Glicerol (0,1%), Bromofenol Azul (0,1%). La relación muestra solución de tratamiento fue de 1:1. 30 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Se emplearon patrones de masas moleculares (14,4 kDa hasta 94 kDa) de la firma Pharmacia o patrones de referencia interno, éstos recibieron el mismo tratamiento que las muestras. Las muestras se calentaron a 100 ºC durante cinco minutos y se aplicaron 10 μL de cada una. La corrida se realizó a 220 V, 35 mA, 60 Watt. La tinción de las bandas se realizó durante una hora con una solución colorante que contenía: Azul Coomassie (0,1%), Metanol (40%) y Ácido Acético (10%). Posteriormente, se decoloraron con una solución de Metanol (40 %) y Ácido Acético (10%). 2.1.5 Determinación del peso seco Esta determinación se realizó luego de tres lavados sucesivos de la muestra con agua destilada, y la masa entre los lavados se separó por centrifugación a 10 000 r. p. m. por 20 minutos a 4 ºC. Las muestras lavadas se resuspendieron a su volumen inicial con agua destilada y se aplicaron a una balanza de peso seco Sartorius, MA 30, donde se secaron a una temperatura de 130 ºC durante 30 - 40 minutos. 2.1.6 Determinación del LPS La concentración de LPS se determinó por el método de Osborn (1963) acorde al PNO 12-056, mediante la cuantificación del KDO, compuesto que representó el 5% de su composición total. Las muestras se sometieron a una hidrólisis ácida con calentamiento, proceso que generó la liberación de sus unidades de KDO, los que reaccionaron con Periodato de Sodio y se oxidaron. Posteriormente, se produjo una reacción entre el KDO y el Ácido Tiobarbitúrico, generándose cromóforos de color rosado que absorbe a 548 nm. Como estándar se utilizó el 2 Keto-octanato. 2.1.7 Determinación del polisacárido La concentración del polisacárido se determinó por el método de Svennerholm (1957) de acuerdo al PNO 12-319, basado en que los PC de los serogrupo B y C son polímeros del ácido N acetil neuroamínico (ácido siálico) y este compuesto en medio ácido y calor sufre una hidrólisis, donde los monómeros del mismo y el resorcinol en presencia del Sulfato Cúprico, forman un complejo azul con máxima absorbancia de 580 nm. Se utilizó como estándar un polisacárido C (PC-C), ajustado previamente con ácido N acetil neuramínico. Materiales y Métodos 31 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 2.1.8 Determinación del ácido nucleico La presencia de los anillos purínicos y pirimidínicos en la estructura de los ácidos nucleicos permite la absorción en la zona ultravioleta del espectro con un máximo a 260 nm. Se empleó una solución de referencia de ácido ribobonucleico (WHO Technical Report Series, 1976) de acuerdo al PNO 12-065. En la presencia de proteínas las muestras deben ser previamente desproteinizadas. 2.1.9 Microscopía electrónica de las VME Se empleó la técnica de tinción negativa con Acetato de Uranilo al 2% en una rejilla de membrana formvar. Se utilizó un microscopio electrónico de transmisión Yeol-Yem 2000EX. Las microfotografías se realizaron con una ampliación de 40K. 2.1.10 Identificación de las proteínas por Western-blot El método se realizó según Estrada (1995) como se refiere en los PNO 12-149 y 12-201, método que combina la alta resolución del SDS – PAGE para separar las proteínas de acuerdo a sus pesos moleculares con la especificidad de la detección inmunoquímica de anticuerpos específicos presentes en los sueros en contacto con ellas. Se detectaron las bandas para cada anticuerpo específico contra cada una de las proteínas separadas electroforéticamente, con el uso de una gamma globulina (material de referencia interno) y un sistema revelador compuesto de un conjugado anti IgG-enzima humana peroxidasa y la Diamino-benzidina como sustrato específico. Cuando se utilizaron los AcM las bandas se visualizaron a través de la reacción con un sistema anti IgG de ratón peroxidasa y la Diamino-benzidina como sustrato. 2.1.11 Determinación de la antigenicidad de las VME in vitro por ELISA de inhibición El ensayo de ELISA por inhibición se diseñó para evaluar si los cambios del proceso afectaban el reconocimiento del antígeno vacunal proteico, por los anticuerpos específicos de la especie a quien iba destinada la vacuna. El método se llevó a cabo a partir de una preparación de las VME de referencia, la que se diluyó con tampón carbonato-bicarbonato 0,05 M pH, = 9.6 para una concentración final de 20 μg.mL-1. Se adicionó 100 μL de las VME diluidas a cada uno de los pocillos de una placa de poliestireno (Nunc, Maxisorp) y se incubó toda la noche de 2 – 8 ºC. Las VME a evaluar se prepararon a una concentración de 100 μg.mL-1, se le realizaron diluciones con factor 2, desde 1:16 hasta 1:512, en tampón fosfato salino (PBS, sin Tween 20) y la inmunoglobulina antimeningocócica humana de referencia se diluyó 1:100 en el mismo tampón. Se tomaron 200 μL de cada dilución de la vacuna y se mezclaron con 200 μL de la inmunoglobulina diluida, y se incubó Materiales y Métodos 32 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ durante toda la noche a una temperatura de 20 - 25 0C, para que los anticuerpos específicos se unieran a los antígenos presentes en las VME; al día siguiente los 400 μL de cada mezcla del antígeno-inmunoglobulina se diluyeron con 400 μL de leche descremada (6%) en PBS-Tween 20. La solución de inmunoglobulina (1:100) se diluyó 1:200 con el mismo diluyente y posteriormente, se le realizaran diluciones seriadas con factor 2 hasta 1:6 400, con leche descremada (3%) en PBSTween 20. En todos los pasos donde procedió, se realizaron cuatro lavados con agua destiladaTween 20 (0,05%). A la placa de reacción se le adicionó, por duplicado, 100μL de cada dilución de las VME y de la inmunoglobulina de referencia, luego se incubó a 37 ºC durante una hora. Después se añadió conjugado anti IgG humana cadena gamma específica-fosfatasa alcalina (Sigma) diluido 1:2 y se incubó de igual manera que las muestras. Posteriormente, se añadió el sustrato p-nitrofenilfosfato (Sigma), 1 mg.mL-1 en solución de dietanolamina (pH = 9,8), el cual se incubó aproximadamente 30 minutos a la temperatura del laboratorio (20 - 25 ºC), de modo que el punto máximo de la curva de la inmunoglobulina de referencia alcanzara un valor de absorbancia de 1,3 a 1,6 cuando la placa se leyera a 405 nm. Posteriormente, se calculó el porcentaje de la actividad antiproteínas B para cada dilución de la vacuna con relación a la inmunoglobulina de referencia, a la cual se le adjudicó el 100% de la actividad. El porcentaje de inhibición de cada dilución de la vacuna se calculó mediante la resta a 100, valor del porcentaje de la actividad de los anticuerpos correspondientes. El ensayo se consideró satisfactorio cuando las curvas de inhibición de las formulaciones paralelas (producidas a partir de lotes de las VME obtenidos por la tecnología tradicional y después del cambio a evaluar), presentaron el mismo comportamiento y el 50% de inhibición estuvo incluido entre las mismas. 2.1.12 Determinación de la actividad de los anticuerpos IgG antiserogrupo B por ELISA Se empleó el método de Peppler y Frasch (1982), según los PNO 12-045 y 12-219, con la utilización de IgG purificadas de ratón antimeningococo B, utilizadas como material de referencia en el rango de 0,39 a 25 UIgG. Se aplicó la dosis a evaluar del preparado vacunal a 10 ratones BALB/c hembras con un peso entre 17 y 22 g y se realizó la medición de la respuesta inmunogénica 21 días después, se utilizaron como controles del ensayo una cantidad igual de animales. Los resultados se expresaron como UIgG.mL-1 o a través del porcentaje de animales respondedores. Materiales y Métodos 33 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Para la determinación de los anticuerpos se distribuyeron, en todos los pocillos de una placa de microtitulación, 100 μL de una solución de sensibilización (VME purificadas del meningococo B, diluidas con solución reguladora de carbonato-bicarbonato 0.005 mol.L-1) y la placa se mantuvo toda la noche en cámara húmeda (2 – 8 ºC). Luego se atemperó 30 minutos y se realizaron cuatro lavados durante 10 segundos, cada vez, con 300 μL por pocillo de Tween 20 (0,05%), tal como se describió anteriormente. Se añadió, por duplicado, 100 μL de las muestras diluidas previamente con la solución reguladora de fosfatos y leche descremada (3%) y se incubó a 37 ± 1 ºC, durante una hora en cámara húmeda. Se realizaron cuatro lavados con Tween 20 (0,05%) como se describió anteriormente. Se añadieron 100 μL del conjugado anti IgG de ratón, cadena gamma específica (Sigma), con fosfata alcalina, diluido previamente con solución reguladora de fosfatos y leche descremada al 3% y se incubó nuevamente a 37 ± 1 ºC durante una hora. La placa se lavó como ya se describió. Se añadieron 100 μL del sustrato (p-nintrofenilfosfato 1 mg.mL-1) y se incubó en la oscuridad en cámara húmeda a temperatura ambiente durante 30 minutos. La reacción enzimática se detuvo con 50 μL de la solución de NaOH 2N y se leyó a 405 nm en un lector de placas (Multiskan, Labysisten). 2.1.13 Determinación de la actividad bactericida del suero El ensayo se realizó por el método de Frasch y Robbins (1978) según los PNO 12-044 y 12-226, con ligeras modificaciones descritas por Sotolongo (1991). Se aplicaron esquemas de inmunización de una y dos dosis de proteínas del preparado vacunal a 10 ratones BALB/c, con un peso entre 18 y 20 g. En el caso del esquema con una dosis la medición de la respuesta inmunogénica se realizó 21 días después, momento en que se aplicó la segunda dosis cuando se empleó un esquema de dos dosis. En este caso la respuesta de anticuerpo fue medida 14 días posteriores a la última inmunización. En una placa de microtitulación, se añadieron 25 μL de solución de Hanks desde la columna 2 hasta la 12. Posteriormente, se adicionaron 50 μL del suero problema en el primer pocillo de cada fila (un suero diferente para cada fila, desde la A1 hasta la F1). Luego se añadió 50 μL del suero control positivo en G-1 y se realizaron diluciones seriadas dobles en cada fila. Se transfirieron 25 μL de los pocillos de la columna 1 a la 2 y así consecutivamente hasta la columna 7. Se eliminaron 25 μL de los pocillos de la columna 7 y la columna 8 quedó como control de los organismos viables de la suspensión bacteriana ajustada a una concentración de Materiales y Métodos 34 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 50 ± 10 UFC.25 μL-1. La suspensión bacteriana fue obtenida a partir de lotes de siembra crioconservados de la cepa de N. meningitidis serogrupo B a emplear en el ensayo, la que fue sembrada en placa de medio Agar Infusión Cerebro Corazón (BHIA) e incubada a 36,5 ± 0,5 ºC en una atmósfera 5-10% de CO2 por un período de 12 a 16 horas, a partir del cual se realizó una resiembra en placas de BHIA, las que se incubaron como se describió anteriormente por un período de cuatro horas. El crecimiento fue recogido en solución Hanks y se ajustó espectrofotométricamente a una concentración de 4 x 107 UFC.mL-1 en comparación con un patrón de opacidad. Se adicionaron 25 μL de la suspensión bacteriana a todos los pocillos (para corroborar la viabilidad de la cepa al inicio, 25 μL de la suspensión fue sembrada en una placa Petri con BHIA). Se agregaron 25 μL de la fuente de complemento (suero de conejo recién nacido de la firma Perfreez), desde la columna 1 hasta la 11 y 25 μL, en todos los pocillos de la fila H, que constituyó el control negativo. Las placas se incubaron (37 ± 1) ºC con atmósfera de 5-10% de CO2 durante 18 a 24 horas. Después de la incubación y mediante el uso de un microscopio estereoscopio, se realizó el conteo de las UFC en todos los pocillos de la placa. El título de la ABS se definió como la dilución del suero que correspondió con el 50 % de las células muertas calculadas por regresión. 2.1.14 Determinación del contenido de endotoxina por LAL La determinación del LAL se realizó mediante un ensayo cromogénico cinético, para el cual se utilizó el Kit “Kinetic-QLC 1000” (Biowhittaker) que emplea el patrón de endotoxina de E. coli 055:B5 en el rango de 0,005 a 50 unidades endotóxicas (UE).mL-1, éste y la solución reactiva se prepararon según lo sugerido por el fabricante. Se efectuó el ensayo de inhibición/potenciación, descrito por la USP 30; seleccionándose como dilución de trabajo, la correspondiente a 1/20 000, después de ser ajustada la muestra 100 μg.mL-1, ya que con estas concentraciones se recuperaba el patrón añadido (5 UE.mL-1) en un porcentaje aceptable (50 -150%) según los PNO 12-175 y 12-220. Para la realización del ensayo, se distribuyeron en placas de microtitulación, 100 μL por duplicado de cada muestra (blanco de agua del Kit, patrones de endotoxina, controles y muestras a analizar). La placa se colocó en la cámara de incubación del lector cinético a 37 °C durante 10 minutos Posteriormente, la placa se retiró del incubador/lector y se le añadió con una pipeta multicanal, 100 μL de la solución reactiva compuesta por el lisado de amebocitos del Limulus y el sustrato Materiales y Métodos 35 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ cromogénico. La placa se colocó de nuevo en el lector durante una hora para la lectura de la respuesta. El ensayo y el procesamiento de los datos se realizaron de forma automatizada, versión 1.2. El resultado fue expresado como UE.mL-1, UE.dosis-1 ó UE.50μg de proteína-1. 2.1.15 Electroforesis bidimensional 2.1.15.1 Geles analíticos de rango pI 3 – 10 A 15 μL (30 μg) de cada lote previamente deslipidado, como se refiere en 2.1.10, se le adicionó una solución de rehidratación (7,5 M Urea, 1,5 M Tiourea, 2% CHAPS, 0,5% ASB-14, 20 mM Tris, 1% DTT, 1% anfolinas portadoras pI 3,5 -10 para un volumen final de 200 μL). A continuación se procedió a la rehidratación del gel de estas muestras en tiras de gradiente inmovilizado de pH (IPG) (Biosciences, Amersham,) de 11 cm. durante toda la noche. La primera dimensión (focalización isoeléctrica) se realizó en un Multiphor II (Amersham). El voltaje se programó como sigue: 220 V (15 minutos), 1 750 V (50 minutos), 2 600 V (38 minutos), 3 500 V (45 minutos), continuando con 3 500 V hasta alcanzar 13,5 kVh. La reducción y alquilación de las muestras se realizó entre la primera y la segunda dimensión, por incubación de las tiras en solución de equilibrio (6 M Urea, 30% Glicerol, 2% SDS, 50 mM Tris pH = 8,8) con DTT al 2% y a continuación se incubaron las tiras en solución de equilibrio con iodoacetamida al 2,5%. Los tiempos de incubación en ambos pasos fue de 15 minutos. La segunda dimensión (electroforesis en gel de poliacrilamida al 16%, SDS-PAGE) se efectuó en una cámara Protean II (BioRad) en geles de 16 x 20 cm. El revelado de los geles se realizó con plata – glutaraldeído (Heukesshoven y Dernick, 1985). 2.1.15.2 Geles analíticos de rango pI 4 – 7 Los geles analíticos de pI 4 - 7 se procesaron con la misma metodología de los geles anteriores, pero con una carga de 50 μg de proteína en las tiras de pI 4 - 7 y con un aumento en el parámetro de focalización isoeléctrica hasta alcanzar 15.5 kVh. 2.1.15.3 Geles preparativos de rangos de pI 4-7 y 6-11 La focalización isoeléctrica se llevó a cabo en tiras de gradiente inmovilizados de proteínas (IPG) (Amersham) de 18 cm (pI 4 - 7 y pI 6 - 11), previamente rehidratados durante toda la noche en solución que contenía: Urea (7,5 M), Tiourea (1,5 M) CHAPS (2%), ASB-14,20 mM Tris (0,5%), DTT (1%), anfolinas 3,5-10 (1%). Una carga de 500 μg de proteínas de VME se solubilizaron en 150 μL de solución de lisis (7 M Urea, 2 M Tiourea, 4% CHAPS, 1% DTT, 1% anfolinas portadoras Pharmacia pH 3.5-10) y se aplicaron en las tiras de papel (Sabounchi-Schϋtt y col, 2000). En ambos Materiales y Métodos 36 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ casos la focalización se llevó a cabo hasta alcanzar 40 kVh, en un Multiphor II (Pharmacia). La electroforesis en gel de poliacrilamida (16.6% SDS-PAGE, 20 x 20 cm) se efectuó en una cámara Protean II (BioRad) y los geles se revelaron con una tinción de plata sin glutaraldehído (Jensen y col, 1999). Luego del análisis de las imágenes, se procedió a recortar las bandas de interés de estos geles, conservándose en tubos a -34 0C hasta ser digeridos 2.1.15.4 Análisis de las imágenes Las imágenes en los geles teñidos se registraron con el uso del equipo ScanJet 6300C (Hewlet Packard), la tinción de los mismos se realizó al mismo tiempo y con un sólo lote de solución colorante. Las imágenes en los geles bidimensionales se procesaron y analizaron con el software Melanie III (GeneBio). Las manchas se detectaron automáticamente, sin previo enriquecimiento de contraste y con una edición manual, cuando fue necesario. 2.1.15.5 Digestión proteolítica y extracción de los péptidos La plata se removió de las manchas con el reactivo de Farmer (Gharahdaghi y col, 1999) y luego se le adicionó Bicarbonato de Amonio (BCA) 250 mM hasta decolorar las manchas. Las manchas se cortaron en cubos de 1 mm3 y se desecaron con Acetonitrilo (ACN) 90%, rehidratándose a continuación con un volumen mínimo de BCA 50 mM que contenía la enzima Tripsina (Promega) a una concentración de 12,5 ng.μL-1. La digestión se realizó a 37 ºC por 18 horas. Los péptidos proteolíticos generados durante la digestión con Tripsina de las bandas de proteína se extrajeron de la solución con el uso de microcolumnas de fase reversa, “ZipTips” C18 (Millipore). Los péptidos adsorbidos al “Zip-Tips” se lavaron con abundante Ácido Fórmico (5% v/v), posteriormente se extrajeron de la columna con la aplicación sucesiva de 1,5 μL de una solución de ACN al 60% y 1% de Ácido Fórmico, seguido de igual cantidad de una solución con Isopropanol (50%) y Ácido Fórmico (5%). Finalmente, ambas soluciones se mezclaron y se aplicaron en un nanodescargador de borosilicato recubierto de oro para aplicar en el espectrofotómetro de masas. 2.1.15.6 Análisis de proteínas por espectrometría de masas Los espectros de baja energía ESI-MS y MS/MS se realizaron en un espectrómetro de masas híbrido con cuadrupolo y tiempo de vuelo (QTof-2TM) (Micromass), equipado con una fuente de nanoESI. Los espectros de masas se obtuvieron en un rango de m/z desde 400 hasta 2 000 en 0,98 segundos y la utilización de 0,02 segundos entre cada uno de los barridos. El espectrómetro se Materiales y Métodos 37 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ calibró con una solución salina compuesta por una mezcla de Yoduro de Sodio y Cesio. Los voltajes empleados en el cono y el capilar fueron de 900 y 35, respectivamente. Para adquirir los espectros MS/MS el primer cuadrupolo se usó para seleccionar a los iones precursores en una ventana de aproximadamente 2 Th. La presión de gas Argón en la celda de colisiones fue de ≈5 x 10-2 Pa. y se seleccionó una apropiada energía de colisión (20 - 50 eV), hasta lograr un espectro de masas con suficiente información estructural que permitiese una secuenciación confiable de los péptidos. 2.1.15.7 Identificación de las proteínas La identificación de proteínas basada en los espectros ESI-MS se realizó mediante el método denominado huella de masas de los péptidos, conocido en ingles por las siglas PMF. Se emplearon los programas ProFound (Zhang y Chait, 2000) y MASCOT (Perkins y col, 1999) disponibles en Internet. La búsqueda se limitó a las secuencias de genes y proteínas de bacterias, contenidas en las bases de datos SwissProt y NCBI y se consideró a la oxidación de metioninas, la desamidación y la carboxiamidometilación de cisteínas como posibles modificaciones presentes. La identificación de las proteínas basada en los espectros MS/MS se realizó a través de interpretación manual o usando la versión del programa MASCOT disponible en internet (Matrix Science Ltd, UK) (Perkins y col, 1999). Entre los parámetros de búsqueda se incluyó la modificación de cisteínas, así como las posibles oxidaciones y desamidaciones. También se empleó el programa Pepsea (Protana, Dinamarca), disponible en Internet, que utiliza como base de datos el Swissprot. 2.1.16 Determinación de pirógenos en conejos Esta prueba se realizó según las recomendaciones de la Farmacopea Europea (Eur. Ph, 2004) acorde los PNO 12-198 y 12-239. Las muestras fueron preparadas como sigue: los IFA obtenidos, según la variante alcohólica se resuspendieron en solución 0,7 mmol.L-1 de fosfatos y Cloruro de Sodio 0,9% (pH = 7,2) a una concentración de 100 μg.mL-1. Las VME en sacarosa, se diluyeron a 100 μg.mL-1 con sacarosa (3%), fosfatos 0,7mmol.L-1, (pH = 7,9). Ambas variantes se diluyeron a 100 y 1000 μg.mL-1 con solución salina fisiológica apirogénica. Los preparados vacunales se diluyeron a 500 μg.mL-1. Se utilizaron tres conejos entre 1,5 y 2,5 kg a los que se les aplicó 1 mL de la muestra por kg de peso corporal por vía intravenosa. A los animales se les determinó la temperatura continuamente Materiales y Métodos 38 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ durante tres horas con la utilización del equipo Probox 45 (Letica). Los resultados fueron evaluados a partir de la sumatoria encontrada en cada conejo, de la diferencia entre el valor de temperatura mas alto observado en la prueba en relación al valor de temperatura inicial. Se consideró que la prueba fue pasada satisfactoriamente, cuando la suma de las diferencias fue menor que 1,15. En los casos en que esto no ocurrió se siguieron los criterios de la Eur. Ph, 2004 para decidir la realización de repruebas o declarar que el lote no pasó la prueba a la concentración de proteínas evaluada. 2.1.17 Determinación del polisacárido capsular serogrupo B En las VME que contenían sacarosa las trazas de PC-B se determinaron por HPLC (Anamula, 1994) según PNO 12-243. El método está basado en que el PC-B contiene unidades repetitivas de ácido siálico (ácido N. acetil neuroamínico) el cual es derivatizado con o-fenildiamina para formar un complejo quinoxalina fluorescente estable, el cual es separado del exceso de reactivo mediante una columna de fase reversa C18. Los derivados fluorescentes fueron detectados a longitudes de ondas de excitación de 230 nm y de emisión e 425 nm. La cuantificación se realizó a partir de una curva de calibración preparada con ácido colomínico como material de referencia. El método detecta 0,1 pmol de polisacárido. 2.1.18 Determinación de ADN Para determinar ADN en las VME purificadas que contienen sacarosa se utilizó el método conocido como Theshold (Kuang y col, 1990) el que facilita una medición rápida, sensible y específica de DNA total en niveles de picogramos (pg) mediante un ensayo de inmunoligando. El ensayo se basa en la formación de un complejo que involucra el analito, en el cual participa una proteína de alta afinidad conjugada con biotina y la estreptavidina y un monoclonal anti-DNA conjugado con ureasa. El complejo es filtrado por una membrana de nitrocelulosa recubierta con biotina y estrectavidina, membrana que retiene el complejo. Mediante un lavado rápido se eliminan todas las enzimas no específicas. La membrana se coloca en el lector que contiene un sustrato de urea. La reacción enzimática de esta con la ureasa, provoca la hidrólisis de la urea y un cambio de pH, cambio detectado por un censor de silicona. La velocidad del cambio de pH en la superficie fue proporcional a la cantidad de DNA. El rango de detección fue de 2 - 200 pg. Las determinaciones se realizaron en el equipo Treshold System (Molecular Devices Corporation). Materiales y Métodos 39 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 2.1.19 Determinación de la sacarosa La concentración de la sacarosa se determinó por el método del fenol-sulfúrico (Dubois y col, 1956) según PNO 12-214, basado en la deshidratación que produce el ácido sulfúrico con el anillo de las hexosas, donde se originan derivados del fulfural que al reaccionar con el fenol, desarrollan un complejo coloreado que absorbe a 490 nm. 2.1.20 Determinación de DOC La determinación de DOC se realizó por un método combinado de cromatografía gaseosa (CG) y MS desarrollado por la firma GSK para medir este residuo en vacunas. El principio del método se basó en que primeramente el DOC es convertido en Ácido Deoxicólico y entonces es extraído con un solvente orgánico. Posteriormente las muestras son secadas y derivatizadas. EL método empleó el Ácido Cólico como referencia interna. La CG permite la separación del Ácido Deoxícolico y el Ácido Cólico. Finalmente ambos son detectados por MS en cuanto a sus tiempos de retención relativos y sus valores específicos de m/z. Se obtiene una curva de calibración mediante el ploteo del área bajo la curva en el espectro del DOC contra diferentes concentraciones del mismo, usadas como estándar. El contenido de DOC se calcula a través de la recta de regresión. Para la determinación se usó el sistema de CG-MS modelo HP6890 de la firma Hewlett Packard acoplado a un detector selectivo de masa modelo 5973. La preparación de la muestra se realizó como sigue: 400 μL de la muestra se introdujeron en un tubo Eppendorf y se añadieron 100 μL de la solución estándar interna de Ácido Cólico de 200 μg.mL-1. Luego se adicionaron 10 μL de Ácido Sulfúrico concentrado y 500 μL de Acetato de Etilo y se agita. La solución anterior se centrifugó a 14 000 r.p.m durante 10 minutos y el sobrenadante se transfirió a otro tubo Eppendorf que contenía aproximadamente 100 mg de Sulfato de Sodio anhidro. Luego de homogeneizar se centrifugó como se refirió anteriormente. El sobrenadante de esta etapa se secó en un evaporador rotatorio durante 30 minutos. Finalmente se adicionaron 75 μL de N,O bis-Trimetil silifluoroacetamida a la muestra seca, se agitó y se colocó en un termomezclador a 80 ºC durante una hora. La solución preparada se enfrió para realizar el análisis cromatográfico. De igual forma se prepararon los nueve puntos del estándar de DOC para la curva de calibración con concentraciones entre 5 y 200 μg.ml-1. Materiales y Métodos 40 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Las muestras y los estándares son inyectados por duplicado en el sistema de CG-MS con la aplicación del modo Scan. A través de la identificación de los picos cromatográficos se registraron los espectros correspondientes a los compuestos analizados de acuerdo a los valores específicos de m/z para el DOC (428 y 345) y para la sal sódica del Ácido Cólico (516 y 426). La cantidad de DOC se determinó a través de la recta de regresión ya referida. 2.1.21 Determinación de la osmolalidad Las determinaciones de la osmolalidad se realizaron de acuerdo con la Farmacopea Británica (British Pharmacopoeia, 2002) según PNO 12-194 en un Auto Osmometor Osmostat® modelo OM6020 (Kyoto Daichi, Kagaku Ltd). La osmolalidad es una manera práctica de medir la contribución de varios solutos presentes en una solución a la presión osmótica que esta genera. El método para determinar la osmolalidad se basa en medir la depresión al punto de congelación de la solución con relación al agua destilada y la calibración del equipo se realiza con soluciones de referencia de osmolalidad conocida. 2.2 Metodologías generales empleadas en los procesos de obtención de VME 2.2.1 Cepas Se utilizó la cepa de N. meningitidis serogrupo B CU 385/83 (B:4:P1.19,15) aislada en Cuba durante la epidemia de los años 80, seleccionada como la cepa vacunal desde 1985. A partir de ese aislamiento se obtuvo el lote de siembra de referencia, y a partir de éste se elaboraron los lotes de siembra de trabajo, confeccionados con alícuotas de cultivo líquido en Skim Milk al 10%, conservándose posteriormente en viales a -70 ± 5 ºC. La estabilidad de los lotes de siembra se chequeó periódicamente, según el programa establecido. Se utilizaron cinco cepas de N. meningitidis clasificadas como (B:4:P1.7-2,4), aisladas en la epidemia de Nueva Zelanda de los años 90 y cuyos aislamientos se identificaron como: NZ 98/018, NZ 98/124, NZ 98/153, NZ 98/223 y NZ 98/228; con estas cepas se prepararon los lotes de siembra, de referencia y de trabajo, siguiendo la misma metodología empleada para la cepa CU 385/83. 2.2.2 Medios de cultivo Medio sólido: La multiplicación en medio sólido se realizó en AMH, suplementado con un 10% de suero bovino sin calostro. Materiales y Métodos 41 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Medio líquido: Para los cultivos en medio líquido se empleó el medio Frantz suplementado con Extracto de Levadura dializado (MFM), recomendado por la OMS (Serie de Informes Técnicos, 1976) (anexo 2). Todos los componentes de los medios de cultivo utilizados están reconocidos, como mínimo, por una Farmacopea. Los mismos se evaluaron previamente a través de las pruebas tecnológicas con el objetivo de asegurar su potencialidad para el crecimiento y la expresión del CPME. 2.2.3 Obtención del inóculo A partir de un tubo correspondiente al lote de siembra de trabajo de la cepa de N. meningitidis a evaluar, se realizaron cultivos en AMH, a la temperatura de 36,5 ± 0,5 ºC, en atmósfera con 5,5% de CO2, por un período de 18 horas; con la biomasa obtenida se inocularon erlenmeyers que contenían MFM. Los cultivos se agitaron a 160 r. p. m. en una zaranda orbital a la temperatura de 36,5 ± 5 ºC entre cuatro y cinco horas. La pureza de los cultivos se determinó según lo descrito en 2.1.2.1. 2.2.4 Cultivo de semilla Se utilizó un fermentador Chemap de 75 L (modelo CH-8604), con 46 L de MFM en el que se sembró un volumen de inóculo obtenido según la metodología descrita en 2.2.3. Este inóculo garantizó una DO inicial entre 0,2 y 0,25. Las condiciones de cultivo empleadas fueron: pH (inicial) =7, ±0,2; temperatura =36,5±0,5ºC, pO2=25% de oxígeno disuelto, agitación=244 r. p. m. Durante la fermentación, los parámetros de los procesos se monitorearon a través del panel de control del equipo. Cuando el cultivo alcanzó una DO entre 1 y 1,5 en la fase exponencial, se verificó su pureza, según se detalló en 2.1.2.1 y se procedió posteriormente a inocular los fermentadores de 300 L. 2.2.5 Cultivo a escala industrial Se utilizaron dos fermentadores Chemap de 300 L (modelo 9 – 712) con 230 L de MFM. Cada fermentador se inoculó con aproximadamente 23 L, procedentes de la fermentación de la semilla. La DO inicial se ajustó entre 0,2 y 0,25 y las condiciones de cultivo fueron: pH (inicial) = 7,4 ± 0,2; temperatura = 36,5 ± 0,5 ºC, pO2 = 25% de oxígeno disuelto y una agitación = 187 r. p. m. Los parámetros del proceso se monitorearon a través del panel de control del equipo durante la fermentación. Al final de la fermentación se determinó la DO según se refiere en 2.1.1 y la pureza microbiana se constató por observación microscópica y siembra en medio de cultivo, igual que como se describe en 2.1.2.1 y 2.1.2.2 Materiales y Métodos 42 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 2.2.6 Separación celular por centrifugación Al final de la fermentación industrial, el cultivo se concentró en una centrífuga Westfalia - Separator con un flujo de 350 L.h-1. Posteriormente, la biomasa se separó por centrifugación a 17 000 x g durante dos horas en centrífugas Beckman (modelo J221). La biomasa compactada se resuspendió en el tampón de proceso Tris-HCl 0,37%, EDTA 0,074%, pH = 8,5 (Tris-EDTA) a 4 ºC con ayuda de perlas de vidrio y se trasladó a un reactor de 35 L para realizar el proceso de extracción de las VME. 2.2.7 Separación celular por microfiltración tangencial. Se utilizó el sistema de MFT Sartocom 3 de la firma Sartorius con 10 membranas planas Hidrosart de 0,2 μm para un área de filtración total de 6 m2, para realizar la etapa de la concentración y lavado celular, a partir de cultivos de 460 L obtenidos según se expresó en 2.2.5. Los cultivos empleados tuvieron una DO entre 3,1 y 3,4, equivalente a un peso seco de alrededor de 1,2 g.L-1. El proceso de MFT se definió como se señala a continuación: ¾ Concentración celular inicial: 15,3 veces. ¾ Diafiltración celular: Tres lavados de forma continúa a volumen constante con el tampón de proceso (Tris-EDTA). ¾ Concentración celular final: 25-35 veces del volumen inicial. Las presiones de trabajo utilizadas fueron: o Alimentación = 1 Bar o Retorno = 0 Bar o Filtrado = 0 Bar 2.2.8 Extracción de las VME con DOC En el reactor de 35 L la biomasa resuspendida en el tampón (Tris- EDTA) se le añadió DOC al 10% para garantizar en el momento de la extracción una concentración final de 0,5%, para una relación de 5 mL de tampón por gramo de masa húmeda. Las VME se extrajeron con agitación mecánica baja durante dos horas a 4 ºC. Los restos celulares se separaron por centrifugación a 17 000 x g durante dos horas a 4 ºC. EL sobrenadante de esta etapa constituyó el material de partida para el proceso de purificación. 2.2.9 Purificación de las VME hasta la fracción cromatográfica El sobrenadante obtenido de la etapa de extracción y que contenía las VME, se sometió a un tratamiento enzimático con nucleasas a 37 ºC, durante dos horas. Posteriormente, se concentró en Materiales y Métodos 43 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ un sistema de filtración tangencial de fibra hueca (modelo 5469), empleando cartuchos filtrantes de 100 kDA. Se realizaron tres lavados a un volumen constante con el tampón de proceso Tris-HCl 0,37 %, EDTA 0,074%, DOC 0,5%, pH = 8,5 (Tris-EDTA-DOC). Luego se ultracentrifugó a 186 000 x g durante ocho horas a 4 0C, utilizando una ultracentrífuga Beckman (modelo L755). Las VME ya sedimentadas se resuspendieron con una solución tampón que contenía Dietanolamina (DEA) 0,52%; DOC 5%; pH = 9,0, mediante agitación orbital a 160 r. p. m., durante 16 a 24 horas a 4 ºC. Después de solubilizar las VME, la concentración de las proteínas se ajustó entre 10 - 12 mg.mL-1. Posteriormente, la solución con la concentración ajustada se sometió a un paso cromatográfico de filtración en gel, para lo cual se utilizó una matriz de Sephacryl S-300 HR (Pharmacia) y un sistema de corrida de escala preparativa con columnas BPG 200 (Pharmacia). Se aplicó un volumen de 4% con relación al volumen total de la columna. El tampón de proceso Tris-EDTA-DOC se utilizó como solución de elución con un flujo de trabajo de 30 cm.h-1. La corrida cromatográfíca se monitoreó de forma continua mediante espectrofotometría a 280 nm y se colectó la primera fracción cromatográfica (FC), donde se encuentran las VME purificadas en el tampón de proceso. 2.2.10 Obtención del IFA por precipitación alcohólica Para eliminar el tampón de proceso, las FC se filtraron por una membrana de 0,2 μm y se precipitaron las VME con alcohol al 80% por un período de 16 a 24 horas a -20 ºC. Posteriormente el precipitado se lavó tres veces de manera sucesiva con alcohol al 80%, con centrifugaciones intermedias. Las VME precipitadas como torta alcohólica se conservaron a -70 ºC. 2.2.11 Obtención del IFA por diafiltración con sacarosa Para eliminar el tampón de proceso las VME fueron diafiltradas con sacarosa al 3%, el proceso se realizó en un sistema de ultrafiltración tangencial (UFT) de fibra hueca de la firma Amicom (Modelo 54169) con cartuchos filtrantes de 100 kDA como sigue: a partir de la FC se realizaron 10 lavados a volumen constante con sacarosa al 3% en tampón fosfato, pH = 7,8 ± 0,2. La presión de alimentación fue de 1 Bar y la de retorno de filtrado 0 Bar. Las VME en sacarosa a una concentración entre 1 y 2 mg.mL-1 de proteína se filtraron por una membrana de 0,2 μm y luego se conservaron entre 2 - 8 ºC. Materiales y Métodos 44 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 2.3 Evaluación de la MFT en la separación celular de la cepa CU 385/83 2.3.1 Comportamiento hidrodinámico del proceso y recobrados celulares Se procesaron 12 cultivos de cinco horas de fermentación como se refiere en 2.2.5, los que se encontraban en el final de la fase logarítmica de crecimiento con una DO entre 3,1 y 3,4, equivalente a un peso seco de alrededor de 1,2 g.L-1 con una pureza satisfactoria de acuerdo a 2.1.2.1. El proceso de MFT se realizó como se señala en 2.2.7. El comportamiento hidrodinámico del sistema se evaluó a través de la medición del flujo de filtrado en la zona de permeado a diferentes tiempos de filtración, con el uso de un cilindro graduado. Los flujos obtenidos se normalizaron teniendo en cuenta el área total de filtrado. Con estos datos se obtuvieron las curvas de filtrado. EL proceso de MFT se realizó a través de un reactor de 35 L donde la biomasa se concentró, lavó y resuspendió en el tampón de proceso Tris – EDTA y posteriormente, las VME se extrajeron de la misma forma que aparee descrito en 2.2.8. Los resultados de la MFT (tecnología en evaluación) se compararon con igual número de proceso donde los cultivos presentaron las mismas características referidas anteriormente, pero la biomasa se obtuvo por centrifugación, según 2.2.6 (tecnología tradicional) y las VME se extrajeron como se refiere en 2.2.8. El anexo 3 muestra las etapas del proceso donde se comparan las dos variantes tecnológicas. Las evaluaciones de la eficiencia del proceso en cuanto al recobrado de la biomasa se realizó a partir de la determinación de peso seco, según se describe en 2.1.5. Para evaluar el impacto del método de separación celular en la etapa de extracción, las VME presentes en el extracto obtenida por las dos variantes, se separaron por ultracentrifugación a 186 000 x g durante ocho horas a 4 ºC. Las VME sedimentadas se resuspendieron en el tampón de proceso Tris – EDTA – DOC y se determinó el contenido de proteínas como se refirió en 2.1.3. 2.3.2 Evaluación del impacto de la MFT en las etapas de extracción y purificación de VME A partir de seis procesos de obtención de VME donde la separación celular se realizó por MFT (tecnología en evaluación), según se refirió en 2.2.7, se evaluó el impacto del cambio en las etapas de extracción y purificación (concentración, ultracentrifugación y cromatografía) descritas en 2.2.8 y 2.2.9, respectivamente, a través de la cuantificación e identificación de las proteínas presentes con el empleo de los ensayos referidos en 2.1.3 y 2.1.4. Se determinó, además, el contenido de LPS y PC-B como se refirió en 2.1.6 y 2.1.7, respectivamente. Materiales y Métodos 45 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Los resultados obtenidos se compararon con las mismas etapas del proceso y la misma metodología analítica obtenidos en igual número de procesos realizado por la tecnología tradicional, donde la separación celular se realizó por centrifugación. Los resultados del control de calidad de seis FC de VME obtenida por la tecnología en evaluación se compararon con los de igual número de procesos procedentes de la tecnología tradicional en cuanto al cumplimiento de las especificaciones de calidad de éstos, referidas en el anexo 4. Además, en la comparación de las FC se verificó la presencia de estructuras vesiculares por microscopia electrónica, según se refiere en 2.1.9. 2.3.3 Evaluación del impacto de la MFT en las VME purificadas como IFA Para medir el impacto en las características definitorias de las VME debido a la introducción de la MFT en la etapa de separación celular seis lotes de IFA en torta alcohólica procedentes de la tecnología en evaluación, se compararon con la misma cantidad de lotes obtenidos por la tecnología tradicional en cuanto al cumplimiento de las especificaciones de calidad referidas en el anexo 5. Se realizaron adicionalmente otras comparaciones complementarias de antigenicidad, inmunogenicidad y actividad endotóxica. Para evaluar la antigenicidad se utilizó una gamma globulina de referencia obtenida a partir de los sujetos vacunados con lotes de VA-MENGOC-BC® obtenidos a partir de las VME tradicionales, empleándose los siguientes métodos: Western – blot (WB) según se refiere en 2.1.10 y la antigenicidad in vitro, por un ensayo inmunoenzimático (ELISA) acorde a 2.1.11. La inmunogenicidad y la endotoxicidad se midieron en preparados vacunales donde las VME fueron solubilizadas en PC-C y adsorbidas en gel de HA, según la composición de VA-MENGOC-BC® referida en 1.7. Para medir la respuesta inmune en ratones se utilizó el método de ELISA y la funcionabilidad de los anticuerpos se determinó por la ABS, para lo cual se aplicó una dosis de 50 μg de proteína y se procedió como se describe en 2.1.12 y 2.1.13, respectivamente. La actividad endotóxica se evaluó por el método de LAL, acorde a lo descrito en 2.1.14. 2.4 Análisis de las proteínas presentes en las VME mediante electroforesis bidimensional y una plataforma de proteómica En el Departamento de Proteómica del Centro de Ingeniería Genética y Biotecnología (CIGB), se evaluaron tres lotes de IFA obtenidos a escala industrial a partir de la cepa CU 385/83 luego de la introducción de la MFT al proceso de obtención de VME, lotes que se identificaron como A, B y C. Materiales y Métodos 46 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Inicialmente, las muestras de IFA en solución acuosa fueron delipidadas con éter etílico de la siguiente forma: a 100 μL de la muestra se le adicionaron 400 μL de éter etílico y se agitó durante 10 minutos. A continuación se centrifugó a 11 000 r. p. m. por cinco minutos y se aspiró la fase superior (orgánica), fase que fue descartada, repitiéndose el procedimiento descrito dos veces más con la fase acuosa. Esta última se secó por evaporación centrífuga y el sedimento se resuspendió en una solución de lisis (7,5 M Urea, 2 M Tiourea, 4 % CHAPS) para obtener una concentración de proteína de 2 μg.μL-1. Para estudiar la composición proteica de las VME y comparar la reproducibilidad del patrón de proteínas entre los lotes, se utilizaron geles analíticos de puntos isoeléctricos (pI) entre los rangos de pI 3 – 10 y pI 4 – 7. Parar identificar las proteínas presentes se utilizaron geles preparativos entre los rangos de pI 4 – 7 y pI 6 - 11. Las metodologías empleadas para realizar las 2DE analíticas y preparativas, el análisis de imágenes y la identificación de las proteínas por espectrometría de masas se describen en 2.1.15.1; 2.1.15.2; 2.1.15.3; 2.1.15.4; 2.1.15.5; 2.1.15.6 y 2.1.15.7. Se realizaron análisis de imágenes para cada gel donde la detección automática, la edición de la mancha y el cálculo del área se realizó dos veces y los valores se compararon para evaluar la consistencia de la producción. La reproducibilidad lote a lote del gel se evaluó con el uso de los informes pareados y el análisis del diagrama de dispersión. 2.5 Valoración del efecto de la sacarosa en la etapa de purificación y conservación de las VME 2.5.1 Comportamiento hidrodinámico del proceso de diafiltración de VME y recobrado Se evaluó la diafiltración con sacarosa como paso final de la purificación de las VME, para eliminar el tampón de proceso mediante un estudio comparativo con la precipitación alcohólica empleada para este fin, para lo cual se realizaron seis procesos de obtención de las VME purificadas a partir de la cepa CU 385/83 hasta el paso de FC. El volumen de cada FC se dividió a partes iguales, y para cada variante se procedió de acuerdo al diagrama de flujo que se presenta en el anexo 6. En la variante de diafiltración con sacarosa se procedió como sigue: el comportamiento hidrodinámico del sistema se evaluó a través de la medición del flujo de filtrado a diferentes tiempos de filtración y se procedió como se refiere en 2.1.11. La eliminación de DOC durante la diafiltración fue seguida mediante la determinación de la absorbancia a 213 nm. Materiales y Métodos 47 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ En la variante de precipitación alcohólica: se procedió a partir del paso de FC como se refiere en 2.1.10. Los recobrados del proceso se evaluaron mediante la determinación de las proteínas, según se describe en 2.1.3. 2.5.2 Evaluación del impacto de la diafiltración con sacarosa en las características de las VME La evaluación del impacto de la diafiltración con sacarosa en el proceso y las características de las VME se analizó a partir de los seis lotes de IFA obtenidos, por la variante de diafiltración con sacarosa y que se evaluaron de forma comparativa con igual cantidad de lotes de IFA, obtenidos por precipitación alcohólica en un estudio de pre-estabilidad (37 ºC por 7 días), en cuanto a las características definitorias de las VME, tales como: identidad, estructura vesicular, endotoxicidad, pirógenos e inmunogenicidad. Los métodos analíticos empleados se presentan en el anexo 7. Las características de endotoxicidad, pirógenos e inmunogenicidad se evaluaron en preparados vacunales obtenidos a partir de los IFA en comparación y que contenían 50 μg.mL-1 de proteína, 4mg.mL-1 de gel de HA, 0,7mM de fosfatos. En los lotes correspondientes a la variante alcohólica la isotonicidad se logró con 0,85% de Cloruro de Sodio, mientras que, en los lotes de la variante en sacarosa esto se logró con un 3% de sacarosa y 0,62% de Cloruro de Sodio. Para determinar la inmunogenicidad en ratones por ELISA se aplicó una dosis de 25 μg y se procedió como se describe en 2.1.11. En el caso de la determinación de anticuerpos funcionales mediante la determinación de la ABS en ratones, se aplicaron dos dosis de 25 μg y se procedió, según fue descrito en 2.1.12. A partir de tres lotes de VME en sacarosa se obtuvo igual número de lotes de monograneles (MG) concentrados a pH = 6,5 y 7,5. Los mismos contenían 400 μg.mL-1 de proteína, 16 mg.mL-1 de gel de HA en un tampón fosfato 0,7 mM para los MG de pH = 6,5. En el caso de los correspondientes a pH = 7,5 se utilizó un tampón fosfato 2,8 mM. Los MG se compararon entre sí en un estudio de pre-estabilidad a la temperatura de 37 ºC durante 7 días, observándose el comportamiento del pH, inmunogenicidad por ELISA, la funcionabilidad de anticuerpos por la ABS y la actividad endotóxica de acuerdo a los ensayos reportados en 2.1.12, 2.1.13 y 2.1.14, respectivamente. Materiales y Métodos 48 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ La actividad endotóxica y la inmunogenicidad de los MG se midió a través de los preparados vacunales correspondientes a la variante de sacarosa, cuya composición fue descrita anteriormente en este acápite. 2.6 Evaluación de las cepas epidémicas de N. meningitidis 2.6.1 Metodologías empleadas a escala piloto Se evaluaron cinco cepas de N. meningitidis serogrupo B como posibles candidatos vacunales, todas correspondían al fenotipo B:4:P1.7-2,4 y se compararon bajo las mismas condiciones del proceso con la cepa vacunal CU 385/83, en las etapas de fermentación y extracción como sigue: a cada cepa se les realizó, como mínimo, tres cultivos de seis horas en un fermentador Chemap de 35 L (modelo FZ-3 000) con 23 de MFM, sembrado con un volumen de inóculo suficiente que garantizara una DO inicial entre 0,2 y 0,25. El inóculo se obtuvo según se refiere en 2.2.3. Se emplearon las siguientes condiciones de cultivo: pH (inicial) = 7,4 ± 0,2; temperatura = 36,5 ± 0,5 ºC; pO2 = 25% de oxígeno disuelto; agitación = 400 r. p. m. La DO de los cultivos y su pureza se midió cada una hora según se refiere en 2.1.1 y 2.1.2.1, respectivamente. Se evaluó la expresión del CPME en los diferentes pasos del proceso, mediante la extracción de éstos con Cloruro de Litio, de acuerdo a la metodología referida por Frasch (1994). La identificación de los CPME se realizó por SDS – PAGE, según aparece descrito en 2.1.4. Al final de la fermentación, se separó la biomasa por centrifugación a 17 000 x g durante dos horas a 4 ºC y se resuspendió en el tampón de proceso Tris-EDTA. Para extraer las VME se añadió DOC al 10%, para una concentración final de DOC = 0,5%, de forma tal que, en el momento de la extracción, la relación tampón–biomasa fue de 5 mL.g-1 de peso húmedo. Las VME se extrajeron con agitación magnética durante dos horas a 4 ºC. Los restos celulares se separaron por centrifugación a 17 000 x g durante dos horas a 4 ºC. Para evaluar la identidad del CPME las VME extraídas presentes en el sobrenadante se separaron por ultracentrifugación a 186 000 x g por ocho horas. La evaluación se realizó por SDS-PAGE como se describe en 2.1.4 a partir de las VME resuspendidas en el tampón de proceso Tris-EDTA – DOC. 2.6.2 Metodologías empleadas a escala industrial Inicialmente, por la metodología tradicional, a partir de las cepas NZ 98/124 y NZ 98/228 se realizaron tres procesos de obtención de VME purificadas de acuerdo a los pasos que están descritos en los acápites 2.2.3, 2.2.4, 2.2.5, 2.2.6, 2.2.8, 2.2.9 y 2.2.10 hasta la obtención del IFA Materiales y Métodos 49 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ como torta alcohólica. Se evaluó comparativamente el comportamiento de las cepas en la etapa de fermentación mediante la determinación de la DO, según se refiere en 2.1.1 y la presencia del CPME por SDS-PAGE como se describe en 2.1.4, previamente estos habían sido extraídos con Cloruro de Litio, según Frasch (1994) durante las etapas de cultivo o con DOC en la extracción y durante la purificación. Los rendimientos de la proteína purificada en FC se determinaron según se refiere en 2.1.3. Así como, la capacidad inmunogénica de cada una en ratones por el método de ABS con la aplicación de una dosis de 50μg de un preparado vacunal que contenía la misma composición de VA-MENGOC-BC® referida en el acápite 1.7, donde las VME se sustituyeron por las obtenidas de las cepas antes referidas. La ABS se evaluó mediante la metodología referida en 2.1.13. La capacidad bactericida alcanzada por cada preparado vacunal se evaluó frente a las cepas NZ 98/124 y NZ 98/228, respectivamente. Posteriormente, la cepa NZ 98/228 se evaluó con la metodología establecida, luego de la introducción del sistema de MFT en la etapa de separación celular y la diafiltración con sacarosa en la etapa final de la purificación para lo cual se realizaron seis procesos de obtención de las VME, acorde al diagrama de flujo presentado en el anexo 8. Los pasos del proceso involucrado se refieren en los acápites 2.2.3, 2.2.4, 2.2.5, 2.2.7, 2.2.8, 2.2.9 y 2.2.11. Los procesos de obtención de las VME se compararon con un igual número de procesos realizados a partir de la cepa CU 385/83 en cuanto a la cinética del crecimiento, el comportamiento hidrodinámico de la MFT, los recobrados celulares, el rendimiento de las proteínas y la eliminación de los contaminantes por etapas. Las VME purificadas se compararon, tomando en cuenta la identidad de las proteínas y la estructura vesicular. Los controles de calidad y las metodologías analíticas empleadas y su referencia, realizadas en las diferentes etapas del proceso, se describen en el anexo 9. A partir de las VME en sacarosa obtenidas de la cepa NZ 98/228 adsorbidas en gel de HA como MG se realizó un estudio de pre-estabilidad (37 ºC-7 días) donde se evaluó el comportamiento del pH, el contenido de endotoxina y la inmunogenicidad, la medición de las dos últimas características se realizó a partir de preparados vacunales cuya composición se refiere en 2.5.2 para la variante en sacarosa. En la determinación de la inmunogenicidad en los ratones, medida por ELISA se aplicó una dosis de 25μg y se procedió según se refiere en 2.1.12. Para determinar la ABS se aplicaron dos dosis de 25μg y se siguió la metodología descrita en 2.1.13. Materiales y Métodos 50 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ El estudio se realizó de forma comparativa con igual número de MG obtenidos a partir de las VME de la cepa CU 385/83 y se evaluaron paralelamente bajo los mismos principios referidos en este acápite. En el anexo 10 se presentan los controles de calidad, los métodos analíticos utilizados y su referencia. 2.7 Obtención del nuevo candidato vacunal bivalente a partir de las VME de N. meningitidis serogrupo B 2.7.1 Formulación de los monograneles y de la vacuna MenB bivalente A partir de las VME en sacarosa al 3%, provenientes de las cepas obtenidas acorde con el diagrama de flujo presentado en el anexo 8, se prepararon MG de forma independiente para cada VME bajo un mismo principio de composición y formulación. El proceso se basó en la adsorción de las VME purificadas en el gel de HA. Las VME en sacarosa se esterilizaron por filtración y el gel concentrado de HA, por calor. El proceso se realizó en condiciones asépticas. Inicialmente, al gel de HA concentrado se le adicionó cantidades suficientes de sacarosa y fosfato para garantizar concentraciones finales de 0,3% de sacarosa y 0,7 mM, respectivamente. Posteriormente, las VME se diluyeron y adsorbieron para lograr una concentración de proteínas en HA, en ocho y cuatro veces superiores respectivamente, con relación a la composición diseñada para la vacuna MenB bivalente (anexo 11a). El gel de HA empleado se produjo por Brenntag Biosector, contenía 30 mg.mL-1 en presentación estéril. Los MG fueron formulados en botellones de vidrio, calidad hidrolítica tipo I con capacidad de 5 L con tapa roscada de resina de melanina y junta de teflón, que puede ser esterilizada a 200 ºC. Finalmente, la composición del MG formulado contenía: 400 µg.mL-1 de proteínas, 16 mg. mL-1 de HA, 0,3% de sacarosa y 0,7 mM de fosfatos con un pH=6.5±0,2. La vacuna bivalente se obtuvo por la unión aséptica a partes iguales de los MG estériles correspondientes a cada una de las cepas. La mezcla en cuestión estaba cuatro veces más concentrada con relación a la composición establecida para la vacuna final, por lo que este preparado se diluyó con soluciones de fosfatos, sacarosa y Cloruro de Sodio, añadidas de forma estéril, por filtración microbiológica, lográndose alcanzar la composición diseñada para la vacuna Materiales y Métodos 51 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ bivalente como sigue: 100 µg.mL-1 de proteínas, 4 mg.mL-1 de HA, 3% de sacarosa, 0,62% de cloruro de sodio y 0,7 mM de fosfatos con un pH=6.5 ± 0,2 (anexo 11b) En las formulaciones todas las mediciones de los componentes se realizaron por pesadas y transferencias cerradas bajo flujo laminar Clase A. La vacuna se formuló en botellones 20 L de cristal, con las características anteriormente señaladas. El producto a granel se llenó en las instalaciones de GSK en Bélgica. 2.7.2 Controles de calidad de las VME en sacarosa, monograneles y la vacuna MenB bivalente Se realizaron controles de calidad a cinco lotes de VME de cada cepa en sacarosa proveniente de las cepas vacunales (CU 385/83 y NZ 98/228). En el anexo 12 se presentan los controles de calidad; límites de especificación o valores esperados, los métodos de ensayo empleados y sus referencias. A cuatro lotes de MG provenientes de las VME de cada una de esas cepas se le realizaron controles de calidad. En el anexo 13 se presentan los límites de la especificación o los valores esperados, los métodos de ensayo empleados y sus referencias. Se realizaron controles de calidad a cuatro lotes de la vacuna MenB bivalente. En el anexo 14 se presentan los límites de la especificación o valores esperados, los métodos de ensayo empleados y sus referencias. 2.7.3 Comparación de la respuesta inmune de los monograneles, MenB bivalente y VA-MENGOC-BC® A partir de los tres lotes del MG de las cepas CU 385/83 y NZ 98/228 se obtuvieron también tres lotes de vacuna MenB bivalente, éstos se compararon entre sí tomando en cuenta la respuesta inmune funcional por la ABS para cada uno de los lotes de vacuna con los MG que le dieron origen. El estudio se realizó en tres grupos de 10 ratones BALB/c de seis a ocho semanas cada uno, a los dos grupos correspondientes a los MG se les aplicó dos dosis de 5 μg de proteínas separadas con un intervalo de 14 días. La vacuna MenB bivalente se evaluó de igual forma pero con la aplicación de 10 μg de proteínas. Se evaluó la respuesta inmune funcional por la ABS de tres lotes de la vacuna bivalente en comparación con igual cantidad de lotes de VA-MENGOC-BC® con la aplicación de dos dosis de 10 μg de proteínas en un esquema similar al referido anteriormente. Materiales y Métodos 52 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 2.7.4 Estudios de estabilidad de los monograneles y de la vacuna MenB bivalente a granel Se realizaron estudios de estabilidad de vida de estante y estrés a tres lotes de MG provenientes de las VME de cada una de las cepas vacunales CU 385/83 y NZ 298/228, e igual número de lotes de la vacuna MenB bivalente a granel de acuerdo con los protocolos resumidos y referidos en los anexos 15 y 16. En el estudio se utilizaron métodos analíticos validados. Cada muestra del estudio se analizó por triplicado. Se realizaron análisis estadísticos de los resultados de acuerdo a los criterios referidos en 2.1.18. 2.8 Análisis estadístico El análisis estadístico se realizó con el uso del paquete SPSS versión 11.5 para Windows. Los gráficos que permiten visualizar los resultados se confeccionaron en STATISTICA versión 7.0. Un nivel de significación del 5% fue usado para las comparaciones. En caso de comparaciones múltiples que requirieron de un ajuste en el nivel de significación se usó el criterio de Fonferroni. Para cada comparación se aplicó la prueba de hipótesis que mejor se ajustó. Se analizó el cumplimiento de los supuestos de homogeneidad de varianza (prueba de Levene) y de normalidad (prueba de Kolmogorov Smirnov). En caso de cumplirse estos supuestos se usó ANOVA de un factor (a la prueba t de Student) para muestras pareadas o no pareadas, dependiendo de la comparación de interés. Se usaron, además, pruebas no paramétricas en caso de no verificarse los supuestos antes mencionados: la prueba de Mann-Whitney para la comparación de dos muestras no pareadas, la prueba de Wilcoxon para dos muestras pareadas, la prueba de Kruskal Wallis para comparar más de dos muestras no pareadas y la prueba de Friedman para más de dos muestras pareadas. Materiales y Métodos 53 RESULTADOS Y DISCUSIÓN CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 3. RESULTADOS Y DISCUSIÓN 3.1 Perfeccionamiento del proceso de separación celular mediante el empleo de la microfiltración tangencial 3.1.1 Comportamiento hidrodinámico del sistema de MFT y recobrados del proceso Los resultados obtenidos muestran un flujo inicial de 120 L.h-1m-2, proceso que se estabilizó a partir de los 35 minutos con flujos medios entre 62 y 67 L.h-1m-2. Estos resultados permitieron concentrar el cultivo de 460 hasta 30 L entre 45 ó 50 minutos, equivalente a una concentración de 15,3 veces (figura 1a). Concluida la etapa de concentración, se comenzó un proceso de lavado celular a volumen constante, con la utilización del tampón de proceso Tris-EDTA a pH = 8,5, con el objetivo de eliminar restos de los medios de cultivos y otros productos del metabolismo excretado durante el crecimiento bacteriano. Lo anterior facilitó la preparación de la biomasa para la posterior extracción de las VME. En esta etapa los flujos de filtrado disminuyeron ligeramente con relación a la etapa de concentración, comportamiento que pudo estar relacionado con los cambios hidrodinámicos del sistema, introducidos por el tampón, encontrándose flujos entre 56 y 71 L.h-1m-2. En un tiempo de operación de 30 minutos, luego de tres volúmenes de diafiltración se alcanzó el pH = 8,5 del tampón de proceso (figura1b). Para realizar el proceso de extracción se necesitó ajustar la concentración final de la biomasa en relación con el volumen del cultivo inicial en una concentración de 25 a 35 veces, para mantener la proporción de 5 mL de tampón por gramo de peso húmedo. Esta relación tampón-biomasa está descrita por diferentes autores y es la utilizada en la tecnología tradicional (Campa y col, 1989; Fredriksen y col, 1991; Frasch y col, 2001). El recobrado celular medio (base peso seco) fue 87,2%, considerado alto para las operaciones que utilizan membranas, lo que indicó una baja interacción entre N. meningitidis y la membrana Hydrosart empleada en la separación, otras aplicaciones de este sistema, como en la separación de lisados de células del Clostridium tetani, Corynebacterium diphteriae y Bordetella pertussis, muestran una menor eficacia, comportamiento que pudiera estar asociado con las diferencias de talla, forma y estructura química de la pared celular bacteriana (Cardoso, 2001). Los recobrados fueron 1,6 veces superiores a los de la tecnología tradicional donde se recupera como promedio el 54,2%, cifra que resultó estadísticamente significativa (p=0.000002) (figura 2a). 54 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Este comportamiento posibilitó contar con una mayor masa celular para realizar la extracción por proceso de fermentación de 460 L; lo que se tradujo en un mayor rendimiento de proteína vesicular media extraída, la que fue de 14 g por proceso a diferencia de los 6,5 g extraídas como promedio en las condiciones de la tecnología tradicional (figura 2b), lográndose un incremento de 2,15 veces, diferencia que resultó estadísticamente significativa (p=0.000000). Es conveniente aclarar que los rendimientos de la proteína vesicular referidos en esta etapa del proceso se calcularon a través de la separación de éstas en muestras del sobrenadante del "debris" celular obtenido posterior a la extracción de las VME. En el extracto de las VME existieron por proceso de 460 L, un promedio de 98,3 g de proteínas totales provenientes de la tecnología propuesta y 69,03 g de la tecnología tradicional, lo que representó un 30% de incremento. Sin embargo, su composición fue diferente, en cuanto a las proteínas vesiculares presentes, las que representaron 14,2% para la tecnología que incorporó la microfiltración tangencial y 9,4% para la tradicional. La extracción constituye una etapa crítica del proceso donde la acción detergente del DOC al 0,5% en presencia del tampón de proceso Tris-EDTA garantiza la disociación de las estructuras de membrana en las VME, la solubilización del LPS libre y la inactivación de la bacteria, así como la cantidad de proteínas que entran al proceso y su adecuada relación con los LPS para asegurar la estructura vesicular durante todo el proceso posterior y en las VME purificadas (Frasch y col, 2001; Rosenqvist y col, 2001). El proceso propuesto para el cambio en la etapa de separación – resuspensión trajo resultados positivos en la etapa de extracción, al parecer no sólo por el alto recobrado celular obtenido durante la separación, sino además porque la centrifugación y la consecuente resuspensión celular que utiliza la tecnología tradicional, hace difícil lograr una buena resuspensión a partir de una torta compacta. Por otra parte, el proceso de concentración – diafiltración evaluado, siempre garantizó una suspensión fluida con pocas posibilidades de agregación celular, lo que posibilita un mejor contacto célula – detergente durante la extracción de las VME. Cuando se intentó comparar los resultados obtenidos en esta tesis respecto a la eficiencia obtenida con la introducción de la MFT en la etapa de separación celular no se encontró en la literatura revisada, resultados descritos por otros autores que pudieran servir de comparación en este acápite. Sin embargo la aplicación de este método en la separación de la biomasa de N. meningitidis se describe por Frasch y colaboradores (2001) quienes recomiendan la utilización de membranas de Resultados y Discusión 55 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Flujo (L.h-1m-2) 120 80 40 9,0 80 8,5 60 8,0 40 7,5 pH Flujo Normalizado 160 b) 100 Flujo (L.h-1m-2) a) 200 Flujo Normalizado pH del filtrado 20 0 0 10 20 30 40 50 60 Tiempo (min) 7,0 6,5 0 0V 1V 2V 3V Lavados Fig. 1. Comportamiento hidrodinámico del sistema de MFT en las etapas de concentración y lavado celular con tampón Tris-EDTA, pH 8,5: a) Flujo de filtrado normalizado en el tiempo para la etapa de concentración; b) Flujo del filtrado normalizado y pH por número o volumen de lavado en la etapa de diafiltración. Fig. 2. Recobrado celular y rendimiento de proteína vesicular extraída en el proceso de obtención de VME purificadas luego de la concentración y lavado celular por MFT en comparación con la tecnología tradicional: a) Media del recobrado celular en base a peso seco de la tecnología evaluada y la tradicional; b) Masa de proteína vesicular extraída por ambas tecnologías. Resultados y Discusión 56 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 0,2μm, coincidiendo con la porosidad de las membranas empleadas en este estudio. Por otra parte Rosenqvist y colaboradores (2001), refieren el uso de sistemas comerciales de MFT para la separación celular de este microorganismo, mediante un proceso de concentración entre cinco y 20 veces a partir de 50 L de cultivo, escala que puede ser considerada piloto. En el presente trabajo se procesaron 460 L, los que fueron concentrados y lavados finalmente entre 25 y 35 veces en el propio reactor de extracción, con la utilización del tampón de proceso Tris-EDTA y posteriormente se añadió el DOC para realizar el proceso de extracción. En el trabajo de Rosenqvist y colaboradores (2001) a la biomasa concentrada y sin lavar se le añade el tampón Tris-EDTA-DOC. EL estudio aquí presentado constituye una aplicación de la MFT en la separación de N. meningitidis serogrupo B a escala industrial mediante un proceso que garantiza condiciones más limpias para la extracción de las VME ya que previamente se eliminaron todos los restos del medio y del metabolismo celular presentes en el cultivo. 3.1.2 Impacto en el proceso de purificación de las VME 3.1.2.1 Contenido e identidad de las proteínas por etapas, rendimiento y recobrado del proceso Como ya se explicó anteriormente, el contenido de las proteínas totales y vesiculares que entró al proceso de purificación fue mayor con la tecnología evaluada en este trabajo, no obstante existió un comportamiento similar en las salidas de las proteínas obtenidas en los diferentes pasos del proceso de purificación (figura 3). Los rendimientos promedios obtenidos al final del proceso de purificación fueron de 7,6 y 3,8 g para las tecnologías en evaluación y la tradicional, respectivamente, con rendimientos superiores en 2,05 veces a favor de la variante en estudio (figura 4), diferencia que fue estadísticamente significativa (p=0.000 000). El resultado anterior estuvo en correspondencia con el contenido de la proteína vesicular que entró al proceso, la que, en este caso fue 2,15 veces mayor. Al comparar los recobrados finales de la proteína vesicular purificada, para cada tecnología se apreció que ambos fueron similares (57 y 59%). Los resultados anteriores demostraron que el proceso de purificación de las VME establecido tuvo la capacidad de asimilar los nuevos rendimientos de la proteína total y vesicular en el extracto, sin cambiar su comportamiento habitual durante la etapa de purificación. La composición cualitativa relativa de las proteínas en la etapa de la extracción y en cada una de las fases del proceso de purificación de las VME para la variante tecnológica en evaluación y la Resultados y Discusión 57 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ tecnología tradicional fue similar (figura 5). Así, como era de esperar, en el SDS-PAGE las líneas 2 y 8 correspondientes a la etapa de extracción, estuvieron presentes las proteínas que forman mayoritariamente el CPME de las VME: PorA (clase 1), PorB (clase 3), RmpM (clase 4), Opc (clase 5) y las proteínas de 70 y 80 kDa, pero pudieron identificarse también claramente otras proteínas con una intensidad relativa similar a las ya mencionadas, que al parecer no forman parte de las VME o se encuentran débilmente unidas a las mismas y son eliminadas o disminuidas durante las etapas de concentración y el lavado del extracto (líneas 3 y 9), aunque después de la ultracentrifugación la presencia de las proteínas características en las VME fue más marcada (líneas 4 y 10). Estos resultados permitieron evidenciar que existió un comportamiento similar en la identidad de las proteínas para ambas variantes tecnológicas durante las etapas de extracción y purificación de las VME. 3.1.2.2 Eliminación de los contaminantes en los pasos de purificación de las VME Los contaminantes celulares de mayor interés presentes en las VME son los LPS y los PC. Los LPS a pesar de considerarse un contaminante que debe disminuirse por su carácter endotóxico, está demostrado que su presencia en una concentración de alrededor del 5%, garantiza la estructura vesicular de las proteínas, y en esta forma es 100 veces menos tóxico que cuando se encuentra libre (Frasch y col, 2001). En la tecnología de purificación, la ultracentrifugación constituyó la etapa fundamental para disminuir el contenido de LPS con relación a las proteínas, es en el proceso de ultracentrifugación donde las VME precipitan y se separan mayoritariamente de los LPS y PC-B que se solubilizaron con DOC durante la etapa de extracción y no forman parte de las VME (figura 6a y 6b). En la tecnología tradicional, al finalizar la etapa de ultracentrifugación, el contenido medio de LPS fue del 10% con relación a la proteína, sin embargo en la tecnología propuesta, el contenido medio se elevó a 14.4% (figura 6a). Los resultados señalados anteriormente pudieran estar relacionados con los cambios propuestos para la concentración, el lavado y resuspensión celular, que al ser un proceso más delicado favorece la formación de VME con un mayor contenido de LPS. Para alcanzar los niveles de LPS establecidos en la especificación (2–6%) las VME se resuspendieron en un tampón que contiene DOC al 5%, concentración que facilitó la resuspensión de las mismas y la depletación parcial de los LPS presentes en las vesículas, compuestos que se separan luego de una etapa de cromatografía de exclusión molecular. Cuando se compararon los resultados obtenidos al concluir la etapa en cuestión se observó un comportamiento similar respecto Resultados y Discusión 58 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Proteína total (g) 160 Tecnología evaluada Tecnología tradicional 120 Fig. 3. Comportamiento medio del contenido de proteína de VME extraídas con DOC, luego de la concentración y lavado celular por MFT en comparación con la tecnología tradicional. Etapas: PE (Proteínas extraídas); CP (Concentrado de proteínas); VUC (Vesículas ultracentrifugadas) y FC (Fracción cromatográfica). 80 40 0 PE CP VUC FC Etapa de Proceso Fig. 4. Rendimiento de proteína vesicular en FC de VME purificadas luego de la concentración y lavado celular por MFT, en comparación con la tecnología tradicional. - - Leyenda: Líneas 1 y 7: VME separadas por ultracentrifugación del extracto con fines analíticos. Líneas 2 y 8: Extracto de proteínas Líneas 3 y 9: Concentrado de proteínas Líneas 4 y 10: VME ultracentrifugadas Líneas 5 y 11: FC de VME PPM: Patrón de peso moleculares Fig. 5. SDS-PAGE de las proteínas presentes en las etapas de extracción y purificación de VME luego de la concentración y lavado celular por MFT (Líneas 1 - 5) en comparación con la tecnología tradicional (Líneas 7 - 10). Resultados y Discusión 59 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ a la disminución del contenido de LPS con relación a las proteínas, que fue del 65% para la variante propuesta y del 66% para la tradicional. Sin embargo, como los valores iniciales de entrada en esta etapa fueron diferentes, el contenido final medio de los LPS con relación a la proteína en las FC fue del 5,3 y 4,1%, respectivamente. Al parecer, la diferencia encontrada en el contenido de LPS no dependió de la capacidad del proceso de purificación sino de la diferencia de las condiciones empleadas en la separación y el lavado celular, comportamiento que se explicó anteriormente. El PC-B como contaminante debe también disminuirse con el objetivo de evitar el riesgo de desencadenar reacciones autoinmunes, por la similitud de ese PC con las estructuras presentes en los tejidos humanos (Jennings, 1986; Zollinger, 1987). A pesar de comenzar el proceso de la tecnología tradicional con un contenido superior de PC con relación a la tecnología propuesta, el paso de la ultracentrifugación, para ambas tecnologías, fue capaz de disminuir su contenido en más del 90%, con valores medios de 0,58% en relación con la proteína para la variante en evaluación y 0,51% para la tecnología tradicional. En el paso cromatográfico se disminuyó aún más el contenido de PC, encontrándose valores medios similares (0,33%) para la variante evaluada y 0,34% en relación a las proteínas para la tecnología tradicional (figura 6b). Los resultados alcanzados pusieron en evidencia que los pasos del proceso establecidos tuvieron la capacidad de purificar las VME obtenidas luego de la introducción de los cambios que generó la variante en evaluación y aunque, los métodos de purificación empleados en este trabajo coincidieron con los recomendados por otros autores (Frasch y col, 2001; Rosenqvist y col, 2001), no fue posible hacer comparaciones, por la ausencia de estudios publicados al respecto. 3.1.3 Cumplimiento de las especificaciones de calidad de las fracciones cromatográficas Los resultados de los controles de calidad de las FC obtenidas por las variantes en estudio y la tradicional demostraron que ambos procesos fueron consistentes y cumplieron con las especificaciones de calidad establecidos. No obstante, a continuación se compararon el comportamiento de cada requisito de calidad y su posible impacto en el proceso. El perfil electroforético de los CPME que conformaron las VME, presentó uniformidad entre los lotes procedentes de las variantes tecnológicas comparadas entre sí, así como entre los lotes en cada una de ellas, donde se detectó la presencia de las proteínas PorA, PorB, RmpM, Opc y las de 70 y 80 kDa (figura 7). Resultados y Discusión 60 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 240 150 -1 180 120 Tecnología evaluada Tecnología tradicional 60 0 PE CP VUC FC Etapa de Proceso PC-B (ug.mg-1) b) 180 LPS (ug.mg ) a) 300 Tecnología evaluada Tecnología tradicional 120 90 60 30 0 PE CP VUC FC Etapa de Proceso Fig. 6. Comportamiento medio del contenido de contaminantes en la purificación de VME extraídas con DOC, luego de la concentración y lavado celular por MFT en comparación con la tecnología tradicional. Etapas: PE (Proteínas extraídas); CP (Concentrado de proteínas; VUC (Vesículas ultracentrifugadas) y FC (Fracción cromatográfica): a) Contenido de LPS en base a proteína total; b) Contenido de PC-B en base a proteína total. Leyenda: - Líneas 1 a 4: Lotes de FC de la tecnología en evaluación. - Líneas 5: Patrón de VME purificada (Tec. Tradicional). - Líneas 6: Patrón de peso molecular - Líneas 7 a 10: FC de la tecnología tradicional. Fig. 7. SDS-PAGE del CPME en FC de VME obtenidas luego de la concentración y lavado celular por MFT en comparación con la variante tradicional. Resultados y Discusión 61 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 En relación a los contaminantes, el contenido medio de LPS con relación a la proteína aumentó de 4,1 a 5,3%, diferencia que resultó estadísticamente significativa (p=0,006), sin embargo ambos cumplieron la especificación (tabla 2a y 2b). En el caso de la vacuna Folkehelsa los límites de especificación para esta característica están entre 4 y 10% relativo a la proteína, por otra parte, se recomienda un 5% para garantizar una estructura vesicular adecuada (Frasch y col, 2001). Al parecer el ligero aumento del contenido de LPS en las VME trajo como consecuencia una disminución de los valores medios de tramitancia (6,61) para el cambio en evaluación, cifras que resultaron muy inferiores a los obtenidos como promedio en la tecnología tradicional (17,4), resultado donde se observó una diferencia estadísticamente significativa (p=0.006) (tabla 2a y 2b). Esta observación está a favor de la presencia de las VME intactas, estructuras que aumentan la opalescencia de las fracciones cromatográficas. La tramitancia es a su vez una medición inversa de esta característica. Tabla 2. Cumplimiento de las especificaciones de calidad de FC de VME de N. meningitidis serogrupo B obtenida luego de la introducción de la MFT en comparación con la tecnología tradicional. a) Proceso en evaluación, b) Procesos tradicionales. a) Proceso en evaluación PE38B PE39B PE40B I PE40B II PE41B PE42B I Concentración de Proteína (1,6-6,0 mg.ml-1) 2,24 2,78 3,65 3,54 2,91 3,34 Contenido de LPS (20-60 µg.mg-1) 44,29 59,36 57,19 49,19 53,03 54,12 3,076 52,86 2,80 15,0 5,1 3,2 3,8 5,3 7,3 6,61 0,53 5,47 0,74 4,34 Concentración de Proteína (1,6-6,0 mg.ml-1) 3,43 2,80 3,01 3,65 2,75 3,6 Contenido de LPS (20-60 µg.mg-1) 35,04 43,15 45,40 39,20 41,05 39,04 -Contenido de ácido siálico <10 µg.mg-1 3,08 3,10 2,30 2,10 2,94 2,71 3,21 40,48 2,71 20 15,1 17,2 21,5 18,3 12,4 17,42 0,40 3,60 0,42 3,31 Media DE Contenido de ácido siálico <10 µg.mg-1 3,38 3,09 2,25 2,00 3,83 2,26 Tramitancia <32 b) Procesos tradicionales P0001 P0002 P0003 P0004 P0005 P0006 Media DE Tramitancia <32 La medición de la tramitancia como criterio de la opalescencia y en última instancia de la presentación vesicular, se estableció desde el inicio de la producción, basado en los estudios Resultados y Discusión 62 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ previos, donde se relacionaron los valores de tramitancia con la presencia de las VME, por microscopía electrónica, resultados no mostrados en este trabajo. Las microfotografías electrónicas de las FC de las VME obtenidas por las dos variantes, muestran una mayor presencia de vesículas intactas a favor de la variante en evaluación. Las VME mostraron un tamaño entre 50 y 90 nm (figuras 8a y 8b). Se recomendó la presencia de las proteínas en forma de VME, con el objetivo de garantizar la presentación nativa de estas dentro de la membrana y facilitar el proceso de purificación. Por otra parte, el LPS en las VME es menos tóxico que el LPS libre (Frasch y col, 2001). Por todo lo expuesto anteriormente se consideró que los cambios que generó la introducción de la MFT en el proceso de obtención de las VME fueron favorables no sólo en relación con los rendimientos sino también con una mayor presencia de VME intactas en la FC. 3.1.4 Cumplimiento de las especificaciones de calidad del IFA y evaluaciones complementarias de antigenicidad, inmunogenicidad y actividad endotóxica Las VME de N. meningitidis serogrupo B, se presentaron como una torta alcohólica, producto que se mantuvo congelado (-70 0C) hasta su uso. Los IFA obtenidos por ambas tecnologías cumplieron de forma consistente todas las especificaciones de calidad establecidas, no obstante, el contenido de LPS en la variante en evaluación aumentó en 1% y mostró diferencia estadísticamente significativa(p=0.006)(tabla3a y 3b). La identidad de las proteínas presentes mostraron uniformidad entre los lotes y variantes, donde pueden apreciarse las proteínas: PorA, PorB, RmpM, Opc y las de 70 y 80 kDa (figura 9a). Para demostrar la equivalencia de identidad antigénica se realizaron evaluaciones inmunoquímicas complementarias, donde se utilizó una gamma globulina de referencia interna obtenida a partir del suero de vacunados con lotes de VA-MENGOC-BC®, que contenían como IFA, VME obtenida por la tecnología tradicional. En el WB se evidenció que los anticuerpos reconocieron las mismas proteínas en ambas variantes tecnológicas, donde se destacan las PorA, PorB, Opc y 70 kDa (figura 9b).Por otra parte, el ELISA mostró que los porcentajes de inhibición de la actividad de los anticuerpos obtenidos en las diferentes diluciones de los IFA provenientes de ambas variantes tecnológicas, presentaron un comportamiento similar, demostrándose la equivalencia de los antígenos presentes en las mismas (figura 10). La inmunogenicidad y la actividad endotóxica de los IFA de ambas variantes tecnológicas se evaluó a través de la formulación de preparados vacunales con la composición de VA-MENGOC-BC®. Se Resultados y Discusión 63 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ a) b) Fig. 8. Microfotografía electrónica de FC de VME obtenidas luego de la concentración y lavado celular por MFT en comparación con la tecnología tradicional: a) Tecnología evaluada; b) Tecnología tradicional. Resultados y Discusión 64 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Fig. 9. SDS-PAGE y Western blot del CPME del IFA, obtenidas luego de la concentración y lavado celular por MFT en comparación con la variante tradicional: Líneas 1, 5 y 6 (Lotes de IFA obtenidos por la tecnología tradicional); Líneas 2 a 4 (Lotes de IFA obtenidos por la tecnología en evaluación); Líneas 7 (Patrón de VME purificada por la tecnología tradicional). 100 Inhibición (%) 80 60 40 Tec. Tradicional Tec. Evaluada 20 0 1 2 3 4 5 6 Log2 (Dilución) Fig. 10. Porcentaje de inhibición de la actividad de anticuerpos contra VME de N. meningitidis serogrupo B para diferentes diluciones del IFA, luego de la concentración y lavado celular por MFT en comparación con la tecnología tradicional. Resultados y Discusión 65 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 pudo evidenciar que las dos variantes tecnológicas cumplieron las especificaciones de calidad de la vacuna para los parámetros anteriormente señalados donde se observó que la inducción de anticuerpos medidos por el método de ELISA fue similar (figura 11) (p=0.748774), igual al comportamiento que mostró la ABS (figura 12) (p=0.074 792). La actividad endotóxica no evidenció diferencias (figura 13) (p=0.420071) Tabla 3. Cumplimiento de especificaciones de calidad del IFA de VME de N. meningitidis serogrupo B obtenida luego de la introducción de la MFT en comparación con la tecnología tradicional. A) Lote en evaluación, b) Lotes tradicionales. a) Contenido de Contenido de Contenido proteínas/gramo Contenido de LPS Lote en de ácido siálico ácido nucleico peso húmedo evaluación (20-60 µg.mg-1) -1 -1 <10 µg.mg <10 µg.mg ≥ 30mg.g-1 LE38B 30,38 48,03 2,81 2,02 LE39B 50,29 44,59 1,67 2,02 LE40B I 42,79 49,57 2,30 2,73 LE40B II 43,04 55,58 2,23 2,43 LE41B 40,25 56,68 2,34 1,61 LE42B I 39,53 50,49 2,08 1,40 Media 41,05 50,82 2,24 2,04 DE 6,47 4,59 0,37 0,49 b) L0001 L0002 L0003 L0004 L0005 L0006 Contenido de proteínas/gramo peso húmedo ≥ 30mg.g-1 39,5 45,3 42,9 39,8 44,5 47,4 Media 43,23 40,48 2,33 1,90 1,53 ,2,02 2,02 1,43 1,19 1,61 DE 3,13 3,62 0,41 0,34 Lotes tradicionales Contenido de LPS (20-60 µg.mg-1) Contenido de ácido siálico <10 µg.mg-1 Contenido de ácido nucleico <10 µg.mg-1 42,03 37,05 41,20 46,18 40,18 36,21 2,93 1,84 2,35 2,43 2,5 1,9 El método de LAL no detectó el incremento del 1% en el contenido del LPS en relación a las proteínas en las VME, aspecto que pudo estar relacionado con los límites de especificación del contenido de proteína en VA-MENGOC-BC® en un rango superior e inferior del 30%, lo cual introduce una variación en el contenido de LPS total presente. Por otra parte el método de LAL presenta su propia variabilidad, por ejemplo se considera aceptable para el método una recuperación del patrón añadido de 5 UE.mL-1 en la prueba entre un 50-150%. Los resultados anteriores demuestran que los IFA obtenidos con el cambio en la etapa de separación celular referido a la MFT fueron equivalentes a los obtenidos por la tecnología tradicional Resultados y Discusión 66 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Fig. 11. Contenido de UIgG.mL-1 en ratones inmunizados con 50 ug de proteína del IFA obtenido luego de la concentración y lavado por MFT en comparación con la tecnología tradicional Fig. 12. Actividad bactericida de ratones inmunizados con una dosis de 50 ug de proteína del IFA obtenido luego de la concentración y lavado por MFT en comparación con la tecnología tradicional Fig. 13 Actividad endotóxica del IFA a una concentración de proteínas de 100 ug de proteínas por mL-1, obtenido luego de la concentración y lavado por MFT en comparación con la tecnología tradicional Resultados y Discusión 67 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ en cuanto a: identidad, antigenicidad, inmunogenicidad, funcionabilidad de anticuerpos y endotoxicidad, requisitos de calidad muy relacionados con la eficacia y seguridad de las vacunas. Se demostró también la equivalencia en las etapas del proceso posterior al cambio y los productos intermedios que se generaron. Esta demostración de la equivalencia estuvo en correspondencia con los lineamientos de la guía para el control de cambios de productos biotecnológicos/ biológicos, vigente en la Unión Europea (EMEA, 2006a). 3.1.5 Ventajas de la introducción de la MFT en el proceso de obtención de VME ¾ La MFT facilitó la demostración del cumplimiento de las BPF, permitiendo la creación de un sistema integrado, cerrado y validable para todas las operaciones con el microorganismo vivo hasta su inactivación, procedimiento que redujo considerablemente los riesgos para el personal y el medio ambiente, así como una mayor seguridad para el producto. Además, posibilitó los procesos de descontaminación y limpieza, así como su validación. ¾ La MFT permitió la salida del proceso de dos centrífugas de flujo continuo, ocho centrífugas de alta velocidad, tres flujos laminares y un reactor. La salida de estos equipos redujo las áreas de producción necesarias en 100 m2. ¾ La MFT posibilitó la reducción del costo de producción de las VME como IFA en un 48% debido a la disminución del consumo material, por duplicar los rendimientos de proteínas y la salida del proceso de áreas y equipos. ¾ La MFT disminuyó el presupuesto para la remodelación de una planta de obtención de IFA en 450 000 USD, por la reducción de las áreas clasificadas y el equipamiento tecnológico. 3.1.6 Conclusiones parciales del perfeccionamiento del proceso de separación celular ¾ La separación celular de la cepa CU 385/83 por MFT permitió aumentar el recobrado celular en un 33% y de las VME purificadas en más de dos veces; así como una disminución del tiempo del proceso de obtención de las mismas en tres horas. ¾ Se garantizó el cumplimiento de las BPF en cuanto al trabajo con microorganismos patógenos en un sistema cerrado, método que facilitó la demostración del cumplimiento de las BPF y una disminución apreciable del número de equipos y áreas utilizados. ¾ El proceso evaluado presentó un comportamiento equivalente en las etapas de extracción y purificación de las VME con relación al tradicional. Resultados y Discusión 68 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ ¾ Las VME purificadas fueron equivalentes a las obtenidas por la tecnología tradicional en cuanto a su identidad, antigenicidad, inmunogenicidad y endotoxicidad, requisitos de calidad muy relacionados con la eficacia y seguridad de las vacunas. ¾ El cambio evaluado, posibilitó la reducción del costo de obtención del IFA en un 48% y el presupuesto de inversión de la remodelación de la planta para su producción en 450 000 USD. 3.2 Análisis de los componentes proteicos de las VME purificadas mediante la electroforesis bidimensional y una plataforma de proteómica Las VME de N. meningitidis serogrupo B utilizadas como IFA en VA-MENGOC-BC® están constituidas fundamentalmente por dos tipos de compuestos: proteínas y lípidos, ambos se ubican y forman una parte importante de la membrana externa de esta bacteria gramnegativa. Las proteínas mayoritarias se identifican bien con el uso de AcM específicos contra las PME individuales. Así, en estudios previos se evidencia la presencia de las proteínas de clase 1 (PorA), clase 3 (PorB), clase 4 (RmpM), clase 5 (opc) y proteínas de alto peso molecular (Campa y col, 1989, Estrada, 1995; Martínez, 2002). A pesar de lo referido anteriormente, se necesitan identificar otras proteínas minoritarias que pudieran tener un impacto importante en la demostración de la consistencia productiva y en la posible justificación de la respuesta inmune heteróloga de la vacuna cubana. 3.2.1 Análisis de los componentes proteicos de las VME por electroforesis bidimensional Los mapas bidimensionales de los tres lotes de producción estudiados evidenciaron una presencia proteica compleja con más de 260 manchas en los geles analíticos con rango de pI 3 – 10. El número de manchas se incrementó en más de dos veces, en los geles con rango de pI 4 – 7 debido a una mayor carga de proteína aplicada y al aumento de la resolución (figura 14). La consistencia de los tres lotes de producción del IFA se evaluó mediante la estimación del volumen correspondiente de mancha a los cinco componentes mayoritarios (tabla 4) y por la opción de diagramas de dispersión del software Melanie III (figura 15). El lote A se seleccionó como referencia para hacer las comparaciones, ya que en ambos sistemas mostró el mayor número de manchas. Resultados y Discusión 69 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Tabla 4. Evaluación de la reproducibilidad lote a lote: número de manchas en los tres lotes y contribución de las proteínas mayoritarias en el IFA. Número de manchas y proteínas mayoritarias A 297 630 9,0% 18,8% 13,9% 9,0% 7,5% Lotes B 282 623 9,1% 19,8% 15,8% 10,7% 8,5% C 264 628 9,2% 21,8% 18,7% 8,3% 7,5% Número de manchas. Gel pI 3-10 Número de manchas. Gel pI 4-7 FrpB PorA PorB RmpM Opa + Opc Contribución de proteínas mayoritarias para el 58,2% 69,3% 65,6% contenido total de proteínas En el rango de separación pI 3 – 10 se evidenciaron 241 manchas comunes en los tres lotes comparados y 16 estuvieron presentes en uno ó dos de los mapas confrontados. Cuando se compararon sólo las manchas intensas cuya contribución al contenido total fue igual o mayor que 0,1% del total del volumen, 78 manchas se identificaron como comunes en todos los geles y siete estuvieron ausentes en uno ó dos de los mismos. Los geles analíticos 2D de pI 4 - 7 también se investigaron con el programa de edición de imágenes y en éstos se obtuvieron 512 manchas comunes y 47 no estuvieron presentes en uno ó dos geles. Mientras que, cuando se consideró sólo la contribución de las manchas que representaban igual o más del 0,1% del volumen total, se evidenciaron 275 manchas y se redujo a nueve la cantidad de manchas no pareadas. Para analizar las similitudes existentes entre los geles de interés se realizaron gráficos de dispersión con la ayuda del programa Melanie III, gráficos que mostraron la distribución obtenida al comparar los valores del porcentaje de volumen de las manchas pareadas en cada gel analizado con respecto al gel de referencia (Lote A) y la línea de ajuste. En la figura 15 aparecen estos gráficos para los geles analíticos de rango de pI 3-10 y pI 4-7, respectivamente. Al comparar los gráficos de cada figura entre sí, se apreció una distribución similar de los valores. En todos los casos se obtuvieron relaciones lineales con coeficientes de correlación cercanos a la unidad, indicando un buen ajuste de la recta obtenida y sin corrimientos de los valores de cada gel con respecto al empleado como referencia (apreciable en la ecuación de la recta). Resultados y Discusión 70 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 120 kDa 15 kDa A A 120 kDa 15 kDa B B 120 kDa 15 kDa pI: 10.0 C pI: 3.0 pI: 7.0 C pI: 4.0 Fig. 14. Electroforesis bidimensionales analíticas de tres lotes de producción de IFA. Izquierda: Rango de separación pI 3-10. Derecha: Rango de separación pI 4-7. Resultados y Discusión 71 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ El lote B y el A (referencia) tuvieron 269 pares de manchas y un coeficiente de correlación para la recta de 0.99, al igual que la figura correspondiente al lote C con respecto al A (con igual coeficiente) y 248 manchas pareadas (figura 15a y 15b). En las figura 15c y 15d se aprecia el mayor número de manchas pareadas, 540 y 550 pares entre los lotes B y C y el lote A, respectivamente (por la expansión en el rango de separación, como se explicó anteriormente), donde se mantuvo un alto coeficiente de correlación cercano a 0,96. En ambos casos la ecuación de la recta obtenida indicó que, en el gel de referencia, el valor del porcentaje de volumen de la mayoría de las manchas pareadas varió ligeramente en relación con los geles analizados. Existió un 3% menos en el gel A (referencia) que en el B y un 10% más en el gel A en comparación con el C, comportamiento que pudo deberse a pequeñas variaciones experimentales como a las variaciones en la intensidad de la tinción. 3.2.2 Identificación de las proteínas por espectrometría de masas A partir de los geles bidimensionales preparativos de los rangos de pI 4-7 y pI 6-11 se extrajeron las manchas de proteínas y se digirieron con tripsina. Los péptidos obtenidos fueron analizados por espectrometría de masas (ESI-MS y ESI-MS/MS). Las proteínas se identificaron a través de la huella de la molécula de los péptidos, método que se conoce por su sigla en inglés PMF (Peptide Mass Finger), bajo los siguientes criterios: a) la identificación de los PMF obtenidos con el uso de los programas de búsqueda (ProFound y MASCOT) y las bases de datos (NCBI y Swiss-Prot) y en bacterias como categoría taxonómica, donde se consideró a las proteínas de N. meningitidis como el candidato más probable; b) secuencias de coberturas (≥20%); c) las señales más intensas del espectro son explicadas desde un punto de vista secuencial; d) un mínimo de cinco péptidos coincidentes con una exactitud de masa menor que 0.05 Da. Cuando no se cumplieron los criterios mencionados, la identificación se confirmó mediante el análisis de los espectros MS/MS, a través de la información estructural y la reconstrucción de la secuencia aminoacídica de los péptidos con el uso del programa MASCOT. Algunas proteínas, generalmente los componentes mayoritarios de las VME, se identificaron repetidamente en varias localizaciones (figura 16 y anexo 18), lo que evidenció la presencia de fragmentos con diferente migración en los valores de pI y de masa impredecibles. La PME clase 3 se identificó en 12 manchas y constituyó la entidad más frecuente. Se detectaron también algunos componentes minoritarios como la proteína citoplasmática conocida como factor G de elongación, Resultados y Discusión 72 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 proteína que se identificó en cuatro manchas (anexo 18). En sentido general, la heterogeneidad no sólo correspondió a los valores de pI (patrón horizontal) sino también con la masa. a) c) b) d) Fig. 15. Gráfico de dispersión del volumen de mancha (%) de electroforesis bidimensionales analíticas de tres lotes A, B y C del IFA. Izquierda: Rango de separación pI 3-10. Derecha: Rango de separación pI 4-7. a y c) Comparación lote B y lote A. b y d) Comparación Lote C y Lote A. Resultados y Discusión 73 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ La presencia de mezcla de proteínas se detectó en la mancha 29. Mediante la identificación por PMF, la proteína más abundante fue la L9 (50S ribosomal) y por el análisis ESI-MS/MS se identificó un sólo péptido de la PME clase 3. Entre las 78 manchas seleccionadas (figura 16), 65 se caracterizaron satisfactoriamente y entre ellas, 31 correspondieron a las proteínas específicas, mientras que las otras 34 pertenecieron a componentes minoritarios de los cuales no se obtuvo información alguna. El resumen de las proteínas identificadas se presenta en el anexo 18. En este trabajo se identificaron 11 PME (anexo 18); cinco correspondieron a las PME mayoritarias, representando entre el 58 y 65% del total de proteínas presentes. De acuerdo a las predicciones genómicas (Tetlein y col, 2000; Parkhill, y col, 2000; y Tettlein y col, 2004), se esperaba identificar un mayor número de PME, resultado que pudo estar influenciado por las dificultades señaladas en la solubilización de la membrana, lo que constituye un factor limitante en la resolución de la electroforesis bidimensional (Churward y col, 2005). Otro factor que pudo influir en los resultados fue la ausencia de algunas PME en las VME, debido a su baja expresión durante los cultivos in vitro, así como a su pérdida o disminución en los procesos de purificación, aspecto que pudiera estar relacionado con lo discutido en el acápite 3.1.2.1. Además de las PME ya analizadas en el presente trabajo, se identificaron otras 20 proteínas citoplasmáticas como componentes minoritarias de las VME (anexo 18). De éstas, 11 pertenecieron a pequeñas moléculas metabólicas, grupo donde se incluyen las clases funcionales relacionadas con la energía y la biosíntesis de los aminoácidos. Las nueve proteínas restantes se identificaron como macromoléculas metabólicas, estructuras vinculadas con la síntesis y modificación de las mismas. Dentro de estas últimas se encontró una enzima amino peptidasa, compuesto que pudiera tener alguna participación en la degradación de las proteínas mayoritarias, lo que dada su importancia debe ser objeto de estudios posteriores. La evidencia de un gran número de PME y otras proteínas citoplasmáticas que pudieran estar asociadas con éstas y no estudiadas hasta el presente respecto a su contribución con la inmunidad, pudiera explicar el comportamiento referente a la protección, mecanismo relacionado hasta la fecha sólo con las proteínas mayoritarias y sobretodo con la PorA, porina que por su gran variabilidad antigénica induce una respuesta serotipo específica. (Perret y Pollard, 2005; Mukhopadhyay y col, 2005). Sin embargo, diferentes estudios clínicos realizados con VA-MENGOC-BC® demuestran también su actividad heteróloga (de Moraes y col, 1992; Zollinger, 1998), respuesta inmunogénica Resultados y Discusión 74 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Fig. 16. Electroforesis bidimensionales preparativas del IFA. Imagen integradas a partir de geles en el rango de separación pI 4-7 y pI 6-11. Los números mostrados corresponden a las proteínas identificadas en el anexo 18. Resultados y Discusión 75 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ que se incrementa con la aplicación de una tercera dosis (Perkins y col, 1998; Tappero y col, 1999) y que pudiera estar relacionado con la presencia de componentes minoritarios en las VME (Boutriau y col, 2006). En este estudio se evidenciaron componentes minoritarios como la “OMP 85”, proteína que se identificó en la mancha 6, conservada en la especie y otras bacterias gramnegativas que es esencial para la viabilidad. Se evidenció también la NspA, otra proteína conservada y de gran interés por poseer actividad bactericida (Danzing, 2004). Las proteínas ribosomales están asociadas con las membranas y son cruciales en la biogénesis y translocación de las membranas. Existen varios estudios que indican para las proteínas ribosomales de los patógenos una alta actividad inmunogénica (Matsuoka y col, 1997; Iborra y col, 2003). Lo anterior pudiera estar relacionado con el hecho de que los ribosomas constituyen alrededor del 25% del peso seco de las bacterias y por otra parte, existe una alta identidad secuencial (>85%) entre las proteínas ribosomales S2, L6, L9 y L25 de varias bacterias (Lecompte y col, 2002). En este trabajo se evidenció la presencia en las VME de las proteínas ribosomales S2, L6, L9, L11 y L25. 3.2.3 Conclusiones parciales del análisis de los componentes proteicos en las VME ¾ Se evidenció la utilidad de la electroforesis bidimensional para la demostración de la consistencia en la presencia de proteínas constituyentes de las VME, estructuras que por su compleja composición resultan difíciles de analizar por los métodos utilizados tradicionalmente. ¾ La combinación de la electroforesis bidimensional con la espectrometría de masas mostró la presencia de otros componentes minoritarios de la membrana externa, así como de otras estructuras celulares relacionadas; componentes que pudieran resultar útiles para profundizar en el conocimiento de los mecanismos de la inmunidad de VA-MENGOC-BC®, aspecto que aún no está esclarecido totalmente. ¾ La caracterización realizada da respuesta al escenario regulatorio actual, con un conocimiento mas profundo de la composición de las VME, aspecto que puede servir de base para el desarrollo de nuevas generaciones de vacunas antimeningocócicas contra el serogrupo B. 3.3 Valoración del efecto de la sacarosa en la etapa de purificación y conservación de las VME 3.3.1 Comportamiento hidrodinámico del sistema de UFT y recobrados Se realizó la diafiltración con sacarosa al 3% a un volumen constante, con un flujo inicial de 47 L.h-1 m-2, flujo que se mantuvo sin alteración hasta el final del proceso. La diafiltración se realizó Resultados y Discusión 76 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ con 10 lavados en 30 minutos (figura 17). El comportamiento anterior evidenció que el proceso de diafiltración de las VME en sacarosa fue eficiente debido a una baja interacción del producto con la membrana filtrante. Esto resulta poco común cuando se utilizan los sistemas de filtración tangencial, métodos donde generalmente se disminuyen los flujos de filtrado durante los procesos debido a la interacción entre los materiales filtrantes y el producto (Cardoso, 2001). La eliminación del DOC se siguió a través de la medición de la absorbancia a 213 nm, donde este producto tiene un máximo de absorción. La presencia del DOC disminuyó en mayor magnitud en los primeros tres lavados, no detectándose a partir del sexto lavado. Determinaciones posteriores mostraron un contenido menor al 2% de DOC en relación con la proteína y con la utilización de un método que combina la CG y MS. En algunos trabajos previos se refieren al uso de la sacarosa al 3% como un estabilizador de las VME (Fredricksen y col, 1991; Frasch y col, 1995; Rosenqvist y col, 2001; Frasch y col, 2001), aunque no se hace referencia al valor del pH de la solución de sacarosa durante el proceso de diafiltración. Está bien documentado que las VME purificadas y obtenidas a partir de la cepa CU 385/83 poseen un punto isoeléctrico con valores que fluctúan en el rango de pH que oscila desde 4,23 a 4,54 (Martínez, 2002). Sin embargo, en las condiciones del proceso de este estudio fue necesario garantizar un pH ≥ 7,5 para evitar la precipitación de las VME durante la diafiltración (datos no mostrados). Basado en lo expresado anteriormente, el proceso de diafiltración se realizó en un tampón fosfato que garantizó un pH de 7,8 ± 0,2. Los recobrados medios para la variante de diafiltración con sacarosa fueron de 80,58% y de 69,25% para la variante de precipitación alcohólica establecida en el proceso tradicional. No se detectaron diferencias estadísticamente significativas entre los recobrados obtenidos en las variantes tecnológicas (p=0.248) (figura 18). 3.3.2 Impacto de la sacarosa en las características de las VME y su pre-estabilidad 3.3.2.1 Comportamiento del pH Los IFA en sacarosa mostraron una tendencia a la disminución del pH en el estudio de preestabilidad, aunque en ningún caso se alcanzó un pH < 7,5, valor donde las VME precipitan (figura 19a). Este resultado presentó diferencias estadísticamente significativas (p=0.023), lo que evidenció Resultados y Discusión 77 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 un posible signo de inestabilidad, debido a lo crítico que resulta este parámetro para mantener las VME en suspensión. 100 1,0 Flujo Normalizado 0,8 DO (Media) 60 0,6 40 0,4 20 0,2 0 0,0 DO213nm -1 -2 Flujo (L.h m ) 80 0 1 2 3 4 5 6 7 No. Lavados 8 9 10 11 Fig. 17. Comportamiento hidrodinámico medio y cinética de eliminación de DOC del lavado con sacarosa por UFT. Fig. 18. Recobrado de proteínas en el paso final de la purificación de VME por diafiltración con sacarosa en comparación con la tecnología tradicional. Resultados y Discusión 78 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 3.3.2.2 Identidad del CPME Las VME obtenidas por diafiltración con sacarosa presentaron los mismos perfiles electroforéticos por SDS – PAGE y WB del CPME que aquellas obtenidas por la precipitación alcohólica en el estudio de pre-estabilidad, comportamiento que puso de manifiesto una estabilidad antigénica para las bandas de proteínas presentes en el CPME y para el reconocimiento de los anticuerpos presentes en la gamma globulina de referencia (figuras 19b1 y 19b2). Estos resultados demostraron la equivalencia existente entre los CPME comparados y el reconocimiento de la variante en estudio de los anticuerpos presentes en la gamma globulina de referencia obtenida de humanos vacunados con lotes de VA-MENGOC-BC®, formulados a partir de las VME procedentes de la tecnología tradicional. 3.3.2.3 Estructura vesicular Las microfotografías electrónicas realizadas a la FC y al IFA obtenido por diafiltración con sacarosa mostraron mayoritariamente a las VME intactas y con un tamaño que osciló entre 50 y 90 nm (figuras 20a y 20c). Sin embargo, en el proceso precipitado con alcohol se observaron principalmente las vesículas rotas (20b). Los resultados referidos anteriormente evidenciaron que la precipitación alcohólica de las VME, afectó su estructura vesicular, no así la diafiltración con sacarosa que las conservó mayoritariamente intactas. Esta observación pudiera relacionarse con los criterios expresados por Frasch y colaboradores (2001), artículo donde se refiere que la precipitación alcohólica utilizada tradicionalmente en la purificación de VME, resulta drástica al proceso, recomendándose el uso de la sacarosa para eliminar el DOC en el paso final de la purificación. Las VME en sacarosa, en el estudio de pre-estabilidad, se mantuvieron mayoritariamente intactas, lo que demostró su estabilidad estructural (figura 20d). 3.3.2.4 Contenido de LPS y pirogenicidad El contenido de LPS en las VME purificadas, obtenidas luego de la diafiltración con sacarosa y de la precipitación alcohólica (figura 21a), no mostraron diferencias estadísticamente significativas entre si, ni con relación a la FC que les dio origen (p=0.588). Los resultados de los ensayos de pirógenos evidenciaron que las VME obtenidas por la variante sacarosa pasaron las pruebas satisfactoriamente a una concentración de 1000 ng de proteínas.Kg-1 de peso, máxima concentración usada en la prueba, mientras que las VME obtenidas por la variante alcohólica pasaron la prueba a la concentración de 100 ng de proteínas.Kg-1de peso. Resultados y Discusión 79 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ a) b1) b2) Fig. 19. Pre-estabilidad de VME en sacarosa comparada con las VME precipitadas con alcohol; a) Pre-estabilidad del pH; b) Pre-estabilidad de la identidad; b1) SDS-PAGE; b2) Western-blot. Leyenda: Líneas 1, 5 y 9 (Lotes de VME precipitadas con alcohol, t=0); Líneas 2, 6 y 10 (Lotes de VME precipitadas con alcohol, t=37ºC- 7d); Líneas 3, 7 y 11 (Lotes de VME en sacarosa, t=0); Líneas 4, 8 y 12 (Lotes de VME en sacarosa t=37ºC- 7d). Resultados y Discusión 80 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 a) b) c) d) Fig. 20. Microfotografías electrónicas de VME; a) Fracción cromatográfica; b) VME precipitadas con alcohol. Pre-estabilidad de la estructura vesicular en sacarosa; c) VME (t=0); d) VME (t=37ºC- 7d). Resultados y Discusión 81 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Los resultados anteriores demostraron que la pirogenicidad en el conejo estuvo principalmente asociada con la presentación del LPS dentro de la estructura vesicular, más que con el contenido absoluto del mismo. Ya en investigaciones previas (Frasch y col, 2001) se señala que el LPS libre es 100 veces más tóxico que cuando está asociado con las VME, pero no refiere el comportamiento de éste en vesículas con afectación estructural. En este trabajo de tesis, el LPS asociado con las VME mayoritariamente intactas fue 10 veces menos pirogénico, como mínimo, que aquel asociado con las VME afectadas estructuralmente, luego del proceso de precipitación alcohólica. Los IFA correspondientes a la variante en sacarosa en el estudio de pre-estabilidad pasaron satisfactoriamente la prueba de pirógeno a una concentración de 1000 ng de proteína. Mientras que, los IFA procedentes de la variante alcohólica pasaron la prueba satisfactoriamente a una concentración de 100 ng. El comportamiento en ambas variantes fue similar al encontrado al inicio, demostrándose que la actividad pirogénica de los preparados se mantuvo estable. 3.3.2.5 Contenido de endotoxinas Cuando se comparó el contenido de endotoxina en los preparados experimentales que contenían las VME procedentes de ambas tecnologías se observó que se cumplieron la especificación establecida (10000 UE.50μg-1 de proteínas), resultado que no se correspondió con los de pirogenicidad en los conejos, donde los preparados vacunales obtenidos por la variante alcohólica no pasaron las pruebas a una concentración de 500 ng de proteínas.Kg-1 de peso, mientras que los preparados logrados por la variante en sacarosa pasaron la prueba a una concentración de 1000 ng.Kg-1 de peso. En este acápite se refuerza el criterio de que la pirogenicidad en los conejos está más asociada con la conformación del LPS en las VME, que con el contenido de éste, no así la actividad endotóxica, observación que no está esclarecida en la bibliografía consultada. La actividad endotóxica aumentó en el estudio de pre-estabilidad de los preparados vacunales obtenidos a partir de ambas variantes, aunque no sobrepasó el límite de 10000 UE por 50 μg de proteína recomendado por Frasch y colaboradores (2001), para vacunas de VME del serogrupo B (figura 21b), detectándose diferencias globales (p=0.004, ANOVA de un factor). Al realizar los análisis post hoc se obtuvo que el grupo con alcohol en tiempo cero difiere del alcohol detectado luego del tratamiento térmico (p=0.008). Resultados y Discusión 82 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 3.3.2.6 Inmunogenicidad La respuesta inmune de los ratones inoculados con los preparados vacunales formulados con las VME purificadas, procedentes de ambas variantes en comparación y evaluados por el método de ELISA fueron similares, sin embargo, el estudio de pre-estabilidad mostró que en los preparados vacunales obtenidos por la variante en sacarosa, se observó una tendencia a la disminución de los valores de UIgG.mL-1. En la variante alcohólica el comportamiento fue diferente y no se evidenció esta tendencia, a pesar de que en esta variante constituyó una condición mucho más severa, si se tiene en cuenta que las VME precipitadas en alcohol se conservaron a -70 0C, a diferencia de las VME en sacarosa que se mantuvieron entre 2-8 ºC (figura 21c). El análisis estadístico realizado detectó diferencias significativas globales (p=0.008, ANOVA de un factor). Al realizar el análisis post hoc, se obtuvo que el grupo de la variante en sacarosa del estudio de pre-estabilidad difiere de la variante alcohólica en esta misma condición (p=0.005). El resto de las diferencias no fueron estadísticamente significativas (p>0.05). Este comportamiento puso de manifiesto un signo de inestabilidad de las VME en sacarosa, aspecto no referido por otros autores. Luego de la aplicación de una y dos dosis, los anticuerpos funcionales medidos por la ABS de los ratones inmunizados con los preparados vacunales formulados a partir de las VME purificadas y procedentes de las variantes comparadas fueron similares. Es de destacar que después de aplicar la segunda dosis, la ABS se incrementó entre cuatro y cinco logaritmos. En el estudio de preestabilidad la ABS para ambas variantes mantuvo un comportamiento similar en cuanto a la respuesta inmune observada después de administrar la primera dosis, resultado que no fue estadísticamente significativo (p>0.05). Sin embargo, la respuesta inmunogénica de los ratones tras aplicar una segunda dosis del preparado vacunal, se afectó en cuatro logaritmos como promedio (figura 21d). Este comportamiento resultó estadísticamente significativo para ambas variantes (p<0.05) y predice que durante la conservación pueden afectarse epítopes antigénicos vinculados con la producción de anticuerpos con actividad bactericida, comportamiento que no está descrito para vacunas de VME conservadas en sacarosa. Resultados y Discusión 83 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 3.3.3 Comportamiento general del efecto de la sacarosa en el proceso y conservación de las VME Las VME conservadas en sacarosa mostraron una actividad pirogénica 10 veces menor (como mínimo) que las tortas obtenidas por precipitación alcohólica, con un comportamiento similar en relación a la respuesta inmune por ELISA así como mediante la determinación de anticuerpos Fig. 21. Contenido de LPS y pre-estabilidad de la actividad endotóxica e inmunogenicidad de VME en sacarosa comparadas con VME precipitadas con alcohol; a) Contenido de LPS en FC y VME purificadas; b) Pre-estabilidad de la actividad endotóxica; c) Preestabilidad del contenido de UIgG.mL-1 en ratones inmunizados con 25 µg de proteínas; d) Pre-estabilidad de la ABS en ratones inmunizados con una y dos dosis de 25µg de proteínas. Resultados y Discusión 84 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ funcionales por ABS, en un proceso que requiere 27 horas menos necesarias para realizar la precipitación y los lavados alcohólicos y permite la salida de 14 centrífugas preparativas con una reducción de las áreas de producción en 100 m2.(anexo 19). Los estudios de pre-estabilidad de las VME en sacarosa mostraron que la estructura vesicular no se afectó y mantuvo estable su pirogenicidad. Sin embargo, la potencia inmunogénica de la variante en sacarosa se afectó luego de la aplicación de una y dos dosis tanto en la respuesta de anticuerpos tipo IgG (ELISA) como en la respuesta de anticuperpos funcionales (ABS). Esta evidencia de inestabilidad antigénica hizo imposible seleccionar la variante en sacarosa como método de eliminación del DOC en el paso final de la purificación de las VME. No obstante, los resultados obtenidos en cuanto a la disminución apreciable de la pirogenicidad de esta variante y las otras ventajas referidas, hacen pensar en la búsqueda de una solución tecnológica que permita su estabilidad antigénica. Teniendo en cuenta lo anteriormente señalado se decidió evaluar la conservación de las VME como MG en sacarosa adsorbidas en HA concentrado a pH = 6,5 y 7,5. El valor inferior seleccionado correspondió a la especificación de la vacuna antimeningocócica BC, utilizada como referencia en este estudio. Se incorporó la evaluación de la conservación a un pH superior debido al conocimiento previo de que las VME en sacarosa a pH = 6,5 precipitan y no se ha evaluado sí este comportamiento pudiera afectar la estabilidad de esta forma de conservación. 3.3.4 Pre-estabilidad de las VME en sacarosa adsorbida en gel de hidróxido de aluminio 3.3.4.1 Comportamiento del pH En el estudio de pre-estabilidad los valores de pH para las variantes 6,5 y 7,5 de los IFA aumentaron ligeramente (figuras 22a1 y 22a2). En ambos casos no se detectaron diferencias significativas con respecto a los valores iniciales de pH y se obtuvo la misma significación estadística (p=0.109). Este comportamiento fue diferente al analizado para las VME conservadas en sacarosa, donde en los estudios de pre-estabilidad se observó una disminución del pH, resultado que mostró diferencia estadísticamente significativa (figura 19a). 3.3.4.2 Actividad endotóxica La actividad endotóxica de los preparados vacunales obtenidos tuvo un comportamiento similar para las variantes en estudio, tanto al inicio como en el estudio de pre-estabilidad, donde se observó una tendencia a su disminución (figura 22b). Esta diferencia no fue significativa para un mismo pH entre los diferentes tiempos (p=0.285 y p=0.109). Resultados y Discusión 85 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ La tendencia observada fue diferente a la que se presentó para las VME conservadas en sacarosa o precipitadas con alcohol, donde los contenidos de endotoxinas tuvieron la tendencia de aumentar en los estudios de pre-estabilidad del IFA (figura 21b). 3.3.4.3 Inmunogenicidad Los preparados vacunales obtenidos con los IFA en el estudio de pre-estabilidad de las dos variantes evaluadas, presentaron un comportamiento similar referente a la respuesta inmune por ELISA (figura 22c), no detectándose diferencias significativas en ninguna de las comparaciones (p>0.05) lo que fue diferente al comportamiento observado para los preparados obtenidos a partir de las VME en sacarosa sin adyuvar (figura 21c), donde se evidenció una tendencia a la disminución de los valores de UIgG.mL-1. Al analizar los preparados vacunales obtenidos de los IFA en el estudio de pre-estabilidad se observó un comportamiento similar en cuanto a la respuesta por el ABS después de aplicar ambas dosis (primera y segunda) y aunque, no se detectaron diferencias estadísticas significativas (p>0.05) se observó una tendencia al incremento de los títulos de anticuerpos después de aplicar la segunda dosis (figura 22d). El comportamiento observado en la evaluación de los MG fue diferente al obtenido en el ensayo correspondiente a la conservación de los IFA en sacarosa sin adyuvar o en las tortas alcohólicas, las que en los estudios de pre-estabilidad referidos en la figura 21d, mostraron una afectación de la respuesta inmune en la ABS, sobre todo después de administrar la segunda dosis. 3.3.4.4 Comportamiento general de la conservación de las VME en sacarosa adsorbida en HA como monograneles En los estudios de pre-estabilidad se evidenció que el HA evitó afectaciones en las características de las VME conservadas en sacarosa al 3% referente al pH, actividad endotóxica e inmunogenicidad. El efecto protector del HA en la conservación de los epítopes antigénicos y el cambio de tendencia con relación a la actividad endotóxica fue independiente del valor del pH de los MG. De esta forma se superó el inconveniente presentado en la variante de conservación en sacarosa, situación donde se evidenció una tendencia a la disminución del pH, el aumento de la actividad endotóxica y la disminución de la respuesta inmune en los estudios de pre-estabilidad, lo que hizo inferir una posible inestabilidad en las condiciones de almacenamiento previstos entre 2 y 8 ºC. Resultados y Discusión 86 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Fig. 22. Pre-estabilidad de VME en sacarosa adsorbidas en HA conservadas como monograneles a pH = 6.5 y 7.5; a) PH = 6.5; b) PH = 7.5; c) Actividad endotóxica; d) Contenido de UIgG.mL-1 en ratones inmunizados con una dosis de 25 µg de proteínas; e) ABS de ratones inmunizados con una y dos dosis de 25 µg de proteínas. Resultados y Discusión 87 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ La tendencia observada respecto a la estabilidad general de las VME conservadas como MG unido a la considerable reducción de la pirogenicidad de las VME en sacarosa demostrada con relación a la variante alcohólica, hace atractiva esta forma de presentación de las VME. La variante de las VME en sacarosa adsorbida como MG facilita la producción de vacunas que no contengan PC, ya que la sacarosa estabiliza las VME, evita su agregación y la presencia de partículas, aspectos que pueden afectar la inmunogenicidad de los preparados vacunales (Frasch, 1995 y Frasch y col, 2001). Los resultados obtenidos evidenciaron la posibilidad de conservar las VME en sacarosa a pH = 6,5 cuando las mismas están adsorbidas en gel de HA, a diferencia de las VME en sacarosa que precipitan con este valor de pH. Al parecer, la interacción electrostática fuerte entre proteína – HA, basado en la diferencia de los puntos de carga cero, para las VME y el HA facilitó su unión, evitó la agregación y su precipitación. Estos resultados por su originalidad no han podido ser discutidos con los de otros autores, ya que no existen referencias de este tipo de enfoque tecnológico para garantizar la estabilidad de las VME en sacarosa. Por todo lo anteriormente expuesto se decidió continuar los trabajos con las VME adsorbidas a pH = 6,5 y utilizar este valor en los preparados vacunales obtenidos a partir de esta variante tecnológica, similar a las ya establecidas para la vacuna antimeningocócica BC tradicional, compuesto que mantiene una alta estabilidad. 3.3.5 Conclusiones parciales de la introducción de la sacarosa en la etapa de purificación y conservación de las VME ¾ La introducción de la sacarosa en el proceso y conservación de las VME permitió reducir, como mínimo, 10 veces la pirogenicidad, en relación con las VME precipitadas en alcohol, con una identidad proteica y actividad endotóxica equivalente, sin afectación de la potencia inmunogénica al ser adsorbidas previamente en HA. ¾ El proceso con sacarosa resultó más eficiente debido a la considerable disminución de los tiempos del proceso, del equipamiento y las áreas necesarias, posibilitando la reducción de 350 000 USD del presupuesto previsto para la remodelación de esta etapa del proceso ¾ Las VME en sacarosa y adsorbidas en HA se mantuvieron estables bajo las condiciones de estrés. Resultados y Discusión 88 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 3.4 Evaluación de las cepas epidémicas en el proceso de obtención de las VME 3.4.1 Evaluación de las cepas a escala piloto Las cinéticas del crecimiento y el pH de cinco cepas epidémicas clasificadas como B:4:P1.7,2-4, en comparación con la cepa vacunal CU 385/83 mostraron potencialidad para el crecimiento con cinéticas características de cultivos a partir de los inóculos en fase logarítmica (figura 23). El crecimiento a las seis horas de cultivo no evidenció diferencias significativas (p=0.068). En los cultivos de todas las cepas se observó una disminución del pH a las tres primeras horas, con un aumento progresivo del mismo hasta la sexta hora, comportamiento característico de la cepa vacunal cubana y de otras cepas del serogrupo B, aspecto relacionado con el metabolismo de la glucosa y descrito también por Fu y colaboradores (1995). Este comportamiento hace que no sea necesario el ajuste del pH en los cultivos, procedimiento que también se señala por otros autores, generalmente para el serogrupo B (Frasch y col, 2001). Las cepas NZ 98/153, NZ 98/223, NZ 98/228 y NZ 98/124 presentaron un perfil electroforético similar a la cepa CU 385/83 en las diferentes etapas de cultivo cuando se extrajeron los CPME con Cloruro de Litio, etapa donde se demostró la presencia de las proteínas mayoritarias de clase 1, 3, 4 y 5 con igual focalización. En la etapa de fermentación, también se observó la presencia de proteínas de alto peso molecular, en especial la de 70 kDa. La cepa NZ 98/018 tuvo un comportamiento diferente y no expresó las proteínas de alto peso molecular (figuras 24, 25 y 26). Las cepas NZ 98/124 y NZ 98/228 mostraron perfiles electroforéticos similares a la cepa vacunal cuando las VME se extrajeron con DOC y se separaron por ultracentrifugación, etapa donde se evidenciaron las proteínas mayoritarias de clase 1, 3, 4 y 5, así como una marcada presencia de la proteína de alto peso molecular de 70 kDa. Las cepas NZ 98/153, NZ 98/018 y NZ 98/223, mostraron perfiles electroforéticos diferentes a los de la cepa CU 385/83 con un aparente desdoblamiento de las proteínas de clase 1 y 3 y la ausencia de la proteína de 70 kDa, antígenos que son fundamentales en la composición de las vacunas de VME, por su capacidad de inducir anticuerpos con actividad bactericida (Zollinger, 1998; Frasch y col, 2001; Urwin, 2003; Holst, 2005). De acuerdo a los resultados descritos anteriormente se decidió descartar estas cepas como candidatas para la cepa vacunal. Los resultados hasta aquí presentados a escala piloto muestran la conveniencia de continuar las evaluaciones con las cepas NZ 98/124 y NZ 98/228 a escala de producción y con las condiciones previamente establecidas para la cepa CU 385/83. Resultados y Discusión 89 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 10 8 7.8 7.6 7.4 7.2 7 6.8 6.6 6.4 6.2 6 pH DO530nm 1 DO pH Tiempo (h) 0.1 0 1 2 3 4 5 6 DO pH Tiempo (h) 0.1 2 3 4 5 6 10 2 3 4 5 6 7 8 7.8 7.6 7.4 7.2 7 6.8 6.6 6.4 6.2 6 pH DO530nm 1 DO pH Tiempo (h) 0.1 0 8 7.8 7.6 7.4 7.2 7 6.8 6.6 6.4 6.2 6 pH 1 DO pH Tiempo (h) 0.1 1 1 1 2 3 4 5 6 7 d) Cepa NZ98/223 DO530nm 0 0.1 7 c) Cepa NZ98/153 10 pH Tiempo (h) 0 8 7.8 7.6 7.4 7.2 7 6.8 6.6 6.4 6.2 6 pH 1 1 DO b) Cepa NZ98/124 DO530nm 0 8 7.8 7.6 7.4 7.2 7 6.8 6.6 6.4 6.2 6 pH DO530nm 1 7 a) Cepa NZ98/018 10 10 2 3 c) Cepa NZ98/228 4 5 6 7 10 8 7,8 7,6 7,4 7,2 7 6,8 6,6 6,4 6,2 6 pH DO530nm 1 DO pH Tiempo (h) 0,1 0 1 2 3 4 5 6 7 d) Cepa CU385/83 Fig. 23. Cinéticas medias de crecimiento y pH en MFM de cinco cepas de N. meningitidis serogrupo B aisladas durante la epidemia de Nueva Zelanda y la cepa CU385/83. Resultados y Discusión 90 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Líneas 1 y 8: Patrón de VME purificada Línea 2: CPME de la cepa CU385/83 extraído con Cloruro de Litio al inóculo Línea 3: CPME de la cepa CU385/83 extraído con Cloruro de Litio al final de la fermentación Línea 4: CPME de la cepa CU385/83 extraído con DOC al final de la fermentación Línea 5: CPME de la cepa NZ98/153 extraído con Cloruro de Litio al inóculo Línea 6: CPME de la cepa NZ98/153 extraído con Cloruro de Litio al final de la fermentación Línea 7: CPME de la cepa NZ98/153 extraído con DOC al final de la fermentación Fig. 24. SDS-PAGE de los CPME extraídos con Cloruro de Litio durante el proceso de cultivo y con DOC al final de la fermentación de las cepas CU385/83 y NZ98/153 cultivadas en MFM a escala piloto. Línea 1: CPME de la cepa NZ98/223 extraído con Cloruro de Litio al inóculo Línea 2: CPME de la cepa NZ98/223 extraído con Cloruro de Litio al final de la fermentación Línea 3: CPME de la cepa NZ98/223 extraído con DOC al final de la fermentación Líneas 4: Patrón de VME purificada Línea 5: CPME de la cepa NZ98/018 extraído con Cloruro de Litio al inóculo Línea 6: CPME de la cepa NZ98/018 extraído con Cloruro de Litio al final de la fermentación Línea 7: CPME de la cepa NZ98/018 extraído con DOC al final de la fermentación Fig. 25. SDS-PAGE de los CPME extraídos con Cloruro de Litio durante el proceso de cultivo y con DOC al final de la fermentación de las cepas NZ98/223 y NZ98/018 cultivadas en MFM a escala piloto. Línea 1: Patrón de VME purificada Línea 2: CPME de la cepa NZ98/228 extraído con Cloruro de Litio al inóculo Línea 3: CPME de la cepa NZ98/228 extraído con Cloruro de Litio al final de la fermentación Línea 4: CPME de la cepa NZ98/228 extraído con DOC al final de la fermentación Línea 5: CPME de la cepa NZ98/124 extraído con Cloruro de Litio al inóculo Línea 6: CPME de la cepa NZ98/124 extraído con Cloruro de Litio al final de la fermentación Línea 7: CPME de la cepa NZ98/124 extraído con DOC al final de la fermentación Fig. 26. SDS-PAGE de los CPME extraídos con Cloruro de Litio durante el proceso de cultivo y con DOC al final de la fermentación de las cepas NZ98/228 y NZ98/124 cultivadas en MFM a escala piloto. Resultados y Discusión 91 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 3.4.2 Evaluación de las cepas NZ 98/124 y NZ 98/228 por la tecnología tradicional a escala industrial El crecimiento bacteriano de las cepas NZ 98/124 y NZ 98/228 en los medios y condiciones de cultivo establecidos para la cepa CU 385/83, mostraron la potencialidad de crecimiento de ambas cepas a esta escala (figura 27). La identidad de los CPME por SDS-PAGE en las diferentes etapas del proceso fue muy similar para ambas cepas. En las FC obtenidas se evidenció la presencia de un perfil electroforético similar a las logradas a partir de la cepa CU 385/83 (figuras 28a y 28b) Los rendimientos obtenidos de proteína total vacunal en las FC de las VME, fueron significativamente superiores (p=0.012) para la cepa NZ 98/228 (figura 29). La respuesta de anticuerpos funcionales medidas por la ABS de los preparados vacunales logrados a partir de las cepas NZ 98/124 y NZ 98/228, formulados con la misma composición de VA-MENGOC-BC® mostraron la misma respuesta frente a la cepa NZ 98/228. Sin embargo, el preparado obtenido a partir de la cepa NZ 98/228 presentó una mayor actividad frente a la cepa NZ 98/124 que el alcanzado a partir de esta propia cepa, aspecto que está a favor de la capacidad inmunogénica funcional de la cepa NZ 98/228 (figura 30). Tomando en consideración los resultados obtenidos se decidió continuar las evaluaciones de proceso con la cepa NZ 98/228 en la tecnología perfeccionada previamente para la cepa CU 385/83 (anexo 8), con el objetivo de seleccionar una cepa epidémica como vacunal, para emplearla en la obtención de una vacuna bivalente de mayor espectro antigénico. 3.4.3 Evaluación de la cepa NZ 98/228 3.4.3.1 Cinética de crecimiento La cepa NZ 98/228 mostró un comportamiento similar a la cepa CU 385/83 hasta la cuarta hora de cultivo, sin embargo entre esta última y la quinta hora existió una tendencia diferente, NZ 98/228 continuó su crecimiento con una potencialidad mayor respecto a la cepa CU 385/83 y basado en el resultado anterior se estableció su cultivo hasta la séptima hora, con el objetivo de igualar las condiciones fisiológicas de los mismos y buscar un mayor rendimiento de las proteínas vesiculares (figura 31). Resultados y Discusión 92 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 3.4.3.2 Comportamiento hidrodinámico en la etapa de concentración y lavado celular El comportamiento hidrodinámico en la etapa de concentración celular fue característico para ambas cepas; con flujos iniciales entre 105 y 120 L.h-1.m-2, comenzando a estabilizarse a partir de los 20 DO530nm 10 1 NZ98/228 NZ98/124 Fig. 27. Cinéticas medias de crecimiento de las cepas NZ98/228 y la NZ98/124 en MFM a escala industrial. 0,1 0 1 2 3 4 5 Tiempo (h) 6 Línea 1: Inóculo Línea 2: Fermentación semilla Líneas 3 – 5: Fermentación, horas de cultivo 2, 4 y 5 respectivamente Línea 6: VME extraída Línea 7: Concentrado de VME Línea 8: Ultracentrifugación Línea 9: Fracción cromatográfica Fig. 28. SDS-PAGE de los CPME extraídos con Cloruro de Litio durante las etapas de obtención de inóculo y fermentación y con DOC desde la etapa de extracción de VME a partir de las cepas NZ98/228 y NZ98/124 a escala industrial. Resultados y Discusión 93 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Fig. 29. Rendimiento de proteínas en FC de VME a partir de las cepas NZ98/124 y NZ98/228 a escala industrial. ABS(log2(tit,)-1) 8 6 VME-NZ98/124 VME-NZ98/228 4,00 4 2,00 2 2,00 2,00 0 Cepa-NZ98/124 Cepa-NZ98/228 Fig. 30. ABS de ratones inmunizados con una dosis de 50 ug de proteínas de los preparados vacunales que contienen VME obtenida a partir de las cepas NZ98/228 y NZ98/124 frente a estas mismas cepas homólogas y heterólogas. Resultados y Discusión 94 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ minutos de la operación, con flujos aproximados de 50 y 70 L.h-1.m-2 para la cepa NZ 98/228 y CU 385/83, respectivamente. El menor valor de flujo estabilizado para la cepa NZ 98/228 puede relacionarse con la mayor concentración de la biomasa celular a procesar. No obstante, la diferencia en el tiempo de procesamiento no superó los 5 minutos (figura 32a) En la etapa del lavado celular los flujos de filtrados se correspondieron con los obtenidos en la etapa de concentración, momento donde la cepa NZ 98/228 mostró flujos de filtrados iniciales de 38 L.h-1.m-2, algo inferiores a los obtenidos para la cepa cubana, disminuyendo ligeramente durante los lavados para ambas cepas (figura 32b). El proceso se completó en 30 minutos, alcanzándose, luego de tres volúmenes de diafiltración, el pH = 8,5 del tampón de proceso. El proceso de concentración y lavado de la cepa NZ 98/228 se consideró eficiente, evidenciándose una baja interacción de la misma con la membrana, aspecto ya analizado para la cepa CU 385/83. 3.4.3.3 Rendimiento de biomasa y proteína vesicular purificada La biomasa húmeda media concentrada a partir de la cepa NZ 98/228 fue de 14,10 g.L-1, cifra superior a los 8,68 g.L-1 obtenidos a partir de la cepa CU 385/83, resultado esperado debido al mayor crecimiento de NZ 98/228 (figura 33a). Existió diferencia estadísticamente significativa (p<0.0001) entre las variantes. A partir de las biomasas referidas se obtuvieron rendimientos de proteínas medias en el IFA de 9,0 y 12,0 mg.L-1 de cultivo para NZ 98/228 y CU 385/83, respectivamente, resultado con diferencias estadísticamente significativas (p=0.001). A pesar de que los rendimientos obtenidos fueron inferiores en la cepa evaluada, esta cumplió con el mínimo aceptado de 3,45 mg.L-1 de cultivo para la cepa cubana, por lo que los rendimientos obtenidos se consideraron satisfactorios para la etapa de desarrollo del producto (figura 33b). 3.4.3.4 Comportamiento de las proteínas en las etapas de la purificación La cepa NZ 98/228 presentó un contenido de proteína inicial extraída tres veces superior a la cepa cubana. Este contenido superior fue equivalente con CU 385/83 en la etapa de concentración del extracto, evidenciándose que el mismo no estuvo asociado con las VME, ya que estas proteínas se eliminaron por ultrafiltración tangencial con una membrana de porosidad de 100 kDa. En los pasos restantes de la purificación, el comportamiento fue similar con la máxima eliminación de proteínas durante la etapa de ultracentrifugación donde las VME se separaron del extracto (figura 34). Resultados y Discusión 95 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 DO530nm 10 1 NZ98/228 CU385/83 0,1 0 1 2 3 4 5 6 7 Tiempo (h) 8 Fig. 31. Cinéticas medias de crecimiento de las cepas NZ98/228 y CU385/83 a escala industrial. a) 150 70 NZ98/228 CU385/83 NZ98/228 CU385/83 60 50 Flujo (L.h m ) -2 90 -1 Flujo (L.h-1m-2) 120 60 30 40 30 20 10 0 0 0 10 20 30 40 50 Tiempo (min) 60 0V b) 1V 2V 3V No. Lavados Fig. 32. Comportamiento hidrodinámico medio de la concentración y lavado celular con tampón Tris-EDTA, pH 8,5 NZ98/228 y CU385/83 a escala industrial: a) Flujo de filtrado normalizado en el tiempo en la etapa de concentración celular; b) Flujo del filtrado normalizado por número o volumen de lavado en la etapa de diafiltración. Fig. 33. Comparación de los rendimientos de biomasa y proteico de las VME purificadas para las cepas CU385/83 y NZ98/228. a) Media del rendimiento de biomasa en base a peso húmedo por litro de cultivo. b) Media del rendimiento de proteínas por litro de cultivo. Resultados y Discusión 96 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 3.4.3.5 Eliminación de contaminantes en las etapas de purificación de las VME El contenido de LPS y el PCB respecto a las proteínas durante las etapas de extracción y purificación mostraron comportamientos similares en ambas cepas, con aumentos durante la concentración del extracto y una máxima disminución durante la etapa de ultracentrifugación (figuras 35a y 35b). Es de destacar que, el contenido de LPS con relación a las proteínas presentes fue menor en las diferentes etapas del proceso para la cepa NZ 98/228 (figura 35b). Las FC obtenidas fueron similares en cuanto al contenido de contaminantes, demostrándose que el proceso de purificación establecido para la cepa CU 385/83 tuvo la capacidad de obtener VME purificadas procedentes de la cepa NZ 98/228 que cumplieron con las especificaciones de calidad establecidas para la primera (figuras 35a y 35b). 3.4.3.6 Recobrado de proteínas en el paso de la diafiltración con sacarosa La cepa NZ 98/228 mostró recobrados medios de proteínas (66,6%), algo inferiores a los obtenidos con CU 385/83 (80,5%) (figura 36). Al comparar los resultados obtenidos no se detectó diferencia estadísticamente significativa (p=0.262). 3.4.3.7 Identidad de los CPME en las VME purificadas El perfil electroforético de los CPME presentes en las VME purificadas, procedentes de la cepa NZ 98/228 mostró uniformidad lote a lote respecto a la composición relativa de las proteínas presentes, demostrándose que en las condiciones del proceso establecido para la cepa CU 385/83, las proteínas de alto peso molecular (reguladas por el hierro) se expresaron y se mantuvieron consistentemente durante el proceso de purificación. La presencia de estas proteínas garantizó la uniformidad del CPME. Otros candidatos vacunales demuestran inestabilidad en la presencia de estas proteínas, aspecto considerado como una debilidad para las vacunas basadas en VME (Corbel, 1994). Los perfiles obtenidos de la cepa NZ 98/228 fueron similares a los de la cepa CU 385/83, con una prevalencia de las proteínas de clase 1 y 3, así como las de 70 kDa y 80 kDa. Otras proteínas (clase 4 y clase 5) se evidenciaron, aunque en una menor magnitud (figura 38). 3.4.3.8 Estructura vesicular y pirogenicidad Las VME purificadas y obtenidas a partir de la cepa NZ 98/228 se presentaron mayoritariamente intactas de tamaño (50 a 90 nm), similares a las VME obtenidas de la cepa CU 385/83. Este resultado corroboró la capacidad del proceso tecnológico para garantizar que la mayoría de estas estructuras vesiculares permanecieran intactas, estructuras que pasaron la prueba de pirógenos en Resultados y Discusión 97 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Proteínas totales (g) 280 240 CU385/83 200 NZ98/228 160 Fig. 34. Comportamiento del contenido total de proteínas por etapas de proceso de las cepas NZ98/228 y CU385/83. Etapas: PE (Proteínas extraídas); CP (Concentrado de proteínas); VUC (VME ultracentrifugadas) y FC (Fracción cromatográfica) 120 80 40 0 PE a) CP 300 CU385/83 NZ98/228 b) 125 200 150 100 CU385/83 NZ98/228 100 PC-B (ug/mg) 250 LPS (ug/mg) VUC FC Etapa de Proceso 75 50 25 50 0 0 PE CP VUC FC Etapa de Proceso PE CP VUC FC Etapa de Proceso Fig. 35. Comportamiento del contenido de contaminantes en etapas de proceso de las cepas CU385/83 y NZ98/228 evaluada a escala industrial. Etapas: PE (Proteínas extraídas); CP (Concentrado de proteínas); VUC (Vesículas ultracentrifugadas) y FC (fracción cromatográfica): a) Contenido de LPS en base a proteína total; b) Contenido de PCB en base a proteína total. Resultados y Discusión 98 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Fig. 36. Recobrado de proteínas en el paso final de la purificación de VME obtenida a partir de las cepas CU385/83 y NZ98/228 por diafiltración con sacarosa Fig. 37. SDS-PAGE de los CPME de lotes de VME purificadas en sacarosa: Líneas 1-6 (Lotes correspondientes a la cepa CU385/83; Líneas 7-12 (Lotes correspondientes a la cepa NZ98/228) Resultados y Discusión 99 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ conejos a 1000ng de proteínas.kg-1 de peso de forma consistente al igual que las VME en sacarosa obtenidas de la cepa CU 385/83 a pesar de contener como promedio 5% de LPS respecto a la proteína (figura 38). 3.4.4 Estudio de pre-estabilidad de las VME purificadas conservadas como monograneles 3.4.4.1 Comportamiento del pH Las VME obtenidas a partir de la cepa NZ 98/228, conservadas como MG mostraron una ligera tendencia al aumento del valor de pH en el estudio de pre-estabilidad. Este comportamiento fue similar para las VME obtenidas de la cepa CU 385/83 (figura 39a). No existió diferencias estadísticamente significativas entre los tiempos ni entre las cepas (p>0,05). 3.4.4.2 Actividad endotóxica La actividad m, para la cepa CU 385/83, a pesar de que disminuyó su actividad endotóxica (figura 39b), los análisis estadísticos no evidenciaron diferencia significativa (p>0,05). Otro tipo de diferencia no fue detectada (p>0,05). 3.4.4.3 Inmunogenicidad Los preparados vacunales obtenidos a partir de las VME de la cepa NZ 98/228, mostraron una actividad inmunógena tipo IgG en ratones, determinada por el método de ELISA. Esta actividad se mantuvo de forma similar en los preparados obtenidos en el estudio de pre-estabilidad del monogranel, no detectándose diferencias significativas entre los tiempos (p=0.285). Igual comportamiento se observó con los preparados obtenidos de las VME a partir de la cepa CU 385/83 (figura 39c), donde tampoco se observaron diferencias entre los tiempos (p=0.109). Los preparados vacunales obtenidos de las VME de los MG de la cepa NZ 98/228 mostraron actividad bactericida, respuesta que se manifestó de igual forma cuando los preparados vacunales se obtuvieron a partir de MG sometidos a 37 °C por 7 días, comportamiento donde no se observaron diferencias estadísticamente significativas (p>0,05). Como cepa diana para la determinación de la ABS se empleó la cepa NZ 98/124, la que mostró en estudios previos, una sensibilidad media relativa a la muerte en la determinación de la ABS, en comparación con otras nueve cepas epidémicas del mismo origen y clasificación que tienen grados de resistencia en diferentes magnitudes (datos no mostrados). La selección de la cepa diana resultó importante en la Resultados y Discusión 100 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ a) b) Fig. 38. Microfotografía electrónica de VME purificadas de N. meningitidis serogrupo B en sacarosa al 3% a partir de las cepas en comparación: a) Cepa CU385/83; b) Cepa NZ98/228. Resultados y Discusión 101 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ estandarización de este método, resultados similares a los obtenidos en este trabajo de tesis se señala también por Holst y colaboradores (2005). Un comportamiento similar de la ABS se obtuvo para el preparado de VME a partir de la cepa CU 385/83, donde tampoco se observaron diferencias significativas (p>0,05) en el estudio de preestabilidad del MG (figura 39d). 3.4.5 Conclusiones parciales de la introducción de la cepa NZ 98/228 al proceso de obtención de VME ¾ La cepa NZ 98/228 presentó una adecuada potencialidad de crecimiento con un perfil electroforético del CPME similar a la cepa CU 385/83, en las etapas de producción de cultivos. ¾ Las VME purificadas de la cepa NZ 98/228 se obtuvieron con niveles de contaminantes y composición del CPME similares a los logrados con la cepa cubana. ¾ Los rendimientos de las proteínas purificadas de la cepa NZ 98/228 fueron inferiores a los obtenidos con la cepa cubana, aunque cumplieron con la especificación establecida para esta cepa. ¾ Las VME obtenidas de la cepa NZ 98/228 mostraron una estructura vesicular mayoritariamente intacta, con una actividad endotóxica y pirogénica similar a la cepa cubana. ¾ Las VME obtenidas de la cepa NZ 98/228 fueron inmunogénicas en ratones produciendo anticuerpos tipo IgG (ELISA) y anticuerpos funcionales con actividad bactericida (ABS). ¾ Las VME adsorbidas en HA como MG fueron estables en las condiciones de estrés. Por todo lo antes señalado la cepa NZ 98/228 se seleccionó como cepa vacunal para obtener una vacuna bivalente en combinación con la cepa CU 385/83. 3.5 Obtención de un nuevo candidato vacunal bivalente contra N. meningitidis serogrupo B a partir de VME 3.5.1 Antecedentes y beneficios esperados de una nueva generación de vacunas multivalente de VME Los estudios de eficacia realizados en Cuba y Noruega con vacunas monovalentes obtenidas a partir de las VME de dos cepas epidémicas (4:P1.15 y 15:P1.16, respectivamente) con una prevalencia elevada muestran resultados satisfactorios en ambos países (Sierra y col, 1991; Bjune y col, 1991). En los últimos años se aplica en Nueva Zelanda un esquema de tres dosis con una vacuna de VME monovalente obtenida a partir de una cepa epidémica (4:P1.4), el programa de inmunización Resultados y Discusión 102 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Fig. 39. Pre-estabilidad de VME en sacarosa adsorbida en HA como monogranel a pH = 6.5 procedentes de la cepa NZ98/228. a) pH; b) Contenido de endotoxina; c) Contenido de UIgG en ratones inmunizados con 25 ug de proteínas; d) ABS de ratones inmunizados con dos dosis de 25 ug de proteínas. Resultados y Discusión 103 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ realizado pone de manifiesto unos resultados de inmunogenicidad y efectividad satisfactorios ante una epidemia clonal con alta prevalencia del sero/subtipo en cuestión (Oster y col, 2007). La respuesta inmune de estas vacunas se dirigió fundamentalmente hacia PorA, porina que se comporta como un buen inmunógeno (Zolinger, 1998), pero muy variable en cuanto a la secuencia de los aminoácidos expuestos en sus lazos epitópicos (Peeters y col, 1999). Los estudios de eficacia realizados con estas vacunas no brindaron información sobre la actividad bactericida cruzada existente entre las mismas. En los estudios clínicos comparativos que se realizan con las vacunas VA-MENGOC-BC® y Folkehelsa, muestran que la cubana alcanzó niveles de actividad bactericida cruzada superior, mientras que la vacuna noruega presentó una mayor actividad frente a la cepa homóloga (Perkins y col, 1998; Tappero y col, 1999). En el caso de VA-MENGOC-BC® la observación anterior se refuerza con los resultados obtenidos en Brasil durante varias campañas de vacunación con la participación de millones de personas, concluyéndose que esta vacuna mostró la misma eficacia frente a las cepas homólogas y heterólogas en una epidemia ocasionada por varios sero/subtipos de N. meningitidis (de Moraes y col, 1992; Milagres y col, 1994). Los resultados anteriores sugirieron que en VA-MENGOC-BC® están presentes otros antígenos minoritarios conservados en la especie que le permiten este comportamiento (Zollinger, 1998). Basado en lo anteriormente expuesto, se consideró que una vacuna que contenga al menos VME de un sero/subtipo prevalente en el país o región donde se aplique, logrará una actividad bactericida homóloga, pero además, si está presente en dicha vacuna una VME con actividad bactericida heteróloga, la aplicación será óptima, ya que la misma protegería contra las cepas epidémicas prevalentes, pero también lograría protección contra otras cepas menos representadas del serogrupo B, cepas que pudieran emerger luego que desciendan las epidémicas predominantes, situación que puede presentarse después de realizar campañas masivas de vacunación (Desmons y col, 2006) Una vacuna óptima para Europa, región donde existe una situación endémica con la circulación de varias cepas del serogrupo B, deberá incorporar VME del sero/subtipo P1.4, perteneciente al clon ST 41/44, linaje 3, como representante de la cepa homóloga predominante y al sero/subtipo P1.15, con actividad heteróloga bactericida demostrada, como la obtenida por la cepa CU 385/83, usada en la Resultados y Discusión 104 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ producción de lotes comerciales de VA-MENGOC-BC® (Desmons y col, 2006). Por otra parte, estos dos sero/subtipos representan el 68,3% de las cepas circulantes en Europa (Noah y col, 1999). En el caso del Reino Unido, el complejo ST-41/44, linaje 3, clon al cual pertenece el subtipo P1.7-2,4 es prevalente y causa el 41,6% de los casos clínicos de ese país. El segundo lugar de prevalencia lo ocupa el clon ST-32/ET-5, que incluye al subtipo P1.15 presente en las VME de la cepa cubana con un 29%, por lo que una vacuna bivalente de ambos subtipos y complejos clonales cubriría el 70% de los clones circulantes en ese país. Se espera que esta combinación evite como mínimo la ocurrencia de 910 casos anuales de los 1 300 que notifican en el Reino Unido (Pollard, 2007). Para otros países como Estados Unidos, región que presenta una situación endémica causada por el serogrupo B, se podría incluir la VME del subtipo P1.7.16 como homólogo, aunque opcionalmente de acuerdo a la circulación existente pudieran utilizarse también los subtipos: P1.1.7; P1.5,2; P1.22a,14 y P1.14. Siempre será recomendable la inclusión de VME con actividad bactericida heteróloga, preferiblemente derivada de la cepa CU 385/83, por los motivos ya analizados en los párrafos anteriores (Desmons y col, 2006). Se espera que las vacunas de VME continuarán ocupando un papel principal en el control de la EM sobre la base de la incorporación de nuevas PorA que cubran la circulación, en condiciones endémicas, de varios subtipos que requieran la intervención de vacunas, ya que aún no está bien definido si las preparadas sobre bases recombinantes podrían superar algún día los resultados alcanzados por las vacunas convencionales de VME que, aunque con limitaciones para un uso global, logran contener epidemias causadas por el serogrupo B (Segal y Pollard, 2004; Perret y Pollard, 2005). 3.5.2 Bases para el diseño y la composición de un candidato vacunal bivalente Para el diseño de un candidato vacunal bivalente se consideró la situación epidemiológica de Europa, tomándose como base a VA-MENGOC-BC®, producto de referencia, y considerado como líder en las vacunas de VME, por haber sido la primera que se patenta y autoriza para su comercialización desde 1987, sobre la base de los resultados satisfactorios de eficacia, seguridad y calidad demostrados. Esta vacuna es la única que se ha comercializado ampliamente y muestra, luego de la aplicación masiva en Cuba y diferentes países de América Latina, ser inmunógena, efectiva y presentar un perfil aceptable de reactogenicidad, propio de las vacunas de VME adsorbidas en un gel de HA. Resultados y Discusión 105 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ El diseño de la vacuna bivalente, además de considerar a VA-MENGOC-BC® como producto de referencia, tomó en consideración los siguientes criterios: ¾ Utilizar como VME con actividad bactericida heteróloga, los preparados vacunales obtenidos a partir de la cepa CU 385/83, estructuras que se conservan en sacarosa como estabilizador y se adsorben en HA para garantizar su estabilidad. Estas VME resultaron ser equivalentes a las tradicionalmente utilizadas en los lotes comerciales de VA-MENGOC-BC®, en cuanto a su identidad e inmunogenicidad, pero superiores en cuanto a la estabilidad de la actividad endotóxica y con una disminución apreciable de la actividad pirogénica, aspecto relacionado con la preservación de la estructura vesicular en el proceso, las que mostraron resultados satisfactorios en los estudios de pre-estabilidad. ¾ Utilizar como VME con actividad bactericida homóloga las obtenidas a partir de la cepa NZ 98/224, con clasificación de subtipo P1.7-2,4 y perteneciente al clon epidémico ST 41/44, linaje 3. Estas VME se obtuvieron en las condiciones del proceso ya mejoradas para la cepa CU 385/83, donde las VME mostraron ser buenas inmunógenas en los ratones, y presentaron un comportamiento equivalente a las VME obtenidas a partir de la cepa vacunal cubana en cuanto al perfil electroforético de las proteínas mayoritarias presentes, la actividad endotóxica, la estructura vesicular y pirogenicidad, así como los resultados satisfactorios obtenidos en los estudios de pre-estabilidad. ¾ Mantener el contenido total de proteínas de 50 µg por dosis al igual que VA-MENGOC-BC®, pero en la nueva formulación utilizar 25 µg procedente de cada cepa. La vacuna noruega monovalente utiliza 25 µg por dosis, así como la vacuna derivada de ella y aplicada en Nueva Zelanda. ¾ No utilizar el PC-C como antígeno vacunal debido a que no es posible justificar su aplicación en Europa, luego de la introducción de la vacunación masiva con MCC en los países europeos desde hace varios años. ¾ Eliminar el uso de tiomersal como preservante debido a la tendencia de reducir o eliminar los preservos mercuriales, principalmente en las presentaciones de monodosis. Estudios previos realizados con VA-MENGOC-BC® demostraron que la eliminación del tiomersal de la formulación no afecta la estabilidad del producto (datos no mostrados) ¾ Mantener la capacidad reguladora del pH de la vacuna de referencia con el empleo de un tampón fosfato 0,7 mM. Resultados y Discusión 106 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 ¾ Ajustar en la nueva formulación las concentraciones de sacarosa al 3% con el objetivo de estabilizar las VME y ajustar el contenido del Cloruro de Sodio necesario para garantizar una tonicidad adecuada. En la tabla 5 se presenta la composición por dosis de VA-MENGOC-BC® y la vacuna MenB bivalente. Tabla 5: Composición por dosis de VA-MENGOC-BC® y MenB bivalente Componente VME-B (B:4:P1.19,15) VME-B (B:4:P1.7-2,4) PC-C Sacarosa Hidrógeno Fosfato de Disodio Dihidrógeno Fosfato de Sodio Cloruro de Sodio Tiomersal Hidróxido de Aluminio Agua para inyección VA-MENGOC-BC® (dosis de 0,5 mL) 50 μg --50 μg ----0,03 mg 0,02 mg 4,25 mg 50 μg 2 mg csp 0,5 mL Vacuna bivalente (dosis de 0,5 mL) 25 μg 25 μg --15 mg 0,03 mg 0,02 mg 3,10 mg ---2 mg csp 0,5 mL Función Antígeno vacunal Antígeno vacunal Antígeno vacunal Estabilizador Regulador de pH Regulador de pH Tonicidad Preservo Adyuvante Vehículo 3.5.3 Aspectos regulatorios incorporados al proceso de obtención del IFA que facilitan el cumplimiento de las BPF Las VME purificadas de la cepa CU 385/83 y NZ 98/228 se obtuvieron bajo un mismo proceso tecnológico, según el diagrama de flujo presentado en el anexo 8, diagrama que tiene incorporado los dos cambios evaluados en este trabajo, en cuanto al perfeccionamiento de la etapa de separación celular con la introducción de un sistema de microfiltración tangencial y la introducción de la sacarosa en el proceso de purificación y como estabilizador de las VME. Ambos aspectos constituían una limitante para la presentación del candidato vacunal a las autoridades regulatorias europeas. El primer cambio fue necesario para demostrar que esta etapa del proceso era cerrada, aséptica y validable, y que desde el punto de vista de seguridad biológica, no implicaba riesgos para el trabajador y el medio ambiente, al facilitarse los procesos de inactivación del sistema y del permeado, acorde a las BPF (WHO Technical Report Series, 2003; EC, 2007). El cambio al proceso se justificó a través de los estudios de caracterización y la demostración de su consistencia. El segundo cambio fue necesario para disminuir los niveles de pirogenicidad recomendados para las vacunas que contiene LPS objetivo que no se lograba alcanzar cuando las VME eran precipitadas en Resultados y Discusión 107 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ alcohol. Se demostró que este cambio en el proceso posibilitó cumplir con los niveles de pirógenos recomendados de pasar la prueba con la aplicación de 1000 ng.Kg-1 de peso de conejo en la IFA y de 500 ng en la vacuna bivalente. Se demostró que la introducción de la sacarosa en el proceso no afectó la inmunogenicidad de las VME (OMS, 2000). La incorporación de una cepa epidémica (NZ 98/228) al proceso de obtención del IFA establecido para la cepa CU 385/83 demostró la robustez de la tecnología utilizada, lo que servirá de base en el futuro para que las autoridades regulatorias otorguen a las vacunas desarrolladas contra el serogrupo B las licencias de operación farmacéutica a una tecnología establecida, donde las cepas a emplear puedan cambiarse acorde con la situación epidemiológica, tal como ocurre anualmente con los virus que se emplean para incorporar en las vacunas contra la gripe (Frasch y col, 2001). 3.5.4 Inmunogenicidad de los monograneles, Men B bivalente y VA-MENGOC-BC® La actividad bactericida funcional generada por las monovacunas independientes obtenidas a partir de las VME de las cepas CU 385/83 y NZ 98/228 fue similar a la que se observó para cada una de ellas, luego de su unión en la vacuna bivalente (figura 40). Los resultados de esta comparación no fueron estadísticamente significativos (p=0.197), comportamiento que ratificó que en la vacuna bivalente no existieron interferencias inmunológicas. Por otra parte, se evidenció que las VME procedentes de la cepa CU 385/83 en la vacuna bivalente mostró una actividad bactericida similar a la notificada en VA-MENGOC-BC® (p=0.104), observación que resultó valiosa porque se pudo demostrar que la nueva vacuna (Men B) mantuvo la potencia inmunogénica de la vacuna de referencia (VA-MENGOC-BC®) y se pudo ampliar esta respuesta hacia otra cepa epidémica predominante en la región hacia donde la vacuna va dirigida y donde la otra cepa muestra una incidencia similar. 3.5.5 Comportamiento de los controles de calidad de lotes de VME purificados, monograneles y vacuna Men B bivalente. Para la selección del lote del ensayo clínico Fase III de la vacuna Men B bivalente se prepararon varios lotes de los productos intermedios (VME purificadas y MG) y se formularon diferentes lotes de la vacuna bivalente, para facilitar la selección del lote a emplear, y disponer además, de los datos del comportamiento de este producto para las comparaciones requeridas con los futuros lotes de consistencia clínica e industrial. Resultados y Discusión 108 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Fig. 40. ABS de ratones inmunizados con dosis de 5µg de proteínas de monovacunas de VME de las cepas CU385/83 y NZ98/228 y con 10µg de MenB bivalente en igual número de dosis. Fig. 41. ABS de ratones inmunizados con dos dosis de 10µg de proteínas en VME de MenB bivalente y VA-MENGOC-BC Resultados y Discusión 109 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ 3.5.5.1 Establecimiento y comportamiento de las especificaciones de calidad y caracterización de las VME purificadas Se establecieron las especificaciones de calidad en cuanto a los contaminantes, considerando las vigentes para los contaminantes de origen biológico presentes en las VME empleadas en VA-MENGOC-BC®, tales como: contenido de LPS, PC-B y AN, además se introdujeron, para los dos últimos compuestos, métodos más sensibles y específicos. Se incorporaron otras determinaciones cuantitativas de acuerdo con las nuevas características de presentación de las VME, tales como: pH, contenido de DOC y sacarosa, también se incorporó la identidad del subtipo. Los resultados del comportamiento de los parámetros de calidad evaluados para ambas VME mostraron que los valores del pH se mantuvieron dentro de los límites establecidos (7,6 - 8,0) con una tendencia al valor medio de la especificación. Esta observación resultó importante ya que para valores de pH<7,5, precipitan las VME (figura 42a y 43a). La concentración de las proteínas se estableció entre 1 y 2 mg.mL-1, desde el paso de diafiltración con sacarosa. Todos los lotes cumplieron la especificación, pero un 30% de los valores se acercaron al límite inferior (figuras 42b y 43b). El contenido de LPS mostró un comportamiento adecuado con una tendencia a los valores medios de la especificación (figuras 42c y 43c). Todos los lotes cumplieron con el contenido de PC-B, aspecto que debe observarse en procesos futuros, no obstante el 30% de los mismos se acercaron al límite de especificación establecido, aspecto que debe cuidarse para procesos futuros (figuras 42d y 43d). El contenido de ADN fue extremadamente bajo para las VME purificadas obtenidas a partir de ambas cepas (figuras 42e y 43e). En el caso del contenido de DOC, la mayoría de los valores estuvieron alrededor de 1,0% en relación con la proteína, lo que equivale a una cifra inferior a 1 μg de DOC por dosis (figuras 42f y 43f) y aunque no se fijó un límite de especificación en esta etapa del desarrollo, se esperaban valores inferiores al 2%, de acuerdo a lo obtenido en el proceso de diafiltración con sacarosa, tal como se presentó en el acápite 3.3.1. Los valores obtenidos son bajos cuando se compararon con otras vacunas licenciadas por la FDA contra la influenza (Fluarix y FluLaval), las que contienen 50 μg de DOC por dosis (FDA, 2006). La vacuna Men B Folkehelsa contiene 30% de DOC en relación con el contenido de proteínas (7,5 μg de DOC, por dosis) (Frasch y col, 2001) y Resultados y Discusión 110 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ para la Men B-NZ se señala una cifra del 16%, porcentaje equivalente a 4 μg de DOC por dosis (Beakley, 2006). Todos los lotes cumplieron la especificación del contenido de sacarosa, no obstante cuatro de ellos estuvieron en el límite superior (figura 42g y 43g). Se realizaron evaluaciones cualitativas de los requisitos de calidad, tales como: la identidad de los subtipos específicos P1.4 y P1.15 que fueron satisfactorios en todos los lotes correspondientes a cada una de las VME de acuerdo a su subtipo y se establecieron ensayos de caracterización para verificar por microscopia electrónica, la presencia de estructuras vesiculares mayoritariamente intactas, así como el perfil característico de las proteínas presentes en el SDS-PAGE. Todos los lotes cumplieron con los resultados esperados. 3.5.5.2 Establecimiento y comportamiento de las especificaciones de calidad y ensayos internos y de caracterización de los monograneles. Se establecieron especificaciones de calidad en los monograneles acorde con las principales características de la formulación, tales como: pH, esterilidad, contenidos y adsorción de proteínas y aluminio. También se establecieron especificaciones, considerando los parámetros intrínsecos de las VME como identidad de subtipo, pirógenos y potencia inmunogénica por ELISA. Con relación al método de ELISA se incorporaron nuevos criterios de evaluación con el objetivo de poder evidenciar mejor las diferencias entre los lotes, para lo cual se disminuyó el contenido de proteínas a inmunizar (10 µg) y se estableció la medición de la respuesta individual de cada animal sobre un nivel de corte de UIgG.mL-1 previamente establecido (2000 para MG-CU y 5000 para MG-NZ). Los resultados se expresaron en función del número de animales respondedores, en lugar de las unidades relativas de UIgG.mL-1, calculadas a partir de una mezcla representativa del suero de los animales. Los nuevos criterios se establecieron sobre la base de un estudio previo de relación dosis-respuesta, partiendo de las cantidades utilizadas en la evaluación de VA-MENGOC-BC® (50 µg) hasta 10 µg (datos no mostrados). Se caracterizaron el perfil electroforético de las proteínas presentes en las VME y la medición de la ABS. En el caso de la evaluación de anticuerpos funcionales por la ABS se incorporó el criterio de aplicar dos dosis de 10 µg, y se expresó el resultado como media geométrica de la dilución donde se produjo el 50% de la muerte bacteriana a partir de las respuestas en los sueros individuales. La aplicación de una segunda dosis se introdujo basado en los resultados de los estudios de Resultados y Discusión 111 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 a) b) Proteína (mg.mL-1) 8,2 pH 8,0 7,8 7,6 7,4 7,2 1 c) 2 3 4 d) PC-B (ug.mg-1) LPS (ug.mg-1) 60 40 20 0 2 3 4 f) 8 DOC (%) ADN (ug.mg-1) 1.5 1.0 0.5 0.0 6 4 2 0 1 2 3 4 5 Lotes 1 2 3 4 5 Lotes 1 2 3 4 5 Lotes 14 12 10 8 6 4 2 0 2.0 10 1.5 1.0 0.5 0.0 1 Sacarosa (mg.mL-1) 2.0 5 Lotes e) g) 2.5 5 Lotes 80 1 3.0 2 3 4 5 Lotes Fig. 42: Comportamiento de las especificaciones de calidad en lotes de VME purificadas obtenidas a partir de la cepa NZ98/228: a) pH; b) Contenido de proteína; c) Contenido de LPS en base a proteína total; d) Contenido de PC-B en base a proteína total; e) Contenido de ADN en base a proteína total; f) Porcentaje de DOC referido a la proteína total; g) Contenido de sacarosa. 50 40 30 20 10 1 2 Resultados y Discusión 3 4 5 Lotes Las líneas continuas representan la media de los valores. Las líneas discontinuas representan los límites de especificación. 112 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 a) b) Proteína (mg.mL-1) 8,2 pH 8,0 7,8 7,6 7,4 7,2 1 c) 2 3 4 d) PC-B (ug.mg-1) -1 LPS (ug.mg ) 60 40 20 0 2 3 4 f) 8 DOC (%) ADN (ug.mg-1) 1.5 1.0 0.5 0.0 6 4 2 0 1 2 3 4 5 Lotes 1 2 3 4 5 Lotes 1 2 3 4 5 Lotes 14 12 10 8 6 4 2 0 2.0 10 1.5 1.0 0.5 0.0 1 Sacarosa (mg.mL-1) 2.0 5 Lotes e) g) 2.5 5 Lotes 80 1 3.0 2 3 4 5 Lotes Fig. 43: Comportamiento de las especificaciones de calidad en lotes de VME purificadas obtenidas a partir de la cepa CU 385/83: a) pH; b) Contenido de proteína; c) Contenido de LPS en base a proteína total; d) Contenido de PC-B en base a proteína total; e) Contenido de ADN en base a proteína total; f) Porcentaje de DOC referido a la proteína total; g) Contenido de sacarosa. 50 40 30 20 10 1 2 Resultados y Discusión 3 4 5 Lotes Las líneas continuas representan la media de los valores. Las líneas discontinuas representan los límites de especificación. 113 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ caracterización de las VME en sacarosa, comportamiento donde se apreció que con una dosis de refuerzo se amplificó la respuesta, cuando el producto no fue sometido a condiciones de estrés, resultado de interés para la evaluación de los lotes. No se establecieron los límites del ensayo para este requisito de calidad, debido a no contarse con suficientes datos para fijarlas. Los requisitos de calidad de los MG obtenidos a partir de las VME de ambas cepas referente a los parámetros cuantitativos, estuvieron dentro de los límites de especificación establecidos, en un análisis detallado de cada uno de ellos se constató que los valores de pH y el contenido de proteínas en la mayoría de los lotes se acercaron al límite inferior de la especificación (figuras 44a, 44b, 45a y 45b). El contenido de aluminio en todos los lotes se mantuvo en el centro del rango de la especificación (figuras 44c y 45c). La actividad endotóxica mostró para ambos MG, valores medios de alrededor de 5 000 UE.50µg.proteína-1, sin observarse tendencias al límite superior (figuras 44d y 45d). La adsorción de las proteínas en todos los lotes se mantuvo en valores muy cercanos al 90%, lo que se consideró un comportamiento adecuado para este parámetro (figuras 44e y 45e). La potencia inmunogénica mostró un 100% de respondedores para todos los lotes (figuras 44f y 45f), por otra parte, los títulos de anticuerpos bactericidas expresados como el inverso del log2 del título bactericida, tuvieron consistencia con valores alrededor de 14 para los MG provenientes de la cepa NZ 98/228 y nueve para la cepa CU 385/83 (figuras 44g y 45g). Los parámetros cualitativos analizados fueron la esterilidad y la identidad de las proteínas presentes y las de subtipo así como la pirogenicidad, donde todos los lotes mostraron el comportamiento esperado según las especificaciones. 3.5.5.3 Establecimiento y comportamiento de las especificaciones de calidad, ensayos internos y de caracterización de la vacuna MenB bivalente Se establecieron especificaciones de calidad de la vacuna bivalente, teniendo en cuenta las principales características de la formulación (en particular) y los inyectables (en general) tales como: pH, esterilidad, toxicidad inespecífica y contenido de proteínas y aluminio. En todos los casos se mantuvieron las especificaciones de calidad ya establecidas para VA-MENGOC-BC®. Otros, como el contenido de sacarosa, también se establecieron. Además, se determinaron las especificaciones de calidad relacionadas con las características intrínsecas de las VME de ambas cepas en la formulación, tales como: la identidad de los subtipos P1.15 y P1.4, la actividad endotóxica, la pirogenicidad y la potencia inmunogénica por ELISA ante Resultados y Discusión 114 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 a) b) 6,8 pH 600 Proteína(mg.mL-1) 7,0 6,6 6,4 6,2 6,0 1 2 3 500 400 300 200 1 4 2 3 4 Lotes 3 4 Lotes 3 4 Lotes Lotes c) d) UE.50ug-1proteína Al3+ (mg.mL-1) 8 7 6 5 4 3 1 100 90 80 70 3 4 Lotes 4000 2000 0 2 110 100 90 80 70 60 50 1 2 Fig. 44: Comportamiento de las especificaciones de calidad, ensayos internos de caracterización de lotes de monograneles (VME purificadas adsorbidas en HA, (cepa NZ98/228): a) pH; b) Contenido de proteína; c) Contenido de aluminio; d) Actividad endotóxica; e) Adsorciónde proteínas; f) porcentaje de respondedores (ELISA); g) Títulos por ABS. 20 ABS(log2tit.-1) 6000 1 f) 2 8000 4 Lotes 110 1 g) 3 Respondedores (%) Adsorción Proteína (%) e) 2 10000 15 10 5 0 1 2 Resultados y Discusión 3 4 Lotes Las líneas continuas representan la media de los valores. Las líneas discontinuas representan los límites de especificación. 115 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 a) b) Proteína (mg.mL-1) 7,0 pH 6,8 6,6 6,4 6,2 6,0 1 2 3 600 500 400 300 200 1 4 2 3 4 Lotes 3 4 Lotes 3 4 Lotes Lotes c) d) UE.50ug-1proteína Al3+ (mg.mL-1) 8 7 6 5 4 3 1 100 90 80 70 3 4 Lotes 4000 2000 0 2 110 100 90 80 70 60 50 1 2 Fig. 45: Comportamiento de las especificaciones de calidad, ensayos internos de caracterización de lotes de monograneles (VME purificadas adsorbidas en HA, (cepa CU385/83): a) pH; b) Contenido de proteína; c) Contenido de aluminio; d) Actividad endotóxica; e) Adsorción de proteínas; f) porcentaje de respondedores (ELISA); g) Títulos por ABS. 15 ABS(log2tit.-1) 6000 1 f) 2 8000 4 Lotes 110 1 g) 3 Respondedores(%) Adsorción Proteína (%) e) 2 10000 10 5 0 1 2 Resultados y Discusión 3 4 Lotes Las líneas continuas representan la media de los valores. Las líneas discontinuas representan los límites de especificación. 116 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ ambos subtipos; en este caso, bajo los mismos principios analizados para los MG se establecieron niveles de corte que consideraran a un animal como respondedor y estos niveles fueron: 500 UIgG.mL-1 para el componente CU y 1000 UIgG.mL-1 para el componente NZ. Como ensayo interno y de caracterización se establecieron la adsorción de proteínas al HA, la osmolalidad y la medición de la ABS frente a las cepas CU 385/83 y NZ 98/124; en la que se siguieron los mismos criterios para el ensayo y los resultados referidos para los MG en 3.5.5.2. Los lotes de las vacunas bivalentes desarrollados para seleccionar el lote de ensayo clínico mostraron un comportamiento muy similar en cuanto al cumplimiento de los requisitos de calidad, con muy poca variación entre ellos y una distribución muy cercana a la media, sin manifestar tendencia hacia algún límite del ensayo y con una mayor homogeneidad en todos los ensayos en relación con las VME purificadas y los MG, productos intermedios en la obtención de la vacuna bivalente. Esta afirmación es válida en cuanto a la determinación del pH, contenido de proteínas, aluminio, endotoxicidad y sacarosa (figura 46a, 46b, 46c , 46d y 46f). Es de destacar que la adsorción de las proteínas fue mayor al 90% en todos los lotes analizados, parámetro que resultó de gran importancia, por su relación con la estabilidad de la actividad endotóxica y la respuesta inmune de la vacuna (figura 46e). La osmolalidad presentó un comportamiento uniforme y todos los valores se distribuyeron muy cercanos a la media, la que correspondió a 300mOsmol.kg-1 (figura 46g). Este preparado bivalente mostró una inmunogenicidad alta con 100% de respondedores por el método de ELISA frente a las VME de ambas cepas vacunales (figura 47a y 47b); similar a los resultados obtenidos por los MG independientes. La respuesta de la ABS expresada como el logaritmo inverso del título fue 14 para el componente P1.4 y de 10 para el componente P1.15 (figura 47c y 47d). Estos resultados coincidieron con los obtenidos a partir de los respectivos MG. Los resultados obtenidos en las evaluaciones inmunológicas reafirmaron el criterio de que la combinación de las VME no manifiesta interferencias. El resto de los requisitos de calidad evaluados como la identidad de subtipos, esterilidad, toxicidad inespecífica en curieles y ratones así como la pirogenicidad, mostraron resultados satisfactorios en el cumplimiento de los límites establecidos para cada ensayo. Los resultados anteriores indicaron que la producción de lotes de vacuna bivalente a granel para ensayos clínicos fue consistente, por lo que, cualquiera de los lotes analizados pudo ser seleccionado como el lote a utilizar en el ensayo clínico. Resultados y Discusión 117 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 a) b) Proteína (ug.dosis-1) 7,5 pH 7,0 6,5 6,0 5,5 1 2 3 80 70 60 50 40 30 20 1 4 2 3 Lotes c) d) Al3+ (mg.dosis-1) 1.0 10000 -1 0.9 UE.dosis 0.8 0.7 0.6 8000 6000 4000 2000 0.5 0.4 0 1 3 f) 100 90 80 70 2 3 4 Lotes 2 3 4 Lotes 45 40 35 30 25 20 15 1 2 3 4 Lotes Fig. 46: Comportamiento de las especificaciones de calidad, ensayos internos de caracterización de lotes de MenB bivalente: a) pH; b) Contenido de proteínas; c) Contenido de aluminio; d) Actividad endotóxica; e) % de adsorción de proteínas; f) Contenido de sacarosa; g) Osmolalidad. 400 (mOsmol.Kg-1) 1 4 Lotes 110 1 g) 2 Sacarosa (mg.mL-1) Adsorción Proteína (%) e) 4 Lotes 350 300 250 Las líneas continuas representan la media de los valores. Las líneas discontinuas representan los límites de especificación. 200 1 Resultados y Discusión 2 3 4 Lotes 118 CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 a) b) 110 100 100 Respondedores (%) Respondedores (%) 110 90 80 70 60 c) 1 2 3 Lotes 4 60 15 10 5 0 1 2 3 Lotes 4 15 ABS (log2tit.-1) ABS (log2tit. ) 70 CU (P1.15) d) 20 -1 80 50 50 NZ (P1.4) 90 10 5 0 1 NZ (P1.4) 2 3 4 Lotes 1 CU (P1.15) 2 3 4 Lotes Fig. 47: Comportamiento de las especificaciones de calidad, ensayos internos y caracterización de MenB bivalente: a) Porcentaje de ratones respondedores (ELISA) inmunizados con 10µg de proteína frente VME del serosubtipo P1.4; b) Porcentaje de ratones respondedores (ELISA) inmunizados con 10µg de proteína frente a VME del serosubtipo P1.15; c) ABS de ratones inmunizados con dos dosis de 10µg frente a la cepa NZ 98/124; d) ABS de ratones inmunizados con dos dosis de 10µg frente a la cepa CU 385/83. Resultados y Discusión 119 CONFIDENCIAL Versión: 3 3.5.7 Página ____ Ejemplar No. _____ Estabilidad de vida de estante y estrés de monograneles de VME de las cepas CU 385/83 y NZ 98/228 El estudio de la estabilidad de los MG de ambas cepas de vida de estante y de estrés mostró que ambos MG cumplieron todos los requisitos de calidad cualitativos durante todos los tiempos y condiciones del estudio tales como: descripción, identidad de los antígenos de serosubtipo (P1.4 ó P1.15), así como la presencia de las bandas proteicas características (PorA, PorB, RmpM, Opc y las de 70 y 80 kDa. También la pirogenicidad y esterilidad (anexos 20 y 21). El pH en ambos MG se mantuvo entre los límites establecidos durante los 12 meses (anexos 20 y 21) del estudio, no mostrando diferencias estadísticamente significativas (p>0,05). La adsorción de las proteínas en los dos MG mantuvieron valores que oscilaron entre el 91 y 95 % durante los ensayos realizados, resultados que no mostraron diferencias significativas para las cepas por separado (p>0,05) en los diferentes tiempos y condiciones de la investigación (figuras 48a y 49a). La actividad endotóxica se mantuvo estable para los MG con resultados donde no se observó diferencia estadísticamente significativa de los estudios en ambos casos independientes, ni una tendencia al aumento de esta característica (p>0,05). El porcentaje de respondedores determinado por ELISA para los MG de ambas cepas se mantuvo entre el 87 y 100% durante toda la investigación, sin mostrar una tendencia a la disminución, un comportamiento similar se evidenció en la estabilidad del estrés. Estos resultados no fueron significativos estadísticamente (p>0,05). La ABS de los MG procedentes de la cepa NZ 98/228 se mantuvo en valores medios cercanos a 14 (inverso del logaritmo de la dilución), mientras que para los de la cepa CU 385/83 los valores medios fueron cercanos a 9. El análisis estadístico no evidenció diferencia significativa para el comportamiento de ambos MG por separado en los diferentes tiempos y condiciones del estudio (p>0,05). Aunque se observó una ligera disminución en la última muestra analizada del MG correspondiente a la cepa CU 385/83, lo que pudo ser debido a la variabilidad propia de los métodos biológicos. Los resultados obtenidos en la estabilidad de los MG en vida de estante evidenciaron que los mismos pueden conservarse entre 2 - 8 ºC por un año, sin afectarse su identidad, pureza y potencia, los estudios de estrés (37 ºC – 7 días) mostraron que el producto fue estable en estas condiciones, Resultados y Discusión 120 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ lo que garantiza su estabilidad en períodos cortos fuera de las condiciones de almacenamiento establecidas. Fig. 48. Estabilidad de vida de estante y estrés de monograneles (VME purificadas adsorbidas en HA, (cepa NZ98/228): a) Comportamiento de la adsorción de proteínas; b) Comportamiento de la actividad endotóxica; c) Comportamiento del porcentaje de respondedores (ELISA); d) Comportamiento de los títulos de la ABS. Resultados y Discusión 121 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Fig. 49: Estabilidad de vida de estante y estrés de monograneles (VME purificadas adsorbidas en HA, (cepa CU385/83): a) Comportamiento de la adsorción de proteínas; b) Comportamiento de la actividad endotóxica; c) Comportamiento del porcentaje de respondedores (ELISA); d)Comportamiento de los títulos de la ABS. Resultados y Discusión 122 CONFIDENCIAL Versión: 3 3.5.8 Página ____ Ejemplar No. _____ Estabilidad de vida de estante y estrés de la vacuna Men B bivalente a granel El estudio de la estabilidad de vida de estante y estrés mostró que la vacuna cumplió sus requisitos de calidad cualitativos durante todos los tiempos y condiciones del estudio, tales como: descripción, toxicidad específica en ratones y curieles, identidad de los antígenos de serosubtipos (P1.4 y P1.15), pirogenicidad y esterilidad (anexo 22). El pH se mantuvo dentro de los límites establecidos sin una tendencia marcada en su comportamiento (anexo 22), lo que no resultó estadísticamente significativa (p>0,05). La adsorción de proteínas se mantuvo entre el 91 y 96 % durante los diferentes tiempos y condiciones de la investigación (figura 50a), resultados que no mostraron diferencias significativas (p>0,05). La actividad endotóxica se mantuvo por debajo del límite de especificación en todo el estudio, sin mostrar tendencia (figura 50b), lo que resultó estadísticamente no significativa (p>0,05). La inmunogenicidad de la vacuna MenB bivalente evaluada por el método de ELISA mostró un comportamiento similar para sus dos componentes, donde el porcentaje de animales con respuesta de anticuerpos sobre los niveles de corte establecidos se mantuvo entre el 93 y 100 % (figura 50c), resultado que no mostró diferencias estadísticamente significativas para ambos componentes (p>0,05). El comportamiento de la ABS en relación al componente CU evidenció que a los nueve meses del estudio los títulos bactericidas bajaron ligeramente con relación a los valores iniciales, lo cual no se evidenció a los 18 meses del estudio (figura 50d). El análisis estadístico que incluyó todos los tiempos y condiciones del estudio, no mostró diferencias estadísticas significativas (p=0,091). La ABS del componente NZ dentro de la vacuna MenB bivalente, mostró un comportamiento similar al referido para el componente CU, donde se observa una caída del título bactericida a los nueve meses del estudio, los que posteriormente se incrementan a los 12 meses y más aún a los 18 meses (figura 50e). El análisis estadístico detectó diferencias significativas en el comportamiento anterior (p=0,1957). Cuando se realizó un análisis “post hoc” por la prueba de Conover, se observa que el tiempo nueve meses difiere de los tiempos inicial y final y la muestra tratada a 37 ºC por 7 días (estrés) (p<0,01), en el resto de los tiempos no se detectaron diferencias significativas entre sí (p>0,05). Resultados y Discusión 123 CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ En general para ambos componentes se observa que los valores de actividad bactericida más bajos en el estudio se observaron a los nueve y 12 meses, lo que pudo estar relacionado con la variabilidad que introducen los animales en la prueba en un estudio a largo plazo, más que con una pérdida de la capacidad del producto para producir anticuerpos funcionales con actividad bactericida. En esta etapa del desarrollo no se fijó un límite de especificación para la ABS debido a la introducción de un nuevo esquema de doble inmunización con 10 μg de proteínas provenientes de 5 μg de cada subtipo (P1.4 y P1.15) y no contarse con datos previos del comportamiento de este requisito de calidad. El estudio de la estabilidad de vida de estante del candidato vacunal Men B bivalente a granel, demostró que la vacuna fue estable durante los 18 meses del estudio. Los resultados satisfactorios en los estudios de estrés garantizan la estabilidad del producto en períodos cortos fuera de las condiciones de almacenamiento establecido. 3.5.9 Conclusiones parciales de la obtención de un nuevo candidato vacunal bivalente contra cepas de N. meningitidis serogrupo B: ¾ Se diseño una nueva vacuna bivalente basada en la combinación de VME de la cepa CU 385/83 con actividad heteróloga demostrada y de la cepa NZ 98/228 con el subtipo P1.4 prevalente en Europa. ¾ Para el desarrollo de la vacuna bivalente se tomó como producto de referencia a VA-MENGOC-BC®, preparado líder en el campo de las vacunas basadas en las VME contra cepas de N. meningitidis del serogrupo B. ¾ La nueva vacuna mantuvo el contenido total de proteínas, HA y fosfatos; incorporó la sacarosa; ajustó el contenido de Cloruro de Sodio y eliminó el uso del PC-C y el tiomersal. ¾ Los dos IFA que contiene la vacuna se obtuvieron por una misma tecnología, ambos IFA y la vacuna bivalente desarrollados, no mostraron interferencias inmunogénicas en la combinación, cumplieron las especificaciones de calidad establecidas y fueron estables en estudios de vida, de estante y de estrés. Resultados y Discusión 124 CONCLUSIONES CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ CONCLUSIONES ¾ Se perfeccionó la etapa de separación celular con el empleo de la MFT logrando aumentos en los rendimientos de las VME, una reducción apreciable del equipamiento y áreas a utilizar y se demostró el cumplimiento de las BPF. ¾ Se evidenció la consistencia de producción en cuanto a la presencia de proteínas en las VME con el empleo de la 2DE de alta resolución. ¾ Se identificaron por proteómica 26 nuevos componentes en las VME, algunos de ellos con potencial contribución a la respuesta inmune. ¾ La sacarosa redujo considerablemente la pirogenicidad de las VME y la adsorción de éstas al HA garantizó su estabilidad como IFA. ¾ La introducción de la sacarosa al proceso de purificación disminuyó considerablemente el número de equipos y áreas a emplear. ¾ La cepa NZ 98/228 se seleccionó como vacunal ya que bajo el mismo proceso de la cepa cubana, se obtuvieron VME equivalentes en cuanto a su perfil de identidad, seguridad y potencia. ¾ El nuevo candidato vacunal bivalente obtenido de la combinación de las VME de las cepas CU 385/83 y NZ 98/228 al igual que los IFA que lo componen cumplieron las especificaciones de calidad y fueron estables en vida de estante y estrés. 125 RECOMENDACIONES CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ RECOMENDACIONES ¾ Continuar la ejecución de ensayos clínicos de la vacuna de MenB bivalente en diferentes grupos etáreos. ¾ Remodelar las instalaciones productivas, acorde a la tecnología perfeccionada y con las regulaciones farmacéuticas europeas. ¾ Completar el estudio de validación de procesos. ¾ Realizar la identificación de las proteínas presentes en las VME en sacarosa mediante técnicas proteómicas. 126 REFERENCIAS BIBLIOGRÁFICAS CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 REFERENCIAS BIBLIOGRÁFICAS o Abdillahi H, Poolman JT. Whole cell ELISA for typing Neisseria meningitidis with monoclonal antibodies. FEEMS Microbiol Letters1987; 48:367-71. o Andrew N, Borrow R, Miller E. Validation of serological correlate of protection of meningococcal C conjugated vaccine by using efficacy estimated from post licensure surveillance in England. Clin Diagn Lab Immunol 2003; 10 (5):780-6. o Anumula KR. Quantitative determination of monosaccharides in glycoproteins by high performance liquid chromatography with highly sensitive fluorescence detection. Anal Biochem1994; 220:277-83. o Baik SC, Kim KM, Song SM y col. Proteomic analysis of the sarcosine-insoluble outer membrane fraction of Helicobacter pylori strain 26695. J Bacteriol 2004; 186(4):949-55. o Baker MG, Martin DR, Kieft CE, Lennon D. A 10 years serotype B meningococcal disease epidemic in New Zealand: descriptive epidemiology, 1991-2000. J Paediatr Child Health 2001; 37:S13-9. o Balmer P, Borrow R, Miller E. Impact of meningococcal C conjugate vaccine in the UK. J Med Microbiol 2002; 51:717-22. o Balmer P, Borrow R. Serological correlates of protection for evaluating the response to meningococcal vaccine. Exp Rev Vaccines 2004; 3(1):77-87. o Baltimore R. Recent trends in meningococcal epidemiology and current vaccine recommendations. Curr Opin Pediatr 2006; 18:58-63. o Beakley C. GE-Free New Zealand in food and enviroment. Avaible from: http://www.gefree.org.nz/meninginfo.html, 2006. o Bernardini G, Renzone G, Comanducci M y col. Proteome analysis of Neisseria meningitidis serogroup A. Proteomics 2004; 4(10):2893-926. o Bjune G, Høiby EA, Gronnesby JK y col. Effect of outer membrane vesicle vaccine against serogroup B meningococcal vaccine in Norway. Lancet 1991; 338:1093-6. Anexos I o Borrow R, Andrews N, Goldblatt D, Miller E. Serological basis for use of meningococcal serogroup C conjugated vaccine in the United Kingdom. Revaluation of correlates of protection. Infect Immun 2001; 69(3):1568-73. o Borrow R, Balmer P, Miller E. Meningococcal subrogates of protection-serum bactericidal antibodies activity. Vaccine 2005; 23:2222-7. o Borrow R, Carlone GM, Rosenstein N y col. Neisseria meningitidis group B correlates of protection and assay standardization-international meeting report Emory University, Atlanta, Georgia, United States. 16-17 March 2005. Vaccine 2006; 24:5093-107. o Boutriau D, Poolman J, Borrow R y col. Immunogenicity and safety of three doses of a bivalent (B:4:P1.19,15 and B:4:P1.7-2,4) meningococcal outer membrane vesicle vaccine in healthy adolescents. Clinical and Vaccine Immunology 2007; 14(1):65-73. o Bröker M. Development of new vaccines against meningococcal disease. Arzeneimittel froschung 2003;53(12):805-13. o Brandileone MC, Zarella RC, Vieira VS y col. Inductions of iron regulated proteins during normal grow of Neisseria meningitidis in a chemically defined medium. Rev Inst Med Trop, São Paulo 1994; 36:301-10. o Bruge J, Boubert-Le CAM, Danve B y col. Clinical evaluation of a group B meningococcal N-propionylated polysaccharide conjugated vaccine in adult, male volunteers. Vaccine 2004; 22 (9-10):1087-96. o Burrell LS, Lindblad EB, White JL y col. Stability of aluminum-containing adjuvant to autoclaving. Vaccine 17, 1999; 2599-2603. o Cadoz M, Armand J, Arminjon F y col. Tetravalent (A, C, Y, W135) meningococcal vaccine in children: immunogenicity and safety. Vaccine 1985; 3-340-2. o Campa C, Sierra G, García L y col. Informe de la tecnología de producción de la vacuna VA-MENGOC-BC. Confidencial. Centro Nacional de la Vacuna Antimeningocócica. 1989. o Campa C, Sierra VG, Gutiérrez MM y col. Method of producing Neisseria meningitidis B vaccine, and vaccine produced by method. United States Patent number 5 597 572. o Cardoso D. Paquete tecnológico para la obtención de vacunas bacterianas con un enfoque de proceso unitario. [Tesis]. ISPJAE, Ciudad de La Habana, 2001. o Carrére H and René F. Industrial multi-stage continuous filtration process: influence of operating parameters. J Membrane Science 1996; 110:191-202. o Caugant DA, Frohølm LO, Bøvre K y col. Intercontinental spread of genetically distinctive complex of clones of Neisseria meningitidis causing epidemic disease. Proc Natl Acad Sca USA 1986; 83:4927-31. o Caugant DA, Kristiasen BE, Frøholm LO y col. Clonal diversity of Neisseria meningitidis from a population of asymptomatic carriers. Infec Immun 1988; 56:2060-8. o Caugant DA, Mocca LF, Frasch CE y col. Genetic structure of Neisseria meningitidis population in relation to serogroup, serotype and outer membrane protein pattern. J Bacteriol 1987;169: 2781-92. o Caugant DA. Populations genetics and molecular epidemiology of Neisseria meningitidis. APMIS 1998; 106:505-25. o Caugant DA. Molecular epidemiology of meningococci. Bull Soc Pathol 2002; 95:319-322. o Centro para el Control de Calidad de Medicamentos (CECMED). Cambios de procesos de producción de productos biológicos registrados, Comparación de productos biológicos. Regulación No. 33 – 2003, MINSAP, 2003. o Centro para el Control de Calidad de Medicamentos (CECMED). Directrices sobre Buenas Prácticas de Fabricación de Productos Farmacéuticos. Regulación No. 16 – 2006, MINSAP, 2006. o Centro para el Control de Calidad de Medicamentos (CECMED). Requerimientos de los estudios de estabilidad para el registro de productos biológicos y biotecnológicos. Regulación No. 252000, MINSAP, 2000. o Center for Disease Control and Prevention (CDC). Prevention and control of meningococcal disease. Recommendations of the Advisory Committee on Immunization Practices (ACIP) MMWR. Recommendations and Reports. 2005, 54 (RR07):pp;1-21. o Churchward MA, Butt RH, Lang JC, Hsu KK, y col. Enhanced detergent extraction for analysis of membrane proteomes by two-dimensional gel electrophoresis. Proteome Sci 2005;3(1):5. o Claassen I, Meylis J, van der Ley P y col. Production, characterization and control of a Neisseria meningitidis hexavalent class 1 outer membrane protein containing vesicle vaccine. Vaccine 1996;14 (10):1001-8. o Committee on Infectious Diseases. Prevention and control of meningococcal disease. Recommendations for use of meningococcal vaccines in paediatrics patients. Paediatrics 2005; 116:496-505. o Corbel MJ. Control testing of combined vaccines: a consideration of potential problems and approaches. Biologicals 1994; 22: 353-360. o Danzig L. Meningococcal vaccines. The Pediatric Infectious Disease Journal 2004;23(12): 528592. o de Moraes JC, Perkins BA, Camargo MCC y col. Protective efficacy of serogroup B meningococcal vaccine in São Paulo, Brazil. Lancet 1992; 340:1074-8. o Desmons PM, Poolman J, Barbera R y col. Vaccine comprising mixtures of multivalent meningococcal outer membrane vaccine. 03735 599.7-2402-EP0306094; 2006. o Diermayer M, Hedberg K, Hoesly F, y col. Epidemic Serogroup B meningococcal disease in Oregon. The evolving epidemiology of the ET-5 strain. JAMA 1999; 218(16):1493-7. o Dubois M, Gilles KQ, Hamilton JK y col. Colorimetric method for determination of sugars and related substances. Analytical chemistry 1956; 28(3):350-356. o Duke T, Curtis N, Fuller DG. The management of bacterial meningitidis in children. Expert Opin Pharmacother 2003; 4: 227-40. o Estabrook MM, Jack DL, Klein NJ, Jarvis GA. Mannose-binding lecitin binds to two major outer membrane proteins, opacity protein and porin, of Neisseria meningitidis. J Immunol 2004; 172: 3784-92. o Estrada EA. Optimización del Western blot y aplicación en el estudio de la inmunogenicidad de las proteínas de la vacuna meningocócica VA-MENGOC-BC. [Tesis]. Ciudad de La Habana: Instituto Superior de Ciencias Médicas de La Habana; 1995. o European Commission (EC). The rules governing medicinal products in the European Union. Vol 4. Good manufacturing practice medicinal product for human and veterinary use. Draft Annex 2. Manufacture of biological medicinal product for human use, 2007. o European Medicines Agency (EMEA). Specifications test procedures and acceptance criteria for Biotechnological/Biological products (CPMP/ICH/365/96), 1999. o European Medicines Agency (EMEA). Note for guidance on Biotechnological/Biological products subject to changes in their manufacturing process (CPMP/ICH/5721/03), 2006a. o European Medicines Agency (EMEA). Guideline of the requirements to the chemical and pharmaceutical quality documentation concerning investigational medicinal products in clinical trials (CHMP/QWP/185401/2004 final), 2006b. o Food and Drug Administration (FDA). Influenza virus vaccine (FluLaval). Highlights of prescribing information, 2006. o Feavers IM, Gray SJ, Urwin R, Russell JE, y col. Multilocus sequence typing and antigen gene sequencing in the investigation of a meningococcal disease outbreak. J Clin Microbiol 1999; 37:3883-87. o Frasch CE, Chapman SS. Classification of Neisseria meningitidis serogroup B into distinct serotypes. III Application of a new bactericidal inhibition technique to distribution of serotypes among cases and carriers. J Infect Dis 1972; 127:149-54. o Frasch CE, Monelis RM, Gotschlich EC. Strain-specific variant in the protein and lipopolysaccharide composition of the Group B meningococcal outer membrane. J Bacteriol. 1976; 973-81. o Frasch CE, Peppler MS. Protection against serogroup B Neisseria meningitidis disease: Preparation of soluble protein and protein-polysaccharide immunogens. Infect Immun 1982; 37: 271-80. o Frasch CE, van Alphen L, Holst J y col. Methods in Molecular Medicine, In: Meningococcal Vaccines: Methods and Protocols. Edited by AJ Pollard and MC Maiden, Human Press Inc, Totowa, NJ 2001; pp: 81-107. o Frasch CE, Zahradnik JM, Wang LY y col. Antibody response of adults to an aluminum hydroxide adsorbed Neisseria meningitidis serotype 2b protein serogroup B-polysaccharide vaccine. J Infect Dis 1988; 158:700-8. o Frasch CE, Zollinger WD, Poolman JT. Serotypes antigens Neisseria meningitidis and a proposed scheme for designation of serotypes. Rev Infect Dis 1985; 7:504. o Frasch CE. Serogroup and serotype classification of bacterial pathogens. Methods in Enzymology. Vol 235: Academic Press Inc 1994; pp: 81-107. o Frasch CE. Meningococcal vaccines: past, present and future. In: Meningococcal disease. Ed. Keith Cartwright 1995, John Wiley & Sons Ltd. pp: 245-83. o Frasch CE. Production and control of Neisseria meningitidis vaccine. In: Bacterial Vaccine, Mizrahi A, ed, Wiley-Liss, New York 1990; pp: 123-145. o Frasch CE, Robbins JD. Protection against group B meningococcal disease. III. Immunogenicity of serotype 2 vaccines and specificity of protection in a guinea pig model. J Exp Med 1978; 147: 629-44. o Frasch CE. Recent developments in Neisseria meningitidis group A conjugate vaccines. Expert Opin Biol Ther 2005;5: 273-80. o Fredriksen JH, Rosenqvist E, Wedege E y col. Production, characterization and control of MenBvaccine “Folkehelsa”, an outer membrane vesicle vaccine against group B meningococcal disease. NIPH Ann 1991; 14:67-80. o Fu J, Bailey FJ King JJ y col. Recent advances in the large scale fermentation of Neisseria meningitidis group B for the production of an outer membrane protein complex. Biotechnology 1995; 13:170-4. o Fusco PC, Michon F, Tai JY, Blake MS. Preclinical evaluation of a novel B meningococcal conjugate vaccine that elicits bactericidal activity in both mice and non human primates. J Infect Dis 1997; 175 (2):364-72. o Galeano LA, Echeverry ML. Efectividad de una vacuna antimeningocócica en una cohorte de Itaqui, Colombia. Boletín Epidemiológico de Antioquia1995; 20-28. o Gharahdaghi F, Weinberg C, Meagher DA y col. M. Mass spectrometric identification of proteins from silver-stained polyacrylamide gel: a method for the removal of silver ions to enhance sensitivity. Electrophoresis 1999; 20:601-5. o Goldshneider I, Gotschlich E, Artenstein MS. Human immunity to the meningococcus. I The role of humoral antibodies. J Exp Med 1969; 129(6):1307-26. o Gotschlich EC, Goldschneider I, Artenstein MS. Human immunity to the meningococcus IV. Immunogenicity of group A, group B and group C meningococcal polysaccharides in human volunteers. J Exp Med 1969; 129:1367-84. o Guiboundenche M, Riou JY. Identification bactériologique des espèces des genres Neisseria et Branhamella serogroupage du méningocoque. Evolution de la nomenclature. Med Mal Infect 1997; 27:763-73. o Guliane MM, Adu-Bobie J, Comanduci M y col. A universal vaccine for serogroup B meningococcus. Proc Nat Acad Sci USA 2006; 103 (29):10834-9. o Guttormsen HK, Bjerknes R, Halstensen A, y col. Cross-reacting serum opsonins to meningococci after vaccination. J Infect Dis 1999; 167:1314-19. o Halpering SA, Langley JM, Smith B, Nunderli P. Phase 1 first- in human studies of the reactogenicity and immunogenicity of recombinant meningococcal NspA vaccine in healthy adults. Vaccine 2007; 25:450-57. o Helting TB, Guthöhrlein G, Blakkolb F, Ronneberg H. Serotype determinant protein of Neisseria meningitidis. Large scale preparation by direct detergent treatment of the bacterial cels. Acta Pathol Microbiol Scand 1981; 89:69-78. o Hem SL, White JL. Characterization of aluminum hydroxide for use as an adjuvant in parenteral vaccines. J Pareter Sci Technol 1984; 38:2-10. o Heukeshoven J, Dernick R. Simplified method for silver staining of proteins in polyacrylamid gels and the mechanism of silver staining. Electrophoresis 1985;6:103-12. o Holst J, Feiring B, Fugleasang JE y col. Serum bactericidal activity correlates which the vaccine efficacy of outer membrane vesicle against Neisseria meningitidis serogroup B disease. Vaccine 2003;21(7-8):734-7. o Holst J, Feiring B, Naess LM y col. The concept of “tailor made”, protein based, outer membrane vesicle vaccine against meningococcal disease. Vaccine 2005;23:2202-5. o Huang F, Hedman E, Funk C y col. Isolation of outer membrane of Synechocystis sp. PCC 6803 and its proteomic characterization. Mol Cell Proteomics 2004;3 (6):586-95. o Iborra S, Soto M, Carrión J y col. The Leishmania infantum acidic ribosomal protein P0 administered as a DNA vaccine confers protective immunity to Leishmania major infection in BALB/c mice. Infect Immun 2003;71 (11): 6562-72. o ICH Harmonised Tripartite Guidance. Quality of Biotechnological Products: stability testing of biotechnological products. Recommended for adoption at step 4 of the IHC process on November 1995 by the ICH steering committee, 1996. o Jennings MP, Srikhanta YN, Moxon ER y col. The genetic basis of the phase variation repertoire of lipolisaccharide immunmotypes in Neisseria meningitidis. Microbiology 1999;145: 3013-21. o Jennings HJ, Roy R, Gamian A. Induction meningococcal group B polysaccharide-specific IgG antibodies in mice using a N-propionylated B polysaccharide-tetanus toxoide conjugated vaccine. J Immunol 1986;137:1708-13. o Jensen ES, Schonheyder HC, Lind I y col. Seasonal variation in meningococcal disease in Denmark: relation to age and meningococcal phenotype. Scand J Infect Dis 2003; 35:226-9. o Jensen ON, Wilm M, Shevchenko A, Mann M. Sample preparation methods for mass spectrometric peptide mapping directly from 2-DE gels. Methods Mol Biol 1999; 112:513-30. o Jodar L, Feavers IM, Salisbury D, and Granoff DM. Development of vaccines against meningococcal disease. Lancet 2002:359:1499-508. o Joklik WK, Willet HP, Amos DB, Wilfer CM. Neisseria. En: Zinzzer, Microbiología 2ª Ed. Editorial Médica Panamericana 1998; pp 611-35. o Jolley KA, Kalmusova J, Feil EJ y col. Carried meningococci in the Chezch Republic: a diverse recombining population. J Clin Microbiol 2002;40:3549-50. o Jones DM, Eldrige J. Development of antibodies to meningococcal protein and lipopolysaccharide antigens in healthy carriers. J Med Microbiol 1979;12:107-11. o Kimmel SR. Prevention of meningococcal disease. American Family Physician 2005;72:2049-55. o Keyserling HL, Pollard AJ, De Tora LM. Experience with MCV-4, a meningoccocal, diphteria toxoid conjugate vaccine against serogroups, A, C, Y and W135. Expert Rev Vaccines 2006;5 (4):445-59. o Kortekass J, Pettersson A, van der Biezent J y col. Shielding of immunogenic domains in Neisseria meningitidis Frp (Fet A) by the major variable region. Vaccine 2007; 25(1):72-84. o Kung VT, Pantili PR, Sheldon EL y col. Picogram quantitation of total DNA using DNA-binding proteins in a silicon sensor-based system, Anal Bioichem, 1990; 187: 220-227. o Kvalsvig AJ, Unsworth DJ. The immunopathogenesis of meningococcal disease. J Clin Pathol 2003; 56: 417-22. o Laemmli UK. Cleavage of structural protein during the assembly of the head of bacteriophage T 4. Nature 1970;227:680-5. o Lecompte O, Ripp R, Thierry JC y col. Comparative analysis of ribosomal proteins in complete genomes: an example of reductive evolution at the domain scale. Nucleic Acids Res 2002;30 (24):5382-90. o Leinonen M, Frasch CE. Class-specific antibody response to serogroup B Neisseria meningitidis capsular polysaccharide use of polylysine precoating in an enzyme-linked immunosorbent assay. Infect Imm 1982;38;1203-7. o Li Y, Zhang Q, Winterbothan J y col. Immunization with live Neisseria lactámica protects mice against meningoccocal challenge and can elicit serum bactericidal antibodies. Infect Immunology 2006;74 11):6348-55. o Lowry OH, Rosenbrought NJ, Farr AL, Randall RH. Protein measurement with the Folin phenol reagent. J Biol Chem 1951;93:265-75. o MacDonals NE, Halperin SA, Law BJ y col. Induction of immunologic memory by conjugated versus plain meningococcal C polysaccharide vaccine in toddlers: a randomized controlled trial. JAMA 1998;280:1685-9. o Maiden MCJ, Bygraves JA, Morelli G y col. Multilocus sequence typing: a portable approach to the identification of clones within populations of pathogenic microorganisms. Proc Natl Acad Sci USA 1998;95:3140-5. o Maiden MC, Russell J, Suker J, Feavers IM. Neisseria meningitidis subtype nomenclature. Clin Diagn Lab Immunol 1999; 6: 771-72. o Maiden,M.C. and Frosch,M. Molecular techniques for the investigation of meningococcal disease epidemiology. Mol Biotechnol 2001;18:119-34. o Mandrell RE, Zollinger WD. Measurement of antibodies to meningococcal serogrupo B polysaccharide: Low avidity binding and equilibrium binding constants. J Immunol 1982;129: 2172-7. o Martínez I. Antígenos vacunales antimeningocóccicos. Aportes al control de la calidad. [Tesis] Ciudad de La Habana: Universidad de La Habana; 2002. o Martínez I. Neisseria meningitidis: Contribución al transporte, conservación y caracterización de cepas aisladas en Cuba (1982-2002). [Tesis]. Ciudad de La Habana: Instituto Finlay-IPK; 2005. o Mastroniano P, Stefanelli P Fazio C y col. Serotype distribution, antibiotic susceptibility and genetic relation of Neisseria meningitidis strains recently isolated in Italy. Clin Inf Dis 2003;36: 422-8. o Matsuoka M, Nomaguchi H, Yukitake H y col. Inhibition of multiplication of Mycobacterium leprae in mouse footpads by immunization with ribosomal fraction and culture filtrate from Mycobacterium bovis BCG. Vaccine 1997;15(11):1214-7. o Mignogna G, Giorgi A, Stefanelli P y col. Inventory of the proteins in Neisseria meningitidis serogroup B strains MC58. J Proteome Res 2005;4(4):1361-70. o Milagres LG, Ramos SR, Sacchi CT y col. Immune response of Brazilian children to a Neisseria meningitidis serogroup B outer membrane protein vaccine: comparison with efficacy. Infection and Immunity 1994; (Oct):4419-24. o Molloy MP, Phadke ND, Chen H y col. Profiling the alkaline membrane proteome of Caulobacter crescentus with two-dimensional electrophoresis and mass spectrometry. Proteomics 2002;2(7): 899-910. o Molloy MP, Phadke ND, Maddock JR, Andrews PC. Two-dimensional electrophoresis and peptide mass fingerprinting of bacterial outer membrane proteins. Electrophoresis 2001;22 (9):1686-96. o Morley S, Cole MJ, Ison C y col. Immunogenicity of a serogroup B meningococcal vaccine against multiple Neisseria meningitidis strains in infants. Pediatr Infect Dis J 2001;20:1054-61. o Mukhopadhyay TK, Halliwell D, O'Dwyer C, Shamlou PA y col Rapid characterization of outermembrane proteins in Neisseria lactamica by SELDI-TOF-MS (surface-enhanced laser desorption ionization-time-of-flight MS) for use in a meningococcal vaccine. Biotechnol Appl Biochem 2005;41(Pt 2):175-82. o Nally JE, Whitelegge JP, Aguilera R y col. Purification and proteomic analysis of outer membrane vesicles from a clinical isolate of Leptospira interrogans serovar Copenhageni. Proteomics 2005;5(1):144-52. o Nandakumar R, Nandakumar MP, Marten MR, Ross JM. Proteome analysis of membrane and cell wall associated proteins from Staphylococcus aureus. J Proteome Res 2005;4(2):250-257. o Nassif X, Bourdoulous S, Eugene E, Couraud PO. How do extracellular pathogens cross the blood-brain barrier?. Trends Microbiolol 2002;10 (5):227-32. o Nassif X, So M. Interaction of pathogenic Neisseria with non phagocytic cells. Clin Microbiol Rev.1995;8:376-88. o Noah N, Henderson B. Surveillance of bacterial meningitis in Europe, 1997-98. Communicable Disease Surveillance Center, October 1999. o Norheim G, Aase A, Caugant DA y col. Development and characterization of outer membrane vesicle vaccines against serogroup A Neisseria meningitidis. Vaccine 2005; 23(29):3762-74. o Osborn MJ. Studies on the gram-negative cell in the lipopolysaccharide of Salmonella typhimurium. Proc Natl Acad Sci USA 1963;50: 99-506. o Offit PA, Peter G. The meningococcal vaccine: policy and individual choices. N England J Med 2003;349:2353-6. o Organización Mundial de la Salud (OMS). Reunión de estandarización de vacunas contra el meningococo del serogrupo B. Río de Janeiro, Brasil, Mayo 11-12, 2000. o Oster P, O'Hallanan J, Aaberge I, y col. Immunogenicity and safety of strain-specific Men B OMV vaccine delivered to under 5-years olds in New Zealand. Vaccine 2007;25(16):3075-9. o Parenteral Drug Association (PDA). Industrial perspectives on validation of tangencial flow filtration in biopharmaceutical applications. Technical Report No 15 Vol. 46, Supplement 1992. o Parkhill J, Achtman M, James KD y col. Complete DNA sequence of a serogroup A strain of Neisseria meningitidis Z2491. Nature 2000;404 (6777):502-6. o Patrick DM, Champagne S, Goh SH y col. Neisseria meningitidis carriage during an outbreak of serogrupo C. Clin Infect Dis 2003;37:1183-8. o Peeters CC, Claassen IJ, Schuller M y col. Immunogenicity of various presentation forms of PorA outer membrane protein of Neisseria meningitidis in mice. Vaccine 1999;17: 2702-12. o Peppler MS, Frasch CE. Protection against group B Neisseria meningitidis: Effect of serogroup B polysaccharide and polymixin B on the immunogenicity of serotype protein preparation Infect Immun 1982;7:264-70. o Pérez A, Dickison F, Tamargo I y col. Resultados y experiencias de la vigilancia nacional de meningitis bacteriana en Cuba. Biotecnología Aplicada 2003;20: 18-22. o Perkins BA, Jonsdottir K, Briem H y col. Immunogenicity of two efficacious outer membrane protein- based serogroup B meningococcal vaccines among young adults in Iceland. J Infect Dis 1998;177: 683-91. o Perkins DN, Pappin DJ, Creasy DM y col. Probability-based protein identification by searching sequence databases using mass spectrometry data. Electrophoresis 1999;20:3551-67. o Perrett KP, Pollard AJ. Towards an improved serogroup B Neisseria meningitidis vaccine. Expert Opin Biol Ther 2005;5(12): 611-25. o Pessione E, Giuffrida MG, Prunotto L y col. Membrane proteome of Acinetobacter radioresistens. Proteomics 2003;3(6):1070-6. o Pichichero M, Casey J, Blatter M y col. Comparative trial of the safety and immunogenecity of quadrivalent (A, C, Y, W135) meningococcal polysaccharide vaccine in two-to ten year-old children. Pediatr Infec Dis J 2004; 24:57-62. o Pichichero ME. Meningococcal conjugate vaccines. Exp Opin Biol Ther 2005; 5(10):1-14. o Pizza M, Scarloto V. Identification of vaccine candidates against serogroup B meningococcus by whole-genome sequencing. Science 2000;287(5459):1816-20. o Pollard AJ, Frasch CE. Development of natural immunity to Neisseria meningitidis. Vaccine 2001;19:327-46. o Pollard AJ, Maiden MC. Epidemic meningococcal disease in sub Saharan Africa: towards a sustainable solution. Lancet Infect Dis 2003;3:68-70. o Pollard AJ. Global epidemiology of meningococcal disease and vaccine efficacy. Pediatr Inf Dis J 2004;23:274-9. o Pollard AJ. Prevention of meningococcal disease in the UK: potential for use of quadrivalent or partially protective MenB vaccines. Lecture presented in Meningitis and Septicaemia in Children and Adults International Conference. London, UK; Nov 7-8, 2007. o Poolman J, Berthet FX. Alternative vaccine strategies to prevent serogroup B meningococcal diseases. Vaccine 2001;20 (Suppl 1):524-6. o Poolman JT, van der Ley PA, Tommamssen J. Surfaces structures and secreted products of meningococci. In: Meningococcal Disease. England (ed) John Wiley & Sons Ltd 1995; pp:21-34. o Poolman JT. Polysaccharides and membrane vaccines in bacterial vaccine. Advances in Biotechnological Process, Vol 13. (ed) AV Shalom Mizrahi, Wilay LSS John Wilay & Sons, Inc Publication 1990; pp:57-86. o Poolman JT. Serotype and subtypes of Neisseria meningitidis. Results of an international study comparing sensitivities and specifies of monoclonal antibodies. Clin Diagn Lab Immunol 1995; 2:69-72. o Ramsay M, Andrews NJ, Trotter CL y col. Herd immunity from meningococcal serogroup C conjugate vaccine in teenagers and toddlers in England. Lancet 2001;357:195-6. o Ramsay ME, Andrews NJ, Kaczmarski E, Miller E. Efficacy of meningococcal serogroup C conjugated vaccine in teenagers and toddlers in England. Lancet 2001;357:195-6. o Rosenqvist E, Harbak K, Nord K y col. Patent. International Publication Number WO 01/9/1788 A1. PCT/N 001/00232, 2001. o Richmond P, Borrow R, Findlow J y col. Evaluation of de-O-acetilated meningococcal C conjugated vaccine in infancy: reactogenecity, immunogenecity, immunologic priming and bactericidal activity against O-acetilated and de-O-acetylated serogroup C strains. Infect Imm 2001;69:2378-82. o Rico O, Bravo JR, Díaz M. Effectiveness after license of BC antimeningococcal vaccine (VA-MENGOC-BC®) in Cuba children from 0-5 years old In: Conde Glez CJ, Morse, Rice P y col. ed. Patholobiology and Immunolobiology of Neisseriace Proceeding of The VIII International Pathogenic Neisseria Conference, Cuernavaca, México: INSP. 1994: pp:888-894. o Rosenqvist E, Hoiby EA, Bjune G y col. Effect of aluminium hydroxide and meningococcal serogroup C capsular polysaccharide on the immunogenicity and reactogenicity of a group B Neisseria meningitidis outer membrane vesicles vaccine. Dis Biol Stand 92 1998; 223-33. o Rosenqvist E, Hoiby EA, Wedege E. Human antibody response to meningococcal outer membrane antigens after three doses of the Norwegian group B meningococcal vaccine. Infect Immun 1995; 63(12):4642-52. o Rosenstein EN, Perkins BA, Stephen DS y col. Meningococcal disease. N Engl J Med 2001; 344:1378-89. o Ruggeberg JV, Pollard AJ. Meningococcal vaccines. Paediatr. Drugs 2004; 6:251-266. o Russell JE, Jolley KA, Feavers IM, Maiden MC, SukerJ.. PorA variable regions of Neisseria meningitidis. Emerg Infect Dis 2004;10: 674-678. o Sabounchi- Schütt F, Åström J y col. An immobiline dry strip application method enabling highcapacity two-dimensional gel electrophoresis. Electrophoresis 2000;21: 3649-3656. o Sacchi CT, de Lemos AP, Camargo MC, Whitney AM, Melles CE, SolariCA y col. Meningococcal disease caused by Neisseria meningitidis serogroup B serotype 4 in Säo Paulo, Brazil, 1990 to 1996. Rev Inst Med Trop. Säo Paulo 1998;40:65-70. o Sánchez JC, Rouge V, Pisteur M y col. Improved and simplified in-gel sample application using rewelling of dry immobilized pH gradients. Electrophoresis 1997;18(3-4):324-7 o Segal S, Pollard AJ. Vaccines against bacterial meningitis. British Medical Bulletin 2004;72:6581. o Shevchenko A, Wilm M, Vorm O y col. Mass spectrometric sequencing of proteins silver-stained polyacrilamide gels. Anal Chem 1996;68:850-58. o Sierra GV, Campa HC, Valcárcel NM y col. Vaccine against group B Neisseria meningitidis protection trial and mass vaccination results in Cuba. NIPH Ann 1991;14 (2):195-210. o Snape MD, Pollard AJ. Meningococcal polysaccharides proteins conjugate vaccine. Lancet. Infection Dis 2005;5:13-22. o Sotolongo F. Aspectos Teóricos-prácticos sobre el diagnóstico, clasificación y valoración de la respuesta inmune. Serie Monográfica. Ciudad Habana, Ediciones Finlay;1995. o Suker J, Feavers IM, Achtman M y col. The porA gene in serogroup A meningococci: evolutionary stability and mechanism of genetic variation. Mol Microbiol 1994;12:253-65 o Svennerholm L. A colorimetric resorcinol – hidrochloric acid method. Biochim. Biophys Acta 24 1957;24:604–611 o Taha MK, Deghmane AE, Antignac A, y col. The duality of virulence and transmissibility in Neisseria meningitidis Trends Microbiol 2002;10:376-82. o Tappero JW, Lagos R, Ballesteros AM y col. Immunogenicity of two serogroup B outermembrane protein meningococcal vaccines, a randomized controlled trial in Chile. JAMA 1999; 281(16):1520-27. o Tettelin H, Parkhill J. The use of genome annotation data and its impact on biological conclusions. Nat Genet 2004; 36(10):1028-9. o Tettelin H, Saunders NJ, Heidelberg J y col. Complete genome sequence of Neisseria meningitidis serogroup B strain MC58. Science 2000;10; 287(5459):1809-15. o The Jordan Report. Accelerated Development of Vaccines 2006. US Department of Health and Human Services National Institute of Allergy and Infections Diseases 2006; P- 182-5. o Thornton Y, Lennon D, Rasanathan K y col. Safety and immunogenecity of New Zealand strain meningococcal serogroup B OMV vaccine in healthy adults: Beginning of epidemic control. Vaccine 2006;24 (9):1395-400. o Trotter C, Gay NJ, Edmunds WJ. Dynamic models of meningococcal carriage, disease and the infect of serogroup C Conjugate Vaccination. American Journal of Epidemiology 2005; 162 (1)89-100. o Trotter CL, Amdrews NJ, Kaczmarski EB y col. Effectiveness of meningococcal serogroup C conjugated vaccine 4 years after introduction. Lancet 2004;364:365-7. o Tsai CM, Frasch CE. Chemical analysis of major outer membrane proteins of Neisseria meningitidis: comparison of serotype 2 and 11. J Bacteriol 1980;141:169-76 o Urwin R, Maiden MC. Multi-locus sequence typing: a tool for global epidemiology. Trends Microbiol 2003;11(10):479-87. o Urwin R, Russell JE, Thompson EAL, y col. Distribution of surface variants among hiperinvasive menongococci. Implications for vaccine design. Infection Immun 2004;72(10): 5952-62. o Valcárcel NM, Rodríguez CR, Molinert HT. La enfermedad meningocócica en Cuba. Cronología de una epidemia. Editorial Ciencias Médicas, Ciudad de La Habana, Cuba 1991; pp: 13-71. o Vazquez JA and Berron S. Multilocus sequence typing: the molecular marker of the internet era. Enferm. Infecc. Microbiol Clin 2004; 22:113-20. o Vázquez JA. Vacunas frente a meningitis bacteriana: ¿realidad o mito?. Aten Primaria 2002; 30:643-7. o Wang LY, Frasch CE. Development of Neisseria meningitidis serogroup B serotype 2b protein vaccine and evaluation in mouse model. Infect Immun 1984;46:408-14. o Wenger JD. Serogroup B meningococcal disease. New outbreaks, new strategies. JAMA 1999; 281(16):1493-7. o World Health Organization (WHO). Requirements for meningococcal polysaccharide vaccine. Technical Report (Twenty seventh), Series No. 594, 1976. o World Health Organization (WHO). Guidelines for stability testing of pharmaceutical products containing well established drug substances in conventional dosage forms. WHO expert committee on specifications for pharmaceutical preparations. 34th Report, WHO. (WHO Technical Report Series, No. 863), 1996. o World Health Organization (WHO). Guidelines on stability evaluation of vaccines. (WHO/B5/06.2049-Final), 2006. o World Health Organization (WHO). Good manufacturing practice for pharmaceutical products: main principles. WHO Technical Report Series No. 908, 2003 o Wong S, Lennon D, Jackson C y col. New Zealand epidemic strain meningococcal B outer membrane vesicle vaccine in children aged 16-24 months. Pediatr Infect Dis J 2007;26(4): 34550. o Zhang W, Chait BT. Profound: an expert system for protein identification using mass spectrometric peptide mapping information. Anal. Chem 2000; 72:2482-2489. o Zollinger WD, Boslego J, Moran E, y col. Meningococcal seroproup B vaccine protection trial and follow-up studies. NIPH Ann 1991;14:211-13. o Zollinger WD, Mandrell RE, Altier P y col. Safety and immunogenicity of a meningococcal type 2 protein vaccine in animals and human volunteers. J Infect Dis 1978;137:728-39. o Zollinger WD, Mandrell RE, Griffiss JM y col. Complex of meningococcal serogroup B polysaccharide and type 2 outer membrane protein immunogenic in man. J Clin Invest 1979; 63:836-48. o Zollinger WD, Moran EE, Devi SJN, Frasch CE. Bactericidal antibody response of juvenile rhesus monkeys immunized with group B Neisseria meningitidis capsular polysaccharide-proteins conjugates vaccines. Infect Immun 1997;65:1053-9. o Zollinger WD. New and Improved Vaccines against meningococcal vaccine. In: New Generation Vaccines, 2nd ed (Levine MM, Woodrow GC, Koper JB, Cobon GS, eds) Marcel Dekker, New York 1998; pp:325-48. ANEXOS CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 ANEXOS Anexo1. Estructura antigénica de Neisseria meningitidis tomado de “N England J Med 2001: 344: 1380. http://www.nejm.org Componente Concentración (g/L) Glucosa 5,00 Extracto de levadura 2,00 Fosfato de Sodio dibásico 1,99 Cloruro de Potasio 0,99 Cloruro de Sodio 6,00 Cloruro de amonio 1,25 Sulfato de Magnesio 1,23 L-Cisteína HCl 0,03 Acido. L-Glutámico 1,39 Anexo 2. Composición del medio Frantz modificado Anexos I CONFIDENCIAL Versión: 3 Lote de siembra de referencia Ð Lote de siembra de trabajo Ð Obtención de Inóculo Ð Fermentación semilla Ð Fermentación Ð Concentración celular centrifugación continua Ð Obtención de biomasa por centrifugación preparativa Ð Resuspensión celular Ð Extracción de vesículas Ð Clarificación del extracto Ð Filtración microbiológica (0.22 um) Ð Tratamiento enzimático con nucleasas Ð Lavado - concentración Ð Ultracentrifugación Ð Resuspensión del sedimento Ð Cromatografía de exclusión molecular Ð Filtración esterilizante (0.22 um) Ð Precipitación – lavado con alcohol Ð VME en torta alcohólica (IFA) Página ____ Ejemplar No. _____ Ð Concentración – lavado celular por microfiltración tangencial Ð Anexo 3. Diagrama de flujo tradicional e identificación del cambio evaluado con la introducción de la MFT en los procesos de obtención del IFA, VME purificadas de N. meningitidis serogrupo B Anexos II CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Requisito de Calidad Concentración de Proteínas Contenido de LPS Límite de Aceptación Método de Ensayo Referencia 1,6-6,0 mg.ml-1 Espectrofotométrico 2.1.3 20-60 μg.mg-1 de proteínas Espectrofotométrico 2.1.6 Espectrofotométrico 2.1.7 SDS-PAGE 2.1.4 μg.mg-1 de Contenido de PC <10 Identidad El perfil cromatográfico deberá mostrar: • Dos bandas mayoritarias en el rango de 36 - 46 kD • Dos bandas de alto peso molecular en el rango de 70 - 80 kD Tramitancia < 32 proteínas Espectrofotométrico (λ = 530 nm) Anexo 4. Especificaciones de calidad de fracciones cromatográficas de VME Requisito de Calidad Concentración de Proteínas Contenido de Proteínas por Gramo de Peso Húmedo Contenido de LPS Identidad Pureza • Contenido de AN • Contenido de PC Límite de Aceptación ≥ 1,6 mg.mL-1 Método de Ensayo Espectrofotométrico ≥ 30 mg.g-1 de peso húmedo Espectrofotométrico 2.1.3 (20-60) μg.mg-1 de proteínas El perfil cromatográfico deberá mostrar: • Dos bandas mayoritarias en el rango de 36 - 46 kD • Dos bandas de alto peso molecular en el rango de 70 - 80 kD Espectrofotométrico 2.1.7 SDS-PAGE 2.1.4 Espectrofotométrico 2.1.8 <10 μg.mg-1 de proteínas <10 μg.mg-1 de proteínas Espectrofotométrico Anexo 5. Especificaciones de calidad del IFA, VME purificada de N. meningitidis serogrupo B Anexos Referencia 2.1.3 2.1.7 III CONFIDENCIAL Versión: 3 Lote de siembra de referencia Ð Lote de siembra de trabajo Ð Obtención de Inóculo Ð Fermentación semilla Ð Fermentación Ð Concentración – lavado celular por microfiltración tangencial Ð Extracción de vesículas Ð Clarificación del extracto Ð Filtración microbiológica (0.22 um) Ð Tratamiento enzimático con nucleasas Ð Lavado - concentración Ð Ultracentrifugación Ð Resuspensión del sedimento Ð Cromatografía de exclusión molecular Ð Filtración esterilizante (0.22 um) Ð Precipitación – lavado con alcohol Ð VME en torta alcohólica (IFA) Página ____ Ejemplar No. _____ Ð Diafiltración con sacarosa Ð Filtración esterilizante (0.22 um) Ð VME en sacarosa 3% (IFA) Anexo 6. Diagrama de flujo establecido con la introducción de la MFT e identificación del cambio evaluado con la introducción de la UFT en el último paso de la purificación del IFA, VME purificadas de N. meningitidis serogrupo B Anexos IV CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Requisitos de Calidad Límite de aceptación Método de ensayo Referencia Identidad de proteínas Bandas características Inmunogenicidad • Contenido de IgG • Actividad bactericida SDS – PAGE WB 2.1.4 2.1.10 ≥ 7000 UIgG.mL-1 ≥ 1/4 ELISA ABS 2.1.12 2.1.13 ≤ 10 000 UE.50mg -1 de proteína Pasa la prueba a 1000ng.Kg-1 de peso del conejo Presencia mayoritaria de VME intactas LAL 2.1.14 Biológico 2.2.16 Microscopía electrónica 2.1.9 Contenido de endotoxina Pirógeno Estructura vesicular Anexo 7. Requisitos de calidad y metodología analítica empleadas en los estudios de pre-estabilidad de VME obtenidas por diafiltración con sacarosa en comparación con la precipitación alcohólica como paso final del proceso de purificación Anexos V CONFIDENCIAL Versión: 3 Página ____ Ejemplar No. _____ Lote de siembra de referencia Ð Lote de siembra de trabajo Ð Obtención de Inóculo Ð Fermentación semilla Ð Fermentación Ð Concentración – lavado celular por microfiltración tangencial Ð Extracción de vesículas Ð Clarificación del extracto Ð Filtración microbiológica (0.22 um) Ð Tratamiento enzimático con nucleasas Ð Lavado - concentración Ð Ultracentrifugación Ð Resuspensión del sedimento Ð Cromatografía de exclusión molecular Ð Diafiltración con sacarosa Ð Filtración esterilizante (0.22 um) Ð VME en sacarosa 3% (IFA) Anexo 8. Diagrama de flujo establecido luego de la introducción de los dos cambios al proceso tradicional (MFT y UFT con sacarosa) en el proceso de obtención del IFA, VME purificadas de N. meningitidis serogrupo B Anexos VI CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Etapa Fermentación Requisitos de Calidad Cinética de crecimiento Método de ensayo DO Referencia 2.1.1 Separación Recobrado celular Peso seco 2.1.5 Purificación Rendimiento de proteína Espectrofotométrico 2.1.3 Purificación Contenido de LPS Espectrofotométrico 2.1.6 Purificación Contenido de PC Espectrofotométrico 2.1.7 VME Purificada Identidad SDS-PAGE 2.1.4 VME purificada Estructura vesicular Microscopía electrónica 2.1.9 Anexo 9. Etapas, controles de calidad y metodología analítica empleadas en la evaluación de los procesos de obtención y VME purificada de la cepa NZ98/228. Requisitos de Calidad Límite de aceptación Método de ensayo Referencia pH 6,3 – 6,7 Potenciométrico Contenido de endotoxina ≤ 10 000 UE.50mg-1 de proteína LAL 2.1.14 ELISA ABS 2.1.12 2.1.13 Inmunogenicidad • Contenido de IgG • Actividad bactericida ≥ 7000 UIgG. mL-1 ≥ 1/4 USP-30 Anexo 10. Requisitos de calidad y metodología analítica empleadas en los estudios de pre-estabilidad de MG de la cepa NZ 98/228 Anexos VII CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Gel de hidróxido de aluminio Ð Esterilización por calor Ð a) Tampón fosfato + sacarosa Æ VME en sacarosa al 3% Æ Agua para inyección Æ Esterilización por filtración Î Adsorción Ð Monogranel b) Monogranel CU Monogranel NZ Ó Ô Tampón fosfato + sacarosa + Cloruro de Sodio Î Formulación Ð Vacuna Men B Bivalente Anexo 11. Diagrama de flujo para la obtención de MG y el candidato vacunal de MenB bivalente. a) Obtención del MG b) Formulación de la vacuna bivalente Anexos VIII CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Especificación Requisitos de Calidad pH Límite de aceptación 7.6 - 8.0 Método de ensayo Potenciométrico Identidad de subtipo Positivo a (P1.15 ó P1.4) WB Esterilidad Ausencia de crecimiento Contenido de proteínas Referencia USP-30 2.1.10 USP-30 Entre 1 y 2 mg.mL-1 Filtración por membrana Espectrofotométrico 2.1.3 Contenido de LPS (20-60)µg.mg-1 de proteína Espectrofotométrico 2.1.6 Contenido de PC-B < 10 µg.mg-1 de proteína HPLC 2.1.17 Contenido de ADN < 10 µg.mg-1 de proteína Treshold 2.1.18 Contenido de DOC % a ser cuantificado Sacarosa 24 - 36 mg.mL-1 Caracterización Requisitos de Calidad Estructura vesicular Identidad del perfil de proteínas Esperado Deben observarse VME mayoritariamente intactas Dos bandas mayoritarias en el rango de 36–46 kDa Dos bandas de alto peso molecular en el rango de 70-80kDa CG y MS Espectrofotométrico Método de ensayo Microscopía electrónica SDS-PAGE 2.1.20 2.1.19 Referencia 2.1.9 2.1.4 Anexo 12. Especificaciones de calidad y ensayos de caracterización de VME en sacarosa a partir de las cepas CU385/83 ó NZ98/228 Anexos IX CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Especificación Requisito de Calidad Límite de aceptación Método de ensayo Referencia pH 6.3 - 6.7 Potenciométrico USP-30 Identidad del subtipo Positivo a subtipo específico (P1.15 ó P1.4) WB 2.1.10 Esterilidad Ausencia de crecimiento Filtración por membrana USP-30 Concentración de Proteínas 320-480 µg.mL-1 Espectrofotométrico 2.1.3 Complexométrico BLG/UNDP/ 82.1. Rev.1, OMS mg.mL-1 Concentración de aluminio 4,4-6.8 Pirogenicidad No pirogénico a 0.5 µg.kg-1 conejo Biológico 2.1.16 Adsorción de proteínas Mínimo 80% Espectrofotométrico 2.1.3 Inmunogenicidad (subtipos P1.4 ó P1.15) Inducción de anticuerpos como mínimo a un 80% de los ratones inmunizados ELISA 2.1.12 Caracterización Requisito de Calidad Identidad del perfil proteínas Actividad bactericida Esperado Dos bandas mayoritarias en el rango de 36-46 kDa. Dos bandas de proteína de alto peso molecular en el rango de 70 - 80 kDa Títulos bactericidas de ratones frente a la cepa específica. CU 385/83 ó NZ 98/124 Método de ensayo Referencia SDS-PAGE 2.1.4 ABS 2.1.13 Anexo 13. Especificaciones de calidad, ensayos internos y de caracterización de MG a partir de las cepas CU 385/83 ó NZ 98/228 Anexos X CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Especificación Requisito de Calidad Descripción pH Límite de especificación Método de ensayo Suspensión blanco opalescente, que lentamente tiende a formar un depósito blanco. Referencia - 6,3-6,7 Potenciométrico USP-30 Identidad de MenB subtipo P1.15 Positivo WB 2.1.10 Identidad de MenB subtipo P1.4 Positivo Esterilidad Ausencia de crecimiento Contenido de endotoxina No más que 10 000UE.dosis-1 LAL Toxicidad inespecífica en curieles No pérdida de peso ni comportamiento anormal de los animales Biológico BLG/UNDP/82.1 Rev.1, OMS Toxicidad inespecífica en ratones No pérdida de peso ni comportamiento anormal de los animales Biológico BLG/UNDP/82.1 Rev.1, OMS Inmunogenicidad (subtipo P1.4) Inducción de anticuerpos como mínimo a un 80% los ratones inoculados ELISA 2.1.12 Inmunogenicidad (subtipo P1.15) Inducción de anticuerpos como mínimo a un 80% los ratones inoculados ELISA 2.1.12 Contenido de proteína 40-60 µg.dosis-1 Espectrofotométrico Contenido de aluminio 0,55-0,85mg. dosis-1 Complexométrico Contenido de sacarosa Osmolalidad Adsorción de proteína 24-36 mg.mL-1 266-345mOms.kg-1 Mínimo 80% Fenol - sulfúrico Físico - Químico Espectrofotométrico Caracterización Requisito de Calidad Actividad bactericida (subtipo P1.4) Esperado Títulos bactericidas frente a la cepa NZ98/228 Método de ensayo ABS Actividad bactericida (subtipo P1.15) Títulos bactericidas frente a la cepa CU385/83 ABS WB Filtración por membrana 2.1.10 USP-30 2.1.14 2.1.3 BLG/UNDP/82.1 Rev.1, OMS 2.1.19 2.1.20 2.1. 3 Referencia 2.1.13 Anexo 14. Especificaciones de calidad y ensayos internos de caracterización del candidato vacunal MenB bivalente a granel Anexos XI CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Sistema Envase-Cierre Tamaño del lote L-NZ-1 L-NZ-2 L-NZ-3 L-CU-1 L-CU-2 LCU-3 Botellón de 5L, calidad hidrolítica I, con tapa roscada de melanina y junta de teflón 5L Diseño del estudio Vida de estante y estrés Tiempos de exposición Vida de estante: 2-8 ºC (0, 3, 6 y 12 meses) Estrés: 37 ºC (7 días) Lotes en estudios: Requisitos de Calidad Límites de Aceptación Método de ensayo Referencia Descripción Suspensión blanco opalescente, que lentamente tiende a formar un depósito blanco. - - pH 6,3 – 6,7 Potenciométrico USP 30 Adsorción de proteínas ≥ 80% Espectrofotométrico 2.1.3 Identidad del subtipo Identidad del perfil de proteínas Positivo a subtipo específico (P1.15 ó P1.4) WB 2.1.10 SDS-PAGE 2.1.4 Contenido de endotoxina Dos bandas mayoritarias en el rango de 36–46 kDa Dos bandas de alto peso molecular en el rango de 70-80kDa No más de 10 000UE.dosis-1 LAL 2.2.14 Pirogenicidad No pirogénico a 500 ng.Kg-1 conejo Biológico 2.1.16 Inmunogenicidad (subtipo P1.4) Inducción de anticuerpos como mínimo a un 80% los ratones inoculados ELISA 2.1.12 Inmunogenicidad (subtipo P1.15) Inducción de anticuerpos como mínimo a un 80% los ratones inoculados ELISA 2.1.12 Actividad bactericida (subtipo P1.4) Títulos bactericidas de ratones frente a la cepa NZ98/228 ABS 2.1.13 Actividad bactericida (subtipo P1.15) Títulos bactericidas de ratones frente a la cepa CU385/83 ABS 2.1.13 Esterilidad Pasa la prueba Filtración por membrana USP-30 Anexo 15. Protocolo resumido del estudio de estabilidad de vida de estante y estrés de MG de VME en sacarosa adsorbidas en HA obtenidas de las cepas NZ 98/228 y CU385/83 Anexos XII CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Lotes en estudios: Sistema Envase-Cierre Tamaño del lote Diseño del estudio Tiempos de exposición L-CU/NZ-1 L-CU/NZ-2 L-CU/NZ-3 Botellón de 20L calidad hidrolítica I, con tapa roscada de melanina y junta de teflón 20L Vida de estante y estrés Vida de estante: 2-8 ºC (0, 9, 12 y 18 meses) Estrés: 37 ºC (7 días) Requisitos de Calidad Descripción Límites de Aceptación Suspensión blanco opalescente, que lentamente tiende a formar un depósito blanco. Método de ensayo - Referencia - pH 6,0 - 7,2 Potenciométrico USP 30 Adsorción de proteínas ≥ 80% Espectrofotométrico 2.1.3 Identidad de proteínas Positivo a subtipos específicos (P1. 4 y P1.15) WB 2.1.10 Contenido de endotoxina No más de 10 000UE.dosis-1 LAL 2.1.14 Inmunogenicidad (subtipo P1.4) Inducción de anticuerpos como mínimo a un 80% los ratones inoculados ELISA 2.1.12 Inmunogenicidad (subtipo P1.15) Inducción de anticuerpos como mínimo a un 80% los ratones inoculados ELISA 2.1.12 Actividad bactericida (subtipo P1.4) Títulos bactericidas de ratones frente a la cepa NZ98/228 ABS 2.1.13 Actividad bactericida (subtipo P1.15) Títulos bactericidas de ratones frente a la cepa CU385/83 ABS 2.1.13 Pirogenicidad No pirogénico a 0.5µg.kg-1 conejo Biológico 2.2.16 Esterilidad Pasa la prueba USP-30 Toxicidad inespecífica en curieles No pérdida de peso ni comportamiento anormal de los animales Filtración por membrana Toxicidad inespecífica en ratones No pérdida de peso ni comportamiento anormal de los animales Biológico BLG/UNDP/82.1 Rev.1, OMS Biológico BLG/UNDP/82.1 Rev.1, OMS Anexo 16. Protocolo resumido del estudio de estabilidad de vida de estante y estrés del candidato vacunal Men B bivalente a granel Anexos XIII CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Concentración celular centrifugación continua Obtención de inóculos Centrifugación Resuspensión Tecnología Evaluada Obtención de inóculos Concentración lavado celular por microfiltración tangencial Extracción celular Etapas Modificadas Anexo 17. Diagrama de flujo de proceso con representación del equipamiento involucrado en el cambio tecnológico de la introducción de la MFT en la etapa de concentración – lavado celular Anexos XIV Extracción celular Etapas a Modificar Tecnología Tradicional CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Anexos XV CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Anexos XVI CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Anexos XVII CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Anexos XVIII CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Anexos XIX CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Anexos XX CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Anexos XXI CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Anexos XXII CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Anexos XXIII CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Anexos XXIV CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Anexos XXV CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Anexos XXVI CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Anexos XXVII CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Anexos XXVIII CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Tecnología Tradicional. Precipitación alcohólica Tecnología Evaluada. Diafiltración con sacarosa al 3% Anexo 19. Diagrama de flujo de proceso con representación del equipamiento involucrado en el cambio tecnológico de la introducción de la diafiltración con sacarosa en el paso final de la purificación de VME Anexos XXIX CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Requisitos de Calidad Límites de Aceptación Lotes Descripción Suspensión blanco opalescente, que lentamente tiende a formar un depósito blanco. pH 6.5 ± 0.2 Adsorción de proteínas (%) ≥ 80 % Identidad de subtipo (P1.4) Positiva Identidad del perfil de proteínas (BC) Bandas características Esterilidad Ausencia de crecimiento Contenido de Endotoxinas < 10000 EU.50µg-1 de proteína Pirógenos en conejo No pirogénico a 0.5 µg.Kg-1 de conejo Inmunogenicidad ≥ 80 % Actividad bactericida - NZ-1 NZ-2 NZ-3 NZ-1 NZ-2 NZ-3 NZ-1 NZ-2 NZ-3 NZ-1 NZ-2 NZ-3 NZ-1 NZ-2 NZ-3 NZ-1 NZ-2 NZ-3 NZ-1 NZ-2 NZ-3 NZ-1 NZ-2 NZ-3 NZ-1 NZ-2 NZ-3 NZ-1 NZ-2 NZ-3 NZ-1 NZ-2 Toxicidad inespecífica en curieles Toxicidad inespecífica en ratones No pérdida de peso ni comportamiento anormal de los animales No pérdida de peso ni comportamiento anormal de los animales T= 0 2-8 º C Satisfactorio Satisfactorio Satisfactorio 6.5 6.4 6.4 95 94 93 Positiva Positiva Positiva BC BC BC Pasa Pasa Pasa 5055 5473 4383 Pasa Pasa Pasa 100 100 100 1/16384 1/32768 1/16384 Pasa Pasa T= 7 días 37 º C Satisfactorio Satisfactorio Satisfactorio 98 96 92 Positiva Positiva Positiva BC BC BC 3489 4170 2062 100 100 100 1/16384 1/16384 1/16384 - T= 3 meses 2-8 º C Satisfactorio Satisfactorio Satisfactorio 6.4 6.3 6.3 96 97 94 Positiva Positiva Positiva BC BC BC Pasa Pasa Pasa 2917 9752 5992 Pasa Pasa Pasa 100 100 90 1/16384 1/32768 1/16384 Pasa Pasa T= 6 meses 2-8 º C Satisfactorio Satisfactorio Satisfactorio 6.4 6.3 6.3 90 96 90 Positiva Positiva Positiva BC BC BC 5426 5713 3765 Pasa Pasa Pasa 100 80 80 1/16384 1/16384 1/32768 Pasa Pasa NZ-3 Pasa - Pasa Pasa Pasa NZ-1 NZ-2 NZ-3 Pasa Pasa Pasa - Pasa Pasa Pasa Pasa Pasa Pasa Pasa Pasa Pasa Anexo 20: Estudio de estabilidad de vida de estante y en condiciones de estrés del MG (Cepa NZ 98/228) Anexos T= 12 meses 2-8 º C Satisfactorio Satisfactorio Satisfactorio 6.3 6.4 6.3 91 95 94 Positiva Positiva Positiva BC BC BC Pasa Pasa Pasa 1483 1169 1613 Pasa Pasa Pasa 90 90 100 1/32768 1/16384 1/32768 Pasa Pasa XXX CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Requisitos de Calidad Descripción CU-1 T= 0 2-8 º C Satisfactorio T= 7 días 37 º C Satisfactorio T= 3 meses 2-8 º C Satisfactorio T= 6 meses 2-8 º C Satisfactorio T= 12 meses 2-8 º C Satisfactorio CU-2 Satisfactorio Satisfactorio Satisfactorio Satisfactorio Satisfactorio CU-3 CU-1 CU-2 CU-3 CU-1 CU-2 CU-3 CU-1 CU-2 CU-3 CU-1 CU-2 CU-3 CU-1 CU-2 CU-3 CU-1 CU-2 CU-3 CU-1 CU-2 CU-3 CU-1 CU-2 CU-3 CU-1 CU-2 CU-3 CU-1 CU-2 CU-3 CU-1 CU-2 CU-3 Satisfactorio 6.3 6.3 6.3 95 91 92 Positiva Positiva Positiva BC BC BC Pasa Pasa Pasa 2011 2421 5509 Pasa Pasa Pasa 100 100 100 1/512 1/1024 1/1024 Pasa Pasa Pasa Pasa Pasa Pasa Satisfactorio 94 94 94 Positiva Positiva Positiva BC BC BC 1054 1575 2787 100 100 100 1/256 1/1024 1/1024 - Satisfactorio 6.5 6.5 6.5 94 95 95 Positiva Positiva Positiva BC BC BC Pasa Pasa Pasa 4910 5535 4682 Pasa Pasa Pasa 100 100 100 1/1024 1/1024 1/1024 Pasa Pasa Pasa Pasa Pasa Pasa Satisfactorio 6.3 6.3 6.3 94 94 97 Positiva Positiva Positiva BC BC BC 2523 3006 3408 Pasa Pasa Pasa 90 90 100 1/512 1/2048 1/512 Pasa Pasa Pasa Pasa Pasa Pasa Satisfactorio 6.3 6.3 6.3 92 92 98 Positiva Positiva Positiva BC BC BC Pasa Pasa Pasa 4858 3224 3224 Pasa Pasa Pasa 100 100 100 512 256 512 Pasa Pasa Pasa Pasa Pasa Pasa Límites de Aceptación Lotes Suspensión blanco opalescente, que lentamente tiende a formar un depósito blanco. pH 6.5 ± 0.2 Adsorción de proteínas (%) ≥ 80 % Identidad de subtipo (P1.4) Positiva Identidad del perfil de proteínas (BC) Bandas características Esterilidad Ausencia de crecimiento Contenido de Endotoxinas < 10000 EU.50µg-1 de proteína Pirógenos en conejo No pirogénico a 0.5 µg.Kg-1 de conejo Inmunogenicidad ≥ 80 % Actividad bactericida - Toxicidad inespecífica en curieles No pérdida de peso ni comportamiento anormal de los animales Toxicidad inespecífica en ratones No pérdida de peso ni comportamiento anormal de los animales Anexo 21: Estudio de estabilidad de vida de estante y en condiciones de estrés del MG (Cepa CU 385/83) Anexos XXXI CONFIDENCIAL Página ____ Ejemplar No. _____ Versión: 3 Ensayo Límites de Aceptación Lote Descripción Suspensión blanco opalescente, que lentamente tiende a formar un depósito blanco. pH 6.0 – 7.2 Concentración de proteínas 80 - 120 µg.mL-1 Adsorción de proteínas (%) ≥ 80 % Identidad a Men B P1.4 (WB) Positiva Identidad a Men B P1.15 (WB) Positiva Esterilidad Ausencia de crecimiento Contenido de Endotoxinas < 10000 EU.dosis-1 Pirógenos en conejo No pirogénico a 0.5 µg.Kg-1.conejo ELISA. Men B P1.4 ≥ 80 % de respondedores ELISA. Men B P1.15 ≥ 80 % de respondedores Bactericida. Men B P1.4 - Bactericida. Men B P1.15 - CU/NZ -1 CU/NZ-2 CU/NZ-3 CU/NZ -1 CU/NZ-2 CU/NZ-3 CU/NZ -1 CU/NZ-2 CU/NZ-3 CU/NZ -1 CU/NZ-2 CU/NZ-3 CU/NZ -1 CU/NZ-2 CU/NZ-3 CU/NZ -1 CU/NZ-2 CU/NZ-3 CU/NZ -1 CU/NZ-2 CU/NZ-3 CU/NZ -1 CU/NZ-2 CU/NZ-3 CU/NZ -1 CU/NZ-2 CU/NZ-3 CU/NZ -1 CU/NZ-2 CU/NZ-3 CU/NZ -1 CU/NZ-2 CU/NZ-3 CU/NZ -1 CU/NZ-2 CU/NZ-3 CU/NZ -1 CU/NZ-2 CU/NZ-3 T= 0 2-8 º C Satisfactorio Satisfactorio Satisfactorio 6.3 6.3 6.3 100 99 94 95 94 90 Positiva Positiva Positiva Positiva Positiva Positiva Pasa Pasa Pasa 6275 7720 7940 Pasa Pasa Pasa 100 100 100 100 100 100 1/16384 1/32768 1/32768 1/2048 1/1024 1/2048 T= 7 días 37 º C Satisfactorio Satisfactorio Satisfactorio 6.4 6.4 6.5 94 91 90 94 97 97 Positiva Positiva Positiva Positiva Positiva Positiva 2673 2446 2372 Pasa Pasa Pasa 100 80 100 100 80 100 1/16384 1/16384 1/32768 1/1024 1/2048 1/2048 T= 9 meses 2-8 º C Satisfactorio Satisfactorio Satisfactorio 6.4 6.4 6.4 91 111 117 89 92 87 Positiva Positiva Positiva Positiva Positiva Positiva Pasa Pasa Pasa 8320 8160 6500 Pasa Pasa Pasa 100 100 100 100 100 100 1/2048 1/1024 1/1024 1/512 1/1024 1/1024 T= 12 meses 2-8 º C Satisfactorio Satisfactorio Satisfactorio 6.4 6.3 6.3 83 82 89 97 96 96 Positiva Positiva Positiva Positiva Positiva Positiva Pasa Pasa Pasa 2701 3470 3897 Pasa Pasa Pasa 100 100 100 100 100 100 1/2048 1/4096 1/2048 1/256 1/512 1/1024 Anexo 22: Estudio de estabilidad de vida de estante y en condiciones de estrés de la vacuna Men B bivalente Anexos XXXII T= 18 meses 2-8 º C Satisfactorio Satisfactorio Satisfactorio 6.4 6.5 6.5 94 91 89 94 92 88 Positiva Positiva Positiva Positiva Positiva Positiva Pasa Pasa Pasa 7587 5678 8140 Pasa Pasa Pasa 90 100 100 80 100 100 1/8192 1/8192 1/4096 1/1024 1/1024 1/512