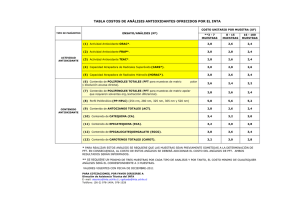
Repositorio Digital UTE - Universidad Tecnológica Equinoccial
Anuncio

UNIVERSIDAD TECNOLÓGICA EQUINOCCIAL FACULTAD DE CIENCIAS DE LA INGENIERÍA CARRERA DE INGENIERÍA DE ALIMENTOS “EFECTO DE LA RADIACIÓN UV-C SOBRE LA FLORA NATIVA Y LA CAPACIDAD ANTIOXIDANTE DE LA MEZCLA PARA TÉ COMPUESTO POR TORONJIL (Melissa officinalis), ORTIGA (Urtica dioica), PEREJIL (Petroselinum sativum) Y PAICO (Chenopodium ambrosioides) DE LA ZONA ANDINA DE COTACACHI” TRABAJO PREVIO A LA OBTENCIÓN DEL TÍTULO DE INGENIERA DE ALIMENTOS DANIELA CAROLINA RUBIO MONTERO DIRECTORA: ING. ELENA BELTRÁN Quito, 2014 © Universidad Tecnológica Equinoccial. 2014 Reservados todos los derechos de reproducción DECLARACIÓN Yo DANIELA CAROLINA RUBIO MONTERO, declaro que el trabajo aquí descrito es de mi autoría; que no ha sido previamente presentado para ningún grado o calificación profesional; y, que he consultado las referencias bibliográficas que se incluyen en este documento. La Universidad Tecnológica Equinoccial puede hacer uso de los derechos correspondientes a este trabajo, según lo establecido por la Ley de Propiedad Intelectual, por su Reglamento y por la normativa institucional vigente. _________________________ Daniela Rubio Montero CI: 1718812314 CERTIFICACIÓN Certifico que el presente trabajo que lleva por título “Efecto de la radiación UV-C sobre la flora nativa y la capacidad antioxidante de la mezcla para té compuesto por Toronjil (Melissa officinalis), Ortiga (Urtica dioica), Perejil (Petroselinum sativum) y Paico (Chenopodium ambrosioides) de la zona andina de Cotacachi”, que, para aspirar al título de Ingeniera de Alimentos fue desarrollado por Daniela Rubio Montero, bajo mi dirección y supervisión, en la Facultad de Ciencias de la Ingeniería; y cumple con las condiciones requeridas por el reglamento de Trabajos de Titulación artículos 18 y 25. __________________________ ING. ELENA BELTRÁN DIRECTOR DEL TRABAJO C.I. 1710472125 El presente trabajo de titulación forma parte del proyecto de investigación: IV.UIO.ING.09: “Efecto de la radiación UV-C sobre el color, la flora nativa y la capacidad antioxidante del toronjil, ortiga, perejil y paico de la zona andina de Cotacachi” DEDICATORIA A mi hermano, Álvaro, por todo su apoyo y sobre todo por creer en mí. AGRADECIMIENTO Primero, quiero agradecer a Dios, por no dejarme a la deriva jamás, por poner a las personas indicadas en mi camino, que hicieron posible alcanzar mi meta tan anhelada al final de este largo camino. A la Universidad Tecnológica Equinoccial y a la Ingeniera Elena Beltrán, por hacerme parte de este proyecto y facilitarme lo necesario para llevar a cabo esta investigación. A mi mamá, por ser el apoyo de mi vida y luchar contra viento y marea por mí. A Juan Fidel, por ser el mejor ayudante que una tesista puede tener, gracias por no dejarme sola y darme tu apoyo a cada momento. A Vale, Susi, Andrés, José, Cynthia y Belén por el apoyo incondicional que siempre me han brindado, su amistad es una de las cosas más valiosas que poseo. A todas las personas que contribuyeron con esta investigación. ÍNDICE DE CONTENIDOS PÁGINA RESUMEN ................................................................................................... vii ABSTRACT ……………………………..………………………………………. viii 1. INTRODUCCIÓN ......................................................................... 1 1.1 OBJETIVOS ................................................................................. 3 1.1.1 OBJETIVO GENERAL ................................................................ 3 1.1.2 OBJETIVOS ESPECÍFICOS ....................................................... 3 2. MARCO TEÓRICO ...................................................................... 5 2.1 TORONJIL (Melissa officinalis) .................................................... 5 2.1.1 ORIGEN ...................................................................................... 5 2.1.2 DESCRIPCIÓN DE LA PLANTA ................................................. 5 2.1.3 USOS DEL TORONJIL ............................................................... 7 2.2 ORTIGA (Urtica dioica) ................................................................ 8 2.2.1 ORIGEN ...................................................................................... 8 2.2.2 DESCRIPCIÓN DE LA PLANTA ................................................. 9 2.2.3 USOS DE LA ORTIGA .............................................................. 11 2.3 PAICO (Chenopodium ambrosiodes)......................................... 12 2.3.1 ORIGEN .................................................................................... 12 2.3.2 DESCRIPCIÓN DE LA PLANTA ............................................... 13 2.3.3 USOS DEL PAICO .................................................................... 15 2.4 PEREJIL (Petroselinum sativum) ............................................... 16 2.4.1 ORIGEN .................................................................................... 16 2.4.2 DESCRIPCIÓN DE LA PLANTA ............................................... 17 2.4.3 USOS DEL PEREJIL................................................................. 19 2.5 2.5.1 HIERBAS SECAS ...................................................................... 20 INFUSIONES ............................................................................ 20 i 2.6 RADIACIÓN ULTRAVIOLETA ................................................... 21 2.6.1 IRRADIACIÓN UV-C ................................................................. 22 2.6.2 ACCIÓN GERMICIDA ............................................................... 23 2.6.3 EFECTO HÓRMICO ................................................................. 24 2.7 ANTIOXIDANTES ...................................................................... 26 2.7.1 RADICALES LIBRES ................................................................ 26 2.7.2 SISTEMA DE DEFENSA ANTIOXIDANTE ............................... 27 2.7.3 CLASIFICACIÓN DE LOS ANTIOXIDANTES ........................... 28 2.7.4 CAPACIDAD ANTIOXIDANTE TOTAL ..................................... 29 2.8 2.8.1 3. POLIFENOLES .......................................................................... 30 CLASIFICACIÓN DE LOS POLIFENOLES ............................... 31 METODOLOGÍA ........................................................................ 33 3.1 MATERIAL VEGETAL ............................................................... 33 3.1.1 PREPARACIÓN DE LA MUESTRA .......................................... 33 3.1.2 TRATAMIENTO CON LUZ UV-C Y SELECCIÓN DE DOSIS ÓPTIMA .................................................................................... 33 3.1.3 3.2 ANÁLISIS MICROBIOLÓGICO .................................................. 34 3.3 CAPACIDAD ANTIOXIDANTE TOTAL ...................................... 35 3.3.1 EXTRACTO PARA CAPACIDAD ANTIOXIDANTE TOTAL ...... 35 3.3.2 PREPARACIÓN DEL REACTIVO ABTS●+ ................................ 36 3.3.3 CUANTIFICACIÓN DE LA CAPACIDAD ANTIOXIDANTE ....... 36 3.3.4 CURVA DE CALIBRACIÓN DE TROLOX ................................. 37 3.4 POLIFENOLES TOTALES ......................................................... 37 3.4.1 EXTRACTO PARA POLIFENOLES TOTALES ......................... 37 3.4.2 PROTOCOLO DE FOLIN-CIOCALTEU .................................... 39 3.4.3 CURVA DE CALIBRACIÓN DE ÁCIDO GÁLICO ...................... 39 3.5 4. PREPARACIÓN DEL TÉ DE HIERBAS .................................... 34 DISEÑO EXPERIMENTAL Y ANÁLISIS ESTADÍSTICO ........... 39 ANÁLISIS DE RESULTADOS ................................................... 41 ii 4.1 EFECTO DEL TRATAMIENTO UV-C SOBRE LA FLORA NATIVA ...................................................................................... 41 4.1.1 AEROBIOS MESÓFILOS TOTALES ........................................ 41 4.1.2 COLIFORMES TOTALES ......................................................... 42 4.1.3 MOHOS ..................................................................................... 44 4.1.4 LEVADURAS ............................................................................ 46 4.2 EFECTO DEL TRATAMIENTO UV-C SOBRE LA CAPACIDAD ANTIOXIDANTE TOTAL EN LA MEZCLA DE HIERBAS .......... 47 4.3 EFECTO DEL TRATAMIENTO UV-C SOBRE LOS POLIFENOLES EN LA MEZCLA DE HIERBAS......................... 50 4.4 SELECCIÓN DE DOSIS ÓPTIMA ............................................. 52 4.5 EFECTO DEL TRATAMIENTO UV-C SOBRE LA CAPACIDAD ANTIOXIDANTE TOTAL EN EL TÉ ........................................... 52 4.6 EFECTO DEL TRATAMIENTO UV-C SOBRE LOS POLIFENOLES EN EL TÉ ......................................................... 54 5. CONCLUSIONES Y RECOMENDACIONES............................. 57 5.1 CONCLUSIONES ...................................................................... 57 5.2 RECOMENDACIONES .............................................................. 58 BIBLIOGRAFÍA ............................................................................................ 60 ANEXOS ……… ........................................................................................... 70 iii ÍNDICE DE TABLAS PÁGINA Tabla 1. Clasificación Taxonómica del Toronjil.......................................... 5 Tabla 2. Valor Nutricional del Toronjil ........................................................ 7 Tabla 3. Clasificación Taxonómica de la Ortiga ......................................... 9 Tabla 4. Valor Nutricional de la Ortiga ..................................................... 11 Tabla 5. Clasificación Taxonómica del Paico .......................................... 13 Tabla 6. Valor Nutricional del Paico ......................................................... 15 Tabla 7. Clasificación Taxonómica del Perejil ......................................... 17 Tabla 8. Valor Nutricional del Perejil........................................................ 19 Tabla 9. Ventajas y Desventajas de la radiación UV-C ........................... 25 Tabla 10. Clasificación de los Antioxidantes, según su origen .................. 29 iv ÍNDICE DE FIGURAS PÁGINA Figura 1. Planta de Toronjil ........................................................................ 6 Figura 2. Planta de Ortiga ........................................................................ 10 Figura 3. Planta de Paico ......................................................................... 14 Figura 4. Planta de Perejil ........................................................................ 18 Figura 5. Espectro electromagnético ........................................................ 22 Figura 6. Recuento de Aerobios Mesófilos Totales .................................. 40 Figura 7. Recuento de Coliformes............................................................ 42 Figura 8. Recuento de Mohos .................................................................. 43 Figura 9. Recuento de Levaduras ............................................................ 45 Figura 10. Resultados de capacidad antioxidante total de la mezcla de hierbas compuesta por toronjil, ortiga, paico, y perejil, control y tratadas con 2.3, 4.1 y 6.5 kJ/m2 ............................................. 48 Figura 11. Resultados de polifenoles totales de la mezcla de hierbas compuesta por toronjil, ortiga, paico, y perejil, control y tratadas con 2.3, 4.1 y 6.5 kJ/m2................................................ 50 Figura 12. Resultados de capacidad antioxidante total del té compuesto por toronjil, ortiga, paico, y perejil, control y tratadas con 4.1 kJ/m2 .......................................................................................... 53 Figura 13. Resultados de polifenoles totales del té compuesto por toronjil, ortiga, paico, y perejil, control y tratadas con 4.1 kJ/m2 .......................................................................................... 54 v ÍNDICE DE ANEXOS PÁGINA Anexo I. Preparación de la muestra……………………………………… 69 Anexo II. Equipos………………….…………………………………………71 Anexo III. Tratamiento con luz UV-C……………..…………………………72 Anexo IV. Análisis Microbiológico……………………………………………73 Anexo V. Elaboración del té de hierbas………………………………..…. 76 Anexo VI. Análisis de Polifenoles…..………………………………………..77 Anexo VII. Tablas de Resultados…………………………………………….78 vi RESUMEN El objetivo del presente estudio fue establecer el efecto de la radiación UV-C sobre la flora nativa, capacidad antioxidante y concentración de polifenoles totales de una combinación de hierbas medicinales y aromáticas, comercializada por la empresa Sumak Jambina de la zona andina de Cotacachi, provincia de Imbabura. La formulación está compuesta por Toronjil (Melissa Officinalis), Ortiga (Urtica dioica), Paico (Chenopodium ambrosioides) y Perejil (Petroselinum sativum); todas estas hierbas fueron sometidas a un proceso de secado previo. La mezcla fue analizada en dos lotes: uno en Octubre del 2012 y otro luego de 5 meses de almacenamiento a temperatura ambiente (Marzo del 2013). Cada lote fue dividido en cuatro partes, una fue tomada como control y las otras 3 fueron tratadas con dosis de radiación UV-C de 2.3, 4.1 y 6.5 kJ/m2. Se realizó un análisis microbiológico utilizando placas Petrifilm para aerobios mesófilos totales, coliformes totales, mohos y levaduras. También se analizó la capacidad antioxidante mediante el método ABTS, y el contenido de polifenoles totales utilizando el método de Folin-Ciocalteu. Las muestras tratadas con 6.5 kJ/m2 mostraron un descenso en las unidades logarítmicas de aerobios totales, mohos y levaduras, sin embargo, en coliformes totales presentaron un leve incremento; las muestras tratadas con 2.3 kJ/m2 mostraron resultados similares a la muestra control en el recuento de aerobios totales, coliformes, mohos y levaduras; la dosis de 4.1 kJ/m2 produjo un leve incremento en el recuento de aerobios totales y coliformes, sin embargo en el recuento de levaduras presentaron resultados similares al control y en el recuento de mohos presentaron un leve descenso de las unidades logarítmicas. La aplicación de radiación UV-C provocó una disminución de la capacidad antioxidante en las muestras de la mezcla de hierbas. La dosis de 4.1 kJ/m2 produjo la menor reducción (4.32%) con respecto a la control, razón por la cual se seleccionó esta dosis para realizar el análisis de capacidad antioxidante total y de polifenoles totales en el té. El lote de Octubre mostró mayor capacidad antioxidante presentando diferencia significativa con vii relación al lote de Marzo. La dosis de 4.1 kJ/m2 produjo un incremento de la capacidad antioxidante del té de hierbas del 8.51% con relación a la muestra control; no se presentó diferencia significativa entre los dos lotes. La radiación UV-C provocó un aumento del contenido de polifenoles en todas las muestras tratadas de mezcla de hierbas secas, destacando la muestra tratada con 4.1 kJ/m2, que presentó el mayor incremento (12.54%). Ambos lotes mostraron diferencia significativa, siendo el lote de Octubre el que presentó una mayor cantidad de polifenoles. En el té elaborado con una muestra tratada con 4.1 kJ/m2 se observó un aumento del contenido de polifenoles del 12.02%, presentando una diferencia significativa respecto al control; los lotes no presentaron diferencia significativa. En conclusión la radiación UV-C presentó un efecto benéfico el contenido de polifenoles de la mezcla de hierbas secas y del té elaborado a partir de toronjil, ortiga, paico y perejil, sin embargo la capacidad antioxidante de la mezcla de hierbas se vio afectada por todas las dosis de radiación utilizadas, y en el té de hierbas la diferencia no fue significativa. El tiempo de almacenamiento produjo una reducción de la capacidad antioxidante y el contenido de polifenoles de la mezcla y del té de hierbas secas. viii ABSTRACT The objective of this study was to establish the effect of UV -C radiation on native flora, antioxidant activity and concentration of total polyphenols of a combination of medicinal and aromatic herbs, marketed by the company sumak Jambina of the Andes Cotacachi province of Imbabura. The formulation is composed by Melissa (Melissa officinalis), Nettle (Urtica dioica), Paico (Chenopodium ambrosioides) and Parsley (Petroselinum sativum), all these herbs were subjected to a preliminary drying process. The mixture was analyzed in two batches: one in October 2012 and another after 5 months storage at ambient temperature (March 2013). Each batch was divided into four parts, one was taken as a control and the other 3 were treated with doses of UV -C radiation of 2.3, 4.1 and 6.5 kJ/m2. Microbiological analysis was carried out using Petrifilm plates for total aerobic mesophilic bacteria, total coliforms, molds and yeasts. Antioxidant capacity by ABTS method was also analyzed, and the total polyphenol content using the Folin - Ciocalteu method. In relation to the antioxidant capacity of the herbal blend was higher in the October batch, showing a significant difference relative to the March batch. samples treated with 2.3 kJ/m2 showed similar results to the control in the total aerobic count, coliforms, molds and yeasts sample; 4.1 kJ/m2 dose produced a slight increase in the count of total coliforms and aerobic, however in yeast counts showed similar results to the control and mold count showed a slight decrease in logarithmic units. The application of UV-C radiation caused a decrease in antioxidant capacity in samples of the herb mixture. The dose of 4.1 kJ/m 2 produced the smaller reduction (4.32%) compared to the control, reason why this dose was selected for the analysis of total antioxidant capacity and total polyphenols in tea. October batch showed higher antioxidant capacity with significant differences relative to March batch. 4.1 kJ/m2 doses caused an increase in the antioxidant capacity of the herbal tea 8.51% relative to the control sample; no significant difference between the two batches are presented. ix The UV-C radiation caused an increase in polyphenol content in all treated samples of mixed dried herbs, highlighting the sample treated with 4.1 kJ/m 2, which had the highest increase (12.54%). Both batches showed significant difference, the October batch had a higher amount of polyphenols. The tea made from a treated sample with 4.1 kJ/m2 increased polyphenol content was 12.02%, showing a significant difference from control; batches showed no significant difference. In conclusion, UV-C radiation showed a beneficial effect on the polyphenol content of the mixture of dried herbs and tea made from lemon balm, nettle, and parsley paico, however the antioxidant capacity of the herb mixture was affected by all doses of radiation used, and herbal tea the difference was not significant. The storage time produced a reduction in antioxidant capacity and polyphenol content of the tea mixture and dried herbs. x 1. INTRODUCCIÓN 1. INTRODUCCIÓN En el Ecuador, el uso de plantas medicinales para aliviar dolencias comunes es parte de su herencia ancestral, es una tradición muy arraigada en la cultura de toda la población, pero debido a la globalización se está dejando a un lado este valioso conocimiento recolectado desde la época precolombina (De la Torre et al., 2008). A lo largo de la historia ecuatoriana se han realizado muchas investigaciones con respecto a las plantas y sus usos, con el objetivo de rescatar un conocimiento que está en riesgo de perderse, por un afán de documentación de sitios inexplorados o peculiares, o bien para profundizar en el uso y manejo de especies o grupos de plantas en las zonas de origen, y con ello, ofrecer mejoras o alternativas de explotación, fomentando el desarrollo de empresas que aporten al crecimiento económico del país (De la Torre & Macía, 2008). Las plantas medicinales son las que se han estudiado con mayor intensidad en la región andina, muchas investigaciones acerca del uso medicinal de especies vegetales andinas se han llevado a cabo con la intención de que los ecuatorianos las incorporen en su cotidianidad y usen las plantas como sustitutas a las medicinas convencionales (De la Torre & Macía, 2008). Las hierbas aromáticas pueden tener una alta carga microbiana pues están en contacto constante con la tierra, además el agua de riego puede estar contaminada con materia fecal, por esta razón en su procesamiento se emplean bactericidas químicos para eliminar microorganismos patógenos, pero generalmente estos bactericidas dejan residuos en el producto final, generando así un riesgo para la salud de las personas que las consumen (Acosta, 2002). 1 Debido a esto, se buscan soluciones alternativas para reducir esta carga microbiana de un modo más seguro, una de estas alternativas es la radiación UV-C, pues no produce residuos químicos o subproductos, además de ser un proceso seco que requiere muy poco mantenimiento y tiene un bajo costo (Bachmann, 1975; Guerrero & Barbosa, 2011). La radicación UV-C es una radiación no ionizante con una longitud de onda de 200 a 280 nm, y tiene su máximo pico de emisión a 254 nm y se ha comprobado que es en esta longitud de onda donde presenta su mayor acción germicida, por lo que ha sido ampliamente estudiada (Artés & Allende, 2005). Por las ventajas que presenta este tipo de radiación, se ha considerado como un tratamiento alternativo para preservar la calidad de frutas y hortalizas (Maharaj et al., 1999). La dosis de aplicación va desde 0.25 hasta 7.5 J/m2, dosis que no incrementa significativamente la temperatura del tejido (1-3 ºC), ni produce alteraciones o favorece los procesos deteriorativos del producto. Una ventaja es que no afecta las características sensoriales (sabor y aroma) del producto. Pero la sensibilidad de los tejidos al tratamiento con UV-C, difiere en función del genotipo, y en ocasiones las dosis altas pueden favorecer la oxidación de compuestos bioactivos del fruto, como vitamina C, carotenos y fenoles, así como el oscurecimiento superficial del tejido (González- Aguilar et al., 2001, 2006). La microempresa Sumak Jambina, conformada por mujeres indígenas nativas de la zona de Cotacachi, provincia de Imbabura, busca rescatar el consumo de plantas nativas medicinales, produciendo infusiones de hierbas aromáticas como manzanilla, orégano, menta, cedrón, paico, ortiga, entre otras. Asimismo amparadas en la actual ley de soberanía alimentaria, buscan reintegrar los alimentos ancestrales que se han ido perdiendo y constituir una potencial fuente de ingresos. 2 Actualmente, la microempresa Sumak Jambina está en busca de métodos para mejorar la calidad de sus procesos y la inocuidad de las hierbas que utilizan en la elaboración de mezclas de hierbas para té con métodos seguros, fáciles de aplicar y de bajo costo. Esta investigación se llevó a cabo con el fin de fomentar el consumo de plantas nativas aromáticas y medicinales para prevenir y combatir enfermedades como el estrés y el cáncer. 1.1 OBJETIVOS 1.1.1 OBJETIVO GENERAL Evaluar el efecto de la radiación UV-C sobre la flora nativa y capacidad antioxidante de la mezcla para té de hierbas compuesto por toronjil (Melissa officinalis), ortiga (Urtica dioica), perejil (Petroselinum sativum), y paico (Chenopodium ambrosioides), de la zona andina de Cotacachi. 1.1.2 OBJETIVOS ESPECÍFICOS Evaluar el efecto de la radiación UV-C sobre la carga microbiana propia de la mezcla para té de hierbas, aplicando tres diferentes dosis: 2.3, 4.1 y 6.5 kJ/m2. Analizar el efecto de la radiación UV-C sobre el contenido de polifenoles y la capacidad antioxidante total presente en la mezcla de hierbas para té. Seleccionar la dosis óptima de radiación UV-C en la mezcla de hierbas para utilizarla en el análisis del té. 3 Analizar el efecto de la radiación UV-C sobre el contenido de polifenoles y la capacidad antioxidante total presente en el té de hierbas. 4 2. MARCO TEÓRICO 2. MARCO TEÓRICO 2.1 TORONJIL (Melissa officinalis) 2.1.1 ORIGEN El toronjil (Melissa officinalis) o también conocido como Melisa, es una hierba aromática nativa de la región mediterránea, sureste de Europa, Asia menor, y África del sur. Tras la conquista, fue traída a América, y se encuentra prácticamente en todos los países del continente y del mundo, debido a que crece de forma silvestre en terrenos ricos en materia orgánica, en lugares sombreados con climas templados y húmedos. Su nombre proviene del griego “melitos” que significa “miel”, pues tiene la propiedad de atraer a muchos insectos, entre ellos las abejas que fabrican miel con su polen (Lemes et al., 2001; Mogrovejo, 2013; López, 2008; Ínce et al., 2013). 2.1.2 DESCRIPCIÓN DE LA PLANTA En la Tabla 1 se describe la clasificación taxonómica del toronjil: Tabla 1. Clasificación Taxonómica del Toronjil (Soriano, 2009). Reino: Plantae División: Magnoliophyta Clase: Magnoliopsida Orden: Lamiales Familia: Lamiaceae Subfamilia: Nepetoideae Género: Melissa Especie: officinalis Nombre científico: Melissa officinalis. 5 El toronjil es una planta aromática perenne, su altura varía entre 30 y 90 cm, con tallos herbáceos rastreros, rectos, angulosos vellosos, simples y recorridos por un surco profundo. Como se observa en la Figura 1, sus hojas son de color verde intenso, miden de 2 a 9 cm de largo y de 1 a 5 cm de ancho se disponen unas frente a otras, acopladas, pecioladas, ovadas, con algunos pelillos en la superficie y borde rizado y serrado (López, 2008; Soriano, 2012; WHO, 2002; Cárdenas, 2009). Posee flores de color blanco, blanco-amarillento o rosado, que nacen en la parte superior, junto con unas pequeñas ramas que salen en la parte alta del vástago; suelen brotar en grupitos de tres (en cimas o verticilios axilares), formando una rodajuela en torno al tallo; su cáliz puede llegar a medir 1.2 cm, es bilabiado, alargado, en tubo abierto con dos labios cortos, los estambres son cuatro didínamos, fusionados con la corola. Las flores del toronjil son ricas en néctar, atrayendo a polinizadores himenópteros (López, 2008; Soriano, 2012; WHO, 2002; Cárdenas, 2009). Toda la planta tiene un agradable aroma que recuerda al limón, debido a su contenido en terpenos, citronella, citronelol, citral y geraniol. El sabor de las hojas es cálido y amargo, no es desagradable al paladar, ya que predomina el aroma sobre el sabor (López, 2008). Figura 1. Planta de Toronjil 6 El toronjil es rico en derivados polifenólicos, como son los ácidos hidroxicinámicos (alrededor de 6%) como el ácido rosmarínico, p-cumárico, clorogénico, cafeico, lo que le confiere características antioxidantes. Otro compuesto principal es su aceite esencial (0.1 a 0.37%), donde los mayores constituyentes son los terpenoides como el citral (mezcla de los isómeros neral y geranial), citronelal, geraniol, nerol y linalool. Otros compuestos de interés incluyen 0.64% de flavonoides (quercetina, apigenina, luteolina), taninos y triterpenos ácidos (ácido ursólico y oleanólico). Diferentes estudios han demostrado variaciones cualitativas del aceite esencial por factores genéticos y por las condiciones ambientales, duración del día y composición del suelo (Boon & Smith, 2004; Sánchez et al., 2010; WHO, 2002, Ínce et al., 2013). El valor nutricional del toronjil se presenta en la Tabla 2: Tabla 2. Valor Nuticional del Toronjil (USDA, 2012). Valor por cada 100 g Energía 99 kcal Agua 70.58 g Proteína 1.82 g Grasa Total 0.49 g Carbohidratos 25.31 g Calcio 65 mg Hierro 8.17 mg Sodio 6 mg Vitamina C 2.6 mg 2.1.3 USOS DEL TORONJIL El toronjil tiene numerosas propiedades medicinales, siendo muy conocido como calmante natural por su efecto sedante y reequilibrador del sistema 7 nervioso, combate el insomnio, depresiones, jaquecas nerviosas, histerias y trastornos provocados por la tensión nerviosa (Cárdenas, 2009). Actúa de manera eficaz contra afecciones gastrointestinales como indigestiones, acidez, cólicos; estimula la secreción biliar, ayuda a la digestión, y se administra como carminativo en casos de dispepsia y meteorismo. Posee propiedades analgésicas calmando los dolores menstruales así como dolores estomacales (Muñoz et al., 1999; Fonnegra & Jiménez, 2007; Cárdenas, 2009). Presenta actividad antibacteriana, antifúngica y sedativa debida al aceite esencial, así como actividad antiviral atribuido a su contenido polifenólico sobre herpes simple (Muñoz et al., 1999; Sánchez et al., 2010). Se consume en forma de infusión, utilizando sus hojas frescas o secas, para tratar los trastornos anteriormente mencionados. Adicionalmente, sus hojas frescas y machacadas se aplican sobre heridas como cicatrizante, ayuda a desinflamar las contusiones y previene infecciones (Fonnegra & Jiménez, 2007; López, 2008). También se usa en la cocina, para sazonar ensaladas, salsas, verduras; aromatizar vinagres y bebidas; y en la elaboración y decoración de postres y tartas (Gonzáles, 2011). 2.2 ORTIGA (Urtica dioica) 2.2.1 ORIGEN La ortiga (Urtica dioica) es una planta originaria de Europa y Asia. Debido a su facilidad para crecer en una variedad de suelos, está distribuida por todo el mundo, especialmente en las zonas templadas y con terreno húmedo (Arango, 2006). Esta hierba terrestre se encuentra en la sierra ecuatoriana y crece a una altura entre 1800 a 3356 m, en las provincias de Bolívar, Chimborazo, Imbabura, Pichincha y Tungurahua. Es muy común encontrarla 8 a las orillas de los caminos, carreteras, jardines y lugares baldíos (Sulca, 2010). 2.2.2 DESCRIPCIÓN DE LA PLANTA La clasificación taxonómica de la ortiga se presenta en la tabla 3: Tabla 3. Clasificación Taxonómica de la Ortiga (Vibrans, 2009). Reino: Plantae División: Magnoliophyta Clase: Magnoliopsida Subclase: Hamamelididae Orden: Urticales Familia: Urticaceae Género: Urtica Especie: dioca Nombre científico: Urtica dioica La ortiga es una planta vivaz herbácea, perenne, dioica, de aspecto tosco que tiene una altura variable entre 0.5 a 1.5 m de altura. Posee tallos rectos, cuadrangulares, con estípulas de 5 a 15 mm de largo de color verde-negro, y están recorridos longitudinalmente por una serie de surcos (López, 2008; Sulca, 2010). Como se muestra en la Figura 2, sus hojas tienen su borde aserrado, son puntiagudas, lanceoladas a ovadas, rugosas, de color verde oscuro, con ápice atenuado, opuestas, de 5 a 15 cm de largo, su base es redondeada y cuenta con pecíolos de 1 a 3 cm (Sulca, 2010). Sus flores, de color verde-amarillo, son dioicas, pequeñas y apétalas, reunidas en panículas pendulares, axilares y terminales. Son unisexuales 9 (masculinas o femeninas), con estambres amarillos, casi siempre polinizadas por el viento. Están dispuestas en racimos de hasta 10 cm, las flores femeninas tienen su estigma en forma de bolita y se las ve como largos racimos colgantes, y las flores masculinas tienen cuatro estambres y son las inflorescencias más cortas (López, 2008; La Patria, 2010; Huerta, 2007). Figura 2. Planta de Ortiga Los tallos y las hojas tienen la característica de estar provistos de pelos urticantes o tricomas glandulares, que se clavan al contacto con la piel e inyectan un líquido irritante que contiene ácido fórmico, acetilcolina, histamina y serotonina, provocando ronchas y escozor. El “veneno” no es mortífero pero si muy molestoso y puede alcanzar cierta gravedad si el contacto con la planta se produce en amplias zonas del cuerpo (López, 2008; Dieter & Ortega, 2011). Dentro de la composición química de la ortiga se encuentran ácidos fenólicos como el cafeico (hasta 1.6%), clorogénico (0.5%), neoclorogénico, ferúlico. Posee también características antioxidantes debido a su contenido de flavonoides (0.7 a 1.8%) principalmente rutina, isoquercitrina, kaempferol, quercetina, isoramnetina y astragalina. Su contenido de sales minerales 10 llega hasta un 20% incluyendo hierro, azufre, calcio, sílica, potasio y manganeso. Otros constituyentes importantes son los ácidos orgánicos como ácetico, butírico, cítrico, fórmico y fumárico. Contiene además taninos, carotenos, esteroides (betasitosterol), alcaloides (betaína) y una proporción elevada de clorofila a y b. La raíz contiene mucílagos, esteroides (betasitosterol, estigmasterol, campesterol), escopoletina, lignanos, taninos astringentes, monoterpenos y triterpenos (Huerta, 2007; Gómez-Serranillos et al., 2006). En la Tabla 4, se detalla el valor nutricional de la ortiga, en donde se observa que tiene un bajo aporte de calorías. Tabla 4. Valor Nuticional de la Ortiga (USDA, 2012). Valor por cada 100 g Energía 42 kcal Agua 87.67 g Proteína 2.71 g Grasa Total 0.11 g Carbohidratos 7.49 g Calcio 481 mg Hierro 1.64 mg Sodio 4 mg 2.2.3 USOS DE LA ORTIGA Esta planta tiene una gran variedad de aplicaciones medicinales, cosméticas, alimenticias, entre otras. En el Ecuador la ortiga es muy conocida pues es utilizada para castigar a delincuentes de pueblos y comunidades indígenas, quienes son sentenciados a recibir baños de agua helada y azotes con ortiga en los páramos andinos, con el fin de “purificar” al 11 imputado, haciéndolo pasar por una humillación pública (Dieter & Ortega, 2011). Su consumo en forma de infusión favorece la digestión y es considerado un laxante suave; ayuda a la recuperación y protección del hígado y favorece la función biliar. Su gran contenido de taninos, especialmente en la raíz, la convierte en un efectivo antidiarreico (López, 2008; Huerta, 2007). Además, la infusión de sus hojas se utiliza como diurético en afecciones genitourinarias como cistitis, uretritis, pielonefritis, oliguria y urolitiasis. Por sus propiedades diuréticas también es utilizado en el tratamiento de cálculos en el riñón, gota, artritis, artrosis y reumatismo (López, 2008; Huerta, 2007). El zumo de la planta fresca tiene una acción hemostática, detiene las hemorragias y previene el flujo descontrolado de la sangre, se usa para tratar hemorragias nasales, la hemofilia y los trastornos de la menopausia. Por su alto contenido de clorofila mejora de la circulación sanguínea y es utilizada en el tratamiento de la arteriosclerosis (López, 2008; Fonnegra & Jiménez, 2007; Pamplona, 2006). La ortiga, al ser consumida como verdura es un alimento muy nutritivo, que además de tener un buen sabor, ayuda a curar la anemia por su alto contenido de hierro (Fonnegra & Jiménez, 2007; Pamplona, 2006). 2.3 PAICO (Chenopodium ambrosiodes) 2.3.1 ORIGEN El paico (Chenopodium ambrosiodes), llamado también pazote o epazote, es una planta originaria de América tropical, pero que ha sido naturalizada en regiones cálidas y templadas de Europa. Esta hierba puede crecer en una 12 variedad de climas: cálido, semicálido, semiseco y templado desde el nivel del mar hasta 3900 msnm, de manera silvestre o cultivada; no es muy exigente respecto a la calidad del suelo, pero necesita buena luminosidad y debe ser regada regularmente. Es una planta medicinal y aromática usada desde tiempos prehispánicos por los indígenas americanos (Arqueta & Gallardo, 1994). 2.3.2 DESCRIPCIÓN DE LA PLANTA En la Tabla 5, se detalla la clasificación taxonómica del paico: Tabla 5. Clasificación Taxonómica del Paico (Soriano, 2009). Reino: Plantae División: Tracheobionta Clase: Magnoliopsida Orden: Caryophyllales Familia: Amaranthaceae Subfamilia: Chenopodioideae Género: Chenopodium Especie: ambrosiodes Nombre científico: Chenopodium ambrosiodes Blair y Madrigal (2005) describen al paico como una planta aromática, perenne, erecta con una altura máxima de 1 metro de altura, con el tallo pubescente, simple o ramificado. Tiene un olor muy fuerte que para algunas personas puede llegar a ser desagradable. Como se observa en la Figura 3, sus hojas son lanceoladas a ovadas y serradas, de entre 1.7 y 7 cm de longitud y 0.5 a 2.5 cm de ancho; las hojas inferiores son pecioladas, y las superiores sésiles, vellosas, con abundantes 13 glándulas color almíbar, cuneadas en la base, obtusas a atenuadas en el ápice (Blair & Madrigal, 2005). Figura 3. Planta de Paico Posee inflorescencias verdes en panículos terminales densos, cada uno con cinco sépalos; el cáliz de 3 a 5 segmentos, persistente circunda al fruto; las semillas son lisas, brillantes café-rojizas a negras y no mayores a 0.8 mm de longitud (Gómez, 2008). Dentro de los componentes de esta planta están las saponinas, geraniol, limoneno, d-alcanfor, p-cimeno, terpineno, mirceno, ácido butírico, espinasterol, metil silicilato, sulfato y fosfato de magnesio, ureasa, alcaloides y glicósidos variados. Su aceite esencial contiene hasta un 90% de ascaridol y pequeñas proporciones ácidos fenólicos como el estragol, timol y carvacrol. En sus frutos se han encontrado flavonoides como kaempferol, isoramnetina, quercetina y flavonolglicósidos (Muñoz, 1999; Blair & Madrigal, 2005). El aceite esencial del paico es un líquido ligeramente amarillo, de consistencia no muy viscosa, con olor penetrante y pungente parecido al 14 alcanfor, con un sabor ligeramente amargo que se extrae de toda planta, especialmente de las semillas y frutos, que en grandes dosis es sumamente tóxico, por lo que no se recomienda usarlo sin prescripción médica (Gómez, 2008). El valor nutricional del paico se presenta en la Tabla 6: Tabla 6. Valor Nuticional del Paico (FUNIBER, 2012). Valor por cada 100 g Energía 54 kcal Proteína 5g Grasa Total 1.10 g Carbohidratos 9.20 g Fibra 2.10 g Calcio 459 mg Hierro 6.30 mg Vitamina C 34.70 mg 2.3.3 USOS DEL PAICO El uso del paico con fines medicinales tiene una larga tradición y remonta tiempos precolombinos por parte de poblaciones nativas de América, que lo utilizaban a manera de infusiones y decocciones de las hojas, flores y raíces. Esta planta destaca por su efecto antihelmíntico especialmente contra áscaris, tenia y otros parásitos intestinales, siendo considerado uno de los mejores vermífugos vegetales por muchos autores (Dieter & Ortega, 2011). También es útil para tratar padecimientos del aparato digestivo como cólicos, diarreas, empachos, disentería, indigestión, es usado como tónico estomacal carminativo. Ayuda a regular la menstruación (Medicamentos Herbarios Tradicionales, 2009). 15 Según investigaciones de campo realizadas en varias provincias del país, esta planta es muy buena para tratar problemas de la piel como granos, verrugas, sarna, pústulas, hongos, facilitar la cicatrización de heridas. Otra propiedad muy conocida del paico es ayudar a la mejorar la memoria (Dieter & Ortega, 2011). Según Blair y Madrigal (2005) el paico tiene propiedades para curar la malaria y el paludismo; se usa para aliviar resfríos, tos y asma, como purgante diurético, hepatoprotector, antinflamatorio, antiemético, antiséptico, antirreumático y antiartrítico. Adicionalmente, las hojas del paico se utilizan como ingrediente en sopas típicas y las semillas sirven de aderezo en la preparación de frijoladas, debido a su olor es usado como condimento (León, 2009). 2.4 PEREJIL (Petroselinum sativum) 2.4.1 ORIGEN El perejil (Petroselinum sativum) es una planta originaria de Cerdeña y de la cuenca mediterránea, y de Asia occidental, sin embargo su cultivo se ha extendido por todo el mundo, pues es muy utilizada como hortaliza por sus hojas y por sus raíces. Necesita de un suelo ligero, medianamente rico en materia orgánica, bien provisto de calcio y bien drenado, con luminosidad media y se adapta a una variedad de climas. También se lo puede cultivar en macetas para disponer de perejil fresco todo el año (Mendiola & Montalbán, 2009; Arango, 2006; Fonnegra & Jiménez, 2007). Es una de las hierbas más conocidas en el mundo gastronómico por su aroma y sabor, muy empleada en la cocina mediterránea pues realza el 16 sabor de las comidas y sus hojas sirven como decoración. Es la base de las salsas verdes en países de Europa central y América del Sur (Green, 2007). 2.4.2 DESCRIPCIÓN DE LA PLANTA En la Tabla 7 se especifica la clasificación taxonómica del perejil: Tabla 7. Clasificación Taxonómica del Perejil (Soriano, 2009). Reino: Plantae División: Magnoliophyta Clase: Magnoliopsida Orden: Apiales Familia: Apiaceae Género: Petroselinum Especie: sativum Nombre científico: Petroselinum sativum El perejil es una planta herbácea, bienal, con una altura que va entre los 30 y 60 cm, aromática, cuenta con una raíz central fusiforme, ramificada por arriba, blanca o amarillenta, pubescente y cónica (Mendiola & Montalbán, 2009). Sus hojas son de color verde intenso y brillante como se observa en la Figura 4, divididas en segmentos bastante anchos, con forma triangular y pecíolo envainador. Las hojas inferiores son dentadas y tienen segmentos ovales, y las hojas superiores poseen un limbo formado por tres segmentos enteros y lanceolados (Fonnegra & Jiménez, 2007; Mendiola & Montalbán, 2009). 17 Figura 4. Planta de Perejil Las flores son verde-amarillentas o blancas, muy pequeñas y regulares, que forman umbelas compuestas de pedúnculos largos, con seis a veinte radios desiguales y umbélulas multifloras (Mendiola & Montalbán, 2009). Sus frutos son diaquenios ovoides, de color marrón, una vez maduros se dividen en dos medios frutos arqueados. Cada aquenio contiene una semilla plana (Restrepo et al., 2005). Entre los compuestos característicos encontramos flavonoides como apíina, luteolina, apigenina y algunos glucósidos; además posee cumarinas como bergapteno, imperatorina, xantotoxina, trioxaleno y angelicina; poliacetilenos (falcarinol, falcarindiol); furocumarinas: bergapteno, oxipeucedanina, isoimperatorina; ácido petroselínico, oleorresinas y taninos. Su aceite esencial (0.3 a 0.7%) está compuesto por apiol, miristicina, y betafelandreno, sustancias que le confieren propiedades antioxidantes. El perejil es la fuente más rica en vitamina A y también aporta vitaminas C y E, complejo B, calcio, hierro, fósforo y azufre; adicionalmente se ha encontrado cantidades moderadas de ácido oxálico en forma de oxalatos (Arango, 2006; Fonnegra & Jiménez, 2007; Reyes et al., 2012). 18 En la Tabla 8 se presenta el valor nutricional del perejil: Tabla 8. Valor Nuticional del Perejil (INCAP, 2012). Valor por cada 100 g Energía 36 kcal Agua 87.71 g Proteína 2.97 g Grasa Total 0.79 g Carbohidratos 6.33 g Calcio 138 mg Hierro 6.20 mg Sodio Vitamina C 56 mg 133 mg 2.4.3 USOS DEL PEREJIL Esta es una planta muy conocida por sus usos en la cocina, es utilizado ampliamente como condimento, sus hojas son utilizadas para elaborar aderezos y como saborizante de carnes, embutidos, sopas, salsas y como sazonador en general, también se le utiliza como elemento decorativo dando el toque final a los platillos (Reyes et al., 2012). Además posee propiedades medicinales, la decocción de las hojas y raíz es muy eficaz como diurético, ayuda a tratar infecciones urinarias y cálculos renales. Favorece el parto, la menstruación y alivia los cólicos debido a acción emenagoga en dosis pequeñas, no se recomienda su uso en mujeres embarazadas ya que en altas dosis es abortivo. Estimula el apetito y la digestión y actúa como carminativo. Su uso tópico funciona como antipruriginoso y emoliente, en contusiones, rasguños y picaduras de mosquitos. También es muy usado para tratar intoxicaciones debido a un 19 consumo excesivo de bebidas alcohólicas (Fonnegra & Jiménez, 2007; Restrepo et al., 2005). 2.5 HIERBAS SECAS Las hierbas medicinales y aromáticas normalmente tienen una gran carga microbiana proveniente del suelo, polvo e insectos propios del medio ambiente donde son cultivadas, sin embargo esta carga también puede venir de agua contaminada y material fecal (Wójcik, 2009). Las prácticas actuales de cultivo, cosecha, procesamiento y almacenamiento, a menudo causan contaminación adicional. La flora microbiana de muchas especias y hierbas secas está conformada mayormente por bacterias aerobias formadoras de esporas y hongos comunes debido a su capacidad para sobrevivir en materiales secos durante largos períodos. No obstante, también se ha reportado la presencia de bacterias patógenas, coliformes, mohos toxigénicos y levaduras (Farkas, 2000). El secado de hierbas y especias inmediatamente después de la cosecha, es uno de los principales métodos para el control del crecimiento microbiano, ya que reduce el número de bacterias vegetativas presente, pero también es considerado como un "punto crítico" y expone a las hierbas al riesgo de contaminación. Por esta razón, las hierbas secas pueden contener altos niveles de diferentes grupos de microorganismos, incluyendo bacterias patógenas y hongos toxigénicos (Wójcik, 2009). 2.5.1 INFUSIONES Las infusiones comúnmente conocidas como “té de hierbas” son bebidas preparadas vertiendo agua hirviendo a hojas secas, partes de flores o hierbas aromáticas, dejando que reposen de 3 a 5 minutos. La diferencia 20 entre infusión y té consiste en que se le denomina té a la bebida elaborada con las hojas y brotes de la planta del té (Camellia sinensis), pero básicamente un té es una infusión, que puede ser consumida caliente o fría (Hurtado et al., 2012). El agua es el medio ideal para extraer la mayor parte de los fitocompuestos, por ser el disolvente universal por excelencia. Por esta razón, las infusiones son la mejor opción para extraer gran cantidad de sustancias activas de las partes delicadas de las plantas como hojas y flores, con muy poca alteración de su estructura química, conservando así sus propiedades al máximo. Esto se debe a que no se somete a las plantas a un proceso de ebullición, lo que evita que se pierdan o evaporen algunos principios activos (Pamplona, 2006). Las plantas aromáticas brindan innumerables cualidades a la hora de preparar una infusión, deleitando los sentidos con un agradable aroma y sabor, además poseen propiedades medicinales ayudando al buen funcionamiento del organismo, ya que contienen principios activos que varían en función de la especie y del momento de maduración de las mismas. Muchos de estos compuestos actúan como antioxidantes protegiendo a las células del daño oxidativo, causante del envejecimiento celular (Boxler, 2009). 2.6 RADIACIÓN ULTRAVIOLETA La luz ultravioleta es una radiación no ionizante, con una longitud de onda que va de 100 a 400 nm y que se subdivide en 3 rangos: UV-A, (onda larga) tiene una longitud de onda entre 315 y 400 nm, provoca cambios en la piel, resultando en un bronceado leve superficial. 21 UV-B, (onda media) abarca longitudes de onda entre 280 y 315 nm, puede causar quemaduras y, finalmente, puede inducir el cáncer de piel. UV-C, (onda corta) su longitud de onda va de 200 a 280 nm, es absorbido por el ARN, ADN y proteínas, y puede dar lugar a mutaciones en las células, cáncer o muerte celular (Bolton & Cotton, 2008). En la Figura 5 se muestra el espectro electromagnético y los rangos en que se divide la luz ultravioleta: Figura 5. Espectro electromagnético (Rivera-Pastrana et al., 2007) 2.6.1 IRRADIACIÓN UV-C Es un tratamiento poscosecha suave, que está siendo utilizado para prolongar la vida útil de frutas y hortalizas enteras y cortadas, pues aplicando dosis bajas de radiación se observa un efecto benéfico en cuanto a su calidad, preservándola, además activa los mecanismos de defensa del producto (González-Aguilar et al., 2005; Shama & Alderson, 2005). 22 Por su efecto germicida, la radiación UV-C ha sido utilizada en diversos alimentos así como en superficies inertes, como un método de desinfección superficial a temperatura ambiente que no deja residuos en el producto, no afecta a las características sensoriales (sabor y aroma) y no favorece los procesos deteriorativos (Rivera-Pastrana et al., 2007). Cabe resaltar que la sensibilidad de los tejidos vegetales a la radiación UV-C varía dependiendo del genotipo y en ocasiones las dosis altas pueden favorecer el oscurecimiento superficial del tejido y la oxidación de compuestos bioactivos como fenoles, vitamina C y carotenoides (GonzálezAguilar et al., 2001), por esta razón que se usan dosis bajas para evitar estos problemas. La eficacia de la desinfección proporcionada por la irradiación UV-C está directamente relacionada con la dosis aplicada, la cual es el producto entre la intensidad de la radiación expresada como energía por unidad de área y el tiempo de contacto con la luz UV en segundos. Altas intensidades durante un breve período de tiempo o bajas intensidades durante un período de tiempo prolongado son prácticamente intercambiables y casi equivalentes en cuanto a eficacia de la desinfección. La dosis como magnitud determinante se indica en µW*s/cm² y con frecuencia también en J/m² (Sterilair, 2013) 2.6.2 ACCIÓN GERMICIDA El pico máximo de emisión de la radiación UV-C es a 254 nm, y es justamente en esta longitud de onda donde existe mayor acción germicida, inactivando bacterias y virus (Artés & Allende, 2005). Este mecanismo de inactivación se da por la transformación fotoquímica de las bases pirimidinas en el ADN de los microorganismos; éstas se dimerizan distorsionando la doble hélice del ADN, volviéndolo inutilizable para los procesos biológicos como el mantenimiento del metabolismo o la replicación celular. Las células que no son capaces de reparar su ADN dañado por la radiación mueren y 23 las células que fueron dañadas subletalmente suelen sufrir mutaciones (Lado & Yousef, 2002). Según la mayoría de estudios realizados la composición química y ordenamiento estructural propios del alimento, juegan un papel importante en el daño causado por la radiación UV-C en el ADN de los microorganismos, ya que dosis similares de UV-C tienen efectos diferentes en el crecimiento de una misma especie microbiana (Shama et al., 2005). Es por esta razón que resulta relevante la evaluación de esta tecnología en cada producto en particular y así poder definir las condiciones óptimas de aplicación y los posibles cambios en la calidad del producto. 2.6.3 EFECTO HÓRMICO Luckey (1991) propuso un mecanismo para la hormesis en la que sugirió que las dosis bajas de la radiación UV podrían infligir daños reparables al ADN y que este ligero traumatismo activaría los mecanismos de reparación de daño en el ADN inducido por radiación. Esto sugiere que la radiación subletal puede estimular procesos vitales dentro de las células y crear un cambio positivo en la homeostasis de una planta. Según Shama & Alserson (2005), hormesis es la aplicación de agentes potencialmente dañinos en dosis bajas a organismos vivos generando cierto estrés con el fin de provocar respuestas, ya sean positivas o negativas. Es una respuesta adaptativa con características diferenciales por la relación dosis-respuesta y puede ser inducida por acción directa o por una sobre-estimulación a bajas dosis (Calabrese & Baldwin, 2002). La radiación UV-C ha tenido un efecto positivo en el aumento de las propiedades nutracéuticas en frutas y hortalizas, así como en la síntesis de compuestos que actúan con los mecanismos de defensa de plantas expuestas a estrés (Cisneros-Zevallos, 2003), la exposición a dosis bajas puede inducir la producción de compuestos fungicidas como fitoalexinas 24 (fenoles, flavonoides y poliaminas) y retrasar los procesos de maduración y senescencia (Nigro et al., 1998; Erkan et al., 2001; González-Aguilar, 2005). La Tabla 9 muestra un resumen con las ventajas y desventajas de la aplicación de la radiación UV-C: Tabla 9. Ventajas y desventajas de la radiación UV-C (Domínguez & Parzanese, 2011) RADIACIÓN UV-C VENTAJAS DESVENTAJAS Es una tecnología eficiente para la Tiene poca penetración en líquidos inactivación de muchos no transparentes y en sólidos la microorganismos irradiación es únicamente superficial No provoca alteraciones Los organismos protegidos por organolépticas en la mayoría de sólidos (partículas, polvo o alimentos cubiertas) no son afectados No produce residuos químicos ni No hay una capacidad de radiaciones desinfección residual La desinfección es muy rápida, son La exposición prolongada a necesarios muy pocos minutos irradiación UV-C puede dañar la vista y causar quemaduras. Es una tecnología de bajo costo y La lámpara o el equipo se debe mantenimiento colocar tan cerca como sea posible al producto a tratar El equipo es fácil de operar y la Los microorganismos pueden técnica es de fácil aplicación a reparar los efectos destructivos de diversos productos alimenticios la radiación UV mediante foto- líquidos y sólidos reactivación o, en ausencia de radiación, mediante reparación en oscuro. 25 2.7 ANTIOXIDANTES 2.7.1 RADICALES LIBRES La mayoría de células y organismos realizan oxidaciones para obtener energía y realizar sus funciones vitales, generando radicales libres (Montero, 1996; Quintanar & Calderón, 2009). Estos radicales libres del oxígeno tienen una función fisiológica en el organismo (Venereo, 2002). Si bien las reacciones de oxidación son imprescindibles para los procesos metabólicos y las funciones del organismo, los radicales libres generados tienen un efecto tóxico y si no son correctamente neutralizados o existe una mayor producción con relación a los mecanismos de defensa que poseen las células pueden causar un daño irremediable, que si es muy extenso puede llevar a la muerte celular (Venereo, 2002; García et al.,2001). Los radicales libres son moléculas que tienen uno o más electrones desapareados en sus orbitales externos y buscan captar electrones de moléculas estables (biomoléculas), oxidándolas para lograr su estabilidad electroquímica, convirtiendo a su vez a estas moléculas en radicales libres, y generando así una reacción en cadena (Venereo, 2002; Quintanar & Calderón, 2009). Además de los radicales libres, existen moléculas oxidantes altamente reactivas resultado de la reducción parcial del oxígeno comúnmente conocidas como EROS o especies reactivas del oxígeno, estas son: Radical Hidroxilo (OH)+ Anión superóxido (O2) Oxígeno Singlete (1O2) Peróxido de Hidrógeno (H2O2) 26 Hidroperoxilo (HO2) Ozono (O3) Oxígeno Nítrico (NO) Peróxido (ROO) (Venereo, 2002). De todas las EROS, el radical hidroxilo es la más dañina, actuando sobre todo tipo de biomoléculas: en los lípidos provoca peroxidación lipídica de las membranas, en las proteínas causa inactivación enzimática y en el ADN genera mutaciones (Montero, 1996). En condiciones normales, en las células y en los organismos existe un equilibrio entre la cantidad de radicales libres producidos incluyendo a las especies reactivas con la cantidad de sustancias antioxidantes generadas; de ese modo, la toxicidad de la oxidación es limitada, siendo este daño limitado en parte el causante del envejecimiento natural que presenta todo organismo (Quintanar & Calderón, 2009). Sin embargo, al presentarse un desequilibrio entre la agresión oxidativa y la eficiencia de los sistemas amortiguadores antioxidantes, producido ya sea por una mayor producción de EROS o por una deficiencia de sustancias antioxidantes, esta condición es conocida como estrés oxidativo, que lleva a una variedad de cambios fisiológicos y bioquímicos que ocasionan el deterioro y muerte celular (Montero, 1996). 2.7.2 SISTEMA DE DEFENSA ANTIOXIDANTE Las células poseen un mecanismo de defensa que consiste en una serie de sustancias que previenen o retardan significativamente el daño causados por la oxidación de biomoléculas; estas sustancias son conocidas como antioxidantes y pueden ser exógenos, que son incorporados al organismo por medio de los alimentos; y endógenos, que son sintetizados por las células (Montero, 1996; García et al, 2001). 27 La función de los antioxidantes es proteger al organismo de la acción de los radicales libres, responsables del envejecimiento celular y de algunas enfermedades, entre ellas el cáncer; éstos retrasan el proceso de envejecimiento combatiendo la degeneración y muerte de las células (Gutiérrez et al., 2007). El mecanismo de acción de los antioxidantes no enzimáticos es ceder sus electrones a los radicales libres, oxidándose y de esta manera debilitan su acción convirtiéndolos en radicales libres no tóxicos; es por esto que su reposición debe ser continua, a través del consumo de nutrientes que los contengan (Venereo, 2002; Mayor-Oxilia, 2010; Quintanar & Calderón, 2009). En cambio, el modo en que actúan los antioxidantes enzimáticos es catalizando o acelerando las reacciones químicas que utilizan sustratos que reaccionan con los radicales libres (García et al., 2001; Mayor-Oxilia, 2010). También existen enzimas que regeneran sustratos o cosustratos reduciéndolos nuevamente y de esta manera devolverles su función antioxidante con lo que se evitarán futuras oxidaciones, como es el caso de la vitamina E. 2.7.3 CLASIFICACIÓN DE LOS ANTIOXIDANTES En la Tabla 10, se detalla la clasificación de los antioxidantes según su origen. Algunos autores colocan dentro de la clasificación de antioxidantes a los oligoelementos cobre, manganeso, zinc, hierro y selenio ya que actúan como cofactores de las enzimas antioxidantes, pero también son capaces de ejercer funciones antioxidantes de manera independiente (Criado & Moya, 2009). 28 Tabla 10. Clasificación de los antioxidantes según su origen (Venereo, 2002) EXÓGENOS Vitamina E ENDÓGENOS ENZIMÁTICOS Superóxido Dismutasa (SOD) ENDÓGENOS NO ENZIMÁTICOS Glutatión Vitamina C Catalasa (CAT) Coenzima Q Betacarotenos Glutatión Peroxidasa (GPx) Ácido Tioctico Flavonoides Licopenos La incapacidad del cuerpo humano para neutralizar por sí solo a los radicales libres a los que está expuesto diariamente, obliga al hombre a recurrir a alimentos con propiedades antioxidantes provenientes de fitonutrientes como las vitaminas C y E, carotenoides, licopenos, flavonoides (incluyendo flavonas, isoflavonas, flavononas, antocianinas y catequinas), todos estos son fuertes antioxidantes y contribuyen significativamente a la capacidad antioxidante total (Gutiérrez et al., 2007). 2.7.4 CAPACIDAD ANTIOXIDANTE TOTAL Para combatir el daño oxidativo, el organismo y las células cuentan con un sistema amortiguador antioxidante muy completo formado por numerosos mecanismos antioxidantes específicos, esto se debe a que debe hacer frente a la variedad de formas de radicales libres y especies reactivas (Quintanar & Calderón, 2009). Todo este sistema amortiguador antioxidante puede ser evaluado indirectamente como una capacidad antioxidante total, dando una idea cuál 29 sería la respuesta antioxidante en conjunto ante agresiones oxidativas. La evaluación va a depender del fluido, tejido o célula que se desee estudiar, pues cada ambiente posee sistemas antioxidantes y una conjunción o integración diferentes (Quintanar & Calderón, 2009). Si se realiza una medición de los antioxidantes individuales por separado, ésta no permitirá conocer con certeza la capacidad antioxidante total de una preparación, compuesto o de un fluido biológico, esto se debe a los efectos sinérgicos que puedan establecerse entre los antioxidantes presentes en él (Gutiérrez et al., 2007). Se han desarrollado algunos métodos con los que se puede determinar la capacidad antioxidante total, siendo todos métodos de inhibición, donde se usa una especie generadora de radicales libres o iniciador y una sustancia que detecta a estas especies (monitora). La actividad antioxidante de la muestra añadida inhibe directa o indirectamente el poder oxidante de una molécula estándar determinada (iniciador) (Gutiérrez et al., 2007). Al ser oxidada la molécula monitora por un radical libre inducido sufre una modificación como: cambio de color, emisión de luz fluorescente o electricidad o se puede detectar por sus productos. La capacidad antioxidante se mide cuando al colocar la muestra a evaluar, la molécula monitora se oxida y con ello el parámetro modificado, se realiza una comparación de la intensidad de la inhibición de la modificación en las mismas condiciones con un antioxidante de potencia conocida como trolox y así se obtienen los equivalentes de la capacidad antioxidante (Quintanar & Calderón, 2009). 2.8 POLIFENOLES Según Quiñones, Miguel y Aleixandre (2012), los polifenoles son el grupo más extenso de compuestos no energéticos de origen vegetal, producto del 30 metabolismo secundario de las plantas que se caracterizan por presentar una estructura molecular que incluye la presencia de uno o varios anillos fenólicos. Los polifenoles participan en las funciones fisiológicas vegetales, en las funciones de defensa ante situaciones de estrés (estímulos diversos: luminosos, hídricos, entre otros), en funciones de protección al ataque de patógenos o herbívoros y también son pigmentos que atraen a los polinizadores (Arranz, 2010). Su importancia biológica para la salud humana se debe a que muchos polifenoles tienen la capacidad de captar radicales libres, confiriéndoles actividad antioxidante, lo que está relacionado con la prevención de enfermedades cardiovasculares y el cáncer; además algunos polifenoles como las isoflavonas, los lignanos y el estilbeno poseen una actividad estrogénica, lo que supone que pueden ayudar en la prevención de los síntomas de la menopausia y la osteoporosis (Tomás-Barberán, 2003). Existen factores que afectan al contenido cualitativo y cuantitativo de polifenoles en los alimentos, influyendo sobre su distribución. Estos factores pueden ser intrínsecos, de origen genético, que llevan a que la composición de estas sustancias sea distinta entre variedades de un mismo producto; también influyen el contenido y la actividad de las enzimas oxidativas presentes en las distintas variedades. Así mismo, pueden influir factores extrínsecos al vegetal, relacionados a las circunstancias de cultivo, las condiciones de conservación poscosecha, el grado de iluminación e irradiación de las plantas y la temperatura de cultivo (Tomás-Barberán, 2003). 2.8.1 CLASIFICACIÓN DE LOS POLIFENOLES Flavonoides: Están formados por dos anillos aromáticos unidos por un heterociclo oxigenado y que dependiendo del grado de hidrogenación y de la sustitución del heterociclo, pueden ser: (Quiñones, Miguel & Aleixandre, 2012). 31 o Flavonoles o Flavonas o Flavanonas o Isoflavonas o Antiocianidinas o Flavanoles No Flavonoides: Contienen un anillo aromático con diferentes grupos funcionales, y que pueden estar formando ésteres con los ácidos orgánicos (Quiñones, Miguel & Aleixandre, 2012). o Acidos fenólicos Derivados del ácido hidroxibenzoico Derivados del ácido hidroxicinámco o Estilbenos o Lignanos o Alcoholes Fenólicos Frutas como manzana, fresa, uva, arándano, ciruelas y asimismo verduras y hortalizas como berenjena, tomate, apio, pimientos, entre otras, son principalmente las fuentes mayoritarias de polifenoles en la dieta humana. Otras fuentes de polifenoles son bebidas como el vino, té e infusiones de hierbas aromáticas como menta, toronjil, cedrón, hierbaluisa, manzanilla, perejil, entre otras. (Tomás-Barberán, 2003; Quiñones, Miguel & Aleixandre, 2012; Boxler, 2009). 32 3. METODOLOGÍA 3. METODOLOGÍA 3.1 MATERIAL VEGETAL La muestra fue proporcionada por la microempresa Sumak Jambina, situada en Cotacachi, provincia de Imbabura. Las hierbas fueron secadas en un deshidratador industrial bajo criterios de humedad y temperatura determinados por la empresa, y almacenadas en recipientes con protección de la luz. Se tomaron muestras aleatorias de toronjil (Melissa officinalis), ortiga (Urtica dioica), perejil (Petroselinum sativum) y paico (Chenopodium ambrosioides) por separado en envases herméticos, para realizar los diferentes análisis. Fueron analizados dos lotes: uno cosechado y analizado en Octubre del 2012 y otro fue almacenado 5 meses en un lugar fresco y seco a temperatura ambiente y analizado en Marzo del 2013. 3.1.1 PREPARACIÓN DE LA MUESTRA Las muestras secas de toronjil, paico, ortiga y perejil, incluyendo sus tallos, fueron trituradas por separado en un molinillo de marca Peabody modelo PE-MC9103. Posteriormente fueron pesadas de acuerdo a la formulación proporcionada por la empresa, el proceso se detalla en el Anexo I. 3.1.2 TRATAMIENTO CON LUZ UV-C Y SELECCIÓN DE DOSIS ÓPTIMA Cada lote fue dividido en cuatro partes: una control (no irradiada) y tres tratadas con dosis diferentes: 2.3, 4.1 y 6.5 kJ/m2. Las muestras fueron sometidas a radiación en una cámara, dotada de cuatro lámparas UV-C (Germicidal, 30W, G30T8), a una distancia de 15 cm y se utilizó un 33 radiómetro marca UVP modelo UVX, para medir la intensidad de la radiación, como se observa en el Anexo II. Para asegurar una exposición uniforme en toda la muestra de hierbas, se utilizó un agitador magnético marca Corning modelo PC-620D, que se muestra en el Anexo III. Se analizó el efecto de las diferentes dosis de radiación sobre la flora nativa de la mezcla de hierbas y se determinó la capacidad antioxidante y contenido de polifenoles. La dosis óptima de radiación UV-C se seleccionó en base a los resultados obtenidos en la determinación del contenido de polifenoles y de la capacidad antioxidante. Una vez seleccionada la dosis se analizó la cuantificación de capacidad antioxidante y contenido de polifenoles en el té de hierbas. 3.1.3 PREPARACIÓN DEL TÉ DE HIERBAS Se pesó 1 g de la mezcla de hierbas, se agregó 240 ml de agua hirviendo, se dejó reposar durante 5 minutos y se filtró con papel filtro común. Debido a su rápida oxidación, el té obtenido fue analizado inmediatamente de ser preparado. Con este extracto acuoso se realizó el análisis de capacidad antioxidante total y de polifenoles con la dosis seleccionada. En el Anexo V se detalla el proceso de elaboración del té. 3.2 ANÁLISIS MICROBIOLÓGICO Se tomaron 10 g de mezcla para té y se homogenizaron en frascos de vidrio estériles con 90 ml de agua peptonada (0.1%) en un agitador de placas a 34 una velocidad constante de 500 RPM durante 15 minutos, correspondiente a la dilución 10-1, a partir de ésta se realizaron dos diluciones sucesivas (10-2 y 10-3) para recuento de coliformes totales, y de mohos y levaduras; para recuento de aerobios mesófilos totales se realizó una dilución adicional (10-4). De cada dilución se tomó una alícuota de 1 ml y se inoculó en placas 3MTM PetrifilmTM para recuento de levaduras y mohos, de aerobios mesófilos totales y de coliformes totales. Los ensayos se realizaron por triplicado. Para el recuento de aerobios mesófilos totales, las placas se incubaron según el método oficial AOAC 990.12 (2005) el cual sugiere incubarlas durante 48 horas a 35ºC. Mientras que para el recuento de mohos y levaduras, las placas se incubaron a 25°C de 3 a 5 días, según la Guía de interpretación Petrifilm. 3.3 CAPACIDAD ANTIOXIDANTE TOTAL La capacidad antioxidante total se determinó por espectrofotometría, según la metodología desarrollada por Re et al. (1999) y descrita por Kuskoski et al. (2005), que se basa en la decoloración del radical ABTS●+. 3.3.1 EXTRACTO PARA CAPACIDAD ANTIOXIDANTE TOTAL Se pesó 1 g de la mezcla de hierbas, se agregó 10 ml de etanol y se homogenizó por 15 minutos. Se centrifugó la suspensión obtenida a 6000 rpm a 10°C por 10 minutos, en una centrífuga Hermle, Labnet modelo Z323K y se filtró el líquido sobrenadante llevándolo a un volumen final de 10 ml. El extracto etanólico fue almacenado a -20°C hasta la realización del análisis. 35 Para el análisis de capacidad antioxidante en el té, éste fue utilizado como extracto acuoso elaborado el mismo día de la realización del análisis. 3.3.2 PREPARACIÓN DEL REACTIVO ABTS●+ Para formar el radical estable ABTS●+ se prepararon 10 ml de ABTS 7mM con persulfato de potasio 2,45 mM en agua destilada y se dejó incubar en oscuridad por 16 horas a temperatura ambiente sin agitación. Transcurrido este tiempo el radical fue almacenado en tubos eppendorf a -20°C. Se diluyó el radical estable con etanol y se agitó durante 30 minutos hasta obtener una solución con absorbancia de 0,700 ± 0,005 medida a 734 nm en un espectrofotómetro marca Thermoscientific modelo evolution 60s UVvisible. A medida que se realizó el análisis, se fue controlando que la absorbancia del reactivo no tenga una variación mayor al rango establecido (0,700 ± 0,005). 3.3.3 CUANTIFICACIÓN DE LA CAPACIDAD ANTIOXIDANTE Se añadió 50 µl de extracto de mezcla de hierbas a 1000 µl de reactivo ABTS●+ y se agitó. Se dejó cursar la reacción por 6 minutos y se midió la absorbancia a 734 nm, resultando una medida válida al obtener entre 2080% de inhibición, comparada con la absorbancia del blanco, preparado con 50 µl de etanol y 1000 µl de reactivo ABTS●+ (sin extracto). Las medidas se realizaron por triplicado. Los resultados fueron expresados en μmol trolox/g de muestra seca. Para la medida de la capacidad antioxidante total del té, se tomó 1 ml de muestra y se añadió 9 ml de agua bidestilada. De esta dilución, se añadió 50 36 µl a 1000 µl de reactivo ABTS●+ y se procedió como se indicó anteriormente. 3.3.4 CURVA DE CALIBRACIÓN DE TROLOX Se preparó una curva de calibración con Trolox 0.5 mM diluido en etanol; se tomaron 1000 μl del reactivo ABTS●+ y se adicionaron (0, 20, 25, 30, 35, 40, 45 y 50) μl de la solución de Trolox. De igual manera se dejó reaccionar 6 minutos a temperatura ambiente y se realizaron las medidas a 734 nm. 3.4 POLIFENOLES TOTALES Para analizar el contenido de polifenoles se utilizó el método desarrollado por Georgé, Brat, Alter & Amiot, (2005), que se basa en la reacción de reducción/oxidación entre los polifenoles (ácido gálico) presentes en la muestra y el reactivo Folin-Ciocalteu, evaluado por espectrofotometría. 3.4.1 EXTRACTO PARA POLIFENOLES TOTALES Se pesó 1 g de mezcla para té en un erlenmeyer de 25 ml cubierto con papel aluminio. Se adicionaron 10 ml de solución extractora acetona/agua 70% v/v y se cubrió con papel parafilm. Se agitó durante 20 minutos con un agitador magnético marca Corning modelo PC-620D y se homogenizó la muestra en el baño ultrasónico marca Brason modelo 2510, durante 10 minutos. Se filtró el líquido sobrenadante, al igual que los residuos del erlenmeyer que fueron lavados con 2 ml de solución extractora. Se almacenó el extracto obtenido en botellas ámbar a -20°C hasta la realización del análisis. 37 Para el análisis de polifenoles en té, se utilizó la infusión como extracto acuoso elaborada el mismo día de la realización del análisis. Las soluciones obtenidas como extractos fueron tratadas de dos formas, según se detalla a continuación: 3.4.1.1 Muestra A: Dilución del extracto Se realizó una dilución de 10 ml de volumen final, tomando una alícuota de 100 µl de extracto cetónico con 9,9 ml de agua bidestilada y se agitó. De esta dilución se tomaron por triplicado 500 µl en tubos de ensayo y se siguió el protocolo del Folin-Ciocalteu descrito posteriormente. Para el blanco se utilizó acetona diluida en la misma proporción que el extracto. Con el té se realizó una dilución de 10 ml de volumen final, tomando una alícuota de 2 ml de té con 8 ml de agua bidestilada y se agitó. De esta dilución se tomaron 500 µl por triplicado en tubos de ensayo y se siguió el protocolo de Folin-Ciocalteu. Para el blanco se utilizó 500 µl de agua bidestilada. 3.4.1.2 Muestra B: Separación de polifenoles y vitamina C Se realizó una dilución de 4 ml de volumen final, tomando 350 µl de extracto y 3650 µl de agua bidestilada. De esta dilución, 2 ml fueron colocados en el cartucho OASIS previamente acondicionado y se recogió el filtrado obtenido en una probeta. Después se lavó el cartucho con 2 ml de agua bidestilada y se recogió el agua del lavado, filtrado por el cartucho, en la misma probeta. De este filtrado se tomó por triplicado 500 µl y se procedió con el protocolo de Folin-Ciocalteu. 38 Con el té se realizó una dilución de 4 ml de volumen final, tomando una alícuota de 3 ml de té con 1 ml de agua bidestilada y se agitó. De esta dilución, 2 ml fueron colocados en el cartucho OASIS previamente acondicionado y se recogió el filtrado obtenido en una probeta. Después se lavó el cartucho con 2 ml de agua bidestilada y se recogió el agua del lavado filtrado por el cartucho en la misma probeta. De este filtrado se tomó por triplicado 500 µl y se procedió con el protocolo de Folin-Ciocalteu. 3.4.2 PROTOCOLO DE FOLIN-CIOCALTEU A los 500 µl de la dilución del extracto, se añadió 2,5 ml del reactivo de Folin-Ciocalteu y se agitó con el vortex, dejando en reposo por 2 minutos. Finalizado este tiempo, se basificó con 2 ml de carbonato de sodio, se agitó con el vortex y se colocó en baño de agua a 50°C por 15 minutos. Posteriormente, se enfrió rápidamente en un baño de hielo y se procedió a realizar las lecturas a 760 nm. 3.4.3 CURVA DE CALIBRACIÓN DE ÁCIDO GÁLICO Se realizó una curva de calibración pesando 0,025 g de ácido gálico, y se aforó a 50 ml con agua bidestilada en un balón cubierto con papel aluminio. Se prepararon diluciones patrón y se siguió el protocolo de Folin-Ciocalteu. 3.5 DISEÑO EXPERIMENTAL Y ANÁLISIS ESTADÍSTICO Para el análisis de los resultados obtenidos en los recuentos microbiológicos se empleó un diseño experimental unifactorial. Los resultados fueron analizados mediante el análisis de varianza (ANOVA) y las medidas 39 comparadas por el test de Tukey con una significancia de 0.05 usando el software InfoStat versión 2013. Para el análisis de capacidad antioxidante total y contenido de polifenoles totales en la mezcla de hierbas y en el té se empleó un diseño experimental AxB, donde se plantearon como variables independientes la dosis de radiación y el tiempo de almacenamiento y como variables dependientes la capacidad antioxidante total y el contenido de polifenoles totales. Los resultados obtenidos fueron analizados estadísticamente usando el software InfoStat versión 2013, con un análisis de varianza y las medidas comparadas por el test de Tukey con una significancia de 0,05. 40 4. ANÁLISIS DE RESULTADOS 4. ANÁLISIS DE RESULTADOS 4.1 EFECTO DEL TRATAMIENTO UV-C SOBRE LA FLORA NATIVA 4.1.1 AEROBIOS MESÓFILOS TOTALES a 4,55 4,50 a a Log UFC/g 4,45 4,40 a 4,35 4,30 4,25 4,20 4,15 Control 2.3 kJ/m2 4.1 kJ/m2 6.5 kJ/m2 Dosis de radiación Figura 6. Recuento de Aerobios Mesófilos Totales de la mezcla para té compuesta por toronjil, ortiga, paico y perejil, control y tratadas con 2.3, 4.1 y 6.5 kJ/m2 Letras diferentes indican diferencias significativas entre dosis de radiación (p<0.05; tukey = 0.364) En la Figura 6, se muestran los resultados del recuento de aerobios totales de las diferentes dosis, en donde la muestra control presentó una población de 4.41 unidades logarítmicas, mientras que las muestras tratadas con 2.3 y 6.5 kJ/m2 presentaron una disminución en el recuento de 0.02 y 0.15 unidades logarítmicas respectivamente a diferencia de la muestra tratada con 4.1 kJ/m2 que tuvo un incremento de 0.08 unidades logarítmicas. Las muestras tratadas no presentaron diferencia significativa con relación a la muestra control. 41 Se encontraron resultados similares en lechuga (Suárez & Piñeros, 2013), en donde se observaron descensos en los recuentos de aerobios mesófilos totales en muestras irradiadas durante 5 y 15 minutos. Las muestras tratadas con 5 minutos de exposición mostraron una reducción de 0,8 unidades logarítmicas aproximadamente, mientras que las muestras irradiadas con 15 minutos mostraron una disminución de 1.5 unidades logarítmicas aproximadamente. En mango, piña y mamey mínimamente procesados irradiados con dosis de 7 y 14 kJ/m2 se observaron descensos en los recuentos de aerobios mesófilos totales de las muestras tratadas (Márquez & Pretell, 2013). También se han reportado resultados similares en toronjil y perejil frescos (García, 2013) y en paico y ortiga frescos (Charpentier, 2013) tratadas con dosis de 3.2 kJ/m2 y 6.0 kJ/m2, sin embargo, en estos estudios se observaron descensos mucho más notorios en la población de aerobios totales. Los resultados obtenidos en esta investigación podrían deberse a que la flora microbiana de una mezcla de hierbas secas es en su mayoría bacterias aerobias formadoras de esporas y hongos comunes, son resistentes a la radiación ultravioleta pero pueden ser destruidas si son sometidas a una exposición prolongada. Las esporas necesitan tener las condiciones óptimas, y principalmente necesitan calor para su germinación y reactivación, esto se produce al momento de incubar las placas petrifilm, después de irradiar las muestras; por otra parte probablemente las dosis de radiación utilizadas fueron bajas como para afectar significativamente su desarrollo (Farkas, 2000). 4.1.2 COLIFORMES TOTALES Los resultados del recuento de coliformes totales se muestran en la Figura 7, en donde la muestra control presentó una población de 2.83 unidades logarítmicas, mientras las muestras tratadas con 2.3 kJ/m2, 4.1 y 6.5 kJ/m2 42 presentaron un incremento de 0.08, 0.17 y 0.28 unidades logarítmicas en el recuento, sin presentar diferencia significativa con respecto a la muestra Log UFC/g control. 3,15 3,1 3,05 3 2,95 2,9 2,85 2,8 2,75 2,7 2,65 a a a a Control 2.3 kJ/m2 4.1 kJ/m2 6.5 kJ/m2 Dosis de radiación Figura 7. Recuento de Coliformes Totales de la mezcla para té compuesta por toronjil, ortiga, paico, y perejil, control y tratadas con 2.3, 4.1 y 6.5 kJ/m2 Letras diferentes indican diferencias significativas entre dosis de radiación (p<0.05; tukey = 0.964) Estos resultados pueden deberse a que las dosis de radiación UV-C utilizadas en el análisis no fueron lo suficientemente altas para producir daños letales en el ADN de las bacterias. La radiación desencadena un sistema de respuesta SOS (de emergencia) para reparar el daño en el ADN, que según Radman, es un sistema de respaldo que ayuda a enfrentar situaciones adversas, provocando un aumento generalizado en la frecuencia de mutaciones como una alternativa para ampliar la variabilidad genética y de este modo incrementar las probabilidades de supervivencia y propagación de la especie en condiciones de estrés (Serment et al., 2005). En esta investigación se utilizaron lámparas UV de baja presión que contienen gas de mercurio, que cuando es estimulado por una carga 43 eléctrica, emite luz UV a 254 nm específicamente. Varios estudios en E. coli han demostrado que el ADN microbiano es capaz de realizar una reparación o reactivación tras haber sido expuesto a UV de baja presión, pero no después de la exposición al UV de mediana presión (Sommer et al., 2000; Hu et al., 2005). Esta reactivación puede desarrollarse tanto a la luz como en la oscuridad y se denomina fotorreactivación y reparación a oscuras, respectivamente; en ambos casos la reactivación se produce gracias a enzimas que reparan el ADN dañado y que permiten que el proceso de replicación vuelva a comenzar. La capacidad de reactivación depende mucho del tipo de daño UV provocado (McClean, 2006). A diferencia de los resultados obtenidos en este estudio, Charpentier (2013) reportó un descenso de 1.19 unidades logarítmicas en ortiga fresca irradiada con 6.0 kJ/m2, mientras que en paico fresco tratado con 6.0 kJ/m2 reportó una reducción total del recuento de coliformes. García (2013) reportó que las dosis de 3.2 kJ/m2 y 6.0 kJ/m2 presentaron una reducción de 3.1 y 1.3 unidades logarítmicas en perejil fresco y toronjil fresco respectivamente; en ambos casos inhiben eficazmente el crecimiento de coliformes. 4.1.3 MOHOS En cuanto al recuento de mohos, como se observa en la Figura 8, la muestra control presentó una población de 2.82 unidades logarítmicas; la muestra irradiada con 2.3 kJ/m2 mostró un incremento de 0.23 unidades logarítmicas en el recuento, mientras que las muestras irradiadas con 4.1 y 6.5 kJ/m2 presentan una disminución de 0.6 y 0.93 unidades logarítmicas respectivamente, siendo la dosis más alta la que presentó la mayor reducción. Las muestras tratadas no presentaron diferencia significativa con relación a la muestra control. 44 3,5 a a Log UFC/g 3 a 2,5 a 2 1,5 1 0,5 0 Control 2.3 kJ/m2 4.1 kJ/m2 6.5 kJ/m2 Dosis de radiación Figura 8. Recuento de Mohos de la mezcla para té compuesta por toronjil, ortiga, paico, y perejil, control y tratadas con 2.3, 4.1 y 6.5 kJ/m2 Letras diferentes indican diferencias significativas entre dosis de radiación (p<0.05; tukey = 1.830) Márquez & Pretell (2013) obtuvieron resultados similares, quienes reportaron descensos en los recuentos de mohos en mango, piña y mamey mínimamente procesados irradiados con dosis de 7 y 14 kJ/m 2 en muestras tratadas, evidenciando la acción antifúngica de este tratamiento físico. Las muestras de mango, piña y mamey irradiadas con 14 kJ/m2 reportaron una reducción total en recuentos de mohos. En toronjil, perejil (García, 2013) y paico (Charpentier, 2013) frescos tratados con 3.2 kJ/m2 y 6.0 kJ/m2, hubo una ligera reducción en el recuento de mohos, mientras que en ortiga fresca (Charpentier, 2013) tratada con 6.0 kJ/m2 se observaron resultados muy parecidos a los obtenidos en la mezcla de hierbas irradiada con 6.5 kJ/m2, en donde se vio una disminución de las colonias de mohos de 1 unidad logarítmica. Se puede ver que a mayor dosis de radiación existe una mayor disminución en el recuento de mohos. 45 4.1.4 LEVADURAS En la Figura 9, se muestran los resultados del recuento de levaduras de los diferentes tratamientos, en donde la muestra control presentó un recuento de 2.86 unidades logarítmicas, mismo recuento que presentó la muestra tratada con 2.3 kJ/m2; la dosis de 4.1 kJ/m2 presentó un incremento de 0.11 unidades logarítmicas, por el contrario el recuento de la muestra tratada con 6.5 kJ/m2 presentó un descenso de 0.40 unidades logarítmicas. Las muestras tratadas no presentaron diferencia significativa con respecto a la muestra control. a a a 3 a Log UFC/g 2,5 2 1,5 1 0,5 0 Control 2.3 kJ/m2 4.1 kJ/m2 6.5 kJ/m2 Dosis de radiación Figura 9. Recuento de Levaduras de la mezcla para té compuesta por toronjil, ortiga, paico, y perejil, control y tratadas con 2.3, 4.1 y 6.5 kJ/m2 Letras diferentes indican diferencias significativas entre dosis de radiación (p<0.05; tukey = 0.895) Beltrán et al. (2010) reportaron resultados similares en fresa, se observó una disminución en el contenido de levaduras que va del 43% hasta el 78%, en muestras irradiadas a 30, 40 y 50 cm durante 5, 7.5 y 10 minutos, sin presentar diferencia significativa entre dosis ni alturas. 46 En lechuga (Suárez & Piñeros, 2013) también se vieron descensos en los recuentos de levaduras en muestras irradiadas durante 5 y 15 minutos. Las muestras tratadas con 15 minutos de exposición mostraron una reducción de 1.4 unidades logarítmicas aproximadamente, mientras que las muestras que fueron irradiadas por 5 minutos presentaron una disminución de 0.4 unidades logarítmicas. En perejil fresco irradiado con 3.2 kJ/m2 (García, 2013) se reportó una disminución de 1 unidad logarítmica en el recuento de levaduras y en ortiga fresca (Charpentier, 2013) tratada con 6.0 kJ/m2 se obtuvo una reducción de 0.8 unidades logarítmicas del recuento de levaduras. En toronjil fresco (García, 2013) y en paico fresco (Charpentier, 2013) tratados con 6.0 kJ/m2, se observó una ligera reducción en el recuento de levaduras correspondiente a 0.1 y 0.2 unidades logarítmicas, respectivamente. En el Anexo IV se observan los resultados del análisis microbiológico en las placas Petrifilm. 4.2 EFECTO DEL TRATAMIENTO UV-C SOBRE LA CAPACIDAD ANTIOXIDANTE TOTAL EN LA MEZCLA DE HIERBAS En la Figura 10 se observan los resultados de los lotes analizados en Octubre del 2012 y Marzo del 2013, en donde se observa que existe una diferencia significativa entre ambos. El lote analizado en Octubre del 2012 presentó una capacidad antioxidante mayor que el lote analizados en Marzo del 2013. En ambos lotes, se observó una disminución de la capacidad antioxidante total en todas las muestras tratadas con relación a la muestra control. 47 6,5 6 a µmoles eq. trolox/g tej. seco 5,5 ab bc c 5 4,5 d 4 de e e 3,5 3 OCTUBRE 2012 2,5 MARZO 2013 2 1,5 1 0,5 0 Control 2.3 kJ/m2 4.1 kJ/m2 6.5 kJ/m2 Dosis de Radiación Figura 10. Resultados de capacidad antioxidante total de la mezcla de hierbas compuesta por Toronjil, Ortiga, Paico, y Perejil, control y tratadas con 2.3, 4.1 y 6.5 kJ/m2 Letras diferentes (a,b,c,d,e) indican diferencias significativas entre dosis de radiación y tiempo de almacenamiento (p<0.05; tukey = 0.287). En el lote analizado en Octubre del 2012, las dosis de 2.3, 4.1 y 6.5 kJ/m2 presentaron una disminución de 0.36, 0.24 y 0.56 µmoles eq. trolox/g tejido respectivamente con relación a la muestra control; las dosis de 2.3 y 6.5 kJ/m2 presentaron diferencia significativa con respecto al control. Las muestras tratadas con 2.3, 6.5 y 4.1 kJ/m2 presentaron una reducción de 6.72%, 9.98% y 4.54% respectivamente, siendo ésta última la dosis que afectó en menor proporción la capacidad antioxidante total de la mezcla de hierbas. En el lote analizado en Marzo del 2013 se encontraron resultados similares pues con respecto a la dosis control las dosis de 2.3 y 6.5 kJ/m2 muestran una disminución de 0.31 y 0.43 µmoles eq. trolox/g tejido y presentaron 48 diferencia significativa, de igual manera la dosis de 4.1 kJ/m2 presenta una diferencia significativa con respecto a la muestra control con una reducción de 0.18 µmoles eq. trolox/g de tejido. La muestra tratada con 2.3 kJ/m2 mostró una reducción de 7.31%, la muestra tratada con 6.5 kJ/m2 presentó una disminución del 10.38% y la muestra tratada con 4.1 kJ/m2 fue la dosis que menos redujo la capacidad antioxidante total de la mezcla de hierbas con una disminución del 4.25%. La disminución de la capacidad antioxidante de la mezcla de hierbas del lote de Marzo del 2013 que fue almacenado 5 meses, pudo deberse a que sus principios activos se degradaron durante el almacenamiento (Sharapin, 2000). Se vieron resultados similares en repollo cortado mínimamente procesado (Ruiz y col., 2010), las muestras irradiadas con UV-C presentaron diferencias significativas con las muestras control, en donde se vio que la capacidad antioxidante total disminuye en las muestras tratadas con 6 kJ/m 2 y 12 kJ/m2 antes de su almacenamiento. Así mismo, en hojas de espinaca mínimamente procesadas tratadas con 4.54 kJ/m2, 7.94 kJ/m2 y 11.35 kJ/m2 se vio una disminución gradual de la capacidad antioxidante a lo largo de un almacenamiento de 13 días, siendo más evidente en las hojas tratadas con la dosis más alta (Artés-Hernández, 2009). A diferencia de los resultados obtenidos, en toronjil y perejil frescos (García, 2013) irradiados con 3.2, 4.4 y 6.0 kJ/m2 se observó un aumento de la capacidad antioxidante total; la dosis de 6.0 kJ/m 2 mostró un aumento de 47.82% en perejil y 36.36% en toronjil. En paico y ortiga frescos (Charpentier, 2013) sometidos a una dosis de radiación de 6.0 kJ/m 2 presentaron un aumento de su capacidad antioxidante en un 29.58% y 34.62% respectivamente. 49 4.3 EFECTO DEL TRATAMIENTO UV-C SOBRE POLIFENOLES EN LA MEZCLA DE HIERBAS LOS La aplicación de radiación UV-C incrementó la cantidad de polifenoles totales en las muestras tratadas de la mezcla de hierbas preparada con toronjil, ortiga, paico y perejil. En la Figura 11 se observa que no existe diferencia significativa entre los lotes analizados en Octubre del 2012 y en Marzo del 2013, con excepción de la muestra tratada con 6.5 kJ/m2. Todas las muestras irradiadas presentan un incremento en la cantidad de polifenoles totales en ambos lotes. 80 a mg eq. ácido gálico/g tej. seco 70 ab bcd 60 d bcd abc ab cd 50 40 OCTUBRE 2012 30 MARZO 2013 20 10 0 Control 2.3 kJ/m2 4.1 kJ/m2 6.5 kJ/m2 Dosis de Radiación Figura 11. Resultados de polifenoles totales de la mezcla de hierbas compuesta por toronjil, ortiga, paico, y perejil, control y tratadas con 2.3, 4.1 y 6.5 kJ/m2 Letras diferentes (a,b,c,d,) indican diferencias significativas entre dosis de radiación y tiempo de almacenamiento. (p<0.05; tukey = 6.368) 50 Con respecto a la muestra control, en el lote analizado en Octubre del 2012 las dosis de 2.3 y 6.5 kJ/m2 muestran un incremento de 3.80 y 2.56 mg equivalente de ácido gálico/g tejido seco correspondiente al 6.19% y 4.17% respectivamente y no presentaron diferencia significativa. Por otro lado la dosis de 4.1 kJ/m2 muestra un incremento de 7.27 mg equivalente de ácido gálico/g tejido seco correspondiente al 11.84% y presenta diferencia significativa con relación a la muestra control. En el lote analizado en Marzo del 2013, se observan resultados similares, con respecto a la muestra control las dosis de 2.3 y 6.5 kJ/m2 muestran un incremento de 3.78 y 1.96 mg equivalente de ácido gálico/g tejido seco correspondiente al 6.80% y 3.53% y no presentan diferencia significativa. Por el contrario la muestra tratada con 4.1 kJ/m2 muestra un incremento de 7.37 mg de equivalente de ácido gálico/g tejido correspondiente al 13.26%, presentando una diferencia significativa con la muestra control. Este incremento de la cantidad de polifenoles puede deberse a un mecanismo de defensa ante una situación de estrés como es la irradiación con UV-C, en donde se da una activación de reacciones enzimáticas, estimulando la síntesis de enzimas como fenilalanina amonio-liasa (PAL) y chalcona sintasa que da como resultado una mayor biosíntesis de fenoles, ligninas y flanonoides (Springob et al., 2003; Jian, 2013). La disminución de polifenoles entre las muestras de Octubre y Marzo puede deberse a que aunque el período recomendado para almacenar las hojas y flores secas es de 12 a 18 meses en un lugar fresco y seco con una mínima exposición al aire y a la luz solar, algunas plantas pierden sus principios activos más rápidamente (Sharapin, 2000). En estudios realizados en arándano azul (Gallardo, 2013) tratado con UV-C como tratamiento poscosecha, se vieron resultados similares en donde dosis de 3 y 5 kJ/m2 indujeron el incremento de polifenoles. En lechuga fresca 51 reportaron que contenido de compuestos fenólicos aumentó 2.25 veces el valor del control, con un tratamiento de 15 minutos y 7 lámparas (Suárez & Piñeros, 2013). Se ha reportado que dosis de 4 a 14 kJ/m2 de radiación UVC aplicada a cabezas de brócoli aumenta la síntesis de fenoles totales (Costa et al. 2006). Charpentier (2013) encontró un efecto benéfico en el aumento de polifenoles en paico y ortiga irradiados con 3.2 kJ/m2, 4.4 kJ/m2 y 6,0 kJ/m2, al igual que García (2013) en toronjil y perejil irradiados con las mismas dosis. 4.4 SELECCIÓN DE DOSIS ÓPTIMA Según los resultados anteriormente obtenidos en capacidad antioxidante total y contenido de polifenoles de la mezcla de hierbas secas, se seleccionó la dosis de 4.1 kJ/m2 como la dosis óptima para realizar los análisis en el té de hierbas, debido a que ésta fue la dosis que presentó la menor disminución de capacidad antioxidante y también presentó el mayor incremento de polifenoles totales. 4.5 EFECTO DEL TRATAMIENTO UV-C SOBRE CAPACIDAD ANTIOXIDANTE TOTAL EN EL TÉ LA La capacidad antioxidante total del té no presentó diferencia significativa entre los lotes de Octubre y Marzo, sin embargo las muestras irradiadas con 4.1 kJ/m2 de ambos lotes presentaron diferencias significativas con relación a las muestras control como se muestra en la Figura 12. 52 4,00 3,50 c bc a 3,00 µmoles eq. Trolox/ml ab 2,50 2,00 OCTUBRE 2012 1,50 MARZO 2013 1,00 0,50 0,00 Control 4.1 kJ/m2 Dosis de radiación UV-C Figura 12. Resultados de capacidad antioxidante total del té compuesto por toronjil, ortiga, paico, y perejil control y tratadas con 4.1 kJ/m2 Letras diferentes (a,b,c) indican diferencias significativas entre dosis de radiación y tiempo de almacenamiento (p<0.05; tukey = 0.229) La muestra tratada en Octubre del 2012 presentó un incremento de 0.25 µmoles eq. trolox/ml que representa el 8.12% con relación al control; la muestra tratada en Marzo del 2013 presentó un incremento de 0.25 µmoles eq. trolox/ml con relación a la muestra control, esto representa el 8.81%. En ambos lotes se vio un efecto de la radiación muy similar. El toronjil, la ortiga, el paico y el perejil tienen diferentes compuestos antioxidantes propios de cada hierba, además cuentan con aceites esenciales que de acuerdo al resultado obtenido, aportarían de manera significativa a la capacidad antioxidante total del té. Según resultados obtenidos por Rusaczonek et al (2010), una infusión de toronjil presentó una capacidad antioxidante total de 2.54 µmoles eq. trolox/ml, siendo ésta menor en comparación con la capacidad antioxidante total del té hecho con la 53 mezcla de hierbas irradiada e incluso menor en comparación con la muestra control. Muñoz et al. (1999), analizaron la capacidad antioxidante de infusiones de manzanilla, hierba luisa y hierbabuena. Los resultaron fueron 0.56 µmoles eq. trolox/ ml para manzanilla y 0.66 µmoles eq. trolox/ ml para hierba luisa, 5 y 4.5 veces menor que el té de hierbas respectivamente; la infusión de hierbabuena fue 1.7 veces menor que el té de hierbas con 1.65 µmoles eq. trolox/ml. Comparando estos resultados con los obtenidos en el té elaborado con la mezcla de hierbas irradiada, se observa que éste posee una capacidad antioxidante superior. 4.6 EFECTO DEL TRATAMIENTO POLIFENOLES EN EL TÉ UV-C SOBRE LOS 90 mg eq. ácido gálico/ ml muestra 80 a b a b 70 60 50 OCTUBRE 2012 40 MARZO 2013 30 20 10 0 Control 4.1 kJ/m2 Dosis de Radiación Figura 13. Resultados de polifenoles totales del té compuesto por Toronjil, Ortiga, Paico, y Perejil, control y tratadas con 4.1 kJ/ m2 Letras diferentes (a,b) indican diferencias significativas entre tratamientos y tiempo de almacenamiento (p<0.05; tukey = 4.106) 54 En los resultados de la Figura 13, se observa que la radiación UV-C aumenta la cantidad de polifenoles totales y que este incremento se mantiene en el té elaborado con la mezcla irradiada con 4.1 kJ/m2; esta dosis presentó un incremento del 10.23% en la muestra analizada en Octubre y 13.82% en la muestra analizada en Marzo, con respecto a la muestra control, sin presentar diferencia significativa entre las muestras de Octubre y Marzo. Al observar la Figura 13, se distingue un efecto benéfico en los polifenoles totales del té, en donde se observa que la dosis de 4.1 kJ/m2 produjo un incremento de 7.28 y 9.6 mg equivalente de ácido gálico / ml en el lote de Octubre del 2012 y de Marzo del 2013 respectivamente, presentando diferencia significativa con respecto a la muestra control. La cantidad de polifenoles obtenidos en el té es mayor que la que fue obtenida con el extracto cetónico debido a que el agua tiene una mayor polaridad y una mayor constante dieléctrica, por lo que solubiliza más compuestos fenólicos que la acetona (Beltrán et al., 2013). Comparando el té de toronjil, ortiga, paico y perejil con una infusión de manzanilla (Muñoz et al., 2012), la cantidad de polifenoles es 65.11 mg equivalente de ácido gálico/ml similar a la cantidad de polifenoles de la muestra control del té analizado que fue 70.4 mg equivalente de ácido gálico/ml; sin embargo en comparación con la muestra tratada de té existe una diferencia de 13.75 mg equivalente de ácido gálico/ml, que representa un aumento del 7.51%. En infusiones de hierba luisa, Muñoz et al. (2012) reportaron 72.48 mg equivalente de ácido gálico/ml, resultados próximos a la muestra irradiada 78.85 mg equivalente de ácido gálico/ml, siendo un 8.07% mayor el té de hierbas tratadas con 4.1 kJ/m2 a la infusión de hierba luisa. 55 Esto lleva a plantear que el té de la mezcla de hierbas, tiene un gran poder antioxidante debido a su contenido de polifenoles, representado principalmente por polifenoles solubles en agua, aunque según Lee et al. (2000) no se puede descartar que existan otras sustancias que contribuyan también a su actividad antioxidante, como los aceites esenciales. En infusiones de menta y hierbabuena (Rodríguez et al., 2006), se han identificado flavonoides como luteolina y apigenina, estos compuestos tienen una gran capacidad para eliminar radicales libres, e incluso a bajas concentraciones puede provocar un efecto manifiesto. Estos flavonoides se encuentran también en el toronjil (que se encuentra en mayor proporción en la mezcla) y en el perejil. También se identificó ácido rosmarínico en infusiones de albaca y menta, que es un polifenol soluble en agua y al que se le ha atribuido una actividad antioxidante mayor a la vitamina E (Rodríguez et al., 2006), es uno de los principales polifenoles que contiene el toronjil en su composición química. 56 5. CONCLUSIONES Y RECOMENDACIONES 5. CONCLUSIONES Y RECOMENDACIONES 5.1 CONCLUSIONES La radiación UV-C tiene un efecto germicida sobre los microorganismos presentes en la mezcla seca de toronjil (Melissa officinalis), perejil (Petroselinum sativum), ortiga (Urtica dioica) y paico (Chenopodium ambrosioides), siendo la dosis de 6.5 kJ/m2 la que presentó una mayor reducción de las unidades logarítmicas; en aerobios mesófilos el descenso fue de 3.37%, en mohos fue de 32.86% y en levaduras tuvo una disminución del 13.99%. En el caso de coliformes totales las unidades logarítmicas se incrementaron un 9.89% con respecto a la muestra control. El lote de la mezcla de hierbas secas analizado en Octubre presentó mayor capacidad antioxidante que el lote analizado en Marzo; se observó una disminución de la capacidad antioxidante total en todas las muestras tratadas con relación a la muestra control de ambos lotes. Por otro lado todas las muestras irradiadas de la mezcla de hierbas secas presentaron un incremento en la cantidad de polifenoles, ambos lotes no presentaron diferencia significativa entre sí. La dosis óptima seleccionada fue 4.1 kJ/m 2, debido a que ésta dosis presentó la menor disminución de la capacidad antioxidante (4.32%) y el mayor incremento de contenido de polifenoles en la mezcla de hierbas secas (12.54%). El té elaborado con la muestra tratada con 4.1 kJ/m2 presentó un incremento de 8.47% de la capacidad antioxidante total. Entre ambos lotes no se vio una diferencia significativa, sin embargo el lote de Octubre presentó una capacidad antioxidante mayor que el lote de Marzo. Asimismo el té preparado con la mezcla de hierbas secas tratada con 4.1 kJ/m2 presentó un incremento del 12.03% en el 57 contenido de polifenoles; no se vio una diferencia significativa entre ambos lotes. A pesar de que el extracto etanólico de la mezcla tratada con UV-C mostró una leve disminución de su capacidad antioxidante, el extracto acuoso (té) elaborado con hierbas irradiadas, mostró un incremento de su capacidad antioxidante y además presentó mayor contenido de polifenoles que el extracto cetónico, reafirmando un resultado positivo para los consumidores de este tipo de bebidas que además de tener propiedades medicinales combaten el estrés oxidativo del organismo. El tiempo de almacenamiento influyó en la cantidad de polifenoles y en la capacidad antioxidante de la mezcla de hierbas, en donde se vio una disminución en el lote de Marzo del 2013 que fue almacenado 5 meses, debido a que sus principios activos van degradándose con el paso del tiempo. 5.2 RECOMENDACIONES Realizar estudios con lámparas UV de mediana presión para analizar su efecto en polifenoles y capacidad antioxidante de frutas y vegetales, ya que estas lámparas emiten longitudes de onda más amplias causan daños en el ADN y en enzimas y proteínas, lo que impide la reparación microbiana. Realizar estudios posteriores sobre la asimilación de polifenoles en el organismo ya que no todos los polifenoles suministrados son metabolizados, así se tendría un resultado mucho más real de su beneficio para la salud. En comparación con los resultados obtenidos por Charpentier (2013) en paico y ortiga frescos, y por García (2013) en toronjil y perejil 58 frescos, se obtiene un mejor resultado en el incremento de la capacidad antioxidante total irradiando a las hierbas en fresco. Es por esto que se recomienda evaluar la capacidad antioxidante total y el contenido de polifenoles en hierbas irradiadas y posteriormente sometidas a un proceso de secado, ya que este proceso también provoca una situación de estrés en la planta generando compuestos fenólicos como respuesta. 59 BIBLIOGRAFÍA BIBLIOGRAFÍA Acosta, L. (2002). Desinfección de plantas medicinales - Principios Básicos. Recuperado el 4 de agosto del 2012 de: http://www.herbotecnia.com.ar/c-public-004.html Álvarez, E., & Orallo, F. (2003). Actividad biológica de los flavonoides (I). Acción frente al cáncer. OFFARM Vol. 22 N° 10. Arango, M. C. (2006). Plantas medicinales: botánica de interés médico. Manizales, Colombia. Universidad de Caldas. Arranz, S. (2010). Compuestos polifenólicos (extraíbles y no extraíbles) en alimentos de la dieta española: Metodología para su determinación e identificación. Madrid, España. Artés, F. & Allende, A. (2005). Processing lines and alternative preservation techniques to prolong the shelf-life of minimally fresh processed leafy vegetables. European Journal of Horticultural Science, 70:231-245. Artés-Hernández, F., Escalona, V., Robles, P., Martínez-Hernández, G. and Artés, F. (2009). Effect of UV-C radiation on quality of minimally processed spinach leaves. J. Sci. Food Agric., 89: 414–421. Argueta, A. & Gallardo, M.C. (1994). Epazote. Atlas de las Plantas de la Medicina Tradicional Mexicana. México: Instituto Nacional Indigenista Bachmann, R. 1975. Sterilization by intense ultraviolet radiation. The Brown Boveri Rev. 62:206-209. Beltrán, A., Ramos, M., Álvarez, M. (2010). Estudio de la Vida Útil de Fresas (Fragaria vesca) Mediante Tratamiento con Radiación Ultravioleta de Onda Corta (UV-C). Revista Tecnológica ESPOL – RTE, Vol. 23, N. 2, 17-24. Ambato, Ecuador. Beltrán, Y., Morris, H., De la Cruz, E., Quevedo, Y., Bermúdez, Rosa. (2013). Contenido de fenoles totales en extractos de Pleurotus obtenidos con 60 solventes de diferente polaridad. Rev Cubana Invest Bioméd 2013; 32(2):121-129. Blair, S., & Madrigal, B. (2005). Plantas antimaláricas de Tumaco: Costa Pacífica colombiana. Medellín: Editorial Universidad de Antioquia. Bolton, J.R., & Cotton, C.A. (2008). The Ultraviolet Desinfection Handbook. Estados Unidos: American Watter Works Association. Boon, H., & Smith, M. (2004). The Complete Natural Medicine Guide to the 50 Most Common Medicinal Herbs. (2nd ed.) Toronto: Robert Rose Inc. Boxler, M. (2009). Infusiones de plantas aromáticas y medicinales. Instituto Nacional de Tecnología Agropecuaria (INTA), Uruguay. Serie Extensión N°77. Brutti, O. (2003). La industria de las plantas medicinales, aromáticas y condimentarias en Entre ríos. Argentina: Editorial del Cardo. Calabrese, E. J., & Baldwin, L. A. (2002) Defining hormesis. Human and Experimental Toxicolology 21:91-97. Cárdenas, G. (22 de Mayo de 2009). Optimización del proceso de secado de manzanilla y toronjil con la unión de comunidades indígenas de Juan Montalvo. Quito, Ecuador. Charpentier, A. (2013). Efecto de la radiación UV-C sobre el color, flora nativa y capacidad antioxidante del Paico (Chenopodium ambrosioides) y de la Ortiga (Urtica dioica) de la zona Andina de Cotacachi. Universidad Tecnológica Equinoccial, Quito, Ecuador. Costa L., Vicente A.E., Civello P.M., Chaves A.R., Martínez G.A. (2006). UVC treatment delays postharvest senescence in broccoli florets. Postharvest Biology and Technology 39: 204-210. 61 Criado, C., & Moya, M. (2009). Vitaminas y Antioxidantes. Departamento de Medicina de la Universidad Autónoma de Madrid. Barcelona: Grupo Saned. De la Torre, L., Navarrete, H., Muriel, M., Macía, M., & H. Balslev, (2008). Usos medicinales de las plantas. Enciclopedia de las plantas útiles del Ecuador. Herbario QCA de la Escuela de Ciencias Biológicas de la Pontificia Universidad Católica del Ecuador and Herbario, AAU Department of Biological Sciences, University of Aarhus, Quito, Ecuador and Aarhus, Denmark. De la Torre, L., & Macía, M. (2008). La etnobotánica del Ecuador. Enciclopedia de las plantas útiles del Ecuador. Herbario QCA de la Escuela de Ciencias Biológicas de la Pontificia Universidad Católica del Ecuador and Herbario, AAU Department of Biological Sciences, University of Aarhus, Quito, Ecuador and Aarhus, Denmark. Dieter, K. & Ortega, F. (2011). La botica de Dios, Plantas medicinales y su uso. 1era edición. Quito: Trama Ediciones. Domínguez, L. & Parzanese, M. (2011). Luz ultravioleta en la conservación de alimentos. Revista Alimentos Argentinos Pág. 71-76. Edición 52. Ministerio de Agricultura, Ganadería y Pesca. República Argentina. Erkan M., Wang C., & Krizek, D. (2001). UV-C irradiation reduces microbial populations and deterioration in Cucurbita pepo fruit tissue. Env. Exp. Bot. 45:1-9. Farkas, J., Lund, B., Baird-Parker, T., & Gould, G. (2000). Spices and Herbs. The Microbiological Quality and Safety of Foods. Editorial Aspen, Maryland, Estados Unidos. FUNIBER. (2012). Base de Datos Internacional de Composición de Alimentos. Recuperado el 28 de Agosto del 2013, de Fundación Universitaria Iberoamericana: http://composicionnutricional.com/alimentos/PAICO-4 62 Fonnegra, R., & Jiménez, S. (2007). Plantas medicinales aprobadas en Colombia (2da ed.). Medellín: Editorial Universidad de Antioquia. Gallardo, A. (2013). Uso de la luz UV-C en la calidad del Arándano Azul (Vaccinium ashei Reade). Tesis de maestría, Institución de Enseñanza e Investigación en Ciencias Agrícolas, Montecillo, México. García, D. (2013). Efecto de la radiación UV-C sobre el color, flora nativa y capacidad antioxidante del Toronjil (Melissa Officinalis) y del Perejil (Petroselinum sativum) de la zona Andina de Cotacachi. Universidad Tecnológica equinoccial, Quito, Ecuador. García Bacallao, L., García Gómez, L., Rojo, M., & Sánches, E. (2001). Plantas con propiedades antioxidantes. Rev Cubana Invest Biomed 2001;20(3):231-5. García-Valdecantos, E. (2000). Infusiones y tisanas para sentirse bien. Editorial Libsa Sa. Georgé, S., Brat, P., Alter, P., & Amiot, M. J. (2005). Rapid determination of polyphenols and vitamin C in plant-derived products. Journal of Agricultural and Food Chemistry, 53(5), 1370-1373. Gómez-Serranillo, P., Carretero, E., & Ortega, T. (2006). Plantas medicinales para enfermedades reumáticas. España: Editorial Complutense. González-Aguilar, G., Gardea, A. A., Cuamea-Navarro, F. (2005). Nuevas Tecnologías de Conservación de Productos Vegetales Frescos Cortados. Logiprint Digital S. de R.L. de C.V. Guadalajara, Jal. México. pp: 271-285. González-Aguilar, G., Wang, C. & Buta, J. (2001). Use of UV-C irradiation to prevent decay and maintain postharvest quality of ripe “Tommy Atkins” mangos. Int. Journal of Food Science and Technology. 36: 775-782. Green, A. (2007). El Libro de las especias: hierbas aromáticas y especias. Barcelona: Ediciones Robinbook. 63 Guerrero, J., & Barbosa, G. (2011). Nonthermal processing technologies for food. Estados Unidos: Wiley-Blackwell Publishing. Gutiérrez Zavala, A., Ledesma, L., García, I., & Grajales, O. (2007). Capacidad antioxidante total en alimentos convencionales y regionales de Chiapas, México. Rev Cubana Salud Pública 2007; 33(1). Hu, J., Chu, S., Ouek, P., Feng, Y. & Tan, X. (2005). Repair and regrowth of Escherichia coli after low- and medium-pressure ultraviolet disinfection. Water Science and Technology: Water Supply, Vol. 5, No. 5, 101-108, IWA Publishing. Huerta, J. (2007). Ortiga Mayor Urtica dioica L. Medicina Natural 2007; Vol. 1 – N° 2: 131-137. Hurtado, C., Menses, J., & Resendiz, J. (2012). Tés e infusiones. Universidad Nacional Autónoma de México. INCAP. (2012). Tabla de composición de alimentos de Centroamérica. (2da ed.) Guatemala: INCAP, OPS. Ince, A., Şahín, S., & Şümnü, S. (2013). Extraction of phenolic compounds from melissa using microwave and ultrasound. Turkish Journal of Agriculture and Forestry (2013) 37: 69-75. Jian, T., Muzammil, J. M., Jiang, Z., Lu, X., & Ying, T. (2010). Influence of UV-C treatment on antioxidant capacity, antioxidant enzyme activity and texture of postharvest shiitake (Lentinus edodes) mushrooms during storage. Postharvest Biology and Technology 56:209 – 215. Lamikanra, O., Kueneman, D., Ukuku, D. & Bett-Garber, K. (2005). Effect of Processing Under Ultraviolet Light on the Shelf Life of Fresh-Cut Cantaloupe Melon. Journal of Food Science 70:534-539. 64 La Patria, Ecológico Kiswara. (25 de marzo de 2010). La Ortiga, astringente, antioxidante y otros. Recuperado el 4 de septiembre del 2013, de http://lapatriaenlinea.com/?nota=22241 Lado, B. H., & Yousef, A. E. (2002). Alternative food-preservation technologies: efficacy and mechanisms. Microbes and Infection, 4: 433–440. Lemes, C. M., Rodríguez, C., & Acosta, L. (2001). Estudios Agrícolas en Melissa officinalis L. (Toronjil): Fecha de propagación y plantación. Rev. Cubana Plant. Med. 2001; (3):93-7 López, C. (2009). Estudio de la extracción y determinación de la composición química del aceite esencial de paico (Chenopodium ambrosioides L.). Revista Ciencia y Tecnología Volumen 12 Nº 1. Callao, Perú. López, E. (2008). Toronjil. Recuperado el 30 de agosto del 2013, de http://www.visionchamanica.com/gente-vegetal/vision-chamanica/lagente-vegetal/toronjil López, E. (2008). Ortiga. Recuperado el 2 de septiembre del 2013, de http://www.visionchamanica.com/gente-vegetal/vision-chamanica/lagente-vegetal/ortiga Luckey T. D. (1991). Radiation Hormesis. CRC Press. Boca Raton, Florida, USA. pp:33-45. Maharaj, R., Arul, J., Nadeau, P. (1999). Effect of photochemical treatment in the preservation of fresh tomato (Lycopersicon esculentum cv. ‘Capello’) by delaying senescence. Postharv. Biol. Technol. 15:13-23. Márquez, L. & Pretell, C. (2010). Irradiación UV-C en frutas tropicales mínimamente procesadas. Scientia Agropecuaria 4 (2013) 147 – 161. Trujillo, Perú. Matute, E. (2013). Estudio para la elaboración de té verde aromatizado con rosas orgánicas “Vitality” de Nevado Ecuador. 65 Mayor Oxilia, R. (2010). Estrés Oxidativo y Sistema de Defensa Antioxidante. Rev. Inst. Med. Trop. 5(2):23-29. Asunción, Paraguay. McClean, J. (2006). Comparación de mecanismos de reparación microbiana con lámparas UV de baja y mediana presión. Agua Latinoamérica; 6(4):12-14. Ministerio de Salud de Chile. (2009). Medicamentos Herbarios Tradicionales. Gobierno de Chile. Santiago. Mendiola, M. A., & Montalbán, J. M. (2009). Plantas aromáticas gastronómicas. Madrid: Ediciones Mundi-Prensa. Mogrovejo, M. (2013). Propiedades medicinales del toronjil o citronela (Melissa officinalis). Recuperado el 29 de agosto del 2013, de http://mednatursagradafamilia.blogspot.com/2013/04/propiedadesmedicinales-del-toronjil-o.html Montero, M. (1996). Los radicales libres y las defensas antioxidantes: revisión. Ann Fac Med, 57(4), 278-81. Muñoz, O., Montes, M., & Wilkomirsky, T. (1999). Plantas medicinales de uso en Chile: química y farmacología (2da ed.). Santiago de Chile: Editorial Universitaria. Nigro, F., Ippolito, A., & Lima, G. (1998) Use of UV-C light to reduce Botrytis rot of table grapes. Postharv. Biol. Technol. 13:171-181. Pamplona, J. D. (2006). Salud por las plantas medicinales. (1era ed.) Madrid: Editorial Safeliz. Quintanar, M. & Calderón, J. (2009). La capacidad antioxidante total. Bases y aplicaciones. Revista de Educación Bioquímica, 28(3): 89-101. Quiñones, M., Miguel, M., & Aleixandre, A. (2012). Los polifenoles, compuestos de origen natural con efectos saludables sobre el sistema cardiovascular. Nutrición Hospitalaria, 27(1), 76-89. 66 Radman, M. (1974). Phenomenology of an inducible mutagenic DNA repair pathway in Escherichiacoli: SOS repair hypothesis. Molecular and Environmental Aspects of Mutagenesis. Charles Thomas Publisher, Springfield, USA. Restrepo, M., Quintero, P., & Fraume, N. (2005). El milagro de las plantas: aplicaciones medicinales y orofaríngeas: manual. Bogotá: Editorial San Pablo. Reyes, A., Zavala D., & Alonso, A. (2012). Perejil (Petroselinum crispum): compuestos químicos y aplicaciones. Revista Académica de Investigación Tlatemoani N°11. Rivera-Pastrana, D. M., Gardea, A. A., Martínez, M. A., Rivera-Domínguez, M., & González-Aguilar, G. A. (2007). Efectos Bioquímicos postcosecha de la irradiación UV-C en frutas y hortalizas. Rev. Fitotec. Mex. Vol. 30 (4): 361–372. Rodríguez, H., Landete, J. M., De las Rivas, B., Curiel, J. A., López, F. Gómez, C., Muñoz, R. (2007). Metabolismo de compuestos fenólicos por bacterias lácticas del vino. Instituto de Fermentaciones Industriales, CSIC, Madrid. Rusaczonek, A., Świderski, F., & Waszkiewicz-Robak, Bożena. (2010). Antioxidant properties of tea and herbal infusions – a short report. Pol. J. Food Nutr. Sci. 60(1), 33-35. Sánchez, E., León, M., Chávez, D., Hechevarría, I., & Pino, J. (2010). Caracterización farmacognóstica de Melissa officinalis L. (toronjil). Rev. Cubana Plant. Med. 2010; 15(4)198-208. Serment, J., Breña, M., & Espinosa, J. (2005). La respuesta SOS en Escherichia coli. Revista Especializada en Ciencias QuímicoBiológicas, 8(2):99-105, 2005. 67 Shama G., & Alderson, P. (2005). UV hormesis in fruits: a concept ripe for commercialization. Trends Food Science and Technology. 16:128136. Sharapin, N. (2000). Fundamentos de tecnología de productos fitoterapéuticos. Bogotá: Convenio Andrés Bello. Sommer, R., Lhotsky, T., Haider, T. & Cabaj, A. (2000). UV inactivation, liquid-holding recovery, and photoreactivation of Escherichia coli O157 and other pathogenic Escherichia coli strains in water. Journal of Food Protection, 63, 1015-1020. Soriano, M. (2009). Herbario de Plantas Medicinales. Recuperado el 31 de agosto del 2013, de http://www.slideshare.net/nildagd/herario-digitalo-mayra-soriano Springob, K., Kakajima, J., Yamazaki, M. & Saito, K. (2003). Recent advances in the biosynthesis and accumulation of anthocyanins. Natural Product Reports, 20, 288 – 303. StelirAir. (2013). Recuperado el 18 de febrero de 2013, de http://www.sterilair.com/es/empresa/competencia/efecto.html Suárez, L., & Piñeros, Y. (2013). Tratamiento con radiación UV: Alternativa en la poscosecha de lechuga (Lactuca sativa) variedad batavia en la sabana de Bogotá. Alimentos Hoy, 22(28), 13-22. Sulca, T. (2010). Determinación de la actividad antimicrobiana de los extractos de Acmella repens (Botoncillo), Urtica dioica (Ortiga negra) y Sonchus oleraceus (Kana yuyo), plantas registradas en la parroquia la Esperanza – Imbabura, sobre Staphylococcus aureus, Pseudomonas aeruginosa y Candida albicans, causantes de enfermedades bucofaríngeas. Escuela Politécnica del Ejército. Sangolquí, Ecuador. Tomás Barberán, F. (2003). Los polifenoles de los alimentos y la salud. Revista Alimentación, nutrición y salud, 10(2), 41-53. 68 USDA. (2012). National Nutrient Database for Standard Reference: Citronella. Recuperado el 28 de Agosto de 2013, de United States Department of Agriculture: http://ndb.nal.usda.gov/ndb/foods/show/3626 USDA. (2012). National Nutrient Database for Standard Reference: Stinging Nettles. Recuperado el 28 de Agosto de 2013, de United States Department of Agriculture: http://ndb.nal.usda.gov/ndb/foods/show/8124 Venereo, J. R. (2002). Daño oxidativo, radicales libres y antioxidantes. Revista Cubana de Medicina Militar, 31(2), 126-133. Vibrans, H. (29 de agosto de 2009). Urticaceae, Urtica dioica L. Recuperado el 30 de Agosto del 2013, de Malezas de México: http://www.conabio.gob.mx/malezasdemexico/urticaceae/urticadioica/fichas/ficha.htm World Health Organization. (2002). WHO monographs on selected medicinal plants, Vol. 2. Genebra, WHO. 69 ANEXOS ANEXO I PREPARACIÓN DE LA MUESTRA Molienda de hierbas Elaboración de la mezcla 70 Peso de las hierbas trituradas Muestras 71 ANEXO II EQUIPOS Radiómetro Cámara de Radiación 72 ANEXO III TRATAMIENTO CON LUZ UV-C Irradiación de muestras Muestras irradiadas 73 ANEXO IV ANALISIS MICROBIOLÓGICO Análisis de Mohos y Levaduras 74 Análisis de Aerobios Mesófilos Totales 75 Análisis de Coliformes Totales 76 ANEXO V ELABORACIÓN DEL TÉ DE HIERBAS Filtración de muestras de té Muestras control de té 77 ANEXO VI ANALISIS DE POLIFENOLES TOTALES Filtrados de los Cartuchos Oasis Soluciones patrones para la elaboración de la curva de calibración de Ácido Gálico 78 ANEXO VII TABLAS DE RESULTADOS Resultados microbiológicos de la mezcla de hierbas para té compuesta por toronjil, ortiga, paico y perejil, control y tratadas con 2.3, 4.1 y 6.5 kJ/m2 Análisis Control Log UFC/g 2.3 kJ/m2 Log UFC/g 4.1 kJ/m2 Log UFC/g 6.5 kJ/m2 Log UFC/g Aerobios Totales 4.45a 4.43a 4.53a 4.30a E. coli 2.83a 2.91a 3.00a 3.11a Mohos 2.83a 3.06a 2.23a 1.90a Levadura 2.86a 2.86a 2.97a 2.46 a Letras minúsculas diferentes (a,b,) indican diferencias significativas entre dosis de radiación y tiempo de almacenamiento (p<0.05) Resultados de capacidad antioxidante total de la mezcla de hierbas para té compuesta por toronjil, ortiga, paico y perejil, control y tratadas con 2.3, 4.1 y 6.5 kJ/m2 TRATAMIENTO OCTUBRE 2012 (µmol trolox/g tej. seco) MARZO 2013 (µmol trolox/g tej. seco) Control 5.51a ± 0.18 4.24d ± 0.11 2.3 kJ/m2 5.14bc ± 0.24 3.93de ± 0.15 4.1 kJ/m2 5.26ab ± 0.22 4.06e ± 0.19 6.5 kJ/m2 4.96c ± 0.22 3.80e ± 0.13 Letras minúsculas diferentes (a,b,c,d,e) indican diferencias significativas entre dosis de radiación y tiempo de almacenamiento (p<0.05; tukey = 0.287) 79 Resultados de polifenoles totales de la mezcla de hierbas para té compuesta por toronjil, ortiga, paico y perejil, control y tratadas con 2.3, 4.1 y 6.5 kJ/m2 TRATAMIENTO OCTUBRE 2012 (mg eq. ácido gálico/g tej. seco) MARZO 2013 (mg eq. ácido gálico/g tej. seco) Control 61.38bcd ± 4.66 55.60d ± 3.38 2.3 kJ/m2 65.18ab ± 2.60 59.38bcd ± 5.05 4.1 kJ/m2 68.65a ± 3.66 62.97abc ± 2.58 6.5 kJ/m2 63.94ab ± 6.34 57.56cd ± 4.80 Letras minúsculas diferentes (a,b,c,d) indican diferencias significativas entre dosis de radiación y tiempo de almacenamiento (p<0.05; tukey = 6.368) Resultados de capacidad antioxidante total del té de hierbas compuesto por toronjil, ortiga, paico y perejil, control y tratadas con 4.1 kJ/m2 TRATAMIENTO OCTUBRE 2012 (µmol trolox/ml) MARZO 2013 (µmol trolox/ml) Control 3.02bc ± 0.15 2.85a ± 0.07 4.1 kJ/m2 3.27c ± 0.23 3.10ab ± 0.23 Letras minúsculas diferentes (a,b,c) indican diferencias significativas entre dosis de radiación y tiempo de almacenamiento (p<0.05; tukey = 0.229) Resultados de polifenoles totales del té de hierbas compuesto por toronjil, ortiga, paico y perejil, control y tratadas con 4.1 kJ/m2 TRATAMIENTO OCTUBRE 2012 (mg eq. ácido gálico/ml) MARZO 2013 (mg eq. ácido gálico/ml) Control 71.18b ± 1.60 69.61b ± 4.17 4.1 kJ/m2 78.46a ± 1.36 79.23a ± 4.42 Letras minúsculas diferentes (a,b) indican diferencias significativas entre dosis de radiación y tiempo de almacenamiento (p<0.05; tukey = 4.106) 80