Biodisponibilidad oral y de formulaciones farmacéuticas de
Anuncio

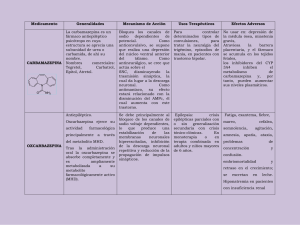
Biodisponibilidad oral y de formulaciones farmacéuticas de Carbamazepina y su metabolito en voluntarios sanos Dra. Susana Parrillo Campiglia - Doctora en Medicina. Ex Asistente de Farmacología y Terapéutica, Facultad de Medicina. UDELAR Ex Profesora Adjunta de Fármacodinamia. Facultad de Química y Farmacia, UDELAR. Profesora Asociada de Farmacología Clínica y Farmacoeconomia. U.M. Directora de la Unidad de Farmacología Clínica, Laboratorios Gautier. Br. Q. F. Mónica Cedrés - Bachiller en Química. Encargada del Laboratorio de Química Analítica de Medicamentos. Laboratorios Gautier. Q. F. Julio Benítez - Técnico en química analítica de medicamentos. Laboratorios Gautier Comité de Ética: Comité de Revisión Institucional. Laboratorios Gautier, S.A. Democracia 2132. Montevideo Centro: Unidad de Farmacología Clínica y Biodisponibilidad. Laboratorios Gautier, S.A. Democracia 2132. Montevideo. Patrocinador: Laboratorios Gautier SA. Democracia 2132. Montevideo. Tel.: +598 2401 5454. Fax.: 402 08 08 Fecha: diciembre de 2005 Resumen La carbamazepina (CBZ) es un derivado del iminoestilbeno con actividad antiepiléptica. Cuando las concentraciones de CBZ aumentan rápidamente, como ocurre con las formulaciones convencionales, produce efectos adversos neurotóxicos. Las características farmacocinéticas de la CBZ son complejas debido a su baja solubilidad en agua y porque auto-induce su metabolismo. Administrada por vía oral se absorbe lenta y erráticamente y se metaboliza por el CYP3A4 hepático. Las formulaciones de liberación controlada (CR) disminuyen la velocidad de cambio de las concentraciones plasmáticas de CBZ en la fase de absorción, contribuyendo a evitar la aparición de efectos adversos neurotóxicos. El objetivo primario del presente estudio es demostrar que la formulación CR de carbamazepina de prueba, es bioequivalente a una formulación de referencia por vía oral. Como objetivo secundario se comparan curvas de una formulación de liberación inmediata con las curvas de la formulación CR y se analizan las curvas de concentración del metabolito activo en plasma vs, tiempo para ambos productos. Se realizó un estudio a dosis única, cruzado, aleatorizado y balanceado con 12 voluntarios sanos. Los sujetos que firmaron el consentimiento informado se seleccionaron de acuerdo a estrictos criterios de inclusión/exclusión. El día del estudio en ayuno, se colocó a cada voluntario una cánula en una vena del brazo y se tomó la primera muestra pre-dosis. Posteriormente se administraron por vía oral en forma aleatoria los tratamientos (Referencia o Auratión® CR) y se efectuó un muestreo seriado de sangre venosa en los siguientes tiempos post-ingestión: 0.50, 1.00, 1.50, 2, 3, 4, 6, 8, 10, 12, 24, 48 horas. Se midió la concentración de CBZ y el metabolito 56 activo en sangre por HPLC. Se calcularon los parámetros fármacocinéticos a partir de las curvas concentración vs. tiempo y se realizó un análisis estadístico apropiado para concluir la biodisponibilidad. Se demostró que la formulación Auratión® CR presenta una velocidad de absorción y alcanza niveles máximos en plasma, ostensiblemente menores que la antigua formulación de liberación inmediata. Se concluyó la bioequivalencia entre los dos productos de CBZ-CR estudiados, por lo cual se puede concluir que ambos son intercambiables. También ha quedado en evidencia en este estudio que el metabolito activo 10,11-epoxiCBZ muestra un perfil acumulativo superponible para ambos productos y compatible con una incipiente autoinducción del metabolismo de la CBZ en el sistema microsomal hepático. Palabras Clave: carbamazepina, biodisponibilidad, metabolito, voluntarios sanos. Correspondencia: Dra. Susana Parrillo Laboratorios Gautier, S.A. Democracia 2132. Montevideo sparrillo@gautier.com.uy BIOMEDICINA, 2006, 1 (2) ISSN: 1510-9747 Biodisponibilidad oral de formulaciones farmacéuticas de Carbamazepina y su metabolito en voluntarios sanos Susana Parrillo, Mónica Cedrés, Julio Benítez Summary Introducción Carbamazepine (CBZ) is an iminostilbene derivative with antiseizure activity. Neurotoxic adverse effects are produced by the regular formulations as CBZ concentration accrue. Pharmacokinetics of CBZ is complex due to its limited aqueous solubility and self-inducement of metabolism. When administered by oral route absorption is slow and erratic and is metabolized through hepatic CYP3A4. Controlled release formulations (CR) lessen CBZ plasma concentration speed of change in the absorption phase, so contributing to avoid adverse effects. The primary hypothesis of this study is that the test CR CBZ formulation (Auratión® CR 400) is bioequivalent to the international reference formulation (Tegretol® CR 400) by the oral route. Complementarily, curves of an immediate release formulation are compared to the CR formulation and, also, concentration vs. time curves of the active metabolite for both products are confronted. A single dose, cross-over, randomized and balanced study was carried out in 12 healthy volunteers. Subjects were recruited according to strict inclusion/exclusion criteria after signing informed consent. The day of the study each fasting volunteer had a vein canula punched in the arm, after which the first pre-dose blood sample was drawn. Afterward treatments were randomly administered by oral route (Tegretol® CR or Auratión® CR) and a serial vein blood sampling was performed at the following times : 0.50, 1.00, 1.50, 2, 3, 4, 6, 8, 10, 12, 24, 48 hours. Concentration of CBZ and its active metabolite was measured in blood by HPLC. Pharmacokinetic parameters were estimated from the concentration vs. time curves and appropriate statistics was carried out to conclude bioequivalence. The Auratión® formulation shows a speed of absorption and maximum plasma levels, ostensibly lower than the old immediate release formulation. Bioequivalence was concluded between both CBZ-CR products, therefore interchangeability is warranted. It is also evident form the present study that the active metabolite 10, 11- epoxyCBZ shows an accrual overlapping profile for both products, which is consistent with an incipient self-inducement of CBZ metabolism at the hepatic microsomal system. La carbamazepina (CBZ) se relaciona desde el punto de vista químico con los antidepresivos tricíclicos. Es un derivado del iminoestilbeno con un grupo carbamilo en posición 5 que es esencial para su actividad antiepiléptica. Cuando se alcanzan concentraciones por arriba de 8-12 µg/mL más o menos rápidamente, como ocurre con las formulaciones convencionales, la CBZ produce efectos adversos neurotóxicos (somnolencia, ataxia, vértigo, diplopía, visión borrosa, etc). Por lo tanto es necesario demostrar que las nuevas fórmulas de liberación controlada desarrolladas, enlentecen la velocidad de cambio de la concentración de CBZ en la sangre sistémica durante la fase de absorción. De esta manera se disminuye la incidencia de efectos adversos dependientes de la velocidad con que se alcanza la concentración máxima. Las características farmacocinéticas de la CBZ son complejas debido a su baja solubilidad acuosa y porque otros antiepilépticos, así como ella misma, inducen su metabolismo. La CBZ administrada por vía oral se absorbe lenta y erráticamente. En estudios clínicos la suspensión, los comprimidos convencionales y los comprimidos de liberación controlada (CR) de CBZ, aportan la misma cantidad del fármaco a la circulación sistémica. Sin embargo la suspensión se absorbe más rápido que los comprimidos de liberación rápida y éstos más rápido que los comprimidos de liberación controlada. A igual dosis, los comprimidos de liberación controlada administrados dos veces por día, determinan niveles plasmático al estado de equilibrio estable comparables a los comprimidos de liberación rápida administrados cuatro veces por día (1). La vía metabólica dominante en los seres humanos es la conversión de la carbamazepina al 10, 11- epóxido. Se ha demostrado en varios modelos animales que este metabolito tiene una actividad semejante a la CBZ. La concentración de 10,11-epóxiCBZ en el plasma y en el cerebro alcanza el 50% de la CBZ sin cambios, especialmente cuando se administran simultáneamente fenitoína o fenobarbital. El 10,11-epóxido continúa metabolizándose a compuestos inactivos que se excretan en la orina como glucorónidos. El principal sistema enzimático responsable de la biotransfomación de la CBZ es el CYP3A4 hepático. La T1/2e de la CBZ varia con el tiempo porque autoinduce su propio metabolismo; la autoinducción se completa entre 3 y 5 semanas de administración crónica. Los valores iniciales de la T1/2e son de 25 a 65 horas disminuyendo a 12-17 horas luego de administración crónica (2). La CBZ se distribuye rápidamente en los tejidos. Se une a Key words: carbamazepine, bioavailabilty, metabolite, healthy volunteer. 57 BIOMEDICINA, 2006, 1 (2) ISSN: 1510-9747 Evaluación Comparativa de la Biodisponibilidad Oral y del Metabolismo de Diferentes Formulaciones Farmacéuticas de Carbamazepina en Voluntarios Sanos Susana Parrillo Campiglia las proteínas plasmática en aproximadamente un 75%. Las concentraciones en el líquido céfalorraquídeo (LCR) y en la saliva se corresponden con las concentraciones de fármaco libre en el plasma. Al comienzo del tratamiento con la formulación de liberación rápida se producen invariablemente mareos, somnolencia, incoordinación, confusión, cefaleas, fatiga, visión borrosa, diplopía, nistagmus, disartria, parestesias, etc., sin embargo aumentando la dosis gradualmente se puede disminuir su incidencia. Las formulaciones de liberación controlada (Controlled Realease, CR), a su vez, dado que truncan los picos de concentración máxima disminuyendo la velocidad de cambio de las concentraciones plasmáticas de CBZ en la fase de absorción, contribuyen a evitar la aparición de estos efectos adversos (1, 3, 4). Por lo tanto el objetivo primario del presente estudio es demostrar que la formulación de carbamazepina vía oral desarrollada por Laboratorios Gautier (Auratión® CR de 400 Tabla I. Datos antropométricos de los voluntarios sanos N° Voluntario Sexo Edad (Años) Peso (Kg) Altura (m) 1 LP M 26 58 1.79 2 JM F 35 73 1.60 3 MCh F 28 70 1.62 4 RJ M 26 76 1.65 5 PF F 33 65 1.55 6 FM M 26 70 1.67 7 SR F 36 75 1.72 8 AM F 27 65 1.75 9 GG M 33 67 1.73 10 RM M 30 64 1.65 11 AM F 25 66 1.75 12 DE M 33 69 1.65 Media 6M,6F 29.8 68.2 1.68 4.0 5.1 0.07 SD M=Hombre; F=Mujer; SD=Desviación Estándar. 58 mg), no es estadísticamente diferente, en cuanto a su biodisponibilidad a la formulación de Referencia (CBZ 400 mg, liberación modificada) vía oral. Como objetivo secundario se comparan curvas de una formulación de liberación inmediata (Immediate Release, IR) con las curvas de la formulación CR y se analizan las curvas concentración del 10, 11-epóxido de CBZ en plasma vs, tiempo para ambos productos. Material y métodos Diseño del estudio. Se realizó un estudio a dosis única, cruzado, aleatorizado y balanceado. Se incluyeron 12 voluntarios cuyos datos antropométricos se observan en la Tabla I. Los sujetos se seleccionaron descartando enfermedadades (particularmente digestivas, hepáticas, renales, neurológicas, cardiovasculares, inmunoalérgicas, psiquiátricas) mediante: a) historia clínica, b) examen físico y c) exámenes de laboratorio (creatininemia, glucemia, ionograma, funcional hepático, hemograma, orina completa, etc.). El estudio fue conducido de acuerdo con las recomendaciones de la Asociación Médica Mundial (como consta en la declaración de Helsinki, 1964, y las últimas enmiendas de Sommerset West, 1966). El protocolo de este estudio fue sometido a un Comité de Revisión Institucional (CRI) y fue aprobado por el Ministerio de Salud Pública (MSP). Cada voluntario firmó un formulario de consentimiento informado. Los voluntarios llegaron el día del estudio a la Unidad de Farmacología Clínica a la hora 8 a.m. con un ayuno de por lo menos 8 horas, se les colocó una cánula en una vena del brazo que se mantuvo durante 12 horas mediante un “Heparin lock” y se tomó la primera muestra predosis (muestra 0). Posteriormente se administró en forma aleatoria uno de los dos productos por vía oral (Formulación de Referencia o Auration® CR 400 mg). Los comprimidos fueron ingeridos con 250 ml de agua sin gas. Se efectúa un muestreo seriado de sangre venosa (10 ml en tubo con heparina) en los siguientes tiempos luego de la toma del producto: 0.50, 1.00, 1.50, 2, 3, 4, 6, 8, 10, 12, 24, 48 horas. Cada voluntario volvió a ingerir un comprimido de la marca que no había tomado en la siguiente sesión con un intervalo libre de una semana y se procedió con el muestreo en las mismas condiciones. Durante cada sesión del estudio se uniformizó la dieta, la ingesta de fluidos, el ejercicio y la postura del voluntario. Todas las comidas y líquidos ingeridos luego de la administración de los productos de referencia o de prueba fueron similares en cuanto a cantidad, composición y horario de administra- BIOMEDICINA, 2006, 1 (2) ISSN: 1510-9747 Biodisponibilidad oral de formulaciones farmacéuticas de Carbamazepina y su metabolito en voluntarios sanos Susana Parrillo, Mónica Cedrés, Julio Benítez ción para todos los participantes. Los sujetos fueron advertidos de no tomar medicamentos desde 14 días antes durante ni una semana después del estudio. Se les instruyó para que se abstuvieran de comidas, bebidas o hábitos que modifican los parámetros hemodinámicos o las funciones gastrointestinal, hepática o renal (por ej., alimentos o bebidas que contengan xantinas, alcohol, jugos de pomelo, fumar, etc.) desde dos días antes al estudio hasta dos días después del mismo. Por otra parte se estableció que durante la sesión podían deambular, permanecer sentados o, en caso de acostarse, lo debían hacer en decúbito dorsal. No se permitieron ejercicios físicos durante el estudio (5). El investigador principal estaba habilitado retirar del estudio a un voluntario en caso de aparecer factores (intolerancia a la medicación, eventos adversos no esperados, afecciones intercurrentes, no cumplimiento de las indicaciones previas, etc.) que hubieran expuesto al voluntario a un riesgo innecesario y/o hubieran hecho difícil la ulterior interpretación de los resultados. Tabla II. Parámetros fármacocinéticos derivados de las curvas de concentración vs. tiempo, agrupados por producto Voluntario ABC0-48 (ug*ml-1*h) Cmax (ug/mL) Tmax (h) T1/2e (h) Aur. Ref. Aur. Ref. Aur. Ref. Aur. Ref. V1 (LP) 112,3 129,7 2,67 3,06 48 24 106,6 31,3 V2 (JM) 102,0 107,9 2,40 2,6 24 12 49,6 96,2 V3 (MCh) 107,9 85,1 2,41 2,23 48 48 165,4 44,8 V4 (RJ) 121,4 113,2 2,84 2,62 48 24 64,9 177,3 V5 (PF) 96,7 106,5 2,33 2,55 24 24 31,3 56,0 V6 (FM) 115,1 125,6 2,85 3,06 24 24 108,4 80,6 V7 (SR) 116,7 147,1 2,89 3,58 48 12 72,2 47,9 V8 (AM) 114,6 123,6 2,88 3,25 48 48 37,9 27,8 V9 (GG) 123,2 120,0 2,79 2,93 12 48 255,9 41,2 V10 (RM) 104,1 105,2 2,59 2,70 24 24 26,8 58,9 V11 (AM) 101,7 101,3 2,50 2,33 48 12 69,9 52,1 V12 (DE) 92,8 85,0 2,25 2,14 24 24 50,4 49,2 Promedio 109,0 112,5 2,62 2,75 35 278764 SD9,7 18,1 0,23 0,43 14,0 13,76641 CV%8,90 16,18,94 15,7340517764 IC95%5,5 10,2 0,257,97,7 0,13 ABC0-48 = Área Bajo la Curva concentración vs. tiempo entre el tiempo 0 y 48 horas post dosis; Cmax: Concentración máxima; Tmax: Tiempo a la Cmax; T1/2e= Vida media de eliminación. Aur.= Auration; Ref. = SD = CV% = IC95% = 38 23 Referencia internacional CBZ 400 mg liberación modificada; Desvió Estándar; Coeficiente de variación; Intervalo de confianza al 95%. 59 BIOMEDICINA, 2006, 1 (2) ISSN: 1510-9747 Procesamiento de las Muestras: cada muestra se procesó antes de una hora de extraída. Se separó el plasma de las muestras de sangre en centrífuga refrigerada a 4° C. El plasma sobrenadante se separó hacia otro tubo seco. Se almacenó en freezer a -20 C° a la espera de ser analizadas. La concentración de carbamazepina (CBZ) y carbamazepina 10,11-epóxido (CBZ-E) en las muestras de plasma se midieron con una técnica cromatográfica específica puesta a punto y validada en nuestro laboratorio (6). La separación de CBZ y CBZ-E se llevó a cabo mediante cromatografía de fase reversa en una columna C18 y con detector UV programado a 210 nanómetros. La fase móvil estaba compuesta por acetonitrilo /metanol/ acetato de amonio 50 mmol/L (22:18:60). Las muestras de plasma, a las que se les agregó el estándard interno (nitrazepam), se extrajeron con cloroformo/hexano (40/60) y se inyectaron en el cromatógrafo. El coeficiente de variación intraensayo e interensayo se ajustó por debajo del 15% y el rendimiento de la recuperación fue mayor al 90%. El método mostró la exactitud, precisión y linearidad necesarias para un estudio farmacocinético (las curvas de calibración se extendió entre 0.05 y 10 µg/mL). El límite de cuantificación (LOQ) fue de 0.05 µg/ml y de 0.02 µg/ml para la CBZ y la CBZ-E , respectivamente. Evaluación Fármacocinética: una vez obtenidos los datos de concentración de CBZ en sangre, se graficaron las curvas concentración vs. tiempo correspondientes para cada voluntario, una con el fármaco de prueba y otra con el fármaco de referencia. A partir de estas curvas concentración vs. tiempo se computó el Área Bajo la Curva (ABC) desde el tiempo 0 hasta el último punto de concentración medido (ABC0-48). Estas estimaciones planimétricas se hicieron con un programa escrito en la planilla de cálculo Excel® de Microsoft. El mismo programa estima el parámetro Ke mediante una regresión Log-Lineal de los puntos de concentración vs. tiempo en la fase final de eliminación y, a partir de este parámetro computa la T1/2 de eliminación. Tomando el último punto de la curva (C48) calcula el ABC48-inf. luego suma (ABC0-48 + ABC48-inf.) obteniendo el ABC0-inf.. (ABC Total). A partir de las mismas curvas se obtienen manualmente la concentración máxima (Cmax) y la latencia a la Cmax (tmax) (7). Evaluación estadística: se aplicará un procedimiento mediante el cual la bioequivalencia se concluye rechazando dos hipótesis nulas (H0=bioinequivalencia) y aceptando las correspondientes hipótesis alternativas (H1=bioequivalencia) mediante dos test de T unicaudales. De esta manera el riesgo 60 Evaluación Comparativa de la Biodisponibilidad Oral y del Metabolismo de Diferentes Formulaciones Farmacéuticas de Carbamazepina en Voluntarios Sanos Susana Parrillo Campiglia de concluir erróneamente la bioequivalencia (hecho grave dado que permitiría liberar a la venta productos NO-equivalentes) queda reducido al error de tipo I, con una probabilidad asociada alfa = 5%. En forma práctica el método estadístico para evaluar la bioequivalencia de dos productos se basa en el Mínimo Intérvalo de Confianza al nivel de probabilidad 90% (IC90%) para el cociente de las medias (Prueba/Referencia) del parámetro considerado. La decisión a favor de la bioequivalencia resulta de la inclusión del IC90% para el cociente µP/µR o la diferencia µP-µP de las medias poblacionales en el respectivo entorno de bioequivalencia, asumiendo un modelo multiplicativo o aditivo, respectivamente. En el primer caso se calcula la media geométrica (previa transformación logarítmica de los datos) a partir de los cocientes individuales. El entorno (rango) de bioequivalencia varía entre de 0.80 y 1.25 para el ABC0-48 y entre 0,70 y 1,43 para la Cmax (Según Deletti y col. 1992). Para el modelo aditivo se calcula la mediana y el rango (recorrido entre el máximo y mínimo valor). El entorno de bioequivalencia se expresa en términos de la diferencia absoluta, por ejemplo, en el caso del tmax se calcula ±20% horas de la media del parámetro para la formulación de referencia. Con el fin de evaluar el efecto de los diferentes factores (fór- Figura 1. Se muestran las curvas concentración vs. tiempo de una formulación de liberación inmediata de CBZ (Auration IR) y de la formulación desarrollada (Auratión CR). La curva de Auratión IR fue tomada de un estudio previo de la Unidad de Farmacología Clínica conducido en iguales condiciones experimentales que el presente. En estos sujetos el muestreo se prolongó hasta las 96 horas. BIOMEDICINA, 2006, 1 (2) ISSN: 1510-9747 mulas, períodos, sujetos, secuencias, etc.) que operan en el estudio, se utilizó un test de ANOVA factorial. Para los parámetros que se derivan de medidas de concentración como el ABC y la Cmax, se realizó transformación logarítmica de los datos crudos antes del análisis (8, 9). En el caso del tmax, la comparaciones estadísticas se computaron mediante el Wilcoxon Matched Pairs Test (STATISTICA® Microsoft). Se utilizaron parámetros estadísticos tales como media geométrica (MG), mediana, desvío estándar (SD), intérvalo de confianza al 90% (IC90%) rango, etc., para describir las variables fármacocinéticos de interés. Todas las rutinas de inferencia estadística del software fueron validados manualmente con datos de la literatura. Biodisponibilidad oral de formulaciones farmacéuticas de Carbamazepina y su metabolito en voluntarios sanos Susana Parrillo, Mónica Cedrés, Julio Benítez La Figura 1 muestra las curvas concentración vs. tiempo de una formulación de liberación inmediata de CBZ (Auration IR) y de la formulación de Auratión® CR. La curva de Aura- tión IR fue tomada de un estudio previo de nuestro laboratorio conducido en iguales condiciones experimentales que el presente excepto que el muestreo se continuó por 96 horas. Se pude apreciar a simple vista la diferencia en la velocidad de absorción de cada una de esas formulaciones. El Auratión IR no solo alcanza niveles plasmáticos máximos de mas del doble que la formulación CR (Cmax de Auratión CR = 2.47 ug/mL; Cmax de Auratión IR = 5.36 ug/mL), sino que además los alcanza mucho más tempranamente (10 horas vs. 24 horas para la formulación IR y CR, respectivamente). La Tabla II muestra los datos individuales de ABC0-48, Cmax, Tmax y T1/2e así como los respectivos promedios, el SD, el CV% y el IC95%. Es de destacar que la variabilidad interindividual de la Referencia es de casi el doble en relación a Auratión® CR para los parámetros ABC0-48 y Cmax (ver Tabla II). En el caso de la Tmax prácticamente no existen diferencias en la variabilidad, mientras que para la T1/2e la variabilidad es mayor para Auratión®. La T1/2e presenta una gran variabilidad y es algo mayor en este estudio ya que, como se dijo en la introducción, diversos autores han comunicado que los valores iniciales de la T1/2e para la CBZ son de 25 a 65 horas disminuyendo hasta 12 a 17 horas luego de administración crónica. Las formulaciones de CBZ CR comparadas entre si, presen- Figura 2. Curvas concentración plasmática de CBZ vs. tiempo para el producto de Referencia y el producto de prueba (Auratión® CR). Apréciese que ambas curvas están prácticamente superpuestas. Cada punto es la media aritmética de 12 concentraciones de CBZ y las barras verticales centradas en los puntos del producto de Referencia son los IC95%. Figura 3. Se pueden observar las curvas concentración vs. tiempo para el metabolito CBZ-10, 11-epóxido, para la Referencia y para Auratión® CR. Cada punto es la media aritmética de 12 concentraciones de 10,11-epóxiCBZ y las barras verticales centradas en los puntos del producto de Referencia son los IC95%. Registro de efectos adversos: La ocurrencia de efectos adversos se consigno en una planilla especialmente diseñada para tales efectos, cuando espontáneamente el voluntario las refirió o mediante preguntas neutras. Resultados 61 BIOMEDICINA, 2006, 1 (2) ISSN: 1510-9747 tan un perfil de concentraciones plasmáticas prácticamente idéntico (ver Figura 2). La fracción de la dosis absorbida es esencialmente la misma para ambos productos (son bioequivalentes). Esto queda demostrado por el análisis de bioequivalencia para el ABC0-48 [MG=0.98, IC90%=(0.92-1.03)], en el cual tanto la MG como el IC90% quedan incluidos entre los límites de bioequivalencia (0.80-1.25). El ANOVA factorial no muestra diferencias estadísticamente significativas para la variable “Fórmulas” (F=0.469; P=0.51, n.s.) ni “Periodos” (F=2.051, P=0.18, n.s.). El ANOVA muestra un efecto estadísticamente significativo de la variable “Sujetos” sobre la varianza (F=4.015, P=0.02). Para la Cmax también se pude concluir la bioequivalencia [MG=0.96, IC90%=(0.91-1.00)] entre los dos productos comparados. Ni las formulaciones (F=2.411, P=0.15, n.s.) ni los periodos (F=0.505, P=0.49, n.s.) alcanzan el nivel de significación estadística en el análisis de varianza. Por otra parte la varianza introducida por los individuos de investigación también en este caso es significativa (F=5.915, P=0.004), como era de esperar ya que la Cmax es más variable que el parámetro integrado ABC0-48. Las medianas de las Tmax son 36 y 24 horas para el producto Auratión® CR y de Referencia, respectivamente. El rango entre los valores extremos de Tmax es de 12 a 48 horas para ambas formulaciones. Las medias aritméticas de las Tmax de Auratión® CR y de la Referencia son 35 y 27 horas, respectivamente; mientras que el SD es 13.97 para Auratión® CR y 13.66 para la Referencia. Para evaluar si esta diferencia es estadísticamente significativa se corrió un test de Wilcoxon para muestras apareadas (Wilcoxon Matched Pairs Test) el cual dio el siguiente resultado T=5.00, Z=1.15 y P=0.25. Como se ve el test de Wilcoxon no alcanza el nivel de significación estadística (P<0.05) por lo cual concluimos que la diferencia entre las medianas de la Tmax de los productos en estudio no es estadísticamente significativa. Por último, en la Figura 3 se muestra las curvas concentración vs. tiempo para el metabolito 10, 11-epoxiCBZ, separadas por producto. También en este caso ambas formulaciones de CBZ se comportan esencialmente igual, el metabolito aumenta continuamente desde los primeros momentos luego de la ingesta del comprimidos hasta la última toma, 48 horas después. Es de destacar que, si bien la concentración en sangre de CBZ ya está decayendo en la muestra del segundo día, el metabolito muestra una marcada tendencia a continuar ascendiendo. Esto sería debido a que: a) a las 48 horas aun queda un porcentaje importante de la dosis en el medio interno (59% para 62 Evaluación Comparativa de la Biodisponibilidad Oral y del Metabolismo de Diferentes Formulaciones Farmacéuticas de Carbamazepina en Voluntarios Sanos Susana Parrillo Campiglia la Referencia y 66% para Auratión® CR) y, b) la autoinducción del metabolismo a nivel del sistema microsomal hepático acelera la biotransformación. Como se dijo en la introducción el CYP3A4 es la principal isoenzima de la familia de citocromos P450 involucrada en la hidroxilación de la CBZ para transformarla en su 10,11-epóxido. Muchos otros fármacos interaccionan con este citocromo para inducir o inhibir el metabolismo de la CBZ. En el presente estudio se les pidió a los voluntarios que se abstuvieran de tomar cualquier medicación que pudiera interactuar con la CBZ a nivel del citocromo CYP3A4. No se registraron efectos adversos neurotóxicos (ataxia, inestabilidad, visión borrosa, nistagmus, mareos, somnolencia, etc.) ni intolerancia digestiva durante el estudio, para ninguno de los dos productos. La presión arterial sistodiastólica y la frecuencia del pulso no sufrieron variaciones significativas por la exposición a los productos en estudio. Discusión y Conclusiones Las agencias regulatorias de países como Canadá, EE.UU., y Alemania requieren de estudios de biodisponibilidad “in vivo” para otorgar la licencia de comercialización a productos genéricos de CBZ. Esto se debe a las características de disolución, permeabilidad, estrecho margen terapéutico y amplio metabolismo por el sistema microsomal hepático que presenta este fármaco antiepiléptico (10). En el presente estudio, se ha confirmado la principal hipótesis planteada: las dos formulaciones de CBZ estudiadas son bioequivalentes, por lo cual, en las condiciones experimentales descritas, se puede concluir la intercambiabilidad entre ambos productos. También se ha demostrado que la formulación Auratión® CR presenta una velocidad de absorción y alcanza niveles pico en plasma, ostensiblemente menores que la antigua formulación de liberación inmediata, todo lo cual valida el desarrollo farmacotécnico del producto. Existen antecedentes de estudios realizados en nuestro país comparando la biodisponibilidad de fármacos que presentan dificultades de absorción y gran variabilidad interindividual en su farmacocinética (itraconazol) (11). También se ha estudiado el perfil metabolizador de fármacos de nuestra población confirmando una enorme variabilidad interindividual en la capacidad metabolizadora de nuestra población (12). Al igual que el itraconazol la CBZ se metaboliza predominantemente por el sistema CYP3A4 hepático, lo cual contribuiría a la variabilidad de los niveles plasmáticos del antiepiléptico. Como lo sugiere el estudio de Estevez y col. (11) BIOMEDICINA, 2006, 1 (2) ISSN: 1510-9747 en estos casos es importante incluir un estudio del perfil de niveles plasmáticos del metabolito, máxime cuando, como en el caso de la CBZ, este es activo y contribuye al efecto terapéutico final. Por último, ha quedado en evidencia en el presente estudio que el metabolito activo 10,11-epoxiCBZ tiene un comportamiento farmacocinético (y una variabilidad inter-individual) similar para ambos productos mostrando un perfil acumulativo ya en las primeras 48 horas post-administración de una dosis única. Esto es compatible con una incipiente autoinducción del metabolismo de la CBZ en el sistema microsomal hepático, ya con la primera dosis. Biodisponibilidad oral de formulaciones farmacéuticas de Carbamazepina y su metabolito en voluntarios sanos Susana Parrillo, Mónica Cedrés, Julio Benítez (Suppl. 1): S59-S62. 10.OMS. Serie de Informes Técnicos 863. “Comité de Expertos de la OMS en Especificaciones para las preparaciones farmacéuticas”. 34° informe. Organización Mundial de la Salud . Ginebra (1994). 11.Estevez FE, Ruiz S, Bellocq B, Leal C, Siri MT, del Campo MJ. Simultaneous itraconazole bioequivalence assessment and CYP3A4 phenotyping in South American Subjects. International Journal of Clinical Pharmacology and Therapeutics.(2005) 43, 2: 109-116. 12.Estevez FE, Giusti M, Parrillo S, Prando M. Variabilidad del metabolismo oxidativo de fármacos en la población Uruguaya. Rev Med Uruguay (1997) 13, 2: 93-100. Referencias bibliográficas 1. Goodman & Gilman. The Pharmacological Basis of Therapeutics. Chapter 21, “Drugs Effective in the Therapy of the Epilepsies”. James O. McNamara. 10th Edition: Joel G. Hardman, Lee E. Limbird. McGraw-Hill. Medical Publishing Division. New York, (2001). 2. Hoffman C, Zschiesche M, Franke G, et al.- A single and multiple dose bioavailability study with carbamazepine 400 mg retard tablets with reference to enzyme autoinduction an circadian time differences. International Journal of Clinical Pharmacology and Therapeutics (1997) 35, 11:496-503. 3. Arroyo S, Samder J. Carbamazepine in comparative trials. Neurology (1999) 53,6:772-780. 4. Yacobi A, Zlotnick S, Colaizzi H, et al. A multiple-dose safety an bioequivalence study of narrow therapeutic index drug: A case for carbamazepine . Clinical Pharmacology and Therapeutics (1999) 65, 4:389-394. 5. Estevez FE. Estudios de Bioequivalencia : Enfoque metodológico y aplicaciones prácticas en al evaluación de medicamentos genéricos. Rev Med Uruguay (2000) 16: 133-143. 6. Liu H, Delgado M, Iannaccone ST, Forman LJ, Eggers CM. Determination of total an free carbamazepine an the principal metabolites in serum by high-performance liquid chromatography with photodiode-array detection. Ther Drug Monit. (1993) 15, 4: 317-327. 7. Rowland M. & Tozer TN. Clinical Pharmacokinetics. Concepts and Applications Second Edition. Lea & Febiger. Philadelphia, London. (1989). 8. Schulz H-U, Steinijans VW. Striving for standards in bioquivalence assessment: a review. International Journal of Clinical Pharmacology, Therapy and Toxicology. (1992) 30, (Suppl. 1): S1-S6. 9. Diletti E, Hauschke D, Steinijans W. Sample size determination: Extended tables for the multiplicative model and bioequivalence ranges of 09 to 1.11 and 0.70 to 1.43. International Journal of Clinical Pharmacology, Therapy and Toxicology. (1992) 30, 63