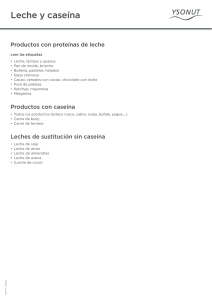
Composición Proteica y su Relación con las Variantes Genéticas A
Anuncio

UNIVERSIDAD AUSTRAL DE CHILE Facultad de Ciencias Agrarias Escuela de Ingeniería en Alimentos Composición Proteica y su Relación con las Variantes Genéticas A y B de κ-caseína y β-lactoglobulina en Leche de Vacas Frisón Negro Tesis presentada como parte de los requisitos para optar al grado de Licenciado en Ingeniería en Alimentos Jaime Andrés Kramm Vásquez Valdivia Chile 2003 PROFESOR PATROCINANTE Agradecimientos A mis padres por su amor, comprensión y estímulo durante mis años de estudio. A !a profesora Luz H. Molina, por su constante orientación y apoyo. A mis familiares, amigos y compañeros por su invaluable espíritu fraterno. A todos aquéllos que de una u otra forma colaboraron en la realización de esta tesis. I INDICE DE MATERIAS Capítulo Página 1 INTRODUCCION 1 2 REVISION BIBLIOGRAFICA 3 2.1 Composición básica de la leche 3 2.2 Proteínas 4 2.3 Estructura y característica de las proteínas de la leche 5 2.3.1 Caseína 8 2.3.1.1 Micela de caseína 9 2.3.1.2 Estabilidad de la caseína 10 2.3.2 Proteínas del suero 11 2.3.2.1 β-lactoglobulina 12 2.3.2.2 α-lactoalbúmina 13 2.4 Factores que influyen en la cantidad y composición de proteínas de la leche 13 2.4.1 Factores fisiológicos 14 2.4.2 Factores alimentarios 15 2.4.3 Factores climáticos 16 2.4.4 Factores genéticos 16 2.4.5 Factores zootécnicos 17 2.5 Polimorfismo genético de las proteínas de la leche 18 2.5.1 Polimorfismo de κ-caseína 22 2.5.2 Polimorfismo de β-lactoglobulina 23 2.5.3 Efecto del polimorfismo de κ-caseína y β-lactoglobulina en la leche 24 II 2.5.3.1 Producción de leche 24 2.5.3.2 Composición de la leche 25 2.5.3.3 Propiedades tecnológicas de la leche 29 2.6 Electroforesis de isoenfoque en la determinación de las 32 variantes genéticas 3 MATERIAL Y MÉTODO 34 3.1 Materiales 34 3.1.1 Obtención de muestras 34 3.1.2 Lugar del ensayo 34 3.1.3 Equipos utilizados 35 3.2 Muestras de leche y análisis 35 3.3 Metodología 36 3.3.1 Cuantificación de proteína total 36 3.3.2 Cuantificación de proteína del suero 37 3.3.3 Determinación del contenido de caseína 37 3.3.4 Determinación del número de caseína 38 3.3.5 Medición de la producción de leche 38 3.4 Preparación de muestras de leche para la determinación de variantes genéticas 38 3.4.1 Separación de κ-caseína 38 3.4.2 Separación de β-lactoglobulina 38 3.4.3 Determinación cuantitativa de proteínas de las muestras para electroforesis 38 3.5 Electroforesis de isoenfoque 39 3.5.1 Condiciones de la electroforesis 39 3.5.2 Estándares de proteínas 39 3.5.3 Preparación de las muestras 40 3.6 Densitometría 40 III 3.7 Análisis estadístico 40 4 PRESENTACION Y DISCUSION DE RESULTADOS 42 4.1 Identificación de variantes genéticas de κ-caseína y βlactoglobulina en leche de vacas Frisón Negro 42 4.1.1 Separación de κ-caseína y β-lactoglobulina 42 4.1.2 Electroforesis de κ-caseína y β-lactoglobulina 43 4.1.3 Expresión de las variantes genéticas de κ-caseína y β46 lactoglobulina 4.2 Variantes genéticas de κ-caseína y β-lactoglobulina en 46 vacas Frisón Negro 4.3 Composición proteica y producción de leche en vacas Frisón negro 48 4.4 Variantes genéticas, producción y composición de la leche 51 4.4.1 Variantes genéticas de κ-caseína, producción y composición proteica de la leche 4.4.1.1 Contenido de proteína total y variantes genéticas de κcaseína 4.4.1.2 53 53 Contenido de proteína del suero y variantes genéticas de κcaseína 54 4.4.1.3 Contenido de caseína y variantes genéticas de κ-caseína 55 4.4.1.4 Número de caseína y variantes genéticas de κ-caseína 56 4.4.1.5 Variantes genéticas de κ-caseína y producción de leche 57 4.4.2 Variantes genéticas de β-lactoglobulina, producción y composición proteica de la leche 4.4.2.1 Contenido de proteína total y variantes genéticas de βlactoglobulina 4.4.2.2 57 Contenido de proteína del suero y variantes genéticas de β- 58 IV lactoglobulina 4.4.2.3 59 Contenido de caseína y variantes genéticas de βlactoglobulina 4.4.2.4 Número de 59 caseína y variantes genéticas de β- lactoglobulina 4.4.2.5 Variantes genéticas de β-lactoglobulina y producción de leche 4.4.3 60 60 Interacción de variantes genéticas de κ-caseína y βlactoglobulina. 61 5 CONCLUSIONES 65 6 RESUMEN - SUMMARY 66 BIBLIOGRAFIA ANEXOS 68 76 V INDICE DE CUADROS Cuadro Página 1 Composición promedio de la leche de vaca. 2 Distribución cuantitativa de los principales componentes nitrogenados de la leche de vaca. 3 3 5 Composición aminoacídica (g/100g) de la proteína total, caseína y proteína del suero de la leche. 6 4 Composición de la leche de vaca para diferentes razas. 17 5 Distribución y propiedades de las principales proteínas de la leche. 6 Frecuencia alélica de las principales variantes genéticas de κ-caseína y β-lactoglobulina para diferentes razas bovinas. 7 23 Valores promedio de contenido proteico para fenotipos de κ-caseína. 9 21 Polimorfismo de variantes genéticas de κ-caseína y βlactoglobulina. 8 20 27 Resultados promedio de contenido proteico para fenotipos de β-lactoglobulina. 29 10 Muestreos y análisis 36 11 Variantes genéticas de κ-caseína y β-lactoglobulina determinadas en la leche de vaca Frisón Negro. 12 45 Frecuencia de variantes genéticas obtenidas en las vacas Frisón Negro del estudio. 47 13 Composición promedio de leche de vaca Frisón Negro. 49 14 Diferencias entre variantes genéticas de κ-caseína A y B, en relación al contenido de proteínas. (Promedio ± Error VI estándar) 15 53 Diferencias entre fenotipos de β-lactoglobulina AA y AB, en relación al contenido de proteínas. (Promedio ± Error estándar) 16 58 Valores de producción de leche y contenido proteico para combinaciones de variantes de κ-caseína lactoglobulina. (Promedio ± Error estándar) y β62 VII INDICE DE FIGURAS Figura 1 Página Electroforesis de isoenfoque para muestras de κ-caseína en vacas Frisón Negro 2 43 Electroforesis de isoenfoque para muestras de βlactoglobulina en vacas Frisón Negro 44 VIII INDICE DE ANEXOS Anexos Página 1 Encuesta de vacas Frisón Negro predio Sta. Rosa 77 2 Información de vacas Frisón Negro predio Sta. Rosa 78 3 Metodología de separación de proteína no caseínica según McGann et al. citado por PINTO et al. (1998) 4 Separación de κ-caseína de las muestras de leche para análisis electroforético 5 82 Curva de calibración para determinación proteica de acuerdo al método propuesto por LOWRY (1951) 8 81 Determinación de proteínas de acuerdo al método de LOWRY (1951) 7 80 Separación de β-lactoglobulina de las muestras de leche para análisis electroforético 6 79 84 Protocolo de electroforesis de isoenfoque en geles de poliacrilamida según CASANOVA (2001) 86 9 Concentración de κ-caseína en muestras semi-purificadas 88 10 Concentración de β-lactoglobulina en muestras preparadas para electroforesis 11 Volumen de muestras preparadas de κ-caseína utilizadas en cada electroforesis 12 90 92 Volumen de muestras preparadas de β-lactoglobulina utilizadas en cada electroforesis 94 13 Identificación de las variantes genéticas de κ-caseína 96 14 Identificación de las variantes genéticas de β-lactoglobulina 98 15 Densitogramas obtenidos en β-lactoglobulina de leche de IX vacas Frisón Negro 16 100 Densitogramas obtenidos en κ-caseína de leche de vacas 102 Frisón Negro 17 Resultados de contenido proteico para leche de vacas Frisón Negro 18 104 Valores F para análisis de varianzas en relación con la producción y composición proteica de la leche de vacas Frisón Negro 19 108 Interacción de variantes genéticas de κ-caseína y β– lactoglobulina e intervalos componentes en estudio. de significancia para 112 1 1. INTRODUCCION La constante evolución tecnológica y la creciente optimización de los procesos productivos a nivel mundial, no han estado ajenos a la industria láctea. Ésta, se ha desarrollado, intentando obtener mejor calidad y mayores rendimientos en la elaboración de sus productos. Así, en países industrializados, el uso eficiente de la leche como materia prima esta supeditada a su composición proteica y de materia grasa, existiendo gran interés en la manipulación de esta por medios biológicos para satisfacer los requerimientos de la industria láctea. En el caso de la industria quesera, el pago de leche por contenido de proteínas ya es una realidad, que va asociada a características técnicas y económicas importantes. El estudio de la leche a nivel composicional y su relación con el polimorfismo genético de las proteínas, permite conocer la incidencia de este último factor, expresado en diversas variantes genéticas, sobre la distribución de la composición proteica y la aptitud tecnológica de la leche. El interés en el estudio de las variantes genéticas en las proteínas κ caseína y β lactoglobulina obedece a la incidencia significativa que tienen estas en las propiedades de la leche. El incremento de las proteínas en la leche como materia prima, puede ser comercialmente beneficiosa pues aumenta el contenido de sólidos lácteos, permitiendo mejoras en el rendimiento en sectores como la industria quesera. El presente estudio tiene como objetivo general determinar el efecto de la expresión de las variantes genéticas de κ caseína y β lactoglobulina sobre el contenido proteico de la leche de 10 vacas Frisón Negro. 2 Los objetivos específicos del estudio son: - Identificar las variantes genéticas de κ caseína y β lactoglobulina en la leche de 10 vacas previamente caracterizada respecto a su edad y número de partos. - Determinar el contenido de proteína total, caseína, proteínas del suero y número de caseína en las muestras de leche. - Relacionar el contenido de proteína total, caseína, proteínas del suero y número de caseína de la leche de vacas individuales, con la presencia de una determinada variante genética. 3 2. REVISION BIBLIOGRAFICA 2.1 Composición básica de la leche Según ALAIS (1985), en la leche se pueden distinguir tres fases: la emulsión de materia grasa en forma globular, la suspensión de caseína ligada a las sales minerales y la solución o fase hídrica, que forma el medio más voluminoso. La composición de la leche puede ser afectada por factores de variación como: clima, aspectos genéticos, etapa fisiológica de la vaca, nivel de alimentación y aspectos sanitarios de la mama, por lo tanto la proporción en la que se encuentran los distintos componentes en la leche no será constante. (ALAIS, 1985; CASADO y GARCIA, 1985) La composición media de la leche en sus elementos fundamentales, según lo reportados por diversos autores, se presenta en el CUADRO 1. CUADRO 1 Composición promedio de la leche de vaca. Composición (g/L) Componente 1 2 3 Agua 905 866 871 Glúcidos 49 50 46 Lípidos 35 41 40 Proteínas 34 36 32,5 Sales 9 7 7 Sólidos totales 127 Sólidos no grasos 92 89 FUENTE: (1) ALAIS (1985); (2) FENNEMA (1993); (3) WALSTRA et al. (1999). Como se aprecia en el cuadro anterior, existen variaciones en los componentes de la leche en relación a los distintos autores. Los valores presentados para el contenido de carbohidratos por ALAIS (1985) y FENNEMA (1993) son similares, 4 a diferencia de WALSTRA et al. (1999) que muestra un valor menor. Respecto al contenido promedio de materia grasa, se puede apreciar que este varía entre 35 y 41 g/L. En cambio, el contenido de proteína varía entre 32,5 y 36 g/L. Las diferencias en la composición según los distintos autores se originan debido a las diversas razas utilizadas en los respectivos estudios. Como lo muestra el CUADRO 1, entre los constituyentes de la leche se encuentra el agua, lípidos, carbohidratos, sales y proteínas. Estas últimas de especial relevancia en relación al tema tratado. 2.2 Proteínas De acuerdo a FENNEMA (1993), la leche contiene entre 30 – 35 g/L de proteína y corresponde al 95% del nitrógeno total de la leche. En la leche, según ALAIS (1985), es posible distinguir tres grupos de proteínas: caseína, proteínas del lactosuero y proteosas-peptonas. La caseína representa el 80 % de las proteínas de la leche y está constituida fundamentalmente por un grupo de proteínas, entre las que se encuentran: α S1, α S2, β, κ caseínas. Se caracterizan por coagular bajo acción del cuajo o por acidificación a pH cercano a 4,6. Estas proteínas, forman un complejo singular hidratado que contiene fosfato de calcio denominado micela. Estos complejos varían en tamaño desde 30 a 300 nm de diámetro (FENNEMA, 1993; CASADO y GARCIA, 1985; ALAIS, 1985). Las proteínas del suero comprenden un grupo más heterogéneo y complejo desde el punto de vista composicional. Se caracterizan por no precipitar por efecto de la acidificación, pero si cuando se aplica calor. Las principales proteínas presentes en el suero son: α- lactoalbúmina, β- Lactoglobulina, seroalbúminas, inmunoglobulinas y proteínas menores. Las proteínas menores, 5 agrupan un cierto número de proteínas que se encuentran en pequeña cantidad, representando menos de un 5% de las proteínas del suero. Entre ellas destacan la transferrina, lactolina y prote ínas de la membrana del glóbulo graso (CASADO y GARCIA,1985; VEYSSEYRE, 1980). En el CUADRO 2 se pueden apreciar las proporciones medias de las sustancias nitrogenadas en la leche de vaca, apreciándose que las caseínas representan una mayor proporción de las proteínas totales de la leche, a diferencia de las proteínas del suero. CUADRO 2 Distribución cuantitativa de los principales componentes nitrogenados de la leche de vaca. Proporciones medias G/L Relativas Prótidos totales 32 100 Proteínas Caseína isoeléctrica 25 78 100 - Caseína α S1 9,0 36 2,5 10 - Caseína α S2 8,5 34 - Caseína β 3,2 13 - Caseína κ 1,75 7 - Diversas Proteínas del suero 5,4 17 100 - Albúminas β-Lactoglobulina 2,7 50 1,2 22 α-Lactoalbúmina 0,25 5 Seroalbúmina 0,65 12 - Globulinas inmunes 0,6 10 - Proteosas-peptonas Sustancias nitrogenadas no proteicas 1,6 5 FUENTE: ALAIS (1985). 2.3 Estructura y características de las proteínas de la leche Las proteínas son polímeros de aminoácidos que pueden contener algunos grupos químicos adicionales (AMIOT, 1991). 6 Los aminoácidos que componen las proteínas de la leche son 19, entre los cuales algunos son hidrocarburos alifáticos y otros tienen grupos funcionales adicionales (AMIOT, 1991). Las propiedades de las proteínas dependen de las proporciones de aminoácidos pertenecientes a diferentes categorías, según el tipo de cadena lateral. Se pueden encontrar grupos alcohol, sulfhidrilo, básicos, ácidos, amido, aromático. Estas funciones darán origen a las diversas propiedades que caracterizan y diferencian a las distintas proteínas (ALAIS, 1985; AMIOT, 1991). En el CUADRO 3, se puede observar la composición de aminoácidos de las proteínas de la leche. CUADRO 3 Composición aminoacídica (g/100 g) de la proteína total, caseína y proteínas del suero de la leche. Proteínas del Aminoácido Proteína total Caseína suero Alanina 3,7 3,1 5,5 Arginina 3,6 4,1 3,3 Acido aspártico 8,2 7,0 11,0 Cistina 0,8 0,3 3,0 Acido glutámico 22,8 23,4 15,5 Glicina 2,2 2,1 3,5 Histidina 2,8 3,0 2,4 Isoleucina 6,2 5,7 7,0 Leucina 10,4 10,5 11,8 Lisina 8,3 8,2 9,6 Metionina 2,9 3,0 2,4 Fenilalanina 5,3 5,1 4,2 Prolina 10,2 12,0 4,4 Serina 5,8 5,5 5,5 Treonina 4,8 4,4 8,5 Triptófano 1,5 1,5 2,1 Tirosina 5,4 6,1 4,2 Valina 6,8 7,0 7,5 FUENTE: BELITZ y GROSCH (1997). 7 La secuencia y la frecuencia de los aminoácidos en una cadena polipeptídica, el número de cadenas por molécula y la disposición espacial de esta son características de cada proteína y está supeditada a la información codificada en los genes (AMIOT, 1991; STRYER, 1995). Por otro lado, según la configuración que presente la molécula de proteína hay numerosas posibilidades para enlaces secundarios y terciarios, tanto dentro de una misma molécula como entre distintas moléculas proteicas. Lo anterior es posible por la existencia de enlaces sulfurados y puentes de hidrógeno, que permiten generar una conformación estructural regular (AMIOT, 1991). Las proteínas tienen una estructura definida que está dividida en cuatro niveles: - Estructura primaria, viene dada por la secuencia de diferentes aminoácidos la que es determinada genéticamente (WALSTRA et al., 1999; FOX y McSWEENEY, 1998). Existen variantes genéticas de las caseínas en algunas razas lecheras que se generan, por lo habitual, debido a la sustitución de algunos aminoácidos en la secuencia de la estructura primaria (BADUI, 1984) - Estructura secundaria, esta relacionada con el ordenamiento espacial de las cadenas de aminoácidos. Aquí se puede encontrar estructuras como hélice α y hojas plegadas β, que se estabilizan por puentes de hidrógeno ( ALAIS, 1985). - Estructura terciaria, se refiere al ordenamiento espacial de residuos de aminoácidos alejados en la secuencia lineal que es asegurada vía enlaces disulfuro entre restos de cisteína o enlaces hidrófobos por proyección hacia el interior de cadenas hidrófobas de la proteína, como en el caso de la caseína (ALAIS, 1985; STRYER, 1995; COULTATE, 1998). 8 - Estructura cuaternaria, referida a proteínas que poseen más de una cadena polipeptídica o subunidad. Estableciendo el ordenamiento espacial de las subunidades y la naturaleza de sus interacciones (STRYER, 1995). En cuanto a la estructura espacial de las proteínas, las caseínas presentan una estructura laxa y sus cadenas peptídicas se enredan conservando espacios para fijar el fosfato cálcico y permitir la entrada de las proteasas. Respecto a las proteínas del suero, estas poseen una estructura circular compacta que impide el ingreso de iones o enzimas en la estructura nativa. (ALAIS, 1985) 2.3.1 Caseína. Las caseínas son un complejo de proteínas fosforados presentes en la leche como largas partículas coloidales o micelas que contienen cantidades apreciables de calcio, fosfato y pequeñas cantidades de magnesio y citrato. Sus diámetros fluctúan entre 30 – 300 nm, contienen un 92% de proteínas, compuesta por α S1, α S2, β y κ- caseína y un 8% de constituyentes inorgánicos, esencialmente fosfato cálcico. Constituye la parte nitrogenada más característica de la leche y precipitan solo cuando se acidifica la leche a pH igual a 4.6 (WEBB et al., 1980; ALAIS, 1985; FENNEMA, 1993). La estructura primaria de todas las caseínas tiene residuos polares y apolares distribuidos desuniformemente, lo que genera regiones hidrofílicas e hidrófobas localizadas. Un alto contenido en aminoácidos apolares, en especial prolina, establece una mínima estructura secundaria y terciaria para estas proteínas (FOX y McSWEENEY, 1998). La caseína puede ser precipitada por diversos agentes químicos como ácidos, alcohol, enzima Lab o cuajo y metales pesados. Existen relaciones entre el calor y el ácido en la precipitación de la caseína siendo esta inversamente proporcional; a mayor acidez menor temperatura es requerida para la coagulación. Por otro lado, el alcohol y la temperatura, por separado, actúan 9 como agentes deshidratantes de la caseína generando así la precipitación de ésta (ALAIS, 1985). Dado que la caseína presenta un carácter anfótero, puede formar sales o caseinatos. Estos últimos son de gran interés ya que la caseína se encuentra en la forma de caseinato cálcico, que a su vez adsorbe en sus micelas a las de fosfato cálcico, formando el complejo conocido como fosfocaseinato cálcico (CASADO y GARCIA, 1985). Las características de las micelas de caseína tienen gran influencia en la conducta de la leche y los productos lácteos durante el procesamiento industrial, debido a lo anterior, las micelas han sido estudiadas en cuanto a su estructura y propiedades permitiendo mejoras en los diversos procesos tecnológicos. (FENNEMA,1993). 2.3.1.1 Micela de caseína. Un 95 % de las caseínas se encuentran en la leche polimerizado en micelas esféricas de 30 a 300 nm de diámetro y el porcentaje restante existe como monómero soluble (AMIOT, 1991; FOX y McSWEENEY, 1998). Las micelas contienen fundamentalmente tres fracciones de caseína: α S, β y κ. Para BADUI (1984), estas tres fracciones de polímeros forman complejos micelares en presencia de iones de calcio encontrándose en una proporción de 5:3:1, respectivamente. A su vez, WONG (1995), señalan que α S caseína comprende entre 50 - 55% de la caseína total, respecto a β y κ-caseína estas representarían el 30% y 15% de la caseína total. La proporción de κ-caseína, varía inversamente con el tamaño de la micela y βcaseína esta en relación directa con él. Existiendo la posibilidad de que κ- 10 caseína sustituya en parte a β-caseína en la micela (BADUI, 1984; AMIOT, 1991). La micela de caseína está formada por submicelas que están constituídas por moléculas de α, β y κ-caseína. La asociación de estas moléculas se produce por interacción hidrófoba de las partes no polares de las cadenas polipeptídicas, dando origen a una submicela que posee un núcleo hidrófobo, lugar donde se ubican las partes apolares de todas las caseínas; este núcleo esta rodeado de una capa polar fuertemente cargada rica en agrupaciones fosfóricas de α y βcaseína. La κ-caseína poco fosforilada, muy polar e incapaz de fijar calcio se ubica formando una especie de casquete (PRIMO, 1997; COULTATE, 1998). Los enlaces entre las submicelas resulta de una interacción electrostática entre los grupos fosfatos de α-caseína y β-caseína con los iones calcio, uniendo así a las submicelas directamente o en cadenas en donde se incorpora fosfato y citrato. La agregación de submicelas se producirá hasta que la superficie de la micela se encuentre rodeada de κ-caseína, generando una repulsión estérica (BELITZ y GROSCH, 1997; COULTATE, 1998). La interacción de κ-caseína con las fracciones de α S y β-caseína, genera que todo el complejo formado sea estable y no precipite en presencia de iones calcio presentes en la leche en pequeña proporción (BADUI, 1984). 2.3.1.2 Estabilidad de la caseína. Ésta se debe esencialmente a cargas electrostáticas y a la hidratación, además las caseínas poseen gran cantidad de aminoácidos no polares que originan enlaces hidrófobos que favorecen la estabilidad del complejo micelar (BADUI, 1984; AMIOT, 1991). En la leche, la micela de caseína tiene carga neta negativa, ya que debido al pH (6,7) predominan los grupos ácidos sobre los aminos. La existencia de cargas 11 eléctricas iguales genera repulsión y evita la coalescencia entre las micelas. Basta neutralizar estas cargas con cargas positivas, iones H+ o cationes de sales, para provocar la aglomeración de las micelas (VEYSSEYRE, 1980; BADUI, 1984; AMIOT, 1991). El fenómeno anterior se explica, por la existencia en abundancia de aminoácidos diácidos (ac. glutámico y aspártico), fosfoserina y ácido siálico en el caso de κ- caseína (VEYSSEYRE, 1980). BELITZ y GROSCH (1997), mencionan que el ácido aspártico y el ácido glutámico corresponden respectivamente, a un 7% y 23,4% de la caseína. Esto puede ser observado en el CUADRO 3. También, existe una estrecha afinidad entre el agua y las proteínas, explicado sobre la base de la existencia de fuerzas electrostáticas opuestas entre las micelas y los grupos polares de la molécula de agua. Esta agua ligada, reduce la tensión superficial y se opone a fuerzas de cohesión (AMIOT, 1991). 2.3.2 Proteínas del suero. Estas proteínas presentan una estructura globular compacta, con una distribución bastante uniforme de residuos no polares polares cargados. Razón por la que estas proteínas se pliegan intramolecularmente, ocultando los grupos hidrófobos de las cadenas polipeptídicas (FENNEMA, 1993; WALSTRA et al., 1999). Las proteínas del suero tienen una estructura compacta, son solubles en un intervalo de pH muy amplio y en estado nativo no se asocian con las caseínas. Son un grupo heterogéneo y existen ocho fracciones distintas, siendo las más importantes: β-lactoglobulina, α-lactoalbúmina, inmunoglobulinas, albúmina bovina y proteosa-peptona. Estas proteínas son termosensibles y se 12 desnaturalizan por acción del calor a temperaturas mayores a los tratamientos de pasterización (BADUI, 1984; AMIOT, 1991). Las proteínas del suero están estabilizadas principalmente por un mecanismo de agua de hidratación. En general, estas proteínas son muy sensibles al calor y en menor grado a la acción del ácido, debido al efecto deshidratante de estos agentes (ALAIS, 1985). Cuantitativamente, las proteínas del suero representan el 20% de las proteínas totales y tienen un importante valor nutritivo, ya que posee más aminoácidos esenciales que las caseínas. Además, estas proteínas no quedan retenidas en los quesos normales, ya que no coagulan por acción del cuajo existiendo interés por recuperarlas a escala industrial (AMIOT, 1991). 2.3.2.1 β -lactoglobulina. Es la proteína más abundante en el lactosuero de la leche de vaca y la mayor fuente de grupos sulfhidrilos (-SH) de la leche. Se caracteriza por ser una molécula muy compacta, dado su naturaleza hidrofóbica, cuya cadena esta fuertemente plegada (VEYSSEYRE, 1980; WALSTRA et al., 1999). La β-lactoglobulina, no esta ligada a otras fracciones proteicas, pero al calentar la leche forma un complejo con κ-caseína. Este complejo es estable y se produce mediante un puente disulfuro (ALAIS, 1985). Esta proteína presenta polimorfismo genético, existiendo a lo menos cuatro variantes distintas: A, B, C y D (AMIOT, 1991; BELITZ y GROSCH, 1997). FOX y McSWEENEY (1998), también señalan que β-lactoglobulina presenta cuatro variantes (A, B, C y D), existiendo una quinta variante detectada en estudios con ganado lechero australiano. 13 Por su parte, EIGEL et al. (1984), mencionan que β-lactoglobulina presenta siete variantes genéticas (A, B, C, D, E, F y G), de las cuales solo A, B, C y D se presentan en ganados lecheros occidentales. 2.3.2.2 α -lactoalbúmina. Ésta es una proteína asociada al complejo lactosa sintetasa y es la segunda en concentración luego de la β-lactoglobulina. Se caracteriza por ser una molécula esférica y compacta, no posee grupos sulfhidrilos libres aunque el contenido en cistina es elevado. Además, presenta una gran proporción de triptófano ( WEBB et al., 1980; WALSTRA et al., 1999). 2.4 Factores que influyen en la cantidad y composición de proteínas de la leche La cantidad y composición de la leche sufre variaciones importantes en función de diversos factores. Estos actúan sobre la composición, en conjunto, y no de manera aislada (ALAIS, 1985; CASADO y GARCIA, 1985; WALSTRA et al., 1999). Según Mahieu; citado por CASADO y GARCIA (1985), dentro de los factores de variación de la composición de la leche, el 36% de ellos están ligados al animal y son caracteres hereditarios y alrededor del 60% se deben al medio en que vive la vaca. Para ALAIS (1985), los principales factores de variación son: - Factores fisiológicos: desarrollo durante la lactancia. - Factores alimentarios: aspectos relacionados a las raciones alimenticias. - Factores climáticos: estación, temperatura y humedad. 14 - Factores genéticos: razas, herencia, selección. - Factores zootécnicos: condiciones de ordeño. Estos factores pueden ser clasificados en dos grupos, unos dependientes del animal (factores genéticos, fisiológicos) y otros no dependientes de él. En los últimos se encuentran factores del medio que rodean al animal como: alimentación, época de parto, clima y ordeño (CASADO y GARCIA, 1985). Por su parte, KROEKER et al. (1985), menciona que los principales factores que afectan el contenido de proteína total y caseína son: la estacionalidad, la etapa de lactancia, edad de la vaca, recuento de células somáticas y las variantes genéticas de las caseínas. Por otro lado, Feagan citado por NG KWAI HANG et al. (1982), señala que los factores que pueden influir en la composición de la leche son: raza del animal, nutrición, manejo y estado sanitario. Respecto de los distintos factores de variación y su efecto en el contenido y composición de proteínas de la leche, diversos autores mencionan lo siguiente. 2.4.1 Factores fisiológicos. Los distintos periodos de la etapa de lactancia tienen influencia sobre la cantidad y composición de la leche, verificándose una modificación en la composición durante la lactancia. La concentración de grasas y proteínas en la leche decrece durante el primer mes de lactancia, para luego ir aumentando progresivamente hasta el final de ésta. Esto se debe a que la producción de leche disminuye de manera significativa, generándose un enriquecimiento de la leche (CASADO y GARCIA, 1985). El ciclo de lactancia no se mantiene de manera invariable durante la vida del animal, obteniéndose la máxima producción de leche entre el tercer y quinto 15 parto para luego decrecer lentamente según el animal. (ALAIS, 1985; CASADO y GARCIA, 1985) A su vez, NG KWAI HANG et al. (1982), señalan que factores como la edad de la vaca y etapa de lactancia contribuyen significativamente en las variaciones en la composición de proteína total, proteína del suero, caseína y la proporción de caseína en la proteína de la leche. KROEKER et al. (1985), señalan que durante los dos primeros meses de lactancia, el porcentaje de α S-caseína decrece vertiginosamente con un incremento recíproco del porcentaje de β-caseína. Posterior a este período, estas dos fracciones proteicas se mantienen relativamente constantes. Para autores como De Peters y Cant; citados por LATRILLE (1993), los cambios en la composición de la leche por efecto del estado en la lactancia, son mínimos. 2.4.2 Factores alimentarios. Según CASADO y GARCIA (1985), la síntesis de proteínas en la glándula mamaria se realiza por el aporte de aminoácidos provenientes básicamente de dos fuentes: aminoácidos provenientes de la dieta no degradables y aminoácidos sintetizados por la flora microbiana del rumen. Los aspectos fundamentales de la alimentación que influyen en el suministro de aminoácidos en la glándula mamaria son: el tipo de proteína presente, la energía disponible y la composición de la ración. Dietas ricas en energía con un aporte de proteína y carbohidratos solubles adecuado influyen positivamente sobre el contenido en proteínas sintetizadas en la glándula mamaria, lo que explica las variaciones por el cambio de régimen alimenticio (ALAIS, 1985; DE PETERS y FERGUSON, 1992). 16 2.4.3 Factores climáticos. Aquí existen una serie de factores variables que actúan de manera conjunta como: estación, temperatura, alimentación, período de lactancia. ALAIS (1985) y CASADO y GARCIA (1985), mencionan que a mayor temperatura se observan cambios en la composición de la leche y se verifica una disminución de la cantidad de proteínas, lactosa y extracto seco total. Esto también es ratificado por DE PETERS y FERGUSON (1992), los que señalan que a altas temperaturas ambientales se reduce el contenido de proteína total de la leche. Así mismo, a un estado de lactancia constante la concentración de materia grasa y proteína de la leche son mayores en invierno y menores en verano presentándose la situación inversa para la producción diaria de leche (ALAIS, 1985; Coulon y Remond, citados por LATRILLE, 1993 ). 2.4.4 Factores genéticos. Es posible encontrar diferencias en la composición de la leche entre razas bovinas existentes, y también hay diferencias entre vacas individuales de una misma raza. Estas diferencias son preponderantes ya que en relación con los proteínas y materia grasa de la leche, constituyen un factor que predispone a favor de la determinación genética de estos caracteres (ALAIS, 1985; BOLAND y HILL, 2001). En el CUADRO 4, se puede apreciar la composición de la leche para diversas razas de ganado lechero. Las variaciones existentes entre las razas y las diferencias en cuanto a la relación proteína/grasa y N° de caseína, son más favorables para la raza Montbeliarde que para las otras tres razas presentadas. Interesante es lo que ocurre con la raza Holstein, la que posee el menor valor de proteína por 100 g, pero presenta un N° de caseína cercano a la raza 17 Normanda, lo que permite inferir que gran parte de la proteína presente es caseína. CUADRO 4 Composición de la leche de vaca para diferentes razas. Grasa g/100g Proteína g/100g Proteína/grasa Frisona 3,79 3,06 0,81 Holstein 3,65 3,01 0,82 Normanda 4,10 3,31 0,81 Montbeliarde 3,60 3,15 0,86 FUENTE: Remond, citado por CASADO y GARCIA (1985). N° de caseína 81,4 81,7 81,8 82,2 Además, dentro de cada familia de caseínas (α, β y κ) existen variantes genéticas que se han asociado a la leche con mejores propiedades para su elaboración. Es así, el caso de κ-caseína en la que existen dos variantes (A y B) y donde la variante B ha sido asociada a una mayor producción de proteína láctea. Esta variante esta presente con mayor frecuencia en la raza Jersey, comparado con la Holstein – Friesian (McLEAN et al., 1984; VAN EENENNAAM y MEDRANO, 1991). En relación a lo anterior, es posible gracias a técnicas de biología molecular, seleccionar reproductores por alelos específicos permitiendo el aumento de la frecuencia de estos, en razas en las que casi no están presentes (LATRILLE, 1993). 2.4.5 Factores zootécnicos. El ordeño es un factor que puede cambiar la composición de la leche en un momento determinado, pero no la cantidad total de cada componente producida a lo largo del día (CASADO y GARCIA, 1985). Durante el ordeño, el contenido de materia grasa aumenta progresivamente, pero a su vez disminuye los contenidos de proteínas, lactosa y sales minerales (CASADO y GARCIA, 1985; WALSTRA et al., 1999). 18 Un ordeño completo es vital para el mantenimiento de una buena producción, ya que tras un ordeño incompleto la leche que queda en la mama tiene un efecto inhibidor sobre la secreción (ALAIS, 1985). 2.5 Polimorfismo genético de las proteínas de la leche En los tejidos animales es posible encontrar proteínas semejantes entre sí por su composición, peso molecular y propiedades. Estas representan varias formas genéticas de una misma proteína, es decir, se trata de variantes cuya síntesis esta comandada por un gen en particular. La existencia de estas variantes para una misma proteína, dentro de una población, es lo que se conoce como polimorfismo (ALAIS, 1985; LEHNINGER y NELSON, 1995). La amplia heterogeneidad de las proteínas lácteas, se debe a que son producto de genes autosomales, alélicos, codominantes, que transmiten el carácter desde los padres por herencia mendeliana simple (Aschaffenburg citado por GONZALEZ de LLANO 1990; FELMER y BUTENDIECK, 1998). Las variantes de una proteína se diferencia solo por mínimas variaciones en su composición, a menudo se trata de la sustitución de uno o dos aminoácidos en la cadena peptídica. En ocasiones existe una delección, o sea, ausencia de un pedazo de la cadena. La existencia de estas variaciones genera leves diferencias en las propiedades fisicoquímicas de las proteínas como: propiedades eléctricas, solubilidad y propiedades asociativas. Existen, por ejemplo, diferencias en la carga neta de la molécula lo que permite identificar las variantes vía técnicas de separación como la electroforesis (ALAIS, 1985; LEHNINGER y NELSON, 1995). Las variantes genéticas se designan por letras (A, B, C, D), pudiendo existir individuos homocigotos y heterocigotos, los que pueden presentar una variante 19 (AA, BB) o una mezcla de ellas (AB, AC, BC), respectivamente. En las especies bovinas la frecuencia con la que se presentan estas variantes esta influenciada por la raza (ALAIS, 1985). La existencia de formas genéticas determinadas, con propiedades distintas y en proporción variable en la leche, puede ser la causa esencial de las diferencias que se observan en el curso de los tratamientos industriales a los que se somete la leche (ALAIS, 1985; Allmere et al. citados por JAKOB y PUHAN, 1995). Según BELITZ y GROSCH (1997), algunas de las variantes genéticas predominan en especies bovinas asociadas a algunas zonas geográficas, tal es el caso de la variante C de α S1-caseína que se encuentra mayoritariamente en la India asociada a la especie Bos indicus. En relación a lo anterior, GONZALEZ de LLANO (1990) menciona que las variante genéticas no aparecen aleatoriamente ni con la misma frecuencia, aun cuando algunas son variantes universales, otras son exclusivas de ciertas razas. El CUADRO 5, presenta las principales proteínas de la leche, sus variantes y algunas de sus propiedades relevantes como: peso molecular y punto isoelectrico. Como se puede apreciar, para cada proteína presente en la leche existen a lo menos tres variantes genéticas identificadas, cada una con un punto isoelectrico diferente. Además, el peso molecular entre las variantes genéticas de cada proteína difiere en un pequeño rango debido principalmente a la sustitución de algunos aminoácidos en la cadena primaria. Existen ciertas diferencias entre autores, en cuanto al punto isoelectrico de las variantes, que por lo general se deben a técnicas de determinación diferentes. 20 CUADRO 5 Distribución y propiedades de las principales proteínas de la leche. Variantes genéticas Peso molecular pI Caseína α S1 – caseína Contenido g/L 27,2 12 – 15 A B C D E 22.068 23.614 23.542 23.724 23.542 .... 4,44 – 4,76 (2) .... .... 4,2 – 4,6(2) α S2 – caseína 3–4 β - caseína 9 – 11 κ - caseína 2–4 A B C D A1 A2 A3 B C D E A B C E 25.230 .... .... .... 24.023 23.983 23.974 24.092 23.944 23.944 23.982 19.039 19.007 .... .... .... .... .... .... 5,3(1) 4,83 – 5,07 (2) .... .... .... .... .... 5.66(4); 7,1(3) 5,88(4); 7,3(3) 3,7 – 4,2(1) .... Proteínas del suero β - lactoglobulina 2–4 A B C D E F G A B C 18.363 18.277 18.286 18.276 18.205 18.243 18.223 14.147 14.175 .... 5,13(1) ; 5,3(2) 5,13(2) .... .... .... .... .... 5,1(1) .... .... Componente α - lactoalbúmina 0,6 – 1,7 FUENTE: (1) ATHERTON y NEWLANDER (1977); (2) EIGEL et al. (1984); (3) ADDEO et al. (1983); (4) Di LUCCIA et al. (1988). En el CUADRO 6 es posible observar la frecuencia en la expresión de las principales variantes genéticas de κ-caseína y β-lactoglobulina, según diversos autores, en distintas razas bovinas. 21 CUADRO 6 Frecuencia alélica de las principales variantes genéticas de κcaseína y β -lactoglobulina para diferentes razas bovinas. κ-caseína Raza A β-lactoglobulina B (4) C (4) A B (4) Ayrshire (NZ) 0,797 0,203 - 0,297 0,703(4) Freisian (NZ) 0,826(4) 0,174(4) - 0,487(4) 0,513(4) Frisón (US) 0,850(2) 0,150(2) - 0,500(2) 0,500(2) Jersey (NZ) 0,519(4) 0,481(4) - 0,316(4) 0,684(4) Holstein (Canadá) 0,744(1) 0,256(1) - 0,387(1) 0,613(1) Holstein (Hungría) 0,704(5) 0,230(5) 0,066(5) 0,453(5) 0,547(5) Holstein – Freisian (US) 0,750(3) 0,250(3) - - - FUENTE: (1) NG KWAI HANG et al. (1984); (2) Aschaffenburg citado por ALAIS (1985); (3) GONZALEZ de LLANO (1990); (4) WINKELMAN y WICKHAM (1997); (5) BARANYI et al. (1997). En relación al cuadro anterior, es importante señalar, que las diferencias en las frecuencias alélicas respecto a una raza en particular, se deben probablemente a variaciones en el tamaño muestreal de la investigación, o bien, a causas inherentes al animal como pureza de las razas o cruza de éstas que harán variar la frecuencia (NG KWAI HANG, 1997). Por su parte, WINKELMAN y WICKHAM (1997), estudiando las variantes genéticas de las proteínas lácteas en ganado lechero Neozelandés, encontraron que la variante A de κ-caseína predomina sobre el alelo B, y es encontrado con mayor frecuencia en la raza Friesian. Además, para βlactoglobulina, establecieron que la variante B de esta proteína predominaba sobre la variante A, presentándose con mayor frecuencia en la raza Ayrshire. Asociaciones similares han sido dilucidadas por BARANYI et al. (1997), quienes trabajaron con ganado lechero húngaro, reportando predominancia de la variante A para κ-caseína y la variante B para β-lactoglobulina en la mayoría 22 de las razas estudiadas. La excepción fue la raza Friesian en la que se presentó un ligero predominio de la variante B de κ-caseína. DELACROIX - BUCHET et al. (1993), señalan que en estudios con ganado lechero francés la variante C de κ - caseína esta presente solo en la raza Tarentaise. Por otro lado, ALAIS (1985), señala que una variante genética específica se expresa con mayor frecuencia en algunas razas bovinas, por ejemplo, respecto a β-caseína, el gen A es mucho mas frecuente en razas como: Ayshire, Shorthorn y Friesian. En cambio, el gen C es muy poco frecuente y se encuentra solo en algunas razas como Guernsey. Buchberger citado por JAKOB y PUHAN (1995), señala que la variante C de β caseína esta presente en muy baja frecuencia (<0,06) y se encuentra en ganados lecheros franceses como: Tarantaise y Normande. El mismo autor, menciona que las variantes C y D de β-lactoglobulina no son frecuentes (<0.05) encontrándose en ganado Simmental ruso y en ganado Montbeliarde francés. 2.5.1 Polimorfismo de κ caseína. Posee 169 residuos de aminoácidos y un peso molecular estimado de 19.000 dalton (BELITZ y GROSCH, 1997). La κ-caseína, difiere de las otras caseínas existentes, por tener dos residuos de cisteína que pueden formar puentes disulfuro intermoleculares y 2/3 de la molécula contiene grupos carbohidratos (WALSTRA et al., 1999). Existe comúnmente 4 variantes genéticas de κ-caseína: A, B, C, E. Para el caso de la especie Bos Taurus, predominan esencialmente dos variantes genéticas: A y B. Las diferencias entre estas, se basan en la sustitución en la cadena aminoacídica de treonina por isoleucina en la posición 136 y un residuo de 23 ácido aspártico por alanina en la posición 148 (GONZALEZ de LLANO , 1990; BELITZ y GROSCH, 1997). 2.5.2 Polimorfismo de β lactoglobulina. β-lactoglobulina, se encuentra en el suero y es una proteína de 162 aminoácidos con un peso molecular estimado de 18.300 dalton. En condiciones de pH de la leche, forma un dímero, con dos unidades monoméricas iguales (FOX y McSWEENEY, 1998). Para β-lactoglobulina existen 4 variantes genéticas: A, B, C y D. Teniendo sustituciones en las posiciones 45, 59, 64, 118, 158 (BELITZ y GROSCH, 1997). En el CUADRO 7, se pueden apreciar los lugares en los que se encuentran las sustituciones aminoacídicas en la estructura primaria de las proteínas κ-caseína y β-lactoglobulina. Como se puede apreciar en el cuadro siguiente, las variantes originadas para ambas proteínas se deben a la sustitución de uno o mas aminoácidos en la estructura primaria, a diferencia de α S-caseínas y β-caseínas que presentan delecciones en sus respectivas estructuras. Polimorfismo de variantes genéticas de κ-caseína y β lactoglobulina. Proteína Variante Posición de las sustituciones κ-caseína 136 148 A Thr Asp B Ile Ala β-lactoglobulina 45 59 64 118 158 A Asp Val B Glu Gln Gly Ala Glu C His D Gln FUENTE: BELITZ y GROSCH (1997). CUADRO 7 24 2.5.3 Efecto del polimorfismo de κ-caseína y β -lactoglobulina en la leche. Según JAKOB (1994), en diferentes estudios realizados se ha investigado la relación entre el polimorfismo genético de las proteínas de la leche y las características de producción lechera, la composición de la leche y las propiedades tecnológicas de ésta. Razón por la que, las variantes genéticas de las proteínas han adquirido interés para la industria láctea, debido a la asociación de estas con la aptitud quesera de la leche. 2.5.3.1 Producción de leche. Para el caso de κ-caseína, autores como BOVENHUIS et al. (1992) y GONYON et al. (1987), han reportado que vacas Holstein con κ-caseína AA fueron asociadas con una mayor producción de leche que el fenotipo BB, desplazando a una posición intermedia al fenotipo AB. Respecto al mismo tema, Ozbeyaz et al. citado por NG KWAI HANG (1997), señalan que para leche de vacas Jersey con presencia del alelo A de κ-caseína se verificó la mayor producción de leche, en contraposición a lo expuesto por Kim y Ng Kwai Hang et al. citados por NG KWAI HANG (1997), quienes descubrieron que vacas con fenotipos AB producían más leche que vacas homocigotas de la misma raza. NG KWAI HANG et al. (1986), señalan a pesar de estudios anteriores contradictorios, que la producción y composición de la leche puede ser influe nciada por las variantes genéticas de las proteínas lácteas, estableciendo que el fenotipo AB de κ-caseína presenta una mayor producción. En el mismo estudio, los autores establecen que las producciones diarias para ganado Holstein fueron superiores para κ-caseína AB con 21,44 kg., en comparación con 20,88 kg. y 20,83 kg. para κ-caseína AA y BB, respectivamente. Por su parte, Kim citado por NG KWAI HANG (1997), trabajando con vacas de la raza Canadienne de segunda lactancia, estableció que aquellas que 25 presentaban fenotipo AB de κ-caseína produjeron 4659 kg. de leche, a diferencia de los fenotipos AA y BB que presentaron 4141 kg. y 4033 kg., respectivamente. Todo esto comprendido en un período de tiempo de 305 días de lactancia. WINKELMAN y WICKHAM (1997), en trabajos con 3761 vacas Friesian y 1328 vacas Jersey, señalan que el fenotipo BB de κ-caseína presenta una producción mayor que la del fenotipo AA, pero la magnitud de la diferencia entre fenotipos es mayor para la raza Friesian. Al contrario, McLEAN et al. (1984), reportan que no existen diferencias en la producción de leche para los diferentes fenotipos de κ-caseína. Esto también es confirmado por HAENLEIN et al. (1987) y LIN et al. (1986). En lo referente a β-lactoglobulina, para NG KWAI HANG et al. (1984) y McLEAN et al. (1984), no existen asociaciones entre las variantes de ésta proteína con la producción de leche en vacas de razas Holstein, Friesian y Jersey. Pero NG KWAI HANG et al. (1986), en estudios con 2045 vacas Holstein, señalan que vacas que poseen la variante A de β-lactoglobulina son altamente productoras. Distinto es lo expuesto por Janicki, citado por NG KWAI HANG (1997), quien menciona que la variante B fue asociada a una producción de leche más alta. BOVENHUIS et al. (1992), pudieron establecer que vacas de primera lactancia, presentando el fenotipo AA para β-lactoglobulina produjeron 93 kg. más de leche que vacas con fenotipo BB. 2.5.3.2 Composición de la leche. Respecto a la composición de la leche y su relación con las variantes genéticas de κ-caseína y β-lactoglobulina, hay 26 concordancia en que leches con alelo B de κ-caseína poseen mayor contenido de materia grasa, proteína y caseína. Al respecto, DELACROIX – BUCHET et al. (1993) y IKONEN et al. (2001), señalan que el alelo B de κ-caseína fue asociada con un mayor contenido de proteína, en comparación con las variantes A,C y E. AMIGO et al. (2001), realizando estudios con 174 vacas Fleckvieh españolas, encontraron que leche de fenotipo AB para κ-caseína tiene un contenido más alto de proteína que las leches con fenotipo AA. NG KWAI HANG et al. (1986), utilizando datos diarios de producción de 2045 vacas Holstein Friesian, durante dos años, establecieron que leches que contenían κ-caseína B presentaban un contenido de materia grasa mayor, que aquellas que presentaban κ-caseína A. Además, NG KWAI HANG et al. (1986), mencionan que leches de vacas con κcaseína fenotipo BB, contienen 0,07% y 0,10% más proteína y caseína, que leches de vacas con fenotipo AA. La proporción de caseína en la leche, indicada como el número de caseína, también se ve favorecida por el fenotipo BB (GONYON et al., 1987; ALEANDRI et al., 1990; BOVENHUIS et al., 1992). En el CUADRO 8, se puede observar los contenidos promedios de proteína reportados por NG KWAI HANG et al. (1986), para cada fenotipo de κ-caseína, en estudios con vacas Holstein – Friesian. Respecto al CUADRO 8, los valores promedio por componentes para los respectivos fenotipos fueron: 3,37% proteína total, 0,71% proteína del suero, 2,65% caseína y un número de caseína igual a 78,91 para κ- caseína AA. Para κ- caseína BB los valores registrados fueron: 3,44% proteína total, 0,69% proteína del suero, 2,75% caseína y número de caseína igual a 80,06. 27 CUADRO 8 Valores promedio de contenido proteico para fenotipos de κcaseína. Fenotipo % Proteína % Caseína total % Proteína del N° de caseína suero AA 3,37 2,65 0,71 78,91 AB 3,37 2,67 0,70 79,32 BB 3,44 2,75 0,69 80,06 FUENTE: NG KWAI HANG et al. (1986). En relación al cuadro anterior, el fenotipo BB es asociado con mayores % proteínas, % caseína y un menor % proteína del suero, resultando un número de caseína más alto. En otras investigaciones, DELACROIX – BUCHET et al. (1993) y MARIANI et al. (1995), determinaron contenidos más altos de caseína en leches de vacas con presencia del fenotipo BB. DELACROIX – BUCHET et al. (1993), mencionan también que leches con el fenotipo BB de κ-caseína fueron asociadas con contenidos mayores de κcaseína. Por el contrario, McLEAN et al. (1984), trabajando con ganado Jersey y Frisón no encontraron diferencias en el contenido de proteínas de leches que presentaron la variante A o B de κ-caseína. La diferencia de esta investigación con las anteriores radica en que fue realizada en un período 4 meses utilizando un número de vacas menor. Las conclusiones establecidas por McLEAN et al. (1984), también fueron informadas por HAENLEIN et al. (1987). Sin embargo, NG KWAI HANG et al. (1990), señalan que los resultados obtenidos en diversos estudios son contradictorios y a veces no comparables, debido a diferencias en el tamaño de la población, raza de las vacas, 28 frecuencias de expresión de las variantes genéticas y formas de expresión de las características en estudio, es decir, datos de producción y composición de la leche recopilados diariamente o por lactancia. Referente a las variantes de β-lactoglobulina y su influencia en la composición de la leche, desde el descubrimiento realizado por ASCHAFFENBURG y DREWRY (1957), quienes señalaron que la leche de vacas que contienen fenotipo AA de β-lactoglobulina presentan un contenido proteico mayor, que los fenotipos AB o BB, numerosos estudios han ratificado lo mismo. Es así como, McLEAN et al. (1984), NG KWAI HANG et al. (1984), NG KWAI HANG et al. (1986) y NG KWAI HANG et al. (1990), coinciden en que leches que presentan el fenotipo AA de β-lactoglobulina tienen un porcentaje mayor de proteína total y proteína del suero. A su vez, manifiestan que leches que contienen el fenotipo BB presentan concentraciones de caseína y número de caseína significativamente mayores, que aquellas con fenotipos AA o AB. Para JAKOB (1994), leches que presentan β-lactoglobulina BB tienen entre 9,5% y 14% menos proteína del suero, que leches con β-lactoglobulina AA. En consecuencia, porcentajes más altos de caseína resultan en números de caseína entre 2% a 3% mayores, para leches con β-lactoglobulina BB que para el fenotipo AA. En el CUADRO 9 se puede apreciar el efecto de las variantes de βlactoglobulina sobre la composición de las proteínas de la leche según la investigación realizada por NG KWAI HANG et al. (1986). Respecto al CUADRO 9, leches con β-lactoglobulina AA presentaron un valor para proteína total de 3,41%, siendo mayor que el valor obtenido para el fenotipo BB. Según NG KWAI HANG (1997), el mayor contenido de proteína se debe a mayores cantidades de proteína del suero (0,76), lo que a su vez se 29 relaciona con una baja concentración de caseína. Leches con fenotipo BB de βlactoglobulina contienen 0,65% de proteína del suero y 2,72% de caseína, con un número de caseína mayor al fenotipo AA. CUADRO 9 Resultados promedio de contenido proteico para fenotipos de β-lactoglobulina. % Proteína % Proteína N° de Fenotipo % Caseína total del suero caseína AA 3,41 2,66 0,76 77,95 AB 3,41 2,71 0,71 79,46 BB 3,37 2,72 0,65 80,86 FUENTE: Ng Kwai Hang, citado por JAKOB y PUHAN (1995). Para van den Berg et al. y Reichardt et al., citados por NG KWAI HANG (1997), contenidos más elevados de caseína se encuentran en leches con βlactoglobulina fenotipo BB. En síntesis, la presencia del fenotipo BB de ambas proteínas (κ- caseína y βlactoglobulina), afectan el contenido proteico de la leche verificándose un aumento del % de caseína y una disminución del % proteína del suero. Lo anterior se expresa en un número de caseína mayor. 2.5.3.3 Propiedades tecnológicas de la leche. Los componentes de la leche, especialmente el contenido de proteína, tienen una influencia preponderante en las propiedades tecnológicas de la misma y por supuesto, un valor económico para la industria láctea. La variación de estos componentes y de las propiedades tecnológicas están influenciadas por las variantes genéticas de las proteínas de la leche. Debido a lo anterior, en los últimos tiempos se ha investigado la influencia que tienen estas variantes genéticas en las 30 propiedades tecnológicas y los beneficios que generaría en relación al procesamiento industrial. (JAKOB, 1994; Lundén et al., citado por JAKOB y PUHAN, 1995) Para DELACROIX - BUCHET et al. (1993) y DALGLEISH (1995), el tiempo de coagulación para leches que contienen la variante B de κ-caseína es más corto, que aquellas que presentan la variante A. Lo que estaría asociado al tamaño de la micela y a la presencia de iones Ca+2 libres. Teniendo una real incidencia en la formación de la cuajada. Por su parte, HORNE y MUIR (1994), señalan que leches de vaca frisona homocigotas para κ-caseína B tienen un tiempo de coagulación “visual” más corto que para la variante A, generando a su vez geles de una consistencia más firme. Lo anterior también es ratificado por autores como Mayer et al. citados por JAKOB y PUHAN (1995), estableciendo que leches de κ-caseína BB generan cuajadas más firmes y en menor tiempo. SCHAAR et al. (1985), menciona que la presencia de la variante B de κcaseína en las leches estudiadas tiene un efecto significativo sobre el contenido de citrato y el tiempo de coagulación, al mismo tiempo la variante B de βlactoglobulina tiene un efecto significativo sobre el número de caseína y el contenido de materia seca en quesos. Macheboeuf et al. citados por CREAMER y HARRIS (1997), determinaron que leches con κ-caseína BB tienen un tiempo de coagulación más corto y una mayor firmeza del gel, que κ-caseína AA. Ubicando al fenotipo AB en una posición intermedia. Según FITZGERALD y HILL (1997), múltiples variedades de queso como: Edam, Gouda, Cheddar, Camembert y Mozarrella provenientes de leches con κ-caseína BB presentan rendimientos de 1% a 10% superiores, que aquellos 31 provenientes de leches con κ-caseína AA. Esto debido a que existe mayor retención de materia grasa y una cuajada más firme. Además, éstos autores señalan que el suero de queso proveniente de leches con κ-caseína BB tienen niveles bajos de materia grasa y finos de cuajada. En otro aspecto, McLEAN et al. (1984), señalan que en estudios con leches de vacas Frisón y Jersey, la estabilidad térmica natural y la estabilidad térmica máxima de la leche es influenciada positivamente por la variante B de κcaseína. Además, Schulte-Coerne et al. citados por JAKOB (1994), confirman que leches con la variante B de κ-caseína tienen una mejor estabilidad térmica. Para leches con κ-caseína BB el tiempo de coagulación térmica a 140 °C es de un 40% a un 90% mayor que para κ-caseína AA. Las mismas relaciones también fueron válidas para los fenotipos de β-lactoglobulina. Otros autores como HILL et al. (1997), señalan que la presencia en la leche de la combinación de fenotipos AA y BB de β-lactoglobulina y κ-caseína, respectivamente, presentó una mayor estabilidad térmica seguida de la combinación AA-AA, BB-BB y BB-AA. Estas diferencias, en la propiedades de coagulación térmica, influenciarán en las propiedades y manufactura de los productos lácteos. En relación a estudios en productos fermentados, Bo y Pitotti citados por FITZGERALD y HILL (1997), reportan que en yoghurt elaborado con leche que contiene κ-caseína BB se obtiene una menor separación de suero. Y para el caso de β-lactoglobulina una mayor sinéresis se logra con leches que contienen β-lactoglobulina AA, a diferencia del fenotipo BB. 32 2.6 Electroforesis de isoenfoque en la determinación de las variantes genéticas Muchas moléculas biológicas poseen carga eléctrica, por lo que migrarán al aplicar un campo eléctrico. La magnitud de esta migración depende de la molécula, del pH y de la composición del medio (PLUMMER, 1981). Esta técnica se basa en el movimiento de una partícula con cierta carga eléctrica, suspendida en un medio, bajo la acción de un campo eléctrico. La partícula se moverá con velocidad constante, proporcional a la carga, debido a la acción del campo eléctrico y la fricción, producto de la viscosidad del medio (FREIFELDER, 1982; ALAIS, 1985). Las proteínas tienen carácter anfotérico, poseen grupos cargados positivos y negativos, y su carga depende del pH. Existirá un pH en el cual la proteína tiene carga neta cero, denominado punto isoelectrico (pI). En éste punto, la proteína no migrará por la acción de un campo eléctrico. Al aplicar una mezcla de proteínas, en un gradiente de pH, estas se movili zarán hasta un punto del mismo en el que no tendrán carga, deteniéndose. Es decir, cada molécula migrará dentro del gradiente de pH, hasta el punto correspondiente a su propio punto isoelectrico. Este método de separación de acuerdo al punto isoelectrico en un gradiente de pH se conoce como electroforesis de isoenfoque (FREIFELDER, 1982). La electroforesis de isoenfoque es una técnica en la que los componentes anfotéricos son fraccionados de acuerdo a su pI a través de un gradiente de pH estable (Righetti et al. citados por HAMES, 1998). El gradiente de pH es establecido con una solución de componentes anfotéricos que tienen puntos isoeléctricos muy cercanos, dentro de un rango de pH. Estos componentes anfotéricos, descritos como una mezcla de polianfolitos de bajo peso molecular, se conocen como anfolitos (FREIFELDER, 1982). 33 El gradiente se genera y se mantiene mediante el paso de una corriente eléctrica. Después de cierto tiempo de aplicación al campo eléctrico, los anfolitos migran, y se establece gradualmente el gradiente de pH (FREIFELDER, 1982; Righetti et al. citados por HAMES, 1998). Righetti et al. citados por HAMES (1998), señala que la electroforesis de isoenfoque presenta ventajas como: trabajar con un parámetro fisicoquímico intrínseco de la proteina, como es su pI. Y permite una buena resolución de proteínas en las que su pI difiere en solo 0.01 unidades de pH. 34 3. MATERIAL Y METODO 3.1 Materiales 3.1.1 Obtención de muestras. Muestras de leche, de diez vacas raza Frisón Negro, se obtuvieron desde el predio Santa Rosa de la Universidad Austral de Chile durante el período Septiembre – Diciembre de 2001. Las diez vacas en estudio fueron seleccionadas de manera que presentaran características similares como: primera lactancia, igual edad, información de la progenie, libres de mastitis y sometidas a un régimen alimenticio similar. La información fue recolectada con una encuesta presentada en el ANEXO 1. Los detalles de la información recopilada puede observarse en el ANEXO 2. Se realizó un muestreo por mes, desarrollado en dos etapas cada uno, completando cuatro muestreos durante este período. Las muestras se recolectaron en el ordeño matinal bajo los procedimientos establecidos por la Norma Chilena 1011/1 (CHILE, INSTITUTO NACIONAL DE NORMALIZACIÓN, 1998). En todos los muestreos se efectuó California Mastitis Test, para verificar el estado sanitario de las vacas en estudio. 3.1.2 Lugar del ensayo. Las muestras de leche se transportaron al Instituto de Ciencia y Tecnología de los Alimentos (ICYTAL) de la Universidad Austral de Chile. Los análisis se realizaron en el laboratorio de Química de Docencia y en el laboratorio Kjeldahl del ICYTAL. 35 3.1.3 Equipos utilizados. Los principales equipos utilizados en las actividades fueron los siguientes. Cuantificación de proteínas. - Block digestor Selecta. - Unidad de destilación Selecta. - Tubos de digestión Kjeldahl. Preparación de muestras. - Centrífuga IEC Centra MP 4. - Centrífuga Beckman J2 – HS. - Espectofotómetro Spectronic Genesys 5. Corrida de electroforesis. - Cámara de electroforesis Karl-Heinz Müller KG. (cámaras con capacidad para doce tubos) - Fuente de poder Karl-Heinz Müller KG (0 - 1500 Volt). 3.2 Muestras de leche y análisis La cantidad de muestreos y las variables a analizar, en relación a la actividad, pueden observarse en el CUADRO 10. Se contemplan cuatro muestreos matinales durante el período Septiembre – Diciembre, correspondiente a la estación primavera. Durante este período, a las muestras de leche, se les determinó la presencia de las variantes genéticas A o 36 B para κ-caseína y β-lactoglobulina. Además, se analizó el contenido proteico total, proteína del suero y caseína. Empleando la información anterior, también fue posible calcular el número de caseína, para las muestras de leche en estudio. Cabe señalar, que en cada muestreo se preparó una leche mezcla correspondiente a las leches de las vacas en estudio, la que fue sometida también a los análisis antes mencionados. CUADRO 10 Muestreos y análisis. Estación Muestreo 1 Proteínas Variantes 2 • κ-caseína. • A, B 3 • β-lactoglobulina. • A, B Primavera 4 Respuesta estudiada • Contenido proteína total. • Contenido de caseína. • Contenido de proteína del suero. • N° de caseína. • Prod. leche AM. 3.3 Metodología 3.3.1 Cuantificación de proteína total. Las muestras de leche fueron sometidas a análisis en duplicado por el método Semi Micro Kjeldahl FIL/IDF 20B: 1993, desarrollado por la Federación Internacional de Lechería. El método consiste en la digestión de la muestra, usando un aparato de bloque de digestión, con una mezcla de ácido sulfúrico concentrado y peróxido de hidrógeno y sulfato de potasio, junto con un catalizador, para convertir el nitrógeno orgánico presente en sulfato de amonio. La adición de un exceso de hidróxido de sodio a la digestión fría libera amoníaco. Se destila el amoníaco usando una unidad de destilación por arrastre de vapor y el destilado se recoge dentro de un exceso de solución de ácido bórico y luego se titula con ácido sulfúrico. 37 Este método determina el contenido de nitrógeno de la leche, a partir del amonio producido. 3.3.2 Cuantificación de proteínas del suero. Esta se determinó según la metodología desarrollada por Rowland presentada por FOX y McSWEENEY (1998). Las muestras de leche fueron tratadas para obtener el suero, según técnica de McGann et al. citado por PINTO et al. (1998) (ANEXO 3). Se separa la proteína no caseínica, precipitando la caseína en su punto isoeléctrico, sin dilución significativa de la fracción proteica no caseínica. Esto se obtiene agregando en volúmenes iguales ácido acético y acetato de sodio y en una cantidad no superior al 6% del volumen de la leche, lo que compensa la contracción en el volumen de leche debido a la separación de caseína y grasa en el precipitado, por lo que a este filtrado se le denomina suero no diluído. Una vez realizada la separación, al suero se le determinó el contenido de nitrógeno, lo que se realizó en duplicado según el método Semi Micro Kjeldahl FIL – IDF 20B: 1993, recomendado por la Federación Internacional de Lechería. 3.3.3 Determinación del contenido de caseína. El contenido para cada muestra de leche, se determinó sustrayendo el contenido de proteína total menos el contenido de proteína del suero, según el procedimiento utilizado por Rowland citado por FOX y McSWEENEY (1998). 38 3.3.4 Determinación del número de caseína. Se refiere al calculo de la proporción del contenido de caseína sobre el contenido de proteína total (KROEKER et al, 1985; SCHAAR et al, 1985). 3.3.5 Medición de la producción de leche. Esta se realizó para cada vaca, en cada uno de los muestreos matinales realizados. La determinación se efectuó una vez recolectada la leche en los tarros lecheros utilizados, contando para ello con una regla de medición. 3.4 Preparación de muestras de leche para la determinación de variantes genéticas 3.4.1 Separación de κ caseína. Se separó κ-caseína de la leche de cada una de las 10 vacas individuales en estudio. Lo anterior, se realizó según el método descrito por McKENZIE y WAKE (1961). Esta técnica comprende una serie de etapas que permiten la purificación completa de la κ-caseína desde la caseína micelar. La metodología se redujo en etapas, hasta el punto en el que se logra la separación de κ-caseína de a S-caseína y ß-caseína (ANEXO 4). 3.4.2 Separación de β lactoglobulina. Se realizó a partir de la leche de cada una de las diez vacas en estudio, según el procedimiento utilizado por LOWE et al. (1995), descrito en el ANEXO 5. 3.4.3 Determinación cuantitativa de proteínas de las muestras para electroforesis. Las muestras una vez preparadas, se les cuantificó la proteína 39 que contenían mediante la metodología sugerida por LOWRY et al. (1951) (ANEXO 6). Para los efectos prácticos se construyó una curva de calibración los detalles pueden apreciarse en el ANEXO 7. 3.5 Electroforesis de isoenfoque. Las variantes genéticas de κ-caseína y βlactoglobulina fueron determinadas utilizando electroforesis de isoelectroenfoque según el método utilizado por CASANOVA (2001) (ANEXO 8). 3.5.1 Condiciones de la electroforesis. La electroforesis de isoenfoque fue realizada bajo refrigeración, usando un sistema de electroforesis vertical en tubos, conectada a una fuente de poder eléctrica (400 volt) El anfolito utilizado en la preparación de los geles fue Ampholine (Bio Rad) con un rango de pH comprendido entre 3 y 10. 3.5.2 Estándares de proteínas. Estándares de β-lactoglobulina liofilizados (Sigma), variante A y B, fueron utilizados para identificar las variantes de las muestras en análisis de las respectivas corridas. Estos estándares fueron preparados a una concentración de 1 mg/ml. disolviéndolos en una solución de urea 7 M con 0.1% de 2 – mercaptoetanol. También fueron utilizados estándares de κ caseína de vacas puras congelados y purificados por CASANOVA (2001). Una masa de 10 µg de cada estándar fue aplicada para las corridas electroforéticas. 40 3.5.3 Preparación de las muestras. Las muestras de κ-caseína semipurificadas fueron diluídas 5 veces en una solución de urea 7 M con 0.1% de 2 – mercaptoetanol, de ésta se extrajo un volumen que contuviera 10 µg de proteína, que fue aplicada en la electroforesis. Para el caso de β-lactoglobulina, las muestras fueron diluídas 10 veces en la misma solución, aplicándose un volumen para la electroforesis que contuviera 10 µg de proteína. 3.6 Densitometría La densitometría de las bandas proteicas teñidas se efectuó, según el procedimiento desarrollado por De JONG (1975). Para esto se utilizó el equipo Pye Unicam SP 8-100 UV/VIS con una longitud de onda de 590 nm. 3.7 Análisis estadísticos Para el análisis de datos se utilizó el paquete estadístico Statgraphics plus 2.0. Se efectuó un análisis de varianza multifactorial, para determinar si el efecto de los factores estudiados (muestreo, variantes de κ-caseína y β-lactoglobulina) generaban diferencias significativas en la producción de leche por ordeño y en los contenido de proteina total, proteína del suero, caseína y número de caseína. Además, se incorporó la evaluación de la interacción entre factores estudiados. El análisis se realizó incorporando una variable a la vez, es decir, se efectuó un análisis de varianza multifactorial para proteína total, proteína del suero, caseína, número de caseína y producción de leche por ordeño AM. Luego, para verificar las diferencias significativas entre los promedios de contenidos proteicos de la leche respecto de las variantes de κ-caseína y β- 41 lactoglobulina, se realizó una prueba de rango múltiple (Tukey) al 95% de confianza. 42 4 PRESENTACIÓN Y DISCUSIÓN DE RESULTADOS 4.1 Identificación de variantes genéticas de κ-caseína y β-lactoglobulina en leche de vacas Frisón Negro La identificación de variantes genéticas de κ-caseína y β-lactoglobulina se realizó mediante electroforesis de isoenfoque, previa separación de ambas proteínas en las distintas muestras de leche. 4.1.1 Separación de κ-caseína y β -lactoglobulina. El procedimiento de McKENZIE y WAKE (1961), para la obtención de κ-caseína, se aplicó hasta la etapa en la que se adiciona cloruro de calcio, a fin de separar las caseínas sensibles al ion calcio. Con esto se separa el complejo micelar y se obtiene la κ-caseína. La concentración de κ-caseína obtenida en cada preparación se presenta en el ANEXO 9. Los resultados de cantidad de proteína obtenida en las preparaciones de βlactoglobulina, según la metodología de LOWE et al. (1995), se presentan en el ANEXO 10. Las diferencias encontradas en el contenido de κ-caseína y β-lactoglobulina en los distintos muestreos, se pueden originar por las metodologías de separación de ambas proteínas, considerando que κ-caseína corresponde sólo a un 13% de las caseínas y β-lactoglobulina representa un 50% de las proteínas del suero. 43 4.1.2 Electroforesis de κ-caseína y β -lactoglobulina. Para identificar las variantes genéticas de las proteínas, se realizaron electroforesis separadas para κ-caseína y β-lactoglobulina, en cada una de estas se incorporaron los estándares de proteína respectivos, debido a las diferentes condiciones de la electroforesis. Los volúmenes de muestra utilizados en cada ensayo son presentados en el ANEXO 11 y ANEXO 12, para κ-caseína y β-lactoglobulina, respectivamente. Los resultados obtenidos para la electroforesis realizada con muestras de κcaseína son presentados en las FIGURA 1. FIGURA 1. Electroforesis de isoenfoque para muestras de κcaseína en vacas Frisón Negro. 1. St. κ-CN 4052-2 (B), 2. St. κ-CN 3971-1 (A), 3. 546, 4. 560, 5. 579, 6. 591, 7. 596, 8. 633, 9. 636, 10. 639, 11. 642, 12. 644. Como se puede observar en la FIGURA 1, para κ-caseína, se identificó la presencia de la variante A y B, pero no se encontraron ambas variantes en una misma muestra de leche. Además, no fue posible determinar si se trataba de un fenotipo específico (AA o BB) debido a la baja resolución ofrecida por el método 44 de electroforesis para esta proteína en particular. Lo anterior, se debe probablemente a que se trabajó con muestras parcialmente purificadas. Una vez realizada la electroforesis y los procedimientos de tinción, se determinó la distancia de migración de las proteínas en el gel, estas mediciones se realizaron desde el polo positivo. Luego, para el caso de κ-caseína, se compararon las lecturas con la medición de los estándares de κ-caseína A y B obtenidos por CASANOVA (2001). En cuanto a β-lactoglobulina, las lecturas registradas se cotejaron con las mediciones de los estándares comerciales de las variantes A y B. En la FIGURA 2, se puede apreciar las variantes genéticas identificadas para las muestras de β-lactoglobulina. FIGURA 2. Electroforesis de isoenfoque para muestras de β -lactoglobulina en vacas Frisón Negro. 1. St. β-Lg Sigma B, 2. St. β-Lg Sigma A, 3. 546, 4. 560, 5. 579, 6. 591, 7. 596, 8. 633, 9. 636, 10. 639, 11. 642, 12. 644. 45 En la identificación de β-lactoglobulina, se encontraron las variantes genéticas A y B, detectándose ambas variantes genéticas en algunas de las muestras de leche. También se observa una tercera banda que probablemente corresponde a a-lactoalbúmina. El CUADRO 11, presenta en resumen las variantes de κ-caseína y βlactoglobulina identificadas para las muestras de leche estudiadas. CUADRO 11 Variantes genéticas de κ-caseína y β-lactoglobulina determinadas en leche de vaca Frisón Negro. Variante Muestra κ-caseína β-lactoglobulina 546 B AyB 560 A A 579 A AyB 591 B AyB 596 B AyB 633 B AyB 636 B AyB 639 B A 642 B A 644 B AyB Como se puede apreciar, en cada una de las muestras de κ-caseína se identificó la variante A o B de esta proteína. En el caso de β-lactoglobulina, se identificó en 7 de las muestras la presencia de las variantes A y B mientras que en las 3 restantes se registró la variante A. Las distancias de migración registradas para las muestras de β-lactoglobulina y κ-caseína se presentan en el ANEXO 13 y ANEXO 14, respectivamente. Las 46 diferencias de migración registradas entre ensayos, se pueden originar por pequeñas fluctuaciones de voltaje o de la fuerza iónica del medio. 4.1.3 Expresión de las variantes genéticas de κ-caseína y β -lactoglobulina. Los ANEXOS 15 y 16, presentan las densitometrías realizadas a las muestras correspondientes a β-lactoglobulina y κ-caseína, respectivamente. En cuanto a la expresión de las variantes genéticas para β-lactoglobulina en las muestras que se identificaron ambas variantes, se logró apreciar que la proporción de la expresión de la variante A es mayor que la variante B cuando ambas se encuentran presentes. Con relación a κ-caseína, se detectaron las variantes genéticas A o B, no detectándose la presencia de ambas en las muestras ensayadas. Además, en todas las muestras el densitómetro solo registró un solo pico debido a la baja resolución de las bandas, lo que no hizo posible determinar a cabalidad si se trataba de fenotipos AA o BB. 4.2 Variantes genéticas de κ-caseína y β -lactoglobulina en vacas Frisón negro En el CUADRO 12, se resume la frecuencia de las variantes genéticas identificadas en la leche de vacas Frisón Negro. Se observa que en las vacas estudiadas la variante A de β-lactoglobulina está presente en un 65% y la variante B en un 35%. Por otro lado, la variante B de κ-caseína está presente en un 80% de la muestra en estudio, la variante A se presentó solo en un 20%. En relación a lo anterior, los valores de frecuencia obtenidos para las variantes genéticas son diferentes a los encontrados en estudios previos. Investigaciones 47 realizadas por FELMER y BUTENDIECK (1998), mencionan que las variantes A y B de κ-caseína se presentan en el ganado Frisón Negro Chileno con una frecuencia de 82,4% y 17,6%, respectivamente. Además, los mismos autores señalan que la frecuencia para el ganado Frisón Negro Danés respecto a las variantes de κ-caseína sería de 85% para la variante A y 15% para la variante B. CUADRO 12 Frecuencia de variantes genéticas obtenidas en las vacas Frisón Negro del estudio. Proteína Variante A B N° de vacas κ-caseína 0,2 0,8 10 β-lactoglobulina 0,65 0,35 10 Referente a β-lactoglobulina, los valores obtenidos en el estudio difieren de los resultados presentados por McLEAN et al. (1984), quienes en un estudio con vacas Friesian determinaron que la variante B de esta proteína esta presente en un 61,4%, mientras que la variante A lo hace en un 38,6%. Valores idénticos son mencionados por NG KWAI HANG (1984), en estudios con vacas Holstein Friesian. Por otro lado, WINKELMAN y WICKHAM (1997), en estudios con vacas de raza Friesian y cruzas de la misma raza, señalan que la frecuencia de expresión de la variante A de β-lactoglobulina es de 48,7%; y 51,3% para la variante B. Para HILL (1993), en estudios con vacas Friesian, la presencia de la variante B de βlactoglobulina corresponde a un 55%, mientras que la variante A esta presente en un 45%. Las diferencias entre los valores obtenidos y los establecidos en estudios anteriores pueden originarse fundamentalmente, por variaciones en el tamaño 48 de las muestras de ganado empleadas en los estudios, utilización de diferentes razas, o bien, por diferencias en las técnicas de identificación (JAKOB, 1995; NG KWAI HANG, 1997). Es así como VAN EENENNAAM y MEDRANO (1991), en estudios con ganado Holstein establecen que la frecuencia para las variantes A y B de κ-caseína es de 82% y 18% respectivamente, pero utilizando 1152 vacas Holstein. A su vez, investigaciones realizadas por NG KWAI HANG et al. (1984), señalan que la frecuencia para estas misma variantes es de 74,4% para A y 25,6% para B, utilizando en este caso 2045 vacas Holstein. Se puede apreciar, que las diferencias en el tamaño de muestreo, genera estimaciones de frecuencias distintas para las variantes genéticas estudiadas, y puede ser posible por aleatoriedad que al tener una muestra pequeña se seleccionen vacas con la presencia mayoritaria de una variante específica. Lo anterior, no excluye la posibilidad de que la pureza de las razas estudiadas por estos autores sea diferente, incidiendo también en la frecuencia de la expresión de una determinada variante genética. 4.3 Composición proteica y producción de leche en vacas Frisón Negro Los valores de producción y composición proteica de leche de vacas Frisón Negro pueden ser apreciados en el ANEXO 17. Los valores promedio correspondientes al porcentaje de proteína total, proteína del suero, caseína, número de caseína y producción de leche de las vacas en estudio durante el período pueden ser apreciados en el CUADRO 13. El valor promedio calculado para el porcentaje de proteína total fue de 3,09 ± 0,18% de proteína. Referente a proteína del suero y caseína el valor promedio 49 para ambos componentes fue de 0,72 ± 0,05% de proteína y 2,36 ± 0,16% de caseína. El N° de caseína promedio registrado fue de 76,44 ± 1,56. La producción de leche promedio, para los cuatro muestreos, corresponde a 10,86 ± 2,24 kg de leche por ordeño. CUADRO 13 Composición promedio de leche de vaca Frisón Negro. Componentes n Promedio ± desv. estándar Producción de leche/ordeño mat. 80 10,86 ± 2,24 kg % Proteína total 80 3,09 ± 0,18% % Proteína del suero 80 0,72 ± 0,05% % Caseína 80 2,36 ± 0,16% N° Caseína 80 76,44 ± 1,56 n: número de muestras. LAVIN (1996), estableció un contenido proteico para vacas Frisón Negro, de primera lactancia, correspondiente a 2,96% de proteína. El valor estimado para el presente estudio es superior al antes mencionado y se encuentra dentro de los rangos señalados por WALSTRA et al. (1999). La diferencia, en cuanto al valor de proteína estimado, se debería a que los estudios se han realizado en distintas estaciones del año y con un número de vacas diferente. El porcentaje de proteína total determinado es inferior al de otras razas, como Holstein y Jersey. Es así como NG KWAI HANG et al. (1990), señala un 3,17% de proteína para estudios con vacas Holstein. A su vez, McLEAN et al. (1984), menciona un porcentaje de proteina total para vacas Jersey y Holstein de 3.93% y 3.09% de proteína, respectivamente. Asimismo, CERBULIS y FARRELL (1975), encontraron valores de proteína total para vacas Holstein, correspondiente a 3,07 ± 0,43% de proteína y 4,07 ± 0,49% de proteína para vacas Jersey. 50 Referente al porcentaje de proteína del suero, el valor estimado en la investigación es mayor al encontrado por NG KWAI HANG et al. (1986), en estudios con vacas Holstein. Estos autores determinaron un porcentaje de 0,699% de proteína del suero en 1908 vacas Holstein - Freisian. En cuanto al porcentaje de caseína presentado en el CUADRO 13, este es inferior al estimado en otras razas, McLEAN et al. (1984), trabajando con vacas Holstein - Friesian estimaron 2,39 ± 0,12% de caseína en 238 vacas. Mientras que para 263 vacas Jersey registraron 3,07 ± 0,15% de caseína. Para CERBULIS y FARRELL (1975), el porcentaje promedio de caseína en muestras individuales es de 2,89%, pudiendo existir variaciones entre 1,53% y 4,15% de caseína. Además, indican que los porcentajes promedio varían dependiendo de la raza desde 2,53% para Holstein hasta 3,39% para Jersey. Respecto al número de caseína promedio obtenido en el estudio, es posible establecer que existen diferencias con otras razas de ganado lechero . Así, NG KWAI HANG et al. (1986), en estudios con vacas Holstein informaron un promedio 79,42. A su vez, CERBULIS y FARRELL (1975), mencionan un número de caseína promedio de 77,9 con variaciones entre 64,3 y 83,7. Indican también que para leche de vacas de una misma raza, es posible encontrar números de caseína dispares. Los resultados encontrados en el estudio difieren de los reportados por los autores antes mencionados. Las diferencias existentes en relación al contenido proteico y producción de leche, pueden originarse debido a un tamaño de muestra menor y a la utilización de una raza distinta de las empleadas en investigaciones previas. 51 4.4 Variantes genéticas, producción y composición de la leche El análisis de varianza, permitió determinar si el efecto de las variantes de κcaseína y β-lactoglobulina originaba diferencias significativas en la producción de leche, porcentaje de proteína total, porcentaje de proteína del suero, porcentaje de caseína y número de caseína (ANEXO 18). Así, el análisis realizado permitió establecer que existen diferencias significativas en la producción de leche por ordeño AM, respecto a las variantes de β-lactoglobulina estudiadas, al 95 % de confianza. Además, existen diferencias en el contenido de proteína del suero y proteína total para la leche con las variantes A y A-B de β-lactoglobulina. Lo anterior, concuerda con lo reportado por NG KWAI HANG et al. (1986), quienes señalan que las variantes de κ-caseína y β-lactoglobulina tienen efectos en la producción lechera de vacas Holstein. Por el contrario, McLEAN et al. (1984), mencionan la no existencia de efectos por parte de las variantes genéticas de las proteínas lácteas sobre la producción de leche. Lo mismo sostienen NG KWAI HANG et al. (1990), que en estudio con vacas Holstein de distintas lactancias , señalan que las variantes de κ-caseína y β-lactoglobulina no tienen efecto sobre la producción de leche de las vacas. Las diferencias entre estudios se deben a la heterogeneidad existente en las características de los rebaños estudiados (etapa lactancia, edad, número de partos), así como también, del número de vacas utilizado en cada caso. En cuanto a κ-caseína, el análisis de varianza establece que existen diferencias significativas (p<0,05) en los porcentajes de proteína total, caseína y número de caseína para las leche que presentan las variantes A y B de κ-caseína. 52 Al respecto, NG KWAI HANG et al. (1986), informan que las variantes de κcaseína tienen efecto significativo sobre los porcentajes de proteína total, caseína y número de caseína. En estudios posteriores, NG KWAI HANG et al. (1990), ratifican que los fenotipos de κ-caseína influencian la composición proteica de la leche. VAN EENENNAAM y MEDRANO (1991), en estudios con ganado lechero californiano, mencionan que las variantes genéticas de κ-caseína tiene un efecto significativo sobre el porcentaje de proteína total de la leche. Similares resultados han obtenido DELACROIX – BUCHET et al. (1993) y RAHALI y MÉNARD (1991), quienes señalan que el efecto de las variantes genéticas de κ-caseína originan diferencias en la composición proteica de la leche. El análisis de varianza efectuado, también evaluó la interacción de los factores estudiados, siendo estadísticamente significativa la interacción de las variantes de κ-caseína y β-lactoglobulina, al 95% de confianza. (ANEXO 18) Resultados diferentes establecen VAN EENENNAM y MEDRANO (1991), quienes no encontraron interacción entre las variantes de β-lactoglobulina y κcaseína al realizar estudios en ganado lechero californiano. Resultados similares a los anteriores fueron encontrados por ROZZI et al. (1989), en estudios con ganado Holstein Friesian italiano, quienes no pudieron establecer la existencia de interacciones significativas entre las variantes de κcaseína y β-lactoglobulina respecto a la producción de leche y el contenido de proteína. 53 4.4.1 Variantes genéticas de κ-caseína, producción y composición proteica de la leche. La prueba de comparación múltiple permitió establecer la diferencia existente entre los promedios en el % proteína total, % proteína del suero, % caseína y número de caseína para las distintas variantes encontradas de κ-caseína y β-lactoglobulina. En el CUADRO 14, es posible apreciar la incidencia de las variantes genéticas de κ-caseína en los componentes en estudio. CUADRO 14 Diferencias entre variantes genéticas de κ-caseína A y B, en relación al contenido de proteínas. (Promedio ± Error estándar) κ-caseína A κ-caseína B Características Promedio ± E.E Promedio ± E.E n = 16 n = 64 a Producción de *11,35±0,46 10,49±0,27ª leche/ordeño AM (kg) % proteína total 3,01±0,03a 3,10±0,02b % proteína del suero 0,729±0,009a 0,715±0,005ª a % caseína 2,29±0,03 2,38±0,02b N° caseína 75,87±0,33a 76,86±0,19b *Promedios para un componente con letras distintas, denotan diferencias significativas. 4.4.1.1 Contenido de proteína total y variantes genéticas de κ-caseína. El CUADRO 14, presenta los promedios del % proteína total y el error estándar para los fenotipos de κ-caseína encontrados en el estudio. En términos cuantitativos, es posible establecer que las variantes B y A de κcaseína tienen un promedio de 3,10% y 3,01% proteína total, respectivamente. Las prueba de comparación de promedios respecto al % proteína total para las variantes de κ-caseína encontrados, permitió determinar que leches de vacas con la variante B de κ-caseína presenta un % proteína total significativamente 54 mayor a la variante A. La variante B presentó un 0,09% más de proteína total que la variante A (95% de confianza). Lo anterior concuerda con lo expuesto por NG KWAI HANG et al. (1986) y NG KWAI HANG et al. (1990), estos autores indican que el fenotipo BB de κcaseína presenta mayor % de proteína que los fenotipos AA y AB. A su vez, RAHALI y MÉNARD (1991), mencionan que las leches de vacas que contienen el fenotipo BB de κ-caseína presentan un contenido proteico mayor (0,12% más) al del estimado para el fenotipo AA. Por otro lado, JAKOB (1994), señala que leche de vacas con el fenotipo BB de κ-caseína presentan % proteína mayores que los fenotipos AA y AB. Si bien, no se pudo determinar un fenotipo específico como lo ha n hecho estudios previos, se puede apreciar que la presencia de la variante B de κcaseína en la leche de vacas Frisón Negro presenta un contenido de proteína mayor. 4.4.1.2 Contenido de proteínas del suero y variantes genéticas de κcaseína. Los valores promedios de proteínas del suero estimados para la variante A y B de κ-caseína corresponden a 0,729% y 0,715%, respectivamente (CUADRO 14). La prueba de comparación permitió ratificar que no existen diferencias significativas en el % de proteína del suero para leche de vacas con las variantes A y B de κ-caseína (95% de confianza). Lo mismo es mencionado por NG KWAI HANG et al. (1986), RAHALI y MÉNARD (1991), quienes no encontraron diferencias significativas entre % proteína del suero para leche de vacas con distintos fenotipos de κ-caseína. 55 Por el contrario, JAKOB (1994), señala que en gran parte de las razas lecheras estudiadas, el contenido de proteína del suero de leches con κ-caseína AB y BB es menor que el fenotipo AA. 4.4.1.3 Contenido de caseína y variantes genéticas de κ-caseína. El valor promedio de % caseína para la variante A de κ-caseína corresponde a 2,29% y para la variante B es 2,38% de caseína. El análisis realizado establece que el % caseína de leches con la variante B de κ-caseína es significativamente mayor (95% confianza), que aquellas que contienen la variante A. La variante B de κ-caseína presentó 0,09% más caseína que la variante A. Asociaciones similares, aunque trabajando con fenotipos, han sido reportadas por NG KWAI HANG et al. (1986), los que señalan que leches que presentaban el fenotipo BB de κ-caseína presentaban 0,10% más de caseína, que aquellas que presentaban el fenotipo AA. Para RAHALI y MÉNARD (1991), en base a estudios con ganado lechero francés, mencionan que el fenotipo BB de κcaseína es significativamente mayor que los otros fenotipos. Estos autores informan valores de 2,55%, 2,65% y 2,72% para los fenotipos AA, AB y BB, respectivamente. A su vez, Rampilli et al. citado por JAKOB (1994), determinó que leches provenientes de vacas Holstein que presentan el fenotipo BB de κ-caseína, tienen un % caseína significativamente mayor que los fenotipos AA y AB. Al contrario, investigaciones realizadas por McLEAN et al. (1984), establecen que no existen diferencias significativas entre los porcentajes de caseína de leches que contengan, ya sea, el fenotipo AA, AB o BB. 56 El porcentaje de caseína significativamente mayor, registrado para κ-caseína B, explica también el incremento en el porcentaje de proteína total presentado previamente. 4.4.1.4 Número de caseína y variantes genéticas de κ-caseína. La variante A de κ-caseína presentó un número de caseína de 75,87, para la variante B el valor estimado es de 76,86 (CUADRO 14). La prueba de comparación ratifica que existen diferencias significativas (95% confianza), entre los números de caseína para leches que contienen las variantes A y B de κ-caseína. Siendo el contenido para la variante B significativamente mayor. Este resultado concuerda con lo señalado por NG KWAI HANG et al. (1986) y RAHALI y MÉNARD (1991), quienes señalan que el número de caseína para leches de vacas que presentaban el fenotipo BB es significativamente mayor que los fenotipos AA y AB. Resultados similares han sido presentados también por DELACROIX -BUCHET et al. (1993). Sin embargo, SCHAAR et al. (1985), en estudios realizados con vacas Friesian, mencionan que no se encontraron diferencias significativas respecto al número de caseína en leches que contenían fenotipos AA y BB de κ-caseína. El resultado obtenido permite inferir que la presencia de la variante B de κcaseína, efectivamente incrementa el contenido de caseína, hecho que se ve reflejado en un número de caseína también mayor para esta variante. 57 4.4.1.5 Variantes genéticas de κ-caseína y producción de leche. El promedio estimado para la variante B de κ-caseína es 10,49 kg/ordeño AM y para la variante A asciende a 11,35 kg/ordeño AM (CUADRO 14). Se determinó que no existen diferencias significativas en la producción promedio de leche por ordeño respecto a las variantes encontradas en el estudio (95% de confianza). Resultados similares han sido reportados por McLEAN et al. (1984) y NG KWAI HANG et al. (1990), quienes no detectaron diferencias significativas entre las producciones de leche para los distintos fenotipos de κ-caseína presentes en las leches. Un resultado distinto es el que obtuvo NG KWAI HANG et al. (1986), quienes, trabajando con datos recolectados diariamente, señalan que leches de vacas que presentan el fenotipo AB de κ-caseína presenta una producción de leche mayor que las leche de vacas que presentan el fenotipo AA o BB. 4.4.2 Variantes genéticas de ß-lactoglobulina, producción y composición proteica de la leche. Las pruebas de comparación permitieron verificar la existencia de diferencias significativas en la producción de leche, % proteína total, % proteína del suero, % caseína y número de caseína para las fenotipos AA y AB encontrados en las leches de las vacas en estudio. En el CUADRO 15, se puede apreciar los promedios del contenido de proteína total, proteína del suero, caseína, número de caseína y producción de leche AM, respecto a los fenotipos de ß-lactoglobulina identificados en leche de vacas Frisón Negro. 58 CUADRO 15 Diferencias entre fenotipos de ß-lactoglobulina AA y AB, en relación al contenido de proteínas. (Promedio ± Error estándar) Característica ß-lactoglobulina AA ? -lactoglobulina AB Promedio ± E.E Promedio ± E.E n = 24 n = 56 a Producción de 9,64±0,40 12,20±0,35b leche/ordeño AM (kg) % proteína total 3,10±0,03b 3,01±0,03ª b % proteína del suero 0,739±0,008 0,705±0,007ª a % caseína 2,36±0,03 2,31±0,02ª a N° caseína 76,14±0,28 76,59±0,25ª *Promedios para un componente con letras distintas denotan diferencias significativas. 4.4.2.1 Contenido de proteína total y variantes genéticas de ß- lactoglobulina. Los valores estimados para los fenotipos AA y AB fueron 3,10% y 3,01% de proteína , respectivamente. (CUADRO 15) La prueba de comparación establece que existen diferencias significativas en los porcentajes de proteína total en las leches que contienen los fenotipos AA y AB de ß-lactoglobulina con un 95% de confianza. Esto no concuerda con lo señalado por VAN EENENNAAM y MEDRANO (1991), quienes no establecieron diferencias significativas en el porcentaje de proteína de vacas Holstein, en el estado de California. También, McLEAN et al. (1984), en estudios con ganado lechero Friesian y Jersey, establece que no existen diferencias significativas respecto del porcentaje de proteína total para leche de vacas con los fenotipos AA, AB y BB de ß-lactoglobulina. Diferencias entre los resultados obtenidos y los planteados por los autores antes mencionados se deberán principalmente a las distintas razas utilizadas en los diversos estudios. 59 4.4.2.2 Contenido de proteínas del suero y variantes genéticas de ßlactoglobulina. El porcentaje de proteína del suero obtenido para el fenotipo AA, corresponde a 0,739% de proteína. Para el fenotipo AB, el valor promedio es menor y corresponde a 0,705% de proteína (CUADRO 15). El análisis estadístico indicó que existen diferencias significativas (95% de confianza) entre los fenotipos de ß-lactoglobulina encontrados en el estudio. Estos resultados concuerdan con lo señalado por otros autores como, NG KWAI HANG et al. (1986), quienes informan que un porcentaje de proteína del suero mayor se verificó en la leche que presentaba el fenotipo AA de ß-lactoglobulina. Asimismo, Mariani citado por JAKOB (1994), en investigaciones con ganado Holstein - Friesian determinó que el fenotipo AA de ß-lactoglobulina presentaba un % proteína del suero significativamente mayor que los fenotipos AB y BB. 4.4.2.3 Contenido de caseína y variantes genéticas de ß-lactoglobulina. El porcentaje promedio de caseína para leches de vacas que presentaban el fenotipo AA corresponde a 2,36%; para el fenotipo AB se determinó un valor de 2,31% de caseína (CUADRO 15). No se establecieron diferencias significativas entre porcentajes de caseína para los fenotipos AA y AB de ß-lactoglobulina. Lo anterior concuerda con lo señalado por CERBULIS y FARREL (1975), quienes no encontraron diferencias significativas en el porcentaje de caseína en leches que presentaban los fenotipos AA, AB ó BB de ß-lactoglobulina A su vez, Aaltonen y Antila citados por JAKOB (1994), al estudiar diversos ganados lecheros mencionan que no existen diferencias significativas en los 60 porcentajes de caseína respecto a los fenotipos de ß-lactoglobulina presentes en la leche. Sin embargo, McLEAN et al. (1984) y SCHAAR et al. (1985), señalan que el fenotipo BB de ß-lactoglobulina tiene un porcentaje de caseína significativamente mayor que los fenotipos AA y AB. 4.4.2.4 Número de caseína y variantes genéticas de ß-lactoglobulina. Los valores obtenidos para los fenotipos AA y AB fueron 76,14 y 76,59, respectivamente (CUADRO 15). La comparación estadística estableció que no existen diferencias significativas (95% de confianza), entre los números de caseína para leches con fenotipos AA y AB. Lo anterior no concuerda con lo reportado por RAHALI y MÉNARD (1991), quienes indican que leches de vacas que presentan el fenotipo AA de ßlactoglobulina, tienen un número de caseína significativamente menor que aquellas que presentan los fenotipos AB y BB. A su vez, NG KWAI HANG et al. (1986), obtuvieron números de caseína para el fenotipo BB y AB correspondientes a 80,86 y 79,46, respectivamente. Para el fenotipo AA obtuvieron un valor significativamente menor correspondiente a 77,95. 4.4.2.5 Variantes genéticas de ß-lactoglobulina y producción de leche. La producción promedio para el fenotipo AA de ß-lactoglobulina es de 9,64 kg/ordeño matinal mientras que para el fenotipo AB es de 12,20 kg/ordeño matinal (CUADRO 15). 61 La prueba de comparación estadística, señala que hay diferencias significativas en los valores de producción de leche por ordeño matinal, para los fenotipos AA y AB de ß-lactoglobulina. Las vacas con el fenotipo AB presentaron una producción de leche matinal promedio superior a las vacas que tenían el fenotipo AA en 2,56 kg/ordeño matinal. Investigaciones previas realizadas por NG KWAI HANG et al. (1986), señalan que la producción de leche de vacas Holstein-Friesian es afectada por las variantes de ß-lactoglobulina, pero encontraron que el fenotipo AA presentaba una mayor producción de leche respecto de los fenotipos AB y BB. Por el contrario, Janicki citado por NG KWAI HANG (1997), alude que la variante B de ß-lactoglobulina está asociada a una mayor producción de leche, esto en investigaciones realizadas con ganado Holstein-Friesian polaco. Respecto a la investigación reali zada, con la identificación de dos fenotipos es posible observar que la variante B de ß-lactoglobulina está asociada a una mayor producción, lo que se ratifica al considerar las pruebas estadísticas realizadas. Las disimilitudes entre esta investigación y anteriores, se deben a diferencias respecto de la raza utilizada en el estudio, estación del año y el tamaño muestreal utilizado, entre otros. 4.4.3 Interacción de variantes genéticas de κ-caseína y ß-lactoglobulina. Mediante la incorporación de la interacción de los factores en el análisis de varianza multifactorial, fue posible establecer que el contenido proteico es más favorecido por la presencia de ciertas variantes de κ-caseína y ß-lactoglobulina combinadas. En el CUADRO 16, se observan los valores promedio de contenido proteico para cada combinación de variantes, además se aprecia la existencia de 62 diferencias significativas entre ciertas combinaciones de variantes, al 95% de confianza (ANEXO 19). En relación al contenido de proteína total, es posible apreciar que la leche con presencia de la variantes A y AB de κ-caseína y ß-lactoglobulina, presentó un contenido promedio de 2,89% que es significativamente menor a las restantes interacciones de variantes genéticas estudiadas. CUADRO 16 Valores de producción de leche y contenido proteico para combinaciones de variantes de κ-caseína y ß-lactoglobulina. (Promedio ± Error estándar) κ-caseína A κ-caseína B ß-Lg AA ß-Lg AB ß-Lg AA ß-Lg AB n= 8 n=8 n = 16 n = 48 Producción de leche/ordeño AM (kg) 9,28±0,65a 13,42±0,65 b 9,99±0,46ª 10,99±0,27ª % proteína total 3,14±0,05b 2,89±0,05ª 3,06±0,03b 3,13±0,02b % proteína del suero 0,789±0,013c 0,669±0,013ª 0,690±0,009 a 0,741±0,005 b % caseína 2,35±0,04a b 2,22±0,04ª 2,37±0,03b 2,39±0,02b N° caseína 74,88±0,46 a 76,87±0,46 bc 77,41±0,33c 76,31±0,19 b Característica *Promedios para un componente con letras distintas denotan diferencias significativas. En cuanto al contenido de proteína del suero, la combinación de variantes de κcaseína y ß-lactoglobulina, A/AA respectivamente, presentó un promedio significativamente mayor (0,789%) a lo estimado para las restantes combinaciones en estudio. La combinación de variantes A/AB y B/AA presentaron los valores más bajos de proteína del suero, mostrando la combinación de variantes B/AB un contenido de proteína intermedio. 63 Referente al contenido de caseína, los mayores valores promedios se registraron para las combinaciones que contenían la variante B de κ-caseína, registrándose valores promedios de 2,39% y 2,37%, para las combinaciones de variantes B/AB y B/AA de κ-caseína y ß-lactoglobulina, respectivamente. Las otras combinaciones estudiadas presentaron contenidos de caseína significativamente menores. Para el número de caseína, el mayor valor promedio (77,41) fue logrado por la leche que contenía la combinación de variantes B/AA de κ-caseína y ßlactoglobulina, respectivamente. Por el contrario, un valor significativamente menor fue registrado para la combinación de variantes A/AA. Pocos autores han encontrado interacción de las variantes genéticas de κcaseína y ß-lactoglobulina sobre algunos de los componentes antes analizados. Sin embargo, HILL et al. (1997), en estudios con ganado Lechero Neozelandés, señalan que la leche de vacas que presentan la combinación de variantes AA/AA de κ-caseína y ß-lactoglobulina tienen un contenido significativamente mayor de proteínas del suero, en comparación con otras combinaciones de variantes de las mismas proteínas. Además, mencionan que la leche de vacas que presentan la combinación BB/BB de κ-caseína y ß-lactoglobulina contiene significativamente un número de caseína mayor que las restantes combinaciones de variantes. Por otro lado, Mayer et al. citados por JAKOB y PUHAN (1995), al estudiar la presencia de las variantes de ß-caseína, κ-caseína y ß-lactoglobulina (ß Cn/ κ Cn/ ß Lg) en leche de ganado austríaco, mencionan la existencia de una interacción altamente significativa entre las variantes de estas tres proteínas para los contenidos de proteína total, caseína y proteína del suero. Es así como la combinación de variantes A2A2/BB/BB presentó un número de caseína mayor que la combinación A2B/AA/AA. Estos autores atribuyen la interacción a la 64 existencia de un efecto epistático entre los locus de los genes de las proteínas antes señaladas. Las diferencias entre los resultados obtenidos en el presente estudio y lo señalado por los autores antes mencionados, se deben esencialmente a la raza estudiada en cada investigación, el número de vacas en estudio, así como también, al diseño experimental y al modelo empleado en el análisis estadístico de los datos. 65 5. CONCLUSIONES De los resultados obtenidos se puede concluir que: § Se identificaron, las variantes genéticas A y B de κ-caseína y ßlactoglobulina en la leche de vacas Frisón Negro. § El contenido promedio de proteína total, caseína y proteína del suero en la leche de vacas Frisón Negro, fue de 3,09, 2,36 y 0,72, respectivamente. § La leche de vacas con la variante B de κ-caseína presentó un contenido significativamente mayor de proteína total, caseína y número de caseína, respecto de la variante A. § La leche de vacas con la variante A de ß-lactoglobulina presentó un contenido mayor de proteína total y proteína del suero, respecto de la leche de vacas que contenían las variantes A y B, conjuntamente. § El contenido de proteína total se ve afectado por la interacción de κ-caseína y ß-lactoglobulina, estableciéndose que el contenido es menor en presencia de las variantes A y AB de κ-caseína y ß-lactoglobulina, respectivamente. Respecto al contenido de caseína, este no es afectado por las variantes de ß-lactoglobulina, pero es mayor cuando está presente la variante B de κcaseína en combinación con A o AB de ß-lactoglobulina. Para el número de caseína se verifica que la presencia de las variantes B y A de κ-caseína y ßlactoglobulina presentan un número de caseína significativamente mayor. 66 6. RESUMEN El presente trabajo tuvo como objetivo determinar el efecto de la expresión de las variantes genéticas de κ caseína y β lactoglobulina sobre el contenido proteico de la leche de 10 vacas Frisón Negro. Las muestras de leche se obtuvieron de vacas raza Frisón Negro, desde el predio Santa Rosa de la Universidad Austral de Chile durante el período Septiembre – Diciembre de 2001. A las muestras de leche se les determinó el contenido proteico total, proteína del suero y caseína. A su vez, se realizó la separación de κ-caseína y βlactoglobulina de las muestras de leche según los métodos establecidos por McKENZIE y WAKE (1961) y LOWE et al. (1995), respectivamente. Una vez realizada la separación, se determinó la presencia de las variantes de κ-caseína y β-lactoglobulina, según el método de electroforesis de isoelectroenfoque utilizado por CASANOVA (2001). Se obtuvo, para la leche de vaca Frisón Negro, un contenido promedio de proteína total, proteína del suero, caseína y número de caseína de 3,09%, 0,72%, 2,36% y 76,44, respectivamente. En la electroforesis, se estableció que las muestras de leche presentaban las variantes A y B de κ-caseína y β-lactoglobulina. Identificándose en algunas muestras de leche la presencia conjunta de las variantes A y B de βlactoglobulina, existiendo en este caso una mayor proporción de expresión para la variante A. Se concluyó que el contenido de proteína total, caseína y número de caseína son afectados significativamente por la variante B de κ-caseína; respecto al contenido de proteínas del suero, se estableció que es afectado por las variantes de β-lactoglobulina. Además, se estableció que existe una interacción significativa entre las variantes de κ-caseína y β-lactoglobulina influenciando el contenido proteico de las leches que presentan una determinada variante genética. 67 SUMMARY The present wo rk had as objective to determine the effect of the expression of the genetic variants of κ-casein and β-lactoglobulin on the milk protein composition in milk from 10 Frisón Negro cows. The samples of milk were obtained of Frisón Negro cows, from the “Santa Rosa” farm of the “Universidad Austral de Chile” during the period September December of 2001. To the samples of milk they were determined total protein, whey protein and casein. In turn, was carried out the κ-casein and β-lactoglobulin separation of the samples of milk according to the methods settled down by McKENZIE and WAKE (1961) and LOWE et al. (1995), respectively. Once carried out the separation, was determined the presence of the genetics variants of κ-casein and β-lactoglobulin, according to the method of isoelectric focusing used by CASANOVA (2001). It was obtained, for the cow milk Frisón Negro, a content average of total protein, whey proteins, casein and number of casein of 3,09%, 0,72%, 2,36% and 76,44, respectively. In the electrophoresis, settled down that the samples of milk presented the A and B variants of κ-casein and β-lactoglobulina. Being identified in some samples the combined presence of the A and B variants of β-lactoglobulina, existing in this case a bigger expression proportion for the A variant. The content of total protein, casein and casein number are affected significantly by the B variant of κ-casein; regarding the content of whey proteins settled down that it is affected by the β-lactoglobulin variants. Also, settled down that a significant interaction exists between the κ-casein and β-lactoglobulin variants influencing the protein composition of the milk that present a certain genetic variant. 68 BIBLIOGRAFIA ADDEO, F., CHIANESE, L., DI LUCCIA, A., PETRILLI, P., MAURIELLO, R., ANELLI, G. 1983. Identification of bovine casein variants by gel isoelectric focusing. Milchwissenschaft. 38 (10): 586 - 588. ALAIS, CH. 1985. Ciencia de la leche: Principios de técnica lechera. Editorial Reverté, Barcelona, España. 873 p. ALEANDRI, R., BUTTAZZONI, L., SCHNEIDER, J., CAROLI, A. y DAVOLI, R. 1990. The effects of milk protein polymorphisms on milk components cheese producing ability. Journal of Dairy Science, 73: 241 – 255. AMIGO, L., MARTIN-ALVAREZ, P., GARCIA-MURO, E. y ZARAZAGA, I.. 2001 Effect of milk protein haplotypes on the composition and technological properties of Fleckvieh bovine milk. Milchwissenschaft, 56 (9): 488 - 491 . AMIOT, J. 1991. Ciencia y tecnología de la leche. Editorial Acribia. Zaragoza , España. Pp. 21 – 32. ASCHAFFENBURG, R. y DREWRY, J. 1957. Genetics of the β lactoglobulins of cow’s milk. Nature, 180: 376 – 378. ATHERTON, H. y NEWLANDER, J. 1977. Chemistry and testing of dairy products, AVI Publishing Company, Inc. Wesport, Connecticut. Pp. 1 – 33. BADUI, S. 1984. Química de los alimentos. Editorial Alhambra mexicana S. A.. México DF. 427 p. BARANYI, M., BÖSZE, Z., BUCHBERGER, J. y KRAUSE, I. 1997. Genetic polymorphism of milk proteins in hungarian cattle breeds and PCR amplification of β lactoglobulin exon 5 to identify genetic variant j by 69 RFLP. En: Milk Protein Polymorphism. International Dairy Federation. Brussels, Belgium. Pp. 87 – 92. BELITZ, H. D. y GROSCH, W. 1997. Leche y productos lácteos. En: Química de los alimentos. Editorial Acribia. Zaragoza, España. Pp. 537 - 552. BOLAND, M. y HILL, J. 2001. Genetic selection to increase cheese yield. The Kaikoura experience. The Australian Journal of Dairy Technology. 56 (2):171- 176. BOVENHUIS, H., van ARENDONK, J., KORVER, S. 1992. Associations between milk protein polymorphism and milk production traits. Journal of Dairy Science. 72: 2549 – 2559. CASADO, P. y GARCIA, J.A. 1985. La calidad de la leche y los factores que la influencian. Industrias Lácteas Españolas, N° 81. 298 p. CASANOVA, M. 2001. Identificación de las variantes genéticas de ?-caseína en leche de vacas Holstein – Friesian y Jersey por electroforesis de isoenfoque. Tesis Lic. en Ing. en Alimentos. Valdivia. Universidad Austral de Chile, Facultad de Ciencias Agrarias. 102 p. CERBULIS, J. y FARRELL, H. 1975. Composition of Milks of Dairy Cattle. I. Protein, Lactose, and Fat Contents and Distribution of Protein Fraction. Journal of Dairy Science. 58: 817 – 827. CHILE. Instituto Nacional de Normalización. INN. 1998. Norma Chilena NCh 1011/1. Leche y Productos lácteos. Muestreo, parte 1. Santiago, Chile. COULTATE, T. 1998. Manual de química y bioquímica de los alimentos. Editorial Acribia, S. A. Zaragoza, España. Pp. 95 – 116. CREAMER, L. y HARRIS, D. 1997. Relationship between milk protein polymorphism and physico-chemical properties. En: Milk Protein Polymorphism. International Dairy Federation. Brussels, Belgium. Pp. 112 – 117. 70 DALGLEISH, D. 1995. Technological Properties of milk Protein Variants. En: Implications of Genetic Polymorphism of Milk Proteins on Production and Processing of milk. FIL - IDF Bulletin. 304. 23p. DE JONG, L. 1975. A quantitative electrophoretic method of studing cheese ripening. Neth. Milk Dairy J. 29: 186 – 192. DELACROIX – BUCHET, A., LEIFIER, D. y NUYTS – PETIT, V. 1993. Polymorphism of kappa casein from three French breeds and its coagulability. Lait. 73: 61 – 72. DE PETERS, E. y FERGUSON, J. 1992. Non protein Nitrogen and Protein Distribution in the Milk of Cows. Journal of Dairy Science, 75 (11): 3192 – 3209. Di LUCCIA, A., ADDEO, F., CORRADINI, C. y MARIANI, P. 1988. Bovine κ Casein C: an electrophoretic study. Scienza e tecnica lattiero-casearia. 39 (6): 413 – 422. EIGEL, W., BUTLER, J. y ERNSTROM, C. 1984. Nomenclature of Proteins of Cow ‘s Milk. Journal of Dairy Science, 67 (8): 1599 – 1631. FELMER, R. y BUTENDIECK, N. 1998. Frecuencia alélica del gen de la κ caseína bovina en un rebaño Frisón Negro Chileno. Archivos de Medicina Veterinaria, 30 (2): 145-151. FENNEMA, O. 1993. Química de los alimentos. Editorial Acribia S. A. Zaragoza, España. Pp. 889 – 929. FITZGERALD, R. y HILL, J. 1997. The Relationship between Milk Protein Polymorphism and the Manufacture and Functionality of Dairy Products. En: Milk Protein Polymorphism. International Dairy Federation. Brussels, Belgium. Pp. 355 – 371. FOX, P. F. Y McSWEENEY, P. 1998. Dairy Chemistry and Biochemistry. Blackie Academic & Professional. London. Pp. 146 – 237. 71 FREIFELDER, D. 1982. Phisycal Biochemistry. Applications to Biochemistry and Molecular Biology. W.H. Freeman and Company. USA. Pp. 309 – 312. GONYON, D., MATHER, R., HINES, H., HAENLEIN, C., ARAVE, C. y GAUNT, S. 1987. Association of bovine blood and milk polymorphism with lactation traits: Holstein. Journal of Dairy Science. 70: 2585 – 2598. GONZALEZ de LLANO, D. 1990. Polimorfismo genético de las proteínas de la leche de vaca. Alimentación, Equipos y Tecnología. Julio – Agosto: 77 – 81. HAENLEIN, C., GONYON, D., MATHER, R. y HINES, H. 1987. Association of bovine blood and milk polymorphism with lactation traits: Guernseys. Journal of Dairy Science. 70: 2599 – 2609. HAMES, B. 1998. Gel electrophoresis of Proteins, A practical approach. Oxford University Press. USA. Pp. 127-187. HILL, J., PATERSON, G. y McGIBBON, A. 1997. Joint Effect of β Lactoglobulin and κ Casein variants on the heat stability of milk. . En: Milk Protein Polymorphism. International Dairy Federation. Brussels, Belgium. Pp. 231 – 236. HORNE, D. y MUIR, D. 1994. Genetic polymorphism of κ- caseína and rennet coagulation time. Milchwissenschaft, 49(8): 446 – 449. IKONEN, T., BOVENHUIS, H., OJALA, M., RUOTTINEN, O. y GEORGES, M.. 2001. Association between Casein Haplotypes and Lactation Milk Production Traits in Finnish Ayrshire Cows. Journal of Dairy Science, 84 (2): 507 – 514. INTERNATIONAL DAIRY FEDERATION. 1993. International IDF Standard. 20B: 1993. Milk. Determination of Nitrogen Content. Part 3: Block – digestion method. Belgium. Pp. 7 – 9. 72 JAKOB, E. 1994. Genetic Polymorphism of Milk Proteins. FIL – IDF Bulletin. 298. 11p. JAKOB, E. y PUHAN, Z. 1995. Implications of Genetic Polymorphism of Milk Proteins on Production and Processing of Milk. Bulletin FIL -IDF. 304. 25 p. KROEKER, E., NG KWAI HANG, K., HAYES, J. y MOXLEY, J. 1985. Effects of Environmental factors and Milk Protein Polymorphism on Composition of Casein Fraction in Bovine Milk. Journal of Dairy Science. 68 (7): 1752 – 1757. LATRILLE, L. 1993. El valor nutritivo de la leche bovina y factores que alteran su composición. En: Producción Animal, Fac. Ciencias Agrarias, Universidad Austral de Chile. Pp. 27 – 56. LAVIN, R. 1996. Variaciones de la composición láctea de vacas con distinto número de lactancia. Tesis Lic. en Med. Veterinaria. Valdivia. Universidad Austral de Chile, Facultad de Ciencias Veterinarias. 54 p. LEHNINGER, A. y NELSON, C. 1995. Principios de bioquímica. Editorial Omega. Barcelona, España. Pp. 136 – 147. LIN, C., McALLISTER, A., NG KWAI HANG, K. y HAYES, J. 1986. Effects of milk protein loci on first lactation in dairy cattle. Journal of Dairy Science. 69: 704 – 712. LOWE, R., ANEMA, S., PATERSON, G. y HILL, J. 1995. Simultaneous separation of the β Lactoglobulina A, B and C variants using polyacrylamide gel electrophoresis. Milchwissenschaft. 50 (12): 663 – 666. LOWRY, O., ROSEBROUGH, N., FARR, A. y RANDALL, R. 1951. Protein Measurement with the Folin Phenol Reagent. Journal of Biological Chemistry. 193: 265-275. 73 MARIANI, P., ZANZUCCHI, G., MASORI, M., SERVENTI, P. y PECORARI, M. 1995. Percentage distribution of caseins and kappa-casein fractions separated by reverse-phase HPLC in Italian Brown cows with different genotypes at the kappa-casein locus. Sc. Tecn. Latt. Caes. 46: 30 – 35. McKENZIE, H. y WAKE, R. 1961. An improved method for the isolation of κcasein. Biochemistry Biophysical Acta. 47: 240 – 242. McLEAN, D., GRAHAM, B. y PONZONI, R. 1984. Effects of milk protein genetic variants on milk yield and composition. Journal of Dairy Research. 51: 531 – 546. NG KWAI HANG, K. 1997. A review of the relationship between milk protein polymorphism and milk composition/milk production. En: Milk Protein Polymorphism. International Dairy Federation. Brussels, Belgium. Pp.2237. NG KWAI HANG, K., MONARDES, H. y HAYES, J. 1990. Association between genetic polymorphism of milk proteins and production traits during three lactations. Journal of Dairy Science. 73: 3414 – 3420. NG KWAI HANG, K., HAYES, J., MOXLEY, J. y MONARDES, H. 1986. Relationships Between Milk Polymorphisms and Major Milk Constituents in Holstein-Fresian Cows. Journal of Dairy Science, 69 (1): 22 – 26. NG KWAI HANG, K., HAYES, J., MOXLEY, J. y MONARDES, H. 1984. Association of Generic Variants of Casein and Milk serum Proteins with Milk, Fat, and Protein Production by Dairy Cattle. Journal of Dairy Science, 67: 835 – 840. NG KWAI HANG, K., HAYES, J., MOXLEY, J. y MONARDES, H. 1982. Environmental Influences on Protein Content and Composition of Bovine Milk. Journal of Dairy Science, 65: 1993 – 1998. 74 PINTO, M., VEGA Y LEON, S. y PEREZ, N. 1998. Métodos de análisis de la leche y derivados. Garantía de calidad. Editorial U.A.CH., Dirección de investigación y desarrollo. Valdivia, Chile. 489 p. PLUMMER, D. 1981. Bioquímica practica. Edit. McGraw – Hill Latinoamericana S. A. Bogotá, Colombia. Pp. 83 – 85. PRIMO, E. 1997. La leche y los productos lácteos En: Química de los Alimentos. Editorial Síntesis. Madrid, España. Pp. 344 – 354. RAHALI, V. y MÉNARD, J. 1991. Influence des variants génétiques de la β lactoglobuline et de la κ - caseína sur la composition du lait et son aptitude fromagere. Lait. 71: 275 – 297. ROZZI, P., SERVENTI, P. y RONCHI, S. 1989. Effetto delle varianti di κ caseína e β - lattoglobulina sugli indici genetici produttivi di bovine di razza frisona. Sc. Tecn. Latt. Caes. 40 (6): 411 - 422. SCHAAR, J., HANSSON, B. y PETTERSSON, H. 1985. Effects of genetic variants of κ - caseína and β - lactoglobulina on Cheesemaking. Journal of Dairy Research, 52 (14): 429 – 437. STRYER, L. 1995. Bioquímica. Editorial Reverté, S. A.. Barcelona, España. Pp.17 – 40. VAN EENENNAAM, A. y MEDRANO, J. 1991. Milk Protein Polymorphisms in California Dairy Cattle. Journal of Dairy Science, 47 (5): 1730 – 1742. VEYSSEYRE, R. 1980. Lactología técnica. Editorial Acribia. Zaragoza, España. Pp. 11 – 32. WALSTRA, P., GEURTS, T., NOOMEN, A., JELLEMA, A. y VAN BOEKEL, M. 1999. Dairy Technology. Marcel Dekker, Inc. New York, USA. 727p. WEBB, B., JOHNSON, A. y ALFORD, J. 1980. Fundamentals of Dairy Chemistry. AVI Publishing Company, Inc. Wesport, Connecticut. Pp. 2 – 124. 75 WINKELMAN, A. y WICKHAM, B. 1997. Associations between milk protein genetic variants and production traits in New Zealand Dairy cattle. En: Milk Protein Polymorphism. International Dairy Federation. Brussels, Belgium. Pp. 38 – 45. WONG, D. 1995. Química de los Alimentos. Editorial Acribia S. A. Zaragoza, España. Pp. 96 – 101. 76 ANEXOS 77 ANEXO 1 Encuesta de vacas Frisón Negro Predio Sta. Rosa. Número predial: ___________________ Nombre de la vaca:________________ Fecha de parto:_____________ Edad de parto:______________ Número de partos:___________ Producción de leche:_________ Producción de grasa:_________ Meses de lactancia:__________ Alimentación:__________________________________________________ _____________________________________________________________ Observaciones:________________________________________________ _____________________________________________________________ 78 ANEXO 2 Información vacas Frisón Negro predio Sta. Rosa. Fechas de N° de Meses de parto lactancias lactancia Vaca Edad % HF 546 3 años 46,75 19/03/01 1 6 560 3 años 27,75 31/03/01 1 6 579 3 años 25,0 23/03/01 1 6 591 3 años 43,5 20/03/01 1 6 596 3 años 34,38 10/04/01 1 5 633 3 años 56,25 23/03/01 1 6 636 3 años 12,5 01/03/01 1 6 639 3 años 7,5 17/03/01 1 6 642 3 años 0 28/03/01 1 6 644 3 años 100 29/03/01 1 6 Alimentación § § Pradera. Suplemento: Concentrado y sales minerales. 79 ANEXO 3 Metodología de separación de proteína no caseínica según McGann et al. citado por PINTO et al. (1998) Separación de la proteína no caseínica (PNC): - Transferir 100 ml de leche en un matraz cónico limpio y seco. - Llevar a 40 °C y agregar 3 ml de ácido acético 33.3 % p/v y colocar a baño María. - Después de 10 minutos agregar 3 ml de acetato de sodio 3.33 N, mezclar y esperar 3 minutos. - Filtrar a través de filtro plegado (Whatmann n° 40) y recibir el filtrado en matraz cónico seco. 80 ANEXO 4 Separación de κ - caseína de las muestras de leche para análisis electroforético. Preparación de κ caseína para electroforesis de isoelectroenfoque en relación a lo descrito por McKENZIE Y WAKE (1961), modificado: - Precipitar la caseína de 950 mL de leche descremada por adición de HCl 0,1 N hasta obtener un pH de 4,5. - Centrifugar a 4000 r.p.m. por 15 min. - El precipitado se filtra a través de filtro Whatman N° 2 u otra forma equivalente. - La caseína obtenida se lava 4 veces con agua destilada. - La caseína lavada se purifica con una re-precipitación isoeléctrica, disolviéndola con NaOH diluido. (0,05 M) - Agregar HCl hasta obtener un pH de 4,7. - Se centrifuga a 4000 r.p.m. por 15 min. - Se disuelve 20 g de caseína ácida con NaOH 1N hasta pH 7,0 – 7,5 y se completa con agua destilada hasta obtener un volumen aproximado de 300 mL. - Se enfría a 2 °C y se agrega 30 mL de CaCl2 4M ajustado a pH 6,5 – 7,0 con NaOH 1N. - Se agita continuamente durante 1h. Las caseínas sensibles al calcio precipitarán por calentamiento a 35 °C. - El precipitado se remueve a temperatura ambiente por centrifugación a 5500 r.p.m. por 60 min. Obteniéndose en el sobrenadante la κ - caseína. 81 ANEXO 5 Separación de β lactoglobulina de las muestras de leche para análisis electroforético. Preparación de β lactoglobulina para electroforesis de isoelectroenfoque según LOWE et al. (1995): - Preparar el suero ajustando las muestras de leche a pH 4,6 con HCl 1M. - Luego, centrifugar a 13.000 r.p.m. por un tiempo de 5 min. - El sobrenadante es diluido 10 veces en buffer muestra. 82 ANEXO 6 Determinación de proteínas de acuerdo al método de LOWRY et al. (1951) Principio. La determinación se basa en el desarrollo de color debido a la reacción de los enlaces peptídicos de las proteínas y cobre alcalino del reactivo y la reducción del fosfomolibdato – fosfotungsteno del reactivo Folin – Ciocalteau, por los aminoácidos aromáticos. Equipos y materiales. - espectofotómetro - pipetas 0.5 y 1.0 ml - Jeringa Hamilton 100 µl - Solución A: Na 2 CO3 2% P/V disuelto en NaOH 0.1 N - Solución B: CuSO4 x 5 H2O al 1% P/V y Tartrato de Na y K al 2% P/V. - Solución C: mezclar solución A y B en proporción 50:1 - Solución E: reactivo Folin – Ciocalteau 1N. A una cantidad de κ caseína, se le adiciona solución A y B las cuales reaccionan con los enlaces peptídicos. Al agregar reactivo Folin – Ciocalteau se desarrolla color azul al reaccionar con los aminoácidos aromáticos. La intensidad del color se mide en un espectofotómetro a 750 nm. Determinación. - Se mide 0,6 ml de κ caseína diluida en agua (1 ml en 3 ml) 83 Continuación ANEXO 6. - Se agrega 3ml de solución C y 0.3 ml de reactivo Folin – Ciocalteau 1N. - Se deja 30 min. a temperatura ambiente. - Se mide la absorbancia a 750 nm. Blanco: 0,6 ml de agua. Se expresan los resultados en % de proteína en la muestra original. Referencia CASANOVA (2001). 84 ANEXO 7 Curva de calibración para determinación proteica de acuerdo a método propuesto por LOWRY et al. (1951). Curva estándar. - Solución patrón: seroalbúmina de bovino (BSA) 2 mg/ml. - Medir de la solución de BSA 10, 20, 30, 40, 50 y 60 µl (20, 40, 60, 80, 100 y 120 µg de proteína) en tubos de ensayo, agregar agua hasta completar 0.6 ml. - Se agrega a cada tubo 3 ml de solución C y se deja a temperatura ambiente 10 min. - Se agrega 0.3 ml de reactivo Folin – Ciocalteau 1N. - Se deja 30 min. a temperatura ambiente. - Se mide la absorbancia a 750 nm. - Se grafica µg de proteína v/s D.O 750 nm. D.O. 750 nm. µL solución BSA (2 mg/mL) µg de proteína 10 1° y 2° muestreo 3° y 4° muestreo 20 0,077 0,103 20 40 0,182 0,157 30 60 0,270 0,275 40 80 0,334 0,340 50 100 0,417 0,419 60 120 0,474 0,485 85 Continuación ANEXO 7. Para efectuar las determinaciones correspondientes a los cuatro muestreo se construyeron dos curvas de calibración. Una se utilizó para el muestreo 1 y 2, y la restante para el muestreo 3 y 4. Muestreo 1 y 2: 0.6 0.5 D.O. 0.4 0.3 0.2 y = 0.0039x + 0.0169 R2 = 0.9911 0.1 0.0 0 20 40 60 80 100 120 140 ug proteína/0.6 mL Muestreo 3 y 4: 0.6 0.5 D.O. 0.4 0.3 0.2 y = 0.0039x + 0.0204 R2 = 0.9919 0.1 0.0 0 20 40 Referencia CASANOVA (2001) 60 80 100 ug proteína/0.6 mL 120 140 86 ANEXO 8 Protocolo de electroforesis de isoenfoque en geles de poliacrilamida, según CASANOVA (2001). Preparación de la muestra La proteína separada se disuelve en urea 7 M que contenga 0,1% de 2mercaptoetanol, obteniendo en la aplicación para la corrida de 10 µg de proteína, Preparación del gel 5 mL Acrilamida (40% acrilamida, 0,6 % bisacrilamida) 1 mL TEMED (1,75 % en agua) 2,5 mL Persulfato (0,37 % en agua) 0,5 mL Anfolito 11 mL agua, Buffer electrodos • Anodo: H2SO4 (0,2%) • Cátodo: NaOH (0,02 N) Ambas soluciones deben estar a temperatura de refrigeración al momento de utilizar, Corrida de geles • Precorrida, 200 volts por 15 min, 300 volts por 30 min, 400 volts por 60 min, Luego de la pre-corrida, se aplicaron las muestras en cada tubo. 87 • Corrida, 400 volts por 13 h, en refrigeración Tinción de geles • Los geles fueron fijados por 30 min, en solución fijadora, empleando ácido tricloroacético 15%, • Luego, se sumergieron en solución de desteñido por 30 min, La solución es preparada de la siguiente forma: 500 mL etanol, 160 mL ácido acético, completando hasta 2 litros con agua destilada, • Acto seguido, los geles se tiñen por 30 min, en solución de tinción a 60 °C, La solución de tinción es preparada utilizando 0,23 g de Coomassie Brilliant Blue G-250 la que se disuelve en 200 mL de solución de desteñido, • Finalmente, los geles se colocan en solución de desteñido. 88 ANEXO 9 Concentración de κ- caseína en muestras semi-purificadas. Muestra Muestreo D.O µg/0,6 mL µg/mL Dilución Proteína 636 1 0,083 16,95 28,25 100 2824,79 2 0,089 18,49 30,81 100 3081,20 3 0,061 10,41 17,35 100 1735,04 4 0,114 24,0 40,0 100 4000,00 1 0,070 13,62 22,69 100 2269,23 2 0,084 17,20 28,68 100 2867,52 3 0,124 26,26 43,77 100 4377,73 4 0,055 8,87 14,78 100 1478,63 1 0,068 13,10 21,83 100 2183,76 2 0,075 14,89 24,83 100 2482,91 3 0,095 18,91 31,52 100 3152,31 4 0,088 17,33 28,89 100 2888,89 1 0,059 10,79 17,99 100 1799,14 2 0,067 12,85 21,41 100 2141,02 3 0,083 15,87 26,45 100 2645,23 4 0,075 14,00 23,33 100 2333,33 1 0,069 13,74 22,90 100 2289,75 2 0,084 17,52 29,20 100 2919,55 3 0,099 20,34 33,89 100 3389,24 4 0,088 17,57 29,28 100 2928,21 1 0,072 14,13 23,55 100 2354,70 2 0,082 16,69 27,82 100 2782,05 3 0,106 21,70 36,17 100 3617,12 4 0,089 17,59 29,31 100 2931,62 644 546 591 633 642 89 Continuación ANEXO 9 Muestra Muestreo D.O µg/0,6 mL µg/mL Dilución Proteína 639 1 0,051 8,74 14,57 100 1457,26 2 0,074 14,64 24,40 100 2440,17 3 0,086 16,63 27,72 100 2772,00 4 0,101 20,66 34,40 100 3444,44 1 0,059 10,79 17,99 100 1799,14 2 0,064 12,07 20,12 100 2012,82 3 0,099 19,92 33,21 100 3321,33 4 0,095 19,12 31,88 100 3188,03 1 0,053 9,25 15,42 100 1542,73 2 0,057 10,28 17,13 100 1713,67 3 0,089 17,39 28,98 100 2898,77 4 0,090 17,84 29,74 100 2974,35 1 0,049 8,23 13,71 100 1371,79 2 0,059 10,79 17,99 100 1799,14 3 0,075 13,84 23,07 100 2307,18 4 0,097 19,64 32,73 100 3273,50 1 A.L - - - A.L 2 0,095 20,03 33,37 100 3337,61 3 0,083 15,87 26,45 100 2645,23 4 0,066 11,69 19,49 100 1948,72 1 0,078 15,67 26,11 100 2611,11 2 A.L - - 100 A.L 3 0,101 20,44 34,06 100 3405,85 4 0,076 14,26 23,76 100 2376,06 579 560 596 LM 1 LM 2 A.L: Accidente de laboratorio. 90 ANEXO 10 Concentración de β - lactoglobulina en muestras preparadas para electroforesis. Muestra Muestreo D.O. µg/0,6 mL µg/mL Dilución Proteína 636 1 0,076 15,15 25,25 100 2525,64 2 0,097 20,53 34,23 100 3423,07 3 0,078 14,76 24,61 100 2461,53 4 0,097 19,64 32,73 100 3273,50 1 0,075 14,89 24,82 100 2482,90 2 0,104 22,33 37,22 100 3722,22 3 0,098 19,89 33,16 100 3316,23 4 0,092 18,35 30,59 100 3059,82 1 0,060 11,05 18,41 100 1841,88 2 0,063 11,82 19,70 100 1970,08 3 0,076 14,25 23,76 100 2376,06 4 0,113 23,74 39,57 100 3957,26 1 0,079 15,92 26,53 100 2653,84 2 0,104 22,33 37,22 100 3722,22 3 0,098 19,89 33,16 100 3316,23 4 0,089 17,59 29,31 100 2931,62 1 0,087 17,97 29,95 100 2995,72 2 0,106 22,84 38,07 100 3807,69 3 0,077 14,51 24,18 100 2418,80 4 0,092 18,37 30,59 100 3059,82 1 0,067 12,84 21,41 100 2141,02 2 0,103 22,07 36,79 100 3679,48 3 0,065 11,43 19,05 100 1905,98 4 0,078 14,76 24,61 100 2461,53 644 546 591 633 642 91 Continuación ANEXO 10 Muestra Muestreo D.O. µg/0,6 mL µg/mL Dilución Proteína 639 1 0,083 16,94 28,24 100 2824,78 2 0,103 22,07 36,79 100 3679,48 3 0,096 19,38 32,30 100 3230,76 4 0,109 22,71 37,86 100 3786,32 1 0,065 12,33 20,55 100 2055,55 2 0,099 21,05 35,08 100 3508,54 3 0,076 14,25 23,76 100 2376,06 4 0,092 18,35 30,59 100 3059,82 1 0,081 16,43 27,39 100 2739,31 2 0,092 19,25 32,09 100 3209,40 3 0,084 16,30 27,17 100 2717,94 4 0,093 18,61 31,02 100 3102,56 1 0,063 11,82 19,70 100 1970,08 2 0,119 26,17 43,63 100 4363,24 3 0,083 16,05 26,75 100 2675,21 4 0,092 18,35 30,59 100 3059,82 1 0,089 18,48 30,81 100 3081,19 2 0,114 24,89 41,49 100 4149,57 3 0,095 19,12 31,88 100 3188,03 4 0,099 20,15 33,59 100 3358,97 1 0,081 16,43 27,39 100 2739,32 2 0,102 21,82 36,37 100 3636,75 3 0,104 21,44 35,73 100 3572,65 4 0,097 19,64 32,73 100 3273,50 579 560 596 LM 1 LM 2 92 ANEXO 11 Volumen de muestras preparadas de κ- caseína utilizadas en cada electroforesis. Muestra Muestreo Proteína total µg/mL V. electroforesis (µL) 636 1 2824,79 564,958 18 2 3081,20 616,240 16 3 1735,04 347,008 29 4 4000,00 800,00 13 1 2269,23 453,846 22 2 2867,52 573,504 17 3 4377,73 875,546 11 4 1478,63 295,726 34 1 2183,76 436,752 23 2 2482,91 496,582 20 3 3152,31 630,462 16 4 2888,89 577,778 17 1 1799,14 359,828 28 2 2141,02 428,204 23 3 2645,23 529,046 19 4 2333,33 466,666 21 1 2289,75 457,950 22 2 2919,55 583,910 17 3 3389,24 677,848 15 4 2928,21 585,642 17 1 2354,70 470,940 21 2 2782,05 556,410 18 3 3617,12 723,424 14 4 2931,62 586,324 17 644 546 591 633 642 93 Continuación ANEXO 11. Muestra Muestreo Proteína total µg/mL V. electroforesis (µL) 639 1 1457,26 291,452 34 2 2440,17 488,034 20 3 2772,00 554,400 18 4 3444,44 688,888 14 1 1799,14 359,828 28 2 2012,82 402,564 25 3 3321,33 664,266 15 4 3188,03 637,606 16 1 1542,73 308,546 32 2 1713,67 342,734 29 3 2898,77 579,754 17 4 2974,35 594,870 17 1 1371,79 274,358 36 2 1799,14 359,828 28 3 2307,18 461,436 22 4 3273,50 654,700 15 1 A.L - - 2 3337,61 667,522 15 3 2645,23 529,046 19 4 1948,72 389,744 26 1 2611,11 522,222 19 2 A.L - - 3 3405,85 681,170 15 4 2376,06 475,212 21 579 560 596 LM 1 LM 2 94 ANEXO 12 Volumen de muestras preparadas de β - lactoglobulina utilizadas en cada electroforesis. Muestra Muestreo Proteína total µg/mL V. electroforesis (µL) 636 1 2525,64 252,564 40 2 3423,07 342,307 29 3 2461,53 246,153 41 4 3273,50 327,350 31 1 2482,90 248,290 40 2 3722,22 372,222 27 3 3316,23 331,623 30 4 3059,82 305,982 33 1 1841,88 184,188 54 2 1970,08 197,008 51 3 2376,06 237,606 42 4 3957,26 395,726 25 1 2653,84 265,384 38 2 3722,22 372,222 27 3 3316,23 331,623 30 4 2931,62 293,162 34 1 2995,72 299,572 33 2 3807,69 380,769 26 3 2418,80 241,880 41 4 3059,82 305,982 33 1 2141,02 214,102 47 2 3679,48 367,948 27 3 1905,98 190,598 52 4 2461,53 246,153 41 644 546 591 633 642 95 Continuación ANEXO 12. Muestra Muestreo Proteína total µg/mL V. electroforesis (µL) 639 1 2824,78 282,478 35 2 3679,48 367,948 27 3 3230,76 323,076 31 4 3786,32 378,632 26 1 2055,55 205,555 49 2 3508,54 350,854 29 3 2376,06 237,606 42 4 3059,82 305,982 33 1 2739,31 273,931 37 2 3209,40 320,940 31 3 2717,94 271,794 37 4 3102,56 310,256 32 1 1970,08 197,008 51 2 4363,24 436,324 23 3 2675,21 267,521 37 4 3059,82 305,982 33 1 3081,19 308,119 32 2 4149,57 414,957 24 3 3188,03 318,803 31 4 3358,97 335,897 30 1 2739,32 273,932 37 2 3636,75 363,675 27 3 3572,65 357,265 28 4 3273,50 327,350 31 579 560 596 LM 1 LM 2 96 ANEXO 13 Identificación de las variantes genéticas de κ- caseína. Muestreo Vaca 1 644 639 Distancia migración muestra (mm) N.O 30,1 633 591 30,0 29,7 546 29,7 560 27,4 642 29,5 596 29,1 579 27,3 636 28,7 LM 1 LM 2 644 639 A.L N.O N.O 25,1 633 591 25,7 24 546 560 642 23,2 22,7 21,35 596 579 636 LM 1 23,7 A.L N.O 21,7 23,5 A.L 2 LM 2 Estándar κ- caseína B (4052 – 2) A (comercial) B (4052 – 2) B (4052 – 2) A (3971) B (4052 – 2) A (3971) B (4052 – 2) A (comercial) B (4052 – 2) A (comercial) B (4052 – 2) A (comercial) B (4052 – 2) A (comercial) B (4052 – 2) A (comercial) B (4052 – 2) B (4052 – 2) A (comercial) B (4052 – 2) B (4052 – 2) A (comercial) B (4052 – 2) B (4052 – 2) B (4052 – 2) A (comercial) B (4052 – 2) B (4052 – 2) Distancia migración estándar (mm) 27,7 25,1 27,7 30,1 29,2 30,1 29,2 30,1 25,1 30,1 25,1 30,1 25,1 30,1 25,1 30,1 25,1 23,0 23,48 20,30 23,0 23,48 20,3 23,0 23 23,0 20,3 23 23 - - Variante N.O B B B B A B B A B A.L N.O N.O B B B B A A B A.L N.O AyB (dfuso) A.L. 97 Continuación ANEXO 13 Muestreo Vaca 3 644 Distancia migración muestra (mm) 33,1 639 31,1 633 31,5 591 32,0 546 33,0 560 30,5 642 31,0 596 33,0 579 30,5 636 33,0 LM 1 LM 2 644 N.O N.O 35,2 639 36,0 633 34,9 591 34,5 546 34,2 560 33,1 642 34,6 596 35,3 579 33,5 636 34,9 LM 1 35,0 39,1 25,9 31,3 4 LM 2 Estándar κ- caseína B (4052 – 2) A (comercial) B (4052 – 2) A (comercial) B (4052 – 2) A (comercial) B (4052 – 2) A (comercial) B (4052 – 2) A (comercial) B (4052 – 2) A (comercial) B (4052 – 2) A (comercial) B (4052 – 2) A (comercial) B (4052 – 2) A (comercial) B (4052 – 2) A (comercial) B (4052 – 2) A (4052 – 2) B (4052 – 2) A (4052 – 2) B (4052 – 2) A (4052 – 2) B (4052 – 2) A (4052 – 2) B (4052 – 2) A (4052 – 2) B (4052 – 2) A (4052 – 2) B (4052 – 2) A (4052 – 2) B (4052 – 2) A (4052 – 2) B (4052 – 2) A (4052 – 2) B (4052 – 2) A (4052 – 2) B (4052 – 2) A (4052 – 2) B (4052 – 2) A (4052 – 2) N.O: No observado. (no visualizado en el gel, luego de teñido y desteñido) A.L: Accidente de laboratorio. Distancia migración estándar (mm) 32,0 29,5 32,0 29,5 32,0 29,5 32,0 29,5 32,0 29,5 32,0 29,5 32,0 29,5 32,0 29,5 32,0 29,5 32,0 29,5 35,0 34,3 35,0 34,3 35,0 34,3 34,9 33,8 34,9 33,8 35,0 34,3 34,9 33,8 35,0 34,3 35,0 34,3 34,9 33,8 35,0 34,3 35,0 34,3 Variante B B B B B A B B A B N.O N.O B B B B B A B B A B AyB (difuso) AyB (difuso) 98 ANEXO 14 Identificación de las variantes genéticas de ß - lactoglobulina. Muestreo Vaca Distancia migración muestra (mm) 644 15,8 – 17,1 639 14,6 633 15,4 – 16,1 591 15,5 – 18,1 546 13,4 – 16,7 560 15,7 642 13 596 14,2 – 16,86 579 15,5 – 17,5 636 17,1 – 19,1 LM 1 15,8 – 16,5 LM 2 15,1 644 15,2 – 16,5 639 N.O 1 2 633 15,3 591 15,4 (difuso) 546 15,0 – 16,5 560 15,2 642 15,4 596 15,5 – 17,5 579 14,48 (difuso) 636 14,48 – 16,8 Estándar β - lactoglobulina B A B A B A B A B A B A B A B A B A B A B A B A B A B A B A B A B A B A B A B A B A (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) (comercial) Distancia migración estándar (mm) 17,8 15,1 16,6 15,26 16,6 15,26 16,6 15,26 16,4 13,4 17,8 15,1 16,6 15,26 16,4 13,4 17,8 15,1 17,8 15,1 17,8 15,1 17,8 15,1 15,26 16,6 17,8 15,1 17,8 15,1 17,8 15,1 16,6 15,26 17,8 15,1 17,8 15,1 16,6 15,26 14,28 Variante AyB A AyB AyB AyB A A AyB AyB AyB AyB A AyB N.O AyB A AyB A A AyB A AyB 99 Distancia migración estándar (mm) B (comercial) 17,40 644 15,90 – 17,86 A (comercial) 15,48 B (comercial) 17,40 639 16,04 A (comercial) 15,48 B (comercial) 17,40 633 15,38 – 17,78 A (comercial) 15,48 B (comercial) 17,40 591 15,40 – 17,82 A (comercial) 15,48 B (comercial) 17,40 546 15,60 – 17,76 A (comercial) 15,48 B (comercial) 17,4 560 15,7 A (comercial) 15,48 3 B (comercial) 17,40 642 15,38 A (comercial) 15,48 B (comercial) 17,40 596 15,42 – 18 A (comercial) 15,48 B (comercial) 17,40 579 16 – 18,38 A (comercial) 15,48 B (comercial) 17,40 636 15,40 – 18,24 A (comercial) 15,48 B (comercial) 18,18 LM 1 16,24 – 17,62 A (comercial) 16,10 B (comercial) 18,18 LM 2 16,48 A (comercial) 16,10 B (comercial) 17,80 644 15,12 – 16,30 A (comercial) 15,76 B (comercial) 17,80 639 16,0 A (comercial) 15,76 B (comercial) 17,80 633 15,70 – 17,22 A (comercial) 15,76 B (comercial) 17,80 591 15,72 – 17,86 A (comercial) 15,76 B (comercial) 17,80 546 15,70 – 17,5 A (comercial) 15,76 B (comercial) 17,80 560 15,46 4 A (comercial) 15,76 B (comercial) 17,80 642 16,0 A (comercial) 15,76 B (comercial) 17,80 596 15,64 – 17,48 A (comercial) 15,76 B (comercial) 17,80 579 16,34 – 18,1 A (comercial) 15,76 B (comercial) 17,80 636 14,70 – 16,10 A (comercial) 15,76 B (comercial) 18,18 LM 1 16,32 – 17,90 A (comercial) 16,10 LM 2 N.O N.O: No observado. (no visualizado en el gel, luego de teñido y desteñido) A.L: Accidente de laboratorio. Muestreo Vaca Distancia migración muestra (mm) Estándar β - lactoglobulina Variante AyB A AyB AyB AyB A A AyB AyB AyB AyB AyB AyB A AyB AyB AyB A A AyB AyB AyB AyB N.O 100 ANEXO 15 Densitogramas obtenidos en ß – lactoglobulina de leche de vacas Frisón negro. 636 560 579 ß-Lg A y B ß-Lg A ß-Lg A y B (1,66 : 1) - (1,02 : 1) 591 596 633 ß-Lg A y B ß-Lg A y B ß-Lg A y B (1,15 : 1) (2,89 : 1) (5,4 : 1) 101 Continuación ANEXO 15. 642 644 546 ß-Lg A ß-Lg A y B ß-Lg A y B - (5 : 1) (0,92 : 1) 102 ANEXO 16 Densitogramas obtenidos en κ- caseína de leche de vacas Frisón Negro. 579 591 639 κ-CN A κ-CN B κ-CN B 560 546 644 κ-CN A κ-CN B κ-CN B 103 Continuación ANEXO 16. 636 633 642 κ-CN B κ-CN B κ-CN B 596 St. 4052-2 St. 3971-1 κ-CN B κ-CN B κ-CN A 104 ANEXO 17 Resultados de contenido proteico para leche de vacas Frisón Negro. 1° Muestreo: Muestra % Prot. total % Prot. Suero % caseína N° de caseína 636 2,89 0,699 2,19 75,81 636 644 2,96 2,91 0,699 0,686 2,26 2,22 76,39 76,43 644 546 2,96 2,90 0,669 0,802 2,29 2,10 77,40 72,34 546 2,97 0,803 2,17 72,96 591 591 2,80 2,79 0,753 0,734 2,05 2,06 73,11 73,69 633 633 2,90 2,89 0,775 0,774 2,13 2,12 73,28 73,22 642 642 3,02 3,02 0,665 0,664 2,36 2,36 77,98 78,01 639 639 3,23 3,03 0,695 0,693 2,54 2,34 78,48 77,13 579 579 2,86 2,87 0,658 0,666 2,20 2,20 76,99 76,79 560 560 3,13 3,09 0,722 0,735 2,41 2,36 76,93 76,21 596 596 3,05 3,06 0,669 0,673 2,38 2,39 78,07 78,01 LM 1 LM 1 3,26 3,19 0,752 0,759 2,51 2,43 76,93 76,21 LM 2 LM 2 3,19 3,17 0,673 0,692 2,52 2,48 78,90 78,17 105 Continuación ANEXO 17. 2° Muestreo: Muestra % Prot. Total % Prot. Suero % caseína N° de caseína 636 636 3,35 3,17 0,802 0,772 2,55 2,40 76,06 75,65 644 3,25 0,801 2,45 75,35 644 546 3,27 3,38 0,713 0,798 2,56 2,58 78,20 76,39 546 591 3,25 3,16 0,772 0,787 2,48 2,37 76,25 75,09 591 3,17 0,770 2,40 75,71 633 633 3,58 3,49 0,775 0,764 2,81 2,73 78,35 78,11 642 642 3,12 3,19 0,713 0,706 2,41 2,48 77,15 77,87 639 639 3,26 3,29 0,712 0,713 2,55 2,58 78,16 78,33 579 579 2,89 2,83 0,659 0,659 2,23 2,17 77,20 76,71 560 560 3,07 3,19 0,806 0,797 2,26 2,39 73,75 75,02 596 596 2,97 3,14 0,678 0,688 2,29 2,45 77,17 78,09 LM 1 LM 1 3,18 3,11 0,758 0,738 2,42 2,37 76,16 76,27 LM 2 LM 2 3,18 3,21 0,743 0,745 2,44 2,47 76,64 76,79 106 Continuación ANEXO 17. 3° Muestreo: Muestra % Prot. Total % Prot. Suero % caseína N° de caseína 636 636 3,27 3,30 0,693 0,699 2,58 2,60 78,81 78,82 644 3,09 0,713 2,38 76,93 644 546 3,11 3,16 0,719 0,745 2,39 2,42 76,88 76,42 546 591 3,17 3,04 0,745 0,759 2,43 2,67 76,50 77,87 591 3,07 0,763 2,68 77,82 633 633 3,43 3,44 0,759 0,763 2,67 2,68 77,87 77,82 642 642 2,97 2,92 0,691 0,686 2,28 2,23 76,73 76,51 639 639 2,86 2,93 0,661 0,677 2,20 2,25 76,89 76,89 579 579 2,86 2,86 0,690 0,689 2,17 2,17 75,87 75,91 560 560 3,18 3,23 0,802 0,807 2,38 2,42 74,78 75,02 596 596 2,81 2,87 0,637 0,642 2,17 2,23 77,33 77,63 LM 1 LM 1 3,24 3,20 0,709 0,719 2,53 2,48 78,12 77,53 LM 2 LM 2 3,00 3,03 0,725 0,722 2,28 2,31 75,83 76,17 107 Continuación ANEXO 17. 4° Muestreo: Muestra % Prot. Total % Prot. Suero % caseína N° de caseína 636 636 3,35 3,32 0,721 0,743 2,63 2,58 78,48 77,62 644 3,04 0,749 2,29 75,36 644 546 3,06 3,22 0,766 0,762 2,29 2,46 74,97 76,34 546 591 3,26 3,15 0,753 0,824 2,51 2,33 76,90 73,84 591 3,16 0,822 2,34 73,99 633 633 3,40 3,45 0,764 0,779 2,64 2,67 77,53 77,42 642 642 2,99 2,94 0,682 0,677 2,31 2,26 77,19 76,97 639 639 3,09 3,04 0,702 0,698 2,39 2,34 77,28 77,04 579 579 2,99 2,98 0,675 0,654 2,32 2,33 77,42 78,05 560 560 3,10 3,15 0,820 0,827 2,28 2,32 73,55 73,75 596 596 3,03 2,98 0,699 0,695 2,33 2,29 76,93 76,68 LM 1 LM 1 3,09 3,10 0,726 0,737 2,36 2,36 76,50 76,23 LM 2 LM 2 3,19 3,24 0,734 0,739 2,46 2,50 76,99 77,19 108 ANEXO 18 Valores F para análisis de varianzas en relación con la producción y composición proteica de leche de vacas Frisón Negro. § Tabla resumen. Composición Factores gl Producción % Proteína % Proteína de leche total del suero % Caseína Número de caseína A: Muestreo 3 1,07 1,99 2,13 1,19 0,31 B: κ Caseína 1 2,60 4,05 * 1,63 6,44 * 6,85 C: β lactoglobulina 1 22,99 4,96 * 10,22 1,92 1,38 AxB 3 3,88 2,17 1,47 2,00 1,31 AxC 3 0,35 1,44 0,67 2,30 2,61 BxC 1 8,65* 18,01 62,04 4,53 * 16,74 AxBxC 3 1,75 1,60 1,19 1,62 1,42 * * * Interacciones: * denota efecto significativo (p<0.05) * * * 109 Continuación ANEXO 18. • Resultados Statgraphics 2.0. Análisis de Varianza para Proteína total. ----------------------------------------------------------------------------------------------------------------Fuente Suma de cuadrados gl Cuadrado medio F Valor p ----------------------------------------------------------------------------------------------------------------Efectos principales A: Muestreo 0,106806 3 0,0356019 1,99 0,1247 B: Variantes ? 0,072463 1 0,072463 4,05 0,0485 C: Variantes ß 0,088838 1 0,088838 4,96 0,0295 INTERACCIONES AB AC BC ABC 0,116556 0,0776057 0,322588 0,0858807 3 3 1 3 0,0388519 0,0258686 0,322588 0,0286269 2,17 1,44 18,01 1,60 0,1003 0,2383 0,0001 0,1986 RESIDUAL 1,1465 64 0,0179141 ----------------------------------------------------------------------------------------------------------------TOTAL (Corregido) 2,60259 79 ----------------------------------------------------------------------------------------------------------------Valor p<0,05 indica que el factor tiene un efecto estadísticamente significativo al 95% de confianza. Análisis de Varianza para Proteínas del suero. ---------------------------------------------------------------------------------------------------------------Fuente Suma de cuadrados gl Cuadrado medio F Valor p ---------------------------------------------------------------------------------------------------------------Efectos principales A: Muestreo 0,00913309 3 0,00304436 2,13 0,1047 B: Variantes ? 0,00232408 1 0,00232408 1,63 0,2065 C: Variantes ß 0,0145778 1 0,0145778 10,22 0,0022 INTERACCIONES AB AC BC ABC 0,00630197 0,00285623 0,0885371 0,00508373 3 3 1 3 0,00210066 0,000952078 0,0885371 0,00169458 1,47 0,67 62,04 1,19 0,2305 0,5753 0,0000 0,3216 RESIDUAL 0,0913272 64 0,00142699 ---------------------------------------------------------------------------------------------------------------TOTAL (Corregido) 0,210615 79 ---------------------------------------------------------------------------------------------------------------Valor p<0,05 indica que el factor tiene un efecto estadísticamente significativo al 95% de confianza. 110 Continuación ANEXO 18. Análisis de Varianza para Caseína. ------------------------------------------------------------------------------------------------------------------Fuente Suma de cuadrados gl Cuadrado medio F Valor p ------------------------------------------------------------------------------------------------------------------Efectos principales A: Muestreo 0,0574671 3 0,0191557 1,19 0,3212 B: Variantes ? 0,103835 1 0,103835 6,44 0,0136 C: Variantes ß 0,0308814 1 0,0308814 1,92 0,1711 INTERACCIONES AB AC BC ABC 0,0969264 0,111117 0,073047 0,0783889 3 3 1 3 0,0323088 0,037039 0,073047 0,0261296 2,00 2,30 4,53 1,62 0,1222 0,0859 0,0371 0,1932 RESIDUAL 1,03158 64 0,0161184 ------------------------------------------------------------------------------------------------------------------TOTAL (Corregido) 2,09488 79 ------------------------------------------------------------------------------------------------------------------Valor p<0,05 indica que el factor tiene un efecto estadísticamente significativo al 95% de confianza. Análisis de Varianza para N° caseína. ----------------------------------------------------------------------------------------------------------------Fuente Suma de cuadrados gl Cuadrado medio F Valor p ----------------------------------------------------------------------------------------------------------------Efectos principales A: Muestreo 1.58367 3 0.52789 0.31 0.8198 B: Variantes ? 11.7513 1 11.7513 6.85 0.0111 C: Variantes ß 2.36519 1 2.36519 1.38 0.2448 INTERACCIONES AB AC BC ABC 6.76078 13.4605 28.7293 7.32512 3 3 1 3 2.25359 4.48684 28.7293 2.44171 1.31 2.61 16.74 1.42 0.2779 0.0587 0.0001 0.2443 RESIDUAL 109.842 64 1.71628 ---------------------------------------------------------------------------------------------------------------TOTAL (Corregido) 192.271 79 ---------------------------------------------------------------------------------------------------------------Valor p<0,05 indica que el factor tiene un efecto estadísticamente significativo al 95% de confianza. 111 Continuación ANEXO 18. Análisis de Varianza para prod. leche --------------------------------------------------------------------------------------------------------------Fuente Suma de cuadrados gl Cuadrado medio F Valor p --------------------------------------------------------------------------------------------------------------Efectos principales A :Muestreo 10.972 3 3.65732 1.07 0.3680 B: variantes ? 8.8752 1 8.8752 2.60 0.1120 C: variantes ß 78.5511 1 78.5511 22.99 0.0000 INTERACCIONES AB AC BC ABC 39.7276 3.6 29.56 17.9778 3 3 1 3 13.2425 1.2 29.56 5.99261 3.88 0.35 8.65 1.75 0.0131 0.7884 0.0045 0.1650 RESIDUAL 218.685 64 3.41695 --------------------------------------------------------------------------------------------------------------TOTAL (Corregido) 392.941 79 --------------------------------------------------------------------------------------------------------------Valor p<0,05 indica que el factor tiene un efecto estadísticamente significativo al 95% de confianza. 112 ANEXO 19 Interacción de variantes genéticas de κ- caseína y ß – lactoglobulina e intervalos de significancia para componentes en estudio. § Proteína total. § Proteínas del Suero. 113 Continuación ANEXO 19. § Caseína. § Número de caseína. 114 Continuación ANEXO 19. § Producción de leche por ordeño AM.