Unidad IV Relaciones periódicas entre los elementos
Anuncio
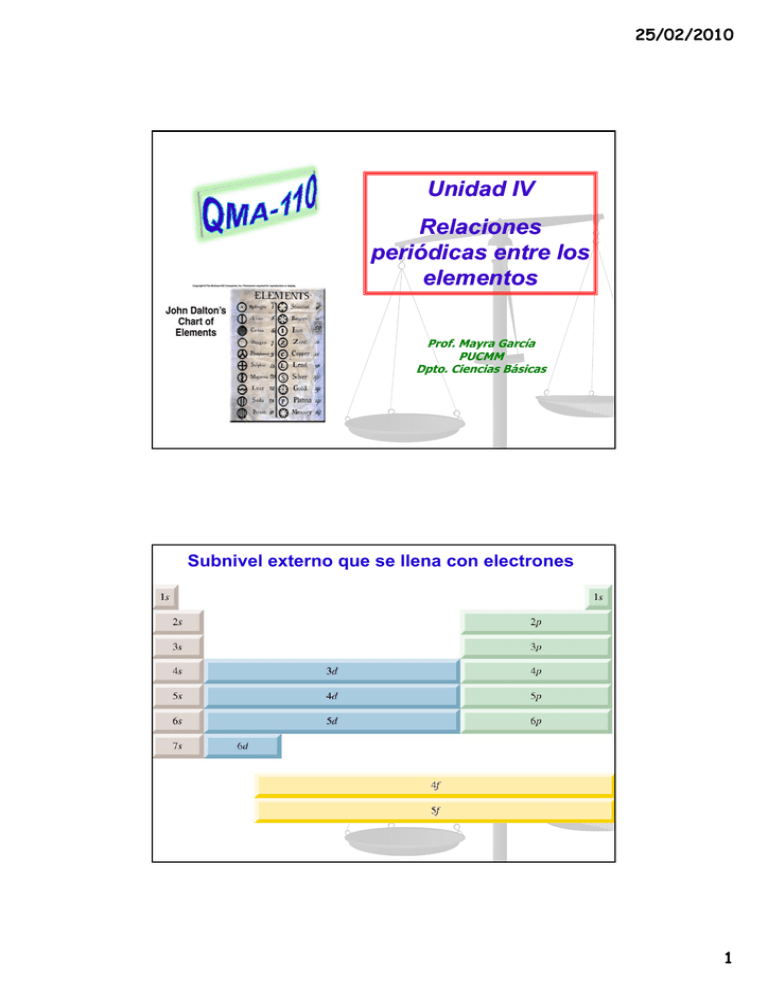
25/02/2010 Unidad IV Relaciones periódicas entre los elementos Prof. Prof Mayra García PUCMM Dpto. Ciencias Básicas Subnivel externo que se llena con electrones 1 ns2np6 ns2np4 ns2np3 ns2np2 ns2np1 d10 d5 d1 ns2 ns1 Configuraciones electrónicas de los elementos en el estado fundamental ns2np5 25/02/2010 4f 5f Configuraciones electrónicas de cationes y aniones de elementos representativos Na [Ne]3s1 Na+ [Ne] Ca [Ar]4s2 Ca2+ [Ar] Al [Ne]3s23p1 Al3+ [Ne] Los átomos g ganan electrones para que el anión tenga una configuración electrónica externa de un gas noble. Los átomos pierden electrones para que el catión tenga la configuración electrónica externa de un gas noble. H 1s1 H- 1s2 or [He] F 1s22s22p5 F- 1s22s22p6 o [Ne] O 1s22s22p4 O2- 1s22s22p6 o [Ne] N 1s22s22p3 N3- 1s22s22p6 o [Ne] 2 25/02/2010 -1 -2 -3 +3 +2 +1 Cationes y aniones de elementos representativos Na+: [Ne] Mg2+: [Ne] Al3+: [Ne] F-: 1s22s22p6 ó [Ne] O2-: 1s22s22p6 ó [Ne] N3-: 1s22s22p6 ó [Ne] Todos isoelectrónicos con Ne ¿Qué átomo neutral es isoelectrónico con H- ? 3 25/02/2010 Configuración electrónica de cationes de metales de transición Cuando un catión se forma de un átomo de un metal de transición, los electrones que siempre se pierden primero son los del orbital ns y después los de los orbitales (n (n–1)d. 1)d Fe: [Ar]4s23d6 Mn: Fe2+: [Ar]4s03d6 o [Ar]3d6 [Ar]4s23d5 Mn2+: [Ar]4s03d5 o [Ar]3d5 Fe3+: [Ar]4s03d5 o [Ar]3d5 Carga nuclear efectiva (Zefec) es la “carga positiva” protegida por el electrón. Zefec = Z - 0<<Z ( = constante pantalla) Para átomos con 3 o mas electrones, los electrones de un determinado nivel están apantallados por los e- de los niveles internos (los mas cercanos al núcleo) Ej: Li 1s2 2s1 4 25/02/2010 RADIO ATÓMICO “mitad de la distancia entre los núcleos de dos átomos metálicos adyacentes adyacentes” Elementos del 2do período IA IIA ..............................VIIA Li Be F Z 3 4 9 2 2 2 Zefec +1 +2 +7 Li- 1s22s1 Be-1s22s2 F-1s22s22p5 5 25/02/2010 Aumento del radio atómico RADIO IÓNICO “radio de un catión o de un anión” Efecto de la reacción sobre el tamaño 6 25/02/2010 El catión siempre p es más p pequeño q que el q átomo del cual se forma. El anión siempre es más grande que el átomo del cual se forma. Radio iónico 7 25/02/2010 La energía de ionización es la energía mínima (kJ/mol) necesaria para quitar un electrón de un átomo en estado gaseoso, en su estado fundamental. I1 + X (g) X+(g) + e- I1 primera energía de ionización I2 + X+ (g) X2+(g) + e- I2 segunda energía de ionización I3 + X2+ (g) X3+(g) + e- I3 tercera energía de ionización I1 < I2 < I3 Variación de la primera energía de ionización con el número atómico Prime era energía de ionizac ción (kJ/mol) Lleno nivel n=1 Lleno nivel n=2 Lleno nivel n=3 Lleno nivel n=4 Lleno nivel n=5 Número atómico Z 8 25/02/2010 Aumentto de la primera energía de ionización Tendencia general de la primera energía de ionización Aumento de la primera energía de ionización Afinidad electrónica es el cambio de energía que ocurre cuando un átomo, en estado gaseoso, acepta un electrón para formar un anión. La afinidad electrónica es positiva si la reacción es exotérmica y negativa si la reacción es endotérmica X (g) + e- X-(g) F (g) + e- F-(g) H = -328 kJ/mol AE = +328 kJ/mol O (g) + e- O-(g) H = -141 kJ/mol AE = +141 kJ/mol Un valor grande positivo de afinidad electrónica significa que el ión negativo es muy estable, por lo que el átomo tiene una gran tendencia a aceptar un electrón 9 25/02/2010 Afinidad electrónica (kJ/mol) Afinidad electrónica contra número atómico Número atómico Z Revisión de las tendencias generales de las propiedades químicas. Elementos de un mismo g grupo p tienen comportamiento p químico semejante debido a su configuración externa semejante El 1er miembro de cada grupo (elementos del 2do período LiF) difieren del resto de los elementos, la diferencia puede atribuirse a su tamaño mas pequeño Otra tendencia en el comportamiento químico son las relaciones diagonales 10 25/02/2010 RELACIONES DIAGONALES EN LA TABLA PERIÓDICA La comparación de propiedades de elementos de un mismo grupo solo es válida si los elementos son todos metales o no metales En los grupos IIIA a VIA los elementos cambian de metales a no metales y metaloides, por lo que es de esperar p una g gran variación de las p propiedades p químicas 11









