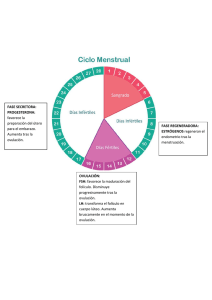
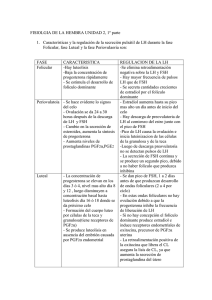
Reproducción Animal - Programa Integración de Tecnologías a la
Anuncio

Dra. LINA XIOMARA LADINO MEDINA Directora Científica Laboratorios Chalver de Colombia – División Veterinaria Médico Veterinaria y Zootecnista Universidad Del Huila Esp. Biotecnología Reproductiva Bovina Universidad de Córdoba – Argentina Esp. Gerencia de Mercadeo Estratégico Universidad Surcolombiana 1 1 INTRODUCCIÓN Los múltiples avances en la ciencia han llevado a mejorar las ganaderías con fines zootécnicos, hoy en día la aplicación de la inseminación artificial, transferencia embrionaria, sexaje de embriones han permitido avanzar mucho a nivel productivo. Pese a esto los diferentes proceso aplicados en la reproducción hacen parte de las estrategias para una excelente rentabilidad productiva, así como es de importante analizar el entorno medioambientales y las características genéticas de los animales para mejorar su producción resulta relevante profundizar en los evento fisiológicos normales durante la reproducción a fin de que el manejo farmacológico que se aplica a ellos tenga un objetivo razonable y no sea solamente una prescripción sin sentido ni una “receta de cocina”. Por lo tanto este manual pretende abordar los aspectos fisiológicos más relevantes del ciclo estral bovino, relacionando la utilización y aplicabilidad de los productos que hacen parte de nuestra Línea Hormonal. En nuestro medio la ganadería bovina abarca más de 40 millones de hectáreas, generando el 35% del empleo agropecuario a nivel nacional. Es el 3,6% del porcentaje total del producto interno bruto y el 27% del agropecuario, resaltando su importancia en la economía. El número de cabezas de ganado alcanzan los 25 millones de acuerdo a la información de Fedegan (2007) en las dos cadenas productivas, carne y leche. La distribución del 90% de los bovinos se encuentras en la región del Caribe, Piedemonte amazónico, Piedemonte Llanero y los Valles interandinos, predominando el ganado cebú y sus cruces; en las zonas frías se destaca el ganado lechero tipo Holstein, Pardo Suizo y Jersey. De acuerdo con los datos del Corpoica el sistema de producción más usado es tipo carne (60%), 34% doble propósito y 6% leche (Gutiérrez, 2007). De acuerdo con algunos estudios solo cerca del 2,18% de las vacas son servidas por inseminación y el 98% son apareadas por monta natural (Obando y Martínez, 1998), con la primera aparición de la inseminación artificial en el país en el año de 1937 con la inseminación se unas perras por José Velásquez y Miciades Martínez, posteriormente en el año de 1946 el Ministerio de Agricultura preparó al primer grupo de profesionales en esta disciplina. Aún así el uso de la inseminación artificial en nuestros días, en ganaderías doble propósito esta por debajo del 5% en regiones como la costa Atlántica (Avendaño, 2007). En la actualidad la transferencia de embriones es de las tecnologías más avanzadas y en el 2007 y de acuerdo con los reportes aproximadamente 1000 ganaderías trabajan con esta tecnología. Empresas como CGR, Vitrogen, Ctelca, Sembrio, Mayavista, Embriogen y Cryogen son las más importantes en superovulación, congelamiento y transferencia de embriones. Por ejemplo la alianza entre Cetelca, CGR y Vitrogen ha producido un total de 60.868 de embriones y 12.610 preñeces con un total de 32% de preñez. Entre el 2005 y el 2006 se ha colectado en Colombia un total de 3.875 vientres, y se transfirieron un total de 25.398 embriones (Gutiérrez, 2007). 2 2 1. CICLO ESTRAL BOVINO El ciclo estral (CE) es el período de tiempo comprendido entre dos celos, empieza con el estro y termina al aparecer el celo siguiente. La duración del ciclo estral en condiciones tropicales es de 18 a 23 días en la mayoría de los animales, con un promedio de 21 días. En el caso de novillas Holstein en la Sabana de Bogotá, en condiciones de semiestabulación, el estro tiene una duración promedio de 10.6 horas y la mayoría de los animales entran en calor entre las 4 pm y las 10 pm. Lo anterior implica que algunos animales en celo pueden escapar a la observación (Hernández et al, 2008). El ciclo estral comprende dos fases, una fase folicular con mayor influencia de estrógenos y una fase de cuerpo lúteo donde predomina la hormona progesterona. En cada una de las fases se presentan varios cambios morfológicos, fisiológicos y endocrinos en varias etapas del ciclo las cuales se relacionan a continuación. 1.1 FASE FOLICULAR Abarca un período corto del ciclo estral, comprende desde el inicio de la regresión del cuerpo lúteo a la ovulación involucrando el proestro y el estro. La fase estrogénica del ciclo estral representa la etapa en la cual se facilita la cópula, el ascenso de los espermatozoides a través del tracto genital de la hembra y la fertilización bajo la influencia de los estrógenos. Por acción de estas hormonas, las glándulas vestibulares de la vagina aumentan la secreción mucosa, hay vasodilatación, aumento de la motilidad y relajación del cérvix y el moco liberado se hace más acuoso. En el útero y el oviducto aumentan la motilidad y el epitelio de revestimiento puede formar cilias. Por el efecto vasodilatador de los estrógenos en el tracto reproductivo, hay cantidades variables de edema especialmente en la capa propia-submucosa del útero. En la vagina, hay infiltración de linfocitos en el epitelio y subepitelio, así como presencia de glóbulos rojos en la propiasubmucosa. • Proestro: es considerado la porción inicial de la fase folicular que comienza con la regresión funcional del cuerpo lúteo. En esta fase ocurre un incremento en las concentraciones de estradiol, caracterizado por un aumento en el tono uterino y la presencia de moco traslúcido en la vulva. • Estro: es la porción tardía de la fase folicular que finaliza con la ovulación del folículo dominante. En esta fase el crecimiento y maduración del folículo preovulatorio ocurre en asociación con la disminución en las concentraciones de 3 3 estradiol y el pico de gonadotropinas, principalmente LH, el cual se presenta aproximadamente 29 horas antes de la ovulación (Peter et al, 2009). La detección del estro reviste significado económico, por cuanto el tiempo de inseminación (artificial o natural), debe hacerse al final del estro. La ovulación sucede entre 24 y 30 horas de iniciado el estro el óvulo tiene una viavilidad de 6-10 horas; los espermatozoides viven entre 24 y 30 y el tiempo requerido por el espermatozoide para ser transportado desde el sitio de la inseminación hasta el lugar de la fertilización es de 4-8 horas (Bó, et al. 2007). Existen varios métodos para la detección del celo y se considera que una hembra está en celo cuando permite la monta de otros animales dos veces consecutivas, permaneciendo quieta, se suma adicionalmente el nerviosismo del animal, el enrojecimiento de la mucosa, secreción de moco vaginal y tumefacción de la vulva. 1.2 FASE LÚTEA Abarca desde la ovulación a la regresión del cuerpo lúteo, involucrando el metaestro y diestro. Se caracteriza por la dominancia posterior a la ovulación de la hormona progesterona, con la subsiguiente formación y maduración del cuerpo lúteo. • Metaestro: es el tiempo inmediatamente después del estro, es considerada como los 5 días posteriores a la ovulación. Durante este período en el ovario ocurre la luteinización de las células foliculares del folículo dominante previo y la formación del cuerpo lúteo. • Diestro: comienza después del metaestro y finaliza cerca del inicio de la regresión del cuerpo lúteo próximo al tiempo del proestro. Durante esta etapa el cuerpo lúteo madura y mantiene las concentraciones de progesterona hasta el reconocimiento materno. En caso de no haber preñez, la regresión del cuerpo lúteo ocurre por acción de la PGF2α en el diestro tardío. Los cambios asociados en las diferentes fases se encuentran ilustrados en la siguiente gráfica: 4 4 Figura 1. Comportamiento hormonal durante el ciclo estral (Tomado de Ramírez, 2009) 1.3 DESARROLLO FOLICULAR El interés de estudiar el desarrollo folicular radica en la importancia que tiene la obtención de un mayor número de ovocitos para los procesos de fertilización in vitro con miras a aumentar la cantidad de individuos de una misma hembra con características genéticas deseables, o en los programas de preservación de especies animales amenazadas de extinguirse. Esta ampliamente documentado que la vaca es un animal que presenta una sola ovulación por cada ciclo estral, aunque en contadas ocasiones hay ovulaciones dobles. Desde el período fetal hay crecimiento folicular en los ovarios, pero la ovulación no ocurre sino hasta cuando el animal llega la pubertad. Los folículos que regresan sufren un proceso de degeneración conocido como atresia o atrofia folicular. 5 5 El folículo es la unidad estructural y funcional de los ovarios. La foliculogénesis es el proceso de formación, crecimiento y diferenciación folicular, abarca desde el estadio de folículo primordial hasta el de folículo preovulatorio (Ver Figura 2). Figura 2. Foliculogénesis bovina El desarrollo folicular ovárico es un proceso dinámico complejo, caracterizado por una proliferación marcada y una diferenciación de células foliculares, proporcionando un medio ambiente óptimo para la maduración del ovocito y su preparación para la fertilización después de la ovulación. Durante este proceso se presentan señales endocrinas, paracrinas y autocrinas dentro del ovario y un intercambio de señales endocrinas entre los ovarios y la hipófisis, además envuelve una combinación de interacciones entre hormonas, factores de crecimiento, sistemas de comunicación celular y genes. 1.3.1 Formación de los folículos en el Ovario Los ovocitos presentes en el ovario adulto se originan de un número definitivo de células germinales primordiales derivadas de la masa celular interna del blastocito en desarrollo. En los mamíferos, la hembra cuenta con una reserva de ovocitos que han interrumpido su crecimiento en los folículos primordiales, única fuente de ovocitos para ser ovulados durante su vida reproductiva. Los ovocitos se originan de las células germinales primordiales en el embrión, específicamente en el endodermo del saco vitelino embrionario y migran por medio de movimientos a través del mesenterio dorsal hasta la cresta gonadal del mesonefro, este proceso se desarrolla hacía el día 35 de gestación en el ganado (Ver figura 3). 6 6 Figura 3. Migración de las células germinales primordiales en el embrión bovino. La mayoría de las especies de mamíferos, presentan proliferación de ovocitos por división mitótica, proceso que ocurre en la fase de desarrollo fetal y culmina cerca al nacimiento. Los folículos primordiales aparecen hacia los 120-130 días en bovinos, 70 días en ovinos y porcinos de gestación. En el caso de las terneras al nacimiento tienen una dotación de folículos primordiales de 42.000 a 325.000, pero a los 10-15 años este número se reduce de a 1.000 - 5.000. El folículo primordial está compuesto de un ovocito cuyo crecimiento se ha detenido (poco antes del nacimiento) en la fase de diploteno de la profase I de la meiosis y está rodeado por una sola capa plana de células escamosas de la pregranulosa, esta capa de células tiene forma plana o cuboidal, llamadas foliculares, sufren hiperplasia para agruparse en varias hileras de células y conforman un folículo primario. Cuando los folículos salen de la reserva, pasan de ser folículos primordiales a ser folículos primarios en transición y las células escamosas pregranulosas que los rodean se transforman en células cuboidales granulosas y empiezan a proliferar. Simultáneamente, la membrana celular del ovocito se recubre de una capa de glicoproteínas conocida como la zona pelúcida (ZP), posteriormente las células foliculares cuboidales comienzan a separarse para formar el antro o cavidad folicular. Después hay diferenciación de las células mesenquimales ubicadas por fuera del acúmulo de las células foliculares para formar la teca interna. Las células de la teca interna 7 7 adquieren capacidad esteroidogénica, lo cual incluye el desarrollo de receptores para las hormonas gonadotrópicas FSH y LH, dependiedo del grado de maduración del folículo. No hay ovulación durante la vida pre-natal ni en la pre-pubertad. Sin embargo, existe un crecimiento folicular continuo de varios folículos que se desarrollan hasta su maduración, o sea, hasta cuando se desarrolla completamente la teca interna formándose completamente la zona pelúcida y el cúmulo ovígero (acúmulo de células foliculares que rodean el ovocito). Consecutivamente a este crecimiento, los folículos se atrofian y comienza una nueva “onda” de crecimiento folicular. Mientras tanto, hay cientos de miles de folículos primordiales que permanecen como tales sin entrar en las mencionadas ondas de crecimiento folicular. Conforme los folículos continúan su desarrollo a través de estructuras primarias, secundarias y preantrales adquieren capas sucesivas de células granulosas, aumentan el tamaño del ovocito y se rodean de las células de la teca. Cuando la reserva disponible de folículos primordiales se acaba, la función reproductiva culmina. El desarrollo de un folículo primordial hasta una estructura primaria en transición, está regulado por varios factores de crecimiento que ejercen su acción dentro del ovario. La regulación endocrina de la foliculogénesis envuelve a las gonadotropinas, hormonas y factores de crecimiento producidos localmente. Existe evidencia de que la foliculogénesis, hasta la etapa en la que se forma el antro folicular, es independiente de la FSH y se ha confirmado que la fase inicial de la foliculogénesis es estimulada por otros factores, mientras que el folículo antral requiere gonadotropinas. Los factores que controlan el crecimiento folicular inicial no se conocen. La acción de las gonadotropinas no es necesaria, de hecho se han realizado estudios en animales hipofisectomizados evidenciando que los folículos preantrales se pueden desarrollar en estos casos. A pesar de estos datos, el crecimiento folicular está bajo control genético y la forma de presentarse se relaciona con la especie animal, por ejemplo, el proceso gradual de desarrollo y diferenciación de un folículo, desde una estructura primordial hasta el folículo preovulatorio, toma aproximadamente 8 semanas en roedores y alrededor de 6 meses en mamíferos mayores como el humano y el bovino. 1.3.2. Fases del desarrollo folicular Las células pre-granulosas derivadas del epitelio ovárico se diferencian en células granulosas, rodean a los ovocitos I quedando así formados los folículos primordiales (Ver figura 4). Estos se caracterizan histológicamente porque el ovocito I detenido en la profase de su primer división meiótica (diploteno) está rodeado por una capa plana de células de la granulosa. Estos folículos forman la reserva gametogénica o «población de folículos de reserva» que una hembra va a utilizar en toda su historia reproductiva. Es a partir de esta población que se origina toda la población de folículos en crecimiento, en el 8 8 bovino se ha estimado la presencia de 42.00-325.000 folículos primordiales y la mayoría se atresian antes de adquirir las condiciones de folículo preovulatorio. Figura 4. Folículo Primordial Las células planas de la granulosa antes de comenzar a dividirse por mitosis se diferencian en una capa de células de forma cúbica que rodea al ovocito I. Cuando esto sucede los folículos se clasifican en folículos primarios. En esta etapa el ovocito comienza a rodearse de una capa celular amorfa de glicoproteínas denominada zona pelúcida. Las células de la teca interna comienzan a rodear por fuera a las células de la granulosa (Ver figura 5). Figura 5. Folículo primario Las células de la granulosa aumentan de tamaño y número denominándose folículo secundario. Las células tecales se diferencian en una capa externa y otra interna rodeando por fuera a las células de la granulosa. Hasta este estadio los folículos se clasifican en preantrales debido a que aún no se ha formado la cavidad antral (Ver figura 6). (a) 9 9 (b) Figura 6. Estructura de Folículo secundario (a) y Folículo preantral (b). Los folículos terciarios o folículos antrales se caracterizan histológicamente por la presencia de la cavidad antral y por estar rodeados de varias capas cúbicas de células de la granulosa que comienzan a secretar el líquido folicular, que al acumularse produce un reordenamiento de las mismas en células del cúmulo y murales (Ver figura 7). En este estadio las características histológicas son la presencia de la teca interna constituida por tejido conectivo y la teca externa formada por una capa de colágeno atravesada por 10 1 capilares con miofibroblastos diferenciados de los fibroblastos del estroma. A nivel molecular se caracterizan por una mayor expresión de receptores para FSH en las células de la granulosa. Las células de la teca expresan receptores para LH. Los folículos terciarios se clasifican en dominantes y subordinados. Los folículos dominantes, a diferencia de los subordinados, expresan en las células de la granulosa además de los receptores para FSH, receptores para LH. Figura 7. Microfotografía y representación esquemática de un folículo antral de la vaca. Los folículos preovulatorios o folículos de De Graaf, en honor a quien fuese el primer científico en examinar ovarios humanos en 1672, tienen la capacidad de responder al estímulo de la LH produciendo cambios morfológicos y bioquímicos desencadenando la ovulación. Todos estos cambios se desarrollarán más adelante al describir los mecanismos implicados en la ovulación. En la yegua el folículo preovulatorio es mayor a 35 mm y en la vaca entre 10 a 20 mm. Posterior al desarrollo del folículo antral, el ovocito permanece rodeado por una capa de células de la granulosa (cumulus oophurus), manteniéndose unidas a la pared folicular por medio del tallo de células de la granulosa (Ver figura 8). 11 1 Figura 8. Estructura de un folículo de Graff. A continuación se resume el crecimiento folicular desde la etapa de folículo primordial hasta la de folículo ovulatorio en la siguiente gráfica: 1.4 ENDOCRINOLOGÍA DE LA FOLICULOGÉNESIS La actividad de los ovarios está regulada por la interacción de mecanismos endocrinos sistémicos y factores locales (paracrinos-autocrinos). El hipotálamo libera GnRH que de acuerdo al patrón de secreción, produce los mecanismos moleculares necesarios para la liberación de FSH (hormona folículoestimulante) y LH (hormona luteinizante) de la hipófisis. Los folículos se desarrollan hasta el estadio preantral sin requerir de las hormonas gonadotróficas. En la yegua los folículos pueden crecer hasta 2 mm en ausencia de FSH. Es decir, que la activación inicial de folículos primordiales es gonadotrófica independiente y comienza en la vida fetal. Para que los folículos puedan pasar del estado preantral, la granulosa y la teca deben desarrollar receptores para las gonadotropinas, los de FSH se producen en la granulosa y los de LH en la teca. Se describen a continuación las hormonas que participan en el desarrollo folicular: 12 1 √ HORMONA DE LIBERACIÓN DE GONADOTROFINAS (GNRH): El hipotálamo es el órgano encargado de convertir las señales neurológicas originadas en estímulos externos e internos en descargas hormonales. Uno de sus productos es la hormona GnRH. Luego de ser secretada, la GnRH es acumulada en la eminencia media hasta que se produce la despolarización neuronal. Como respuesta al estímulo adecuado, la GnRH entra a capilares fenestrados y llega a la hipófisis vía vasos portales, según los pulsos liberados se secreta como respuesta la FSH o LH. La GnRH está regulada por la secreción endógena de diversas hormonas entre ellas la melatonina. Esta última se libera por estímulo de la oscuridad, es decir, que un impulso nervioso percibido por la retina se transforma en liberación de melatonina desde la glándula pineal. Por lo tanto, la cantidad de horas luz influye en la secreción de GnRH en las especies fotoperiódicas. Las especies animales cuyos ciclos reproductivos se encuentran afectados por las horas luz, se clasifican en fotoperiódicos positivos y fotoperiódicos negativos. En las especies fotoperiódicas positivas como la equina, el aumento de las horas luz (en forma natural o artificial), produce una disminución de la liberación de melatonina, permitiendo la liberación de GnRH y estimulando la biosíntesis de FSH y LH. Es decir, que en especies con gestaciones prolongadas, como la equina, la melatonina inhibe el eje hipotálamo- hipofisario- gonadal determinando que la temporada reproductiva sea primavera- verano. En cambio, en las especies con gestaciones cortas (oveja, cabra), la melatonina estimula el eje hipotálamo-hipofisario-gonadal estableciendo que la temporada reproductiva sea otoño- invierno. Este mecanismo evolutivo permite que los animales centralicen las pariciones durante la primavera-verano. √ HORMONAS GONADOTRÓFICAS: La hormona folículo estimulante (FSH) y hormona luteinizante (LH) son glicoproteínas producidas por la hipófisis. Al igual que la hormona gonadotrofina coriónica equina (eCG) y la tirotrofina (TSH), están formadas por la unión de las subunidades α y β. La subunidad α es específica de especie y es idéntica en las otras hormonas glicoproteícas mencionadas. La subunidad β determina la función biológica de cada hormona. o HORMONA FOLÍCULO ESTIMULANTE (FSH): La FSH es necesaria para el reclutamiento de folículos antrales. Las células de la teca interna de los folículos terciarios responden al estímulo de la FSH produciendo andrógenos y estimulando la activación de la enzima aromatasa en las células de la granulosa y transformando a los andrógenos en estradiol. La FSH también está involucrada en el aumento de la vascularización del folículo dominante. El aumento de la irrigación permite una mayor obtención de nutrientes. Bajo la influencia de la FSH, las células de la granulosa se dividen por mitosis incrementando las capas que rodean al ovocito I y aumentando el tamaño folicular. La FSH junto con el estradiol estimula la 13 1 formación de la cavidad antral y la expresión de receptores para LH en las células de la granulosa del folículo preovulatorio. o HORMONA LUTEINIZANTE (LH): La función de la LH es reiniciar la meiosis en el folículo preovulatorio, desencadenar la ovulación y controlar el desarrollo y mantenimiento del cuerpo lúteo (CL). Ejerce su acción uniéndose a receptores de membrana en las células de la granulosa y tecales del folículo preovulatorio. Produce un aumento de AMPc vía adenil ciclasa, estimulando la conversión de colesterol en pregnenolona y desencadenando los sucesos de la ovulación. La concentración de LH es baja durante la mitad de la fase luteal, aumenta pocos días antes del estro y alcanza su mayor concentración en plasma generalmente un día antes de que se produzca la ovulación. * LIBERACIÓN DE GONADOTROPINAS DURANTE EL CICLO ESTRAL La liberación de gonadotropinas se da de forma pulsátil y está determinado por la secreción de GnRH desde el hipotálamo. De hecho si se administra de forma continua GnRH o sus análogos, el sistema puede inactivarse; la ocupación continua de los receptores de GnRH en las células gonadotrópicas interrumpe la señal intracelular para la síntesis y liberación de gonadotropinas. De forma general, el sistema generador de pulsos para la liberación de gonadotropinas se incrementa en la fase folicular y disminuye en la fase luteínica del ciclo estral. Los estrógenos disminuyen la amplitud del pulso y la progesterona disminuye la frecuencia de secreción de gonadotropinas, por lo tanto durante la fase folicular, la frecuencia del pulso aumenta por la ausencia de progesterona, mientras que su amplitud disminuye por la presencia de estrógenos. La combinación de aumento de la frecuencia y disminución de la amplitud de los pulsos es importante en la fase final del crecimiento para la nutrición del folículo antral en desarrollo. El aumento súbito y constante de estrógenos, que se presentan durante uno o varios días en la fase final del desarrollo del folículo antral, provoca un incremento de la secreción de gonadotropinas mediante el aumento de la frecuencia de liberación pulsátil de GnRH; el objetivo del aumento súbito en la concentración de gonadotropinas es la inducción de cambios dentro del folículo que conduzcan a su ruptura, causando la ovulación; su duración es corta (de forma general 12 a 24 horas), debido posiblemente a la disminución de la concentración de estrógenos, la cual se produce a medida que los folículos responden al pico preovulatorio de gonadotropinas. Este mecanismo eficaz, permite al folículo comunicar su estado de madurez al hipotálamo y a la adenohipófisis mediante la producción de estrógenos en cantidades que aumentan al progresar la maduración folicular. 14 1 Al comienzo de la fase folicular, cuando la concentración de estrógenos es baja, se almacena y se segrega poca cantidad de FSH y LH, a medida que la concentración de estrógenos aumenta, la secreción de FSH y LH se incrementa lentamente al igual que su almacenamiento. Es durante esta fase del ciclo que los estrógenos tienen un efecto positivo sobre la síntesis y el almacenamiento de gonadotropinas. El efecto negativo de los estrógenos en la secreción de FSH y LH impide que las gonadotropinas almacendas se segreguen antes de hora. A medida que la fase folicular avanza, mayores concentraciones de estrógenos van a sensibilizar las células gonadotropas. A los pulsos de GnRH que ahora se producen se responde cada vez más con intensidad. Cada impulso de GnRH provoca la secreción de los gránulos y activa el almacén intracelular para el siguiente pulso, dicha sensibilización se ve reforzada con la multiplicación de los receptores de GnRH, proceso que también depende de los estrógenos. En el folículo dominante se producen estrógenos, andrógenos, inhibina y somatostatina que son antagonistas de la acción de FSH. Cada onda de crecimiento folicular se genera a partir de un aumento en la secreción de FSH 2 a 4 días antes de la iniciación de la primera onda de crecimiento folicular. Durante la maduración folicular el núcleo del ovocito se mantiene en arresto meiótico, existe control en la secreción de FSH en la hipófisis por parte de los esteroides y la inhibina, los cuales ejercen una retroalimentación negativa. La inhibina es producida por las células foliculares y suprime la secreción de FSH durante el desarrollo folicular en la fase luteal temprana. En los programas de superovulación la aplicación de FSH o de algún análogo busca inducir el crecimiento de un mayor número de folículos y favorecer la posibilidad de ser dominantes. Basicamente el control endocrino de la maduración folicular se basa en las células de la granulosa y de la teca. Al comienzo el número de receptores de FSH de una célula de la granulosa es limitado, de forma que un folículo en desarrollo puede multiplicar hasta cierto punto los receptores de FSH de una célula de la granulosa. El aumento del número de células de la granulosa sin embargo, le permite aumentar rápidamente el número de receptores de FSH; los estrógenos sintetizados tienen un efecto mitógeno (estimulante de la mitosis), el destino del folículo dependrá de su habilidad para aumentar el número de sus células de la granulosa, aumentando indirectamente sus receptores de FSH. A medida que el folículo adquiere cada vez más células de la granulosa se sintetiza continuamente y de forma creciente estrógenos. Los estrógenos secretados tienen dos efectos importantes, primero a nivel folicular en donde inducen la invasión de vasos sanguíneos por la teca interna, recibiendo mayor cantidad de sangre que el resto de folículos de su oleada en desarrollo. En la hipófisis, en donde ejerce el segundo efecto, la concetración creciente de estrógenos junto con el incremento en la producción de inhibina impide que sigua creciendo la secreción de FSH mediante una retroalimentación negativa. 15 1 Una vez la secreción de FSH alcanza el nivel máximo comienzan a bajar las concentraciones en sangre durante varios días, mientras que los folículos crecen de 4 a 8.5 mm. De forma general los folículos crecen a una tasa similar, hasta cuando aparece el folículo dominante, de mayor tamaño que los demás, alcanzando un diámetro de 8.5 mm, los demás son denominados subordinados. El estradiol producido en cantidades crecientes por parte del folículo dominante inhibe la secreción de FSH, además los factores insulínicos de crecimiento (IGF) y la inhibina contribuyen en la disminución de la secreción de está hormona. La diferencia en el tamaño entre los folículos subordinados y el dominante se presenta en un lapso de 8 horas, cuando los niveles séricos de FSH declinan. El folículo antral en desarrollo por acción de la FSH y los estrógenos inicia la formación de receptores de LH en la granulosa, mientras que la FSH comienza a disminuir. La secreción creciente de estrógenos por parte del folículo antral finalmente resulta en el inicio del pico preovulatorio de gonadotropinas, en las últimas fases de desarrollo el folículo pasa progresivamente a estar bajo el control de la LH a medida que atraviesa su última fase de crecimiento antes de alcanzar la ovulación. En el caso de los machos, los mecanismos que regulan el control de la secreción de gonadotropinas son similares a los de la hembra: pulsos de GnRH, que inician en el hipotálamo y afectan la secreción pulsátil de estas hormonas, activando la secreción de testosterona desde los testículos. La diferencia fundamental con la hembra, es que ésta necesita un pico de gonadotropinas para la ruptura de la superficie ovárica y la consecuente liberación de los ovocitos; los machos no requieren autorregulación positiva para la liberación de gonadotropinas, ya que los gametos se producen y liberan de forma continua en un sistema tubular que se abre al exterior, eliminado la necesidad de un pico de liberación de gonadotropinas. La secreción de gonadotropinas también se encuentra regulada por péptidos y hormonas proteícas. Por ejemplo la B-endorfina que inhibe la secreción de LH, la inhibina, la cual se describió anteriormente y la tercera sería la prolactina, su secreción es pulsátil, y su control sobre las gonadotropinas es más importante en la inhibición, además la prolactina ejerce su efecto sobre la glándula mamaria y la lactación en los mamíferos. Las sustancias que inhiben la secreción de prolactina son la dopamina (catecolamina) y el GABA (ácido γ aminobutírico). Los agonistas de la dopamina como cabergolina, bromocriptina se pueden utilizar para suprimir la secreción de prolactina en casos de hiperprolactinemia. En perras por ejemplo se utiliza cabergolina para acortar los espacios entre los celos y causar luteólisis. En el caso contrario dentro de las sustancias que favorecen la liberación de la prolactina se encuentra el péptido intestinal vasoactivo (PIV), el cual inhibe la secreción de dopamina en el hipotálamo. Los estrógenos pueden incrementar esta secreción hormonal disminuyendo la sensibilidad de los lactotrópos a la dopamina. 16 1 √ PRODUCCIÓN FOLICULAR DE ESTRADIOL: La regulación de la secreción de estradiol ha dado lugar al modelo conocido como «dos células dos gonadotrofinas». La síntesis de estrógenos se produce por la proximidad de las células de la teca y de la granulosa. Las células de la teca producen andrógenos (testosterona y androstenodiona) bajo la influencia de LH, la cual difunde a través de la membrana propia hasta la granulosa, donde los andrógenos se transforman en estrógenos (17-estradiol). La FSH se une a sus receptores en las células de la granulosa y produce el aumento de la enzima aromatasa. Esta enzima convierte a los andrógenos en estradiol, es decir, las células de la teca interna y granulosa actúan en forma conjunta para lograr la síntesis de estradiol (Ver figura 10). Figura 10. Representación esquemática de la síntesis de estrógenos √ SISTEMA DEL FACTOR DE CRECIMIENTO TIPO INSULÍNICO (IGF): Estos factores se denominan así por tener una secuencia de aminoácidos muy similar a la insulina, estos factores se producen en el hígado por medio de la acción de la hormona GH (Hormona de crecimiento). Los IGFs (IGF-1 e IGF-2) funcinan como moduladores de la acción de las gonadotropinas a nivel celular. Estimulan la proliferación y diferenciación de las células de la granulosa y de la teca. La acción del IGF consiste en estimular la proliferación de las células de la granulosa, la síntesis de hormonas esteroideas y también la producción de inhibinas y activinas. En otras palabras, amplifica la respuesta 17 1 desencadenada por la FSH. La acción de IGF está regulada por la enzima proteolítica PAPP-A, por sus siglas proteína plasmática asociada a la preñez. √ FAMILIA DE FACTORES TRANSFORMADORES DE CRECIMIENTO (TGF): Los miembros de esta superfamilia, integrada por más de 40 proteínas, regulan la proliferación y diferenciación en una amplia variedad de tejidos. Las inhibinas y activinas son producidas por las células de la granulosa del folículo dominante. Están formadas por la unión de las subunidades α y β. Tanto las inhibinas como las activinas actúan en forma paracrina, inhibiendo o estimulando el crecimiento de los folículos subordinados respectivamente. Las inhibinas además actúan en forma sistémica inhibiendo la secreción de FSH a nivel de la hipófisis. La secreción de las inhibinas es estimulada por la FSH formando así un circuito de regulación. 1.5. OVULACIÓN La ovulación es la culminación de una serie de mecanismos complejos desencadenados por la elevación de LH que como resultado producen la expulsión del ovocito del folículo preovulatorio. Los sucesos de ovulación abarcan cambios bioquímicos, fisiológicos y morfológicos. Predecir el momento exacto de la ovulación es difícil y requiere práctica en la palpación y observación ultrasonográfica transrectal. De acuerdo con los datos fisiológicos, se ha calculado la duración necesaria para el desarrollo del folículo antral hasta el punto de ovulación en alrededor de 10 días en animales domésticos. En grandes animales el desarrollo del folículo antral se ha divido en dos fases: una lenta que dura 4 a 5 días, seguida de una segunda fase de crecimiento con igual duración para finalizar en la ovulación. El folículo en fase de crecimiento rápido requiere la exposición a unos pulsos más rápidos de gonadotropinas al tercer o cuarto día, de modo que al menos un folículo puede completar su patrón de desarrollo normal hasta la ovulación. Este incremento de gonadotropinas suele coincidir con el inicio de la regresión del cuerpo lúteo, que permite de forma pasiva el incremento de los pulsos de secreción de gonadotropinas (Ver figura 11 y 12). Figura 11. Esquema de folículo antral. Rol de la LH y FSH antes de la ovulación, síntesis de estrógenos (Fuente: Hernández et al, 2008). 18 1 Figura 12. Diagrama de folículo antral y la acción de la LH previo a la ovulación. (Fuente: Hernández et al, 2008). El ovocito es expulsado por la fosa de ovulación. Los procesos que ocurren durante la ovulación han sido descriptos por diferentes mecanismos la contracción muscular y bioquímico. - Mecanismo de contracción muscular: Este mecanismo se basa en la presencia de células musculares lisas en la teca externa. A esto se suma la contracción producida por contracciones espasmódicas de la musculatura lisa de los vasos sanguíneos ováricos producidos como respuesta al estímulo producido por la PGF2α y PGE2. - Mecanismo bioquímico: El aumento preovulatorio de la LH aumenta la expresión de las enzimas proteolíticas y sus factores inhibitorios permitiendo que la ovulación sea un proceso controlado. Por un lado, la plasmina aumenta a través de la activación del plasminógeno. La procolagenasa se activa en colagenasa rompiendo el colágeno de la teca externa y disminuyendo la tensión de la pared folicular. La plasmina aumenta tanto en las células granulosas como en las células tecales por estímulo de la LH, pero la regulación en uno y otro tipo celular es diferente, sirviendo como control en la degradación del folículo. A medida que se suceden los cambios de degradación del tejido conectivo se produce la formación del estigma en el ápice folicular. El estigma es la zona más delgada de la pared folicular por donde se liberará el ovocito en el momento de la ovulación. La acción de eicosanoides: prostaglandinas (PG), tromboxanos y lipoxidasas intervienen en el proceso de la ovulación de diferente forma: • PGF2α y PGE2: intervienen en la ruptura de la pared folicular a través de la liberación de las enzimas contenidas en los lisosomas y en cambios 19 1 vasculares. La administración de inhibidores de la síntesis de PGF2α como la indometacina bloquea la ruptura de la pared folicular. • Los tromboxanos aumentan su expresión en folículos preovulatorios. Su acción es antagónica al efecto producido por las prostaglandinas a nivel vascular, logrando que la ovulación sea un proceso autocontrolado. • Las lipoxidasas medidas por radioinmunoensayos muestran un incremento como respuesta a la LH, pero la inhibición farmacológica de las mismas facilita el proceso de ovulación. Queda aún por determinar la función de las mismas. La ovulación, por lo tanto, es un proceso dinámico donde se produce ruptura de la pared folicular por la activación de enzimas proteolíticas y cambios vasculares (Ver figura 13). Los cambios en el aumento de la irrigación y en la producción del edema han llevado a comparar el proceso de la ovulación con un proceso inflamatorio. Figura 13. Representación esquemática de la ovulación 1.6 DESARROLLO DEL CUERPO LÚTEO Como se menciono anteriormente el folículo está compuesto por dos tipos de células: las células de la teca (productoras de androstenediona a partir de progesterona) y las células de la granulosa (reciben el metabolito, lo aromatizan y convierten en estradiol). Poco antes de la ovulación, durante el pico preovulatorio de LH, las células de la granulosa que recubren el folículo preovulatorio adquieren la capacidad de producir progesterona a partir del colesterol y pierden la capacidad de producir estrógenos debido a la inhibición de la producción de la enzima aromatasa, fenómeno conocido como luteinización. 20 2 Es bien sabido que el cuerpo lúteo es una glándula endocrina transitoria, cuyo principal producto de secreción es la progesterona, por lo cual participa en varios procesos como: 1. Reconocimiento, adhesión e implantación del cigoto. 2. Mantenimiento de la gestación en estadios tempranos. 3. Regulación de la dinámica folicular. Para describir la funcionalidad del CL, se puede dividir la regulación luteal en tres etapas: formación, mantenimiento y regresión del cuerpo lúteo. - FORMACIÓN CUERPO LÚTEO: El cuerpo lúteo se forma a partir de la pared del folículo, que se destruye y pliega después de la ovulación. La ruptura del folículo conduce a una degradación de los tejidos que rodean la granulosa y a la liberación de la sangre de los vasos de la teca en el interior de la cavidad. Los pliegues tisulares que protruyen hacia el interior de ésta contienen células de la teca y de la granulosa, el sistema vascular que servirá de soporte al crecimiento y diferenciación celular. Aunque las células de la granulosa son predominantes en el cuerpo lúteo, las de la teca contribuyen de forma importante en la configuración de la estructura. Durante la luteinización, hay hipertrofia e hiperplasia de las células de la teca interna, mientras que las de la granulosa no presentan divisiones celulares. Las células grandes (>15 mm) del cuerpo lúteo provienen de las células granulosas y las pequeñas de las tecales y ambos tipos de células son capaces de secretar progesterona. La progesterona es secretada en forma de gránulos por las células luteales grandes en un 80%, producen además relaxina, oxitocina y otras moléculas. Adicionalmente las células luteales grandes poseen casi todos los receptores para la PGE2 y PGF2α. Las células pequeñas poseen casi todos los receptores de LH, y contribuye también con un 15% de la secreción de progesterona (Bó et al., 2007, Hernández et al., 2008, Hafez, 2003). Como se menciono anteriormente se denomina Luteinización al proceso que siguen las células de la granulosa durante el cambio de secreción de estrógenos a progesterona, comienza con el establecimiento del aumento preovulatorio de LH y se acelera con la ovulación. En la mayoría de las especies domésticas, el cuerpo lúteo produce una cantidad significativa de progesterona en las primeras 24 horas después de la ovulación. En otras como el perro y los primates, se producen pequeñas cantidades de progesterona durante el aumento preovulatorio de LH. Este período abarca en la yegua del día 0 al 5 y en la vaca del día 5 al 10 pos-ovulación. A las 10-12 horas posovulación el CL de la yegua ya produce altas concentraciones de progesterona, esto se relaciona con la alta concentración sérica de LH posovulación (Ver figura 14). 21 2 Figura 14. Producción de progesterona durante el ciclo estral - MANTENIMIENTO DEL CUERPO LÚTEO. El cuerpo lúteo se mantiene tanto en animales gestantes como en no gestantes debido a un patrón pulsátil lento de liberación de LH (un pulso cada 2 o 3 horas), luteotropina más importante. - REGRESIÓN DEL CUERPO LÚTEO. La regresión del cuerpo lúteo es importante en los grandes animales que no están gestando para que puedan entrar en un nuevo ciclo reproductivo en el menor tiempo posible. La duración del cuerpo lúteo después de la ovulación debe permitir los siguientes procesos: 1. La síntesis y liberación de factores para el inicio y desarrollo de la gestación. 2. Que un animal no gestante entre en un nuevo ciclo reproductivo, En grandes animales dura aproximadamente 14 días. Después de varias investigaciones hoy se sabe que el útero es el responsable del control del ciclo vital del cuerpo lúteo, principalmente en grandes animales. La regresión se logra por la acción de la sustancia uterina denominada Prostaglandina F2α (PGF2α), en la mayoría de especies animales (vacas, cabras, yeguas, cerdas y ovejas). En ausencia del reconocimiento materno de la preñez, se produce la regresión del CL alrededor del día 16-17 en la vaca. La regresión resulta en una caída rápida de las concentraciones de progesterona a valores menores de 1 ng/mL, los niveles de progesterona se deben a la acción sobre el ovario de la PGF2α secretada por el útero. El efecto parece ser local, ya que la remoción del cuerno uterino ipsilateral al cuerpo lúteo evita la regresión luteal, no ocurre lo mismo si se remueve el cuerno del lado contrario al CL. 22 2 La PGF2α es liberada en una serie de pulsos más o menos de 5 a 8, los cuales se presentan en intervalos de 6 a 8horas iniciando antes de la regresión luteal. En los rumiantes y porcinos la PGF2α es metabolizada eficientemente en el pulmón, por lo tanto existe un mecanismo local en donde la prostaglandina sintetizada en el endometrio se transportada entre la vena útero-ovárica y la arteria a través de un mecanismo de contracorriente en el cuerno ipsilateral al CL (Ver figura 15). El mecanismo de contracorriente implica el movimiento de moléculas a través del sistema vascular desde los sitios de mayor concentración (vena uterovárica) hasta áreas de menor concentración (arteria ovárica).En equinos, la PGF2α se metaboliza muy poco en el pulmón y no existe el mecanismo local debido a que la arteria no está en contacto directo con la pared de la vena útero-ovárica, por lo que la llegada de la PGF2α se realiza de forma sistémica. Figura 15. Vía de secreción de la PGF2a. La PGF2α, se sintetiza en las células del endometrio, si no se produce gestación se vierte a las venas uterinas. Se ilustra el mecanismo de contracorriente en vaca, cerda y oveja, donde la PGF2α pasa a través de la vena uterina llegando a la arteria ovárica que transcurre sinuosamente sobre el vaso sanguíneo. (Imagen modificada de Engelhardt, et al. 2002) El patrón de síntesis y liberación de la PGF2α es importante para causar su efecto luteolítico. La síntesis es máxima por el endometrio, el proceso se inicia hacia el día 11-13 en el ovino y hacia el día 16-17 en la vaca, yeguas y cerdas. La secreción se realiza en pulsos que se incrementan a medida que avanza el proceso luteolítico. La prostaglandina ejerce un efecto de reducción del flujo sanguíneo del cuerpo lúteo, estructura altamente vascularizada (Ver figura 16). 23 2 Figura 16. Mecanismo de acción producido por la PGF2α en el cuerpo lúteo (Modificado de Hernández, 2008) Además de la PGF2α otras hormonas participan de la lisis del CL. Los estrógenos tienen un efecto positivo sobre el útero en su habilidad de liberar PGF2α para esto, es necesario que la progesterona haya actuado previamente sobre las células endometriales. Los estrógenos tienen un feedback positivo sobre ellos mismos al aumentar sus propios receptores en el endometrio y producen aumento de los receptores para oxitocina. El CL de los rumiantes posee receptores para oxitocina y para estradiol, sugiriendo que los estrógenos tendrían una acción directa sobre la lisis del CL, la PGF2α en estos animales, actuaría sobre el CL por dos mecanismos: 1. Estimulando a las células luteales grandes a secretar oxitocina, produciendo un mecanismo de retroalimentación positiva al estimular la liberación de más PGF2α por parte del endometrio. 2. Regulando directamente su propia síntesis estimulando a las células del endometrio a producir PGF2α. La PGF2α que sale del útero por el sistema venoso y llega al ovario por el los vasos arteriales, estimula adicionalmente la liberación de oxitocina en el cuerpo lúteo, dicha oxitocina induce una mayor secreción de PGF2α en el endometrio, estableciendose una retroalimentación positiva entre estas hormonas que conduce al aumento de los niveles de PGF2α y posterior destrucción del cuerpo lúteo. Antes del día 6 se considera que el cuerpo lúteo es una estructura inmadura, y es maduro a partir del día 6, la diferencia entres estas estructuras se halla en que el cuerpo maduro tiene la capacidad de producir PGF intraluteal que asegura el proceso de luteólisis. Esto expliacaría por qué una sola aplicación de PGF2α antes del día 4 no produce luteólisis, pero dosis repetidas o una sola inyección a partir del día 5 sí produce la regresión del CL (Bó, et al 2007). 1.7 DINÁMICA FOLICULAR DURANTE EL CICLO ESTRAL 24 2 El proceso de crecimiento continuo y regresión de folículos antrales que conduce al desarrollo del folículo preovulatorio se conoce como dinámica folicular y se refiere al crecimiento de dichas estructuras en oleadas o grupos. Se ha establecido que existe un patrón de ondas de crecimiento folicular en el ciclo estral de la vaca de forma normal se presenta de dos ó tres, comienza con el desarrollo de un grupo de 3 a 6 folículos o hasta 24 folículos, todos con un diámetro igual o mayor a 3 mm. Después de varios días, uno de ellos se vuelve dominante (aumenta su tamaño en mayor proporción que los demás y adquiere gradulamente capacidad ovulatoria) e inhibe el desarrollo de los demás folículos, llamados subordinados, que empiezan a atrofiarse. Solamente en la última onda del ciclo, el folículo dominante continúa su crecimiento para llegar a ser el folículo ovulatorio, ya que el folículo de la onda anterior también sufre atresia (Ver figura 17). La primera onda de desarrollo folicular se detecta el día de la ovulación, considerado como el día cero (0) en los ciclos de 2 ó 3 ondas. La segunda onda comenzaría el día 9 ó 10 en ciclos de 2 ondas, en los ciclos de tres ondas la segunda onda se presenta entre el 8 ó 9 día, en estos ciclos la tercera onda emerge el día 15 ó 16, aunque estos patrones están sujetos a la varibilidad individual. La presentación de ondas en desarrollo folicular se ha reportado por medio del uso de ultrasonografía en novillas antes de la pubertad y en vacas posparto antes de la primera ovulación. En animales en gestación las ondas en desarrollo persisten hasta aproximadamente tres semanas antes del parto. En una onda de crecimiento folicular el desarrollo de forma sincrónica de un grupo de folículos a partir de un díametro de 4 mm, proceso que ocurre en los dos ovarios. Durante unos 2 ó 3 días todos los folículos crecen y uno de ellos es selecionado para segur creciendo y ser el dominante, mientras los demás sufren atresia. El grupo de folículos empieza a crecer al recibir una señal hasta ahora desconocida de este grupo de folículos que reaccionan a las gonadotropinas se selecciona una cohorte aproximadamente de 3-5 folículos de los cuales se destacará el dominante. De acuerdo con reportes recientes la emergencia de ondas foliculares en el ganado se caracteriza por el crecimiento (en 2-3 días) de 8-41 folículos pequeños que son detectados inicialmente por medio de ultrasonografía a un diámetro de 3-4 milímetros (Adams et al , 2008). 25 2 Figura 17. Representación esquemática de la dinámica folicular en bovinos. Durante el ciclo estral de la vaca regularmente se preentan 2 ó 3 oleadas foliculares. En cada oleada, un grupo de folículos es escogido de la reserva para que inicien un proceso de crecimiento, de este conjunto uno o varios son seleccionados y finalmente uno de ellos se convierte en dominante, el resto sufre atresia, en tanto que el folículo dominante de la última oleada está destinado a ovular. Durante el ciclo estral, la formación de la cavidad antral se inicia en el bovino cuando el folículo alcanza un diámetro de 0.2 a 0.4 mm, llegando hasta uno de 15 a 20 mm en la fase preovulatoria en el caso del folículo dominante. La incidencia de atresia folicular es muy alta, precisamente antes del crecimiento final que resulta en la formación del folículo dominante. √ FASES DEL DESARROLLO FOLICULAR Independientemente de la especie y del número de oleadas de cada una, el desarrollo folicular tiene tres fases: A. RECLUTAMIENTO: etapa en la que un grupo de folículos adquiere la habilidad para responder a las gonadotropinas y empieza a crecer rápidamente. B. SELECCIÓN: proceso en la que un grupo de folículos son seleccionados para continuar creciendo. C. DOMINANCIA: etapa donde un folículo se desarrolla de forma más rápida que el resto, suprimiendo el crecimiento de los subordinados e impidiendo el reclutamiento de un nuevo grupo de estructuras foliculares. El desarrollo folicular presenta una fase de dependencia de las gonadotropinas y otra de independencia. En la primera de ellas la FSH conduce el reclutamiento folicular y la LH continua el desarrollo folicular hasta el estado preovulatorio. Hay aumento transitorio en los niveles circulantes de FSH antes del reclutamiento de un grupo de folículos y éstos se caracterizan porque expresan el mRNA que codifica la elaboración de las aromatasas en las células foliculares. 26 2 o RECLUTAMIENTO FOLICULAR El reclutamiento folicular se refiere a la formación de una población de folículos antrales de donde uno o varios, dependiendo de la especie (monotoca o politoca) es seleccionado para la ovulación. En cada ciclo ovárico es reclutado un grupo de folículos primordiales que crecen de manera continua debido a los incrementos en la concentración de FSH. Aún se desconoce por qué algunos folículos inician su crecimiento tan pronto como se forman, mientras que otros permanecen en latencia durante meses, años o décadas. En la última década se han propuesto dos conceptos en cuanto al reclutamiento folicular, el reclutamiento inicial y el reclutamiento cíclico. - Reclutamiento inicial: se atribuye a que dejan de estar presentes factores inhibitorios que mantenían a los folículos en latencia. Se considera que es un proceso continuo que se inicia poco después de la formación del folículo, mucho antes de la pubertad. Tan pronto como ocurre la formación del folículo, algunos de ellos dejan la reserva y empiezan a crecer. Este proceso se conoce como activación folicular. Cuando algún folículo sale de esta reserva sigue creciendo hasta la ovulación o hasta que degenera. - Reclutamiento cíclico: el reclutamiento cíclico tiene inicio después de la pubertad y resulta del incremento en los niveles de la FSH en la circulación sanguínea durante cada ciclo ovárico. El incremento en los niveles de FSH comienza dos días antes de la emergencia de una onda folicular. Durante el reclutamiento cíclico, solamente sobrevive un número limitado de folículos y los demás sufren atresia. Los ovocitos en los folículos que sobreviven completan su crecimiento, adquieren su zona pelúcida y son competentes para reiniciar la meiosis. Con la posibilidad de uso del ultrasonido el reclutamiento es detectado como el crecimiento de un grupo de folículos de 4 mm que ocurre durante los primeros 5 días del ciclo estral y posteriormente a los 10 a 16 días en vacas con tres oleadas. El pico sérico de la FSH ocurre al momento o poco antes de que el futuro folículo dominante de la oleada resultante alcance un diámetro de 4 mm. Al parecer, los primeros folículos de 3 mm de una oleada aparecen durante el ascenso en el pico de FSH y siguen creciendo hasta que los niveles de la hormona alcanzan niveles basales. La primera y segunda onda folicular están precedidas por un aumento en los niveles séricos de FSH. o SELECCIÓN FOLICULAR Una vez que los folículos primordiales comienzan a diferenciarse, es decir abandonan la población de folículos de reserva tienen dos caminos posibles a seguir: ovular o sufrir atresia. Alrededor del 99% de los folículos que comienzan la activación se atresian sin llegar nunca a ovular. El proceso de atresia puede ocurrir en cualquier momento de la foliculogénesis, se relaciona con varios cambios de tipo morfológico, bioquímico e 27 2 histológico, que varían con la etapa de crecimiento folicular y con la especie animal. Los cambios que se presentan se relacionan con una disfución de las células de la granulosa y con la alteración del paso de sustancias nutritivas del plasma en los folículos. Este proceso de degeneración se acompaña de pérdida del ovocito, células de la granulosa y receptores para varias hormonas (Hafez, 2003). El proceso de selección se presenta al final de la fase de crecimiento. El folículo dominante crece a una tasa constante y el resto de folículos sufren atresia o crecen a una velocidad menor para después finalmente dejar de hacerlo, fenómeno denominado (desviación) (Ginter, 2001). La desviación durante la oleada folicular en bovinos empieza con una reducción en la tasa de crecimiento constante en el folículo dominante. En vaquillas la desviación de la tasa de crecimiento de los dos folículos de mayor diámetro tiene inicio cuando el diámetro del futuro folículo dominante y el del subordinado son de 8.5 y 7.7mm, respectivamente, 2 a 3 días después de iniciada la oleada mientras que en yeguas se presenta cuando el diámetro del futuro folículo dominante es de 22mm y el subordinado mide 19mm, 6 días después del inicio de la oleada. El ovocito del folículo preovulatorio se encuentra en profase meiótica hasta la ovulación, con el pico de LH preovulatorio se activa el proceso de meiosis, pero esta no se completa sino hasta después de la fertilización, cuando ingresa el espermatozoide. √ DIFERENCIAS ENTRE EL FOLÍCULO DOMINANTE Y LOS SUBORDINADOS Los cambios moleculares que llevan a la desviación folicular pueden ocurrir en cualquier folículo terciario, es decir que todos los folículos pertenecientes a una misma onda tienen la capacidad de ser dominantes, esto se comprueba al remover quirúrgicamente el folículo dominante una vez producida la selección, el folículo subordinado que le sigue en tamaño de la misma onda pasará a dominar sobre los otros. Por muchos años se consideró que el mecanismo de selección folicular estaba regulado únicamente por factores endocrinos, hoy se sabe que previo a los cambios en las concentraciones hormonales de forma evidente y aún así antes de que los cambios de tamaño sean visibles ecográficamente, el mecanismo de selección está determinado por mecanismos intraováricos, específicamente a nivel del folículo. Los factores intrafoliculares que han sido sugeridos son aquellos relacionados con el sistema de los factores de crecimiento similares a la insulina (IGF), esteroides, inhibina, activina, receptores de gonadotropinas, factores angiogénicos entre otros. Los factores implicados de forma temporal o funcional son en IGF, el estradiol y los receptores de la hormona luteinizante (LH), el mecanismo que los activa aún no está muy claro, pero ocurre durante un descenso progresivo de las concentraciones circulantes de FSH y un incremento inicial en la de LH (Ver figura 18 y 19). El intervalo desde que empieza la disminución de los niveles de FSH y el inicio de la desviación es de 3 días en la vaca y la yegua. Después de haber iniciado la desviación, las concentraciones de FSH siguen bajando durante 10 a 20 horas en vaquillas y durante varios días en las yeguas, se ha señalado que el folículo seleccionado suprime la secreción de FSH. 28 2 Figura 18. Rol de la hormona FSH durante el ciclo estral Figura 19. Rol de la hormona LH durante el ciclo estral Una característica del folículo dominante es su mayor capacidad para la producción de estradiol tanto en vacas como en yeguas. En la vaca el estradiol comienza a incrementarse en la circulación al momento que inicia la desviación, lo que ocasiona el descenso de FSH como se ilustra en la figura. 29 2 Figura 20. Rol de los estrógenos durante el ciclo estral La selección del folículo dominante se asocia a concentraciones sanguíneas decrecientes de FSH durante los tres primeros días de la onda. Las concentraciones más bajas de FSH se alcanza cuatro días después de la aparición de la onda y las concentraciones continúan siendo bajas durante los siguientes 2-3 días. Los receptores de FSH solamente están presentes en las células granulosas, mientras que los receptores de LH se encuentran localizados tanto en las células granulosas como en las tecales en la pared de los folículos antrales. El folículo dominante adquiere más receptores de LH sobre sus células granulosas que sus subordinados y por lo tanto puede sustituir su dependencia a la gonadotropina por la dependencia a la LH durante la concentración más baja de FSH y continuar creciendo mientras se degeneran los subordinados (Ver figura 21) Figura 21. El folículo dominante inhibe la secreción de FSH y expresa más receptores para LH y aumenta la secreción del factor de crecimiento insulínico. (Fuente: Hernández et al, 2008) 30 3 Los altos niveles de progesterona producidos por un CL funcional durante el diestro o la gestación inhiben la frecuencia de los pulsos de LH (Ver figura 22). El aumento de las concentraciones de estradiol y la disminución de la progesterona después de la luteólisis aumentan aún más la frecuencia de los pulsos de LH, dando como resultado un gran incremento preovulatorio de LH. Figura 22. Rol de la hormona progesterona durante el ciclo estral. 31 3 Representación esquemática del rol hormonal durante el ciclo estral de la vaca. 32 3 2. MANEJO FARMACOLÓGICO DEL CICLO ESTRAL BOVINO En hatos con manejo intensivo se programan los celos e inseminaciones mediante manipulación hormonal del ciclo estral buscando lograr fertilidad al primer servicio y en el caso de animales en anestro la inducción del celo fértil de manera sincronizada. Los esquemas de sincronización de ovulaciones han sido desarrollados para resolver el problema de escasa manifestación del celo en época de estrés calórico y han dado buenos resultados en hatos con mala detección de calores. 2.1 PRINCIPIOS DE LA SINCRONIZACIÓN DE ESTROS. Las hormonas que se usan para sincronizar el estro son idénticas a las hormonas reproductivas encontradas en el hipotálamo (GnRH), ovario (estradiol y progesterona) y útero (prostaglandina) o análogos de ellas. El primer método de sincronización se desarrollo en el año de 1960 con la utilización de progestágenos para bloquear la ovulación, el problema de este método fue la baja tasa de concepción debido al envejecimiento de los folículos. Años después se desarrollaron protocolos a base de PGF2α, para lograr mejor eficiencia se combinaron los dos protocolos, sin embargo, un período muy prolongado de acción de los progestágenos deprime el porcentaje de concepción. Con el estudio de la dinámica folicular se logro determinar que la persistencia del folículo dominante era la causa de la baja fertilidad, buscando mejorar esto se desarrollaron programas de control folicular, a fin de controlar la fase lútea y el tiempo de ovulación. En la actualidad la mayoría de los métodos de sincronización utilizan: • • • • Control del crecimiento folicular (en inglés follicular wave). Prevención de la ovulación prematura y promoción de la ovulación en vacas en anestro. Inducción de la lisis del cuerpo lúteo en vacas que se encuentran en ciclo. Sincronización del celo o la ovulación al final del tratamiento o ambos. 2.2 CONTROL DEL CRECIMIENTO FOLICULAR (FOLLICULAR WAVE) Como es bien sabido cuando se manipula las “oleadas” foliculares se mejora la fertilidad, ya que los folículos dominantes se hacen más uniformes en el tamaño y madurez en el hato. Para lograr este objetivo se usan dos métodos básicos: 1º. Aplicación de una dosis ovulatoria de GnRH, la cual induce la liberación de LH, provocando la ovulación y luteinización de los folículos dominantes. Tiene como desventaja que se debe contar con folículos maduros, ya que los folículos en fase de reclutamiento no responden a la acción de la GnRH por carencia de receptores para LH. La dosis recomendada de GnRH es de 50 a 100 µg por vaca. 2º. Utilización del benzoato de estradiol o cipionato. Cuando hay dominancia progestacional (por acción de progestágenos endógenos o exógenos), el estradiol reduce la secreción de LH e induce atresia del folículo dominante y una nueva oleada folicular. En 33 3 caso contrario cuando no hay progestágenos, el estradiol induce la liberación de GnRH, causando la síntesis de LH, provocando de este modo la ovulación y luteinización del folículo dominante. El estradiol actúa directamente sobre el folículo dominante para inducir atresia y al mismo tiempo inhibir la síntesis y liberación de FSH. También induce la regresión del cuerpo amarillo si se aplica al inicio del ciclo estral. Los estrógenos en soluciones oleosas para aplicación parenteral se absorben rápidamente, de forma general los estrógenos esterificados poseen absorción retardada después de su administración intramuscular, un éster es una cadena compuesta por átomos de carbono adheridos a la hormona esteroide matriz en la posición del carbono 17. El benzoato de estradiol es un éster sintético del estrógeno natural (estradiol). Posterior a su administración éstos ésteres son absorbidos e hidrolizados hacia el estradiol, estrógeno más activo. En estudios realizados con el benzoato de estradiol, este suprime el desarrollo folicular cuando es administrado al momento de la inserción del implante combinado con la administración de 50 ó 100 mg, de progesterona vía imtramuscular en protocolos de superovulaciones. Bó y colaboradores (2007) reportan que de varias dosis evaluadas de benzoato de estradiol (1 mg, 2.5 mg y 5 mg), combinadas con progesterona, la más efectiva fue la de 2.5 mg , con un comienzo de una nueva onda folicular de 3,9 días (con un rango de 3 a 4 días). Rol hormonal durante el ciclo estral en una hembra bovina con dos ondas foliculares. 2.3 INVOLUCIÓN DEL CUERPO LÚTEO EN VACAS Una sola inyección de PGF2α es eficaz para inducir la luteolisis a partir del día 5 a 7 del ciclo. La presentación del celo varía con el momento en que se aplica la prostaglandina o su análogo, por lo general el intervalo es corto cuando de aplica al inicio del ciclo en los días 7 a 9, o en una etapa más tardía 14 a 16, coincidiendo con la presentación de la primera y segunda oleada de crecimiento folicular. Si se aplicara la prostaglandina entre 34 3 los días 10 y 12, la presentación del celo se reparte entre los tres y 10 días posteriores debido a que la primera oleada folicular se encuentra en proceso de atresia y aún está muy inmadura la segunda y no está cerca de un estado preovulatorio. Con la administración de dos dosis de prostaglandina se logra una mayor sincronía de celos con un intervalo de 11 a 14 días de diferencia o si se establece una sincronía folicular siete días antes de la inyección de prostaglandina, los celos se presentan 72 a 96 horas. 2.4 MANIFESTACIÓN DE CELOS Y OVULACIÓN El celo en las vacas será más evidente cuanto más estrógenos tanto exógenos como endógenos presente. Puede haber manifestación del celo sin ovulación, y una vaca con ovulación puede tener una fase lútea corta si se le aplican estrógenos únicamente. Esta demostrado que la combinación de estrógenos en una sincronización folicular utilizando progesterona mejora la tasa de concepción. Es por esto que en muchos hatos se recomienda añadir estrógenos al programa de sincronización, especialmente en aquellas vacas en anestro o anovulatorias al inicio del procedimiento. Se pueden mejorar los índices de fertilidad aplicando una dosis de GnRH ovulatoria, 48 horas después de la segunda dosis de PGF2α e inseminando a tiempo fijo. 2.5 MÉTODOS DE SINCRONIZACIÓN ● MÉTODOS CON PROSTAGLANDINAS (PGF2α) La sincronización estral con prostaglandina F2 alfa se basa en que ésta destruye el CL con la consecuente presentación temprana del estro, para esto se administra análogos de la PGF2α. En vista de que el 95% de esta prostaglandina se oxida casi de inmediato en los pulmones, y debido a sus efectos broncoconstrictores potentes, surgieron los análogos de esta hormona natural, con los que se incrementa el poder luteolítico y se disminuyen los efectos colaterales. Existen varios protocolos, por ejemplo la utilización de PGF2α: Se utilizan dos inyecciones IM de PGF2α con ocho días de intervalo, se realiza inseminación artificial (IA) al momento de detectar celos e inseminar am-pm. 35 3 - Alternativa 1: se utiliza la inyección de todos los animales, inseminando los que se detecten en celo (am-pm) tras la inyección. Las hembras no detectadas en celo reciben una segunda inyección en 11 - 14 días y se someten a detección de celos e I. A. - Alternativa 2: Detección del calor e inseminar durante los primeros 6 días, las vacas que no entren en calor recibirán una inyección de PGF2α, las vacas son inseminadas a celo detectado. 36 3 ● MÉTODOS CON GNRH Y PROSTAGLANDINAS (PGF2α) Se puede lograr la sincronización de una oleada folicular y un celo posterior si se aplica GnRH y siete días después PGF2α. La inyección de GnRH induce la ovulación de los folículos dominantes y el posterior desarrollo de una nueva onda folicular y posteriormente la inyección del análogo de prostaglandina 7 días después induce la luteólisis. De esta forma, dos o tres días después de la inyección de la prostaglandina se presenta celo y la ovulación del nuevo folículo dominante. A pesar de que con este protocolo de observaban más estros sincrónicos, no se tenía la suficiente precisión al momento de la ovulación para realizar la inseminación artificial a tiempo fijo. La aplicación de una segunda dosis de GnRH, la cual causa la ovulación del folículo dominante 1.5 a 2 días después de la aplicación de la PGF (Bó, 2007). Existen varios protocolos de sincronización de estros y ovulaciones con GnRH y prostaglandina. Uno de ellos es el Ovsynch (abreviatura de Ovulation Synchronization), que es muy usado en bovinos lecheros para inseminar a tiempo fijo sin detectar celos. El esquema es: GnRH - (7 días) - PGF2 alfa - (2 días) - GnRH - (17 - 24 horas) - I.A. La segunda GnRH provocará la ovulación del folículo dominante sincronizado. La inseminación se realiza de 16 a 18 horas después de la segunda dosis de GnRH. De acuerdo con estudios realizados, el pocentaje de gestación es del 50% sin detección de estros (Bó, 2007) La fertilidad mejora si se hace una "presincronización" (Presynch) para tener a las vacas en fase lútea temprana al iniciar el Ovsynch: PGF2 alfa - (14 días) - PGF2 alfa - (12 - 14 días) - Ovsynch (ver Figura). Hasta un 20% de las vacas puede presentar celo los días 6 - 9 del Ovsynch, se inseminan (am-pm) y se suspende el tratamiento. 37 3 Con el fin de simplificar un poco el Ovsynch se desarrolló el protocolo Cosynch (Coordinated Synchonization), en el que se reduce de 4 a 3 el número de veces que se maneja el ganado al realizar la inseminación al mismo tiempo que se aplica la segunda GnRH: GnRH - (7 días) - PGF2 alfa - (2 días) - GnRH + I.A. Este protocolo se usa más en ganado de carne, aunque se puede emplear en ganado lechero, con o sin presincronización. Los resultados son similares al Ovsynch, siendo posible obtener 40 - 45% de gestación en ganado de carne. En Ovsynch y Cosynch la fertilidad es mejor con I.A. a calor detectado (am-pm). El método Selectsynch (Selective Synchronization) se desarrolló con base en los resultados obtenidos al inseminar a calor detectado las vacas sometidas a los tratamientos anteriores. El protocolo es: GnRH - (7 días) - PGF2 alfa - I.A. al calor detectado (am-pm). La observación para detección de celos se hace desde 24 - 48 horas 38 3 antes de la prostaglandina y se continúa por 5 - 7 días. Si hay estro antes de la prostaglandina se debe suspender el tratamiento e inseminar (am-pm). Como algunas hembras no manifiestan el celo después del tratamiento la alternativa para estos casos es la de detectar celos hasta 48 - 60 horas después de la PGF2 alfa, inseminar las que manifiesten celo y las que no lo hicieron se inseminan a las 60 – 72 horas aplicándoles GnRH al momento de la I. A., convirtiendo el tratamiento en un Cosynch con unas horas más entre la prostaglandina y el servicio. Recientemente se ha desarrollado un nuevo esquema llamado Heatsynch (abreviatura de "sincronización de calores"), que es similar al Ovsynch pero se utiliza estradiol (1 mg) en vez de la segunda aplicación de GnRH . El esquema es: GnRH - (7 días) - PGF2 alfa - (1 día) - estradiol - (2 días) - I.A. En el método Ovsynch la segunda GnRH estimula el pico de LH que provoca la ovulación; en condiciones fisiológicas la secreción de GnRH que va a causar el pico ovulatorio de LH se produce por retroalimentación del estradiol producido en el folículo dominante. La razón para utilizar el estradiol es que es mucho más barato que la GnRH, pero su efecto es más lento. La GnRH provoca el pico de LH una hora después de su aplicación, por otra parte en estudios realizados aplicando 1 mg de benzoato de estradiol o 17B-estradiol después de la remoción del CIDR demostrarón que la ovulación se indujo aproximadamente a las 52 horas (Bó, et al 2007). Por lo cual se palica solo 24 horas después de se aplica solo 24 horas después de la prostaglandina (día 8) y la inseminación se hace hasta 48 horas después de inyectarlo. 39 3 ● MÉTODOS CON PROGESTÁGENO, ESTRADIOL, PROSTAGLANDINA Y ESTRADIOL (P.E.P.E) El empleo de progestágenos (progesterona o sus análogos) se fundamenta en la acción inhibitoria de la progesterona para la manifestación del celo. Al administrarlos en dispositivos vaginales (durante 7 días), implantes subcutáneos (9 días) o por vía oral (14 días) actúan como un CL artificial y mientras ejercen su acción la vaca no manifiesta estro y al retirarlos permiten la presentación del celo. En la actualidad se utiliza los dispositvos intravaginales de progesterona, existen diferentes dispositivos con progesterona: PRID (Sanofi), CIDR-B (Pfizer), DIB (Syntex), Cue-Mate (Bioniche) y los TRIU-B (Biogénesis), cada uno varia en la forma y concentración de progesterona, por ejemplo el CDR-B contiene1.3 g de progesterona y el DIB 1 g de progesterona (Ver figura). Formas de los diferentes dispositivos de liberación controlada de progesterona, en la parte de arriba se encuentran los intravaginales y en la parte inferior de la figura se encuentra el implante subcutáneo. 40 4 Con la creación de estos dispositivos se han desarrollado una gran variedad de protocolos, al principio se utilizaban durante un periodo de 14 a 21 días logrando una buena sincronía de celos pero una baja fertilidad, por la formación de folículos persistentes, con el fin de inducir regresión luteal se combino el protocolo con benzoato de estradiol al momento de la inserción del dispositivo, utilizándose en ese momento una capsula de 10 mg. Posteriormente con el avance de la ciencia se combino la aplicación de PGF, pero los resultados obtenidos fueron variables ya que cuando se utilizaban en una fase luteal tardía (después del día 14) se reportaba una baja fertilidad. En la actualidad se han desarrollado protocolos donde se sincroniza los celos utilizando los dispositivos intravaginales con progesterona combinados con: progesterona, estradiol y prostaglandina. Este protocolo busca sincronizar el desarrollo folicular de forma que los animales tengan un folículo en crecimiento y con capacidad de ovular al momento de retirar el dispositivo. La aplicación de benzoato de estradiol más progestágeno en estudios realizados resulta en un comienzo sincrónico de una nueva onda folicular (en promedio 4.3 días) independiente del momento del ciclo estral en el cual se administre (Bó et al, 2007). En estudios realizados en Nueva Zelanda, se recomienda inducir el pico preovulatorio de LH con la administración de estradiol, esto produce un feed-back positivo sobre la GnRH, y la dosis utilizada fue de 0.75 mg ó 1 mg de EB a las 24 horas de removido el CIDR-B. Los resultados obtenidos demostrarón que el pico de LH se da en promedio a las 16,1 horas después de la aplicación del benzoato y la ovulación 40 horas después (66 horas promedio después de removido el dispositivo). Considerando que los espermatozoides tardan entre 8 a 12 horas en llegar al sitio de la fertilización se recomienda entonces realizar la inseminación entre las 52 y 56 horas de haber retirado el dispositivo (Bó, et al. 2007). En algunos protocolos se ha recomendado la utilización de cipionato de estradiol en vez de benzoato de estradiol para inducir la ovulación y reducir el número de veces que se maneja a los animales. Desde el punto de vista farmacológico la diferencia del cipionato con el el benzoato de estradiol radica en que el primero tiene una vida media mayor y por lo tanto no se sincroniza adecuadamente la emergencia de una nueva onda folicular, es por esto que se prefiere utilizar estrógenos con una vida media corta como la del benzoato de estradiol. A continuación se describen diferentes protocolos recomendados en vacas y novillas a celo detectado o a tiempo fijo: 41 4 Protocolo para Vacas - inseminación a tiempo fijo Protocolo para Novillas - inseminación a tiempo fijo 42 4 Protocolo en Vacas con inseminación a celo detectado Protocolo en Novillas a celo detectado 43 4 REFERENCIAS BIBLIOGRÁFICAS • • • • • • • • • • • • • • • • ADAMS, G.P. JAISWAL, R. SINHG, J. MALHI, P. Progress in understanding ovarian follicular dynamics in cattle. Theriogenology. Vol. 69. p: 72-80. 2008, ALLEN, WR. Luteal deficiency and embryo mortality in the mare. Reproduction Domestic Animal. 2001. Vol. 36. p: 121-131. ASPRÓN, M.A. Curso de actualización-Manejo reproductivo del Ganado Bovino. IVIS. 2004. En Internet: www.ivis.org. BARUSELLI, P,S,;REIS, E.L.; MARQUES M.O. Técnicas de manejo para optimizar a eficiencia reprodutiva em femeas bos indicus. Grupo de estudio de nutricao de rumiantes – Departamento de melhoramiento e nutriciao animal FCA –FMVZ Unesp Botucatu, Sao Paulo, 2004. BARRAGRY, T. Veterinary Drug Therapy. Lea & Febiger. 1994. p 696-700. BERETTA, C. CAVALLI M. A sheer pharmacologic approach to compare the contractile effects of PGF2α , DL-cloprostenol y D-cloprostenol on isolates uterine, trácheal, ileal and arterial smooth muscle preparations. Theriogenology. 2004, 62: 837-846. BÓ, G. Dinámica Folicular y tratamientos hormonales para sincronizar la ovulación en el ganado bovino. Memorias. XI Congreso Venezolano de Producción e industria animal. ULA. Trujillo. 2002. p:1-17. BÓ, G. ALONSO A, CACCIA M, CARCEDO J, CUTAIA L., MORENO D. Manual de Fisiología de la reproducción de la vaca. Especilización en Reproducción Bovina. Instituto de Reproducción Animal Córdoba (IRAC). 2007. BÓ, G. ALONSO A, CACCIA M, CARCEDO J, CUTAIA L., MORENO D. Manual de Tansferencia de Embriones y nuevas Tecnologías. Especilización en Reproducción Bovina. Instituto de Reproducción Animal Córdoba (IRAC). 2007. BÓ, G. ALONSO A, CACCIA M, CARCEDO J, CUTAIA L., MORENO D. Manual de Sincronización de celos e inseminación artificial. Especilización en Reproducción Bovina. Instituto de Reproducción Animal Córdoba (IRAC). 2007. BOTANA, L.M. LANDONI, F. MARTÍN, T. Farmacología y terapéutica veterinaria. Ed. Mc. Graw Hill. 2002. p:411-434 BURGOS, R. HANCKE, J. Estrógenos, andrógenos y progetágenos. Capítulo 31 y DE LA SOTA, R.L, SOTTO A.T. GOBELLO M.C. Capítulo 32. En: BOTANA, L.M. LANDONI, F. MARTÍN-JIMÉNEZ, T. Farmacología y Terapéutica Veterinaria. Editorial Mc. Graw Hill. 2002. p. 411-433. CAVALIERI, J. HEPWORTH, G. FITZPATRICK L.A, SHEPHARD, R.W. MACMILLAN, K.L. Manipulation and control of the estrous cycle in pasture-based dairy cows. Theriogenology. 2006. Vol. 65. p: 45-64 CLEMENTE R. FRANCISCO J. Aplicación de protectores de alta biodisponibilidaden la síntesis en fase sólida a gran escala de goserelina y buserelina , carbetocina : nuevo proceso industrial por ciclación mediante la formación de un enlace tioeter. Universidad de Barcelona . 2000. DAELS, P. Progesterone therapy and pregnancy loss. 8th. AAEP. Annual Resort Symposium. Rome, Italy – January 19-21, 2006. DRIANCOURT, M.A. Regulation of ovarian folicular dynamics in farm animals. Implications for manipulation of reproduction. Therogenology . 1211 – 1239, 2001 44 4 • • • • • • • • • • • • • • • • • EMEA. The European Agency fr the Evaluation of Medicinal Products. Evaluation of Medicines and Inspections. Committee for Veterinary Medicinal Products. EMEA/MRL/146/96-FINAL. December 1999. EMEA. The European Agency for the Evaluation of Medicinal Products. Oestradiol. Summary Report. ESPINOZA, J.L. ORTEGA, R., PALACIOS, A., VLAENCIA, J. ARÉCHIGA, C. Crecimiento folicular ovárico en animales domésticos: Una revisión. Iterciencia. 2007. Vol. 32. No. 2. p 93-99. FARWELL, A y BRAVERMAN, L. Estrogens and Progestins. Chapter 57. En: Goodman and Gilman. The Pharmacological Basic of Therapeutics. Eleventh Edition. Laurence Brunton, John S. Lazo and Keith L. Parker. Editorial McGraw Hill. 2006. p: 1558-15561. GIGLI, I. RUSSO, A. AGÜERO, A. Consideraciones sobre la dinámica ovárica en equino, bovino y camélidos sudamericanos. In. Vet. 2006. Vol. 6. 183-204. GONZÁLEZ-DOMÍNGUEZ, M y MALDONADO-ESTRADA, J. Gestación prolongada asociada con la prescripción inadecuada de medroxiprogesterona acetato. ¿Es racional y ético el uso de progestágenos exógenos en perras?. Revista Colombiana de Ciencias Pecuarias. 2006. Vol.19. No. 4. p:442-450. HIRSBRUNNER, G. KNUTTI,B. BURKHARDT, H. KÜPFER, U. STEINER, A. Effect of two dosages of d-cloprostenol on intrauterine pressure and uterine motility during dioestrus in experimental cows. Journal of the American Veterinary Medical Association. 1999, 46: 345-352. HIRSBRUNNER G, KÜPFER, U. BURKHARDT, H. SETEINER, A. Effect of diferent prostaglandins on intrauterine pressure and uterine motility during diestrus in experimental cows. Theriogenology. 1998, 50: 445-455. HOUNTER D. J., SCHULZ P., WASSENAAR, W., Efect of carbetocin, a long – acting oxytocin analog on the postpartum uterus. Clin Pharmacol. Ther.; vol 52 ISS Jul 1992, P60-67. KAEOKET, K. The effect of dose and route of administration of R-cloprostenol on the parturient response of sows. Reproduction in Domestic Animals.2006. 41: 472476. KUSTRITZ, R. Use of supplemental progesterone in management of canine pregnancy. In: Recent Advances in Small Animal Reproduction. 2001. En internet: www.ivis.org LANDONI, M.F. SORACI, A.L. DELATOUR, P. LEES, P. Enantioselective behaviour of drugs used in domestic animals: a review. Journal of Veterinary Pharmacology and Therapeutics. 1997. 20: 1-16. MAPLETOFT, R.J. Transferencia de embriones bovinos. IVIS. 2006. En Internet: www.ivis.org. MARTÍNEZ, M.F. KASTELIC, J.P. COLAZO, M.G. Effects of estradiol on Gonadotrophin release, estrus and ovulation in CIDR-treated beef cattle. Domestic Animal Endocrinology . 2007. Vol. 33. p: 77-90. MELLISHO, E. Guía práctica de sincronización de estro. Curso de Reproducción Animal-Práctica. Universidad Nacional Agraria La Molina. 2006 NASSER, L.F. REIS, E.L. OLIVEIRA, M.A. BÓ, G.A. BARUSELLI, P.S. Comparison of four synchronization protocols for fixed-time bovine embryo transfer in Bos indicusxBos taurus recipients. Theriogenology. 2004. 62: 1577-1584. OLIVERA, M. RUIZ, T. GIRALDO, C. Vías implicadas en la luteólisis bovina. Revista Colombian de Ciencias Pecuarias. 2007. p 387-393. 45 4 • • • • • • • • • • • • PETERS, A.R.,S.J.WARD, M,J, WARREN, P,J,GORDON,1999. Ovarian and hormonal responses of cows to treatment with an analohue of gonadotropin releasing hormone and prostaglandin F2alfa. Vet.Rec.,343-346 PLUMB, D. Veterinary drug handbook. Fourth Edition. Iowa State Press. 2002. p. 203-204. RE, G. BADINO, P. NOVELLI, A. VALLISNERI, A. GIARDI, C. Specific binding of dl-cloprostenol and d-cloprostenol to PGF2 alpha receptors in bovine corpus luteum and myometrical cell membranas.ABSTRACT. Journal of Veterinary Pharmacology and Therapeutics. 1994. 17:455-8. RIBADU, A.Y,W.R. WARD AND H. DOBSON. 1994. Comparative evaluation of ovarian structures in cattle by palpation per rectum, ultrasonography and plasma progesterone concentration. Vet Rec., 452 – 456. SPENCER,T. JOHNSON, G. BURGHARDT, R AND BAZER, F. Progesterone and placental hormone actions on the uterus: insights from domestic animals. Minireview. Biology of Reproduction. 2004. Vol. 71.p: 2-10. SUMANO, H. OCAMPO, L. Farmacología Veterinaria. Tercera Edición. 2006. ed. Mc Graw Hill. p:839-867. TANIGUCHI, M. IKEDA, A. ARIKAWA, E. Ovarian follicular and corpus luteum changes, progesterone concentrations, estrus and ovulation following estradiol benzoate/progesterone based treatment protocol in cross-bred cows. Animal Reproduction Science. 2007. Vol 99. p: 389-394. TAPONEN,J. Kindahl, H. Effect of dexcloprostenol on endogenous prostaglandin F2α release in dairy heifers. Theriogenology. 2005. 63:1659-1666. TENHAGEN B.A, BIRKELBACH, E. HEUWIESER, W. Serum progesterone levels in post-partum dairy cows after repeated application of the prostaglandin analogue D (+) Cloprostenol sodium. Journal of the American Veterinary Medical Association. 2000. 5: 213-220. THOMPSON, F. Hormonas que afectan la reproducción. Capítulo 31. En: Adams R. Farmacología y terapéutica veterinaria. Segunda edición. Editorial Acribia. 2002. p. 654-655. TSUTSUI, T. MIZUTANI, W. Estradiol benzoate for preventing pregnancy in mismated dogs. Theriogenology. 2006. Vol. 66. P: 1568-1572. WALTERS,D,L.,D, SHAMS AND E. SCHALLEMBEGER. 1984. Pulsatile secretion of gonadotrophins, ovarian steroids and ovarian oxytocin during the luteal phase of oestrus cycle in the cow. J.Reprod Fert,. 479 – 491. 46 4