Modificaciones dela teoría de Böhr y números cuánticos
Anuncio

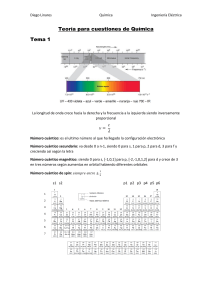
Modificaciones dela teoría de Böhr y números cuánticos Con el perfeccionamiento de las técnicas espectroscópicas surgieron interrogantes que no podían responderse por medio del modelo de Bör. Los espectrógrafos de alta resolución mostraron que muchas de las líneas de un espectro de emisión típico no eran líneas simples sino grupo de líneas muy poco espaciadas. En 1916, Sommerfeld trató de explicar esto indicando que además de los orbitales circulares existen otras orbitas elípticas para cuya descripción necesitan dos números cuánticos: el número cuántico principal y el número cuántico azimutal secundario o de momento angular l. El nuevo número cuántico secundario puede tomar, según los datos experimentales, n valores desde l = 0 a l= n-1 Energéticamente, significa que los niveles de energía están conformados por varios subniveles. El número de subniveles en cada nivel es igual a n, y se representan por las letras minúsculas s, p, d, f en orden creciente de energía. Las modificaciones al modelo de böhr no terminaron con las órbitas elípticas. Experimentos posteriores demostraron que al colocar la fuente emisora de luz en un campo magnético fuerte, dividía las líneas del espectro en más líneas. Un tercer valor llamado número cuántico magnético representado por ml fue introducido para explicar el efecto magnético. Se introdujo un cuarto número cuántico para tomar en cuenta el giro del electrón. La hipótesis establece que un electrón puede girar en sentido de las agujas del reloj o en dirección contraria respecto a un eje, y en cada tipo de giro da una línea espectral característica. Este es el número cuántico spin, ml El físico Werner Heisenberg mostró que es imposible medir simultáneamente la posición exacta de un cuerpo tan pequeño como el electrón. El número cuántico principal representado por la letra minúscula n determina el nivel de energía principal o capa donde se encuentra el electrón. Puede tener cualquier valor entero positivo, para los elementos que se conocen actualmente; los valores van de n=1 a n=7 o con las letras mayúsculas K; L; M; N; O; P; Q. El número cuántico secundario, orbital o azimutal determina el subnivel o subcapa dentro del nivel principal de energía, e indica la forma de la nube electrónica u orbital alrededor del núcleo. Los números cuánticos secundarios se designan por las letras minúsculas s, p, d, f, puede tener los valores 0, 1, 2, 3,…n-1. Del núcleo hacia afuera aumenta la energía El número cuántico magnético, representa la orientación de los orbitales electrónicos en el espacio, puede tener valores de -1 a +1 incluyendo 0. 7s 7p 7d 7f n =7 6s 6p 5s 6d 5p 5d 7f n =6 n =5 4s 4p 4d n =4 3s 3p n =3 2s 2p n =2 1s n=1 Números Cuánticos Principal n Secundario Magnético Espín l ml s nivel de subnivel número de giro del energía de energía orbitales electrón