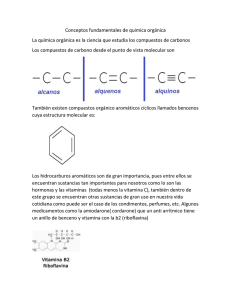
documentación
Anuncio

JORNADAS DE ONCOLOGÍA Y ATENCIÓN PRIMARIA 2002 CONTROL DE S ÍNTOMAS GRUPO DE PALIATIVOS DE LA SAMFYC Clavelina Arce García Belén Cuesta Castro Isabel Fernández Rodríguez Juan Santos Suarez Carmen Valdés Gomez Paloma Virgala Teijeiro PRINCIPIOS GENERALES INTRODUCCIÓN En nuestro medio tres de cada mil personas fallecen cada año por cáncer. A pesar de los avances en prevención, diagnóstico y tratamiento, la enfermedad oncológica sólo es curable en menos de un 50% de los casos; además de ser una causa importante de mortalidad, afecta a personas jóvenes frecuentemente y causa un importante sufrimiento en pacientes y familiares que afecta a todas las esferas de su vida. Por todo ello es fundamental el desarrollo de la Medicina Paliativa para el correcto tratamiento de éstos pacientes. El enfoque del tratamiento de un enfermo oncológico, varía en función de las posibilidades de curación de la enfermedad. No hay una línea definida de paso de un tratamiento activo a uno paliativo, sino que la importancia del paliativo aumenta a medida que disminuyen las posibilidades de curación de la enfermedad. Se definen los cuidados paliativos como la atención integral de los enfermos en situación terminal, cuando la curación ya no es posible. El objetivo es proporcionar a los pacientes el mayor grado de bienestar posible. Lo conseguiremos con un adecuado control de síntomas, ayuda emocional, apoyo psicológico y social. Se define como tratamiento de soporte la atención a las necesidades físicas, psicológicas y sociales de los enfermos oncológicos durante la fase de tratamiento activo, cuando el paciente tiene posibilidades de curación. Incluye el control de los síntomas derivados de la propia enfermedad y los efectos secundarios de los tratamientos específicos, una atención adecuada al proceso de información y comunicación con el paciente y la familia, y la atención psicológica y social en los casos necesarios. TRATAMIENTO ACTIVO TRATAMIENTO PALIATIVO DIAGNÓSTICO EXITUS CONTROL DE SINTOMAS El control de síntomas es una de las herramientas que tenemos en Medicina Paliativa, para conseguir que los pacientes diagnosticados de cáncer y sus familiares disfruten del mayor grado de bienestar posible. Saber reconocer, evaluar y tratar convenientemente los síntomas, influye de forma directa en su calidad de vida. A lo largo de la evolución de la enfermedad los pacientes con enfermedad oncológica presentan síntomas múltiples. Se calcula que al ingreso en una Unidad de Cuidados Paliativos los pacientes presentan una media de entre 6 y 9 síntomas, según diferentes series. En el mismo enfermo coexisten varios síntomas a la vez, con diferentes grados de intensidad, y tiempo de evolución, que le causan sufrimiento y dependencia. Esto nos obliga a hacer una correcta valoración y establecer prioridades para su control. La intensidad de los síntomas depende, por un lado, del estimulo nociceptivo y, por otro, del umbral de percepción que, a su vez, viene condicionado por factores asociados como: el estado de ánimo, el apoyo emocional que reciba, la capacidad de distracción de que disponga, el grado de control de otros síntomas, etc. Es conveniente, contar con algún instrumento de medida que permita evaluar el resultado de nuestra intervención. La escala más utilizada es la escala analógico visual; también son útiles escalas numéricas o verbales, siempre que utilicemos la misma y, nos permita valorar la respuesta al tratamiento. Otra característica de los síntomas es que son multifactoriales, cada síntoma puede ser producido por diferentes causas que en ocasiones se asocian. Determinar la etiología es importante, ya que nos permitirá realizar un tratamiento más eficaz. Por ejemplo: los vómitos pueden deberse a causas tan dispares como hipertensión craneal, obstrucción intestinal, intolerancia a diferentes fármacos o hipercalcemia; el tratamiento adecuado es diferente en cada una de ellas. A medida que avanza la enfermedad y, en función de nuestra intervención, los síntomas van cambiando, se controlan unos y aparecen otros nuevos, esto nos obliga a efectuar cambios continuos en el tratamiento. La prevalencia de cada síntoma varía en las diferentes series publicadas, los datos que expongo a continuación son aproximativos. El grupo de síntomas más frecuente lo constituye el denominado síndrome general: astenia, anorexia y pérdida de peso que está presente en el 90% de los enfermos en fases avanzadas. El dolor afecta al 80% y, en muchas ocasiones, no es único sino que el mismo enfermo presenta dolor en diferentes localizaciones, que obedece a diversas causas. Existen síntomas que causan gran malestar en el enfermo, que son frecuentes y, tienen soluciones sencillas como: el estreñimiento, los problemas de la boca (sequedad, candidiasis) y de la piel, que son frecuentemente olvidados. Diferentes grados de ansiedad y depresión e insomnio están presentes hasta en un 60% de los enfermos. La disnea afecta al 50%. Nauseas y vómitos los presentan el 40%. Un síntoma cada vez más frecuente, que causa un gran impacto emocional en el paciente y la familia, y de difícil control, es el delirium. INTERVENCIÓN Previamente a iniciar el tratamiento debemos realizar una valoración global del paciente; para ello utilizaremos la entrevista clínica, realizando las exploraciones y pruebas complementarias que consideremos adecuadas, para conseguir el objetivo de acercarnos (dentro de lo posible y razonable para la situación del enfermo), a un diagnóstico causal de los problemas que presente. No debemos olvidar que, aunque en la mayor parte de los casos los síntomas de un enfermo con cáncer obedecen a la progresión de la enfermedad, en ocasiones son debidos a complicaciones de los tratamientos (farmacológicos o no) recibidos y, otras veces, se deben a procesos que nada tienen que ver con él. En la historia clínica de éstos pacientes debe constar: tipo y extensión del tumor, tratamientos recibidos y su finalidad, tratamiento actual, grado de información sobre su enfermedad y adaptación emocional a la misma, situación socio-familiar, nivel funcional, síntomas actuales (percibidos o no). Registraremos el número de síntomas que presenta, su intensidad y, la influencia que tiene en el nivel de actividad y estado de ánimo, es decir, el grado de dependencia y sufrimiento que causan al paciente. Buscaremos la causa de cada síntoma, utilizando las exploraciones y pruebas complementarias que consideremos adecuadas, teniendo en cuenta el estado general del enfermo, su pronóstico y, el beneficio que esperamos obtener. En función de la valoración realizada, de acuerdo con el enfermo y su familia, estableceremos un plan de cuidados dando prioridad a aquellos síntomas que más afecten al paciente y sean fácilmente controlables. Es importante explicar al paciente que síntomas podemos controlar y cuales no, ser realistas y, cuando no podemos controlar un síntoma, favorecer la adaptación. El plan debe incluir, además del tratamiento farmacológico, una serie de medidas generales que aumenten el umbral de percepción del síntoma: compañía, distracción, ambiente relajado; o bien, contribuyan al control del mismo: cambios higiénico-dietéticos, calor, masaje, etc. El tratamiento farmacológico debe ser etiológico, en la medida de lo posible. Utilizaremos preferentemente la vía oral y, si no tolera, la subcutánea por ser más fácilmente manejable y no dolorosa. Dado que la causa no desaparece, es de esperar que el síntoma persista, por esto debemos establecer pautas fijas y regulares, olvidando el tratamiento a demanda; conociendo los efectos secundarios más habituales de los tratamientos que prescribimos, debemos explicarlos y prevenirlos en la medida de lo posible. El mejor tratamiento prescrito no tiene ningún efecto si no se cumple, para facilitar el cumplimiento es imprescindible una explicación detallada de la posología, de los efectos que buscamos y posibles efectos secundarios, dejar documentación escrita, adecuar la posología, sabor y presentación de los fármacos a cada paciente. Utilizaremos el menor número de medicamentos posible que permita un adecuado control de síntomas. El plan de cuidados debe ser revisado evaluando los resultados. Debemos valorar el grado de control de los síntomas previos, la aparición de otros nuevos y establecer los cambios necesarios. CASO PRÁCTICO Jose Angel, 65 años En Marzo de 2001 fue diagnosticado, en el Hospital Central, de carcinoma epidermoide de pulmón T3 N0 M0 . Se le realizó una neumectomía izquierda y recibió radioterapia complementaria, que finalizó en Junio de 2001. En Octubre de 2001 presenta recidiva en pared torácica realizándosele resección quirúrgica y RT complementaria en parrilla costal izquierda que finalizó en Abril de 2002. En Julio de 2002 acudió a revisión presentando en la exploración una tumoración de partes blandas en región axilar posterior, se realizó PAAF informada como metástasis de carcinoma escamoso, en el TAC presentaba además probables nódulos en pulmón derecho. Como reside en Gijón fue derivado para valoración de tratamiento quimioterápico al Servicio de Oncología del Hospital de Cabueñes. Acude a Consulta el 7/8/2002 en silla de ruedas por disnea de mínimos esfuerzos y astenia. El Oncólogo desestima tratamiento quimioterápico y nos lo deriva para Cuidados Paliativos. ENTREVISTA: Al interrogar sobre otros síntomas el paciente refiere pérdida de apetito importante, estreñimiento y dolor moderado en axila izquierda que se modifica con el movimiento y la postura y en ocasiones le dificulta el sueño. Realiza tratamiento con codeína y paracetamol que toma “a demanda”, a pesar de tenerlo pautado, sólo una vez al día por producirle sudoración, con buena respuesta. EXPLORACIÓN: Ictericia conjuntival. Disneico y taquipneico (30 respiraciones/minuto). Ausencia de ventilación en hemitórax izquierdo, hipoventilación y crepitantes en base derecha. Tumoración subcutánea dolorosa en región axilar posterior sin signos inflamatorios. En auscultación cardiaca, ruidos cardiacos rítmicos a una frecuencia aproximada de 140 por minuto. Abdomen blando con hepatomegalia a 6 cm. de línea medio-clavicular. Edemas con fóvea en miembros inferiores hasta rodilla. Elaborar la lista de problemas y tratar de buscar la causa de cada uno de ellos. ¿Necesitaríamos alguna prueba complementaria? DOLOR ONCOLÓGICO En la valoración de cualquier tipo de dolor y, específicamente, en el caso del enfermo oncológico, debemos de conocer y preguntarnos sobre: • Intensidad. (nos indica en que escalón terapéutico debemos situarnos, nos permite conocer la respuesta al tratamiento instaurado…). Podemos utilizar como método más sencillo la escala analógica visual. • Causas posibles del dolor. (compresión, infiltración, distensión…). Por ello es fundamental hacer una valoración general del paciente y un plan de cuidados antes de tomar decisiones terapéuticas, porque conociendo las causas de ese dolor podemos instaurar tratamientos específicos más eficaces. • Tipo o características del dolor. (nociceptivo, neuropático...) • Identificar factores de mal pronóstico para el control del dolor. • Qué tratamiento está más indicado, teniendo en consideración, además de la escalera analgésica de la OMS, el uso de adyuvantes y otros tratamientos paliativos como la radioterapia, quimioterapia, hormonoterapia, cirugía… 1. Intensidad del dolor: • Puede utilizarse la escala analógica visual: No dolor ------------------------------------ Peor dolor pos ible • Escala numérica: No dolor 0 1 2 3 4 5 6 7 8 9 10 El peor dolor posible. • Escala descriptiva : no dolor / ligero / moderado / severo / muy severo / el peor posible 2. Causas posibles del dolor: I. Directamente relacionadas con el desarrollo del tumor (78%): Ej: metástasis óseas, compresión/infiltración de nervios, afectación de víscera hueca, afectación de un órgano. II. Relacionado con la terapia del cáncer: Ej: cirugía, radioterapia, quimioterapia, neuritis… III. Dolor no relacionado con ninguno de los anteriores: Ej: neuralgia postherpética, artritis, otros… 3. Tipo o características del dolor: II. Dolor nociceptivo: • Somático: constante o intermitente, punzante, sordo, en ocasiones opresivo, bien localizado. Se produce por activación de receptores nociceptivos (ej: metástasis óseas, infiltración de tejidos blandos…). • Visceral: constante, sordo, punzante, atenazante. Se produce por activación de nociceptores, (metástasis intraabdominales, metástasis de hígado…). III. Neuropático: se produce por destrucción, infiltración, o compresión de tejido nervioso. Puede tener dos manifestaciones clínicas: • Disestésico o por desaferentación: sensación quemante continua, en ocasiones se irradia (ej: neuralgia postherpética) • Neurálgico: paroxismos de dolor lancinante, cortante, en descargas. (ej: neuralgia del trigémino). 4. ¿Existen factores de mal pronóstico para el control del dolor?: • Dolor neuropático. • Dolor incidental (dolor severamente exacerbado por un incidente como un movimiento, un acceso de tos...) o dolor irruptivo (no se detecta la causa que lo desencadena). • Deterioro cognitivo. • Alto distréss psicológico. • Historia de alcoholismo o drogadicción. 5. Tratamiento del dolor: I. Principios generales en el uso de analgésicos II. Escalera terapéutica de la OMS III. Fármacos adyuvantes. I. PRINCIPIOS GENERALES SOBRE EL USO DE ANALGÉSICOS • • • • • • • • • • “Si duele….duele” No usar placebos. El manejo ha de ser simple. Dosis individualizada. No mezclar opioides. Utilizar adyuvantes si se precisan. No utilizar psicotropos de rutina. Tratar siempre el insomnio. Utilizar la vía oral siempre que sea posible. Administrarlos “ reloj en mano”. En ocasiones debemos ingresar a los pacientes en el hospital. II. ESCALERA TERAPÉUTICA EN EL DOLOR ONCOLÓGICO OPIOIDES POTENTES (Morfina, metadona, fentanilo…) +/-coanalgésicos OPIOIDES DÉBILES (Codeína, dihidrocodeína, tramadol…) +/-coanalgésicos ANALGÉSICOS PERIFÉRICOS (Paracetamol, AAS, AINES) +/-coanalgésicos PRIMER ESCALÓN Dosis mg. Intervalo dosis Dosis máxima/día Paracetamol 500/1000 4-6 h 6000 mg AAS 500/1000 4-6 h 6000 mg Ibuprofeno Naproxeno Diclofenaco 400-600 4-6 h 2400 mg 250-500 8-12 h 1500 mg 50 mg 6-8 h Ketorolaco* 10 mg 6h 40 mg Metamizol** 500 mg/2000 g 6-8 h 8000 mg Parenteral Comentario Nombre comercial Hepatotóxico. No antinflamatorio. Efectos negativos gastrointestinales… oral, rectal EFG oral, rectal EFG oral, rectal EFG oral Toradol oral sup. 1 g Nolotil EFG 75 mg ampolla 10-30 mg ampolla 2 g/ampolla (bebible) EFG EFG AAS y AINES son especialmente efectivos en el tratamiento de los dolores óseos. *30 mg de KETOROLACO parenteral equivalen a 10 mg de morfina. **Por su actividad espasmolítica, el METAMIZOL es eficaz en los dolores viscerales. ***Los analgésicos periféricos pueden combinarse con opioides. Una combinación clásica y efectiva es codeína 30mg+ paracetamol 500mg. SEGUNDO ESCALÓN OPIOIDES DÉBILES*** Fármaco Dosis 30-60 mg Codeína Dihidrocodeína 60-120 mg Tramadol* 50 mg Retard: 100-200 mg Intervalo dosis 4-6 h 12 h 6-8 h 12-24 horas Dosis máx. 360 mg/24 h 240 mg/24 h 100 mg/6 h Vía Nombre comercial oral, rectal Codeisan comp 30 mg oral Contugesic comp 60 mg, 90 y 120 mg oral, rectal, EFG comp 50 mg, subcutánea. Sup 100, amp 100, IM, IV.** 1gota=2,5 mg *La potencia analgésica del tramadol es ligeramente superior a la de la codeína. **Por vía intravenosa, la ampolla de tramadol ha de diluirse en 10 ml de suero fisiológico e inyectarlo lentamente. ***Los efectos secundarios comunes a los tres son: estreñimiento, náuseas, vómitos y somnolencia. El tramadol produce menos estreñimiento que la codeína y la dihidrocodeína. No se deben mezclar nunca dos analgésicos opioides. La potencia del analgésico vendrá determinada por la intensidad del dolor y no por la supervivencia prevista. Cuando el paciente está con dosis máxima de opioide (codeína o dihidrocodeína) y no tiene controlado el dolor, podemos pasar directamente a formas retard de morfina a la dosis de 30 mg cada 12 horas. TERCER ESCALÓN MORFINA La MORFINA es el fármaco de elección en el dolor severo. No tiene techo analgésico. Siempre que sea posible se utilizará por vía oral, ya que es igual de eficaz que por otras vías. Cuando iniciamos el tratamiento con morfina, es mejor utilizar la de liberación inmediata (Sevredol ) para ajustar dosis (se administra cada 4 horas). Cuando tengamos titulada la dosis diaria total eficaz, podemos pasar a las formas de morfina de liberación controlada (MST continus, Skenan, MST unicontinus.). Ej: Podemos comenzar con 5-10mg de morfina oral rápida (Sevredol) cada 4hs. Transcurridas 24hs, si el paciente no tiene dolor, se mantiene la misma dosis. Si continúa con dolor, se aumenta la dosis total diaria en un 50% y así sucesivamente. Si se produce excesiva sedación se reduce la dosis diaria un 50%. ¿CÓMO PASAR DE MORFINA RÁPIDA A MORFINA RETARDADA? Se divide la dosis diaria total de morfina entre dos, y ésta será la dosis a administrar de morfina retard, cada 12 horas. Ej: Dosis total de morfina rápida:120 mg/24 h. Dosis de morfina retard: 60 mg/12 h. ¿CÓMO PASAR DE MORFINA ORAL A SUBCUTÁNEA? Se divide entre dos la dosis de morfina diaria total, y el resultado es la morfina diaria a administrar por vía subcutánea. Ej: Dosis diaria total de morfina oral: 120 mg. Dosis diaria subcutánea equivalente: 60 mg. (si se administra en bolos pautaremos 10 mg/4 h). ¿CÓMO PASAR DE MORFINA SUBCUTÁNEA A MORFINA ORAL? Se multiplica por dos la dosis subcutánea diaria que recibe el enfermo, y ésta cantidad, se divide entre el número de tomas orales diarias que precise (entre dos si pasamos a una forma retard de morfina o entre 6 si pasamos a una forma rápida de morfina). Ej: Dosis diaria subcutánea: 60 mg. Dosis diaria oral: 120 mg/2= 60 mg cada 12 horas si administramos forma retard. Dosis morfina rápida: 120 mg/6 h = 20 mg cada 4 horas. EFECTOS SECUNDARIOS DE LA MORFINA: • • • • • • • Estreñimiento: Muy frecuente. Debemos realizar profilaxis con laxantes. Nauseas, vómitos: Suelen remitir al cabo de 3-4 días. Somnolencia: suele desaparecer espontáneamente al cabo de 4-5 días, si la dosis pautada es correcta. Vértigo (se trata con cinarizina). Retención urinaria (a veces precisa sondaje). Prurito (antihistamínicos). Sudoración (a veces responde a corticoides). Signos de toxicidad: • • • • Nausea intratable. Delirium y alucinaciones (el haloperidol es de elección). Deterioro cognitivo. Hiperalgesia. • • Mioclonias (clonazepán). Depresión respiratoria en pacientes terminales con dolor intenso es extremadamente infrecuente. Estas manifestaciones de toxicidad suelen ocurrir en pacientes que toman altas dosis de opioides, en tratamientos prolongados, y en pacientes que desarrollan insuficiencia renal: Se postula que la acumulación de determinados metabolitos activos es la responsable de la mayor ía de estos efectos tóxicos. Cuando aparecen estos síntomas, se recurre a las siguientes estrategias: • • • Disminuir dosis de opioides. Rotación de opioides o de vía de administracción. Hidratación. Además se deben excluir factores metabólicos agravantes, como la hipercalcemia y la uremia. FORMAS DE PRESENTACIÓN DE LA MORFINA: 1- Sulfato de morfina: forma oral, soluble, para administrar cada 4 horas. No está comercializada, la prepara el farmacéutico. 2- Cloruro mórfico (parenteral) • • • Al 1% en 1 ml (10 mg en 1 ml) Al 2% en 1 ml (20 mg en 1 ml) Al 2% en 2 ml (1 ampolla de 2 ml contiene 40 mg de cloruro mórfico) (morfina Palex) 3- Formas orales de liberación rápida (cada 4 horas) .Sevredol: 10 y 20 mg. Los comprimidos se pueden masticar. Indicado en el dolor severo, en la titulación de dosis de inicio de opioides y como dosis de rescate en el tratamiento con formas retard de morfina o con fentanilo. 4- Formas orales de liberación sostenida o retard (cada 12 –24 horas): .Skenan: 10-30-60-100-200 mg. Cápsulas con microgránulos, puede abrirse la cápsula y vaciar el contenido. .MST continus : 5-10-15-30-60-100-200 mg. Comprimidos, deben ingerirse enteros. .MST unicontinus (cada 24 horas). DOSIS EQUIVALENTES DE MORFINA: .M.retard/M.rápida:1/1 .M.oral/rectal:1/1 .M.oral/subcutánea:1/2 .M.oral/intravenosa:1/3 FENTANILO Es un opiáceo que tiene como característica su presentación en forma de parches transdérmicos, capaces de liberar la sustancia de forma sostenida durante 72 horas. No tiene techo analgésico como la morfina. Las concentraciones séricas de fentanilo aumentan gradualmente a lo largo de las primeras 12 –24 horas de su administración y se mantienen relativamente constantes hasta las 72 horas de su administración. Cuando se retira el parche las concentraciones séricas de fentanilo disminuyen gradualmente a la mitad al cabo de 17 horas. Indicaciones: • • • Cuando existen dificultades para ingerir morfina oral. Intolerancia a los efectos secundarios de la morfina. Imposibilidad para realizar correctamente la pauta de administración oral de morfina. La vida media del fentanilo puede verse modificada en: • • • ancianos (se prolonga) caquécticos con la fiebre y/o la sudoración FORMAS DE PRESENTACIÓN COMERCIAL: Durogésic 25-50-100 microgramos/hora. 25 microgramos/h: parches con 2,5 mg de fentanilo. 50 “ : “ con 5 mg de fentanilo. 100 “ “ con 10 mg de fentanilo. En pacientes no tratados previamente con opioides potentes, se deben utilizar parches de 25 microgramos/h y administrar a la vez morfina de liberacion rápida (5-10mg) o subcutánea (5mg) que podrá repetirse cada 4 horas si el paciente tiene dolor. ¿CÓMO INICIAR TTO CON FENTANILO EN PACIENTES PREVIAMENTE TRATADOS CON MORFINA? 50 mg de morfina oral en 24 horas equivalen a un parche de 25 microgramos/hora de fentanilo Los pacientes que tomaban morfina de liberación lenta, tomarán la última dosis de morfina retard a la vez que se les administra el primer parche de fentanilo. Los que tomaban morfina de liberación rápida o subcutánea, continuarán con la dosis de morfina durante 12 horas más después de haber administrado el primer parche de fentanilo. Los parches se cambian cada 3 días. Si se precisan dosis de rescate de morfina oral rápida o subcutánea, se incrementará la dosis previa de fentanilo. ¿CÓMO PASAR DE FENTANILO A MORFINA? El cambio ha de ser gradual porque las concentraciones en sangre de fentanilo se reducen un 50% a las 17 horas. Se retira el parche de fentanilo y se administra la dosis equivalente de morfina (cada 4 o cada 12 horas según sea rápida o retard). Durante las 12 primeras horas de retirada del parche es preferible utilizar morfina de liberación rápida. III. FÁRMACOS ADYUVANTES Coanalgésicos son aquellos fármacos que, no teniendo como primera indicación la analgesia, tienen efecto analgésico; coadyuvantes son fármacos que carecen de efecto analgésico pero su utilización ayuda al control del dolor o permite reducir los efectos secundarios de los analgésicos utilizados. Comúnmente se administran junto a los analgésicos clásicos. • Antidepresivos. • Anticonvulsivantes. • Glucocorticoides. • Anestésicos. • Difosfonatos. • Benzodiacepinas. • Neurolépticos. Antidepresivos triciclicos: La amitriptilina es el fármaco más utilizado de este grupo, indicado especialmente en el dolor neuropático tipo disestésico. Dosis de inicio: 10-20 mg v.o /noche. Dosis efectiva: 50-100 mg/día.(8) Anticonvulsivantes: • Gabapentina: Indicado especialmente en el dolor neuropático tipo neuralgia (presenta menos efectos secundarios que la carbamacepina). Dosis inicio: 300 mg. en la cena, a las 24 h. 300 mg en comida y cena, a las 24 horas 300 mg. cada 8 horas. Si no es eficaz a los 4-5 días se puede incrementar la dosis. Dosis máxima: 600 mg cada 8 horas. • Carbamacepina: Indicada especialmente en el dolor neuropático tipo neuralgia. Dosis: 200 mg/noche e ir aumentando hasta 400 mg/8 horas. Debe hacerse control hematológico, especial precaución en inmunosuprimidos. Glucocorticoides: Además de su uso en la hipertensión intracraneal, compresión medular, y de su efecto antiinflamatorio global, eleva el estado de ánimo, es antiemético y estimula temporalmente el apetito. Dosis: dexametasona 4-16 mg /día en el desayuno (produce insomnio). Anestésicos locales por via oral: Flecainida oral y mexiletine son eficaces en el tratamiento del dolor neuropático, tipo disestésico y tipo neuralgia. Tienen efectos secundarios importantes. Anestésicos tópicos: .EMLA (Eutetic Mixture of Local Anesthetics). .Capsaicina Difosfonatos: .Pamidronato (Aredia) 90mg en dosis única (iv) cada 3-4 semanas. .Clodrato disódico (Mebonat): 5mg/kg /dia iv en 2 horas, 10 días. Benzodiacepinas: .Diacepan: 5-10 mg al dia. .Midazolan:7,5 mg al dia Neurolépticos: .Clorpromacina (Largactil) Gotas:1 mg = 1 gota. Comprimidos: 25-100 mg. Indicado en el dolor por tenesmo rectal., también es antiemético, sedante nocturno, útil en el hipo. .Haloperidol: 10 gotas = 1 mg. Por encima de los 5 mg/día, puede producir reacciones extrapiramidales. Indicado como antiemético, sedante y antipsicótico. Se puede administrar por vía subcutánea. Bibliografía: 1- Control de síntomas del enfermo terminal: Unidad de medicina Paliativa El Sabinal 2- Manejo del dolor oncológico: Guias Fisterra.www.fisterra.com 3- Guía de analgésicos: SECPAL: www.secpal.com. 4- BMJ:wwwbmj.com312(7034):823.Recomendations for use of morphine for cancer pain. 5- OMS.Cáncer pain relief.1986. 6- Protocolo de cuidados paliativos FMC1997. 7- BMJ 200;321:555-558 Palliative care, recent advances.(clinical review) 8- Palliative Care Association of Alberta Handbook.(Palliative.net): -“Adjuvant analgésics.” -“Management of cancer pain.” CASO PRÁCTICO Florentino, 70 años Diagnosticado en Mayo de 2000 de hipernefroma, tras ingreso para estudio por hematuria. Se le realizó una nefrectomía derecha. En Octubre de 2001, estando asintomático, en una revisión se objetiva en TAC la presencia de lesiones pulmonares, óseas y adenopatías mediastínicas compatibles con metástasis. En Marzo de 2002 ingresa en Neurología por hemiparesia dcha que se pone en relación con sangrado de lesión en cráneo. Desde Abril presenta cuadro de dolores óseos que han ido aumentando de intensidad. En gammagrafía ósea lesiones compatibles con metástasis en: calota, escápula, columna cervical y dorsal, arcos costales y pelvis. Ingresa en la Unidad, en Agosto de 2002, para C. P., derivado desde la consulta de Urología a la que acudió la mujer. El paciente presenta dolor intenso desde hace un mes, fundamentalmente en columna dorsolumbar, que aumenta con la movilidad y, por tanto, le obliga a permanecer en cama, dificultándole además el sueño. En ocasiones el dolor se irradia por miembro inferior izquierdo con sensación de hormigueo. Realiza tratamiento con: Ibuprofeno/6 h., metamizol 2g/8 h., paracetamol 1gr/6h., dexametasona 8mg./24h., y omeprazol. ¿Qué te parece el tratamiento que realiza?. Elaborar el listado de problemas y plan de cuidados. DISNEA Y TERMINALIDAD Concepto y prevalencia. • Sensación desagradable de falta de aire. • Hasta un 70% en últimas 6 semanas de vida. Causas • • Caja torácica: Enfermedades degenerativas (ELA). Pulmonar: Vías respiratorias » Parénquima (infecciones, inflamación , neoplasias...) » Pleura (derrame, neumotórax) » Vasos (TEP, linfangitis) • Cardiaca: Miocardiopatías (ICC, IAM). » Pericardio. » Arritmia. • • Sangre: Anemias. Elevación del diafragma: Ascitis Diferencias Causa orgánica • • • • • No suspirosa Continua Aumenta con el esfuerzo Creciente en intensidad Opioides Causa psíquic a • • • • • Suspirosa Discontinua No relación esfuerzos Variable Psicotrópicos Pruebas Complementarias. • Domicilio: Pulsioximetría » Hemograma • Fuera del domicilio: Gasometría » Rx torax Tratamiento (I) 1. Opioides. 2. BZD. 3. 4. 5. 6. Neurolépticos. Psicoestimulantes. Oxígeno. Otros (tó raco/laparocentesis) Tratamiento (II) 1. Morfina: • • • • • • El mejor fármaco. Mejora la eficiencia respiratoria. Usada correctamente no suprime la función respiratoria. Usar la dosis más pequeña que sea efectiva. Un buen comienzo: 3 mg. Si tratamiento previo con opioide: aumentar entre 30-50% dosis para control disnea. Tratamiento (y III) 2. Ansiolíticos: • • Loracepam 0,5-1 mg. V.SL./ V.O. Midazolam 2,5-5 mg. V.SC. Actitudes. 1. Veracidad. 2. Disponibilidad. 3. Confianza. 4. El enfermo como protagonista (preguntar lo que desea). 5. Identificar los miedos. 6. Evitar la sedación como tratamiento. Conclusiones. • • • • Identificar el tipo de disnea. La morfina es el mejor fármaco. Nuestra actitud es la de aliviar al paciente. No realizar pruebas diagnósticas innecesarias. CASO CLÍNICO BF. 72 años. Fumador de 2-3 paquetes/día hasta 1992. HTA en tratamiento con betabloqueantes. Diabetes Mellitus en tratamiento con sulfonilureas. Hipercolesterolemia en tratamiento con estatinas. Hiperuricemia en tratamiento con alopurinol. En octubre de 2000 se le diagnostica de adenocarcinoma pulmonar (S. de Med. Int. Hospital San Agustín), TAC torácico: “masa de unos 7 cm con nódulos pulmonares bilaterales. Hígado normal.”; gasometría arterial: PO2 61, PCO2 41, PH 7.48, HCO3 29. Pasa al S. de Oncología Médica del H. Central donde recibe quimioterapia desde noviembre 2000 hasta septiembre de 2001, interrumpiéndose por “estado general precario”, pasando entonces a fase de cuidados. Desde abril de 2001 sigue con oxigenoterapia domiciliaria por insuf iciencia respiratoria: PO2 57, PCO2 45. En julio de 2001 se le trasfunde por Hg. 9,5 g. Aumento progresivo de su disnea habitual, haciéndose de reposo en septiembre 01, por lo que se decide tratamiento con morfina de liberación normal V.O., sin respuesta. Actitud a seguir: NÁUSEAS Y VÓMITOS Expulsión del contenido gastrointestinal a través de la boca. La náusea es la sensación desagradable que provoca el reflejo antiperistáltico. Prácticamente todos los pacientes con cáncer avanzado van a padecer vómitos y náuseas en algún momento de su evolución. DIAGNÓSTICO Anamnesis: Lo primero es confirmar que realmente vomite (diagnóstico diferencial con regurgitación y expectoración profusa). Características: contenido, volumen, en qué momento. Síntomas asociados. Si lleva más de 4-5 días sin deposición. Fármacos con capacidad emetizante: Nuevos tratamientos o aumento reciente de dosis de morfina. Exploración: General y abdominal. Analítica: Con iones y calcio (es importante descartar hipercalcemia). Valorar RX. CAUSAS Aunque la etiología suele ser multifactorial, el éxito del tratamiento dependerá de si lo dirigimos correctamente a la causa. Causas gástricas: gastritis, ulcus, compresión exógena, carcinoma de estómago, obstrucción al vaciamiento gástrico. Causas químicas: Opioides, quimioterapia, hipercalcemia, insuficiencia renal, infección, toxinas tumorales. Obstrucción intestinal. Estreñimiento. Otras: hipertensión intracraneal, estimulación vestibular, radioterapia, tos, ansiedad. TRATAMIENTO MEDIDAS NO FARMACOLÓGICAS Cantidades pequeñas de comida pero frecuentes, elegidas por el paciente, asegurar aporte de líquidos, evitar olores fuertes. FÁRMACOS Es necesario hacer una profilaxis con fármacos antes de exponer al paciente a una situación potencialmente emetizante. QUE ACTÚAN A NIVEL PERIFÉRICO. Disminuyen el tiempo de tránsito en estómago e intestino acelerando el vaciamiento gástrico y el tránsito por intestino delgado. • Metoclorpamida (Primperan) 10 mg/4-6 horas • Domperidona (Motilium) 10 mg/6 horas. Tiene menos reacciones extrapiramidales. Son efectivos en el retraso del vaciamiento gástrico que provoca la morfina. QUE ACTÚAN A NIVEL CENTRAL • Butirofenonas: Haloperidol (10-15 gotas cada 12-24 horas). Eficaz en los vómitos por morfina. • Fenotiacinas: Clorpromacina (Largactil: 75-100 mg repartidos en 3 tomas, comenzando con dosis mínimas nocturnas). Es una alternativa al haloperidol si existe ansiedad. • Antihistamínicos: Hidroxicina (Atarax) • Benzodiazepinas • Corticoides: Dexametasona. En vómitos por quimioterapia, edema cerebral, compresión de vísceras huecas y tejido nervioso. • Hioscina: Buscapina 0,4-0,8 mg/4 horas vía subcutánea. En obstrucción intestinal. Actúa a nivel central y periférico. • Antiserotoninérgicos. En vómitos por quimioterapia. Uso hospitalario. Resumen para la elección del tratamiento: CAUSAS Opioides Uremia Compresión gástrica Obstrucc intest Estreñimiento HT Intracraneal Vestibular Tos Ansiedad TRATAMIENTO DE ELECCIÓN Haloperidol Haloperidol Corticoides Hioscina Laxantes Corticoides Antihistamínicos Opioides Benzodiazepinas ALTERNATIVA Metoclopramida Antihistamínico Metoclopramida Neurolépticos Corticoides Haloperidol Neuroléptico Haloperidol Clorpromacina ESTREÑIMIENTO Emisión infrecuente de heces (menos de tres veces por semana), de consistencia dura, y que resulta dificultosa para el paciente. Muy frecuente: Afecta al 80-90% de los enfermos terminales. DIAGNÓSTICO Anamnesis: ¿En qué aspectos ha cambiado el hábito intestinal? Frecuencia, consistencia Síntomas asociados: náuseas, vómitos, dolor abdominal, distensión, retención urinaria, inquietud o confusión, hemorroides, anorexia Existencia o no de diarrea (por rebosamiento tras impactación). Ventoseo. Dieta, movilidad, acceso al cuarto de baño, falta de privacidad. EXPLORACIÓN General: Consciencia, halitosis. Abdomen: Dolor. Masas (las heces en colon suelen ser móviles, mientras que las masas tumorales suelen ser duras y fijas). Ruidos intestinales: si existe obstrucción la auscultación muestra ruidos muy aumentados o silencio, Tacto rectal (o del estoma): Imprescindible Ampolla llena o vacía, consistencia de las heces, masas tumorales, hemorroides, fisuras. Valorar exploración neurológica (incluyendo sensibilidad perianal y tono del esfínter) si se sospecha lesión neurológica por compresión medular. Cuando tras la anamnesis y exploración no está claro el diagnóstico, se realizará una radiografía simple de abdomen. Siempre hay que intentar descartar la existencia de obstrucción intestinal. La elección del tratamiento depende de las características de las heces, de la causa del estreñimiento y de las preferencias del paciente. CAUSAS DE ESTREÑIMIENTO Disminución de la ingesta por anorexia : disminuye el volumen de la masa fecal y las heces son más secas por ingerir pocos líquidos. Escasa actividad física. Debilidad: Poca fuerza de los músculos del suelo de la pelvis y abdominales. Alteraciones metabólicas: hipercalcemia, hipopotasemia, deshidratación. Obstrucción mecánica por el tumor. Déficit neurológico por síndrome de compresión medular o de cola de caballo. Enfermedades concurrentes: hemorroides, fisura anal, divertículos, hipotiroidismo, depresión, deterioro cognitivo. Dificultades para acceder al cuarto de baño, falta de privacidad. Fármacos: Opiáceos, anticolinérgicos, hierro, etc. Muchos de los fármacos que debemos emplear para el tratamiento de otros síntomas van a ser la causa del estreñimiento. Siempre debe hacerse una correcta profilaxis del estreñimiento con fármacos cuando se va a prescribir un opioide. Un recto o un colon distendidos pueden ser causa de agitación y dolor. La evacuación con supositorios o enemas pueden solucionarlo, mientras que el uso de opio ides para tratar ese dolor no haría más que empeorar el cuadro. TRATAMIENTO El objetivo del tratamiento es una defecación confortable, más que una frecuencia concreta de la deposición. MEDIDAS GENERALES: Favorecer la ingesta de líquidos y la actividad física, no suelen tolerar el aumento de fibra en la dieta. Responder rápidamente a los deseos de defecar, permitir la intimidad. Modificar en lo posible los tratamientos que puedan producir estreñimiento. FÁRMACOS LAXANTES: A pesar de las medidas generales, la mayoría de los pacientes terminales necesitan el uso de laxantes. Debe conocerse el mecanismo de acción de los distintos laxantes para hacer una elección correcta. TIPOS DE LAXANTES P0R VIA ORAL 1. REGULADORES o formadores de masa. Aumentan el volumen de la masa fecal. Salvado, Psilio (Metamucil), Metilcelulosa. No suelen estar indicados y son mal tolerados por el enfermo terminal. 2. OSMÓTICOS: Favorecen el paso de agua hacia la luz intestinal. Tienen un período de latencia de unos 1-3 días. • Lactulosa (Duphalac: 15-30 cc cada 6-12 horas), Lactitiol (10-20 gr/24 h). Suelen producir flatulencia, sobre todo si se emplean a dosis altas. 3. LUBRICANTES o detergentes. Humidificadores de superficie de las heces. Parafina (Hodernal, Emuliquen). 5 ml 2-3 veces al día. 4. ESTIMULANTES. Aumentan el peristaltismo. Contraindicados si se sospecha obstrucción. Deben utilizarse en la profilaxis del estreñimiento por opiáceos. Periodo de latencia de 6-12 horas.. • Senósidos: Puntual (8-12 gotas cada 8-12 horas), Pursenid, X-prep solución 88-12 gr cada 8-12 h) • Bisacólido: Dulco-laxo (1-2 grageas cada 24 horas) TIPOS DE LAXANTES POR VIA RECTAL Su gran ventaja es el corto período de latencia. Siempre hay que asociar laxantes orales. 1. Laxantes rectales osmóticos: Supositorios de glicerina. Ablandan las heces que están duras en recto. 2. Laxantes rectales lubricantes: Aceite de oliva. Se usan en forma de ene mas para desimpactar las heces. 3. Laxantes rectales salinos: Enema casen. Enemas de fosfato sódico y citrato. Favorecen la liberación de agua y estimulan el peristaltismo rectal y colónico. 4. Laxantes rectales estimulantes. Dulco-laxo supositorios. Polifenólicos. Estimulan la expulsión de heces de colon y recto. DATOS QUE NOS PUEDEN AYUDAR EN LA ELECCIÓN DE LOS LAXANTES ¿Está el recto (o el estoma) lleno? ¿Son las heces duras o blandas? ¿Esté el recto vacío pero el colon lleno? ¿Están tanto el colon como el recto llenos? ¿Tiene el paciente sensibilidad anal? ¿Tiene el paciente tono anal normal? Si existe una lesión medular, ¿a qué nivel? En caso de duda sobre si existe obstrucción intestinal utilizar sólo agentes reblandecedores como la lactulosa. Si las heces son blandas: Asociar un laxante osmótico (lactulosa) con laxantes rectales estimula ntes del peristaltismo (Dulcol-laxo sup). Una alternativa es utilizar estimulantes por vía oral. Si esto no fuera eficaz se puede administra un enema de 250cc de suero salino del cual se retira un poco y se añade solución de lactulosa y 2 Micralax hasta completar el líquido retirado. Si las heces están duras en el recto pueden ablandarse con supositorios de glicerina. A veces es útil combinar supositorios de Dulco-laxo con supusitorio de glicerina. Si las heces son muy duras (fecalomas): Aplicación de un enema de 100 cc de aceite de oliva por la noche durante 2 días seguidos y un enema Casen cada mañana. Si no es eficaz será necesaria la extracción manual. Si la ampolla está vacía: estimulantes por vía oral y dosis altas de laxantes osmóticos. A veces es necesario combinar laxantes orales de todos los tipos. Una posibilidad es: • Duphalac + X-prep + Hodernal G 5-10 cc de cada 8-12 horas Puede aumentarse según necesidades (30cc/8h) Si el paciente tolera mal los jarabes: Pursenid (1 gragea/12h a 2 grageas/8h) + Dulco-laxo sup/noche. Si con el uso de 3 laxantes asociados no se consigue una deposición cada 48-72 horas sin esfuerzo: Pautar enemas cada 3 días. OBSTRUCCIÓN INTESTINAL Inmovilización completa y persistente del contenido sólido, líquido y gaseoso en un segmento del intestino. Relativamente frecuente en enfermos terminales, especialmente en tumores intestinales. Muchos pacientes con enfermedad avanzada o mal estado general no pueden someterse a cirugía y necesitan tratamiento paliativo de los síntomas. CAUSAS • Causas mecánicas: Compresión extrínseca: por el tumor primario, por metástasis, adherencias malignas o postquirúrgicas o por fibrosis postradioterapia. Obstrucción intraluminal por el tumor. • Causas funcionales que alteran la motilidad intestinal: fármacos opiáceos, antiperistálticos, antihistamínicos, corticoides; causas metabólicas (hipercalcemia) DIAGNÓSTICO Anamnesis sobre alteración del hábito intestinal, estreñimiento, puede existir diarrea en la obstrucción parcial; nauseas y vómitos, que producen una mejoría temporal, son más intensos y precoces en la obstrucción alta; distensión abdominal, que puede provocar disnea, dolor tipo cólico por las contracciones que intentan mantener el tránsito; dolor continuo; detención del tránsito intestinal, ausencia de eliminación de heces y gas; signos de deshidratación. Los síntomas pueden ser intermitentes por resolución espontánea incluso sin tratamiento, y tardar incluso semanas en instaurarse. Exploración: Distensión abdominal, percusión timpánica, ruidos intestinales hidroaéreos. Una obstrucción alta puede no dar hiperperistalsis. Signos de deshidratación. Tacto rectal. Analítica: gasometría para descartar desequilibrio ácido-base, iones, Pruebas de función renal. RX abdominal en bipedestación: dilatación de asas y niveles hidroaéreos. Al principio de la clínica sirven para diferenciar el estreñimiento de la obstrucción maligna. En los casos en que se pueda pla ntear cirugía, indican el nivel de la obstrucción. TRATAMIENTO El único tratamiento curativo es el quirúrgico. En la mayoría de los pacientes no se puede realizar. Si existe la posibilidad quirúrgica, se coloca una sonda nasogástrica, conectada a una bolsa para el vaciamiento gástrico por gravedad, dieta absoluta y reposición hidroelectrolítica para estabilizar al paciente hasta que sea intervenido. Tratamiento paliativo: Se empleará la vía rectal o parenteral (subcutánea) Para el dolor abdominal continuo: Morfina, ajustando dosis. Para el dolor cólico: Suspender laxantes estimulantes y administrar Hioscina 60-120 mg/día. Para los vómitos: Haloperidol (5-15 mg/dia) o metoclopromida (40-240 mg/día) o dexametasona (860 mg/día) Se considera un control correcto si existe 1 vómito al día, ausencia de náuseas, y dolor tolerable. Es necesaria una higiene escrupulosa de la boca. Muchos pacientes pueden seguir comiendo y bebiendo en pequeñas cantidades a pesar de la obstrucción. CASO PRACTICO Manuel, 68 años. Vive en Gijón con su esposa, una hija de 30 años y su suegra (que tiene demencia senil) AP: Hematoma subdural postraumático operado Autotrasplante de médula ósea por Leucemia en 1996 en remisión completa. Hernia inguinal izquierda reducible No alergias conocidas ni hábitos tóxicos Historia oncológica: En Mayo 2000 se le practicó una colostomía con anastomosis terminoterminal por Adenocarcinoma de Ciego T3N0M0. En Junio 2001 comenzó con dolor a nivel de fosa renal derecha irradiado a fosa iliaca, progresivo y severo, sin aparente síndrome general y que producía aumento de las molestias a nivel de la hernia inguinal. A la exploración presentaba un buen estado general, abdomen distendido con peristaltismo conservado y una masa dolorosa a la palpación entre mesogastrio y fosa iliaca derecha, no defensa ni peritonismo. Se le practicó un TAC abdominal donde se vio una Masa ileocecal más engrosamiento de pared de asas de intestino delgado y un hígado sin evidencia de metástasis. Se decidió intervención quirúrgica pero, en el curso de la laparotomía, se objetivó Carcinomatosis peritoneal por lo que se decidió tratamiento paliativo Con esta situación: 1. ¿En que creéis que desembocó este cuadro? 2. ¿Cuales serían sus síntomas principales? 3. ¿Que medicación pondríais para controlarlo y por que vía? 4. ¿Os parece que se puede atender en el domicilio si es el deseo del paciente y la familia? CAQUEXIA Es un síndrome complejo que combina pérdida de peso, lipólisis, pérdida de proteínas musculares y viscerales, anorexia, nausea crónica y debilidad. CONSECUENCIAS DE LA CAQUEXIA El síndrome de la caquexia produce, per se, disminución de la supervivencia , aumento de las complicaciones de cirugía, radioterapia y quimioterapia, anorexia, nausea crónica y debilidad y en la gran mayoría de los casos sufrimiento psicológico en el paciente y en la familia. Cuando tenemos un paciente en el que sospechamos caquexia, nos podemos acercar a él haciéndonos cuatro preguntas: • ¿Tiene caquexia? • ¿Porqué tiene caquexia? • ¿Qué tratamientos son efectivos? • ¿Cómo podemos individualizar el tratamiento? ¿TIENE CAQUEXIA? Más del 80% de pacientes con Cáncer desarrollan caquexia antes de la muerte. Aproximadamente en el momento del diagnóstico el 80% de los canceres gastrointestinales superiores y el 60% de los de pulmón tienen una pérdida de peso sustancial. En general, los pacientes con tumores sólidos (excepto el de mama) tienen una frecuencia más elevada. También es más común en los niños, pacientes mayores y va aumentando según progresa la enfermedad. EVALUACIÓN DEL ESTADO NUTRICIONAL Debido a la naturaleza crónica de la caquexia en el cáncer, el diagnóstico es simple. Suele ser suficiente con la historia clínica, la presencia de pérdida de peso sustancial, el examen físico y las pruebas de laboratorio sencillas como la albúmina en plasma. Las investigaciones de laboratorio más sofisticadas son normalmente innecesarias. 1. Pérdida de peso: la determinación de los cambios que ha experimentado el peso del individuo en los últimos seis meses no solo aporta una valiosa información sobre el estado nutricional, sino que también nos orienta sobre el pronóstico de la neoplasia Antes de aplicarla ha de excluirse la existencia de edemas, ascitis y deshidratación. i. Malnutrición leve: pérdida menor del 5% ii. Malnutrición moderada. Entre el 5 –10% iii. Malnutrición grave: pérdidas mayores del 10% 2. Ingesta de alimentos : posibles cambios en la ingesta alimentaria y si pueden atribuirlos a algún factor desencadenante y que ocurre si intentan comer más. 3. Pérdida de grasa corporal: el examen físico de algunas regiones del cuerpo puede orientar sobre la pérdida de tejido graso subcutáneo (la región del tríceps, la región costal a nivel de la línea axilar media, la región deltoidea) 4. Reserva proteica muscular: valoraremos el cuádriceps y el deltoides. En casos de desnutrición desaparece la redondez de los hombros, que adoptan una forma cuadrada, y el cuádriceps pierde tono y masa muscular. 5. Reserva proteica visceral: diversas proteínas sintetizadas por el hígado reflejan el estado de la misma, en nuestro caso la mejor es la albúmina plasmática, ya que al ser de vida media 20 días, es un buen marcador para desnutriciones prolongadas i. Malnutrición leve: entre 2,8-3,4 g/dl ii. Malnutrición moderada: entre 2,1-2,7 g/dl iii. Malnutrición grave: menos de 2,1 g/dl ¿POR QUÉ TIENE CAQUEXIA? Las alteraciones metabólicas son la causa principal de la caquexia contribuyendo al síndrome la ingesta calórica disminuida y la malabsorción. 1. Anorexia. La anorexia es un componente casi universal de la caquexia, siendo la causa fundamental en una minoría de casos, y consecuencia de la caquexia en la mayoría de ellos. La reducción de la ingesta puede ser más severa en casos de disfagia por tumores de cabeza y cuello, esófago, enfermos deprimidos, alteraciones del gusto o nausea crónica. Esta última es un síntoma común en enfermedades malignas y puede ser debida a alteraciones vegetativas, opioides u otras drogas, estreñimiento y obstrucción intestinal. 2. Alteraciones metabólicas. Los últimos estudios sugie ren que la caquexia del cáncer es principalmente debida a alteraciones metabólicas que son causadas sobre todo por citoquinas producidas por el sistema inmune del paciente como respuesta a la presencia del tumor (factor de necrosis tumoral o caquectina, interleukina 1 y 6. También se han identificado factores del propio tumor (hormonas lipolíticas) que causan profunda lipólisis, balance nitrogenado negativo y anorexia. Esto explica el fracaso de la nutrición agresiva para cambiar el curso clínico, los síntomas y el estado nutritivo del paciente. 3. Malabsorción. Es una causa rara de caquexia. Debe sospecharse en pacientes con insuficiencia pancreática debida a cusas gastrointestinales y pancreáticas o en pacientes que han recibido recientemente radioterapia agresiva en abdomen. ¿QUE TRATAMIENTOS SON EFICACES? A pesar de los avances en el conocimiento de la fisiopatología de la caquexia y el interés creciente por el tema, las novedades terapéuticas confirmadas son escasas OPCIONES TERAPEUTICAS 1. Soporte nutricional 2. Soporte farmacológico: Corticosteroides Procinéticos Progestágenos 3. Tratamiento específico 4. Otras drogas en estudio: Ciproheptadina Cannabinoides Agentes anabolizantes Inhibidores de citoquinas SOPORTE NUTRICIONAL 1. NUTRICION ORAL: es el tratamiento más adecuado para los enfermos que están bajo cuidados paliativos. Los consejos dietéticos son capaces de aumentar la ingesta calórica diaria en 450 cal. Para ello hay que contar con la colaboración del paciente y la familia por lo que es importante dedicar tiempo para informar de forma adecuada: evitarse preguntas del tipo ¿por qué no come?,que las comidas se desarrollen en una atmósfera relajada, realizar comidas pequeñas pero frecuentes (5 ó 6 al día), alimentos templados o fríos, suele preferirse el sabor dulce y los alimentos proteicos de consistencia bla nda ( leche y derivados, huevos y puré), estimular la ingesta de tentempiés entre las comidas y si se consideran los suplementos alimenticios que los tomen entre las comidas principales y no como sustitutos; permitirle caprichos y recomendar pequeñas cantidades de alcohol que suelen hacer más agradables las comidas. En aquellos casos en los que la enfermedad progresa, la ingesta oral puede reducirse al mínimo: atender a la higiene oral, utilizar bebidas frías o incluso heladas, tranquilizar a la familia explicándole que las necesidades calóricas del enfermo son muy reducidas y que por ello no está justificada la sueroterapia, en casos que la deshidratación produjera síntomas se podría valorar la hipodermoclisis. 2. NUTRICION PARENTERAL: no ha demostrado benefic ios con respecto a la enteral en pacientes con intestino funcionante y, salvo en casos raros de pérdida de peso reversible no tiene sentido en medicina paliativa. 3. NUTRICION ENTERAL: Mediante sonda nasogástrica o gastrostomía mantiene la funcionalidad y el trofismo intestinales. Puede manejarse sin dificultad en domicilio. Se utiliza fundamentalmente en cáncer de cabeza y cuello o esofágico con disfagia severa pero con conservación del apetito y del estado general, me jorando el estado nutricional (cuando la pérdida de peso es secundaria a la incapacidad para la ingesta oral), el grado de confort y la imagen corporal del paciente. SOPORTE FARMACOLÓGICO Tiene por objeto el alivio sintomático de la anorexia y las nauseas. La astenia también es otro objetivo terapéutico, pero hoy por hoy, está en discusión si es posible su manejo con los fármacos actuales. 1. PROCINÉTICOS: para el alivio de las nauseas y la saciedad precoz muchas veces es suficiente con la administración de Metroclopramida a dosis de 10-20mg 30 minutos antes de las comidas. Podrían ser alternativas adecuadas Domperidona o Cisaprida 2. CORTICOIDES: son fármacos con múltiples indicaciones en medicina paliativa. Su mecanismo de acción no es bien conocido: por un lado el efecto euforizante podría mejorar la astenia y otros síntomas subjetivos, por otro su acción antiemética, y analgésico-antiinflamatoria podría contribuir a mejorar la anorexia; por último los corticoides también producen inhibición de citoquinas (IL-1 y FNT). Sus Efectos Secundarios no son despreciables: debilidad y pérdida muscular, edemas, inmunosupresión, diabetes, osteoporosis, cambios en el estado mental, ulcus... Cuando los pongamos debemos dar de plazo una semana para valorar la respuesta. Se prefieren dosis únicas matutinas o en desayuno y comida para evitar el efecto estimulante por la noche. Dentro de los corticoides los más estudiados en medicina paliativa son dexametasona, metilprednisolona y prednisolona. • Dexametasona: mejora el apetito y la debilidad tras dos semanas de tratamiento; no ha mostrado efectos en peso, estado general o supervivencia. La dosis oscila entre 4 mg tras la comida, hasta 8mg por toma en dos tomas. La respuesta no es dosis dependiente. • Metilprednisolona: el apetito mejora de forma significativa así como la ingesta, pero desaparece el beneficio en 4-5 semanas. Algunos autores hacen referencia a mejoría de la calidad de vida y sensación de bienestar. La dosis es de 16mg por toma en dos tomas. • Prednisolona: aumenta significativamente el apetito y bienestar, con tendencia a aumentar la ingesta pero sin efecto sobre el peso. Todos los estudios han demostrado: efecto limitado en apetito, ingesta y sensación de bienestar, pero con una duración del efecto de cuatro semanas. Ninguno ha demostrado ganancia de peso o mejoría de otros parámetros. Estarían indicados en pacientes terminales encamados, con corta expectativa de vida, en los que el aspecto euforizante o de mejoría subjetiva tenga mayor peso que la pérdida muscular. 3. PROGESTAGENOS: Acetato de Megestrol y Acetato de Medroxiprogesterona. Son dos derivados sintéticos de la progesterona usados inicialmente en el tratamiento de tumores hormonosensibles, donde se comprobó que aumentaban el apetito y el peso. • Acetato de Megestrol (Borea®, Megefren®, Maygace®) su mecanismo de acción se relaciona con una verdadera estimulación del apetito y efecto anabólico, que sugiere que puede actuar en parte modulando la respuesta de citoquinas y neuropéptidos. Existen numerosos estudios rabdomizados y doble ciego que demuestran el efecto orexígeno y el beneficio ponderal en enfermos oncológicos con caquexia tumoral. Los escasos efectos secundarios que producen no suelen obligar a su retirada: retención hídrica, flush, sangrado vaginal, impotencia y trombosis venosa profunda. Está contraindicado en pacientes con enfermedad tromboembólica, cardiopatía y otras situaciones con riesgo de retención hídrica severa. Todos los estudios han demostrado una mejoría significativa del apetito y de la ingesta que ya aparecen a la primera semana de tratamiento. Existe gran controversia en cuanto a la dosis adecuada: con 160mg al día ya se obtiene un considerable estímulo del apetito, por lo que se puede empezar con esta dosis y aumentar hasta 800mg al día si se tolera. En cuanto al peso u otros parámetros antropométricos se han observado resultados positivos con dosis de 240mg al día o superiores.Con dosis de 160 mg/día se mantienen el peso y parámetros nutricionales. Existe un estudio rabdomizado en que se ha asociado acetato de megestrol con ibuprofeno mejorando el efecto obtenido por megestrol solo sobre la ganancia de peso a partir de la 4º semana de tratamiento y una mejoría en la calidad de vida a partir de la 8ª (los AINES disminuyen la respuesta inflamatoria por lo que podrían ser de utilidad en la modulación de los niveles de citoquinas) • Acetato de Medroxiprogesterona (Progevera®): disponible para administración oral y en forma i.m. depot, provoca aumento del apetito y de la ingesta calórica y en grupo importante de pacientes aumento de peso a expensas de la masa grasa. Hay pocos estudios y se usa menos que megestrol o corticoides. 4. CANNABINOIDES: Dronabinol. Los estudios controlados en caquexia tumoral son pocos. Datos aislados sugieren que podría obtenerse mejoría sintomática de ánimo y apetito, siendo especialmente útiles cuando existen nauseas y en pacientes jóvenes. Una de las mayores limitaciones son los efectos adversos: somnolencia, confusión, alteraciones perceptivas que son más severas en pacientes en situación terminal con estado cognitivo bordeline. 5. CIPROHEPTADINA: antihistamínico inhibidor de la serotonina que en enfermos con cáncer tiene pequeño efecto sobre el apetito, pero no influye en conservar el peso y además tiene efectos secundarios que limitan su utilización (sedación, vértigo, sequedad de boca...) 6. AGENTES ANABOLIZANTES Y HORMONA DEL CRECIMIENTO: provocan aumento del peso cuando la ingesta energético-calórica es adecuada, y aumentan la masa magra cuando se realiza ejercicio físico, pero la necesidad de estos factores hace que no tengan aplicación a pacientes con caquexia tumoral. 7. INHIBIDORES DE LAS CITOQUINAS. Talidomida : Sus usos potenciales en Medicina Paliativa se centran en el Síndrome anorexia -caquexia, nauseas crónicas, insomnio, fiebre de origen tumoral, sudoración profusa y dolor. La mayoría de los estudios controlados se han realizado sobre pacientes con SIDA. En los estudios realizados como tratamiento de Caquexia no se describen efectos secundarios significativos y parece que es bien tolerada en pacientes muy enfermos. Dentro de este mismo grupo también está en estudio la melatonina. ¿COMO PODEMOS INDIVIDUALIZAR EL TRATAMIENTO? * Los aspectos psicológicos de la caquexia pueden ser los más importantes para el paciente y sus cuidadores, siendo en estos casos imprescindible una intervención en este sentido. * Pacientes incapaces de tragar debido a disfagia severa (cáncer de cabeza y cuello, esófago y alteraciones neurológicas) y que manifiestan hambre o preocupación expresa por la desnutrición : Nutrición enteral. * Pacientes con nausea crónica o saciedad temprana: Procinéticos * Cuando la anorexia intensa es la manifestación esencial de la caquexia y la esperanza de vida es de semanas o meses: Acetato de Megestrol * Pacientes con menor expectativa de vida y/o con síntomas complejos múltiples se beneficiaran más de los efectos sintomáticos múltiples de una pauta corta de esteroides * Cuando la anorexia es un síntoma menor y en enfermos con severo deterioro cognitivo puede no requerirse ningún tratamiento farmacológico SÍNDROME CONFUSIONAL AGUDO INTRODUCCIÓN Los Trastornos Mentales Orgánicos son muy frecuentes en pacientes con Cáncer. Tienen una prevalencia del 30-35% y en fase final de la enfermedad esta llega al 85 %. Estos Trastornos Mentales tiene una causa conocida o sospechada. Puede ser primaria como en las lesiones cerebrales o secundaria como en las alteraciones sistémicas que afectan al cerebro. Los rasgos esenciales se pueden dividir en dos grupos: Síndromes en los que destaca la alteración de las funciones cognitivas: - Memoria - Capacidad de juicio - Razonamiento abstracto - Alteraciones de la conciencia o atención. Síndromes en los que destaca la alteración de la percepción y el pensamiento: - Alucinaciones - Ideas delirantes - Humor y emocio nes - Rasgos de la personalidad - Alteraciones del comportamiento. En muchas ocasiones estas alteraciones se atribuyen al impacto emocional de la enfermedad del paciente y se pasa por alto el diagnóstico. No son infrecuentes los cuadros mixtos. DEFINICIÓN TERMINOLOGÍA Y CRITERIOS DIAGNÓSTICOS Delirium es sinónimo de estado confusional (Lipowski). Es una disfunción cerebral global que carece de etiología específica y está caracterizada por la presencia simultánea de trastornos a nivel de conciencia, atención, pe nsamiento, percepción, memoria, psicomotricidad, emociones y ciclo sueño vigilia. La intensidad de los síntomas mencionados, así cómo el inicio abrupto, agudo o subagudo son característicos del delirio y puede ser transitorio y reversible. CRITERIOS DIAGNÓSTICOS DEL DELIRIUM EN LA DSM -IV: Alteración de la conciencia con disminución de la capacidad para centrar, mantener o dirigir la atención. Cambio en las funciones cognitivas (déficits de memoria, desorientación, alteración del lenguaje) o presencia de una alteración perceptiva que no se explique por la existencia de una demencia previa o en desarrollo. La alteración se presenta en un corto periodo de tiempo (horas o días) y tiende a fluctuar a lo largo del día. Demostración a través de la historia, de la exploración física y de las pruebas de laboratorio que la alteración es un efecto fisiológico directo de una enfermedad médica o del consumo de medicamentos. CRITERIOS DIAGNÓSTICOS CIE-10: Criterios más sólidos y consensuados. 1. Alteración de la conciencia y atención, oscilando entre la obnubilación y el coma. 2. Trastorno cognitivo global con: • Alteración de la percepción, que se manifiesta por la presencia de alucinaciones visuales, ideas delirantes. • Alteración del pensamiento que se manifiesta por la presencia de desorientación temporoespacial. • Alteración de la memoria que se manifiesta fundamentalmente a través del deterioro de la memoria reciente. 3. Alteraciones de la psicomotricidad: oscilando desde la hiperactividad hasta la hipoactividad. 4. Alteraciones emocio nales: se puede manifestar por la presencia de depresión, ansiedad, miedo, euforia. 5. Alteraciones del ciclo sueño-vigilia: puede oscilar desde el insomnio a la somnolencia o manifestarse exclusivamente por la presencia de pesadillas. El delirium es a menudo reversible, a diferencia de la demencia, aún en personas con edad avanzada. Sin embargo, es posible que se presente en las últimas 24-48 horas de vida (agotamiento terminal o agitación terminal), debido a la influencia de procesos irreversibles como el fracaso multiorgánico. CLÍNICA El inicio agudo de la situación o conducta no cooperadora, cambio de personalidad, función cognitiva deteriorada, lapso alterado de la atención o nivel de conciencia fluctuante, o ansiedad o depresión no características intensas en cualquier paciente médicamente enfermo se debe considerar el diagnóstico de síndrome confusional. Los síntomas tempranos de delirium son a menudo erróneamente diagnosticados como ansiedad, ira, depresión o psicosis. Otra situación clínica relativamente frecuente es el falso dolor in crescendo en el contexto de un síndrome confusional, producido por una alterada percepción del dolor o falsa interpretación de la agitación por parte de la familia o el cuidador, a lo cual se responde con un aumento de la dosis de opioides, con el consiguiente empeoramiento del cuadro. ETIOLOGÍA DE LA CONFUSIÓN EN EL ENFERMO TERMINAL No se debe olvidar que un dolor sin controlar, es causa suficiente para originar un síndrome confusional agudo. Y como dice Lipowsky, la deprivación sensorial o el stress emocional, son agentes facilitadores del delirio. Son múltiples las causas de este síndrome y a veces son concomitantes. En ocasiones la causa no puede ser determinada. CAUSAS DE SÍNDROME CONFUSIONAL AGUDO: • • Enfermedad Intracraneal: - Tumor Primario - Metastásico Enfermedades Sistémicas con afectación Cerebral: - Desequilibrio Hidroeléctrico - Fracaso Orgánico - Anoxia Cerebral (Anemia, Insuficiencia Cardiaca) - Infecciones • • - Complicaciones Vasculares - Alteraciones Bioquímicas (hipercalcemias, hiponatremia, hipo-hiperglucemia) Síndrome de Abstinencia Fármacos Anticolinérgicos - Diuréticos, Digoxina - Cimetidina, ranitidina, famotidina - Anticonvulsivantes - Antihipertensivos (propanolol) - AINES - Esteroides - Citostáticos - Aciclovir - Opioides (sobredosificación, toxicidad) - Benzodiazepinas Factores de riesgo para la aparición de delirium en pacientes hospitalizados: - Edad avanzada - Deterioro cognitivo previo - Enfermedad crónica severa - Deterioro funcional En casi 2/3 de los casos, las causas principales son tóxico-metabólicas. DIAGNOSTICO DIFERENCIAL DEMENCIA puede ser difícil distinguirlos ya que comparten características clínicas como desorientación, alteración de la memoria, del juicio y del pensamiento. La demencia, sin embargo se presenta en individuos relativamente en alerta, sin disminución del nivel de conciencia, que siempre ha de estar presente en el síndrome confusional. La demencia, es también, de inicio menos agudo, generalmente crónico, progresivo y el ciclo sueño vigilia parece menos deteriorado. Lo más característico de la demencia son el deterioro de la memoria a corto y largo plazo, deterioro también del juicio y de pensamiento abstracto y la alteración de las funciones corticales superiores (afasia, apraxia y agnosia). Con frecuencia el síndrome confusional agudo, se superpone a una demencia subyacente. PSICOSIS REACTIVA BREVE: Caracterizadas más por alucinaciones no inducidas y sobre todo auditivas. Así como, en este caso la inexistencia de causa tóxico metabólica que justifique el cuadro, la edad (más típica en adultos jóvenes). PSEUDODEMENCIA DEPRESIVA: con rasgos psicóticos. Los antecedentes el tratamiento como diagnóstico adyuvantivus y las alteraciones previas del humor son la clave. MANÍA: En ocasiones producidas por los esteroides. Estos fármacos, pueden producir trastornos que van desde una debilidad menor del animo hasta l manía grave, depresión, fallo cognitivo y delirium. ALUCINOSIS ORGÁNICA No hay alteración del estado cognitivo, ni del nivel de conciencia. Aparecen alucinaciones visuales, ocasionalmente táctiles y raramente auditivas. El paciente tie ne miedo a estar enloqueciendo o a ser considerado un paciente psiquiátrico, por lo que no lo manifiesta espontáneamente, precisando anamnesis dirigida. Son frecuentes las reacciones de hostilidad y depresión, como los cambios del estado de ánimo. Con frecuencia tienen un origen tóxico (metabolitos opioides) aunque cualquier otra causa señalada como etiología para el delirium puede originar una alucinosis orgánica. MANEJO DEL DELIRIUM DE LA CONDUCTA El delirium puede causar mucha alarma en la familia y ser causa de agotamiento familiar y hospitalización. Cuando el delirium cursa con un cuadro de agitación ha de ser considerado como una situación de urgencia, lo primero es tratar estos síntomas y en el curso del tratamiento sintomático reconocer la existencia o no de factores desencadenantes y actuar sobre ellos. Cuando una persona con enfermedad terminal, desarrolla un cuadro de delirio, debe ser estudiada a fondo ya que la aparición de este síndrome puede indicar un cambio evolutivo de la enfermedad (por compromiso del SNC). Las medidas técnicas de apoyo (no farmacológicas) como un cuarto tranquilo, un reloj, iluminación de la habitación, por si solas, se han comprobado que en el síndrome confusional no son efectivas y siempre es necesario el tratamiento farmacológico sintomático con neurolépticos o sedantes. MANEJO FARMACOLÓGICO El 60% de los pacientes que reciben tratamiento farmacológico mejoran, por lo que el diagnóstico precoz es fundamental. Como ya se ha dicho anteriormente, hay que considerar dos aspectos, el tratamiento sintomático y el etiológico, cuando las causas son reversibles. Siempre hay que reconsiderar la pauta analgésica y en su caso evaluar la posibilidad de hacer rotación de opioides. I. Rotación de Opioides La acumulación de metabolitos activos tóxicos de los opioides puede explicar la toxicidad de estos, aunque otra causa pueda ser debida a alteraciones de receptores que condiciona la toxicidad en el uso de estos fármacos durante largos periodos de tiempo. La monitorización de rutina del estado cognitivo de estos pacientes, así como el uso de otros opioides a dosis equianalgésica puede reducir la incidencia de la agitación en el paciente terminal y en cuidados paliativos. II. Neurolépticos El Haloperidol es un antipsicótico, bloqueador potente de la dopamina. Es el fármaco de elección para el tratamiento del delirium en pacientes con cáncer por la baja incidencia de efectos cardiovasculareas y anticolinérgicos. La vía de administración de elección en estados confusionales agudos sería la subcutánea o IM. Dosis habituales utilizadas en el síndrome confusional agudo entre 0’5-1 mg subcutáneos cada 2040’ si es preciso para el control de síntomas (otros 1 mg/h) Alcanzando concentraciones mensurables en plasma a los 15-30’ de su administración. La vía intravenosa, puede ser usada, pero hay que pensar que es difícil en pacientes agitados. La vía oral alcanza su nivel máximo en plasma a las 2-4 horas y aún más tarde en pacientes ancianos y /o con daño cerebral, por lo que no debe utilizarse en el control de síntomas agudos. No obstante cuando el control de síntomas lo permita pasaremos a la administración oral, teniendo en cuenta que las dosis parenterales son dos veces más potentes que las dosis orales. Efectos Secundarios del haloperidol: Extrapiramidales: - Acatisia - Dificultad de movilidad - Rigidez - Distonía - Aquinesias Son tratables con difenhidramina y/o trihexifenidilo, de los que hay que tener en cuenta que son potentes anticolinérgicos y que por si mismo pueden empeorar el delirium. Una complicación rara pero a veces fatal de los neurolépticos es la aparición del Síndrome Neuroléptico Maligno , caracterizado por hipertermia, mayor confusión mental, rigidez muscular, leucocitosis, mioglobinuria y CPK sérica elevada. Su tratamiento consiste en suspender todos los neurolépticos que está tomando el paciente (incluyendo los recetados para las nauseas y vómitos como la clorpromacina –Largactil- y Metoclopramida –Primperan-) y proveer medidas de apoyo y a veces administrando dantrolene sódico (0’8 a 1 mg/kg/ día o mensilato de bromocriptina 2’5-10 mg 3 veces al día ). Este síndrome generalmente ocurre después de la administración prolongada de dosis elevadas de neurolépticos, pero también puede ocurrir al iniciar el tratamiento. Otros neurolépticos que también pueden ser útiles en el manejo del delirium, especialmente si se necesita la sedación en personas agitadas, son: • Tioridacina (Meleril) entre 10 y 25 mg tres veces al día, que se puede aumentar hasta un total de 50-100 mg tres veces al día. Solo está disponible en forma oral. • Clorpromacina (Largactil) está disponible tanto para uso oral como parenteral y la dosis es similar a la tioridazina. La principal complicación que estos neurolépticos de potencia baja pueden producir, es la hipotensión ortostática. Se han añadido a esta lista los neurolépticos atípicos , cuyos efectos secundarios extrapiramidales y cardiovasculares (alteración del ECG) son significativamente menores. Estos son la risperidona (Risperdal) y la olanzapina (Zyprexa), solo están disponibles en forma oral y esta última tiene como efecto secundario una ganancia de peso significativa. Cuando la sintomatología no es controlada con dosis estándar de haloperidol, su uso, se asocia a benzodiacepinas. Con el uso de estas la sedación es más eficaz y el requerimiento de dosis de haloperidol es menor, por tanto se disminuye la probabilidad de desarrollo de reacciones extrapiramidales. BENZODIACEPINAS El lorazepam a dosis entre medio y dos mg (uno cada doce horas) en vía oral. En otros países se usa en IM dado que es de las pocas BZD cuya absorción es buena por vía IM. Midazolam por vía subcutánea en ampollas de 5 y 15 mg. CASO PRÁCTICO Jesús, 48 años AP: Bebedor importante hasta hace 2 años. Ingresa en Febrero- 00 en Medicina Interna para estudio, remitido por su médico de cabecera por presentar lesión lítica en sacro. Cuadro de un mes de evolución de dolor en glúteo derecho y síndrome general de dos meses. Diagnosticado de adenocarcinoma metastático por PAAF ósea, con probable primario hepático. Vive con su mujer que es la cuidadora principal y dos hijos. Ingresa en la Unidad, tras el alta hospitalaria el 17 de Febrero, para Cuidados Paliativos presentando: 1. Dolor óseo y neuropático en zona sacra y MII 2. Astenia. 3. Anorexia. 4. Insomnio 5. Estreñimiento. Se instaura tratamiento con MST 20 mg/12h., dexametasona, omeprazol, senósidos y loracepam. Presenta un control aceptable hasta que el 2 de marzo comienza con vómitos, se pautó metoclopramida pues se pusieron en relación con aplastamiento gástrico. Cuatro días después inició cuadro de delirium por lo que redujo la dosis de MST. A las 24 horas se valoró de nuevo: los vómitos continuaban y el deterioro cognitivo era mayor. Causas probables del cuadro de delirium. Elaborar el listado de problemas y plan de cuidados. SÍNDROME DE COMPRESIÓN MEDULAR Es una urgencia en Medicina Paliativa. Un correcto y rápido diagnóstico y tratamiento evitarán la parálisis irreversible que causaría un importante deterioro en la calidad de vida, además de acortarla. En el 85% de los casos está causado por metástasis óseas. En el 70% de los casos es la columna dorsal la afectada. El síntoma que primero aparece es dolor que puede presentarse incluso semanas antes del déficit neurológico, en principio será localizado y posteriormente irradiado según el nivel afectado. Característicamente el dolor aumenta con la tos, el decúbito y las maniobras de Valsalva, y mejora con la sedestación. Posteriormente y de forma progresiva aparecerá el déficit neurológico con debilidad muscular, hipoestesia e hiporeflexia por debajo del nivel de la lesión. Al cuadro anterior se añaden trastornos en los esfínteres con retención urinaria y estreñimiento severo. La instauración del cuadro completo puede acontecer en días o semanas, y la posibilidad de respuesta al tratamiento disminuye conforme avanza el deterioro neurológico. Con el tratamiento pretendemos controlar el dolor además de mantener la función neurológica. Ante la sospecha clínica la prueba diagnóstica fundamental es la RNM. El tratamiento fundamental es la radioterapia , en ocasiones la cirugía tiene un papel importante. Ante la sospecha y mientras se confirma el diagnóstico y se inicia el tratamiento, lo más adecuado es instaurar una pauta de esteroides a dosis altas, mantener la columna lo más estabilizada posible y procurar la analgesia necesaria al paciente. ABORDAJE Y TRATAMIENTO DE LA AGONÍA DEFINICIÓN Agonía es el estado que precede a la muerte, en aquellas situaciones en que la vida se extingue gradualmente. INTRODUCIÓN En nuestro entorno socio-cultural se rechaza la muerte, hasta casi negarla; a pesar de ser lo único seguro que tenemos al nacer. Durante muchos siglos, y actualmente en algunas culturas, se consideraba a la muerte como un hecho importante en la vida de las personas, para el que había que estar preparado; la mejor forma de morir, era aquella que permitía vivir ese momento de forma consciente, acompañado de los seres queridos, despidiéndose de ellos. En la segunda mitad del siglo XX, el aumento en la esperanza de vida, derivado de la mejora en la calidad de vida y el progreso de la medicina, hace concebir esperanzas de inmortalidad; por otro lado, la sociedad actual prima valores de felicidad, belleza, poder, éxito. Esto lleva a considerar la muerte como un fracaso, algo ajeno a la evolución natural de la vida; la mejor forma de morir es aquella que acontece de forma inconsciente y rápida. Aunque sea obvio, con frecuencia nos olvidamos de que la muerte es inevitable, además de necesaria para que la vida continúe. Su negación, y el temor que nos produce, no hace más que dificultar la ayuda que podemos prestar a las personas en esta situación. Podemos luchar contra la enfermedad y terminar con determinadas patologías, pero surgirán otras. Por mucho que nos empeñemos en lo contrario, siempre habrá enfermos que fallezcan y necesiten nuestros cuidados. Para acompañar y ayudar a los pacientes y sus familias, en el momento de la muerte, los profesionales sanitarios tenemos una serie de dificultades: Por un lado, estamos formados para curar y, aceptar que no podemos hacerlo, produce sensación de fracaso profesional; además, al acompañar a alguien en el proceso de morir, nos enfrentamos a nuestra propia muerte que nos resulta difícil de asumir; por último, carecemos de la formación necesaria para el cuidado de estos pacientes, lo que hace que no sepamos qué hacer para aliviar su sufrimiento. Sólo disponiendo de los conocimientos necesarios y del imprescindible interés, podremos ayudar a estos enfermos y a sus familiares. Cuando lo hacemos bien, aunque parezca mentira, es una de las actividades que en medicina produce más satisfacción. NECESIDADES Los pacientes en esta situación necesitan tener sus síntomas controlados, mantener una serie de cuidados de confort: higiene, boca, etc., un ambiente tranquilo, y la compañía de sus seres queridos. Aunque el enfermo esté muy deteriorado, incluso con bajo nivel de conciencia, necesita que le expliquemos siempre lo que le vamos a hacer, que le preguntemos cómo se siente, qué le preocupa, y en qué le podemos ayudar; en definitiva que continuemos tratándole como una persona con autonomía y dignidad. También es importante facilitar la comunicación con sus familiares, recordemos que el oído y el tacto son los últimos sentidos que se pierden y, aunque el enfermo no pueda hablar, salvo que el nivel de conciencia ya sea muy bajo, puede oír y sentir. En muchas ocasiones la familia es la primera vez que se enfrenta a una situación así y la incertidumbre sobre lo que va a pasar incrementa el grado de angustia, es importante que sepan que cuentan con ayuda sanitaria las 24 horas del día, todos los días, que les informemos de lo que puede suceder y cómo deben actuar. OBJETIVO El objetivo que perseguimos es conseguir el máximo grado de confort y bienestar para el enfermo y para su familia. Para ello, como en fases previas de la enfermedad terminal, utilizamos el control de síntomas y la comunicación y soporte emocional. Antes de establecer el tratamiento, realizaremos una valoración de los problemas físicos, psicológicos y sociales que presenta el enfermo y la familia. Tan importante como la medicación que pautemos para el control de los síntomas físicos, es el apoyo emocional y el establecimiento de una serie de medidas generales de confort. VALORACIÓN Los síntomas que presenta el paciente dependen de la localización del tumor y del grado de control previo a la situación final de enfermedad. A los síntomas previos se añade un deterioro progresivo del estado general, con debilidad marcada que condiciona encamamiento. Aunque no siempre, es frecuente que presenten disminución del nivel de conciencia y deterioro cognitivo en diferentes grados. Como consecuencia, existe una importante dificultad para la ingesta oral, y alteraciones en el control de esfínteres. En función del grado de adaptación a la enfermedad y muerte y, del nivel de confort, el paciente presentará diferentes grados de ansiedad y depresión. Por su parte la familia, se enfrenta a una situación de estrés emocional importante por la cercanía de la pérdida de un ser querido. Las consecuencias del mismo vendrán condicionadas por la personalidad previa de cada uno, y por el proceso de la enfermedad y la atención sanitaria recibida. Es frecuente, si la adaptación no es buena, que presente demandas poco realistas de tratamientos que con información y soporte adecuados se pueden solucionar fácilmente. MEDIDAS GENERALES Debemos garantizar la presencia de sus seres queridos y hacerles participes de su cuidado. Les educaremos sobre la forma de realizar la higiene corporal, los cambios posturales, los cuidados de la boca y otros que necesite, manteniendo siempre el principio de no molestar. Se sustituye la toma de constantes físicas por constantes de bienestar: comodidad, descanso, sueño, ausencia de dolor, etc. Mantendremos al paciente en un ambiente de silencio, tranquilidad e intimidad. Informaremos a la familia de los cambios que pueden producirse y la forma de afrontarlos: incontinencia de esfínteres, retención urinaria, estertores, qué debe hacer cuando se produzca el éxitus, etc. TRATAMIENTO FARMACOLÓGICO Respecto a la medicación, lo primero que debemos hacer es suspender todos los fármacos que no tengan utilidad inmediata, con 3 ó 4 como máximo, se pueden controlar los síntomas del paciente y no tiene sentido utilizar más. Cuando no sea posible administrar la medicación por vía oral, colocaremos una palomilla para administrarla por vía subcutánea. Debemos establecer pautas fijas regulares, añadiendo pautas adicionales para cambios previsibles en la evolución. Los síntomas más frecuentes y fármacos a utilizar son: - Debilidad, incapacidad para la ingesta: En ésta fase el tratamiento farmacológico y la utilización de sueros ó alimentación por sonda nasogástric a, no tiene sentido. Es fundamental explicar a la familia que su uso no modificará el proceso y además lo hará más penoso. - Disnea: El fármaco de elección es la morfina. Dosis: si el paciente ya la recibía, incrementaremos la dosis previa en un 30- 50% y, si no, pautaremos 5mg. cada 4 horas por vía subcutánea. En muchas ocasiones añadiremos ansiolíticos, fundamentalmente midazolam. - Dolor: Morfina Dosis: si tomaba morfina oral previamente, ajustaremos la dosis a la vía subcutánea y, según el grado de control, la incrementaremos. Si fuera necesario algún antiinflamatorio, podemos añadir ketorolaco, o diclofenaco. - Estertores: Aunque no producen incomodidad al enfermo, si provocan angustia en los familiares por lo que procuramos evitarlos en lo posible, además explicaremos a la familia que el paciente no sufre por ellos. Utilizamos buscapina. Dosis: 20 mg. cada 6–8 horas vía subcutánea. Es imprescindible iniciar el tratamiento antes de que se acumulen gran cantidad de secreciones. - Síntomas neuropsicológicos: Delirium, crisis de pánico. Haloperidol. : Dosis: 5- 8 mg. vía subcutánea cada 8 horas. Midazolam: Dosis: 5- 15 mg. cada 4 horas por vía subcutánea. También se puede utilizar levopromacina subcutánea. ¿HOSPITAL Ó DOMICILIO? El lugar más adecuado para el fallecimiento de estos pacientes es su domicilio, siempre que su situación clínica, emocional y social lo permita. Cuando ésto no sea posible, el lugar ideal es una Unidad de Cuidados Paliativos. Decimos que es el domicilio el mejor sitio, porque permite mayor autonomía, comodidad, independencia e intimidad, tanto al paciente como a la familia. Les facilita la comunicación y las manifestaciones de afecto, así como la realización de cuidados. En ocasiones el paciente demanda el ingreso debido a que tiene falsas expectativas respecto a su situación por desconocer su diagnóstico, a que cree que en el Hospital estará más protegido y mejor atendido, porque piensa que es una carga para la familia, ó porque no dispone de una correcta atención en el domicilio. Otras veces es la familia la que solicita el ingreso por falta de seguridad en la adecuación de los cuidados, ó porque lleva mucho tiempo sufriendo una situación que le produce un gran desgaste físico y emocional y, sencillamente, no puede más. Hay otros casos en que el ingreso está indicado por necesidad clínica o social. SEDACIÓN La definición más aceptada de sedación terminal es la administración deliberada de fármacos para producir una disminución suficientemente profunda y previsiblemente irreversible de la conciencia, en un paciente cuya muerte se prevé próxima, con la intención de aliviar un sufrimiento físico y/ o psicológico inalcanzable con otras medidas y con el consentimiento explícito, implícito o delegado del paciente. La Medicina Paliativa recupera el concepto de mejor muerte como aquella que se produce en el domicilio del paciente, acompañado por sus seres queridos, permitiendo expresar a cada uno sus emociones y, facilitando la despedida por muy dolorosa que sea. Esto exige un abordaje adecuado desde el inicio de la enfermedad de la información, seguido de una comunicación y un apoyo emocional, que en ocasiones precisará de psicoterapia a lo largo del proceso, junto a un control de síntomas adecuado. Cuando el paciente desconoce su situación, no tiene con quien compartir sus angustias y temores, ó tiene síntomas mal controlados, es probable que él, su familia, ó el Equipo que le atiende encuentren necesaria la sedación. Por otro lado en ocasiones hay síntomas que no podremos controlar salvo que recurramos a la sedación del enfermo. La prevalencia de necesidad de sedación terminal en Unidades de Cuidados Paliativos es variable, porque no todos los autores entienden lo mismo por este término. Hay grandes diferencias culturales, parece que en los países latinos la prevalencia es mayor. En un reciente estudio multicéntrico la indicación de sedación para el control de síntomas varió desde el 15% al 36%, el síntoma más frecuente que motivó la sedación fue el delirium. La intención de controlar síntomas y no la de provocar la muerte es lo que la diferencia de la eutanasia. Cada caso requiere una valoración individualizada, en la que lo más importante es tener en cuenta el deseo del enfermo, y no el de su familia o del Equipo que le atiende; muchas veces es difícil conocer la voluntad del paciente, porque desconoce su situación y no es el momento de informarle. En segundo lugar tenemos que estar seguros de que no hay posibilidad de controlar los síntomas de otra manera