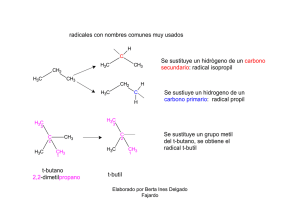
ALDEHIDOS Y CETONAS
Anuncio

ALDEHIDOS Y CETONAS En las plantas y en los animales se encuentra una amplia variedad de aldehídos y cetonas. Existen en la naturaleza, contribuyendo al aroma y al sabor de muchos alimentos y ayudando en la función biológica de muchas enzimas por ejemplo en la biosíntesis de azúcares y de aminoácidos. Las hormonas esteroidales como la testosterona, la progesterona y la cortisona, tienen en su estructura grupos carbonilo. Elaborado por: Berta inès Delgado Fajardo ALDEHIDOS Y CETONAS Generalidades Los aldehídos y las cetonas son dos clases de compuestos orgánicos, caracterizados por una unidad reactiva que consiste de un carbono unido con un doble enlace a un oxigeno, esta unidad reactiva se conoce con el nombre de grupo carbonilo. El oxigeno más electronegativo que el carbono, presenta una mayor densidad electrónica π, en el extremo oxigenado del grupo, generando un dipolo de enlace como se indica en la siguiente figura: Elaborado por: Berta inès Delgado Fajardo ALDEHIDOS Y CETONAS Generalidades Las estructuras resonantes del grupo carbonilo, permiten observar la localización de una carga positiva sobre el átomo de carbono, que se comporta como un electro filo y la localización de cargas negativas sobre el oxigeno, que se comporta como un nucleòfilo. Debido posiblemente a esta resonancia, los dobles enlaces del grupo carbonilo son unas 30 Kcal mol-1 más fuertes, que los dobles enlaces carbono-carbono. Por ésta razón y por su gran momento bipolar, el doble enlace carbonilo adiciona con facilidad reactivos polares como el agua, sin embargo el equilibrio de la reacción se desplaza a la izquierda, favoreciendo termodinámicamente al aldehído y a la cetona. Elaborado por: Berta inès Delgado Fajardo ALDEHIDOS Y CETONAS Propiedades Físicas Debido a las interacciones entre estas moléculas bipolares, Los aldehídos y las cetonas presentan puntos de ebullición mayores que los puntos de ebullición de los hidrocarburos correspondientes. Las cetonas y los aldehídos entre sí, no pueden formar puentes de hidrógeno, por esto sus puntos de ebullición son inferiores a los de los alcoholes de peso molécular similar. Esto se explica, porque los alcoholes si pueden formar entre si puentes de hidrógeno. Los compuestos carbonìlicos más pequeños como el acetaldehído y la propanona son solubles en agua. Sin embargo a medida que crece la cadena carbonada (hidrofòbica) la solubilidad en agua disminuye. La solubilidad en agua y en alcoholes, se explica por su polaridad y por la presencia de los pares de electrones libres sobre el átomo de oxigeno del grupo carbonilo, pueden formar con el agua puentes de hidrógeno. Elaborado por: Berta inès Delgado Fajardo OBTENCION DE ALDEHIDOS Y CETONAS Oxidación del Metanol H HC H clorocromato de piridinio (PCC) O Metanol H H C5H5NH+CrO3ClCH2Cl2 Elaborado por: Berta inès Delgado Fajardo O H Formaldehído (Metanal) OBTENCION DE ALDEHIDOS Y CETONAS Acilacion de Friedel Crafts GRUPO FUNCIONAL ÈTER CH3 CH3 O O HC HC C CH CH + H3C CH O O C C O CH3 HC HC C C O CH CH HO C CH3 C CARBONO SOBRE ELCUÀL VA A OCURRIR LA SUSTITUCIÒN ELECTROFÌLICA (SE SUSTITUYE EL HIDRÒGENO) H3C GRUPO FUNCIONAL CETONA O ÀCIDO ACÈTICO (ÀCIDO ETANOICO) Metoxibenceno Elaborado Anhídrido acético 1-(4-metoxifenil)-metilcetona por: Berta inès Delgado Fajardo REACCIONES DE ADICION NUCLEOFILICA ADICION DE AGUA A ALDEHIDOS Y CETONAS forman gem dioles: C OH dos grupos hidroxi sobre el mismo OH àtomo de carbono ejemplos a partir de formaldehido (metanal) (diapositiva 9) acetona (propanona) (diapositiva 10) Elaborado por: Berta inès Delgado Fajardo indeno (1,2,3-triona) (diapositiva 11) Reacciones de Adición Núcleofilica 1. Adición de Agua Formación de hidratos llamados gem-glicoles H H C O H + O formaldehido + agua (metanal) H H O + H C H OH H metanodiol (gem-glicol: dos grupos hidroxi sobre el mismo àtomo de carbono) Elaborado por: Berta inès Delgado Fajardo Reacciones de Adición Núcleofilica 1. Adición de Agua: Formación de hidratos llamados gem-glicoles Los electrones pi se deslocalizan sobre el oxìgeno (O) y enlazan al protòn (H+) proveniente de la molècula de agua H 3 C H C H 3 C O + O H H O + H 3 C C H O H C H El C, cuando se des localizan los electrones pi, queda como un carbocatiòn y se enlaza con el grupo hidroxi (OH) (proveniente del agua) a travès de los pares electrònicos libres Propanona Agua 2,2-propanodiol (gem-diol) Elaborado por: Berta inès Delgado Fajardo 3 Reacciones de Adición Núcleofilica 1. Adición de Agua: Formación de hidratos llamados gem-glicoles O O O + OH H O H OH O O Indeno-1,2,3-triona Ninhidrina Elaborado por: Berta inès Delgado Fajardo Reacciones de Adición nucleofilica ADICION DE ALCOHOLES A ALDEHIDOS Y CETONAS forman Hemiacetales Hemicetales OR C OR C OH se caracterizan por un grupo èter y un grupo alcohol sobre el mismo àtomo de carbono. Se originan en un aldehido Se originan en un aldehido. (diapositivas 13 y 14) Acetales o Cetales OH se caracterizan por un grupo èter y un grupo alcohol sobre el mismo àtomo de carbono. Su origen es una cetona Su origen es una cetona Elaborado por: Berta inès Delgado Fajardo OR C OR Se caracterizan por dos grupos eter sobre el mismo àtomo de carbono. Reacciòn catalizada por un àcido Su origen es un aldehido o una cetona. (diapositiva 15) Reacciones de Adición Núcleofilica 2. Adición de Alcoholes (formación de hemiacetales y hemicetales) R C O H O R C H O H Aldehido R OH Alcohol R Hemiacetal (porque su origen fue un aldehido) Las características estructurales de los hemiacetales y hemicetales son: un grupo OH y un grupo OR, sobre el mismo átomo de carbono. los hemiacetales/hemicetales de cadena cerrada, con cinco o seis átomos de carbono, son estables y es la forma que adoptan los azúcares simples. Elaborado por: Berta inès Delgado Fajardo Reacciones de Adición Núcleofilica 2. Adición intramolecular de Alcoholes H C O H C OH HO C H H C OH H C O H2C OH Glucosa H H C OH H C OH H C OH HO C H H C H2C O C HO C H H C OH CH2OH OH H O H H C C OH OH α-D-glucopiranosa (hemiacetal) (> 99%) Elaborado por: Berta inès Delgado Fajardo Reacciones de Adición Núcleofilica 2. Adición de Alcoholes en medio ácido H H3C C O + + 2 O CH3 H H H3C C H O O CH3 H3C Acetaldehído Metanol Elaborado por: Berta inès Delgado Fajardo 1,1-dimetoxietano (acetal) REACCIONES DE ADICION NUCLEOFILICA ADICIONDEAMONIACOAALDEHIDOSYCETONAS forman IMINAS se caracterizan por el doble enlace C=N Elaborado por: Berta inès Delgado Fajardo Reacciones de Adición Núcleofilica 3. Adición de Amoniaco: formación de iminas nucleòfilo R C O +H R NH2 C O NH2 R R Compuesto carbonìlico Amoniaco (cetona). Se ruptura desplazan los heterolìtica electrones pi H Se adicionò el nucleòfilo al carbocatiòn Propanona Amoniaco R C NH + R H O H CH4 Imina 2-aminopropan-2-ol Elaborado por: Berta inès Delgado Fajardo propan-2-imina Agua REACCION DE ADICION NUCLEOFILICA ADICION DE DERIVADOS DELAMONIACO A ALDEHIDOS Y CETONAS los derivados del amoniaco son piperidina H N H2C H2C hidrazina H CH2 CH2 2,4-dinitrofenilhidrazina CH2 H O N - NH2 H H producen H2N - OH N+ N OC HN hidroxilamina C CH H H 2N N+ CH N C O CH C semicarbacida O- producen H NH O producen ENAMINAS (son aminas que en el carbono adyacente al nitrògeno, presentan un doble enlace) producen producen OXIMAS 2,4-DINITROFENILHIDRAZONAS (se caracterizan por doble enlace C=N) HIDRAZONAS (se caracterizan por el doble enlace C=N Elaborado por: Berta inès Delgado Fajardo SEMICARBAZONAS 4. Adición de derivados del amoniaco Adición de aminas secundarias para formar enaminas CH3 H 3C CH3 H3C CH2 C C O H CH3 H N H2C CH2 2 CH2 +H C CH2 H CH2 C C H CH3 O CH3 H3C CH2 N H 2C CH2 H 2C CH2 CH2 C C CH3 N H2C CH2 H2C CH2 CH2 H O H 2-metil-3-piperidinil-3-pentanol 1-(1-etil-2-metilprop-1-enil)piperidina (enamina: posee funciòn alqueno y amina) Elaborado por: Berta inès Delgado Fajardo 5. Adición de derivados del amoniaco Adición de hidrazina para formar hidrazonas H H3C C O H3C propanona H + H3C N NH2 N NH2 H C O H3C hidrazina H 2-hidrazinopropan-2-ol Elaborado por: Berta inès Delgado Fajardo H3C C N H3C H + O H NH2 hidrazona de la propanona 6. Adición de derivados del amoniaco Adición de 2,4-dinitrofenilhidrazina para formar 2,4-dinitrofenilhidrazonas O H H3C C O H3C +H O + N N - O C NH C Acetona CH C CH + N H3C O C - O C N CH + N CH 2,4-dinitro fenilhidrazina H3C NH C C - O CH CH O + N + H O - O 2,4-dinitrofenilhidrazona de la acetona Elaborado por: Berta inès Delgado Fajardo H 7. Adición de derivados del amoniaco a los compuestos carbonilicos para formar Oximas con hidroxilamina OH O CH HC C C HC N H CH CH Benzaldehido H + CH N OH H C HC C HC CH H + H O H CH hidroxilamina sin-benzaldoxima Elaborado por: Berta inès Delgado Fajardo agua 8. Adición de Derivados del Amoniaco a los compuestos carbonilicos forman semicarbazonas con la semicarbacida H H2N N C NH + H CH2 O C CH2 CH2 H2N CH2 O semicarbacida CH2 N C NH C CH2 CH2 CH2 H + O H O ciclopentanona ciclopentanona semicarbazona Elaborado por: Berta inès Delgado Fajardo OXIDACION DE ALDEHIDOS Y CETONAS REACCIONES DE OXIDACION ALDEHIDOS CETONAS reaccionan con oxidantes como Tollens (nitrato de plata amoniacal, en medio alcalino) Ag(NH3)2NO3/ -OH Fehling (sulfato cùprico en medio alcalino) CuSO4/ -OH, Fehling A. Se adicionan iones tartrato para evitar la precipitaciòn del Cu+2 , en el medio alcalino Permanganato de potasio KMnO4 ò Dicromato de potasio K2Cr2O7 Las cetonas no reaccionan con los oxidantes de los aldehidos Elaborado por: Berta inès Delgado Fajardo reaccionan con Haloformo I2/KI/NaOH REACCIONES DE OXIDACION DE ALDEHIDOS R C O H + Ag C O H2O + Aldehido R NH3 + HO Tollens C O + Cu Aldehido R C O + KMnO4 + Cu2O HO Acido carboxìlico oxido cuproso (precipitado) -OH R C O + HO H Aldehido + permanganato de potasio R MnO2 + K OH Acido carboxìlico + biòxido de manganeso (precipitado) R C O H C O tartrato de sodio y potasio Fehling espejo de plata R Na OH, H OH 2+ H Ag Acido carboxìlico R + + C O K2Cr2O7 Aldehido + dicromato de potasio + Cr2O3 + K OH HO Acido carboxìlico + triòxido de dicromo Elaborado por: Berta inès Delgado Fajardo Reacción de oxidación para metilcetonas y metilalcoholes REACCION DEL HALOFORMO Metil cetonas R R C O Metil alcoholes CH3 C HO CH3 H Los metil alcoholes dan la prueba positiva, porque frente al reactivo (que es oxidante) se oxidan primero a metilcetonas. Elaborado por: Berta inès Delgado Fajardo Reacciòn del haloformo Las metil cetonas y los metil alcoholes reaccionan con los halògenos (X-X) en presencia de una base fuerte NaOH, produciendo un iòn carboxilato y el haloformo (CHCl3, CHBr3, CHI3 ). Es una reacciòn selectiva para èsta clase de compuestos y por lo tanto se emplea para su identificaciòn. grupo metilo grupo metilo R R C C CH3 HO O grupo carbonilo directamente enlazado al grupo metilo CH3 H carbono con grupo hidroxilo directamente enlazado al grupo metilo Una metilcetona Un metil alcohol La reacciòn general, se representa a continuaciòn: R C O CH3 + 3X2 + R - 3OH C O - + O Metilcetona + halògeno + base iòn carboxilato + haloformo Elaborado por: Berta inès Delgado Fajardo HCX3 Mecanismo de Reacción del Haloformo 1. la base, H - O-, extrae el protòn H+, forma agua y un carbaniòn (especie donde el carbono queda con un par de electrones, cargado negativamente) R H C H + C O H O R - H O + H H metilcetona base fuerte H C - C H O agua carbaniòn 2. El carbanion reacciona con el cloro, ocasionando en esta molecula una ruptura heterolitica, y estabilizandose con el ion cloronio (Cl+) y produciendo un anion cloruro (Cl-) R H C O R - C H + Cl - Cl H C O Cl C H + Elaborado por: Berta inès Delgado Fajardo Cl - Continuación Mecanismo de Reacción del Haloformo 3. las dos etapas anteriores se repiten para extraer los otros dos hidrogenos y formar un compuesto trihalogenado: una trihaloacetona. R Cl C Cl C O Cl 4. En la trihaloacetona el enlace C-C se rompe por accion de la base fuerte, formandose el ion carboxilato y el cloroformo R Cl C O R Cl C Cl O - Cl C H OH O + C - Cl Cl Cl R C O - O Ion carboxilato C Cl Cl H Cloroformo Elaborado por: Berta inès Delgado Fajardo CONDENSACION ALDOLICA Elaborado por: Berta inès Delgado Fajardo Condensación Aldòlica Condensacion Aldòlica: ocurre entre compuestos carbonilicos que tengan hidrogenos α (son los hidrogenos que estàn localizados en el carbono adyacente al carbono del grupo carbonilo) en presencia de una base fuerte NaOH. Hidrogenos α O H 2 HC HC CH CH C C CH Benzaldehido H3C O + C O H3C NaOH CH HC C HC CH CH2 C CH2 CH2 CH2 CH C CH Dibenzalacetona Elaborado por: Berta inès Delgado Fajardo + CH HC CH Acetona CH 2 HO H