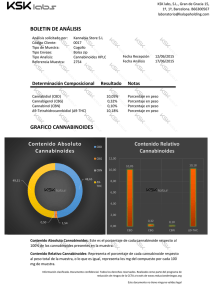
Tesina de Grado Cannabinoides y síntomas neurológicos
Anuncio

Tesina de Grado: "Cannabinoides y síntomas neurológicos: ¿La pieza faltante en la farmacología clínica?" UNIVERSIDAD NACIONAL DE SAN MARTÍN INTITUTO DE CIENCIAS DE LA REHABILITACIÓN Y EL MOVIMIENTO SEDE ROSARIO LICENCIATURA EN KINESIOLOGÍA Y FISIATRÍA Trabajo final: Cannabinoides y síntomas neurológicos: ¿La pieza faltante en la farmacología clínica? Autor: Pablo Alberto Ascolani Director: Dr. Roberto Balaban Co-Director: Dr. Daniel Magliaro Dedicatoria: Para todas las personas que me enseñaron, empezando por mis padres, mis primeros y más queridos maestros. Para las plantas, que, además de alimentar la vida, guardan en su ADN palacios de conocimiento. Agradezco a Roberto Balaban y Daniel Magliaro por acompañarme en la revisión y corrección de esta tesis. A Mariano Diodati y Mónica Prioti por interesarse y alentarme cuando les presenté las primeras ideas del proyecto. A la Fundación del Gran Rosario y su gente, por este viaje que cambió mi mirada; Fernanda Arroyo, Jorge Barragán, Silvio Falconi, Paco Raya, Germán Digerolamo, César Petronio, Martín Managó, Carla Silvestre Begnis, Carlos Martínez, Luis Salvatico y todos los que trabajan –docentes y no docentes- para sostener este espacio de producción de conocimiento. Índice Resumen……………………………………………………………….………7 Introducción …………………………………………………………..………7 Objetivos y metodología………………………………………………………8 Historia del uso de cannabinoides…………………………………….…..…9 Políticas de drogas y cannabis medicinal: Coyuntura mundial……………10 Argentina: coyuntura local……………………………………………...………12 Fisiopatología del dolor neuropático………………………………………..14 Evaluación……………………………………………………………..……….15 Tratamientos disponibles……………………………………………….………16 Fisiopatología de la espasticidad………………………………….…………16 Evaluación……………………………………………………………..……….18 Tratamientos disponibles……………………………………………………….19 Fisiología del sistema cannabinoide endógeno y farmacología de los cannabinoides……………………………………………………………….…………19 Clasificación y química de los cannabinoides……………………..…………21 Fitocannabinoides……………………………………………………..………22 Farmacocinética de los fitocannabinoides…………………………...………23 Absorción y distribución…………………………………………………...……23 Eliminación de fitocannabinoides: metabolismo y excreción………….…………24 Toxicidad y efectos adversos…………………………………………………….25 Perfil de seguridad…………………………………………………………….…25 Efectos clínicos a largo plazo……………………………………………………25 Cannabis y psicosis………………………………………………………………26 Contraindicaciones………………………………………………………………27 Advertencias……………………………………………………………………..27 Precauciones…………………………………………………………………..…27 Principales fitocannabinoides………………………………………………...27 Tetrahidrocannabinol……………………………………………………………27 Cannabidiol……………………………………………………………...………28 Cannabinol……………………………………………………………...………28 Cannabinoides sintéticos o patentados………………………………………28 Variedades patentadas………………………………………………………..29 Variedad de flores de cannabis Bedrocan……………………………………...…29 Sativex…………………………………………………………………………..29 Cannabinoides sintéticos……………………………………………………...30 Dronabinol………………………………………………………………………30 Nabilona……………………………………………………………………...…30 Farmacodinamia de los cannabinoides………………………………………31 Receptores Cannabinoides………………………………………………………31 Endocannabinoides…………………………………………………………….31 Función regulatoria de los endocannabinoides en el sistema nervioso: Señalización retrógrada………………………………………………………………………………33 Usos actuales y potenciales de los cannabinoides en neurología………….33 Cannabinoides y dolor crónico………………………………………………34 Nuevas investigaciones preclínicas sobre dolor neuropático y cannabinoides…35 Cannabinoides y espasticidad…………………………………..36 Ensayos clínicos con cannabis y cannabinoides en el tratamiento de la espasticidad…………………………………………………………………37 Esclerosis múltiple………………………………………………………...…….37 Lesiones medulares……………………………………………………………...39 Otros usos potenciales de los cannabinoides en neurología………………..40 Cannabinoides y movimiento…………………………………………………43 Cannabinoides como suplemento…………………………………………….44 Conclusiones……………………………………………………………….…..45 Consideraciones para el diseño de un ensayo clínico………………………..47 Lineamientos éticos……………………………………………………………47 APENDICE: Los contenidos de un protocolo de ensayo clínico…………..49 Bibliografía principal………………………………………………...………..50 Fuentes…………………………………………………………………………51 Cannabinoides y síntomas neurológicos: ¿La pieza faltante en la farmacología clínica? Pablo Alberto Ascolani Resumen El Sistema Cannabinoide Endógeno (SCE) es un sistema de comunicación intercelular involucrado en la modulación de la neurotransmisión, las células inmunológicas y otros órganos y tejidos. Juega un rol fundamental en la regulación de una amplia variedad de funciones del sistema nervioso, entre ellas neuroprotectivas, analgésicas y relacionadas al movimiento. Es una nueva vía para el tratamiento de la espasticidad y el dolor crónico, comunes a patologías de alta prevalencia. Realizamos una revisión sistemática sobre los cannabinoides como medicamento incluyendo a) breve perspectiva histórica; b) situación mundial y local; c) farmacología de los cannabinoides y fisiología del SCE; d) posibles mecanismos de acción de los cannabinoides sobre el dolor crónico y espasticidad; e) revisión de ensayos clínicos donde se evalúe la eficacia terapéutica de los cannabinoides ante la espasticidad; f) una vez resueltos los primeros puntos realizamos la planificación de un proyecto de ensayo clínico controlado con cannabinoides para el tratamiento de la espasticidad en nuestro medio, utilizando la escala de Ashwort para medir la espasticidad e incluyendo un kinesiólogo para aplicarla. Introducción El dolor neuropático y la espasticidad son de infructuoso tratamiento farmacológico y limitantes para la rehabilitación. La funcionalidad y la vida de relación de los pacientes se ve seriamente limitada. Lo mismo puede afirmarse de la dificultad para el descanso nocturno, que impide la correcta recuperación del plan de rehabilitación correspondiente; el control vesical como importante independencia; todos ellos intervienen como elementos centrales en la calidad de vida. El tratamiento correcto de estos síntomas también colabora con un desarrollo conveniente de las diferentes etapas de su reinserción social. El cannabis en bruto y diferentes derivados como las tinturas, se han usado históricamente como analgésicos y tónicos para el sistema nervioso. Hoy, junto con sucedáneos sintéticos de los cannabinoides, presentan una nueva esperanza para el tratamiento de estos síntomas de escasa o inadecuada respuesta a los fármacos hoy indicados. En Argentina, el conocimiento de sus propiedades permanece mayoritariamente desconocido. En el ámbito de la rehabilitación, se han sumado evidencias anecdóticas, pero el debate sobre su utilización permanece ajeno tanto a los profesionales médicos, kinesiólogos y otros miembros del equipo de salud. Objetivos y metodología: Se realizará una revisión sistemática de los cannabinoides como medicamento incluyendo a) breve perspectiva histórica; b) situación mundial y local; c) farmacología de los cannabinoides y fisiología del SCE; d) posibles mecanismos de acción de los cannabinoides sobre el dolor crónico y espasticidad; e) revisión de ensayos clínicos controlados de asignación aleatoria, evaluado contra otra droga activa y/o placebo, donde se evalúe la eficacia terapéutica de los cannabinoides ante la espasticidad; f) planificación de un proyecto de ensayo clínico controlado con cannabinoides para el tratamiento de la espasticidad en nuestro medio, utilizando la escala de Ashwort para medir la espasticidad y un kinesiólogo para utilizarla. Para ello se buscará en Pub Med utilizando los términos “marijuana”, “cannabis,” and tetrahydrocannabinol”, “cannabinoids”, “therapeutic use,” “administration & dosage,” “smoking,” “metabolism,” “physiology,” “adverse effects”, “pharmacology”, “receptors, cannabinoid”, “endocannabinoids,” “marihuana”, “ tetrahidrocannabinol”, “THC”, “dronabinol”, “nabilone”, “randomized”, “double-blind”, “placebo-controlled”, “human”, “cronic pain”, “neuropathic pain”, “spasticity”. Después de realizar las búsquedas iniciales se seleccionará un ensayo clínico realizado con una metodología adecuada para trasladar el protocolo a nuestro medio. Se elegirán estudios del uso de cannabinoides para tratar espasticidad y otros síntomas neurológicos, de asignación aleatoria, evaluado contra otra droga activa y/o placebo, excluyéndose otros. Se incluirán estudios de diversa duración. También se estudiarán las referencias de los artículos relevantes. Se identificarán para cada ensayo clínico el país donde se realizó el proyecto, el número de pacientes estudiados, el tipo de estudio y comparaciones hechas, los productos y dosajes usados, la eficacia y los eventos adversos. Historia del uso de cannabinoides El cannabis es una de las primeras plantas cultivadas. Siendo fuente de fibras, semillas y compuestos biológicamente activos, ha tenido y continúa teniendo una influencia mayor en la cultura humana. Las pruebas más antiguas del tratamiento y utilización de sus fibras se remontan 10.000 años atrás en Taiwan. La documentación más temprana del uso de cannabis como agente farmacológicamente activo tiene 2700 años y también fue hallada en china, en la región de Xinjiang-Uighur. Su uso médico más antiguo registrado en papel es el Pen Ts´ao, y data del año 100 D. C. Es de un autor desconocido que dice transcribir un escrito del emperador y herbolario chino Sheng Nung. En la antigüedad ha sido utilizada como medicina en medio y lejano Oriente, África y Europa. Fue señalado como remedio por Galeno y otros médicos de la era clásica y helenística. También tuvo influencia en las culturas germánicas. Tanto en la historia antigua como en la contemporánea (previa a su prohibición en 1937) el cáñamo a tenido múltiples usos tradicionales: en la malaria, estreñimiento, dolores reumáticos, dismenorrea, como antifebril, antidepresivo, inductor del sueño, contra la disentería, para estimular el apetito y facilitar la digestión, dolor de cabeza, insomnio, incontinencia urinaria, gota, epilepsia, neuralgia, entre otros. La primera descripción moderna de sus propiedades farmacológicas las realizó William O ´Shaughnessy en 1839, y fue listado en el United States Dispensary en 1854 basados en su supuestas propiedades analgésicas, sedativas, anti-inflamatorias, antiespasmódicas, anti-asmáticas y anticonvulsivantes. A principios del siglo XX formaba parte de la composición de virtualmente todos los preparados tópicos para tratar contracturas, artralgias, tendinitis y demás afecciones del aparato locomotor. Los motivos de la prohibición del cannabis sativa fueron varios, principalmente de índole política y económica. El principal fue La intervención en 1925 de Inglaterra en la Comisión Internacional del Opio, que influyó en la prohibición del cáñamo negándose a firmar el acuerdo si no se incluía en él al cannabis. Los motivos de Inglaterra eran de orden político relacionados con su ocupación colonial de Egipto. Los sectores egipcios partidarios de la independencia hacían del consumo del cannabis, tradicional en Egipto, un símbolo de resistencia. La prohibición facilitaba las tareas de contrainsurgencia. Este marco cultural se repetía en el norte de África donde eran potencias coloniales Italia y Francia, sirviendo también al interés de estos países. Dentro de Estados Unidos, los motivos económicos proscribieron el cáñamo. Competía en ese momento en la industria textil con el algodón y el recién surgido nylon. El gobierno y los medios de comunicación impulsaron un fuerte conservadurismo propio del ideal de las clases dominantes de la sociedad estadounidense de la época, y asoció al inmigrante mexicano y la manía homicida al cannabis, estigmatizándose y demonizándose su uso. La medicina no consolidó su interés porque luego de la legislación de la “Marihuana Tax Act” de 1937, la combinación de la burocracia y restricciones impuestas por el Federal Bureau of Narcotics imposibilitaron que los médicos lo utilicen en su práctica. También disminuyó el interés sobre el cannabis las dificultades en su aplicación clínica, la fuerza variable de los preparados de cannabis, la aparición de nuevos fármacos como los opioides y los barbitúricos y el surgimiento en 1850 de la jeringa hipodérmica que permitía la dosificación exacta de drogas hidrosolubles para un rápido alivio del dolor, característica que no comparten los preparados liposolubles a base de cannabis. También influyó la lucha del monopolio de la producción y la comercialización de todas las drogas por parte de laboratorios. La marihuana resultaba un pésimo negocio, dada su facilidad de producción, bajo coste y su imposibilidad de síntesis –hasta ese momento- en laboratorio. Finalmente, secundario a presiones gubernamentales, la marihuana fue retirada de la U.S. Pharmacopoeia en 1942. Políticas de drogas y cannabis medicinal: Coyuntura mundial. Las políticas de drogas prohibicionistas impulsadas por Estados Unidos lo han situado como poseedor del control político-militar hegemónico, pero no han solucionado los daños que acarrea el abuso de drogas. De acuerdo a los resultados, estas políticas han amplificado los daños causados por las drogas resultando inefectivas y contraproducentes , además de haber obstaculizando la investigación científica. En 1970 se aprobó en Estados Unidos el Comprehensive Drug Abuse and Control Act, comúnmente referido como Acta de Control de Sustancias, que posteriormente se hizo extensiva a la mayor parte del globo. Se clasificó las sustancias en 5 categorías o listas que imponen varias restricciones al acceso a las drogas bajo la dirección de la DEA en E.E.U.U. u organismo correspondiente en cada país. Las drogas colocadas en la Lista I tienen a) alto potencial de abuso b) no tienen uso médico aceptado en USA c) hay ausencia de seguridad en el uso bajo supervisión médica. El cannabis fue situado en esta lista. Pese a ello, en los últimos veinte años y debido a los adelantos técnicos en el aislamiento y estudio de proteínas específicas, se han producido notables descubrimientos en relación al llamado “SCE”. Esto fue sentando las bases teóricas del potencial de los cannabinoides como medicamento, poniendo en evidencia la notable falacia que supone colocar el cannabis sativa en la lista I. Actualmente esta clasificación se está revisando en diferentes países. El gobierno alemán quiere permitir que las compañías farmacéuticas puedan solicitar la aprobación de medicamentos a base de cannabis. Según las autoridades alemanas: "Dado que en Gran Bretaña ha sido aprobado un fármaco de extracto de cannabis para el tratamiento sintomático de la espasticidad en la esclerosis múltiple, es necesario levantar la prohibición general sobre el cannabis con fines medicinales para que se pueda autorizar dicho medicamento". El comité de expertos en drogas recomendó la reclasificación del cannabis con fines terapéuticos en la Ley de Estupefacientes del anexo I al II de dicha ley si "está destinada a la elaboración de preparados con fines terapéuticos". Además, el comité recomendó añadir en el anexo III de la ley de estupefacientes la siguiente opción: "Extracto de cannabis (extracto obtenido de la planta perteneciente a la especie de cannabis y de sus distintas partes)" y sólo "en forma de preparado autorizado como medicamento." La nueva clasificación del cannabis en el anexo II lo capacita para la fabricación de preparados con fines terapéuticos, lo que hace que pueda ser comercializado y que las farmacias puedan manejarlo sin tener que contar con un permiso especial. Hasta ahora las que querían vender cannabis para uso terapéutico, importado de los Países Bajos, tenían que solicitar permiso para poder hacerlo. La inclusión del extracto de cannabis en el anexo III de la ley de narcóticos se establece ante la prevista aprobación del Sativex, extracto de cannabis de la compañía británica GW Pharmaceuticals. Si bien hasta la fecha no se han expedido, el gobierno federal sigue las recomendaciones de este comité de expertos. En parte de Europa, Canadá, y 15 estados de USA se indica como estimulante del apetito, contra los vómitos y náuseas como efectos secundarios de la quimioterapia, la radioterapia y la medicación antirretroviral en Cáncer y VIH/SIDA. También en Esclerosis múltiple y problemas de médula espinal, contra el dolor crónico de origen nervioso, espasmos musculares y otras síntomas neurológicos. Son varios los documentos emitidos por Instituciones de jerarquía que declaran al cannabis como una medicina eficaz y de elevada seguridad en sus usos vigentes. Entre ellos se pueden citar el documento emitido por el Comité de Ciencia y Técnica del Parlamento del Reino Unido (The House of the Lords), El Instituto Catalán de Farmacología, el reporte del Ministerio de Salud de Bélgica, El reporte del Senado de Canadá. En noviembre del 2009 la AMA, primera asociación médica de Estados Unidos se sumó al pedido del Colegio Médico Americano, segunda asociación en importancia (ACP), reclamando el traspaso del cannabis de la lista I a la lista II y III de sustancias controladas, para facilitar la investigación clínica. El documento de la AMA declara “…un número pequeño de ensayos clínicos controlados y randomizados se han realizado (…) Los resultados indican que el cannabis fumado reduce el dolor neuropático, mejora el apetito y la ingesta calórica especialmente en pacientes con masa muscular reducida, y puede aliviar la espasticidad y el dolor en pacientes con esclerosis múltiple (…) La marihuana es la droga ilícita más común. Sin embargo el hecho de que sea común el uso no terapéutico del cannabis, no obvia su potencial para el desarrollo de medicamentos. Muchos productos farmacéuticos legales usados para paliar el dolor e inducción del sueño tienen toxicidades agudas más serias que la marihuana, incluyendo la muerte (…) La asociación médica americana insta a revisar el estatus de la marihuana en la lista I de sustancias controladas con la meta de facilitar la conducción de investigación clínica y desarrollo de medicinas basadas en el cannabis.” Previamente la ACP había declarado “…los efectos adversos del uso de marihuana están dentro del rango de efectos tolerados para otras medicaciones.”, concluyendo “La evidencia no solo soporta el uso médico de la marihuana en ciertas condiciones sino que también sugiere numerosas indicaciones para los cannabinoides…”. En el estado de California, EE.UU., ya se están aplicando para el cannabis medicinal, con más de 2000 dispensarios abiertos a la fecha en el estado. El 46% de los votantes de California están a favor de legalización según el referendo de noviembre de este año. Chris Lehane, uno de los responsables de la iniciativa, dijo que los votantes "ya aceptan" que el cannabis es de uso común. Argentina: coyuntura local. En Argentina existe un fallo unánime de la Honorable Corte Suprema de Justicia que despenaliza la tenencia para consumo, pero no hay referencias en el mismo al uso médico. En marzo del 2006, la Justicia argentina consideró que la posesión de cannabis para consumo personal podría estar justificada cuando se trata de un uso terapéutico. El fallo fue emitido por la sala II de la Cámara Federal y revocó el procesamiento de una mujer en cuya casa se encontraron, durante un allanamiento, marihuana en el dormitorio. La acusada adujo que utilizaba la droga para paliar los intensos dolores y el insomnio producidos por una enfermedad de columna. La defensa estuvo centrada en el derecho a la salud. Se presentaron certificados médicos de las especialistas. La doctora Inés Becu explicó que la acusada “presenta marcada cifoescoliosis cervicotoracicolumbar, dolor a la palpación y/o percusión de apófisis espinosas cervicales y articulaciones de miembros superiores” y “un síndrome neuroosteoarticular degenerativo de columna vertebral con compresión de raíces nerviosas”, por lo que se la había derivado a neuroortopedia e indicado “medidas generales de sostén, no pudiendo indicarse analgésicos por la intolerancia gastrointestinal que la paciente presenta a los mismos”. En otro certificado, la psiquiatra Stella Maris Corominas sostuvo que la cronicidad del problema que presentaba la mujer – insomnio y anorexia secundarios a dolores articulares y musculares que interrumpen el sueño– la había llevado “a un cuadro de ansiedad de difícil tratamiento, ya que la paciente no tolera drogas analgésico-antiinflamatorias”. Para abordar la cuestión del uso terapéutico de la marihuana fue requerida la opinión del doctor Rodolfo Rothlin, titular del Departamento de Farmacología de la Facultad de Medicina de la Universidad de Buenos Aires, quien confeccionó un informe incorporado al expediente donde establece que “el dronabinol o tetrahidrocannabinol, mayor metabolito activo de la planta cannabis sativa (marihuana) ha sido aprobado por la Food and Drugs Administration (FDA) de Estados Unidos para su uso en el tratamiento de la anorexia asociada con pérdida de peso en pacientes con sida y de las náuseas asociadas al tratamiento quimioterapéutico en pacientes con cáncer y que no respondían a los tratamientos convencionales”. Agregó que “existen otras condiciones en las cuales parecería tener beneficios, aunque no ha sido aprobado para esas patologías debido al hecho de que no existe suficiente evidencia clínica o los efectos adversos limitan su utilidad”. Entre ellos se menciona el “cuadro de dolor crónico”. Se han presentado varios proyectos para la despenalización pero todavía no han debatido en el congreso. En la Cámara de Diputados están vigentes en la actualidad dos proyectos para despenalizar la tenencia y el consumo de marihuana. Uno es de la diputada Diana Conti (FPV-Buenos Aires), y otro del hoy ex legislador socialista Eduardo García (Córdoba). Además, Conti presentó una iniciativa para despenalizar la marihuana para uso terapéutico, en marzo de 2005, volviendo a presentarlo este año. En uno de los fundamentos de esta última iniciativa la legisladora explica: "Cabe destacar que el uso medicinal de la marihuana no debería ser castigado penalmente, ya que si bien la ley 23.737 penaliza la tenencia de drogas para consumo personal, el usuario se encontraría amparado por un estado de necesidad justificante debido a que provoca un mal menor para evitar un mal mayor". En otro de los puntos del proyecto se propone: "La aprobación de esta propuesta destinada a autorizar expresamente el uso de compuestos cannabinoides y químicos de tetrahidrocannabinol (THC) con fines medicinales y para la investigación de su posible eficacia como medicación terapéutica o de control de síntomas". Ante esta situación irregular surgen diferentes interrogantes ¿Qué implicancias tienen sus usos terapéuticos vigentes y potenciales en la salud nacional y mundial? ¿Que aplicación clínica pueden tener los cannabinoides en nuestro medio y como ésta puede interaccionar con la rehabilitación y el hacer kinésico? ¿Que estructura institucional del estado es necesario implementar para producir y dispensar cannabis medicinal? ¿Qué conocimiento hay en el personal de salud al respecto? ¿Qué hay de los métodos alternativos de administración como la vaporización? Estas y muchas otras incógnitas buscarán respuesta en los años por venir. Fisiopatología del dolor neuropático y tratamientos disponibles El dolor neuropático, al contrario del dolor nociceptivo, no tiene utilidad en sí mismo y es considerado un dolor anormal o patológico. El Dolor nociceptivo proviene de estructuras nerviosas intactas que comprenden los receptores, vías aferentes y circuitos específicos de procesamiento, y tiene la función relativa de proteger de mayor daño una zona lesionada. Al contrario, el dolor neuropático proviene de señales desordenadas y ectópicas de nervios, donde las misma estructura y funcionalidad de las estructuras sensitivas están alteradas. La descripción subjetiva puede ser una sensación quemante o ardorosa o "a manera de choque". El ejemplo por excelencia es el dolor del “miembro fantasma” de los amputados. Los casos clásicos comprenden el que surge después del accidente cerebrovascular y en la invasión tumoral del plexo braquial. Los síndromes dolorosos perfectamente identificados aparecen en casos de neuropatía periférica después de quimioterapia, operaciones, diabetes o VIH. Evaluación El dolor es una vivencia subjetiva. Con base en las circunstancias, perspectivas y estado fisiológico del enfermo, el mismo tipo de lesión puede originar niveles distintos de dolor expresado, y la necesidad de su alivio. La evaluación sistemática incluye esclarecer los aspectos siguientes: 1) periodicidad: si el dolor es continuo, con exacerbaciones o sin ellas, o nuevo; 2) sitio; 3) intensidad; 4) factores que lo modifican; 5) efecto de los tratamientos; 6) impacto funcional, y 7) efectos trascendentes en el paciente. En Estados Unidos se han utilizado algunos métodos de evaluación validados como Visual Analogue Scale, the Brief Pain Inventory y the Memorial Symptom Assessment Scale. Para valorar las intervenciones y sus efectos es necesario hacer revaloraciones frecuentes. Etiopatogenia Las sensaciones dolorosas pueden desaparecer o disminuir cuando existen lesiones del sistema nervioso central y periférico. Paradójicamente, las lesiones o trastornos funcionales del sistema nervioso pueden producir dolor. Por ejemplo, las lesiones de los nervios periféricos (como ocurre en la neuropatía diabética) o de las neuronas aferentes primarias (como en el herpes zoster) producen dolores irradiados en la región del cuerpo que normalmente está inervada por los nervios lesionados. También, aunque con menor frecuencia, hay dolores que se vinculan a ciertas lesiones del sistema nervioso central, especialmente las del tálamo y el haz espinotalámico. Estos dolores neuropáticos suelen ser intensos y bastante refractarios a los tratamientos habituales del dolor. En general, el dolor neuropático tiene propiedades extrañas; semeja un hormigueo, quemazón o descarga eléctrica, y los roces muy suaves pueden desencadenarlo, datos todos que son diferentes en otras clases de dolor. En la exploración, es característico que se descubra un déficit sensorial en el territorio del dolor. La hiperalgesia es un primer indicio característico del advenimiento del dolor neuropático; la persona suele quejarse de que los estímulos cinéticos más insignificantes desencadenan dolor intensísimo (alodinia). Diversos mecanismos contribuyen a la aparición del dolor neuropático. Al igual que ocurre con los nociceptores aferentes primarios sensibilizados, las fibras aferentes primarias y también los nociceptores, una vez lesionados, se vuelven muy sensibles a los estímulos mecánicos y empiezan a emitir impulsos en ausencia de todo estímulo. Existen pruebas de que este aumento de la sensibilidad y de la activación espontánea se debe en parte a una concentración alta de los canales del sodio. Cuando las fibras aferentes primarias se lesionan, también pueden sensibilizarse a la noradrenalina. Curiosamente, las neuronas medulares transmisoras del dolor, que por lo regular interrumpen los impulsos aferentes, también pueden activarse espontáneamente. De ese modo, los cambios lesivos tanto del sistema nervioso central como del periférico contribuyen a la aparición del dolor neuropático. Tratamientos disponibles El dolor de tipo neuropático es menos reactivo al uso de aines y opioides. Los analgésicos complementarios o coadyuvantes son productos no opiáceos que potencian los efectos de los opiáceos contra el dolor. En el tratamiento del dolor neuropático, los antidepresivos tricíclicos como la desipramina, algunos anticonvulsivos como la gabapentina, o la carbamazepina, tienen relativa eficacia para aliviar el dolor neuropático. También la clonidina y el baclofeno. Son complementarios o coadyuvantes y deben utilizarse junto con los opiáceos (no como sustitutivos). Fisiopatología de la espasticidad y tratamientos disponibles. La espasticidad es una alteración de la función motora que se define como un aumento de la resistencia al estiramiento pasivo de los músculos, en proporción a la velocidad del mismo. Se suele acompañar de hipertonía, hiperreflexia osteotendinosa y espasmos musculares. También produce limitación de la movilidad y torpeza que dificulta la deambulación, y afecta a la capacidad funcional y la autonomía para las actividades de la vida diaria (vestirse, comer, bañarse, etc.) y las laborales. Indirectamente puede provocar alteraciones del sueño, úlceras de decúbito y contracturas musculares. El tono es la resistencia de un músculo al estiramiento pasivo. Los trastornos del sistema nervioso central (SNC) que originan debilidad muscular en general producen espasticidad, un aumento del tono a causa de la afección de la neurona motora superior. La espasticidad depende de la velocidad, se libera de forma repentina después de alcanzar un máximo (fenómeno de la "navaja") y afecta de forma predominante a los músculos antigravitatorios (es decir, los músculos flexores de las extremidades superiores y los extensores de las extremidades inferiores). La espasticidad es diferente de la rigidez que se caracteriza por un incremento del tono presente en todo el arco de movimiento (rigidez en "tubo de plomo"y afecta por igual a los flexores y a los extensores. Se observa en algunos trastornos extrapiramidales como la enfermedad de Parkinson, al contrario de la afectación de la vía piramidal que produce espasticidad. Este tipo de síntoma es consecuencia de trastornos que afectan a las neuronas motoras superiores o a sus axones en la corteza cerebral, la sustancia blanca subcortical, la cápsula interna, el tallo encefálico o la médula espinal. Las lesiones de la neurona motora superior producen debilidad por una menor activación de las neuronas motoras superiores. En general, son afectados con mayor gravedad los grupos musculares distales que los proximales, y se conservan los movimientos axiales, a menos que la lesión sea grave y bilateral. La espasticidad forma parte del cuadro de debilidad de la neurona motora superior, pero puede no estar presente en la fase aguda. Aunque la fisiopatología de la espasticidad no es bien conocida, se sabe que es producida por la afectación o lesión de la primera motoneurona que produce una interrupción de la vía inhibitoria motora descendente espinal e hiperactividad de la motoneurona alfa. Desde el punto de vista neuroquímico, hay una estimulación de las neuronas excitatorias glutamatérgicas y una inhibición de las neuronas inhibitorias gabaérgicas. También se ha implicado la proyección cerúleo-espinal, que modula la actividad de las motoneuronas espinales adrenérgicas. Se desconoce, no obstante, el papel exacto de cada uno de estos neuromoduladores en la regulación del movimiento y el tono muscular. Las enfermedades que pueden manifestarse con espasticidad son patologías que afectan al encéfalo y/o los tractos descendientes medulares: esclerosis múltiple (EM), parálisis cerebral, traumatismo craneoencefálico, enfermedad vascular cerebral y lesión medular (LM) traumática o por otra causa. La presentación clínica de la espasticidad y su respuesta al tratamiento varían en función del lugar y grado de la lesión (médula, tronco o cerebro). Con frecuencia, sobre todo en pacientes con EM y LM, se puede asociar a espasmos musculares extensores y flexores, clonus, ataxia, temblor y dolores paroxismales. Evaluación: Hay diferentes maneras de evaluar la espasticidad de forma clínica y/o combinado con herramientas técnicas. Los más utilizados en clínica son el test del péndulo de Wartenberg, la escala de Tardieu, la cantidad de pulsaciones de clonía, el reflejo de los tendones profundos, la Escala Modificada de Ashworth y la Escala de Penn de frecuencia de los espasmos, estos dos últimos desarrollados a continuación y que utilizaremos en el planteo de ensayo clínico para medir la espasticidad. La Escala Modificada de Ashworth es un instrumento útil y valido determinado por el movimiento pasivo realizado por el evaluador a una articulación específica. Como herramienta evaluativa puede propiciar la mejor valoración al requerirse una medida clínica cuantitativa del compromiso y/o severidad de la espasticidad de los pacientes. Tiene la siguiente tabla evaluativa: 0. -No hay cambios en la respuesta del músculo en los movimientos de flexión o extensión 1. -Ligero aumento en la respuesta del músculo al movimiento (flexión ó extensión) visible con la palpación o relajación, o solo mínima resistencia al final del arco del movimiento. 1+. - Ligero aumento en la resistencia del músculo al movimiento en flexión o extensión seguido de una mínima resistencia en todo el resto del arco de movimiento (menos de la mitad). 2.- Incremento en la resistencia del músculo durante la mayor parte del arco de movimiento articular, pero la articulación se mueve fácilmente 3.- Marcado incremento en la resistencia del músculo; el movimiento pasivo es difícil en la flexión o extensión 4. - Las partes afectadas están rígidas en flexión o extensión cuando se mueven pasivamente Escala de “Penn” de la frecuencia de los espasmos, es una escala realizada por el paciente y utilizada para reportar cuan frecuentes e intensos son los espasmos musculares. Tiene dos componentes: A) frecuencia de espasmos: 0= sin espasmos, 1= espasmos inducidos solamente por estímulos, 2= espasmos ocurren menos de una vez cada hora, 3= espasmos ocurren más de una vez cada hora, 4= espasmos ocurren más de 10 veces por hora. B) severidad de los espasmos: 1= leve, 2= moderado, 3= severo. Tratamientos disponibles La medicación existente en la actualidad para tratar la espasticidad, espasmos y dolor neuropático es poco eficaz. Algunos de sus efectos adversos, como debilidad y astenia, común al baclofén, tizanidina y dantroleno, van en detrimento de la intensidad del proceso kinesiológico. Las benzodiacepinas pueden causar aturdimiento, laxitud, trastorno de las funciones psicomotoras, y también atentan contra la calidad del tratamiento de rehabilitación. La evidencia de la eficacia de las drogas existentes es marginal, los eventos adversos son comunes, y especialmente remarcable es el hecho de que no mejoran la calidad de vida de los pacientes. La toxina botulínica tipo A es otro tratamiento farmacológico disponible. Es la neurotoxina biológica más potente conocida, tiene un efecto local de denervación química temporal y revierte entre 3 y 4 meses luego de su aplicación. Acompañada de un correcto plan de medicina física y rehabilitación da buenos resultados. Su mayor inconveniente es su alto costo y sus efectos adversos, como fatiga generalizada, debilidad, náuseas, reacciones alérgicas y la posibilidad de efecto inmunogénico, con generación de anticuerpos que inmunizan al paciente a los efectos útiles de la toxina. Fisiología del SCE y farmacología de los cannabinoides. El descubrimiento del SCE El desarrollo de la farmacología molecular durante los 70 y 80 permitió darle entidad a receptores y a los mecanismos subyacentes, teóricos hasta ese momento. La posibilidad de aislar, depurar y averiguar la secuencia de aminoácidos de los receptores permitió la clonación por Matsuda y su equipo del primer receptor cannabinoide ( RCB1) en 1990. Mechoulam –el químico que elucidó la estructura del THC en 1964- junto con Pertwee y sus grupos identificaron el primer endocannabinoide en 1992, la AEA. Munro et al clonó el segundo receptor cannabinoide (RCB2) en 1993. Mechoulam nuevamente, en 1995 descubrió el segundo endocannabinoide más común, el 2AG. A partir de allí y hasta la fecha a aumentado enormemente el caudal de investigaciones sobre el SCE y sus componentes, sustentándose el potencial terapéutico de los agonistas cannabinoides y de la manipulación de elementos de este sistema como un tratamiento alternativo de diversos síntomas, entre ellos el dolor neuropático y la espasticidad. En muchas enfermedades se ha manifestado que existen cambios en la propia actividad cannabinoide que justifican el estudio farmacológico de este sistema. Hoy se conocen los elementos que forman parte de este sistema de señalización intercelular. Se han caracterizado los ligandos endógenos, la mayoría de ellos derivados del ácido araquidónico, que son sintetizados a demanda por distintos tipos de enzimas habituales del metabolismo lipídico. Se conocen los receptores de membrana a través de los que actúan estos ligandos, principalmente los receptores CB1 y CB2, sin descartar la posible existencia de otros subtipos o de receptores relacionados, como los receptores vainilloides TRPV1 (Receptor de potencial transitorio V1). También se han relacionado dos receptores huérfanos acoplados a proteína G, el GPR55 y GPR119, que explicaría parte de la acción de cannabinoides no mediada por CB1 y CB2. Evidencia reciente indica también que los cannabinoides actúan en miembros de la familia de receptores que regulan la transcripción genética, los PPARs (perxisome proliferator-activated receptors) que regulan la diferenciación celular, el metabolismo lipídico y están involucrados en funciones neuroprotectivas, antiinflamatorias y relacionadas con la alimentación y el peso corporal. y Los receptores cannabinoides poseen 7 dominios transmembrana, por tanto, se trata de receptores acoplados a proteínas que unen GTP de las que deriva la activación de varios tipos de cascadas intracelulares y/o la modificación de la conductancia para varios tipos de iones. También se conoce el mecanismo por el que finaliza la acción biológica de estos ligandos que incluye dos elementos, un sistema de transporte a nivel de membrana y la actuación de enzimas encargadas de la hidrólisis de los cannabinoides endógenos. A partir del estudio de la distribución de estos elementos en el organismo, de los efectos que causan los agonistas y los antagonistas cannabinoides o de los cambios que se producen en ratones deficientes en algunas de las proteínas clave de este sistema, se ha podido demostrar que dicho sistema es activo tanto a nivel del sistema nervioso central como periférico, y también en los sistemas inmune y cardiovascular. En el sistema nervioso el SCE desarrolla un papel modulador, incluyendo su participación como sistema de comunicación retrógrada en ciertas sinapsis, en procesos tales como el control de la actividad motora, la memoria y el aprendizaje, la regulación del apetito y la emésis, el control nociceptivo, y ciertas respuestas motivacionales. Además, participa en la decisión celular muerte/supervivencia, fenómeno que es especialmente importante en el tejido nervioso por el carácter postmitótico de la gran mayoría de células neuronales, y en el cáncer, por la alteración del mecanismo natural de apoptosis de las células mutadas que los cannabinoides reactivan. A partir de la demostración de la función moduladora que el sistema cannabinoide ejerce en éstas y otras funciones cerebrales, se ha podido sustentar el potencial terapéutico que la manipulación de los diversos elementos de este sistema podría tener en el tratamiento de diversas enfermedades neurológicas. Posiblemente la manipulación terapéutica del sistema cannabinoide no se logre con un solo agonista, sino con la interacción de diversos agonistas y antagonistas, y la modificación de síntesis, transporte y degradación de los cannabinoides. Es opinión del autor que en uno o dos lustros se van a estar usando agonistas cannabinoides o combinaciones de agonistas/antagonistas en las UTI como agentes neuroprotectores para prevenir los graves deterioros neurológicos productos de daños secundarios al daño agudo. Modelo animales han mostrado que la activación del RCB2 (cuyos agonistas carecen de psicoactividad) es protectiva contra injuria de isquemia-reperfusión miocárdica, cerebral y hapática disminuyendo la respuesta inflamatoria/activación de células endoteliales (expresión de moléculas de adhesión, secreción de quimioquinas, etc), y atenuando la quimiotaxis leucocitaria, rodamiento, adhesión al endotelio, activación y migración transedotelial y daño oxidativo/nitrosativo relacionado. La terapia intensiva, donde la tecnología se aplica de forma continua y terapéutica es ámbito de múltiples disquisiciones bioéticas. Al día de hoy es grande el éxito logrado en las intervenciones terapéuticas en este ámbito, permitiendo la supervivencia de pacientes que antes fallecían, pero que produce pacientes en estado vegetativo o coma, donde el daño neurológico impide la interacción con el entorno. Otros con estados cognoscitivos disminuidos –estados de mínima conciencia- donde hay un alto grado de invalidez y pérdida en diferentes grados de la afectividad, comunicación y conciencia de sí. En este ámbito también los cannabinoides parecen ser una pieza faltante. Clasificación y química de los cannabinoides. En función de su estructura química, la amplia variedad de moléculas que se comportan como agonistas de los receptores cannabinoides se pueden dividir en cannabinoides clásicos, no clásicos, aminoalquilindoles y eicosanoides. Bajo esta clasificación los cannabinoides clásicos serían los botánicos, y los análogos dronabinol, nabilona, HU-210 y HU-243. Los cannabinoides no clásicos son los análogos bicíclicos y tricíclicos del delta-9-THC que carecen de anillo pirano. El principal representante es el CP55, 940, que se utilizó para demostrar la existencia de receptores específicos para cannabinoides en el cerebro de rata. Otros cannabinodes no clásicos son el levonantradol y desacetilevonantradol. El tercer grupo de compuestos cannabimiméticos son los aminoalquilindoles, cuyo principal representante es el WIN 55.212-2. Su estructura proviene de la pravadolina y difiere de los compuestos antes mencionados. La última familia de moléculas con actividad cannabimimética se ha desarrollado a partir de los cannabinoides endógenos. Ellas se describirán en el apartado sobre la biología del sistema cannabinoides endógeno. Comprende una serie de compuestos derivados del ácido araquidónico, cuyo principal representante es la araquidoniletanolamina. Una de las clasificaciones de los cannabinoides los divide en tres tipos, en función de su origen: Los fitocannabinoides, grupo de compuestos terpenoides que se producen como metabolitos secundarios en el Cannabis Sativa L. Los cannabinoides endógenos o endocannabinoides: se producen naturalmente en el sistema nervioso e inmune de los animales y seres humanos. Cannabinoides sintéticos, grupo de sustancias de variada estructura química que se acoplan a los receptores cannabinoides. Fitocannabinoides: Los fitocannabinoides, pertenecientes al grupo de los cannabinoides clásicos, sólo se conoce que ocurren naturalmente en la planta de cannabis, concentrados en una resina viscosa que se produce en estructuras glándulares llamadas tricomas. Esta resina es rica también en terpenos, que son responsables en gran medida por el perfume de la planta. La combinación de cannabinoides, terpenoides y terpenos en las variedades de cannabis exhiben una gran variabilidad. La cría selectiva se ha usado para controlar la genética de las plantas modificando su perfil de cannabinoides. Por ejemplo, las variedades comúnmente utilizadas para fibra, llamada vulgarmente cáñamo, son bajas en compuestos psicoactivos como el THC. Las variedades medicinales normalmente se seleccionan para que tengan un contenido alto de CBD, y variedades usadas para fines recreativos son seleccionadas con un alto contenido de THC o un balance químico preciso. El análisis cuantitativo del perfil de cannabinoides se determina por cromatografía de gases preferentemente en combinación con un espectrómetro de masa. La cromatografía líquida es posible, pero es semi-cuantitativa o cualitativa. Los fitocannabinoides son casi insolubles en agua pero solubles en lípidos, alcoholes, y otros solventes no polares. Suelen tener una estructura carbocíclica de 21 carbonos y están formados por tres anillos, ciclohexeno, tetrahidropirano y benceno. La producción biosintética de los cannabinoides empieza cuando una enzima causa la combinación de geranil pirofosfatasa con ácido olivetolico para formar Cannabigerol (CBG), que es independientemente convertido a CBD o CBC por dos sintasas. El CBD es ciclado enzimáticamente a THC. Farmacocinética de los fitocannabinoides. Absorción y distribución. Cuando los preparados del Cannabis sativa L. se consumen inhalados mediante vaporizadores o en forma de cigarrillos, la entrada del THC en sangre y la posterior distribución en tejidos son muy rápidas y presentaría una cinética similar en velocidad de absorción a la obtenida tras su administración intravenosa. La máxima concentración plasmática de THC se alcanza antes de que finalice el consumo del cigarrillo, entre los 3 y los 10 minutos. A diferencia de la vía intravenosa cuya biodisponibilidad es del 100%, la de los cannabinoides inhalados es típicamente entre 10 y 30% dependiendo de la familiaridad con el método. En Alemania se aprobó este año el primer inhalador médico de cannabinoides, la empresa Vapormed ha lanzado el primer inhalador médico de cannabinoides autorizado oficialmente, el vaporizador Volcano Medic. El sistema de vaporización Volcano Medic evapora y facilita la inhalación del THC disuelto en alcohol y el de los cannabinoides de las flores de cannabis. En su comunicado de prensa del 2 de junio, la compañía señala que "el sistema de vaporización Volcano Medic resuelve dos problemas médico-técnico al mismo tiempo. Por un lado, permite por primera vez la inhalación terapéutica de un líquido, en este caso cannabinoides disueltos en alcohol. Por otro, se puede inhalar los cannabinoides directamente utilizando flores secas de cannabis. (...) En el sistema de vaporización Volcano Medic los cannabinoides son evaporados sólo por el impacto de calor. No ocurre combustión, como cuando se fuma. "Esto evita la formación de productos de combustión nocivos". Las principales ventajas de la inhalación de los cannabinoides en comparación con la administración oral es la fácil dosificación con la consiguiente disminución de efectos adversos en comparación con la vía oral. La ingestión de los cannabinoides por vía oral da lugar a unos niveles plasmáticos de THC inicialmente más bajos que cuando se toma por inhalación. Por vía oral su biodisponibilidad se ve reducida por su sensibilidad a la acidez del jugo gástrico, por el metabolismo hepático e intestinal, o aumentada por su acceso a la circulación enterohepática. Produce niveles plasmáticos mucho mas erráticos que los observados después de fumar, con picos de concentración detectable en plasma entre 1 y 6 horas variando ampliamente la biodisponibilidad. Solo un 3% del THC presente en sangre esta en forma libre. Dada su elevada hidrofobicidad se une a diferentes componentes plasmáticos. Un 9% está unido a las células sanguíneas. Otro 60% a las lipoproteínas plasmáticas y el resto a albúmina. Esta misma propiedad explica su rápida penetración en los tejidos, sobre todo en aquellos que están altamente vascularizados: pulmón, hígado, riñón, corazón, estomago, bazo, tejido adiposo marrón, placenta, corteza adrenal, tiroides, pituitaria y glándula mamaria. Posteriormente pasa al tejido adiposo, que junto con el bazo son sus principales depósitos tres días después de su ingesta. La droga puede tardar varias semanas en ser totalmente eliminada tras el cese de su administración. Su retención en estos reservorios hidrofóbicos amortigua la penetración del THC en el cerebro, donde su concentración y la de sus metabolitos es más baja (suele ser un 1% de la concentración plasmática máxima) El THC y su metabolito, el 11hidroxi-THC (11-OH-THC) son los que en mayor proporción se acumulan en los tejidos. Una parte del THC aparece conjugada con ácidos grasos, sobre todo en la fase final del almacenamiento. La paulatina liberación del THC, desde estos almacenes tisulares a la sangre, enlentece la caída de los niveles plasmáticos de este compuesto, tras el cese de su administración. Esto prolonga su presencia en sangre y la posterior entrada al cerebro, lo que podría explicar las dificultades para identificar un síndrome de abstinencia a esta droga, tras la suspensión de su administración. Eliminación de fitocannabinoides: metabolismo y excreción. En hombres y animales, se identifican más de 100 metabolitos, siendo el 11-hidroxi-THC (11-OHTHC) y el THC-11 oico (THC-COOH) los metabolitos dominantes. La mayor parte de la biotransformación ocurre en el hígado, aunque también puede producirse en otros órganos como el pulmón y el intestino. La primera enzima que actúa en el catabolismo del THC es el citocromo P-450 por medio de la CYP2C9, CYP2C19 y la CYP3A4 que lo oxida a derivados mono- di- o trihidroxilados. La primera hidroxilación suele producirse en el hígado a 11-OH-THC. Este compuesto puede oxidarse al ácido THC-11-oico (THC-11-COOH) o volver a hidroxilarse. En el segundo caso se convierte en 8,11-dihidroxi-delta 9-THC, que puede ser hidroxilado en la cadena lateral. Estos compuestos hidroxilados son transformados, posteriormente, en otros metabolitos más polares, por rotura de la cadena lateral y oxidación al correspondiente ácido carboxílico. Los metabolitos de los cannabinoides son eliminados en forma de ácidos libres o conjugados con glucurónico. Estos últimos se almacenan en el cuerpo durante períodos relativamente prolongados de tiempo y pueden llegar a ser detectados en la orina varias semanas después del consumo de los cannabinoides. La excreción del THC se produce mediante sus metabolitos en heces primariamente 11-OH-THC (un 68%) o en orina (12%) donde se detecta la presencia de 11-OH-THC y hay una elevada concentración de ácido THC-11 -oico, ambos en forma libre o conjugada con ácido glucurónico. También, aunque en menor medida, se elimina a través del pelo, la saliva y el sudor. Toxicidad y efectos adversos. Perfil de seguridad: Según el Informe de La OMS de 1995 sobre el cannabis Estudios en animales indican que la dosis letal 50 en roedores, de THC es extremadamente alta comparada con otras drogas farmacéuticas o recreativas. La dosis letal se eleva a medida que subimos en el árbol filogenético, sugiriendo por extrapolación que la dosis letal en humanos no se puede alcanzar inhalando o ingiriendo la droga, ya que por estas vías el proceso de absorción se va solapando con la distribución, el metabolismo y la excreción. La vía que permite administrar más cantidad de compuesto es la oral, no pudiéndose lograr una dosis letal incluso administrando cantidades máximas. Efectos clínicos a largo plazo Si el uso del cannabis se extiende al tratamiento de condiciones crónicas, la posibilidad de toxicidad acumulativa debe ser considerada. Aún no se conoce claramente, porque al contrario de drogas de uso médico habitual, donde la información acumulada se basa en un conocimiento razonablemente certero en relación al dosaje acumulativo, circunstancias de uso, y características de los pacientes, la prohibición impuso obvias limitaciones a esta tarea. La mayoría del conocimiento en relación a los efectos a largo plazo se basan en el uso recreacional no controlado en forma de marihuana. En una revisión sistemática de 2008 se estableció que el uso a corto plazo de cannabinoides terapéuticos (con una media de dos semanas de duración) determinó que los cannabinoides incrementan el riesgo de eventos adversos leves, pero no graves . Los ensayos clínicos incluidos en la revisión eran sobre pacientes con cáncer y esclerosis múltiple, y el uso de los cannabinoides estaba dirigido a los síntomas como dolor o las nauseas y vómitos en quimioterapia. Los eventos leves más comunes fueron, para un n = 4615: vértigo (714), somnolencia (377), espasmos musculares (289), boca seca (239), dolor (278), astenia (198), entre otros menos numerosos. Podemos inferir que de poseer efectos secundarios negativos importantes, ya debería tenerse suficiente registro de los mismos, dado lo extendido del uso actual e histórico. Cannabis y psicosis. Se ha planteado que el cannabis que el cannabis puede causar psicosis, pero la evidencia científica actual termina de evidenciar que no hay una relación causal entre el uso de cannabis y las enfermedades mentales. Una revisión sistemática de 2009 sobre 600.000 pacientes comparó incidencia y prevalencia de uso de cannabis con la incidencia y prevalencia de psicosis en el Reino Unido de 1996 a 2005. Los investigadores reportaron que la “incidencia y prevalencia de psicosis y esquizofrenia estaba estable o declinando” durante este período, mientras que el uso de cannabis entre la población general se estaba elevando. . Un metanálisis reciente reporta que el uso de cannabis moderadamente y a largo plazo “no va a producir daños mentales o físicos (…) A grandes rasgos por comparación con otras drogas usadas principalmente para propósitos `recreativos´, el cannabis puede ser considerado una droga relativamente segura” Si bien nuestro interés es la incidencia de efectos adversos sobre el uso medicinal, también es útil saber su perfil de efectos adversos como droga de abuso. Cualquier riesgo asociado a una droga debe ser documentado científicamente para que tenga una regulación adecuada y evitar la utilización entre grupos de riesgo. Contraindicaciones: La variedad de efectos fisiológicos y psicoactivos del cannabis hace que este contraindicado pacientes con historia personal de enfermedad mental. Pacientes con hepatitis C o enfermedad cardíaca grave. La administración fumada en pacientes con EPOC. Advertencias: no se aconseja conducir, operar maquinaria u otras actividades peligrosas hasta que el paciente haya desarrollado tolerancia y considere que puede desempeñar normalmente estas actividades. Precauciones: En poblaciones especiales como adolescentes, madres embarazadas, amamantando y ancianos, y pacientes con historia familiar de enfermedad mental, epilepsia, enfermedad cardíaca, y uso concomitante de sedativos he hipnóticos, debe evaluarse riesgo/beneficio. Principales fitocannabinoides. Se han aislado al menos 66 cannabinoides de la planta de cannabis. Tetrahidrocannabinol, (THC) cannabidiol (CBD) y cannabinol (CBN) son los cannabinoides botánicos mas prevalentes y se han estudiado mas. Recientemente se ha encontrado actividad agonista CB2 en el terpeno aromático beta cariofileno, que forma entre el 12% y 35% del aceite esencial del cannabis. Este terpeno es común en la alimentación, estando presente en el orégano, la canela, la pimienta negra, clavo de olor y lúpulo, entre otros, e incluso esta aprobado por la FDA como aditivo en alimentario, siendo el primer cannabinoide alimentario. Al ser agonista CB2 y no actuar sobre CB1, no tiene acción central, sino periférica, y esta actividad sería la explicación de la actividad antiinflamatoria en ratones. Tetrahidrocannabinol: Es el principal componente psicoactivo de la planta y tiene diferentes cualidades terapéuticas comprobadas y supuestas. Tiene una afinidad aproximadamente igual entre el RCB1 y el RCB2. Tiene un pKa de 10.6, con muy alta solubilidad en lípidos y muy baja en agua, se adhiere al vidrio, difunde en el plástico y es degradado por la luz, el calor, los ácidos y la oxidación. Cannabidiol: Uno de los compuestos más comunes de la planta cannabis, sobre todo en su estadio temprano de floración es el Cannabidiol (CBD). No es psicoactivo, y ejerce una acción moduladora sobre el THC, el más psicoactivo de los cannabinoides, disminuyendo su psicoactividad. Hay numerosas investigaciones pre clínicas que mostraron efectos antiepilépticos, sedativos. ansiolíticos, antipsicóticos, anti-inflamatorios, anti-oxidantes y neuropotectivos. Estos estudios han sugerido un amplio rango de posibles efectos terapéuticos del cannabidiol en numerosas condiciones, pero todavía aguardan a ser confirmados por ensayos clínicos. Se ha demostrado que actúa como agonista sobre los receptores 5-HT1A relacionándose con sus efectos antidepresivos y ansiolíticos. A principios de los 90 se investigó y confirmó la actividad antipsicótica del cannabidiol en animales. Recientes estudios clínicos y pre-clínicos sugieren que el CBD es un efectivo, seguro y bien tolerado tratamiento alternativo para pacientes esquizofrénicos. Su eficacia sería comparable al haloperidol o la olanzapina, antipsicóticos de uso común. En otro se mostró igual de eficaz que el amisulprid, pero con menor incidencia de efectos secundarios. Abría menos reportes de síntomas esquisotípicos entre fumadores de cannabis con una alta relación CBD/THC Cannabinol Es el producto principal de la degradación del THC por acción del aire y luz. Es levemente psicoactivo. La afinidad por el RCB2 es mayor que por RCB1, con una afinidad más baja que el THC. Cannabinoides sintéticos o patentados. Históricamente, la síntesis en laboratorio de los cannabinoides se basó en la estructura de los cannabinoides botánicos, y un gran número de análogos se han producido y testeado. Los nuevos compuestos ya no están relacionados a los cannabinoides botánicos y se basan en la estructura de los endocannabinoides. La farmacocinética de los compuestos sintéticos o patentados es muy similar a la de los cannabinoides botánicos y no se explicita para cada droga o formulación. En relación al costo, la producción de cannabinoides botánicos es mucho más barato que la síntesis, pero debido a la ilegalidad del cultivo para uso medicinal e investigación en nuestro medio, esta opción no está disponible. Las formas farmacéuticas comerciales conteniendo cannabinoides sintéticos o naturales son: Variedades patentadas Hay poco conocimiento científico disponible en relación al cultivo y producción de cannabis medicinal estandarizado. Una de las metas principales de la investigación es el conocimiento del mecanismo biológico que determina los componentes activos principales, THC y CBD, y de esta manera definir variedades con diferentes usos medicinales. Las únicas empresas que lo producen son Bedrocan, empresa privada holandesa que produce tres variedades para el ministerio de salud de Holanda, GW pharmaceuticals, originaria del Reino Unido, cultiva variedades patentadas para producir el spray orofaríngeo sativex y cannador, una cápsula conteniendo un extracto completo de la planta, con contenido estandarizado de THC y CBD en cantidades controladas para que permanezcan en un estrecho margen de relación THC:CBD de 2:1 que se está fabricando en suiza y estudiando en ensayos clínicos open label para la determinación de dosis. Variedad de flores de cannabis Bedrocan: Bedrocan: el porcentaje de THC es alrededor del 19 % y el de CBD 0,8 %. Bedrobinol: THC 12%, CBD 0,2% Bediol: THC 6% y CBD 7,5% Sativex: Es un spray orofaríngeo desarrollado por GWpharmaceuticals para los pacientes con esclerosis múltiple, para aliviar el dolor neuropático, la espasticidad, los espasmos vesicales y otros síntomas neurológicos, actualmente en fase III, aunque se comercializa en Canadá, el Reino unido y algunos países de Europa. Esta aprobado en Canadá como tratamiento adyuvante para el alivio sintomático del dolor neuropático en esclerosis múltiple, y recientemente por dolor causado por cáncer. Se diferencia de otros cannabinoides producidos farmacéuticamente actualmente disponibles porque se deriva de material botánico. Esta estandarizado en composición, formulación y dosis. Los principales cannabinoides son el THC y CBD. La administración del spray orofaríngeo libera una dosis fija de 2.7 mg de THC y 2.5 mg CBD. Sativex ha recibido permiso de la FDA para entrar directamente a la última parte de la fase III en Estados Unidos. Se está evaluando en ensayos doble ciego, randomizado, controlado con placebo su eficacia en aliviar el dolor neuropático, disminuir la utilización de medicación opioide, mejorando la calidad del sueño y otros aspectos relevantes de la calidad de vida. En los ensayos clínicos el sativex fue generalmente bien tolerado. Cannabinoides sintéticos Dronabinol: Dronabinol es el ingrediente activo de las cápsulas de MARINOL, un sucedáneo sintético del THC. Es una resina amarilla clara, pegajosa a temperatura ambiente, endureciendo con el frío. Es insoluble en agua y formulado en aceite de sésamo. Tiene un pKa de 10.6 y el coeficiente de partición de octanol-agua: 6,000:1 a pH 7. Las cápsulas blandas de gelatina para administración oral de marinol contienen 2,5 mg o 10 mg. Está aprobado para la caquexia/anorexia por VIH y las nauseas por quimioperapia. Nabilona: Es un cannabinoide con utilidad terapéutica como antiemético. En Canada, Estados Unidos, Reino Unido, México y Argentina se comercializa con la marca de fantasía Cesamet. Fue aprobado en 1985 por la FDA para el tratamiento de la nausea y vómitos inducidos por quimioterapia que no responden a los antieméticos convencionales, o para tratar las llamadas “nauseas tardías”. Se comenzó a comercializar en Estados Unidos en 2006, cuando se aprobó para el uso en el tratamiento de la anorexia de pacientes con VIH. Como indicación of-label es utilizada como terapia adyuvante el manejo del dolor crónico. Farmacodinamia de los cannabinoides. Receptores Cannabinoides. Dos tipos de receptores cannabinoides (CB1 y CB2) han sido claramente identificados y ambos son miembros de la superfamilia de receptores acoplados a proteína G. El RCB1 se expresa primariamente en el cerebro y la médula espinal. La distribución es heterogénea con mayores densidades en los ganglios basales, el hipocampo y el cerebelo, con comparativamente menos receptores en el tallo encefálico. Los receptores CB1 son los receptores acoplados a proteína G más abundantes del cerebro. Al estar acoplados de forma predominante a proteínas G inhibitorias, su activación inhibe ciertos canales de entrada de calcio, activan canales de salida de potasio y activan varias proteínas activadas por mitógeno, MAP kinasas. Esto último se relaciona con la modulación de la plasticidad sináptica, migración celular, y remodelación de neuritas. Los receptores CB1 se localizan en las terminales de neuronas periféricas y centrales. Generalmente su activación hiperpolariza las neuronas e inhibe la liberación de neurotransmisores exitatorios. El receptor CB2 es predominantemente expresado en células del sistema inmune y hematopoyético pero también está presente en las células no parenquimatosas del hígado, páncreas endócrino y hueso. Algunos receptores CB2 también son funcionalmente expresados en el SNC, en microglias. La activación del receptor CB2 altera la liberación de citoquinas del sistema inmune y participa en la regulación de la función inmune. Endocannabinoides: Paralelamente al descubrimiento de los receptores cannabinoides, fueron identificadas sustancias endógenas que se unen y activan estos receptores (endocannabinoides). Los dos mejor caracterizados son la araquidonoiletanolamina (AEA o anandamida) y el 2-araquidonoilglicerol (2AG), pero hay otros supuestos endocannabinoides. En contraste con los neurotransmisores convencionales, los endocannabinoides no son almacenados en vesículas, se producen a demanda por medio de un clivaje de lípidos precursores de membrana y luego son liberados. Una vez formados en la terminal post-sináptica en respuesta a la actividad o liberación de neurotransmisores de la terminal pre-sináptica, los endocannabinoides actúan como mensajeros retrógrados, difundiendo a través de la sinapsis y señalizando a la neurona pre-sináptica a disminuir la actividad o liberación de neurotransmisores. Estos efectos están implicados en la modulación de la plasticidad sináptica tanto a corto como a largo plazo, eventos integrales al remodelamiento de las redes sinápticas del SNC, así como fundamentales en procesos como el aprendizaje y la memoria. Son los ligandos naturales de los receptores del SCE . Investigaciones llevadas a cabo en nuestro país, en la Universidad de Córdoba, demuestran que el sistema endocannabinoide puede ser modulado por la ingesta de ácidos grasos poliinsaturados ya que dichos ácidos son precursores de los endocannabinoides. Se reconocen actualmente 4 tipos: Araquidonoiletanolamina (anandamida o AEA) Fue identificada en 1992 en el laboratorio de Raphael Mechoulam. Se deriva del ácido araquidónico. Tiene una potencia similar al THC sobre el RCB1, más allá de que su estructura química sea diferente, y se encuentra en casi todos los tejidos de una amplia gama de animales. Es agonista parcial del RCB2 y agonista del receptor vainilloide 1 (TRPV1) La AEA se produce mediante la hidróilsis, catalizada por la fosfolipasa D, de un precursor fosfolipídico presente en la membrana celular, el N-araquidonilfosfatidiletanolamina. Este compuesto sirve como depósito de almacenaje para la AEA que va a ser sintetizada y liberada en el momento en que exista una necesidad de la misma. La vida media de la AEA es muy corta ya que es recaptada rápidamente por un transportador de gran afinidad, denominado ANT, aún no caracterizado molecularmente. 2-araquidonoilglicerol (2-AG) Se une tanto al RCB1 como al RCB2 con similar afinidad, actuando como agonista pleno en ambos. Está presente en concentraciones significativamente más altas en el cerebro que la AEA. La ruta de síntesis del 2-AG posiblemente sea una lipasa que convierte el diacilglicerol en este endocannabinoide. Luego es recaptada por el mismo transportador de AEA y degradado por la actuación de una monoacilglicerol lipasa. 2-araquidonilglicerileter (noladín éter) Fue aislado en 2001 este tercer tipo de endocannabinoide del cerebro porcino. Se une primariamente al RCB1 y débilmente al RCB2, causando sedación, hipotermia y antinocicepción suave en ratones. N-araquidonoildopamina (NADA) Se une preferentemente a RCB1, y como la AEA es agonista del receptor vainilloide 1 (TRPV1) O-araquinoiletanolamina (OAE) Es una agonista pleno de RCB2 y parcial de RCB1 siendo antagonista in vivo. Función regulatoria de los endocannabinoides en el sistema nervioso: Señalización retrógrada. Sus sitios de acción donde los RCB están densamente concentrados en las terminales axonales en las zonas desde donde son liberados los neurotrasmisores convencionales. El SCE permite que la célula postsináptica controle el propio tráfico sináptico ingresante. Por ello el efecto último sobre la célula que libera los cannabinoides va a depender de la naturaleza del neurotramisor convencional que está siendo controlado. Si es una terminal gabaérgica va a haber un incremento en la exitabilidad de la célula postsináptica que produce los cannabinoides. Al contrario, si es una vía glutamatérgica, el efecto neto va a ser de reducción de la excitabilidad de la célula póstsináptica liberadora de cannabinoides. Como son moléculas hidrofóbicas no pueden viajar largas distancias en un medio acuoso que rodea las células de las que son liberados, y actúan localmente en células vecinas. Usos actuales y potenciales de los cannabinoides en neurología. De forma resumida, del análisis de los efectos fisiológicos, el estímulo de los receptores cannabinoides puede dar lugar a: sensación de euforia, sedación y relajación; alteraciones de la percepción temporal y de la memoria reciente, acciones sobre el tono muscular y la actividad motora; actividad analgésica y antiinflamatoria; actividad orexígena y antiemética; disminución de la presión intraocular; hipotermia; broncodilatación; efectos inmunomoduladores: efectos antiproliferativos; efectos cardiovasculares (hipotensión y taquicardia) y neuroendócrinos (disminución de hormonas sexuales e incremento en la liberación de hormonas relacionadas con la respuesta al estrés), estos dos últimos solo en individuos no habituados. Su uso en neurología reviste interés, además del tratamiento de síntomas, por la actividad protectiva y reparativa del SCE. Los cannabinoides han demostrado efectos neuroprotectivos e incluso neurorregenerativos en diversos ensayos preclínica. Como se revisa más adelante, estos efectos neurorregenerativos a nivel hipotalámico sustentarían el efecto antidepresivo. La depresión es una manifestación común en los pacientes en rehabilitación por traumatismo encéfalocraneano y raquimedular o ictus, enfermedades de alta prevalencia. El informe de la OMS/OPS presentado en el 2008 titulado “Trastornos neurológicos: desafíos para la salud pública” precisó que trastornos neurológicos como la epilepsia, la Enfermedad de Parkinson, la de Alzheimer, Ictus y las otras condiciones que son causa de impedimentos y secuelas neurológicas ya representan más del 6% de la carga global de enfermedad. Cincuenta millones de personas en todo el mundo sufren de epilepsia, y las proyecciones indican que las cifras de individuos afectados por demencia se duplicarán cada 20 años. Y esas cifras aumentarán sobre todo en los países en vías de desarrollo, como Argentina, donde además los servicios de rehabilitación son escasos. Aseguran que si no se actúa en forma inmediata y a escala global, la carga futura de enfermedades neurológicas puede llegar a ser un problema incontrolable y pasar a constituir una de las más grandes amenazas para la salud pública mundial. Cannabinoides y dolor crónico La activación de los receptores CB1 conduce a la acción selectiva en el procesamiento de los estímulos nociceptivos, ambos en la médula espinal y en el núcleo ventroposterolateral del tálamo. Este mecanismo está dado por los receptores que se localizan en las terminales nerviosas, lo cual es indicativo de que su función presináptica es de un neuromodulador en la liberación de neurotransmisores. De esta forma, el efecto analgésico se debe a la influencia que ejercen en la inhibición presináptica y en la modulación de la señal de la neurona y su subsecuente comunicación con otras neuronas. La estimulación agonista de los receptores CB1 y CB2 activa diversos caminos de transducción mediados por la proteína G. La estimulación de los receptores inhibe la movilización del calcio, lo cual se lleva a cabo a través de su receptor CB1 inhibiendo negativamente a la adenilciclasa y a la liberación de neurotransmisores. Los receptores CB1 son 10 veces más abundantes que los receptores mu opioides, estos últimos responsables de los efectos de la morfina. Es probable que los agonistas del receptor CB1 puedan ser más efectivos que los opioides en supresión del dolor causado por lesión nerviosa (dolor neuropático). Esta clase de dolor es evocado en parte por descargas espontáneas anormales de fibras mielinizadas gruesas (fibras Aß y Ad). Los canabinomiméticos han demostrado reducir la hiperalgesia y la alodinia en el modelo de la formalina asociado a un daño neuronal persistente. Un ensayo clínico del 2006 doble ciego, controlado con placebo y cruzado demostró que el cannabinoide sintético Nabilona redujo significativamente el dolor asociado a la espasticidad. Se realizó sobre 13 pacientes, de los cuales 11 completaron el estudio. En la escala de dolor 11-PointBox se explicitó un significativo decremento del dolor bajo nabilona (p < 0,05), mientras la espasticidad, la función motora y las actividades de la vida diaria no cambiaron. Cinco pacientes reportaron efectos adversos: debilidad transitoria de los MMII (fase de nabilona, abandonó el estudio), tres somnolencia leve (dos en nabilona, uno en placebo) y uno suave disfagia (en placebo). Un paciente fue excluido del estudio debido a un relapso agudo de esclerosis múltiple (fase de nabilona, abandonó). Los autores concluyen que 1mg de nabilona por día probó ser una opción segura y fácilmente aplicable en el cuidado de pacientes con dolor asociado a espasticidad causada por síndrome de neurona motora superior de difícil tratamiento. Nuevas investigaciones preclínicas sobre dolor neuropático y cannabinoides. A la fecha es variada la evidencia que indica que la analgesia que produce el analgésico común paracetamol esta mediada por el SCE. Se debería a la activación indirecta de los receptores cannabinoides CB1. En el cerebro y en la médula espinal, el paracetamol, a continuación de la desacetilación a su amina primaria (p-aminofenol), se conjuga con ácido araquidónico por medio de la enzima hidrolasa de amida de ácidos grasos (FAAH). El resultante es N-araquidonoilfenolamina, un compuesto conocido como AM404, potente inhibidor del transportador de araquidoniletanolamida (AEA), el principal cannabinoide endógeno. La N-araquidonoilfenolamina además es agonista en los receptores TRPV1 y por otro lado la inhibición de la recaptación de araquidoniletanolamida (AEA), lleva a niveles aumentados de cannabinoides endógenos. En un ensayo en ratas con hot plate, el efecto analgésico del paracetamol se previene con dos antagonistas de los receptores CB1 (AM281 y SR141716A) a dosis que previenen la actividad analgésica del agonista CB1 HU210. Esta abolición del efecto analgésico provocada por el bloqueo a los receptores cannabinoides orientaba hacia el SCE como sistema que media el efecto analgésico del paracetamol. De esta manera podemos inferir que el paracetamol es un pro-farmaco, logrando analgesia por medio del agonismo indirecto cannabinoide. Según investigaciones realizadas con animales en la Facultad de Medicina de Dartmouth en New Hampshire, EE.UU., tras una agresión quirúrgica es necesaria la señalización endocannabinoide vía receptores cannabinoides para limitar la hipersensibilidad del comportamiento y la señalización proinflamatoria de los astrocitos. Los autores sugieren "que las estrategias terapéuticas destinadas a mejorar la señalización endocannabinoide pueden evitar que los pacientes quirúrgicos desarrollen dolor persistente o crónico." Investigadores de la Universidad de Frankfurt, Alemania, han estudiado el mecanismo de acción del R-flurbiprofeno en el dolor neurológico. Han visto que inhibe la enzima amidohidrolasa de ácidos grasos (FAAH), responsable de la degradación de la anandamida. Llegan a la conclusión de que R-flurbiprofeno "mejora los mecanismos endógenos regenerando la estabilidad después de una lesión axonal y mitigando el dolor neurológico crónico mediante la modulación del SCE". Estudios llevados a cabo en la Universidad de Modena y Reggio Emilia (Italia) apoyan la evidencia de que el ácido acetilsalicílico (aspirina) y los cannabinoides actúan de forma sinérgica en la reducción del dolor. Para ello los autores utilizaron el cannabinoide sintético HU210. En dicha interacción participan receptores de la serotonina y de los cannabinoides. Concluyen afirmando que "la combinación a dosis baja de cannabinoides y AINEs puede ser interesante desde el punto de vista terapéutico." También es interesante revisar los estudios llevados a cabo en la Universidad de Miami, EE.UU., el efecto de alivio del dolor del cannabinoide sintético WIN 55,212-2 no provoca desarrollo de tolerancia tras 7 días de tratamiento en un modelo en rata de dolor neurológico por lesión de la médula espinal. Por el contrario, la eficacia de la morfina disminuyó durante el mismo periodo de tratamiento. Cannabinoides y espasticidad En los últimos diez años se han llevado a cabo experiencias en modelos animales con parámetros específicos y muy controlados, sobre enfermedades neurológicas autoinmunes como la EM. Tanto el THC como algunos cannabinoides sintéticos y los endógenos han mostrado efecto antiespástico y sobre el control del temblor. También hay estudios que sugieren que podrían tener algún efecto beneficioso sobre la progresión de la enfermedad. En modelos experimentales de enfermedades autoinmunes del cerebro, la médula espinal y el ojo, se ha observado que la progresión de estas enfermedades es más rápida en los ratones transgénicos sin receptores CB1 (knockaout) que en los controles. La administración de THC y Win-55,212-2 produce retardo en el avance de la enfermedad. La falta de un tratamiento eficaz para la EM ha hecho que muchos pacientes con esta enfermedad buscaran alternativas terapéuticas, sobre todo para aliviar síntomas como la espasticidad. La Sociedad de Esclerosis Múltiple del Reino Unido estima que como mínimo 1.000 de los 85.000 pacientes con EM de este país utilizan marihuana para paliar sus síntomas. También hay descripciones de numerosos casos anecdóticos de pacientes con EM y LM que han referido mejoría de la espasticidad y de otros síntomas con el uso de cannabis. Ensayos clínicos con cannabis y cannabinoides en el tratamiento de la espasticidad El Instituto Catalán de farmacología realizó en 2005 una revisión cualitativa del uso de cannabinoides en espasticidad , en él se analizan los ensayos clínicos realizados con una metodología adecuada hasta ese momento. Posteriormente se han realizado dos ensayos sobre pacientes con EM y dos con LM que también revisamos. Estos ensayos son muy heterogéneos, sobre todo en cuanto al tipo de pacientes incluidos (EM y LM), los preparados cannabinoides y sus dosis, la duración de los tratamientos y la medida de eficacia. Esclerosis múltiple La duración de los estudios analizados en la revisión del Insituto Catalán de farmacología fue muy variable, entre 3 días y 20 semanas. Las variables objetivas de medida de la espasticidad fueron: reflejos tendinosos profundos, resistencia al estiramiento muscular, digit spam y la escala de Ashworth. Las variables subjetivas fueron mejoría de la espasticidad en una escala analógica visual, la evaluación clínica por parte del médico y del paciente y frecuencia de espasmos musculares. En cuatro estudios también se evaluaron variables secundarias de discapacidad, calidad de vida, impresión global, síntomas urinarios y/o movilidad. , La edad de los pacientes fue de 22 a 64 años. El THC por vía oral produjo una mejoría de la espasticidad objetivada también por los investigadores. En dos ensayos, el THC a dosis de 5-25 mg al día y un extracto de cannabis con el mismo contenido de THC, ambos administrados por vía oral, no mostraron eficacia antiespástica medida con la escala de Ashworth, aunque la sensación subjetiva de mejoría de la espasticidad fue favorable según los pacientes. En los estudios en los que se midió la calidad de vida, la movilidad, la mejoría del dolor y la mejoría subjetiva de la espasticidad, los resultados fueron favorables a los cannabinoides. En agosto del 2004 se publico el resultado de un ensayo clínico sobre EM realizado sobre 57 pacientes, con un extracto estandarizado en cápsulas conteniendo 2,5 mg de THC y 0,9 mg de CBD. Se dividió en dos grupos, el A realizó una escala en las dosis de 15 mg hasta un máximo de 30 mg aumentando 5 mg por día si se toleraba, permaneciendo bajo la medicación activa durante 14 días antes de comenzar el placebo. Los pacientes del grupo B comenzaron con placebo por siete días, cruzaron al período activo 14 días y cerraron con un período de tres días de placebo. Las medidas utilizadas en el estudio incluyeron el reporte diarios de frecuencia de espasmos, la escala de Ashworth, el Indice de movilidad Rivermead, la caminata de 10 minutos, el test de los 9 hoyos (nine-hole peg test), test PASAT y el digit span test. El resultado en los 50 pacientes incluidos en el análisis de intensión de tratar, no se objetivó de forma estadísticamente significativa al tratamiento activo comparado con el placebo, pero con tendencia a favorecer el tratamiento activo en relación a la frecuencia de los espasmos, movilidad y mejora del sueño. En los 37 pacientes que recibieron al menos el 90% de la dosis prescripta, mejoras en la frecuencia de los espasmos (P=0,013) y movilidad después de excluir a un paciente que cayó y paro de caminar (P=0,01). Los eventos adversos fueron levemente más frecuentes durante el tratamiento activo, y los síntomas de toxicidad, que fueron en general leves, fueron más pronunciados durante la fase activa. Los autores concluyen que el extracto estandarizado de cannabis sativa puede disminuir la frecuencia de espasmos y aumentar la movilidad con efectos adversos tolerables en pacientes con EM y espasticidad persistente que no responden a otras drogas. Por último en el 2007 se publicó un ensayo clínico sobre la eficacia, tolerabilidad y seguridad de un extracto estandarizado de pulverización orofaríngeo conteniendo 2,7 mg THC y 2,5mg CBD, doble ciego, randomizado, controlado con placebo. Un total de 189 pacientes fueron randomizados para recibir la preparación activa (n=124) o placebo (n=65) durante 6 semanas. El resultado primario era el cambio en la Escala de calificación numeral de la espasticidad (Numerical Rating Scale of spasticity), realizada por el paciente. Los resultados secundarios incluyeron la Escala de Ashworth, y la medida de espasmos. El análisis primario de la eficacia en la población ITT (n = 184) mostró que la preparación activa era significativamente superior (P = 0,048). Las medidas de eficacia secundaria fueron todas favorables a la preparación activa, 40% de los sujetos alcanzaron >30% del beneficio (P = 0,0014). Ocho abandonos fueron atribuidos a eventos adversos; seis en la preparación activa y dos en el placebo. Los autores concluyen que la medicina a base de cannabis puede ser un nuevo agente útil para el alivio sintomático de la espasticidad en EM. Lesiones medulares La espasticidad es un síntoma frecuente de los pacientes que sufren una lesión medular traumática o por otra causa. Aunque las pruebas clínicas sobre la eficacia del cannabis y los cannabinoides en esta indicación son escasas, los resultados sugieren un posible efecto beneficioso, tanto en el tratamiento de la espasticidad como el del dolor (véase: cannabinoides y dolor crónico) En un estudio cruzado, a doble ciego, de 20 días de duración, el THC a dosis alta (35 mg al día por vía oral) mostró un efecto antiespástico objetivo en dos de los cinco pacientes parapléjicos lesionados medulares que se incluyeron. Se realizó un estudio open label en 2007 para determinar dosificación de futuros estudio randomizado, doble ciego controlados con placebo. En este estudio se comparó la eficacia y efectos adversos de THC oral y THC-hemisuccinato rectal en pacientes con LM. Veinticinco pacientes fueron incluidos en este estudio. La suma del score de espasticidad disminuyó significativamente en el tratamiento activo que duró 6 semanas (P = 0,001). Los autores concluyen que el THC es una droga efectiva y segura para el tratamiento de la espasticidad, y que al menos 15-20 mg por día son necesarios para alcanzar un efecto terapéutico. Por último, se publicó en mayo de este año un estudio realizado en Canadá sobre el efecto de la nabilona sobre la espasticidad en pacientes con LM. El diseño fue doble ciego, controlado con placebo y cruzado. Doce pacientes fueron reclutados (n = 12) con LM y espasticidad. Un sujeto abandonó el estudio por una causa no relacionada. Once sujetos completaron el estudio; la edad promedio fue de 42,36 años; 6 pacientes con tetraplejía y 5 con paraplejía. Los participantes recibieron nabilona o placebo durante 4 semanas. Después, y tras 2 semanas de lavado, se cruzaron al otro medicamento. Los enfermos iniciaron el tratamiento con 0’5 mg de nabilona una vez al día con la opción de aumentarlo a 0’5 mg dos veces al día. Uno de los sujetos se retiró durante la fase de placebo por una estenosis urinaria y 11 completaron el estudio. Los resultados mostraron una disminución significativa en la escala de Ashworth en el grupo muscular mas involucrado (P = 0,003) así también como en el escore total (P = 0,001). Los efectos secundarios fueron leves y tolerables, concluyendo que la nabilona puede ser beneficiosa para reducir la espasticiad en LM, y recomendando ensayos más largos con un período de tratamiento prolongado con opción a incrementar la dosificación. Cannabinoides y movimiento. La integración y relaciones del sistema endocannabinoide y el movimiento es compleja. El ejercicio puede producir cambios en las sensaciones y estado mental caracterizados por ansiólisis, analgesia, sedación y sensación de bienestar. Descubrimientos recientes contradicen la hipótesis de que sólo las endorfinas serían responsables de estos efectos y sugieren que son cambios en la concentración sérica de endocannabinoides y de la actividad de dicho sistema la explicación para algunos de estos fenómenos . Según el boletín del 7 de junio de la IACM, investigaciones realizadas con animal sobre ejercicio voluntario, utilizando una rueda de correr a libre disposición, produjeron un aumento de la densidad de receptores CB1 y del contenido del endocannabinoide anandamida en el hipocampo cerebral. El ejercicio también aumenta la formación de nuevas células nerviosas en el hipocampo. Los científicos concluyen diciendo que su investigación sugiere que "el sistema endocannabinoide en el hipocampo es sensible a los cambios ambientales y sugieren que se trata de un mediador de la plasticidad inducida por la experiencia", y por lo tanto de la adaptación de los procesos en esta región cerebral. Es interesante resaltar que en el seguimiento de 12 meses de la CAMS (Cannabinoids in Multiple Sclerosis Study) se produce una disminución de la espasticidad cuantificable en la escala de Ashworth . Cabe preguntarse si esta disminución cuantificable obedece a una mejora de la capacidad neuroplástica del SNC. Si bien no está claro que los cannabinoides puedan colaborar con efectos neuroplásticos que aumenten la efectividad de la rehabilitación, la disminución de la espasticidad y el dolor neuropático, el control vesical y el descanso nocturno, son todos aspectos que inciden directamente en la calidad de vida del paciente, en su capacidad de integración y relación y por ende en la calidad de su rehabilitación. Otros usos potenciales de los cannabinoides en neurología Investigaciones sobre la función del sistema endocannabinioides como agentes neuroprotectores: Es interesante revisar la neuroprotección mediada por cannabinoides. , , , , , Los agonistas RCB inhiben la transmisión sináptica glutamatérgica, implicada en la exitotoxicidad de células nerviosas y la pérdida de sinapsis. La lesión cerebral dispara la liberación de mediadores nocivos como el glutamato, citoquinas (como el factor de necrosis tumoral-α) y especies reactivas de oxígeno (ROS) que inducen la muerte de neuronas y células gliales. Vasoconstrictores como la endotelina (ET) y tromboxano, también se elevan luego del daño cerebral, y contribuyen, actuando en la vasculatura cerebral local, en el desarrollo de la isquemia. Los agonistas cannabinoides inhiben la liberación de glutamato, ROS, citoquinas, y la actividad de la ET. Algunos terpenos y otros cannabinoides presentes en la planta que no se unen a los RCB también han demostrado ser neuroprotectivos, por ser poderosos antioxidantes, y posiblemente por mecanismos aún no dilucidados completamente como la acción directa sobre el sistema glutamatérgico, o el aumento de afinidad y potencia de otros cannabinoides ligandos de los RCB. Todos estos mecanismos de los endocannabinoides contribuyen a la cerebroprotección. En Italia, investigadores han comparado los niveles en sangre de 10 pacientes con accidente cerebrovascular agudo dentro de los seis horas después del comienzo de los síntomas comparado con 8 sujetos controles, comprobando que el nivel del endocannabinoide anandamida fue significativamente mayor en los primeros. Se encontró una correlación positiva entre los niveles sanguíneos de anandamida y el volumen de la lesión, indicando que la síntesis y liberación de anandamida es un mecanismo para mitigar la lesión celular. En un estudio realizado en la Universidad de Leipzig, Alemania, se determinaron las concentraciones séricas de los endocannabinoides anandamida (AEA), 2-araquidonil-glicerol (2AG) y oleoiletanolamida (OEA) a 20 pacientes con apnea del sueño y 57 controles sanos. En los enfermos con apnea del sueño la concentración séricas de OEA se duplicó en comparación con los controles. Los investigadores concluyen diciendo que las altas concentraciones de OEA "podrían interpretarse como mecanismo neuroprotector frente a factores de estrés oxidativo crónico y para aumentar la vigilia en pacientes con insomnio nocturno e hipersomnolencia diurna." Estudios realizados en la Universidad Tor Vergata de Roma, Italia, los niveles de anandamida en el líquido cefalorraquídeo de pacientes con enfermedad de Parkinson son más del doble comparado con los controles sanos. Después de un tratamiento crónico con levodopa estos niveles se normalizan. Los científicos destacan que "el anormal aumento de la anandamida podría reflejar un mecanismo compensatorio que se establece en el curso de la enfermedad de Parkinson destinado a normalizar la disminución de dopamina". Estos datos tienen un indudable interés para el tratamiento tanto de episodios agudos de neurodegeneración (ictus cerebral y trauma), previniendo el daño inicial, mejorando la resolución de la zona de penumbra y la recuperación posterior. Estos efectos también también se comprueban en modelos animales de encefalopatía hipóxica isquémica perinatal. Este devastador cuadro de asfixia perinatal es la causa más frecuente de lesión cerebral en recién nacidos, y los recursos para la prevención y el tratamiento del daño cerebral posterior a la asfixia continúan siendo muy limitados en la práctica clínica. También se han sugerido como posibles herramientas terapéuticas en enfermedades neurodegenerativas crónicas como el Parkinson, Huntington o Alzheimer. La enfermedad de Alzheimer (AD) es la principal causa de demencia entre los acianos. Se caracteriza por la deposición acelerada de péptido amiloideo (A ) junto con activación microglial en forma de placas seniles. El El 9-tetrahidrocannabinol (THC), inhibe competitivamente la enzima acetilcolinesterasa (AChE), previniendo la agregación inducida por AChE del péptido amiloideo, el marcador clave en esta patología. Los cannabinoides se unen al sitio periférico aniónico del la AChE, la zona crítica implicada en la amiloidogénesis, impactando directamente en la progresión de esta enfermedad. Comparados con las drogas prescritas actualmente para el tratamiento de la AD, el THC es un inhibidor considerablemente superior de la agregación amiloidea. Además previenen la activación microglial inducida por A , evitando las cascadas nocivas, como la liberación de factor de necrosis tumoral-α o el estrés oxidativo. El efecto neuroprotector de los cannabinoides en la AD implica adaptaciones a corto plazo a stress neuronal, como limitar la exitotoxicidad, así como adaptaciones a largo plazo, como aumentar la neurogénesis, estimulando la transcripción de factor neurotrópico derivado del cerebro (brain-derived neurotrophic factor). Reducirían el stress oxidativo, neuroinflamación (reduciendo la transcripción de citoquinas proinflamatorias y aumentando la transcripción de especies antiinflamatorias como la IL-1ra) y apoptosis evocada por el péptido A , al mismo tiempo que promueven los mecanismos de reparación intrínsecos del SNC. Según una revisión realizada por científicos de la Facultad de Medicina de la Universidad de Washington, EE.UU., ya hay disponible suficientes datos científicos para respaldar la realización de ensayos clínicos con cannabis en la esclerosis lateral amiotrófica (ELA). Señalan que "los datos preclínicos indican importantes efectos antioxidantes, anti-inflamatorios y neuroprotectores del cannabinoides", los cuales pueden ser útiles para retrasar la progresión de la enfermedad. En los últimos años se han llevado a cabo varios estudios con animales que demuestran que los cannabinoides podrían tener un efecto retrasante en la aparición de la enfermedad y mejora en la supervivencia. Por ejemplo, un cannabinoide sintético que se acopla selectivamente al receptor CB2 demostró prolongar la supervivencia en un estudio realizado en 2007. La inyección a ratones diaria del AM-1241, agonista selectivo de los CB2, aumentó el tiempo de supervivencia a partir del inicio de la enfermedad en un 56 por ciento. En un estudio de 2006 la administración a los animales de un cannabinoide sintético (el WIN 55,212-2) y la inhibición de la degradación de los endocannabinoides retrasó la aparición de la enfermedad sin afectar el tiempo de supervivencia. Además, el cannabis tiene muchas propiedades que pueden ser útiles en el tratamiento sintomático de la ELA. Incluyen analgesia, relajación muscular, broncodilatación, reducción salival, estimulación del apetito e inducción del sueño, y de forma anecdótica es utilizado por muchos enfermos de ELA. Los investigadores declaran que "los ensayos clínicos con cannabis son el siguiente paso lógico, como modificador del curso de la enfermedad y como tratamiento sintomático. Basándonos en los datos científicos disponibles actualmente, es razonable pensar que el cannabis podría retrasar de manera significativa la progresión de la ELA, lo que podría aumentar la expectativa de supervivencia y reducir sustancialmente la carga global de la enfermedad". Como agentes neurorregeneradores: Estudios en ratas demostraron un efecto neurorregenerativo de los cannabinoides. , El giro dentado del hipocampo en el cerebro de mamíferos adultos contiene células madre nerviosas (NS/PCs) capaces de generar nuevas neuronas. Los agonistas CB1 catalizarían el desarrollo de nuevas células nerviosas en esta zona, implicada en la memoria y el comportamiento. El uso crónico pero no agudo de un agonista cannabinoide (HU210) favoreció la proliferación de células nerviosas en el hipocampo produciendo un efecto ansiolítico y antidepresivo. Otras drogas lícitas e ilícitas analizadas hasta el momento (nicotina, cocaína, alcohol, opiáceos) disminuyen la neurogénesis en el hipocampo del adulto. Los cannabinoides serían la única droga ilícita capaz de incrementar el número de neuronas, y esto se relacionaría con efectos ansiolíticos y antidepresivos. También disminuye la inflamación y mejora la memoria en ratas de edad avanzada, y atenúa los efectos del envejecimiento en relación a neuroinflamación y la neurogénesis. En el hipocampo de estas ratas también produjo formación de nuevas neuronas. Asimismo el sistema cannabinoide ha demostrado ser una potencial vía terapéutica para el tratamiento de desórdenes relacionados con la ansiedad y stress post-traumático en modelos animales , , y en un ensayo clínico comorbilidades que se deben tenerse en cuenta en lesionados medulares, traumatizados craneoencefálicos y accidentes cerebrovasculares. Cannabinoides como suplemento. Al contrario de la inmensa mayoría de los fármacos y drogas recreativas, los cannabinoides botánicos tienen una toxicidad notablemente baja para células y órganos saludables. No se ha alcanzado la dosis letal para dichos compuestos, y se postula que no es posible alcanzarla. Los efectos adversos, de carácter leve, devienen en su mayoría de su psicoactividad y pueden traducirse en disforia, amnesia, alteraciones motoras o de la percepción y otros efectos adversos cognitivos o alteraciones del sistema nervioso autónomo. Si bien se sigue buscando cannabinoides no psicoactivos, es muy interesante que el uso regular desarrolle tolerancia a ellos y disminuya su incidencia. El SCE tiene la función de mantener la homeostasis/homeocinesis, jugando un rol central en la regulación del apetito, control de la ansiedad, presión arterial, masa ósea, reproducción y control motor entre otras funciones del organismo. En los estudios realizados con ratones genéticamente modificados que no expresan elementos propios del sistema endocannabinoide se producen muerte prematura y fallas en la adaptación al entorno. Hoy se especula que uno de los orígenes de determinadas enfermedades –incluyendo migraña, fibromialgia, síndrome del colon irritable y otras enfermedades cuyos síntomas clínicos son aliviados por el cannabis- se debe a una alteración o deficiencia del SCE. La administración de cannabinoides exógenos botánicos supliría la carencia constitutiva. Este concepto ya ha llegado al periodismo de divulgación. Conclusiones Porque la kinesiología es una disciplina relativamente nueva dentro de las ciencias de la salud, debemos estar actualizados. La perspectiva kinésica viene desde una visión global de la salud del individuo, siempre basada en la evidencia científica, y bajo esta mirada los cannabinoides aparecen como una herramienta útil en el tratamiento de síntomas neurológicos. No pueden obviarse desde la perspectiva académica y de investigación, ya que los mismos pacientes han comenzado a utilizarlos por haber comprobado empíricamente que generan alivio. La experiencia clínica bien controlada se desarrolla lentamente, pero los casos anecdóticos de sus usos medicinales se reproducen imparablemente en la historia antigua y contemporánea. Por ello también interesa darle un marco formal a la investigación sobre su eficacia, sea en la espasticidad u otros parámetros, aunque la pregunta más importante a contestar en los años por venir es si realmente pueden mejorar la calidad de vida de los pacientes. Como con cualquier otro tratamiento sintomático, el tratamiento de la espasticidad debe ser individualizado. Los fármacos utilizados comúnmente para tratarla (baclofeno, la tizanidina, el dantroleno y el diazepam) han mostrado eficacia antiespástica pero los ensayos clínicos son escasos, con pocos pacientes, con cortos períodos de seguimiento, sin uniformidad en las variables analizadas y con resultados poco relevantes desde un punto de vista clínico. Efectos indeseados de estos fármacos, como somnolencia, alteraciones motoras, hipotonía y la debilidad muscular, pueden interferir o empeorar la autonomía del paciente, no siendo del todo satisfactorias. En los pacientes con esclerosis múltiple, y en los lesionados medulares por causa traumática o por otras causas, la espasticidad es un síntoma frecuente. La finalidad de su tratamiento es reducir el exceso del tono muscular en las extremidades afectadas con el objetivo de incrementar la capacidad funcional del paciente y reducir la incomodidad. Actualmente hay pruebas preclínicas y clínicas suficientes para afirmar que los cannabinoides exógenos y endógenos disminuyen la espasticidad y que estos efectos están mediados por los receptores cannabinoides CB1 y CB1. Aunque hasta el momento no se les había atribuido un papel en el SNC, los receptores CB2 participarían en parte en el control de la espasticidad. Los estudios experimentales en modelos animales de EM y algunos ensayos clínicos sugieren que los cannabinoides exógenos y el sistema endocannabinoide podrían tener un papel en el desarrollo y el tratamiento de la EM. Esta posibilidad abre nuevas alternativas terapéuticas con un mejor perfil de efectos indeseados, como por ejemplo los inhibidores de la degradación de los endocannabinoides o los cannabinoides más selectivos sobre los receptores CB2. No obstante, de momento no hay ensayos clínicos que evalúen su eficacia en el tratamiento de la espasticidad. Aunque no siempre se haya comprobado la eficacia antiespástica según variables objetivas, sí pueden mejorar la sensación de rigidez, el dolor y la calidad del sueño y podrían ser de utilidad en los pacientes que no responden a los tratamientos antiespásticos disponibles que, por otra parte, no han mostrado tampoco una clara eficacia. Son necesarios ensayos clínicos metodológicamente correctos y de larga duración con un número suficiente de pacientes, que evalúen la eficacia del cannabis y los cannabinoides en el tratamiento de la espasticidad. Estos estudios deberían incluir variables secundarias para evaluar los síntomas urinarios, el temblor y el dolor, así como variables de calidad de vida y de evaluación de las actividades de la vida diaria. En la actualidad hay en marcha varios estudios que cumplen estos criterios metodológicos. Será necesario esperar sus resultados para definir el posible lugar en terapéutica del cannabis y sus derivados en el tratamiento sintomático de la espasticidad, y otros síntomas neurológicos. APENDICE Protocolo de ensayo clínico con cannabinoides para tratar espasticidad en lesionados medulares. El propósito fundamental de un ensayo clínico es determinar si un fármaco es bueno o no para el tratamiento de determinada enfermedad y proveer una evidencia sólida sobre la validez de los resultados. Para evitar sesgos se han diseñado los ensayos comparativos, controlados, aleatorizados y doble ciego. La validez dependerá de la precisión estadística y del grado de representatividad de la muestra seleccionada. El sustento racional para la ejecución de un ensayo clínico se resume en cuatro aspectos: a) buena chance de obtener resultados positivos (experimentación clínica y preclínica); b) Investigación de una práctica que si bien está aceptada no ha sido rigurosamente evaluada; c) Pérdida o escasa eficacia de los tratamientos utilizados hasta el momento. d) evaluación en mayor profundidad de regímenes de uso (toxicidad, farmacocinética). Actualmente los cannabinoides en diversas formas se hallan en fase II, III y IV. Consideraciones para el diseño de un ensayo clínico. La fundamentación y presentación de los objetivos de la investigación, preparación de formularios para la recolección de datos. Protocolo pormenorizado para la evaluación por el comité de bioética. Variables a tener en cuenta: a) criterio respecto del conocimiento sobre el tipo de tratamiento que reciba el paciente. b) configuración de los grupos a tratar. c) de que manera se constituirá el grupo control. d) Cuál es el valor delta, cual nivel de diferencia entre fármacos es considerada clínicamente significativa. e) Cuales serán las escalas de eficacia con que trabajaremos: semicuantitativa (escala de Ashwort, Escala de Penn), cuantitativa (VAS). f) de que manera se recogerán los efectos adversos para el análisis de la inocuidad. Lineamientos éticos: “Nunca será ético actuar en pos de un propósito que no es el de aquellos que no tienen poder” Oscar Botasso. a) El proyecto debe ser sólido científicamente, debe ser una pregunta concreta y un diseño correcto que la responda. b) Debe sopesar siempre riesgo/beneficio. c) Debe mantenerse la confidencialidad. d) Profunda autocrítica del investigador ante cualquier forma de presión sobre el paciente para que participe del estudio en pos de un bien mayor. e)En el caso de que los participantes del ensayo sean personas carenciadas debe evitarse los sesgos de la selección desigual de candidatos y el abuso, entendido como la selección del investigador por razones ajenas a lo científicamente correcto. Consentimiento Escrito Informado (CEI) La comisión de revisión presta especial atención a como fue preparado el CEI: a) debe explicar al participante que se trata de una investigación, poniéndolo al tanto de los posibles riesgos y beneficios. b) describir los procedimientos del estudio y la duración del mismo. c) Referir posibles incomodidades. d) Indicar que tratamientos adicionales o alternativos existen al presente. e) especificar que medidas se adoptarán de observarse toxicidad y a quién contactar de producirse dicha eventualidad. f) asegurar la confidencialidad de los datos. g) indicar que la participación es voluntaria y puede retirarse en cualquier momento del estudio sin que ello afecte su derecho de ser tratado y controlado por su enfermedad. h) aclarar que será notificado ante cualquier información que surja sobre el tratamiento administrado que pueda afectar su decisión de seguir siendo tratado en el estudio. i) mencionar si existen circunstancias por las cuales sería excluido y que actitud se tomará al respecto. La documentación a evaluar por el comité de ética de tal manera es: A) Protocolo y modificaciones posteriores si las hubiera. B) Nota de invitación del laboratorio al responsable del centro. C) Curriculum Vitae del investigador principal. D) Curriculum Vitae de los co-investigadores. E) Declaración de los investigadores respecto de su aceptación a ser integrantes del grupo. F) Formulario CEI que deberá firmar el paciente. G) Certificación de los valores normales de laboratorio con firma del director. H) Antecedentes del fármaco (Drug Investigator Brochure). I) Seguro para cubrir riesgos eventuales. J) Formulario para comunicación de efectos adversos. Los contenidos de un protocolo de ensayo clínico: 1. Título: Eficacia de los agonistas cannabinoides en la espasticidad por LM 2. Sitio de realización: Ilar, hospitales públicos, centros de APS, clínicas. 3. Investigadores: Médico Clínico, Farmacólogo, Kinesiólogo. 4. Comité de revisión institucional: Ministerio de salud Nacional-Provincial/UNR/UNSAM-FGR 5. Resumen: véase información previa. 6. Justificación: véase información previa. 7. Objetivos: Evaluar la eficacia antiespástica del cannabinoides sintético nabilona. 8. Definición del paciente: Criterios de inclusión: Pacientes con lesión medular de 18 a 65 años, lesión C5 e inferiores (ASIA A-D), de un años de evolución o más. Deben tener un nivel de lesión estable y con espasticidad moderada (Ashworth menor o igual a 3) sin alteraciones cognitivas. Criterios de exclusión: enfermedad cardíaca, historia de desórdenes psicóticos, sensibilidad previa a la marihuana u otros agentes cannabinoides, disfunción hepática severa, deterioro cognitivo, enfermedad grave en otra área del cuerpo, embarazo o amamantamiento, historial de drogadependencia, uso de cannabis menos de 30 días antes del estudio o que no quiera dejar de consumir durante el estudio, o tienen contracturas tendinosas fijas. 9. Diseño del estudio y definición del tratamiento: Doble ciego, asiganción aleatoria y cruzada, controlado con placebo. Recibirán o el agente activo o el placebo ( 0,5 mg por día con opción a incremetar a 0,5 mg dos veces por día) durante un período de cuatro semanas de duración con dos semanas de whashout entre ellas. Después del lavado se los pasa al otro tratamiento. 10. Tratamientos concomitantes: La medicación utilizada para tratar la espasticidad no debe sufrir modificaciones por al menos 30 días antes de la inclusión, ni haber recibido inyecciones de toxina botulínica a menos de 4 meses. 11. Mediciones clínicas y bioquímicas de eficacia y seguridad: La medición primaria será la Escala de Ashworth en el grupo muscular mas implicado, elegido por el paciente y el clínico; las mediciones secundarias serán las Escala de Penn, el promedio de la Escala de Ashworth para ocho grupos musculares de cada hemicuerpo y la Visual Analog Scale para el dolor asociado a la espasticidad. 12. Análisis de datos. 13. Cuestiones administrativas. 14. Consentimiento informado. 15. Comité de revisión institucional o comité de ética. 16. Confidencialidad. 17. Efectos adversos. 18. Firma de los investigadores. Bibliografía principal: - Janet E. Joy, Stanley J. Watson, Jr., and John A. Benson, Jr., Editores. Marijuana and Medicine: Assessing the Science Base, Institute Of Medicine, National Academy Press Washington, D.C. 1999. -Sociedad Española de Investigación sobre Cannabinoides (SEIC), Guía Básica sobre los Cannabinoides, Ministerio del Interior, Delegación del Gobierno para el Plan Nacional sobre Drogas, España, Julio 2002. -The House of Lords (Parlamento del Reino Unido) , Science and Technology Committee, Cannabis: The Scientific And Medical Evidence, 4 Nov 1998. -Grant I., Rael Cahn B., Cannabis and endocannabinoid modulators: Therapeutic promises and challenges, Clinical Neuroscience Research, 2005. -Iversen, Leslie Cannabis and the brain, Journal of Neurology, University of Oxford, Junio del 2003. -Gonzalez R., E. Martin I., Grant. Marijuana. En: Ari Kalechstein, Wilfred G. van Gorp. Neuropsychology and Substance Use State-of-the-Art and Future Directions. Psychology Press, abril 2007. -Tongtong Wang MSc, Jean-Paul Collet PhD MD, Stan Shapiro PhD, Mark A. Ware MBBS MSc, Adverse effects of medical cannabinoids: a systematic review. CMAJ 2008;178(13):1669-78 -Mohamed Ben Amar. Cannabinoids in medicine: A review of their therapeutic potential. Journal of Ethnopharmacology 105 (2006) 1–25. -Oscar Botasso, Lo esencial en investigación clínica, 2º ed. –Rosario: Corpus Libros Médicos y Científicos, 2006. Bibliografía general: Ernest L. Abel, Marijuana - The First Twelve Thousand Years. Springer, 1980. Russo E., Jiang H., Li X.,, Sutto A., Carboni A., Del Bianco, F., Mandolino G., et al. Phytochemical and genetic analyses of ancient cannabis from Central Asia, Journal of Experimental Botany, Vol. 59, No. 15, pp. 4171–4182, 2008 American Medical Asociation, REPORT 3 OF THE COUNCIL ON SCIENCE AND PUBLIC HEALTH (I-09) Use of Cannabis for Medicinal Purposes (Resolutions 910, I-08; 921, I-08; and 229, A-09) Antonio Escohotado. Historia elemental de las drogas. Ed. Anagrama, Barcelona, 1996. Eugenio Zaffaroni, Antonio Escohotado, Silvia Inchaurraga y otros. Las drogas, entre el fracaso y los daños de la prohibición. Ed. CEADS-UNR/ARDA. Rosario 2003 News of the Federal Association of the Pharmaceutical Industry del 4 de mayo de 2010 http://americansforsafeaccess.org/downloads/AMA_Report.pdf http://www.upi.com/Top_News/US/2010/03/24/California-will-vote-on-legalizing-pot/UPI14341269443356/ http://www.lanacion.com.ar/nota.asp?nota_id=806151 E. Montané, A. Vallano, and J. R. Laporte, Oral antispastic drugs in nonprogressive neurologic diseases, Neurology 2004;63:1357-1363. Apuntes de cátedra Psicomotricidad y Neurodesarrollo, Prof. Titular: Silvio Falcolni. AJ Brown, Novel cannabinoid receptors British Journal of Pharmacology (2007) 152, 567–575; doi:10.1038/sj.bjp.0707481; published online 1 October 2007. S E O'Sullivan, Cannabinoids go nuclear: evidence for activation of peroxisome proliferatoractivated receptors Article first published online: 29 JAN 2009. DOI: 10.1038/sj.bjp.0707423 Zhang M, Martin BR, Adler MW, Razdan RK, Tuma RF. Modulation of the balance between cannabinoid CB(1) and CB(2) receptor activation during cerebral ischemic/reperfusion injury. Neuroscience. 2008 Mar 27;152(3):753-60. Epub 2008 Jan 25. Pacher P, Haskó G. Endocannabinoids and cannabinoid receptors in ischaemia-reperfusion injury and preconditioning. Br J Pharmacol. 2008 Jan;153(2):252-62. Epub 2007 Nov 19. Gieringer, D. et al. Cannabis Vaporizer Combines Efficient Delivery of THC with Effective Suppression of Pyrolytic CompoundsJournal of Cannabis Therapeutics, Vol. 4(1) 2004 http://www.haworthpress.com/web/JCANT Gonzalez, Martin, Grant, Marijuana. Neuropsychology and Substance Use, Psychology Press. http://www.druglibrary.org/schaffer/hemp/general/who-index.htm Tongtong Wang, MSc, Jean-Paul Collet, PhD MD, Stan Shapiro, PhD and Mark A. Ware, MBBS MSc, Adverse effects of medical cannabinoids: a systematic review, CMAJ • June 17, 2008; 178 (13). doi:10.1503/cmaj.071178. Frisher M, Crome I, Martino O, Croft P. Assessing the impact of cannabis use on trends in diagnosed schizophrenia in the United Kingdom from 1996 to 2005. Schizophr Res. 2009 Sep;113(2-3):123-8. Epub 2009 Jun 27. Iverson, Leslie. “Long-term effects of exposure to cannabis.” Current Opinion in Pharmacology 5(2005): 69-72. Gertsch J, Leonti M, Raduner S, Racz I, Chen JZ, Xie XQ, Altmann KH, Karsak M, Zimmer A. Beta-caryophyllene is a dietary cannabinoid. Proc Natl Acad Sci U S A. 2008 Jul 1;105(26):9099104. Epub 2008 Jun 23. Cannabidiol: from an inactive cannabinoid to a drug with wide spectrum of action.Rev Bras Psiquiatr. 2008 Sep;30(3):271-80. PMID: 18833429 Zanelati T, Biojone C, Moreira F, Guimarães F, Joca S (December 2009). "Antidepressant-like effects of cannabidiol in mice: possible involvement of 5-HT receptors". British Journal of Pharmacology. do Campos AC, Guimarães FS (August 2008). "Involvement of 5HT1A receptors in the anxiolytic-like effects of cannabidiol injected into the dorsolateral periaqueductal gray of rats". Psychopharmacology 199 (2): A.W.Zuardi, et al, Effects of Cannabidiol in Animal Model Predective of Antipsychotic activity, Psychopharmacology 1991. A.W. Zuardi, Cannabidiol, a Cannabis sativa constituent, as an antipsychotic drug, Brazilian Journal of Medical and Biological Research, Abr 2006. D Koethe, F Schulze-Lutter, The endocannabinoid modulator cannabidiol as an antipsychotic, Pharmacopsychiatry 2005. Morgan CJ, Curran HV (April 2008). "Effects of cannabidiol on schizophrenia-like symptoms in people who use cannabis". The British journal of psychiatry : the journal of mental science 192 (4): 306–7. doi:10.1192/bjp.bp.107.046649. PMID 18378995. Holdcroft A, Maze M, Doré C, Tebbs S, Thompson S. A multicenter dose-escalation study of the analgesic and adverse effects of an oral cannabis extract (Cannador) for postoperative pain management. Anesthesiology. 2006 May;104(5):1040-6. Nurmikko T, Serpell M, et al. Sativex Successfully Treats Neuropathic Pain Characterised by Allodynia: a Randomised, Double-Blind, Placebo-Controlled Trial. Pain. 2007: doi:10.1016/j.pain.2007.08.028M Dain A, Repossi G, Das UN, Eynard AR, Role of PUFAs, the precursors of endocannabinoids, in human obesity and type 2 diabetes. Front Biosci (Elite Ed). 2010 Jun 1;2:1432-47. Ranganathan M, Braley G, Pittman B, Cooper T, Perry E, Krystal J, D'Souza DC. The effects of cannabinoids on serum cortisol and prolactin in humans. Psychopharmacology (Berl). 2009 May;203(4):737-44. Epub 2008 Dec 16. Wissel J, Haydn T, Müller J, Brenneis C, Berger T, Poewe W, Schelosky LD. Low dose treatment with the synthetic cannabinoid Nabilone significantly reduces spasticity-related pain : a doubleblind placebo-controlled cross-over trial. J Neurol. 2006 Oct;253(10):1337-41. Epub 2006 Sep 20. PMID: 16988792 [PubMed - indexed for MEDLINE] Bertolini A, et al, Paracetamol: new vistas of an old drug. CNS Drug Rev. 2006 Fall-Winter;12(34):250-75. A. Ottani, S. Leone, M. Sandrini, A. Ferrari and A.Bertolini The analgesic activity of paracetamol is prevented by the blockade of cannabinoid CB1 receptors, European Journal of Pharmacology, Volume 531, Issues 1-3, 15 February 2006, Pages 280-281. Alkaitis MS, et al. Evidence for a Role of Endocannabinoids, Astrocytes and p38 Phosphorylation in the Resolution of Postoperative Pain, PLoS One. 2010 May 28;5(5):e10891. Bishay P, et al. R-flurbiprofen reduces neuropathic pain in rodents by restoring endogenous cannabinoids. PLoS One 2010;5(5):e10628.) Ruggieri V, et al. The antinociceptive effect of acetylsalicylic acid is differently affected by a CB1 agonist or antagonist and involves the serotonergic system in rats. Life Sci. 2010 Mar 27;86(1314):510-7. Epub 2010 Feb 12. Hama A, et al. Sustained antinociceptive effect of cannabinoid receptor agonist WIN 55,212-2 over time in rat model of neuropathic spinal cord injury pain. J Rehabil Res Dev 2009;46(1):135-43.) Fundació Institut Català de Farmacología, USO TERAPÉUTICO DEL CANNABIS Y SUS DERIVADOS 2004, Espasticidad [http://www.icf.uab.es] http://terapiaocupacional50.files.wordpress.com/2007/12/espasticidad.pdf Zajicek J, Fox P, Sanders H, Wright D, Vickery J, Nunn A et al. Cannabinoids for treatment of spasticity and other symptoms related ton multiple sclerosis (CAMS study): multicentro randomised placebo-controlled trial. Lancet 2003;362:1517Vaney C, et al. Efficacy, safety and tolerability of an orally administered cannabis extract in the treatment of spasticity in patients with multiple sclerosis: a randomized, double-blind, placebocontrolled, crossover study. Mult Scler. 2004 Aug;10(4):417-24. PMID: 15327040. Vaney C. op. cit. Collin C, et al. Randomized controlled trial of cannabis-based medicine in spasticity caused by multiple sclerosis. Eur J Neurol. 2007 Mar;14(3):290-6. PMID: 17355549 Fundació Institut Català de Farmacología, Op. Cit. Hagenbach U, et al. The treatment of spasticity with Delta9-tetrahydrocannabinol in persons with spinal cord injury. Spinal Cord. 2007 Aug;45(8):551-62. Epub 2006 Oct 17. PMID: 17043680 Pooyania S, et al. A randomized, double-blinded, crossover pilot study assessing the effect of nabilone on spasticity in persons with spinal cord injury. Arch Phys Med Rehabil. 2010 May;91(5):703-7. PMID: 20434606 A Dietrich, W F McDaniel Endocannabinoids and exercise Br. J. Sports Med. 2004;38;536-541 doi:10.1136/bjsm.2004.011718 Zajicek, J. (2004) The cannabinoids in MS study – final results from 12 months follow-up. Mult. Scler. 10 (Suppl), S115 Hee Jung Kim, Jonathan J. Waataja, and Stanley A. Thayer, Cannabinoids inhibit network-driven synapse loss between hippocampal neurons in culture, J Pharmacol Exp Ther. Author manuscript; available in PMC 2009 June 1. Raphael Mechoulam,David Panikashvili y Esther Shohami, Cannabinoids and brain injury: therapeutic implications, TRENDS in Molecular Medicine Vol.8 No.2 February 2002. S.Y. Zhuang et al. Cannabinoids produce neuroprotection by reducing intracellular calcium release from ryanodine-sensitive stores. Elsevier, Neuropharmacology 48, 2005. Giovanni Marsicano et al, CB1 Cannabinoid Receptors and On-Demand Defense Against Excitotoxicity, Science vol. 302 Oct 2003. R. Mechoulam and A. H. Lichtman, Stout Guards of the Central Nervous System, Science vol. 302 Oct 2003. E Eljaschewitsch et al, The endocannabinoid anandamide protects neurons during CNS inflammation by induction of MKP-1 in microglial cells. Neuron 2006. A. J. Hampson et al, Cannabidiol and (2)D9-tetrahydrocannabinol are neuroprotective antioxidants Proc. Natl. Acad. Sci. USA Vol. 95, Jul 1998. Naccarato M, et al. Possible Anandamide and Palmitoylethanolamide involvement in human stroke. Lipids Health Dis. 2010 May 14;9:47. Jumpertz R, et al. Circulating Endocannabinoids and N-acyl-ethanolamides in Patients with Sleep Apnea - Specific Role of Oleoylethanolamide. Exp Clin Endocrinol Diabetes 2010 Apr 28. [En imprenta]) Pisani V, et al. Dynamic changes of anandamide in the cerebrospinal fluid of Parkinson's disease patients. Mov Disord 2010;25(7):920-4.) Martínez-Orgado J, Fernández-Frutos B, González R, Romero E, Urigüen L, Romero J, Viveros MP. Neuroprotection by the cannabinoid agonist WIN-55212 in an in vivo newborn rat model of acute severe asphyxia. 1: Brain Res Mol Brain Res. 2003 Jun 10;114(2):132-9. Fernández-López D, Pazos MR, Tolón RM, Moro MA, Romero J, Lizasoain I, Martínez-Orgado J. The cannabinoid agonist WIN55212 reduces brain damage in an in vivo model of hypoxic-ischemic encephalopathy in newborn rats. 1: Pediatr Res. 2007 Sep;62(3):255-60. Kim D. Janda et al, A Molecular Link between the Active Component of Marijuana and Alzheimer's Disease Pathology, Mol. Pharm., August, 2006 Manuel Guzmán, et al, Prevention of Alzheimer’s Disease Pathology by Cannabinoids: Neuroprotection Mediated by Blockade of Microglial Activation, The Journal of Neuroscience, February, 2005. VA Campbell and A Gowran, Alzheimer’s disease; taking the edge off with cannabinoids? British Journal of Pharmacology (2007) 152, 655–662 Carter GT, Abood ME, Aggarwal SK, Weiss MD. Cannabis and Amyotrophic Lateral Sclerosis: Hypothetical and Practical Applications, and a Call for Clinical Trials. Am J Hosp Palliat Care. 2010 May 3. [en imprenta]) Xia Zhang, Wen Jiang, Yun Zhang,Lan Xiao, Cannabinoids promote embryonic and adult hippocampus neurogenesis and produce anxiolytic- and antidepressant-like effects. The Journal of Clinical Investigation, octubre 2005. Aguado T, Stella N, Kokaia Z, Guzman M, et al. The endocannabinoid system drives neural progenitor proliferation. FASEB J. Oct 2005. 1 Marchalant Y., Cerbai F., Brothers H.M., Wenk G.L.: cannabinoid receptor stimulation is antiinflammatory and improves memory in old rats. Neurobiology of aging 2008: 29 (12):1894-1901 Marchalant Y., Brothers H.M., Norman G.H., Karelina K., Devries A.C., Wenk G.L.: cannabinoids attenuate the effects of aging upon neuroinflammation and neurogenesis .. Neurobiol. Dis., 2009 Volume 34, Issue 2, May 2009, Pages 300-307 Jasmeer P Chhatwal, Enhancing Cannabinoid Neurotransmission Augments the Extinction of Conditioned Fear, Neuropsychopharmacology, Nature Publishing Group 2005. Sachin Patel and Cecilia J. Hillard Pharmacological evaluation of cannabinoid receptor ligands in a mouse model of anxiety: further evidence for an anxiolytic role for endogenous cannabinoid signaling, JPET, American Society for Pharmacology and Experimental Therapeutics 2006. Fraser GA: The use of a synthetic cannabinoid in the management of treatment-resistant nightmares in posttraumatic stress disorder (PTSD). CNS Neurosci Ther 2009,15:84-88. D'Souza DC, et al, Blunted psychotomimetic and amnestic effects of delta-9-tetrahydrocannabinol in frequent users of cannabis. Neuropsychopharmacology. 2008 Sep;33(10):2505-16. Epub 2008 Jan 9. http://health.blogs.foxnews.com/2010/03/10/are-you-cannabis-deficient/ Joan-Ramon Laporte, Principios Básicos de la Investigación Clínica, Barcelona, Fundació Institut Català de Farmacologia, actualizado 13 junio 2007. Disponible en: Oscar Botasso, Lo esencial en investigación clínica, 2º ed. –Rosario: Corpus Libros Médicos y Científicos, 2006.