Reacciones redox espontáneas
Anuncio
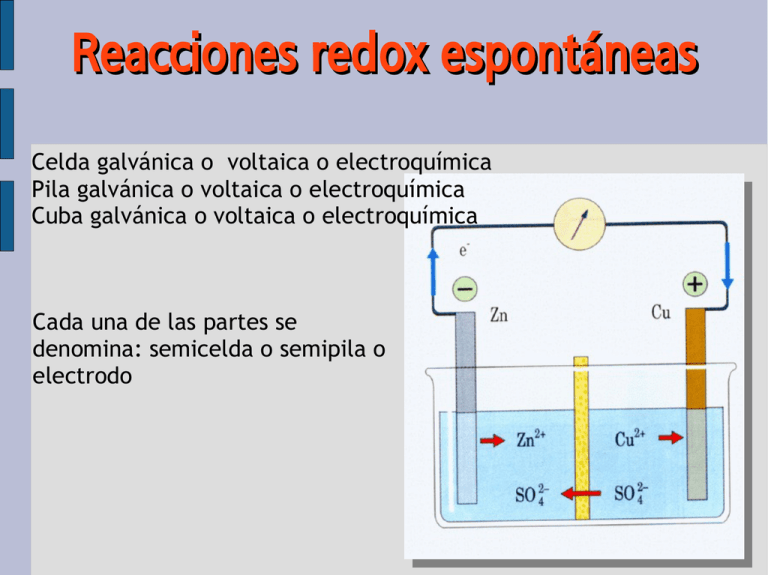
Reacciones redox espontáneas Celda galvánica o voltaica o electroquímica Pila galvánica o voltaica o electroquímica Cuba galvánica o voltaica o electroquímica Cada una de las partes se denomina: semicelda o semipila o electrodo Reacciones redox espontáneas Pila Daniell Reacciones redox espontáneas Notación simplificada Ánodo – puente salino - Cátodo forma reducida | forma oxidada || forma oxidada | forma red Pila Daniell Zn(s) | Zn2+ (1,0 M) || Cu2+ (1,0 M) | Cu(s) Reacciones redox espontáneas Tipos de electrodos Metálico de metal activo. Zn Zn2+ (1M) | Zn(s) Zn2+ (aq) (1 M) Reacciones redox espontáneas Tipos de electrodos Metálico de metal inerte y especies en disolución. Pt Pt | Fe3+ (0,1M) , Fe2+ (0,1M) Fe2+ (0,1 M) Fe3+ (0,1 M) Reacciones redox espontáneas Tipos de electrodos De gases. Pt Pt | H+ (1M) | H2 (1 atm) H+ (1M) H2 (g) (1 atm) Reacciones redox espontáneas Potenciales de electrodo La característica principal de una pila es su voltaje, potencial o fem, que mide la ddp eléctrico entre sus dos electrodos. Este dependerá de las especies químicas redox que se enfrenten formando la pila y de las condiciones en las que se encuentren (concentración, presión y temperatura). Si se trabaja en condiciones estándar (1 M, 1 atm, 25 ºC) la fem de la pila se denomina fem estándar o potencial estándar y se o representa mediante . Para una pila cualquiera: pila = cátodo− ánodo Reacciones redox espontáneas Potenciales de electrodo ¿Cómo medir el potencial de un electrodo aislado? Sólo pueden medirse diferencias de potencial de dos electrodos, es decir, sólo puede medirse el potencial de una pila. Para asignar valores a los potenciales de electrodos se escoge uno como referencia, se le asigna un valor arbitrario y los demás, medidos respecto a este, serán potenciales relativos. La escala de potenciales relativos se basa en tomar como referencia el llamado electrodo estándar de hidrógeno, al que se le asigna un potencial arbitrario de cero voltios (0,00 V). Pt | H2 (1 atm) | H+ (1 M) Reacciones redox espontáneas Electrodo estándar de hidrógeno Es un electrodo de gas, en el que el H2 a 1 atm de presión está en contacto con una disolución de iones H+ en concentración 1 M, y todo ello a una temperatura de 25 ºC. Pt | H2 (1 atm) | H+ (1 M) Según que actúe como ánodo o como cátodo tenemos: Ánodo (-): H2 – 2e- → 2 H+ Cátodo (+) : 2 H+ + 2e- → H2 o =0,00 V o =0,00 V Reacciones redox espontáneas Medida del potencial de un electrodo Se construye una pila con el electrodo estándar de hidrógeno y el electrodo cuyo potencial queremos medir. Se toman dos datos: (1) La fem de la pila. (2) La polaridad del electrodo problema. De (1) se tiene el valor numérico y de (2) el signo. Para el electrodo de cinc y cobre tenemos, respectivamente: Zn(s) | Zn2+(1 M) || H+(1 M) | H2(1 atm) | Pt eo = 0,76 V Pt | H2(1 atm) | H+(1 M) || Cu2+(1 M) | Cu(s) eo = 0,34 V El electrodo de cinc actúa de ánodo y por tanto su potencial es negativo, mientras que el electrodo de cobre hace de cátodo y por tanto su potencial es positivo. Reacciones redox espontáneas Potenciales de reducción Así, los potenciales antes calculados son: o Zn 2 / Zn o 2 Cu /Cu = −0,76 V = 0,34 V Los potenciales de electrodo miden la tendencia de una especie a reducirse frente al hidrógeno (tomado como referencia), son por ello potenciales de reducción. Cuanto mayor sea el potencial de reducción de un electrodo más tendencia tendrá a reducirse, es decir, mayor será su poder oxidante, y viceversa, cuanto menor sea el potencial de reducción de un electrodo (más negativo), más tendencia tendrá a oxidarse, es decir, mayor será su poder reductor. Los potenciales de diversos electrodos, ordenados del más negativo al más positivo, constituyen la llamada serie electroquímica o serie electromotriz. Reacciones redox espontáneas Potenciales de reducción Un electrodo oxidará a todos aquellos que tengan un potencial de reducción menor. Un electrodo reducirá a todos aquellos que tengan un potencial de reducción mayor. La tabla de potenciales puede utilizarse para calcular la fem de una pila formada por cualquier pareja de electrodos y predecir la polaridad de los mismos. Reacciones redox espontáneas Predicción de reacciones redox El proceso de reducción de una semirreacción redox cualquiera: → Red Ox + n e- ← (1) o Cuanto mayor sea su potencial, Ox / Red mayor es la tendencia de la especie Ox a reducirse ganando n electrones y, consecuentemente, menor es la tendencia de la especie Red a oxidarse cediendo n electrones. o El valor de Ox / Red indica en qué extensión la semirreacción (1) está desplazada hacia la derecha. Las especies Ox y Red, que se diferencian en n electrones se denominan par oxidante/reductor conjugados. Cuanto más fuerte sea un oxidante más débil es su reductor conjugado. Reacciones redox espontáneas Predicción de reacciones redox Termodinámicamente, un proceso es espontáneo cuando la variación de entalpía libre DG < 0. La relación existente entre la entalpía libre y el potencial de una pila viene dada por la expresión: G = −n F Si las condiciones son las estándar: G o = −n F o Donde n es el número de electrones intercambiados y F una constante denominada constante de Faraday, que constituye la carga, en culombios, correspondiente a 1 mol de electrones. Reacciones redox espontáneas Corrosión Tipo de reacción redox de efectos indeseados, fundamentalmente sobre el hierro. Se requiere medio acuoso y presencia de oxígeno. Un medio ácido y la presencia de iones disueltos acelera el proceso corrosivo. Para paliar los efectos de la corrosión se proponen tres métodos: Técnica de pasivado: Oxidar la superficie que impida la progresiva oxidación interior. Recubrimientos superficiales: Impedir el contacto entre el hierro y el oxígeno (mediante pintado o recubriéndolo con capas metálicas protectoras -electrodeposición-). Protección catódica: Conectar el metal que se quiere proteger (el hierro) con otro que tenga más tendencia que él a oxidarse. A este metal, que actúa de ánodo, se le denomina ánodo de sacrificio. Reacciones redox no espontáneas Electrolisis Proceso por el que se obliga una reacción redox no espontánea mediante un agente energético externo (que suministra la energía eléctrica necesaria). El fenómeno es contrario al que ocurre en una celda galvánica. o + =−2,71 V Ox: Na – 1e → Na / Na o Red: Cl + 2e → 2 Cl 2 Cl /Cl =1,36 V 2 Na + Cl2 → 2 Na+Cl- Na − 2 2 Na+Cl- → 2 Na + Cl2 eo = – 4,07 V DGo > 0 eo = 2,71 V eo = 1,36 V eo = 4,07 V DGo < 0 No espontánea Esta reacción no espontánea se puede llevar a cabo utilizando una corriente eléctrica que suministre como mínimo esta fem de 4,07 V, con ello se obligará la reducción del catión sodio y la oxidación del cloruro. Reacciones redox no espontáneas Electrolisis La sal (cualquier sal) es un electrolito (sustancia compuesta por iones), y aunque en estado sólido no conducen la corriente eléctrica, sí lo hacen en estado líquido (fundidos o disueltos). Pero esta conducción, a diferencia de la que ocurre en los metales, es una conducción iónica (son los iones los que se mueven y transportan la corriente por el líquido. Cuando hacemos circular una corriente por él lograremos que se produzca una cesión forzada de electrones del anión al catión, produciéndose una reacción química. A este proceso se le llama electrolisis y al recipiente donde se lleva a cabo celda o cuba electrolítica. (+) Ánodo → Oxidación: Cl– – 2e– → Cl2 (–) Cátodo → Reducción: Na+ + e– → Na 2 Na+ + 2 Cl– → 2 Na + Cl2 eo = –1,36 V eo = – 2,71 V eo = – 4,07 V Para forzar la electrolisis del NaCl fundido es necesario utilizar una pila cuya fem sea mayor de 4,07 V. Reacciones redox no espontáneas Electrolisis Reacciones redox no espontáneas Electrolisis Electrolisis del agua La electrolisis del agua es la descomposición del agua en sus elementos por la acción de la corriente eléctrica. Es necesario al menos 1,23 V. (+) Ánodo → Oxidación: 2 H2O – 4e– → O2 + 4 H+ (–) Cátodo → Reducción: 2 H2O + 2e– → H2 + 2 OH– 2 H2 O → O 2 + 2 H 2 eo = –0,81 V eo = –0,42 V eo = – 1,23 V Electrolisis de una sal disuelta en agua Resulta difícil predecir qué reacciones se producirán en los electrodos, ya que en el cátodo, además del catión de la sal, puede reducirse el protón del agua, mientras que en el ánodo, además del anión de la sal, puede oxidarse el hidroxilo del agua. Pero para esto no sólo bastan razonamientos termodinámicos (potenciales) sino que los factores cinéticos pueden resultar determinantes. Reacciones redox no espontáneas Electrolisis Leyes de Faraday Existe una relación definida entre la cantidad de electricidad que pasa por una cuba electrolítica y la cantidad de productos liberados en los elctrodos. Esta relación viene dada por las leyes de Faraday: La cantidad de sustancia liberada (depositada o descargada) en un electrodo es directamente proporcional a la cantidad de electricidad (q) que ha pasado. Para liberar un equivalente gramo de cualquier sustancia se necesita 1 Faraday de electricidad. 1 Faraday (carga de 1 mol de e–) = NA·e = 6,02·1023 mol–1·1,6·10–19 C = = 96485 C/mol ≈ 96500 C/mol








