5. Cinética Electroquímica Aplicaciones - Quimica
Anuncio

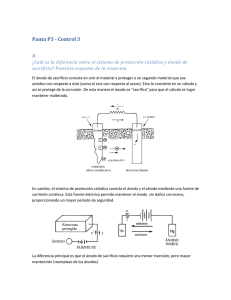
5. Cinética Electroquímica Aplicaciones Acumulación y conversión de energía: Baterías Células de combustible Corrosión: Punto de vista termodinámico de la corrosión Punto de vista cinético de la corrosión Métodos de protección Ira N. Levine, Fisicoquímica (McGraw Hill, Madrid, 2004). Capítulo 14. P. Atkins, J. de Paula, Química Física. (Ed. Médica Panamericana, Madrid, 2008) Cap. 25. T.Engel, P.Reid, Química Física, (Ed. Pearson, Addison-Wesley, Madrid, 2006) Cap. 11. UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 1 Acumulación y conversión de energía Baterías y células de combustible células electroquímicas en las que se explota la posibilidad de convertir energía química en eléctrica o viceversa: • reacción electroquímica → suministro de corriente eléctrica (descarga) • suministro de corriente eléctrica → reacción electroquímica (recarga) están diseñadas para maximizar la potencia de salida y el peso o volumen de la célula (potencia = intensidad de corriente × diferencia de potencial de la célula) baterías: contienen los reactivos necesarios para realizar la reacción electroquímica global. Pueden ser recargables o no recargables Actúan como células galvánicas en la descarga y como célula electrolítica en la recarga. células de combustible: alimentación continua de los reactivos de la reacción global electroquímica (normalmente: H2 o CH4 –combustibles; O2 o aire –oxidante) trabajo continuo sin pausas para la recarga UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 2 Baterías y células de combustible Diferencia de potencial de las baterías y células de combustible células galvánicas operando en circuito cerrado: IRREVERSIBLEMENTE la reacción de cada uno de los dos electrodos ocurre irreversiblemente, pudiendo detectarse sobretensión en cada uno de ellos; en consecuencia la diferencia de potencial de la célula trabajando (E') es MENOR que su fuerza electromotriz (E) (fem=diferencia de potencial de la célula abierta o equilibrada con un potencial externo) E ' = ∆φD − ∆φI D= cátodo; I = ánodo ∆φD = ∆φD,eq +ηD ∆φI = ∆φI ,eq +ηI UAM 2011-12. Química Física I. E ' = E +ηD −ηI (ηD < 0; ηI > 0) E ' = E − ηD − ηI ⇒ E ' < E Cinética Electroquimica Aplicaciones 3 Baterías y células de combustible Otras contribuciones negativas al potencial de la pila E' asociadas a: sobretensión de concentración (variación de conc. en la doble capa) resistencia de la disolución electrolítica: IRdis En la figura se observa la variación del potencial de la pila y de la potencia frente a la densidad de corriente. A valores altos de j la sobretensión de concentración corta el funcionamiento de la pila. UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 4 Baterías: batería de plomo-ácido Batería de plomo-ácido (inventada en 1859) Uso: coches (potencia del orden de 1 kw; capaz de generar un centenar de amperios) Batería recargable (500 – 1500 ciclos de recarga desde una descarga profunda) Electrodos: Pb, PbO2 y PbSO4 ; electrolito: H2SO4 Pb | PbSO4 (s) | H2 SO4 (ac) | PbSO4 (s) | PbO2 (s) | Pb ánodo − Pb(s) + SO42− (ac) → PbSO ( s ) + 2 e 4 ← cátodo PbO2 (s) + 4H + (ac) + SO42− (ac) + 2e− ← → PbSO4 (s) + 2H2O(l ) global Pb(s) + PbO2 (s) + 2H2 SO4 (ac) → 2PbSO4 (s) + 2H2O(l ) → descarga ← carga ← Eo = EDo − EIo = [1.685− (− 0.356)] V = 2.04V Factores limitantes de los ciclos de descarga: estrés mecánico (distinta densidad y estructura de los sólidos obtenidos en la recarga) dilución del electrolito (formación de agua) UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 5 Baterías: batería de plomo-ácido global Pb(s) + PbO2 (s) + 2H2 SO4 (ac) → 2PbSO4 (s) + 2H2O(l ) ← Eo = EDo − EIo = [1.685− (− 0.356)] V = 2.04V UAM 2011-12. Química Física I. → descarga ← carga ×6 Cinética Electroquimica Aplicaciones 6 Baterías: célula alcalina Pilas alcalinas Uso: múltiple NO recargables (uso hasta consumo de reactivos) Electrodos: polvo de Zn (ánodo) y MnO2 + carbón en polvo (cátodo) Electrolito: KOH(ac) (“alcalina”) ánodo Zn(s) + 2OH− (ac) → ZnO(s) + H2O(l) + 2e− cátodo 2MnO2 (s) + H2O(l ) + 2e− → Mn2O3 (s) + 2OH− (ac) global Zn(s) + 2MnO2 (s) → ZnO(s) + Mn2O3 (s) → descarga ← carga Eo = EDo − EIo = [1.1− (− 0.76)] V = 1.86V UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 7 Baterías: células de Ni e hidruro metálico Células de Ni e hidruro metálico (Ni-MH) Uso: batería de vehículos eléctricos e híbridos (38 módulos de 6células de 1.2V/célula → 274V); otros usos Recargables M es un compuesto intermetálico (común: AB5; A= lantánido; B=met. transición) Electrolito: KOH(ac) ánodo cátodo global MH(s) + OH− (ac) ← → M (s) + H2O(l ) +1e− NiOOH(s) + H2O(l) +1e− ← → Ni(OH)2 (s) + OH− (ac) → descarga ← carga MH(s) + NiOOH(s) → M (s) + Ni(OH)2 (s) ← Eo = EDo − EIo = [0.52 − (− 0.83)] V = 1.35V UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 8 Baterías: células de ion Li+ Células de ion Litio Uso: aparatos electrónicos portátiles Recargables Los iones Li+ se extraen y migran de un electrodo para intercalarse en otro (y viceversa) ánodo cátodo global + − CLi x(s) → C ( s ) + xLi + xe ← Li 1−xCoO2 (s) + xe− + xLi+ ← → LiCoO2(s) CLix (s) + Li1−xCoO2 (s) ← → C(s) + LiCoO2 (s) Eo ≅ 3.7 V → descarga ← carga UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 9 Células de combustible Células de combustible de hidrógeno-oxígeno de Bacon Flujo continuado de reactivos: generalmente: H2 y O2 (o aire) Uso inicial: misiones espaciales Apolo a la Luna Ánodo: disociación del H2 y neutralización; cátodo: reducción del O2 Electrolito: KOH(ac) cátodo H2 ( g) + 2OH− (ac) → 2H2O(l ) + 2e− O2 ( g) + 2H2O(l ) + 4e− → 4OH− (ac) global 2H2 ( g) + O2 ( g) → 2H2O(l ) ánodo Eo = EDo − EIo = [0.40 − (− 0.83)] V = 1.23V UAM 2011-12. Química Física I. electrolyte Cinética Electroquimica Aplicaciones 10 Células de combustible Células de combustible de ácido fosfórico Flujo continuado de reactivos: H2 y aire Disociación del H2 en el ánodo y migración a través del electrolito hacia el cátodo Electrolito: H3PO4 (ac) ánodo cátodo global 2H2 ( g) → 4H + + 4e− O2 ( g) + 4H + (ac) + 4e− → 2H2O(l ) 2H2 ( g) + O2 ( g) → 2H2O(l ) UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 11 Células de combustible Células de combustible de membrana de intercambio de protones Flujo continuado de reactivos: H2 y O2 o aire Disociación del H2 en el ánodo y migración a través de la membrana hacia el cátodo; la membrana –polímérica de ac. perfluorosulfónico- impide el paso de aniones en sentido opuesto ánodo cátodo global 2H2 ( g) → 4H + + 4e− O2 ( g) + 4H + (ac) + 4e− → 2H2O(l ) 2H2 ( g) + O2 ( g) → 2H2O(l ) UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 12 Corrosión El oro resiste a la corrosión incluso durante tiempos en la escala geológica. El hierro, en cambio, se corroe. ¿Qué es la corrosión? ¿Por qué ocurre o no? ¿Es un problema termodinámico/cinético? UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 13 Corrosión Punto de vista termodinámico de la corrosión comparación de los potenciales estándar de electrodo de reducción del metal con el de los posibles agentes oxidantes Pepita de oro: Au3+ (ac) + 3e− → Au(s), Eo = 1.50 V expuesta a aire/agua: disolución ácida: disolución básica: (a) (b) (c) 2H+(ac) + 2e− → H2(g) 4H+(ac) + O2(g) + 4e− → 2H2O(l) 2H2O(l) + O2(g) + 4e− → 4OH−(ac) Eo = 0 V Eo = 1.23 V Eo = 0.40 V El oro resiste a la oxidación incluso durante tiempos en la escala geológica porque su potencial de electrodo estándar de reducción es más positivo que el de los agentes externos: El oro se reduce más fácilmente ⇒ su forma reducida Au0 es termodinámicamente estable ante ellos. UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 14 Corrosión: punto de vista termodinámico Punto de vista termodinámico de la corrosión comparación de los potenciales estándar de electrodo de reducción del metal con el de los posibles agentes oxidantes Objeto de hierro: Fe2+ (ac) + 2e− → Fe(s), Eo = −0.44V expuesto a aire/agua: disolución ácida: disolución básica: (a) (b) (c) 2H+(ac) + 2e− → H2(g) 4H+(ac) + O2(g) + 4e− → 2H2O(l) 2H2O(l) + O2(g) + 4e− → 4OH−(ac) Eo = 0 V Eo = 1.23 V Eo = 0.40 V Cualquiera de las reacciones (a)-(c) puede, en principio, provocar la oxidación del hierro porque sus potenciales de electrodo estándar son más positivos que el del hierro. Incluyendo el efecto del pH: Ea= Eao + (RT/F) ln aH+ = (−0.059 V) pH Eb= Ebo + (RT/F) ln aH+ = 1.23V − (0.059 V) pH Los productos de la corrosión del Fe son sólidos escamosos (“el óxido”) que se desprenden del objeto dejándolo expuesto a más corrosión ⇒ Entender la cinética y diseñar métodos de protección UAM 2011-12. Química Física I. Problema 58 Cinética Electroquimica Aplicaciones 15 Corrosión: punto de vista cinético Punto de vista cinético de la corrosión Modelo: hierro + gota de agua (ligeramente ácida o básica) + aire área A (borde externo de la gota; rico en O2 ) área A' (superficie de hierro; lejos del área A) se reduce O2 se oxida Fe velocidad de corrosión: es medida por la corriente de iones Fe2+ que dejan la superficie en la región anódica: Icorr = Ia y es igual a la corriente en la región catódica: Icorr = Ic 1/ 2 Icorr = jA = j ' A' = ( j j ' A A ') = j A donde 1/ 2 1/ 2 j = ( j j ') ; A = ( A A ') usaremos Butler-Volmer para expresar las densidades de corriente en los puntos de oxidación ( j') y de reducción ( j) UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 16 Corrosión Icorr = j A donde 1/ 2 1/ 2 j = ( j j ') ; A = ( A A ') Usaremos ec. Butler-Volmer suponiendo: límite de sobrepotencial alto sobrepotencial de concentración despreciable velocidad determinada por la transferencia de 1 sólo electrón coeficiente de transferencia α = ½ no hay diferencia de potencial entre la zona anódica y la catódica (gota pequeña), por tanto, ∆φ (Fe-discn.) es igual en ambas zonas → diferencia de potencial de corrosión ∆φcorr η = ∆φcorr − ∆φeq ; η ' = ∆φcorr − ∆φ'eq η F / 2 RT ∆φcorr F / 2 RT −∆φeq F / 2 RT j = joe = joe e −∆φcorr F / 2 RT ∆φ 'eq F / 2 RT −η ' F / 2 RT j ' = jo' e = jo' e e La velocidad de corrosión depende de: área de las zonas expuestas 1/ 2 jo = ( jo j 'o ) E = ∆φ 'eq −∆φeq Icorr = A joe F E / 4RT UAM 2011-12. Química Física I. ⇒ protección por pintura y anodización diferencia de potenciales de electrodo de los pares involucrados ⇒ protección con elementosAplicaciones más reductores 17 Cinética Electroquimica Métodos de protección Protección por pintura impermeable: inconvenientes: grietas o defectos provocan el comienzo de la corrosión que se extiende debajo de la pintura Galvanizado (cubrimiento de un objeto de Fe con Zn) Eo(Zn2+/Zn)= −0.76 V Eo(Fe2+/Fe)= −0.44 V • la oxidación del Zn es (termodinámicamente) preferente • los productos de oxidación del Zn forman una capa estable, protectora del objeto UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 18 Métodos de protección Pasivación: protección por óxidos cinéticamente inertes Eo(Al3+/Al)= −1.66 V • Eo(Fe2+/Fe)= −0.44 V los productos de oxidación del Al forman una capa de alúmina, Al2O3, impermeable, protectora del objeto; con frecuencia se cubre un objeto de Al con una capa de alúmina protección de tuberías de acero por ánodos de Al protección de material de escalada de Al por una capa de alúmina por “anodización” UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 19 Métodos de protección Protección catódica a) ánodo de sacrificio: conexión a un bloque de Mg Eo(Mg2+/Mg)= −2.36 V ; debe reponerse cuando se agota protección del casco de un barco con Mg b) por corriente impresa: una celda externa provee los electrones sistema de corriente impresa para la protección de tuberías UAM 2011-12. Química Física I. Cinética Electroquimica Aplicaciones 20