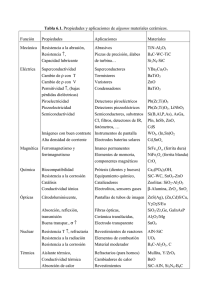
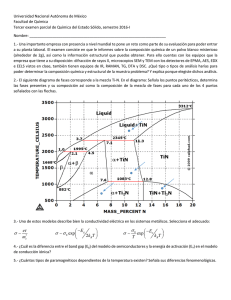
Síntesis y caracterización de Compósitos integrados por BT, y
Anuncio

Universidad de Chile Facultad de Ciencias Químicas y Farmacéutica Departamento de Química Orgánica y Fisicoquímica SÍNTESIS Y CARACTERIZACIÓN DE NANO-COMPÓSITOS DE BaTiO3 MEZCLADOS CON POLÍMEROS LIQUIDO-CRISTALINOS Y SU POSIBLE USO COMO DISPOSITIVOS DE MEDICIÓN. DIRECTOR DE MEMORIA PATROCINANTE Dr. Eduardo Soto Bustamante Dr. Eduardo Soto Bustamante DEPARTAMENTO DE QUIMICA ORGANICA Y FISICOQUIMICA DEPARTAMENTO DE QUIMICA ORGANICA Y FISICOQUIMICA Memoria para optar al Título de Químico Farmacéutico ARIEL ANTONIO MENESES FRANCO Santiago, Chile 2010 ÍNDICE DE CONTENIDO INDICE DE FIGURAS ----------------------------------------------------------------------------------------------------------------- 4 TABLAS --------------------------------------------------------------------------------------------------------------------------------- 5 RESUMEN ------------------------------------------------------------------------------------------------------------------------------ 6 ABSTRACT ----------------------------------------------------------------------------------------------------------------------------- 7 1. 2. 3. INTRODUCCION -------------------------------------------------------------------------------------------------------------- 8 1.1. MATERIALES FERROELÉCTRICOS ---------------------------------------------------------------------------- 8 1.2. PEROVSKITAS----------------------------------------------------------------------------------------------- 10 1.3. CRISTALES LÍQUIDOS FERROELÉCTRICOS ------------------------------------------------------------------ 13 1.4. NANOCOMPÓSITOS FERROELÉCTRICOS ------------------------------------------------------------------- 15 HIPOTESIS Y OBJETIVOS ------------------------------------------------------------------------------------------------- 16 2.1. HIPÓTESIS -------------------------------------------------------------------------------------------------- 16 2.2. OBJETIVO GENERAL ---------------------------------------------------------------------------------------- 17 2.3. OBJETIVOS ESPECÍFICOS ----------------------------------------------------------------------------------- 17 MATERIALES Y MÉTODOS ---------------------------------------------------------------------------------------------- 17 3.1. SÍNTESIS DE PEROVSKITAS -------------------------------------------------------------------------------- 17 3.1.1. Método Solvotérmico ----------------------------------------------------------------------------- 18 3.1.2. Método por calcinación de precursores órgano-metálicos sintetizados por vía solgel. ----------------------------------------------------------------------------------------------------- 19 3.2. FABRICACIÓN DEL NANOCOMPÓSITO --------------------------------------------------------------------- 19 3.2.1. Suspensión de NpBT ------------------------------------------------------------------------------- 19 3.2.2. Compatibilización ---------------------------------------------------------------------------------- 20 3.2.3. Fabricación de la matriz de FLC ---------------------------------------------------------------- 20 3.2.4. Fabricación del nanocompósito ---------------------------------------------------------------- 21 3.3. CARACTERIZACIÓN ----------------------------------------------------------------------------------------- 21 3.3.1. Análisis termogravimétrico --------------------------------------------------------------------- 21 3.3.2. Calorimetría diferencial de barrido ----------------------------------------------------------- 22 3.3.3. Difracción de Rayos X ----------------------------------------------------------------------------- 23 3.3.4. Microscopia de transmisión de electrones TEM ------------------------------------------- 24 3.3.5. Microscopia de luz polarizada ------------------------------------------------------------------ 26 2 3.3.6. 4. Técnica piroeléctrica ------------------------------------------------------------------------------ 28 RESULTADOS Y DISCUSIÓN --------------------------------------------------------------------------------------------- 29 4.1. SÍNTESIS Y CARACTERIZACIÓN DE PEROVSKITAS BATIO3------------------------------------------------- 29 4.1.1. Método solvotérmico ----------------------------------------------------------------------------- 29 4.1.2. Método por calcinación de gel precursor --------------------------------------------------- 31 4.2. FABRICACIÓN Y CARACTERIZACIÓN DEL NANOCOMPÓSITO ---------------------------------------------- 45 4.2.1. Resuspensión en DMF ---------------------------------------------------------------------------- 46 4.2.2. Compatibilización con acido oleico BT(OA). ------------------------------------------------ 46 4.2.3. Fabricación del compósito PM10M6 --------------------------------------------------------- 47 4.2.4. Fabricación de los nanocompósitos ----------------------------------------------------------- 47 4.2.5. Caracterización piroeléctrica de los compósitos ------------------------------------------- 49 5. CONCLUSIONES ------------------------------------------------------------------------------------------------------------ 51 6. ANEXO ------------------------------------------------------------------------------------------------------------------------ 54 7. BIBLIOGRAFÍA -------------------------------------------------------------------------------------------------------------- 57 3 INDICE DE FIGURAS Figura 1: Fenómenos asociados a la aparición de ferroelectricidad en materiales inorgánicos ... 9 Figura 2: Representación de la estructura cubica de una Perovskita, donde A es el catión mono o bivalente y B el catión tetra o pentavalente. ............................................................................. 11 Figura 3: Esquema de fases liquido-cristalinas termotropas de moleculas calamiticas .............. 14 Figura 4: Elevación del diseño para el reactor de teflón utilizado en el método solvotermal. ..... 18 Figura 5: Estructuras de los componentes de la matriz liquido-cristalina PM10M6. ................... 21 Figura 6: DTA para mediciones de calorimetría de barrido diferencial ....................................... 23 Figura 7: Equipo para la medición de difracción de Rayos X en polvos ..................................... 24 Figura 8: Esquema de la microscopia electrónica; izq) de transmision, der) de barrido ............. 25 Figura 9 : Equipo para microscopia de transmisión de electrones .............................................. 26 Figura 10: Esquema del funcionamiento de la microscopia de luz polarizada ............................ 27 Figura 11: Equipo para microscopia de luz polarizada ................................................................ 27 Figura 12: Esquema del set-up utilizado en la determinación de respuesta piroeléctrica .......... 29 Figura 13: Efecto del cambio de contraion alrededor de la NpBT. .............................................. 30 Figura 14: A) DSC, B) DRX del producto seco ............................................................................ 31 Figura 15: Imagen de TEM a 30000x de aumento e histograma de la dispersión de tamaño donde se aprecia el diámetro con mayor frecuencia (40-45 nm). ............................................... 31 Figura 16: TGA y DTGA del polvo secado NpBT-0h a 150°C ..................................................... 32 Figura 17: A) DSC polvo secado a 150°C B) XRD de NpBT-0h seco ......................................... 33 Figura 18: Imagen TEM del precursor seco resuspendido en acético glacial, tomada a 12000x e histograma de la distribución de su tamaño ................................................................................ 34 Figura 19: TGA del NpBT-1h a 1000°C ....................................................................................... 35 Figura 20: A) DSC de NpBT-1h; B) Patrón XRD de NpBT-1h con detalle a 45° ......................... 36 Figura 21: Imagen de TEM de NpBT-1h a 20000x ...................................................................... 37 Figura 22: TGA y DTA de NpBT-3h a 1000°C ............................................................................. 38 Figura 23: A) DSC de NpBT-3h; B) Patrón DRX de NpBT-3h con detalle a 45° ......................... 38 Figura 24: Imagen TEM de NpBT-3h a 20000x e histograma de la distribución de su tamaño. . 39 Figura 25: TGA y DTGA; A) NpBT-1+3h B) NpBT-3+3h…………………………………...……….38 4 Figura 26: Grafico de la pérdida de peso porcentual y la razón de cambio máxima a 750°C para cada proceso ................................................................................................................................ 41 Figura 27: DSC de A) NpBT-1h y NpBT-1+3h B) NpBT-3h y NpBT-3+3h .................................. 41 Figura 28: A) DRX de NpBT-1+3h indicando señales de impurezas. B) DRX de NpBT-3+3h. Ambas con el detalle del conjunto de señales características a 45°………………………………40 Figura 29: Imagen de TEM de A) NpBT-1+3h y B) NpBT-3+3h a 3000x .................................... 43 Figura 30: A) DSC del producto NpBT-6h. B) DRX de NpBT-6h donde se observa en el detalle de 45° el desacoplamiento de las señales 200 y 002. ................................................................. 44 Figura 31: Imagen de TEM del producto BT-6h a 12000x e Histograma de la dispersión de su tamaño………………………………………………………………………………………………….…42 Figura 32: Imagenes de TEM de las suspenciones organicas A) NpBT en DMF. B) BT(OA) en Hexano, ambas a 20000x. ........................................................................................................... 47 Figura 33: DSC de los compósitos preparados ........................................................................... 50 Figura 34: Señales piroeléctricas de los nanocompósitos preparados ....................................... 51 TABLAS Tabla 1: Principales características de compuestos cristalinos ferroeléctricos ........................... 10 Tabla 2: Temperaturas de Curie de perovskitas ferroeléctricas .................................................. 12 5 RESUMEN La ferroelectricidad es un fenómeno descrito a principios del siglo XX, en el cual se observó la polarización remanente de un material al aplicarle un campo eléctrico externo. Desde entonces se han desarrollado diversos materiales tanto orgánicos como inorgánicos que presentaban dicho fenómeno, hasta que en 1974 Meyer predice la existencia de polarizabilidad en cristales líquidos que poseen una fase esméctica inclinada quiral (SmC*). En este trabajo se intenta combinar las propiedades de ambos tipos de materiales ferroeléctricos (cerámicas-inorgánicas y líquido-cristalinos). Para ello se fabricó un nanocompósito liquido-cristalino constituido por una mezcla de polímero (PM6R10) y un monómero (M6R6) en una razón 2:1, denominado PM10M6, que presentó señal piroeléctrica, el que se utilizó como matriz para las nanopartículas de BaTiO3. Las Nano-partículas de BaTiO3 (NpBT) fueron sintetizadas por un método hidrotermal, que no produjo NpBT tetragonales, por lo que se utilizó un método de calcinación de un precursor órgano-metálico. Con el que finalmente se obtuvo un producto con características estructurales adecuadas para el objetivo de este trabajo. Enseguida al compósito liquido-cristalino, mezcla de monómero y polímero anteriormente señalados, (PM10M6) se adicionaron NpBT suspendidas en solventes orgánicos, en una concentración al 5% y ácido oleico para aumentar la compatibilidad del material cerámico en la matriz liquidocristalina. Al medir la señal piroeléctrica, se observó que la adición de NpBT en un 5% aumenta en forma considerable la respuesta piroeléctrica del material en comparación con el compósito original (PM10M6). En cambio al adicionar ácido oleico como compatibilizante esta prácticamente desaparece. 6 ABSTRACT The ferroelectricity is a phenomenon described in the early twentieth century, which was observed as a remanent polarization of a material under the influence of an external electric field. Since then, various organic and inorganic materials (ceramics) have been developed that showed this phenomenon, until in 1974 Meyer predicts the existence of polarizability in liquid crystals that has a chiral tilted smectic phase (SMC *). This thesis combines the properties of both types of ferroelectric materials (inorganic-ceramic and liquid-crystal), trying to get a plastic material exhibiting high polarization. To realize this target, a liquid-crystalline nanocomposites was prepared that comprises a polymer blend made of a polymer (PM6R10) and a monomer (M6R6) in a 2:1 ratio, that we called PM10M6, presenting pyroelectric signal, that was used as a matrix for BaTiO3 nanoparticles . The Nano-particles (NpBT) were synthesized by a hydrothermal method widely described in literature, that did not produce tetragonal NpBT. Then, we used a method of calcination of a gel precursor in acetic acid. By studying the dependence of the morphological and structural characteristics with the annealing time at 1.000 ° C, we obtained a product with suitable characteristics for the purpose of this work. Then to the liquid-crystalline composite PM10R6, NpBT were added at a concentration of 5%, with oleic acid, to increase the compatibility of the ceramic material in liquid-crystalline matrix and also without oleic acid. By measuring the pyroelectric signal, it was observed that the addition of 5% NpBT increases significantly the pyroelectric response of the material compared to the original composite. However when adding oleic acid as compatibilizer the pyroelectric signal and therefore their polar property practically disappears. 7 1. INTRODUCCION 1.1. Materiales Ferroeléctricos Se denomina ferroelectricidad a la propiedad que poseen ciertos materiales de presentar una polarización espontánea en ausencia de un campo eléctrico externo y en un rango de temperatura definido. Este fenómeno es propiciado por la conformación estructural interna de los materiales, que beneficia la estabilización de momentos dipolares permanentes1. La ferroelectricidad fue observada por primera vez en 1920 por Valasek en cristales de tartrato de sodio y potasio (NaKC4H4O6·4H2O), sintetizada en 1655, por el químico francés Signette en la Rochelle2, Francia. Quien en esa época describió un efecto eléctrico anómalo causado por compresión de los cristales, fenómeno primeramente llamado electricidad de Signette y que finalmente hoy se conoce como piezoelectricidad. Valasek describió una polarización en el material que podía ser revertida por un campo eléctrico externo. El investigador observó en una curva de histéresis, que sus características dieléctricas en relación a un campo eléctrico externo, presentaban un comportamiento similar al observado en los materiales magnéticos al someterlos al efecto de a un campo magnético. Pero no fue sino cerca de la década de los ’40 que el termino ferroelectricidad fue masivamente utilizado para denominar tal comportamiento. Esto, principalmente porque por que la sal de Rochelle era hasta ese entonces el único caso conocido y por las numerosas teorías barajadas hasta ese entonces como la ya obsoleta propuesta por Kurchatov en 1933, enfocada principalmente a la interacción con las moléculas del agua de cristalización3. Posteriormente comenzó una búsqueda por preparar este tipo de materiales y así fue como se descubrieron a mediados mediados de los ’30, los fosfatos di ácidos de potasio y amonio, KH2PO4 y NH4H2PO4 (KDP y ADP 8 respectivamente) y sus derivados deuterados, que no poseen agua en la de cristalización4, hasta llegar en el año 1945 con el descubrimiento del BaTiO3 (BT) tetragonal y sus derivados denominados perovskitas5. Figura 1: Fenómenos asociados a la aparición de ferroelectricidad en materiales inorgánicos La aparición del fenómeno de ferroelectricidad depende de la existencia, para el caso de ferroeléctricos inorgánicos, de centros de alta asimetría que permitan una distorsión del equilibrio eléctrico de la red cristalina. E, en este sentido podemos agruparlos por la naturaleza de este, como se muestra en la tabla 1: Transición Orden-desorden: la presentan materiales de estructuras diversas que poseen puentes de hidrogeno, como KDP y ADP y sus derivados, o dipolos moleculares que alordenarse generan una polarización en el material como NaNO2 o HCl. Está parece estar relacionado con el movimiento de los enlaces de los catiónes al interior de la red cristalina (Figura 1-B)6. Transición de Desplazamiento: provocada por la dislocación de una subred cristalina con relación a otra, distorsionando todo el cristal, y por ende forzando una relación asimétrica entre cargas positivas y negativas (Figura 19 A). E, este fenómeno lo presentan minerales como BT y otras perovskitas como LiNbO3, KTaO3, y otros con estructura de seudoperovskita que poseen ferroelectricidad como el Bi4Ti3O12.7 Tabla 1: Principales características de compuestos cristalinos ferroeléctricos Familia formula Transición Ordendesorden Sal de Rochelle NaK(C4H4O6)4H2O PLZT Pb 0,88 La 0,08 Zr 0,35 Ti 0,65 O3 Tipo KDP KH2PO4 KD2PO4 RbH2PO4 RbH2AsO4 KH2AsO4 Tc, °C Ps, mC/cm2 a T, °K 4 0,25 5 7 47 20 150 5,3 -177 60 4,5 -93 126 5 417 162 -273 177 5 -193 20 26 23 241 3 -269 39 30 250 90 >50 27 17 23 447 197 300 Transición de desplazamiento Perovsquitas BaTiO3 SrTiO3 KNbO3 PbTiO3 LiTaO3 LiNbO3 1.2. Perovskitas La familia de minerales denominadas Perovskitas, poseen estructuras similares al CaTiO3, descubierto en los montes Urales (Rusia). Son óxidos 10 complejos de estructura relativamente sencilla ABO3, donde A es generalmente un catión mono o bivalente, localizados en los vértices del cristal y B otro catión tetra o pentavalente ubicado en el centro de la estructura y alrededor del cual se encuentran los átomos de oxigeno en forma octaédrica orientados hacia las caras del cristal (IlustraciónFigura 1Figura 2)8. Si bien es cierto, el CaTiO3 presenta una simetría cúbica en un amplio rango de temperaturas9, la mayoría de las perovskitas poseen transiciones de fases a temperaturas definidas (Tabla 2). Dicha temperatura es llamada temperatura de Curie (Tc), o temperatura de transición, por sobre la cual la estructura toma una conformación cúbica primitiva de alta simetría, con la desaparición de la ferroelectricidad, por lo que es llamada también temperatura o punto paraeléctrico. IlustraciónFigura 2: Representación de la estructura cubica de una Perovskita, donde A es el catión mono o bivalente y B el catión tetra o pentavalente. Aunque la familia de las Perovskitas es extensamente variada no todas presentan una marcada ferroelectricidad, e . E incluso miembros de esta familia, con estructuras similares, presentan antiferroelectricidad, como el PbZrO310. Las principales representantes de las perovskitas ferroeléctricas son, KNbO3, NaNbO3, KTaO3, PbTiO3 y BaTiO3. Todas estas tienen en común un perfil de fases similares, diferenciándose exclusivamente en las temperaturas de 11 transición de una simetría a otra:, a altas temperaturas presentan simetría cubica para-eléctrica, y a medida que va descendiendo la temperatura, presentan cambios de fases tetragonal, monoclínica y romboédrica.11 Tabla 2: Temperaturas de Curie de perovskitas ferroeléctricas Fórmula Cubicatetragonal BaTiO3 130°C Tetragonal- ortorrómbicaortorrómbica romboédrica 5°C -90°C KNbO3 435°C 225°C -10°C PbTiO3 493°C 320°C -25°C Dentro de estas cerámicas, la más estudiada es son la BaTiO3 perovskitas compuestas p(BT), tanto por su aplicación tecnológica como por la relativa facilidad de sintetizarlas, ya sea como mono cristales o como nanopartículas (NpBT). Con una constante dieléctrica bastante alta = 7000, es un excelente material para ser utilizado en capacitores, pudiendo reducir bastante el tamaño de estos. Es, ampliamente utilizado como material piezoeléctrico, incluso en biomedicina, en sensores de presión. Pero también su utilización queda restringida al igual que todos los materiales nanocerámicos por sus limitaciones mecánicas. Por lo general los materiales cerámicos poseen una pobre (elasticidad, ductibilidad, tenacidad, etc.), que complican en cierta medida su manipulación industrial12. Existen diversos métodos para sintetizar NpBT descritos en literatura, sin embargo es necesario tomar en cuenta la estructura cristalina del material obtenido, que como se mencionó anteriormente, resulta fundamental para un ferroeléctrico, en donde la presencia de una asimetría en la red cristalina, le otorga polarización espontanea13. Por otra parte la reducción de tamaño de la partícula también representa un límite para lo anteriormente expuesto, puesto que a medida que el tamaño disminuye también lo hacen sus propiedades 12 ferroeléctricas, en parte debido a la disminución de la relación de tetragonalidad y también al decremento de polarización macroscópica del material 14. Los métodos de precipitación en medio fuertemente alcalino acuoso15, denominados hidrotermales, permiten la obtención de NpBT de tamaños adecuadamente pequeños y homogéneashomogéneos. Sin embargo, pero la presencia de OH-, Cl- y Na+ que contaminan el cristal lleva a la formación de especies cristalinas cubicas meta estables no ferroeléctricas , que requieren tratamientos adicionales de purificación y estabilización 16. La ausencia de agua en la síntesis evita los inconvenientes anteriores. P, para ello se desarrollaron métodos solvotérmicos de precipitación, como el descrito por Pramanik et al17 donde se disminuye la cantidad de agua utilizando solventes orgánicos miscibles con esta y de polaridad similar. Otro método utilizado es la síntesis de precursores en gel de ácidos orgánicos y posterior tratamiento térmico18. Estos métodos eliminan totalmente el agua, y además proveen de un producto libre de impurezas iónicas y carbonatos. Se basan en la formación de complejos macromoleculares organometálicos y su posterior descomposición a altas temperaturas. En el proceso se elimina agua, posteriormente se forman los óxidos complejos y por ultimo al superar la temperatura de amorfización del cristal (alrededor de los 850°C, en el caso del NpBT)19 se lleva a temperatura ambiente, obteniendo nano polvos de alta pureza con simetría tetragonal, como lo muestra el método desarrollado por Wang et al.20 1.3. Cristales líquidos ferroeléctricos En 1880 el botánico Austriaco Friederich Reinitzer, al estudiar derivados del colesterol que presentaban dos temperaturas de fusión, observó que al calentar estos derivados pasaban desde un líquido turbio a un líquido transparente, con un cambio de volumen y absorción de calor. Este cambio lo denominó transición de fase, utilizando por primera vez el término “cristal 13 líquido”. Un año más tarde Otto Lehman, especialista en microscopía polarizada, coincidió con la observación de Reinitzer en la presencia de anisotropía y birrefringencia en estos compuestos y validó el uso del término Cristal Líquido. Este término es utilizado hasta nuestros días para describir fluidos que poseen un estado parcialmente ordenado, anisótropo y termodinámicamente estable. En un principio los cristales líquidos se dividieron en dos categorías: termótropos y liótropos, dependiendo si los cambios de fase se observan por cambios de temperatura (ΔT), ó por cambios en la concentración (Δc) entre un solvente isótropo y una molécula anfifílica, respectivamente. Estas categorías se subdividen además en calamíticos, discóticos y sanídicos, por nombrar algunos, según el tipo de estructuras que se formen, ya sea láminas, cilindros o cintaspizarras21. En el año 1922 Friedel propone una sub-clasificación de los cristales líquidos, en la cual considera la formación de fases nemáticas y esmécticas (Figura 3), según el grado de orden adquirido22. Figura 3: Esquema de fases liquido-cristalinas termotropas de moleculas calamiticas Pero eEl descubrimiento de Ferroelectricidad en cristales líquidos no fue accidental sino que fue el resultado de conjeturas basadas en argumentos de simetría23. En 1974 Meyer postula la posibilidad de existencia de ferroelectricidad en una fase lamelar inclinada de un compuesto quiral líquido 14 cristalino, lo que atribuyó a la ausencia de centrosimetría y a la estructura que se produce entre las capas24. Este hecho permite la orientación unidireccional de un momento dipolar eléctrico lateral neto dentro de las capas esmécticas, lo que es conocido como polarización lateral. P, para ello las moléculas deben ubicarse en una estructura centroasimétrica donde las componentes vectoriales de sus momentos dipolares no queden completamente anuladas y posean un orden que permita la estabilización de este fenómeno 25. E, esto lo cumplen las fases inclinadas de moléculas con centros quirales como por ejemplo la esméctica C (SmC*). En este sentido el conjunto de moléculas liquido cristalinas estabiliza solo en cierta medida el momento dipolar lateral por lo que la respuesta ferroeléctrica es bastante mas baja que en un material cristalino 26. Otro fenómeno particular es la presencia de ferroelectricidad en cristales líquidos aquirales con esméctica C (SmC)27. E, en este caso al parecer el ordenamiento macroscópico de la red como conjunto, estaría estabilizando un momento dipolar. Es el caso de las moléculas banana y de los compósitos liquido cristalinos desarrollados por nuestro equipo28. 1.4. Nanocompósitos ferroeléctricos UnLos nanocompósitos basados en polímeros, es una combinación al menos binaria de una matriz orgánica o polimérica continua y dominios de tamaño nanométrico de otro un sólido, los que han atraído gran interés y han sido ampliamente explorados recientemente29. Esto es porquedebido a que los estos Nanocompósitos pueden exhibir mostrar un mejores miento de propiedades tales como mecánicas30, ópticas31, magnéticas32, eléctricas33, y optoelectrónicas34 respecto a la matriz original. Por ejemplo, algunos nanocristales semiconductores de cerámicas se han incorporado en matrices de polímeros para aumentar el índice de refracción de los compositos para su uso en los campos de guías de onda ópticas, lentes oftálmicas, o revestimientos antirreflejo35. Otro ejemplo es el de los condensadores integrados que se 15 utilizan en el desarrollo de productos electrónicos flexibles, tales como el despliegue de las pantallas de visualización, tableros de circuitos, o e-papers36. A fin de alcanzar las mencionadas características propiedades, y e interesantes aplicaciones interesantes de los nanocompósitos, es muy importante ser capaz de dispersar el nano cristal de forma homogénea en matrices organicas. Las nanopartículas de titanato de bario (NpBT) tienen un gran potencial en muchas aplicaciones, por tanto el desarrollo de técnicas químicas adecuadas para la manipulaciónde manipulación de superficies, es esencial?????. En general, las nanopartículas comerciales que se utilizan, muestran una capacidad de dispersión pobre en los medios orgánicos37. La lucha por mejorar la dispersión de las nanopartículas en las matrices orgánicas, se ha alcanzado por adsorciones de surfactantes o recubrimientos 38 macromoleculares . Sin embargo, la interacción de estas con la mayoría de los surfactantes o polímeros sólo es consecuencia de una adsorción física sobre las partículas ya sea por atracción electrostática o por interacciones hidrofóbicas reversibles, lo que puede modificar la composición de la matriz circundante, y por ello las propiedades que dependan de su estructura. Esto se debe al hecho de que las NpBT comerciales carecen de grupos reactivos funcionales en su superficie y por lo tanto es difícil generar interacciones químicas con los agentes de la modificación orgánica39. 2. HIPOTESIS Y OBJETIVOS 2.1. Hipótesis La inclusión de nanopartículas de cerámicas ferroeléctricas como BaTiO3, en una matriz FLCliquido-cristalina polarizable, aumentaríanaumentará la respuesta piroeléctrica del nanocompósito formado este ultimo material. 16 2.2. Objetivo general Preparar y caracterizar nanocompósitos, integrados por nanopartículas de BaTiO3 tetragonal, y un material liquido-cristalino con respuesta piroeléctrica. 2.3. Objetivos específicos Síntesis de nanopartículas de BaTiO3 tetragonal (NpBT). Caracterización de NpBT obtenidas, mediante calorimetría diferencial de barrido, difracción de rayos X, microscopia de transmisión electrónica, etc. Estabilizar suspensiones de NpBT en solvente orgánicos, utilizando ácido oleico como surfactante. Preparar y caracterizar los nanocompósitos suspendiendo NpBT en una matriz liquido-cristalina con señal piroelectrica. 3. MATERIALES Y MÉTODOS 3.1. Síntesis De Perovskitas Existen diversos métodos para la síntesis de perovskitas, en este trabajo se utilizarán el método solvotermal y el método sol-gel. Para el primero se diseño un reactor de teflón a presión atmosférica, como el de la Figura 4, para evitar corrosión en material de vidrio. 17 Figura 4: Elevación del diseño para el reactor de teflón utilizado en el método solvotermal. 3.1.1. Método Solvotérmico En el reactor de teflón disolver 1.67g de hidróxido de bario monohidratado en 50 ml de agua desionizada y desgasificada (DDW), con agitación y flujo de nitrógeno a 50°C (solución A), en otro balón de vidrio agregar 2.7 ml de tetraisopropóxido de titanio y 5.9 ml de etilendiamina, a 12.7 ml de alcohol Isopropílico y agitar a 50°C por 30 min (solución B). Adicionar gota a gota la solución B sobre la solución A, que esta en el reactor sin detener la agitación ni el flujo de N2 y calentar a 70°C por 2h. Luego ajustar el pH de la suspensión entre 4 y 5 con acido acético, centrifugar a 5.000 rpm y lavar con agua milli-q desgasificada (DDW) y luego con metanol con ayuda de ultrasonido. Secar en estufa el precipitado y suspender 1g en 7 ml de dimetilformamida, la suspensión resultante es sometida a un tratamiento térmico a 170°C por 24 h con presión autogenerada en una bomba Par. 18 3.1.2. Método por calcinación de precursores órgano-metálicos sintetizados por vía sol-gel. Solución A: En el balón de dos cuellos agregar 25 ml de alcohol isopropílico calentando a 40°C con agitación constante, sobre este adicionar 27 ml de Tetraisopropóxido de Titanio burbujeando la mezcla 10 min con nitrógeno. Finalmente cuando no salgan vapores, adicionar 19 ml de acido acético glacial, manteniendo la agitación por 30 min y Cuidando que la temperatura no sobrepase los 55°C. Solución B: Paralelamente disolver 19 g de hidróxido de bario monohidratado en 20 ml de DDW calentando suavemente. C, cuando estée completamente disuelto, ajustar a pH 3 con AcOH y enfriar a temperatura ambiente. Adicionar gota a gota la solución acuosa anterior A a la solución Bque contiene el TIP a una temperatura entre 60 y 70° C, con agitación vigorosa y constante. Al finalizar la adición ajustar el pH a 3 con acido acético glacial y elevar la temperatura, observar la formación del gel entre 90 y 95° C. Se seca por 24 h a 150°C en una estufa, el residuo cristalino se pulveriza en mortero y se somete a calentamiento en un horno a 1.000° C con diferentes tiempos de tratamiento. Todo el material fue cuidadosamente lavado con una mezcla de agua oxigenada:acido sulfúrico (2:1) durante 30 min, luego de enjuagar 3 veces con agua y dejar otros 30 min con agua regia, lavar tres veces con agua potable, y luego con agua destilada, finalmente enjuagar con agua milli-q. 3.2. Fabricación del nanocompósito 3.2.1. Suspensión de NpBT Se fabricaron dos tipos de compósitos (con y sin ácido oleico, OA) utilizando las nanopartículas con mejores características. Para esto se pesaron exactamente dos series de alrededor de 60 mg cada una de NpBT y se suspendieron en 1 ml de DMF utilizando ultrasonicación por 60 min. (frecuencia 19 xxxxHz). , lLuego se decantaron por 12h, se separó el sobrenadante y el precipitado se seco al vacio a 80°C, para ser pesado, a fin de determinar la cantidad de NpBT restante en suspensión. Fueron rotulados dos ependorff de 1,5 ml (A: 140 mg B: 148 mg de NpBT-3h), los que fueron sonicados por 1 hora. 3.2.2. Compatibilización 3.2.3. Una de las series de NpBT anteriormente señaladas, se seco al vacio y se agregaron 50l de OA, se sometió a ultrasonido por 10 min. (frecuencia, zxx Hz) y , luego se adicionó 1 ml de hexano, se centrifugo a 2000 rpm por 10 minutos y se descarto el sobrenadante que no contenía nanopartículas, restituyéndose la suspensión con hexano necesario para alcanzar un volumen de 1 ml. S, se repitió esta operación 2 veces más obteniéndose una suspensión homogénea. Se utilizó el contenido del tubo rotulado como B, con 10,5 mg de NpBT-3h, las que se secaron al vacio a 80° C por 24 h. 3.2.4.3.2.3. Fabricación de la matriz de FLC Se peso exactamente alrededor de 100 mg del polimero PM6R10 (Figura 5-A), este polímero fue obtenido por el método de polimerización vinílica por radicales libres, utilizando azabisisobutilnitrilo (AIBN) como iniciador térmico. y Se disolvió el polímero en la mínima cantidad de tetrahidrofurano y se adicionaron 50 mg (33%) del monómero metacrílico M6R6 (Figura 5-B). , eEsta solución se filtro y se evaporo suavemente el solvente. P, posteriormente se llevo ae 200°C, temperatura a la cual el compósito liquido-cristalino PM6M10/M6R6 33% (PM10M6) FLC se encuentra fundido en estado isótropo. 20 Con formato: Normal, Sin viñetas ni numeración A O OH N O O O PM6R10 B O O OH N O O M6R6 Figura 5: Estructuras de los componentes de la matriz liquido-cristalina PM10M6. 3.2.5.3.2.4. Fabricación del nanocompósito Se disuelve una cantidad exactamente pesada de PM10M6 en THF y se adiciona la cantidad necesaria de la suspensión de NpBT para obtener un 5% en el peso final de estas. S, se sónica por 30 min y se seca al vacio a 8060°C, para una rápida evaporación del solvente,. luego el solido se funde a 200° C y se dejo enfriar a temperatura ambiente tapado.Para fabricar el nanocompósito PM10M6/BT:(OA)5%, se pesaron 30 mg del composito, y se siguió el mismo procedimiento anteriormente descrito, adicionando 150 µl de la suspensión que contiene 10,5 mg/ml de NpBT(OA) en Hexano. 3.3. Caracterización 3.3.1. Análisis termogravimétrico Según lo que se ha descrito para el método mediante precursor gel y posterior calentamiento, la formación del titanato de bario podría ser seguida por las sucesivas perdidas de peso que se producen por la descomposición térmica del precursor. T, también se podría determinar si existe una perdida de peso luego de los tratamientos térmicos en el material obtenido, para esto es útil la técnica de análisis termogravimétrico o TGA (thermogravimetric analysis) 21 y su manejo de datos DTGA (differential thermogravimetric analisys). Esta última, que consisten en determinar la cantidad de masa perdida en función de la temperatura, con respecto a una referencia, y la derivada de este proceso en función a la temperatura respectivamente. El equipo es un NETZSCH TG 209 F1. y fue utilizada cComo referencia se utilizó Al2O3 con una rampla de temperatura de 150° a 1.000°C a 5°C/min. 3.3.2. Calorimetría diferencial de barrido La calorimetría diferencial de barrido o “DSC” (differential scanning calorimetric) es una técnica termo analítica donde se registra la diferencia en el flujo de calor desde el equipo hacia una muestra y una referencia en función de la temperatura. Esta técnica permite determinar varios parámetros asociados a procesos físico-químicos, como son: las temperaturas de transicióones de la fase de 1er 1º y 2º orden, sus entalpías de transiciones de fasey valores de Cp. De esta forma es posible determinar , transiciones de fases en cristales líquidos cristalinas, polimorfismos en la comida o fármacos, cambios de fase polímeros termoplásticos, etc. en Además es posible realizar de medidas de purezas y estudios cinéticos, en donde la técnica de el DSC es muy eficaz. Como se menciono anteriormente el titanato de bario tetragonal presenta una temperatura de Curie Alrededor de 125° C, en una transición tetragonal a cubica que requiere una cantidad de energía, la que mediante esta metodología es fácil de determinar. El equipo de análisis térmico diferencial (DTA), utiliza una mesa de calentamiento Mettler Toledo FP84HT (Figura 6), que es controlada mediante un procesador FP 90, el que esta conectado a un PC para el almacenamiento de los datos. Este sistema trabaja en un rango de 0 a 300 ° C, y permite obtener Análisis Térmicos mediante software. Para obtener los gráficos de DSC se calibro con un estándar de indio. El procedimiento de reconocimiento de las transiciones de fase se realiza mediante barridos a 10ºC/min, por calentamiento 22 y enfriamiento, en un rango de 40° a 200°C. Se utilizaron celdas de aluminio Perkiín Elmer de 20 μL. Las que fueron pesadas en una balanza analítica Presisa 125 A. Las celdas fueron llenadas completamente con el material, intentando pesar 20 mg por celda. IlustraciónFigura 6: DTA para mediciones de calorimetría de barrido diferencial 3.3.3. Difracción de Rayos X El fenómeno de la difracción de Rayos X consiste básicamente en un proceso de interferencias constructivas de ondas de rayos X que se produce en determinadas direcciones de espacio. La difracción de rayos X en muestras de polvo cristalino o muestras policristalinas se puso de manifiesto primeramente en Alemania por P.Debye y P.Scherrer en (1916) y casi al mismo tiempo se desarrolló a través de los estudios de Hull en los Estados Unidos. El descubrimiento del fenómeno de la difracción en este tipo de muestras se convierte rápidamente en una técnica experimental de extendido uso, debido básicamente al amplio campo de aplicación que podemos encontrar para el estudio de sustancias cristalinas. Hoy día esta técnica constituye una habitual herramienta de trabajo con una extraordinaria utilidad en muy distintas disciplinas científicas y tecnológicas, por el carácter polifacético en lo que se refiere a la gran variedad de información que proporciona. 23 La identificación de fases cristalinas mediante el método de polvo, constituye uno de los campos de aplicación más importantes del método de polvo cristalino en una primera etapa, para la identificación de sustancias. La identificación de una fase cristalina por este método se basa en el hecho de que cada sustancia en estado cristalino tiene un diagrama de rayos X que le es característico. Estos diagramas están coleccionados en fichas, libros y bases de datos del Joint Committee on Powder Difraction Standards y agrupados en índices de compuestos orgánicos, inorgánicos y minerales. Se trata, por lo tanto, de encontrar el mejor ajuste del diagrama problema con uno de los ya coleccionados. Para la caracterización de la estructura cristalina de los productos obtenidos por los distintos métodos de síntesis se utilizo el método de difracción de polvo, en un equipo SIMENS D5000 (Figura 7) en una placa de anillos concéntricos DK 5 cm. Figura 7: Equipo para la medición de difracción de Rayos X en polvos 3.3.4. Microscopia de transmisión de electrones TEM Una herramienta fundamental para el estudio de materiales a escalas nanométricas es la microscopia electrónica de transmisión, TEM (transmission 24 electron microscopy). Esta, , fundamentada a diferencia de otras microscopias electrónicas, se diferencia en que el haz de electrones incidentes atraviesa la muestra e impacta en una pantalla electro-fluorescente (Figura ). M, mientras máas densa sea la envoltura electrónica de de los átomos que conforman la muestra, menor será la cantidad de electrones del haz que lograrán traspasarla, y la sombra de la partícula adquirirá mayor contraste. Esta técnica, por lo que es partinculiparlmente útil para muestras conformadas por átomos de alto peso como el Au, tierras raras, y en este caso el Ba. Para el caso de , aunque es ampliamente utilizada para muestras de menor densidad como C, Si y otros metales, en donde también es ampliamente utilizada, siendo es necesario aumentar la resolución. Figura 8: Esquema de la microscopia electrónica; izq) de transmision, der) de barrido En este último aspecto cCon el desarrollo de la microscopia electrónica de transmisión de alta resolución, HR-TEM (high resolution transmission electron microscopy), bajo que posee el mismo fundamento anterior ya descrito, es posible permite definir características importantísimas en cuanto a la estructura del material. Esta técnica entrega información respecto , pudiendo observar a la prescencia de ciertas redes cristalinas, e incluso la disposición de celdas cristalinas unitarias. Así, ha sido posible Esto dio origen al la determinación de la estructuras cristalinas de una muestra aprovechando la 25 información que entrega la parte del haz que es difractada por la muestraella. D, dicho patrón de difracción es característico para ciertas estructuras y así como en el caso de lo descrito para la difracción de rayos X, son almacenadas en una base de datos. Figura 9 : Equipo para microscopia de transmisión de electrones Las muestras se observaron en un Microscopio Electrónico de Transmisión (MET) marca Zeiss, modelo EM-109 (Figura 9), en rejillas metálicas, las cuales estaban recubierta de un soporte de FORMAVAN®, en el caso de muestras acuosas y carbono en el caso de muestras orgánicas. 3.3.5. Microscopia de luz polarizada Esta técnica se basa en que un material anisótropo posee birrefringencia y presenta diferencias y defectos microscópicos en sus fases líquido-cristalinas. Luego, cada fase forma un complejo cuadro de imágenes, conocido como textura, las que pueden ser observadas en un microscopio cuando el material se encuentra entre dos polarizadores cruzados como lo demuestra el esquema de la (Figura ). Si bien es cierto por la observación des texturas observadas mediante la técnica de microscopía de luz polarizada (MLP), es posible identificar mesofases de bajo orden como la fase N, SmA ó SmC, ésta técnica no es considerada como 26 absoluta ya que depende en gran parte de la experiencia empírica del observador. La forma de alineación Figura 10: Esquema del funcionamiento de la microscopia de luz polarizada La forma de alineación de las moléculas influye fuertemente en las texturas observadas por MLP. Podemos obtener dos tipos de alineación: la alineación planar, en la cual el eje óptico longitudinal de las moléculas se encuentren paralelo al plano formado por la superficie del soporte y la alineación ortogonalhomeótropa, en donde las moléculas que se encuentran con su eje longitudinal perpendicular a éste plano. Figura 11: Equipo para microscopia de luz polarizada 27 Se utilizó un equipo Linkam THMSE 600, conectado a un PC con un controlador de temperatura CI / 93, el cual está ubicado en un Microscopio de luz polarizada Leica DMLP (Figura 11). Con formato: Sangría: Izquierda: 0 cm 3.3.6. Técnica piroeléctrica Esta técnica es sensible a cualquier cambio de polarización macroscópica, ya sea espontánea o no. En una medida piroeléctrica la celda está conectada a un circuito eléctrico externo, el cual considera una resistencia de referencia RL y un campo eléctrico aplicado DC. Cuando la fuente externa está apagada, la corriente es generada por cambios de temperatura, los que inducen un cambio en la densidad de carga superficial, el que podemos asociar a un cambio en la polarización. Para desarrollar las medidas piroeléctricas de cada celda (1) se utilizó un equipo como el descrito en la Figura 12, en donde la muestra se ubica introducidas en el horno termo regulado Linkam THMSE 600 (2), trabajando en un rango de temperatura entre 30°C y 180°C. Los procesos de calentamiento y enfriamiento se programaron con un PC compatible (3). Para aplicar el estimulo térmico se utilizó un láser de diodo semiconductor de λ=690 nm y P=27mW (4) alimentado por corriente de 5 V DC (5). Las señales obtenidas se almacenaron en un computador (3), e. El cual que también controla la modulación de la frecuencia entregada por un Amplificador Lock-In EG&G 7260 (6), la cual se utilizó principalmente en 35 y a 70 Hz. Como control, y la señal es visualizada en un osciloscopio HP 54603B (7). Los compósitos fabricados fueron fundidos e introducidos por capilaridad en una celda comercial, recubierta con ITO como conductor, recubiertos de poliamida, con un espacio de 6,8 μm. Una vez 28 introducido el material fue calentado al isótropo y poleado con 100 V (D.C.) y enfriado con este voltaje a 5 C°/min. Figura 12: Esquema del set-up utilizado en la determinación de respuesta piroeléctrica 4. RESULTADOS Y DISCUSIÓN 4.1. Síntesis y caracterización de perovskitas BaTiO3 4.1.1. Método solvotérmico Con este método se Se produjo obtuvo un precipitado blanco caseoso en la solución madre que al momento de ser lavado con una solución acética a pH 45 se suspendió completamente dando una apariencia más lechosa. E, esto puede deberse a dos razones, : la primera es que la presencia de BaCO3 provocaría la aglomeración de NpBT. E, estas impurezas son solubles a pH inferiores a 5 y esto se evidencian debido a puesto que al adicionar paulatinamente acido acético se desprende CO2. E, el acetato de bario es soluble en agua por lo que éste queda en solución. E, el exceso de iones H3O+ - neutraliza el OH presentes sobre la superficie facilitando el intercambio del Con formato: Subíndice Con formato: Superíndice Con formato: Superíndice contra ión. Por otro lado el punto isoeléctrico de BT se encuentra entre 4 y -5. Por lo que al cambiar el contra ion alrededor del Ti +4 por acetato, al llegar al 29 Con formato: Superíndice punto isoeléctrico, se debilita la interacción partícula-partícula por lo que los flóculos formados requieren menor energía para ser resuspendidos (Figura 13). CH3 HO HO + HO - Na HO - HO + Na - HO - HO + Na HO HO- - HO O O CH3 - - CH3 O O - - - O + Na - + HO O - H3C Na - HO - HO HO - O CH3COOH O - O O - O O H3C H3C O H3C O CH3 pH 4-5 - - - - O O O - O - O CH3 O H3C Figura 13: Efecto del cambio de contraion alrededor de la NpBT. Luego de lavar y secar, como se describió en la metodología y secar, se realizo un DSC del polvo, utilizando aproximadamente 25 mg en la celda. E, en este no se aprecia un pico de entalpia a la temperatura señalada (125-130°C), pudiendo debido erse probablemente a la presencia de una estructura cubica metaestable a temperatura ambiente como ya se ha mencionado en la sección 1.2. También en el difractograma de polvo se observan interferencias que no corresponden al producto buscado y que deben corresponder a impurezas como TiO2, BaO, BaCO3, etc., además de ser evidente la falta de tetragonalidad en la muestra (Figura 14). A B 30 150 100 R.I. BaCO3 50 BaO TiO2 BaTiO3 BaTiO3 BaO 0 20 30 40 2 50 60 70 80 Figura 14: A) DSC, B) DRX del producto seco La suspensión en DMF rápidamente se agregaba al diluirla en agua, por lo que se utilizo finalmente para TEM una dilución al 1% v/v de la suspensión en DMF, en acético a pH 5 para disminuir la agregación. Las imágenes muestran nanopartículas de tamaño homogéneo y superficie irregular agregadas considerablemente, de un diámetro medio de 42.5 nm (Figura ). Figura 15: Imagen de TEM a 30000x de aumento e histograma de la dispersión de tamaño donde se aprecia el diámetro con mayor frecuencia (40-45 nm).---¿??? 4.1.2. Método por calcinación de gel precursor El precursor seco (NpBT-0h), con apariencia vidriosa y fuerte olor a acido acético, se sometió al análisis termogravimétrico (Figura 16) presentando un 31 perfil similar a los descrito en literatura. en En este podemos distinguir 3 zonas, la primera hasta 100°C donde se encuentra una perdida de agua y solventes volátiles, que no fueron eliminados en el proceso de secado o bien absorbidos después de este, que representa una perdida de masa cercana al 5%. , luego Luego entre 250 y 450°C una zona de gran perdidapérdida de masa correspondiente a la descomposición de materia orgánica, en conjunto con la formación de BaCO3 y Ti-complejo (TixOyCO3z)n, y quese desprende un olor característico a quema de materia orgánica, representando una perdida del 22%. , sSobre los 600°C y hasta 750°C aproximadamente existe una zona donde se descomponen los carbonatos precursores, seguido de un proceso alrededor de 800°C donde se forma el oxido complejo BaTiO3., en En este periodo se puede perder entre 8 y 10% del material. , eEste método nos entrega por una parte la cantidad de masa que se pierde y su razón de cambio y por otra la posibilidad de seguir el proceso determinando la temperatura de trabajo optima. De esta forma, se estimó que en este ultimo aspecto la temperatura de calcinación no debe ser menor a 900°C, para asegurar la descomposición de todas las impurezas presentes. , pPor otra parte el punto de fusión del BaTiO3 está cercano a los de 1.100°C, por lo que la temperatura del proceso entonces se fijóara a 1.000°C. 100 -0.30 TG DTA razon de cambio %/°C -0.25 Perdida de peso % -0.20 80 -0.15 -0.10 -0.05 60 200 400 600 Temperatura °C 800 0.00 1000 Figura 16: TGA y DTGA del polvo secado NpBT-0h a 150°C 32 El análisis por calorimetría de barrido diferencial entre 40 y 180°C muestra el perfil característico de materiales con transición difusa (Figura 17-A), tal vez amorfa, conclusión desprendida por el ancho del pico cuyo máximo se encuentra a 105°C, y que también se puede observar en un difractograma de rayos X (Figura 17-B). E, en este además se aprecian algunas señales características de materiales laminares macromoleculares. A B 70 3 7x10 60 3 6x10 50 3 40 R.I. C (W/g) 5x10 3 4x10 30 3 3x10 20 3 2x10 10 3 1x10 40 60 80 100 120 temperatura (°C) 140 160 180 0 10 20 30 2 40 50 60 70 80 Figura 17: A) DSC polvo secado a 150°C B) XRD de NpBT-0h seco Las imágenes de microscopia electrónica dan cuenta de un material particulado heterogéneo con zonas poco contrastadas, con un radio de partícula medio cercano a los 150 nm (Figura )., Varias pueden ser las causas que explican estas características: se podría deber a la presencia de distintos materiales dentro de la nanopartícula por una parte, ; a una gran cantidad de 33 complejos macromoleculares de Ti-acetato-Ba. , eEsto determinaría posteriormente el tamaño de la partícula ya que un gran porcentaje del volumen de éesta desaparecerá en el tratamiento térmico tal como lo indica el análisis termo gravimétrico. También el patrón de difracción de rayos X apoya lo anteriormente dicho en cuanto a la estructura amorfa del precursor. Figura 18: Imagen TEM del precursor seco resuspendido en acético glacial, tomada a 12000x e histograma de la distribución de su tamaño En primer lugar el crudo se sometió a una hora de calentamiento a 1000°C en un crisol de porcelana previamente tarado. , la La masa de precursor seco y pulverizado fue de 18,875 g. , pPosterior al calentamiento la masa remanente fue de 11,579 g lo que da un decremento de 38,6% el TGA (Figura ) del producto resultante del tratamiento térmico por 1 hora del precursor (NpBT1h) muestra una perdida cercana al 5% en su mayoría producida alrededor de 800°C, punto en el temperatura a la cual se produce la formación de BaTiO3. 34 100 -0.025 95 -0.020 85 -0.015 80 -0.010 75 70 razon de cambio %/°C Perdida de peso % 90 -0.005 65 60 200 400 600 800 0.000 1000 Temperatura °C AAG 1h Figura 19: TGA del NpBT-1h a 1000°C El DSC de NpBT-1h (Figura 20-A) muestra un pequeño hombro a 120° y la disminución drástica del la señal del crudo (BT-0h)., lLa señal de la transición de fase entre 120 y 130°C es casi imperceptible, lo que hace suponer que solo un pequeño porcentaje de la mu8estra presenta transición tetragonal-cubica. A B 35 150 400 200 3 2.2x10 100 3 2.0x10 300 50 200 3 43 44 45 46 47 200 3 1.6x10 intensidad C (mW/g) 1.8x10 3 1.4x10 100 3 1.2x10 0 3 1.0x10 40 60 80 100 t°C (°C) 120 140 160 180 40 60 2 80 100 Figura 20: A) DSC de NpBT-1h; B) Patrón XRD de NpBT-1h con detalle a 45° El patrón de difracción de rayos X (Figura 20-B), muestra una combinación de señales que da cuenta de la coexistencia de la especie tetragonal y cubica siendo esta última la que predomina en intensidad de señal. , eEl ángulo más importante para discriminarlas es ° puesto que los patrones de NpBT cúbica (Pm3m) y tetragonal (P4mm), tienden a parecerse bastante. , lLa simetría cubica posee una única señal intensa cercana a dicho ángulo correspondiente al plano la cara 200, a diferencia de la tetragonal donde aparece otra señal pequeña junto a la anterior correspondiente al plano la cara 002. Las microscopia de imágenes de transmisión de electrones (Figura ) muestran un particulado material poco homogéneo, prácticamente diferencias en el contraste y de forma y irregular. tamaño sin 36 40 30 20 Con formato: Centrado 10 0 10 20 30 40 50 Figura 21: Imagen de TEM de NpBT-1h a 20000x En vista de lo anterior se propuso determinó aumentar el tiempo de calentamiento a 3 horas a la misma temperatura. El procedimiento fue similar, se procedió en forma similar, pesando 33,595 g de precursor seco. , aAl final del proceso este pesóo 20,687 g con un decremento de 38,45%, similar a lo obtenido anteriormente. , aAl realizar un TGA del producto la pérdida total de peso de la muestra y la razón de cambio máxima próxima a 800°C mostraron diferencias considerables (Figura 22). , lLa perdida de peso porcentual al calcinar NpBT-3h fue cercana al 1% a diferencia de la anterior de 4% y la razón de cambio de peso v/s temperatura a 750°C, disminuyo de -0,0175 a -0,0025 %/°C. S, según lo descrito anteriormente, entre 600 y 700°C ocurre la descomposición de BaCO3 y Ti-complejo, por tanto podríamos deducir que las impurezas responsables de lasesta diferencias observadas serian estas especies. 37 Con formato: Justificado 100 -0.025 99 98 -0.020 97 -0.015 razon de cambio %/°C Perdida de peso % 96 95 94 -0.010 93 92 -0.005 91 90 200 400 600 0.000 1000 800 Temperatura °C AAG 3h Figura 22: TGA y DTA de NpBT-3h a 1000°C El DSC exhibe un pequeño pico cuyo máximo se encuentra entre 120 y 125°C que corresponde al la transición tetragonal-cubica (Figura 23-A), claramente distinguible. Por otra parte, en tanto el patrón de difracción de rayos X, posee un perfil de señales muy definido y de intensidades mayores, mucho mas cercano a lo descrito en literatura para la estructura buscada, de tipo tetragonal. A 600 3 2.0x10 B 80 200 002 40 3 1.8x10 400 intensidad C (mW/g) 3 1.6x10 3 1.4x10 0 43 44 45 46 47 200 200 002 3 1.2x10 3 1.0x10 40 60 80 100 120 temperatura (°C) 140 160 180 0 20 40 2 60 80 Figura 23: A) DSC de NpBT-3h; B) Patrón DRX de NpBT-3h con detalle a 45° 38 y aAl analizar la señal a 45° se observa la aparición de un hombro acoplado que podríamos identificar como el conjunto de señales asociadas a los planos 002 y 200 de la estructura tetragonal (Figura 23-B). La imagen de TEM de NpBT-3h muestra una morfología similar a la anterior NpBT-1h, bastante irregular. , pero vVisualmente se perciben menos impurezas poco contrastadas. , lLa irregularidad y agregación del material hace muy difícil la determinación de un tamaño de partícula representativo, pero se estima observando el histograma que es alrededor de 70 nm (Figura ). Figura 24: Imagen TEM de NpBT-3h a 20000x e histograma de la distribución de su tamaño. A lLas dos muestras anteriores NpBT-1h y NpBT-3h fueron expuestas a un segundo proceso de calcinación por otras 3 horas a 1.000°C, con la finalidad de determinar si éeste era capazs de modificar las características del material. 39 Con , eneste el proceso se espera que ambos productos pierdan el remanente de impurezas que poseen y al pasandor a un estado amorfo forzado sobre los 950°C. A B 100 100 -0.02 Perdida de peso % -0.01 60 0.00 temperatura (°C) 500 1000 80 -0.01 perdida de peso % razon de cambio %/°C 80 razon de cambio %/°C -0.02 60 Temperatura (°C) 500 0.00 1000 Figura 25: TGA y DTGA; A) NpBT-1+3h B) NpBT-3+3h El TGA de ambos productos (Figura 25) muestra un perfil similar, aunque existe una perdida de peso levemente mayor en NpBT-1h+3h. , lLa razón máxima de cambio a 750 ºC cualitativamente y cuantitativamente, no presenta grandes diferencias cuantitativas siendo cercana a 750°C. Es interesante observar comparar lo que ocurre al compararcon la pérdida de peso y la razón de cambio de dicha pérdida, expresada en %/ºC a 750 ºCesta (IlustraciónFigura 21), entre las cinco muestras anteriores (Figura 26). , sDe estos dactos queda claro e podría inferir que el proceso es óptimo con tres horas de calcinaciónentamiento. , debido a que A tiempos mayores, el porcentaje del peso perdido, es cercano al 1% muy próximo al lo que puede considerarse dentro del error instrumental de la balanza. A, además la razón de cambio máximarapidez en de la péerdida de masa a 750°C se mantiene prácticamente constante, alrededor de 0,002 %/ºC. 40 40 -0.040 -0.035 perdida de peso total (%) -0.030 -0.025 20 -0.020 -0.015 -0.010 -0.005 0 razon de cambio maxima (%/°C) perdida de peso total razon de cambio maxima 0.000 BT-0h BT-1h BT-1+3h proceso BT-3h BT-3+3h Figura 26: Grafico de la pérdida de peso porcentual y la razón de cambio máxima a 750°C para cada proceso El análisis térmico de barrido de BT-1+3h y BT-3+3h, exhibe una agudización del pick representativo de la transición tetragonal-cubica cercana a 125°C, con un aumento notorio de la señal, indicando la predominancia de la tetragonalidad en el material (Figura 27). A B 3 3.5x10 3 3.0x10 1h 1+3h 3h 3+3h 3 2.8x10 3 2.4x10 3 C mW/g 2.1x10 3 1.8x10 3 C mW/g 1.4x10 3 1.2x10 2 7.0x10 60 temperatura (°C) 120 180 60 temperatura (°C) 120 180 Figura 27: DSC de A) NpBT-1h y NpBT-1+3h B) NpBT-3h y NpBT-3+3h 41 Tabla 3: Der) Valores de perdida de peso porcentual y razón de cambio máxima del decremento a 750°C La difracción de Rayos X afirma confirma el aumento del conjunto de picos característicos de la forma tetragonal a 45°, aunque se aprecia en el producto NpBT-1+3h, una gran cantidad de otras impurezas, como carbonatos y óxidos de Ba y Ti, o combinación de estructuras meta-estable, que no desaparecieron después del Proceso tratamiento térmico adicional (Figura 28). A B 60 002 45 250 200 intensidad 0 43 -0,0294 BT-1h 4 -0,0175 1,7 -0,00195 44 45 46 100 0 43 47 200 1 150 BT-3+3h 50 15 200 39 BT-3h 30 %/°C BT-0h BT-1+3h200 75 300 -% 002 0,895 44 45 -0,0025 -0,00204 46 47 150 002 TiO2 50 0 20 40 60 2 80 Con formato: Posición: Horizontal: 14,36 cm, Con relación a: Página, Vertical: 2,5 cm, Con relación a: Párrafo Con formato: Posición: Horizontal: 14,36 cm, Con relación a: Página, Vertical: 2,5 cm, Con relación a: Párrafo 600 intensidad Con formato: Posición: Horizontal: 14,36 cm, Con relación a: Página, Vertical: 2,5 cm, Con relación a: Párrafo Con formato: Posición: Horizontal: 14,36 cm, Con relación a: Página, Vertical: 2,5 cm, Con relación a: Párrafo BaO 750 Tabla con formato Con formato: Posición: Horizontal: 14,36 cm, Con relación a: Página, Vertical: 2,5 cm, Con relación a: Párrafo BaTiO3 200 BaCO3 BaO 100 Con formato: Posición: Horizontal: 14,36 cm, Con relación a: Página, Vertical: 2,5 cm, Con relación a: Párrafo 450 300 200 150 002 0 20 40 2 60 80 Figura 28: A) DRX de NpBT-1+3h indicando señales de impurezas. B) DRX de NpBT-3+3h. Ambas con el detalle del conjunto de señales características a 45°. 42 Figura 29: Imagen de TEM de A) NpBT-1+3h y B) NpBT-3+3h a 3000x Por microscopia electrónica de transmisión (Figura ) se observa un aumento abrupto del tamaño de partícula en ambos productos con tres horas adicionales de calentamiento. Esto se debe, , debido probablemente, a que el material ha sido expuesto a temperaturas de amorfización con lo que se promueve también el crecimiento del cristal. , eEsto a su vez podría ser la posible causa del aumento de las señales características de la simetría tetragonal a pesar de la cantidad de otras impurezas presentes. Por ultimo se realizó un proceso con seis horas continuadas de calentamiento a 1000°C. Puesto Como que ya las variaciones de peso y su razón de cambio eran muy parecidas se decidió no realizar TGA y solo se caracterizó la muestra por realizar DSC, XRD y TEM para caracterizarlas. Mediante DSC se pudo observar que existe un aumento y mayor definición de la señal característica a 125 ºC, y un descenso de señales rlo que se esto atribuye ble a un posible aumento en la tetragonalidad del material. Esta, hipótesis que es respaldada por el patrón de difracción de rayos X, siendo de especial importancia el conjunto de señales alrededor de ya que a 45° 43 donde se puede observar observa con mayor claramenteidad el doble pico propio del sistema 002 y 200 (Figura 30). A B 150 500 3 2.4x10 200 100 3 2.2x10 400 002 50 3 intensidad relativa C (mW/g) 2.0x10 3 1.8x10 3 1.6x10 3 1.4x10 300 0 43 44 45 46 47 200 200 100 3 1.2x10 002 3 1.0x10 40 60 80 100 120 temperatura (°C) 140 160 180 0 20 40 2 60 80 Figura 30: A) DSC del producto NpBT-6h. B) DRX de NpBT-6h donde se observa en el detalle de 45° el desacoplamiento de las señales 200 y 002. Mediante Utilizando las imágenes obtenidas por TEMde microscopia electrónica de transmisión para esta última muestra (Figura 31), se midió, aunque con dificultad, el tamaño de partícula de las fotografías llegándose aobteniéndose una aproximación de su tamaño medio con alta dispersión. , aAl no poseer una distribución de tamaños de tendencia normal, es complejo hablar de un tamaño estadísticamente representativo. Entonces, por lo que se recurre a identificar el intervalo que presenta mayor frecuencia, el que está alrededor de 60 nm. 44 Figura 31: Imagen de TEM del producto BT-6h a 12000x e Histograma de la dispersión de su tamaño. 4.2. Fabricación y caracterización del nanocompósito Como se mencionó en la sección 3.2.4anteriormente, las nanopartículas así obtenidas y caracterizadas, se utilizaron para se fabricaron nanocompósitos con un sistema polímero-monómero ferroeléctricoliquido-cristalino. Las NpBT corresponden a la fracción NpBT-3h, desde ahora solo NpBT, en las que se observa tetragonalidad y un tamaño de partículas adecuadamente pequeño (alrededor de 35 nm). Las Nppartículas dBT se utilizaron con y sin funcionalizar con ácido oléico (NpBT y NpBT(OA) respectivamente (ver capitulo xxxx)). El uso de ácido oléico como compatibilizante de nanopartículas en materiales orgánicos, está descrito en la literatura40. La funcionalización del material inorgánico con cadenas largas alifáticas permite una mayor incorporación al guespemateriald organico en este caso al composito liquido-cristalino PM10M6.NpBT y NpBT compatibilizada con acido oleico, para ello se pesaron dos cantidades de NpBT con tres horas de calentamiento a 1000°C, por ser este producto el que posee las mejores características para los fines perseguidos (estructura cristalina y diámetro de particula). Al producto NpBT se 45 les realizaron los siguientes procedimientos siguientes de acuerdo a su destino final. 4.2.1. Resuspensión en DMF Fueron rotulados dos ependorff de 1,5 ml (A: 140 mg B: 148 mg de NpBT3hrespectivamente), los que fueron sonicados por 1 hora. luego Luego del proceso de ultrasonido por 1h y decantación por 30min, las cantidades en suspensión fueron, 12 y 10,5 mg respectivamente calculadascalculados por diferencia de pesoada. Las suspensiones fueron homogéneas y no presentaron sedimento luego de 72 h. para Para las imágenes de TEM se utilizaron rejillas recubiertas de carbono (Figura ). 4.2.2. Compatibilización con acido oleico BT(OA). Se utilizoó el contenido del tubo rotulado como B, con 10,5 mg de NpBT-3h, las que se y se secaron al vacio a 80° C por 24 h. Una vez secas, o el precipitado se adicionó a las nanopartículas la cantidad descrita de OA (3.2.1 Compatibilización), se sónico por 5 min para ayudar a su homogenizacion, y se lavo con Hexano 2 veces, para remover el exceso de acido oleico. Finalmente se resuspendió con 1ml de Hexano. La suspensión fue homogénea y precipitaba totalmente luego de 15 min. , eEl sobrenadante fue totalmente claro y el precipitado rápidamente se resuspendía por agitación suave, los que indicandoría que el acido es un excelente floculante para el material. A B 46 Figura 32: Imagenes de TEM de las suspenciones organicas A) NpBT en DMF. B) BT(OA) en Hexano, ambas a 20000x. 4.2.3. Fabricación del compósito PM10M6 Se procedió de la forma indicada en la sección 3.2.3. , eEl producto posee un aspecto plástico, céreo, homogéneo y compacto. La técnica de microscopía de luz polarizada fue utilizada de igual forma que en los polímeros, para ratificar la temperatura de aclaramiento obtenida por los gráficos termogramas de DSC (Figura 33), ya que la microestructura de las mezclas es muy pequeña como para realizar un análisis de texturas. 4.2.4. Fabricación de los nanocompósitos Al proceder como lo descrito en la sección 3.2.4, se obtuvieron dos nanocompósitos: i. PM10M6FLC/BT 5% Se pesaron 26 mg de FLC y se disolvieron en la mínima cantidad de THF. , aA esta solución se adicionaron 114 µl de una suspensión de NpBT-3h en DMF 12 mg/ml. , lLuego de evaporar rápidamente el solvente al vacio y llevar el solido a 200°C, Sse obtuvo un producto con características similares al compósito original. En la microscopia de luz polarizada (ver Anexo), se presenta una textura microestructurada, homogénea como la de PM10M6 sin modificar 47 pero esta vez con granulación dispersas en la matriz. N, no son detectables por este método los cambios de fases observados en el DSC (Figura 33), en el cual se aprecia una modificación en el perfil de mesofases con respecto a la matriz. Al analizar el DSC de ambos (PM10M6 y PM10M6/BT 5%), podemos distinguir básicamente dos diferencias; : (1) el corrimiento a temperaturas mas bajas y disminución de las señales presentes en la matriz original hacia 60 y 160°C respectivamente con una disminución de la señal algo propio de un plastificante y (2) la aparición de dos picos (con mesofases asociadas), una a 85 y otra a 97°C, lo que estaría asociado a la aparición de una mesofase o a algún otro cambio en la configuración del material. ii. PM10M6/BT(OA)5% Para fabricar este nanocompósito se pesaron 30 mg de FLC, y se siguió el mismo procedimiento anteriormente descrito en (i), adicionando 150 µl de la suspensión que contiene 10,5 mg/ml de NpBT-3hOA en Hexano, previamente estabilizada con Acido oleico. Por microscopia de luz polarizada se observa que el composito fabricado en frio al ser calentado por sobre la temperatura del isótropo no recupera sus características y se observan zonas en el material con distintas texturas, existiendo una zona granulosa y otra en la que se observan texturas definidas similares al monómero pero a mayores temperaturasXXXXXXX .. por Por DSC se puede corroborar la información anterior, observando el corrimiento del pico a temperaturas menores correspondiente a la transición al estado isotrópico desde 165° hasta 145°C. , eEl primer pick correspondiente a la transición desde el estado cristalino, no es posible observarlo en la condicioneslas condiciones en las que se realizó el termograma. llevaron a cabo las mediciones, se postula que estaría a temperaturas inferiores. 48 4.2.5. Caracterización piroeléctrica de los compósitos Los compositos fabricados fueron fundidos e introducidos por capilaridad, en una celda marca blabla, recubierta con ITO como conductor recubiertos con una blablá de poliamida, con un espacio de XX μm, como lo muestra el esquema del anexo X. al analizar sus respuestas piroelectricasEn primer lugar se mezclo monómero M6R6 con un 40% de BT a fin de identificar su respuesta piroelectrica en una matriz que no presenta señal obteniéndose un pick cercano la temperatura de transición de alrededor de 2,8 mV de magnitud. Luego de realizar el estudio con las tres celdas se pudo observar que: la matriz de Liquido-cristalina posee una respuesta piroelectrica máxima entre 50 y 120°C de 15µV promedio. 49 Con formato: Sangría: Primera línea: 1,25 cm 2000 40 60 80 100 120 140 160 180 200 120 140 160 180 200 PM10M6/BT:OA 5% C mW/g 1500 1000 500 PM10M6/BT 5% C mW/g 1500 1000 500 C mW/g 2000 PM10M6 1500 1000 500 40 60 80 100 temperature (°C) Figura 33: DSC de los compósitos preparados En tanto el compósito que contiene NpBT-3h presentó una señal casi 10 veces mayor que la matriz original, con un máximo cercano a 150 µV a 60°C. este máximo decrece lentamente hasta 125 µV a 125°C temperatura a la cual comienza a decrecer abruptamente. Por otra parte el nanocompósito que contiene NpBT-3h/OA, no presenta señal piroeléctrica (Figura ). 50 175.00µ PM6R10 M6R6 33% PM6R10 M6R6 33% BT 5% PM6R10 M6R6 33% BT 5% OA 150.00µ Magnitud(uV) 125.00µ 100.00µ 75.00µ 50.00µ 25.00µ 0.00 40 60 80 100 120 Temp(C) 140 160 180 Figura 34: Señales piroeléctricas de los nanocompósitos preparados Con formato: Centrado, Sangría: Primera línea: 0 cm, No conservar con el siguiente Con formato: Fuente: Sin Negrita 1. Con formato: Fuente: Sin Negrita Con formato: Fuente: Sin Negrita Con formato: Epígrafe, Centrado, Conservar con el siguiente Con formato: Sin viñetas ni numeración Con formato: Esquema numerado + Nivel: 1 + Estilo de numeración: 1, 2, 3, … + Iniciar en: 1 + Alineación: Izquierda + Alineación: 0 cm + Sangría: 0,63 cm 1. CONCLUSIONES Con formato: Fuente: Sin Negrita, Sin subrayado Con formato: Sin viñetas ni numeración 5. Conclusiones Con formato: Título 1, Ninguno, Espacio Antes: 0 pto Mediante el método hidrotermal utilizado, fue posible obtener NpBT pequeñas, del orden de los 40 nm y de tamaños homogéneos, pero que al ser caracterizadas no presentaron estructura tetragonal debido probablemente a la presencia de impurezas en su estructura como ya se ha mencionado. Este método requiere, por tanto, mayor cuidado de las condiciones de síntesis y 51 Con formato: Normal, Sin viñetas ni numeración Con formato: Esquema numerado + Nivel: 1 + Estilo de numeración: 1, 2, 3, … + Iniciar en: 1 + Alineación: Izquierda + Alineación: 0 cm + Sangría: 0,63 cm Con formato: Título 1, Ninguno, Espacio Antes: 0 pto métodos de purificación más eficientes, considerando las características morfológicas finales del producto. Un segundo método de síntesis por calcinación de un gel órganometálico, permitió la obtención de un nano-polvo de alta pureza que presentó estructura P4mm a temperatura ambiente. Sus propiedades estructurales guardaron relación con el tiempo de calentamiento, observándose un aumento de tetragonalidad aumentando el tiempo del tratamiento térmico. Según los resultados expuestos anteriormente a tres horas de calentamiento se obtiene un producto con las propiedades buscadas en este trabajo, siendo un nano-polvo irregular en forma y tamaño y que requiere condiciones drásticas de re-suspensión. La DMF resulto ser un solvente adecuado para resuspender las NpBT, mientras que el ácido oleico actúa como un excelente floculante para NpBT en solventes muy apolares como hexano. Fue posible obtener Nanopartículas de BaTiO3 tetragonales con señal piroeléctrica y utilizarlas para la preparación de un nanocompósito mesogénico, mejorando las propiedades piroeléctricas del sistema. La mezcla entre el compósito líquido-cristalino y NpBT-3h resulta ser bastante estable en un rango amplio de temperaturas, así mismo las texturas del compósito PM10M6 comparadas con PM10M6/NpBT-3h son bastante similares, tal vez debido a que la Nanopartícula no modifica la conformación supramolecular del compósito, lo que explicaría la conservación de las propiedades piroeléctricas, y el aumento de la señal piroeléctrica original gracias a la mayor constante dieléctrica del nanomaterial inorgánico. La incorporación de surfactantes, unidos en forma reversiblemente a la superficie de la nanopartícula, como agentes estabilizantes de la mezcla, no es útil en materiales cuyas características dependen de su estructuración 52 supramolecular. En este caso al calentar la mezcla, el ácido oleico migra hacia la matriz alterando su estructura, posiblemente por desplazamiento del componente monomerico, ocasionando la separación de la mezcla a temperaturas superiores al punto de aclaramiento, siendo esta inestabilidad probablemente la responsable de la perdida de la señal piroeléctrica. Finalmente se postula que el origen del aumento en la señal piroeléctrica está dado por las características ferroeléctricas de la nanocerámica y por las interacciones que ésta tiene con la matriz liquido-cristalina. 53 5.6. ANEXO 54 55 56 6.1. Conclusiones generales Con formato: Título 2 1. 7.1. Con formato: Título 1, Ninguno, Espacio Antes: 0 pto, Esquema numerado + Nivel: 3 + Estilo de numeración: 1, 2, 3, … + Iniciar en: 1 + Alineación: Izquierda + Alineación: 1,27 cm + Sangría: 2,16 cm ANEXOS Aexo A: Esquemas Con formato: Esquema numerado + Nivel: 1 + Estilo de numeración: 1, 2, 3, … + Iniciar en: 1 + Alineación: Izquierda + Alineación: 0 cm + Sangría: 0,63 cm Con formato: Oculto Con formato: Título 1, Ninguno, Espacio Antes: 0 pto Con formato: Sangría: Primera línea: 0 cm Ilustración 29: esquema de la celda utilizada para la medicion de propiedades piroelectricas 7. BIBLIOGRAFÍA 1 LINES M.E. , GLASS A.M., BASIC CONCEPTS, En su: PRINCIPLES AN APPLICATIONS OF FERROELECTRICS AND RELATED MATERIALS,3° EDITION, NEW YORK, CLARENDON PRESS OXFORD, 2001, pp.1-19. 2 J. VALASEK, PIEZOELECTRIC AND ALLIED PHENOMENA IN ROCHELLE SALT, PHYS REV.(15) :537-541, Oct. 1920. 57 Con formato: Fuente: 12 pto, Superíndice Con formato: Fuente: 12 pto, Superíndice Con formato: Fuente: 12 pto Con formato: Fuente: 12 pto, Sin Cursiva, Subrayado Con formato: Fuente: 12 pto 3 KURCHATOV I.V. (1933). SEGNETOELEKTRIKI MOSCOW; C-M GTTI, ABBEVIATED FRENCH VERSIÓN PUB. HERMANN AND CIE, PARIS, 1936. 4 I. PRITULA ET AL. LINEAR AND NONLINEAR OPTICAL PROPERTIES OF DYE-DOPED KDP CRYSTALS: EFFECT OF THERMAL TREATMENT, OPTICS COMMUNICATIONS (282): 1141–1147, Jun. 2009 5 JIHUA PENG ET AL. STUDY ON THE MICROSTRUCTURAL EVOLUTION OF BATIO3 ON TITANIUM SUBSTRATE DURING MAO, MATERIALS LETTERS, (62): 1801–1804, Oct. 2007 6 I. PRITULA ET AL. LINEAR AND NONLINEAR OPTICAL PROPERTIES OF DYE-DOPED KDP CRYSTALS: EFFECT OF THERMAL TREATMENT, OPTICS COMMUNICATIONS, (282): 1141–1147, Ene. 2009 7 UNIVERSIDAD DE NAVARRA, CAMPUS TECNOLOGICO, DEPARTAMENTO DE INGENIERIA EN MATERIALES [en línea] <http://www.tecnun.es/asignaturas/PFM_Mat/Prog/Ferroelecv2.pdf>[consulta : 04 OCTUBRE 2008]. 8 D. TALANTIKITE, L. TAÏBI-BENZIADA, PHASE TRANSITIONS OF CATIO3 CERAMICS SINTERED WITH THE AID OF NaF AND MgF2 SOLID STATE SCIENCES, 28 1-5, May. 2008 9 S.K. MANIK ET AL. NANOCRYSTALLINE CATIO3 PREPARED BY SOFTCHEMICAL ROUTE, PHYSICA E, (25): 421–424, Mar. 2005. 10 LINES M.E., GLASS A.M., OXYGEN OCTAHEDRA, En su: PRINCIPLES AN APPLICATIONS OF FERROELECTRICS AND RELATED MATERIALS,3° EDITION, NEW YORK, CLARENDON PRESS OXFORD, 2001, pp. 241-285. 11 A. MELDRUM ET AL., AMORPHIZATION AND RECRYSTALLIZATION OF THE ABO3 OXIDES, JOURNAL OF NUCLEAR MATERIALS, (300): 242–254, Jul. 2002. 12 JUAN LI ET AL. PREPARATION OF A MONODISPERSED SUSPENSION OF BARIUM TITANATE NANOPARTICLES AND ELECTROPHORETIC DEPOSITION OF THIN FILMS, JOURNAL AMERICAN CERAMICS SOCIETY, (8), 87, 1578-1581, Ene. 2004. 13 R. MACHADO, FERROELECTRICOS CERAMICOS, REVISTA MEXICANA DE FÍSICA, 51 (2): 186–192, Abr. 2005. 58 Con formato: Fuente: 12 pto, Superíndice 14 T. YAN ET AL., SIZE DEPENDENCE ON THE FERROELECTRIC TRANSITION OF NANOSIZED BATIO3 PARTICLES, MATERIALS CHEMISTRY AND PHYSICS, (98): 450–455, May. 2006. 15 FAN GUANGNENG, HUANGPU LIXIA, HE XUEGUANG, SYNTHESIS OF SINGLE-CRYSTAL BATIO3 NANOPARTICLES VIA A ONE-STEP SOLPRECIPITATION ROUTE, JOURNAL OF CRYSTAL GROWTH, (279): 489– 493, Feb. 2005. 16 MADONA BOULOS ET AL., HYDROTHERMAL SYNTHESIS OF NANOSIZED BATIO3 POWDERS AND DIELECTRIC PROPERTIES OF CORRESPONDING, CERAMICS SOLID STATE IONICS, (176): 1301 – 1309, Feb 2005. 17 N.C. PRAMANIK ET AL., WET CHEMICAL SYNTHESIS OF REDISPERSIBLE CRYSTALLINE BATIO3 IN ORGANIC MEDIUM, JOURNAL OF ALLOYS AND COMPOUNDS, (449): 77–81, Jun. 2008. 18 X. WANG ET AL., SYNTHESIS OF BATIO3 NANOCRYSTALS BY STEARIC ACID GEL METHOD, JOURNAL OF ALLOYS COMPOUNDS, (204): 33–36, AGO. 1994. 19 A. MELDRUM ET AL., AMORPHIZATION AND RECRYSTALLIZATION OF THE ABO3 OXIDES, JOURNAL OF NUCLEAR MATERIALS, (300): 242–254, 2002 20 L. WANG ET AL., WET ROUTES OF HIGH PURITY BATIO3 NANOPOWDERS, JOURNAL OF ALLOYS AND COMPOUNDS, (440): 78–83, Nov. 2007. 21 CORRIE T. IMRIE, PETER A. HENDERSON, LIQUID CRYSTAL DIMERS AND OLIGOMERS, CURRENT OPINION IN COLLOID & INTERFACE SCIENCE, (7),5-6: 298-311, Nov. 2002. 22 JOHN W. GOODBY ET AL, MOLECULAR COMPLEXITY AND THE CONTROL OF SELF-ORGANISING PROCESSES, LIQUID CRYSTALS, (36), 6–7: 567-605 Jun–Jul. 2009. 23 H. TAKEZOE, FERROELECTRIC, ANTIFERROELECTRIC, AND FERRIELECTRIC LIQUID CRYSTALS: APPLICATIONS, ENCYCLOPEDIA OF MATERIALS SCIENCE AND TECHNOLOGY, (25): 3063-3074, NOV 2008 59 24 OZHAN KAYACAN, NONEXTENSIVE MEAN-FIELD THEORY FOR FERROELECTRIC NEMATIC LIQUID CRYSTAL PHASES, CHEMICAL PHYSICS, (317): 63-72, Oct. 2005. 25 M.F. BONE ET AL., FERROELECTRIC LIQUID CRYSTAL DISPLAY CAPABLE OF VIDEO LINE ADDRESSES TIMES, DISPLAYS, (8). 115-118 Jul. 1987. 26 ABHISHEK KUMAR SRIVASTAVA ET AL. FERROELECTRIC LIQUID CRYSTALS VERSUS DYED FERROELECTRIC LIQUID CRYSTALS IN SMC* PHASE, PHYSICS LETTERS A, (371), 5-6: 490-498, Nov 2007. 27 HIDEO FUJIKAKE ET AL, POLYMER-STABILIZED FERROELECTRIC LIQUID CRYSTAL FOR FLEXIBLE DISPLAYS, DISPLAYS, (25): 3-8, MAY 2009. 28 E.A.SOTO BUSTAMANTE, S.V.YABLONSKI, L.A.BERESNEV, L.M.BLINOV, W. HAASE, W.DULTZ, YU.G.GALYAMETDINOV, “METHODE ZUR HERSTELLUNG VON POLYMEREN PYROELEKTISCHEN UND PIEZOELEKTRISCHEN ELEMENT” GERMAN PATENT: NO.195 47 934.3 (20.12.95) DE195 47 934 A1, (26.06.97), EUROPEAN PATENT: EP 0 780 914 A1 (25.06.97), JAPAN PATENT: JP 237921/907 (09.09.97), U.S.PATENT: US 5 883 833, (10.11.98). 29 S. KOMARNENI, J.C. PARKER, G.J. THOMAS, NANOPHASE AND NANOCOMPOSITE MATERIALS, PITTSBURGH, PA, 1993, pp. 246, (MATERIALS RESEARCH SOCIETY). 30 G. CAROTENUTO ET AL., PREPARATION OF MICROMETRIC SILVER FILAMENTS FOR POLYMERIC PRESSURE SENSORS, SENSORS AND ACTUATORS A: PHYSICAL, (132): 541-546, Nov. 2006. 31 JINGHONG LI, JIN Z. ZHANG, OPTICAL PROPERTIES AND APPLICATIONS OF HYBRID SEMICONDUCTOR NANOMATERIALS, COORDINATION CHEMISTRY REVIEWS, (253), 23-24: 3015-3041, Dic. 2009. 32 JING JIANG, LIANGCHAO LI, MINGLI ZHU, POLYANILINE/MAGNETIC FERRITE NANOCOMPOSITES OBTAINED BY IN SITU POLYMERIZATION, REACTIVE AND FUNCTIONAL POLYMERS, (68), 1: 57-62, Ene. 2008. 33 M. G. KANATZIDIS ET AL., STRUCTURAL AND ELECTRONIC ANISOTROPY IN POLYCRYSTALLINE COMPACTIONS OF THE HIGH-TC SUPERCONDUCTOR EuBa2Cu3O7−Δ, SOLID STATE COMMUNICATIONS, (65), 11: 1333-1337, Mar. 1988. 60 34 F. PIRET ET AL., A NEW SERIES OF OPTOELECTRONIC NANOCOMPOSITES: CMI-1 MESOPOROUS CORE/ZnS SHELL, CHEMICAL PHYSICS LETTERS, (441), 1-3: 83-87, Jun. 2007. 35 K.S. LEE ET AL., WAVEGUIDE PROPERTIES AND OPTICAL SWITCHING OF PRISM-COUPLED AU:SIO2 NANOCOMPOSITE FILMS, APPLIED SURFACE SCIENCE, (254), 23: 7893-7896, Sep. 2008. 36 CHENHUI WANG, PHILIP J. BOS, BISTABLE C1 FERROELECTRIC LIQUID CRYSTAL DEVICE FOR E-PAPER APPLICATION, DISPLAYS, VOLUME 25, 5 187-194, Dic. 2004. 37 LONGHAI PIAO ET AL., THE SIMPLE AND FACILE METHODS TO IMPROVE DISPERSION STABILITY OF NANOPARTICLES: DIFFERENT CHAIN LENGTH ALKYLCARBOXYLATE MIXTURES, JOURNAL OF COLLOID AND INTERFACE SCIENCE, (334), 2: 208-211, Jun. 2009. 38 MANJUNATHA PATTABI, B. SARASWATHI AMMA, K. MANZOOR, PHOTOLUMINESCENCE STUDY OF PVP CAPPED CDS NANOPARTICLES EMBEDDED IN PVA MATRIX, MATERIALS RESEARCH BULLETIN, (42), 5: 828-835, May. 2007. 39 CHIA-CHEN LI, MEI-HUI CHANG, COLLOIDAL STABILITY OF CUO NANOPARTICLES IN ALKANES VIA OLEATE MODIFICATIONS, MATERIALS LETTERS, VOLUME 58, 30: 3903-3907, Dic. 2004. s: Pendiente DSC de BT-HT MLP de nanocompósitos Con formato: Sangría: Primera línea: 0 cm, Interlineado: sencillo Con formato: Inglés (Estados Unidos) Repetición de piroe Con formato: Inglés (Estados Unidos) Con formato: Resaltar 61 40 SHINN-JEN CHANG ET AL., AN EFFICIENT APPROACH TO DERIVE HYDROXYL GROUPS ON THE SURFACE OF BARIUM TITANATE NANOPARTICLES TO IMPROVE ITS CHEMICAL MODIFICATION ABILITY, JOURNAL OF COLLOID AND INTERFACE SCIENCE, (2): 300-305, Ene 2009, 62