Document
Anuncio

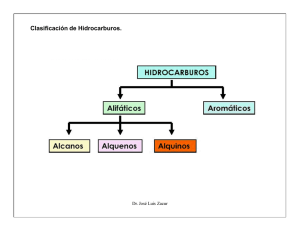
ALQUENOS, ALQUINOS Y POLIENOS Alqueno sp2 1 σ (C-C) 1 π (C-C) Dieno Conjugado Los enlaces π se extienden parcialmente a los 4 C Dieno Aislado El carbono sp3 interrumpe la conjugación Alquino sp 1 σ (C-C) 2 π (C-C) Alquenos, polienos y alquinos en la naturaleza H H H H eteno β-caroteno (E)-Dec-2-en-4,6,8-triinoato de metilo progesterona retinal Histrionicotoxina Comparación de las propiedades de enlace y propiedades físicas Los alcanos, alquenos y alquinos tienen propiedades físicas parecidas: Los isómeros configuracionales de los alquenos tienen propiedades físicas diferentes X X X X Momento dipolar neto Dienos Conjugados El solapamiento lateral de los cuatro orbitales atómicos p produce “delocalización” de los electrones p en los cuatro átomos de C. Esto explica el carácter doble parcial del enlace central. Los alcanos, alquenos y alquinos son compuestos muy poco ácidos. Solo reaccionan con bases muy fuertes H H H C C H H H H H C C C C - H H H H C Ka = 10-50 + H+ Ka = 10-44 + H+ Ka = 10-25 H H H + H+ - C H C H C H H H H C C - Electrófilos y Nucleófilos ELECTRÓFILO es una sustancia capaz de ACEPTAR un (o mas) par de electrones. NUCLEÓFILO es una sustancia capaz de DONAR un (o mas) par de electrones F F H Capaz se aceptar un par de electrones N B F F H Capaz se donar un par de electrones ELECTRÓFILO (Acido de Lewis) F H B + N F H H H NUCLEÓFILO (Base de Lewis) F F H B N F H H H H H H C C C+ H H H Capaz se aceptar un par de electrones ELECTRÓFILO Carbocation H H H H C C C- H H H Capaz se donar un par de electrones NUCLEÓFILO Carbanion H H Capaz se donar un par de electrones π H H NUCLEÓFILO Centros de ataque Electrófilos y Nucleófilos en una molécula O C O O δO + C O - δ+ C δ+H Cl O C O centro “electrofílico” H H + δ- centro “nucleofílico” δ- - O H H C δ+ δ C C X H H H δ+ δ- Br Br Cl Al Cl Cl REACCIONES DE ADICIÓN ELECTROFÍLICA Un doble enlace C=C tiene una nube electrónica π desde la que se pueden ceder electrones a un atacante electrófilo. Por tanto, la reacción más importante de los alquenos es la adición electrófila. El X-Y puede ser hidrógeno, un hidrácido (HX), agua, etc. Reducción catalizada de alquenos Un alqueno e hidrógeno reaccionan en la presencia de una suspensión de un catalizador heterogéneo (Pd/C, PtO2 o Ni-Raney) para dar un alcano (usando alcoholes o esteres como solvente) El hidrógeno se escinde en la superficie del metal, formándose dos átomos de hidrógeno electrófilos y muy reactivos. La π del doble enlace es así atacada fácilmente por los H, obteniéndose el alcano correspondiente. La adición es sin. Reducción catalizada de alquinos La hidrogenación de alquinos puede llevarse a cabo de manera total hasta llegar al alcano usando un catalizador (Pd/C, PtO2 o Ni-Raney) H + 2 H2 H H H Para reducir eficientemente alquinos a alquenos con metales es necesario limitar la actividad de éstos. Un ejemplo es el catalizador de Lindlar, en el que el Pd se envenena con diversas sustancias para hacerlo menos activo H H Adición de hidrácidos al doble enlace (HX) Regla de Markovnikov: El protón del haluro de hidrógeno se une al carbono menos substituído (la protonación inicial del alqueno se produce de forma que se obtenga el carbocatión mas estable) H+ H3C H C H H H H H C C C H H H + C H H H+ H H + C C C H H H H Carbocation secundario mas estable Esquema de energía para la adición de hidrácidos al doble enlace (HX) Adición de hidrácidos (HX) al triple enlace El alquino ataca al protón del haluro de hidrógeno, produciéndose el carbocatión mas estable, que es el más sustituido. La siguiente adición al alqueno resultante sigue la misma pauta, produciéndose una doble adición Markovnikov y el dihaluro geminal. Adición 1,2 y 1,4 de hidrácidos (HX) en dienos La adición también sigue la regla de Markovnikov, aunque es posible formar mas de un carbocation intermediario H H C H H H C C H H C H C C + H C C H H H Adición 1,2 H H H+ C H H + C H C C H H Adición 1,4 H La adición da lugar a TRES productos distintos (acá solo consideramos el ataque al carbono primario) Adición de agua catalizada por ácidos a doble y triple enlaces Alqueno Alquino Adición de halógenos al doble enlace La nube π del doble enlace puede provocar la ruptura heterolítica de la molécula de bromo, formándose un intermedio reactivo con estructura de catión heterociclopropano, que se abre por ataque del contraión haluro, dando lugar a un dihaloderivado vecinal de estereoquímica anti. Oxidación de un alqueno Las olefinas suponen un estado de oxidación del carbono relativamente bajo y, por tanto, pueden transformarse en otras sustancias más oxidadas. La oxidación de olefinas puede llevarse a cabo de forma suave o enérgica Test de Baeyer (disolución diluída de permanganato en frío): El cambio de color pone de manifiesto la presencia de un doble enlace (las cetonas, aldehido y alquinos interfieren con el ensayo) Polimerización de alquenos y dienos Las olefinas pueden reaccionar consigo mismas para dar lugar a moléculas de longitud variable. Si se unen dos moléculas se obtienen dímeros. Si las cadenas formadas son de longitud corta de denominan oligómeros y si son de larga (miles de unidades de monómero), polímeros. La polimerización de las olefinas puede lograrse por diversos métodos: Polimerización catiónica Polimerización aniónica Polimerización radicalaria Al igual que los alquenos, los alquinos y dienos pueden polimerizarse. Los dienos conjugados pueden dar lugar a polímeros ramificados con propiedades diferentes. Algunos productos naturales esenciales para la vida, como el colesterol o, en general, los terpenos, se cree se producen por polimerización biológicamente controlada de sistemas poliénicos: