R.Cuena Boy/J.R.Azanza Perea/L.M. Echeverría Ech~pare: J
Anuncio

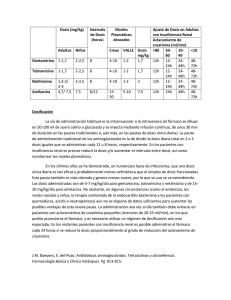
1 R.Cuena Boy/J.R.Azanza Perea/L.M. Echeverría Ech~pare: J. Honorato Pérez Introducción Al grupo de los antibióticos aminoglucósidos pertenecen fármacos como la gentamicina, tobramicina, amikacina, sisomicina, ribostamicina, dibekamicina, metilmicina y la estreptomicina, que, por tener una gran actividad frente a los bacilos gram negativos aerobios, son hoy en día imprescindibles para el tratamiento de las infecciones causadas por estos microorganismos. Por otra parte, y debido a la mayor supervivencia actual de los enfermos con neoplasias y otras enfermedades caquectizantes, a la introducción de medidas como la quimioterapia antineoplásica y al uso amplio de antibióticos en el medio hospitalario, cada día se presentan con más frecu'encia las infecciones producidas por estos bacilos, lo que hace que la utilización de aminoglucósicos sea abundante e imprescindible en muchos casos. Sin embargo, su dosificación en diversas situaciones clínicas, el control de su toxicidad y sus indicaciones son problemas terapéuticos no resueltos definitivamente y de gran trascendencia, ya que estos fármacos tienen un margen terapéutico estrecho y una toxicidad potencialmente grave. En este artículo nos referiremos únicamente a la gentamicina, la tobramicina y la amikacina, por ser los miembros del grupo más utilizados en nuestro medio, siendo nuestro objetivo el revisar las bases farmacológicas y los aspectos clínicos de la utilización de estos fármacos. • Servicio de Farmacologla Clinica. Clinica Universitaria. Facultad de Medicina. Universidad de Navarra. Pamplona. 201 Mecanismos de acción y resistencias Los aminoglucósidos penetran en el interior de las bacterias mediante un mecanismo aeróbico de transporte activo, se fijan irreversiblemente a los ribosomas y ocasionan una síntesis de proteínas alteradas. Su efecto es bactericida, independientemente de que las bacterias estén en fase de multiplicación o no, siendo inactivos en ausencia de oxigeno y menos activos en medios ácidos. Se fijan a los orgánulos intracelulares, por lo que su acción persiste algún tiempo de~pués de que el antibiótico haya desaparecido del med10. Existen al menos tres mecanismos de resistencia bac~ teriana frente a los aminoglucósidos: pérdida de la afinidad del ribosoma por el antibiótico, alteración de la permeabilidad de la pared celular y síntesis de enzimas inactivadores, siendo este último mecanismo el que más importancia clínica parece tener. Los genes que codifican la síntesis de enzimas inactivadores habitualmente se sitúan en material genético extracromosómico (plásmidos), pudiendo transferirse entre bacterias-. ~a resistencia a menudo es cruzada entre la gentanncma y la tobramicina, pero las cepas resistentes a estos antibióticos suelen seguir siendo sensibles a la amikacina, ya que la mayoría de los enzimas inactivadores no actúan sobre ella. Por el contrario, las cepas resistentes a la amikacina habitualmente también lo son a la gentamicina y a la tobramicina. La aparició_n de gérmenes ~es~s­ tentes probablemente está favorecida por. e.l uso .md1scriminado de estos fármacos y por la admm1strac1ón de dosis infraterapéuticas; el uso incorrecto de un aminoglucósido puede originar resistencias frente a otros f~r­ macos del grupo. No es frecuente que aparezcan resistencias durante el tratamiento. REVISTA OE MEDICINA OE LA UNIVERSIDAD OE NAVARRA 21 Espectro antibacteriano Son activos a concentraciones semejantes a las plasmátic as que se consiguen habitualmente , fre nte a la gran mayoría de las cepas de bacilos gram negativos a er obios (Proteus, E. coli, enterobacter, Acinetobacter, Pseudomonas, Klebsiella, Serratia, Shigella y Salmonella), S. aureus, S. epidermidis, H. influenzae y Listeria. También inhiben "in vitr o" el crecimiento del Mycoplasma pneumoniae. Son inactivos frente a estreptococos y bacterias anaerobias. El espectro de la gentamicina y tobramicina es semejante, si bien "in vitro" la tobramicina es más activa sobre Pseudomonas Aeruginosa y menos sobre Serratia que la gentamicina; no está claro si estas diferencias tienen significación clínica. El número de cepas sensibles a la amikacina es mayor que el de las sensibles a los otros dos antibióticos. Cada vez son más frecuentes las cepas de Pseudomonas, Serratia y Acinetobacter resistentes a la gentamicina y la tobramicina ; afortunadamente la mayoría de ellas siguen siendo sensibles a la amikacina. Se debe realizar un antibiograma individual para cada uno de estos fármacos. Farmacocinética La absorción oral de los aminoglucósidos es muy pequeña, no siendo útil esta vía para el tratamiento de infecciones sistémicas. Por vía intramuscular, la absorción suele ser completa y rápida (T máx. ± 1 hora). Utilizados tópicamente sobre grandes heridas o quemaduras, o en soluciones intraperitoneales o intrapleurales, pueden absorberse de forma importante. Tras una inyección intravenosa se produce un pico plasmático elevado, que se sigue de un descenso rápido (vida media= 5-15') correspondiente a una distribución en el líquido intersticial. Las concentraciones que se alcanzan en dicho medio son semejantes a las plasmáticas, siendo el volumen de distribución del compartimiento central (V) de 0,2 -0,3 l/kg. Unos 30 minutos después comienza un descenso más lento de las concentraciones plasmáticas (Cp) con una vida media (tl/ 2) de 2 a 3 horas. En esta fase predomina fundamentalmente la excreción renal, siendo la pendiente de la curva de niveles plasmáticos proporcional al GFR (Tabla I). Tabla I. VIDA MEDIA (h) DE LOS AMINOGLUCOSIDOS EN DIVERSAS SITUACIONES Gentamicina Indi viduo norm al Rec ié n nacido Insuficie ncia re na l terminal He modiálisis Di álisis perilon ea l Tobramicina Amikacina 2-3 5-9 2 -3 5-8 4 5-5 5 3- 10 10-37 50 -80 3 -7 18-29 2-3 5- 11 45 -55 5,5- 11 5-29 Los aminoglucósidos, como se ha dicho, penetran bien en el liquido extracelular, con excepción de liquido cefalorraquídeo, donde no se alcanzan concentraciones terapéuticas (esto puede no ser cierto en recién nacidos). En la bilis, los niveles oscilan entre 1/4 y 3/4 de los plasmáticos, siendo quizás menores con la amikacina que con la gentamicina y la tobramicina y, para los tres antibióticos, en pacientes con litiasis del cístico o hepatopatias importantes. La penetración en las secreciones bronquiales es irregular. 22 REVI STA DE MEDICINA DE LA UNIVERSIDAD DE NAVARRA Los aminoglucósidos tienen una gran afinidad por las estructuras tisulares, por lo que se van acumul ando a lo largo del tratamiento en distintos tejidos; esta acumulación es lenta, ya que , por ser fármacos muy polares , atraviesan con dificultad las membranas celulares. Este hecho explica el que durante el tratamiento vayan elevándose pr ogresivamente las Cp, aun cuando no se pro duzcan variaciones en el GFR, y que habitualmente no se llegue a alcanzar el estado de equilibrio estacionario con las duraciones medias de los tratamientos. Entre 8 y 24 horas después de administrar la última dosis ?el fármaco comienza una caída muy lenta de la Cp (vida media mayor de 100 horas). En esta fase el factor limitante de la cinética del antibiótico no es la función renal sino la liberación de aminoglucósido de sus almacenes tisulares. El volumen de distribución en el equilibrio estacionario es de 0,8 a 1 l/kg, siendo mayor el volumen de distribución del compartimiento periférico que el V, por lo que en el equilibrio est~ci?nario la. m~yor par~e del fármaco está en el compartimiento penfénco, y mas del 40 % de éste en la corteza r enal, en la que el fármaco alcanza concentraciones decenas de veces superiores a las plasmáticas; esta acumulación es menor en los riñones patológicos. Los aminoglucósidos prácticamente no se unen a las proteínas plasmáticas. Con fines prácticos, se puede decir que la eliminación del fármaco se realiza de forma exclusiva por filtración glomerular, alcanzándose en orina concentraciones mayor es a las Cp. Dur ante las prii:ie.ras dosis el acla~a­ miento (Cl) es inferior al de creatmma, pero a medida que se prolonga el tratamiento , el Cl va aumentando hasta igualarse al de cre~tinin~ . Este hec~o pue~e deberse a que con la admimstración de sucesivas dosis los lugares de unión del fármaco a la corteza renal se van saturando, desapareciendo cualquier proceso de reabsorción tubular. Después de finalizar el tratamiento el Cl renal del fármaco vuelve a disminuir, probablem~nte por desaturación de sus puntos de fijación . El secuestro tisular de los aminoglucósidos explica el que en orina de 24 horas no se recoja más del 80 % de la dosis , recuperándose sin embargo prácticamente todo el fármaco en orina de 10-15 días. Factores que alteran la farmacocinética de los aminoglucó sidos La constante de absorción por vía intramuscular puede presentar una gran variabilidad interindividual; dos de los factores que la reducen, dando lugar a concentraciones máximas más bajas y tardías, son el shock y las inyecciones repetidas en el mismo lugar. El V se correlaciona bien con el volumen de agua del espacio extracelular, estando por ~anta incremen.t_ado en los pacientes edematosos, ascíticos y en los nmos; también tiende a elevarse en los insuficientes renales . Por el contrario, el V es menor en los deshidratados Y también en los obesos si se calcula en relación al peso corporal total, mientras que si se expresa en función del peso ideal, las diferencias con los individuos normales disminuyen. Los incr ementos del V dan lugar a concentraciones plasmáticas máximas (Cmax) menores y tl /2 mayores, mientras que lo contrario sucederá en los casos en que este parámetro esté disminuido. La tl/2 se correlaciona bien con la tasa de filtración glomerular , estando prolongada por tant~ en los pacientes con insuficiencia renal, algunos ancianos y en los r ecién nacidos. En estos últimos la hipoxemia puede originar un aumento adicional de este parámetro . En los 202 quemados aumenta el GFR, disminuyendo en consecuencia la tl/2 y lo mismo parece suceder en los pacientes con procesos febriles agudos. La mayor fuente de variabilidad en la farmacocinética de los aminoglucósidos proviene de las alteraciones del GFR. En la insuficiencia renal, el tiempo necesario para alcanzar el estado equilibrio estacionario aumenta, de forma que si se ajusta la dosis a su grado de eliminación, no parece haber una mayor acumulación tisular del fármaco. Sin embargo, en el equilibrio estacionario (30-60 días después del inicio del tratamiento), la cantidad de fármaco situado en el compartimento periférico puede ser significativamente mayor que en pacientes no nefrópatas. La velocidad y el grado de acumulación tisular muestran una importante variabilidad interindividual. Los factores que alteran la farmacocinética de los aminoglucósidos se detallan en la tabla II. Tabla II. FACTORES QUE MODIFICAN LA FARMACOCINETICA DE LOS AMINOGLUCOSIDOS manifiesta por la aparición de vértigo, nistagmus y náuseas. Los tres antibióticos tienen el mismo potencial ototóxico. En la tabla III se detallan los factores que se relacionan con la aparición de ototoxicidad, de los que el más importante parece ser la insuficiencia renal previa o de aparición durante el tratamiento. La nefrotoxicidad suele ser reversible en el plazo de 4 a 8 semanas, aunque también puede progresar tras la suspensión del fármaco. La tobramicina parece ser menos nefrotóxica que la gentamicina y la amikacina. La acumulación progresiva del antibiótico en el túbulo contorneado proximal origina un aumento de la beta-2 microglobulina en orina, cilindruria, proteinuria, aumento de lisozima en orina, hipostenuria, disminución del GFR y oligoanuria; las manifestaciones más precoces son los signos de disfunción tubular (aumento de beta-2 microglobulina, cilindruria, proteinuria), posteriormente comienza a elevarse la creatinina sérica, pudiendo llegar a producirse un cuadro de necrosis tubular aguda con oligoanuria. Como ya se ha dicho, los aminoglucósidos se acumulan en la corteza renal, permaneciendo allí hasta 6 meses, pudiendo estar aumentada durante ese tiempo la sensibilidad renal a los efectos de los fármacos nefrotóxicos. En la tabla IV se deta11 ............ J..1Q.1J. 1,... ..... J.V\l .P................................ .10.Vl.U..l V.::> ....................... Y. UV i'.)Ci ......... 1,....,...,~ ...... - ............ J. VJ.ClLtJ.U.1.10.J.J. ............... \.IU.1.1 1 .... .lCl v..-..f'............. ,..... ..... ~ J.J.V.1.1 VLV.A..1.- cidad. Tabla III. FACTORES QUE POTENCIAN LA OTOTOXICIDAD Reacciones adversas Las reacciones adversas de tipo alérgico se presentan en menos del 3 % de los pacientes tratados y consisten habitualmente en "rash", fiebre y eosinofilia. Los aminoglucósidos pueden ocasionar bloqueo neuromuscular reversible con la administración de anticolinesterásicos o sales de calcio. Esta reacción adversa no tiene gran importancia clínica, excepto en pacientes afectos de miastenia gravis o hipopotasemia, y en aquellos a los que se les haya administrado bloqueantes neuromusculares. Al igual que con otros antiinfecciosos, en algún caso se pueden presentar sobreinfecciones, fundamentalmente por Gandida, Bacteroides y S. fecalis. Los efectos tóxicos que más limitan el uso de estos fármacos son los producidos en el oído interno y el riñón. La incidencia de oto- y nefrotoxicidad en los pacientes tratados con aminoglucósidos oscila ampliamente según su situación clínica, la definición de oto- y nefrotoxicidad que se aplique y la pauta posológica que se utilice. En cualquier caso, entre el 1O y el 20 % de los pacientes pueden sufrir alteraciones moderadas de la función renal y ototoxicidad subclínica, mientras que las alteraciones graves pueden presentarse con una frecuencia menor del 5 %. La ototoxicidad habitualmente no es reversible e incluso puede progresar después de la suspensión del tratamiento. La amikacina produce con más frecuencia toxicidad coclear con pérdida de audición de tonos agudos, mientras que la gentamicina y la tobramicina producen preferentemente toxicidad vestibular, que se 203 Cuando se utilizan aminoglucósidos, es necesario tomar una serie de precauciones con el fin de reducir la aparición de oto- y nefrotoxicidad; estas precauciones se pueden resumir en dos apartados: evitar los factores que potencian la oto- y nefrotoxicidad (tablas III y IV), sometiendo a especial vigilancia a los pacientes en que ello no sea posible y detectar precozmente cualquier alteración renal o auditiva, con el fin de suspender el tratamiento. Uno de los factores que más se correlaciona con la oto- y nefrotoxicidad es la administración de dosis innecesariamente elevadas. Ello se puede evitar ajustando la posología a la función renal del paciente para mantener los niveles plasmáticos del fármaco dentro de ciertos limites (ver luego) y no prolongando innecesariamente el tratamiento. Tabla IV. FACTORES QUE POTENCIAN LA NEFROTOXICIDAD REVISTA DE MEDICINA DE LA UNIVERSIDAD DE NAVARRA 23 En cuanto a la detección de la ototoxicidad, es necesario realizar en todos los pacientes una anamnesis diaria dirigida a posibles alteraciones auditivas, teniendo presente que el uso de antihistanúnicos puede enmascarar los síntomas de disfunción vestibular. Sin embargo, a menudo, cuando se detecta alguna alteración por este método, la toxicidad es ya importante e irreversible . Por ello lo ideal sería realizar audiometrías y tests vestibulares basales y semanales en todos los pacientes. Obviamente ello no es posible, pero al menos en pacientes en que por su trabajo sea importante la integridad del oído interno, en los que haya antecedentes de ototoxicidad y en aquellos en que el tratamiento sea prolongado, se debería hacer. La detección de las alteraciones renales producidas por los aminoglucósidos es también un problema clínico. No se ha desarrollado un método de uso rutinario capaz de predecir el riesgo de nefrotoxicidad antes de que la creatinina sérica comience a elevarse. La creatinina sérica puede ser un buen indicador, pero es poco sensible, ya que se pueden producir variaciones importantes del GFR con pequeñas elevaciones plasmáticas de esta sustancia y, por otra parte, a menudo es dificil distinguir hasta qué punto indica una disfunción renal yatrogénica, ya que su elevación puede ser una consecuencia de la propia enfermedad que se está tratando . El aumento de determinados enzimas y proteínas en orina indica más precozmente la aparición de nefrotoxicidad, pero no se suelen determinar de forma rutinaria en la mayoría de los hospitales. Las pequeñas alteraciones de la función renal que con relativa frecuencia se producen en los pacientes tratados con aminoglucósidos, aunque suelen ser reversibles, tienen importancia, ya que en el mejor de los casos prolongan el período de ingreso, y en pacientes con lesiones renales previas o concomitantes de otro origen pueden provocar o aumentar las necesidades de diálisis, hacer más estrictas las restricciones dietéticas en insuficientes renales crónicos, o incluso precipitar el fallecimiento del enfermo en situaciones límite . Siempre que se utilicen los aminoglucósidos se debe realizar una determinación basal de· la creatinina sérica y sedimento urinario y repetir estas exploraciones, según la situación clínica del paciente, entre una y siete veces por semana. En cualquier caso, no existe un método capaz de evitar totalmente la oto- y nefrotoxicidad. La asociación con cefaloridina es muy nefrotóxica. Existe una controversia sobre si otras cefalosporinas y cefamicinas potencian la nefrotoxicidad de los aminoglucósidos; en cualquier caso la asociación es clínicamente tan útil que, en nuestra opinión, no debe limitarse su uso en razón a un hipotético aumento del riesgo de nefrotoxicidad. Tampoco está definitivamente comprobado en clínica humana que los diuréticos "de asa" potencien la nefrotoxicidad. En la tabla V se esquematizan las interacciones de los aminoglucósidos. Tabla V. INTERACCIONES DE LOS AMINOGLUCOSIDOS /~ -Lactámicos Enterocolitis pseudomembranosa Fluocitosina t Niveles d e ambos fá1m acos ¿Diuréticos? Vancomicina l.o li s1ina Otros aminog lu cósidos Anfotericina -B ¿Cefa lospori nas? Cisp latino Metoxillurano t Oto y/o nefrotox icidad Posología y formas de administración Cuando el cuadro infeccioso es grave debe adminis trarse una dosis inicial (Di) suficiente para obtener concentraciones plasmáticas efectivas (Tabla VI); la Di debe calcularse en función del V, no de la función renal. En los obesos, por tener un V inferior expresado en función del peso real, la Di debe calcularse para el peso ideal, si bien en infecciones graves puede ser preferible administrar una Di excesiva que insuficiente, por lo que puede utilizarse el peso real. En los casos en que el V esté aumentado, la Di debe ser mayor. DOSIS INICIAL Y NIVELES PLASMATICOS OBTENIDOS Interacciones 24 REVISTA DE MEDICINA DE LA UNIVERSIDAD DE NAVARRA Potenciación, inactivación del am inoglu cósi do Clind amici na Tabla VI. La asociación con betalactámicos suele ser sinérgica "in vitro" frente a la mayoría de los bacilos gram negativos, probablemente debido a que la alteración de la pared celular que los betalactámicos producen mejora la entrada del aminoglucósido en la bacteria. Esta interacción se ha mostrado clínicamente útil frente a las infecciones graves por Pseudomonas aeruginosa, endocarditis por Streptococus viridans y fecalis y sepsis en granulocitopénicos, siempre que el betalactámico sea activo frente a la bacteria causante de la infección. Sin embargo, las penicilinas y cefalosporinas inactivan químicamente a los aminoglucósidos, por lo que no se deben administrar simultáneamente por la misma vía. Esta interacción es mayor entre la gentamicina y la tobramicina y las carboxi- y ureidopenicilinas, y adquiere importancia clínica en la insuficiencia renal, en los que la asociación disminuye la vida media del amino glucósido. Consecuencia Fármaco Dosis inicial mg/kg mg/kg 5 -7,5 mg/kg Gentamicina 1,5 -2 Tobramicina Amikacina 1,5 -2 Niveles plasmá ticos 4-10 mg/l 4 - 10 mg/l 15 -30 mg/l Posteriormente, se administrarán dosis de mantenimiento (Dm) que repongan la cantidad de aminoglucósido eliminada durante cada intervalo de dosificación. En la tabla VII se indican las Dm propuestas para pacientes con función renal normal, siendo preciso indicar que estas dosis suelen ser insuficientes para muchos de los pacientes sin alteraciones del GFR y excesivas para aquellos en que esté disminuido este parámetro. Para el cálculo de la Dm en estos últimos existen numerosos métodos, siendo quizás el más útil en adultos el propuesto por Sarubbi y Hull, consistente en modificaciones simultáneas de la Dm y del intervalo posológico, con 204 Tabla VII. DOSIS DE MANTENIMIENTO EN PACIENTES CON FUNCION RENAL NORMAL lo que se evitan las Cmáx excesivas tras la administración, e insuficientes durante la mayor parte del intervalo que se producen cuando sólo se alarga dicho intervalo y las Cmáx insuficientes y concentraciones plasmáticas mínimas (Cmin) excesivas obtenidas cuando sólo se reduce la dosis. No se han desarrollado nornograrnas fiables para niños y adolescentes. Todos estos métodos se basan en relaciones lineales entre la creatinina y parámetros farrnacocinéticos del arninoglucósido, fundamentalmente la tl/2. Sus resultados no son óptimos, ya que con frecuencia las Cp obtenidas se desvían de las previstas. Una de las razones de la mala relación entre la Cp obtenida y la prevista es la dificultad en determinar el aclaramiento de creatinina, ya sea rnidiéndoio directamente (errores en la recogida de orina), ya sea a través de la creatinina sérica, pues la tasa de producción de esta sustancia varia en función de factores corno la edad y el sexo; el método más eficaz para estimar el aclaramiento de creatinina es el uso de nornograrnas que tornen en cuenta todos los factores que puedep influenciar la tasa de producción de esta sustancia. Otras fuentes de error son el que los nornograrnas no prevén la influencia de los factores que modifican la farrnacocinética de los arninoglucósidos (Tabla II), asumen una farrnacocinética rnonocornpartirnental y una velocidad de absorción intramuscular constante y suelen basarse en correlaciones entre la tl/2 y el GFR, cuando este parámetro farrnacocinético depende simultáneamente de la eliminación y la distribución. Los nornograrnas no son útiles en los pacientes con función renal inestable, ya que la creatinina sérica no es un fiel indicador del GFR en esta situación. Las Drn/kg que se administran a los recién nacidos (Tabla VIII), aparentemente superiores a las de los adultos con un GFR semejante, no lo son cuando se expresan en función de la superficie corporal. Tabla VIII. DOSIS DE GENTAMICINA Y TOBRAMICINA EN RECIEN NACIDOS . Meµ.o~ .de· .2kg Más de 2 kg Mev.osde.Zdías MlÍs de? días 2,5 mglkg ca<la 12,24.hol'as . 2,;i;~m~g ca;pa 8-12 horas 2-2,smg¡'kgcada 12 horas 2,5mglkgcada 8hoi:as: Tras un periodo de hernodiálisis de 4 a 6 horas de duración se recomienda administrar un 50 % de la Di, si bien la tasa de eliminación de los arninoglucósidos por este sistema es muy variable. Los arninoglucósidos se administran por via intramuscular e intravenosa; la vía intramuscular y la infusión intravenosa de 30 minutos de duración son seguras 205 y eficaces, la administración intravenosa directa presenta la ventaja teórica de favorecer la distribución tisular y el inconveniente, no demostrado en clínica humana, de aumentar la ototoxicidad, mientras que la administración en perfusión continua puede ser de elección especialmente en el tratamiento de la sepsis en pacientes granulocitopénicos, al mantenerse en todo momento Cp superiores al MIC, pero es posible que la incidencia de toxicidad sea mayor. En el caso de meningitis por gram negativos es necesario administrar el antibiótico por vía intratecal, a la dosis de 4 rng de gentamicina o tobrarnicina cada 18 horas, diluidas en suero fisiológico o liquido cefalorraquídeo. En infecciones respiratorias, dada la distribución irregular en las secreciones bronquiales de los aminoglucósidos, puede ser conveniente su administración en aerosoles. Por vía tópica e intracavitaria, la dosis total no debe superar a la dosis que se administraría por vía parenteral en el mismo período de tiempo y las disoluciones utilizadas deben tener una concentración semejante a la plasmática que se considera útil. La administración de antibióticos aminoglucósidos tópicos probablemente favorece la aparición de resistencias. Monitorización de los niveles plasmáticos En la tabla IX se indican las concentraciones plasmáticas de estos antibióticos que se consideran tóxicas y terapéuticas. Tabla IX. NIVELES PLASMATICOS DE LOS AMINOGLUCOSIDOS (mg/I) Para que la monitorización de los niveles plasmáticos de los arninoglucósidos sea útil deben de cumplirse las siguientes condiciones: l. Que sea necesario individualizar la dosis: El margen terapéutico estrecho de estos fármacos hace que se deban evitar las dosis innecesariamente elevadas. 2. Que sea imposible individualizar la dosis en todos los casos mediante el uso de parámetros clínicos y de nornograrnas: no es posible elevar la dosis cuando no se obtiene eficacia, pues no todas las infecciones tienen por qué responder al antibiótico, ni se debe esperar a que aparezca toxicidad para reducir la dosis. Por otra parte, los métodos que existen para dosificar estos fármacos según la función renal del paciente, como ya se ha dicho, tienen muchas limitaciones. 3. Que exista una relación establecida entre las concentraciones plasmáticas del fármaco y sus efectos: las Cmin elevadas se acompañan de una incidencia mayor de toxicidad, asimismo, las Cmáx elevadas pueden ser uno de los determinantes de la ototoxicidad. No obstante, manteniendo los niveles plasmáticos por debajo de los valores que se consideran tóxicos (Tabla IX) no se consigue evitar totalmente la aparición de reacciones REVISTA DE MEDICINA DE LA UNIVERSIDAD DE NAVARRA 25 adversas, pues hay otros muchos factores que influyen en la toxicidad (Tablas III y IV). En cuanto a la eficacia, se admite que las concentr aciones de antibiótico en el lugar de la infección deben superar al MIC del ger men causante, pero se desconoce cuántas veces y durante qué proporción del intervalo posológico han de ser mayores. En el caso de antibióticos menos tóxicos, como los betalactámicos, este problema se soslaya administrando grandes dosis; sin embargo, y por su estrecho margen terapéutico, no es posible hacer lo mismo con los aminoglucósidos. Por otra parte, la Cp puede no reflejar la concentración en el lugar de la infección. Los hechos anteriormente indicados, y los que se recogen en la tabla XI, han impedido establecer correlaciones estrictas entre el nivel plasmático del fármaco y la eficacia. Sin embargo, se ha demostrado que, con Cm~x dentro del rango de los valores indicados en la tabla IX, la evolución clínica de los pacientes es mejor, y que la mortalidad se reduce cuando la posología de los aminoglucósidos se ajusta en función de su concentración plasmática. Tabla X. SITUACIONES EN OUE ESTA ESPECIALMENTE INDICADA LA MONITORIZACION DE LOS NIVELES PLASMATICOS DE LOS AMINOGLUCOSIDOS - Función renal inestable , insuficiencia renal, diálisis . - Ancianos, niños . - Quemados , fiebre, obesidad , edemas. colecciones Uquidas , deshidratación, cirrosis. - Infecciones graves. inefi cacia terapéutica. s ignos d e toxicidad. toxicidad previ a . - Tratamien t o prolongado. - Tratamiento con fármacos que potencien la toxicidad. - Tratamiento previo con aminoglucósidos. - Tratamiento simultáneo con carboxi- y ureidopenicilin as en insuficientes renales. Los hechos anteriormente expuestos justifican la monitorización de los niveles plasmáticos de estos antibióticos con el fin de, soslayando la influencia de los factores que modifican la relación entre dosis y Cp, evitar la administración de dosis innecesariamente elevadas o insuficientes. En las situaciones clínicas que se especifican en la tabla X está especialmente indicada la monitorización de los niveles plasmáticos. La selección inicial de la Dm debería realizarse a partir de nomogramas y pautas posológicas stándard, ajustándola posteriormente, cuantas veces sea necesario, mediante la determinación de los niveles plasmáticos. Tabla XI. - FACTORES QUE ALTERAN LA RELACION ENTRE NIVEL PLASMATICO Y EFECTO Infecciones tis ulares. Variabilidad en las d efensas individual es. Variabilid a d en la sensibilidad del germen. Interacciones con otros antiinfecc iosos. Efecto postantibiótico. Indicaciones Por ser fármacos de toxicidad potencialmente grave y relativamente frecuente, se debe restringir al máximo su utilización. La aparición de nuevos betalactámicos 26 REVISTA OE MEDICINA OE LA UNIVERSIDAD DE NAVARRA Tabla XII. Bacteria INDICACIONES Antibiótico de primera elección Enterobacter. E coli , proteus indo! +. pse udo mona a eruginosa Gentamicin a, tobramicina (amikacina ) Klebsiell a pneumoniae Gentamicina. tobramicina. cefa losporinas lamik acina l Serratia Amikacina (gentamicinal con gran actividad frente a bacterias gram negativas posiblemente reduzca el número de situaciones en que es necesario utilizar aminoglucósidos . Sin embargo, por el momento los aminoglucósidos siguen estando indica· dos en el tratamiento de las infecciones graves por bacterias gram negativas (Tabla XII), con excepción de las producidas por Salmonella, Shigella, H. infiuenzae y quizás Klebsiella pneumoniae. La asociación de aminoglucósidos con betalactámicos es eficaz y se debe usar, con o sin aislamiento del germen, en los cuadros febriles de los inmunosuprimidos y en las sepsis graves . Esta asociación es sinérgica, reduce la aparición de' resistencias al antibiótico betalactámico durante el tratamiento y aumenta el espectro cubierto . Cuando por el origen de la infección (pélvico o abdominal) se sospeche la existencia simultánea de bacterias anaerobias, hay que asociar al aminoglucósido clindamicina, metronidazol o cefoxitina; si se sospecha la existencia de un S. fecalis, el antibiótico a asociar será la ampicilina o una ureidopenicilina. La combinación de aminoglucósido y penicilina o ampicilina es superior al tratamiento con betalactámicos sólo de las endocarditis por S. viridans y fecalis. También están indicados los aminoglucósidos en el tratamiento "a ciegas" de las neumonías hospitalarias. En las infecciones urinarias pueden no ser eficaces cuando el aclaramiento de creatinina sea inferior a 30 mVmin, y sólo están indicados cuando hayan fracasado otros fármacos, en las pielonefritis agudas, cuando haya una importante afectación general o cuando el germen causante sea sensible únicamente a aminoglucósidos. En las infecciones urinarias no complicadas las dosis necesarias suelen ser pequeñas. Los aminoglucósidos no son antibióticos de elección en las estafilococias. En cuanto a la elección del aminoglucósido, la amikacina se debe reservar para el tratamiento de infecciones por gérmenes resistentes a la gentamicina y a la tobramicina, pero, dependiendo del cuadro de resistencias de cada hospital, puede estar indicada para el tratamiento empírico de las infecciones graves en inmunosuprimidos y de todas aquellas que pongan en peligro inmediato la vida del paciente. También es el aminoglucósido de elección en los pacientes con insuficiencia renal que necesiten un tratamiento simultáneo con carboxi- o ureidopenicilinas. En cuanto a la gentamicina y la tobramicina, no hay criterios claros para preferir uno de ellos; es posible que en las infecciones del aparato respiratorio por Pseudo monas aeruginosa sea más eficaz la tobramicina. Dado que hay estudios en que, aunque con deficiencias meto dológicas, se demuestra que la tobramicina es menos nefrotóxica, nuestra opinión es que este antibiótico debe preferirse en los pacientes con un mayor riesgo de toxicidad renal o en los que las consecuencias de una disminución del GFR sean más graves. 206 Bibliografía 10. Mangione A y Schentag JJ. Therapeutic monitoring of aminoglycoside antibiotics: An approach. Therap Drug Monit 2: 159, 1980. 1. 2. Bender JF, Fortner CL, Schimpff SC, Grove WR, Hahn DM, Love LJ y Wiernik PH. Comparative auditory toxicity of aminoglycoside antibiotics in leukopenic patients. Am J Hosp Pharm 36: 1.083, 1979. Bootman JL, Wertheimer Al, Zaske D y Rowland C. Individualizing Gentamicin dosage regimens in burn patients with gram negative septicemia: A cost-benefit analysis. J Pharmac Sci 68: 11. Michael D, Halkin H y Rubinstein E. Interstitialjluid concentrations of aminoglycosides. J Antimicr Chemother 7: 551, 1981. 12. Ristuccia AM y Cunha BA. The aminoglycosides. Med Clin North America. 66: 303, 1982. 13. Sarubbi FA y Hull JM. Amikacin serum concentrations: Prediction of levels and dosage guidelines. Ann Inter Med 89: 612, 267, 1979. 1978. 14. Schentag JJ, Jusko WJ, Vanee JW, Cumbo TJ, Abrutyn E, Delattre M y Gerbracht LH. Gentamicin disposition and tissue accumulation on multiple dosing. J Pharm Biopharm 5: 559, 1977. Ther (ed. esp.) 4: 29, 1982. 15. Schentag JJ y Jusko WJ. Renal clearance and tissue accumulation of gentamicin. Clin Pharm Therap 22: 364, 1977. 5. Follath F, Wenk MY y Vozeh S. Plasma monitoring of aminoglycosides. J. Antimic Chemother 8 (supl. A): 37, 1981. 16. 6. Haughey DB, Hilligoss DM, Grassi A y Schentag JJ. Twocompartment gentamicin pharmacokinetics in premature neonates: A comparison to adults with decreased glomerular filtration rates. J Pediat 96: 325, 1980. Schentag JJ. Accumulation des aminosides dans'les tissus. Étude comparative de la gentamicine et de la tobramicine chez des malades aux reins sains. Nouv Presse Med 7: 3.824, 1978. 1 7. Schumacher GE. Pharmacokinetic anal y sis of gentamicin dosage regimens recomendedfor renal impairment. J Clin Pharma- 7. Hull JH y Sarubbi FA: Gentamicina serum concentrations: Pharmacokinetics predictions. Ann Intern Med 85: 183, 1976. 18. Smith CR, Lípsky JJ, Laskin OL, Reliman DB, Mellits ED, Longstreth J y Lietman PS. Double-blind comparison ofthe nephroto- 8. Lerner SA y Matz GJ. Suggestions far monitoring patients during treatment with aminoglycosides antibiotics. Otolaryng Head Neck Surg 87: 222, 1979. 3. 4. Davies J y Courvalin P. Mechanism ofresistence to aminoglycosides. Am J Med 62: 868, 1977. Elección de medicamentos antimicrobianos. Med Let Drugs col 15: 656, 1975. xicity and auditory toxicity of gentamicin and tobramycin. N 9. Lott RS y Hayton WL. Estimation of creatinine clearance from serum creatinine concentration. A review. Drug Intell Clin · Pharm 12: 140, 1978. 207 Eng J Med 302: 1.106, 1980. 19. Traub SL y Johnson CE. Comparison of methods of estimating creatinine clearance in children. Am J Hosp Pharm 37: 195, 1980. 20. Whelton A. Prediction de la toxicité des aminosides. Nouv Presse Med 7: 3.838, 1978. REVISTA DE MEDICINA DE LA UNIVERSIDAD DE NAVARRA 27 COLECCION CIENCIAS MEDICAS BOLSJ . _,,"'_. . . CIE ES~~~ LA EN RMEDAD EPILEPTICA CONOZCA SU DIABETES Francisco Abad Alegría 1983. ISBN 84-313-0796-X (2.ª edición) 100 págs. 575 ptas. Emilio Moneada 1983. ISBN 84-313-0711-0 128 págs. 650 ptas. Este manual sobre la enfermedad epiléptica pretende facilitar al enfermo y a sus familiares o allegados. especial- Cuando un individuo cae enfermo de pulmonía no le hace mente docentes o ásistenciales, la cooperación con el mé- falta saber cómo se le ha producido, cuál ha sido la causa y dico de modo que el tratamiento del epiléptico sea true- qué tratamiento necesita. ya que el médico se ocupa de tuoso y simple al máximo. Surge de la reflexión que plantea curarle en poco más de una semana. Por el contrario. dado la experiencia cotidiana de la consulta y nada de lo que que la diabetes es un desequilibrio crónico. hoy por hoy. y plantea procede de la forma de pensar del autor. sino que cuyo tratamiento se basa en algo tan cotidiano como el responde a los interrogantes que con más frecuencia les comer. pasear Y tomar diariamente una medicina durante plantean a los epileptólogos los enfermos 0 quienes convi- años. parece muy conveniente que el interesado sepa el ven con ellos. Al tiempo pretende ser un memorándum útil por qué Y el para qué de estas medidas. sobre los diversos problemas y contingencias que se sus- Con este pequeño manual, pretendemos ayudar al diabécitan a diario en el enfermo. procurando eludir el sím- tico a liberarse de una exagerada e inútil dependencia del olismo (consulte a su médico ... ). pero dando datos claros médico. del analista y de la enfermera así como a conocer 1 que sean útiles. . . l .._m_ej_o_r_su_d_ia_b_et_e_s_Y_P_º_r_ta_n_to_a_yu_d_a_r1_e_e_n_s_u_e_v_o_1u_c_ió_n_._, ALERGIA A MEDICAMENTOS (2.ª edición) FARMACOTERAPIA PSIQUIATRICA (2.ª ed.). A. Oehling 1982. ISBN 84-313-0702-1 Otto Benkert y Hanns Hippius 1982. ISBN 84-313-0730-7 436 págs. 112 págs. 525 ptas. EPILEPSIA: DIAGNOSTICO Y TRATAMIENTO EN LA PRACTICA DIARIA (2.ª edición) Francisco Abad 1981. ISBN 84-313-0701-3 178 págs. 750 ptas. 1.350 ptas. ELEMENTOS DE HIGIENE HOSPITALARIA Y TECNICAS DE AISLAMIENTO EN EL HOSPITAL (3.ª edición) F. Tanner, J. J. Haxhe, M. Zumofen, G. Ducel 1982. ISBN 84-313-0628-9 224 págs. 550 ptas. HEMOTERAPIA. NOCIONES FUNDAMENTALES Antonio Medarde 1977. ISBN 84-313-0479-0 140 págs. 400 ptas. LA ACUPUNTURA EN EL TRATAMIENTO DEL DOLOR Luis M. ª Gonzalo 1979. ISBN 84-313-0594-0 200 págs. 600 ptas. FISIOTERAPIA RESPIRATORIA (3.ª edición) NOTAS DE VIROLQGIA MEDICA Morag C. Timbury 1981. ISBN 84-313-0700-5 236 págs. INTRODUCCION A LA ELECTROENCEFALOGRAFIA Y NEUROFISIOLOGIA CLINICA (Guía del Hospital Brompton) D. V. Gaskell y B. A. Webber (En prensa) Francisco Abad Alegría 1978. ISBN 84-313-0521-5 INTRODUCCION A LA ESTADISTICA MEDICA MANUAL DE FARMACOTERAPIA ANTIALGICA (2.ª edición) R. F. Mould (Trad. de E. Alegría) 1978. ISBN 84-313-0547-9 208 págs. 600 ptas. 950 ptas. Jesús Flórez Beledo (En prensa). €UNSA EDICIONES UNIVERSIDAD DE NAVARRA, S. A. Plaza de los Sauces, 1 y 2 - Apdo. 396 - Tel. (948) 256850• BARAÑAIN-PAMPLONA (ESPAÑA) 168 págs. 600 ptas.