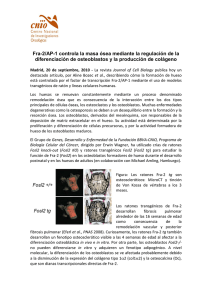
Untitled - Universidad de Granada
Anuncio

Editor: Editorial de la Universidad de Granada Autor: Consuelo Lourdes Díaz Rodríguez D.L.: Gr. 974 - 2007 ISBN: 978-84-338-4308-1 DEPARTAMENTO DE ENFERMERÍA E.U. CIENCIAS DE LA SALUD INSTITUTO DE NEUROCIENCIAS FEDERICO OLÓRIZ CRITERIOS DE ELECCIÓN DE UN AINE EN EL TRATAMIENTO DEL TEJIDO ÓSEO EN REPARACIÓN MEDIANTE EL ESTUDIO DE SU EFECTO SOBRE LA LÍNEA DE OSTEOSARCOMA MG-63. LOURDES DÍAZ RODRÍGUEZ UNIVERSIDAD DE GRANADA 2007 Dª CONCEPCIÓN RUIZ RODRÍGUEZ, catedrática de Ciencias Fisiológicas del Departamento de Enfermería de la Escuela Universitaria de Ciencias de la Salud de la Universidad de Granada. CERTIFICA: Que Dª LOURDES DÍAZ RODRÍGUEZ, Licenciada en Antropología Social y Cultural por la Universidad de Granada, ha realizado su Memoria de TESIS DOCTORAL con el título CRITERIOS DE ELECCIÓN DE UN AINE EN EL TRATAMIENTO DEL TEJIDO ÓSEO EN REPARACIÓN MEDIANTE EL ESTUDIO DE SU EFECTO SOBRE LA LÍNEA DE OSTEOSARCOMA MG-63, bajo mi tutela y dirección para optar al grado de DOCTOR por la Universidad de Granada, dando mi conformidad para que sea presentada, leída y defendida ante el Tribunal que le sea asignado para su juicio crítico y calificación. Y para que conste y surta efectos donde proceda, expido el presente certificado Granada, 13 Abril 2.007 Fdo. Concepción Ruiz Rodríguez La memoria de Tesis Doctoral que lleva por título CRITERIOS DE ELECCIÓN DE UN AINE EN EL TRATAMIENTO DEL TEJIDO ÓSEO EN REPARACIÓN MEDIANTE EL ESTUDIO DE SU EFECTO SOBRE LA LÍNEA DE OSTEOSARCOMA MG-63, ha sido presentada por la Licenciada Lourdes Díaz Rodríguez para aspirar al grado de Doctor, habiendo sido dirigida por Dª Concepción Ruiz Rodríguez, catedrática de Ciencias Fisiológicas del Departamento de Enfermería de la Escuela Universitaria de Ciencias de la Salud de la Universidad de Granada. Granada, 13 Abril 2.007 Fdo. Lourdes Díaz Rodríguez De los resultados obtenidos en esta tesis se han presentado a congresos las siguientes comunicaciones: • Díaz Rodríguez, L.; Aguilera Castillo O.; Alaminos Fajardo, E.; GarcíaMartínez O.; Reyes-Botella C.; Ruíz C. Análisis de la expresión de marcadores y capacidad fagocítica en la línea MG-63 de osteosarcoma. II Jornadas de Ciencias de la Salud Granada 2005. • Díaz Rodríguez, L.; García-Martínez O.; Arroyo Morales M.; Ruíz Rodríguez C. Efecto de los AINES sobre la proliferación osteoblástica. II Jornadas de Ciencias de la Salud Granada 2005. • Díaz Rodríguez, L.; García-Martínez, O.; Arroyo Morales, M.; Montes MJ; Ruíz Rodríguez, C. La Nimesulida como inhibidor de la proliferación celular en la línea de osteosarcoma humana, MG-63. III Jornadas Científicas Nacionales y I Internacionales de Ciencias de la Salud. Granada 11, 12 y 13 de Mayo de 2006. • Díaz Rodríguez, L.; García-Martínez, O.; Arroyo Morales, M.; Mazzaglia, G.; Ruíz Rodríguez, C. Análisis del tratamiento con Indometacina de la línea MG-63 sobre el perfil antigénico y el crecimiento celular. III Jornadas Científicas Nacionales y I Internacionales de Ciencias de la Salud. Granada 11, 12 y 13 de Mayo de 2006. • Díaz, L., García-Martínez, O., Muñoz, R. and Ruíz, C. The effect of Diclofenac on MG-63 cells proliferation. Europerio 5 Madrid, 29,30 de Junio y 1 de Julio 2006. • R.Mazzglia, L. Díaz, G. Mazzaglia, O. García-Martinez, M. Arroyo, and C. Ruiz. Modulation of phagocytosis of MG-63 cells by indomethacin and diclofenac IADR Pan European Federation Dublín September 13-16 2006. AGRADECIMIENTOS En primer lugar, quiero agradecer a mi directora, Concepción Ruiz Rodríguez, por su gran esfuerzo realizado en este trabajo, pues bien sabes, que sin tu ayuda, nunca habría llegado este maravilloso día. Estaba perdida y tú me guiaste por el buen camino. Gracias por haberte acordado de mí y haberme dado esta gran oportunidad de investigar con tu equipo, pues es un lujo estar a vuestro lado. Gracias por tu comprensión, paciencia, amabilidad y cariño. Bien sabes, que soy un manojo de nervios y que a veces es complicado sobrellevarme, pero me has demostrado que puedes con todo: primero vino la boda…., luego el embarazo…., hace 10 meses nació Paulita y por fin, ¡la defensa de esta tesis! Durante estos cuatro años, me han sucedido cosas maravillosas como acabo de comentar, y una de ellas ha sido la suerte de haberte conocido. Espero seguir trabajando duro a vuestro lado durante mucho tiempo y poder aportar así mi pequeño granito de arena. Sin la ayuda desinteresada de todas y cada una de las personas que a continuación citaré, no habría sido posible la realización de este trabajo. A todos vosotros, os doy las gracias. A mi compañera de equipo, Olga, gracias por tu simpatía, paciencia y optimismo. Hiciste que el comienzo en el laboratorio fuese risueño y ameno. Gracias por hacer fácil lo difícil. Gracias por hacerme ver las cosas que realmente son importantes en la vida. A Jose Antonio, técnico de laboratorio de la Escuela Universitaria Ciencias de la Salud por su valiosísima ayuda continua. Sabes que más de un día, no habrían salido adelante las experiencias sin tu presencia. Al Centro de Instrumentación Científica, en concreto a Jaime Lazúen, por su labor en el análisis de las muestras, por su paciencia y más paciencia. Al Departamento de Enfermería de la Escuela Universitaria de Ciencias de la Salud, por haber aceptado la realización de este proyecto. Gracias por vuestros ánimos continuos y, sobre todo, a Manuel Peñas. Gracias por tu apoyo incondicional siempre apostaste por mí, y espero algún día no defraudarte. A mis padres, quienes me infundieron los valores morales y éticos y el rigor que guían mi transitar por la vida. A mi gran madre, porque siempre transmites paz y tranquilidad, porque me apoyas en todo momento, porque ante la adversidad impones optimismo y entereza y ante las penas, alegrías. Gracias por haberme traído al mundo. A mis hermanos, por creer siempre en mí. A mis suegros, cuñadas y cuñados, por apoyarme y ayudarme en todo momento. A mis sobrinos, por alegrarme la vida. A mi marido, fiel compañero y amigo. Gracias por compartir tus sabios consejos y confiar en mí. Te quiero. A mi pequeña Paula. A ti, te dedico todo el esfuerzo y sudor de este trabajo, porque eres lo más grande que me ha dado la vida. I. INTRODUCCIÓN. Página 1. TEJIDO ÓSEO 3 A) Componente celular 3 A.1.- Osteoblastos 3 A.2.- Osteocitos 4 A.3.- Osteoclastos 4 B) Matriz ósea B.1.- Matriz Orgánica 5 5 B.1.1.- Colágeno 5 B.1.2.- Sustancia Fundamental 5 B.2.- Sales Minerales 7 1.1. Formación y crecimiento del tejido óseo 7 1.2. Modelado y remodelación 8 2. OSTEOBLASTOS 11 2.1. Ontogenia 11 2.2. Diferenciación 12 2.3. Identificación 14 2.3.1. Identificación Morfológica 14 2.3.2. Identificación Bioquímica 15 2.3.3. Identificación Antigénica 18 a) CD10 19 b) CD13 20 c) CD44 20 d) CD54, CD80, CD86, HLA-DR 21 e) Expresión de otros antígenos 22 2.3.4. Identificación Genética 2.4. Factores reguladores del remodelado óseo 2.4.1. Factores genéticos 24 24 24 2.4.2 Factores mecánicos 25 2.4.3 Factores vasculonerviosos 25 2.4.4 Factores nutricionales 25 2.4.5. Factores hormonales 26 2.4.5.1. Paratohormona 26 2.4.5.2. Calcitonica 28 2.4.5.3. Calcitriol 28 2.4.5.4. Andrógenos 29 2.4.5.5. Estrógenos 29 2.4.5.6. Progesterona 30 2.4.5.2. Insulina 30 2.4.5.2. Glucocorticoides 30 2.4.5.2. Hormona del crecimiento 31 2.4.6 Factores locales 31 2.5 Papel funcional del osteoblasto 39 2.6. Línea celular de osteosarcoma: MG-63 42 3. INFLAMACIÓN 44 3.1. Concepto 44 3.2. Fases de la inflamación 45 3.3 Mediadores de la inflamación 46 4. ANTIINFLAMATORIOS NO ESTEROIDEOS 47 4.1. Mecanismo general de acción 47 4.2. Acciones farmacológicas con interés terapéutico 49 4.2.1. Acción analgésica 49 4.2.2. Acción antitérmica 50 4.2.3. Acción antiinflamatoria 50 4.2.4. Acción antiagregante plaquetario 51 4.2.5. Acción uricosúrica 51 4.2.6. Acción anticancerígena 52 4.3. Reacciones adversas 52 4.3.1. Localización gastrointestinal 52 4.3.2. Localización renal 53 4.3.3. Fenómenos de hipersensibilidad 54 4.3.4. Reacciones hematológicas 54 4.4. Clasificación 55 4.4.1. Salicilatos 55 4.4.2. Paraaminofenoles 57 4.4.3. Derivados Pirazólicos 59 4.4.4. Derivados del Acido Propiónico 59 4.4.5. Derivados del Acido Acético 62 4.4.6. Oxicams 65 4.4.7. Derivados del Ácido Antranílico 66 4.4.8. Otros fármacos 67 5. OSTEOBLASTOS Y ANTIINFLAMATORIOS NO ESTEROIDEOS 69 II. OBJETIVOS 75 III. METODOLOGÍA 77 1. Línea de osteosarcoma humano, MG-63 (ATCC:CRL-1427) 77 2. Cultivo de la línea MG-63 77 3. Expresión antigénica de la línea MG-63 78 4. Capacidad fagocítica de la línea MG-63 76 4.1 Análisis de la capacidad fagocítica mediante citometría de flujo 79 4.2 Análisis de la capacidad fagocítica mediante microscopía 80 electrónica de transmisión 5. Efecto de los AINEs sobre la línea MG-63 81 5.1 Efecto de los AINEs sobre la proliferación celular 81 5.2 Efecto de los AINEs sobre la diferenciación celular 82 5.3 Efecto de los AINEs sobre el perfil antigénico 83 5.4 Efecto de los AINEs sobre la capacidad fagocítica 84 6. Análisis Estadístico 85 IV. RESULTADOS I. Fenotipo antigénico de la línea MG-63 87 II. Capacidad fagocítica de la línea MG-63 89 III. Efecto de los AINEs sobre la proliferación de 92 la línea MG-63 IV. Efecto de los AINEs sobre el perfil antigénico 99 de la línea MG-63 a) Efecto de los AINEs sobre el perfil antigénico 100 de la línea MG-63: expresión del antígeno CD13 b) Efecto de los AINEs sobre el perfil antigénico 102 de la línea MG-63: expresión del antígeno CD21. c) Efecto de los AINEs sobre el perfil antigénico 105 de la línea MG-63: expresión del antígeno CD44. d) Efecto de los AINEs sobre el perfil antigénico 107 de la línea MG-63: expresión del antígeno CD54. e) Efecto de los AINEs sobre el perfil antigénico 109 de la línea MG-63: expresión de los antígeno CD80 y CD86. f) Efecto de los AINEs sobre el perfil antigénico 113 de la línea MG-63: expresión del antígeno HLA-DR. V. Efecto de los AINEs sobre la capacidad fagocítica 115 de la línea MG-63 VI. Efecto de los AINEs sobre la síntesis de osteocalcina de la línea MG-63 118 V. DISCUSIÓN I. CARACTERIZACIÓN ANTIGÉNICA Y CAPACIDADFAGOCÍTICA 121 121 DE LA LÍNEA DE OSTEOSARCOMA HUMANO MG-63 1. Expresión antigénica de la línea celular de osteosarcoma 115 MG-63 2. Capacidad fagocítica de la línea celular de osteosarcoma 125 MG-63 II.- EFECTO DE LOS AINES SOBRE LA LÍNEA CELULAR DE 128 OSTEOSARCOMA HUMANO, MG-63. 1. Efecto de los AINEs sobre la proliferación celular 130 de la línea de osteosarcoma humano, MG-63. 2. Efecto de los AINEs sobre la diferenciación celular 137 en la línea de osteosarcoma humano, MG-63. 3. Efecto de los AINEs sobre la expresión antigénica 138 en la línea celular de osteosarcoma humano, MG-63. 4. Efecto de los AINEs sobre la capacidad fagocítica 144 en la línea de osteosarcoma humano, MG-63. VI. CONCLUSIONES 149 VII. BIBLIOGRAFÍA 151 INTRODUCCIÓN I. INTRODUCCIÓN: 1. TEJIDO ÓSEO. El tejido óseo, es un tejido altamente complejo que representa la parte principal del esqueleto y está formado por un componente celular y una matriz ósea. A.- COMPONENTE CELULAR. Las células del hueso, proceden de células mesenquimatosas indiferenciadas pluripotenciales, las cuales, se multiplican y diferencian, unas, en osteoblastos que posteriormente se diferencian a osteocitos, y las otras, en osteoclastos. A.1.- Osteoblastos: Son las células responsables de sintetizar y secretar la matriz orgánica. Derivan de las células mesenquimatosas de la médula ósea local y se localizan en las superficies activas del hueso (Ducy & Karsenty, 1998; Manolagas, 2000). Morfológicamente, poseen un cuerpo celular cúbico o prismático del que nacen expansiones citoplasmáticas más o menos alargadas. El núcleo, es redondeado y contiene un voluminoso nucleolo. El citoplasma, es rico en ribosomas y mitocondrias, el retículo endoplasmático granular es abundante, y el aparato de Golgi yuxtanuclear (Lian et al., 1999). Cuando los osteoblastos dejan de formar hueso, pueden permanecer en la superficie como células de revestimiento óseo, o bien, se rodean a sí mismas con matriz y se convierten en osteocitos. El papel principal de las células de revestimiento, es formar y secretar las enzimas que eliminan la capa de osteoide que recubre a la matriz mineralizada. De esta forma, los osteoclastos pueden adherirse al hueso e iniciar la resorción (Buckwalter & Cooper, 1987). 3 INTRODUCCIÓN A.2.- Osteocitos: Los osteocitos, que provienen de la diferenciación de los osteoblastos, son las células principales del tejido óseo adulto. Constituyen más del 90% de las células del hueso humano maduro. A través de proyecciones citoplasmáticas de los conductos que atraviesan la matriz mineralizada, los osteocitos, conectan con otras células óseas (Boivin, Anthoine-Terrier & Obrant, 1990). Estas conexiones, según algunos autores, permiten sentir a las células cómo se deforma el hueso, debido a las fuerzas mecánicas, y coordinar el proceso de remodelado. Son osteoblastos rodeados de matriz ósea en vías de mineralización ( Lian et al., 1999; Boivin, Anthoine-Terrier & Obrant, 1990). Morfológicamente, los osteocitos poseen un cuerpo celular estrellado, el núcleo es ovalado y el citoplasma contiene las mismas organelas que los osteoblastos pero en menor cantidad, ya que, son células con una escasa actividad metabólica, pero su preservación parece necesaria para que el tejido óseo mantenga sus propiedades biomecánicas. A.3.- Osteoclastos: Son células muy voluminosas redondeadas, que proceden de las células madre hematopoyéticas extraesqueléticas, y se encuentran en las superficies del hueso que van a sufrir la resorción. Para poder reabsorber la matriz, los osteoclastos se unen a la superficie ósea acidificando el medio al secretar enzimas y protones, rompiéndose así, los enlaces entre los cristales de hidroxiapatita y el colágeno (Peck & Woods, 1998; Khan et al., 2001). Morfológicamente, estas células se caracterizan por poseer varios nucleolos, y el citoplasma presenta numerosas microvellosidades, mitocondrias, lisosomas, vesículas y vacuolas. 4 INTRODUCCIÓN B.- MATRIZ ÓSEA: La matriz ósea, lugar donde se encuentran las células óseas, consta de una matriz orgánica impregnada en sales minerales. B.1. MATRIZ ORGÁNICA: La matriz orgánica, está formada por fibras de colágeno incluidas en una sustancia fundamental. En adultos, el colágeno representa alrededor del 90% de la matriz orgánica, por lo que, la matriz ósea es eosinófila. La dureza y la resistencia a la compresión del tejido óseo se deben al contenido de sales inorgánicas, mientras que sus propiedades elásticas y resistencia a la tracción, dependen del colágeno (Geneser, 2000). Por ello, la estructura y las propiedades mecánicas y bioquímicas del hueso dependen de ella. B.1.1- COLÁGENO: El colágeno, es una proteína de tres cadenas polipeptídicas y de unos 1.000 aminoácidos que se enrollan entre sí de forma helicoidal y se unen a través de puentes de hidrógeno. Cada molécula, se alinea paralelamente con la siguiente, y así, forman una fibrilla de colágeno, las cuales, se agrupan, dando lugar a las fibras de colágeno (Einhorn, 1996) que en su mayoría, son de tipo I, es decir, el mismo tipo general del tejido conectivo (Geneser, 2000). B.1.2.- SUSTANCIA FUNDAMENTAL. Las proteínas no colagénicas constituyen el 10 o 15 % del total de las proteínas óseas. Aproximadamente, una cuarta parte de las proteínas no colagénicas óseas son de procedencia exógena, quedando atrapadas en el espacio de la matriz ósea (Termine, 1993). Esta fracción, está compuesta principalmente por proteínas séricas de carácter acídico unidas a la hidroxiapatita. 5 INTRODUCCIÓN El resto de las proteínas no colagénicas son sintetizadas por el osteoblasto. Se calcula que la célula ósea, sintetiza y secreta tantas moléculas de colágeno como de proteínas no colagénicas. Podemos dividir estas proteinas en cuatro grupos principales: proteínas de adhesión celular, proteoglicanos, proteínas gammacarboxiladas y factores de crecimiento. Las células óseas sintetizan cuatro proteínas que afectan a la adhesión celular: fibronectina, trombospondina, osteopontina y sialoproteína ósea (Robey, Young, Fisher & McClain, 1989; Somerman, Fisher, Foster & Sauk, 1988). Los proteoglicanos, son macromoléculas que contienen cadenas de polisacáridos ácidos (glicosaminoglicanos) adheridas a una proteína nuclear central. A nivel óseo, hallamos dos tipos de glicosaminoglicanos: condroitín sulfato, que es la forma predominante, y heparín sulfato. Existen dos proteínas no colagénicas gamma-carboxiladas: la osteocalcina (bone gla-protein) y la MGP (matrix-gla-protein) que se caracterizan por poseer residuos glutamil dicarboxílicos (gla). La osteocalcina, es una proteína predominantemente ósea aunque también se halla en la dentina, mientras que la MGP se halla en cartílago y hueso (Termine, 1993). Los factores de crecimiento, como el factor transformante beta (TGFβ) y los factores de crecimiento derivados de la insulina (IGF), son secretados por los osteoblastos y pueden estimular el crecimiento de las células osteoblásticas de forma autocrina o paracrina (Robey et al., 1987; Canalis, McCarthy & Centrella, 1989). Otra proteína no colagénica producida por las células óseas es la osteonectina, una glicoproteína fosforilada, que constituye la principal glicoproteína secretada por los osteoblastos. Sus funciones a nivel óseo son múltiples, y se ha relacionado con el crecimiento y/o proliferación osteoblástica, así como con la mineralización de la matriz ósea (Termine, 1993). 6 INTRODUCCIÓN B.2.- SALES MINERALES. Los componentes inorgánicos del tejido óseo, representan en el adulto alrededor del 75% del peso seco, y están compuestos en su mayor parte, por depósitos de fosfato cálcico cristalino, aunque también hay una pequeña cantidad de fosfato cálcico amorfo. Los cristales, son casi idénticos a los del mineral hidroxiapatita, con forma de varas finas de unos 3 nm de espesor y hasta 60 nm de largo y se disponen en paralelo en relación con las fibras de colágeno. Junto al fosfato cálcico, el hueso contiene numerosos iones diferentes que parecen estar adsorbidos sobre la superficie de los cristales de apatita, o como sustitución de iones dentro de la estructura cristalina; entre ellos están: el magnesio, potasio, sodio, carbonato, citrato, y algunos normalmente extraños, como los iones de plomo, oro y otros metales pesados (Geneser, 2000). 1.1. FORMACIÓN Y CRECIMIENTO DEL TEJIDO ÓSEO. Existen dos tipos de osificación denominados endoconjuntiva y endocondral. En la osificación endoconjuntiva, las células mesenquimatosas indiferenciadas, se transforman en osteoblastos en el seno del tejido conjuntivo y se desarrolla la histiogénesis. Cuando se ha constituido una pequeña zona de tejido óseo, otras células, se diferencian en osteoblastos y se disponen alrededor formando una hilera osteoide, y así sucesivamente. Los huesos de la bóveda del cráneo, la maxila y la mayor parte de la mandíbula, pertenecen a este tipo. En la osificación endocondral, la formación de tejido óseo es idéntica, pero se complica con la destrucción del tejido cartilaginoso que es reemplazado por tejido óseo (Poirier, 2002). Cualquiera que sea el tipo de tejido óseo obtenido o el lugar de su formación, la histogénesis responde siempre al mismo proceso básico, distinguiéndose cuatro etapas: 7 INTRODUCCIÓN 1ª.- Diferenciación de los osteoblastos a partir de células madre. 2ª.- Secreción por los osteoblastos de la matriz orgánica. 3ª.- Mineralización de la matriz orgánica. 4ª.- Aparición de los osteoclastos. 1.2. MODELADO Y REMODELACIÓN. El modelado y la remodelación, son los procesos que dan lugar a los cambios en la geometría y la masa del hueso (Einhorn, 1996). El modelado, es una actividad organizada de la célula ósea que permite el crecimiento del hueso y regula la resistencia de éste, mediante la actividad de los osteoblastos y los osteoclastos situados estratégicamente, aunque no adyacentes (Frost, 1990). La remodelación, es un proceso continuo y secuencial de degradación y reparación de las cavidades microscópicas del hueso. Está controlado por un balance de la formación ósea y la resorción (Roodman, 1996). En el proceso participan tanto osteoclastos como osteoblastos, los cuales, se organizan en grupos bien definidos recibiendo el nombre de unidades multicelulares básicas (Frost, 1991; Seeman, 2002). La regulación del proceso del remodelado óseo, sugiere la existencia de una comunicación entre las células formadoras y resortivas óseas. La actividad de osteoblastos y osteoclastos, se halla estrechamente relacionada y se cree que la información es transferida desde células de linaje osteoblástico hacia los osteoclastos (Chambers & Fuller, 1985). De forma semejante, la información pasaría de los osteoclastos o de las zonas de resorción hacia los osteoblastos maduros, indicándoles la necesidad de iniciar un nuevo ciclo de formación ósea. La base bioquímica de esta comunicación no está totalmente establecida. La existencia de un factor único de acoplamiento capaz de explicar la comunicación 8 INTRODUCCIÓN intercelular, ha sido discutida ampliamente pero no ha podido ser demostrada (Drivdahl, Howard & Baylink, 1982; Farley, Puzas & Baylink, 1982). Recientemente, se ha implicado como posible factor en el proceso de acoplamiento el ligando de la osteoprotegerina (RANKL), también llamado factor de diferenciación osteoclástica (ODF). Es una glicoproteína de la familia del receptor del factor de necrosis tumoral (TNF), sintetizada por los osteoblastos que al unirse a un receptor de membrana de los osteoclastos denominado RANK, produce un estímulo de la diferenciación osteoclástica, favoreciendo, como consecuencia, la resorción ósea. La actividad biológica de este factor, sería regulada por la osteoprotegerina, receptor soluble de la familia del TNF, sintetizado también por los osteoblastos que inhibe la diferenciación osteoclástica al unirse al RANKL (Hofbauer, 2006). El hecho de que los osteoblastos sinteticen osteoprotegerina y RANKL, sugiere la existencia de un bucle de retroalimentación negativo en el que el osteoblasto podría modular, por sí mismo, la diferenciación de precursores osteoclásticos al presentar moléculas de RANKL en su superficie celular, cuya actividad sería regulada, a su vez, por la producción de osteoprotegerina (Hofbauer, Kuhne & Viereck, 2004). Una excesiva resorción que supere a la formación ósea puede conllevar anormalidades, tales como, la osteoporosis, la cual, se caracteriza por una reducción de la masa ósea y un aumento en la incidencia de las fracturas óseas ( Manolagas & Jilka, 1995; Rodan, 1998; Weinreb, Rodan & Thompson, 1989). La resorción ósea comprende cinco fases: quiescencia, activación, reabsorción, formación y mineralización (Compston, 2001). Gracias a la mediación de un estímulo iniciador que puede ser hormonal, químico o físico, una pequeña zona de la superficie del hueso, pasa de una situación de reposo (Quiescencia), a la fase de actividad. Al quedar expuesta la 9 INTRODUCCIÓN superficie mineralizada, se produce la atracción de osteoclastos circulantes procedentes de los vasos próximos. Seguidamente, los osteoclastos comienzan a disolver la matriz mineral y a descomponer la matriz osteoide. Este proceso es acabado por los macrófagos y permite la liberación de los factores de crecimiento contenidos en la matriz, fundamentalmente TGFβ, factor de crecimiento derivado de las plaquetas (PDGF), e IGF-I y II (Reabsorción). Simultáneamente, en las zonas reabsorbidas se produce el fenómeno de agrupamiento de preosteoblastos, atraídos por los factores de crecimiento que se liberaron de la matriz actuando como quimiotácticos y estimulando su proliferación (Lind et al., 1995). Los preosteoblastos, sintetizan una sustancia cementante sobre la que se va a adherir el nuevo tejido y expresan proteínas morfogenéticas óseas (BMPs), responsables de la diferenciación. A los pocos días, los osteoblastos ya diferenciados van a sintetizar la sustancia osteoide que rellenará las zonas horadadas (Formación). A los 30 días del depósito de osteoide comienza la mineralización, que finalizará a los 130 días en el hueso cortical y a los 90 días en el trabecular (Mineralización). 10 INTRODUCCIÓN 2. OSTEOBLASTOS. El osteoblasto, responsable de la deposición de matriz ósea y su mineralización, es decir, de la formación de hueso; se diferencia a partir de células primitivas mesenquimáticas pluripotenciales, pasando a veces por una etapa intermedia de preosteoblastos. Su vida se estima de algunos días a pocas semanas de actividad funcional. Dentro de la familia osteoblástica, se encuentran además los osteocitos y las células de revestimiento o “lining cells”, que son osteoblastos inactivos. 2.1. Ontogenia: Los osteoblastos se originan a partir de células mesenquimales primitivas pluripotenciales, que dan lugar a una progenie con capacidad de diferenciación más limitada, incluso monopotencial. Los mediadores que intervienen en este proceso, no son del todo conocidos, aunque está demostrado que los glucocorticoides, la superfamilia del TGFβ y las BMPs, desempeñan una función reguladora en estadios de diferenciación tempranos de algunas líneas celulares (Aubin, 1995). Algunos investigadores tienen la hipótesis de que, a partir de un único precursor derivado de células mesenquimales, se originan los osteoblastos, los adipocitos y las células hematopoyéticas secundarias en la médula ósea; cada una de estas líneas, se distingue en base a su morfología y su función. En los últimos años, este precursor se ha identificado como células Westen-Baiton, células progenitoras mesenquimales y células fibroblásticas estromales de la médula (Blair, Sidonio, Friedberg, Khan & Dong, 2000; Caplan, 1994; Gundle, Joyner & Triffit, 1995; Gimble, Robinson, Wu & Kelly, 1996; Waela, InagawaOgashiwa, Shimizu, Yasamoto & Hashimoto, 2002). 11 INTRODUCCIÓN La existencia de un progenitor pluripotencial, hace que haya una estrecha relación entre los adipocitos y los osteoblastos. En este sentido, hay algunas hipótesis que los relacionan: los mecanismos que regulan la formación de adipocitos en el estroma, pueden favorecer la osteogénesis y la hematopoyesis; los adipocitos de la médula, sirven como reserva energética para situaciones de emergencia relacionadas con la osteogénesis, como en el caso de las fracturas; y los adipocitos, expresan fenotipo osteoblástico como la actividad fosfatasa alcalina (AP), síntesis de osteocalcina, osteopontina, colágeno tipo IV, expresión de CD44, VCAM y expresión de citocinas, entre otros (Gimble, Robinson, Wu & Kelly, 1996; Noth et al., 2002). Asímismo, entre las líneas celulares de osteoblastos y condroblastos, existe una relación muy estrecha. La mayoría de los experimentos son ambiguos y presentan un precursor monopotencial o bipotencial. Aún no se ha podido demostrar que exista un progenitor bipotencial para células formadoras de hueso y cartílago, aunque Manduca y cols. en el año 1992 (Manduca, Cancedda & Cancedda, 1992), han aislado clones derivados de tibia de embrión de pollo que expresan bipotencialidad para hueso y cartílago (Hall et al., 2001). En esta línea, parece apropiado considerar además de un progenitor bipotencial, la posibilidad de la transdiferenciación o un cambio fenotípico directo de unas células a otras. Esta hipótesis, está reforzada por el hecho de que los condrocitos no mueren, sino que pueden transdiferenciarse en osteoblastos e incluso pueden expresar fenotipo osteoblástico, como la expresión de matriz mineralizada o la expresión de marcadores de superficie (Aubin, 1995). 2.2. Diferenciación: Las células osteoblásticas se dividen en una secuencia lineal, desde osteoprogenitores a preosteoblastos, osteoblastos y osteocitos. 12 INTRODUCCIÓN Los preosteoblastos, son células de aspecto fibroblástico cercanas a las superficies óseas, pero separadas de éstas, por otros tipos celulares (células del endostio, osteoblastos) (Puzas, 1993). Son difíciles de identificar en condiciones normales, pero pueden observarse con facilidad si sufren una hiperplasia, como por ejemplo, en el hiperparatiroidismo. Estas células, derivan de una célula madre del estroma medular y en condiciones normales, constituyen el compartimento proliferativo del linaje osteoblástico. Los osteoblastos, son células de forma fusiforme, con citoplasma basófilo y ricas en una isoenzima específica de la fosfatasa alcalina (Puzas, 1993). Derivan de los preosteoblastos y suelen considerarse células con diferenciación terminal y, por tanto, incapaces de dividirse. No obstante, existen datos que sugieren que, al menos en parte, conservan la capacidad de proliferar. Se hallan en contacto directo con las superficies óseas formando grupos compactos de una sola capa de espesor, son las responsables de la síntesis del componente orgánico de la matriz ósea (colágeno tipo I, proteoglicanos, proteínas implicadas en la adhesión celular, osteocalcina y factores de crecimiento) y controlan el depósito de las sales minerales. Tanto, in vivo, como, in vitro, los osteoblastos pasan sucesivamente por tres estadios funcionales (Lian & Stein, 1992; Lian & Stayn, 1993): proliferación celular y síntesis de los componentes orgánicos de la matriz ósea; maduración de la matriz ósea (cambios en la composición y organización de la matriz que la hacen competente para ser mineralizada); y depósito de mineral. In vitro, se ha comprobado que estos estadios coinciden con la activación sucesiva de una serie de genes: c-fos, c-jun, histona H4, colágeno tipo I, fibronectina y el TGFβ, el cual, interviene en la proliferación y síntesis de los componentes orgánicos de la matriz ósea; la AP, que participa en la maduración de la matriz; y la sialoproteina ósea, osteopontina y osteocalcina, que contribuyen 13 INTRODUCCIÓN en el depósito de mineral. Existe información que demuestra que marcadores como la AP, la síntesis colagénica y no colagénica y la respuesta a hormonas, entre otros, refleja la existencia de células relativamente maduras. Los osteoblastos, pueden permanecer en la superficie ósea o quedar rodeados por la matriz que sintetizan. Cuando los osteoblastos que han permanecido en la superficie, finalizan la síntesis de matriz, se aplanan y se convierten en células de revestimiento (células del endostio o "lining cells"). Estas células, a través de la producción de factores locales como la Interleucina-6 (IL-6) o la IL-11, parecen desarrollar un importante papel en el control del remodelado óseo. Los osteoblastos que quedan en el espesor de la matriz se diferencian, adquiriendo un aspecto estrellado pasando a denominarse osteocitos (Lian & Stein, 1992). Así, los osteocitos, se hallan en contacto entre sí y con las células de la superficie mediante finas prolongaciones tubulares de su citoplasma que recorren la matriz ósea en diversas direcciones. 2.3. Identificación: La caracterización de los osteoblastos, se realiza en base a su ubicación en el hueso atendiendo a cuatro parámetros: morfológicos, bioquímicos, antigénicos y genéticos. 2.3.1. Identificación Morfológica: Los osteoblastos, son células grandes que poseen un cuerpo celular cúbico o prismático, con un núcleo redondeado y un nucleolo voluminoso. El citoplasma, es rico en ribosomas y mitocondrias, lo que sugiere, un metabolismo celular muy 14 INTRODUCCIÓN activo. El estudio ultraestructural, también permite comprobar que entre el núcleo y la membrana celular, se sitúan de manera sucesiva el aparato de Golgi y abundantes cisternas de retículo endoplásmico rugoso (Puzas, 1993). Hay bastantes vacuolas que contienen material amorfo o grumoso de apreciable densidad. Estas características ultraestructurales, son típicas de las células con capacidad para segregar grandes cantidades de proteínas. En ocasiones, se observan gotitas lipídicas y cuerpos densos limitados por membrana que al parecer son los lisosomas (Tullberg-Reinert & Jundt, 1999). Dado que estas células son las responsables de la formación del tejido óseo, se ubican en el frente de avance del hueso que crece o desarrolla; disponiéndose en una capa epiteloide de células cuboideas conectadas con otras, a través de expansiones finas y cortas. De manera característica, el núcleo de estas células, se sitúa en el extremo que se halla más alejado de la superficie ósea sobre la que se asientan. 2.3.2. Identificación Bioquímica: Se ha demostrado en diferentes estudios, que las células de aspecto osteoblástico, presentan una serie de propiedades asociadas al fenotipo de éstas, como la secreción de osteocalcina, osteopontina, síntesis de colágeno tipo I o AP. - Producción de osteocalcina: La osteocalcina, puede suponer hasta un 3% de la proteína total del hueso y contiene dos o tres residuos de ácido carboxiglutámico gamma (GLA), de ahí su designación como proteína GLA ósea (BGP) (Poser, Esch, Ling & Price, 1980) . 15 INTRODUCCIÓN En los humanos, el gen de la osteocalcina, está localizado en el cromosoma 1 y está regulado a nivel trascripcional por el 1,25 (OH)2- vitamina D3 (Puchacz et al., 1989). Es un marcador específico y un índice de la fase media de la diferenciación de los osteoblastos. Se cree que desempeña un papel en el proceso de mineralización y está bajo la influencia de otras hormonas reguladoras del calcio: calcitonina (Civitelli et al., 1988), hormona paratiroidea y vitamina D y K (Caniggia et al., 1986; Price & Baukol, 1980), y su producción puede variar por la presencia de determinados factores, disminuyendo con algunos aminoácidos como la arginina (Chevalley, Rizzoli, Manen, Caverzasio & Bonjour, 1998) y aumentando en presencia de determinados factores de crecimiento, como el factor de crecimiento de fibroblastos (FGFβ) (Globus, Patterson & Gospodarowicz, 1988). Esta proteína morfogenética juega un papel importante en el mantenimiento de la calcificación ósea y en la inhibición del cartílago (Yang et al., 2001). Está demostrado que la osteocalcina sólo se encuentra en el tejido óseo y es un producto específico de los osteoblastos (Raisz, 1990; Price, Poser & Raman, 1976; Owen et al., 1990; Price, Williamson & Lothringer, 1981), sin embargo, hay estudios que demuestran que los adipocitos y megacariocitos expresan ARNm de osteocalcina (Thiede et al., 1994; Benyahu, Shamay & Wientroub, 1997). Dado que los niveles de osteocalcina son un reflejo directo de la formación ósea, su medida se relaciona estrechamente con el estado real del metabolismo óseo del paciente. A pesar de que mediciones como las de fosfatasa alcalina e hidroxipolina han sido utilizadas ampliamente como marcadores bioquímicos del metabolismo óseo, presentan importantes limitaciones en cuanto a su utilidad porque tienden a ser inespecíficas. Por lo general, la osteocalcina se correlaciona con la fosfatasa alcalina, pero ocasionalmente una gran parte de la fosfatasa alcalina de la sangre puede ser de origen no óseo. Este hecho limita su utilidad como marcador específico del recambio metabólico óseo. La osteocalcina, sin embargo, es completamente específica de los huesos. 16 INTRODUCCIÓN - Producción de osteopontina: La osteopontina, es sintetizada por osteoblastos pero también puede estar presente en otros tejidos conectivos. Es una proteína de 317 aminoácidos y con un 20% de su peso molecular correspondiente a ácido siálico. Tiene la propiedad de fijarse a la hidroxiapatita pero también a las células, y participa durante la resorción osteoclástica, posiblemente, mediatizando la fijación de los osteoclastos a la superficie de la fase mineral (Reinholt, Hultenby, Oldberg & Heinegard, 1990) (Walker, Preston, Magnay, Thomas & El Haj, 2001). Está expresada en zonas de inflamación y se liga a una gran variedad de receptores de superficie celular, preferentemente, a las integrinas y al CD44 (Weber, Ashkar, Glimcher & Cantor, 1996). - Actividad fosfatasa alcalina: La AP, es un índice de diferenciación temprana de osteoblastos y su expresión aumenta con el desarrollo de la diferenciación. Juega un papel importante en la mineralización extracelular, en la hidrólisis de los fosfatos orgánicos y en la liberación de fosfatos inorgánicos para formar hidroxiapatita (Yang, 2001). La localización de este enzima por técnicas citoquímicas, se utiliza, para identificar poblaciones de osteoblastos en el hueso humano en desarrollo, así como, los preosteoblastos del tejido conectivo mesenquimal y del estroma medular (Dodds, Merry, Littlewood & Gowen, 1994). Sustancias como el PDGF, parece tener un efecto estimulador sobre la AP en osteoblastos (Howes, Bowness, Grotendorst, Martin & Reddi, 1998), al igual que la arginina (Chevalley, Rizzoli, Manen, Caverzasio & Bonjour, 1998), la dexametasona (Walsh et al., 2000) o el IGF, sugiriendo una función en la formación ósea (Bollag et al., 2000). 17 INTRODUCCIÓN - Síntesis y secreción de colágeno: Según estudios realizados en osteoblastos de calvaria fetal de ratas (Lian & Stayn, 1993; Stein, Lian, Stein, Van Wijnen & Montecino, 1996), el colágeno tipo I, que constituye el 90% de la matriz ósea orgánica, es sintetizado por los osteoblastos durante los últimos periodos de proliferación y los primeros periodos de la maduración de la matriz. El colágeno, es la proteína más abundante del organismo y el principal componente del tejido conectivo. Hasta 1992, se habían descrito 13 tipos de colágeno (Burgeson & Nimni, 1992), pero actualmente se han identificado al menos 19 tipos de moléculas de colágeno genéticamente distintas (Prockop & Kivirikko, 1995), dividiéndose en base a su estructura primaria y unión molecular, en fibrilares y no fibrilares. El colágeno tipo I es el mayor componente proteico del hueso, constituyendo el 90% de la matriz orgánica distinguiéndose por su capacidad para retener mineral. Se halla ampliamente distribuido localizándose a nivel de ligamentos, dentina, esclerótica, aponeurosis y cápsulas y, en altas concentraciones, a nivel de piel, hueso y tendones. 2.3.3. Identificación Antigénica: La caracterización antigénica de los osteoblastos es reciente. Estas células, poseen un perfil antigénico propio, en el que se combinan distintos antígenos que son coexpresados por otras células que tienen su origen en la médula ósea. El estudio del fenotipo antigénico de esta población celular, se ha realizado tanto a nivel de membrana como a nivel intracitoplasmático. La presencia o no de los marcadores descritos, nos dan información, no sólo del perfil antigénico, sino también, del estado de activación celular. 18 INTRODUCCIÓN Entre los antígenos descritos en la membrana celular, se encuentran los propios de células hematopoyéticas, como el CD34; los antígenos de células de estirpe mielomonocítica, como las moléculas CD10, CD11b, CD13 y CD16; antígenos propios de células presentadoras de antígeno como CD44, CD54, CD80, CD86 y HLA-DR, así como el antígeno específico de las células foliculares dendríticas. Estas células, también expresan antígenos más específicos, como la AP y la osteocalcina (Reyes-Botella, Montes, Abadía-Molina, Vallecillo-Capilla & Ruiz, 1999; Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2000; Reyes-Botella C, Montes, Vallecillo-Capilla, Olivares & Ruiz , 2002a). Nuestro grupo de investigación, puede ser considerado pionero en dichos estudios y el que más información ha publicado en el análisis antigénico de los osteoblastos (Reyes-Botella, Montes, Abadía-Molina, Vallecillo-Capilla & Ruiz, 1999; Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2000; ReyesBotella C, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2002a; Perez, GarciaMartinez, Arroyo-Morales, Reyes-Botella & Ruiz, 2006; Garcia-Martinez, ReyesBotella, Aguilera-Castillo, Vallecillo-Capilla & Ruiz, 2006; Ruíz, Reyes-Botella, Garcia-Martinez & Montes, 2004). a) CD10 Es el marcador de superficie celular más característico para el diagnóstico de la leucemia linfoblástica aguda, también conocido como cALLa. Es una glicoproteína presente en la superficie de algunas células como los linfocitos pre-B, fibroblastos, “stem cells”, células epiteliales renales o células deciduales estromales (Platt, Le Bien & Michael, 1983; Montes et al., 1996). Se ha descubierto la expresión del antígeno CD10 en determinadas poblaciones de osteoblastos humanos, tanto en cultivos como en cortes de tejido óseo, a través de técnicas inmunohistoquímicas y citometría de flujo (ReyesBotella, Montes, Abadía-Molina, Vallecillo-Capilla & Ruiz, 1999; Garcia-Martinez, 19 INTRODUCCIÓN Reyes-Botella, Aguilera-Castillo, Vallecillo-Capilla & Ruiz, 2006), al igual que la presencia de actividad aminopeptidasa neutra en osteoblatos murinos (Indig, Benayahu, Fried, Wientroub & Blumberg, 1990). Letarte y cols. en 1988 (Letarte et al., 1988), consideraron que el antígeno CD10 y la endopeptidasa neutra humana, eran la misma molécula, pues encontraron una similitud en la secuencia de aminoácidos de ambas. Asimismo, Howell y cols. en 1993 (Howell, Caswell, Kenny & Turner, 1993), describieron cinco actividades endopeptidasas en células humanas parecidas a osteoblastos en cultivo, y una de éstas, es la denominada 24.11 (E-24.11), que es idéntica al antígeno leucocitario CD10; sugiriendo que las peptidasas de membrana, y por tanto, el antígeno CD10, pueden tener gran importancia en los procesos de formación y resorción ósea, e incluso en la participación de la homeostasis del ión calcio. b) CD13 El antígeno CD13 es una glicoproteína de superficie de membrana, que originalmente se reconoció como marcador de células mieloides normales y malignas, pero más tarde se encontró en otras células (Shipp & Look, 1993). Es idéntica a la aminopeptidasa N (APN; EC 3.4.11.2) (Look, Ashmun, Shapiro & Peiper, 1989). Desempeña un papel importante en el control del crecimiento y la diferenciación, en la fagocitosis y en actividades bactericidas y tumorales e incluso está involucrada en la regulación biológica del metabolismo peptídico (Shipp & Look, 1993). c) CD44 Es una molécula de adhesión funcional distinta de las cadherinas e integrinas (Hynes, 1987), también se conoce con el nombre de Pgp-I o antígeno Hermes y ECMR III (Carter & Wayner, 1988). 20 INTRODUCCIÓN Se considera receptor del ácido hialurónico (presente en leucocitos, fibroblastos, células epiteliales y osteoblastos), y pertenece a la familia de las glicoproteínas transmembrana codificada por un solo gen (Ponta, Sherman & Herrlich, 2003; Miyake, Underhill, Lesley & Kincade, 1990; Horton, 1995). El CD44, es una molécula que ha sido descrita en células osteoblásticas, pero se discrepa sobre el estadio de la diferenciación en que es expresada (Kennel, Lankford, Foote, Shinpock & Stringer, 1993; Hughes, Salter & Simpson, 1994). Unos autores describen su expresión sólo en osteocitos, mientras que otros, indican ya su presencia en osteoblastos (Nakamura et al., 1998; ReyesBotella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2000; Aubin, Liu, Malaval & Gupta, 1995). Se ha demostrado que esta molécula, tiene una función significativa en la hematopoyesis, en el reclutamiento de leucocitos hacia los tejidos (DeGrendele, Estess, Picke & Siegelman, 1996), en el desarrollo de metástasis tumorales y como coestimulante de linfocitos T (Galandrini, Galluzo, Albi, Grossi & Velardi, 1994). Pero la mayor función fisiológica, es el mantenimiento de la homeostasis de los tejidos a través de la conexión de distintos componentes de la matriz, como el ácido hialurónico, el condroitín sulfato y la osteopontina, hacia la superficie celular (Aruffo, Stamenkovic, Melnick, Underhill & Seed, 1990; Weber , Ashkar, Glimcher & Cantor, 1996). Se ha observado que un déficit del CD44 en modelos con reacciones agudas inflamatorias, en hígado y pulmón, conlleva a una mayor agresividad y un curso más prolongado de la enfermedad (Teder et al., 2002; Chen et al., 2001). Recientemente, se ha descubierto que el CD44, funciona como inhibidor de la pérdida ósea por procesos inflamatorios (Hayer et al., 2005). d) CD54, CD80, CD86 y HLA-DR Estas moléculas, están implicadas en los mecanismos de presentación de antígenos y en la activación de células T. Desarrollan una primera señal que 21 INTRODUCCIÓN estimula a las células T, a través del antígeno de clase II HLA-DR, y una señal coestimulante que depende del CD80 y CD86. El CD44 o el CD54 complementan esta señal estimuladora. Estudios con osteoblastos humanos, han demostrado que estas células expresan los antígenos CD54, CD80, CD86 y HLA-DR, por lo que, además de la función formadora de hueso, podrían participar en las funciones inmunes del tejido óseo (Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2000). Dicha expresión, se ve modulada por diferentes citocinas y factores de crecimiento con función reguladora sobre los osteoblastos (Lisignoli et al., 2004; Perez, GarciaMartinez, Arroyo-Morales, Reyes-Botella & Ruiz, 2006). e) Expresión de otros antígenos Para estudiar el perfil antigénico en los osteoblastos, Reyes y cols. en el año 2002 (Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2002a), seleccionaron antígenos expresados en las células inmunocompetes, cuyo origen está, al igual que en los osteoblastos, en la médula ósea. Los antígenos típicamente expresados en células hematopoyéticas investigados en los osteoblastos humanos en cultivo, son los siguientes: la expresión de CD45 fue negativa con los dos Anticuerpos monoclonales (Abmo) utilizados, sin embargo el CD34, asociado comúnmente con un origen hematopoyético y presente en células endoteliales y células hematopoyéticas inmaduras, fue positivo en los osteoblastos humanos en cultivo. De los antígenos del linaje B, expresaron el CD20 y CD23 y no así el CD19; mientras que el antígeno de células T (CD3), no fue detectado. El antígeno de las células natural Killer (NK), el CD56, fue detectado en una amplia proporción de células. Los antígenos del linaje mielomonocítico, el CD11b, CD16 y CD36, fueron positivos excepto el CD14, CD15 y CD33. También se expresan antígenos como el CD25 y el CD38. Tampoco se detectó el CD68. Por último, destacar la expresión positiva en el 100% de las células de los antígenos 22 INTRODUCCIÓN específicos de las células foliculares dendríticas, el FCD y el DRC-1 (ReyesBotella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2002a). El CD14, es una glicoproteína de cadena sencilla que se localiza fundamentalmente en la membrana de los monocitos, pero también se puede detectar en otras células, como en los granulocitos, algunos macrófagos y en las células dendríticas (Abbas & Lichtman, 2006). El CD45, llamado Antígeno Común Leucocitario, está presente en la mayoría de los leucocitos, por lo que se considera un antígeno que tiene su origen en la médula ósea (Abbas & Lichtman, 2006). Estas dos moléculas, el CD14 y el CD45, no se detectaron en cultivos de osteoblastos, por lo que son utilizadas por algunos investigadores para descartar la presencia de leucocitos como contaminantes, así como de la contaminación por macrófagos óseos (osteoclastos). Se ha demostrado que diferentes tipos de células, expresan moléculas funcionales de CD40, como las células endoteliales (Mach et al., 1997), epiteliales (Van Den Berg et al., 1996), células musculares lisas (Mach et al., 1997) y fibroblastos (Sempowski, Rozenblit, Smith & Phipps, 1998). En un estudio reciente, se ha comprobado la expresión del CD40 funcional, en osteoblastos humanos y de ratones, al interactuar con el Staphylococus aureus o la Salmonella enteric, por lo que sugieren, que las células formadoras de hueso pueden interactuar directamente con los linfocitos T durante una infección ósea (Schrum, Bost, Hudson & Marriott, 2003a). Las moléculas de adhesión CD11a y CD49d y el receptor de quimiocinas, CXCR3, están involucradas en el mecanismo por el que los osteoblastos interactúan, reclutan y modulan la proliferación de linfocitos T, bajo condiciones inflamatorias. La proliferación de linfocitos T, está aumentada cuando las células crecen en contacto directo con el TNF-α y el interferón ganma (IFNγ), activadores de osteoblastos, o en presencia de sobrenadantes de osteoblastos activados por 23 INTRODUCCIÓN el TNF-α y el IFN-γ (Lisignoli et al., 2004). Intracitoplasmáticamente, también se ha descrito la presencia de IL-4, IL-12, IL-15, IL-18 e IFNγ en osteoblastos en cultivo, expresión que puede verse modulada por distintas citoquinas y los factores de crecimiento (Ruiz et al., 2007). 2.3.4. Identificación Genética: Todos los genes expresados en los fibroblastos, también aparecen en los osteoblastos, sin embargo, solamente se han identificado dos transcriptores específicos de osteoblastos: la osteocalcina, una molécula que inhibe la función osteoblástica y que se expresa cuando estas células están diferenciadas (Ducy et al., 1996; Desbois, Hogue & Karsenty, 1994; Hauschka, Lian, Cole & Gundberg, 1989); y el factor de transcripción Cbfa1 (Ducy, Zhang, Geoffroy, Ridall & Karsenty, 1997). El Cbfa1, tiene todos los atributos para identificarse como un factor de diferenciación de la línea osteoblástica. Durante el desarrollo embrionario, la expresión de Cbfa1, precede a la diferenciación de los osteoblastos y está restringida a las células mesenquimales destinadas a convertirse en condrocitos u osteoblastos (Ducy, Zhang, Geoffroy, Ridall & Karsenty, 1997). Consecuentemente, la expresión del Cbfa1, se limita a osteoblastos, con unos niveles menores de expresión en condrocitos hipertróficos (Kim, Otto, Zabel & Munmdlos, 1999). También se expresa en odontoblastos (Komori et al, 1997). Cbfa1, es el marcador más temprano y más específico de la osteogénesis. En cultivos celulares, actúa como activador de la transcripción pudiendo inducir la expresión del gen específico de osteoblastos en fibroblastos, incluso en mioblastos. Esto sugiere, que el Cbfa1 es un gen importante para la diferenciación (Ducy, Zhang, Geoffroy, Ridall & Karsenty, 1997). 24 INTRODUCCIÓN 2.4 Factores reguladores del remodelado óseo: 2.4.1. Factores genéticos: Los factores genéticos son muy importantes en el pico de masa ósea, ya que éste, se encuentra determinado genéticamente en el 60-80% de los casos (Grant & Ralston, 1997). Así, los sujetos de raza negra poseen una masa ósea mayor que los de raza blanca y éstos, mayor que la amarilla. La masa ósea se transmite de padres a hijos, por ello la predisposición a padecer osteoporosis es mayor en hijas de madres que la padecen (Pocock et al., 1987). 2.4.2 Factores mecánicos: La actividad física es imprescindible para el correcto desarrollo del hueso. Se cree que la acción muscular, transmite al hueso una tensión que es detectada por la red de osteocitos incluida en el interior del fluido óseo. Estos osteocitos, producen mediadores como prostaglandinas (PGs), óxido nítrico (NO) e IGF-I, que estimulan tanto su actividad como la de los osteoblastos y originan una mayor formación ósea, y por el contrario, la falta de actividad muscular, el reposo o la ingravidez tienen un efecto deletéreo sobre el hueso, acelerando la reabsorción (Morey & Baylink, 1978). 2.4.3 Factores vasculonerviosos: La vascularización, constituye el primer paso para la osificación: los vasos sanguíneos invaden el cartílago y posteriormente se produce la reabsorción ósea por los osteoclastos, procedentes de los vasos próximos. Igualmente, la neoformación vascular es el primer hecho en el fenómeno de la reparación de fracturas o de la regeneración ósea, ya que la existencia de oxígeno es fundamental para que se produzca la restitución e integración y no aparezca tejido fibroso. Ham en 1952 constató este fenómeno (Ham, 1952) al observar que los 25 INTRODUCCIÓN osteocitos se mueren cuando están lejos de un capilar (la distancia máxima es de 0.1 mm). 2.4.4 Factores nutricionales: El factor nutricional es interesante al poder ser modificado. Se necesita un mínimo de calcio para permitir la mineralización que la mayoría de los autores cifran en unos 1.200 mg. diarios hasta los 25 años; después y hasta los 45 no debe ser inferior a 1 gramo y tras la menopausia, debe ser por lo menos 1.500 mg al día (Davey, 1997; Peris, 1999). Asímismo, se conoce que hábitos tóxicos como tabaco, cafeína, alcohol y exceso de sal constituyen factores de riesgo para la aparición de osteopenia (Krall & Dawson-Hughes, 1991; Cooper et al., 1992) (Peris, 1999). 2.4.5. Factores hormonales: El desarrollo normal del esqueleto está condicionado por el correcto funcionamiento del sistema endocrino, fundamentalmente de la hormona somatotropa (GH) y las hormonas calcitrópicas (parathormona (PTH), calcitonina y metabolitos de la vitamina D). Las hormonas, son mensajeros sistémicos que actúan a distancia de su lugar de producción (efecto endocrino), pero también regulan la síntesis y acción de los factores locales, que intervienen directamente en el metabolismo celular con efectos autocrino y/o paracrino (Mundy, 1992). Las hormonas más importantes que intervienen en la fisiología ósea son: 2.4.5.1. Paratohormona: La PTH es la hormona que controla la homeostasis del calcio a través de la acción directa sobre el hueso y el riñón, e indirecta en el intestino. Producida en las glándulas paratiroideas que responden al descenso de la calcemia, es la hormona hipercalcemiante por excelencia al favorecer la reabsorción. No obstante, 26 INTRODUCCIÓN se ha descubierto un papel estimulador en la formación ósea, cuando se administra de forma intermitente a dosis bajas (Finkelstein et al., 1994) o a través de la síntesis de IGF-I y TGFβ (Canalis, McCarthy & Centrella, 1989). Este doble efecto de reabsorción y formación se explicaría porque la PTH en administración continua, estimularía la reabsorción ósea a través de la síntesis de un factor favorecedor de la osteoclastogénesis (RANKL) por parte de las células osteoblásticas, mientras que a dosis intermitentes, estimularía la formación de hueso, asociado a un incremento de los factores de crecimiento mencionados anteriormente y a una disminución de la apoptosis de los osteoblastos (Horowitz, 2003). Los osteoblastos, poseen receptores para la PTH, con lo cual, pueden ser intermediarios de la resorción ósea y estimular indirectamente a los osteoclastos, a través de las citocinas liberadas para su activación (Horowitz, 2003). Algunos datos atribuyen a esta hormona una acción directa sobre las células osteoblásticas acelerando su diferenciación, proliferación y AP (Klaushofer et al., 1995). Los factores producidos por estas células en respuesta a la PTH, son el factor estimulador de colonias tipo 1 (CSF-1) o el factor estimulador de colonias de macrófagos (M-CSF) (Weir, Lowik, Paliwal & Insogna, 1996); la IL-11 (Romas et al., 1996); el factor de diferenciación osteoclástica (Yasuda et al., 1998) y la IL-6 (Onyia, Bidwell, Herring, Hulman & Hock , 1995). Esta hormona tiene efectos sobre la apoptosis inducida por el TNF-α, y estimula la producción de osteocalcina y AP como marcadores de osteoblastos maduros (Pascher, Perniok, Becker & Feldkamp, 1999). 27 INTRODUCCIÓN 2.4.5.2 Calcitonina: Las células C o parafoliculares del tiroides producen calcitonina, una hormona hipocalcemiante que inhibe la reabsorción ósea, al reducir el número y la actividad de los osteoclastos. Sin embargo, esta acción es transitoria, ya que los osteoclastos parecen volverse “impermeables” a la calcitonina en pocos días (Prieto, 2000). 2.4.5.3 1,25(OH)2 vitamina D3 o calcitriol: Para el crecimiento normal del esqueleto es necesario el calcitriol, hormona esteroidea que favorece la absorción intestinal de calcio y fosfato y, por tanto, la mineralización ósea. Algunos autores piensan que puede ser producida por células linfocíticas o monocíticas del hueso, ejerciendo un papel importante como regulador local de la diferenciación de los osteoclastos (Raisz, 1993a). Estimula la síntesis osteoblástica de fosfatasa alcalina (Fritsch, Grosse, Lieberherr & Balsan, 1985; Beresford, Gallagher & Russell, 1986) y osteocalcina (Price & Baukol S.A., 1980; Price, Williamson & Lothringer, 1981) tras la unión a su receptor (Kream, Jose, Yamada & DeLuca, 1977; McDonnell, Pike & O'Malley, 1988) y, a dosis elevadas, aumenta la resorción ósea. Junto a la PTH, aumentan de forma sinérgica la resorción ósea, estimulando a los precursores inmaduros de los osteoclastos que poseen receptores para ambas (Tilyard, Spears, Thomson & Dovey, 1992). Existe una asociación directa entre el calcitriol y el receptor del factor de crecimiento epidérmico, el cual sinérgicamente, parece inducir la maduración osteoblástica en la línea celular de osteosarcoma MG-63 (Yarram et al., 2004). 28 INTRODUCCIÓN 2.4.5.4 Andrógenos: A través del estímulo de los receptores de los osteoblastos, los andrógenos, tienen un efecto anabolizante sobre el hueso, así mismo, actúan de mediadores en el pico de GH existente en la pubertad. Mientras que la deficiencia androgénica se asocia a una menor densidad ósea, la administración de testosterona en jóvenes antes del cierre epifisario incrementa la masa ósea. Igualmente, las mujeres con exceso de andrógenos presentan densidades óseas más altas (Alexandre, 2005). Los andrógenos, regulan algunos aspectos de las células del linaje osteoblástico como la proliferación, diferenciación o mineralización. Estudios recientes, demuestran sus efectos anabólicos y anti-reabsorción sobre el hueso, tal vez, mediatizados por factores como el IGF-1, TGFβ y la IL-6 (Hofbauer et al., 1999). 2.4.5.5 Estrógenos: Son esenciales para el cierre de los cartílagos de conjunción y se ha descubierto que juegan un papel importante en el desarrollo esquelético, tanto femenino como masculino, durante la adolescencia. Los estrógenos, tienen un doble efecto sobre el metabolismo óseo: por un lado, favorecen la formación ósea al aumentar el número y la función de los osteoblastos y, por otro lado, disminuyen la reabsorción. Se han descrito receptores de estrógenos en osteoblastos, osteocitos y osteoclastos humanos. Hofbauer y cols. en 1999 (Hofbauer et al., 1999), han comprobado que los estrógenos pueden aumentar los niveles de osteoprotegerina (OPG), proteína producida por los osteoblastos que inhibe la reabsorción, por lo que podrían jugar un papel importante en la regulación de la osteoclastogénesis. Un déficit estrogénico, estimula la resorción ósea al incrementar la producción de PGs y la producción de IL-6 y de IL-1 (Amin et al., 29 INTRODUCCIÓN 2000). Es por esto, que el déficit de estrógenos durante la menopausia constituya el factor patogénico más importante de la pérdida ósea asociada a la osteoporosis. Estas hormonas, estimulan la producción de sustancias con efecto anabólico sobre el hueso, como es el caso del IGF-I, o reducen la síntesis de citocinas catabólicas por los osteoblastos y fagocitos monocucleares. Hughes y cols. en el año 1996 (Hughes, Dai & Tiffee, 1996), demostraron el efecto de los estrógenos sobre la apoptosis o muerte celular programada de los osteoclastos. 2.4.5.5 Progesterona: Otra hormona anabolizante sobre el hueso es la progesterona, la cual, actúa directamente a través de los osteoblastos, que poseen receptores para la hormona, o bien, indirectamente, mediante la competición por los receptores osteoblásticos de los glucocorticoides. Tiene una acción positiva directa sobre la formación ósea por los osteoblastos gracias a la presencia de estrógenos. En mujeres menopáusicas, la pérdida de masa ósea es debida a la privación simultánea de estrógenos y progesterona (Rickard et al., 2002). 2.4.5.6 Insulina: La insulina, estimula la síntesis de la matriz directa e indirectamente, a través del aumento de la síntesis hepática del IGF-I. In vitro, incrementa la incorporación de aminoácidos en el hueso embrionario y estimula la síntesis de proteínas por los osteoblastos, mientras que, in vivo, un déficit insulínico inhibe la formación de cartílago y la osteogénesis (Cai et al., 2002). 2.4.5.7. Glucocorticoides: A dosis altas, los glucocorticoides, tienen efectos catabólicos sobre el hueso, ya que inhiben la síntesis de IGF-I por los osteoblastos, y suprimen 30 INTRODUCCIÓN directamente la BMP-2 y el Cbfa1, factores críticos para la osteoblastogénesis (Manolagas, 2000). Sin embargo, otros estudios demostraron que a dosis fisiológicas tienen capacidad osteogénica favoreciendo la diferenciación osteoblástica (Lukert & Kream, 1996). 2.4.5.8. Hormona del crecimiento (GH): Tiene dos acciones sobre el hueso, directa e indirecta. La GH actúa directamente sobre los osteoblastos estimulando su actividad, lo que produce un aumento en la síntesis de colágeno, osteocalcina y fosfatasa alcalina. La acción indirecta, se produce a través del aumento de la síntesis de IGF-I e IGF-II por los osteoblastos. Estos factores, favorecen la proliferación y diferenciación de los osteoblastos aumentando su número y función. Desde hace unos años se viene considerando a la GH como un factor de crecimiento local, ya que no sólo se sintetiza en la adenohipófisis, sino en casi todas las células del organismo incluidos los osteoblastos (Harvey & Hull, 1997), teniendo un efecto autocrino y paracrino además de endocrino. 2.4.6 Factores locales: El remodelado óseo, también está regulado por factores locales entre los que destacan, las citoquinas, PGs, los factores de crecimiento y las proteínas de la matriz ósea, implicadas en la modulación de la acción de otros factores locales (Zheng, Vrintis & Lopez, 1997). Las citocinas, son sustancias endógenas biológicamente activas que desencadenan respuestas específicas, y participan como mediadores importantes, tanto en procesos fisiológicos como fisiopatológicos en el sistema inmune. Su síntesis, se induce en respuesta a estímulos activadores, se liberan y actúan sobre receptores específicos de membrana celular, cuya expresión es también, a veces, un fenómeno transitorio regulable. Ejercen su actividad secuencial y coordinadamente y están sometidas a una compleja interregulación destinada a 31 INTRODUCCIÓN mantener la homeostasis de los procesos de proliferación, diferenciación y reparación celular. Son secretadas por linfocitos, macrófagos, células endoteliales, neuronas y células gliales entre otras. Algunas de ellas, actúan como mediadoras entre los leucocitos y se denominan, interleucinas (Morcillo y Cortijo, 2004). Los principales grupos de citocinas son las interleucinas (IL-1, IL-6, IL-8, IL-11), los factores de necrosis tumoral (TNF-α, TNF-β), los interferones (IFN-α, IFN-β y IFNγ) (Garcia-Moll & Kaski, 2000) y las PGs. La IL-1, es un polipéptido con dos formas, la IL-1α, la cual, está unida a la célula, y la IL-1β, soluble y predominante en fluidos biológicos. Aunque la fuente principal de la IL-1 es el macrófago activado, es producido así mismo, por otros tipos de células como los fibroblastos, células endoteliales y epiteliales y algunos linfocitos B, en respuesta a una lesión tisular, una infección o un estímulo antigénico. Desempeña un papel primordial en la respuesta inmune e inflamatoria, tanto local como sistémica (Morcillo y Cortijo, 2004). Es un factor local muy importante en el metabolismo óseo, tanto como mediador del proceso inflamatorio, como inductor potente de prostanoides (Pilbeam et al., 1997b), de la expresión de la PGHS-2 y de la producción de Prostaglandina E2 (PGE2), en la línea celular MG-63 y osteoblastos humanos (Min, Rao, Okada, Raisz & Pilbeam, 1998). Estimula directamente la reabsorción osteoclástica, incrementando la proliferación y diferenciación de los preosteoclastos, así como la actividad osteoclástica e inhibiendo la apoptosis de los osteoclastos (Compston, 2001). Su acción sobre la reabsorción es directa e indirecta, a través de la síntesis de prostaglandinas (Kumar et al., 2001). La IL-6, es un mediador inflamatorio y una hormona circulante, implicada en la proliferación y diferenciación de linfocitos T y B y en la hematopoyesis (Morcillo y Cortijo, 2004). Induce de forma potente la osteoclastogénesis y es producida por células osteoblásticas en respuesta a la PTH, la IL-1 y el TNF (Holt, Davie, Braidman & Marshall, 1994). Esta citocina, es un mediador importante de la 32 INTRODUCCIÓN resorción ósea producida por la PTH, in vivo, y según algunos autores, desempeña un papel importante en la formación y resorción ósea inducida por la PTH (Grey et al., 1999; Pollock, Blaha, Lavish, Stevenson & Greenfield, 1996). Estimula la reabsorción ósea y parece implicada en la patogenia de la enfermedad de Paget (Roodman et al., 1992). La IL-11 es una citocina funcionalmente pleiotrópica que se aisló en una línea celular de la médula ósea y que tiene la capacidad de estimular la proliferación de las células dependientes de la IL-6 (Paul et al., 1990). Una señal de que la IL-11 tal vez regule las respuestas al tejido conectivo, es su expresión en células de la línea mesenquimática, tales como fibroblastos, células de la médula ósea, placentarias, condrocitos articulares y sinoviocitos (Elias et al., 1994; Maier, Ganu & Lotz, 1993). En algunas líneas se observa a la IL-11 como un factor osteotrópico. Los receptores de la IL-11 están presentes en células progenitoras condroblásticas y osteoblásticas durante la embriogénesis de ratones (Neuhaus et al., 1994). Esta interleuquina es producida por células de la línea de osteosarcoma SaOs-2 (Elias et al., 1994). Según Girasole y cols. en el año 1994 (Girasole, Passeri, Jilka & Manolagas, 1994) la IL-11 estimula la formación de células osteoclásticas multinucleadas (OCL) de forma dosis-dependiente en osteoblastos de ratón y células de la médula ósea. Dentro del grupo del TNF, existen dos formas, α y β, ésta última también denominada como linfotoxina, produce prostanoides, citocinas y moléculas de adhesión en células endoteliales, es quimiotáctico de neutrófilos y macrófagos, y activa fibroblastos. La IL-1, actúa de modo sinérgico con el TNF-α (Morcillo y Cortijo, 2004). El TNF-α, es producido principalmente por los linfocitos T activados y monocitos; es un potente regulador de la resorción ósea, pues es el principal 33 INTRODUCCIÓN responsable en la expresión del ODF, sintetizado en osteoblastos y células estromales, de tal modo que, induce la formación de osteoclastos y su activación (Romas, Gillespie & Martin, 2002; Kumar et al., 2001). Según algunos autores (Jilka, 1998; Pacifici, 1996), la IL-1β, el TNFα y la IL6, están implicadas en la patogénesis de la pérdida ósea postmenopáusica. La IL-1-β y el TNF-α, estimulan otras citocinas de resorción ósea, incluidas la IL-6 y la IL-11 (Manolagas & Jilka, 1995; Romas et al., 1996). Además, la producción de IL-1β y de TNF-α por células estromales de la médula, es regulada por otras hormonas y citocinas, aumenta ante el déficit de estrógenos y es suprimida por el tratamiento con estrógenos (Kimble, Srivastava, Ross, Matayoshi & Pacifici, 1996). Los interferones, son proteínas generadas por una infección vírica y otros estímulos. Se han descrito tres clases: IFN-α, el IFN-β y el IFN-γ. Éste último, es de producción restringida a linfocitos T activados por antígeno. Todos los interferones, tienen actividad antivírica y antitumoral, y únicamente el IFN-γ tiene un papel central en el control de la respuesta inmunológica. Éste, inhibe la resorción ósea pero no afecta sobre la actividad reabsortiva de los osteoblastos maduros (Takayanagi et al., 2001; Kumar et al., 2001). Junto al TNF-α, producen efectos inhibidores sobre la síntesis de colágeno (Siwik, Chang & Colucci, 2000) y modulan la expresión de las moléculas de adhesión como las integrinas, selectinas y cadherinas (Tsutsumimoto, Kawasaki , Ebara & Takaoka, 1999). Las PGs son hormonas de origen lipídico, que poseen efectos múltiples y complejos, siendo el hueso una fuente abundante de ellas, sobre todo, de PGE2 y de prostaciclina (PGI2), producidas por los osteoblastos (Kawaguchi, Pilbeam, Harrison & Raisz, 1995). Son sintetizadas a partir del ácido araquidónico por la acción enzimática de la ciclooxigenasa (COX), cuya actividad está modulada por un proceso de feed-back autocrino (Pilbeam et al., 1995; Esplugues y Barrachina, 34 INTRODUCCIÓN 2004). Las hormonas sistémicas y algunos factores locales pueden actuar, en parte, a través de la producción de prostaglandinas, desempeñando así, un importante papel en el control local del metabolismo óseo. Son importantes en la reparación ósea tanto normal como patológica, por ejemplo, un déficit de estrógenos puede aumentar la síntesis de prostaglandinas en el hueso, lo cual, provocaría una pérdida aséptica (Westacott , Taylor, Atkins & Elson, 1992). Ciertos estudios, in vitro, han demostrado que las PGs favorecen la reabsorción ósea, fundamentalmente la PGE2, aunque también la PGE1, PGG2, PGI2 y PGH2 (Kawaguchi, Pilbeam, Harrison & Raisz, 1995). Según Offenbacher y cols. en 1993 (Offenbacher, Heasman & Collins, 1993), analizando los niveles de PGs en el líquido crevicular, in vivo, vieron su participación en la destrucción ósea de la enfermedad periodontal (Offenbacher, Heasman & Collins, 1993). Sin embargo, según otros autores, el efecto de las PGs E1 y E2 sobre las funciones osteoblásticas de calvaria de raton, in vitro, producen una inhibición de la síntesis de ADN y mitosis celular de forma tiempo/concentración dependiente, por lo que, tal vez, estén involucradas en la maduración de la matriz y en la mineralización ósea en los primeros estadios de la diferenciación osteoblástica (Ho, Chang, Chuang, Hsu & Wang, 1999). Las PGs exógenas, tienen un efecto doble sobre la proliferación de osteoblastos, por lo que, puede ser tanto estimulador como inhibidor de células óseas según la concentración utilizada (Raisz, Pilbeam & Fall, 1993b). Los factores de crecimiento, son polipéptidos que regulan la diferenciación, migración y metabolismo celular. Sobre el hueso, actúan incrementando la expresión fenotípica y el número de células de estirpe osteoblástica u osteoclástica. Son sintetizados y secretados localmente por el tejido sobre el que actúan y regulan la síntesis de moléculas de adhesión específicas, que controlan la interacción célula-célula y célula-sustrato (implante)( Tresguerres, 2006). 35 INTRODUCCIÓN La acción de cada uno de los factores de crecimiento en los defectos óseos es múltiple. Según el momento, inducen actividad, proliferación, diferenciación y quimiotáxis en diferentes células blanco, como lo pueden ser macrófagos y osteoblastos, e incluso estimulan la angiogénesis (Singer & Clark, 1999; Kessler, Kastler, Mayr-Wohlfart , Puhl & Gunther, 2000; Solheim, 1998; Lind, 1996). El IGF, pertenece al grupo de las somatomedinas, péptidos que mediatizan la acción de la hormona somatotropa en el cartílago y el hueso. Tienen acciones biológicas semejantes a las de la insulina, de ahí que también se llamen “factores de crecimiento semejantes a la insulina o Insulin-like Growth Factor”. Se conocen dos tipos, el IGF-I y el IGF-II. Ambos, son sintetizados en el hígado, en tejidos no esqueléticos y en osteoblastos. Se hallan en gran concentración en la matriz osteoide (Cohick & Clemmons, 1993). Los IGFs están regulados por hormonas y factores de crecimiento locales; así la GH, los estrógenos y la progesterona aumentan su producción, mientras que los glucocorticoides la inhiben. Asímismo, median en la interacción osteoblastoosteoclasto e intervienen de forma activa en el remodelado óseo (Hill, Reynolds & Meikle, 1995). El IGF-I, estimula la replicación de las células preosteoblásticas, incrementa la síntesis de matriz osteoide y aumenta la síntesis de ADN y proteoglicanos en el cartílago. Interviene en la acción anabólica de la PTH, a dosis bajas, sobre el tejido esquelético, e, in vitro, inhibe la degradación de colágeno (Nasu, Sugimoto, Tsutsui & Chihara, 2000; Langdahl, Kassem, Moller & Eriksen, 1998). En cultivos primarios de osteoblastos, se ha observado recientemente, que al añadir IGF-I y TGFβ sobre una superficie de titanio, aumenta la producción de colágeno tipo I, por lo que sugieren un mayor uso clínico en implantes (Wildemann, Lübberstedt , Hass, Raschke & Schmidmaier, 2004). 36 INTRODUCCIÓN El IGF-II, es el factor de crecimiento más abundante de la matriz ósea, es importante durante la embriogénesis, pero sus efectos sobre el esqueleto ya desarrollado actualmente se desconocen (Mohan & Baylink, 1991). Hay dos tipos de TGF, el TGFα, que favorece la proliferación de los osteoblastos, inhibe la síntesis de matriz osteoide y estimula la resorción del tejido esquelético; y el TGFβ, secretado por los osteoblastos y depositado en la matriz ósea, el cual, inhibe la progresión de adipocitos, estimula la proliferación y la diferenciación temprana osteoblástica, in vitro e in vivo, e inhibe la diferenciación terminal (Alliston, Choy, Ducy, Karsenty & Derynck, 2001; Choy, Skillington & Derynck, 2000; Bonewald & Dallas, 1994). La PTH, parece aumentar la liberación del TGFβ en osteoblastos humanos y tal vez este factor de crecimiento, mediatice la acción de la PTH en estas células (Wu & Kumar, 2000). A nivel óseo están presentes tres formas, las tres con similar actividad biológica: TGFβ1, TGFβ2, TGFβ3. Estos factores, pueden inhibir o estimular la proliferación osteoblástica y aumentar la síntesis de colágeno según el tipo de célula que se estudie (Wu & Kumar, 2000). Fisiológicamente en el suero y en el plasma, se encuentran altas concentraciones del factor de crecimiento TGFβ1 (Zambonin et al., 2000; Ivanovic, Melman, Davis-Joseph, Valcic & Geliebter, 1995). En las células maduras y con la presencia de ciertas citocinas, parecen tener un efecto coestimulador sobre la proliferación y la diferenciación, especialmente en células dendríticas y macrófagas (Strobl et al., 1996). Las BMPs, están incluidas dentro de la familia de los TGFβ. Constituyen un grupo de 15 proteínas capaces de conseguir la transformación de tejido conjuntivo en tejido óseo, por lo que se consideran osteoinductivas. Asímismo, son capaces de estimular la diferenciación de células pluripotenciales hacia diferentes líneas celulares (tejido adiposo, cartílago y hueso). Son muy abundantes en el tejido óseo y durante la embriogénesis participan en la formación de hueso y cartílago. Actualmente, se las considera como los factores más potentes de la diferenciación 37 INTRODUCCIÓN osteoblástica (Yamaguchi, Komori & Suda, 2000) y algunos autores creen que además de estimular la osteogénesis, inhiben la osteoclastogénesis (Canalis, Economides & Gazzerro, 2003). De la familia del FGF, se conocen dos factores, el ácido y el básico. Ambos, tienen actividad mitógena sobre células endoteliales vasculares y sobre células de la estirpe osteoblástica, favoreciendo la síntesis de matrices extracelulares cartilaginosa y ósea, y reparando heridas y fracturas (Fromigue, Modrowski & Marie, 2005). Recientemente se ha descubierto que el TGFβ y el FGF, in vitro, aumentan significativamente el crecimiento celular y la adherencia de los osteoblastos a distintas superficies (Reyes-Botella, Vallecillo-Capilla, Olivares & Ruiz, 2002b). El PDGF, tiene una acción mitógena sobre los fibroblastos y las células precursoras presentes en el periostio. Es producido por las plaquetas durante su agregación. Favorece la síntesis y la degradación de la matriz osteoide y estimula la replicación celular y la formación de nuevos vasos sanguíneos (Gruber, Varga, Fische & Watzek, 2002; Yang, Jin, Chen, Jing & Wu, 2000). El factor epidérmico del crecimiento (EGF), es un péptido que estimula la replicación de fibroblastos y de células preosteoblásticas en el periostio. Estimula la reabsorción de tejido esquelético, probablemente a través de la PGE2. Aunque incrementa la proliferación de osteoblastos, inhibe la síntesis de matriz osteoide, ya que, la propia replicación, limita la función de las células maduras (Chaudhary & Hruska, 2001; Chang & Wong, 2000). El factor de crecimiento vascular endotelial (VEGF), induce la angiogénesis y la proliferación endotelial vascular. Produce vasodilatación y un incremento de la permeabilidad vascular. Se produce en situaciones de hipoxia y actualmente se está considerando como uno de los factores claves en el desarrollo de las 38 INTRODUCCIÓN primeras fases del proceso de reparación de fracturas y regeneración ósea, así como en el desarrollo tumoral. El factor estimulador de colonias de granulocitos y macrófagos (GM-CSF), es importante para la osteoclastogénesis y puede intervenir en la patogenia de la osteopetrosis. El M-CSF, es producido por los osteoblastos y células del estroma medular y es requerido como factor esencial en las primeras fases de la osteoclastogénesis para la formación de células gigantes multinucleadas, pero no tiene efecto sobre la actividad osteoclástica. Recientemente, se ha descubierto que las proteínas de la matriz actúan como moduladores de los factores de crecimiento (Young, 2003). Hay que tener en cuenta, que estas proteínas se hallan a una concentración mil veces mayor que los factores de crecimiento, por lo que podrían jugar un papel más importante en la regulación de las diferentes funciones celulares. Por otro lado, participan en la regulación de la diferenciación de las células contenidas en la matriz. Por ejemplo el colágeno tipo I, es uno de los marcadores más tempranos que regulan las células osteoprogenitoras y la fosfatasa alcalina, es una proteína de superficie que podría participar en la regulación de la proliferación, migración y diferenciación de las células osteoblásticas (Horwith, Tedesco, Gundberg, García-Orana & Stewart , 2003). 2.5 Papel funcional del osteoblasto: La función más conocida de los osteoblastos, es la de sintetizar los componentes de la matriz ósea y controlar la actividad de resorción de los osteoclastos. Los productos secretados, mantienen un equilibrio complejo de relación con los osteoclastos. 39 INTRODUCCIÓN Recientemente, se ha demostrado que estas células también poseen funciones asociadas al sistema inmune; como la capacidad fagocítica, la estimulación de los linfocitos T o la síntesis de citoquinas (Ruiz, Perez, VallecilloCapilla & Reyes-Botella, 2003; Stanley, Vandort, Motyl, Endres & Fox, 2006; Lisignoli et al., 2003; Rifas, Arackal & Weitzmann, 2003). Diversos estudios han demostrado que los osteoblastos secretan citocinas y receptores de citocinas que mediatizan la respuesta para secretar productos de linfocitos activados (Rifas, Arackal & Weitzmann, 2003; Takeuchi, Fukumoto & Matsumoto, 1995; Ishibashi, Karube, Yamakawa & Koshihara, 1995). Entre ellas destacamos las citocinas proinflamatorias IL-1(Li et al., 1991), IL-6 (Bost et al., 1999; Ishimi et al., 1990; Li et al., 1991), TNF-α (Gowen et al., 1990), IL-12 (Bost et al., 1999) y la IL-18 (Udagawa et al., 1997); GM-CSM (Bost, Bento, Ellington, Marriott & Hudson, 2000), quimiocinas como la MCP-1 (Proteína quimiotáctica de monolitos tipo 1) (Bost et al., 2001; Williams, Jiang, Cochran, Dorsam & Graves, 1992), Proteína inflamatoria de macrófagos (MIP) (Kukita et al., 1997) y la IL-8 (Chaudhary & Avioli, 1994), e incluso, factores de crecimiento como el TGFβ1, el cual, puede ser antiinflamatorio (Robey et al., 1987). En la superficie celular de los osteoblastos, se describe la expresión de antígenos propios de células inmunocompetentes, incluyendo moléculas coestimuladoras y ligandos para dirigir las moléculas de la superficie de las células T, documentadas en líneas de osteoblastos humanos y en tejidos óseos intactos (Lisignoli et al., 2004; Chen, Qian, Neff, Satomura & Horowitz, 1999; Okada et al., 2002; Nelissen et al., 2000; Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2000; Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2002a; Kikuchi et al., 2001; Schrum, Bost, Hudson & Marriott, 2003a). Según algunos autores, diferentes tipos de osteoblastos humanos, tienen propiedades inmunocompetentes e interaccionan bidireccionalmente con las células T, sugiriendo, que estas interacciones, in vitro, son representativas de 40 INTRODUCCIÓN procesos fisiológicos o patológicos que ocurren, in vivo (Stanley, Vandort, Motyl, Endres & Fox, 2006). En cultivos primarios de osteoblstos humanos y de rata, se ha observado actividad fagocítica pudiendo incorporar distintos biomateriales. Las partículas estudiadas, eran polímeros sintéticos y partículas de desecho de material protésico de diferente composición. En general, las partículas fagocitadas tenían un tamaño entre 1-3 µm de diámetro (Pioletti, Takei, Kwon, Wood & Sung, 1999; Heinemann et al., 2000; Lohmann et al., 2000) si bien, otros autores, demuestran que esta capacidad fagocítica se extiende tanto a material sintético no degradable (bolitas de látex), como a distintos microorganismos (Candida Albicans, Escherichia Coli y Klebsiella (Ruiz, Perez, Vallecillo-Capilla & Reyes-Botella, 2003). Dichas dianas al ser fagocitadas, se incorporaban al citoplasma y no al núcleo como demuestran otros autores (Heinemann et al., 2000; Lohmann et al., 2000). Morfológicamente, las células presentaban modificaciones y no aparecían signos de apoptosis o necrosis celular (Pioletti, Takei, Kwon, Wood & Sung, 1999). Estos resultados sugieren, que durante la diferenciación celular osteoblástica, una subpoblación de las células puede verse involucrada en funciones inmunes, tales como la fagocitosis y la activación de células T. Como propone Heinemann y cols. en el año 2000 (Heinemann et al., 2000), la situación, in vitro, tal vez, refleje la situación, in vivo. Cuando los osteoblastos están en contacto con microorganismos y materiales endoprotésicos, desarrollan funciones inmunológicas para eliminarlos. Esta actividad, puede conllevar cambios morfológicos, antigénicos y bioquímicos. Esta nueva función, puede ser importante en algunas situaciones como en procesos inflamatorios, los cuales, van acompañados de la liberación de ciertas citocinas. Éstas, pueden modular y acentuar el fenotipo antigénico de los osteoblastos y, por tanto, su papel funcional inmunológico (presentación de antígenos y fagocitosis), el cual, podría, parcialmente, detener el proceso de diferenciación y maduración, por ejemplo, la formación ósea. Este proceso, es propuesto como un mecanismo de emergencia y 41 INTRODUCCIÓN no como un proceso fisiológico (Ruiz, Perez, Vallecillo-Capilla & Reyes-Botella, 2003). Los osteoblastos además, pueden entrar en contacto con células del sistema inmune bajo distintas circunstancias, incluyendo la erosión ósea por invasión del pannus sinovial en la artritis reumatoide, la inflamación linfocítica de la médula ósea adyacente a una articulación afectada por artritis inflamatoria (Gortz et al., 2004), la remodelación ósea durante la reparación de la fractura, la invasión del hueso por neoplasias que contienen linfocitos infiltrantes del tumor (Tanaka et al., 1998) y el desarrollo linfoide en regiones de la médula ósea directamente adyacente al hueso. Estudios previos, han sugerido que los osteoblastos, tal vez, interactúen con los linfocitos B y T, de forma que podrían facilitar su activación (Lisignoli et al., 2004; Skjodt, Moller & Freiesleben, 1989). 2.6. Línea celular de Osteosarcoma: MG-63. El osteosarcoma, es el tumor primario maligno óseo más común (Link et al., 1986). Hay tres tipos principales: osteoblástico, condroblástico y fibroblástico. Además, es uno de los tumores humanos más heterogéneos: sus características microscópicas varían entre las diferentes lesiones e incluso a lo largo de las zonas del mismo tumor; pero todas tienen en común, la expresión constitutiva del enzima COX-2 (Dickens, Kozielski, Khan, Forus & Cripe, 2002; Dickens, Kozielski, Leavey, Timmons & Cripe, 2003). Está demostrado que la línea celular MG-63, posee mayores niveles de COX-2, que otras líneas de osteosarcoma (Naruse, Nishida, Hosono & Ishiguro, 2006). Hay tipificadas distintas líneas osteoblásticas de osteosarcoma, como la línea MG-63, HOS, U2-OS, SaOS o MCF-7, las cuales, han sido de gran utilidad en la investigación, ya que, son utilizadas para el estudio, in vitro, del efecto de distintas biomoléculas (factores de crecimiento, citoquinas, hormonas o drogas) sobre las células óseas, o bien, para valorar las ventajas de ciertas superficies de 42 INTRODUCCIÓN biomateriales, empleadas para la elaboración de material protésico utilizado en terapia reparadora ósea, como es el caso de los implantes (Stanley, Vandort, Motyl, Endres & Fox, 2006; Cai, Byth & Shapiro, 2006, Kuo, Huang, Chang & Chang 2006; Herath, Silvio & Evans, 2005). El uso de estas líneas tumorales en estudios, in vitro, presentan ventajas frente a los cultivos primarios de osteoblastos, tales como, la pureza celular, la capacidad proliferativa ilimitada y la homogeneidad de respuesta. La línea MG-63, tal vez, sea la mas comúnmente utilizada. Junto a su gran capacidad proliferativa, cabe señalar su capacidad para diferenciarse y retener la maduración a futuros osteoblastos, así como una mineralización potencial. Por ello, esta línea, está considerada como precursora de osteoblastos, o como una línea que posee las características comunes a los osteoblastos (Prouillet et al., 2004; Nayab, Jones & Olsen, 2005; Aubin, 1998). 43 INTRODUCCIÓN 3. INFLAMACIÓN. 3.1. Concepto: La inflamación, es la respuesta de los tejidos ante una agresión de cualquier naturaleza física, química, mecánica o biológica. Es por tanto, un mecanismo inmunológico inespecífico, que tiene como objetivo eliminar el agente causal, cicatrizar el tejido dañado y restablecer la función normal (Feria, 2004). Así, en caso de que el daño tisular sea de naturaleza biológica, como los procesos infecciosos, constituye una respuesta elemental, pero rápida, de defensa frente a la infección que precede y prepara la respuesta específica. En esta respuesta inmunológica, tiene lugar la liberación de mediadores, que son los responsables de los cambios vasculares que acompañan a la respuesta inflamatoria, y que a su vez, originan los signos típicos de la inflamación: tumor, rubor, calor y dolor (Díaz-Rubio y Espinós, 1994). La inflamación es, por tanto, una respuesta fisiológica, aunque en determinadas circunstancias se puede hacer patológica como en la inflamación crónica ( Algarra, García, Garrido y Molina, 2001). Hay varias vías inflamatorias, cada una de las cuales, progresa a través de una cascada de procesos biológicos, por lo que, cada etapa en el proceso, tiene la propiedad de inducir las etapas subsecuentes y dar origen a una respuesta integrada. El conjunto de procesos particulares que tienen lugar durante una respuesta inflamatoria, depende de múltiples factores que incluyen, la naturaleza del estímulo desencadenante, su puerta de entrada y las características del huésped. 44 INTRODUCCIÓN 3.2 Fases de la inflamación: En la inflamación, tienen lugar una serie de fases sucesivas. En la primera de ellas, como consecuencia del traumatismo, el mastocito se desgranula, liberando un número importante de mediadores de la inflamación (histamina, heparina, kininogenasas y factores quimiotácticos, entre otros). Algunos, actúan sobre las células endoteliales que tapizan internamente los vasos, aumentando la permeabilidad vascular. Ésto, permite que en una primera etapa pasen moléculas circulantes de la sangre como anticuerpos, factores del complemento o proteínas de la fase aguda, hacia el foco inflamatorio, o lo que es lo mismo, al tejido que ha sufrido el traumatismo. Las células endoteliales activadas por los mediadores de la inflamación, expresan determinadas moléculas de adhesión que se unen a sus ligandos expresados por los leucocitos que circulan por la sangre y determinan, en una fase tardía, la llegada de estos leucocitos al foco inflamatorio. Las moléculas y leucocitos atraídos hasta el tejido que ha sufrido el traumatismo, desarrollan sus funciones inmunológicas en dicho foco. La respuesta inflamatoria, es activada por las citocinas inflamatorias, tales como la IL-1, IL-6 o el TNF y citocinas TH1 como el IFNγ, e inhibida por citocinas TH2 como la IL-4, IL10, TGFβ-1 y, glucocorticoides. Una vez que el problema ha sido resuelto, en el caso de que la agresión sea de origen biológico y cuando la infección ha sido eliminada, se inicia el proceso de reparación, el cual, constituye la última etapa de la respuesta inflamatoria. En esta etapa, es muy importante la participación de células fibroblásticas, sobre todo en el tejido conjuntivo. Estas células producen fibras de la matriz extracelular e inducen la retracción de las heridas (Serhan, 2006). 45 INTRODUCCIÓN 3.3. Mediadores de la inflamación: En el proceso inflamatorio, participan conjuntamente células y moléculas. El componente celular, lo forma, y por orden de participación, los monocitos, los neutrófilos, los mastocitos, los macrófagos, los eosinófilos, las plaquetas, los linfocitos y las células endoteliales (Esplugues y Barrachina, 2004). En cuanto a los mediadores moleculares de la inflamación (Abbas & Lichtman, 2001; Connell & McInnes, 2006), destacaremos los siguientes: Proteinas plasmáticas, como las proteínas del Sistema del Complemento, las Kininas, o las proteínas fibrinolíticas y de la coagulación. Mediadores lipídicos o mediadores de “novo” sintetizados “in situ”, como las PGs, los Tromboxanos (TXs), leucotrienos y lipoxinas. Péptidos y Aminas, como la Histamina, Serotonina, quimiocinas, citocinas (IL-1, IL6, IL-12, TNF-β) y el NO. 46 INTRODUCCIÓN 4. ANTIINFLAMATORIOS NO ESTEROIDEOS Los antiinflamatorios no esteroideos (AINEs), constituyen un grupo farmacológico muy heterogéneo que posee actividad antitérmica, antiinflamatoria, antiagregante y analgésica. 4.1. Mecanismo general de acción: Poseen un mecanismo de acción en común, caracterizado por evitar la síntesis de eicosanoides que ejercen un importante papel, tanto en la sensibilización de los nociceptores, como en la mediación de los procesos inflamatorios, fiebre e interferencia de la agregación plaquetaria (Vane, 1997). Por esta razón, son usados en terapéutica como analgésicos, antiinflamatorios, antipiréticos y antiagregantes plaquetarios. El ácido araquidónico, se libera de los fosfolípidos de membrana por la activación de la enzima fosfolipasa A2 (Kudo, Murakami, Hara & Inoue, 1993). Una vez liberado, parte de él, es metabolizado de forma rápida hasta obtener productos oxigenados por la acción de diferentes sistemas enzimáticos como la ciclooxigenasa (COX) o varias lipooxigenasas, transformándose en PGs, TXs y leucotrienos (Narumiya & Fitzgerald, 2001; Smith, Dewitt & Garavito, 1992; DeWitt, 1991). No obstante, cada familia química de AINEs, presenta un mecanismo distinto de inhibición de la COX, por ejemplo, el ácido acetilsalicílico, inhibe irreversiblemente este enzima y se utiliza diferencialmente por su importante efecto antiagregante; el paracetamol, la bloquea por retención de radicales libres, caracterizándose por una baja actividad antiinflamatoria, y el resto de los AINEs, la inhiben de forma competitiva y esteroespecífica (Lands, 1981). 47 INTRODUCCIÓN Además, cada molécula puede tener ciertas acciones farmacológicas diferenciales que potencien su utilización preferente en terapéutica como antiinflamatorios; interfiriendo la activación de neutrófilos, produciendo aniones superóxido o inhibiendo moléculas de adhesión, como analgésicos; pasando al Sistema Nervioso Central o modulando la síntesis de glutamato (Feria, 2004; Dubois et al., 1998; Brune et al., 1991). En general, los AINEs tienen un uso clínico en cefaleas, artralgias, mialgias o dolores moderados. Como la gran mayoría de los fármacos, presentan efectos secundarios, y los más frecuentes se deben, principalmente, a la inhibición de la COX (Vane, 1997). La COX, está compuesta por dos isoenzimas: la COX-1 y la COX-2, y su consecuente bloqueo por los AINEs, interfiere la producción de PGs y TXs, mediadores de la inflamación que originan dolor y fiebre (Mitchell, Akarasereenont, Thiemermann, Flower & Vane, 1993). Este enzima, tiene una porción que presenta una disposición tridimensional en el espacio complementaria a la del AINE que puede encajar con ella (Kiefer et al., 2000; Rady & Khan, 2005). La unión del AINE a la COX, le confiere un cambio estructural a la enzima que anula su acción en la cascada del ácido araquidónico, evitando la síntesis de PGs que actúan como mediadores de inflamación y favorecedores de la transmisión del estímulo nervioso. Las dos isoformas, se expresan en circunstancias fisiológicas, pero existen diversos procesos inflamatorios, donde la expresión de la COX-2, aumenta hasta 20 veces, mientras que la expresión de la COX-1 no se afecta o lo hace en menor grado entre 2 y 3 veces (Feria, 2004; Abramson & Weissmann, 1989). La COX-1, tiene característica de enzima constitutiva y su actividad, tiene que ver con la participación de las PGs y TXs en el control de funciones fisiológicas (Smith, Dewitt & Garavito, 2000; Pilbeam et al., 1993; Xie, Chipman, 48 INTRODUCCIÓN Robertson, Erikson & Simmons, 1991). En cambio, la COX-2, tiene características de enzima inducible en determinadas células bajo circunstancias patológicas (por ejemplo en macrófagos, monocitos, células endoteliales y sinoviales en el curso de un proceso inflamatorio), y está inducida fuertemente, por distintas citoquinas y factores de crecimiento (Simon, 2005; Williams, Mann & DuBois, 1999; Kudo,Murakami, Hara & Inoue, 1993; Jones, Carlton, McIntyre, Zimmerman & Precott, 1993). La COX-1, se encuentra preferentemente asociada al retículo endoplasmático, y se expresa constitutivamente en la práctica totalidad de los tejidos, especialmente, en plaquetas, células endoteliales, tracto gastrointestinal, microvasculatura renal, glomérulos y túbulos colectores; mientras que la COX-2, se asocia en mayor medida a la envoltura nuclear (Rady & Khan, 2005). La COX-2, es la mayor enzima que regula la síntesis de PGs como respuesta a distintos factores de resorción ósea; tales como el FGF-β, la IL-1 y la PGE2 (Onoe et al., 1996; Harrison, Lorenzo, Kawaguchi, Raisz & Pilbeam, 1994). La importancia terapéutica que representaría disponer de un inhibidor selectivo de la COX-2, reside en el hecho de poder utilizarlo en el tratamiento de procesos inflamatorios, sin ocasionar ninguna de las reacciones adversas gastrointestinales, renales o de la coagulación, que caracterizan a los AINEs clásicos (Simon, 2005). 4.2. Acciones farmacológicas con interés terapéutico: 4.2.1. Acción analgésica: La acción analgésica de los AINEs, tiene lugar a nivel periférico mediante la inhibición de la síntesis de PGs producidas en respuesta a una agresión o lesión tisular, impidiendo que los eicosanoides contribuyan, con su acción 49 INTRODUCCIÓN sensibilizadora, sobre las terminaciones nerviosas nocioceptivas al aumentar la acción estimulante del dolor de otros mediadores allí liberados histamina o bradicina. A pesar de ello, no debe descartarse un lugar de acción central (McCormack & Brune, 1991; Brune et al., 1991; Bannwarth, Demotes-Mainard, Schaeverbeke & Dehais, 1993). Su actividad antiálgica, es de intensidad moderada o media, son útiles en dolores articulares, musculares, dentarios y cefaleas de etiología diversa (Feria, 2004). Incluso, la propia actividad antiinflamatoria, contribuye a disminuir la cascada de producción, liberación y acceso de sustancias que pueden sensibilizar o activar directamente las terminaciones sensitivas. A medida que los AINEs controlen este proceso junto a la infiltración celular, se manifestará en mayor grado su acción analgésica, a pesar de que en determinadas patologías no se consiga (Feria, 2004). 4.2.2. Acción antitérmica: La fiebre, es una respuesta autónoma, neuroendocrina y conductual compleja y coordinada que se desencadena ante la existencia de una infección, lesión tisular, inflamación o rechazo de tejidos, y sirve, para alertar sobre una situación anómala y potencialmente lesiva, desencadenándose una serie de mecanismos fisiológicos para la defensa del organismo. 4.2.3. Acción antiinflamatoria: La capacidad de los AINEs para reducir la inflamación es variable según el tipo de proceso inflamatorio, la participación relativa de algunos eicosanoides en él, y la posibilidad de que actúen a través de mecanismos de acción independientes de la inhibición de las COXs. 50 INTRODUCCIÓN Además, los AINEs pueden interferir en diversas funciones de los neutrófilos como en la adhesividad, la agregación, la quimiotaxis, la fagocitosis, la desgranulación y la generación de radicales libres. Por lo tanto, el espectro y la eficacia de la acción antiinflamatoria dependerán, tanto del grado de participación de las PGs en la inflamación, como de la capacidad de estas sustancias de interferir con los mecanismos de la inflamación no dependientes de esta inhibición enzimática (Feria, 2004). 4.2.4. Acción antiagregante plaquetaria: Esta acción, es consecuencia de su efecto inhibidor sobre la COX-1. Las plaquetas, son incapaces de sintetizar nuevas proteínas y una vez acetilada su COX, resulta inhibida durante toda la vida de la plaqueta. Como consecuencia, se produce un marcado descenso de los niveles de TXA2 plaquetario, responsable de parte de los mecanismos que provocan la agregación plaquetaria (Schafer, 1995). Por ello, los AINEs, se utilizan en la prevención a largo plazo de accidentes tromboembolíticos coronarios y cerebrales, aunque puede devenir como reacción adversa facilitando la aparición de hemorragias. 4.2.5. Acción uricosúrica: Esta acción, es consecuencia de la inhibición del transporte del ácido úrico desde la luz del túbulo renal hasta el espacio intersticial. Es un proceso de competencia en el transporte de ácidos orgánicos que sólo es apreciable con algunos AINEs, como por ejemplo, dosis elevadas de salicilato, fenilbutazona o sulfinpirazona. Ésto, no limita la utilidad de otros AINEs en el tratamiento del ataque agudo de gota, en el cual, a dosis altas, son útiles en virtud de su acción analgésica y antiinflamatoria (Feria, 2004). 51 INTRODUCCIÓN 4.2.5. Acción anticancerígena: Recientes investigaciones, han demostrado la actividad antitumoral de ciertos AINEs, como el Meloxicam, sobre células cancerígenas de colon (Goldman et al., 1998), de pulmón (Tsubouchi et al., 2000) y de hueso (Naruse, Nishida, Hosono & Ishiguro, 2006). Del mismo modo ocurre con el Celecoxib, que inhibe la proliferación celular en células de osteosarcoma humano (Wang et al., 2004), incluso se ha demostrado que ciertos AINEs, inducen la apoptosis celular en líneas de células tumorales y disminuyen la capacidad de producir metástasis (Qiao, Shiff & Rigas, 1998; Naruse, Nishida, Hosono & Ishiguro, 2006). 4.3. Reacciones adversas: 4.3.1. Localización gastrointestinal: La acción lesiva de los AINEs sobre el aparato digestivo se produce, en parte, como consecuencia de sus efectos tóxicos directos, pero los más importantes, derivan de sus efectos sistémicos que incluyen los deletéreos de la inhibición de la síntesis de PGs endógenas y otros citotóxicos mediados por neutrófilos y citocinas (Kelly et al., 1996). Los AINEs, pueden alterar la hidrofobicidad de la mucosa gástrica, pueden favorecer la retrodifusión de iones de hidrógeno y contribuir al desarrollo de daño tisular (Lichtenberger, 1995). El efecto regulador del flujo sanguíneo y la protección gástrica, parece ser mediado preferentemente a través de la COX-1, aunque es posible que la COX-2 también se halle implicada (Hirata, Ukawa, Yamakuni, Kato & Takeuchi, 1997). La inhibición de la COX-1 por parte de los AINEs reduce la formación de PGs, las 52 INTRODUCCIÓN cuales, son fundamentales para el mantenimiento de la integridad de la mucosa gástrica (Warner et al., 1999). Así, existe una correlación entre el grado de inhibición de la COX y la aparición de lesiones en la mucosa gástrica (Whittle, Higgs, Eakins, Moncada & Vane, 1980). Datos recientes sugieren que éstas, aparecen sólo cuando se inhiben simultáneamente la COX-1 y la COX-2 (Wallace, McKnightW, Reuter & Vergnolle, 2000); lo cual, concuerda con resultados obtenidos en modelos animales, de supresión genética de la actividad de uno de los dos genes (Langenbach et al., 1995; Morham, Lagenbach, Loftin, Tiano, Vouloumanos & Jenette, 1995). Además, la administración exógena de PGs, protege la mucosa gástrica frente a estas lesiones (Henegan, Schmidt & Miller, 1989; Graham et al., 1993). Un espectro de la toxicidad intrínseca de los AINEs a nivel gástrico, es el siguiente (Hawkins & Hanks, 2000; Mandell, 1999): Bajo riesgo Ibuprofeno Diclofenaco Naproxeno Ketoprofeno Indometacina Piroxicam Alto riesgo 4.3.2 Localización renal: Algunos AINEs se asocian con una nefrotoxicidad por la inhibición renal de las PGs dado que la acción del riñón es directa en el mantenimiento de la hemodinámica renal y el balance de fluido y de sodio ( Martindale, 2000). 53 INTRODUCCIÓN Los inhibidores selectivos de la COX-2, disminuyen de forma transitoria el porcentaje de filtrado glomerular y promueven la retención de sodio y potasio, sobre todo, en pacientes con disminución de sal y de agua. Interfieren menos sobre los mecanismos de regulación que los AINEs convencionales, y su administración en pacientes mayores de 80 años, parece aportar un beneficio terapéutico con un adecuado perfil de tolerabilidad (Schnitzer, Tritt & Fleischmann, 1999). 4.3.3. Fenómenos de hipersensibilidad: Reacciones de hipersensibilidad con manifestaciones clínicas como, rinitis alérgica, edema angioneurótico, erupciones maculopapulares, urticaria generalizada, asma bronquial, hipotensión o shock anafiláctico, aparecen en un 1 o 2% de los pacientes bajo tratamiento con AINEs, y posiblemente, estén relacionadas con la inhibición de la síntesis de PGs en conexión con una sensibilidad individual especial. Menos frecuentes, pero más graves, son el eritema multiforme, que puede llegar a alcanzar la gravedad del síndrome de Stevens-Johnson, la púrpura, la fotodermatitis, preferentemente asociada a derivados del ácido propiónico, y la necrólisis epidérmica tóxica (síndrome de Lyell), excepcional pero muy grave, y asociada a la administración de diversos AINEs (piroxicam, diflunisal, diclofenaco, paracetamol) ( Martindale, 2000; Boyce, 2000; Huang, 2000). 4.3.4. Reacciones hematológicas: La frecuencia de aparición de reacciones adversas hematológicas durante el tratamiento con AINEs es, en su conjunto, baja, aunque el amplio uso de estos fármacos y la gravedad de algunas de ellas, nos obliga a tenerlas en cuenta. La mayoría de las reacciones hematológicas, se deben a fenómenos en los que 54 INTRODUCCIÓN intervienen mecanismos inmunitarios como la agranulocitosis, la anemia aplásica, la trombocitopenia y la anemia hemolítica (Feria, 2004). La aspirina inhibe irreversiblemente la agregación plaquetaria, inhibición que va de 5 a 7 días, por lo que se aconseja evitar el consumo de aspirina en personas con daño hepático intenso, hipoprotrombinemia, déficit de vitamina K o hemofilia (Hardman, Limbird, Molinoff, Ruddon y Goodman Gilman, 1996; Martindale, 2000; Boyce, 2000). 4.4. Clasificación: Según el grupo farmacológico al que pertencen nos encontramos con diferentes tipos de AINEs (Tabla 1). Tabla 1. Clasificación de los antiinflamatorios no esteroideos (Feria, 2004) Grupo farmacológico Fármaco Salicilatos Ácido Acetil salicílico Paraaminofenoles Paracetamol Derivados pirazólicos Metamizol Derivados ácido propiónico Ibuprofeno Derivados ácido acético Indometacina/Diclofenaco Oxicams Meloxicam Derivados ácido antranílico Fenamatos Otros Nimesulida 4.4.1. SALICILATOS: Los salicilatos utilizados en terapéutica son productos de síntesis que comparten como núcleo fundamental el ácido salicílico (Figura 1), el cual, resulta ser muy irritante y por ello solo se puede utilizar de forma externa (Goddman, Rall, Nies y Taylor, 1996). 55 INTRODUCCIÓN Entre los más utilizados en clínica destacan: 1. El ácido acetil salicílico (AAS): es un éster de ácido acético del que se han obtenido algunos derivados. 2. Derivados del ácido salicílico: salicilato sódico; trisalicilato de colina y magnesio; salsalato o diplosal (ácido salicilsalicílico); diflunisal; sulfasalazina; fosfosal y salicilamida. 3. Existen además ciertas formulaciones galénicas que tratan de cubrir diversos objetivos: • Formulaciones tamponadas-efervescentes: diseñadas para aumentar la solubilidad y la velocidad de absorción, reduciendo la irritación gástrica. • Formulaciones de liberación controlada: diseñadas para reducir la irritación gástrica, prolongar el tiempo de absorción y la duración del efecto. Los salicilatos, son biotransformados en muchos tejidos, aunque dicho proceso ocurre sobre todo en el retículo endoplasmático y en las mitocondrias del hígado (Insel, 1996). Se ha demostrado que a concentraciones elevadas, afectan intensamente el metabolismo intermediario y estimulan directamente el centro respiratorio, favoreciendo la aparición de una alcalosis respiratoria, y a dosis tóxicas, desacoplan la fosforilación oxidativa, disminuyen la producción de ATP, interfieren el metabolismo aerobio de la glucosa, inhiben las deshidrogenasas y la 6-fosfofructocinasa de la glucólisis, y la vía de las pentosas (Brenner & Simon, 1982). Fig.1. Ácido acetil salicílico. 56 INTRODUCCIÓN El AAS, se metaboliza rápidamente a ácido salicílico, que inhibe débilmente, in vitro, la producción de PGs. In vivo, el salicilato sódico, posee menor eficacia analgésica, pero similar eficacia antiinflamatoria que el AAS, al inhibir la transcripción de la COX-2 (Allen, 1995). El AAS, muestra una marcada actividad antiagregante plaquetaria a dosis inferiores a las analgésicas y, a concentraciones elevadas, interfiere en la síntesis de protrombina (Touraine, Moldovan, Touraine, Chenot & Bonnaud, 2005; Feria, 2004). 4.4.2. PARAAMINOFENOLES: Son derivados de la anilina, entre los que se encuentran el paracetamol o acetaminofeno (el más utilizado) (Figura 2), propacetamol, y la fenazopiridina. El propacetamol, es un profármaco hidrosoluble del paracetamol que permite administrarlo por vía intravenosa y la fenazopiridina, que también pertenece a este grupo, se utiliza en el tratamiento sintomático de las disurias. Fig.2. Paracetamol. A pesar de que el paracetamol posea una leve actividad antiinflamatoria, se ha demostrado una reducción en tejidos inflamados tras cirugía dental (Graham, Robins, Bryant & Skott, 2001; Skjelbred & Lokken, 1979). Tiene una eficacia antipirética y analgésica comparable a la del AAS (Mehlisch & Frakes, 1984). Su 57 INTRODUCCIÓN mecanismo de acción es aún objeto de debate (Graham & Scott, 2005; Feria M., 2004), ya que, puede estimular la síntesis de PGs a nivel de la mucosa gástrica (Danon, Leibson & Assouline, 1983), no modificarla en pulmón y plaquetas, (Boutaud, Aronoff, Richardson, Marnett & Oates, 2002; Tolman et al., 1983) o inhibirla moderadamente, como por ejemplo, a nivel del sistema nervioso central (Wierkosz, Mitchell & Botting, 1997; Muth-Selbach, Tegeder, Brune & Geisslinger, 1999; Feldberg, 1973). Por otro lado, el paracetamol, puede producir analgesia por diversos mecanismos centrales, que parecen implicar a los aminoácidos excitatorios, el óxido nítrico o la serotonina (Pini, Sandrini & Vitale, 1996). Posee una alta tolerabilidad y está especialmente recomendado para personas con intolerancia a la aspirina o con alto riesgo de complicaciones gastrointestinales (Prescott, 2000; Mehlisch & Frakes, 1984), sin embargo, carece de propiedades anticoagulantes. En un modelo inflamatorio en ratas donde se indujo la inflamación con carragenina, tras 48 horas, cuando se estaba dando la resolución de la inflamación, se expresó una COX que no produjo prostanoides proinflamatorios como por ejemplo la PGE2, sino miembros prostanoides antiinflamatorios. Al tratar a los animales de nuevo con los AINEs e inhibidores de la COX-2, la respuesta inflamatoria no se resolvió ni cedió (Willoughby, Moore & Colville-Nash, 2000). Tras este hallazgo, algunos autores proponen la existencia de otra isoforma, que sea inhibida selectivamente por el acetaminofen, en lugar de inhibir la COX-1 y/o COX-2 (Botting, 2000; Botting, 2006). En evidencia de la poca sensibilidad del acetaminofen a ambas isoformas de la COX, se postula la existencia de otra isoforma llamada provisionalmente COX-3, que se encuentra libre en el citosol, en vez de estar unida a la membrana celular (Willoughby, Moore & Colville-Nash, 2000; Simmons, Wagner & Westover, 2000). Esta enzima, es selectivamente inhibida por drogas, como el acetaminofeno, fenacetina, antipirina y dipirona, lo cual, podría representar un mecanismo central primario por el que estas drogas alivian el dolor y la fiebre (Chandrasekharan et al., 2002). 58 INTRODUCCIÓN 4.4.3. DERIVADOS PIRAZÓLICOS: Incluimos dentro de este grupo al metamizol o dipirona (Figura 3), la propifenazona (productos derivados de algunos otros que sólo tienen interés histórico, como la antipirina y la aminopirina) y la fenilbutazona. Con fines preferentemente analgésicos y antipiréticos, se emplea el metamizol y la propifenazona; y con fines antiinflamatorios y analgésicos, la fenilbutazona (Feria, 2004). Fig.3. Metamizol. La acción analgésica del metamizol, es dosis dependiente, comparable a la de dosis bajas de opiáceos. En su acción analgésica, existe un componente de acción central, quizás más importante que el periférico sobre la COX. El metamizol, es un analgésico comparable al AAS y superior al paracetamol, a igualdad de base y vía de administración, en dolores agudos de tipo moderado/medio. También se utiliza en el tratamiento de la fiebre elevada que no responda a otros antipiréticos (Feria, 2004). 4.4.4. DERIVADOS DEL ÁCIDO PROPIÓNICO: Son derivados del ácido fenilpropiónico y forman un grupo bastante homogéneo farmacológicamente. El primero de la serie fue el ibuprofeno (Figura 4), al que siguieron el naproxeno (Figura 5), fenoprofeno, ketoprofeno (Figura 6), flurbiprofeno, ácido tiaprofénico y oxaprocina. Son antiinflamatorios de eficacia 59 INTRODUCCIÓN moderada, aunque también se observa un uso creciente con fines preferentemente analgésicos (por ejemplo, dismenorreas, cefaleas vasculares, y dolor postparto o postquirúrgico). Se unen intensamente a la albúmina, aumentando la fracción libre en determinadas situaciones (por ejemplo, cirrosis hepática, artritis reumatoide y ancianos). Alcanzan concentraciones sinoviales entre el 50%-70% de las plasmáticas, aunque más estables que éstas, en administración crónica (Harris, Beebe-Donk, Doss & Burr Doss, 2005). Aunque sus reacciones adversas son cualitativamente semejantes a las de otros AINEs, hay que destacar que en conjunto, su uso se asocia a una menor incidencia de problemas gastrointestinales que el AAS, fenilbutazona o indometacina; no presentan los problemas hematológicos de las pirazolonas y producen menos molestias neurológicas que la indometacina. Por estos motivos, se prefieren en muchas situaciones clínicas de intensidad leve o moderada, ya que su eficacia clínica no alcanza la de los AINEs más potentes. Pueden aumentar el tiempo de hemorragia debido a su acción antiagregante (Feria, 2004). Fig.4. Ibuprofeno. El ibuprofeno, inihibidor de la COX-1 y COX-2 (Capone et al., 2007), cuando se utiliza como analgésico o antipirético, es bastante bien tolerado; sin embargo, con dosis más elevadas como antirreumático, puede producir el mismo abanico de reacciones adversas que otros AINEs (Hao, Wang & Sun, 2005). 60 INTRODUCCIÓN Fig.5. Naproxeno. El naproxeno, tiene una vida media de 12 a 14 horas. El pico de los niveles en el plasma, aparece tras 2-4 horas de administrarse (Honing, 1994). Parece ser efectivo en cirugía traumática y en dolores agudos como el de la migraña, dolor de cabeza tensional, dismenorrea o tras una cirugía, parto, o procedimientos ginecológicos (Todd & Clissold, 1990), e incluso, inhibe la función leucocitaria (Goddman, Rall, Nies y Taylor, 1996). Sus reacciones adversas más frecuentes, son las de localización gastrointestinal y las de origen neurológico, parecidas a las de la indometazina, aunque menos intensas (Capone et al., 2005; Boutaud, Aronoff, Richardson, Marnett & Oates, 2002). Fig.6. Ketoprofeno. El ketoprofeno, es una mezcla racémica formada a partes iguales por dos enantiómeros, R(-) y S(+). Está demostrado que de ellos, solo el enantiómero S(+) o dexketoprofeno, presenta actividad terapéutica al bloquear la acción de las dos COXs, la COX-1 y la COX-2 (Carabaza et al., 1996), mientras que el R(-), Ketoprofeno, es terapéuticamente inactivo y se puede considerar como una impureza (Mauleon, Artigas, Garcia & Carganico, 1996; Mazieres, 2005). 61 INTRODUCCIÓN El dexketoprofeno (Figura 7), es el ácido S (+)-2-(3-benzoilfenil) propiónico o enantiómero S(+) del ketoprofeno (Jamli & Brooks, 1990). Su acción analgésica y antiinflamatoria se debe, principalmente, a la inhibición de la COX-1 y COX-2 a nivel periférico y la acción analgésica, a nivel central, por la inhibición de la COX-1 (Mazario, Roza & Herrero, 2000). Fig.7. S(+)Ketoprofeno. Presenta un efecto analgésico y antiinflamatorio potente y dosis dependiente, que equivale al de una dosis doble del ketoprofeno racémico. Su efecto analgésico, se inicia a dosis más bajas que el efecto antiinflamatorio (Cabre et al., 1998). Su actividad analgésica, se debe a un doble efecto a nivel periférico y central, siendo más potente que otros AINEs como el diclofenaco, la indometacina, el flurbiprofeno o el rofecoxib (Mazario, Solano & Herrero, 1999). 4.4.5. DERIVADOS DEL ÁCIDO ACÉTICO: Son fármacos que comparten diversos anillos (indólicos, pirrólicos, fenilos o piranoindólicos) conteniendo ácido acético. Existen diversas series de derivados: a. Indolacético: indometacina (Figura 8), acemetacina, glucametacina, oxametacina y proglumetacina. b. Pirrolacético: sulindaco, ketorolaco (Figura 9) y tolmetina. 62 INTRODUCCIÓN c. Fenilacético: diclofenaco (Figura 10), aceclofenaco y fentiazaco. d. Piranoindolacético: etodolaco. Fig.8. Indometacina. La indometacina, es un inhibidor de la COX-1 y COX-2 (Pilbeam, Fall, Alander & Raisz, 1997a). Aunque su eficacia en el tratamiento de la artritis reumatoide y procesos inflamatorios relacionados, es muy notable, la alta incidencia de efectos secundarios intolerables, a veces irreversibles y potencialmente fatales, han limitado su uso. Sus acciones farmacológicas, son similares a las del AAS, presentando una poderosa actividad antiinflamatoria, antipirética y analgésica. No es uricosúrica, aunque es muy eficaz como antiinflamatorio en el tratamiento agudo de la gota. Fig.9. Ketorolaco. El ketorolaco, tiene muy buena eficacia y potencia analgésica. Posee también efecto antipirético, aunque no se utiliza con tal fin, moderada eficacia antiinflamatoria e inhibe la agregación plaquetaria. 63 INTRODUCCIÓN Comparte reacciones adversas con el resto de los AINEs, aumentando el riesgo, especialmente, de las de localización gastrointestinal, tanto con la duración del tratamiento, como con la dosis diaria total. Con frecuencia, pueden presentar dolor abdominal, diarrea, somnolencia, cefaleas, mareo o náuseas. Menos comunes son el edema, dolor en el sitio de inyección, estreñimiento o aumento de la sudación (Reinhart, 2000; Pallapies et al., 1995). Fig.10. Diclofenaco. El diclofenaco, inhibidor preferencial de la COX-2 (Pilbeam, Fall, Alander & Raisz, 1997a), de amplio uso en nuestro país, posee actividad analgésica, antipirética y antiinflamatoria potente y eficacia comparable a la de los derivados del ácido propiónico. A dosis habituales, presenta menor riesgo de interferir con la agregación plaquetaria que la mayoría de los AINEs, y es uricosúrico. Como el resto de los AINEs, inhibe la síntesis de PGs pero, además, disminuye la concentración de ácido araquidónico en leucocitos. Alcanza concentraciones en líquido sinovial menores, pero más estables que las plasmáticas, lo cual explica, que la duración de sus efectos sea más prolongada que lo que se deduciría de su semivida (1-2 h). Las reacciones adversas son, en conjunto, similares a las de los derivados del ácido propiónico. Destaca, sin embargo, que un 15% de los pacientes presente un aumento temporal de las transaminasas hepáticas, normalmente reversible. Se han detectado algunos casos de anemia aplásica (Kaspar et al., 2005; Sell et al., 64 INTRODUCCIÓN 1999). 4.4.6. OXICAMS: Los oxicams, son ácidos enólicos introducidos en terapéutica como AINEs de vida media larga, que permitían una sola toma diaria, algo especialmente importante en el tratamiento de procesos inflamatorios y dolorosos crónicos. Los más utilizados son el piroxicam (Figura 11), tenoxicam y meloxicam. Todos ellos muestran actividad antiinflamatoria, analgésica, antipirética y antiagregante plaquetaria. Están indicados para el tratamiento sintomático, agudo o crónico, de la artritis reumatoide y osteoartritis (Salvi & Lang, 2005). Fig.11. Piroxicam. El piroxicam, además de inhibir las dos COXs, inhibe la quimiotaxis, liberación de enzimas lisosómicos y agregación de los neutrófilos (y su capacidad generadora de aniones superóxido) e inhibe la proteoglicanasa y colagenasa en el cartílago, mecanismos que deben contribuir a su eficacia como antiartrítico. La incidencia de reacciones adversas del piroxicam en uso crónico, puede alcanzar hasta el 60% de los pacientes. Las más frecuentes son las de localización gastrointestinal (hasta un 25%). Con frecuencia baja, puede producir alteraciones neurológicas (por ejemplo, sedación, somnolencia, mareo, cefaleas). El riesgo es mayor que con la mayoría de los AINEs, en pacientes con alteraciones de la función renal. Debido a su elevada fijación proteica, debería utilizarse con precaución en pacientes tratados con anticoagulantes orales. 65 INTRODUCCIÓN Además, disminuye la excreción renal de litio con consecuencias clínicas importantes (Waddell, 1998). Fig.12. Meloxicam. La incidencia de reacciones adversas del meloxicam (Figura 12), es algo inferior a la del piroxicam. Como con éste, predominan las de localización gastrointestinal (17%-19%) aunque la incidencia de complicaciones gastrointestinales graves, es significativamente menor para el meloxicam (0,1%0,2%). Su perfil de seguridad sobre la función renal o hepática, es similar al de otros AINEs y sus efectos sobre la agregación plaquetaria no son significativos. Se ha utilizado en el tratamiento de la espondilitis anquilosante, ataques agudos de gota o pseudogota, trastornos musculoesqueléticos agudos y dismenorreas. Se distingue por inhibir preferentemente a la COX-2 (Capone et al., 2007), lo cual, en principio, le confiere una ventaja sobre los otros AINEs (Fleischmann, Iqbal & Slobodin, 2002; Engelhart, 1996). 4.4.7. DERIVADOS DEL ÁCIDO ANTRANÍLICO: También denominados fenamatos, incluye los ácidos mefenámico, meclofenámico (Figura 13), flufenámico y la floctafenina y glafenina. Sus propiedades farmacológicas, son similares a las de otros grupos, aunque, con el mefenámico y meclofenámico, los efectos sobre la agregación plaquetaria son menos importantes que con la mayoría del resto de los AINEs (Chu, Chen, Lin & Sun, 2003). 66 INTRODUCCIÓN Fig.13. Acido Meclofenámico. El mefenámico, se utiliza para dolores de corta duración con escaso componente inflamatorio y posee eficacia para el dolor de la dismenorrea. Sin embargo, el meclofenámico, se utiliza para la artritis reumatoide, osteoartritis, artritis psoriásica, dolor, dismenorrea e hipermenorrea idiopática (Izzo, Pagnoni & Rigoli, 1991). Las reacciones adversas más frecuentes, afectan al aparato digestivo superior, aunque también son frecuentes la diarrea profusa, acompañada de esteatorrea e inflamación intestinal, y los vómitos, que pueden inducir una deshidratación e insuficiencia renal. Somnolencia, cefaleas y mareo, pueden aparecer con cierta frecuencia (Conroy, Randinitis & Turner, 1991). 4.4.8. OTROS FÁRMACOS: La nimesulida (Figura 14), inhibidor preferencial de la COX-2; es una sulfoanilida, con actividad analgésica (similar al ibuprofeno y superior a la indometacina), antiinflamatoria (similar a la de la indometacina, diclofenaco, piroxicam o ibuprofeno) y antipirética (superior a la de la indometacina, aspirina, ibuprofeno o paracetamol) (Capone et al., 2007). 67 INTRODUCCIÓN Fig.14. Nimesulida. Se absorbe de forma rápida y casi completa por vía oral (por vía rectal su biodisponibilidad cae a un 70%). Su espectro de efectos secundarios, no se diferencia de otros AINEs. Es especialmente útil en pacientes hipersensibles a la aspirina o a otros AINEs y en pacientes asmáticos (Senna et al., 1996). 68 INTRODUCCIÓN 5. OSTEOBLASTOS Y AINES. Durante los últimos 50 años la investigación sobre fármacos que tuvieran efectos antipiréticos, antiinflamatorios y analgésicos ha sido extraordinariamente extensa, dando lugar al desarrollo de los llamados fármacos antiinflamatorios no esteroideos, que se han convertido en la piedra angular del tratamiento de numerosas enfermedades. El uso clínico de los AINES es muy común tanto en la terapia de distintas patologías óseas, como tras las intervenciones quirúrgicas que afectan a este tejido. Conocer todos los posibles efectos que estos fármacos ejercen sobre el hueso constituye un tema de interés que viene siendo objeto de estudio de distintos grupos de investigación. Entre los reguladores del metabolismo esquelético, como ya indicamos anteriormente, se encuentran las PGs, las cuales, modulan la proliferación y la diferenciación osteoblástica (Ho, Chang, Chuang, Hsu & Wang, 1999; Nemoto, Bernecker, Pilbeam & Raisz, 1995), acción que es ejercida por la interacción de los receptores específicos expresados en la superficie celular del osteoblasto. Estas células, no solo se muestran como células diana para dichos reguladores, sino que incluso son capaces de sintetizarlos, lo que explica, que la síntesis de PGs sea un proceso autorregulable (Kawaguchi, Pilbeam, Harrison & Raisz, 1995; Pilbeam, Raisz, Voznesenasky, Alander, Delman & Kawaguchi, 1995; Raisz, Pilbeam & Fall, 1993b). La síntesis de PGs se realiza gracias a la acción catalítica de la enzima prostaglandina sintetasa (PGHS), más conocida como COX, al actuar sobre el ácido araquidónico. Existen dos isoenzimas para dicho enzima, codificadas por genes diferentes, la COX-1 y la COX-2 (Smith, Dewitt & Garavito, 2000; Pilbeam, Raisz, Voznesenasky, Alander, Delman & Kawaguchi, 1995; Tjandrawinata, Dahiya & Hughes-Fulford, 1997). 69 INTRODUCCIÓN En osteoblastos, la COX-1 es una enzima constitutiva; mientras que la COX-2, es un enzima inducible, la cual, se encuentra en muy bajas concentraciones e incluso en concentraciones indetectable en osteoblastos no estimulados. Sin embargo, esta isoenzima puede ser rápidamente inducida en procesos inflamatorios y cancerígenos (Williams, Mann & DuBois, 1999). La producción de PGs regulada por fuerzas mecánicas, hormonas, citocinas y factores de crecimiento, parece estar controlado por los efectos de la enzima inducible COX-2 (Pilbeam et al., 1993; Kawaguchi et al., 1994). Distintos datos revelan que la COX-1, parece desempeñar un papel importante en la respuesta inicial a las alteraciones producidas en la liberación del ácido araquidónico. Sin embargo, la COX-2, se puede considerar como el mayor regulador de la renovación ósea como respuesta a citocinas, hormonas, fuerzas mecánicas, factores de crecimiento y promotores tumorales (Pilbeam et al., 1997b; Herschman, 1994). Cabe señalar que las PGs exógenas no sintetizadas por el propio osteoblasto, tienen un efecto doble sobre la proliferación osteoblástica, por lo que, pueden ser estimuladoras o inhibidoras según su concentración (Eujimori, Tsutsumi, Fukase & Fujita, 1989; Kawaguchi, Pilbeam, Harrison & Raisz, 1995; Mori, Jee , Li , Chan & Kimmel, 1990). Los AINEs, constituyen uno de los grupos de medicamentos más prescritos, con múltiples usos terapéuticos, tanto en el tratamiento de dolencias músculoesqueléticas, como en otra amplia gama de indicaciones, debido a sus efectos analgésico, antipirético y antiagregante plaquetario. Los fármacos de esta categoría incluyen muchos compuestos que en general no tienen relación química entre ellos, pero comparten algunas actividades terapéuticas y efectos secundarios ( Hardman, Limbird, Molinoff, Ruddon y Goodman Gilman, 1996). 70 INTRODUCCIÓN Administrados en dosis únicas o como terapia a corto plazo proveen adecuada analgesia en la reducción del dolor leve a moderado. El efecto antiinflamatorio se refleja de varios días hasta dos semanas, sin embargo, la combinación de ambos efectos hacen a estos fármacos particularmente útiles en el alivio sintomático del dolor y/o inflamación, de desórdenes musculoesqueléticos y de las articulaciones (Martindale, 2000). Su mecanismo de acción es inhibiendo la actividad de las enzimas COX-1 y COX-2, aunque pocos, son completamente específicos por una de ellas. Así por ejemplo, la aspirina e indometacina, bloquean la actividad de las dos isoenzimas, aunque su efecto es mayor sobre la COX-1 (Yuan, Mandal, Zhang & Mukherjee, 2000; Vane & Botting, 1998), la nimesulida y el meloxicam parecen tener predilección por la COX-2 (Hawkey, 1999) y el rocecoxib y el celecoxib, actúan de forma selectiva sobre la COX-2 ( Lacy, Armstrong, Goldman & Lace, 2000). Dado que los AINEs actúan bloqueando la síntesis de PGs por la vía de la ciclooxigenasa, y las PGs tiene un papel regulador importante a nivel óseo, es por lo que, algunos autores sugieren que éste, es el mecanismo de acción de los AINES para provocar la inhibición de la reparación ósea (Norrdin, Jee & High, 1990). En este sentido, se sabe que estos fármacos inhiben la síntesis de PGs en cultivos de células osteoblásticas (Klaushofer et al., 1988), como es el caso del Ketorolaco, potente AINE que bloquea la síntesis de PGs por la vía de la ciclooxigenasa, provocando una inhibición de la reparación y el remodelamiento óseo en ratones (Buckley & Brogden, 1990; Ho, Chang & Wang, 1995) y disminuye la proliferación celular, como lo demuestran diversos estudios histológicos (Ho, Chang & Wang, 1998; Ho, Chang Chuang, Hsu & Wang, 1999), acción también observada con el diclofenaco (Kaspar et al., 2005; Sell et al., 1999; Matziolis, Rau, Cléber, Erli & Paar, 2002). 71 INTRODUCCIÓN Paralelamente, se ha descrito en cultivos celulares de osteosarcoma humano tratados con indometacina, que ésta, provoca una inhibición significativa sobre la proliferación de forma dosis dependiente tras 48h de tratamiento (Evans & Butcher, 2004); resultados que vienen a corroborar los ya obtenidos por otros autores en cultivos primarios de osteoblastos (Min, Rao, Okada, Raisz & Pilbeam, 1998). Aunque los AINES son de gran utilidad clínica, su uso se ve limitado por la posible aparición de efectos adversos, algunos incluso potencialmente letales, como pueden ser la enfermedad ulcerosa péptica o la insuficiencia renal. Estos efectos secundarios afectan incluso al tejido óseo, pudiendo inhibir la reparación y la cicatrización ósea (Langman et al., 1994; Muscara, McKnight, Asfaha & Wallace, 2000; Altman et al., 1995; DiCesare, Nimni, Peng, Yazdi & Cheung, 1991; Keller et al., 1989a; Trancik, Mills & Vinson, 1989). En este sentido, algunos autores, muestran en sus estudios, que los pacientes que toman determinados AINEs, tienen mayor riesgo de sufrir una fractura, que los que no los toman (Van Staa, Leufkens & Cooper, 2000; Vestergaard, Rejnmark & Mosekilde, 2006). También se ha observado, que estos fármacos disminuyen el crecimiento óseo en implantes ortopédicos (Keller et al., 1989b) y retrasan la formación del callo óseo en pacientes con fracturas (Giannoudis et al., 2000; Butcher & Marsh, 1996). Con objeto de disminuir los efectos adversos de los AINEs, se han desarrollado nuevos fármacos que bloqueen específicamente a la COX-2 (DeWitt, 1999; Watson, 1998). Gracias a ellos, se pueden mejorar y precisar los tratamientos (Mantry, Shah & Sundaram, 2003; Spiegel, Targownik , Dulai & Gralnek, 2003; Igarashi, Woo & Stern, 2002). No obstante, algunos de sus efectos no deseados se mantienen, como la acción que ejercen a nivel óseo, donde a pesar de inhibir selectivamente la COX2, siguen disminuyendo la proliferación en osteoblastos humanos, como el DFU 72 INTRODUCCIÓN tras 48 horas de cultivo (Evans & Butcher, 2004), o el rocecoxib, tras su administración oral en ratones durante 4 semanas (Goodman et al., 2002) . Otro aspecto, no menos importante, es como los AINEs pueden interferir en la proliferación de las células tumorales. Muchos estudios, evidencian el papel crucial de la COX-2 en diferentes aspectos de la carcinogénesis y en la prevención y el tratamiento de las alteraciones inflamatorias. Esta enzima, está sobreexpresada en diferentes tumores malignos como en el tumor de colón (Eberhart, Coffey, Radhika & Giardiello, 1994), de próstata (Gupta, Srivastava, Ahmad, Bostwick & Mukhtar, 2000), de mama (Hwang, Scollard, Byrne & Levine, 1998), de pulmón (Watkins, Lenzo, Segal, Garlepp & Thompson, 1999) y en el de hueso (Naruse, Nishida, Hosono & Ishiguro, 2006). Se ha observado que los inhibidores selectivos de la COX-2, disminuyen la formación, el crecimiento y las metástasis de tumores experimentales (Yao et al., 2003; Sheng et al., 1997), incluso, se ha encontrado conexión causa-efecto, entre la COX-2 y la formación de tumores, mediante estudios genéticos (Liu et al., 2001). En algunos estudios, se ha observado que hay una disminución del riesgo de padecer cáncer de colon, en aquellas personas que regularmente ingieren inhibidores de la COX-2 (Thun, Henley & Patrono, 2002; Fosslien, 2000). En este mismo sentido, se ha descrito que en ratones transgénicos que poseen una sobreexpresión de COX-2 en la glándula mamaria, desarrollaron hiperplasias, displasias y metástasis de esta glándula (Liu et al., 2001). Cabe señalar el efecto inhibitorio de la proliferación, observado con meloxicam sobre células cancerígenas de colon (Goldman et al., 1998) y de pulmón (Tsubouchi et al., 2000). A nivel del tejido óseo, los AINEs, parecen ejercer una acción similar a la descrita en otras poblaciones tumorales. En células de osteosarcoma humano, concretamemente la línea celular MG-63, se ha demostrado que el tratamiento con celecoxib a una concentración entre 1 y 100 µM, inhibe la proliferación de forma 73 INTRODUCCIÓN dosis dependiente y aumenta la concentración del calcio intracelular, al salir del retículo endoplasmático por la vía de la fosfolipasa C, de manera independiente (Wang et al., 2004), y el tratamiento con meloxicam, disminuye la proliferación celular y la capacidad invasiva del tumor (Naruse, Nishida, Hosono & Ishiguro, 2006). Todos estos datos, avalan el gran interés que tiene el estudio detallado del efecto de los AINEs sobre las células del tejido óseo, bien bajo circunstancias fisiológicas, o bien en situaciones de transformación neoplásica. 74 OBJETIVOS II. OBJETIVOS: Los antecedentes bibliográficos revelan claramente que los AINEs, pueden ejercer su acción sobre el tejido óseo, y más concretamente, sobre los osteoblastos, que son las células responsables de la formación y reparación ósea. Esta acción, se ha traducido fundamentalmente, en una disminución de la capacidad proliferativa. El mecanismo por el que se explica esta acción se centra, fundamentalmente, en la capacidad que dichos fármacos poseen para inhibir la actividad de la enzima ciclooxigenasa y más concretamente de la isoenzima COX2, lo que a su vez, conduce a una inhibición de la síntesis de PGs, las cuales desempeñan un papel importante a nivel de la regulación del tejido óseo. El análisis del efecto a diferentes niveles de distintos AINEs sobre las células responsables de la formación y reparación ósea, creemos que es un tema de gran interés científico, que nos podría dar información útil a nivel clínico; permitiendo incluso, establecer criterios de elección de dichos fármacos en el tratamiento del tejido óseo. Además, son muy pocos los AINEs que hasta la fecha se han estudiado y limitados los parámetros valorados, ya que, prácticamente, los diferentes estudios se han centrado exclusivamente en determinar su efecto sobre la capacidad proliferativa. Mientras que otros parámetros no estudiados, creemos igualmente, que podrían verse afectados o modulados por dichos fármacos, como la diferenciación o maduración celular y la capacidad inmunológica; lo que podría implicar otras posibles repercusiones clínicas que deberíamos conocer de estos medicamentos, cuando se utilizan en el tratamiento del tejido óseo; y que además, no hanenemos constancia de que hayan sido analizados por ningún otro grupo de investigación. Por todo ello, en la presente Tesis Doctoral nos hemos planteado como objetivos de la misma, estudiar el efecto de distintos AINEs (indometacina, nimesulida, diclofenaco, ibuprofeno y paracetamol) sobre diferentes parámetros fisiológicos y funcionales de los osteoblastos humanos; tales como, proliferación, 75 OBJETIVOS diferenciación celular, perfil antigénico y capacidad fagocítica. Para ello, utilizaremos como población de estudio una línea celular tipificada de osteosarcoma humano, la línea MG-63. Esta línea celular, es comúnmente utilizada en el estudio de los osteoblastos; pero hay características de la misma que se desconocen; tales como su perfil antigénico o su capacidad fagocítica, por lo que como objetivo previo al estudio del efecto de los AINEs sobre los osteoblastos, determinaremos las características fenotípicas y funcionales de la línea MG-63. 76 METODOLOGÍA III. METODOLOGÍA: 1.- LÍNEA DE OSTEOSARCOMA HUMANO, MG-63 (ATCC: CRL-1427) Los distintos ensayos se realizaron con la línea MG-63. Ésta, es una línea tipificada de osteoblastos, que se obtuvo a partir de tejido óseo humano procedente de un varón caucasiano de 14 años con osteosarcoma (ATCC: CRL1427); la cual, fue proporcionada por la American Type Culture Collection (ATCC), a través del Centro de Instrumentación Científica de nuestra Universidad. 2.- CULTIVO DE LA LÍNEA MG-63 Las células se cultivaron en frasco de cultivo de 25 cm2 de superficie (Falcon, Labware, Oxford, UK), con 10 ml de medio DMEM (Gibco, Cell Culture Products, Carlsbad, CA), suplementado con 100 UI/ml de penicilina (Lab Roger S.A., Barcelona, España); 50 µg/ml de gentamicina (Braun Medical S.A., Jaén, España); 2.5 µg/ml de anfotericina B (Sigma, St Louis, MO, USA); L-Glutamina al 1% (Sigma, St Louis, MO, USA); HEPES al 2% (Sigma, St Louis, MO, USA) y un 10% de suero bovino fetal (SBF) (Gibco, ,Paisley, UK), que previamente había sido descomplementado en un baño a 56ºC durante 30 minutos. Las células se cultivaron en este medio a 37ºC, en una atmósfera de CO2 al 5% hasta conseguir un crecimiento semiconfluente. La línea MG-63, crece adherida a la superficie del frasco de cultivo, por lo que, una vez cultivados los osteoblastos según el procedimiento descrito anteriormente, es necesario despegarlos de la superficie, ya sea para subcultivo o para su estudio o tratamiento. Para despegar las células del frasco de cultivo, se utilizan 10 ml de una solución de Tripsina-EDTA (Sigma, St Louis, MO, USA) durante 10 minutos a 37ºC. Transcurrido este tiempo, se neutraliza la actividad enzimática con otros 10 ml de medio DMEM suplementado al 10% con SBF. La suspensión celular obtenida se deposita en un frasco universal y se centrifuga a 77 METODOLOGÍA 1200 rpm durante 10 minutos en frio. El sedimento obtenido se resuspende en medio de cultivo. 3.- EXPRESIÓN ANTIGÉNICA DE LA LÍNEA MG-63 El perfil antigénico de la línea MG-63, se determinó mediante la técnica de citometría de flujo y el uso de una amplia batería de anticuerpos monoclonales, los cuales quedan recogidos en la tabla 2. La suspensión de células se obtiene tras tratar el cultivo con una solución de EDTA al 0.04%, neutralizar con DMEM suplementado al 10% y lavar por centrifugado con un tampón fosfato salino (PBS) durante 10 min a 1200 rpm. Esta suspensión celular se ajusta a una concentración de 2x104 cells/ml. 100 µl de la suspensión celular se incuban con 10 µl del Abmo correspondiente, durante 30 minutos a 4ºC en oscuridad. Transcurrido el periodo de incubación con el Abmo, las células se lavan por centrifugación con PBS y el sedimento se suspende en 1 ml de PBS para su lectura en un citómetro de flujo (FACS Vantage SE, Becton Dickinson, Paloalto, California, USA), con un laser de argón de 488 nm de longitud de onda para determinar el porcentaje de fluorescencia en las células. Como control negativo, las células se incubaron con controles de isotipo marcados con isocianato de fluoresceína (FITC) o ficoeritrina (PE). El porcentaje de células positivas frente a los anticuerpos, se calculó entre 2.000 y 3.000 células. Todos los ensayos se realizaron por cuadruplicado. 78 METODOLOGÍA Tabla 2. Anticuerpos monoclonales utilizados para el estudio fenotípico en la línea celular MG-63. Abmo CD/especificidad Fluorocromo Casa comercial Control PE - PE Ortho DS, (Belgium) Control FITC - FITC Ortho DS, (Belgium) OKB-cLLa CD10 PE Ortho DS, (Belgium) OKM13 CD13 FITC Ortho DS, (Belgium) Sigma Immunochemicals, CD21 CD21 PE (USA) Sigma Immunochemicals, CD44 CD44 FITC (USA) IOL1b CD54 FITC Caltag (Burlingame,CA) CD69 CD69 FITC Caltag (Burlingame,CA) CD80 CD80 FITC Pharmingen, (USA) CD86 CD86 FITC Pharmingen, (USA) OKDR HLA-DR FITC Ortho DS, (Belgium) 4.- CAPACIDAD FAGOCÍTICA DE LA LÍNEA MG-63 La capacidad fagocítica fue estudiada siguiendo una técnica citométrica y el uso de bolitas de latex fluorescentes. Posteriormente fue confirmada mediante microscopía electrónica de transmisión, en cuyo caso utilizamos como partículas diana bolitas de látex y el microorganismo Candida sp, proporcionado por el servicio de microbiología del Hospital Universitario San Cecilio de Granada. 4.1.- ANÁLISIS DE LA CAPACIDAD FAGOCÍTICA MEDIANTE CITOMETRÍA DE FLUJO La actividad fagocítica de la línea MG-63 fue determinada mediante una técnica de citometría de flujo utilizando como partículas diana, bolitas de látex de 2 µm de diámetro marcadas con fluoresceína (Sigma Chem. Comp., St Louis, Mo, USA). 79 METODOLOGÍA 100µl de una suspensión de células MG-63 en medio DMEM suplementado con un 10% de SBF y una densidad celular media de 2x104 células/ml, se incubaron con 10 µl de una suspensión de bolitas de látex de 2 µm de diámetro y marcadas con fluoresceína, a 37°C durante 30 min en oscuridad. Posteriormente, las células fueron lavadas y suspendidas en 1 ml de PBS (Sigma, St Louis, MO, USA), e inmediatamente después analizadas en un citómetro de flujo (FACS Vantage SE, Becton Dickinson, Paloalto, California, USA). Los resultados se expresaron como el porcentaje de células que fluorescen o células fagocitadas. Todos los ensayos se realizaron por cuadruplicado, incluyendo un grupo control sin tratamiento. 4.2.- ANÁLISIS DE LA CAPACIDAD FAGOCÍTICA MEDIANTE MICROSCOPÍA ELECTRÓNICA DE TRANSMISIÓN Con objeto de confirmar la capacidad fagocítica de la línea celular MG-63, analizamos dichas células mediante microscopía electrónica de transmisión, para lo cual, las células se cultivaron durante 90 min o durante 24h en presencia de bolitas de látex o en presencia de una suspensión de Candida sp a 37º C en atmosfera de CO2. Tras la incubación, las células adheridas al frasco de cultivo se fijaron con una solución que contenía un 1% de glutaraldehido y un 15% de formaldehído en tampón cacodilato 0.1 M, a un ph de 7.4 y a una temperatura de 4ºC. Con tetróxido de osmio al 2%, se realizó una segunda fijación en el mismo tampón, llevando como aditivo el ferricianuro potásico. A continuación, las células se deshidrataron en gradientes de etanol para ser finalmente incluidas en Epon 812. Una vez tratadas así las muestras, se cortaron en un ultramicrotomo Ultracut E (Reichert) con cuchillas de vidrio a un grosor aproximado de 500-700 A. Como agentes de contraste, se utilizaron el acetato de uracilo y el citrato de plomo, para poder visualizar las células en un microscopio electrónico de transmisión EM10C de Zeiss. 80 METODOLOGÍA 5.- EFECTO DE LOS AINEs SOBRE LA LÍNEA MG-63: Hemos estudiado el efecto de diferentes AINEs sobre distintos parámetros fisiológicos y funcionales de los osteoblastos, tales como la proliferación, la diferenciación, la expresión antigénica y la capacidad fagocítica. Para este estudio hemos seleccionado un total de cinco AINEs escogidos fundamentalmente por su utilidad clínica: indometacina (Sigma Chem. Comp., St Louis, Mo, USA), nimesulida (Sigma Chem. Comp., St Louis, Mo, USA), diclofenaco (Sigma Chem. Comp., St Louis, Mo, USA), ibuprofeno (Sigma Chem. Comp., St Louis, Mo, USA) y paracetamol (Sigma Chem. Comp., St Louis, Mo, USA). Con dichos antiinflamatorios hemos tratados, in vitro, la línea MG-63 con objeto de determinar su efecto sobre distintos parámetros celulares. 5.1.- Efecto de los AINEs sobre la proliferación celular: El efecto sobre la capacidad proliferativa de la línea MG-63, se realizó mediante el recuento del número de células tras el tratamiento con distintas concentraciones de AINEs durante 24 y 48 horas, utilizando como contador de células un citómetro de flujo Ortho Cytoron Absolute (Ortho Diagnostic System, Raritan, USA). Las células suspendidas en medio de cultivo sin SBF y ajustadas a una concentración final de 1x104 células/ml, se dispusieron en una placa de cultivo de 24 pocillos (Falcon, Becton Dickinson Labware, N.J., USA), conteniendo cada uno de ellos un volumen de 2 ml. Cada pocillo fue tratado con la dosis correspondiente de antiinflamatorio a estudiar: 1, 10 y 100 µM para la indometacina, nimesulida y diclofenaco; y para el ibuprofeno y el paracetamol, 5, 25 y 75 µM. Como grupo control se incluyeron pocillos sin tratamiento. Todos los ensayos se realizaron por cuadruplicado. Las placas de cultivo fueron posteriormente incubadas a 37°C durante 24 o 48 horas. Una vez transcurrido el periodo de incubación, las células 81 METODOLOGÍA se despegaron con 1ml de una solución de Tripsina-EDTA durante 10 minutos a 37ºC. Transcurrido este tiempo, se neutralizó la actividad enzimática con otro ml de medio DMEM suplementado al 10% con SBF. La suspensión celular obtenida se depositó en un frasco universal y se centrifugó a 1200 rpm durante 10 minutos. El sedimento suspendido en 500 µl de PBS, se agitó y se procedió al recuento del número total de células en un citómetro de flujo. Los datos se expresaron como el número de células totales/ml. 5.2,-Efecto de los AINEs sobre la diferenciación celular El efecto de los AINEs sobre la diferenciación celular se realizó valorando la síntesis de osteocalcina. Síntesis de Osteocalcina. La osteocalcina ha sido descrita como una de las proteínas no colagénicas más abundantes del hueso. Es utilizada como marcador bioquímico del metabolismo óseo, puesto que se encuentra específicamente en este tejido y es producida por los osteoblastos. Para determinar la existencia de esta proteína, se ha utilizado el Kit N-tact® osteo SP para osteocalcina IRMA (Diasorin-Stillwater, Minesota, USA), y como sustratro, los sobrenadantes de los cultivos de osteoblastos recogidos tras el tratamiento. - Procedimiento de estudio: Las células se cultivaron sin SBF durante 24 horas con las siguientes dosis: 10 µM de indometacina, nimesulida, diclofenaco y 25 µM de ibuprofeno y paracetamol. Trascurrido dicho tiempo se recogió el sobrenadante de cultivo centrifugándose a 1600 rpm. Un ml del sobrenadante así obtenido, se dispuso en viales de 5 ml para 82 METODOLOGÍA ser liofilizados. Las muestras se regeneraron con 100 µl de agua destilada. Paralelamente, se determinó el número de células/ml de cada una de las muestras. Posteriormente veinte microlitros de cada muestra por duplicado, fueron analizados usando el equipo Ntact ® osteo SP. En todo momento se siguieron las instrucciones del Kit, realizándose la lectura con el mismo equipo. Los resultados obtenidos se expresaron en nanogramos de osteocalcina /mlx104 células. 5.3.- Efecto de los AINEs sobre el perfil antigénico Para determinar el efecto de los distintos AINEs estudiados sobre la expresión antigénica de la línea MG-63, las células se cultivaron durante 24 horas con las siguientes dosis: 10 µM de indometacina, nimesulida y diclofenaco y, 25 µM de ibuprofeno y paracetamol. Trascurrido dicho tiempo, las células se separaron del frasco de cultivo con EDTA al 0.04% (Merck, Darmstadt, Alemania) en PBS. Posteriormente, se lavaron con PBS por centrifugación a 1200 rpm durante 10 minutos y el sedimento se suspendió en medio de cultivo. 100 µl de la suspensión celular se incubó con 10 µl del Abmo correspondiente (Tabla 3) durante 30 minutos a 4ºC en oscuridad. Transcurrido el periodo de incubación con el Abmo, las células se lavaron por centrifugación con PBS y el sedimento se suspendió en 1 ml de PBS para su lectura en un citómetro de flujo (FACS Vantage SE, Becton Dickinson, Paloalto, California, USA). En todos los ensayos se incluyeron controles de isotipo, con objeto de descartar los falsos positivos por unión inespecífica. 83 METODOLOGÍA Tabla 3. Anticuerpos monoclonales utilizados para el estudio del efecto de los AINEs sobre el perfil fenotípico en la línea celular MG-63. Abmo CD/especificidad Fluorocromo Casa comercial Control PE - PE Caltag (Burlingame,CA) Control FITC - FITC Caltag (Burlingame,CA) OKM13 CD13 FITC Caltag (Burlingame,CA) CD21 CD21 PE Caltag (Burlingame,CA) CD44 CD44 FITC Caltag (Burlingame,CA) IOL1b CD54 FITC Caltag (Burlingame,CA) CD80 CD80 FITC Caltag (Burlingame,CA) CD86 CD86 FITC Caltag (Burlingame,CA) OKDR HLA-DR FITC Caltag (Burlingame,CA) 5.4.- Efecto de los AINEs sobre la capacidad fagocítica: El estudio del efecto de los AINEs sobre la capacidad fagocítica de la línea MG-63 se realizó mediante citometría de flujo. Para estos ensayos 2ml de una suspensión célular en medio DMEM y con una densidad media de 1x104 células/ml, se dispusieron en placas de cultivo de 24 pocillos. Posteriormente estas células fueron tratadas durante 24 horas con indometacina (10 µM), nimesulida (10 µM), diclofenaco (10 µM), ibuprofeno (25 µM) y paracetamol (25 µM). Trascurrido el periodo de tratamiento, se despegaron de la superficie del frasco de cultivo con una solución Tripsina-EDTA, se lavaron y se suspendieron en medio de cultivo con un 10 % de SBF, ajustándose a una concentración de 2x105 células/ml. 100 µl de esta suspensión celular fueron incubados con 10 µl de bolitas de látex de 2 µm de diámetro y marcadas con fluoresceína (Sigma Chem. Comp., St Louis, Mo, USA), a 37ºC durante 30 minutos en oscuridad. A continuación, las células se lavaron por centrifugación con PBS y se suspendieron en 1 ml de PBS, e inmediatamente después se analizaron en un citómetro de flujo (FACS Vantage SE, Becton Dickinson, Paloalto, California, USA). Los resultados obtenidos, se expresaron como el porcentaje de células que han fagocitado partículas de látex y por lo tanto, se muestran fluorescentes. Todos los ensayos se realizaron por cuadruplicado, incluyendo un grupo control sin tratamiento. 84 METODOLOGÍA 6. ANÁLISIS ESTADÍSTICO Todas las experiencias realizadas para la consecución de cada uno de los objetivos de esta Tesis Doctoral, se repitieron al menos 4 veces. • Análisis descriptivo El análisis descriptivo de la muestra, se ha realizado mediante la elaboración de resúmenes numéricos que incluyen el valor de la media, como medida de tendencia central y la desviación típica, como medida de dispersión. • Análisis bivariante Para analizar la asociación de variables se ha realizado la comparación de medias, aplicando el test de la t de Student, considerando un intervalo de confianza del 95%. En todos los casos, el análisis estadistico se ha realizado utilizando la versión 14.0 del paquete estadístico SPSS. 85 METODOLOGÍA 86 RESULTADOS IV. RESULTADOS: Como en ensayos previos, en la presente tesis, nos planteamos la necesidad de analizar el perfil antigénico de la línea de osteosarcoma humano MG-63 y su capacidad fagocítica; ya que, ambos aspectos, serán estudiados junto a otros, a la hora de valorar el efecto de los AINEs sobre las células formadoras de hueso. I. Fenotipo antigénico de la línea MG-63 El estudio de la expresión antigénica de la línea MG63 mediante citometría de flujo reveló que los antígenos CD10, 13, CD44 y CD54 (Figuras 15, 16, 17 y 18) se expresan en un alto porcentaje de la población analizada. Los antígenos CD21, CD80 y CD86 (Figuras 19, 20 y 21) presentaron expresión positiva pero no se detectaron en toda la población, mientras que los antígenos CD69 y HLA-DR fueron de expresión negativa. (Figuras 22 y 23). CD10 CD13 Fig.15.- Histograma de fluorescencia de la expresión Fig.16.- Histograma de fluorescencia de la expresión del Antígeno CD10 mediante citometría de flujo. del Antígeno CD13 mediante citometría de flujo. Grupo control=Negro; Expresión=Gris. Grupo control=Negro; Expresión=Gris. 87 RESULTADOS CD44 Fig.17.- Histograma de fluorescencia de la expresión del Antígeno CD44 mediante citometría de flujo. Grupo control=Negro; Expresión=Gris. CD54 CD21 Fig.18.- Histograma de fluorescencia de la expresión Fig.19.- Histograma de fluorescencia de la expresión del Antígeno CD54 mediante citometría de flujo. del Antígeno CD21 mediante citometría de flujo. Grupo control=Negro; Expresión =Gris Grupo control=Negro; Expresión=Gris CD80 CD86 Fig.20.- Histograma de fluorescencia de la expresión Fig.21.- Histograma de fluorescencia de la expresión del Antígeno CD80 mediante citometría de flujo. del Antígeno CD86 mediante citometría de flujo. Grupo control=Negro; Expresión=Gris Grupo control=Negro; Expresión=Gris 88 RESULTADOS HLA-DR CD69 Fig.22.- Histograma de fluorescencia de la expresión Fig.23.- Histograma de fluorescencia de la expresión del Antígeno CD69 mediante citometría de flujo. del Antígeno HLA-DR mediante citometría de flujo. Grupo control=Negro; Expresión=Gris Grupo control=Negro; Expresión=Gris II. Capacidad fagocítica de la línea MG-63 El análisis cuantitativo de la capacidad fagocítica se realizó utilizando como partículas diana, bolitas de látex fluorescentes y como técnica de estudio, la citometría de flujo. En dicho ensayo observamos que el 100% de las células analizadas presentaron capacidad fagocítica (Figura 24). También observamos una alta intensidad de fluorescencia, lo que indica un número elevado de partículas por célula. Dada la importancia de estos resultados, y aunque daban una respuesta clara a uno de los objetivos de nuestro trabajo, consideramos que era conveniente ratificarla mediante ensayos adicionales. Fig.24.- Histograma de fluorescencia del estudio de la capacidad fagocítica de la línea de osteosarcoma MG-63 mediante citometría de flujo. El eje de ordenadas corresponde al número de células analizadas y el eje de abscisas, al logaritmo de la intensidad de fluorescencia. 89 RESULTADOS Para confirmar esta propiedad funcional y descartar la simple adhesión celular mediante visualización de la internalización de las partículas diana, se ha estudiado dicha actividad mediante microscopía electrónica de transmisión. En este ensayo, como podemos observar en la Figura 25, las partículas se encuentran en el citosol celular y además podemos apreciar un elevado número de partículas por célula. Fig. 25.- Micrografía electrónica de transmisión de la línea de osteosarcoma humano MG-63, tras su incubación en presencia de partículas de látex. 90 RESULTADOS Mediante microscopia electrónica de transmisión, hemos igualmente estudiado la capacidad fagocítica de distintos microorganismos (utilizando para ello como diana una levadura, Candida sp. (Figura 26). Este ensayo fue realizado por incubación conjunta de una suspensión celular de la línea MG-63 y una suspensión del microorganismo a estudiar durante 90 minutos. Como podemos observar en la figura 26, la levadura se encuentra en el interior del fagosoma, que demuestra la capacidad fagocítica de la población celular estudiada de material biológico. Periodos superiores de incubación a los 90 minutos dificultaron su observación por microscopía electrónica. Candida sp. Fig.26. Micrografía electrónica de transmisión de la línea de osteosarcoma humano MG-63, tras su incubación en presencia de Candida sp. 91 RESULTADOS III. Efecto de los AINEs sobre la proliferación de la línea MG-63 Para estudiar el efecto de los distintos AINEs sobre la proliferación de la línea celular MG-63, las células se trataron con diferentes dosis del AINE a estudiar durante 24 y 48 horas. Los resultados obtenidos, como podemos observar en la Figura 27, mostraron que el tratamiento con 1 y 10 µM de indometacina produce un descenso significativo de la proliferación tras 24h de incubación con respecto de las células no tratadas, con valores de p< 0.01 y p< 0.001 respectivamente. nº células/ml x10 4 24 horas 80 70 60 50 40 30 20 10 0 * ** Control Indometacina 1µM 10 µM 50 µM Concentración AINE Indometacina (micromoles/ml) Fig.27. Efecto de la indometacina sobre la proliferación osteoblástica de la línea celular MG-63 tras 24 horas de incubación.*p<0.01; **p< 0.001 Sin embargo, cuando estos tratamientos se prolongaron durante 48h no se observaron efectos significativos (Figura 28). De igual modo, la dosis 50 µM de este AINE no ejerció efecto sobre la proliferación de la línea MG-63, independientemente del tiempo de tratamiento (Tabla 4). 92 RESULTADOS 48 horas nº células/ml x10 4 100 80 Control 60 Indometacina 40 20 0 1µM 10 µM 50 µM Concentración AINE Indometacina (micromoles/ml) Fig.28. Efecto de la indometacina sobre la proliferación osteoblástica de la línea celular MG-63 tras 48 horas de incubación. Tabla 4. Proliferación celular de la línea MG-63 tras 24 y 48h de incubación con indometacina expresado en células/ml x104. Tratamiento m sd p 24 horas Tratamiento m sd p 48 horas Control 66.59 6.76 --- Control 56.90 7.51 --- 1 µM 59.37 8.64 0.01 1 µM 57.90 8.41 0.725 10 µM 54.93 6.54 <0.001 10 µM 53.62 7.72 0.233 Control 30.71 5.01 --- Control 35.34 4.25 --- 50 µM 30.93 4.21 0.433 50 µM 37.15 2.96 0.172 m=media; sd=desviación típica En la Figura 29, se muestran los resultados obtenidos con el AINE nimesulida. 93 RESULTADOS nº células/ml x10 4 24 horas 80 70 60 50 40 30 20 10 0 * * Control Nimesulida 1µM 10 µM 50 µM Concentración AINE Nimesulida (micromoles/ml) Fig. 29. Efecto de la nimesulida sobre la proliferación osteoblástica de la línea celular MG-63 tras 24 horas de incubación. *p<0.001 Como podemos comprobar, el efecto de este fármaco, fue muy parecido al obtenido con indometacina. Solo el tratamiento con las dosis 1 y 10 µM durante 24h, mostró un efecto significativo sobre la proliferación celular, el cual se tradujo en una inhibición de la misma (p< 0.001), no detectándose efecto alguno con la dosis mayor ensayada (50 µM) ni en ninguno de los tratamientos a 48h (Figura 30)(Tabla 5). nº células/ml x10 4 48 horas 80 70 60 50 40 30 20 10 0 Control Nimesulida 1µM 10 µM 50 µM Concentración AINE Nimesulida (micromoles/ml) Fig. 30. Efecto de la nimesulida sobre la proliferación osteoblástica de la línea celular MG-63 tras 48 horas de incubación. 94 RESULTADOS Tabla 5. Proliferación celular de la línea MG-63 tras 24 y 48h de incubación con nimesulida expresado en células/ml x104. Tratamiento m sd p Tratamiento 24 horas m sd p 48 horas Control 66.59 6.76 --- Control 56.90 7.51 --- 1 µM 49.56 4.34 <0.001 1 µM 53.59 10 0.298 10 µM 54.78 5.72 <0.001 10 µM 55.12 5.92 0.462 Control 30.71 5.01 --- Control 35.34 4.25 --- 50 µM 30.46 6.34 0.902 50 µM 35.71 4.91 0.819 m=media; sd=desviación típica El paracetamol ha mostrado un perfil de actividad similar a los AINEs anteriores descritos (Figura 31 y 32), utilizándose como dosis de estudio 5, 25 y 75 µM (Tabla 6). 24 horas nº células/ml x10 4 50 40 * 30 * Control Paracetamol 20 10 0 5µM 25 µM 75 µM Concentración AINE Paracetamol (micromoles/ml) Fig. 31. Efecto del paracetamol sobre la proliferación osteoblástica de la línea celular MG-63 tras 24 horas de incubación. *p< 0.001 95 RESULTADOS 48 horas nº células/ml x10 4 50 40 30 Control 20 Paracetamol 10 0 5µM 25 µM 75 µM Concentración AINE Paracetamol (micromoles/ml) Fig. 32. Efecto del paracetamol sobre la proliferación osteoblástica de la línea celular MG-63 tras 48 horas de incubación. Tabla 6. Proliferación celular de la línea MG-63 tras 24 y 48h de incubación con paracetamol expresado en células/ml x104. Tratamiento m sd p 24 horas Tratamiento m sd p 48 horas Control 39.53 8.38 --- Control 32.21 7.85 --- 5 µM 28.37 4.56 <0.001 5 µM 29.28 4.71 0.211 25 µM 26.18 4.58 <0.001 25 µM 30.18 5.3 0.399 Control 30.71 5.01 --- Control 35.34 4.25 --- 75 µM 31.23 4.98 0.777 75 µM 32.62 3.63 0.061 m=media; sd=desviación típica El estudio del efecto del diclofenaco sobre la capacidad proliferativa de la línea MG-63, mostró un efecto negativo en los tratamientos durante 24h con las dosis de 1 y 10 µM con valores de p< 0.001 (Figura 33), no apareciendo diferencias significativas con 50 µM. 96 RESULTADOS 24 horas nº células/ml x10 4 60 50 40 * 30 * Control Diclofenaco 20 10 0 1µM 10 µM 50 µM Concentración AINE Diclofenaco (micromoles/ml) Fig. 33. Efecto del diclofenaco sobre la proliferación osteoblástica de la línea celular MG-63 tras 24 horas de incubación. *p< 0.001. El tratamiento durante 48h, se mostró efectiva únicamente con la dosis más alta utilizada (Figura 34), (Tabla 7). 48 horas nº células/ml x10 4 50 40 * 30 Control Diclofenaco 20 10 0 1µM 10 µM 50 µM Concentración AINE Diclofenaco (micromoles/ml) Fig. 34. Efecto del diclofenaco sobre la proliferación osteoblástica de la línea celular MG-63 tras 48 horas de incubación. *p< 0.001 97 RESULTADOS Tabla 7. Proliferación celular de la línea MG-63 tras 24 y 48h de incubación con diclofenaco expresado en células/ml x104. Tratamiento m sd p 24 horas Tratamiento m sd p 48 horas Control 39.53 8.38 --- Control 32.21 7.85 --- 1 µM 28.53 5.76 <0.001 1 µM 30.53 5.97 0.5 10 µM 26.21 5.48 <0.001 10 µM 35.43 6.65 0.221 Control 30.71 5.01 --- Control 35.34 4.25 --- 50 µM 31.31 3.3 0.695 50 µM 28.46 5.47 <0.001 m=media; sd=desviación típica El tratamiento con ibuprofeno, produjo un descenso significativo de la proliferación únicamente con la concentración de 75 µM, tras 24 h de incubación con respecto a las células no tratadas, con un valor de p< 0.05 (Figura 35). 24 horas nº células/ml x10 4 60 50 40 * 30 Control Ibuprofeno 20 10 0 5µM 25 µM 75 µM Concentración AINE Ibuprofeno (micromoles/ml) Fig. 35. Efecto del ibuprofeno sobre la proliferación osteoblástica de la línea celular MG-63 tras 24 horas de incubación. *p< 0.05 Cuando los tratamientos con 5 y 25 µM se prolongaron durante 48 h, se observaron aumentos significativos con valores de p<0.05 y p<0.01 respectivamente. De igual modo, la dosis 75 µM de este AINE no ejerció efecto 98 RESULTADOS sobre la proliferación de la línea MG-63 tras 48 h (Figura 36) (Tabla 8). 48 horas nº células/ml x10 4 60 ** * 50 40 Control 30 Ibuprofeno 20 10 0 5µM 25 µM 75 µM Concentración AINE Ibuprofeno (micromoles/ml) Fig. 36. Efecto del ibuprofeno sobre la proliferación osteoblástica de la línea celular MG-63 tras 48 horas de incubación. *p < 0.05; **p< 0.01 Tabla 8. Proliferación celular de la línea MG-63 tras 24 y 48h de incubación con ibuprofeno expresado en células/ml x104. Tratamiento m sd p 24 horas Tratamiento m sd p 48 horas Control 40.62 4.84 --- Control 42.87 4.32 --- 5 µM 37.75 6.64 0.172 5 µM 46.12 4.9 0.05 25 µM 37.28 5.92 0.091 25 µM 50.28 9.13 <0.01 Control 30.71 5.01 --- Control 35.34 4.25 --- 75 µM 27.37 3.47 <0.05 75 µM 35.59 3.74 0.861 m=media; sd=desviación típica IV. Efecto de los AINEs sobre la el perfil antigénico de la línea MG-63 El estudio del efecto de los AINEs sobre el perfil antigénico se ha centrado en el análisis de la modulación de la expresión de los antígenos CD13, CD21, CD44, CD54, CD80, CD86 y HLA-DR. Dichos marcadores, han sido seleccionados en 99 RESULTADOS base a investigaciones anteriores. Unos, por ser considerados constitutivos de esta población, como el CD13 y CD44 y otros, por ser considerados modulables y relacionados con procesos de activación y/o capacidad funcional, como el CD54, el CD80, CD86 y HLA-DR. Con respecto a los antiinflamatorios objeto de estudio, cabe señalar, que el tiempo de tratamiento seleccionado ha sido 24 horas, ya que el cultivo en presencia del antiinflamatorio durante dicho tiempo se mostró más efectivo a nivel de la proliferación. Asimismo, hemos seleccionado como dosis de tratamiento, 10 µM para los antiinflamatorios no esteroideos indometacina, nimesulida y diclofenaco y 25 µM para el paracetamol y eliIbuprofeno. a. Efecto de los AINEs sobre el perfil antigénico de la línea MG-63: expresión del antígeno CD13 El tratamiento con los diferentes AINEs de la línea MG-63 durante 24h y a la dosis indicada no provocó cambio alguno a nivel del porcentaje de expresión del antígeno CD13, que se detectó por encima del 90% en todos los casos; pero sí que observamos un efecto muy significativo en el número de moléculas por unidad celular, parámetro que viene definido por la intensidad de fluorescencia. Los resultados recogidos en la Tabla 9 y Figuras 37-41, muestran que todos los AINES estudiados disminuyeron de forma importante la intensidad de fluorescencia para la molécula CD13 (p < 0.001). Fig.37.- Histograma de fluorescencia de la expresión Fig.38.-Histograma de fluorescencia de la expresión del Antígeno CD13 tras 24h de cultivo de la línea celular del Antígeno CD13 tras 24h de cultivo de la línea celular MG-63 con 10 µM de Indometacina mediante citometría MG-63 con 10 µM de Nimesulida mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. de flujo. Grupo control=Azul; Tratamiento=Rojo. 100 RESULTADOS Fig.39.- Histograma de fluorescencia de la expresión Fig.40.-Histograma de fluorescencia de la expresión del Antígeno CD13 tras 24h de cultivo de la línea celular del Antígeno CD13 tras 24h de cultivo de la línea celular MG-63 con 25 µM de Paracetamol mediante citometría MG-63 con 10 µM de Diclofenaco mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. de flujo. Grupo control=Azul; Tratamiento=Rojo. Fig.41.- Histograma de fluorescencia de la expresión del Antígeno CD13 tras 24h de cultivo de la línea celular MG-63 con 25 µM de Ibuprofeno mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. 101 RESULTADOS Tabla 9. Expresión del antígeno CD13 en células tumorales de la línea MG-63, tras 24h de incubación con AINEs, mediante citometría de flujo. Tratamiento % de expresión CD13 Intensidad de fluorescencia m sd p m sd p Control 90.24 3.52 --- 131.66 3.78 --- Indometacina 93.64 1.47 0.19 84.60 3.99 <0.001 Diclofenaco 91.64 1.54 0.48 90.40 2.74 <0.001 Nimesulida 93.19 2.56 0.30 88.87 1.59 <0.001 Paracetamol 93.29 2.60 0.29 89.15 1.58 <0.001 Ibuprofeno 91.75 1.55 0.53 87.49 2.15 <0.001 m=media; sd=desviación típica b. Efecto de los AINEs sobre el perfil antigénico de la línea MG-63: expresión del antígeno CD21. Como podemos comprobar en la Tabla 10 y figuras 42-46, la molécula CD21 se detectó en un alto porcentaje de la población de células analizadas tras su incubación con los diferentes AINEs estudiados. Este incremento de la expresión del marcador fue estadísticamente significativo en todos los casos con respecto del control. De igual modo, como consecuencia del tratamiento la intensidad de fluorescencia se vio incrementada. 102 RESULTADOS Fig.42.- Histograma de fluorescencia de la expresión Fig.43.-Histograma de fluorescencia de la expresión del Antígeno CD21 tras 24h de cultivo de la línea celular del Antígeno CD21 tras 24h de cultivo de la línea celular MG-63 con 10 µM de Indometacina mediante citometría MG-63 con 10 µM de Nimesulida mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. de flujo. Grupo control=Azul; Tratamiento=Rojo. Fig.44.- Histograma de fluorescencia de la expresión Fig.45.-Histograma de fluorescencia de la expresión del Antígeno CD21 tras 24h de cultivo de la línea celular del Antígeno CD21 tras 24h de cultivo de la línea celular MG-63 con 25 µM de Paracetamol mediante citometría MG-63 citometríade flujo. Grupo control=Azul; Tratamiento=Rojo. con 10 µM de Diclofenaco mediante de flujo. Grupo control=azul; Tratamiento=Rojo 103 RESULTADOS Fig.46.- Histograma de fluorescencia de la expresión del Antígeno CD21 tras 24h de cultivo de la línea celular MG-63 citometría con 25 µM de Ibuprofeno mediante de flujo. Grupo control=Azul; Tratamiento=Rojo. Tabla 10. Expresión del antígeno CD21 en células tumorales de la línea MG-63, tras 24h de incubación con AINEs, mediante citometría de flujo. Tratamiento % de expresión CD21 Intensidad de fluorescencia m sd p m sd p Control 79.91 2.38 --- 34.22 3.98 --- Indometacina 96.31 1.04 <0.001 74.77 3.98 <0.001 Diclofenaco 96.30 2.54 0.001 63.42 2.79 <0.001 Nimesulida 98.52 0.96 <0.001 78.53 2.29 <0.001 Paracetamol 93.34 2.10 0.01 65.83 2.42 <0.001 Ibuprofeno 96.84 1.14 <0.001 80.87 4.35 <0.001 m=media; sd=desviación típica 104 RESULTADOS c. Efecto de los AINEs sobre el perfil antigénico de la línea MG-63: expresión del antígeno CD44. El receptor para el ácido hialurónico, como se observa en la tabla 11 y figuras 47-51, se expresó en un alto porcentaje en todos los cultivos, independientemente de las condiciones de trabajo; ahora bien, en presencia de nimesulida, diclofenaco, paracetamol e ibuprofeno, estadísticamente el porcentaje de expresión fue ligeramente mayor. La intensidad de fluorescencia también se vio ligeramente modulada en algunos tratamientos. Así, el diclofenaco disminuyó la intensidad de fluorescencia y la nimesulida la incrementó, aunque en este caso no se vio afectado significativamente el porcentaje de expresión. Fig.47.- Histograma de fluorescencia de la expresión Fig.48.-Histograma de fluorescencia de la expresión del Antígeno CD44 tras 24h de cultivo de la línea celular del Antígeno CD44 tras 24h de cultivo de la línea celular MG-63 con 10 µM de Indometacina mediante citometría MG-63 con 10 µM de Nimesulida mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. de flujo. Grupo control=Azul; Tratamiento=Rojo. Fig.49.- Histograma de fluorescencia de la expresión del Antígeno CD44 tras 24h de cultivo de la línea celular MG-63 con 25 µM de Ibuprofeno mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. 105 RESULTADOS Fig.50.- Histograma de fluorescencia de la expresión Fig.51.-Histograma de fluorescencia de la expresión del Antígeno CD44 tras 24h de cultivo de la línea celular del Antígeno CD44 tras 24h de cultivo de la línea celular MG-63 con 25 µM de Paracetamol mediante citometría MG-63 con 10 µM de Diclofenaco mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. de flujo. Grupo control=Azul; Tratamiento=Rojo. Tabla 11. Expresión del antígeno CD44 en células tumorales de la línea MG-63, tras 24h de incubación con AINEs, mediante citometría de flujo. Tratamiento % de expresión CD44 Intensidad de fluorescencia m sd p m sd p Control 84.61 0.51 --- 41.79 1.60 --- Indometacina 89.24 3.56 0.090 37.96 2.30 0.077 Diclofenaco 91.14 1.88 <0.01 36.24 2.47 <0.05 Nimesulida 89.75 4.08 0.097 46.12 1.79 <0.05 Paracetamol 88.63 1.90 <0.05 38.92 1.74 0.104 Ibuprofeno 90.29 3.11 <0.05 45.09 1.94 0.087 m=media; sd=desviación típica 106 RESULTADOS d. Efecto de los AINEs sobre el perfil antigénico de la línea MG-63: expresión del antígeno CD54. El antígeno CD54 expresado en un alto porcentaje de la línea MG-63, no sufrió grandes cambios tras el tratamiento con los diferentes AINEs analizados, salvo el descenso observado con indometacina y nimesulida. Sin embargo, si observamos en todos los casos un descenso importante en la intensidad de fluorescencia que fue estadísticamente significativo. (tabla 12 y figuras 52-56). Fig.52.- Histograma de fluorescencia de la expresión Fig.53.-Histograma de fluorescencia de la expresión del Antígeno CD54 tras 24h de cultivo de la línea celular del Antígeno CD54 tras 24h de cultivo de la línea celular MG-63 con 10 µM de Indometacina mediante citometría MG-63 con 10 µM de Nimesulida mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. de flujo. Grupo control=Azul; Tratamiento=Rojo. Fig.54.- Histograma de fluorescencia de la expresión Fig.55.-Histograma de fluorescencia de la expresión del Antígeno CD54 tras 24h de cultivo de la línea celular del Antígeno CD54 tras 24h de cultivo de la línea celular MG-63 con 25 µM de Paracetamol mediante citometría MG-63 con 10 µM de Diclofenaco mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. de flujo. Grupo control=Azul; Tratamiento=Rojo. 107 RESULTADOS Fig.56.- Histograma de fluorescencia de la expresión del Antígeno CD54 tras 24h de cultivo de la línea celular MG-63 citometría con 25 µM de Ibuprofeno mediante de flujo. Grupo control=Azul; Tratamiento=Rojo. Tabla 12. Expresión del antígeno CD54 tras 24h de incubación con AINEs, mediante citometría de flujo. Tratamiento % de expresión CD54 Intensidad de fluorescencia m sd p m sd p Control 75.01 3.84 --- 63.67 3.28 --- Indometacina 64.80 2.06 <0.01 31.29 3.30 <0.001 Diclofenaco 69.86 2.53 0.125 30.81 3.22 <0.001 Nimesulida 68.14 2.07 <0.05 32.88 3.74 <0.001 Paracetamol 77.71 2.59 0.37 47.32 3.01 <0.01 Ibuprofeno 71.36 2.27 0.231 39.91 2.13 <0.001 m=media; sd=desviación típica 108 RESULTADOS e. Efecto de los AINEs sobre el perfil antigénico de la línea MG-63: expresión de los antígeno CD80 y CD86. El CD80 y el CD86 son moléculas coestimuladoras que están implicadas directamente en el proceso de presentación del antígeno, por lo que su expresión es propia de células presentadoras de antígeno. Con respecto al CD80, el tratamiento con indometacina y nimesulida, pero sobretodo, con el paracetamol e ibuprofeno, provocó un aumento significativo del porcentaje de expresión de esta molécula como podemos observar en la tabla 13 y figuras 57-61. Fig.57.- Histograma de fluorescencia de la expresión Fig.58.-Histograma de fluorescencia de la expresión del Antígeno CD80 tras 24h de cultivo de la línea celular del Antígeno CD80 tras 24h de cultivo de la línea celular MG-63 con 10 µM de Indometacina mediante citometría MG-63 con 10 µM de Nimesulida mediante citometría de flujo.Grupo control=Azul; Tratamiento=Rojo. de flujo. Grupo control=Azul; Tratamiento=Rojo. 109 RESULTADOS Fig.59.- Histograma de fluorescencia de la expresión Fig.60.-Histograma de fluorescencia de la expresión del Antígeno CD80 tras 24h de cultivo de la línea celular del Antígeno CD80 tras 24h de cultivo de la línea celular MG-63 con 25 µM de Paracetamol mediante citometría MG-63 con 10 µM de Diclofenaco mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. de flujo. Grupo control=Azul; Tratamiento=Rojo. Fig.61.- Histograma de fluorescencia de la expresión del Antígeno CD80 tras 24h de cultivo de la línea celular MG-63 con 25 µM de Ibuprofeno mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. 110 RESULTADOS Tabla 13. Expresión del antígeno CD80 tras 24h de incubación con AINEs, mediante citometría de flujo. Tratamiento % de expresión CD80 Intensidad de fluorescencia m sd p m sd p Control 16.17 2.47 --- 24.05 4.06 --- Indometacina 27.85 2.61 <0.01 18.19 2.12 0.091 Diclofenaco 17.39 6.31 0.77 23.42 2.45 0.83 Nimesulida 27.97 2.6 <0.01 18.58 1.77 0.099 Paracetamol 62.92 2.77 <0.001 22.68 2.62 0.64 Ibuprofeno 62.74 3.50 <0.001 22.30 3.20 0.59 m=media; sd=desviación típica Resultados equivalentes se obtuvieron para CD86 en la línea MG63 tras el tratamiento con los diferentes AINES estudiados. Cabe señalar el aumento de expresión tras el tratamiento con indometacina, paracetamol e Ibuprofeno (tabla 14 y Figuras 62-66). 111 RESULTADOS Fig.62.- Histograma de fluorescencia de la expresión Fig.63.-Histograma de fluorescencia de la expresión del Antígeno CD86 tras 24h de cultivo de la línea celular del Antígeno CD86 tras 24h de cultivo de la línea celular MG-63 con 10 µM de Indometacina mediante citometría MG-63 con 10 µM de Nimesulida mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. de flujo. Grupo control=Azul; Tratamiento=Rojo. Fig.64.- Histograma de fluorescencia de la expresión Fig.65.-Histograma de fluorescencia de la expresión del Antígeno CD86 tras 24h de cultivo de la línea celular del Antígeno CD86 tras 24h de cultivo de la línea celular MG-63 con 25 µM de Paracetamol mediante citometría MG-63 con 10 µM de Diclofenaco mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. de flujo. Grupo control=Azul; Tratamiento=Rojo. Fig.66.- Histograma de fluorescencia de la expresión del Antígeno CD86 tras 24h de cultivo de la línea celular MG-63 con 25 µM de Ibuprofeno mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. 112 RESULTADOS Tabla 14. Expresión del antígeno CD86 tras 24h de incubación con AINEs, mediante citometría de flujo. Tratamiento % de expresión CD86 Intensidad de fluorescencia m sd p m sd p Control 6.62 1.55 --- 27.14 1.70 --- Indometacina 16.56 1.55 0.001 23.35 2.77 0.114 Diclofenaco 9.68 2.44 0.141 26.08 1.98 0.521 Nimesulida 6.30 1.92 0.835 25.79 1.76 0.395 Paracetamol 29.81 3.46 <0.001 23.63 1.80 0.070 Ibuprofeno 41.11 4.59 <0.001 19.94 0.91 <0.01 m=media; sd=desviación típica f. Efecto de los AINEs sobre el perfil antigénico de la línea MG-63: expresión del antígeno HLA-DR. La molécula de Clase II que codifica el Sistema Principal de Histocompatibilidad HLA-DR y que juega un papel clave en el proceso de presentación del antígeno, vio incrementada su expresión tras el tratamiento con los distintos AINEs, salvo en los cultivos realizados en presencia de nimesulida, traduciéndose la acción, como podemos observar en la tabla 15 y figuras 67-71, en un incremento del porcentaje de expresión del marcador. Con respecto a la intensidad de fluorescencia, ésta disminuyó significativamente en los tratamientos con indometacina, paracetamol, diclofenaco e ibuprofeno a la dosis y tiempo ensayados. 113 RESULTADOS Fig.67.- Histograma de fluorescencia de la expresión Fig.68.-Histograma de fluorescencia de la expresión del Antígeno HLA tras 24h de cultivo de la línea celular del Antígeno HLA tras 24h de cultivo de la línea celular MG-63 con 10 µM de Indometacina mediante citometría MG-63 con 10 µM de Nimesulida mediante citometríade flujo.Grupo control=Azul; Tratamiento=Rojo. de flujo. Grupo control=Azul; Tratamiento=Rojo. Fig.69.- Histograma de fluorescencia de la expresión Fig.70.-Histograma de fluorescencia de la expresión del Antígeno HLA tras 24h de cultivo de la línea celular del Antígeno HLA tras 24h de cultivo de la línea celular MG-63 con 25 µM de Paracetamol mediante citometría MG-63 con 10 µM de Diclofenaco mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. de flujo. Grupo control=Azul; Tratamiento=Rojo. 114 RESULTADOS Fig.71.- Histograma de fluorescencia de la expresión del Antígeno HLA tras 24h de cultivo de la línea celular MG-63 con 25 µM de Ibuprofeno mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. Tabla 15. Expresión del antígeno HLA-DR tras 24h de incubación con AINEs, mediante citometría de flujo. Tratamiento % de expresión HLA-DR Intensidad de fluorescencia m sd p m sd p Control 5.93 1.60 --- 31.10 3.53 --- Indometacina 13.32 2.71 0.01 21.55 1.23 0.01 Diclofenaco 10.84 2.68 0.053 18.36 2.65 <0.01 Nimesulida 5.45 1.24 0.703 24.26 3.56 0.078 Paracetamol 11.75 3.18 <0.05 18.68 1.35 <0.01 Ibuprofeno 14.02 3.49 <0.01 22.28 2.91 <0.05 m=media; sd=desviación típica V. Efecto de los AINEs sobre la capacidad fagocítica de la línea MG-63 Uno de los objetivos trazados en el presente trabajo es analizar el efecto de los distintos AINEs estudiados sobre un parámetro funcional poco estudiado de los 115 RESULTADOS osteoblastos como es la capacidad fagocítica, utilizándose como población celular la línea de osteosarcoma MG-63. Para ello, las células fueron tratadas con la dosis de AINE seleccionada durante 24 horas, como queda recogido en el correspondiente apartado de material y métodos de esta memoria. Los resultados obtenidos se muestran en la tabla 16. Como podemos observar, el tratamiento produjo un descenso de la capacidad fagocítica cuando se trató con paracetamol, diclofenaco e ibuprofeno (figuras 72-74) respectivamente, sin embargo, el tratamiento con indometacina o nimesulida, no afectó de forma significativa a la capacidad fagocítica de esta población en las condiciones de trabajo señaladas (figuras 75 y 76) respectivamente. Tabla 16. Modulación de la capacidad fagocítica de la línea celular MG-63 tras su tratamiento con diferentes AINEs determinado mediante citometría de flujo. % de expresión Intensidad de fagocitosis fluorescencia Tratamiento m sd p m sd p Control 97.21 1.33 --- 127 42.50 --- Indometacina 98.54 0.47 0.178 105 3.46 0.422 Diclofenaco 54.37 12.48 <0.01 105 12.28 0.438 Nimesulida 98.77 0.68 0.146 116.66 10.21 0.703 Paracetamol 51.25 7.26 <0.001 106.66 7.63 0.461 Ibuprofeno 30.71 3.51 <0.001 73 4.58 0.094 116 RESULTADOS Fig.72.- Histograma de fluorescencia de la expresión Fig.73.-Histograma de fluorescencia de la expresión de la capacidad fagocítica de la línea celular MG-63 de la capacidad fagocítica de la línea celular MG-63 tras su tratamiento con 25 µM de Paracetamol mediante tras su tratamiento con 10 µM de Diclofenaco mediante citometría de flujo. Grupo control=Azul;Tratamiento=Rojo. citometría de flujo. Grupo control=Azul;Tratamiento=Rojo Fig.74.- Histograma de fluorescencia de la expresión de la capacidad fagocítica de la línea celular MG-63 tras su tratamiento con 25 µM de Ibuprofeno mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. Fig.75.- Histograma de fluorescencia de la expresión Fig.76.-Histograma de fluorescencia de la expresión de la capacidad fagocítica de la línea celular MG-63 de la capacidad fagocítica de la línea celular MG-63 tras su tratamiento con 10 µM de Indometacina mediante tras su tratamiento con 10µM de Nimesulida mediante citometría de flujo. Grupo control=Azul; Tratamiento=Rojo. citometría de flujo.Grupo control=Azul; Tratamiento=Rojo 117 RESULTADOS VI. Efecto de los AINEs sobre la síntesis de osteocalcina de la línea MG-63 La osteocalcina es una proteína que se encuentra exclusivamente en el hueso, representando del 10% al 20% de las proteínas no colagénicas del hueso. La función de la osteocalcina, in vivo, es desconocida aunque su afinidad por los constituyentes minerales del hueso implica un papel en su formación. Por ésto, la osteocalcina es un indicador de utilidad del recambio óseo y paralelamente de la maduración del osteoblasto. Con objeto de valorar el efecto de los AINEs sobre el proceso de diferenciación del osteoblasto, hemos cuantificado la osteocalcina secretada al medio de cultivo tras el tratamiento durante 24 horas con los AINEs objeto de nuestro estudio a la dosis establecida en el correspondiente apartado de material y métodos. Los resultados obtenidos se muestran en la tabla 17 y figura 77. Como podemos observar los distintos AINES, salvo la indometacina, disminuyen los niveles de osteocalcina, pero dada la alta desviación obtenida, solo el tratamiento con paracetamol mostró un efecto muy significativo, efecto que se tradujo en un descenso de los niveles de osteocalcina. Tabla 17. Determinación cuantitativa de osteocalcina tras la incubación de la línea MG-63 con diferentes AINEs durante 24h de incubación expresado en pg/ml x104 células. Tipo de tratamiento Media Desviación típica p Control 2.6 1.9 --- Indometacina 2.3 3.3 0.852 Diclofenaco 1.1 1.7 0.251 Nimesulida 1.4 1.6 0.384 Paracetamol 0.5 0.5 <0.05 Ibuprofeno 1.5 2.2 0.429 118 RESULTADOS 24 horas osteocalcina pg/mlx10 céls 4 6 5 Control Indometacina 4 Ibuprofeno 3 Nimesulida 2 Diclofenaco Paracetamol 1 0 Tipos de AINEs Fig. 77. Efecto de diferentes AINEs sobre la determinación cuantitativa de osteocalcina en la línea celular MG-63 tras 24 horas de incubación. 119 RESULTADOS 120 DISCUSIÓN V. DISCUSIÓN: I. CARACTERIZACIÓN ANTIGÉNICA Y CAPACIDAD FAGOCÍTICA DE LA LÍNEA DE OSTEOSARCOMA HUMANO MG-63 1. Expresión antigénica de la línea celular de osteosarcoma, MG-63 La función más conocida de los osteoblastos, es la de sintetizar los componentes de la matriz ósea y controlar la actividad de resorción de los osteoclastos. Los productos secretados, son los responsables de mantener un equilibrio complejo de relación con los osteoclastos y, por lo tanto, entre la formación y la resorción. Recientemente, se ha demostrado que estas células también poseen funciones asociadas al sistema inmune; como la capacidad fagocítica, la estimulación de los linfocitos T o la síntesis de citoquinas (Ruiz, Perez, VallecilloCapilla & Reyes-Botella, 2003; Stanley, Vandort, Motyl, Endres & Fox, 2006; Lisignoli et al., 2003; Rifas, Arackal & Weitzmann, 2003). Diversos estudios muestran que los osteoblastos expresan antígenos CD10 y CD13, moléculas con actividad aminopeptidasa, clásicamente asociada con las células del linaje mielomonocítico (Indig, Benayahu, Fried, Wientroub & Blumberg, 1990; Howell, Caswell, Kenny & Turner, 1993; Reyes-Botella, Montes, AbadíaMolina, Vallecillo-Capilla & Ruiz, 1999), y antígenos de superficie implicados en la activación de células inmunes, como el CD44 y CD54 (Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2000; Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2002a; Nakamura, Kenmotsu, Sakai & Ozawa, 1995; Indovina, Ferrante, Rainaldi & Santini, 2006), la molécula de clase II, HLA-DR y HLA-DQ (Skjodt, Hughes, Dobson & Russell, 1990; Reyes-Botella, Montes, VallecilloCapilla, Olivares & Ruiz, 2000), y moléculas coestimuladoras encargadas de la presentación de antígenos como el CD80 y CD86 (Reyes-Botella, Montes, 121 DISCUSIÓN Vallecillo-Capilla, Olivares & Ruiz, 2002a). García-Martínez y cols. en el año 2006 (Garcia-Martinez, Reyes-Botella, Aguilera-Castillo, Vallecillo-Capilla & Ruiz, 2006) investigaron la presencia de estos antígenos en cortes de tejido óseo y detectaron la expresión positiva de los antígenos CD10, CD44 y fosfatasa alcalina en osteoblastos, una ligera o moderada expresión en el antígeno CD54 y una expresión variable de los antígenos CD80 y HLA-DR. La importancia de estos resultados radica, en que al no utilizar suero bovino fetal para el cultivo de las células, se elimina el sesgo de la posible modulación de los factores hormonales y/o factores de crecimiento presentes en el mismo sobre la expresión antigénica. Los resultados obtenidos en nuestro estudio, demuestran que la línea MG-63, presenta un perfil antigénico equivalente al descrito en osteoblastos humanos en cultivos primarios obtenidos a partir de muestras de tejido óseo; sin embargo, no se detectó la expresión del antígeno HLA-DR, molécula implicada directamente en la presentación de antígenos, función atribuida a los osteoblastos (Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2000; Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2002a). La expresión positiva de los antígenos CD10 y CD13, nos hace pensar, que estas moléculas desempeñan a nivel óseo un papel múltiple contribuyendo a la formación y reparación ósea (Blair, Sidonio, Friedberg, Khan & Dong, 2000; Karsdal, Andersen, Bonewald & Christiansen, 2004; George et al., 2004), o bien, participando en funciones de carácter inmunológico (Santos, Langner, Herrmann & Riemann, 2000) (Larsen, Pedersen, Buus & Stryhn, 1996; Riemann, Kehlen & Langner, 1999), ya que, estos enzimas se ven implicados en ambas funciones y, a su vez, estan atribuidas a la población objeto de nuestro estudio. El antígeno CD21, es un marcador específico de las células foliculares dendríticas, que se expresa en el 100 % de los osteoblastos de cultivos primarios 122 DISCUSIÓN en una alta densidad. Dicha molécula se detectó en el 80% de las células analizadas de la línea MG-63. El CD44, se expresó de forma positiva en las células tumorales de osteosarcoma en el 85% de los casos. Es una molécula que ha sido descrita en células osteoblásticas, pero se discrepa sobre el estadio de diferenciación en que es expresada (Kennel, Lankford, Foote, Shinpock & Stringer, 1993; Hughes, Salter & Simpson, 1994). Unos autores describen su expresión sólo en osteocitos, mientras que otros, indican ya su presencia en osteoblastos (Nakamura et al., 1998; Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz 2000; Aubin, Liu, Malaval & Gupta, 1995). El uso de diferentes metodologías, podría explicar las discrepancias entre unos resultados y otros. El antígeno CD54, es una glicoproteína de la familia de las inmunoglobulinas expresada constitutivamente en el endotelio, en algunos linfocitos y monocitos y sobre otros muchos tipos de células tras la estimulación con IL-1, TNF-α, IFN-γ y LPS (lipopolisacáridos) (Hubbard & Rothlein, 2000). En nuestro estudio, este antígeno se detectó en el 100% de la población; sin embargo, tanto en osteoblastos humanos procedentes de cultivos primarios (Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2000; Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2002a), como en osteoblastos presentes en cortes de tejido óseo (Garcia-Martinez, Aguilera-Castillo, VallecilloCapilla & Ruiz, 2006), este marcador solo se detectó en parte de la población estudiada. Trabajos previos de nuestro grupo de investigación, demuestran que el TGFβ1 produce un descenso significativo de la expresión de CD54 en la membrana celular de los osteoblastos procedentes de cultivos primarios, sin embargo, otras biomoléculas como la IL-1, el LPS o el IFN-γ, producen un incremento en la expresión de este antígeno (Perez, Arroyo-Morales, ReyesBotella & Ruiz, 2006). 123 DISCUSIÓN De igual modo, la expresión del CD54, se vio modulada por el tratamiento con IFN-γ, en la línea celular SaOs-2 de osteosarcoma, sin embargo, su expresión fue constitutiva en las líneas celulares hFOB1.19, la cual, es una línea transformada de osteoblastos fetales y en la línea NHOst de osteoblastos humanos (Stanley, Vandort, Motyl, Endres & Fox, 2006). Lisignoli y cols. en el año 2004 (Lisignoli et al., 2004), demostraron que las citocinas proinflamatorias, el TNF-β y el IFN-γ, aumentan la expresión de la molécula CD54, sin embargo, en los osteoblastos sin tratamiento, se observó una baja expresión. Tanaka y cols. (Tanaka et al., 1995; Tanaka et al., 1998; Tanaka et al., 2000), en contraposición a los resultados anteriores, encontraron una alta expresión del CD54 en celúlas no tratadas. La discrepancia entre estos resultados, puede deberse a que Lisignoli y cols. (2004) (Lisignoli et al., 2004), utilizaron el método enzimático de Robey y Termine (1985) para obtener el aislamiento de los osteoblastos, el cual selecciona células maduras que se dividen lentamente o no todas. En cambio, en los trabajos del grupo de Tanaka y cols. (Tanaka et al., 1995; Tanaka et al., 1998; Tanaka et al., 2000), probablemente se seleccionaran células con capacidad para emigrar fuera del explante óseo y con una alta capacidad proliferativa, como se demuestra en el estudio de Sottile y cols. del 2002 (Sottile, Halleux, Bassilana, Keller & Seuwen, 2002). Así, Lisignoli y cols. en el año 2004 (Lisignoli et al., 2004), deducen que el marcador CD54 está altamente expresado en precursores de osteoblastos humanos (células madre mesenquimáticas) y desaparece durante la maduración y diferenciación de estas células. Sólo en condiciones inflamatorias se restaura su expresión en osteoblastos maduros. El aumento del CD54 bajo condiciones inflamatorias, afirmaría el reclutamiento de los linfocitos T en osteoblastos e induciría un aumento en su proliferación. 124 DISCUSIÓN Para que las células T lleguen a activarse, no solo tienen que reconocer al antígeno, sino que también necesitan recibir una señal coestimuladora o señales de las células presentadoras de antígeno. Se conocen muchas moléculas que son importantes en este proceso, entre las que se incluyen al CD80 y al CD86. En nuestra investigación con la línea MG-63, estas moléculas se detectaron, aunque no se expresaron en el 100% de las células analizadas, lo que guarda relación con la expresión mostrada en osteoblastos de cultivos primarios y en osteoblastos de cortes de tejidos (Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2002a; Garcia-Martinez, Reyes-Botella, Aguilera-Castillo, Vallecillo-Capilla & Ruiz, 2006). En contraposición a estos resultados, encontramos que Stanley y cols. en el año 2006 (Stanley, Vandort, Motyl, Endres & Fox, 2006), no encontraron una expresión significativa de estas dos moléculas. A la vista de tales resultados, sugerimos que los antígenos CD10, CD13 y CD44 son constitutivos y otros, como el CD54, CD80 y CD86, o bien, son modulables, dependiendo de la presencia de distintos factores de crecimiento, citoquinas y hormonas a nivel del tejido óseo, o bien, dependen del estado de diferenciación o maduración celular, lo que a su vez, dependen de la presencia de esos mismos factores reguladores. Algunos de los antígenos modulables, están directamente implicados en la capacidad inmunológica atribuida a estas células y estarían a su vez, en relación directa con el grado de maduración de la célula y/o grado de activación celular. En condiciones fisiológicas, cabría esperar que la célula siga su proceso de diferenciación y participe en la formación de hueso; sin embargo, en condiciones inflamatorias el papel funcional podría ser inmunológico, deteniéndose la maduración o diferenciación de las células osteoblásticas. 2. Capacidad fagocítica de la línea celular de osteosarcoma, MG-63 La expresión de antígenos implicados en respuestas de tipo inmunológico en los osteoblastos, ha promovido distintos estudios funcionales. 125 DISCUSIÓN El estudio de la capacidad fagocítica de la línea MG-63 analizada mediante citometría de flujo, reveló que el 100% de la población estudiada presentaba dicha capacidad funcional. De dichos resultados, también se deduce, que las células no solo fagocitan, sino que, el número de partículas por célula es elevado, dada la alta intensidad de fluorescencia presentada. Estos datos fueron corroborados mediante el estudio por microscopía electrónica de transmisión. Cuando utilizamos bolitas de látex, como partículas diana, y la técnica de microscopía electrónica, pudimos visualizar claramente el fagosoma en las células y en cuyo interior se observaba la presencia de un número elevado de partículas por célula; el cual, era generalmente superior a dos. Estos resultados corroboran los obtenidos en otros estudios (Pioletti, Takei, Kwon, Wood & Sung, 1999; Heinemann et al., 2000; Lohmann et al., 2000), en cultivos primarios de osteoblastos humanos y de ratas. Estos autores utilizaron polímeros sintéticos y partículas de desecho de material protésico de diferente composición. Nuestro estudio demuestra que las partículas fagocitadas, se incorporaban al citoplasma y no al núcleo como demuestran otros autores (Heinemann et al., 2000; Lohmann et al., 2000). Morfológicamente, las células presentaban modificaciones pero no aparecían signos evidentes de apoptosis o necrosis celular, como se describe en otros estudios (Pioletti, Takei, Kwon, Wood & Sung, 1999). Estos resultados sugieren, que durante la diferenciación celular osteoblástica, una subpoblación de las células, podría involucrarse en funciones inmunes, tales como la fagocitosis y la activación de células T. Cuando las partículas utilizadas en el ensayo de fagocitosis fueron microorganismos, el fagosoma se observaba siempre que el proceso de fijación de la muestra tras la incubación de ambas células no fuese superior a los 90 minutos, ya que periodos superiores dificultaban su observación. 126 DISCUSIÓN Cabe también señalar, que en el caso de microorganismos, no se detectaron fagosomas que hubiesen fagocitado mas de un microorganismo, hecho éste, igualmente descrito en osteoblastos humanos de cultivos primarios (Ruiz, Perez, Vallecillo-Capilla & Reyes-Botella, 2003). Estos datos nos sugieren, que esta capacidad funcional, podría guardar relación con el grado de diferenciación o maduración celular; ya que, a diferencia de los resultados obtenidos con las células tumorales de la línea MG63, los osteoblastos procedentes de cultivos primarios, presentan esta capacidad funcional solo en parte de la población (Ruiz, Perez, Vallecillo-Capilla & Reyes-Botella, 2003). Como propone Heinemann y cols. en el año 2000 (Heinemann et al., 2000), la situación in vitro, tal vez, refleje la situación, in vivo, lo cual es demostrado posteriormente por Schrum y cols (Schrum et al., 2003a) que observan que la presencia de Staphylococcus aureus y Salmonella, dos agentes causales comunes de infecciones óseas e infecciones articulares, en cultivos primarios de osteoblastos murinos y humanos, produce un incremento de la expresión de moléculas de clase II, lo que permitiría activar linfocitos T nativos de una manera específica de antígeno. De igual modo, en otro artículo de estos mismos autores (Schrum et al., 2003b) se describe un incremento en la expresión de la molécula CD40, que es una molécula coestimuladora de la activación del linfocito T. Todos estos datos junto a los descritos por nuestro grupo de investigación y a los aquí presentados, ratifican nuestra hipótesis de que los osteoblastos cuando están en contacto con microorganismos y materiales endoprotésicos, desarrollan funciones inmunológicas para eliminarlos. Esta actividad, puede conllevar cambios morfológicos, antigénicos y bioquímicos. Esta nueva función, puede ser importante en algunas situaciones como en procesos inflamatorios que provocan una liberación de ciertas citocinas. Éstas, a su vez, pueden modular y acentuar la expresión de determinados antígenos de los osteoblastos y, por tanto, su papel funcional inmunológico (presentación de antígenos y fagocitosis), el cual, podría parcialmente, detener el proceso de diferenciación y maduración del osteoblasto y, por tanto, la formación y reparación ósea. Este proceso, consideramos que es un mecanismo de emergencia y no un mecanismo fisiológico. 127 DISCUSIÓN II.- EFECTO DE LOS AINES SOBRE LA LÍNEA CELULAR DE OSTEOSARCOMA HUMANO, MG-63. El progresivo envejecimiento de la población y la incorporación de nuevas indicaciones para los antiinflamatorios no esteroideos, ha favorecido que este grupo de fármacos se encuentre entre los más consumidos en todo el mundo, a pesar de que su utilización no está exenta de efectos secundarios, pudiendo aparecer dichos efectos adversos hasta en el 25% de los pacientes. Los antecedentes bibliográficos revelan claramente que los AINEs, pueden ejercer su acción sobre el tejido óseo, y más concretamente, sobre los osteoblastos, células responsables de la formación y reparación ósea. Esta acción, se ha traducido fundamentalmente, en una disminución de la capacidad proliferativa; aunque hay que señalar que son muy pocos los AINEs que hasta la fecha se han estudiado en este sentido (Murnaghan, Li & Marsh, 2006; Gerstenfeld et al., 2003; Brown, Saunders, Kirsch, Donahue & Reid, 2004). En la presente Tesis Doctoral nos hemos planteado entre nuestros objetivos, el estudio de la acción de los AINEs, que se detallan a continuación, sobre distintos parámetros celulares y funcionales de los osteoblastos humanos; células que juegan un papel importante en el proceso de reparación ósea; tales como, proliferación, diferenciación celular, perfil antigénico y capacidad fagocítica, con objeto de establecer un criterio de elección a la hora de su uso clínico en el tratamiento del tejido óseo. Los antiinflamatorios utilizados en este estudio han sido la indometacina, la nimesulida, el diclofenaco, el paracetamol y el ibuprofeno, bien, por que hay algún dato que haga referencia a su efecto negativo sobre la capacidad proliferativa del osteoblasto, o bien, por que son comúnmente empleados para el alivio del dolor e inflamación en la práctica clínica, sobre todo en Odontología, tras intervenciones quirúrgicas que afectan al hueso, como las extracciones dentales o quistectomías, 128 DISCUSIÓN donde normalmente se requiere una rápida recuperación del hueso para su pronta rehabilitación, o tras la colocación de implantes dentales donde se precisa un rápido crecimiento óseo en torno a las fijaciones para asegurar su oseointegración (Esplugues y Barrachina, 1993). En todos los ensayos las dosis de antiinflamatorio utilizadas se encontraban dentro del rango terapéutico utilizado en la práctica diaria. Así, las dosis diarias recomendadas de estos AINEs son para la indometacina 200 mgr; para el diclofenaco 225 mgr; para la nimesulida 100-200 mgr; para el paracetamol 3.000 mgr y para el ibuprofeno 2.000 mgr. El pico medio de la concentración en el plasma tras la administración oral de 50 mgr de indometacina resultó ser de 2 µg/ml (Oberbauer, Krivanek & Turnheim, 1993), tras 50 mgr de diclofenaco 1.5 µg/ml (Todd & Sorkin, 1988), con 100 mgr de nimesulida 3 µg/ml (Panara et al., 1998), 1.000 mgr de paracetamol 15 µg/ml (Thummel et al., 2000) y tras 400 mgr de ibuprofeno 17.3 µg/ml (Stangier, Su, Fraunhofer & Tetzloff, 2000). Según estos datos, las concentraciones teóricas terapéuticas de estos AINEs para los cultivos celulares, deberían aproximarse en el caso de la indometacina, diclofenaco y nimesulida a 10 µM, y en el caso del paracetamol y el ibuprofeno a 25 µM, por ello, hemos utilizado 1, 10 y 50 µM para la indometacina, nimesulida y diclofenaco y 5, 25 y 75 µM para el paracetamol y el ibuprofeno. Dichas dosis fueron ajustadas a una densidad celular predeterminada y similar en todos los casos estudiados. Para llevar a cabo el estudio, hemos utilizado como población diana, la línea celular tipificada de osteosarcoma humano, MG-63, la cual, está considerada como precursora de osteoblastos, o como una línea que posee las características comunes a los osteoblastos (Prouillet, 2004; Nayab, Jones & Olsen, 2005) . El uso de una línea tumoral presenta ciertas ventajas con respecto al uso de líneas celulares establecidas por primo cultivo a partir de tejido óseo sano, tales como, su pureza celular, su capacidad proliferativa ilimitada y su homogeneidad de 129 DISCUSIÓN respuesta. Sin embargo, presentan una desventaja y es que los resultados con ellas obtenidos pueden ser menos extrapolables a situaciones, in vivo, que los obtenidos con cultivos primarios. 1. Efecto de los AINEs sobre la proliferación celular de la línea de osteosarcoma humano, MG-63. El efecto de los antiinflamatorios sobre la proliferación celular se evaluó a corto plazo, 24 y 48 horas. Nuestro interés se centraba en valorar este efecto en estadios tempranos; ya que, como hemos comentado con anterioridad, son muchas las intervenciones quirúrgicas, que cursan con pérdida de tejido óseo. Este tejido, conviene recuperarlo de manera rápida. En el caso concreto de las intervenciones odontológicas, por ejemplo, se colocan implantes para su posterior rehabilitación oral. Si bien, en condiciones de salud el tejido óseo en sí tiene capacidad de regenerarse, nos interesaba conocer en qué medida el empleo de antiinflamatorios en las primeras etapas de cicatrización podrían enlentecer el fenómeno de regeneración ósea. Los resultados obtenidos muestran un efecto inhibidor significativo de la capacidad proliferativa de la línea MG-63 tras el tratamiento con 1 y 10 µM de indometacina, nimesulida y diclofenaco y con 5 y 25 µM de paracetamol durante 24 h. Este efecto, sin embargo, no se observó cuando el tratamiento se prolongó 48 h. Estos resultados se hallan en consonancia con los obtenidos por otros autores que muestran el efecto negativo que presentan algunos AINES sobre la capacidad de crecimiento del osteoblastos. Ho y cols en diferentes estudios (Ho, Chang & Wang, 1995; Ho, Chang & Wang, 1998; Ho, Chang, Chuang, Hsu & Wang, 1999), ponen claramente de manifiesto que el ketorolaco disminuye el crecimiento de los osteoblastos, la formación del callo óseo y la mineralización de la matriz. De igual modo, se ha observado que la indometacina inhibe la proliferación de los 130 DISCUSIÓN osteoblastos de manera dosis-dependiente, in vitro. Dichos estudios se realizaron tratando durante 48 horas a concentraciones de 3x10-7 M y 3x10-9 M osteoblastos en cultivo de origen humano (Evans & Butcher, 2004); y durante 24 horas a dosis de 0.01, 0.1, 1, 10 y 100 µM osteoblastos en cultivo aislados de calvaria de ratón (Ho, Chang, Chuang, Hsu & Wang, 1999). El paracetamol, según Arias y Márquez-Orozco (Arias & Marquez-Orozco, 2006), es el AINE de elección como analgésico en el tratamiento del dolor asociado a las ortodoncias, al no afectar a la resorción ósea ni al desplazamiento dental, sugerencia realizada con anterioridad por otros autores (Roche, Cisneros, & Acs, 1997; Kehoe, Cohen, Zarrinnia & Cowan, 1996). En este estudio realizado en ratas, se analizaron junto al paracetamol, otros AINEs como la aspirina y el ibuprofeno, que sí afectaron a la resorción ósea y provocaron desplazamiento dental, mediante una disminución del crecimiento de los osteoclastos, acción que es atribuida a la inhibición de la secreción de PGs. Sin embargo, nuestros resultados sí muestran un efecto del paracetamol sobre el crecimiento del osteoblasto; hay que considerar que las condiciones del estudio son muy diferentes a las nuestras; ya que, nuestro estudio es un ensayo, in vitro, realizado sobre células humanas transformadas y no se ha valorado en ningún momento el efecto sobre los osteoclastos. La COX-2 es una de las enzimas implicadas en el mecanismo de acción de algunos AINES. Diferentes estudios evidencian el papel crucial que desempeña esta enzima en la prevención y el tratamiento de las alteraciones inflamatorias, así como sobre diferentes aspectos de la carcinogénesis. La COX-2 está sobreexpresada en diferentes tumores malignos como en el tumor de colon (Eberhart, Coffey, Radhika & Giardiello, 1994), de próstata (Gupta, Srivastava, Ahmad, Bostwick & Mukhtar, 2000), de mama (Hwang, Scollard, Byrne & Levine, 1998), de pulmón (Watkins, Lenzo, Segal, Garlepp & Thompson, 1999) y en el de hueso (Naruse, Nishida, Hosono & Ishiguro, 2006). Se ha observado que los inhibidores selectivos de la COX-2, disminuyen la formación, el crecimiento y las 131 DISCUSIÓN metástasis de tumores experimentales (Yao et al., 2003; Sheng et al., 1997). Se ha llegado ha establecer una conexión causa-efecto entre la COX-2 y la formación de tumores mediante estudios genéticos (Liu et al., 2001). En este mismo sentido, se ha observado en ratones transgénicos, que poseen una sobreexpresión de la COX-2 en la glándula mamaria, presentan un mayor desarrollo de hiperplasias, displasias y metástasis de esta glándula (Liu et al., 2001). En esta misma línea se ha observado que el meloxicam posee un efecto inhibitorio del crecimiento sobre células cancerígenas de colon (Goldman et al., 1998) y de pulmón (Tsubouchi et al., 2000). Dado que el mecanismo de acción de algunos AINEs es mediante la inhibición de la COX-2, ello podría explicar que determinados AINES puedan presentar un efecto inhibitorio de la proliferación de aquellas poblaciones con sobreexpresión de dicho enzima. Incluso, hay distintos estudios que establecen una correlación inversa entre el riesgo de padecer cáncer de colon y el consumo regular de inhibidores de la COX2 (Thun, Henley & Patrono, 2002; Fosslien, 2000). A nivel del tejido óseo, los AINEs, parecen ejercer una acción similar a la descrita en otras poblaciones tumorales. El diclofenaco, inhibidor preferencial de la COX-2, disminuye el crecimiento osteoblástico, in vitro, en la línea celular de osteosarcoma humano, SaOs, tras 24 horas de incubación (Kaspar et al., 2005). Pero este efecto observado en líneas tumorales ha sido igualmente descrito en cultivos primarios de osteoblastos humanos, tras tratamientos a más largo plazo con dosis de 1.6µg/ml y 6µg/ml durante 9 días (Matziolis, Rau, Cléber, Erli & Para, 2002; Sell et al., 1999), donde el diclofenaco mostró una acción negativa sobre la capacidad proliferativa de esta población celular. Estos resultados guardan estrecha relación con los obtenidos en nuestro estudio, así como, con los resultados recientemente descritos (Krischak et al., 2007a; Krischak, Augat, Claes, Kinzl, & Beck, 2007b) en ensayos, in vivo, en animales de experimentación; en los que describen la alteración en la maduración del callo perióstico en osteotomías y la inhibición de la proliferación y migración de los osteoblastos, lo que condicionó 132 DISCUSIÓN el retraso en la recuperación de fracturas tras el tratamiento con diclofenaco. Utilizando la línea de osteosarcoma humano MG-63, que es la línea objeto de nuestro estudio, se ha observado que el tratamiento con celecoxib a una concentración entre 1 y 100 µM, inhibe la proliferación de forma dosis dependiente (Wang et al., 2004), y el tratamiento con meloxicam, no solo disminuye la proliferación celular sino que incluso afecta otros parámetros celulares como la capacidad invasiva del tumor (Naruse, Nishida, Hosono & Ishiguro, 2006). Otro de los AINES que ha sido objeto de nuestro estudio es el ibuprofeno. En este caso, el efecto mostrado sobre la capacidad proliferativa de la línea MG-63 ha sido muy diferente al obtenido con los restantes AINES analizados. De modo que, el tratamiento durante 24 horas no afectó a la proliferación celular e incluso cuando se prolongó durante 48 horas con las dosis de 5 y 25 µM, produjo un aumento significativo en el crecimiento celular. Si bien, cuando utilizamos dosis del orden de 75 µM el efecto observado fue otro; ya que, a las 24 h se produjo un descenso de la proliferación y en tratamientos a las 48 h no se detecto efecto alguno. Los resultados obtenidos con el ibuprofeno en nuestro estudio sobre la capacidad proliferativa del osteoblasto, a pesar de no estar en consonancia con lo observado por los otros AINEs, sí guardan relación con ciertos estudios que demuestran que individuos tratados con ciertos AINEs derivados del ácido propiónico, entre los que se incluye el ibuprofeno, han aumentado la masa ósea en relación con un grupo control (Morton, Barrett-Connor & Schneider, 1998). Otros autores sugieren, que el flurbiprofen nitroxybutilester (HCT1026), un fármaco en donde se combina el efecto inhibidor de la síntesis de PGs, típico de los AINES, con la capacidad de liberar óxido nítrico (NO), como los nitratos orgánicos, a los que se les conoce como antiinflamatoros nitrosilados (NO-AINEs), posee un efecto protector frente a la perdida de hueso, tanto en humanos como en 133 DISCUSIÓN animales de experimentación. Estudios del efecto del HCT1026 sobre el metabolismo óseo, in vivo, muestran que dicho fármaco posee un papel protector frente a la perdida de hueso inducida por ovariectomía en ratones, efecto que es atribuido a la inhibición de la resorción ósea osteoclástica. Igualmente se describe que el tratamiento, in vitro, con dicho fármaco, en cocultivos de osteoblastos y osteoclastos de origen murino, inhibe la formación de osteoclastos y por tanto la resorción (Armour et al., 2001). Estos datos podrían, en parte, explicar los resultados obtenidos por nosotros en la línea celular MG-63 tras el tratamiento con ibuprofeno, ya que, este es un AINE del grupo de los derivados del ácido propiónico al igual que el flurbiprofen. Aunque hay que señalar que el efecto descrito, in vitro e in vivo, para el HCT1026, un NO-AINEs, fue mucho más potente significativamente que el tratamiento con flurbiprofen; e incluso, el efecto no era reproducible cuando se combinó el flurbiprofen con otra variedad de liberador de NO (Armour et al., 2001). Diversos estudios describen que el ibuprofeno, puede disminuir la proliferación de distintas líneas celulares tumorales mediante la inducción de apoptosis (Palayoor, Youmell, Calderwood, Coleman & Price, 1999; Zhang, Yu, Park, Kinzler & Vogelstein, 2000), pero en dichos estudios, se utilizan dosis del orden del 0.2 a 2 mM, concentraciones muy superiores a las aplicadas en nuestro estudio, lo que explicaría que a la dosis más elevada, 75 µM, este AINE tenga un efecto contrario sobre la proliferación de la línea MG-63. El hueso hay que encuadrarlo como un órgano dinámico que está en un proceso continuo y secuencial de degradación y reparación, controlado por un balance equilibrado entre la formación y la resorción ósea. La homeostasis esquelética se mantiene por muchos factores entre los que incluimos las PGs (Kawaguchi, Pilbeam, Harrison & Raisz, 1995). Éstas, por tanto, modulan la proliferación osteoblástica y el proceso de diferenciación y maduración. Según las dosis utilizadas, pueden disminuir o estimular el crecimiento en osteoblastos (Raisz, Pilbeam & Fall, 1993), y, a su vez, son inhibidas por los AINEs. Ésto, 134 DISCUSIÓN podría justificar en parte, la gran variabilidad de resultados obtenidos en los estudios del efecto de los AINEs sobre el tejido óseo, los cuales, tal vez, puedan ser atribuidos parcialmente, al uso de diferentes tipos de células; a los protocolos utilizados en los cultivos de los osteoblastos, a las concentraciones de las drogas utilizadas, así como, al tiempo de incubación para el análisis de los resultados en cada caso. Aunque inicialmente se pensó que el posible mecanismo de acción de los AINES sobre el tejido óseo se debía a la inhibición de la síntesis de PGs, hay distintos datos que sugieren que el mecanismo a través del cual actúan los AINEs sobre la formación y resorción ósea, es independiente de la vía de las PGs (Ho, Chang, Chuang, Hsu & Wang, 1999; Armour et al., 2001; Naruse, Nishida, Hosono & Ishiguro, 2006). Diversos estudios realizados con líneas celulares procedentes de otros tejidos revelan que los AINEs producen la paralización del ciclo celular e inducen la apoptosis (Hanif et al., 1996; Piazza et al., 1997; Agarwal et al., 2003). Se han descrito diferentes vías para explicar el efecto apoptótico de los inhibidores de la COX-2, demostradas fundamentalmente en células de cáncer de colón. Así, el celecoxib puede inducir apoptosis, bien, por una vía dependiente de la COX-2, que causa activación de la capasa 3 y 9 junto con la liberación del citocromo c, o bien, por una vía independiente de la COX-2, a través del aumento de la expresión de la cilina A y B1 y disminución de la expresión de p21, Wafl y Kipl (Maier, Schilling, Schmidt, Geisslinger & Grosch, 2004). El ibuprofeno, un inhibidor no selectivo de la COX, también puede inducir apoptosis, en células de cáncer de próstata, por bloqueo de la fosforilación de distintos factores de transcripción. Concretamente, puede inhibir la activación constitutiva de NFkappaB y de IKKalpha en células de las líneas PC-3 y DU-145, y bloquear la activación estimulada de NF-kappaB en células LNCaP. Sin embargo, no inhibe directamente el factor de transcripción IkappaB-Kinasa α (Palayoor, Youmell, 135 DISCUSIÓN Calderwood, Coleman & Price, 1999). Otro mecanismo de apoptosis descrito con el ibuprofeno en células epiteliales transformadas, es inhibiendo la expresión de las proteínas antiapoptóticas de la familia Bcl-x, tales como Bax y Bcl-2 (Zhang, Yu, Park, Kinzler & Vogelstein, 2000). Todos estos datos, revelan que el mecanismo por el que los AINEs actuan disminuyendo la proliferación celular de distintas líneas celulares tumorales, es un mecanismo complejo en el que interfieren distintos factores, desde la inhibición de la síntesis de PGs, la inducción de apoptosis por diferentes vías e incluso por la alteración o detención del ciclo celular, junto con la dosis del AINE en cuestión. De igual modo, en las líneas de osteosacoma MG-63, HOS y U2-OS, se ha mostrado que el meloxicam inhibe la producción de PGE2, la proliferación y la capacidad invasiva de estas células, especialmente en la línea MG-63, la cual, tiene niveles relativamente más altos de COX-2. Pero solo altas concentraciones de meloxicam (100µM), causaron apoptosis y paralelamente, una mayor expresión de la proteína Bax, determinada por ensayos semicuantitativos de PCR en tiempo real (RT-PCR) de su ARNm. Sin embargo, en las otras líneas estudiadas, no se detectaron signos de apoptosis, ni siquiera a altas dosis. Estos datos sugirieron a sus autores que el efecto apoptótico del meloxican, podría ser el resultado de una interacción compleja entre la vía dependiente e independiente de la COX-2. Otros AINES, tales como la indometacina, el ketorolaco o el diclofenaco en cultivos de calvaria de rata, inhiben la proliferación, in vitro, por alteración de la cinética del ciclo celular y/o muerte celular, bien por necrosis o citotoxicidad o por apoptosis (Lee & Choi, 2005). No hemos de olvidar, que durante el remodelado óseo en condiciones fisiológicas, algunos osteoblastos se diferencian a células de “lining” y a osteocitos. Entre el 50-70% de los osteoblastos podrían no seguir alguna de estas vías y sucumbir por apoptosis. Diversos factores regulan el proceso para que haya un balance equilibrado entre la proliferación y la apoptosis, aquí juegan un papel clave los miembros de la familia Bcl-x. La proteína P53, 136 DISCUSIÓN también es una importante molécula apoptótica que regula la apoptosis y la detención del ciclo celular. Los resultados del presente estudio, sustentan nuestra hipótesis previa de que los AINEs actúan sobre el tejido óseo, y más concretamente, sobre los osteoblastos, demostrando que la indometacina, nimesulida, diclofenaco y paracetamol, disminuyen el crecimiento celular óseo, mientras que el ibuprofeno a dosis terapéuticas lo incrementa. Dada la trascendencia de estos datos, consideramos de interés, el ampliar el estudio a otros AINEs y profundizar en el estudio que nos permita determinar el mecanismo por el que dichos fármacos actúan aumentando o disminuyendo la formación de tejido óseo, dada la repercusión y trascendencia clínica que esto conlleva. 2. Efecto de los AINEs sobre la diferenciación celular en la línea de osteosarcoma humano, MG-63. Es bien sabido, que los osteoblastos producen colágeno tipo I, fosfatasa alcalina y osteocalcina. Dichas sustancia son asociadas con la maduración de la matriz y con la mineralización ósea, por lo que comúnmente son utilizados como marcadores de la diferenciación del osteoblasto (Lee & Choi, 2005; Choi, 2007). La expresión del colágeno tipo I, es considerado un marcador de la diferenciación inicial del osteoblasto (Stein & Lian, 1993), la actividad fosfatasa alcalina, es uno de los marcadores fenotípicos del osteoblasto y es considerada esencial para la mineralización (Bellows, Aubin & Heersche, 1991), y la osteocalcina, es la proteína no colagénica más abundante del hueso, cuya síntesis se incrementa en las últimas etapas de la diferenciación y maduración del osteoblasto (Aubin, Liu, Malaval & Gupta. 1995). De estos tres marcadores utilizados frecuentemente para el estudio de la diferenciación y maduración del osteoblasto, hemos seleccionado el de mayor interés dentro de nuestro estudio con la línea MG-63, que ha sido la síntesis de osteocalcina; ya que, los osteoblastos de esta línea celular, están considerados como los más pobremente diferenciados; y por tanto, utilizados con 137 DISCUSIÓN mas frecuencia en el estudio del efecto de distintas sustancias sobre la maduración del osteoblasto (Clover & Gowen, 1994). Los resultados obtenidos muestran, en general, una disminución de la síntesis de osteocalcina por las células de la línea MG-63, como consecuencia del tratamiento con los diferentes AINEs, pero solo el tratamiento con paracetamol a dosis terapéuticas, se mostró estadísticamente significativo. Estos datos, nos podrían sugerir que este fármaco detiene, de forma importante, la diferenciación del osteoblasto, pero hasta la fecha no conocemos la existencia de otros trabajos que hagan referencia al efecto de este o de otro AINE sobre alguno de los parámetros comúnmente utilizados para determinar la maduración osteoblástica. Ésto nos anima a seguir estudiando el efecto de los AINES sobre la diferenciación utilizando otros parámetros de medida. 3. Efecto de los AINEs sobre la expresión antigénica en la línea celular de osteosarcoma humano, MG-63. Los estudios que han permitido un mayor conocimiento del perfil antigénico de los osteoblastos humanos, se han realizado mayoritariamente por nuestro grupo de investigación, utilizando cultivos primarios y cortes de tejido. En la presente tesis, dichos datos se han complementado analizando una línea de osteosarcoma humano. Estas células, muestran una serie de marcadores constitutivos como las aminopeptidasas CD10 y CD13, el CD44 y la fosfatasa alcalina, junto a otros marcadores, entre los que se describe el CD21 de expresión intermedia y que solo han sido estudiado en cultivos primarios, mientras que hay otro grupo de marcadores expresado en menor porcentaje, pero de gran importancia, ya que parecen guardar relación con el grado de maduración celular y/o la presencia de ciertas citoquinas, como son el CD54, CD80, CD86 y HLA-DR (Reyes-Botella, Montes, Abadía-Molina, Vallecillo-Capilla & Ruiz, 1999; Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2000; Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2002a; Garcia-Martinez, Reyes-Botella, Aguilera-Castillo, 138 DISCUSIÓN Vallecillo-Capilla & Ruiz, 2006; Perez, Garcia-Martinez, Arroyo-Morales, ReyesBotella & Ruiz, 2006). Estos últimos marcadores, se han relacionado con la capacidad funcional recientemente atribuida a esta población como células presentadoras de antígeno, con actividad fagocítica y capacidad para estimular alogénicamente a los linfocitos T (Ruiz, Perez, Vallecillo-Capilla & Reyes-Botella, 2003). Debido a que el perfil antigénico puede guardar relación con el papel funcional de esta población, el estudio de los AINES se ha extendido al análisis de su posible efecto modulador sobre el perfil antigénico de la línea MG-63. Dicho estudio, se realizó utilizando una única dosis y tratamientos a corto plazo, ya que la mayoría de los estudios que analizan el efecto modulador sobre el perfil antigénico se realizan con tratamientos a 24 horas (Perez, Garcia-Martinez, Arroyo-Morales, Reyes-Botella & Ruiz, 2006; Ruiz, Reyes-Botella, Garcia-Martinez & Montes, 2004). En general, señalaremos que el tratamiento con los AINES estudiados no provocaron grandes cambios a nivel del porcentaje de expresión de los antígenos denominados constitutivos, tales como CD13 y CD44. El CD13 no varió tras el tratamiento y el CD44 aumentó ligeramente, aunque sí observamos cambios a nivel de la intensidad de fluorescencia en algunos ensayos. Con respecto al CD13, el tratamiento de la línea MG-63 con los distintos AINES se tradujo en un incremento significativo de la intensidad de fluorescencia en todos los casos. En estudios realizados en cultivos primarios de osteoblastos, igualmente, se detectó un incremento de la expresión de dichos marcadores cuando fueron tratados con citoquinas como IL-1, IL-2 e IFNγ, factores de crecimiento del tipo del TGF-β1, FGF-b, PDGF-BB o productos de origen bacteriano como el LPS (Perez, Garcia-Martinez, Arroyo-Morales, Reyes-Botella & Ruiz, 2006). 139 DISCUSIÓN La función más característica atribuida al antígeno CD44, es el mantenimiento de la homeostasis de los tejidos, a través de la conexión de distintos componentes de la matriz, como el ácido hialurónico, el condroitín sulfato y la osteopontina, hacia la superficie celular (Aruffo, Stamenkovic, Melnick, Underhill & Seed 1990; Weber, Ashkar, Glimcher & Cantor, 1996). Recientemente, se ha descubierto que el CD44, funciona como inhibidor de la pérdida ósea por procesos inflamatorios (Hayer et al., 2005). Esta molécula, aumentó su porcentaje de expresión por la acción del diclofenaco, paracetamol e ibuprofeno, aunque el diclofenaco disminuyó la intensidad de fluorescencia. El CD21, antígeno específico de las células foliculares dendríticas, aumentó su expresión ligeramente en todos los tratamientos, si bien, la intensidad de fluorescencia disminuyó tras el tratamiento con indometacina, diclofenaco y paracetamol. Hay que señalar, que este marcador presenta una menor expresión en los osteoblastos humanos en cultivos primarios, lo que puede tener relación, con el grado de maduración osteoblástica (Reyes-Botella, Montes, VallecilloCapilla, Olivares & Ruiz, 2002a), de modo que, a menor diferenciación, mayor expresión de este marcador, pero desconocemos hasta la fecha otros trabajos que nos permitan corroborar este planteamiento en relación al CD21. Sin duda, los antígenos en los que más centramos nuestra atención fueron los antígenos denominados modulables, los cuales, han sido relacionados por nuestro grupo de investigación con la capacidad funcional de esta población como célula inmunocompetente, así como, con el grado de maduración celular ( Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2000; Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2002a; Garcia-Martinez, Reyes-Botella, Aguilera-Castillo, Vallecillo-Capilla & Ruiz, 2006; Perez, Garcia-Martinez, ArroyoMorales, Reyes-Botella & Ruiz, 2006). Estos antígenos son el CD54, CD80, CD86 y el HLA-DR. 140 DISCUSIÓN Nuestros resultados, muestran que no hay cambios en la expresión del antígeno CD54 salvo en los tratamientos con indometacina y nimesulida, que ligeramente, pero de manera significativa, disminuyeron su expresión. Efectos parecidos han sido descritos tras el tratamiento de osteoblastos humanos en cultivo con TGFβ1, sin embargo, el tratamiento de esta población con citoquinas proinflamatorias, tales como TNF-β, IFN-γ e IL-1, o el propio LPS, aumentó su expresión (Lisignoli et al., 2004; Perez, Garcia-Martinez, Arroyo-Morales, ReyesBotella & Ruiz, 2006). En esta misma línea, ciertos autores deducen que el marcador CD54 está altamente expresado en precursores de osteoblastos humanos (células madre mesenquimáticas) y desaparece durante la maduración y diferenciación de estas células. Sólo en condiciones inflamatorias se restaura su expresión en osteoblastos maduros. El aumento del CD54 bajo condiciones inflamatorias, afirmaría el reclutamiento de los linfocitos T en osteoblastos e induciría un aumento en su proliferación (Lisignoli et al., 2004). En investigaciones con líneas tumorales de osteosarcoma, se ha observado que la expresión del CD54, en la línea celular SaOs-2, es modulada por la presencia de IFNγ. Sin embargo, otras líneas celulares como, la linea NHOst de osteoblastos humanos o la línea hFOB1.19 transformada de osteoblastos fetales, no modularon la expresión de CD54 en presencia de dicha citoquina. Sin embargo, el tratamiento aumentó en las tres líneas la expresión de moléculas de clase II, como el HLA-DR. Además, los linfocitos T, particularmente cuando fueron activados por citoquinas durante 7 días antes del cocultivo con una de las tres líneas de osteosarcoma, estimulando la producción de IL-6 en las tres líneas de osteoblastos, efecto que se bloqueó tras añadir al cocultivo IL-17, citoquina proinflamatoria de linfocitos T que se encuentra en altos niveles en el líquido sinovial de pacientes con artritis reumatoide (Stanley, Vandort, Motyl, Endres & Fox, 2006). La expresión del antígeno CD80 en la línea MG63, aumentó por el tratamiento con indometacina, nimesulida, paracetamol e ibuprofeno. Pero sin 141 DISCUSIÓN duda, el incremento mayor fue con paracetamol e ibuprofeno. De forma paralela, tal y como cabría esperar, la indometacina, el paracetamol y el ibuprofeno incrementaron la expresión de CD86. Nuevamente, cabe señalar el mayor efecto modulador mostrado por paracetamol y el ibuprofeno. Estudios realizados en cultivos primarios de osteoblastos humanos (Pérez, Garcia-Martinez, Arroyo-Morales, Reyes-Botella & Ruiz, 2006), mostraron que el tratamiento de estas células con distintos factores de crecimiento y/o citoquinas, como el TGFβ1, FGFb, PDGF-BB, IL-1β, IL-2, IFNγ y el LPS, modula la expresión de antígenos como el CD54, CD80, CD86 y HLA-DR. Concretamente, el tratamiento con TGFβ1 durante 24 h a dosis de 0.1 ng/ml, produjo un descenso significativo de la expresión de los antígenos CD54 y CD86. Por el contrario, y como consecuencia del tratamiento con IL-1β, se detectó un incremento en el porcentaje de expresión del CD54, CD86 y HLA-DR. El tratamiento tanto con IFNγ como LPS, incrementó la expresión de los antígenos CD54, CD80, CD86 y HLADR, no describiendo cambios por el tratamiento con FGFb, PDGF-BB e IL-2. Los autores proponen que la respuesta de los osteoblastos a distintos factores de crecimiento y/o citoquinas, modula la expresión de antígenos, lo cual, guarda relación con la capacidad funcional de estas células. Dicha modulación, es controlada por la presencia de ciertos factores de crecimiento presentes habitualmente en el tejido óseo, que promueven la maduración y diferenciación de las células de linaje osteoblástico. En situaciones proinflamatorias, habría una activación del papel inmunológico de esta población como célula presentadora de antígeno. Resultados equivalentes fueron obtenidos en distintas líneas de osteosarcoma humano por Stanley y cols en el 2006 (Stanley, Vandort, Motyl, Endres & Fox, 2006). En estudios llevados a cabo en células dendríticas, se han obtenido resultados relacionados con los aquí descritos, de modo que las células dendríticas en presencia de acído lipoteicóico y muramildipéptido, la célula aumenta la síntesis de citoquinas proinflamatorias y aumenta la expresión de 142 DISCUSIÓN antígenos como CD86, siendo un signo de maduración y/o activación funcional como célula presentadora de antígeno (Kim et al., 2007; Steinbrink et al., 2000). Schrum y cols. en el año 2003 (Schrum et al., 2003a), detectaron la expresión de la molécula de clase II HLA-DR y del CD40, en cultivos de osteoblastos humanos y murinos, frente a la exposición de microorganismos patógenos como el Staphylococcus aureus y Salmonella. En esta misma línea, se pronuncian algunos autores que descartan la expresión de moléculas de clase II del complejo de histocompatibilidad, HLA-DR en osteoblastos no estimulados (Heinemann et al., 2000; Khoury & Arnaud, 1993). Sin embargo, dos grupos de investigación, entre ellos el nuestro, describen la presencia del HLA-DR en cultivos primarios de osteblastos (Skjodt, Moller & Freiesleben, 1989; Skjodt, Hughes, Dobson & Russell, 1990; Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2000; Reyes-Botella, Montes, Vallecillo-Capilla, Olivares & Ruiz, 2002a) y, posteriormente, en el 2006, se describió la expresión de HLA-DR en tres líneas de osteosarcoma humano, SaOs-2, Hfob1.19 y en la NHOst; si bien, esta expresión se vió incrementada en presencia de IFNγ (Stanley, Vandort, Motyl, Endres & Fox, 2006) . En nuestro estudio, hemos visto que la indometacina, el paracetamol y el ibuprofeno, han producido un aumento en la expresión de HLA-DR, antígeno comúnmente incrementado en presencia de citoquinas, que indican signos de inflamación y/o activación inmune, como el IFN-γ (Skjodt, Hughes, Dobson & Russell, 1990; Lee, Cossoy, Chau, Singh & Madrenas, 1997), o bien, en presencia de microorganismos (Schrum et al., 2003a). Nuestros resultados nos sugieren, que los AINES pueden modular el perfil antigénico de los osteoblastos. El principal mecanismo se traduciría en un retraso de la diferenciación celular, lo cual, explicaría la no alteración del CD54 y el aumento de CD80 y CD86, por lo que guardaría relación con la disminución en la síntesis de osteocalcina que anteriormente ha sido mostrada por nosotros. El 143 DISCUSIÓN incremento de HLA-DR, tal vez, no sea tan específico de inmadurez celular, sino que parece ir asociado a signos de inflamación y su incremento se deba a otros mecanismos. Otro mecanismo que explicaría la modulación antigénica, podría ser la activación celular, como le ocurre a otras poblaciones como a las células dendríticas (Banchereau et al., 2000). 4. Efecto de los AINEs sobre la capacidad fagocítica en la línea de osteosarcoma humano, MG-63. La fagocitosis es una función inmune que es llevada a cabo, clásicamente, por macrófagos, células dendríticas y neutrófilos, con objeto de capturar y destruir patógenos y antígenos particulados. Esta capacidad funcional ha sido descrita en osteoblastos humanos y también en la línea MG-63, en esta tesis. Al analizar el efecto del tratamiento durante 24 h con distintos AINEs de la función fagocítica de la línea celular de osteosarcoma MG-63, observamos que el paracetamol, el diclofenaco y el dbuprofeno, disminuyeron la capacidad fagocítica. Cabe señalar que el paracetamol y el ibuprofeno, los más activos inhibiendo la función fagocítica, son los que a su vez, actúan sobre esta población celular incrementando la expresión de moléculas coestimuladoras, tales como CD80, CD86 y la molécula HLA-DR, lo que sugiere, un incremento de la función presentadora de antígeno a expensas de disminuir la capacidad fagocítica. Este efecto, nos recuerda a otra población celular con la que ha sido relacionado el osteoblasto, las células dendríticas, con las que comparte la expresión de determinados antígenos, la síntesis de citoquinas, la capacidad fagocítica y la presentación antigénica a los linfocitosT (Banchereau et al., 2000). Las células dendríticas, son bien conocidas por su papel en la activación de células T y en desencadenar respuestas inmunes específicas. Hay dos estados bien definidos de maduración de las células dendríticas que incluyen, las células dendríticas-inmaduras y las células dendríticas-maduras (Banchereau et al., 2000). 144 DISCUSIÓN Las células dendríticas-inmaduras presentan un fenotipo que refleja su especialización funcional como célula encargada de capturar antígenos, por lo que, presenta una alta endocitosis capaz de ingerir sustancias solubles por macropinocitosis, tomar proteínas o complejos antígeno-anticuerpo por endocitosis mediada por receptores o ingerir células enteras por fagocitosis. Asímismo, expresan niveles relativamente bajos, tanto de moléculas de clase I y de clase II, codificadas por el Complejo Mayor de Histocompatibilidad (MHC), y como de moléculas coestimuladoras, tales como CD80 y CD86. Aunque captan antígenos, son incapaces de procesarlos y presentarlos eficazmente a las células T (Banchereau et al., 2000; Zhang, Li, Yu, Zhang & Cao, 2001; Herrmann, Morita, Lee & Kusner, 2005). Las células dendríticas maduras, tienen un fenotipo más inmunogénico, presentando moléculas de superficie importantes para la activación de las células T. La maduración se asocia con la disminución de la capacidad fagocítica, la macropinocitosis y con un incremento en la eficacia en el procesamiento y presentación del antígeno, por lo que el fenotipo antigénico cambia con un aumento de la expresión de moléculas de clase I y clase II y moléculas coestimuladoras como el CD80 y CD86. Por otra parte, Herrmann y cols. (Herrmann, Morita, Lee & Kusner, 2005), sugieren que las células dendríticas maduras cuando son activadas por factores externos o señales de daño o peligro ejercen su función activando a las células T. Ahora bien, las células dendríticas maduras en reposo pueden inducir tolerancia. Durante la infección, las células dendríticas incrementan la expresión de moléculas de clase II y moléculas coestimuladoras, e incluso, cuando se exponen a productos microbianos modifican la expresión de receptores de quimiocinas y moléculas de adhesión (Andreae, Piras, Burdin & Triebel, 2002). En este sentido, algunos autores señalan que hay que diferenciar maduración de activación, de modo que la activación de células dendríticas por infección o inflamación, cambia su capacidad funcional de tolerogenicidad por inmunogenicidad. Las células 145 DISCUSIÓN dendríticas activadas, se caracterizan por expresar altos niveles de moléculas del MHC y moléculas coestimuladoras y por producir citoquinas como IL12 e IFN α (Chow, Toomre, Garrett & Mellman, 2002; Celluzzi & Welbon, 2003; Wilson, ElSukkari & Villadangos, 2004). Todos estos datos muestran una gran similitud entre las células dendríticas y los osteoblastos, como hemos observado cuando se incrementan ciertos marcadores se disminuye la capacidad fagocítica, esto, podría ser un signo de activación como se ha sugerido para las células dendríticas, más que una maduración, de modo que se activa la función presentadora de antígeno. Por otra parte, pensamos que la mayor capacidad fagocítica esta asociada al osteoblasto inmaduro, capacidad que disminuye a medida que el osteoblasto madura, ya que en este estado de maduración, solo parte de la población muestra dicha capacidad funcional. Nuestros resultados muestran que el osteoblasto, es una célula altamente compleja, tanto a nivel antigénico, como a nivel de diferenciación, como funcionalmente, la cual, es altamente sensible a los factores externos o ambientales, por lo que éstos, deben de estar estrechamente controlados y valorados para evitar posibles repercusiones no deseadas sobre el tejido óseo. Si valoramos conjuntamente todos los datos obtenidos en relación con el efecto de los AINEs sobre los osteoblastos humanos, señalaremos que la indometacina, la nimesulida, el paracetamol y el diclofenaco enlentecen el proceso de regeneración ósea, al disminuir la proliferación celular, por lo que deberían utilizarse con limitación en situaciones que requieran una rápida cicatrización de los defectos óseos; si bien, no creemos que se provoquen alteraciones en otros parámetros fisiológicos de la célula, ya que no se producen grandes cambios a nivel del perfil antigénico o capacidad fagocítica de esta población tras su tratamiento a dosis terapéuticas, salvo en el caso del paracetamol, en donde sí observamos un cambio del perfil antigénico asociado con una disminución de la 146 DISCUSIÓN capacidad fagocítica y de la síntesis de osteocalcina, y en el diclofenaco que disminuye la capacidad fagocítica. En el caso del tratamiento con Ibuprofeno, se observó un aumento de la proliferación celular asociado a otros cambios celulares; tales como, modulación del perfil antigénico y disminución de la capacidad fagocítica, lo que nos sugiere una activación celular, lo cual, a corto plazo puede ser deseado, ya que se favorecería la mayor presencia de células más o menos indiferenciadas con una mayor capacidad de crecimiento que podría acelerar a corto plazo la regeneración ósea. 147 DISCUSIÓN 148 CONCLUSIONES VI. CONCLUSIONES: 1. La línea de osteosarcoma humano MG-63 presenta un perfil antigénico propio, donde se combinan una serie de antígenos expresados en un alto porcentaje entre los que se incluye el CD10, CD21, CD44, CD54 y otros antígenos de expresión más débil, tales como el CD80, CD86 y HLA-DR. AsÍmismo, esta población mostró capacidad fagocítica siendo capaz de ingerir partículas de látex y microorganismos como Candida sp. 2. En aquellas circunstancias clínicas en las que se requiera una rápida formación de tejido óseo, no deseando una inhibición de la proliferación osteoblástica, debería valorarse el uso de ciertos AINEs como la indometacina, nimesulida, diclofenaco y el paracetamol en cada caso específico, mostrándose el ibuprofeno como el AINE de elección en tales circunstancias. 3. El ibuprofeno a dosis terapéuticas en tratamientos a corto plazo, incrementa la expresión de los antígenos CD80, CD86 y HLA-DR, lo cual, va asociado con la disminución de la capacidad fagocítica, lo que sugiere una activación de esta población celular. 149 CONCLUSIONES 150 BIBLIOGRAFÍA VII. BIBLIOGRAFÍA: Abbas A.K. & Lichtman A.H. (2006). Inmunología celular y molecular. (2ªed.). Madrid: Elsevier. Abramson S. & Weissmann G. (1989). The mechanisms of action of nonsteroidal antiinflammatory drugs. Arthritis Rheum, 32(1), 1-9. Agarwal B., Swaroop P., Protiva P., Raj S.V., Shirin H. & Holt P.R. (2003). COX-2 is needed but not sufficient for apoptosis induced by Cox-2 selective inhibitors in colon cancer cells. Apoptosis, 8(6), 649-54. Alexandre C. (2005). Androgens and bone metabolism. Joint Bone Spine, 72(3), 202-6. Algarra I., García E., Garrido F y Molina I. (2001). Inmunología. ( 3ª ed.). Ed. Ave María. Allen K.N. (1995). Aspirin: now we can see it. Nat Med, 1(9), 882-3. Alliston T., Choy L., Ducy P., Karsenty G. & Derynck R. (2001). TGF-beta-induced repression of CBFA1 by Smad3 decreases cbfa1 and osteocalcin expression and inhibits osteoblast differentiation. EMBO J, 20(9), 2254-72. Altman R.D., Latta L.L., Keer R., Renfree K., Hornicek F.J. & Banovac K. (1995). Effect of nonsteroidal antiinflammatory drugs on fracture healing: a laboratory study in rats. J Orthop Trauma, 9(5), 392-400. Amin S., Zhang Y., Sawin C.T., Evans S.R., Hannan M.T., Kiel D.P., Wilson P.W. & Felson D.T. (2000). Association of hypogonadism and estradiol levels with bone 151 BIBLIOGRAFÍA mineral density in elderly men from the Framingham study. Ann Intern Med, 133(12), 951-63. Andreae S., Piras F., Burdin N. & Triebel F. (2002). Maturation and activation of dendritic cells induced by lymphocyte activation gene-3 (CD223). J Immunol, 168(8), 3874-80. Arias O.R. & Marquez-Orozco M.C. (2006). Aspirin, acetaminophen, and ibuprofen: their effects on orthodontic tooth movement. Am J Orthod Dentofacial Orthop, 130(3), 364-70. Armour K.J., van't Hof R.J., Armour K.E., Torbergsen A.C., Del Soldato P. & Ralston S.H. (2001). Inhibition of bone resorption in vitro and prevention of ovariectomy-induced bone loss in vivo by flurbiprofen nitroxybutylester (HCT1026). Arthritis Rheum, 44(9), 2185-92. Aruffo, A., Stamenkovic, I., Melnick, M., Underhill, C.B., & Seed, B. (1990). CD44 is the principal cell surface receptor for hyaluronate. Cell, 61(7), 1303-13. Asako H., Kubes P., Wallace J., Wolf R.E. & Granger D.N. (1992). Modulation of leukocyte adhesion in rat mesenteric venules by aspirin and salicylate. Gastroenterology, 103(1), 146-52. Aubin J.E., Liu F., Malaval L. & Gupta A. K. (1995). Osteoblast and chondroblast differentiation. Bone 17(2), 77S-83S. Aubin J.E. (1998). Bone stem cells. J Cell Biochem Suppl, 30-31, 73-82. Banchereau J., Briere F., Caux C., Davoust J., Lebecque S., Liu Y.J., Pulendran B. & Palucka K. (2000). Immunobiology of dendritic cells. Annu Rev Immunol, 18, 152 BIBLIOGRAFÍA 767-811. Banerjee C., McCabe L.R., Choi J.Y., Hiebert S.W., Stein J.L., Stein G. S. & Lian J.B. Runt homology domain proteins in osteoblast differentiation: AML3/CBFA1 is a major component of a bone-specific complex. (1997). J Cell Biochem 66(1), 1-8. Bannwarth B., Demotes-Mainard F., Schaeverbeke T. & Dehais J. (1993). Where are peripheral analgesics acting? Ann Rheum Dis 52(1), 1-4. Bell N.H., Hollis B.W., Shary J.R., Eyre D.R., Eastell R., Colwell A. & Russell R.G. (1994). Diclofenac sodium inhibits bone resorption in postmenopausal women. Am J Med, 96(4), 349-53. Bellows C.G., Aubin J.E. & Heersche J.N. (1991). Initiation and progression of mineralization of bone nodules formed in vitro: the role of alkaline phosphatase and organic phosphate. Bone Miner, 14(1), 27-40. Benyahu D., Shamay A. & Wientroub S. (1997). Osteocalcin (BGP) gene expresión, and protein production by marrow stromal adipocytes. Biochem Biophys Res Commun., 231, 442-446. Beresford J.N., Gallagher J.A. & Russell R.G. (1986). 1,25-Dihydroxyvitamin D3 and human bone-derived cells in vitro: effects on alkaline phosphatase, type I collagen and proliferation. Endocrinology, 119(4), 1776-85. Blair H.C., Sidonio R.F., Friedberg R.C., Khan N.N. & Dong S.S. (2000). Proteinase expression during differentiation of human osteoclasts in vitro. J Cell Biochem, 78(4), 627-37. Boivin G., Anthoine-Terrier C. & Obrant K.J. (1990). Transmission electron 153 BIBLIOGRAFÍA microscopy of bone tissue. A review. Acta Orthop Scand, 61(2), 170-80. Bollag, R. J., Zhong, Q., Phillips, P., Min, L., Zhong, L., Cameron, R., Mulloy, A. L., Rasmussen, H., Qin, F., Ding, K. H., & Isales, C. M. (2000). Osteoblast-derived cells express functional glucose-dependent insulinotropic peptide receptors. Endocrinology 141(3), 1228-35. Bonewald, L.F. & Dallas S.L. (1994). Role of active and latent transforming growth factor beta in bone formation. J Cell Biochem, 55(3), 350-7. Bost K.L., Ramp W.K., Nicholson N.C., Bento J.L., Marriott I. & Hudson M.C. (1999). Staphylococcus aureus infection of mouse or human osteoblasts induces high levels of interleukin-6 and interleukin-12 production. J Infect Dis, 180(6), 1912-20. Bost K.L., Bento J.L., Ellington J.K., Marriott I. & Hudson M.C. (2000). Induction of colony-stimulating factor expression following Staphylococcus or Salmonella interaction with mouse or human osteoblasts. Infect Immun, 68(9), 5075-83. Bost K.L., Bento J.L., Petty C.C., Schrum L.W., Hudson M.C. & Marriott I. (2001). Monocyte chemoattractant protein-1 expression by osteoblasts following infection with Staphylococcus aureus or Salmonella. J Interferon Cytokine Res, 21(5), 297304. Botting R.M. (2000). Mechanism of action of acetaminophen: is there a cyclooxygenase 3?. Clin Infect Dis, 31 Suppl 5, S202-10. Botting R. M. (2006). Inhibitors of cyclooxygenases: mechanisms, selectivity and uses. J Physiol Pharmacol 57(5), 113-24. 154 BIBLIOGRAFÍA Bouldin M.B., Clowers-Webb H.E., Davis J.L., McEvoy M.T. & Davis M.D. (2000). Naproxen-associated linear IgA bullous dermatosis: case report and review. Mayo Clin Proc, 75(9), 967-70. Boutaud O., Aronoff D.M., Richardson J.H., Marnett L.J. & Oates J.A. (2002). Determinants of the cellular specificity of acetaminophen as an inhibitor of prostaglandin H(2) synthases. Proc Natl Acad Sci U S A, 99(10), 7130-5. Boyce E. (2000). Nonsteroidal antiinflammatory-drugs: review of factors guiding formulary selection. Formulary, 35, 142-168. Brenner B.E. & Simon R.R. (1982). Management of salicylate intoxication. Drugs, 24(4), 335-40. Brown K.M., Saunders M.M., Kirsch T., Donahue H.J. & Reid J.S. (2004). Effect of COX-2-specific inhibition on fracture-healing in the rat femur. J Bone Joint Surg Am, 86-A(1), 116-23. Brune K., Beck W.S., Geisslinger G., Menzel-Soglowe, S., Peskar, B.M. & Peskar B.A. (1991). Aspirin-like drugs may block pain independently of prostaglandin synthesis inhibition. Experientia, 47(3), 257-61. Buckley M.M. & Brogden R.N. (1990). Ketorolac. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic potential. Drugs, 39(1), 86-109. Buckwalter J.A. & Cooper R.R. (1987). Bone structure and function. Instr Course Lect, 36, 27-48. Burgeson R.E. & Nimni M.E. (1992). Collagen types. Molecular structure and tissue distribution. Clin Orthop Relat Res, (282), 250-72. 155 BIBLIOGRAFÍA Butcher C.K. & Marsh D.R. (1996). The effects of non-steroidal anti-inflammatory drugs on the rate of tibial fracture union. Injuty., 27, 375-376. Cabre F., Fernandez M.F., Calvo L., Ferrer X., Garcia M.L. & MauleonD. (1998). Analgesic, antiinflammatory, and antipyretic effects of S(+)-ketoprofen in vivo. J Clin Pharmacol, 38(12 Suppl), 3S-10S. Cai L., Okumu F.W., Cleland J.L., Beresini M., Hogue D., Lin Z. & Filvaroff E.H. (2002). A slow release formulation of insulin as a treatment for osteoarthritis. Osteoarthritis Cartilage, 10(9), 692-706. Cai D., Byth K.F. & Shapiro G.I. (2006). AZ703, an imidazo[1,2-a]pyridine inhibitor of cyclin-dependent kinases 1 and 2, induces E2F-1-dependent apoptosis enhanced by depletion of cyclin-dependent kinase 9. Cancer Res, 66(1), 435-44. Canalis E., Economides A.N. & Gazzerro E. (2003). Bone morphogenetic proteins, their antagonists, and the skeleton. Endocr Rev, 24(2), 218-35. Canalis E., McCarthy T.L. & Centrella M. (1989). The role of growth factors in skeletal remodeling. Endocrinol Metab Clin North Am, 18(4), 903-18. Caniggia A., Nuti R., Galli M., Lore F., Turchetti V. & Righi G.A. (1986). Effect of a long-term treatment with 1,25-dihydroxyvitamin D3 on osteocalcin in postmenopausal osteoporosis. Calcif Tissue Int, 38(6), 328-32. Caplan A.I. (1994). The mesengenic process. Clin Plast Surg, 21(3), 429-35. Capone M.L., Sciulli M.G., Tacconelli S., Grana M., Ricciotti E., Renda G., Di Gregorio P., Merciaro G. & Patrignani P. (2005). Pharmacodynamic interaction of naproxen with low-dose aspirin in healthy subjects. J Am Coll Cardiol, 45(8), 156 BIBLIOGRAFÍA 1295-301. Capone M.L., Tacconelli S., Di Francesco L., Sacchetti A., Sciulli M.G. & Patrignani P. (2007). Pharmacodynamic of cyclooxygenase inhibitors in humans. Prostaglandins Other Lipid Mediat, 82(1-4), 85-94. Carabaza A., Cabre F., Rotllan E., Gomez M., Gutierrez M., Garcia M.L., & Mauleon D. (1996). Stereoselective inhibition of inducible cyclooxygenase by chiral nonsteroidal antiinflammatory drugs. J Clin Pharmacol, 36(6), 505-12. Carter W.G. & Wayner E.A. (1988). Characterization of the class III collagen receptor, a phosphotylated, transmembrane glycoprotein expressed in nucleated human cells. J Biol Chem. , 263(9), 4193-4201. Celluzzi C.M. & Welbon C. (2003). Dendritic cell culture: a simple closed culture system using ficoll, monocytes, and a table-top centrifuge. J Hematother Stem Cell Res, 12(5), 575-85. Chambers T.J. & Fuller K. (1985). Bone cells predispose bone surfaces to resorption by exposure of mineral to osteoclastic contact. J Cell Sci, 76, 155-65. Chandrasekharan N.V., Dai H., Roos K.L., Evanson N.K., Tomsik J., Elton T.S., & Simmons D.L. (2002). COX-3, a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: cloning, structure, and expression. Proc Natl Acad Sci U S A, 99(21), 13926-31. Chang S.Y. & Wong R.W. (2000). Expression of epidermal growth factor in transgenic mine causes growth retardation. J Biol Chem., 275(49), 38693-38698. Chaudhary L.R. & Avioli L.V. (1994). Dexamethasone regulates IL-1 beta and 157 BIBLIOGRAFÍA TNF-alpha-induced interleukin-8 production in human bone marrow stromal and osteoblast-like cells. Calcif Tissue Int, 55(1), 16-20. Chaudhary I.R. & Hruska K.A. (2001). The cell survival signal AKT is differentially activated PDGF-BB, EGF and FGF-2 in osteoblastic cells. J Cell Biochem., 81(2), 304-311. Chen X.D., Qian H.Y., Neff L., Satomura K. & Horowitz M.C. (1999). Thy-1 antigen expression by cells in the osteoblast lineage. J Bone Miner Res, 14(3), 362-75. Chen D., McKallip R.J., Zeytun A., Do Y., Lombard C., Robertson J.L., Mak T.W., Nagarkatti P.S. & Nagarkatti M. (2001). CD44-deficient mice exhibit enhanced hepatitis after cancanavalin A injection: evidence for involvement of CD44 in activation-induced cell death. J Inmunol., 166, 5889-5897. Chevalley T.H., Rizzoli R., Manen D., Caverzasio J. & Bonjour J.P. (1998). Arginine increases insulin-like growth factor-I production and collagen synthesis in osteoblast-like cells. Bone., 23(2), 103-109. Choi E.M. (2007). Modulatory effects of luteolin on osteoblastic function and inflammatory mediators in osteoblastic MC3T3-E1 cells. Cell Biol Int, Chow A., Toomre D., Garrett W. & Mellman I. (2002). Dendritic cell maturation triggers retrograde MHC class II transport from lysosomes to the plasma membrane. Nature, 418(6901), 988-94. Choy L., Skillington J. & Derynck R. (2000). Roles of autocrine TGF-β receptor and Smad signaling in adipocyte differentiation. J Cell Biol., 149, 667-682. Chu CY, Chen YL, Lin LJ, & Sun CC. (2003). Allergic contact dermatitis from 158 BIBLIOGRAFÍA etofenamate without cross-sensitization to other anthranilic acid derivatives. Dermatology., 206(4), 341-342. Civitelli R., Gonnelli S., Zacchei F., Bigazzi S., Vattimo A., Avioli L.V. & Gennari C. (1988). Bone turnover in postmenopausal osteoporosis. Effect of calcitonin treatment. J Clin Invest, 82(4), 1268-74. Clover J. & Gowen M. (1994). Are MG-63 and HOS TE85 human osteosarcoma cell lines representative models of the osteoblastic phenotype? Bone, 15(6), 58591. Cohick W.S. & Clemmons D.R. (1993). The insulin-like growth factors. Annu Rev Physiol, 55, 131-53. Compston, J.E. (2001). Sex steroids and bone. Physiol Rev, 81(1), 419-447. Connell L. & McInnes I.B. (2006). New cytokine targets in inflammatory rheumatic diseases. Best Pract Res Clin Rheumatol, 20(5), 865-78. Conroy M.C., Randinitis E.J. & Turner J.L. (1991). Pharmacology, pharmacokinetics, and therapeutic use of meclofenamate sodium. Clin J Pain., 7, S44-S48. Cooper C., Atkinson E.J., Wahner H.W., O'Fallon W.M., Riggs B.L., Judd H.L., & Melton L.J. 3rd. (1992). Is caffeine consumption a risk factor for osteoporosis? J Bone Miner Res, 7(4), 465-71. Danon A., Leibson V., & Assouline G. (1983). Effects of aspirin, indomethacin, flufenamic acid and paracetamol on prostaglamdin output from rat stomach and renal papilla in vitro and ex-vivo. J Pharm Pharmacol , 35, 576-579. 159 BIBLIOGRAFÍA Davey D.A. (1997). Calcium and the prevention and treatment of postmenopausal osteoporosis. S Afr Med J, 87(2), 132-3. DeGrendele H.C., Estess P., Picker L.J. & Siegelman M.H. (1996). CD44 and its ligand hyaluronate mediate rolling under physiologic flow: a novel lymphocyteendothelial cell primary adhesion pathaway. J Exp Med., 183(3), 1119-1130. Desbois C., Hogue D.A. & Karsenty G. (1994). The mouse osteocalcin gene cluster contains three genes with two separate spatial and temporal patterns of expression. J Biol Chem., 269, 1183-1190. DeWitt D.L. (1991). Prostaglandin endoperoxide synthase: regulation of enzome expression. Biochim Biophys Acta. 1083, 121-134. DeWitt D.L. (1999). Cox-2-selective inhibitors: the new super aspirins. Mol Pharmacol, 55(4), 625-31. Díaz-Rubio M. y Espinós D. (1994). Tratado de medicina interna. (1ªed.). Madrid: Médica Panamericana. DiCesare P.E., Nimni M.E., Peng L., Yazdi M. & Cheung D.T. (1991). Effects of indomethacin on demineralized bone-induced heterotopic ossification in the rat. J Orthop Res., 9, 855-861. Dickens D.S., Kozielski P., Khan J., Forus A. & Cripe T.P. (2002). Cyclooxigenase-2 expression in pediatric sarcomas. Pediatr Dev Pathol., 5 (4), 356-364. Dickens D.S., Kozielski R., Leavey P.J., Timmons C. & Cripe T.P. (2003). Cyclooxigenase-2 expression does not correlate with outcome in osteosarcoma or 160 BIBLIOGRAFÍA rhabdomyosarcoma. J Pediatr Hematol Oncol., 25, 282-285. Dodds RA, Merry K, Littlewood A. & Gowen M. (1994). Expression of mRNA for ILβ1, IL6 and TGFβ1 in Developing Human Bone and Cartilage. J Histochem Cytochem 42(6), 733-744. Drivdahl R.H., Howard G.A. & Baylink D.J. (1982). Extracts of bone contain a potent regulator of bone formation. Biochim Biophys Acta, 714(1), 26-33. Dubois R.N., Abramson S.B., Crofford L., Gupta R.A., Simon L.S., Van De Puete L.B.A. & Lipsky P.E. (1998). Ciclooxigenase in biology and disease. FASEB J., 12, 1063-1073. Ducy P., Desbois C., Boyce B., Pinero G., Story B., Dunstan C., Smith E., Bonadio J., Goldstein S., Gundberg C., Bradley A. & Karsenty G. (1996). Increased bone formation in osteocalcin-deficient mice. Nature., 382, 448-452. Ducy P., Zhang V., Geoffroy A., Ridall L. & Karsenty G. (1997). Osf2/Cbfa1: a transcriptional activator of osteoblast differentiation. Cell, 89, 747-754. Ducy, P & Karsenty G. (1998). Genetic control of cell differentiation in the skeleton. Curr Opin Cell Biol., 10, 614-619. Eberhart C.E., Coffey R.J., Radhika A. & Giardiello F.M. (1994). Up-regulation of cyclooxigenase 2 gene expression in human colrectal adenomas and adenocarcinomas. Gastroenterology., 107, 1183-1188. Einhorn T.A. (1996). The bone organ system: form and function. In Marcus R ,Feldman D, Kelsey J. (Ed.), Osteoporosis. (pp. 3-22). San Diego. 161 BIBLIOGRAFÍA Elias J.A., Zheng T., Whiting N.L., Trow T.K., Merrill W.W., Zitnik R., Ray P. & Alderman E.M. (1994). IL-1 and transforming growth factor-beta regulation of fibroblast-derived IL-11. J Immunol, 152(5), 2421-9. Engelhart G. (1996). Pharmacology of meloxicam, a new non-steroidal antiinflammatory drug with an improved safety profile trough prederential inhibition of COX-2. Br J Pharmacol., 35(Supl 1), 4-12. Esplugues J, Morcillo EJ, y de Andrés-Trelles F. (1993). Farmacología en clínica dental. Barcelona: Prous. Esplugues J.V. y Barrachina M.D. (2004). Mediadores celulares II. Eicosanoides. Óxido Nítrico y factor activador de plaquetas. In Flórez J & M. A. Armijo J.A. (Eds.), Farmacología Humana. (pp. 347-362.). Barcelona.: Masson. Eujimori A., Tsutsumi M., Fukase M. & Fujita T. (1989). Cyclooxigenase inhibitors enhance cell growth in a osteoblastic cell line, MC3T3-E1. J Bone Miner Res, 4, 697-704. Evans C.E. & Butcher C. (2004). The influence on human osteoblasts in vitro of non-steroidal anti-inflammatory drugs which act on different cyclooxygenase enzymes. J Bone Joint Surg Br, 86(3), 444-9. Farley J.R., Puzas J.E. & Baylink D.J. (1982). Effect of skeletal alkaline phosphatase inhibitors on bone cell proliferation in vitro. Miner Electrolyte Metab, 7(6), 316-23. Feldberg W & Gupta KP. (1973). Pyrogen fever and prostaglandinlike activity in cerebrospinal fluid. J Physiol. 228, 41-53. 162 BIBLIOGRAFÍA Feria M. (2004). Fármacos analgésicos-antitérmicos y antiinflamatorios no esteroideos. Antiartríticos. In Flórez J., Armijo J.A., Mediavilla A. (Ed.), Farmacología Humana. (pp. 375-408.). Barcelona.: Masson-Little Brown. Finkelstein J.S., Klibanski A., Schaefer E.H., Hornstein M.D., Schiff I. & Neer R.M. (1994). Parathyroid hormone for the prevention of bone loss induced by estrogen deficiency. N Engl J Med, 331(24), 1618-23. Fleischmann R, Iqbal I. & Slobodin G. (2002). Meloxicam. Expert Opin Pharmacother., 3(10), 1501-1512. Fosslien E. (2000). Biochemistry of cyclooxigenase (COX)-2 inhibitors and molecualr pathology of COX-2 on neoplasia. Crit Rev Clin Lab Sci., 37, 431-502. Fritsch, J., Grosse, B., Lieberherr, M. & Balsan, S. (1985). 1,25 Dihydroxyvitamin D3 is required for growth-independent expression of alkaline phosphatase in cultured rat osteoblasts. Calcif Tissue Int, 37(6), 639-45. Fromigue O., Modrowski D. & Marie P.J. (2005). Apoptosis in membranous bone formation: role of fibroblast growth factor and bone morphogenetic protein signaling. Crit Rev Eukaryot Gene Expr, 15(1), 75-92. Frost H.M. (1990). Skeletal structural adaptations to mechanical usage (SATMU): 1. Redefining Wolff's law: the bone modeling problem. Anat Rec, 226(4), 403-13. Frost H.M. (1991). Some ABC's of skeletal pathophysiology. 6. The growth/modeling/remodeling distinction. Calcif Tissue Int, 49(5), 301-2. Galandrini R., Galluzo E., Albi N., Grossi C. & Velardi A. (1994). Hyaluronato is costimulatory for human T cells effector functions and binds to CD44 on activated 163 BIBLIOGRAFÍA T cells. J Inmunol., 153, 21-31. Garcia-Martinez O., Reyes-Botella C., Aguilera-Castillo O., Vallecillo-Capilla M.F. & Ruiz C. (2006). Antigenic profile of osteoblasts present in human bone tissue sections. Biosci Rep, 26(1), 39-43. Garcia-Moll X. & Kaski J.C. (2000). Cardiopatía isquemica: marcadores de inflamacion y riesgo cardiovascular. Rev Cubana Med, 39(2), 120-140. Geneser F. (2000). Histología. ( ed.). Buenos Aires.: Panamericana. George M., Stein B., Muller O., Weis-Klemm M., Pap T., Parak W.J. & Aicher W.K. (2004). Metabolic activation stimulates acid secretion and expression of matrix degrading proteases in human osteoblasts. Ann Rheum Dis, 63(1), 67-70. Gerstenfeld L.C., Thiede M., Seibert K., Mielke C., Phippard D., Svagr B., Cullinane D. & Einhorn T.A. (2003). Differential inhibition of fracture healing by non-selective and cyclooxygenase-2 selective non-steroidal anti-inflammatory drugs. J Orthop Res, 21(4), 670-5. Giannoudis P.V., MacDonald D.A., Matthews S.J., Smith R.M., Furlong A.J. & De Boer P. (2000). Nonunion of the femoral diaphysis. The influence of reaming and non-steroidal anti-inflammatory drugs. J Bone Joint Surg Br, 82(5), 655-8. Gimble J.M., Robinson C.E., Wu X. & Kelly K.A. (1996). The function of adypocites in the bone marrow stroma: an update. Bone, 19(5), 421-428. Girasole, G. Passeri, G. Jilka, R.L. & Manolagas S.C. (1994). Interleukin-11: a new cytokine critical for osteoclast development. J Clin Invest, 93(4), 1516-24. 164 BIBLIOGRAFÍA Globus R., Patterson P. & Gospodarowicz D. (1988). Regulation of bovine bone cell proliferation by fibroblast growth factor and transforming growth factor beta. Endocrinology., 123, 98-105. Goddman G.A., Rall W.T., Nies S.A. y Taylor P. Analgésicos-antipiréticos y antiinflamatorios y fármacos antigotosos. (1996). (9ª ed). México. Mc Graw-Hill Interamericana. Goldman A.P., Williams C.S., Sheng H., Lamps L.W., Williams V.P., Pairet M., Morrow J.D. & DuBois R.N. (1998). Meloxicam inhibits the growth of colorectal cancer cells. Carcinogenesis, 19(12), 2195-9. Goodman S., Ma T., Trindade M., Ikenoue T., Matsuura I., Wong N., Fox N., Genovese M., Regula D. & Smith R.L. (2002). COX-2 selective NSAID decreases bone ingrowth in vivo. J Orthop Res, 20(6), 1164-9. Gortz B., Hayer S., Redlich K., Zwerina J., Tohidast-Akrad M., Tuerk B., Hartmann C., Kollias G., Steiner G., Smolen J.S. & Schett G. (2004). Arthritis induces lymphocytic bone marrow inflammation and endosteal bone formation. J Bone Miner Res, 19(6), 990-8. Gowen M., Chapman K., Littlewood A., Hughes D., Evans D. & Russell G. (1990). Production of tumor necrosis factor by human osteoblasts is modulated by other cytokines, but not by osteotropic hormones. Endocrinology, 126(2), 1250-5. Graham D.Y., White R.H., Moreland L.W., Schubert T.T., Katz R., Jaszewski R., Tindall E., Triadafilopoulos G., Stromatt S.C. & Teoh, L.S. (1993). Duodenal and gastric ulcer prevention with misoprostol in arthritis patients taking NSAIDs. Misoprostol Study Group. Ann Intern Med, 119(4), 257-62. 165 BIBLIOGRAFÍA Graham GG, Robins S-A, Bryant KJ. & Skott K.F. (2001). prostaglandin synthesis in intact cells by paracetamol Inhibition of (acetaminophen). Inflammopharmacology. 9(1-2), 131-142. Graham G.G. & Scott K.F. (2005). Mechanism of action of paracetamol. Am J Ther, 12(1), 46-55. Grant SFA. & Ralston SH. (1997). Genes and osteoporosis. Endocrinology., 8, 232-239. Grey A., Mitnick M.A., Masiukievicz U., Sun B., Rudikoff S., Jilka R.L., Manolagas S.C. & Insogna K. (1999). A role for interleukin-6 in parathyroid hormone-induced bone resorption in vivo. Endocrinology., 140(10), 4683-4690. Gruber R., Varga F., Fische M.B. & Watzek G. (2002). Platelets stimulate proliferation of bone cells: involvement of platelet-derived growth factors, microparticles and membranes. Clin Oral Implants. , 13(5), 529-535. Gundle R., Joyner C.J. & Triffit J.T. (1995). Human bone tissue formation in difusión chamber culture in vivo by bone-derived cell and marrow stromal fibroblastic cells. Bone, 16, 597-601. Gupta S., Srivastava M., Ahmad N., Bostwick D.G. & Mukhtar H. (2000). Overexpression of cyclooxigenase-2 in human prostate adenocarcinoma. The Prostate, 42, 73-78. Hall F.L., Han B., Kundu R.K., Yee A., Nimmi M.E. & Gordon E.M. (2001). Phenotypic differentiation of TGF beta1 responsive pluripotent premesenchymal prehematopoietic progenitor (P4 stem) cells from murine bone marrow. J Hematother Stem Cell Res., 10(2), 261-271. 166 BIBLIOGRAFÍA Ham A.W. (1952). Some histophysiological problems peculiar to calcified tissues. J Bone Joint Surg Am , 24-A-3, 701-28. Hanif R., Pittas A., Feng Y., Koutsos M.I., Qiao L., Staiano-Coico L., Shiff S.I. & Rigas B. (1996). Effects of nonsteroidal anti-inflammatory drugs on proliferation and on induction of apoptosis in colon cancer cells by a prostaglandin-independent pathway. Biochem Pharmacol, 52(2), 237-45. Hao H, Wang G. & Sun J. (2005). Enantioselective pharmacokinetics of ibuprofen and involved mechanisms. Drug Metab Rev., 37(1), 215-234. Hardman J.G., Limbird L.E., Molinoff P.B., Ruddon R.W. y Goodman Gilman A. (1996). Las bases farmacológicas de la terapéutica . (9ªed.). Mexico: Mc Graw Hill Interamericana. Harris RE, Beebe-Donk J, Doss H, & Burr Doss D. (2005). Aspirin, ibuprofen, and other non-steroidal anti-inflammatory drugs in prevention: a critical review of non-selective COX-2 blockade (review). cancer Oncol Rep., 13(4), 559-583. Harrison J.R., Lorenzo J.A., Kawaguchi H., Raisz L.G. & Pilbeam C.C. (1994). Stimulation os prostaglandin E2 production by interleukin-1alfa and transforming growth factor alfa in osteoblastic MC3T3-E1 cells. J Bone Miner Res., 9, 817-823. Harvey S. & Hull K.L. (1997). Growth hormone. A paracrine growth factor? Endocrine, 7(3), 267-79. Hauschka P.V., Lian J.B., Cole DEC. & Gundberg C.M. (1989). Osteocalcin and matrix gla protein: vitamin K-dependent proteins in bone. Physiol Rev., 69, 9901046. 167 BIBLIOGRAFÍA Hawkey C.J. (1999). COX-2 inhibitors. Lancet, 353(9149), 307-14. Hawkins C. & Hanks G.W. (2000). The gastroduodenal toxicity of nonsteroidal anti-inflammatory drugs: a review of the literature. J Pain Symptom Manage, 20(2), 140-51. Hayer S., Steiner G., Gortz B., Reiter E., Tohidast-Akrad M., Amling M., Hoffmann O., Redlich K., Zwerina J., Skriner K., Hilberg F., Wagner E.F., Smolen J.S. & Schett G. (2005). CD44 is a determinant of inflammatory bone loss. J Exp Med, 201(6), 903-14. Heinemann D.E., Lohmann C., Siggelkow H., Alves F., Engel I. & Koster G. (2000). Human osteoblast-like cells phagocytose metal particles and express the macrophage marker CD68 in vitro. J Bone Joint Surg Br, 82(2), 283-9. Henegan J.M., Schmidt K.L. & Miller T.A. (1989). Prostaglandin prevents aspirin injury in the canine stomach in vivo but not in vitro conditions. Gastroenterology. 97, 649-659. Herath H.M., Silvio L.D. & Evans J.R. (2005). Scandia a potential biomaterial? J Mater Sci Mater Med., 16(11), 1061-1065. Herrmann T.L., Morita C.T., Lee K. & Kusner D.J. (2005). Calmodulin kinase II regulates the maturation and antigen presentation of human dendritic cells. J Leukoc Biol, 78(6), 1397-407. Herschman H.R. (1994). Regulation of prostaglandin synthase-1 and prostaglandin synthase-2. Cancer Metastasis Rev, 13(3-4), 241-56. Hill P.A., Reynolds J.J. & Meikle M.C. (1995). Osteoblasts mediate insulin-like 168 BIBLIOGRAFÍA growth factor-I and -II stimulation of osteoclast formation and function. Endocrinology, 136(1), 124-31. Hirata T., Ukawa H., Yamakuni H., Kato S. & Takeuchi K. (1997). Ciclooxygenase isozymes in mucosal ulcerogenic and functional response following barrier disruption in rat stomachs. Br J Pharmacol. 122, 447-454. Ho M.L., Chang J.K. & Wang G.J. (1995). Antiinflammatory drug effects on bone repair and remodeling in rabbits. Clin Orthop., 313, 270-278. Ho M.L., Chang J.K. & Wang G.J. (1998). Effects of ketorolac on bone repair: A radiographic study in modeled demineralized bone matrix grafted rabbits. Pharmacology, 57(3), 148-59. Ho M.L., Chang L.Y., Chuang L.Y., Hsu H.K. & Wang G.J. (1999). Effects of nonsteroidal anti-inflammatory drugs and prostaglandins on osteoblastic functions. Biochem Pharmacol., 58, 983-990. Hofbauer L.C., Lacey D.L., Dunstan C.R., Spelsberg T.C., Riggs B.L. & Khosla S. (1999). Interleukin-1beta and tumor necrosis factor-alpha, but not interleukin-6, stimulate osteoprotegerin ligand gene expression in human osteoblastic cells. Bone, 25(3), 255-9. Hofbauer L.C., Kuhne C.A. & Viereck V. (2004). The OPG/RANKL/RANK system in metabolic bone diseases. J Musculoskelet Neuronal Interact, 4(3), 268-75. Hofbauer L.C. (2006). Pathophysiology of RANK ligand (RANKL) and osteoprotegerin (OPG). Ann Endocrinol (Paris), 67(2), 139-41. Holt I., Davie M.W.J., Braidman I.P. ., & Marshall M.J. (1994). Interleukin- does not 169 BIBLIOGRAFÍA mediate the stimulation by prostaglandin E2, parathyroid hormone or 1,25 dihydroxyvitamin D3 of osteoclast differentiation and bone resorption in neonatal mouse parietal bones. Calcif Tissue Int., 55, 114-119. Honig SM. (1994). Nonsteroidal anti-inflammatory drugs. In: Tollison CD, ed. Handbook of Pain Management. (2nd ed). Baltimore: Williams & Wilkins. Horowitz M. (2003). Matrix proteins versus cytokines in the regulation of osteoblast function and bone formation. Calcif Tissue Int, 72(1), 5-7. Horton M.A. (1995). Interactions of connective tissue cells with the extracellular matrix. Bone, 17(Supl 2), 51s-53s. Horwith M.J., Tedesco M.B., Gundberg C., García-Orana A. & Stewart A.F. (2003). Short-term, high-dose parathyroid hormone-related protein as a skeletal anabolic agent for the treatment of postmenopausal osteoporosis. J Clin Endocrinol, 88(2), 569-575. Howell S., Caswell A.M., Kenny A.J. & Turner A.J. (1993). Membrane peptidases on human osteoblast-like cells in culture: hydrolysis of calcitonin and hormonal regulation of endopeptidase-24.11. Biochem J, 290 ( Pt 1), 159-64. Howes R., Bowness J.M., Grotendorst G.R., Martin G.R. & Reddi A.H. (1998). Platelet-derived growth factor enhances demineralised bone matrix-induced cartilage and bone formation. Calcif Tissue Int. 42, 34-38. Huang S.H. (2000). Rheumatology: 7. Basics of therapy. CMAJ, 163(4), 417-23. Hubbard A.K. & Rothlein R. (2000). Intercellular adhesion molecule-1 (ICAM-1) expression and cell signaling cascades. Free Radic Biol Med, 28(9), 1379-86. 170 BIBLIOGRAFÍA Hughes D.E., Salter D.M. & Simpson R. (1994). CD44 expression in human bone: a novel marker of osteocytic differentiation. J Bone Miner Res., 9(1), 39-44. Hughes DE, Dai I, & Tiffee JC. (1996). Estrogen promotes apoptosis of murine osteoclasts mediated by TGF. Nat Med. , 2, 1132 Hwang D., Scollard D., Byrne J. & Levine E. (1998). Expression of cyclooxigenase-1 and cyclooxigenase-2 in human breast cancer. J Natl Cancer Inst., 90, 455-460. Hynes R.O. (1987). Integrins: a family of cell surface receptors. Cell., 48(4), 549554. Igarashi K., Woo J.T. & Stern P.H. (2002). Effects of a selective cyclooxigenase-2 inhibitor, celecoxib, on bone resorption and osteoclastogenesis in vitro. Biochem Pharmacol., 63, 523-532. Indig F.E., Benayahu D., Fried A., Wientroub S. & Blumberg S. (1990). Neutral endopeptidase (EC 3.4.24.11) is highly expressed on osteoblastic cells and other marrow stromal cell types. Biochem Biophys Res Commun, 172(2), 620-6. Indovina P., Ferrante A., Rainaldi G. & Santini M.T. (2006). Hypoxia and ionizing radiation: changes in adhesive properties and cell adhesion molecule expression in MG-63 three-dimensional tumor spheroids. Cell Commun Adhes, 13(3), 185-98. Ishibashi H., Karube S., Yamakawa A. & Koshihara Y. (1995). Interleukin-4 stimulates pro-alpha 1(VI) collagen gene expression in cultured human osteoblastlike cells. Biochem Biophys Res Commun, 211(3), 727-34. Ishimi Y., Miyaura C., Jin C.H., Akatsu T., Abe E., Nakamura Y., Yamaguchi A., 171 BIBLIOGRAFÍA Yoshiki S., Matsuda T., Hirano T. & et al. (1990). IL-6 is produced by osteoblasts and induces bone resorption. J Immunol, 145(10), 3297-303. Ivanovic V, Melman A, Davis-Joseph B, Valcic M, & Geliebter J. (1995). Elevated plasma level of TGF1 in patients with invasive prostate cancer. Nat Med., 1, 282284. Izzo V, Pagnoni B, & Rigoli M. (1991). Recent acquisitions in pain therapy: meclofenamic acid. Clin J Pain. 7(Supl 1), S49-S53. Jamli F. & Brooks D.R. (1990). Clinical pharmacokinetics of Ketoprofen and its isomers. Clin Pharmacokinet., 19, 197-217. Jilka R.L. (1998). Cytokines, bone remodeling and estrogen defeciency: a update. Bone, 23(75-81.) Jones D.A., Carlton D.P., McIntyre T.M., Zimmerman G.A. & Precott S.M. (1993). Molecular cloning of human prostaglandin endoperoxide synthase type II and demonstration of expression in response to citokynes. J Biol Chem., 268, 90499054. Karsdal M.A., Andersen T.A., Bonewald L. & Christiansen C. (2004). Matrix metalloproteinases during (MMPs) safeguard osteoblasts from apoptosis transdifferentiation into osteocytes: MT1-MMP maintains osteocyte viability. DNA Cell Biol, 23(3), 155-65. Kaspar D., Hedrich C.M., Schmidt C., Liedert A., Claes L.E. & Ignatus A.A. (2005). Diclofenac inhibits proliferation and matrix formation of osteoblasts cells. Unfallchirurg., 108(1), 20-24. 172 BIBLIOGRAFÍA Kawaguchi H., Raisz L.G., Voznesenasky O., Alander C.B., Hakeda Y. & Pilbeam C.C. (1994). Regulation of the two prostaglandin G/H synthase by parathyroid hormone, interleukin-1, and prostaglandin E2 in cultured neonatal mouse calvariae. Endocrinology., 135, 1157-1164. Kawaguchi H., Pilbeam C.C., Harrison J.R. & Raisz L.G. (1995). The role of prostaglandins in the regulation of bone metabolism. Clin Orthop., 313, 34-46. Kehoe M.J., Cohen S.M., Zarrinnia K. & Cowan A. (1996). The effect of acetaminophen, ibuprofen, and misoprostol on prostaglandin E2 synthesis and the degree and rate of orthodontic tooth movement. Angle Orthod, 66(5), 339-49. Keller J., Bayer-Kristensen I., Back B., Bunger C., Anderson P.K., Lucht U. & Melsen F. Keller J. (1989a). Indomethacin and bone remodelling effect on cortical bone after osteotomy in rabbits. Acta Orthop Scand., 60, 119-121. Keller J.C., Trancik T.M., Young F.A & St Mary E. (1989b). Effects of indomethacin on bone ingrowth. J Orthop Res., 7, 28-34. Kelly J.P., Kauffman D.W., Jurgelon J.M., Shehan J., Koff R.S. & Shapiro S. (1996). Risk of aspirin-associated major upper gastrointestinal bleeding with enteric-coated or buffered product. Lancet., 348, 1413-1416. Kennel S.J., Lankford T.K., Foote L.J., Shinpock S.G. & Stringer C. (1993). CD44 expression on murine tissues. J Cell Sci., 104(2), 373-382. Kessler S., Kastler S., Mayr-Wohlfart U., Puhl W. & Gunther K.P. (2000). Stimulation primarer osteoblastenkulturen mit rh-TGF-beta, rh-bFGF, rh-BMP 2 und rx-BMP 4 in einem in-vitro-modell. Der Orthopade., 29(2), 107-111. 173 BIBLIOGRAFÍA Khan K., McKay H., Kannus P., Bailey D., Wark J. & Bennell K. (2001). Physical activity and bone health. ( 1ªed.). Champaign: Human Kinetics. Khoury E.L. & Arnaud C.D. (1993). Alkaline phosphatase-positive human osteoblasts do not normally express MHC class II antigens in vivo. Bone, 14(3), 289-95. Kiefer J.R., Pawlitz J.L., Moreland K.T., Stegeman R.A., Hood W.F., Gierse J.K., Stevens A.M., Goodwin D.C., Rowlinson S.W., Marnett L.J., Stallings W.C. & Kurumbail R.G. (2000). Structural insights into the stereochemistry of the cyclooxygenase reaction. Nature, 405(6782), 97-101. Kikuchi T., Matsuguchi T., Tsuboi N., Mitani A., Tanaka S., Matsuoka M., Yamamoto G., Hishikawa T., Noguchi T. & Yoshikai Y. (2001). Gene expression of osteoclast differentiation factor is induced by lipopolysaccharide in mouse osteoblasts via Toll-like receptors. J Immunol, 166(5), 3574-9. Kim H.J., Yang J.S., Woo S.S., Kim S.K., Yun C.H., Kim K.K. & Han S.H. (2007). Lipoteichoic acid and muramyl dipeptide synergistically induce maturation of human dendritic cells and concurrent expression of proinflammatory cytokines. J Leukoc Biol, 81(4), 983-9. Kim I.S., Otto F., Zabel B. & Munmdlos S. (1999). Regulkation of chondrocyte differentiation by Cbfa1. Mech Dev., 80, 159-170. Kimble R.B., Srivastava S., Ross F.P., Matayoshi A. & Pacifici R. (1996). Estrogen deficiency increases the ability of stromal cells to support murine osteoclastogenesis via an interleukin-1 and tumor necrosis factor-mediated stimulation of macrophage colony-stimulating factor. J Biol Chem, 271, 2889028897. 174 BIBLIOGRAFÍA Klaushofer K.,Hoffman O., Czerwenka E., Leis H.J., Gleispach H., Koller K. & Peterlik M. (1988). Comparison of the inhibitory effect of nonsteroidal antiinflammatory drugs on bone prostaglandin synthesis and resorption. J Rheumatol., 15, 486-491. Klaushofer K., Varga F., Glantschning H., Fratzl-Zelmon N., Czerwenka E., Leis H.J., Koller K. & Peterlik M. (1995). The regulatory role of thyroid hormones in bone cell growth and differentiation. J Nutr, 125(7 Suppl), 1996S-2003S. Komori T,. Yagi H., Nomura S., Yamaguchi A., Sasaki K., Deguchi K., Shimizu Y., Bronson R.T., Gao Y.H., Inada M., Sato M., Okamoto R., Kitamura Y., Yoshiki S. & Kishimiti T. (1997). Targeted disruption of Cbfa1 results in a complete lack of bone formation owing to maturational arrest of osteoblasts. Cell, 89, 755-764. Krall E.A. & Dawson-Hughes B. (1991). Smoking and bone loss among postmenopausal women. J Bone Miner Res, 6(4), 331-8. Kream B.E., Jose M., Yamada S. & DeLuca H.F. (1977). A specific high-affinity binding macromolecule for 1,25-dihydroxyvitamin D3 in fetal bone. Science, 197(4308), 1086-8. Krischak G.D., Augat P., Blakytny R., Claes L., Kinzl L. & Beck A. (2007a). The non-steroidal anti-inflammatory drug diclofenac reduces appearance of osteoblasts in bone defect healing in rats. Arch Orthop Trauma Surg, Krischak G.D., Augat P., Claes L., Kinzl L. & Beck A. (2007b). The effects of nonsteroidal anti-inflammatory drug application on incisional wound healing in rats. J Wound Care, 16(2), 76-8. Kudo I., Murakami M., Hara S. & Inoue K. (1993). Mammalian non-pancreatic 175 BIBLIOGRAFÍA phospholipases A2. Biochim Biophys Acta., 1170, 217-231. Kukita T., Nomiyama H., Ohmoto Y., Kukita A., Shuto T., Hotokebuchi T., Sugioka Y., Miura R. & Iijima T. (1997). Macrophage inflammatory protein-1 alpha (LD78) expressed in human bone marrow: its role in regulation of hematopoiesis and osteoclast recruitment. Lab Invest, 76(3), 399-406. Kumar S., Votta B.J., Rieman D.J., Badger A.M.., Gowen M. & Lee .C. (2001). IL-1 and TNF-induced bone resorption is mediated by p38 mitogen activated protein kinase. J Cell Physiol., 187(3), 294-303. Kuo P.L., Huang Y.T., Chang C.H. & Chang J.K. (2006). Bone morphogenetic protein-2 and -4 (BMP-2 and -4) mediates fraxetin-induced maturation and differentiation in human osteoblast-like cell lines. Biol Pharm Bull., 29(1), 119- 124. Lacy C., Armstrong L., Goldman M., & Lace L. (2000). Drug information handbook (8ªed.). USA: Edición Internacional. American Pharmaceutical Association. Lexi. Comp. Lands W.E. (1981). Actions of anti-inflammatory drugs. Trends Pharmacol Sci. 2, 78-80. Langdahl B.L., Kassem M., Moller M.K. & Eriksen E.F. (1998). The effects of IGF-I and IGF-II on proliferation and differentiation of human osteoblasts and interactions with growth hormone. Eur J Clin Invest., 28(3), 176-183. Langenbach R., Morham S.G., Tiano H.F., Loftin C.D., Ghanayem B.I., Chulada P.C., Mahler J.F., Lee C.A., Goulding E.H., Kluckman K.D., Kim H.S. & Smithies O. (1995). Prostaglandin synthase 1 gene disruption in mice reduces arachidonic 176 BIBLIOGRAFÍA acid-induced inflammation and indomethacin-induced gastric ulceration. Cell, 83(3), 483-92. Langman M.J., Weil J., Wainwright P., Lawson D.H., Rawlins M.D., Logan R.F., Murphy M., Vessey M.P. & Colin-Jones D.G. (1994). Risks of bleeding peptic ulcer associated with individual non-steroidal anti-inflammatory drugs. Lancet, 343(8905), 1075-8. Larsen S.L., Pedersen L.O., Buus S. & Stryhn A. (1996). T cell responses affected by aminopeptidase N (CD13)-mediated trimming of major histocompatibility complex class II-bound peptides. J Exp Med, 184(1), 183-9. Lee J.E., Cossoy M.B., Chau L.A., Singh B. & Madrenas J. (1997). Inactivation of lck and loss of TCR-mediated signaling upon persistent engagement with complexes of peptide:MHC molecules. J Immunol, 159(1), 61-9. Lee K.H. & Choi E.M. (2005). Biochanin A stimulates osteoblastic differentiation and inhibits hydrogen peroxide-induced production of inflammatory mediators in MC3T3-E1 cells. Biol Pharm Bull, 28(10), 1948-53. Letarte M., Vera S., Tran R., Addis J.B., Onizuka R.J., Quackenburth E.J., Jongeneel C.V. & McInnes R.R. (1988). Common acute lymphocytic leukemia antigen is identical to neutral endopeptidase. J Exp Med., 168, 1247-1253. Li N.H., Ouchi Y., Okamoto Y., Masuyama A., Kaneki M., Futami A., Hosoi T., Nakamura T. & Orimo H. (1991). Effect of parathyroid hormone on release of interleukin 1 and interleukin 6 from cultured mouse osteoblastic cells. Biochem Biophys Res Commun, 179(1), 236-42. Lian J.B. & Stein G.S. (1992). Concepts of osteoblast growth and differentiation: 177 BIBLIOGRAFÍA basis for modulation of bone cell development and tissue formation. Crit Rev Oral Biol Med, 3(3), 269-305. Lian J.B., & Stayn G.S. (1993). The developmental stages of osteoblast growth and differentiation exhibit selective responses of genes to growth factors (TGF beta1) and hormones (vitamin D and glucocorticoids). J Oral Implantol., 19, 95105. Lian J.B. (1997). Runt homology domain proteins in osteoblast differentiation: AML3/CBFA1 is a major component of a bone-specific complex. J Cell Biochem, 66(1), 1-8. Lian JB, Stein GS, Canalis E, Canalis E, Gehron Robey P, Boskey AL. (1999). Bone formation: osteoblast lineage cells, growth factors, matrix proteins, and the mineralization process. In Favus MJ. (4ª Ed.), Primer on the Metabolic Bone Diseases of Mineral Metabolism. Philadelphia: Lippincott Williams & Wilkins. Lichtenberger L.M. (1995). The hydrophobic barrier properties of gastrointestinal mucus. Annu Rev Physiol., 57, 565-583. Lind M., Deleuran B., Thestrup-Pedersen K., Soballe K., Eriksen E.F. & Bunger C. (1995). Chemotaxis of human osteoblasts. Effects of osteotropic growth factors. APMIS, 103(2), 140-6. Lind M. (1996). Growth factors: possible new clinical tools. A review. Acta Orthop Scand, 67(4), 407-17. Link M.P., Goorin A.M., Miser A.W., Green A.A., Pratt C.B., Belasco J.B., Pritchard J., Malpas J.S., Baker A.R. & Kirkpstrick J.A. (1986). The effect of adjuvant chemoterapu on relapse-free survival in patients with osteosarcoma of the 178 BIBLIOGRAFÍA extremity. N Engl J Med., 19(314), 1600-1606. Lisignoli G., Toneguzzi S., Piacentini A., Cattini L., Lenti A., Tschon M., Cristino S., Grassi F. & Facchini A. (2003). Human osteoblasts express functional CXC chemokine receptors 3 and 5: activation by their ligands, CXCL10 and CXCL13, significantly induces alkaline phosphatase and beta-N-acetylhexosaminidase release. J Cell Physiol, 194(1), 71-9. Lisignoli G., Toneguzzi S., Piacentini A., Cristino S., Cattini L., Grassi F. & Facchini A. (2004). Recruitment and proliferation of T lymphocytes is supported by IFNγand TNFα-activated human osteoblasts: involvement of CD54 (ICAM-1) and CD106 (VCAM-1) adhesion molecules and CXCR3 chemokine receptor. J Cell Physiol, 198, 388-398. Liu C.H., Chang S.H., Narko K., Trifan O., Wu M.T., Smith E., Haudenschild C., Lane T.F. & Hla T. (2001). Overexpression of cyclooxigenase-2 is sufficient to induce tumorigenesis in transgenic mice. J Biol Chem., 276, 18563-18569. Lohmann C.H., Schwartz Z., Koster G., Jahn U., Buchhorn G.H., MacDougall M.J., Casasola D., Liu Y., Sylvia V.L., Dean D.D. & Boyan B.D. (2000). Phagocytosis of wear debris by osteoblasts affects differentiation and local factor production in a manner dependent on particle composition. Biomaterials, 21(6), 551-61. Look A.T., Ashmun R.A., Shapiro L.H. & Peiper S.C. (1989). Human myeloid plasma membrane glycoprotein CD13 (gp150) is identical to aminopeptidase N. J Clin Invest, 83(4), 1299-307. Lukert BP. & Kream BE. (1996). Clinical and basic aspects of glucocorticoid action in bone. In Bilezikian JP, Raisz LG, Rodan GA. Principles of Bone Biology. (pp. 533-48.). San Diego, California: Academic Press. 179 BIBLIOGRAFÍA Mach F., Schonbeck U., Sukhova G.K., Bourcier T., Bonnefoy J.Y., Pober J.S. & Libby P. (1997). Functional CD40 ligand is expressed on human vascular endothelial cells, smooth muscle cells, and macrophages: implications for CD40CD40 ligand signaling in atherosclerosis. Proc Natl Acad Sci USA., 94, 19311936. Maier R., Ganu V. & Lotz M. (1993). Interleukin-11, an inducible cytokine in human articular chondrocytes and synoviocytes, stimulates the production of the tissue inhibitor of metalloproteinases. J Biol Chem, 268(29), 21527-32. Maier T.J., Schilling K., Schmidt R., Geisslinger G. & Grosch S. (2004). Cyclooxygenase-2 (COX-2)-dependent and -independent anticarcinogenic effects of celecoxib in human colon carcinoma cells. Biochem Pharmacol, 67(8), 1469-78. Mandell B.F. (1999). General tolerability and use of nonsteroidal anti-inflammatory drugs. Am J Med, 107(6A), 72S-76S; discussion 76S-77S. Manduca P., Cancedda F.D. & Cancedda R. (1992). Chondrogenic differentiation in chick embryo osteoblast cultures. Eur J Cell Biol., 57, 193-201. Manolagas S.C., & Jilka R.L. (1995). Bone marrow, cytokines, and bone remodeling. Emerging insights into the pathophysiology of osteoporosis. N Engl J Med., 332, 305-311. Manolagas S.C. (2000). Birth and death of bone cells: basic regulatory mechanisms and implications for the pathogenesis and treatment of osteoporosis. Endocr Rev., 21, 115-137. Mantry P., Shah A. & Sundaram U. (2003). Celecoxib associated esophagitis: review of gastrointestinal side effects from COX-2 inhibitors. J Clin Gastroenterol., 180 BIBLIOGRAFÍA 37, 61-63. Martindale W. (2000). The extra pharmacopoeia. ( 32ed.). London: The pharmaceutical press. Matziolis G., Rau H.M., Cléber P., Erli H.J. & Paar O. (2002). Modification of human osteoblasts by various analgesics. Unfallchirurg. 105(6), 527-531. Mauleon D., Artigas R., Garcia M.L. & Carganico G. (1996). Preclinical and clinical development of dexketoprofen. Drugs, 52 Suppl 5, 24-45; discussion 45-6. Mazario J., Roza C. & Herrero J. F. (1999). The NSAID dexketoprofen trometamol is as potent as mu-opioids in the depression of wind-up and spinal cord nociceptive reflexes in normal rats Brain research, 816, 512-517. Mazario J., Solano R.E., & Herrero J.F. (2000). El efecto analgésico agudo de los antiinflamatorios no esteroideos se debe al bloqueo de la ciclooxigenasa-1. Rev Soc Esp Dolor, 7, 503-510. Mazieres B. (2005). Topical ketoprofen patch. Drugs R.D., 6(6), 337-344. McCormack K. & Brune K. (1991). Dissociation between the antinociceptive and anti-inflammatory effects of the nonsteroidal anty-inflamatory drugs: a survey of their analgesic efficacy. Drugs., 41, 533-547. McDonnell D.P., Pike J.W. & O'Malley B.W. (1988). The vitamin D receptor: a primitive steroid receptor related to thyroid hormone receptor. J Steroid Biochem, 30(1-6), 41-6. Mehlisch D.R., & Frakes L.A. (1984). A controlles comparative evaluation of 181 BIBLIOGRAFÍA acetaminophen and aspirin in the treatment of postoperatice pain. Clin Ther, 7, 8997. Min Y.K. Rao Y. Okada Y. Raisz L.G. & Pilbeam C.C. (1998). Regulation of prostaglandin G/H synthase-2 expression by interleukin-1 in human osteoblast-like cells. J BOne Miner Res., 13(7), 1066-1075. Mitchell J.A., Akarasereenont P., Thiemermann C., Flower R.J. & Vane J.R. (1993). Selectivity of nonsteroidal antiinflammatory drugs as inhibitors of constitutive and inducible cyclooxygenase. Proc Natl Acad Sci U S A, 90(24), 11693-7. Miyake K., Underhill C.B., Lesley J. & Kincade P.W. (1990). Hyaluronate can function as a cell adhesion molecule and CD44 participates in hyaluronate recognition. J Exp Med., 172(1), 69-75. Mohan S., & Baylink D.J. (1991). Bone growth factors. Clin Orthop Relat Res, (263), 30-48. Montes M.J., Aleman P., García-Tortosa C., Borja C., Ruiz C. & García-Olivares E. (1996). Cultured human decidual stromal cells express antigens associated with hematopoietic clels. J Reprod Immunol., 30, 53-56. Morcillo E. y Cortijo J. (2004). Mediadores celulares III. Angiotensinas, quininas, citoquinas y otros mediadores peptídicos. In Flórez J, Armijo J.A, & Mediavilla A. (4ªEd.), Farmacología Humana. (pp. 363-373.). Barcelona.: Masson. Morey, E.R. & Baylink, D.J. (1978). Inhibition of bone formation during space flight. Science, 201(4361), 1138-41. 182 BIBLIOGRAFÍA Morham S.G., Lagenbach R., Loftin C.D., Tiano H.F., Vouloumanos N., & Jenette J.C. (1995). Prostaglandin synthase 2 gene disruption causes severe renal pathology in the mouse. Cell, 83, 473-482. Mori S., Jee W.S., Li X.J., Chan S. & Kimmel D.B. (1990). Effects of prostaglandin E2 on production of new cancellous bone in the axial skeleton of ovariectomized rats. Bone., 11, 103-113. Morton D.J., Barrett-Connor E.L. & Schneider D.L. (1998). Nonsteroidal anti- inflammatory drugs and bone mineral density in older women: the Rancho Bernardo study. J Bone Miner Res, 13(12), 1924-31. Mundy GR. (1992). Factores locales en el control de la reabsorción y formación del hueso. In Cannata Andía JB. (Ed.), Actualizaciones en metabolismo óseo. Madrid: Jarpyo. Murnaghan M., Li G. & Marsh D.R. (2006). Nonsteroidal anti-inflammatory druginduced fracture nonunion: an inhibition of angiogenesis? J Bone Joint Surg Am, 88 Suppl 3, 140-7. Muscara M.N., McKnight W., Asfaha S. & Wallace J.L. (2000). Wound collagen deposition in rats: effects of a NO-NSAID and a selective COX-2 inhibitor. Br J Pharmacol, 129, 681-686. Muth-Selbach U.S., Tegeder I., Brune K. & Geisslinger G. (1999). Acetaminophen inhibits spinal prostaglandin E2 release after peripheral noxious stimulation. Anesthesiology., 91(231-239.) Nakamura H., Kenmotsu S., Sakai H. & Ozawa H. (1995). Localization of CD44, the hyaluronate receptor, on the plasma membrane of osteocytes and osteoclasts 183 BIBLIOGRAFÍA in rat tibiae. Cell Tissue Res, 280(2), 225-33. Nakamura T., Hara Y., Tagawa M., Tamura M., Yuga T., Fukada H. & Nigi H. (1998). Recombinant human basic fibroblast growth factor accelerates fracture healing by enhancing callus remodeling in experimental dog tibial fracture. J Bone Miner Res., 13, 942-949. Narumiya S. & Fitzgerald G.A. (2001). Genetic and pharmacological analysis of prostanoid receptor function. J Clin Invest., 108, 25-30. Naruse T., Nishida Y., Hosono K. & Ishiguro N. (2006). Meloxicam inhibits osteosarcoma growth, invasiveness and metastasis by COX-2-dependent and independent routes. Carcinogenesis, 27(3), 584-92. Nasu M., Sugimoto T., Tsutsui H. & Chihara K. (2000). Estrogen modulates osteoblast proliferation and function regulated by parathyroid hormone in osteoblastic SaOs-2 cells: role of insuline-like growth factor (IGF)-I and IGF-binding protein-5. J Endocrinol., 167(2), 305-313. Nayab S. N., Jones F.H. & Olsen I. (2005). Effects of calcium ion implantation on human bone cell interaction with titanium. Biomaterial, 26, 4717-4727. Nelissen, J.M., Torensma, R., Pluyter, M., Adema, G.J., Raymakers, R.A., van Kooyk, Y., & Figdor, C.G. (2000). Molecular analysis of the hematopoiesis supporting osteoblastic cell line U2-OS. Exp Hematol, 28(4), 422-32. Nemoto K., Bernecker P.M., Pilbeam C.C. & Raisz L.G. (1995). Expression and regulation of prostaglandin F receptor mRNA in rodent osteoblastic cells. Prostaglandins., 50, 349-358. 184 BIBLIOGRAFÍA Neuhaus H., Bettenhausen B., Bilinski P., Simon-Chazottes D., Guenet J.L. & Gossler A. (1994). Etl2, a novel putative type-I cytokine receptor expressed during mouse embryogenesis at high levels in skin and cells with skeletogenic potential. Dev Biol, 166(2), 531-42. Norrdin R.W., Jee W.S. & High W.B. (1990). The role of prostaglandins in bone in vivo. Prostaglandins Leukot Essent Fatty Acids., 41, 139-149. Noth V., Osyczka A.M., Tuli R., Hickok N.J., Danielson K.G. & Tuan R.S. (2002). Multilineage mesenchymal differentiation potential of human trabecular bonederived cells. J Orthop Res., 20(5), 1060-1069. Oberbauer R., Krivanek P. & Turnheim K. (1993). Pharmacokinetics of indomethacin in the elderly. Clin Pharmacokinet, 24(5), 428-34. Offenbacher S., Heasman P.A. & Collins J.G. (1993). Modulation of host PGE2 secretion as a determinant of periodontal disease expression. J Periodontol, 64(5 Suppl), 432-44. Okada Y., Morimoto I., Ura K., Watanabe K., Eto S., Kumegawa M., Raisz L., Pilbeam C. & Tanaka Y. (2002). Cell-to-Cell adhesion via intercellular adhesion molecule-1 and leukocyte function-associated antigen-1 pathway is involved in 1alpha,25(OH)2D3, PTH and IL-1alpha-induced osteoclast differentiation and bone resorption. Endocr J, 49(4), 483-95. Onoe Y., Miyaura C., Kaminakayashiki T., Nagai Y., Noguchi K., Chen Q.R., Seo H., Ohta H., Nozawa S., Kudo I. & Suda T. (1996). IL-13 and IL-4 inhibit bone resorption by supressing cyclooxigenase-2-dependent prostaglandin synthesis in osteoblasts. J Immunol., 156, 758-764. 185 BIBLIOGRAFÍA Onyia J.E., Bidwell J.E., Herring J., Hulman J. & Hock J.M. (1995). In vivo, human parathyroid hormone fragment (hPTH 1-34) transiently stimulates immediate early response gene expression, but not proliferation, in trabecular bone cells of young rats. Bone, 17, 479-484. Owen T.A., Aronow M., Shalhoub V., Barone L.M., Wilming L., Tassinari M.S., Kennedy M.B., Pockwinse S., Lian J.B. & Stein G.S. (1990). Progressive development of the rat osteoblast phenotype in vitro: reciprocal relationships in expression of genes associated with osteoblast proliferation and differentiation during formation of the bone extracellular matrix. J Cell Physiol, 143(3), 420-30. Pacifici R. (1996). Estrogen, cytokines and pathogenesis of postmenopausal osteoporosis. J Bone Miner Res., 11, 1043-1051. Palayoor S.T., Youmell M.Y., Calderwood S.K., Coleman C.N. & Price B.D. (1999). Constitutive activation of IkappaB kinase alpha and NF-kappaB in prostate cancer cells is inhibited by ibuprofen. Oncogene, 18(51), 7389-94. Pallapies D., Salinger A., Meyer zum Gottesberge A., Atkins D.J., Rohleder G., Nagyivanyi P. & Peskar B.A. (1995). Effects of lysine clonixinate and ketorolac tromethamine on prostanoid release from various rat organs incubated ex vivo. Life Sci, 57(2), 83-9. Panara M.R., Padovano R., Sciulli M.G., Santini G., Renda G., Rotondo M.T., Pace A., Patrono C. & Patrignani P. (1998). Effects of nimesulide on constitutive and inducible prostanoid biosynthesis in human beings. Clin Pharmacol Ther, 63(6), 672-81. Pascher E., Perniok A., Becker A. & Feldkamp J. (1999). Effect of 1alpha,25(OH)2-vitamin D3 on TNF alpha-mediated apoptosis of human primary 186 BIBLIOGRAFÍA osteoblast-like cells in vitro. Horm Metab Res, 31(12), 653-6. Paul S.R., Bennett F., Calvetti J.A., Kelleher K., Wood C.R., O'Hara R.M. Jr, Leary A.C., Sibley B., Clark S.C., Williams D.A. & et al. (1990). Molecular cloning of a cDNA encoding interleukin 11, a stromal cell-derived lymphopoietic and hematopoietic cytokine. Proc Natl Acad Sci U S A, 87(19), 7512-6. Peck W.A. & Woods W.L. (1998). The cells of bone. In Osteoporosis: etiology, diagnosis, and management. New York.: Raven Press. Pérez E., Garcia-Martinez O., Arroyo-Morales M., Reyes-Botella C. & Ruiz C. (2006). Modulation of antigenic phenotype in cultured human osteoblast-like cells by FGFb, TGFbeta1, PDGF-BB, IL-2, IL-1beta, LPS and IFNgamma. Biosci Rep, 26(4), 281-9. Peris P. (1999). Calcium consumption and use of calcium supplements and vitamin D in postmenopausal women. Med Clin (Barc), 113(1), 36 Piazza G.A., Rahm A.K., Finn T.S., Fryer B.H., Li H., Stoumen A.L., Pamukcu R. & Ahnen D.J. (1997). Apoptosis primarily accounts for the growth-inhibitory properties of sulindac metabolites and involves a mechanism that is independent of cyclooxygenase inhibition, cell cycle arrest, and p53 induction. Cancer Res, 57(12), 2452-9. Pilbeam C.C., Kawaguchi H., Hakeda Y., Voznesenasky O., Alander C.B. & Raisz L.G. (1993). Differential regulation of inducible and constitutive prostaglandin endoperoxide synthase in osteoblastic MC3T3-E1 cells. J Biol Chem, 268, 2564325649. Pilbeam C.C., Raisz L.G., Voznesenasky O., Alander C.B., Delman B.N. & 187 BIBLIOGRAFÍA Kawaguchi H. (1995). Autoregulation of inducible prostaglandin G/H synthase in osteoblastic cells by prostaglandins. J Bone Miner Res., 10, 406-414. Pilbeam C.C., Fall P.M., Alander C.B. & Raisz L.G. (1997a). Differential effects of nonsteroidal anti-inflammatory drugs on constitutive and inducible prostaglandin G/H synthase in cultures bone cells. J Bone Miner Res., 12, 1198-1203. Pilbeam C., Rao Y., Voznesensky O., Kawaguchi C., Alander C., Raisz L. & Herschman H. (1997b). Transforming growth factor-1 regulation of prostaglandin G/H dynthase-2 expression in osteoblastic MC3T3-E1 cells. Endocrynology., 138, 4672-4682. Pini L.A, Sandrini M. & Vitale G. (1996). The antinociceptive action of paracetamol is associated with changes in the serotonergic system in the rat braim. Eur J Pharmacol., 308, 31-40. Pioletti D.P., Takei H., Kwon S.Y., Wood D. & Sung K.L. (1999). The cytotoxic effect of titanium particles phagocytosed by osteoblasts. J Biomed Mater Res, 46(3), 399-407. Platt J.L., Le Bien T.W. & Michael A.K. (1983). identified with monoclonal antibodies reactive Stages of renal ontogenesis with lymphohematopoietic differentiation antigens. J Exp Med., 157, 155-163. Pocock N.A., Eisman J.A., Hopper J.L., Yeates M.G., Sambrook P.N. & Eberl S. (1987). Genetic determinants of bone mass in adults. A twin study. J Clin Invest, 80(3), 706-10. Poirier J. (2002). Histología. ( 1ª ed.). Madrid: Masson. 188 BIBLIOGRAFÍA Pollock J.H., Blaha M.J., Lavish S.A., Stevenson S. & Greenfield E.M. (1996). In vivo demostration that parathyroid hormone and parathyroid hormone-related protein stimulate expression by osteoblasts of interleukin-6 and leukemia inhibitory factor. J Bone Miner Res., 11, 754-759. Ponta H.L., Sherman L. & Herrlich P.A. (2003). CD44:from adhesion molecules to signalling regulators. Nat Rev Mol Cell Biol., 4, 33-45. Poser J.W., Esch F.S., Ling N.C. & Price P.A. (1980). Isolation and sequence of the vitamin K-dependent protein from human bone. Undercarboxylation of the first glutamic acid residue. J Biol Chem, 255(18), 8685-91. Prescott L.F. (2000). Paracetamol, alcohol and the liver. Br J Clin Pharmacol, 49(4), 291-301. Price P.A., Poser J.W., & Raman N. (1976). Primary structure of the gammacarboxyglutamic acid-containing protein from bovine bone. Proc Natl Acad Sci USA, 73, 3374-3375. Price P.A. & Baukol S.A. (1980). 1,25-dihydroxyvitamin D increases synthesis of vitamin K-dependent bone protein by osteosarcoma cells. J Biol Chem., 255, 11660-3. Price P.A., Williamson M.K. & Lothringer J.W. (1981). Origin of the vitamin Kdependent bone protein found in plasma and its clearance by kidney and bone. J Biol Chem, 256(24), 12760-6. Prieto S. (2000). Hormonas calcitrópicas. In A. E. D. J. M. B. Tresguerres J. A (Ed.), Tratado de Endocrinología Básica y Clínica. Editores. Madrid: Síntesis. 189 BIBLIOGRAFÍA Prockop D. J. & Kivirikko K. I. (1995). Collagens: molecular biology, diseases, and potentials for therapy. Annu Rev Biochem, 64, 403-434. Prouillet C., Mazičre J.C., Mazičre C., Wattel A., Brazier M. & Kamel S. (2004) Stimulatory effect of naturally occurring flavonols quercetin and kaempferol on alkaline phosphatase activity in MG-63 human osteoblasts through ERK and estrogen receptor pathway. Bioch Pharmacol, 67, 1307-1313. Puchacz E., Lian J.B., Stein G.S., Wozney J., Huebner K., & Croce C. (1989). Chromosomal localization of the human osteocalcin gene. Endocrinology., 124, 2648-2650. Puzas J.E. (1993). The osteoblasts. In M.J. Favus (2ª Ed.), Primer of the metabolic bone diseases and disorders of mineral metabolism. New York: Raven Press. Qiao L., Shiff S.J. & Rigas B. (1998). Sulindac sulfide alters the expression of cyclin proteins in HT-29 colon adenocarcinoma cells. Int J Cancer, 76(1), 99-104. Rady Z.A. & Khan N.K. (2005). Effects of cyclooxigenase inhibition on bone, tendon, and ligament healing. Inflamm Res., 54(9), 358-366. Raisz L.G. (1990). Recent advances in bone cell biology: interactions of vitamin D with other local and systemic factors. Bone Miner, 9(3), 191-7. Raisz L.G. (1993a). Bone cell biology: new approaches and unanswered questions. J Bone Miner Res, 8 Suppl 2, S457-65. Raisz L.G., Pilbeam C.C. & Fall P.M. (1993b). Prostaglandins: mechanism of action and regulation of production in bone. Osteoporosis Int., 3(Suppl 1), 136140. 190 BIBLIOGRAFÍA Reinhart D.I. (2000). Minimising the adverse effects of ketorolac. Drug Saf., 22(6), 487-497. Reinholt F.P., Hultenby K., Oldberg A. & Heinegard D. (1990). Osteopontin--a possible anchor of osteoclasts to bone. Proc Natl Acad Sci U S A, 87(12), 4473-5. Reyes-Botella C., Montes M.J., Abadía-Molina A.C., Vallecillo-Capilla M.F. & Ruiz C. (1999). CD10 expression in cultured human osteobalst-like cells. Folia Biologica (Praha)., 45, 257-260. Reyes-Botella C., Montes M.J., Vallecillo-Capilla M.F., Olivares E.G. & Ruiz C. (2000). Expression of molecules involved in antigen presentation and T cell activation (HLA-DR, CD80, CD86, CD44 and CD54) by cultured human osteoblasts. J Periodontol., 71, 614-617. Reyes-Botella C., Montes M.J., Vallecillo-Capilla M.F., Olivares E.G. & Ruiz C. (2002a). Antigenic phenotype of cultured human osteoblast-like cells. Cell Physiol Biochem., 12, 359-364. Reyes-Botella C., Vallecillo-Capilla M.F., Olivares E.G. & Ruiz C. (2002b). Effect of different growth factors on human cultured osteoblast-like cells. Cell Physiol Biochem., 12, 353-358. Rickard D.J., Waters K.M., Ruesink T.J., Khosla S., Katzenellenbogen J.A., Katzenellenbogen B.S., Riggs B.L. & Spelsberg T.C. (2002). Estrogen receptor isoform-specific induction of progesterone receptors in human osteoblasts. J Bone Miner Res, 17(4), 580-592. Riemann D., Kehlen A. & Langner J. (1999). CD13--not just a marker in leukemia typing. Immunol Today, 20(2), 83-8. 191 BIBLIOGRAFÍA Rifas L., Arackal S. & Weitzmann M.N. (2003). Inflammatory T cells rapidly induce differentiation of human bone marrow stromal cells into mature osteoblasts. J Cell Biochem, 88 (4), 650-9. Robey P.G., Young M.F., Flanders K.C., Roche N.S., Kondaiah P., Reddi A.H., Termine J. D., Sporn M. B. & Roberts A. B. (1987). Osteoblasts synthesize and respond to transforming growth factor-type beta (TGF-beta) in vitro. J Cell Biol, 105(1), 457-63. Robey P.G., Young M.F., Fisher L.W. & McClain T.D. (1989). Thrombospondin is an osteoblast-derived component of mineralized extracellular matrix. J Cell Biol, 108(2), 719-27. Roche J.J., Cisneros G.J. & Acs G. (1997). The effect of acetaminophen on tooth movement in rabbits. Angle Orthod, 67(3), 231-6. Rodan G.A. (1998). Control of bone formation and resorption: biological and clinical perspective. J Cell Biochem, 30-31(Supl.), 55-61. Romas E., Udagawa N., Zhou H., Tamura T., Saito M., Taga T., Hilton D.J., Suda T., Ng K.W. & Martin T.J. (1996). The role of gp 130-mediated signals in osteclast development: Regulation of interleukin 11 production by osteoblasts and distribution of its receptor in bone marrow cultures. J Exp Med, 183, 2581-2591. Romas E., Gillespie M.T. & Martin T.J. (2002). Involvement of receptor activator of NFkB ligand and tumor necrosis factor-alfa in bome destruction in rheumatoid arthritis. Bone, 30, 340-346. Roodman G.D., Kurihara N., Ohsaki Y., Kukita A., Hosking D., Demulder A., Smith J.F. & Singer F.R. (1992). Interleukin 6. A potential autocrine/paracrine factor in 192 BIBLIOGRAFÍA Paget's disease of bone. J Clin Invest, 89(1), 46-52. Roodman G.D. (1996). Advances in bone biology: the osteooclast. Endocrinol Rev, 17, 308-332. Ruiz C., Perez E., Vallecillo-Capilla M. & Reyes-Botella C. (2003). Phagocytosis and allogeneic T cell stimulation by cultured human osteoblast-like cells. Cell Physiol Biochem, 13(5), 309-14. Ruiz C., Reyes-Botella C., Garcia-Martinez O. & Montes M.J. (2004). Modulation of antigenic phenotype by IL-1beta, IFNgamma and TGFbeta on cultured human decidual stromal cells. Biosci Rep, 24(1), 55-62. Ruiz C., Pérez E., García-Martínez O., Díaz L., Arroyo M & Reyes-Botella C. (2007). Expression of cytokins IL-4, IL-12, IL-15, IL-18 y IFN and modulation by different growth factors in cultured human osteoblast-like cells. Journal of Bone and Mineral Metabolism, 25(5), Not available Salvi GE, & Lang NP. (2005). The effects of non-steroidal anti-inflammatory drugs (selective and non-selective) on the treatment of periodontal diseases. Curr Pharm Des., 11(14), 1757-1769. Santos A.N., Langner J., Herrmann M. & Riemann D. (2000). Aminopeptidase N/CD13 is directly linked to signal transduction pathways in monocytes. Cell Immunol, 201(1), 22-32. Schafer A.I. (1995). Effects of nonsteroidal antiinflammatory drugs on platelet function and systemic hemostasis. J Clin Pharmacol, 35(3), 209-19. Schnitzer T.J., Tritt K., & Fleischmann R. (1999). The safety profile, tolerability, 193 BIBLIOGRAFÍA and effective dose range of rofecoxib in the treatment of rheumatoid arthritis. Phase II rofecoxib rheumatoid arthritis study group. Clin Ther., 21(10), 16881702. Schrum L.W., Bost K.L., Hudson M.C. & Marriott I. (2003a). Bacterial infection induces expression of functional MHC class II molecules in murine and human osteoblasts. Bone, 33(5), 812-21. Schrum L.W., Marriott I., Butler B.R., Thomas E.K., Hudson M.C. & Bost K.L. (2003b). Functional CD40 expression induced following bacterial infection of mouse and human osteoblasts. Infect Immun, 71(3), 1209-16. Seeman E. (2002). Pathogenesis of bone fragility in women and men. Lancet, 359, 1841-1850. Sell S., Teschner M., Gaissmaier C., Martín F., Weidner S.A. & Kusswetter W. (1999). Effect of diclofenac on human osteoblasts and their stromal precursors in vitro in relation to arthroplasty. Z Rheumatol. 58(1), 13-20. Sempowski G.D., Rozenblit J., Smith T.J. & Phipps R.P. (1998). Human orbital fibroblasts are activated through CD40 to induce proinflammatory cytokine production. Am J Physiol., 274( ), C707-C714. Senna GE, Passalacqua G, Andri G, Dama AR, Albano M, Fregonese L, Andri L. (1996). Nimesulide in the treatment of patients intolerant of aspirin and other NSAIDs. Drug Saf. 14(2), 94-103. Serhan C.N. (2006). Resolution Phases of Inflammation: Novel Endogenous AntiInflammatory and Proresolving Lipid Mediators and Pathways. Annu Rev Immunol, 194 BIBLIOGRAFÍA Sheng H., Shao J., Kirkland S.C., Isakson P., Coffey R.J., Morrow J., Beauchamp R.D. & DuBois R.N. (1997). Inhibition of human colon cancer cell growth by selective inhibition of cyclooxigenase-2. J Clin Invest., 99, 2254-2259. Shipp M.A. & Look A.T. (1993). Hematopoietic differentiation antigens that are membrane-associated enzymes: cutting is the key! Blood, 82(4), 1052-70. Simmons D.L., Wagner D. & Westover K. (2000). Nonsteroidal anti-inflammatory drugs, acetaminophen, cyclooxygenase 2, and fever. Clin Infect Dis, 31 Suppl 5, S211-8. Simon L.S. (2005). The COX-2 inhibitors:a reasoned review of the data. Swiss Med Wkly., 135(29-30.), 419-424. Singer A.J. & Clark R.A. (1999). Cutaneous wound healing. N Engl J Med, 341(10), 738-46. Siwik D.A., Chang D.L. & Colucci W.S. (2000). necrosis factor-alpha decrease collagen Interleukin-1 beta and tumor synthesis and increase matrix metalloproteinase activity in cardiac fibroblasts in vitro. Circ Res., 23(1259-1265.) Skjelbred P. & Lokken P. (1979). Paracetamol versus placebo: effects on postoperative course. Eur J Clin Pharmacol, 15, 27 Skjodt H., Moller T. & Freiesleben S.F. (1989). Human osteoblast-like cells expressing MHC class II determinants stimulate allogeneic and autologous peripheral blood mononuclear cells and function as antigen-presenting cells. Immunology, 68(3), 416-20. Skjodt H., Hughes D.E., Dobson P.R. & Russell R.G. (1990). Constitutive and 195 BIBLIOGRAFÍA inducible expression of HLA class II determinants by human osteoblast-like cells in vitro. J Clin Invest, 85(5), 1421-6. Smith W.L. (1992). Prostamoide biosynthesis and mechanism of action. Am J Physical., 268, F181-F191. Smith W.L., Dewitt D.L. & Garavito R.M. (2000). Cyclooxigenases: structural, cellular, and molecular biology. Annu Rev Biochem., 69, 145-182. Solheim E. (1998). Growth factors in bone. Int Orthop, 22(6), 410-6. Somerman M.J., Fisher L.W., Foster R.A. & Sauk J.J. (1988). Human bone sialoprotein I and II enhance fibroblast attachment in vitro. Calcif Tissue Int, 43(1), 50-3. Sottile V., Halleux C., Bassilana F., Keller H. & Seuwen K. (2002). Stem cell characteristics of human trabecular bone-derived cells. Bone, 30(5), 699-704. Spiegel B.M., Targownik L., Dulai G.S. & Gralnek I.M. (2003). The cost- effectiveness of cyclooxigenase-2 selective inhibitors in the management of chronic arthritis. Ann Intern Med, 138, 795-806. Stangier J., Su C.A., Fraunhofer A. & Tetzloff W. (2000). Pharmacokinetics of acetaminophen and ibuprofen when coadministered with telmisartan in healthy volunteers. J Clin Pharmacol, 40(12 Pt 1), 1338-46. Stanley K.T., Vandort Immunocompetent C., properties Motyl of C., human Endres J. osteoblasts: & Fox D.A. interactions (2006). with T lymphocytes. J Bone Miner Res, 21(1), 29-36. 196 BIBLIOGRAFÍA Stein G.S. & Lian J.B. (1993). Molecular mechanisms mediating proliferation/differentiation interrelationships during progressive development of the osteoblast phenotype. Endocr Rev, 14(4), 424-42. Stein G.S., Lian J.B., Stein J.L., Van Wijnen A.J. & Montecino M. T. (1996). Transcriptional control of osteoblast growth and differentiation. Physiol Rev., 76, 593-629. Steinbrink K., Paragnik L., Jonuleit H., Tuting T., Knop J. & Enk A.H. (2000). Induction of dendritic cell maturation and modulation of dendritic cell-induced immune responses by prostaglandins. Arch Dermatol Res, 292(9), 437-45. Strobl H, Riedl E, Scheinecker C, Bello-Fernandez C, Pickl WF, Majdic O, Knapp W. (1996). TGF-1 promotes in vitro development of dendritic cells from CD34+ hemopoietic progenitors. J Immunol., 157(4), 1499-1507. Takayanagi H., Ogasawara K., Hida S., Chiba T., Murata S., Sato K., Takaoka A., Yokochi T., Oda H., Tanaka K., Nakamura K., and TaniguchiT. (2001). T-cell mediated regulation of osteoclastogenesis by signaling cross-talk between RANKL and IFN-gamma. Nature, 408, 600-605. Takeuchi Y., Fukumoto S. & Matsumoto T. (1995). Relationship between actions of transforming growth factor (TGF)-beta and cell surface expression of its receptors in clonal osteoblastic cells. J Cell Physiol, 162(3), 315-21. Tanaka Y., Morimoto I., Nakano Y., Okada Y., Hirota S., Nomura S., Nakamura T. & Eto S. (1995). Osteoblasts are regulated by the cellular adhesion through ICAM1 and VCAM-1. J Bone Miner Res, 10(10), 1462-9. Tanaka Y., Mine S., Hanagiri T., Hiraga T., Morimoto I., Figdor C.G., van Kooyk Y., 197 BIBLIOGRAFÍA Ozawa H., Nakamura T., Yasumoto K. & Eto S. (1998). Constitutive up-regulation of integrin-mediated adhesion of tumor-infiltrating lymphocytes to osteoblasts and bone marrow-derived stromal cells. Cancer Res, 58(18), 4138-45. Tanaka Y., Maruo A., Fujii K., Nomi M., Nakamura T., Eto S. & Minami Y. (2000). Intercellular adhesion molecule 1 discriminates functionally different populations of human osteoblasts: characteristic involvement of cell cycle regulators. J Bone Miner Res, 15(10), 1912-23. Teder P., Vandivier R.W., Jiang D., Liang J., Cohn L., Pure E., Henson P.M. & Noble P.W. (2002). Resolution of lung inflammation by CD44. Science. , 296, 155-158. Termine J.D. (1993). Bone matrix proteins and the mineralization process. In M. J. Favus (2ª Ed.), Primer on Metabolic Bone Diseases and Disorders of Mineral Metabolism . (pp. 21-25). Philadelphia: Lippincott-Raven. Thiede M.A., Smock S.L., Petersen D.N., Grasser W.A., Thompson D.D., & Nishimoto S.K. (1994). Presence of messenger ribonucleic acid encoding osteocalcin, a marker of bone turnover, in bone marrow megakaryocytes and peripheral blood platelets. Endocrinology., 135, 929-937. Thummel K.E., Slattery J.T., Ro H., Chien J.Y., Nelson S.D., Lown K.E. & Watkins P.B. (2000). Ethanol and production of the hepatotoxic metabolite of acetaminophen in healthy adults. Clin Pharmacol Ther, 67(6), 591-9. Thun M.J., Henley S.J. & Patrono C. (2002). Nonsteroidal anti-inflammatory drugs as anticancer agents: mechanics, pharmacologic, and clonical issues. J Natl Cancer Inst, 94, 252-266. 198 BIBLIOGRAFÍA Tilyard M.W., Spears G.F., Thomson J. & Dovey S. (1992). Treatment of postmenopausal osteoporosis with calcitriol or calcium. N Engl J Med, 326(6), 357-62. Tjandrawinata R.R., Dahiya R. & Hughes-Fulford M. (1997). Induction of cyclooxygenase-2 mRNA by prostaglandin E2 in human prostatic carcinoma cells. Br J Cancer, 75(8), 1111-8. Todd P.A. & Sorkin E.M. (1988). Diclofenac sodium. A reappraisal of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy. Drugs, 35(3), 244-85. Todd P.A. & Clissold S.P. (1990). Naproxen: a reappraisal of its pharmacology, and therapeutic use in rheumatic diseases and pain states. Drugs, 40, 91-137. Tolman E.L., Fuller B.L., Marinan B.A., Capetola R.J., Levisnson S.L., & Rosenthale M.E. (1983). Tissue selectivity and variability of effects of acetaminophen on arachidonic acid metabolism. Prostaglandins Leukot Med., 12, 347-356. Touraine F, Moldovan D, Touraine P, Chenot P, & Bonnaud F. (2005). Aspirin and non steroidal anti-inflammatory drugs hypersensitivity review(2002-2004). Allerg Immunol (Paris)., 37(7), 279-282. Trancik T., Mills W. & Vinson N. (1989). The effect of indomethacin, aspirin, and ibuprofen on bone remodeling. Clin Orthop., 249, 113-121. Tresguerres J.A.F. (2006). Fisiología humana. (4ª ed.). Interamericana. Madrid: McGraw-Hill. 199 BIBLIOGRAFÍA Tsubouchi Y., Mukai S., Kawahito Y., Yamada R., Kohno M., Inoue K. & Sano H. (2000). Meloxicam inhibits the growth of non-small cell lung cancer. Anticancer Res, 20(5A), 2867-72. Tsutsumimoto T., Kawasaki S., Ebara S. & Takaoka K. (1999). TNF-alpha and IL1BETA supress N-cadherin expression in MC3T3-E1 cells. J Bone Miner Res., 14, 1751-1760. Tullberg-Reinert, H. & Jundt G. (1999). In situ measurement of collagen synthesis by human bone cells with a sirius red-based colorimetric microassay: effects of transforming growth factor beta2 and ascorbic acid 2-phosphate. Histochem Cell Biol, 112(4), 271-6. Udagawa N., Horwood N.J., Elliott J., Mackay A., Owens J., Okamura H., Kurimoto M., Chambers T.J., Martin T.J. & Gillespie M.T. (1997). Interleukin-18 (interferongamma-inducing factor) is produced by osteoblasts and acts via granulocyte/macrophage colony-stimulating factor and not via interferon-gamma to inhibit osteoclast formation. J Exp Med, 185(6), 1005-12. Van Den Berg T.K., Hasbold J., Renardel De Lavalette C., Dopp E.A., Dijkstra C.D. & Klaus G.G. (1996). Properties of mouse CD40: differential expression of CD40 epitopes on dendritic cells and epithelial cells. Immunology., 88, 294-300. Van Staa T.T., Leufkens H.G. & Cooper C. (2000). Use of nonsteroidal anti- inflammatoru drugs and risk of fractures. Bone., 27, 563-568. Vane J. (1997). Inhibition of prostaglandin synthesis as a mechanism of action for aspirin like drugs. Nature., 231., 232-235. Vane J.R. & Botting R.M. (1998). Mechanism of action of antiinflammatory drugs. 200 BIBLIOGRAFÍA Int J Tissue React. , 20, 3-15. Vestergaard P., Rejnmark L. & Mosekilde L. (2006). Fracture risk associated with use of nonsteroidal anti-inflammatory drugs, acetylsalicylic acid, and acetaminophen and the effects of rheumatoid arthritis and osteoarthritis. Calcif Tissue Int, 79(2), 84-94. Waddell WR. (1998). Stimulation of apoptosis by sulindac and piroxicam. Clin Sci (Lond). 95(3), 385-388. Waela M.R., Inagawa-Ogashiwa M., Shimizu S., Yasamoto S. & Hashimoto N. (2002). Generation of different fates from multipotent muscle stem cells. Development, 129(12), 2987-2995. Walker L.M., Preston M.R., Magnay J.L., Thomas P.B. & El Haj A.J. (2001). Nicotinic regulation of c-fos and osteopontin expression in human-derived osteoblast-like cells and human trabecular bone organ culture. Bone., 28(6), 603608. Wallace J.L., McKnightW., Reuter B.K., & Vergnolle N. (2000). NSAID-induced gastric damage in rats: requirement for inhibition of both cyclooxigenase 1 and 2. Gastroenterology, 119, 706-714. Walsh S., Jefferis C., Stewart K., Jordan G.R., Screen J. & Beresford J.N. (2000). Expression of development markers STRO-1 and alkaline phosphatase in cultures of human marrow stromal cells: regulation by fibroblasts growth factor (FGF-2) and relationship to the expression of FGF receptors 1-4. Bone. 27(2), 185-195. Wang J.L., Lin K.L., Chen J.S., Lu Y.C., Jiann B.P., Chang H.T., Hsu S.S., Chen W.C., Huang J.K., Ho C.M. & Jan C.R. (2004). Effect of celecoxib on Ca2+ 201 BIBLIOGRAFÍA movement and cell proliferation in human osteoblasts. Biochem Pharmacol, 67(6), 1123-30. Warner T.D., Giuliano F., Vojnovic I., Bukasa A., Mitchell J.A., & Vane J.R. (1999). Nonsteroidal drug selectivities for ciclooxigenase-1 rather than cyclooxigenase-2 are associated with human gastrointestinal toxicity: A full in vitro analysis. Proc Natl Acad Sci. 96, 7563-7568. Watkins D.N., Lenzo J.C., Segal A., Garlepp P.J. & Thompson P.J. (1999). Expression and localization of cyclo-oxigenase isoforms in non-small cell lung cancer. Eur Respir J., 14, 412-418. Watson A.J. (1998). Chemopreventive effects of NSAIDs against colorectal cancer: regulation of apoptosis and mitosis by COX-1 and COX-2. Histol Histopathol, 13(2), 591-7. Weber G.F., Ashkar S., Glimcher M.J. & Cantor H. (1996). Receptor-ligand interaction between CD44 and osteopontin (Eta-1). Science, 271(5248), 509-12. Weinreb M., Rodan G.A. & Thompson D.D. (1989). Osteopenia in the immobilized rat hind limb is associated with increased bone resorption and decreased bone formation. Bone, 10, 187-194. Weir E.C., Lowik C.W., Paliwal L. & Insogna K.L. (1996). Colony stimulating factor-1 plays a role in osteoclast formation and function in bone resorption induced by parathyroid hormone and parathyroid hormone-related protein. J Bone Miner Res, 11, 1474-1481. Westacott C.L., Taylor G., Atkins R. & Elson C. (1992). Interleukin 1 alpha and beta production by cells isolated from membranes around aseptically loose joint 202 BIBLIOGRAFÍA replacements. Ann Rheum Dis., 51, 638-642. Whittle B.J.R., Higgs G.A., Eakins K.E., Moncada S., & Vane J.R. (1980). Selective inhibition of prostaglandin production in inflammatory exudate and gastric mucosa. Nature, 284, 271-273. Wierkosz T.A., Mitchell J.A., & Botting R.M. (1997). Paracetamol (acetaminophen) stimulates and inhibits COX activity in cell and tissue homogenates. Pharmacologist, 39(65), A242. Wildemann B., Lübberstedt M., Hass N.P., Raschke M & Schmidmaier G. (2004). IGF-I and TGF-beta 1 incorporated in a poly (D,L-lactide) im`lant coating maintain their activity over long-term storage-cell culture studies on primary human osteoblast-like cells. Biomaterials, 25, 3639-3644. Williams S.R., Jiang Y, Cochran D., Dorsam G & Graves D.T. (1992). Regulated expression of monocyte chemoattractant protein-1 in normal human osteoblastic cells. Am J Physiol, 263(1 Pt 1), C194-9. Williams C.S., Mann M. & DuBois R.N. (1999). The role of cyclooxigenases in inflammation, cancer, and development. Oncogene., 18, 7908-7916. Willoughby D.A., Moore A.R. & Colville-Nash P.R. (2000). COX-1, COX-2, and COX-3 and the future treatment of chronic inflammatory disease. Lancet, 355(9204), 646-8. Wilson N.S., El-Sukkari D & Villadangos J.A. (2004). Dendritic cells constitutively present self antigens in their immature state in vivo and regulate antigen presentation by controlling the rates of MHC class II synthesis and endocytosis. Blood, 103(6), 2187-95. 203 BIBLIOGRAFÍA Wu Y. & Kumar R. (2000). Parathyroid hormone regulates transforming growth factor beta1 and beta2 synthesis in osteoblasts via divergent signalling pathways. J Bone Miner Res. 15., 879-84. Xie W., Chipman J.G., Robertson D.L., Erikson R.L. & Simmons DL. (1991). Expression of a mitogen-responsive gene encoding prostaglandin synthase is regulated by mRNA splicing. Proc Natl Acad Sci USA., 88, 2692-2696. Yamaguchi A., Komori T. & Suda T. (2000). Regulation of osteoblast differentiation mediated by bone morphogenetic proteins, hedgehogs, and Cbfa1. Endocr Rev, 21(4), 393-411. Yang D., Jin D., Chen J., Jing Z. & Wu D. (2000). Modulation of transforming growth factor beta to platelet-derived growth factor receptor-alpha of human osteoblasts. Chin Med J (Engl)., 113(7), 621-624. Yang L., Tao T.Z., Liu F.C, et al. (2001). Experimental study: the effect of desamethasone on adult osteoblast proliferation and differentiation. Chin J Orthop (Chin)., 21, 493-497. Yao M., Kargman S., Lam E.C., Kelly C.R., Zheng Y., Luk P., Kwong E., Evans J.F. & Wolfe M.M. (2003). Inhibition of cyclooxigenase-2 by rofecoxib attenuates the growth and metastasis potential of colorectal carcinoma in mice. Cancer Res., 63, 586-592. Yarram S.J., Tasman C., Gidley J., Clare M., Sandy J.R. & Mansell J.P. (2004). Epidermal growth factor and calcitriol synergically induce osteoblast maduration. Mollecular and cellular Endocrinology. 220, 9-20. Yasuda H., Shima N., Nakagawa N., Yamaguchi K., Kinosaki M., Mochizuki S., 204 BIBLIOGRAFÍA Tomosayu A., Yano K., Goto M., Murakami A., Tsuda E., Morinaga T., Higashio K., Udagawa N., Takahashi N. and Suda T. (1998). Osteoclast differentiation factor and is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proc Natl Acad Sci USA, 95, 3597-3602. Young M.F. (2003). Bone matrix proteins: more than markers. Calcif Tissue Int, 72(1), 2-4. Yuan C.J., Mandal A.K., Zhang Z. & Mukherjee A.B. (2000). Transcriptional regulation of cyclooxigenase-2 gene expression: novel effects of nonsteroidal antiinflammatory drugs. Cancer Res., 60, 1084-1091. Zambonin G., Camarino C., Greco G., Patella V., Moretti B. & Grano M. (2000). Hydroxyapatite coated with hepatocyte growth factor (HGF) stimulated human osteoblasts in vitro. Br J Bone Joint Surg., 82, 457-460. Zhang J., Li N., Yu J., Zhang W. & Cao X. (2001). Molecular cloning and characterization of a novel calcium/calmodulin-dependent protein kinase II inhibitor from human dendritic cells. Biochem Biophys Res Commun, 285(2), 229-34. Zhang L., Yu J., Park B.H., Kinzler K.W. & Vogelstein B. (2000). Role of BAX in the apoptotic response to anticancer agents. Science, 290(5493), 989-92. Zheng SX, Vrintis Y, & Lopez M. (1997). Increase in cytokine production (IL-1-beta, IL-6, TNF alpha but not INF gamma, GM-csf or LIF) by stimulated whole blood cells in postmenopausal osteoporosis. Maturitas, 26, 63. 205