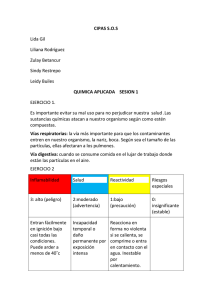
ASIGNATURA: QUÍMICA INORGÁNICA
Anuncio

FACULTAD Ciencias Naturales e Ingenierías. PROGRAMA ACADÉMICO Tecnología en Recursos Ambientales y Tecnología en Petróleo y Gas en Superficie ASIGNATURA: QUÍMICA INORGÁNICA Tipo Asignatura: TEORICA Créditos: 4 TP: 64 Código asignatura: DCB 015 Requisitos: NINGUNO TI: 128 Semestre académico: I y II JUSTIFICACIÓN: Desde el principio de la historia el Hombre se ha esforzado por comprender y transformar su mundo físico. Actualmente, gracias a la herencia, conocimientos empíricos milenarios y a los modelos teóricos que para entender la materia propone la Química, el hombre moderno es capaz de planificar y controlar el cambio de su entorno. Al estudiar los modelos teóricos básicos propuestos por la Química Inorgánica, nuestros estudiantes comprenderán, al mismo tiempo, el papel central que ha jugado esta ciencia en la evolución de la humanidad y los graves problemas ecológicos que su uso irracional ha provocado en el ecosistema los últimos 50 años. En esta asignatura se busca que los estudiantes incentiven el espíritu creativo, intuitivo, racional y analítico y se apropien de los fundamentos básicos de la química inorgánica para que estén en capacidad de plantear posibles soluciones a problemas ambientales. OBJETO DE ESTUDIO: La transformación, composición e interrelación de la materia estructurada por fenómenos observables que constituyen el universo y que ocurren por medio de cambios fisicoquímicos que son el soporte fundamental en los procesos naturales que genera el medio ambiente. OBJETIVO DE FORMACIÓN: Al terminar la asignatura los estudiantes estarán en capacidad de comprender las transformaciones químicas que sufre la materia y como interactuar, en forma responsable, para propiciar la conservación y buen uso del medio ambiente. COMPETENCIAS TRANSVERSALES: Expresión comunicativa escrita Capacidad para obtener y procesar información de diferentes fuentes Capacidad para trabajar y aprender en equipo Interpretar la información de diferentes fuentes clasificándola de acuerdo a las necesidades propias del entorno. COMPETENCIAS ESPECÍFICAS DE LA ASIGNATURA: Relacionar las propiedades de la materia y de la energía, su comportamiento y relación con los fenómenos naturales. Explicar la importancia de los modelos atómicos y la variabilidad de la estructura atómica en los diferentes elementos de la tabla periódica. Explicar los tipos de reacciones químicas y efectuar cálculos estequiométricos que involucren relaciones de masa, volumen en reacciones químicas balanceadas. Aplicar los conceptos de soluciones, preparación de soluciones de diferentes concentraciones y su incidencia en la conservación y aprovechamiento de los recursos naturales. ESTRUCTURA DE LA ASIGNATURA POR UNIDADES TEMÁTICAS Horas COMPETENCIAS ESPECÍFICAS Relacionar las propiedades de la materia y de la energía, su comportamiento y relación con los fenómenos naturales Explicar el enlace químico teniendo en cuenta la estructura atómica de los elementos de acuerdo a su ubicación en la tabla periódica Explicar los tipos de reacciones químicas y efectuar cálculos estequiométricos que involucren relaciones de moles, masa, volumen en reacciones químicas balanceadas. UNIDADES TEMÁTICAS Semanas TP TI 2 8 16 4 16 32 5 20 40 MATERIA Y MEDICIÓN TABLA PERIODICA Y ENLACE QUIMICO REACCIONES QUÍMICAS Y ESTEQUIOMETRÍA Aplicar los conceptos de soluciones, preparación de soluciones de diferentes concentraciones y su incidencia en la conservación y aprovechamiento de los recursos naturales. 5 20 40 16 64 128 SOLUCIONES Total UNIDAD 1: MATERIA Y MEDICION COMPETENCIA: Relacionar las propiedades de la materia y de la energía, su comportamiento y relación con los fenómenos naturales. RESULTADOS DE APRENDIZAJE: Identifica las propiedades físicas y químicas de la materia. Clasifica los tipos de elementos, compuestos y mezclas que se presentan en la naturaleza. Realiza cálculos con factores de conversión. Relaciona los diferentes sistemas de unidades. Utiliza los factores de conversión en la medición de propiedades fisicoquímicas de la materia. CONTENIDOS Conocimientos Materia y Energía. Propiedades físicas y químicas de la materia. Cambios físicos y químicos de la materia Unidades de medición Sistema de unidades de medida Factores de conversión. Habilidades Diferenciación, clasificación y cuantificación de las manifestaciones de la materia. Describir las propiedades físicas y químicas de la materia. Diferenciar las magnitudes fundamentales y derivadas. Realizar conversiones de medida en las diferentes unidades y sistemas. ACTIVIDADES DE ENSEÑANZA Y APRENDIZAJE En el Aula Fuera del Aula Socialización en mesa redonda sobre un tema en particular. Aplicación de cuestionario sobre ideas previas. Explicación del docente. Revisión por muestreo del trabajo extraclase. Desarrollo de ejercicios en grupo con sustentación en clase. Taller evaluativo en grupo. Socialización de quices, exámenes y trabajos Búsqueda de información en libros, en la Web sobre temas específicos. Resolución de problemas planteados en clase. Desarrollo de ejercicios con apoyo de Guías-Docente. UNIDAD 2: TABLA PERIODICA Y ENLACE QUIMICO COMPETENCIA: Explicar el enlace químico teniendo en cuenta la estructura atómica de los elementos de acuerdo a su ubicación en la tabla periódica. RESULTADOS DE APRENDIZAJE. El estudiante: Explica la sistematización de la tabla periódica y como los elementos químicos se combinan para formar sustancias con características físicas y químicas particulares mediante enlaces químicos. Identifica los grupos funcionales inorgánicos y los compuestos que se forman nombrándolos de acuerdo con las reglas IUPAC. CONTENIDOS Conocimientos Tabla periódica Habilidades Manejo de la información encontrada en la Propiedades periódicas de los elementos Descripción de los elementos que tienen incidencia en el medio ambiente Enlaces químicos y clasificación de los compuestos según el tipo de enlace. Nomenclatura compuestos químicos inorgánicos. tabla periódica Identificación de algunas propiedades periódicas de los elementos. Reconocimiento de los enlaces químicos y la relación de éstos con los diferentes tipos de compuestos químicos que alteran o benefician el medioambiente. Identificación de las funciones de química inorgánica ACTIVIDADES DE ENSEÑANZA Y APRENDIZAJE En el Aula Fuera del Aula Socialización en mesa redonda sobre un tema en particular. Aplicación de cuestionario sobre ideas previas. Explicación del docente. Revisión por muestreo del trabajo extraclase. Desarrollo de ejercicios en grupo con sustentación en clase.. Taller evaluativo en grupo. Socialización de quices, exámenes y trabajos Búsqueda de información en libros, en la Web sobre temas específicos. Resolución de problemas planteados en clase. Desarrollo de ejercicios con apoyo de Guías-Docente. Elaboración de un informe de lectura UNIDAD 3: REACCIONES QUIMICAS Y ESTEQUIOMETRIA COMPETENCIA: Explicar los tipos de reacciones químicas y efectuar cálculos estequiométricos que involucren relaciones de masa, moles y volumen en reacciones químicas balanceadas. RESULTADOS DE APRENDIZAJE. El estudiante: Identifica los tipos de reacciones químicas que se llevan a cabo en la formación de compuestos químicos de su entorno. Balancea reacciones químicas por diferentes métodos teniendo en cuenta la transformación de la materia y las proporciones definidas en las cuales se lleva a cabo una reacción química. Realiza cálculos estequiométricos para cuantificar la eficiencia de una reacción química, e identificar el reactivo límite y los reactivos en exceso. CONTENIDOS Conocimientos Habilidades Teorías de los gases ideales y reales Tipos de reacciones químicas y sus efectos en el ambiente Balance de ecuaciones químicas Eficiencia de una reacción: pureza y rendimiento. Reactivo límite y reactivo en exceso Cálculos químicos en reacciones químicas Realización de balanceo de ecuaciones químicas por diferentes métodos. Determinación del reactivo límite y la masa molar Realización de cálculos de eficiencia de una reacción química Realización de cálculos estequiométricos aplicando las leyes de los gases. ACTIVIDADES DE ENSEÑANZA Y APRENDIZAJE En el Aula Fuera del Aula Socialización en mesa redonda sobre un tema en particular. Aplicación de cuestionario sobre ideas previas. Explicación del docente. Revisión por muestreo del trabajo extraclase. Desarrollo de ejercicios en grupo con sustentación en clase.. Taller evaluativo en grupo. Socialización de quices, exámenes y trabajos. Búsqueda de información en libros, en la Web sobre temas específicos. Resolución de problemas planteados en clase. Desarrollo de ejercicios con apoyo de Guías-Docente. UNIDAD 4: SOLUCIONES COMPETENCIA: Aplicar los conceptos de soluciones, preparación de soluciones de diferentes concentraciones y su incidencia en el aprovechamiento y conservación de los recursos naturales. RESULTADOS DE APRENDIZAJE. El estudiante: Realiza, cálculos con soluciones expresando en forma correcta su concentración, en formas físicas y químicas, y su aplicación en el análisis de los recursos naturales. Resuelve, ejercicios de cálculo de pH de soluciones de electrolitos fuertes, soluciones amortiguadoras e hidrólisis. CONTENIDOS Conocimientos Componentes de una solución: soluto y solvente. Tipos de solutos: electrolitos fuertes y no electrolitos. Formas físicas y química de expresar la concentración de una solución. Factor de dilución y concentración de una solución. Soluciones estándar e indicadores. pH Propiedades coligativas Habilidades Calculo del pH de una solución. Resolución de ejercicios de concentración de una solución y sus aplicaciones frecuentes en el análisis de agua, suelos, aire. Resolución de ejercicios de cálculo de pH en diferentes soluciones y su incidencia en la optimización de los diferentes recursos naturales. ACTIVIDADES DE ENSEÑANZA Y APRENDIZAJE En el Aula Socialización en mesa redonda sobre un tema en particular. Aplicación de cuestionario sobre ideas previas. Explicación del docente. Revisión por muestreo del trabajo extraclase. Desarrollo de ejercicios en grupo con sustentación en clase.. Taller evaluativo en grupo. Socialización de quices, exámenes y trabajos Fuera del Aula ESTRATEGIAS DE ENSEÑANZA Al estudiante se le entregará una guía de estudio o guía taller, la cual se trabajará tanto dentro como fuera de clase. En la siguiente clase el docente evaluará al estudiante y resolverá dudas e inquietudes que hayan surgido del trabajo en la guía. Búsqueda de información en libros, en la Web sobre temas específicos. Resolución de problemas planteados en clase. Desarrollo de ejercicios con apoyo de Guías-Docente. ESTRATEGIAS DE APRENDIZAJE Leer el documento entregado, subrayando las ideas importantes del texto. Realizar a los estudiantes preguntas intercaladas del tema trabajado. Realizar analogías para lograr un mayor entendimiento del tema. Diseñar mapas conceptuales que contengan conceptos claves y explicaciones del tema CRITERIOS INSTITUCIONALES DE EVALUACIÓN La evaluación se hará teniendo como referente los resultados de aprendizaje previstos en cada unidad y corte, los cuales serán comunicados a los estudiantes antes de valorar su desempeño. Se hará uso de diversas estrategias para recoger, como mínimo, tres evidencias de aprendizaje en cada uno de los tres cortes que establece el calendario académico semestral. Para garantizar un seguimiento efectivo del aprendizaje es necesario realizar una evaluación diagnóstica al comienzo del semestre con el fin de determinar los presaberes requeridos para iniciar el nuevo proceso de aprendizaje. Igualmente, se deben realizar evaluaciones periódicas para observar progresos en el aprendizaje de los estudiantes. Al finalizar casa corte se realizará una evaluación escrita (parcial) para evidenciar los aprendizajes esperados y certificarlos mediante una calificación (valoración cuantitativa) en una escala de 0.0 a 5.0. INSTRUMENTOS DE EVALUACIÓN Talleres de evaluación por parejas. Evaluación escrita) Proyecto de aula BIBLIOGRAFÍA BIBLIOGRAFIA BASICA BROWN, T.; LEMAY, E y BURSTEN, B. Química, La ciencia central. México: Prentice Hall Hispanoamericana S.A., 2003. CHANG, R. Química General. México: Editorial Mc Graw-Hill. 1995. BIBLIOGRAFIA SUGERIDA HEIN, Morris y ARENA, Susan. Fundamentos de química. México: Editorial Thomson, 2003. HILL, John y KOLB, Doris. Química para el Nuevo Milenio. 8ª Ed. México: Prentice Hall, 1999. WHITTEN, Kenneth. Química Inorgánica. México: Mc Graw-Hill, 1998. MORTIMER, C. Química. México: Editorial Iberoamericana, 1983. SAWYER, Clair. Química para Ingeniería Ambiental México: Editorial Mc Graw-Hill. VALENZUELA, Calahorro, Cristóbal. Introducción a la química Inorgánica. Mc Graw-Hill, 2003. www.merck.com. w.w.w.educaplus.net/sp2002/index_sp.html w.w.w.liv.ac.uk/Chemistry/Links/refperiodic.html http://b.cartage.org.Lb/webbio/1NDX/E/925/Toc.html http://scat0.phys.psu.edu/ask/chemistry/Default.html