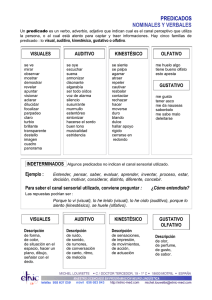
DESCRIPCIÓN DE LAS VÍAS OLFATIVAS (Roseta – Bulbo olfativo
Anuncio

DESCRIPCIÓN DE LAS VÍAS OLFATIVAS (Roseta – Bulbo olfativo) Y EVALUACIÓN DE LOS EFECTOS HISTOPATOLÓGICOS CAUSADOS POR EL Roundup® Activo SOBRE EL SISTEMA OLFATIVO DE ALEVINOS DE CACHAMA BLANCA (Piaractus brachypomus). TRABAJO DE GRADO DIANA CAROLINA CASTAÑEDA CORTÉS UNIVERSIDAD MILITAR NUEVA GRANADA FACULTAD DE CIENCIAS BÁSICAS BIOLOGÍA APLICADA Bogotá, 2012 DESCRIPCIÓN DE LAS VÍAS OLFATIVAS (Roseta – Bulbo olfativo) Y EVALUACIÓN DE LOS EFECTOS HISTOPATOLÓGICOS CAUSADOS POR EL Roundup® Activo SOBRE EL SISTEMA OLFATIVO DE ALEVINOS DE CACHAMA BLANCA (Piaractus brachypomus). DIANA CAROLINA CASTAÑEDA CORTES CÓDIGO. 0500516 TRABAJO DE GRADO Para optar al título de Biólogo HERNÁN HURTADO GIRALDO, Ph.D. DIRECTOR EDWIN GOMÉZ RAMÍREZ M.Sc. CODIRECTOR UNIVERSIDAD MILITAR NUEVA GRANADA FACULTAD DE CIENCIAS BÁSICAS BIOLOGÍA APLICADA Bogotá, 2012 2 AGRADECIMIENTOS A mis padres Maureen Helena Cortés Moreno y Moisés Castañeda Tibaquirá, como también a mis hermanas Eliana, Camila, Daniela y Gabriela por su esfuerzo, su constante apoyo y paciencia a lo largo de mi carrera. Al Doctor Hernán Hurtado Giraldo por su colaboración y orientación continua a lo largo del desarrollo de este trabajo. Al grupo de investigación de Virología de la Universidad del Bosque, en especial al Doctor Jaime Eduardo Castellanos Parra y a la Doctora Myriam Lucía Velandia Romero, por su colaboración en el préstamo de equipos para la realización de este trabajo A Oswaldo Tovar, por su comprensión, paciencia, colaboración y apoyo incondicional lo largo de toda mi formación académica. A Edwin Gómez Ramírez y Martha Obando Bulla por su apoyo durante la realización de este trabajo. A Sheryll Corchuelo por su paciencia y compresión durante mi carrera, además de su ayuda en todas las etapas del trabajo. A mis demás compañeros y amigos de carrera en especial Juan Camilo Bejarano y Juan Sebastián Dueñas por su incondicional apoyo. 3 TABLA DE CONTENIDO RESUMEN 12 1. 14 JUSTIFICACIÓN 2. REVISIÓN BIBLIOGRÁFICA 2.1. 16 CACHAMA BLANCA (Piaractus brachypomus) 16 2.1.1. Características Morfológicas 16 2.1.2. Hábitat 17 2.1.3. Hábitos Alimenticios 17 2.1.4. Reproducción 18 2.1.5. Piscicultura 18 2.2. SISTEMA OLFATIVO 19 2.2.1. Roseta Olfativa 20 2.2.2. Bulbo Olfativo 21 2.2.3. Glomérulos: unidades funciónales del sistema olfativo. 22 2.2.4. Vías Olfativas 23 2.3. GLIFOSATO - Roundup® 24 2.3.1. Naturaleza y Efectos 25 2.3.2. Efectos Sobre Los Ecosistemas Acuáticos 26 3. OBJETIVOS 3.1. OBJETIVO GENERAL 3.2. OBJETIVOS ESPECÍFICOS 29 29 29 4. MATERIALES Y MÉTODOS 30 4.1. UBICACIÓN DEL ENSAYO 30 4.2. MATERIAL BIOLÓGICO 4.3. SUSTANCIA EXPERIMENTAL 30 4.4. DISEÑO EXPERIMENTAL 31 4.5. OBTENCIÓN DE MUESTRAS 31 30 4 4.6. TINCIÓN H&E Y NISSL 31 4.7. MICROSCOPIA ÓPTICA DE ALTA RESOLUCIÓN (MOAR) 4.8. TRAZADO ANTERÓGRADO CON DiI 34 4.9. DESCRIPCIÓN HISTOLÓGICA 34 4.10. ANÁLISIS ESTADÍSTICO 35 5. RESULTADOS 5.1. 32 36 DESCRIPCIÓN HISTOLÓGICA DEL SISTEMA OLFATIVO 37 5.1.1. Roseta olfativa 37 5.1.2. Bulbo olfativo 41 5.2. ALTERACIONES HISTOPATOLÓGICAS 45 5.2.1. Roseta olfativa 45 5.2.2. Bulbo olfativo 46 5.3. TRAZADO ANTERÓGRADO ROSETA-BULBO OLFATIVO 6. DISCUSIÓN 49 52 6.1. SISTEMA OLFATIVO 52 6.2. ROSETA OLFATIVA 52 6.3. BULBO OLFATIVO 55 6.4. ALTERACIONES HISTOPATOLÓGICAS 56 6.5. TRAZADO ANTERÓGRADO ROSETA-BULBO OLFATIVO 59 7. CONCLUSIONES 61 8. RECOMENDACIONES 62 BIBLIOGRAFÍA 63 5 LISTA DE FIGURAS Figura 1. Alevino de P. brachypomus (www.wetwebmedia.com) Figura 2. Esquema que representa las tres vías del sistema olfativo en peces, observando las distribuciones axónicas de las células cripta (rojo), las neuronas sensoriales ciliadas (azul), y las neuronas sensoriales microvellosas (verde), en el bulbo olfativo y el tracto olfativo (Tomado de Hamdani & Døving, 2007). Figura 3. Vista lateral del sistema olfativo de P. brachypomus. Roseta olfativa (RO), Lámela olfativa (LO), Rafe (Ra) Nervio olfativo (NO), Bulbo olfativo (BO), Telencéfalo (T). Figura 4. A) Lamela olfativa de P. brachypomus se observa el núcleo central (NC) y las dos capas del epitelio olfativo (CE), epitelio olfativo no sensorial (Flechas negras). B) Epitelio olfativo cilíndrico estratificado con presencia de células mucosas (CM) y células ciliadas no sensoriales (flechas indican los cilios), en el núcleo central se observa tejido conectivo (TC) y vascularización (vaso sanguíneo VS). H&E. Figura 5. Epitelio olfativo no sensorial de la lamela de P. brachypomus. Se observa células de soporte (CS), células basales con abundante heterocromatina (Flechas punteadas negras), células basales con poca heterocromatina (Flechas punteadas blancas), núcleo central (NC), vaso sanguíneo (VS) y fibras nerviosas (FN). Azul de toluidina. Figura 6. Epitelio olfativo sensorial de la lamela olfativa de P. brachypomus. Neuronas receptoras olfativas ciliadas (ORNc). Neuronas receptoras olfativas microvellosas (ORNm), células basales con abundante heterocromatina (Flechas punteadas negras), células basales con poca heterocromatina (Flechas punteadas blancas), vaso sanguíneo (VS), lamina basal (punta de flechas). Azul de toluidina. Figura 7. Epitelio olfativo sensorial de la lamela de P. brachypomus. Neuronas receptoras olfativas microvellosas (ORNm), Célula Cripta (CC). Células ciliadas no sensoriales (CCN), células de soporte (CS), vaso sanguíneo (VS), Protrusión de la dendrita de las 6 neuronas receptoras olfativas ciliadas y microvellosas (punta de flechas). Azul de toluidina. Figura 8. Corte trasversal del bulbo olfativo de P. brachypomus. Capa del nervio olfativo (CNO), Capa glomerular (CGL), Capa de células mitrales (CCM) y Capa interna de células (CIC). H&E. Figura 9. Corte trasversal del bulbo olfativo de P. brachypomus. Capa del nervio olfativo (CNO), Capa glomerular (CGL), Capa de células mitrales (CCM) y Capa interna de células (CIC). H&E. Figura 10. Bulbo olfativo de P. brachypomus. A) Capa del nervio olfativo (CNO) y capa glomerular (CGL) se observa: Pia madre (PM), glomérulos (GL), células mitrales (CM), célula de glia (flechas punteadas), Paquete de fibras nerviosas (PFN) y vaso sanguíneo (VS). B) Capa de células mitrales se observa: células mitrales (CM) y prolongaciones dendríticas de estas células (punta de flechas). Azul de toluidina. Figura 11. Capa de células mitrales y capa interna de células del bulbo olfativo de P. brachypomus. Células mitrales (CM), células ruffed (CR), células granulares (flechas punteadas), prolongaciones dendríticas de las células ruffed (punta de flechas) y vaso sanguíneo (VS). Azul de toluidina. Figura 12. Lamela olfativa de P. brachypomus. Cortes del tratamiento 2. A) Células granulares eosinofílicas (Flechas) núcleo central (NC). B) Epitelio olfativo no sensorial (EONS), Células granulares eosinofílicas (Flechas), Tejido conectivo (TC). H&E. Figura 13. Lamela olfativa de P. brachypomus. Cortes del tratamiento 3. A) Células granulares eosinofílicas (Flechas). B) Detalle de las células granulares eosinofílicas en el epitelio olfativo no sensorial. C) Presencia de Células granulares eosinofílicas (Flechas) en la región dorsal de la lamela olfativa. H&E. Figura 14. Bulbo olfativo de P. brachypomus. Cortes del tratamiento 2 A-E) Células granulares (Flechas), vaso sanguíneo (VS). Capa del nervio olfativo (CNO), Pia madre (PM) y capa glomerular (CGL). Azul de toluidina. 7 Figura 15. Bulbo olfativo de P. brachypomus. Cortes del tratamiento 3 A-E) Células granulares (Flechas), vaso sanguíneo (VS). Capa del nervio olfativo (CNO), Pia madre (PM), capa glomerular (CGL) y célula mitral (CM). Azul de toluidina. Figura 16. A) Vista dorsal del cerebro de P. brachypomus, que muestra el nivel de corte de la figura de la derecha, bulbo olfatorio (BO), telencéfalo (T) B) Corte longitudinal del bulbo olfatorio (BO), donde se observa el nervio olfatorio (NO), la inervación de los axones provenientes de la roseta olfativa en el bulbo que conforman la capa del nervio olfatorio (CNO) hasta llegar a la capa glomerular. Figura 17. Niveles de Corte del bulbo olfativo de P. brachypomus. Figura 18. Cortes trasversales del bulbo olfativo de rostral (A) a caudal (H) (ver figura 7), donde se muestra el patrón de distribución de los glomérulos observados en los bulbos olfativos de P. brachypomus. Agrupaciones glomerulares identificadas: Plexo anterior (ap), Grupo dorsal (dc), Plexo de la cadena lateral (lc), Asociación de glomérulos del grupo dorsal (a-e), Glomérulos de la tripleta ventral (u-w). Glomérulos identificados: Glomérulo mediodorsal posterior1 (f), Glomérulo mediodorsal posterior2 (g), Glomérulo mediodorsal (h), Glomérulo medioanterior (i), Glomérulo medio alargado (k), Glomérulo de la cadena lateral2 (m), Glomérulo lateroventral posterior (q), Glomérulo ventroanterior (r), Glomérulo ventroposterior (s) y Glomérulo ventromedial (t). 8 LISTA DE TABLAS Tabla 1. Tiempos de deshidratación Tabla 2. Mezclas de epón con óxido de propileno y tiempos de inclusión Tabla 3. Datos del promedio de las variables de crecimiento de P. brachypomus en los tres tratamientos de los dos tiempos evaluados. Valores con letras iguales no difieren significativamente (P>0,05). Tabla 4. Parámetros de Calidad de agua (promedio, mínimo y máximo) obtenidos durante los 30 días de experimentación con P. brachypomus. Tabla 5. Número de lamelas en diferentes especies de teleósteos. 9 LISTA DE CONVENCIONES a-e, Asociación de glomérulos del grupo dorsal AMPA, Ácido Aminometilfosfonico ap, Plexo Anterior BO, Bulbo Olfativo CC, Células Cripta CCM, Capa de Células Mitrales CCN, Células Ciliadas No Sensoriales CG, Célula Granular CGE, Células Granulares Eosinofílicas CGL, Capa Glomerular CIC, Capa Interna de Células CM, Células Mucosas CNO, Capa del Nervio Olfativo CR, Células Ruffed CS, Células de Soporte dc, Grupo Dorsal DiI, 1'- Dioctadecil-3,3,3',3'- Tetramethilindocarbocianina-Perclorato. EONS, Epitelio Olfativo No Sensorial FN, Fibras Nerviosas g, Glomérulo mediodorsal posterior GL, Glomérulos h, Glomérulo mediodorsal i, Glomérulo medioanterior IPA, Sal Ácida Isopropilamina de Glifosato k, Glomérulo medio alargado lc, Plexo de la cadena lateral LO, Lámela Olfativa 10 LOT, Tracto Olfativo Lateral m, Glomérulo de la cadena lateral2 MOT, Tracto Olfativo Medio NC, Núcleo Central NO, Nervio Olfativo ORNc, Olfactory Receptor Neurons ciliadas ORNm, Olfactory Receptor Neurons Microvellosas ORNs, Olfactory Receptor Neurons PFN, Paquete de Fibras Nerviosas PGF, Prostaglandinas de la Serie F. PM, Pia Madre POEA, Piliexietilamina q, Glomérulo lateroventral posterior r, Glomérulo ventroanterior Ra, Rafe RO, Roseta Olfativa s, Glomérulo ventroposterior t, Glomérulo ventromedial T, Telencéfalo T1, tratamiento 1 control T2, tratamiento 2 (0.1 mg/l) T3, tratamiento 3 (1 mg/l) TC, Tejido conectivo TRPC2, Transient Receptor Potential C2 u-w, Glomérulos de la tripleta ventral VS, Vaso Sanguíneo 11 RESUMEN El glifosato, en su presentación comercial Roundup® Activo es un herbicida de amplio uso en Colombia. Se ha reportado que en Piaractus brachypomus este herbicida puede generar alteraciones a nivel cerebral incluyendo los bulbos olfatorios y se plantea que una de sus posibles vías de entrada al sistema nervioso central es el sistema olfativo. Sin embargo, en esta especie se desconoce su conformación histológica, la conectividad e inervación de la roseta - bulbo olfativo si estas son alteradas o no por este herbicida. Se utilizaron 45 alevinos de cachama blanca tratados con tres dosis (0, 0.1 y 1 mg/l) de Roundup® Activo durante un mes. Trascurrido un mes los cerebros y rosetas olfativas fueron disectados, fijados y procesados para las técnicas de Nissl, H&E y MOAR. Se realizó el trazado anterógrado (Roseta-Bulbo olfativo) con cristales de Dil. No se presentaron diferencias significativas en los datos de crecimiento registrados durante el experimento entre los tres tratamientos evaluados. P. brachypomus presenta bulbos olfativos sésiles y una roseta olfativa redondeada con 26 a 28 las lamelas radiales. El epitelio olfativo se distribuye de manera aleatoria, en el epitelio sensorial se identificaron tres tipos de neuronas sensoriales olfativas: las microvellosas, las ciliadas y las células cripta y en epitelio olfativo no sensorial las células ciliadas no sensoriales, las células mucosas, las células de soporte y las células basales. El bulbo olfativo está compuesto por cuatro capas: la capa del nervio olfativo, la capa glomerular, la capa de células mitrales y la capa interna de células, adicionalmente se identificaron 3 tipos de células neuronales: mitrales, ruffed y granulares. Los individuos expuestos a Roundup® Activo presentan células granulares que se identificaron principalmente en región basal del epitelio olfativo no sensorial, así como asociadas a los vasos sanguíneos de la pía madre en el bulbo olfativo. Fueron identificados 10 glomérulos como unidades morfológicas individuales, entre los que se destacan los del grupo lateral, la región media y la región ventral del bulbo. El patrón de inervación y la organización topográfica de los glomérulos anteriormente descritos, no presentaron diferencias en los tres tratamientos evaluados. La presencia de células granulares en los tejidos del sistema olfativo de P. brachypomus demuestra que las concentraciones subletales Roundup® Activo (0.1 y 1 mg/l) utilizadas en este trabajo causan alteraciones a nivel tisular en la roseta y bulbo olfativo, razón por la cual se plantea la idea de que el sistema olfativo es una de las posibles vías de entrada 12 del Roundup® Activo al sistema nervioso central. Finalmente teniendo en cuenta que el sistema olfativo está directamente implicado procesos vitales para los peces como la alimentación, la reproducción y el reconocimiento intra e inter específico; exposiciones prolongadas a este herbicida podrían afectar estos procesos vitales para el desarrollo de P. brachypomus y su interacción con el ambiente. 13 1. JUSTIFICACIÓN El glifosato es un herbicida de amplio espectro y se reporta que es el más usado en el mundo. Sin embargo, el uso del glifosato no solo afecta los ecosistemas terrestres, este también puede llegar a los ecosistemas acuáticos, ya sea por lixiviación, escorrentía, aspersión accidental y/o por el viento (Kolpin et al. 2006). Varios estudios reportan los daños que puede causar este herbicida en los organismos acuáticos, especialmente sobre los peces, dentro de las que se han descrito alteraciones a nivel celular y tisular que tienen grandes implicaciones en aspectos importantes de la vida como son el comportamiento y la reproducción (Lushchak et al. 2009, Glusczak et al. 2006). En Colombia, bajo la formulación comercial Roundup® Ultra, el glifosato aparte de ser utilizado en las prácticas tradicionales agrícolas para el control de arvenses, también es utilizado en combinación con otras sustancias surfactantes para la erradicación de cultivos ilícitos. Sin embargo, para la erradicación de estos cultivos, se utilizan dosis muy altas de Roundup® Ultra, los fabricantes de este producto recomiendan que las concentraciones para la mezcla de aspersión estén entre 1,6 y 7,7 % y que la tasa aspersión sea de 2,33 l/ha, pero en Colombia se utilizan concentraciones de hasta 44 % y una tasa de aspersión de 30,8 l/ha (Eslava et al. 2007). Considerando que se ha reportado que el Roundup® causa problemas en las superficies respiratorias de los organismos acuáticos (Dinehart et al. 2010), y que en Cachama Blanca (Piaractus brachypomus) existen estudios que demuestran las alteraciones morfológicas causadas por esta formulación de glifosato en órganos como hígado, riñón, estómago, intestino, branquias, piel y cerebro (Eslava et al. 2007). Aun así, son pocos los estudios que se han realizado sobre el efecto de este herbicida a nivel del sistema nervioso central, en particular en el sistema olfativo. Los trabajos adelantados por el grupo de Sanidad de la Universidad de los Llanos reportan alteraciones en el telencéfalo y los bulbos olfativos de esta especie, planteando que una de las posibles vías de entrada de este herbicida al sistema nervioso central es el sistema olfativo. 14 A pesar que el cultivo de P. brachypomus, ha sido uno de los más importantes en Colombia en las últimas décadas, ocupando el tercer lugar de los peces de consumo más cultivados (CCI 2011, Pineda et al. 2004). En términos generales se conoce poco de la biología básica y la conformación histológica de sus tejidos. Algunos de estos estudios han sido adelantados por el grupo de Ictiología de la Universidad Militar Nueva Granada, enfocados en la descripción histológica del sistema digestivo, hipófisis, ganglios de la raíz dorsal y cerebro de esta especie (Caldas et al. 2008, Jaramillo et al. 2009, Muñoz et al. 2006, Vargas et al. 2006). Sin embargo la conformación tisular del sistema olfativo, la inervación y conectividad de la roseta olfativa- nervio olfativo - bulbo olfativo, en cachama blanca no han sido estudiadas en detalle. A pesar de ser uno de los sistemas sensoriales más importantes en la interacción de los peces con su ambiente por estar relacionado directamente con la obtención de alimento, la defensa de predadores y la reproducción (Hamdani & Døving 2007). Teniendo en cuenta las razones anteriormente expuestas y que P. brachypomus es una especie endémica de las regiones de la Orinoquía y Amazonía (Agudelo et al. 2011), las cuales son sometidas a continuas fumigaciones con herbicida, esta especie sería un buen modelo estudio para determinar los efectos causados por el Roundup® Activo. Este estudio busca describir de manera detallada las posibles alteraciones tisulares generadas por dos concentraciones subletales de Roundup® Activo (0.1 y 1 mg/l) sobre las diferentes estructuras del sistema olfativo de P. brachypomus. De esta forma es posible corroborar y enriquecer los reportes acerca de los posibles efectos negativos de este herbicida con el fin de promover eventualmente su mejor manejo y/o control, además de contribuir con el conocimiento relacionado a la biología básica de la especie. 15 2. REVISIÓN BIBLIOGRÁFICA 2.1. CACHAMA BLANCA (Piaractus brachypomus) Reino: Animalia Filo: Chordata Clase: Actinopterygii Orden: Characiformes Familia: Characidae Subfamilia: Serrasalminae Género: Piaractus Especie: P. brachypomus (Cuvier, 1818) Figura 1. Alevino de P. brachypomus (www.wetwebmedia.com). Nombre común: Cachama, Cachama blanca, Paco, Pacú blanco, Morocoto, Pirapitinga, Caranha, Tambaquí. 2.1.1. Características Morfológicas Es un pez de color plateado con la región dorsal oscura, de cuerpo romboidal, posee de 70 a 89 escamas cicloideas pequeñas. Tiene abdomen sin sierras y espina predorsal ausente. La aleta adiposa no posee radios, en cambio la dorsal posee de 12 a 13 radios. Los adultos y juveniles tienen una mancha oscura en el opérculo y tonalidades de rojo 16 intenso en la parte anterior del abdomen (Figura 1.). Se ha reportado una longitud de hasta 85 cm y un peso de 20 Kg (Salinas & Agudelo 2000). 2.1.2. Hábitat P. brachypomus es un pez originario de las cuencas de los ríos Orinoco, Amazonas y sus afluentes, (Díaz & López 1993, González 2001), vive en aguas con temperaturas de 23 a 30 C, con una concentración de oxígeno disuelto de 3 a 6.5 mg/l y pH de 6 a 7.5 (Salinas & Agudelo 2000). En el Amazonas los juveniles por lo general, se encuentran en lagos de aguas claras entre las raíces de las macrófitas, y los adultos en los tributarios de los ríos y sus cabeceras. En el Orinoco la cachama tiene hábitos diurnos, vive asociada a áreas cubiertas de gran cantidad de vegetación y comúnmente se encuentra en el cauce principal de los ríos, esteros, lagunas y caños (Agudelo et al. 2011). 2.1.3. Hábitos Alimenticios Es una especie omnívora predominantemente herbívora en estado adulto. La dieta de P. brachypomus varía durante diferentes etapas de su ciclo de vida, en los primeros estadios larvales los individuos se alimentan de plancton, mientras que la dieta de los juveniles y adultos, se basa en frutos en forma de baya o drupa como la guayaba (Psidium guajaba) y guayabilla (Bellusia grassularoides). Se han registrado en los contenidos estomacales semillas de Sapotáceas (Pouteria sp.), Arecacea (Geonoma sp.), Anacardiacea (Spondias sp.) y Pasifloraceas (Passiflora sp.) (guayaba y guayabilla), semillas de reventillo (Mabea sp.), carutillo (Genipa sp.), jobos (Spondias mombin) totumos (Crescentia cujete), y gramíneas (Oryza sp.) (Salinas & Agudelo 2000). Sin embargo durante los meses de sequía, cuando los peces abandonan los bosques inundados y retornan al lecho de los ríos y lagos, aumenta el consumo de insectos acuáticos, larvas, invertebrados bentónicos, crustáceos planctónicos entre otras fuentes de origen animal. Por tal motivo se considera un pez oportunista que cambia sus hábitos alimenticios, según la disponibilidad de estos en el medio ambiente (Agudelo et al. 2011). 17 2.1.4. Reproducción La cachama alcanza su madurez sexual después de los tres o cuatro años de edad. Tiene una estrategia reproductiva estacional, en la cual desovan solo durante la época de lluvias una vez al año con mayor intensidad en los meses de Mayo y Junio, estos desoves son completamente sincronizados y adaptados a los cambios hidrobiológicos. La fecundidad de esta especie es alta, en promedio una hembra puede poner entre 193.000 y 1,423.000 ovocitos. Las hembras, colocan sus huevos en el cauce principal de los ríos y no tienen cuidado parental (Agudelo et al. 2011). 2.1.5. Piscicultura P. brachypomus es el pez nativo de mayor importancia a nivel comercial en Colombia. Debido a su amplia producción ocupa el tercer puesto de los peces más cultivados en el país después de la Tilapia roja y la plateada. Según el informe de Pesca y Acuicultura Colombia 2010 de la Corporación Colombia Internacional CCI, para el 2010 se presentó una producción cercana a las 8372 toneladas, siendo el departamento del Meta el mayor productor con 2422 toneladas. La producción de la cachama incremento un 17,83% con respecto al informe del año anterior. Por otra parte los desembarcos de producto pesquero de consumo reportados para el 2010 de cachama en la región del Orinoquía fueron de 33,8 desembarcos, que comparados con los años anteriores han ido disminuyendo, debido a que para el 2005 se reportan cerca de 211,1 siendo el mayor en los últimos diez años, en el 2006 y 2007 hubo 51, 5 y 50,2 desembarcos respectivamente y para el 2009 esta cifra alcanzo 41 desembarcos (CCI 2011). En Colombia el cultivo de cachama es uno de los más desarrollados entre los peces dulceacuícolas de cultivo (González 2001). Las características que favorecen el cultivo de la cachama son: rápido crecimiento, excelente capacidad de conversión alimenticia, hábitos alimenticios omnívoros, por lo que se adaptan fácilmente a recibir una gran variedad de alimentos naturales y sobrantes de procesos industriales y domésticos. Las cachamas aceptan alimento concentrado, soportan en cierto nivel parásitos y enfermedades, se adaptan a aguas de diversas características químicas pero carentes de tóxicos, se desarrollan muy bien en temperaturas entre los 23°C y 30°C en promedio y 18 resisten grandes bajas de oxígeno disuelto, mientras esto no se prolongue mucho tiempo (Díaz & López 1993). Además de ser una especie de fácil manejo en estanques de cultivo (Estévez 1989), tiene alta aceptación en el mercado, se reproduce en condiciones de cultivo, soporta altas densidades, resiste la manipulación y el transporte (Guerra et al. 1996). 2.2. SISTEMA OLFATIVO La vida de cualquier ser vivo depende de varios procesos fundamentales como: la reproducción, la alimentación, la evasión de predadores, el reconocimiento intra e interespecífico y en algunos las migraciones; en los peces estas funciones pueden ser mediadas a través del sistema olfativo, donde participan diferentes tipos de moléculas ya sean amino ácidos, sales biliares, prostaglandinas o esteroides gonadales (Hamdani & Døving 2007, Hara 1994, Labergea & Hara 2001). Múltiples investigaciones se han desarrollado para determinar en qué comportamientos específicos intervienen estas moléculas. En estudios realizados sobre Oncorhynchus mykiss, se evidenció que los aminoácidos son muy importantes para desencadenar comportamientos alimenticios (Speca et al. 1999). También se reporta que las hormonas gonadales o sus metabolitos, contenidos en la orina del pez, al ser expulsados pueden indicar a los demás individuos el estado reproductivo del pez que las liberó, mediando comportamientos de apareamiento (Liley & Stacey 1983). El rol de las sales biliares no es muy bien conocido, pero se ha propuesto que pueden estar involucradas en los procesos de migración en ciertas especies (LI & Sorensen 1997), también son reconocidas por alterar el comportamiento de algunas especies cuando están presentes en el agua circundante (Hara 1994). Numerosos estudios han revelado que las prostaglandinas tienen una rol importante en la reproducción, por lo cual se cree que otros peces también utilizarían estas moléculas como feromonas reproductivas (Moore & Waring 1996, Munakata & Kobayashi, 2010). Por ejemplo, las prostaglandinas de la serie F (PGF), tienden a estar involucradas en la ruptura folicular durante la ovulación de los peces. Un estudio realizado en Carassius auratus, revela que una mezcla entre PGF2α y 15-keto PGF2α es utilizada por estos peces 19 como una feromona post-ovulatoria (Eom 2009, Goetz & Garczynski 1997). Se cree que todas estas moléculas son detectadas por mecanismos diferentes de recepción y traducción en el sistema olfativo del pez (Labergea & Hara 2001). 2.2.1. Roseta olfativa En los teleósteos, el órgano olfativo está localizado encima de la boca. Consiste en una cavidad olfatoria, que se conecta con el exterior a través de las narinas, teniendo contacto directo con el flujo de agua (Hamdani & Døving 2007). En los peces como en todos los vertebrados las principales neuronas sensoriales se encuentran en el epitelio sensorial, que en peces se encuentra en la roseta olfativa, la cual está compuesta por una serie de lamelas olfativas (Sorensen et al. 1991). Los estudios demuestran la gran diversidad morfológica de la roseta olfativa, en cuanto a cantidad, disposición de lámelas y la distribución del epitelio sensorial y no sensorial (Belanger et al. 2003, Kumari 2008, Mana & Kawamura 2002, Mandal et al. 2005), lo cual refleja el grado de desarrollo de las especies y el ambiente que habitan (Zeiske et al. 1992). En la lámela olfativa se distinguen dos tipos de epitelio: el sensorial y el no sensorial. En términos generales el epitelio sensorial está constituido por tres tipos de neuronas receptoras olfativas (ORNs por sus siglas en ingles Olfactory Receptor Neurons): las ORN ciliadas (ORNc), las ORN microvellosas (ORNm) y las células cripta (CC). Las ORNc pueden ser consideradas generalistas, debido a que responden a diferentes sustancias odoríficas como aminoácidos y sales biliares. A diferencia de las ORNm que son más específicas, pues solo responden a nucleótidos y aminoácidos (Hansen et al. 2003, Sato & Suzuki 2001, Speca et al. 1999), sustancias odoríferas biológicamente importantes (Thommesen 1983). Por último las células cripta, son consideradas como una característica común entre los teleósteos (Hansen & Finger 2000). Estas células están implicadas en la detección de feromonas sexuales (Hamdani & Døving 2002, Lastein et al. 2006,). Es muy importante mencionar que las células cripta son continuamente remplazadas debido a las lesiones axonales o químicas que sufren (Saucier & Astic 1995). 20 El epitelio no sensorial es un epitelio estratificado, que contiene células mucosas, células basales y células ciliadas no sensoriales. Este epitelio brinda protección al epitelio sensorial en caso de una lesión mecánica o por sustancias peligrosas, mantiene la película de mucus sobre todo el epitelio, una función muy importante, teniendo en cuenta que este es el medio en el cual se difunden las partículas odoríficas (Ghosh & Chakrabarti 2009, 2010). Por último las células ciliadas no sensoriales podrían ser las responsables de controlar la calidad del agua que ingresa en esta zona (Ghosh & Chakrabarti 2011). 2.2.2. Bulbo olfativo En general para los teleósteos el bulbo olfativo (BO) tiene una estructura histológica laminar, compuesta por cuatro capas principales (Hamdani & Døving 2007, Labergea & Hara 2001, Villanueva & Bryd 2009, Zielinski & Hara 2007): 1) Capa del Nervio Olfativo (CNO), a esta capa llegan todos los axones aferentes del epitelio olfativo, cubriendo la mayor superficie del bulbo excepto la región más posterior, en esta capa también se encuentran células gliales entre los axones (Bryd & Brunjes 1995). 2) Capa Glomerular (CGL), está compuesta por estructuras sinápticas esféricas denominadas glomérulos, estas estructuras están compuestas por las terminales axónicas de las ORNs (Baier & Korsching 1994), las cuales hacen contacto sináptico con las dendritas de las neuronas olfativas de salida (Células Mitrales y células Ruffed) y las interneuronas juxtaglomerulares que participan en la modulación de la actividad neuronal dentro del BO (Zielinski & Hara 2007). 3) Capa de Células Mitrales (CCM), en esta capa se encuentra el soma de las células mitrales y Ruffed, cuyos axones se proyectan hacia el telencéfalo (Labergea & Hara 2001). Las células mitrales son reconocidas como las principales neuronas de salida en el bulbo olfativo de los vertebrados. Estas células se caracterizan por su soma triangular u ovoide (Dryer & Graziadei 1994, Oka 1983). El estudio realizado por Fuller et al. 2009, describe dos tipos de células mitrales según su morfología: (1) células que tienen una sola dendrita acompañada de uno o más ramificaciones y (2) células con múltiples dendritas 21 que tienen varias ramificaciones, por lo general uno cerca del otro. En estudios realizados en C. auratus y Cyprinus carpio se reporta que el diámetro de las células mitrales es de 10 a 25 m (Kosaka & Hama 1982, Oka1983), en Danio rerio el diámetro de las células mitrales varia de 4 a 18 m y su área es de 31 a 96 m2 (Fuller et al. 2009). Las células ruffed son neuronas de salida, que han sido identificadas en peces como Carassius carassius, Chondrostoma polylepis, C. carpio, Tinca tinca, O. mykiss, Parasilurus asotus, Conger myriaster, Oncorhynchus tshawytscha entre otros, sin embargo no se han reportado en otros grupos de animales (Alonso et al. 1987, Kosaka & Hama 1980, Matz 1995). Fuller & Bryd 2005 reportan que las células ruffed en D. rerio tienen somas ovoides o esféricos, con diámetros de 7 a 15 m y que su característica típica es que presentan una protrusión significativa de la membrana en el segmento inicial del axón. 4) Capa Interna de Células (CIC), es el núcleo interior del BO que contiene numerosas interneuronas inhibitorias denominadas células granulares. Estas células se caracterizan por no tener axón, sus dendritas se extienden hacia la capa de células mitrales donde se crean interacciones sinápticas reciprocas con las dendritas, el soma y los segmentos iniciales de los axones de las células mitrales (Labergea & Hara 2001). 2.2.3. Glomérulos: unidades funciónales del sistema olfativo Los glomérulos son característicos de todos los vertebrados y representan el primer punto de integración de señales del sistema olfativo (Allison & Warwick 1949). La mayoría de los axones de las ORN convergen en glomérulos individuales donde hacen contacto sinápticos con las células mitrales o ruffed (Labergea & Hara 2001). Se cree que los glomérulos son las unidades funcionales del bulbo olfativo (Allison & Warwick 1949, Le Gros Clark 1975), Esta hipótesis esta soportada por estudios electrofisiológicos y de mapeo, que muestran que las respuestas a ciertos estímulos odoríficos, que están localizados en una región especifica en el bulbo olfativo que pueden corresponder a una unidad glomerular (Buonviso & Chaput 1990; Imamura et al. 1992, Lancet et al. 1982, Stewart et al. 1979). 22 En teleósteos especialmente en D. rerio, Baier & Korsching 1994, realizó un estudio donde se describe la organización espacial de los glomérulos en el bulbo olfativo. Se identificaron 22 glomérulos, que presentaron las mismas características morfológicas en todos los individuos evaluados, presentando simetría bilateral para ambos bulbos. Concluyendo así que la organización glomerular, presenta un patrón estereotipo, el cual fue similar al encontrado en C. auratus. Ya entendida la topografía glomerular, el siguiente paso es determinar que función tiene cada glomérulo. Para lo cual Sato et al. 2005, realizó un estudio con transgénicos de pez zebra caracterizando la expresión de OMP (Olfactory Marker Protein) y TRPC2 (Transient Receptor Potential C2) en las neuronas receptoras olfativas y evidenciaron que la proyección axonal de estas neuronas hacia el bulbo es mutuamente exclusiva para diferentes regiones de la capa glomerular. Por otra parte Goyaso et al. 2011 describieron la distribución inmunoreactiva para Calretinina (CR) y S100, proteínas fijadoras de calcio encontrando que cada una se proyectaba en diferentes regiones glomerulares del bulbo, aunque hacia la parte ventral del bulbo se encontraban las dos. Estos estudios apoyan la idea, que para cada receptor odorífero hay una unidad morfológica glomerular (Hamdani & Døving 2007). 2.2.4. Vías olfativas Como ya se mencionó anteriormente cada tipo de ORNs (ciliadas, microvellosas y cripta), responden a un conjunto específico de sustancias odoríficas que así mismo producen a diferentes respuestas comportamentales. En consecuencia, se cree que el sistema olfativo de los peces está organizado en tres vías paralelas al epitelio sensorial que van a través del bulbo y el tracto olfativo hacia el telencéfalo (Hamdani & Døving 2007). Se han realizado múltiples experimentos, colocando con precisión cristales de DiI en la región glomerular del bulbo olfativo con el fin de establecer las conexiones que se forman entre las células primarias ORNs y las neuronas secundarias del BO y cómo los axones de estas últimas forman el tracto olfativo (Hamdani & Døving, 2007). Es así que se determinó que los axones de las neuronas sensoriales ciliadas terminan en las neuronas secundarias, cuyos axones forman la parte media del tracto olfativo medio. (Hamdani & 23 Døving, 2002). Las células cripta al llegar a las neuronas secundarias forman la región lateral del tracto olfativo medio (Hamdani & Døving 2006) y las neuronas sensoriales microvellosas hacen contacto con las neuronas secundarias que forman el tracto olfativo lateral (Hamdani. et al. 2001). El tracto olfativo se divide en región media (MOT) y lateral (LOT) y su función es trasmitir la información odorífica a los hemisferios telencefálicos. Aunque se presentan variaciones entre especies de peces, es usual que las proyecciones del LOT lleguen a la región dorsal y posterior del telencéfalo (Levine & Dethier 1985, Resink et al. 1987). La región MOT tiene dos ramificaciones importantes: la dorsolateral y la ventromedial. Esta última inerva la región ventral del telencéfalo, el área preóptica y el diencéfalo. La agrupación dorsolateral inerva varias áreas de la parte dorsal y ventral del telencéfalo, como también el área preóptica y el diencéfalo (Resink et al. 1987, Stacey & Kyle 1983). Figura 2. Esquema que representa las tres vías del sistema olfativo en peces, observando las distribuciones axónicas de las células cripta (rojo), las neuronas sensoriales ciliadas (azul), y las neuronas sensoriales microvellosas (verde), en el bulbo olfativo y el tracto olfativo (Tomado de Hamdani & Døving, 2007). 2.3. GLIFOSATO - Roundup® Los herbicidas son ampliamente usados en ecosistemas terrestres y acuáticos para controlar las arvenses. Su uso ha generado serias preocupaciones sobre los efectos 24 potencialmente adversos de estos químicos en el ambiente y en la salud humana (Lushchak et al. 2009). Durante las últimas décadas, el desarrollo de las actividades humanas ha repercutido en la disminución de la calidad de los ambientes acuáticos, particularmente por la contaminación extensiva con pesticidas y otros contaminantes, los cuales pueden ser transportados a los ambientes acuáticos por diferentes vías (Evrard et al. 2010). El Roundup® es una presentación comercial del glifosato. Este es el herbicida con mayor espectro y el más usado en el mundo (Kolpin et al. 2006), siendo empleado para controlar muchas plagas y arvenses en las prácticas agrícolas (Evrard et al. 2010). En Colombia la formulación comercial Roundup® Activo se utiliza como herbicida en la agricultura tradicional, como desecante de granos, madurante de la caña de azúcar y además para la erradicación forzosa de cultivos ilícitos por medio de aspersiones aéreas (Nivia 2001, Rodón-Barragan et al. 2007). Esta última práctica es apoyada por el gobierno nacional y justificada por ayudar en la destrucción de los cultivos de coca y amapola, que son la fuente de financiación de los grupos al margen de la ley (Eslava et al. 2007). Sin embargo, falta definir mejor las implicaciones y daños que puede causar el Roundup® Activo y sus surfactantes quew aun son desconocidos sobre los ecosistemas terrestres y acuáticos circundantes al cultivo (Ramírez et al. 2004). 2.3.1. Naturaleza y efectos El glifosato es un ácido, con clase II de toxicidad (moderadamente tóxico según la categorización de la agencia de protección ambiental de los Estados Unidos), pero comúnmente es usado en forma de sal de isopropilamina. Es una sustancia polar, altamente soluble en agua que hace complejos fácilmente, se adhiere fuertemente a las partículas de suelo durante 45 a 60 días después de la aplicación (Peruzzo et al. 2008). El uso del glifosato como herbicida fue propuesto por primera vez por los científicos de la compañía Monsanto en 1970 (Lushchak et al. 2009). La formulación de Roundup® fue propuesta en 1974 y contenía glifosato como ingrediente activo (48%) junto con el 25 surfactante no iónico piliexietilamina POEA (15%), adicionado para incrementar la eficiencia de los ingredientes activos porque promueve la penetración del herbicida a través de la cutícula de la planta (Lushchak et al. 2009, Cavalcante et al. 2008, Giesy et al. 2000, Dinehart et al. 2009). Las formulaciones comerciales del glifosato generalmente son más tóxicas que el glifosato puro (Cavalcante et al. 2008), principalmente debido a los surfactantes, como POEA usado en la formulación del Roundup®, el cual es mucho más tóxico que el mismo glifosato para los organismos acuáticos (Cavalcante et al. 2008). Estas formulaciones son rápidamente disipadas en aguas superficiales, sufren una biodegradación a AMPA (ácido aminometilfosfonico), el cual tiene la misma toxicidad que el glifosato (Giesy et al. 2000, Monheit 2003), posteriormente es degrado a metilamina formaldehido (Nivia 2001), y finalmente a dióxido de carbono (CO2) y amonio (NH3) (Evrard et al. 2010, Gluscak et al. 2007). Se reporta que esta degradación es más rápida en condiciones aeróbicas que anaeróbicas (Eslava et al. 2007). 2.3.2. Efectos sobre los ecosistemas acuáticos Por medio de la lixiviación, escorrentía, aspersión accidental y/o por el viento, las fuentes acuáticas se convierten finalmente en los reservorios de sustancias tóxicas como el Roundup® y de sus metabolitos secundarios (Eslava et al. 2007, Ramírez et al. 2004). Un estudio realizado en la Pampa Argentina encontró que las concentraciones de glifosato en los cuerpos de agua son similares a las concentraciones aplicadas en los cultivos cercanos y que este es transportado por escorrentía (Peruzzo et al. 2008). El glifosato se encuentra en mayor concentración en los sólidos suspendidos sobre el agua que en el fondo. Las diferencias de concentración entre los lugares de aplicación y los cuerpos de agua cercanos depende principalmente de la precipitación, a mayor precipitación mayor escorrentía y por lo tanto mayor transporte de glifosato hacia el agua (Peruzzo et al. 2008). Sin embargo, en condiciones de laboratorio se ha observado que la escorrentía del glifosato y de su producto de degradación AMPA (ácido aminometilfosfónico) puede alcanzar hasta 1 metro de profundidad, lo cual sugiere un riesgo para el ambiente acuático (Contardo-Jara et al. 2009). 26 Se reporta que el glifosato puede permanecer en ambientes acuáticos durante 1 o 2 semanas por lo menos (Dinehart et al. 2009) mientras que el surfactante POEA persiste durante 3 a 4 semanas (Dinehart et al. 2010). Además un estudio realizado en Lumbricuslus variegatus, demostró que la bioacumulación del Roundup® Ultra (formulación comercial con 41.5% de glifosato y 16% de POEA) aumenta con la concentración del herbicida en el medio; también se ha reportado bioacumulación en carpa y tilapia después de tres días de exposición, donde el POEA aumenta la tasa de acumulación (Contardo-Jara et al. 2009). Se han estudiado los efectos del glifosato y su formulación en diferentes organismos acuáticos, los cuales producen diferentes grados de toxicidad (Achiorno et al. 2008). Los surfactantes no iónicos, como el POEA, causan problemas en las superficies respiratorias de los organismos acuáticos (Dinehart et al. 2009). Un estudio realizado por Lushchak et al. 2009, mostró que concentraciones bajas de herbicida puede causar efectos muy marcados en peces. Se reporta que la toxicidad aguda del Roundup® para peces se encuentra en un rango de 2 – 55 mg/l, pero varía según la especie, el estadio de desarrollo, la temperatura del agua, el pH y la dureza (Ramírez et al. 2004). Un estudio realizado por Glusczak et al. 2006 en Leporinus obtusidens y por Glusczak et al. 2007 en Rhamdia quelen, especies de agua dulce, que habitan al sur de Brasil, mostró que la actividad de la acetílcolinesterasa en el cerebro disminuye a causa de la exposición a POEA. Debido a la disminución en los niveles de la enzima, se acumula acetilcolina causando alteraciones en el nado y letargia, este estudio confirma que el POEA es el componente más tóxico del herbicida Roundup®. La reducción de la acetílcolinesterasa encontrada en Prochilodus lineatus en el cerebro y el músculo después de 96 h de exposición también fueron encontrados en L. obtusidens y R. quelen expuestos al mismo herbicida (Gusczak et al. 2006, Modesto & Martinez, 2010). Modesto & Martínez 2010 hicieron el primer reporte de inhibición de acetíl colina en el musculo de peces expuestos a glifosato, la acumulación de acetíl colina debido a la reducción de la actividad de la enzima puede afectar el comportamiento reproductivo de los peces (Saglio & Trijasse 1998; Bretaud et al. 2000). 27 Uno de los pocos estudios realizados del efecto del Roundup® sobre el sistema olfativo, fue el realizado por Tierney et al, 2007, donde a través de electro-olfatogramas en O. mykiss, determinaron una disminución en la respuesta neurofisiológica cuando los individuos eran expuestos 1 mg/l de Roundup®, en concentraciones mayores (10 mg/l) se presentaron respuestas de evasión a este herbicida. Algunos estudios realizados con juveniles de cachama blanca concluyen que, el Roundup® genera alteraciones patológicas, en las branquia, hígado, riñones, piel y cerebro (Eslava et al. 2007). En el caso del cerebro específicamente en los bulbo olfativos y el telencéfalo se encontraron células granulares eosinofílicas, que pueden estar asociadas con la activación o aceleración de los procesos apoptóticos que sufren las neuronas (Ramírez et al. 2008). 28 3. OBJETIVOS 3.1. OBJETIVO GENERAL Describir las vías olfativas (roseta - bulbo olfativo) y establecer el efecto del Roundup® Activo sobre la roseta olfativa y el bulbo olfativo en alevinos de Cachama Blanca (Piaractus brachypomus). 3.2. OBJETIVOS ESPECÍFICOS Describir la conformación histológica de la roseta olfativa y el bulbo olfativo. Describir la distribución de las inervaciones de la roseta olfativa en el bulbo olfativo. Definir las alteraciones histopatológicas causadas por dos concentraciones de Roundup® Activo en la roseta olfativa y el bulbo olfativo. Determinar las curvas de crecimiento de los alevinos de P. brachypomus. 29 4. MATERIALES Y MÉTODOS 4.1. UBICACIÓN DEL ENSAYO El estudio se realizó en los Laboratorios de Embriología y Fisiología Animal del programa de Biología Aplicada, de la Facultad de Ciencias Básicas de la Universidad Militar Nueva Granada, sede Campus Cajicá (Cundinamarca), a una altitud de 2558 msnm. 4.2. MATERIAL BIOLÓGICO Se trabajó con alevinos de Cachama blanca (P. brachypomus) de 30 días después de la eclosión de un mismo desove, los cuales fueron adquiridos en la estación piscícola del Instituto de Acuicultura de los Llanos. Estos peces fueron mantenidos en acuarios de vidrio de 40 L de agua, con aireación constante y sin filtro, se alimentaron tres veces al día (9:00, 12:00 y 16:00 horas) con “Mojarrina” al 35% de proteína bruta ajustada al 5% de la biomasa total. La temperatura promedio del agua se mantuvo entre 24-29 ºC, con un fotoperíodo de 12:12 h (luz/oscuridad). Los parámetros de calidad de agua (oxígeno disuelto: mayor de 3 mg/l, pH: 6.5 a 8.5, amonio: 0.1 mg/l) fueron medidos semanalmente. 4.3. SUSTANCIA EXPERIMENTAL En el experimento se utilizó la marca comercial Roundup® Activo del herbicida glifosato, que está compuesto por un 48% de sal ácida isopropilamina de glifosato (IPA) y surfactante que para esta formulación la casa Monsanto no aclara cual es y en que porcentaje lo contiene (Tsui y Chu, 2003; Oldham et al., 2002). Con el fin de evitar los efectos deletéreos del glifosato sobre el ambiente, el agua que se utilizó en el experimento se mantuvo en tanques plásticos por un periodo de 30 días para permitir la evaporación y transformación del herbicida y pasado este tiempo fue percolada en el suelo (Soso et al., 2007). 30 4.4. DISEÑO EXPERIMENTAL El diseño experimental fue completamente aleatorizado con tres replicas por tratamiento. El estudio evaluó dos concentraciones subletales de herbicida Roundup® Activo, de la siguiente manera: el tratamiento 1 sin Roundup®, el tratamiento 2 con una concentración 0.1 mg/l de Roundup® Activo y el tratamiento 3 contenía una concentración de 1 mg/l de Roundup® Activo. En cada unidad experimental (acuario 40 L) se manejó una densidad de 20 peces/acuario. Se realizaron recambios diarios del 50% del volumen de agua, manteniendo la concentración a través de la adición de la mitad de la dosis (RondonBarragan et al., 2007). Los peces fueron mantenidos durante 30 días bajo estas condiciones, transcurrido este tiempo se registraron variables de crecimiento (peso, la longitud total y estándar). 4.5. OBTENCIÓN DE MUESTRAS Se seleccionaron 16 individuos por tratamiento aleatoriamente para procesamiento histológico, estos peces fueron anestesiados con Benzocaina (0.1 g/L) y posteriormente sacrificados por un corte medular a nivel cervical. Este trabajo siguió los lineamientos indicados para el manejo peces ético de los en la investigación (CCAC guidelines on: the care and use of fish in research, teaching and testing, 2005). De los 16 individuos sacrificados de cada tratamiento, 13 fueron fijados con una solución de formaldehído al 4%, ajustado a pH 7.2-7.4 a 4°C realizando una ventana craneal para mejor penetración del fijador. Los 3 restantes se utilizaron para el procesamiento de Microscopia Óptica de Alta Resolución. 4.6. TINCIÓN H&E Y NISSL Después de la fijación con formaldehído al 4% se extrajeron las rosetas y bulbos olfativos de 8 individuos por tratamiento. La deshidratación consistió en tres cambios de media hora en alcohol de 95%, tres cambios de Iso-propanol por el mismo tiempo y aclaramiento con xilol por dos minutos. Finalmente los tejidos fueron impregnados (dos cambios de una hora) e incluidos en parafina Histopat® con punto de fusión entre 56-59°C. 31 Se realizaron cortes transversales de 5 m de espesor, con un micrótomo rotatorio HM340E. Para la coloración de las secciones histológicas de al roseta y el bulbo olfativo de 5 individuos de cada tratamiento se tiñeron con el protocolo modificado de la tinción de Harris H&E (Gómez et al., 2010). Por otra parte, con el protocolo modificado de Nissl (Gridley 1960), se tiñeron la secciones histológicas de las bulbos olfativos de tres individuos del tratamiento 1, para la descripción histológica de este órgano. El protocolo utilizado para esta tinción se muestra a continuación. 1. Desparafinar. a. Dos cambios en xilol de 5 min cada uno. b. Un cambio en n-propanol de 5 min. c. Cuatro cambios en alcohol al 95% de 5 in cada uno. d. Un cambio en agua destilada de 5 min. 2. Teñir 3 min en Cresyl Violeta acetato. 3. Hacer dos cambios en agua destilada. 4. Un cambio en alcohol al 95% de 30 segundos. 5. Un cambio en etanol absoluto de 30 segundos. 6. Un cambio en xilol de 1 min. 7. Para diferenciar hacer dos cambios de 30 segundos cada uno en etanol absoluto y observar al microscopio 8. Dejar las láminas en xilol y hacer el montaje. 4.7. MICROSCOPIA ÓPTICA DE ALTA RESOLUCIÓN (MOAR) Para esta técnica se utilizaron 3 individuos de cada tratamiento y se procesaron modificando las metodologías publicadas por Caldas et al. (1993) como se describe a continuación: Fijación: Después de sacrificar al individuo, se realizó la disección de los bulbos olfativos que fueron fijados en Karnovsky modificado: una solución de Formaldehido al 2% y Glutaraldehido al 2.5% en buffer fosfato, durante dos horas. Posteriormente se hicieron tres lavados con buffer fosfato, cada uno de 10 minutos. 32 Postfijación: en este caso se utilizó Tetraóxido de Osmio al 2% con buffer fosfato durante tres horas. Después de la postfijación se hicieron tres lavados con buffer fosfato cada uno de 10 minutos. Deshidratación: se introdujo el tejido en concentraciones ascendentes de 70%, 90%, 95% y 100% preparados a partir de etanol absoluto. Los tiempos de deshidratación se muestran en la tabla 1. Concentración Tiempo 70% 5 minutos 3 veces 90% 5 minutos 1 vez 95% 10 minutos 1 vez 100% 10 minutos 2 veces Tabla 1. Tiempos de deshidratación. Inclusión en resina epóxica: las muestras deshidratadas se impregnaron en resina Poli/Bed®812 mezclada con óxido de propileno, la Tabla 2 describe estas combinaciones y los tiempos de cada una de las fases requeridas en este procedimiento. Combinación Tiempo Poli/Bed®812 1:2 oxido de propileno 30` Poli/Bed®812 1:1 oxido de propileno 30` Poli/Bed®812 2:1 oxido de propileno 30` Poli/Bed®812 100% 1h Polimerización Poli/Bed®812 puro a 60ºC 12 h Tabla 2. Mezclas de epón con oxido de propileno y tiempos de inclusión. Cortes y tinción: se realizaron cortes trasversales con la ayuda de un micrótomo 33 rotatorio (Microm Slee Cut4060), a 1 micra de espesor. Se tiñeron con azul de toluidina durante 30 o 40 segundos al calor (Caldas et al 1993). 4.8. TRAZADO ANTERÓGRADO CON DiI Después del periodo de fijación con formaldehído 4%, se tomaron 5 individuos de cada tratamiento, y se procedió a colocar los cristales de DiI (,1'- dioctadecil-3,3,3',3'tetramethilindocarbocianina-perclorato) en la rosseta olfativa con la ayuda de un alfiler entomológico observando al estereoscopio (Carl Zeiss DV4). Una vez colocado el cristal, se cubrió la superficie con una gota de agar (al 4%) para evitar que el cristal de DiI se moviera durante el periodo de incubación, el cual fue de 24 h a 37 ºC en solución de formaldehído 4%. Transcurrido este período de incubación, se extrajeron los bulbos olfativos y se embebieron en agar-agar al 6%, para la obtención de los cortes en vibrátomo (Campden instruments, MA752-626) a 40 micras de espesor. Estos cortes se observaron en el microscopio de fluorescencia con filtro de rodamina (absorción a 549 nm). 4.9. DESCRIPCIÓN HISTOLÓGICA Se realizaron observaciones con el microscopio de luz (marca CARL ZEISS AXIOSKOP PLUS), y se procedió a la captura de imágenes con la cámara CANON Power Shot G5 para la identificación de los diferentes tejidos y células de estructuras que se nombran a continuación: Roseta olfativa: epitelio olfativo no sensorial, células mucosas, células de soporte, células ciliadas no sensoriales, células basales, epitelio olfativo sensorial, células cripta, neuronas receptoras olfativas ciliadas y microvellosas, basándose en las descripciones hechas por Camacho et al. 2010, Díaz et al. 2002 y Mandal et al. 2005. 34 Bulbo olfativo: capa del nervio olfativo, capa glomerular, capa de células mitrales, capa interna de células (CIC), células ruffed, células mitrales, células granulares, basándose en las descripciones realizadas por Bryd & Bunjes 1995 y Kosaka & Hama 1982. La topografía de los glomérulos en el bulbo olfativo se realizó de acuerdo con las descripciones hechas por Baier & Korsching 1994 y Goyaso et al. 2011 Alteraciones patológicas: se identificaron células granulares y granulares eosinofílicas, en el la roseta olfativa y el bulbo olfativo, siguiendo las descripciones realizadas por Ramírez et al. 2008 y Retie & Evense 2006. 4.10. ANÁLISIS ESTADÍSTICO A la variables de crecimiento (peso, la longitud total y estándar), se les aplico una prueba ANOVA y Tukey para compararlas entre los tres tratamientos, considerando el nivel de P<0.05 como estadísticamente significativo. 35 5. RESULTADOS Las variables de peso, longitud estándar y longitud total registradas para los individuos a lo largo del experimento, no presentaron diferencias significativas entre los tratamientos, como se muestra en la tabla 3. Los parámetros fisicoquímicos en la tabla 4 se registran los valores mínimos y máximos que presentó cada parámetro. Inicial Final T1 Peso (g) 2,30 0,51 a Long. Total (cm) 5,12 0,40 b Long. Estándar (cm) 3,98 0,31 c T2 2,28 0,57 a 5,06 0,42 b 3,95 0,32 c T3 2,28 0,56 a 5,06 0,40 b 3,92 0,31 c T1 T2 T3 6,30 1,80 A 6,20 1,64 A 6,48 1,72 A 7,13 0,72 B 7,07 0,62 B 7,11 0,63 B 5,64 0,72 C 5,51 0,50 C 5,56 0,48 C Tabla 3. Datos del promedio de las variables de crecimiento de P. brachypomus en los tres tratamientos de los dos tiempos evaluados. Valores con letras iguales no difieren significativamente (P>0,05). Parámetro Media Mínimo Máximo pH Temperatura ( C) Amonio total (mg/L) Oxígeno disuelto (mg/L) Dureza de carbonatos (mg/L) Dureza total (mg/L) 7,1 27,4 0,2 7,1 30,6 65,6 6,9 26,2 0,0 7 17,5 52,5 7,4 29,4 0,38 8 35 70 Tabla 4. Parámetros de Calidad de agua (promedio, mínimo y máximo) obtenidos durante los 30 días de experimentación con P. brachypomus. 36 5.1. DESCRIPCIÓN HISTOLÓGICA DEL SISTEMA OLFATIVO El sistema olfativo de P. brachypomus está compuesto por un par de rosetas olfativas (órgano olfativo), de cada una sale un nervio olfativo que conecta con el bulbo olfativo, este pez tiene bulbos olfativos sésiles (unidos al telencéfalo) por lo cual no se visualiza el tracto olfativo (Figura 3). LO T NO BO RO Ra Figura 3. Vista lateral del sistema olfativo de P. brachypomus. Roseta olfativa (RO), Lámela olfativa (LO), Rafe (Ra) Nervio olfativo (NO), Bulbo olfativo (BO), Telencéfalo (T). 5.1.1. Roseta olfativa La roseta olfativa (RO) de P. brachypomus es redondeada y en promedio tiene de 26 a 28 lámelas, que están dispuestas de manera paralela una a la otra en orientación antero posterior, unidas ventralmente por el rafe, compuesta por tejido conectivo. Cada lámela olfativa está compuesta por dos capas de epitelio cilíndrico estratificado, separadas por el núcleo central (NC), el cual contiene tejido conectivo, fibras nerviosas y vasos sanguíneos 37 (Figura 4A y 5). El epitelio olfativo se divide en dos regiones, la sensorial y la no sensorial, que se intercalan de manera irregular a lo largo de toda la lamela (Figura 4A). B A NC CM CE CE TC VS Figura 4. A) Lamela olfativa de P. brachypomus se observa el núcleo central (NC) y las dos capas del epitelio olfativo (CE), epitelio olfativo no sensorial (Flechas negras). B) Epitelio olfativo cilíndrico estratificado con presencia de células mucosas (CM) y células ciliadas no sensoriales (flechas indican los cilios), en el núcleo central se observa tejido conectivo (TC) y vascularización (vaso sanguíneo VS). H&E. El epitelio no sensorial está compuesto por cuatro tipos de células epiteliales estratificadas: (1) células mucosas (CM), (2) células de soporte (CS), (3) células ciliadas no sensoriales (CCN) y (4) células basales (Figura 5). 1) Las células mucosas se caracterizan por tener el núcleo basal y en la región apical tiene gránulos de mucígeno, los cuales se tiñen débilmente con H&E (Figura 4B). 2) Las células de soporte se diferencian porque su cuerpo celular tiene poca afinidad por el azul de toluidina y en su citoplasma se observan gran cantidad de vesículas (Figuras 5 y 7). 38 3) Las células ciliadas no sensoriales se extienden desde la base del epitelio hasta la superficie, donde se observan sus cilios; el citoplasma se tiñe más claro que las neuronas receptoras, característica que permite diferenciarlas (Figura 7). Por último, (4) las células basales se encuentran en la parte más profunda del epitelio, justo encima de la lámina basal, algunas de estas células se caracterizan por tener abundante heterocromatina y citoplasma con áreas homogéneas, por el contrario el otro grupo de células basales contienen poca heterocromatina (Figuras 5 y 7). FN CS NC VS CS Figura 5. Epitelio olfativo no sensorial de la lamela de P. brachypomus. Se observa células de soporte (CS), células basales con abundante heterocromatina (Flechas punteadas negras), células basales con poca heterocromatina (Flechas punteadas blancas), núcleo central (NC), vaso sanguíneo (VS) y fibras nerviosas (FN). Azul de toluidina. El epitelio sensorial está compuesto por neuronas receptoras olfativas que se encuentran entremezcladas con las células ciliadas no sensoriales y las células de soporte, además también se observan células basales aunque en menor cantidad que en el epitelio no sensorial. Se reconocieron los tres tipos de neuronas receptoras olfativas, las ciliadas (ORNc) las microvellosas (ORNm) (Figura 6) y las células cripta (CC) (Figura 7). 39 ORNm ORNc VS Figura 6. Epitelio olfativo sensorial de la lamela olfativa de P. brachypomus. Neuronas receptoras olfativas ciliadas (ORNc). Neuronas receptoras olfativas microvellosas (ORNm), células basales con abundante heterocromatina (Flechas punteadas negras), células basales con poca heterocromatina (Flechas punteadas blancas), vaso sanguíneo (VS), lamina basal (punta de flechas). Azul de toluidina. Las ORNc y las ORNm son neuronas bipolares, las dendritas de estas células proyectan por el encima del epitelio un protrusión con cilios para las ORNc o microvellosidad para las ORNm. Las ORNc se caracterizan por tener un cuerpo dendrítico largo y delgado por lo cual el soma neuronal está más cerca a la base del epitelio (Figura 6 ), por el contrario el cuerpo dendrítico de las ORNm es más corto y grueso, el soma neural está más cerca al lumen del epitelio (Figura 6 y 7). Las células cripta (CC) son globosas y grandes en comparación con los otros tipos celulares, se encuentran en la superficie del epitelio y su núcleo se ubica hacia la parte basal de la célula (Figura 7). 40 CC CS CS CCN VS ORNm Figura 7. Epitelio olfativo sensorial de la lamela de P. brachypomus. Neuronas receptoras olfativas microvellosas (ORNm), Célula Cripta (CC). Células ciliadas no sensoriales (CCN), células de soporte (CS), vaso sanguíneo (VS), Protrusión de la dendrita de las neuronas receptoras olfativas ciliadas y microvellosas (punta de flechas). Azul de toluidina. 5.1.2. Bulbo olfativo El bulbo olfativo de P. brachypomus está organizado en cuatro capas concéntricas, desde las más externa a la más interna: capa del nervio olfativo (CNO), capa glomerular (CGL), capa de células mitrales (CCM) y la capa interna de células (CIC). La distribución de estas capas varia a largo del bulbo; en un nivel de corte anterior (C) (Figura 8), la CNO es más prominente que en nivel de corte medio (E), por el contrario la CIC en el nivel medio es relativamente más grande que en el nivel anterior (Figura 9). Sin embargo, un nivel de corte posterior no se observaron diferencias con respecto al nivel medio. La capa del nervio olfativo está compuesta por los axones del nervio olfativo que se extiende sobre la superficie del bulbo (Figura 8 y 10A), siendo menos visible en la parte más posterior del bulbo (Figura 9). En la capa glomerular las terminales axónicas del nervio se agrupan formando los glomérulos, estos se tiñen fuertemente con el azul de toluidina y pueden ser ovoides o tener formas irregulares, entre los glomérulos se observan células gliales y algunas células mitrales (Figura 10A). 41 C 1mm CIC CCM CGL CNO Figura 8. Corte trasversal del bulbo olfativo de P. brachypomus. Capa del nervio olfativo (CNO), Capa glomerular (CGL), Capa de células mitrales (CCM) y Capa interna de células (CIC). H&E. E CNO CGL CCM 1 mm CIC 42 Figura 9. Corte trasversal del bulbo olfativo de P. brachypomus. Capa del nervio olfativo (CNO), Capa glomerular (CGL), Capa de células mitrales (CCM) y Capa interna de células (CIC). H&E. B A PM VS CM FN FN CNO FN CM CM GL CM GL GL CGL CM GL Figura 10. Bulbo olfativo de P. brachypomus. A) Capa del nervio olfativo (CNO) y capa glomerular (CGL) se observa: Pia madre (PM), glomérulos (GL), células mitrales (CM), célula de glia (flechas punteadas), Paquete de fibras nerviosas (PFN) y vaso sanguíneo (VS). B) Capa de células mitrales se observa: células mitrales (CM) y prolongaciones dendríticas de estas células (punta de flechas). Azul de toluidina. La capa de células mitrales, está compuesta por células ruffed y células mitrales como su nombre lo indica, estos dos tipos celulares se caracterizan por tener núcleos considerablemente grandes que se tiñen débilmente con el azul de toluidina, por el 43 contrario el soma de las células ruffed tienen más afinidad por el azul de toluidina, por lo cual se pueden diferenciar (Figura 10B y 11). Por último la capa interna de células, esta densamente poblada por agrupaciones de células granulares, las cuales se caracterizan por ser redondas y más pequeñas comparadas con las células mitrales y ruffed (Figura 11). CCM CIC VS CR CM Figura 11. Capa de células mitrales y capa interna de células del bulbo olfativo de P. brachypomus. Células mitrales (CM), células ruffed (CR), células granulares (flechas punteadas), prolongaciones dendríticas de las células ruffed (punta de flechas) y vaso sanguíneo (VS). Azul de toluidina. 44 5.2. ALTERACIONES HISTOPATOLÓGICAS 5.2.1. Roseta olfativa En el tratamiento 1 (control), no se observaron cambios morfológicos en la lamela olfativa (Figura 3), por el contrario en el tratamiento 2 y 3, se observaron células granulares eosinofílicas (CGE) (Figuras 12 y 13). Estas células se caracterizaron por tener gran afinidad a la eosina, ser grandes y ovoides con tinción H&E. La mayoría de estas células se observaron en la parte ventral de la lamela olfativa, tanto para el T2 y T3, ubicadas hacia la región basal del epitelio olfativo no sensorial, cerca al tejido conectivo del núcleo central (Figuras 12 y 13A,B). En el T3 unas pocas CGE se observaron en la región dorsal de la lamela olfativa, ubicadas principalmente en la región del epitelio olfativo no sensorial (Figura 13C). De modo apreciativo se observó un número relativamente mayor de CGE en el T3 con respecto T2. A B TC NC EONS Figura 12. Lamela olfativa de P. brachypomus. Cortes del tratamiento 2. A) Células granulares eosinofílicas (Flechas) núcleo central (NC). B) Epitelio olfativo no sensorial (EONS), Células granulares eosinofílicas (Flechas), Tejido conectivo (TC). H&E. 45 B A TC C TC Figura 13. Lamela olfativa de P. brachypomus. Cortes del tratamiento 3. A) Células granulares eosinofílicas (Flechas). B) Detalle de las células granulares eosinofílicas en el epitelio olfativo no sensorial. C) Presencia de Células granulares eosinofílicas (Flechas) en la región dorsal de la lamela olfativa. H&E. 5.2.2. Bulbo olfativo En los cortes teñidos con H&E del bulbo olfativo, no se observaron CGE en ninguno de los tratamientos. Por el contrario en las secciones obtenidas con MOAR para el T2 y el T3 se evidenciaron células granulares CG, que fueron caracterizadas por la gran afinidad que tienen los gránulos de estas células al azul de toluidina. La mayoría de las CG observadas están cercanas a los vasos sanguíneos que se encuentran en las meninges que cubren el bulbo olfativo (Figuras 14 A,C,D y 15 A,B,D). También se observaron unas pocas CG en la capa del nervio olfativo y en la capa glomerular cercanas a células mitrales o vasos sanguíneos (Figuras 14 B,E y 15 C,E). 46 A B C VS VS PM PM CNO CNO CNO D E CNO VS CNO PM VS CNO CGL Figura 14. Bulbo olfativo de P. brachypomus. Cortes del tratamiento 2 A-E) Células granulares (Flechas), vaso sanguíneo (VS). Capa del nervio olfativo (CNO), Pia madre (PM) y capa glomerular (CGL). Azul de toluidina. 47 A B VS V PM CNO CNO C CNO D E CNO PM CGL VS CNO CGL CM Figura 15. Bulbo olfativo de P. brachypomus. Cortes del tratamiento 3 A-E) Células granulares (Flechas), vaso sanguíneo (VS). Capa del nervio olfativo (CNO), Pia madre (PM), capa glomerular (CGL) y célula mitral (CM). Azul de toluidina. 48 5.3. TRAZADO ANTERÓGRADO ROSETA-BULBO OLFATIVO Como se mencionó anteriormente el sistema olfativo en P. brachypomus, está compuesto por las narinas, los nervios olfativos y bulbos olfativos (sésiles). Tras la aplicación de DiI en la roseta olfativa se observó el marcaje del nervio olfativo y sus terminales nerviosas en el bulbo olfativo ipsilateral, conformando la capa del nervio olfativo en el bulbo (Figura 16). Las terminales axónicas se extienden hacia la capa glomerular para formar estructuras sinápticas llamadas glomérulos, estas estructuras se observaron a lo largo del bulbo. B A T BO 1 mm Figura 16. A) Vista dorsal del cerebro de P. brachypomus, que muestra el nivel de corte de la figura de la derecha, bulbo olfatorio (BO), telencéfalo (T) B) Corte longitudinal del bulbo olfatorio (BO), donde se observa el nervio olfatorio (NO), la inervación de los axones provenientes de la roseta olfativa en el bulbo que conforman la capa del nervio olfatorio (CNO) hasta llegar a la capa glomerular. El patrón glomerular fue el mismo para los tres tratamientos evaluados y se dividió en cinco grupos: dorsal, ventral, lateral, medial y anterior de acuerdo con su ubicación en el bulbo. La identificación de algunos de los glomérulos más sobresalientes en P. 49 brachypomus, se hizo teniendo en cuenta la forma y ubicación espacial de estos en el bubo olfativo (Figuras 17 y 18). H G F E D C B A 1 mm Figura 17. Niveles de Corte del bulbo olfativo de P. brachypomus 50 Figura 18. Cortes trasversales del bulbo olfativo de rostral (A) a caudal (H) (ver figura 7), donde se muestra el patrón de distribución de los glomérulos observados en los bulbos olfativos de P. brachypomus. Agrupaciones glomerulares identificadas: Plexo anterior (ap), Grupo dorsal (dc), Plexo de la cadena lateral (lc), Asociación de glomérulos del grupo dorsal (a-e), Glomérulos de la tripleta ventral (u-w). Glomérulos identificados: Glomérulo mediodorsal posterior1 (f), Glomérulo mediodorsal posterior2 (g), Glomérulo mediodorsal (h), Glomérulo medioanterior (i), Glomérulo medio alargado (k), Glomérulo de la cadena lateral2 (m), Glomérulo lateroventral posterior (q), Glomérulo ventroanterior (r), Glomérulo ventroposterior (s) y Glomérulo ventromedial (t). 51 6. DISCUSIÓN Los datos de crecimiento registrados durante el experimento para los alevines de P. brachypomus, no presentaron diferencias significativas entre los tres tratamientos, lo cual indica que comparado con el control (T1), los individuos de los otros dos tratamientos crecieron igual. Este crecimiento es menor al obtenido por Rebaza et al. 2002 en cultivos en estanque, considerando que en esta investigación se alimentó a un menor porcentaje de proteína y se ajusto la ración al 5% y no al 10% como recomiendan en producción en estanques en tierra (Diaz & lopez 2001). Se utiliza esta ración porque en estudios de toxicología se manejan dietas de mantenimiento, con el fin de evitar pérdidas de alimento y alteraciones considerables en los parámetros fisicoquímicos. Por otra parte los parámetros fisicoquímicos se mantuvieron entre los rangos de tolerancia que tiene P. brachypomus en los tres tratamientos (Poleo et al. 2011). 6.1 SISTEMA OLFATIVO Se reporta que el sistema olfativo de los teleósteos en general, está compuesto por las rosetas olfativas (órgano receptor), el nervio olfativo, el bulbo olfativo y el tracto olfativo. En algunas especies de Ciprínidos y Silúridos los bulbos olfativos están adyacentes al telencéfalo, sin embargo la mayoría de los teleósteos presentan bulbos pedunculados, en este caso los bulbos olfativos están muy cercanos a la roseta olfativa y están unidos al telencéfalo por un tractor olfativo largo (Hara 2000). P. brachypomus presenta bulbos olfativos sésiles al igual que lo reportado para otros representantes de las familia Characidae (e.g. Paracheirodon alxerodi) (Obando 2006), y especies como O. mykiss, D. rerio y Orizyas latipes (Butler 2000, Byrd & Brunjes 1995, Wakamatsu et al. 2006). 6.2 ROSETA OLFATIVA La roseta olfativa en los peces es uno de los órganos quimio-sensoriales más importantes para su interacción con el ambiente (Hara 1994), ya que las neuronas receptoras están en 52 contacto directo con el medio acuático (Tierney et al. 2010). Numerosos estudios morfológicos muestran la gran variabilidad que tiene la roseta olfativa en los peces, en cuanto su forma, la densidad de neuronas receptoras olfativas que la conforman y la organización y número de lamelas que posee (Camacho et al. 2009, Chakrabarti & Ghosh 2011, Chakrabarti & Ghosh 2009, Fishelson et al. 2010, Kudo et al. 2009, Mana & Kawamura 2002). En P. brachypomus la roseta olfativa es redondeada y las lamelas se organizan de forma radial al rafe, esta morfología es reportada en otras especies de teleósteos como Lampris guttatus, Acipenser naccari y Oncorhynchus keta (Mana & Kawamura 2002, Camacho et al. 2009, Kudo et al. 2009). En cuanto al número de lamelas, existe una gran variabilidad entre las diferentes especies de teleósteos estudiados (Tabla 5). Varios autores coinciden en que el número de lamelas y de neuronas receptoras olfativas (ORNs), está directamente relacionado con la agudeza olfativa (Fishelson et al. 2010). P. brachypomus es una especie pelágica y posee de 26 a 28 lámelas radiales en cada roseta, parece ser un numero bajo comparado con otras especies Wallago attu, Saurida macrolepis y Coryphaena hippurus, estas tres especies son demersales, habitando lugares con escasa luminosidad, por lo cual en contraposición a esta poca luminosidad la especies desarrollan más el sistema olfativo que la visión y por tanto presentan mayor número de lamelas (Tabla 5). El bajo número de lamelas encontradas también puede estar relacionado a que los individuos estudiados eran alevinos y como reportan Kudo et al. 2009 en O. keta especie que al igual que P. brachypomus tiene crecimiento indeterminado, el numero de lamelas incrementa durante el ciclo de vida de los peces. Especie N⁰ de lamelas Referencia Wallago attu 164 a 168 Ghosh & Chakrabarti 2009 Saurida macrolepis 80 a 84 Fishelson et al. 2010 Coryphaena hippurus 61 a 64 Mana & Kawamura 2002 Synodus falcatus 36 Fishelson et al. 2010 Acipenser naccarii 20 Camacho et al. 2009 Trachinocephalus myops 22 a 28 Fishelson et al. 2010 Oncorhynchus keta 16 a 21 Kudo et al. 2009 Lampris guttatus 12 a 14 Mana & Kawamura 2002 Tabla 5. Número de lamelas en diferentes especies de teleósteos. 53 La distribución del epitelio sensorial y el no sensorial a lo largo de la lamela, varía según las especies (Hara 1982), presentándose diferencias marcadas entre especies que ocupan hábitats similares y muy diferentes (Singh 1994). El epitelio olfativo de las especies pelágicas puede presentar dos tipos de distribución: (1) aleatoria, donde el epitelio sensorial y no sensorial están entremezclados a lo largo de la superficie lamelar y (2) el epitelio sensorial es restringido a la región apical de la lamela y el no sensorial a la parte basal (Singh 1994, Zeiske et al. 1992). El epitelio olfativo de P. brachypomus se distribuye de manera aleatoria, esta distribución también es reportada para el silúrido bentopelágico Channa punctatus (Mandal et al. 2005) y otras especies pelágicas (Mana & Kawamura 2002). Sin embargo, aún no son claras las implicaciones ecológicas y fisiológicas de los diferentes tipos de distribución del epitelio olfativo (Singh 1994). El epitelio sensorial y no sensorial de P. brachypomus presenta la conformación reportada para la mayoría de los teleósteos. En el epitelio sensorial se identificaron los tres tipos de neuronas sensoriales olfativas: las microvellosas (ORNm), las ciliadas (ORNc) y las células cripta (CC). Por otra parte el epitelio olfativo no sensorial está compuesto por cuatro tipos de células: las células ciliadas no sensoriales (CCN), las células mucosas (CM), las células de soporte (CS) y las células basales (CB). Los primeros dos tipos ORNm y ORNc, se han reportado en la mayoría de los teleósteos (Labergea & Hara 2001). Por el contrario las CC, no han sido descritas para todas las especie de peces estudiadas (Hansen et al.1999, Hansen & Finger 2000, Belanger et al. 2003). En el epitelio de P. brachypomus, las CC se identificaron por su forma globosa y su posición apical, se reporta que estas células están relacionadas con la percepción de feromonas sexuales, por lo tanto su presencia en el epitelio es de gran importancia (Hamdani & Døving 2007). Estudios realizados en C. carassius se encontraron incrementos en el número de CC en diferentes épocas del año, que coincidían con los eventos reproductivos de la especie (Hamdani & Døving 2008), lo cual sugiere que estas células son muy importantes en la mediación de la reproducción en los peces (Schmachtenberg et al. 2006, Hamdani & Døving 2007, Labergea & Hara 2001). No solo para las CC se han reportado estas variaciones en el numero de células durante la reproducción, también se reporta que los hábitos alimenticios están directamente 54 relacionados con la densidad de células ORNm y ORNc, por ejemplo Schizothorax richardsonii, una especie omnívora con un amplio rango en la búsqueda de su alimento, está sometida a cambios de hábitats contrastantes, requiriendo especializaciones en la proporción de ONRs para suplir sus necesidades (Singh et al. 1995). Teniendo en cuenta que P. brachypomus también es una especie omnívora consumidora de frutos, insectos, crustáceos y peces y que en las épocas secas estos peces se trasladan de los bosques inundados a los ríos (Salinas & Agudelo 2000), sería muy interesante realizar estudios que cuantifiquen la densidad de ORNs, para verificar si los cambios de hábitat influyen en la proporción de ORNs. 6.3 BULBO OLFATIVO Todos los estímulos odoríficos captados por las ORNs son traducidos en señales eléctricas que viajan a través del nervio olfativo, el cual inerva el bulbo olfativo (BO), donde se procesan y retrasmiten estas señales hacia el resto del cerebro (Friedrich & Korsching 1997, Hamdani & Døving 2007). Como la mayoría de los teleósteos el bulbo olfativo de P. brachypomus está compuesto por cuatro capas concéntricas: la capa del nervio olfativo (CNO), la capa glomerular (CGL), la capa de células mitrales (CCM) y la capa interna de células (CIC) (Byrd & Brunjes 1995, Kosaka & Hama 1982, Baile et al. 2008, Hamdani & Døving 2007). En el bulbo olfativo de P. brachypomus se identificaron 3 tipos de células neuronales: mitrales, ruffed y granulares. Como se ha reportado en C. auratus estos tres tipos de celulares forman una compleja red de conexiones en el cerebro (Satou 1990, Zippel et al. 1999,). Las mitrales reciben los estímulos sinápticos de las ORNs y son las principales neuronas de salida del BO, proyectando sus axones a hacia el telencéfalo (Shipley & Ennis 1996, Friedrich & Korsching 1997). Las células granulares, tienen función inhibitoria lateral sobre las células mitrales y ruffed, mejorando la precisión en el procesamiento de las señales que relacionadas con un mismo estimulo (Abraham et al. 2010, Mori et al. 1999. Dryer & Graziadei 1996). 55 A diferencia de las células mitrales y las granulares, la células ruffed solo han sido reportadas en algunos teleósteos y no en otro grupo de vertebrados (Byrd & Brunjes 1995). En P. brachypomus fueron identificadas debido a que el citoplasma tiene mayor afinidad por el azul de toluidina que las células mitrales tal como lo reportado para C. auratus (Kosaka & Hama 1980). Un estudio realizado por Fuller & Bryd 2005 determinó que las células ruffed constituyen menos del 10% de las neuronas de salida. Además, aparentemente estas células no reciben directamente los impulsos sinápticos de las ORNs, sino que estos se transmiten por medio de las células mitrales (Byrd & Brunjes 1995, Zippel et al. 1999). 6.4 ALTERACIONES HISTOPATOLÓGICAS El principal cambio histológico observado en los individuos expuestos a Roundup® Activo con respecto a los individuos control, es la presencia de células granulares (CG), que en el caso del epitelio olfativo se denominaron células granulares eosinofílicas (CGE), debido a la tinción con H&E (Reite 1997). Las CG/CGE en peces están asociadas con los mecanismos de respuesta a procesos infecciosos de los tejidos ya sea por parásitos o agentes citotóxicos (Cammarata et al.2000, Dezfuli et al. 2003, Matsuyama & Iida 1999, Sharp et al. 1989). Algunos autores sugieren que las CG/CGE son homólogas de las células mast de los mamíferos (Dezfuli et al. 2010 y Reite & Evensen 2006) las observaciones realizadas en el presente estudio apoyan esta hipótesis, debido a que la morfología de las CG/CGE observadas (en especial el citoplasma lleno de gránulos), junto con su distribución en los tejidos y sus propiedades de tinción coinciden con estos reportes. Numerosos estudios reportan el aumento de las CGE en los tejidos después de la exposición a agentes inmunotóxicos (Dezfuli & Giari 2008, Flaño et al.1996, Holland & Rowley 1998, Lamas et al. 1991, Schmale et al. 2004). En este trabajo aunque no se realizaron conteos del número de CGE presentes en el epitelio olfativo de los diferentes tratamientos, de manera cualitativa se observó un aumento considerable en el número de CGE en el tratamiento 3 (1 mg/l) con respecto al T2 (0.1 mg/l), lo cual sugiere que la 56 concentración de 1 mg/l de Roundup® Activo puede generar un grado mayor de daño en el epitelio olfativo. Por lo general las CGE están asociadas principalmente a los vasos sanguíneos del tejido conectivo (Blackstock & Pickering 1980, Lauriano et al. 2012, Matsuyama & Iida 1999, Reite & Evensen 2006), se cree que los precursores de estas células se originan en sistema hematopoyético y viajan a través del torrente sanguíneo hacia los tejidos, migrando y terminando de diferenciándose para llevar a cabo sus funciones (Galli 1990, Kirshenbaum et al. 1991). Sin embargo, en el presente estudio las CGE fueron comúnmente encontradas en la región basal del epitelio olfativo no sensorial y no en el núcleo central, donde se encuentran numerosos vasos sanguíneos. Por lo anterior en este trabajo se plantea la hipótesis que los precursores de estas células residen en este epitelio y solo se diferencian cuando se produce una señal de alarma, generando una respuesta rápida a cualquier agente nocivo. Esta hipótesis es apoyada por estudios realizados en branquias, donde Flaño et al. 1996 infectaron cultivos de tejidos branquiales de O. mykiss con Renibacterium salmoninarum, causando un aumento en el número de CGE. Y en otro estudio realizado con Sparus aurata, se encontró que después de la exposición a bifenilo piliclorado PCB 126 (compuesto organoclorado), las branquias presentaban un aumento de CGE que no estaban asociadas a los vasos sanguíneos (Lauriano et al. 2012). Las branquias al igual que la roseta olfativa son órganos inmunológicos importantes, que están en contacto directo con el ambiente por lo cual siempre deben estar alerta a cualquier cambio en el ambiente que pueda generar una reacción inmunológica (Dezfuli et al. 2003, Flaño et al. 1996, Holland & Rowley 1998, Lauriano et al. 2012, Tierney et al. 2010). Por otra parte en el bulbo olfativo, también se observó la presencia de células granulares (CG) en los individuos expuestos a Roundup® Activo, en este caso fueron identificadas en cortes teñidos con azul de toluidina, el cual tiñe fuertemente los gránulos de estas células. Al igual que lo reportado en otros peces, estas células presentan poblaciones heterogéneas con diferentes morfologías y contenido granular (Dezfuli et al. 2010, Reite & Evensen 2006). 57 La mayoría de CG observadas en el bulbo olfativo, están asociadas a los vasos sanguíneos de la pía madre, característica común descrita en otros vertebrados (Blackstock & Pickering 1980, Matsuyama & Iida 1999, Reite & Evensen 2006). Esta asociación con las células capilares siguiere que las CG migran a través del endotelio, hasta llegar al lugar donde deben cumplir sus funciones (Powell et al. 1990). Teniendo en cuenta que las CG fueron observadas en la capa del nervio olfativo y en la capa glomerular del bulbo, y en algunos casos cercanas a las células mitrales, se puede decir que las CG si presentaron migración a diferentes partes del bulbo olfativo. Algunos autores describen que una vez las CG han madurado y migrado ocurre la degranulación, se cree que este evento es inducido por el compuesto 48/80 (polímero) (Reite 1997), liberando o produciendo sustancias que intervienen en la reacción inflamatoria de los tejidos como histamina y de péptidos antimicrobianos (Noga & Silphaduang 2003, Silphaduang & Noga 2001, Vallejo & Ellis 1989). Por otro lado, según los reportado por Wilhelm et al. 2005, en mamíferos las células mast (homologas de las CG) pueden interactuar con las neuronas por procesos de transgranulación, ya sea por fusión directa de los gránulos y las membranas plasmáticas de ambas células, por la captura de restos de gránulos insolubles tras los eventos de degranulación de las células mast o por endocitosis de estas. Son pocos los estudios acerca del papel de las CG en el cerebro de peces, de hecho los primeros reportes de la aparición de CG en el cerebro tras la exposición a surfactantes (Cosmoflux®) o herbicidas (Roundup®), fueron realizados por Rondón-Barragan et al. 2007 y Ramírez et al. 2008 respectivamente. En este último estudio se encontraron CGE en el telencéfalo y en el bulbo olfativo de P. brachypomus, utilizando concentraciones mayores de Roundup® (desde 7,5 a 120 mg/l) a las utilizadas en el presente trabajo. Ramírez et al. 2008 reportaron daños como gliosis y presencia de CGE alrededor de neuronas con procesos degenerativos, tal vez desencadenando o acelerando eventos de muerte celular. Aunque estos daños neurodegenerativos no fueron observados en el presente trabajo, posiblemente debido a que las concentraciones de Roundup® evaluadas fueron menores a las utilizadas por Ramírez et al. 2008. Aun así es muy importante destacar que este es 58 uno de los primeros reportes de CG/CGE en el sistema olfativo tras la exposición a concentraciones subletales de este herbicida (0.1 y 1 mg/l), que se encontraron disueltas en los ecosistemas acuáticos (Eslava et al. 2007), por ende es más pertinente evaluar el efectos de estas concentraciones. De esta manera la presencia de CGE indica que hay una reacción y un cambio histopatológico en el sistema olfativo de P. brachypomus, por tanto se hace importante realizar estudios más profundos que determinen las funciones que las CG cumplen en estos tejidos, como se relacionan con las neuronas, que tipo de compuestos secretan y como estos influyen en las neuronas. 6.5 TRAZADO ANTERÓGRADO ROSETA-BULBO OLFATIVO En general las vías olfatorias de P. brachypomus tienen la misma organización que la mayoría de los teleósteos. Las fibras provenientes de nervio olfativo penetran el bulbo y se extienden por la capa del nervio olfativo hasta llegar a la capa glomerular; en esta capa las fibras se distribuyen hacia la periferia del bulbo y forman los glomérulos, cuyos axones conectan con las células mitrales o ruffed (Hamdani & Døving 2007, Labergea & Hara 2001, Hara & Zielinski 2007). La organización topográfica de los glomérulos en P. brachypomus se dividió en dorsal, medial, lateral, anterior y ventral, siguiendo las descripciones realizadas en D. rerio, donde fueron identificados 22 glomérulos como unidades morfológicas individuales (Baier & Korsching 1994), de los cuales en P. brachypomus se identificaron 10, esto puede deberse a que el espesor, nivel y/o orientación del corte no permitió diferenciar todos los glomérulos individualmente. A diferencia de D. rerio para P. brachypomus no se identificaron de manera individual los cinco glomérulos de la asociación de glomérulos del grupo dorsal (a-e), cuatro de los glomérulos de la cadena lateral y los glomérulos de la tripleta ventral (u-w). Sin embargo, fueron clasificados los grupos más sobresalientes (ap, dc, lc, u-w y algunos del grupo medio), que como reporta Baier & Korsching 1994, esta organización puede indicar que en los teleósteos hay un estereotipo común en la topografía glomerular del bulbo, esto 59 teniendo en cuenta que en otras especies como C. auratus y O. mykiss se encontró una gran similitud con este patrón. Los glomérulos son el centro de integración de la información en el bulbo (Hamdani & Døving 2007). Entre los glomérulos identificados en P. brachypomus, se destaca el grupo lateral, para el cual estudios realizados por Døving et al. 1980 demostraron que responde a estímulos causados por diferentes aminoácidos. También se identificaron los glomérulos de la región media, que a diferencia de la región lateral, se reporta que se activan específicamente con las sales biliares (Hara & Zhang 1996, Thommesen 1978). Finalmente fue posible caracterizar los glomérulos ubicados en la región ventral del bulbo, para la cual Friedrich & Korsching 1997 reportan que es activada por las prostaglandinas, que son componentes de las feromonas sexuales. El patrón de inervación y la organización topográfica de los glomérulos anteriormente descritos, no presentaron diferencias en los tres tratamientos evaluados. Esto puede indicar que las concentraciones de Roundup® Activo evaluados no tienen un efecto marcado sobre las fibras nerviosas ni en sus conexiones, lo cual está asociado a que tampoco se observó muerte celular neuronal en los tejidos. Otra posibilidad a considerar es que el trazado con DiI no es una técnica lo suficientemente flexible para detectar daños tan específicos, como a nivel de unas cuantas conexiones afectadas. En resumen, la presencia de CG/CGE en los tejidos del sistema olfativo de P. brachypomus demuestra que las concentraciones subletales Roundup® Activo (0.1 y 1 mg/l) utilizadas en este trabajo causan alteraciones a nivel tisular en la roseta y bulbo olfativo. Es importante resaltar que al parecer este sería el primer reporte de daños histopatológicos causados por un herbicida en el epitelio olfativo en peces (Tierney et al. 2010). Este hallazgo apoyaría la idea de que el sistema olfativo es una de las posibles vías de entrada del Roundup® Activo al sistema nervioso central, por lo tanto y teniendo en cuenta que el sistema olfativo está implicado en aspectos fisiológicos importantes para los peces como la alimentación, la reproducción y el reconocimiento intra e inter específico; exposiciones prolongadas a este herbicida podrían afectar estos procesos vitales para el desarrollo de P. brachypomus y su interacción con el ambiente. 60 7 CONCLUSIONES Los individuos de P. brachypomus utilizados en los tres tratamientos no presentaron diferencias en las variables de crecimiento. La roseta olfativa y el bulbo olfativo de P. brachypomus presentan la conformación anatómica e histológica típica de los teleósteos. Al igual que el patrón de inervación (roseta - bulbo olfativo) y la organización topografía de los glomérulos. La roseta olfativa de P. brachypomus tiene en promedio de 26 a 28 lamelas. La exposición a concentraciones subletales Roundup® Activo, causa alteraciones histopatológicas en la roseta olfativa y en el bulbo olfativo de P. brachypomus, registrando la presencia CG o CGE en estos tejidos. No se observaron cambios en el patrón de inervación, ni en la organización de topográfica de los glomérulos en el bulbo olfativo, en los individuos de P. brachypomus expuestos a Roundup® Activo. 61 8 RECOMENDACIONES Realizar estudios de trazados anterógrados y retrógrados con DiI, para identificar las diferentes proyecciones de las células mitrales en el telencéfalo y el resto del cerebro. Realizar estudios de densidad de neuronas olfativas receptoras y los cambios en el número de lamelas olfativas en las diferentes etapas del desarrollo de P. brachypomus. Hacer estudios morfométricos para establecer de manera cuantitativa si existen diferencias en el número de CG presentes en los tejidos del sistema olfatorio a diferentes concentraciones subletales de Roundup® Activo. Realizar estudios con MOAR en la roseta olfativo de P. brachypomus, evaluando concentraciones subletales de Roundup® Activo, para obtener descripciones más detalldas de los efectos el histopatológicos de este herbicida. Evaluar si el Roundup® Activo tiene implicaciones en el desarrollo del sistema olfativo en etapas larvales de P. brachypomus. Realizar estudios de microscopia electrónica para así realizar descripciones más detalladas de la morfología de las CG, sus procesos de degranulación y su relación con las neuronas. 62 BIBLIOGRAFÍA Abraham NM, Egger V, Shimshek DR, Renden R, Fukunaga I, Sprengel R, Seeburg PH, Klugmann M, Margrie TW, Schaefer AT, Kuner T. 2010. Achiorno CL, Villalobos C, Ferrari L. 2008.Toxicity of the herbicide glyphosate to Chordodes nobilii (Gordiida, Nematomorpha). Chemosphere, 71: 1816–1822. Agudelo C, Pineda Z, Acosta S, Ramírez G, Ajiaco M, Gonzales C. 2011. Piaractus brachypomum (Cuvier 1818). p. 236-242. En: Lasso A, Agudelo C, Jimenez S, Ramirez G, Morales B, Ajiaco M, Gutierrez F, Usma O, Muñoz , Sanabria O. 2011. Catalogo de recursos pesqueros continentales en Colombia. Serie editorial recursos hidrobiológicos y pesqueros continentales de Colombia. Instituto de investigaciones de los recursos biológicos Alexander von Humboldt. Bogotá, Colombia. Alonso JR, Lara J, Miguel JJ, Aijon J. 1987. Ruffed cells in the olfactory bulb of freshwater teleosts. I. Golgi impregnation, J. Anat, 155: 101–107. Allison AC, Warwick RTT. 1949. Quantitative observations on the olfactory system of the rabbit. Brain, 72:186-197. Baier H, Korsching S. 1994. Olfactory glomeruli in the zebrafish form an invariant pattern and are identifiable across animals. J. Neuroscienses, 14: 219–230. Baile VV, Raut IN, Bhute YV. 2008. Organization of olfactory system, forebrain and pituitary gland of a teleost. Notopterus notopterus. Annals of Neurosci, 15(2): 43–50. Belanger RM, Smith CM, Corkum LD, Zielinski BS. 2003. Morphology and histochemistry of the peripheral olfactory organ in the round goby, Neogobius melanostomus (Teleostei: Gobiidae). Journal of Morphology, 257: 62-71. Bettini S, Ciani F, Franceschini V. 2006. Cell proliferation and growth-associated protein 43 expression in the olfactory epithelium in Poecilia reticulata after copper solution exposure. European Journal of Histochemistry, 50 (2): 141–146. Bretaud S, Toutant JP, Saglio P. 2000. Effects of carbofuran, diuron and nicosulfuron on acetylcholinesterase activity in goldfish (Carassius auratus). Ecotoxicol. Environental, 47: 117–124. 63 Breucker H, Zeiske Ε and Melinkat R. 1979. Development of the olfactory organ in the rainbow fish Nematicentris macculochi (Atheriniformes, Melanotaeniidae). Cell Tissue Res, 200: 53–68. Buonviso N, Chaput MA .1990. Response similarity to odors in olfactory bulb output cells presumed to be connected to the same glomerulus: electrophysiological study using simultaneous single-unit recordings. J Neurophysiol, 63: 447-454. Butler AB 2000. Nervous system 129-145. En: Ostrander GK (ed.) The Laboratory Fish. Elsevier, 678 p. Byrd CA, Brunjes PC. 1995. Organization of the olfactory system in the adult zebrafish: histological, immunohistochemical, and quantitative analysis. J. Comp. Neurol, 358: 247–259. Caldas ML, Hurtado H, Barrera B. 2008. Estudio histológico y morfológico preliminar de la hipófisis de alevinos de cachama blanca Piaractus brachypomus, (Characidae: Piaractus). Actualidades Biológicas, 30 (89): 100-110 Caldas ML, Ricaurte O, Rodríguez G, Amaya J. 1993. Microscopía óptica de alta resolución “MOAR”. Instituto Nacional de Salud. Bogotá, Colombia. Camacho S, Ostos-Garrido MV, Domezain A, Carmona R. 2010. Study of the Olfactory Epithelium in the Developing Sturgeon. Characterization of the Crypt Cells Chem. Senses, 35: 147–156. Cammarata M, Vazzana M, Cervello M, Arizza V, Parrinello N. 2000. Spontaneous cytotoxic activity of eosinophilic granule cells separated from the normal peritoneal cavity of Dicentrarchus labrax. Fish Shellfish Immunol, 10:143-54 ® Cavalcante D, Martinez C, Sofia S. 2008. Genotoxic effects of Roundup on the fish Prochilodus lineatus. Journal Mutation Research, 655: 41-46. CCAC. Canadian Council on Animal Care. 2005. Guidelines on: the care and use offish in research, teaching and testing. Ottawa, Ontario, Canada: Canadian Council on Animal Care. Contardo-Jara V, Klingelmann E, Wiegand C. 2009. Bioaccumulation of glyphosate and its formulation Roundup Ultra in Lumbriculus variegatus and its effects on biotransformation and antioxidant enzymes. Environmental Pollution, 157: 57–63. Chakrabarti P, Ghosh SK. 2011. Histological and ultrastructural studies of the olfactory epithelium of spotted butter fish Scatophagus argus (Linnaeus). Folia Morphol, 70(2): 74–79. 64 Chakrabarti P. 2005. Histological and histochemical studies on the olfactory rosette of Mugil parsia (Hamilton).Folia Morphol, 64 (1): 41–46. Dezfuli BS, Giari L, Simoni E, Palazzi D, Manera M. 2003. Alteration of rodlet cells in chub caused by herbicide Stam® M-4 (Propanil). J Fish Biol;63:232–9. Dezfuli BS, Giovinazzo G, Lui A, Giari L. 2008. Inflammatory response to Dentitruncus truttae (Acanthocephala) in the intestine of brown trout. Fish Shellfish Immunol, 24:726–33. Dezfuli BS, Pironi F, Giari L, Noga EJ. 2010. Immunocytochemical localization of piscidin in mast cells of infected seabass gill. Fish & Shellfish Immunology 28: 476-482 Díaz F, López RA. 1993. El cultivo de la cachama blanca (Piaractus brachypomus) y de la Cachama Negra (Colossoma macropomum). En: Rodríguez H, Polo G, Salazar G.2001. Fundamentos de Acuicultura Continental. Instituto Nacional de Pesca y Acuicultura INPA. Bogotá, Colombia. p: 207-219. Diaz JP, Prie-granie M. Blasco C. Noell T. Connes R. 2002. Ultrastrutural study of the olfactory organ in adult and developing European sea bass, Dicentrarchus labrax. Can. J. zool, 80: 1610– 1622. Dinehart S, Smith L, McMurry S, Anderson T, Smith P, Haukos D. 2009. Toxicity of a glufosinate and several glyphosate based herbicides to juvenile amphibians from the Southern high Plains, USA. Journal science of the Total Environmental, 407: 1065-1071. Dinehart SK, Smith LM, McMurry ST, Smith PN, Anderson TA, Haukos DA. 2010. Acute and chronic toxicity of Roundup Weathermax and Ignite 280 SL to larval Spea multiplicata and S. bombifrons from the Southern High Plains, USA. Environ Pollut,158(8): 2610-7. Døving KB, Dubois-Dauphin M, Holley A, Jourdan F. 1977. Functional anatomy of the olfactory organ of fish and the ciliary mechanism of water transport. Acta Zool, 58: 245–255. Døving KB, Selset R, Thommesen G. 1980. Olfactory sensitivity to bile acids in salmonid fishes. Acta Physiol. Scand, 108: 123–131. Dryer L, Graziadei P. 1994. Mitral cell dendrites: a comparative approach. Anat Embryol, 189: 91– 106. Dryer L, Graziadei PPC. 1996. Synaptology of the olfactory bulb of an elasmobranch fish, Sphyrna tiburo. Anat. Embryol. 193, 101–114. 65 Eom J, Jung YR, Park D. 2009. F-series prostaglandin function as sex pheromones in the Korean salamander Hynobius leechii. Comparative Biochemistry and Physiology, 154: 61–69. Eslava-Mocha PR, Ramirez-Duarte WF, Rondon-Barragan IS. 2007. Sobre los efectos del glifosato y sus mezclas: Impacto sobre peces nativos. Universidad de los Llanos. Colombia, 150 p. Estévez M. 1989. Bases para el cultivo de cachama. Federación Nacional de Cafeteros de Colombia FEDERACAFE, Instituto Nacional de Recursos Naturales Renovables y del Ambiente INDERENA. Manizales, Colombia. 29 p. Evrard E, Marchand J, Theron M, Pichanvant-Rafini K, Durand G, Quiniou L, Laroche J. 2010. Impacts of mistures of herbicides on molecular an physiological responses of the European flounder Platichthys flesu. International journal Comparative Biochemistry and Physiology, 152(3): 321-31. Fishelson L, Golani D, Galil B, Goren M. 2010. Comparison of taste bud form, number and distribution in the oropharyngeal cavity of lizardfishes (Teleostei, Aulopiformes, Synodontidae), Cybium, 34: 269-277. Flaño E, Lopez-Fierro P, Rasquin BE, Villena A. 1996. In vitro differentiation of eosinophilic granular cells in Renibacterium salmoninarum-infected gill cultures from rainbow trout. Fish & Shellfish Immunology 6:173-84. Flaño E, López-Fierro P, Razquin E, Villena A. 1996. In vitro differentiation of eosinophilic granular cells in Renibacterium salmoninaruminfected gill cultures from rainbow trout. Fish Shellfish Immunol, 6:173–84. Friedrich RW, Korsching SI. 1997. Combinatorial and chemotopic odorant coding in the zebrafish olfactory bulb visualized by optical imaging. Neuron, 18: 737–752. Friedrich RW, Korsching SI. 1998. Chemotopic, combinatorial, and noncombinatorial odorant representations in the olfactory bulb revealed using a voltage-sensitive axon tracer. J. Neurosci, 18: 9977–9988. Fuller CL, Byrd CA. 2005. Ruffed cells identified in the adult zebrafish olfactory bulb. Neurosci Lett, 379(3):190-4. Fuller CL, Yettaw HK, Byrd CA. 2006. Mitral cells in the olfactory bulb of adult zebrafish (Danio rerio): morphology and distribution. J Comp Neurol, 10; 499(2): 218-30. 66 Galli SJ. Biology of disease. 1990. New insights into ‘‘The riddle of the mast cells’’: microenvironmental regulation of mast cell development and phenotypic heterogeneity;62:5-33. Gayoso JÁ, Castro A, Anadón R, Manso MJ. 2011. Differential Bulbar and Extrabulbar Projections of Diverse Olfactory Receptor Neuron Populations in the Adult Zebrafish (Danio rerio). The Journal of Comparative Neurology|Research in Systems Neuroscience, 519: 247–276. Ghosh SK, Chakrabarti P. 2009. Cellular architecture and functional aspects of the olfactory rosette of Wollogo ottu (Bleeker). Turk. J. Fisheries and Aquatic Science, 9: 187-190. Ghosh SK, Chakrabarti P. 2009. Cellular Architecture and Functional Aspects of the Olfactory Rosette of Wallago attu (Bleeker). Turkish Journal of Fisheries and Aquatic Sciences, 9: 187-190. Ghosh SK, Chakrabarti P. 2010. Histological and scanning electron microscopic organization and functional aspects of the olfactory epithelium of the freshwater minor carp, Puntius sophore (Hamilton). Proc. Zool. Soc., 63: 115-119. Giesy JP, Dobson S, Solomon KR. 2000. Ecotoxicological risk assessment for Roundup® herbicide, Rev. Environmental Contamination Toxic, 167: 35–120. Glusczak L, Santos DM, Crestani M, Fonseca MB, Araujo FP, Frescura MD, Pimentel V L. 2006. Effect of glyphosate herbicide on acetylcholinesterase activity and metabolic and hematological parameters in piava (Leporinus obtusidens). Ecotoxicology and Environmental Safety, 65: 237–241. Glusczak L, Santos DM, Silveira MB, Rodrigues RS, Chitolina MRS, Morsch VM, Loro VL. 2007. Acute effects of glyphosate herbicide on metabolic and enzymatic parameters of silver catfish (Rhamdia quelen) Comparative Biochemistry and Physiology, Part C 146: 519–524. Goetz FW, Garczynski M. 1997. The ovarian regulation of ovulation in teleost fish. Fish Physiology and Biochemestry, 17: 33–38. Gómez RE, Tovar MO, Obando MJ, Hurtado HG. 2010. Estudio histológico del tracto digestivo del pez Ariopsis seemani (Ariidae). Revista Facultad de Ciencias Básicas, 6(2): 216-225. González R. 2001. El cultivo de la cachama. En: Rodríguez H, Polo G, Salazar G.2001. Fundamentos de Acuicultura Continental. Instituto Nacional de Pesca y Acuicultura INPA. Bogotá, Colombia. p: 329-346. Gridley MF. 1960. Manual of Histologic Special Staining Techniques. Second Edition. McGraw Hill Book Company, Inc. New York 67 Guerra FH., Alcantara BF., Campos Al. 1996. Amazon fish farming with native species. Piscicultura amazónica con especies nativas. Tratado de Cooperación Amazónica, Lima (Perú). Secretaría ProTempore; FAO, Rome (Italy). Dept. de Montes. Lima (Peru) Pub. p: 171. H.P. Zippel, C. Reschke, V. Korff, Simultaneous recordings from and their two physiologically different types of relay neurons, mitral cells and ruffed cells, in the olfactory bulb of goldfish, Cell. Mol. Biol. 3317. 45 (1999) 327–337 Hamdani EH, Døving KB. 2002. The alarm reaction in Crucian carp is mediated by olfactory neurons with long dendrites. Chem Senses, 27: 395–398. Hamdani EH, Døving KB. 2007. The functional organization of the fish olfactory system. Progress in Neurobiology, 82: 80–86. Hamdani H, Lastein S, Gregersen F, Døving K. 2008 Seasonal Variations in Olfactory Sensory Neurons Fish Sensitivity to Sex Pheromones Explained? Chem. Senses 33: 119–123. Hansen A, Finger TE. 2000. Phyletic distribution of crypt type olfactory receptor neurons in fishes. Brain, Behavior and Evolution, 55: 100–110. Hansen A, Finger TE. 2000. Phyletic distribution of crypt-like olfactory receptor neurons in fishes. Brain Behav Evol 55:100– 110. Hansen A, Rolen SH, Anderson K, Morita Y, Caprio J, Finger TE. 2003. Correlation between olfactory receptor cell type and function in the channel catfish. Journal of Neuroscience, 23 (28): 9328–9339. Hansen A, Zippel HP, Sorensen PW, Caprio J. 1999. Ultrastructure of the olfactory epithelium in tact, axotomized, and bulbectomized goldfish, Carassius auratus. Microsc Res Tech 45: 325–338. Hara JT, Zielinski B. 2007. Fish Physiology: Sensory Systems Neuroscience. Academic Press, Elsevier. California, USA, 536p. Hara T. 2000. Chemoreceptions 245-247 En: Ostrander GK (ed.) The Laboratory Fish. Elsevier, 678 p. Hara TJ, Zhang C. 1996. Spatial projections to the olfactory bulb of functionally distinct and randomly distributed primary neurons in salmonid fishes. Neurosci. Res, 26: 65–74. Hara TJ. 1982. Chemoreception in Fishes. Elsevier Scientific, Amsterdam, p. 39–59. 68 Hara TJ. 1994. The diversity of chemical stimulation in fish olfaction and gustation. Rev. Fish Biol.Fish., 4(1): 1–35. Holland JW, Rowley AF. 1998. Studies on the eosinophilic granule cells in the gills of the rainbow trout Oncorhynchus mykiss. Comp Biochem Physiol C: Pharmacol Toxicol Endocrinol 120:321–8. Imamura K, Mataga N, Mori K (1992) Coding of odor molecules by mitral/tufted cells in rabbit olfactory bulb. I. Aliphatic compounds. J Neurophysiol, 68:1986-2002. Instituto Nacional de Pesca y Acuicultura (INPA). 2000. Fishing statistical anual report. Grafimpresos Quintero, Bogotá. 350 p. Jaramillo J, Gómez E, Caldas ML, Rodríguez D, Hurtado H. 2009. Histology and morphometry of dorsal root ganglia and their neurons in a fish of indeterminate growth the white cachama (Piaractus brachypomus). Actualidades Biológicas, 31: 43-52. Keith B. Tierney, David H. Baldwin, Toshiaki J. Hara, Peter S. Ross, Nathaniel L. Scholz, Christopher J. Kennedy. 2010. Olfactory toxicity in fishes. Aquatic Toxicology, 96: 2–26. Kirshenbaum AS, Kessler SW, Goff JP, Metcalfe DD. 1991. Demonstration of the origin of human mast cells from CD34Cbone marrow progenitor cells. Journal of Immunology;146:1410-5. Kolpin D, Thurman M, Lee E, Meyer M, Furlong E, Glassmeyer S. 2006. Urban contributions of gliphosate and its degradate AMPA to streams in the United States. Journal Science of the total environment, 354: 191-197. Kosaka T, Hama K. 1980. Presence of the ruffed cell in the olfactory bulb of the catfish, Parasilurus asotus, and the Sea Eel, Conger myriaster. J. Comp. Neurol, 193: 103–117. Kosaka T, Hama K. 1982. Structure of the mitral cell in the olfactory bulb of the goldfish (Carassius auratus). J Comp Neurol, 212: 365–384. Kudo H, Shinto M, Sakurai Y, Kaeriyama M. 2009. Morphometry of Olfactory Lamellae and Olfactory Receptor Neurons during the Life History of Chum Salmon (Oncorhynchus keta). Chem. Senses 34(7): 535-545 Kumari K. 2008. Morphology and Morphometry of the Olfactory Rosette of a Teleostean Fish: Catla catla (Ham). Our Nature, 6: 30-37. 69 Laberge F, Hara TJ. 2001. Neurobiology of fish olfaction: a review. Brain Research Reviews, 36: 46–59. Lamas J, Bruno DW, Santos Y, Anadon R, Ellis AE. 1991. Eosinophilic granular cell response to intraperitoneal injection with Vibrio anguillarum and its extracellular products in rainbow trout Oncorhynchus mykiss. Fish Shellfish Immunol;1:187–94. Lancet D, Greer CA, Kauer JS, Shepherd GM. 1982. Mapping of odor-related neuronal activity in the olfactory bulb by high-resolution 2-deoxyglucose autoradiography. Proc Nat1 Acad Sci USA, 79 (2): 670-674. Lastein S, Hamdani EH, Døving KB. 2006. Gender distinction in neural discrimination of sex pheromones in the olfactory bulb of crucian carp, Carassius carassius. Chem Senses, 31: 69–77. Le Gros Clark WE (1957) Inquiries into the anatomical basis of olfactory discrimination. Proc R Sot Lond, 146: 299-319. Li W, Sorensen PW. 1997. Highly independent olfactory receptor sites for naturally occurring bile acids in the sea lamprey, Petromyzon marinus. Journal of comparative physiology A, 180 (4): 429– 438. Liley NR, Stacey NE. 1983.Hormones, pheromones, and reproductive behavior in fish. En: Hoar WS, Randall DJ, Donaldson EM. Fish Physiology. 1988. Vol. IX, Parte B, Academic Press, New York, p. 1–63. Lushchak O, Kubrak O, Storey J, Storey K, Lushchak VI. 2009. Low toxic herbicide Roundup induces mild oxidative stress in goldfish tissues. International Journal Chemosphere, 76: 932-937. Mana RR, Kawamura G. 2002. A comparative study on morphological differences in the olfactory system of red sea bream (Pagrus major) and black sea bream (Acanthopagrus schlegeli) from wild and cultured stocks. Aquaculture, 209: 285-306. Mandal DK, Roy D, Ghosh L. 2005. Structural organization of the olfactory epithelium of a spotted snakehead fish, Channa punctatus. Acta Ichthyologica et Piscatoria, 35(1): 45-50. Matz SP. 1995. Connections of the olfactory bulb in the Chinook Salmon(Oncorhynchus tshawytscha). Brain Behav. Evol, 46: 108–120. 70 Modesto KA, Martinez CBR. 2010. Roundup ® causes oxidative stress in liver and inhibits acetylcholinesterase in muscle and brain of the fish Prochilodus lineatus. Chemosphere, 78:294– 299. Monheit S. 2003. Glyphosate-Based Aquatic Herbicides An Overview of Risk. CDFA-IPC. Moore A, Waring CP. 1996. Electrophysiological and endocrinological evidence that F-series prostaglandins function as priming pheromones in mature male Atlantic salmon (Salmo salar) parr, The Journal of Experimental Biology, 199: 2307–2316. Mori K, Nagao H, Yoshihara Y. 1999.The olfactory bulb: coding and processing of odor molecule information, Science 286, 711– 715. Munakata A, Kobayashi M. 2010 Endocrine control of sexual behavior in teleost fish. General and Comparative Endocrinology, 165: 456–468. Muñoz A, Caldas ML, Hurtado H. 2006. Análisis histomorfométrico del sistema digestivo y glándulas anexas de alevino de cachama blanca. Revista Facultad De Ciencias Básicas, 2 (1): 3345. Nivia E. 2001. Conferencia: Las Guerras en Colombia: Drogas, Armas y Petróleo” “The Wars in Colombia: Drugs, Guns and Oil” Instituto Hemisférico de las Américas Universidad de California, Davis, Mayo 17-19, 2001 Las fumigaciones aéreas sobre cultivos ilícitos si son peligrosas – Algunas aproximaciones. Noga EJ, Silphaduang U. 2003. Piscidins: a novel family of peptide antibiotics from fish. Drug News Perspect 16:87-92. Obando MJ. 2006. Estudio morfométrico y anatómico del cerebro del pez neón Cardenal, Paracheirodon axelrodi (Characiformes: Characidae). Universidad Militar Nueva Granada. Bogotá, Colombia. 101 p. Oka Y. 1983. Golgi, electron-microscopic and combined Golgi-electron microscopic studies of the mitral cells in the goldfish olfactory bulb.Neuroscience, 8: 723–742. Oldham J, Massey R, Cryan P. 2002. Aerial spraying in Colombia: and environmental effects. The Institute for Science & Interdisciplinary Studies (Fact Sheet) 4p. Percy R. 1970.Wandering cells in the epidermis of the goldfish (Carassius auratus). Proceedings of the University of Newcastle upon Tyne Philosophical Society 1:189-91. 71 Peruzzo P, Porta A, Ronco A. 2008. Levels of glyohosate in surface waters, sediments and soils associated with direct sowing soybean cultivation in north pampasic región of Argentina. Journal Environmental Pollution, 156: 61-66. Pesca y Acuicultura De Colombia. 2010. la Corporación Colombia Internacional Ministro de Agricultura y Desarrollo Rural.Bogotá. Colombia. Pineda SH, Olivera AM, Urcuqui IS, Builes GJ, Trujillo BE. 2004. Polimorfismo genético en cachama blanca Piaractus brachypomus (Characidae, Serrasalminae) mantenida en cautiverio. II Congreso Colombiano de Acuicultura. Villavicencio. p. 49-50. Poleo G, Aranbarrio JV, Mendoza L, Romero O. 2011. Cultivo de cachama blanca en altas densidades y en dos sistemas cerrados. Pesq. agropec. bras., Brasília, 46 (4):429-437. Powell MD, Wright GM, Burka JF. 1990. Eosinophilic granule cells in the gills of rainbow trout, Oncorhynchus mykiss: evidence of migration? J Fish Biol;37:495-7. Ramírez-Duarte WF, Rondón-Barragán IS, Eslava-Mocha PR. 2008. Acute toxicity and histopathological alterations of Roundup® herbicide on “cachama blanca” (Piaractus brachypomus). Pesq. Vet. Bras, 28 (11): 547-554. Ramirez-Duarte WF, Rondon-Barragan IS, Vidal Barrios HH, Eslava-Mocha PR. 2004. Efectos del glifosato (GP) con énfasis en organismos acuáticos. Orinoquia, 7 (1-2): 70-100. Rebaza C, Villafana E, Rebaza M, Deza S. 2002. Influencia de tres densidades de siembraen el crecimiento de Piaractus brachypomus.“paco” en segunda fase de alevinaje en estanques seminaturales. Folia amazónica VOL. 13 (1-2) –121-134 Reite OB, Evensen O. 2006. Inflammatory cells of teleostean fish: A review focusing on mast cells/eosinophilic granule cells and rodlet cells. Fish & Shellfish Immunology, 20(2): 192-208. Reite OB. 1997. Mast cells/eosinophilic granule cells of salmonids: staining properties and responses to noxious agents. Fish & Shellfish Immunology, 7:567-84. Rondón-Barragán IS, Ramírez-Duarte WF, Eslava-Mocha PE. 2007. Evaluación de los efectos tóxicos y concentración letal 50 del surfactante Cosmoflux® 411F sobre juveniles de cachama blanca (Piaractus brachypomus). Rev Col Cienc Pec, 20: 431 – 446. Rondon-Barragan IS, Ramirez-Duarte WF, Eslava-Mocha PR. 2007. Implicaciones bioenergéticas de la exposición de juveniles de cachama blanca (Piaractus brachypomus) a la mitad de la CL50 72 de la mezcla Roundup® más Cosmoflux® 411F. Revista De La Facultad De Medicina Veterinaria Y De Zootecnia, 54 (2): 178-178. Saglio P, Trijasse S. 1998. Behavioral responses to atrazine and diuron in goldfish. Arch. Environmental. Contamination Toxic, 35: 484–491. Salinas Y, Agudelo E. 2000. Peces de importancia económica en la cuenca amazónica colombiana. Instituto Amazónico de investigaciones científicas SINCHI. Editorial Scriopto. Bogotá, Colombia. p: 140. Sato K, Suzuki N. 2001. Whole cell response characteristics of ciliated and microvillous olfactory receptor neurons to amino acids, pheromone candidates and urine in rainbow trout. Chemical Senses, 26: 1145–1156. Sato Y, Miyasaka N, Yoshihara Y. 2005. Mutually exclusive glomerular innervation by two distinct types of olfactory sensory neurons revealed in transgenic zebrafish. J. Neurosci, 25: 4889–4897. Satou M. 1990. Synaptic organization, local neuronal circuitry, and functional segregation of the teleost olfactory bulb, Prog. Neurobiol. 34, 115–142. Saucier D, Astic L. 1995. Morpho-functional alterations in the olfactory system of rainbow trout (Oncorhynchus mykiss) and possible acclimation in response to long-lasting exposure to low copper levels. Compation Biochemistry Physiological, 112 (A): 273–284. Schmachtenberg O. 2006 Histological and Electrophysiological Properties of Crypt Cells from the Olfactory Epithelium of the Marine Teleost Trachurus symmetricus. The Journal of Comparative Neurology 495:113–12. Schmale MC, Vicha D, Cacal SM. 2004. Degranulation of eosinophilic granule cells in neurofibromas and gastrointestinal tract in the bicolor damselfish. Fish Shellfish Immunol, 17:53–63. Sharp GJE, Pike AW, Secombes CJ. 1989. The immune response of wild rainbow trout Salmo gairdneri Richardson to naturally acquired plerocercoid infections of Diphyllobothrium dendriticum (Nitzsch 1824) and D. ditremum (Creplin 1825). J Fish Biol; 35:781–94. Shipley MT, Ennis M. 1996. Functional organization of olfactory system. J Neurobiol, 30: 123–176. Silphaduang U, Noga E. 2001. Peptide antibiotics in mast cells of fish. Nature;414:268-9. 73 Singh Ν, Bhatt ΚC, Bahuguna M, Kumar. 1995. Fine structure of olfactory epithelium in Schizothoraichthys progastus McClelland and Schizothorax richardsonii Gray (Cyprinidae: Teleostei) from Garhwal Himalaya (India). J. Biosci. Vol. 20:3 385–396 pp. Singh Ν. 1994. Scanning electron microscopic study of the olfactory epithelium of four coldwater hillstream teleosts from Garhwal hills (India). J. Biosci., 19: (1), 91-102. Sorensen PW, Hara TJ, Stacey NE. 1991. Sex pheromones selectively stimulate the medial olfactory tracts of male goldfish. Brain Res, 558: 343–347. Soso AB, Gil Barcellos LJ, Ranzani-Paiva MJ, Kreutz LC, Quevedo RM, Anziliero D, Lim M, Bolognesi da Silva L, Ritter F, Calliari Bedin A, Finco JA. 2007. Chronic exposure to sub-lethal concentration of a glyphosate-based herbicide alters hormone profiles and affects reproduction of female Jundiá (Rhamdia quelen). Environmental Toxicology and Pharmacology, 23: 308–313. Speca DJ, Lin DM, Sorensen PW, Isacoff EY, Ngai J, Dittman AH. 1999.Functional identification of a goldfish odorant receptor, Neuron, 23: 487–498. Stewart WB, Kauer JS, Shepherd GM. 1979. Functional organization of the rat olfactory bulb analyzed by the 2-deoxyglucose method. J Comp Neurol, 185: 7 15-734. Synaptic inhibition in the olfactory bulb accelerates odor discrimination in mice. Neuron 63, 399– 411. Thommesen G. 1978. The spatial distribution of odour induced potentials in the olfactory bulb of char and trout (Salmonidae). Acta Physiol. Scand, 102: 205–217. Thommesen G. 1983. Morphology, distribution, and specificity of olfactory receptor cells in salmonid fishes. Acta Physiolgical, 117: 241–249. Thornhill RA. 1970. Cell division in the olfactory epithelium of lamprey, Lampetra fluviatilis. Zeitschrift für Zellforsch, 109: 147-157. Tierney KB, Singh CR, Ross PS, Kennedy CJ. 2007. Relating olfactory neurotoxicity to altered olfactory-mediated behaviors in rainbow trout exposed to three currently-used pesticides. Aquatic Toxicology 81: 55–64. ® Tsui M, Wang W, Chu L. 2005. Influence of glyohosate and its formulation (Roundup ) on the toxicity and biovailability of metals to Ceriodaphnia dubia. Journal of Environmental Pollution,l 138: 59-68. 74 Tsui TK, Chu LM. 2003. Aquatic toxicity of glyphosate-based formulations: comparison between different organisms and the effects of environmental factors. Chemosphere, 52: 1189–1197. Vallejo AN, Ellis AE. 1989. Ultrastructural study of the response of eosinophil granule cells to Aeromonas salmonicida extracellular products and histamine liberators in rainbow trout Salmo gairdneri Richardson. Developmental and Comparative Immunology 13:133-48. Villanueva R, Byrd-Jacobs CA. 2009. Peripheral sensory deafferentation affects olfactory bulb neurogenesis in zebrafish. Brain Research, 7 (1269): 31–39. Wakamatsu Y, Ishikawa Y, Hori H. 2006 Medaka Histological Atlas. Edited by the Editorial Board of Medaka Histological Atlas of NBRP Medaka. Zeiske E, Theisen B, Gruber SH. 1987. Functional morphology of the olfactory organ of two carcharhinid shark species. Canadian Journal of Zoology, 65 (10): 2406-2412 Zeiske E, Theisen B, Breucker H. 1992. Structure, Development and Evolutionary Aspects of the Peripheral Olfactory System. En: Hara, T. 1992. Fish Chemoreception. Chapman and Hall, London, p: 13-39. Zippel HP, Reschke C, Korff V. 1999. Simultaneous recordings from two physiologically different types of relay neurons, mitral cells and ruffed cells, in the olfactory bulb of goldfish, Cell. Mol. Biol. 3317. 45, 327–337. Páginas de internet (www.wetwebmedia.com) 75