Ud5 Reacciones Químicas
Anuncio

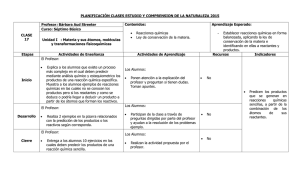
Profesor: Juan Luis Gil Martínez UNIDAD 5: REACCIONES QUÍMICAS 1.- CONCEPTO DE REACCIÓN QUÍMICA Una reacción química es un proceso mediante el cual unas sustancias (reactivos) se transforman en otras (productos de la reacción) por la reorganización de los átomos conformando moléculas nuevas. Para ello es necesario que rompan enlaces en las moléculas originales y se formen enlaces nuevos. Ejemplo: En la reacción: H2 + I2 — 2 HI se rompen 1 enlace H—H y 1 enlace I — I y se forman 2 enlaces H—I. Las ecuaciones químicas son el modo de representar a las reacciones químicas. Por ejemplo el hidrógeno gas (H2) puede reaccionar con oxígeno gas(O2) para dar agua (H20). La ecuación química para esta reacción se escribe: El "+" se lee como "reacciona con" La flecha significa "produce". Las fórmulas químicas a la izquierda de la flecha representan las sustancias de partida denominadas reactivos. A la derecha de la flecha están las formulas químicas de las sustancias producidas denominadas productos. Los números al lado de las formulas son los coeficientes (el coeficiente 1 se omite). Las fórmulas de los reactivos se escriben a la izquierda, y las de los productos a la derecha, separadas ambas por una flecha que indica el sentido de la reacción. El coeficiente de cada reactivo o producto se llama coeficiente estequiométrico. 1 Profesor: Juan Luis Gil Martínez 2.- AJUSTE DE ECUACIONES QUÍMICAS El número de átomos de cada elemento tiene que ser igual en los reactivos y en los productos. Se llama ajuste a la averiguación del número de moles de reactivos y productos (coeficientes estequiométricos). Durante el ajuste se pueden ir cambiando los coeficientes, pero NUNCA pueden cambiarse los subíndices de las fórmulas de reactivos o productos. Métodos de ajuste: o Tanteo (en reacciones sencillas). Consiste en ir probando coeficientes hasta dar con la solución. o Algebraicamente (en reacciones más complejas) resolviendo un sistema de ecuaciones. Pasos a seguir: 1.- Asignamos una letra a cada coeficiente estequiométrico. Conviene asignarlas por orden alfabético de izquierda a derecha. 2.- Cogemos el primer elemento de la izquierda y planteamos la ecuación que representa el balance de átomos de dicho elemento: número de átomos del elemento en la izquierda = número de átomos del elemento en la derecha 3.- Planteamos la ecuación del balance de átomos para el resto de elementos. 4. - Asignamos el valor 1 a la letra (incógnita) que queramos. 5. - Resolvemos el resto de las ecuaciones. 6.- Si en los resultados tenemos fracciones, debemos multiplicar todas las incógnitas por un mismo número de tal forma que desaparezcan las fracciones. Ejemplo: aNa2SO4 + b BaCl2 c NaCl + d BaSO4 Na : 2a = c S:a=d O : 4a = 4d (igual a la anterior) Ba: b = d Cl: 2b = c Por tanto , las ecuaciones son: 2a = c ; a = d ; b = d ; 2b = c Si asignamos a ‘d’ el valor 1: d=1, quedará: a = d a =1 b = d b= 1 2·b=c 2·1=cc=2 La ecuación ajustada es la siguiente: Na2SO4 + BaCl2 2NaCl + BaSO4 2 Profesor: Juan Luis Gil Martínez 3.- ESTEQUIOMETRÍA DE LAS REACCIONES QUÍMICAS La estequiometria es la proporción en moles en la que se combinan los distintos reactivos y en la que se forman los distintos productos de la reacción. Una vez determinado el número de moles de reactivos y productos (ajuste de la reacción) se puede hacer el cálculo en masa (gramos) o en volumen (litros) en el caso de gases o disoluciones. CÁLCULO CON MASAS Realizaremos este tipo de cálculos si en un problema de reacciones químicas nos dan el dato de la masa de un reactivo o producto y nos piden averiguar la masa de cualquier otra sustancia que intervenga en la reacción. Los pasos que seguiremos son los siguientes: 1. Escribir la reacción y ajustarla. 2. Calcular las masas moleculares de todos los compuestos que entran en juego. (Con las masas atómicas de los distintos elementos) 3. Calcular los moles de lo que me dan. 4. Calcular los moles de lo que me piden (aquí utilizamos los coeficientes estequiométricos). 5. Calculamos la masa de los que me piden: Ejemplo: El zinc reacciona con el ácido clorhídrico formando cloruro de zinc e hidrógeno gas. Si hacemos reaccionar 6,0 g de ácido. ¿Cuántos gramos de zinc reaccionan? 1. Identifica reactivos y productos. Plantea la ecuación y a continuación formula las sustancias que intervienen: Ácido clorhídrico + Zinc Cloruro de zinc + Hidrógeno HCl + Zn Zn Cl2 + H2 2. Ajusta la ecuación: 2 HCl + Zn Zn Cl2 + H2 3. Pasa el dato que te dan a moles: 3 Profesor: Juan Luis Gil Martínez 4. Transforma ahora los moles del dato en moles de la incógnita leyendo el correspondiente factor de conversión en la ecuación ajustada: 5. Transforma moles en gramos usando la masa atómica o molecular: CÁLCULO CON GASES Si alguna de las sustancias es un gas, además de calcular los moles y la masa como se ha descrito anteriormente, también se puede calcular su volumen, sabiendo que en condiciones normales (C.N.) de presión y temperatura (P = 1 atm, T = 0 ºC ó 273 K): 1 mol = 22,4 litros 4.- ENERGÍA DE LAS REACCIONES QUÍMICAS La humanidad ha utilizado las reacciones químicas para producir energía: combustión de madera o de carbón, motores de explosión de los coches y motores de propulsión de las naves espaciales. La energía desprendida o absorbida puede ser en forma de energía luminosa como la eléctrica, pero también, en forma de calor que se llama calor de reacción y tiene un valor característico para cada reacción, en unas determinadas condiciones da presión y temperatura. Las reacciones químicas pueden entonces clasificarse en: exotérmicas o endotérmicas, según se produzca desprendimiento o absorción de calor respectivamente. Si la reacción es exotérmica la energía o entalpía de la reacción (H) se considera negativa. Si es endotérmica se considera positiva. Las reacciones exotérmicas desprenden calor. La oxidación y la combustión son ejemplos de reacciones exotérmicas. La energía interna de los reactivos es mayor que la de los productos. Ejemplo: C (s) + O2 (g) CO2 (g) H = - 393,5 kJ El proceso de síntesis de amoniaco (Haber-Bosch) también: 2N2(g) + 3H2(g) 2NH3(g) ΔH= -92.2 KJ Las reacciones endotérmicas absorben calor, como por ejemplo la descomposición del carbonato de calcio. En este caso la energía de los reactivos es menor que la de los productos, por lo tanto se necesita calor para que se produzca la reacción. CaCO3 (s) CaO (s) + CO2 (g) ΔH= 178 KJ 4 Profesor: Juan Luis Gil Martínez 5.- VELOCIDAD DE LAS REACCIONES QUÍMICAS No todas las reacciones químicas ocurren a igual velocidad. En una reacción química, cuanto más fuertes sean los enlaces de los reactivos que deben romperse, más tiempo tardará la reacción en transcurrir. Los factores que influyen en la velocidad son: a) Concentración de reactivos: Al aumentar la concentración de los reactivos, aumenta la velocidad por que crece la probabilidad de choque entre partículas. b) Fragmentación de reactivos: cuanto mayor sea, más velocidad de reacción. c) Temperatura: al aumentar la temperatura, aumenta la velocidad de reacción. d) Catalizadores: sustancias que se aplican para modificar la velocidad y que al final, quedan inalteradas. Los catalizadores que aumentan la velocidad de una reacción se denominan catalizadores positivos, y los que la frenan, catalizadores negativos o inhibidores. 6.- TIPOS DE REACCIONES QUÍMICAS a) Síntesis: proceso de obtener compuestos químicos a partir de sustancias más simples. Ejemplos: Cl2 + H2(g) → 2HCl 4Na + O2 → 2Na2O Na2O + H2O → 2Na(OH) b) Descomposición: ruptura de moléculas largas formando así moléculas más pequeñas o átomos. 2 H2O → 2 H2 + O2 H2CO3 → H2O + CO2 2 KClO3 → 2 KCl + 3 O2 c) Sustitución o desplazamiento: aquella donde un átomo o grupo en un compuesto químico es sustituido por otro átomo o grupo. CH4 + Cl2 → CH3Cl + HCl CuSO4 + Fe FeSO4 + Cu d) Redox: Se denomina reacción simplemente, reacción redox, a de reducción-oxidación, toda reacción química en de óxido-reducción o, la que uno o más electrones se transfieren entre los reactivos, provocando un cambio en sus estados de oxidación. Para que exista una reacción de reducción-oxidación, en el sistema debe haber un elemento que ceda electrones, y otro que los acepte: 5 Profesor: Juan Luis Gil Martínez El agente reductor es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir, siendo oxidado. El agente oxidante es el elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir, siendo reducido. Ejemplos: 2 Fe + O2 2 FeO El Fe es el agente reductor: se oxida, pasa de tener e.o.= 0 a tener e.o. = +2 El O es el agente oxidante: se reduce, pasa de tener e.o. = 0 a tener e.o. = -2 Otro ejemplo típico son las reacciones de combustión: e) Combustión: reacción química en la que un elemento combustible se combina con otro comburente (generalmente oxígeno en forma de O2 gaseoso), desprendiendo calor (y normalmente luz) y produciendo un óxido. Combustible + O2 → H2O + CO2 + energía f) Ácido – Base: Una reacción ácido-base o reacción de neutralización es una reacción química que ocurre entre un ácido y una base produciendo una sal y agua. Normalmente son exotérmicas. ácido + base sal + agua Ejemplo: HCl + NaOH → H2O + NaCl + Una sustancia ácida es aquella que puede donar H , y una base es una sustancia que + puede aceptar H . Los ácidos y las bases se caracterizan por: Ácidos Bases Tienen sabor agrio (limón, vinagre, etc). Tiene sabor cáustico o amargo (a lejía) En disolución acuosa enrojecen la tintura o papel de tornasol En disolución acuosa azulean el papel o tintura de tornasol Producen efervescencia con el carbonato de calcio (mármol) Producen una sensación untuosa al tacto Reaccionan con algunos metales (como el cinc, hierro,…), desprendiendo hidrógeno Precipitan sustancias disueltas por ácidos Neutralizan la acción de las bases Neutralizan la acción de los ácidos Concentrados destruyen los tejidos biológicos vivos (son corrosivos para la piel) Suaves al tacto pero corrosivos con la piel (destruyen los tejidos vivos) Pierden sus propiedades al reaccionar con bases Pierden sus propiedades al reaccionar con ácidos Se usan en la fabricación de jabones a partir de grasas y aceites 6 Profesor: Juan Luis Gil Martínez 7.- LA DESTRUCCIÓN DE LA CAPA DE OZONO La capa de ozono en la estratosfera juega un importante papel para la vida, ya que ejerce una función de "pantalla natural" filtrando gran parte de las radiaciones ultravioleta que llegan del sol. Los CFC o ClFC son una familia de gases que se emplean en múltiples aplicaciones, principalmente en la industria de la refrigeración y de propelentes de aerosoles. Están también presentes en aislantes térmicos. Los CFC tienen una gran persistencia en la atmósfera, de 50 a 100 años. Con el paso del tiempo alcanzan la estratosfera, donde se disocian por acción de la radiación ultravioleta, liberando el cloro y dando comienzo al proceso de destrucción del ozono. Existe una gran cantidad de reacciones envueltas en los procesos de destrucción del ozono, pero podemos simplificar este proceso en: Cl + O3 -----> ClO + O2 ClO + O -----> Cl + O2 Reacción neta: O3 + O -----> 2 O2 El átomo de cloro actúa como catalizador, es decir, no es consumido en la reacción, por lo que destruye miles de moléculas de ozono antes de desaparecer. Por este motivo, es importante que la emisión de moléculas a la atmósfera con este tipo de átomos que actúan como catalizadores sea mínima. Efectos de la destrucción de la capa de ozono Las radiaciones ultravioleta llevan mucha energía e interfieren con los enlaces moleculares provocando cambios de las moléculas. Pueden alterar moléculas muy importantes para la vida como el ADN y provocarían daños irreparables si no fuera porque son absorbidas por la parte alta de la atmósfera, especialmente por la capa de ozono. El ozono, O3, absorbe con gran eficacia estas radiaciones, y por tanto, una disminución en la capa de ozono tiene efectos muy perjudiciales sobre los seres humanos y los ecosistemas en general. En los seres humanos, la sobre-exposición a estas radiaciones produce efectos perjudiciales en la salud. En cuanto a la vegetación, estas radiaciones disminuyen la eficiencia de la fotosíntesis en plantas, lo que afecta a su crecimiento y al número de hojas, semillas y frutos que producen. 7 Profesor: Juan Luis Gil Martínez 8.- LA LLUVIA ÁCIDA La lluvia normalmente presenta un pH de aproximadamente 5.65 (ligeramente ácido). Se considera lluvia ácida si presenta un pH menor que 5 y puede alcanzar el pH del vinagre (pH 3). Se forma cuando la humedad en el aire se combina con los óxidos de nitrógeno, el dióxido de azufre y el trióxido de azufre emitidos por fábricas, centrales eléctricas, calderas de calefacción y vehículos que queman carbón o productos derivados del petróleo que contengan azufre. En interacción con el agua de la lluvia, estos gases forman ácidos nítricos, ácido sulfuroso y ácido sulfúrico. Finalmente, estas sustancias químicas caen a la tierra acompañando a las precipitaciones, constituyendo la lluvia ácida. Las reacciones que tienen lugar son: SO2 + H2O H2SO3 SO3 + H2O H2SO4 N2O5 + H2O 2 HNO3 Los efectos de la lluvia ácida tienen especial importancia sobre los ecosistemas y la salud, entre otros aspectos. • En los ecosistemas acuáticos El aumento de la acidez de los lagos y los ríos afecta a la supervivencia de aquellos organismos que no toleran un medio ácido. También se ha observado un aumento de la concentración de ciertos metales, liberados de los sedimentos por la acción de los ácidos. • En los ecosistemas terrestres El efecto principal es la contaminación directa, que afecta sobre todo a los vegetales, limitando la producción forestal y favoreciendo la degradación de los bosques. • Edificios y monumentos Se produce un efecto corrosivo sobre los materiales de construcción y los metales, así como sobre las rocas calcáreas y los mármoles expuestos al aire libre, conocido como «mal de piedra». • La salud de las personas Los efectos en la salud se manifiestan con un aumento de las enfermedades cardiovasculares y de las vías respiratorias, así como por la aparición de ciertas alergias. Según sugieren recientes estudios, la lluvia ácida es un fenómeno más complejo de lo esperado, en el que son muy importantes las sustancias básicas en suspensión en la atmósfera y que neutralizan a los ácidos. Los niveles de sustancias ácidas en la atmósfera disminuyeron de forma radical en las décadas de 1980 y 1990, gracias a las medidas tomadas por los gobiernos de algunos países industrializados. 8