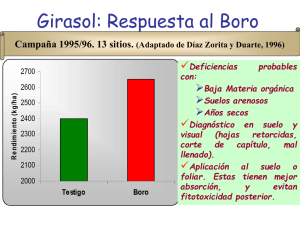
priliminares corregidos
Anuncio

PONTIFICIA UNIVERSIDAD CATÓLICA DEL ECUADOR Sede - Ibarra Escuela de Ciencias Agrícolas y Ambientales E.C.A.A. INFORME FINAL DE TESIS “Aplicación de cuatro soluciones estimulantes del crecimiento radicular en tres variedades de lechuga (Lactuca sativa) previo al transplante en un cultivo bajo sistema hidropónico” Previa a la Obtención del Título de Ingeniero Agropecuario Autor: Diego Rafael Navas Albán Asesor: Ing. Paola Sosa IBARRA – ECUADOR 2007 PRESENTACION Esta tesis de grado tiene la finalidad de investigar la influencia de los bioestimulantes como inductores de raíz en el cultivo de lechuga, en diferentes variedades. La experiencia de los agricultores dedicados a este cultivo enfatiza la importancia de una adecuada nutrición, especialmente de la raíz de la planta, para lograr una cosecha más rentable y de mayor aceptación en los mercados. El estudio ha sido llevado a cabo en los cultivos hidropónicos de la finca Greenlab, ubicada en Píntag, en la provincia de Pichincha. El estudio está dividido en tres capítulos, brevemente descritos a continuación. El primer capítulo consiste en una necesaria introducción a la temática, en la que se describen la motivación de este trabajo, que es la de lograr, como ya se mencionó, una mejora en la calidad de la cosecha; se plantea, entonces, la manera en que se aborda el tema y los objetivos que se desprenden de éste. A partir de estos puntos, a su vez, se realiza el planteamiento de la hipótesis que se busca evaluar con este estudio, a saber, si la utilización de sustancias bioestimulantes de distintas composiciones tiene una influencia en el desarrollo de las radicular y foliar de las plantas de lechuga, de tres variedades diferentes. El segundo capítulo presenta el sustento teórico de esta investigación. En éste se describen las principales características del cultivo de la lechuga, especialmente de la descripción botánica, de las etapas de desarrollo y de las enfermedades que pueden afectar al cultivo. A continuación se realiza una explicación de las tres variedades de lechugas que se utilizarán específicamente para este estudio y asimismo de los fertilizantes con que se tratará a los cultivos para determinar la influencia de los mismos en el desarrollo de los anteriores. El tercer capítulo hace referencia a la parte metodológica y logística del trabajo. En esta se describen los materiales utilizados y la manera en que ha sido diseñado y se ha llevado cabo el experimento, así como una descripción del tipo de análisis al que han de ser sometidos los datos obtenidos, las principales variables e indicadores y la manera de interpretar los resultados a obtenerse. El cuarto y último capítulo hace precisamente referencia a los resultados obtenidos al emplear los métodos referidos en el capítulo previo, una vez que se ha llevado a cabo el experimento y análisis referidos. Se presentan las conclusiones y la respuesta a la hipótesis planteada que se pueden extraer de estos resultados, así como las observaciones adicionales del trabajo realizado. iii DEDICATORIA A mi Madre Dolorosa. A mis amados padres Marcelo y Marianita. A mis hermanos, Marcelo y Paúl. A mi sobrino Rafael y a mis sobrinas Maria Beatriz, Florencia y Manuela. A mis queridos abuelitos Papi Luchi,(+) Mami Pepi,(+) Papi Manuel (+) y Mami Bachi Especialmente para Mami Bachi por su guía, amor y ejemplo, además de su apoyo incondicional para ayudarme a culminar con esta meta en mi vida. A mis buenos amigos de la ECAA. iv AGRADECIMIENTO A los docentes de la Escuela de Ciencias Agropecuarias y Ambientales de la Pontificia Universidad Católica del Ecuador Sede Ibarra (PUCE-SI), por sus conocimientos y experiencias brindadas. Para el Señor Ingeniero Roberto Serrano y familia, mi más eterno agradecimiento por sus consejos y el apoyo incondicional brindado para el desarrollo de este trabajo. Al Ingeniero Marcelo Fiallos por su colaboración, y al personal de la granja Greenlab. Al ing. Valdemar Andrade por sus innumerables demostraciones de aprecio y confianza a los largo de estos años y por su ayuda en la realización de este trabajo. Y a todas las personas que de una u otra forma fueron un apoyo para la culminación de este trabajo v RESUMEN Esta investigación se basa en la influencia de los reguladores de crecimiento, ácidos húmicos y nutrientes minerales, para incrementar el desarrollo de masa radicular en plántulas de tres variedades de lechuga. Este trabajo se lo realizó en la finca Greenlab, provincia de Pichincha, cantón Píntag, donde se evaluaron las variedades Rosa Verde, Romana y Crispada, cuatro soluciones estimulantes, para lo cual se utilizó un Diseño de bloques completamente al azar con arreglo factorial A x B con tres repeticiones. Las variables en estudio fueron: masa radicular, masa foliar y el análisis económico respectivamente. Los mejores resultados en cuanto a masa radicular durante la fase de enraizamiento recayeron en la variedad Romana cuando se utilizó como bioestimulante a Evergreen, y el mejor desarrollo de la masa foliar se consiguieron con la variedad Rosa Verde y el bioestimulante Amino Starter. En la fase de cultivo el mejor rendimiento de masa foliar se alcanzó con la variedad Rosa Verde y el bioestimulante Evergreen. Palabras Claves: Bioestimulantes, hidroponía, lechuga. vi SUMARY The following research project has the object to investigate the influence that the growth regulators, humic acids and mineral nutrients have in order to induce the development of the root mass in lettuce plants from three different sorts. The investigation was undertaken at the Greenlab farm, which is located in Píntag, a subdistrict of the province of Pichincha, in the northern part of Ecuador. The plant sort that were evaluated were “Rosa Verde” (Green Rose), “Romana” (Roman), and “Crispada” (Curled), together with four different sorts of growth stimulating solutions, under a random design of blocks with a factorial arrangement A x B, with three trials. The variables under study were: root mass, leave mass and economical analysis. The best results, respect to root mass and total weight, were obtained through the harvest of “Rosa Verde”, treated with the “Evergreen” stimulating solution. Key words: growth regulators , hydroponic, lettuce. vii viii ÍNDICE PORTADA I PRESENTACIÓN Ii DEDICATORIA Iii AGRADECIMIENTO Iv RESUMEN V SUMARY Vi ÍNDICE 8 CAPITULO I. INTRODUCCIÓN 1.1 Planteamiento del problema 16 1.2 Justificación 18 1.3 Objetivos 20 1.3.1 Objetivo general 20 1.3.2 Objetivo específico 20 1.4 Hipótesis 20 CAPITULO II. MARCO TEÓRICO 2 La lechuga 21 2.1 Generalidades 21 2.2 Clasificación Botánica 22 2.3 Etapas Fenológicas 22 2.4 Importancia de la raíz en un sistema de cultivo hidropónico 25 2.5 Nutrición 26 2.6 Reguladores de crecimiento en el desarrollo radicular y foliar 28 2.6.1 Generalidades 28 2.6.1.1 Auxinas 29 2.6.1.2 Giberelinas 31 2.6.1.3 Citocininas 33 2.6.1.4 Etileno 35 2.7 Bioestimulantes Radiculares 36 2.7.1 Kelpak 36 2.4.1.1 Composición 36 2.7.1.2 Características 36 2.7.1.3 Beneficios 36 2.7.1.4 Modo de Acción 37 2.7.1.5 Compatibilidad 37 2.7.1.6 Dósis 37 2.7.2 Amino Starter SC 38 2.7.2.1 Composición 38 2.7.2.2 Características 38 2.7.2.3 Recomendaciones 38 2.7.2.4 Compatibilidad 39 2.7.2.5 Dósis 39 2.7.3 Evergreen 40 2.7.3.1 Composición 40 2.7.3.2 Características 40 2.7.3.3 Compatibilidad 41 2.7.3.4 Dósis 41 CAPITULO III. MATERIALES Y MÉTODOS 3.1 Ubicación del experimento, materiales, equipos, materia 42 prima e insumos 3.1.1 Ubicación del experimento 42 3.1.2 Materiales 42 3.1.3 Equipos 43 3.1.4 Insumos 43 3.2 Métodos 44 3.2.1 Diseño experimental (FASE I) 44 3.2.2 Factores en estudio 44 9 3.2.2.1 Factor A (Variedades) 44 3.2.2.2 Factor B (Bioestimulantes) 44 3.2.3 Tratamientos 45 3.2.4 Repeticiones 45 3.2.5 Unidades experimentales 45 3.2.6 Esquema de ADEVA 46 3.2.7 Prueba de significancia 46 3.2.8 Variables e indicadores 46 3.2.9 Diseño experimental (FASE II) 46 3.2.9.10 Factores en estudio 46 3.2.9.10.1 Factor A (variedades) 46 3.2.9.10.2 Factor B (Bioestimulantes) 47 3.2.11 Tratamientos 47 3.2.12 Repeticiones 48 3.2.13 Unidades Experimentales 48 3.2.14 Esquema de ADEVA 48 3.2.15 Pruebas de Significancia 48 3.2.16 Variables e Indicadores 48 3.3 Métodos de evaluación (FASE I) 49 3.3.1 Masa Foliar 49 3.4 Métodos de evaluación (FASE II) 49 3.4.1 Masa Foliar 49 3.4.2 Análisis Financiero 49 3.5 Manejo específico del experimento (FASE II) 50 3.5.1 Limpieza y desinfección de piscinas de enraizamiento 50 3.5.2 Riego 50 3.5.3 Aplicación de las soluciones enraizantes 50 3.6 Manejo específico del experimento (FASE II) 50 3.6.1 Limpieza y desinfección de tuberías de cultivo 50 3.6.2 Transplante 51 3.6.3 Fertirrigación 51 3.6.4 Controles fitosanitarios 51 3.6.5 Cosecha 51 10 CAPITULO IV. RESULTADOS Y DISCUSIONES 4.1 Masa radicular FASE I (Vivero) 52 4.2 Masa foliar FASE I (Vivero) 57 4.3 Peso unitario FASE II (Cultivo) 61 4.4 Análisis Financiero 65 CAPITULO V. CONCLUSIONES Y RECOMENDACIONES 5.1 Conclusiones 70 5.2 Recomendaciones 72 BIBLIOGRAFÍA CONSULTADA 74 ANEXOS Anexo 5 Datos de campo del experimento peso de masa radicular FASE I Datos de campo del experimento peso de masa foliar FASE I Datos de campo del experimento peso de masa foliar FASE II Distribución de los bloques y unidades experimentales FASE I Cronograma de actividades Anexo 6 Presupuesto Anexo 1 Anexo 2 Anexo 3 Anexo 4 76 76 77 78 79 80 ÍNDICE DE FOTOGRAFÍAS Fotografía 1 Arribo de plántulas 81 Fotografía 2 Piscinas para el ensayo 81 Fotografía 3 Adecuación del sistema de riego 82 Fotografía 4 Colocación del timer 82 Fotografía 5 Comparación de raíces 83 11 Fotografía 6 Distribución del ensayo FASE I 83 Fotografía 7 Bioestimulante Kelpak 84 Fotografía 8 Bioestimulante Amino Starter SC 84 Fotografía 9 Bioestimulante Evergreen 85 Fotografía 10 Distribución general del ensayo FASE I 85 Fotografía 11 Bandejas para la colocación de las plántulas FASE I 86 Fotografía 12 Colocación de plántulas FASE I 86 Fotografía 13 Adición de bioestimulantes 87 Fotografía 14 Rotulación del ensayo FASE I 87 Fotografía 15 Recolección de plántulas FASE I 88 Fotografía 16 Recolección de plántulas FASE I 88 Fotografía 17 Asesor alemán en riego 89 Fotografía 18 Limpieza de plántulas FASE I 89 Fotografía 19 Limpieza de plántulas FASE I 90 Fotografía 20 Plántulas listas para pesaje Fase I 90 Fotografía 21 Limpieza de tuberías Fase II 91 Fotografía 22 Colocación de plántulas Fase II 91 Fotografía 23 Plantas de lechuga Fase II 92 Fotografía 24 Plantas de lechuga Fase II 92 Fotografía 25 Plantas de lechuga Fase II 93 Fotografía 26 Vista del ensayo Fase II 93 Fotografía 27 Vista del ensayo Fase II 94 Fotografía 28 Cosecha de lechugas Fase II 94 Fotografía 29 Cosecha de lechugas Fase II 95 Fotografía 30 Día de campo 95 Fotografía 31 Día de campo 96 Fotografía 32 Día de campo 96 12 ÍNDICE DE GRÁFICOS Gráfico 1 Representación gráfica del factor variedades de la variable 54 masa radicular FASE I (Vivero) Gráfico 2 Representación gráfica del factor bioestimulantes de la 55 variable masa radicular FASE I (Vivero) Gráfico 3 Representación gráfica de los tratamientos de la variable 56 masa radicular FASE I (Vivero) Gráfico 4 Representación gráfica del factor variedades de la variable 58 masa foliar FASE I (Vivero) Gráfico 5 Representación gráfica del factor bioestimulantes de la 59 variable masa foliar FASE I (Vivero) Gráfico 6 Representación gráfica de los tratamientos de la variable 60 masa foliar FASE I (Vivero) Gráfico 7 Representación gráfica del factor variedades de la variable 62 peso unitario en gramos FASE II (Cultivo) Gráfico 8 Representación gráfica del factor bioestimulantes de la 63 variable peso unitario en gramos FASE II (Cultivo) Gráfico 9 Representación gráfica de los tratamientos de la variable 64 peso unitario en gramos FASE II (Cultivo) Gráfico 10 Representación gráfica de los tratamientos de la variable 66 análisis financiero (%) en la FASE II (Cultivo) Gráfico 11 Representación gráfica de variedad Crispada comparada 67 con los bioestimulantes de la variable análisis financiero (%) en la FASE II (Cultivo). Gráfico 12 Representación gráfica de variedad Rosa Verde 68 comparada con los bioestimulantes de la variable análisis financiero en la FASE II (Cultivo). Gráfico 13 Representación gráfica de variedad Romana comparada 69 con los bioestimulantes de la variable análisis financiero (%) en la FASE II (Cultivo). 13 ÍNDICE DE TABLAS Tabla 1 Análisis de varianza de la variable masa radicular FASE I 52 (Vivero) Tabla 2 Prueba de Tukey al 5 % para el factor variedades de la 53 variable masa radicular FASE I (Vivero) Tabla 3 Prueba de Tukey al 5 % para el factor bioestimulantes de 54 la variable masa radicular FASE I (Vivero) Tabla 4 Prueba de Tukey al 5 % para los tratamientos de la 56 variable masa radicular FASE I (Vivero) Tabla 5 Análisis de varianza de la variable masa foliar FASE I 57 (Vivero) Tabla 6 Prueba de Tukey al 5 % para el factor variedades de la 58 variable masa foliar FASE I (Vivero) Tabla 7 Prueba de Tukey al 5 % para el factor bioestimulantes de 59 la variable masa foliar FASE I (Vivero) Tabla 8 Prueba de Tukey al 5 % para los tratamientos de la 60 variable masa foliar FASE I (Vivero) Tabla 9 Análisis de Varianza de la Variable Peso Unitario en 61 gramos Fase II (Cultivo) Tabla 10 Prueba de Tukey al 5 % para el factor variedades de la 62 variable peso unitario en gramos FASE II (Cultivo) Tabla 11 Prueba de Tukey al 5 % para el factor bioestimulantes de 63 la variable peso unitario en gramos FASE II (Cultivo) Tabla 12 Prueba de Tukey al 5 % para los tratamientos del peso 64 unitario en gramos FASE II (Cultivo) Tabla 13 Análisis financiero para los tratamientos del peso unitario 65 en gramos FASE II (Cultivo) 14 CAPÍTULO I INTRODUCCIÓN 1.1 PLANTEAMIENTO DEL PROBLEMA En una explotación bajo sistema de hidroponía, obtener plántulas en condiciones ideales, es fundamental para el desarrollo óptimo de la actividad. En general, una vez obtenida la planta de 3 a 4 semanas en empresas especializadas en la germinación y crecimiento inicial, se desarrolla un proceso de adaptación previo al transplante durante 15 a 21 días (dependiendo de: variedad, condiciones ambientales y tamaño de la planta) en invernaderos para el acondicionamiento previo al transplante. El propósito de este paso es la reducción de días a la cosecha después del trasplante, bajo un concepto de optimizar el espacio destinado para plantación hidropónica que por unidad de área es más costoso que un sistema tradicional. Al presentarse un desarrollo deficiente en el sistema radicular el crecimiento posterior de la planta será defectuoso y por debajo del potencial genético; se incurre en costos de producción más elevados y lógicamente pérdidas importantes por mala calidad. La escasez de raíz provoca la nutrición inadecuada con lo que se produce una evidente pérdida económica, de tal manera que las soluciones nutritivas no están siendo aprovechadas correctamente por las plantas, la incidencia de plagas y enfermedades es mayor, con un consiguiente incremento del uso de plaguicidas y lo mas grave, la muerte de las plantas. Además la fragilidad que presentan los plugs con el sustrato, que ocasiona la presencia de importantes volúmenes de sedimento en los tanques cisterna y pone en riesgo los equipos de bombeo por la presencia excesiva de material sólido. Tratándose de un sistema hidropónico con agua recirculante, es importante minimizar la contaminación de la solución nutritiva e incrementar la vida útil de los equipos lo cual se lograría desarrollando un sistema radicular abundante que le dé firmeza al pilón. Una vez iniciada la producción a mayor escala, las plantas presentan un comportamiento diferente al normal en cuanto a la producción de raíz, y viene a ser una de las principales dificultades a la que el área productiva de Greenlab ha enfrentado los últimos años. Con este estudio que consiste en la utilización de tres productos compuestos fundamentalmente por, Auxinas (11 ppm)+ Citocinas (0.03 ppm), (Kelpak) Auxinas (1ppm)+ Citocinas (0.6 ppm), (Speedfol Amino Starter SC), y Auxinas (40 ppm)+ Citocinas (90 ppm), (Evergreen). Se busca incrementar la masa radicular y foliar de las plántulas de lechuga, de igual manera se tomará en cuenta como factor de estudio el potencial de altura de las plantas, con lo que se busca solucionar el problema anteriormente descrito. De acuerdo a la planificación, este estudio tiene previsto un tiempo de duración aproximado de 6 meses, para el cual se necesita un área experimental de 36 m2. 17 1.2. JUSTIFICACIÓN Para aprovechar el potencial genético de las variedades, un adecuado desarrollo de la masa radicular es de vital importancia en un sistema de cultivo hidropónico ya que ello asegurar el más alto rendimiento. La reducción en el tiempo de cosecha mejora las proyecciones de la empresa para satisfacer de una mejor manera las demandas del mercado. De igual manera la disminución en el costo de mantenimiento del sistema de bombeo contribuirá a destinar esos recursos en la implementación de mejoras para la plantación. La calidad del producto final es otro factor muy importante, dado que al tener una disminución progresiva del pilón, la planta tiende a sufrir una pérdida de altura, la misma que compromete al correcto desarrollo de la planta. También podemos acotar que al existir un mejor desarrollo de las plantas previo al transplante contribuye a la disminución del uso de plaguicidas, dado que se obtienen plantas más vigorosas, por ende se está logrando obtener producciones más limpias que sean amigables con el medio ambiente. Las empresas productoras de lechuga en sistema hidropónico son muy susceptibles a las variaciones del mercado, ya se ha constatado que muchos casos por pequeños errores en el manejo han provocado el cierre de las mismas, por lo que es de suma importancia optimizar los procesos de producción y minimizarlos al máximo. En la búsqueda de mejorar el sistema radicular de plántulas mediante el uso de fitohormonas toma en cuenta como la opción principal para la corrección de esta deficiencia, ésta propuesta de investigación busca mejorar la solución nutritiva aplicando tres productos comerciales de similar composición química, que preveen un incremento en la masa radicular. Cada día nos enfrentamos a nuevos retos comerciales, que conducen a mejores sistemas de producción, no solamente en la cantidad de productos que 18 se pueden ofertar al mercado sino el buscar alimentos de mejor calidad en el menor tiempo posible, es por esto que una vez más, la alternativa que busca contribuir a la solución del problema descrito oportunamente y en el sistema hidropónico de producción hortícola, mismo que se encuentra en ejecución en la empresa Greenlab, contribuirá al mejor desarrollo de la misma así como para quienes estén interesados en esta modalidad agrícola. 19 1.3. Objetivos 1.3.1 Objetivo General Aplicar cuatro soluciones estimulantes del crecimiento radicular en tres variedades de lechuga (Lactuca sativa) previo al transplante en un cultivo bajo sistema hidropónico 1.3.2 Objetivos Específicos: Comprobar el incremento de la masa radicular y masa foliar de las plantas de lechuga al ser expuestas a diferentes soluciones nutritivas y estimulantes Realizar una comparación costo/beneficio de los tratamientos Desarrollar un día de campo para la difusión entre los interesados en este tema de los resultados preliminares 1.4. Hipótesis Las soluciones enraizantes (auxinas, citoquininas, macro y micro elementos, aminoácidos y carbohidratos) suministrados en la solución nutritiva previa al transplante tienen un efecto significativo en el incremento de masa radicular de las tres variedades de lechuga 20 21 CAPITULO II MARCO TEÓRICO 2. LA LECHUGA 2.1 Generalidades: De acuerdo con Valadez, A. (1994), “La lechuga es una planta herbácea anual, que cuando joven contiene en sus tejidos un jugo lechoso llamado látex cuya cantidad disminuye con la edad de la planta”. Domínguez, A. (1997), manifiesta que: “La lechuga pertenece a la especie Lactuca sativa, de la que se han desarrollado muchas variedades para cuya mejora se siguen como criterios básicos la calidad del cogollo, la precocidad o rapidez del desarrollo vegetativo, la adaptación climatológica y la resistencia a las enfermedades”. “La lechuga es una planta anual que forma una roseta de hojas en la base y subsecuentemente un alto tallo floral 0.30 a 1 metro de alto, algunos cultivares forman una cabeza definida mientras que otros producen una roseta suelta, formada de hojas”. (Gordon, H. 1984). Por su parte Resh, H. (2001), indica que “las lechugas crecen muy bien en cultivos hidropónicos. Hay cuatro tipos básicos de lechugas: Lechuga europea, lechuga sin acogollar, lechuga acogollada redonda o iceberg y lechuga romana”. “Dada la gran cantidad de variedades, existe una amplia gama de adaptación a lo diferentes climas y épocas del año. No obstante, la temperatura óptima de desarrollo varía entre 15 y 20 °C, influye tanto en la formación del cogollo como en la subida a flor que puede producirse con temperaturas elevadas”. (Domínguez, A. 1997). 2 .2 Clasificación Botánica Reino Plantae Subdivisión Magnoliophyta Clase Magnoliopsida Familia Compositae Género Lactuca Especie sativa Variedad botánica Capitata: cabeza Longifolia Romana o Cos Crespa Hoja Asparagina Tallo Fuente: Valadez, A. (1994). 2.3 Etapas Fenológicas Verduras que no forman cabeza Codificación BBCH de los estadios fenológicos del desarrollo de las verduras que no forman cabeza (Lechuga de campo = Valerianella locusta L., Espinaca = Spinacia oleracea L., Col enana = Brassica oleracea L. var. sabellica L.) Código Descripción Estadio principal 0. 00 01 03 05 07 09 Germinación Semilla seca Comienza la imbibición de la semilla Imbibición completa La radícula emerge de la semilla El hipocotilo con los cotiledones atraviesan el tegumento seminal Emergencia: Los cotiledones salen a la superficie del suelo 22 _______________________________________________________________ Estadio principal 1. 10 11 12 13 1. 19 Cotiledones completamente desplegados; el punto de crecimiento o el inicio de la hoja verdadera, visible Primera hoja verdadera desplegada Segunda hoja verdadera desplegada Tercera hoja verdadera desplegada Los estadios continúan hasta 9 o más hojas verdaderas desplegadas Estadio principal 3. 33 35 37 39 Desarrollo de las hojas (tallo principal) Elongación del tallo o crecimiento de la roseta. La roseta foliar alcanza el 30 % del diámetro típico esperado de cada variedad. 1) El tallo principal ha alcanzado el 30 % de la altura típica esperada de la variedad. 2) La roseta foliar alcanza el 50 % del diámetro típico esperado de cada variedad. 1) El tallo principal ha alcanzado el 50 % de la altura típica esperada de la variedad. 2) La roseta foliar alcanza el 70 % del diámetro típico esperado de cada variedad. 1) El tallo principal ha alcanzado el 70 % de la altura típica esperada de la variedad. 2) La roseta completamente desarrollada. 1) El tallo principal alcanza la altura típica para la variedad. 2) Estadio principal 4. Desarrollo de las partes vegetativas cosechables 41 el 10 % de la masa foliar esperada típica de cada 42 43 44 45 46 Se alcanza variedad. Se alcanza variedad. Se alcanza variedad. Se alcanza variedad. Se alcanza variedad. Se alcanza variedad. el 20 % de la masa foliar esperada típica de cada el 30 % de la masa foliar esperada típica de cada el 40 % de la masa foliar esperada típica de cada el 50 % de la masa foliar esperada típica de cada el 60 % de la masa foliar esperada típica de cada 23 47 48 49 Se alcanza el 70 % de la masa foliar esperada típica de cada variedad. Se alcanza el 80 % de la masa foliar esperada típica de cada variedad. Se alcanza la altura típica. Estadio principal 5. 51 53 55 59 El tallo principal empieza a brotar. 1) Inflorescencia principal visible entre las hojas más altas. 2) El tallo principal ha alcanzado el 30 % de la altura típica esperada para la variedad Primeras flores individuales de la inflorescencia principal, visibles (cerradas todavía). Primeros pétalos florales, visibles; flores cerradas todavía Estadio principal 6. 60 61 62 63 64 65 67 69 Aparición del órgano floral Floración Primeras flores abiertas (esporádicamente) Comienzo de la floración: 10 % de las flores abiertas 20 % de las flores abiertas 30 % de las flores abiertas 40 % de las flores abiertas Plena floración: 50 % de las flores abiertas Floración se está terminando: la mayoría de los pétalos caídos o secos Fin de la floración Estadio principal 7. Formación del fruto 71 Primeros frutos formados 72 20 % de los frutos alcanzan el tamaño típico 73 30 % de los frutos alcanzan el tamaño típico 74 40 % de los frutos alcanzan el tamaño típico 75 50 % de los frutos alcanzan el tamaño típico 76 60 % de los frutos alcanzan el tamaño típico 77 70 % de los frutos alcanzan el tamaño típico 78 80 % de los frutos alcanzan el tamaño típico 79 Todos los frutos alcanzan el tamaño típico ______________________________________________________________ 24 Estadio principal 8. Maduración de frutos y semillas 81 82 83 84 85 86 87 88 89 Comienza la maduración: 10 % de los frutos maduros, o 10 % de las semillas con el color típico, secas y duras 20 % de los frutos maduros, o 20 % de las semillas con el color típico, secas y duras 30 % de los frutos maduros, o 30 % de las semillas con el color típico, secas y duras 40 % de los frutos maduros, o 40 % de las semillas con el color típico, secas y duras 50 % de los frutos maduros, o 50 % de las semillas con el color típico, secas y duras 60 % de los frutos maduros, o 60 % de las semillas con el color típico, secas y duras 70 % de los frutos maduros, o 70 % de las semillas con el color típico, secas y duras 80 % de los frutos maduros, o 80 % de las semillas con el color típico, secas y duras Madurez completa: Semillas de toda la planta de color y dureza típicos Estadio principal 9. 92 95 97 99 Senescencia Las hojas y brotes comienzan a decolorarse 50 % de las hojas amarillas o muertas Las plantas mueren Partes cosechadas (semillas) 1) Para variedades de lechuga que no forman cabeza, espinaca y especies con crecimiento tipo roseta. 2) Para col rizada y especies que crecen por encima de la roseta. Feller, et al., 1995a Fuente: BBA BSA IGZ IVA AgrEvo BASF Bayer Novartis (1996). 2.4. Importancia de la raíz en un sistema de cultivo hidropónico De acuerdo con el criterio anteriormente citado, se ha demostrado por diferentes investigadores la esencialidad de los siguientes elementos químicos: En síntesis, Parker, R. (2000), manifiesta lo siguiente: frecuentemente las raíces se consideran como las partes ocultas de la planta ya que se localizan por debajo del suelo. Las funciones principales de las raíces son: • Sujeción de la planta. 25 • Absorción de agua y minerales del suelo y su transporte al tallo. • Reserva del alimento producido por la porción aérea de la planta. Los sistemas radicales están formados por una raíz primaria principal, unas radículas o raíces secundarias, y unos pelos radicales. La raíz primaria se origina a partir de un embrión. Los pelos radicales son extensiones celulares especializadas que penetran en las aperturas existentes entre las partículas del suelo. La pared externa de la célula se destiende para originar una formación tubular que contacta con el suelo y absorbe agua y minerales disueltos en él. De acuerdo con Barceló, J. et al (1980), “La raíz es el órgano especializado en la sujeción de la planta y en la absorción del agua y de los nutrientes minerales del suelo. La zona de máxima absorción se halla situada en la porción subapical de la raíz, por encima de la zona de división y elongación celular. Esta absorción máxima se logra por incremento de la superficie de las raíces, por mediación de los pelos absorbentes o pelos radiculares”. 2.5 Nutrición “La nutrición de esta especie tiene características similares a las de los demás cultivos hortícolas. La absorción de elementos guarda relación con la formación de materia seca. Así, aproximadamente, el 70-80% de los elementos nutritivos son absorbidos durante el último mes de desarrollo”. (Domínguez, A. 1997). Salisbury, F. et al (2000), “Las sales minerales disponibles más fácilmente para las raíces son las que están disueltas en la solución del suelo, aunque su concentración suele ser baja. Dichos nutrientes pueden llegar a las raíces de tres maneras diferentes: difundiéndose a través del suelo, por transporte pasivo junto con el agua que entra en las raíces por desplazamiento en masa y por crecimiento de las raíces hacia ellos.” Domínguez, V. (1997), considera que, “se entiende por nutrición vegetal el proceso mediante el cual la planta absorbe del medio que le rodea las 26 sustancias que le son necesarias para llevar a cabo su metabolismo y en consecuencia, desarrollarse y crecer”. Barceló, J. et al (1980), cita que: “La simple presencia de un elemento en un suelo no es indicativa de su disponibilidad para la planta. Solamente se hallan disponibles para ella aquellos elementos que se encuentran en forma soluble o por intercambio iónico con las micelas del suelo. Este intercambio es preferencialmente catiónico, dado el predominio de cargas negativas superficiales en las micelas inorgánicas (arcillas) y orgánicas (humus) del suelo. “Una característica particular de las plantas verdes, es que las sustancias requeridas para su alimentación son exclusivamente de tipo mineral o inorgánicas”. (Domínguez, V. 1997). De acuerdo a Domínguez, V. 1997, considera que: “Se define como elemento nutritivo a los elementos químicos integrantes de estos compuestos y más concretamente a aquellos elementos que son absolutamente imprescindibles o esenciales para el desarrollo completo del ciclo vegetativo. Para establecer este carácter de esencialidad en relación con un elemento determinado, se ha establecido a nivel internacional el siguiente criterio unificado: La falta de un elemento esencial impide a la planta completar su ciclo vegetativo. La falta o deficiencia es exclusiva del elemento en cuestión y sólo puede ser corregida suministrando dicho elemento y no otro. El elemento esencial está relacionado directamente con la nutrición de la planta, bien por ser constituyente de alguna sustancia esencial, bien por participar en funciones vitales de la planta. 27 2.6 Reguladores de crecimiento en el desarrollo radicular y foliar 2.6.1 Generalidades. Bidwell, R.G.S. (1993), expone: “Muchas técnicas agrícolas diferentes se basan en distintos aspectos de la fisiología vegetal. Uno de los más evidentes es la aplicación de factores y hormonas del crecimiento así como productos químicos sintéticos modificadores del crecimiento y el desarrollo”. De acuerdo con Pierik, R.L.M. (1990),”Las hormonas son, por definición, compuestos orgánicos sintetizados por las plantas superiores, que influyen sobre el crecimiento y desarrollo; actúan generalmente en lugar diferente a donde son producidas y se encuentran presentes y activas en muy pequeñas cantidades.” “Las hormonas reguladoras de crecimiento son de los compuestos más importantes que se incluyen en un medio de cultivo. Del propósito del medio de cultivo que se está preparando depende el tipo y la dosis de hormona a utilizar” (Espinal, D. 2001). “Estas diversas sustancias son de naturaleza endógena, es decir que pueden sintetizarse por el vegetal; además existen otras que el hombre sintetiza, cuyas fórmulas químicas son similares o diferentes a las sustancias naturales pero presentan una actividad fisiológica similar.” (Vidalie, H. 1986). Al conjunto de estos productos sintéticos junto con las hormonas se denomina reguladores y son responsables en primer lugar de la distribución de los compuestos que la planta biosintetiza. También determinan el crecimiento relativo de todos los órganos de la planta”. (Pierik, R. L. M. 1990). “Todos los compuestos tienen algunas características en común”: (Vidalie, H. 1986) • Actúan en dosis muy bajas; en dósis altas son tóxicas, lo que ha permitido que algunas se utilicen como herbicidas; • Solo interactúan con los otros reguladores; 28 • El funcionamiento esta determinado por el equilibrio establecido entre ellos; • Intervienen en múltiples fenómenos fisiológicos, lo que implica varias modalidades de acción. “Las fitohormonas pertenecen a cinco grupos conocidos de compuestos que ocurren en forma natural, cada uno de los cuales exhibe propiedades de regulación del crecimiento en plantas, y cada uno con su estructura particular y activos a muy bajas concentraciones dentro de la planta:” (1) • Auxinas • Citoquininas • Giberelinas • Etileno “Las auxinas y el etileno fueron los primeros compuestos utilizados comercialmente,…… Además de sus usos para enraizamiento bien conocidos la inducción de partenocarpia, el mejoramiento del prendimiento del fruto y el raleamiento de frutos para mejorar el rendimiento, las auxinas se han utilizado con éxito para mejorar la densidad de crecimiento y el rendimiento de muchos cultivos”. (Bidwell, R.G.S. 1993). De acuerdo con Vidalie, H. (1986), “La presencia de hormonas vegetales se ha observado desde fines del siglo pasado. Las primeras en ser descubiertas fueron las auxinas, en 1934; las giberelinas y las citoquininas en la década de 1950.” 2.6.1.1 AUXINAS “Las auxinas comprenden una gran familia de sustancias que tienen en común la capacidad de producir un agrandamiento y alargamiento celular; sin embargo, se ha encontrado al mismo tiempo que promueven la división celular en el cultivo de tejidos” (Roca, W. et al 1991). 29 El mismo autor manifiesta que: “También se utiliza ampliamente un buen número de sustancias que provocan un efecto fisiológico similar y que se han producido sintéticamente”. De igual manera sostiene que: “Las auxinas comprenden una gran familia de sustancias que tienen en común la capacidad de producir un agrandamiento y alargamiento celular; sin embargo, se han encontrado al mismo tiempo que promueven la división celular en el cultivo de tejidos” “En la práctica, el uso de las auxinas es un arte. No es posible establecer una concentración particular de la auxina que se debe utilizar en un solo caso. Sin embargo, en general se utiliza el AIA (Acido-Indol-Acético) en concentraciones que varían de 0,001 a 10 mg/lt. con un punto óptimo de alrededor de 0,1 a 10 mg/lt; el 2,4-D se utiliza en concentraciones que varían de 0,1 a 10 mg/lt, con un punto óptimo cerca de 2 mg/lt” (Roca, W. M, et al 1991). “A menudo es necesaria una concentración de auxinas sustancialmente menor para mantener los cultivos. Uno de los mejores ejemplos que se conocen de un cambio nominalmente “permanente”, en relación con el requerimiento de auxina en los tejidos cultivados, es el de la “habituación” a esta sustancia; en esta situación, tejidos que originalmente requerían un suministro exógeno de auxina para el crecimiento, pierden gradualmente este requerimiento (Gautheret, H.1959). Coincidiendo además Meins, et al (1978). que el mismo criterio se aplica a las citocininas. Según Steward, et al (1951), en algunos casos, “la adición de una de las auxinas al medio basal puede ser suficiente para iniciar y sustentar el crecimiento. Sin embargo, desde hace mucho tiempo se sabe que se puede obtener un efecto sinergístico entre una auxina y los factores de crecimiento como los encontrados en el AC”. Según Reynier, (1989) citado por Del Solar C, et al. ¨las auxinas en combinación con las citoquininas producidas en el nivel de las raíces y que migran a los frutos jóvenes, serian responsables de la división celular ¨ (2) 30 Vidalie, H. (1986), manifiesta que: “La auxina interviene en numerosos fenómenos fisiológicos, su acción depende de su concentración y sus interacciones con los otros reguladores. Al estudiar por separado los diversos efectos, es posible observar lo siguiente”. • Crecimiento celular debido al aumento consecutivo de la plasticidad en la pared esquelética y la penetración de agua en la célula. • Modificación de la permeabilidad de la membrana. • Estimulación de la división celular en células de origen cambial • Acción en la síntesis de etileno • Acción en las acciones de crecimiento (tropismo), y en las correlaciones entre órganos, en especial en el fenómeno de dominancia apical. • Clara acción rizógena 2.6.1.2 GIBERELINAS De acuerdo con MacMillan, (1984): “Luego de su aislamiento a partir del hongo Gibberella fujikuroi, el ácido giberélico (AG) se convirtió en un tema de intensa investigación, aunque la adición de este compuesto a los medios de cultivo de tejidos ha sido ocasional a pesar de sus efectos fisiológicos tan amplios. SE sabe muy bien que hay varias giberelinas, relacionadas con al AG, que son productos complejos del metabolismo del hongo o de plantas superiores, y que son capaces de intervenir en el crecimiento de muchas plantas ocasionando especialmente en alargamiento celular, que de otra forma no ocurriría” “Las giberelinas han sido de amplio uso en la agricultura. Uno de los primeros fue la inducción de partenocarpia que resulta en frutos sin semilla, a menudo de mayor tamaño”. (Bidwell, R.G.S. 1993). Según Espinal, D. (2001), “Este grupo de sustancias ocurre naturalmente en las plantas en influencia el alargamiento de las células y la elongación de tallos, por lo general estas sustancias inhiben la formación de tallos y raíces adventicias”. 31 De acuerdo con Stewart, et al (1964), y Schroeder, et al (1957), citado por Roca, W. M, et al (1991). Manifiesta lo siguiente: “Una evaluación de algunas giberelinas en cultivos de zanahoria. Ya que el AG se encuentra muy disponible y ha mostrado ser bastante activo, generalmente es el que se utiliza cuando se desea usar una giberelina; la concentración varía entre 0.01 a 1 mg/l con un punto óptimo alrededor de 0.1 mg/l. “Estas sustancias como la auxina, aparecieron mucho antes de que pudieran identificarse. Las primeras observaciones (1926) se hicieron en plantas de arroz atacadas por un hongo (Gibberella); los tallos tenían entrenudos muchos más alargados y sus hojas eran cloróticas. Los extractos acuosos del hongo provocaban los síntomas, de aquí la idea de una sustancia responsable de estos efectos”. (Vidalie, H. 1986). “En la práctica las giberelinas utilizadas son extractos más o menor purificados sobre todo la AG3” (Vidalie, H. 1986). Las propiedades fisiológicas de las giberelinas son: • Clara acción en alargamiento de entrenudos. • Inflorescencias más desarrolladas. • Efecto estimulante en el metabolismo; • Regulador de la cantidad de auxina ya que provoca su incremento o inhibición • Acción compleja en la floración, inducción floral. • Actúa en partenocarpia. • Desarrollo de los frutos. • Liberación de dormancia, De acuerdo con Bidwell, R.G.S. (1993), “las citocininas se han utilizado, si bien no en forma extensiva para prolongar la vida de plantas o partes de ella”. Pierik, R. L. M. (1990), afirma: “Generalmente estimulan la división celular, sobre todo si van en compañía de una auxina. En concentraciones elevadas (1-10 32 mg/l) puede inducir la formación de vástagos adventicios, sin embargo, generalmente se inhibe la formación de raíces. Promueven la formación de vástagos axilares, por que disminuyen la dominancia apical; también retardan el envejecimiento” Vidalie, H. (1986). Propone algunas propiedades fisiológicas: • Son indispensables en la división celular, pero ineficaces en ausencia de auxina. • La auxina favorece la duplicación de los ácidos desoxirribonucléicos DNA y las citocininas hacen posible la separación de los cromosomas. • Brindan estimulación considerable a la formación de yemas. • Acción estimulante en el metabolismo, este efecto causa un retrazo de la senescencia. • Efecto antagónico de la dominancia apical. 2.6.1.3 CITOCININAS Vidalie, H. (1986), cita que: “Las citocininas se descubrieron en forma accidental en un cultivo in Vitro. Se sabía que en los medios de cultivo, la adición de leche de coco provocaba un efecto favorable en la multiplicación celular y en la formación de yemas. Las investigaciones que intentaron descubrir el factor responsable de este efecto condujeron al aislamiento de un complejo activo de naturaleza púrica, el cual no pudo identificarse. Esto permitió hacer investigaciones con las purinas y, en 1956. Skoog aisló a partir de DNA desnaturalizado, una sustancia muy activa a la que dió el nombre de cinetina.” “Estas sustancias reguladoras del crecimiento son utilizadas para estimular la división celular, especialmente se agregan junto con una auxina, altas concentraciones inducen la formación de brotes adventicios o inhiben la formación de raíces; promueven la multiplicación de tallos y la proliferación de yemas laterales a través de la disminución de la dominancia apical. Las 33 citocininas ayudan, así mismo, al dilatar el proceso de envejecimiento de las células e influencian el transporte de las auxinas” (Espinal, D. 2001). Para Vidalie, H. (1986), “Todas las plantas poseen citocininas, cuya elaboración esencial ocurre por las raíces y también a nivel de los embriones. Aplicaciones localizadas en las hojas provocan que las sustancias nutritivas se dirijan hacia estos puntos para responder a la estimulación del metabolismo. Se supone que las citocininas endógenas ejercen el mismo efecto, ya sea en los frutos o en los tubérculos en vía de crecimiento. Las citocininas pueden estar ligadas a azúcares y circulan sin polaridad. De hecho, es posible que circulen bajo una forma inactiva o bien que permanezcan localizadas como en el caso de las aplicaciones foliares”. “Un efecto muy claro en la división celular; en este proceso son indispensables, pero ineficaces en ausencia de auxinas; las dos se complementan, la auxina favorece la duplicación de los ácidos desoxirribonucléicos (DNA) y la citocinina hace posible la separación de los cromosomas. Un papel muy claro en la organogénesis, en la que brinda estimulación considerable a la formación de yemas; en contraste, son antagónicas en la rizogénesis. Acción estimulante en el metabolismo, favoreciendo por una parte la síntesis protéica y, por otra, protegiendo a los metabolitos de las acciones de las enzimas hidrolíticas. Este efecto causa un retraso de la senescencia, a tal grado que las hojas viejas tratadas con citocinina pueden competir con las hojas más jóvenes. Efecto antagónico de la dominancia apical; las yemas laterales tratadas empiezan a crecer y a competir con el eje terminal.” (Vidalie, H. 1986). 34 2.6.1.4 ETILENO “Es un gas producido por las plantas que tiene efecto en su crecimiento”. (Espinal, D. 2001). De acuerdo con Vidalie, H. (1986), “El etileno es un compuesto gaseoso identificado desde hace mucho tiempo en las bodegas de almacenamiento de frutos, pero sus funciones como regulador de crecimiento sólo se demostraron hasta que los adelantos en los medios analíticos permitieron detectarlo en trazas. A partir de ese momento, se comprobó que todas las partes de una planta eran capaces de producir etileno. Aceleración del proceso de abscisión de hojas y frutos; al respecto, se usa para permitir las cosechas mecánicas. Inducción de la floración en plantas de las bromeliáceas, propiedad que han puesto en práctica los agricultores. Modificación de las correlaciones del crecimiento que se logra, si duda, por una acción en la polaridad de transporte de la auxina, acción que favorece la tuberización.” Todas las partes de una planta son capaces de sintetizar etileno, los más importantes productores son los frutos, en menor grado las flores y también los órganos lesionados.” 35 2.7 BIOESTIMULANTES RADICULARES 2.7.1 KELPAK Nombre Comercial KELPAK Nombre Químico Bioestimulante radicular Uso General Fertilizante 2.7.1.1 COMPOSICIÓN Nitrógeno Fósforo Potasio Sodio Calcio Boro Cobre Hierro Magnesio Manganeso Zinc Alanita Valina Glicina Isoleucina Prolina Treonina Serina Metionina Hidroxiprolina Pentanilalina Acido aspártico Acido glutamínico Tirosina Ortinina Lisyna Arginina Auxinas Citoquininas 0,28 % 0,72 % 0,42 % 0,11 % 0,01 % 3,2 mg 1,8 mg 2,2 mg 56,4 mg 0,8 mg 0,9 mg 150 mg 70 mg 70 mg 40 mg 92 mg 84 mg 140 mg 25 mg 27 mg 60 mg 31 mg 35 mg 60 mg 63 mg 80 mg 48 mg Fuente: Ecological Consultants, Ltda. 2.7.1.2 CARACTERÍSTICAS • Bioestimulante radicular extraído de algas marinas 2.7.1.3 BENEFICIOS • Incrementa el volumen y masa radicular • Incrementa el número de pelos absorbentes 36 • Mejora la capacidad de absorción de nutrientes y agua • Estimula la brotación de meristemas radiculares latentes • Otorga mayor tolerancia a situaciones de stress 2.7.1.4 MODO DE ACCIÓN • La alta relación de auxinas, citoquininas, estimula la formación de raíces • El aumento de raíces, aumenta la producción de citoquininas, ya que estas son formadas en los ápices radiculares • El mayor número de raíces aumenta la absorción de nutrientes que sumado a la provisión adicional de citoquininas, incrementa el desarrollo foliar • Por tanto, Kelpak, determina aumento en la producción de las cosechas 2.7.1.5 COMPATIBILIDAD Kelpak, es compatible con la mayoría de productos fitosanitarios y fertilizantes foliares de uso común 2.7.1.6 DÓSIS 2,0 l/Ha 2,5 cc/ lt de solución 37 2.7.2 AMINO STARTER SC Nombre Comercial Amino Starter SC Nombre Químico Bioestimulante nutricional Uso General Fertilizante 2.7.2.1 COMPOSICIÓN Nitrógeno Fósforo Potasio Azufre Zinc * Hierro * Manganeso * Cobre * Boro Molibdeno Citoquininas Auxinas Aminoácidos 15,7 % 17,8 % 19,4 % 2,0 % 750 mg/l 750 mg/l 300 mg/l 300 mg/l 1500 mg/l 80 mg/l 0,6 mg/l 1 mg/l 12 mg/l *Todos los microelementos son EDTA quelatados Fuente: SQM-Ecuador 2.7.2.2 CARACTERÍSTICAS • Suspensión líquida soluble en agua, 2:1:2, fertilizante con micro elementos para nutrición foliar y fertirrigación. • Corrección, prevención y bioestimulación foliar • Speedfol es un programa integral de nutrición vegetal de especialidad para aplicación foliar, el único triplemente efectivo. • Esto significa que además de corregir y prevenir rápidamente de las deficiencias nutricionales, aporta elementos activos especiales que bioestimulan foliarmente los cultivos, garantizando frutos de calidad final insuperable. • Speedfol Amino Starter SC NPK + Micro elementos rico en fósforo para promover el crecimiento de raíces 2.7.2.3 RECOMENDACIONES • Speedfol Amino Starter SC es recomendado para ser usado durante los períodos de crecimiento que requieren niveles relativamente altos de fósforo tales como germinación, transplantes, plantas jóvenes y durante 38 período de stress cuando el crecimiento activo de la planta es esencial o ha sido reducido • Es absorbido rápidamente por la planta ya que está formulado para aplicación foliar y para fertirrigación. • Debe ser aplicado preferentemente temprano en la mañana o en las últimas horas de la tarde. No aplicar a plantas que atraviesen períodos de stress por humedad o calor. 2.7.2.4 COMPATIBILIDAD • Es compatible con la mayoría de los agroquímicos. Sin embargo, es recomendable efectuar una prueba de compatibilidad antes de mezclarlo con otros agroquímicos. • La tasa de aplicación depende de la fertilidad del suelo y la reacción requerida. Las tasas más bajas deben ser usadas para mantención mientras que las más altas corregirán deficiencias nutricionales 2.7.2.5 DÓSIS 2,6 lt/ Ha 2,5 cc /lt 39 2.7.3 EVERGREEN Nombre Comercial Evergreen Nombre Químico Bioestimulante nutricional Uso General Fertilizante 2.7.3.1 COMPOSICIÓN Nitrógeno nítrico Fósforo asimilable Potasio soluble Citoquinina Giberelina Auxinas Ácidos húmicos Boro Cobre Hierro EDTA Magnesio Magnesio EDTA Molibdeno Zinc EDTA Colina Tiamina Niacina Acido Pantoténico Ácido fólico Nicotinamida Riboflavina 7% 7% 7% 90 ppm 40 ppm 40 ppm 12 % 0,024 % 0,013 % 0,050 % 0,036 % 0,018 % 0,0003 % 0,0009 % 750 ppb 150 ppb 90 ppb 12 ppb 1 ppb 2 ppb 1, ppb Fuente: ExcelAg, Corp. 2.7.3.2 CARACTERÍSTICAS • Es un bioestimulante nutricional que contiene un complejo de 7 macroelementos y fitohormonas, 7 microelementos y 7 vitaminas obtenidas de extractos de origen vegetal • Es formulado especialmente en suspensión con ácidos húmicos de alta calidad obtenidos de la Leonardita, que es un eficaz acondicionador que incrementa la eficiencia del producto y de las mezclas con pesticidas. • Proporciona beneficios significativos incrementando el desarrollo radicular, maximiza la eficiencia de la absorción de nutrientes, uniformiza la calidad y tamaño del fruto, aumentando el rendimiento del cultivo tratado, y mejora la acción de los agroquímicos cuando se mezcla con ellos. 40 2.7.3.3 COMPATIBILIDAD • Puede ser usado en todos los cultivos, anuales y perennes. • Es compatible con la mayoría de agroquímicos, pero se recomienda una previa mezcla 2.7.3.4 DÓSIS 1 litro/ ha 2,5 cc/ lt 41 42 CAPÍTULO III MATERIALES Y METODOS 3.1 UBICACIÓN DEL EXPERIMENTO, MATERIALES, EQUIPOS, E INSUMOS. 3.1.1 UBICACIÓN DEL EXPERIMENTO: La presente investigación se realizó en la zona de Píntag en la Provincia de Pichincha Las características de cada localidad son detalladas a continuación. Provincia: Cantón: Parroquia: Barrio: Sitio: Altitud: Latitud: Longitud: Temperatura promedio anual: Precipitación promedio anual: Humedad Relativa: *Fuente: INAMHI (s/f). 3.1.2 MATERIALES • Bandejas de germinación • Invernadero para germinación • Manguera de riego • Libreta de campo • Rótulos • Fundas plásticas Pichincha Rumiñahui Píntag San Pedro Finca Greenlab 2165 m.s.n.m 00º23´47´´ 77º56´30´´ 16°C 400 a 820 mm* 60% • Letreros • Piscinas de vivero • Tubería de PVC • Umbráculo 3.1.3 EQUIPOS • Pulverizador manual • Balanza electrónica • Cámara fotográfica • Computador • Impresora • Bombas de agua • Inyectores de fertilizante • Temporizadores • Potenciómetro • Termo-higrómetro • Conductímetro 3.1.4 INSUMOS • Plántulas de lechuga o Variedad romana o Variedad rosa verde o Variedad crispada • Bioestimulantes o Kelpak ® o Evergreen ® o Animo Starter ® • Sales fertilizantes • Fungicidas • Insecticidas 43 3.2 MÉTODOS 3.2.1 DISEÑO EXPERIMENTAL (FASE I) En la presente investigación se utilizó un diseño de bloques completos al azar en arreglo factorial A x B. 3.2.2 FACTORES EN ESTUDIO 3.2.2.1 FACTOR A (Variedades) Variedades de lechuga A1: Crispada A2: Rosa Verde A3: Romana Variedades de lechuga A1: Crispada A2: Rosa verde A3: Romana Código VC VR VRv 3.2.2.2 FACTOR B (Bioestimulantes) Bioestimulantes B1: Kelpak + solución nutritiva B2: Evergreen + solución nutritiva B3: Amino Starter + solución nutritiva B4: solución nutritiva (testigo) Bioestimulantes Código B1: Kelpak + solución nutritiva B2: Evergreen + solución nutritiva B3: Amino Starter + solución nutritiva B4: solución nutritiva (testigo) KSN ESN AsSN SN 44 3.2.3 TRATAMIENTOS Tratamientos en estudio doce (12) Tratamiento T1 T2 T3 T4 T5 T6 T7 T8 T9 T10 T11 T12 Simbología A1B1 A1B2 A1B3 A1B4 A2B1 A2B2 A2B3 A2B4 A3B1 A3B2 A3B3 A3B4 CODIGO VC + KSN VC + ESN VC + AsSN VC + SN VRv + KSN VRv + ESN VRv + AsSN VRv + SN VR + KSN VR + ESN VR+ AsSN VR + SN 3.2.4 REPETICIONES Se realizaron tres (3) por cada uno de los tratamientos 3.2.5 UNIDADES EXPERIMENTALES Tomando en cuenta el número de tratamientos y réplicas se dispusieron de 36 unidades experimentales cada una consta de dos bandejas con una capacidad de 96 plantas en 12 filas por 8 columnas, el área total de la unidad experimental es de 0.19 m2. El área neta de estudio es la bandeja con 8 filas y 6 columnas con un total de 48 plantas 0.09 m2. Unidad experimental total: 7.50 m x 1.21 m x 4 36.3 m2 piscinas 0.35m. x 0.56m. 0.19 m2 Unidad experimental neta: 0.37 m. X0.26 m. Área total experimental: 0.09 m2 45 3.2.6 ESQUEMA DEL ADEVA ADEVA Fuente de Variación Grados de libertad Total 35 Tratamientos 11 Repeticiones 2 Factor A (Variedades) 2 Factor B (Bioestimulantes) 3 Interacción A x B 6 Error Experimental 22 3.2.7 PRUEBAS DE SIGNIFICANCIA • Coeficiente de variación • Prueba de Tukey al 5% • Comparaciones ortogonales para A y B 3.2.8 VARIABLES E INDICADORES Variables Indicadores Área radicular Peso de área radicular Área foliar Peso de área foliar 3.2.9 DISEÑO EXPERIMENTAL (fase II) En la fase experimental de campo se utilizó un diseño de bloques completos al azar en arreglo factorial A x B. 3.2.10 FACTORES EN ESTUDIO 3.2.10.1 FACTOR A (Variedades) Variedades de lechuga A1: Crispada A2: Rosa Verde A3: Romana 46 Variedades de lechuga A1: Crispada A2: Rosa verde A3: Romana Código VC VR VRv 3.2.10.2 FACTOR B (Bioestimulantes) Bioestimulantes B1: Kelpak + solución nutritiva B2: Evergreen + solución nutritiva B3: Amino Starter + solución nutritiva B4: solución nutritiva (testigo) Bioestimulantes Código B1: Kelpak + solución nutritiva B2: Evergreen + solución nutritiva B3: Amino Starter + solución nutritiva B4: solución nutritiva (testigo) KSN ESN AsSN SN 3.2.11 TRATAMIENTOS Tratamientos en estudio doce (12) Tratamiento T1 T2 T3 T4 T5 T6 T7 T8 T9 T10 T11 T12 Simbología A1B1 A1B2 A1B3 A1B4 A2B1 A2B2 A2B3 A2B4 A3B1 A3B2 A3B3 A3B4 CODIGO VC + KSN VC + ESN VC + AsSN VC + SN VRv + KSN VRv + ESN VRv + AsSN VRv + SN VR + KSN VR + ESN VR+ AsSN VR + SN 47 3.2.12 REPETICIONES Se realizaron tres (3) por cada uno de los tratamientos. 3.2.13 UNIDADES EXPERIMENTALES El total de unidades experimentales dentro de la investigación fue de 36, cada unidad experimental estaba conformada de un tubo de pvc de 12 m de largo dividido en secciones de seis metros y 75mm. de diámetro, mismos que son perforados para la inserción de las plantas a una distancia 0.20 m con un total de 200 hoyos en los que se colocará una planta por hoyo. 3.2.14 ESQUEMA DEL ADEVA ADEVA Fuente de Variación Total Tratamientos Repeticiones Factor A (Variedades) Factor B (Bioestimulantes) Interacción A x B Error Experimental Grados de libertad 35 11 2 2 3 6 22 3.2.15 PRUEBAS DE SIGNIFICANCIA • Coeficiente de variación • Prueba de Tukey al 5% 3.2.16 VARIABLES E INDICADORES Variables Indicadores Peso unitario Rendimiento en g. Análisis financiero Rentabilidad en % 48 3.3 MÉTODOS DE EVALUACIÓN (FASE II) 3.3.1 MASA RADICULAR Esta variable se utilizó para determinar el peso de la raíz a los 42 días después de la siembra, para realizar este análisis se tomaron las plántulas, y con la ayuda de un tamiz se eliminó el sustrato que conformaba el pilón. Liberada la parte radicular se procedió a la disección de la misma y a la toma de su respectivo peso luego del escurrimiento para eliminar el exceso de agua. 3.3.2 MASA FOLIAR Se pesó la masa foliar a los 42 días después de la siembra, al finalizar la primera etapa de la investigación. El mismo que consistió en desprender toda el área radicular para obtener sólo el área foliar, seguidamente se colocó en la balanza y se obtuvo su peso respectivo. 3.4 MÉTODOS DE EVALUACIÓN (FASE II) 3.4.1 MASA FOLIAR Cuando se terminó la cosecha de las lechugas se tomó una muestra del 10 % de la parcela neta, descontando los efectos de borde y se peso cada una de las muestras de cada uno de los tratamientos en una balanza electrónica. 3.4.2 ANÁLISIS FINANCIERO Se elaboraron los costos de producción tomando en cuenta materia prima, mano de obra y costos indirectos de fabricación que varían de acuerdo a cada tratamiento, comparando el beneficio que se obtuvo de cada uno para determinar el porcentaje de rentabilidad. El análisis financiero se realizó al término de la cosecha de las lechugas. 49 3.5 MANEJO ESPECÍFICO DEL EXPERIMENTO (FASE I) 3.5.1 LIMPIEZA Y DESINFECCIÓN DE PISCINAS DE ENRAIZAMIENTO Previo a la inmersión de la bandejas que contienen las plántulas, con la ayuda de una escoba, detergente y desinfectante (hipoclorito de sodio 5%) se limpió cada una de las piscinas en donde permanecieron las plántulas donde posteriormente se colocó la solución nutritiva con los diferentes tratamientos anteriormente descritos, con esta actividad se buscó eliminar por competo cualquier impureza que pudo provocar patologías en las plántulas, asimismo la eliminación de cualquier residuo de elementos contaminantes. 3.5.2 RIEGO El riego en el área de semilleros, es un factor muy importante. Se mantuvo siempre a las plántulas con una adecuada cantidad de agua para evitar stress en las mismas, todos los días se inyectó solución nutritiva a las piscinas, para que se mantengan inmersas en la misma. 3.5.3 APLICACIÓN DE LAS SOLUCIONES ENRAIZANTES Las soluciones enraizantes fueron dividas en 2 aplicaciones, según la dósis recomendada por cada fabricante, las mismas que se inyectaron al sistema, se las realizaron cada 5 días. Para cuantificar la dósis que se aplicó, se dividió la dósis total para 2. 3.6 MANEJO ESPECÍFICO DEL EXPERIMENTO (FASE II) 3.6.1 LIMPIEZA Y DESINFECCIÓN DE TUBERÍAS DE CULTIVO Una vez que las plántulas salieron del semillero se procedió a la colocación en las tuberías de cultivo, para lo cual se realizó un proceso de limpieza de las mismas. 50 Manualmente se extrajo cualquier residuo vegetal y se condujo una esponja con solución desinfectante de hipoclorito de sodio al 5 %. 3.6.2 TRANSPLANTE Se delimitó el área correspondiente para cada tratamiento y se fueron colocando las plántulas de lechuga correspondiente a cada tratamiento respectivamente. 3.6.3 FERTIRRIGACIÓN La finca Greenlab cuenta con un sistema de riego automatizado y con su propia formulación de fertilizante para el área de cultivo, asimismo la solución nutritiva fue monitoreada diariamente al igual que la programación del mismo. 3.6.4 CONTROLES FITOSANITARIOS Durante el cultivo se realizaron aspersiones preventivas especialmente contra hongos que pudieran causar pudriciones radiculares y se controlaron áfidos, de acuerdo al cronograma de aspersiones. 3.6.5 COSECHA La cosecha se la realizó manualmente, colocando cada una de las lechugas en fundas de polietileno y fueron llevadas inmediatamente al cuarto frío para evitar cualquier cambio de condición para la recopilación de datos. 51 52 CAPITULO IV RESULTADOS Y DISCUSIONES 4.1 MASA RADICULAR FASE I (Vivero) TABLA 1. Análisis de Varianza de la Variable masa radicular en gramos Fase I (Vivero). FV Total Tratamientos Repeticiones FA (variedades) Co1 Co2 FB (bioestimulantes) Co1 Co2 Co3 Int A x B E. experimental ADEVA GL 35 11 2 2 1 1 3 1 1 1 6 22 CM 777,23 1723,49 17,47 5835,94 8050,18 3621,71 1891,42 147,97 3264,22 2262,06 268,71 373,17 ** Ns ** ** ** ** Ns ** * Ns Fuente: Datos de campo del experimento CV = 12.74 % En el análisis de varianza de la variable masa radicular en gramos de la fase I (vivero) (tabla 1), se observa que existió diferencias altamente significativas para tratamientos, factor variedades (A) y factor bioestimulantes (B). Como resultado de las comparaciones ortogonales para el factor variedades con respecto a la variable masa radicular (tabla 1) se determinó que existe diferencias altamente significativas entre las variedades Crispada vs Rosa Verde, a favor de la primera (Co1), y diferencia altamente significativa entre la variedad Crispada y Rosa Verde vs Romana (CO2), a favor de esta última. En lo que respecta al factor bioestimulantes, el análisis de la comparación ortogonal (Co1), determinó que no existió diferencia significativa entre la solución nutritiva (testigo) vs Kelpak; así mismo la comparación entre Evergreen y Amino Starter generó una alta significancia a favor de Evergreen. De la CO2, que compara Kelpak con Evergreen, generó alta significancia a favor de Evergreen; de la misma manera la comparación entre Amino Starter con la solución nutritiva (testigo) es altamente significativa a favor de Amino Starter. (gráfico 2) TABLA 2.- Prueba de Tukey al 5% para el Factor Variedades de la variable masa radicular Fase I (Vivero). Variedades V3 (Romana) V1 (Crispada) V2 (Rosa Verde) Media 165,80 162,84 126,21 Rango a a b Fuente: Datos de campo del experimento Después de realizar la prueba de Tukey al 5%, para el factor variedades se pudo identificar dos rangos de acuerdo a los valores obtenidos en la tabla 2. En el primer rango encontramos que las variedades Romana y Crispada tienen una masa radicular con un peso muy similar, no así la variedad Rosa Verde, que generó una menor masa radicular. 53 GRÁFICO 1.- Representación gráfica del factor variedades de la variable masa radicular Fase I (Vivero). Peso de masa radicular en (g) fase I 180,00 162,84 165,80 160,00 126,21 140,00 120,00 100,00 80,00 60,00 40,00 20,00 0,00 V3 V1 V2 VARIEDADES Fuente: Datos de campo del experimento TABLA 3.- Prueba de Tukey al 5% para el Factor Bioestimulantes de la variable masa radicular Fase I (Vivero). Producto Media Rango F2 (Evergreen) 172,68 a F3 (Amino Starter) 149,00 b F4 (Solución nutritiva) 142,92 b F1 (Kelpak) 141,27 b Fuente: Datos de campo del experimento 54 Mediante la prueba de Tukey al 5%, se determinaron dos rangos. El bioestimulante que ayuda al incremento de la masa radicular es Evergreen y los otros tres bioestimulantes tienen un valor de la masa radicular similar entre ellos. GRÁFICO 2.- Representación gráfica del factor bioestimulantes de la variable masa radicular Fase I (Vivero). Peso de masa radicular en (g) fase I 200,00 180,00 172,68 160,00 149,00 142,92 141,27 F4 F1 140,00 120,00 100,00 80,00 60,00 40,00 20,00 0,00 F2 F3 BIOESTIMULANTES Fuente: Datos de campo del experimento 55 TABLA 4.- Prueba de Tukey al 5% para los tratamientos de la variable masa radicular Fase I (Vivero). Tratamiento T2 T10 T11 T4 T9 T6 T1 T3 T12 T7 T5 T8 Media 184,90 182,08 175,12 166,02 158,03 151,07 150,98 149,47 147,98 124,22 114,80 114,77 Rango a ab b bc c c c c c c c d Fuente: Datos de campo del experimento En el análisis de la prueba de Tukey al 5% para los tratamientos de la variable masa radicular de la fase I (vivero) tabla 4 se observa que existen 4 rangos, el mejor fue T2 (Crispada con Evergreen), que presentó la mayor masa radicular. Por otro lado el tratamiento que generó menor masa radicular corresponde al tratamientos T8 (Rosa verde con solución nutritiva, testigo). GRÁFICO 3.- Representación gráfica de los tratamientos de la variable masa radicular Fase I (Vivero). 147,98 T3 T12 114,77 149,47 T1 120,00 114,80 150,98 T6 140,00 124,22 151,07 160,00 158,03 T10 166,02 T2 180,00 175,12 182,08 200,00 184,90 Peso de masa radicular Fase I T5 T8 100,00 80,00 60,00 40,00 20,00 0,00 T11 T4 T9 T7 Tratamientos Fuente: Datos de campo del experimento 56 4.2 MASA FOLIAR FASE I (Vivero) TABLA 5. Análisis de Varianza de la Variable masa foliar en gramos Fase I (Vivero). ADEVA GL Total 35 Tratamientos 11 Repeticiones 2 FA (Variedades) 2 Co1 1 Co2 1 FB (Bioestimulantes) 3 Co1 1 Co2 1 Co3 1 Int A x B 6 Eexp 22 FV CM 445,16 1197,97 50,70 4473,12 4072,92 4873,31 662,15 167,72 1782,95 35,78 374,16 104,61 ** ns ** ** ** ** ns ** ns * Fuente: Datos de campo del experimento CV =6.07 % En el análisis de varianza de la variable masa foliar en gramos de la fase I (vivero) (tabla 5), se observa que existe diferencias altamente significativa para tratamientos, factor variedades (A) y factor bioestimulantes (B), y diferencia significativa para la interacción variedades de lechuga con bioestimulantes. Como resultado de las comparaciones ortogonales para el factor variedades con respecto a la variable masa foliar (tabla 5) se determinó que existe diferencias altamente significativas entre las variedades Crispada vs Rosa Verde, a favor de la segunda (Co1), y diferencia altamente significativa entre la variedad Crispada y Rosa Verde vs Romana (CO2), a favor de Rosa Verde. En lo que respecta al factor bioestimulantes, el análisis de la comparación ortogonal (CO1), determinó que no existe diferencia significativa entre la solución nutritiva (testigo) vs Kelpak, siendo mejor en este caso la solución nutritiva o de control; de la misma manera al comparar Evergreen y Amino Starter generó una alta significancia a favor de Evergreen. De la (CO2), que comparó Kelpak con Evergreen, generó alta 57 significancia a favor de Evergreen, así la comparación entre Amino Starter con la solución nutritiva (testigo) es significativa a favor de Amino Starter. TABLA 6.- Prueba de Tukey al 5% para el Factor Variedades de la variable masa foliar Fase I (Vivero) Variedad V2 (Rosa Verde) V1 (Crispada) V3 (Romana) Media 189,72 163,66 152,01 Rango a b c Fuente: Datos de campo del experimento Con la prueba de Tukey al 5%, tenemos tres rangos de acuerdo a los valores obtenidos en la tabla 6. En el primer rango encontramos que las variedad Rosa Verde tiene un mayor peso de la masa foliar en comparación con la variedad Crispada, no así la variedad Romana, que generó una menor masa foliar que las anteriores. GRÁFICO 4.- Representación gráfica del factor Variedades de la variable masa foliar Fase I (Vivero). Peso de masa foliar en g 200,00 180,00 189,72 163,66 160,00 140,00 120,00 152,01 100,00 80,00 60,00 40,00 20,00 0,00 V2 V1 Variedades V3 Fuente: Datos de campo del experimento 58 TABLA 7.- Prueba de Tukey al 5% para el Factor Bioestimulantes de la variable masa foliar Fase I (Vivero) Producto F3 (Amino Starter) F2 (Evergreen) F1 (Kelpak) F4 (Solución nutritiva) Media 175,87 175,13 164,76 158,08 Rango a a b c Fuente: Datos de campo del experimento De acuerdo con la prueba de Tukey al 5%, se presentaron tres rangos. Los bioestimulantes que ayudaron al incremento de la masa foliar fueron Amino Starter y Evergreen, Kelpak se colocó en el tercer lugar, y la de menor valor para la solución nutritiva. GRÁFICO 5.- Representación gráfica del factor bioestimulantes de la variable masa foliar Fase I (Vivero) Peso de masa foliar en g 180,00 175,00 170,00 165,00 160,00 155,00 150,00 145,00 F3 F2 F1 F4 Bioestimulantes Fuente: Datos de campo del experimento 59 TABLA 8.- Prueba de Tukey al 5% para los tratamientos de la variable masa foliar Fase I (Vivero) Tratamiento T7 T6 T5 T2 T8 T11 T1 T4 T3 T10 T9 T12 Media 206,48 197,27 180,03 176,72 175,08 168,48 168,42 156,87 152,65 151,40 145,85 142,30 Rango a b c cd d d d de e e f f Fuente: Datos de campo del experimento En el análisis de la prueba de Tukey al 5% para los tratamientos de la variable masa foliar de la fase I (vivero) tabla 8 se observa que existen 6 rangos, de estos el mejor tratamientos fue T7 (Rosa verde con Amino starter) que presentó la mayor masa foliar. Por otro lado los tratamientos que generaron menor masa foliar corresponden a T12 (Romana con solución nutritiva, testigo), T9 (Romana con Kelpak). GRÁFICO 6.- Representación gráfica de los tratamientos de la variable masa foliar Fase I (Vivero). 145,85 142,30 T1 151,40 T11 152,65 T8 156,87 175,08 T2 168,42 176,72 T5 168,48 180,03 200,00 197,27 250,00 206,48 Peso de masa foliar Fase I T4 T3 T10 T9 T12 150,00 100,00 50,00 0,00 T7 T6 Tratamientos Fuente: Datos de campo del experimento 60 4.3 PESO UNITARIO FASE II (Cultivo) TABLA 9. Análisis de Varianza de la Variable Peso Unitario en gramos Fase II (Cultivo) ADEVA GL Total 35 Tratamientos 11 Repeticiones 2 FA (Variedades) 2 Co1 1 Co2 1 FB (Bioestimulantes) 3 Co1 1 Co2 1 Co3 1 Int A x B 6 E. experimental 22 FV CM 28827,19 80778,74 1645,50 334828,19 566507,55 103148,82 40043,02 8026,69 70924,57 41177,81 16463,45 5322,48 ** ns ** ** ** ** ns ** * * Fuente: Datos de campo del experimento CV = 9.29 % En el análisis de varianza de la variable peso unitario en gramos de la fase II (cultivo) (tabla 8), se observa que existe diferencias altamente significativa para tratamientos, factor variedades (A) y factor bioestimulantes (B), y diferencia significativa para la interacción variedades de lechuga con bioestimulantes Como resultado de las comparaciones ortogonales para el factor variedades con respecto a la variable peso unitario (tabla 8) se determinó que existe diferencias altamente significativas entre las variedades Crispada vs Rosa Verde, a favor de Rosa Verde (Co1), y diferencia altamente significativa entre la variedad Crispada y Rosa Verde vs Romana (CO2), a favor de Rosa Verde. En lo que respecta al factor bioestimulantes, el análisis de la comparación ortogonal (Co1), determinó que no existió diferencia significativa entre la solución nutritiva (testigo) vs Kelpak, a favor de Kelpak; de la misma manera al comparar Evergreen y Amino Starter generó una alta significancia a favor de Evergreen. De la CO2, que compara Kelpak con Evergreen, se estableció alta significancia a favor de 61 Evergreen, así la comparación entre Amino Starter con la solución nutritiva (testigo) fue significativa a favor de Amino Starter. TABLA 10.- Prueba de Tukey al 5% para el Factor Variedades de la variable peso unitario en gramos Fase II (Cultivo) Variedad V2( Rosa Verde) V3 (Romana) V1 (Crispada) Media 976,64 709,45 669,36 Rango a b c Fuente: Datos de campo del experimento Con la prueba de Tukey al 5%, se identificaron tres rangos de acuerdo a los valores obtenidos en la tabla 10. En el primer rango encontramos a la variedad Rosa Verde, seguida de la variedad Romana y la variedad con menor masa foliar resultó ser la variedad Crispada. GRÁFICO 7.- Representación gráfica del Factor Variedades de la variable peso unitario en gramos Fase II (Cultivo) Peso unitario (g) 800,00 669,36 709,45 1000,00 976,64 1200,00 600,00 400,00 200,00 0,00 V2 V3 V1 Variedades Fuente: Datos de campo del experimento 62 TABLA 11.- Prueba de Tukey al 5% para el Factor Bioestimulantes de la variable peso unitario en gramos Fase II (Cultivo). Productos Media Rango F2 (Evergreen) 881,59 a F3 (Amino Starter) 777,48 b F1 (Kelpak) 745,67 c F4 (solución Nutritiva) 735,86 c Fuente: Datos de campo del experimento Del análisis de la prueba de Tukey al 5% podemos observar que existen tres rangos en cuanto, al uso de los bioestimulantes. El producto que generó mejores pesos unitarios en la fase de vivero es Evergreen, seguido de Amino Starter y encontramos en el mismo rango a Kelpak y en último lugar la solución nutritiva. GRÁFICO 8.- Representación gráfica del factor bioestimulantes de la variable peso unitario en gramos Fase II (cultivo) 900,00 881,59 Peso unitario (g) 745,67 800,00 750,00 735,86 777,48 850,00 700,00 650,00 F2 F3 F1 F4 Bioestimulantes Fuente: Datos de campo del experimento 63 TABLA 12.- Prueba de Tukey al 5% para los tratamientos del peso unitario en gramos Fase II (Cultivo) Tratamiento T6 T7 T8 T5 T2 T10 T9 T11 T1 T4 T12 T3 Media 1080,65 1068,23 903,93 853,73 793,88 770,23 721,40 695,20 661,88 652,67 650,97 569,02 Rango a a b c cd d d e e e e f Fuente: Datos de campo del experimento De la prueba de Tukey al 5 % para los tratamientos en la fase II cultivo podemos observar que existieron seis rangos. A la cabeza como mejores tratamientos tenemos a T6 (Rosa verde con Evergreen) y T7 (Rosa verde con Amino Starter). El tratamiento que menor masa foliar fue T3 (Crispada con Amino Starter). GRÁFICO 9.- Representación gráfica de los tratamientos de la variable peso unitario en gramos Fase II (Cultivo) 652,67 650,97 T9 T11 T1 T4 T12 600,00 569,02 661,88 T10 695,20 T2 721,40 770,23 800,00 793,88 T7 853,73 T6 1000,00 903,93 1068,23 1200,00 1080,65 Peso unitario (g) 400,00 200,00 0,00 T8 T5 T3 Tratamientos Fuente: Datos de campo del experimento 64 65 Peso Unitario (g) Costo producción USD/200 (g) 661,88 0,0020 793,88 0,0020 569,02 0,0020 652,67 0,0020 853,73 0,0020 1080,65 0,0020 1068,23 0,0020 903,93 0,0020 721,40 0,0020 770,23 0,0020 695,20 0,0020 650,97 0,0020 Costo Unitario 2,176 2,176 2,176 2,176 3,013 3,013 3,013 3,013 2,170 2,170 2,170 2,170 PVP 2,78 3,33 2,39 2,74 3,59 4,54 4,49 3,80 3,03 3,23 2,92 2,73 PVP - C.U 0,604 1,159 0,214 0,566 0,573 1,526 1,473 0,783 0,860 1,065 0,750 0,564 Rentabilidad % 27,78 53,26 9,85 26,00 19,00 50,63 48,90 26,00 39,63 49,08 34,56 26,00 como Rosa Verde y Romana el mejor bioestimulante fue Evergreen con 50,63% y 49,08% respectivamente. Evergreen con un 53,26 %, de retorno por cada unidad monetaria invertida. De la misma manera si se comparan las otras variedades Como resultado del análisis financiero a la cosecha, se pudo observar que la mejor variedad y bioestimulante utilizado fue Crispada y Fuente: Datos de campo del experimento Tratamientos T1 (Crispada Kelpak) T2 (Crispada Evergreen) T3 (Crispada Amino Starter) T4 (Solución Nutritiva) T5 (Rosa Verde Kelpak) T6 (Rosa Verde Evergreen) T7 (Rosa Verde Amino Starter) T8 (Rosa Verde Solución Nutritiva) T9 (Romana Kelpak) T10 (Romana Evergreen) T11 (Romana Amino Starter) T12 (Romana Solución Nutritiva) TABLA 13.- Análisis financiero para los tratamientos del peso unitario en gramos FASE II (Cultivo) 4.4 ANALISIS FINANCIERO 27,78 T1 53,26 T2 T3 9,85 26,00 T4 19,00 T5 50,63 T7 48,90 Tratamientos T6 26,00 T8 T9 T10 49,08 T11 T12 66 porcentaje de rentabilidad de 26% independientemente de la variedad de lechuga utilizada, y si se toma en cuenta que con la En la representación gráfica se puede observar los tratamientos que recibieron únicamente Solución Nutritiva alcanzaron un Fuente: Datos de campo del experimento 0,00 10,00 20,00 30,00 40,00 50,00 60,00 39,63 Análisis Financiero de los tratamientos 34,56 GRÁFICO 10.- Representación gráfica de los tratamientos de la variable Análisis Financiero (%) en la FASE II (Cultivo) 26,00 0 10 20 30 40 50 Kelpak Fuente: Datos de campo del experimento Porcentaje 60 27,78 Tratamientos Evergreen Amino Starter Rentabilidad Var Crispada 53,26 (%) en la FASE II (Cultivo). 9,85 Solución Nutritiva 67 GRÁFICO 11.- Representación gráfica de variedad Crispada comparada con los bioestimulantes en la variable Análisis Financiero estimulante del desarrollo radicular, estos tratamientos son: T3 (Crispada, Amino Starter) 9,58%, T5 (Rosa Verde, Kelpak) 19,00%. Así mismo se presentaron dos tratamientos cuya rentabilidad fue inferior a la obtenida al utilizar únicamente la solución nutritiva como 34,56%. Verde, Amino Starter) 48,90%, T9 (Romana, Kelpak) 39,63%, T10 (Romana, Evergreen) 49,08%, T11 (Romana, Amino Starter) margen, siendo T1 (Crispada, KelpaK) 27,78%, T2 (Crispada, Evergreen) 53,26%, T6 (Verde Rosa, Evergreen) 50,63%, T7 (Rosa tecnología utilizada por la empresa Green lab se obtuvo un 26% de rentabilidad, encontramos que siete tratamientos superaron este 26,00 0 10 20 30 40 50 Kelpak 19,00 Fuente: Datos de campo del experimento Porcentaje 60 Amino Starter Tratamientos Evergreen 50,63 Rentabilidad Var Rosa Verde 48,90 (%) en la FASE II (Cultivo). Solución Nutritiva 68 GRÁFICO 12.- Representación gráfica de variedad Rosa Verde comparada con los bioestimulantes en la variable Análisis Financiero Amino Starter con esta variedad la rentabilidad disminuyó hasta 9,85%. 53,26%, comparando con el 26% de rentabilidad que se obtuvo con la Solución Nutritiva. En el caso de utilizar el bioestimulante dos productos superaron la eficiencia económica de la solución nutritiva, Kelpak generó una rentabilidad de 27,78% y Evergreen En el análisis por variedades de lechuga con los diferentes bioestimulantes y la solución nutritiva, se pudo observar claramente que 26,00 0 10 20 30 40 50 Kelpak Amino Starter Tratamientos Evergreen Solución Nutritiva Kelpak generó un 39,63% de retribución, 49,08% con Evergreen y 34,56% con Amino Starter. 69 en estudio superaron a la rentabilidad que generó la solución nutritiva estándar utilizada por la empresa Green lab; así tuvimos que Al analizar el comportamiento financiero de la variedad Romana con la utilización de bioestimulantes tuvimos que los tres productos Fuente: Datos de campo del experimento Porcentaje 60 39,63 Rentabilidad Var Romana 49,08 (%) en la FASE II (Cultivo). 34,56 GRÁFICO 13.- Representación gráfica de variedad Romana comparada con los bioestimulantes en la variable Análisis Financiero reducción de la rentabilidad hasta el 19.00%. utilización de Evergreen con un 50,63% de rentabilidad, y Amino Starter con el 48,90%. Pero la utilización de Kelpak generó una En lo que respecta al uso de los bioestimulantes con la variedad Rosa Verde, la mejor respuesta financiera se alcanzó con la 26,00 70 CAPITULO V CONCLUSIONES Y RECOMENDACIONES 5.1 CONCLUSIONES Finalizado el trabajo de investigación se establecen las siguientes conclusiones: • Al utilizar el bioestimulante Evergreen con la variedad Crispada se encontró un aumento significativo de la masa radicular (184,90 g.); con respecto a los otros bioestimulantes y variedades. Este efecto puede ser debido al balance de los componentes del producto, en cuanto a reguladores de crecimiento (auxinas, giberelinas y citoquininas), aminoácidos, vitaminas del complejo B, macro y microelementos. • Un efecto similar se observa en la variedad Rosa Verde con el bioestimulante Evergreen al aumentar la masa radicular. De la misma manera este efecto es notorio en la variedad Romana con el mismo bioestimulante ya que si se compara con el resto de productos el aumento es significativo en la masa radicular de las plántulas en la fase previa al transplante. • Comparando el desarrollo de la masa foliar en la fase de vivero previa al transplante, los efectos son diferentes en cuanto al uso de los bioestimulantes con las variedades de lechuga empleadas en el estudio. Así tenemos que la variedad Crispada mantiene un rendimiento superior del follaje cuando se utiliza Evergreen (176,72 g.); seguido de cerca de Kelpak (168,42 g.). Por el contrario cuando fueron aplicados los bioestimulantes en la variedad Rosa Verde el mayor desarrollo de la masa radicular se consigue cuando se aplica Amino Starter (206,48 g.), seguido de Evergreen (197,27 g.). Un efecto parecido se alcanza en el desarrollo de la masa foliar con Amino Starter con la variedad Romana (168,48 g.) al igual que la variedad Rosa Verde seguido de Evergreen (151,40 g.). • En la fase de cultivo el comportamiento que presentan las variedades de lechuga luego de ser aplicados los bioestimulantes en vivero, es diferente para cada una de ellas. Se alcanza la mayor masa foliar (peso unitario) con Evergreen y Rosa Verde con 1080,65 g. En cuanto a la variedad Crispada y Evergreen el peso promedio es de 793.88 g. y la variedad Romana con Evergreen alcanza un peso de 770,23 g. • Las diferencias de los pesos de masa foliar y radicular en vivero de las variedades de lechuga, son debidas principalmente a la naturaleza de las mismas y se puede comparar el efecto que generan los bioestimulantes cuando estos se comparan con la solución nutritiva, ya que la misma sólo proporciona a las plantas de macro y micronutrientes exclusivamente. • El diferente peso unitario a la cosecha se debe principalmente a la naturaleza varietal de las lechugas, puesto que sus estructuras externas presentan conformaciones distintas. • La variedad Rosa Verde es una variedad que desarrolló poca masa radicular, siendo normal obtener plántulas con un sistema radicular corto independientemente de la estimulación que se de a la misma. . 71 5.2 RECOMENDACIONES • Utilizar Evergreen ® como bioestimulante radicular, además de la solución nutritiva, por ser el bioestimulante que generó los valores más altos de masa radicular y foliar en la fase de vivero, además se lograron los mejores rendimientos a la cosecha. • Realizar una investigación en la que se utilice Evergreen ®, en diferentes dósis, para encontrar la cantidad adecuada de producto que además genere el mayor beneficio económico por unidad producida. • Implementar el uso de tela tipo zarán que permita la deflexión de luz ya que se pudo observar que la zona del pote que se encuentra expuesto a la luz en forma directa presenta una capa de coloración verde en el cual no se encuentra un desarrollo de raíz normal, mientras tanto en la parte del pote donde la raíz se encuentra bajo la cobertura vegetal se desarrolla de mejor manera. • Realizar otras investigaciones en las que se controlen las variaciones de temperatura y humedad relativa, entre el día y la noche, tanto en la fase de vivero como en la de cultivo. • Establecer un sistema de oxigenación de las soluciones nutritivas para evitar la degradación de los componentes de las mismas. • Llevar un control de las descargas de la solución nutritiva ya que si no tienen una regularidad en la inyección hacia las piscinas, se pueden presentar desordenes y pérdidas en las plántulas. • Evaluar el efecto de cada uno de los elementos necesarios para el desarrollo del cultivo, de acuerdo a las etapas fenológicas para determinar la dósis aplicar. • Probar la incidencia de los productos bioestimulantes en la fase de cultivo y medir su efecto en la calidad organoléptica y de conservación poscosecha. • Realizar un estudio en el que se analicen los efectos de los productos bioestimulantes en cultivos hidropónicos sometidos a stress por calor y fototoxicidad causada por nitratos. • Se recomienda un monitoreo constante de la calidad del agua utilizada para la fase de vivero y de cultivo con el objetivo de controlar la cantidad de sales disueltas, especialmente carbonatos y sulfatos, que pudiesen ser nocivos al cultivo. 72 • Establecer un sistema de monitoreo de la cantidad de nitratos presentes en la lechuga y mantener el nivel de los mismos en los parámetros establecidos por la legislación establecida en la norma para el consumo humano. • En la fase de poscosecha además del sistema de sanitización de las lechugas se recomienda envasarlas en una atmósfera con niveles mayores de CO2 con el fin de aumentar la vida poscosecha. • Probar los productos bioestimulantes en otros cultivos bajo el sistema hidropónico. 73 CAPITULO VI BIBLIOGRAFÍA CITADA • BBA BSA IGZ IVA AgrEvo BASF Bayer Novartis. 1996, Compendio para la identificación de los estadios fenológicos de especies mono - y dicotiledóneas cultivadas escala BBCH extendida versión. • Barceló, J. 1980, Fisiología Vegetal, Ediciones Pirámide, S.A. Madrid España • Bidwell, R.G.S. 1993, Fisiología Vegetal, AGT Editores México D.F. segunda reimpresión. • Ecological Consultants, Ltda.. Main Road Simona Town 7975 South Africa, PO Box 325 • Edmond, J. B. 1988, Principios de Horticultura, Compañía Editorial Continental, S.A. de C.V. México. • Espinal, D. 2001, Cultivo de Tejidos Vegetales y Propagación In Vitro Módulo Biotecnología Aplicada, Carrera de Ciencia y Producción Agropecuaria. El Zamorano. • Excel Ag, Corp. 9130 S. Datran Center, Suite 1607 Miami, Florida 33156, USA (305) 6681835. • Gordon, R. 1984, Horticultura A.G.T, Editor, S.A. México D.F. 74 • Little, T. M. 2001, Métodos Estadísticos para la Investigación en la Agricultura, Editorial Trillas S.A. de C.V. México D.F. • Pierik, R.L.M. 1990, Cultivo in Vitro de la Plantas Superiores, Ediciones Mundi Prensa Madrid España. • Resh, H.M. 2001, Cultivos Hidropónicos Nuevas Técnicas de Producción, Ediciones Mundi Prensa Madrid España. • Reyes, P. 1999, Diseño de Experimentos Aplicados, Editorial Trillas S.A. de C.V. México D.F. Tercera reimpresión. • Roca, M.W. et al 1991, Cultivo de Tejidos en la Agricultura, Centro Internacional de Agricultura Tropical, Cali Colombia. • SQM-Ecuador Av. Juan Tanca Marengo y Av. José Orrantia. Edif.. Executive Center, piso 3, Oficina 303 Guayaquil-Ecuador. sqme@impsat.net.ec • Valadez, H. A. 1994, Producción de Hortalizas, Editorial Limusa, S.A. de C.V. México D.F. • Vidalie, H. 1986, Cultivo in Vitro Editorial Científica, S.A. de C.V. México D.F. 1986 Información Internet 1 http://www.biologia-en-internet.com/default.asp?Id=0&Fs=0 2 http://www.uvademesa.cl/investigaciones 75 76 Anexo 1 DATOS DE CAMPO DEL EXPERIMENTO Peso de masa radicular FASE l Tratamientos R1 R2 R3 SUMA MEDIA T1 142,05 148,85 162,05 452,95 150,98 T2 183,10 187,25 184,35 554,70 184,90 T3 127,90 167,95 152,55 448,40 149,47 T4 153,20 176,90 167,95 498,05 166,02 T5 119,05 112,85 112,50 344,40 114,80 T6 206,50 121,75 124,95 453,20 151,07 T7 135,15 114,15 123,35 372,65 124,22 T8 111,90 121,50 110,90 344,30 114,77 T9 155,10 167,20 151,80 474,10 158,03 T10 163,05 182,70 200,50 546,25 182,08 T11 168,10 186,65 170,60 525,35 175,12 T12 170,60 126,90 146,45 443,95 147,98 SUMA 1835,70 1814,65 1807,95 5458,30 1819,43 MEDIA 152,98 151,22 150,66 151,62 Anexo 2 Peso de masa foliar FASE l Tratamientos R1 R2 R3 SUMA MEDIA T1 155,65 176,75 172,85 505,25 168,42 T2 191,40 176,60 162,15 530,15 176,72 T3 159,70 150,90 147,35 457,95 152,65 T4 159,00 145,85 165,75 470,60 156,87 T5 186,50 172,20 181,40 540,10 180,03 T6 204,35 196,90 190,55 591,80 197,27 T7 216,55 193,90 209,00 619,45 206,48 T8 159,85 191,45 173,95 525,25 175,08 T9 147,60 148,95 141,00 437,55 145,85 T10 144,85 167,30 142,05 454,20 151,40 T11 164,65 172,45 168,35 505,45 168,48 T12 144,50 143,70 138,70 426,90 142,30 SUMA 2034,60 2036,95 1993,10 6064,65 2021,55 MEDIA 169,55 169,75 166,09 168,46 Anexo 3 Peso de masa foliar FASE II Tratamientos R1 R2 R3 SUMA MEDIA T1 611,75 655,55 718,35 1985,65 661,88 T2 764,10 820,10 797,45 2381,65 793,88 T3 506,20 583,00 617,85 1707,05 569,02 T4 601,40 701,30 655,30 1958,00 652,67 T5 812,55 853,75 894,90 2561,20 853,73 T6 1269,00 936,70 1036,25 3241,95 1080,65 T7 1154,75 969,45 1080,50 3204,70 1068,23 T8 847,50 972,70 891,60 2711,80 903,93 T9 688,00 758,50 717,70 2164,20 721,40 T10 710,70 795,20 804,80 2310,70 770,23 T11 693,75 696,60 695,25 2085,60 695,20 T12 693,95 585,50 673,45 1952,90 650,97 SUMA 9353,65 9328,35 9583,40 28265,40 9421,80 MEDIA 779,47 777,36 798,62 785,15 77 Anexo 4. Distribución de los bloques y unidades experimentales FASE I FASE l DBCA A*B Bloque I (fertilización 1) T1R1 T5R3 T5R3 T9R2 T1R3 T9R3 T5R2 T1R2 T1R1 T9R1 T5R2 T9R3 T1R2 T5R1 T1R3 T9R1 T5R1 T9R2 Bloque III (fertilización 3) T7R1 T3R2 T11R1 T11R2 T3R1 T11R3 T7R3 T11R3 T7R3 T3R1 T7R2 T3R3 T3R3 T11R2 T7R2 T11R1 T7R1 T3R2 T6R3 T10R1 T2R1 T6R1 T6R2 T10R2 Bloque IV (fertilización 4) T10R1 T2R3 T6R1 T2R2 T6R3 T10R3 T6R2 T2R2 T10R2 T10R3 T2R3 T2R1 T8R2 T4R3 T12R3 T8R1 T8R3 T12R1 Bloque II (fertilización 2) T12R1 T4R3 T12R3 T4R1 T4R2 T4R1 T8R3 T12R2 T4R2 T8R1 T12R2 T8R2 78 Anexo 5. CRONOGRAMA DE ACTIVIDADES MES 1 MES 2 MES 3 MES 4 MES 5 MES 6 ACTIVIDAD 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 Planteamiento del Tema x Recopilación de bibliografía x X X Ordenamiento de la información Redacción Presentación del anteproyecto Aprobación del anteproyecto Arreglo de la Infraestructura Preparación de las bandejas Fertilización Riego Monitoreos Toma de datos Tabulación de datos Primer borrador Corrección del borrador Presentación del informe final Defensa de tesis x x x x x x x x x x X x x x X x x x x x x x x X x x X x x X x x x x x x x x x 79 Anexo 6. Presupuesto Presupuesto Detalle Unidad Cantidad Valor Total Infraestructura Invernadero Plástico m2 m2 200 150 3 1,8 Subtotal 600 270 870 Insumos Plántulas de lechuga Evergreen Kelpak AminoStarter Fertilizantes Inorgánicos Balanza Presurizador Manual Insecticidas Fungicidas Lt Lt Lt 760 1 1 1 1 1 1 0,01 11 13 9,8 36 35 Lt Lt Subtotal Oficina Computador Cámara fotográfica Impresiones Rotulación Empastado Copias Trípticos CDs Hojas Cartucho de Impresora Humanos Jornales Asesoría 7,6 11 13 9,8 36 0 35 0 0 112,4 horas fotos 50 25 500 36 3 400 15 6 500 3 0,35 0,25 0,06 0,15 28 0,02 0,6 1,5 0,03 14 Subtotal 17,5 6,25 30 5,4 84 8 9 9 15 42 226,15 Días 33 5 165 600 765 80 45 80 45 125 Subtotal Otros Movilización Alimentación 1 1 Subtotal SUBTOTAL IMPREVISTOS 10% TOTAL 2098,55 209,855 2308,405 80 4