Comision Noche - materias.unq.edu.ar
Anuncio

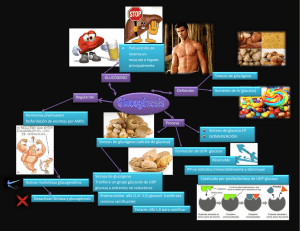
Bioquímica II – TP. Nº 2 – síntesis de glucógeno Última Modificación 26/10/2012 UNIVERSIDAD NACIONAL DE QUILMES BIOQUÍMICA II TRABAJO PRÁCTICO N° 2 : SÍNTESIS 1. DE GLUCÓGENO Objetivos. a. Estudiar la síntesis de glucógeno por bacterias de Escherichia coli DH5 en distintos medios de cultivo. b. Verificar el fenotipo bacteriano mediante la utilización de distintas fuentes de carbono. 2. Procedimiento. a. Día Uno (Docentes) i. Preparación Del Cultivo Inicial de E. coli DH5. Se inocula un medio de cultivo líquido LB (Luria-Bertani) con bacterias de Escherichia coli DH5, las cuales se encuentran guardadas a -20°C con criopreservante (glicerol 20%). Se crece este cultivo toda la noche hasta saturación a 37°C y 200 rpm. Composición del medio de cultivo LB Extracto de levadura 5 g/l Triptona ó Peptona 10 g/l NaCl 5 g/l b. Día Dos (Un Alumno Por Grupo) i. Preparación De Los Medios de Cultivo. Cada medio de cultivo de prueba se siembra con un inóculo de bacterias, que se obtiene a partir de una alicuota de 400 µl del cultivo del día anterior. Se centrifuga a 14.000 rpm en microcentrífuga durante 1 minuto, para eliminar el medio rico. Finalmente, se lava el pellet bacteriano dos veces con NaCl 0,85 %. Luego de inoculados los medios se hacen crecer 16 hs a 37ºC con agitación (200 rpm), durante la noche. 1. Composición de los Medios de Prueba. Los medios de prueba a utilizarse tienen la siguiente composición (en mg/ml) y un volumen final de 20 ml. Componentes Concentración Fuente de carbono Fuente de nitrógeno Na2SO4 Buffer fosfato Tiamina Micronutrientes: MgCl2.6H2O FeCl3 MnCl2.4H2O CaCl2.2H2O CuCl2.2H2O CoCl2.2H2O Na2MoO4.2H2O Borax Ver FC Ver FN 100 mg/l 0,05 M pH 7,0 1mM 20 mg/l 2 mg/l 2 mg/l 1 mg/l 0,2 mg/l 0,1 mg/l 0,1 mg/l 0,05 mg/l FC (Fuente de Carbono) Medio Medio Medio Medio I y II: glucosa: 1,98 mg/ml III: lactosa: 1,88 mg/ml IV: acetato de sodio: 3,6 mg/ml V: ribosa: 1,98 mg/ml FN (Fuente de Nitrógeno) Medio I, III, IV, V: Medio II: Página 1 NH4Cl: 180 g/ml NH4Cl: 18,0 mg/ml Bioquímica II – TP. Nº 2 – síntesis de glucógeno Última Modificación 26/10/2012 2. Distribución de Medios por Grupo. Se prepararán réplicas(R) cada medio. La cantidad de réplicas para los medios que cada grupo debe preparar se detallan en la siguiente tabla. Medio I Medio II Medio III Medio IV Medio V Grupo 1 Réplica 1 Réplica 1 Réplica 1 Grupo 2 Réplica 2 Réplica 2 Réplica 2 Grupo 3 Réplica 3 Réplica 3 Grupo 4 Réplica 4 Réplica 4 Réplica 1 Réplica 2 Grupo 5 Réplica 5 Réplica 5 Réplica 2 Réplica 1 3. Recetas de los Medios. Reactivos Medio I Na2SO4 100 g/l 20 l ◊◊◊◊◊ 20 l ◊◊◊◊◊ 20 l ◊◊ 20 l Micronutrientes 1000X 20 l ◊◊◊◊◊ 20 l ◊◊◊◊◊ 20 l ◊◊ FeCl3 1000X 20 l ◊◊◊◊◊ 20 l ◊◊◊◊◊ 20 l ◊◊ Buffer fosfato 0,5 M 2 ml ◊◊◊◊◊ 2 ml ◊◊◊◊◊ 2 ml ◊◊ Glucosa 180 g/l Medio II Medio III Medio IV 220 l ◊ ◊ ◊ ◊ ◊ 220 l ◊ ◊ ◊ ◊ ◊ Medio V ◊◊ 20 l ◊◊ 20 l ◊◊ 20 l ◊◊ 20 l ◊◊ 20 l ◊◊ 2 ml ◊◊ 2 ml ◊◊ 265 l ◊◊ - Lactosa 10 g/l Acetato de sodio 30 g/l Ribosa 150 g/l - - - - - - - - NH4Cl 180 g/l 20 l ◊◊◊◊◊ 2 ml ◊◊◊◊◊ 20 l ◊◊ 20 l ◊◊ 20 l ◊◊ Tiamina 260 X 76 l ◊◊◊◊◊ 76 l ◊◊◊◊◊ 76 l ◊◊ 76 l ◊◊ 76 l ◊◊ H2O estéril Volumen Total c. Día Tres 3,8 ml ◊ ◊ 2,4 ml ◊ ◊ 17,6 ml ◊ ◊ ◊ ◊ ◊ 15,6 ml ◊ ◊ ◊ ◊ ◊ 14,0 ml ◊ ◊ 17,5 ml ◊ ◊ 17,5 ml ◊ ◊ 20 ml ◊◊◊◊◊ 20 ml ◊◊◊◊◊ 20 ml ◊◊ 20 ml ◊◊ 20 ml ◊◊ (Todos) i. Determinación Del Número de Bacterias. Debido a que el crecimiento será desigual en los distintos medios, es necesario conocer el número de bacterias antes de hacer las determinaciones de glucógeno. Esto se lleva a cabo en forma rápida mediante la medida de turbidez (densidad óptica) y por recuento en placa. 1. Estimación por Densidad Óptica. La determinación de la DO se realiza en un espectrofotómetro leyendo a 600 nm. Para ello, debe hacerse una dilución del medio de cultivo de modo que el valor leído se encuentre entre 0,1 y 1,0. En este rango nos aseguramos que la relación entre el número de bacterias y la DO sea lineal. Luego se toma un volumen equivalente a 4 unidades de DO para cada uno de los medios. (Vol [ml] = 4 / DO medida). El volumen equivalentes a 4 DO significa el volumen del medio de cultivo que tiene una cantidad de bacterias tal que si se encontraran en una suspensión de 1ml, esta tendría una densidad óptica de 4 unidades de DO. El objetivo de realizar esta medición es normalizar, aunque sea de manera aproximada, la cantidad de bacterias a procesar posteriormente. Página 2 Bioquímica II – TP. Nº 2 – síntesis de glucógeno Última Modificación 26/10/2012 DO Dilución 600 DO 600 Corregida Volumen 4 DO MI - R1(G1) MI - R2(G2) MI - R3(G3) MI - R4(G4) MI – R5(G5) MII - R1(G1) MII - R2(G2) MII - R3(G3) MII - R4(G4) MII – R5(G5) MIII - R1(G1) MIII - R2(G2) MIV - R1(G3) MIV – R2(G4) MV - R1(G5) MV - R2(G1) 2. Recuento de Unidades Formadoras de Colonias en Placas de Petri. Muestras diluidas de los medios de cultivos de prueba en esterilidad con NaCl 0,85% se plaquean en medio LB sólido para obtener recuentos de unidades formadoras de colonia (UFC). De cada medio se sembrarán 100 µl de tres diluciones diferentes, por duplicado. Las diluciones correspondientes a cada medio se muestran en la siguiente tabla. Los duplicados a sembrar se realizan en series de diluciones seriadas independientes. Recuerde que para preparar cada una de las diluciones de la serie debe agitar la suspensión de bacterias antes de tomar y luego de depositar la alícuota. Una forma de asegurase el correcto mezclado de la suspensión cuando deposita la alícuota con bacterias es mezclar al menos siete veces con la micropipeta, subiendo y bajando el émbolo con cuidado. Medios Medio I Medio II Medio III Medio IV Medio V 1,0 1,0 1,0 1,0 1,0 x x x x x 10-4 10-5 10-4 10-4 10-4 Diluciones 1,0 x 10-5 1,0 x 10-6 1,0 x 10-5 1,0 x 10-5 1,0 x 10-5 1,0 1,0 1,0 1,0 1,0 x x x x x 10-6 10-7 10-6 10-6 10-6 ii. Separación Del Glucógeno. A partir del volumen equivalente a 4 unidades de DO para cada medio, se extrae el glucógeno contenido en las bacterias. Cuando el volumen de 4 DO supere a los 10 ml se tomaran 10 ml. El procedimiento consiste de dos etapas, la primera de ellas es una lisis celular en un medio alcalino en caliente para obtener una hidrólisis casi completa del material celular. El glucógeno es resistente a esta hidrólisis y permanece en solución sin degradarse. La segunda etapa consiste en la precipitación del glucógeno con etanol, en el cual el glucógeno es insoluble. 1. Protocolo De Extracción De Glucógeno. Se toman alícuotas de los distintos medios, cuyo volumen equivalga a 4 unidades de DO a 600 nm y se centrifugan en microcentrífuga 1 min. a 14.000 rpm. Cuando el volumen supera los 1,5 ml conviene utilizar varios tubos de 1,5 ml en simultáneo o centrifugar en tubos cónicos de 15ml. En el primer caso, los pellets deben resuspenderse en un pequeño volumen y pasar el contenido a un único tubo de 1,5 ml. Los tubos deben estar equilibrados al centrifugar. Cada pellet se resuspende en NaCl 0,85% y se centrifuga nuevamente, en las mismas condiciones, para lavar las bacterias. El lavado se realiza por duplicado. Cada pellet se resuspende en 50 ul de H2O, luego se agrega 0,25 ml de KOH 50% y se hierve 45 min. CUIDADO: EL KOH QUEMA LA PIEL. Se deja enfriar y se agrega a cada tubo 0,75 ml de etanol 96% preenfriado. Se deja reposar en baño de hielo 10 min. Página 3 Bioquímica II – TP. Nº 2 – síntesis de glucógeno Última Modificación 26/10/2012 Se centrifuga en microcentrífuga 10 min. a 14.000 rpm y se elimina el sobrenadante con micropipeta (EN ESTA ETAPA ES POSIBLE QUE UD. NO VEA EL PELLET Y CREA QUE LO PERDIÓ. ¡¡¡NO SE PREOCUPE!!! ES FRECUENTE QUE EL PELLET NO SE VEA, PERO ESTÁ). Conviene retirar la mayor cantidad de líquido posible para acelerar el secado del pellet. Se seca el pellet en un bloque térmico. Se resuspende cada pellet en 0,1 ml de agua bidestilada. d. Día Cuatro (Todos) i. Determinación De La Concentración De Glucógeno. 1. Curva De Calibración. Para poder estimar la concentración de glucógeno en la muestra se debe construir una curva de calibración. Para ello se realizan distintas diluciones de un patrón de glucosa 100 mg/ml, para obtener muestras que contengan entre 1 y 25 µg de glucosa cada 250 ul. A cada uno, se le hace la reacción de antrona. Realice, a partir de la solución patrón de glucosa (100 mg/ml) una dilución 1:1000, por medio de tres diluciones 1:10 en serie para obtener una solución patrón secundaria de 3ml cuya concentración es 100 µg/ml. Tome de esta solución 10 µl para el punto de 1 µg de glucosa de la curva de calibración, 30 µl para el punto de 3 µg de glucosa de la curva de calibración, etc. Para el último punto (25 µg) tome 250 µl. En los casos que sea necesario complete a 250 µl totales con agua bidestilada. Protocolo De La Reacción De Antrona. Se toman 25 µl del resuspendido de cada medio y se llevan a 0,25 ml con agua bidestilada. Esto se hace por duplicado. (Para las curvas de calibración se obvia esta dilución y se sigue con el próximo paso tomando 0,25 ml de las soluciones de la curva de calibración) Se agrega a cada tubo 0,5 ml de solución de antrona al 0,2% en ácido sulfúrico 95% (Ojo con el ácido) lentamente, sobre la pared del tubo y dentro de un baño de hielo. (Cuidado: La reacción es exotérmica. Nunca agregue el ácido sobre el agua en forma violenta. Nunca agregue el agua sobre el ácido, porque se producirán proyecciones de agua con ácido. Recuerde la máxima: Al sulfúrico no le gusta que lo mojen). Se mezcla bien y se lleva a un baño en ebullición durante 10 min. Se deja enfriar unos minutos y se lee la absorbancia a 630 nm (los positivos dan un color verdoso, los negativos, amarillo). Las mediciones se realizan en un lector de placas para ELISA, para ello deben sembrarse 300 ul de cada reacción y de cada punto de la curva de calibración, por duplicado, en una placa de 96 wells, como se muestra en la tabla. Curva 0 1 3 5 8 10 13 15 18 20 23 25 Curva 0 1 3 5 8 10 13 15 18 20 23 25 Curva 0 1 3 5 8 10 13 15 18 20 23 25 0 1 3 5 8 10 13 15 18 20 23 25 Curva Muestra Muestra Muestra Muestra Reacc. 1 Reacc. 2 MI R1 MII R1 MI R2 MII R2 MI R3 MII R3 MI R4 MII R4 MI R5 MII R5 MI R1 MII R1 MI R2 MII R2 MI R3 MII R3 MI R4 MII R4 MI R5 MII R5 MI R1 MII R1 MI R2 MII R2 MI R3 MII R3 MI R4 MII R4 MI R5 MII R5 MI R1 MII R1 MI R2 MII R2 MI R3 MII R3 MI R4 MII R4 MI R5 MII R5 Grupo 1 Grupo 2 Grupo 3 Curva 0 1 3 5 8 10 13 15 18 20 23 25 Curva 0 1 3 5 8 10 13 15 18 20 23 25 Curva 0 1 3 5 8 10 13 15 18 20 23 25 Curva 0 1 3 5 8 10 13 15 18 20 23 25 Muestra Muestra Muestra Muestra Reacc. 1 Reacc. 2 Grupo 4 Grupo 5 MIII R1 MV R2 MIII R2 MIV R1 MIV R2 MV R1 MIII R1 MV R2 MIII R2 MIV R1 MIV R2 MV R1 MIII R1 MV R2 MIII R2 MIV R1 MIV R2 MV R1 MIII R1 MV R2 MIII R2 MIV R1 MIV R2 MV R1 Grupo 1 Grupo 2 Grupo 3 Página 4 Grupo 4 Grupo 5 Bioquímica II – TP. Nº 2 – síntesis de glucógeno Última Modificación 26/10/2012 ii. Recuento En Placa. Se realizará el conteo de las colonias que han sido sembradas el día tres. Se debe tener en cuenta que los valores más confiables son aquellos que se encuentran entre 30 y 300 colonias. Conteo 10-3 10-3 10-4 10-4 10-5 10-5 10-6 10-6 10-7 10-7 UFC/ml MI - R1(G1) MI - R2(G2) MI - R3(G3) MI - R4(G4) MI – R5(G5) MII - R1(G1) MII - R2(G2) MII - R3(G3) MII - R4(G4) MII – R5(G5) MIII - R1(G1) MIII - R2(G2) MV - R1(G3) MV – R2(G4) MIV - R1(G5) MIV - R2(G1) 3. Presentación del Informe y Discusión de Conceptos Teóricos. Cada grupo de trabajo deberá entregar un informe del trabajo práctico en formato paper según las indicaciones que se encuentran en la guía de redacción de informes de laboratorio, que se encuentran en la página web de la materia. Los resultados de todos los grupos deben estar presentes en cada informe. Es por ello que cada grupo debe proveer sus datos a los demás grupos. Es importante asignar el contenido de cada sección (introducción, materiales y métodos, etc) del informe correctamente. Es muy frecuente confundir materiales y métodos con resultados y estos con la discusión. Cada figura que utilicen debe incluir una leyenda, la cual contiene el título y un texto informativo. Además debe ser citada desde el texto. La longitud máxima permitida para el trabajo se detalla a continuación: Texto: (Introducción, Métodos, Resultados, Discusión y leyendas de figuras, excluyendo referencias y tablas): 2500 palabras Número combinado de tablas y figuras: 6 (seis). Resumen: Extensión máxima de 250 palabras Longitud Total Combinada: No más de dos hojas A4 impresas a doble faz. No hay restricciones en el número de referencias. En la Introducción del informe de este trabajo práctico debe hacer una breve explicación del fundamento de la reacción de antrona y del comportamiento del glucógeno frente a los distintos tratamientos que se realizan durante el trabajo práctico. Además de aquellos otros conceptos que considere convenientes. La sección Materiales & Métodos debe contener al menos estas subsecciones: Preparación de los medio de cultivo de prueba. Determinación del número de bacterias. Purificación del glucógeno. Cuantificación de la concentración de glucógeno usando la reacción de Antrona. La sección Resultados debe contener al menos estas subsecciones: Efecto de la disponibilidad de NH4+ en el crecimiento bacteriano y la acumulación de glucógeno. Diferencias en el crecimiento de E. coli DH5- con distintas fuentes de carbono. Página 5 Bioquímica II – TP. Nº 2 – síntesis de glucógeno Última Modificación 26/10/2012 Eficiencia de la acumulación de glucógeno utilizando distintas fuentes de carbono. Para todos los medios debe informar: DO, volumen de medio de cultivo usado en la extracción, recuento de bacterias viables, la relación UFC/DO, y la masa de glucógeno acumulada por DO y por UFC. Además debe mostrar la(s) curva(s) de calibración usadas en la reacción de antrona. Estos datos deben estar presentes en la(s) subsección(es) adecuadas de Resultados. En la sección Discusión del informe de este trabajo práctico deben relacionarse los resultados con respecto a la glucólisis, glucogenogénesis, ciclo de pentosas fosfato. Deberán también discutir acerca de las condiciones energéticas en las que funcionaran estas vías y de las condiciones metabólicas de las bacterias creciendo en cada uno de los medio utilizados. Para poder comparar los resultados obtenidos entre los distintos medios, estos deben tener normalizada la fuente de carbono utilizada (misma masa, misma concentración u otro factor). Cuando describa ó discuta la preparación de los medios debe indicar como fue esta normalización, para ello analice la composición de cada uno de ellos y la vía de metabolización de las fuentes de carbono correspondientes. Cuando quiera describir los procedimientos usados, debe tener en claro de que no debe hacer copia de texto, ni de tablas de esta guía de trabajos prácticos. Si desea redactar algún procedimiento, hágalo de forma precisa y sin extenderse demasiado. Deje en claro los puntos que deben ser importantes para el lector. Evite usar referencias internas, como por ejemplo. "el grupo 12" ó el "tubo 23", que sólo conoce ud. y sus compañeros de trabajo. Es conveniente redactar el informe de este trabajo considerando que el potencial lector No es Docente del Curso y que por ello no debe saber que es lo que se hizo en el trabajo práctico. Sea lo suficientemente claro para que él pueda reproducir sus experimentos y, con un poco de suerte, llegar a sus mismos resultados. Página 6