Boletín informativo sobre medicamentos
Anuncio

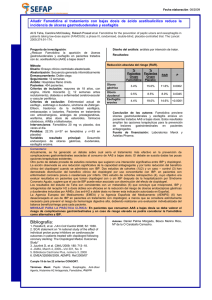
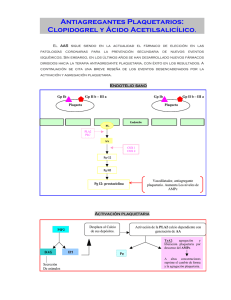
Boletín informativo sobre medicamentos BIM Nº1 Editorial Fecha: Abril 2010 A través del Boletín Informativo sobre Medicamentos, el Ministerio de Salud establece, una fluida comunicación con los equipos de la provincia de Santa Fe. En este instrumento se plasmarán los principales aspectos vinculados al uso racional del medicamento y a la seguridad de los pacientes; se incluirán noticias relacionadas con la gestión del medicamento en nuestra red, se difundirán las propuestas y asesorías de la Comisión Provincial del Medicamento, noticias de los laboratorios públicos LIF y LEM y del intercambio y articulación de su producción. Asimismo, se publicarán artículos científicos con actualización de la información sobre drogas de uso frecuente en nuestros servicios, como también temáticas vinculadas a este campo, propuestas por los profesionales de la salud. Esperamos que este espacio se convierta en una herramienta útil para mejorar la comunicación entre los equipos, lo que redundará en una mejor atención de nuestros pacientes. Comisión Provincial de Medicamentos En el año 2008, el Ministerio de Salud de Santa Fe, pone en vigencia un nuevo Formulario Terapéutico Provincial, renovado tanto en lo referente a su listado de medicamentos como a su implementación. Paralelamente se constituye la Comisión Provincial del Medicamento, constituida por profesionales que cumplen con la función de asesorar en todo lo relativo al uso de medicamentos en la provincia. En el año 2009, por Resolución Ministerial 433/09, se aprueban las normativas técnicas para la implementación del FTP, ocasión en que la Dirección Provincial de Farmacia, Bioquímica y DC es designada como el organismo responsable de hacer conocer fehacientemente las citadas normativas técnicas y su aplicación. La modalidad de trabajo de esta Comisión, consiste en recibir las solicitudes de medicamentos de los distintos efectores de Salud, las que son clasificadas en función de la categorización del medicamento y respecto de su inclusión o no en el FTP. Una vez clasificadas, son evaluadas por la Comisión y luego se emite respuesta al efector. Hasta la fecha se ha registrado un número de 1098 intervenciones. Se pueden observar en el gráfico las distintas categorías: LIF SE - Nueva presentación del producto Enalapril 10 Desde marzo de 2009 se puede disponer de Enalapril 10 mg. en un blister alu-alu (aluminio-aluminio), el cual favorece a la conservación del producto. Esta iniciativa forma parte de las actividades incluidas dentro del programa de mejora de la calidad, las cuales se desarrollan en el Laboratorio Industrial Farmacéutico, sociedad del Estado. Esta nueva presentación se elabora en un área de producción que se encuentra controlada “psicrometricamente” (temperatura y humedad) en todo el proceso productivo: desde la pesada hasta el envasado del producto, lo que asegura contar con un producto que cumple con los parámetros de calidad actuales. Desde el inicio de este proceso hasta la obtención del producto terminado, se realizan análisis de las características físicas y químicas del mismo con el fin de verificar que posea todas las cualidades descriptas en Farmacopea. Además, entre los lotes producidos, es seleccionado un lote de cada veinte, el cual permanecerá en el sector Estabilidad del LIF. Este Lote es analizado durante toda su vida útil, basado en un cronograma estipulado por ANMAT, asegurando así el cumplimiento de las especificaciones durante todo este tiempo. Página 1 Boletín informativo sobre medicamentos Provision centralizada de medicamentos de uso crónico A fines del año 2009 se realizó una gestión de compra de medicamentos en la cual se han incorporado excepcionalmente, rubros que no se suministraban desde el nivel central y que serán entregados por Droguería Central según la logística habitual. Los medicamentos adquiridos pertenecen a distintos grupos terapéuticos, a saber: vasodilatadores coronarios, antiarrítmicos, anticonvulsivantes, antiparkinsonianos y ansiolíticos. Se detallan en la siguiente tabla, los medicamentos mencionados: Acido Valproico 200 mg. comprimidos Amiodarona 200 mg. comprimidos Fenitoína 100 mg. capsulas Acido Valproico 400 mg. comprimidos Carbamacepina 200 mg. comprimidos Levodopa/Carbidopa 250mg./25mg. Comp. Acido Valproico 250mg./5ml jarabe Clonazepam 0.5 mg. comprimidos Nifedipina Retard 20 mg. comprimidos Actualización sobre medicamentos Posible interacción del clopidogrel con inhibidores de la bomba de protones (IBP) El clopidogrel es un antiagregante plaquetario indicado en la prevención de acontecimientos aterotrombóticos en pacientes que han sufrido recientemente un infarto agudo de miocardio, un infarto cerebral o que padecen enfermedad arterial periférica establecida; así como, junto a ácido acetilsalicílico en aquellos que presentan un síndrome coronario agudo. Los IBP están indicados en el tratamiento y prevención de la úlcera gastroduodenal y de sus complicaciones, entre ellas, la hemorragia digestiva alta. Dado que el uso de clopidogrel incrementa el riesgo de hemorragia digestiva alta, es frecuente la utilización concomitante de IBP para prevenir este tipo de complicaciones en pacientes con factores de riesgo, como son aquellos con antecedentes de úlcera péptica o de hemorragia digestiva alta, edad avanzada, o uso concomitante de antiinflamatorios no esteroideos, o ácido acetilsalicílico. Recientemente se han publicado diversos estudios en los que se pone de manifiesto que los IBP podrían reducir la actividad antiagregante de clopidogrel y que esta interacción conllevaría un mayor riesgo de sufrir acontecimientos cardiovasculares de tipo aterotrombótico y en particular, de reinfarto o recurrencia de un síndrome coronario agudo. Aunque este incremento de riesgo resulta moderado en términos relativos (en torno al 27%), podría tener gran relevancia para la salud pública dada la alta prevalencia del síndrome coronario agudo y el amplio uso de clopidogrel. Sin descartar la existencia de otros mecanismos, es posible que la interacción pueda explicarse por la reducción de la transformación de clopidogrel en su metabolito activo mediante la inhibición de la isoenzima CYP2C19 del citocromo P450. Otras drogas también son inhibidoras potentes de la enzima CYP2C19, por lo cual, podría esperarse un efecto similar y deberían ser evitadas en combinación con clopidogrel; entre ellas se pueden citar: cimetidina, fluconazol, ketoconazol, voriconazol, felbamato, fluoxetina, fluvoxamina, ticlopidina. Otros factores pueden ser responsables de una reducción del efecto clínico de clopidogrel. En concreto, el CYP2C19 está sujeto a polimorfismo genético, registrándose casos de individuos considerados metabolizadores lentos de clopidogrel que no convierten eficazmente clopidogrel en su metabolito activo. Entretanto se completa la evaluación, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) recomienda a los profesionales lo siguiente: • En pacientes en tratamiento con clopidogrel, se desaconseja el uso de inhibidores de bomba de protones, a menos que se considere estrictamente necesario para prevenir el riesgo de hemorragia digestiva alta, para lo cual deberá realizarse una evaluación individualizada del balance beneficio/riesgo para cada paciente. • Con los datos actualmente disponibles no se puede concluir que alguno de los IBP pueda estar exento de esta posible reducción de la actividad antiagregante de clopidogrel y son necesarios más estudios. Referencias: 1-“Posible interacción del clopidogrel con inhibidores de la bomba de protones”. Agencia Española de Medicamentos y Productos Sanitarios. Junio/2009. www.agemed.es 2-“Potential interaction of Proton Pump Inhibitors (PPIs) with Plavix Potential interaction of Proton Pump Inhibitors (PPIs) with Plavix (clopidogrel)”. 14/08/2009 Health Canada. www.hcsc.gc.ca 3- “Clopidogrel. Possible interaction between clopidogrel and proton pump inhibitors”. WHO Pharmaceuticals Newsletter. Nº 4, 2009. www.who.int 4- “Clopidogrel and omeprazole: reduced effectiveness. WHO Drug Information” Vol 23, Nº 4, 2009. www.who.int 5- “Food and Drug Administratio, Medwatch, 17 november 2009”. www.fda.gov/Drugs/DrugSafety Página 2 Boletín informativo sobre medicamentos Aciclovir. Ficha técnica e Indicaciones. Categoría: Antiviral Mecanismo de acción: Es un análogo sintético de un nucleósido purínico que tiene actividad antiviral esencialmente ante los herpes virus. Es convertido por la timidinoquinasa viral en aciclovir monofosfato que luego es convertido en aciclovir trifosfato, el cual interviene en la actividad de la ADN polimerasa del herpes virus e inhibe la replicación del ADN viral. El aciclovir es captado preferentemente por las células infectadas por el virus del herpes simple que lo convierten selectivamente en el trifosfato activo, por lo cual, es menos tóxico para las células no infectadas. Absorción: Biodisponibilidad oral 20%, disminuye con el aumento de la dosis y no es afectada significativamente por los alimentos. Unión a proteinas plasmáticas: Baja: 9-33%. Biotransformación: Hepática <15%. El único metabolito que se ha identificado es el 9carboximetoximetilguanina, sin actividad antiviral. Vida media: Oral: 2,5 3,3 horas Parenteral: Neonatos 0-3 meses: 4 horas; Niños 0-18 años: 2,6 horas; Adultos: 2,5 horas. Insuficiencia renal: Cl Cr > 80 ml/': 2,5 h; Cl Cr 50 –80 ml/':3 h; Cl Cr 15 –50 ml/':3.5 h; Anuria: 19.5 hs; Hemodiálisis: 5.7 hs Eliminación: Renal, por filtración glomerular y secreción tubular. Parenteral: 60-90% del fármaco no metabolizado; oral: 14% del fármaco no metabolizado. Distribución: Amplia en los tejidos y líquidos corporales, incluyendo L.C.R., leche materna, líquido amniótico y placenta. Embarazo/lactancia: Factor de riesgo fetal (F.R.F.): B. Lactancia permitida. Uso en pediatría: Seguridad y eficacia no adecuadamente establecidas en menores de 2 años. Uso en geriatría: No se han identificado respuestas diferentes en los pacientes ancianos. Se recomienda comenzar el tratamiento con la mínima dosis efectiva considerando la mayor frecuencia de disfunción renal, otras enfermedades o tratamientos concomitantes. Alteraciones de laboratorio: • Aumento de la urea • Aumento de la creatinina • Tests de función hepática Contraindicaciones: • Hipersensibilidad al aciclovir o al valaciclovir Precauciones: • Deshidratación • Disfunción renal • El aciclovir endovenoso debe administrarscon precaución en pacientes con alteracionesneurológicas subyacentes, con hipoxia significativas o anormalidades electrolíticas o hepáticas graves. El paciente debe estar adecuadamente hidratado y la infusión se debe realizar durante más de una hora. Monitoreo del paciente: Uremia y creatinina (antes y durante la terapia endovenosa). Efectos adversos: • Más frecuentes: disturbios gastrointestinale pérdida del apetito, náuseas, vómitos), fatiga, cefalea, rash, flebitis o inflamación en el sitio de inyección (endovenoso) • Menos frecuentes: anemia, leucocitosis, neutropenia, trombocitopenia, trombocitosis, hematuria, urticaria, diarrea, dolor abdominal, taquicardia. • Raros: encefalopatía (endovenoso), temblores, alucinaciones, convulsiones, coma, confusión, anafilaxia, aumento de las transaminasas, fiebre, edema periférico, eritema multiforme, necrólisis epidérmica tóxica, síndrome de Stevens Johnson La infusión rápida del aciclovir EV puede causar insuficiencia renal aguda, especialmente si el paciente recibe otras medicaciones nefrotóxicas, no está adecuadamente hidratado o presenta una insuficiencia renal. Dosis: Virus Herpes Simple (Tipos 1 y 2) • Parálisis de Bell: 400 mg.- 5 dosis/día durante 10 días V.O. • Genital: Primaria: 200 mg.– 5 dosis/día durante 10 días V.O. ó 400 mg. cada 8 horas durante 7 a 10 días V.O. (No impide recidivas) Recurrente: (< 6 episodios/año) 400 mg. cada 8 horas por 5 días V.O. u 800 mg cada 8 horas por 2 días V.O. Recurrente: supresión crónica (> 6 episodios/año) 400 mg cada 12 horas hasta 12 meses V.O. • Mucocutáneo: Labial oral: Huésped normal: 400 mg – 5 dosis/día por 5 días V.O. Iniciar tratamiento con síntomas prodrómicos (hormigueo, ardor) antes de las lesiones Labial oral o genital: Huésped inmunocomprometido: 5 mg/kg cada 8 horas o 250 mg/m2 (infusión en 1 hora) cada 8 horas por 7 días E.V. 400 mg – 5 dosis/día por 14 a 21 días V.O. • Gingivoestomatitis, primaria (niños): 15 mg/kg 5 dosis/día por 7 días V.O. • Encefalitis: 10 mg/kg (infusión en 1 hora) cada 8 horas por 14 a 21 días E.V. Hasta 20 mg/kg cada 8 horas en niños < 12 años Virus Herpes Zoster: • Huésped normal: 800 mg – 5 dosis/día por 7 a 10 días V.O. Iniciar tratamiento dentro de las 72 horas de aparición del exantema • Huésped inmunocomprometido: Severo (mayor a 1 dermatoma, nervio trigémino o diseminado): 10 a 12 mg/kg (infusión en 1 hora) cada 8 horas durante 7 a 14 días E.V. Pacientes mayores: 7,5 mg/kg cada 8 Página 3 Boletín informativo sobre medicamentos horas durante 7 a 14 días E.V. No severo: 800 mg. – 5 dosis/día por 7 días V.O. Virus Varicela Zoster • Huésped normal: Niños 2 a 12 años: 20 mg/kg cada 6 horas por 5 días V.O. Iniciar dentro de las 24 horas de aparición del exantema. Dosis límite: 800 mg/dosis. Adolescentes, adultos jóvenes: 800 mg–5 dosis/día por 5 a 7 días V.O. Iniciar dentro de las 24 horas de aparición del exantema. Embarazo (3er trimestre), neumonía: 800 mg – 5 dosis/día por 5 días V.O. 10 mg/kg cada 8 horas (infusión en 1 hora) por 5 días E.V. • Huésped inmunocomprometido: 10 a 12 mg/kg o 500 mg/m2 (infusión en 1 hora) cada 8 horas por 7 días E.V. Iniciar dentro de las 24 horas de aparición del exantema. Modificación de dosis en insuficiencia renal: Vía EV: Cl de creatinina (ml/'/1.73 m2) Porcentaje de dosis usual Intervalo > 50 100 % 8 hs 25-50 100 % 12 hs 10 -25 100 % 24 hs 0-10 50 % 24 hs Dosis usual Dosis ajustada Vía oral: Cl de creatinina (ml/'/1.73 m2) 10-25 800 mg c/4 hs (5 dosis/día) 800 mg c/8 hs 0-10 800 mg c/4 hs (5 dosis/día) 800 mg c/12 hs 0-10 400 mg c/12 hs 200 mg c/ 12 hs 0-10 200 mg c/4 hs (5 dosis/día) 200 mg c/ 12 h Interacciones: (A: aciclovir / B: droga interactuante) • Acido valproico, fenitoina (disminuyen concentraciones plasmáticas de B) • Micofenolato (aumenta concentraciones plasmáticas de A, por inhibición de la secreción tubular renal) • Probenecid (aumenta concentraciones plasmáticas de A) • Tizanidina (aumenta concentraciones plasmáticas de B, sedación, hipotensión) • Vacuna antivaricela (disminuye la efectividad de B) • Zidovudina (aumenta letargia y fatiga) Profilaxis postexposición para varicela: a) Inmunoprofilaxis: • VZIG (Inmunoglobulina hiperinmune contra vari- cela): disminuye el riesgo de infecciones severas, puede prolongar el período de incubación. Debe aplicarse dentro de las 96 hs de la exposición. Dosis: 1 ml/kg EV (Varitect*) • Inmunoglobulina estándar EV: Dosis: 200 a 400 mg/kg/dosis (los pacientes que reciben Ig estándar no necesitan VZIG Indicaciones: • Inmunodeficiencias 2ª con afectación celular • Cáncer y transplante de órganos, tratamiento quimioterápico, corticoides o radiación • Infección por VIH • Quemados, enfermedad fibroquística • Embarazada susceptible • Pretérminos > 28 sem de gestación cuya madre no tuvo varicela • Pretérminos < 28 semanas ó < 1 kg independiente de la historia materna de varicela b) Vacuna antivaricela: para control de brote dentro de los 3 días y posiblemente hasta 5 días del contacto Contraindicaciones: • Reacción alérgica severa o anafilaxia a la vacuna o a alguno de sus componentes (neomicina, gelatina) • Inmunodeficiencias celulares (congénitas, adquiridas, procesos tumorales, tratamiento inmunosupresor) • Paciente VIH con alteraciones inmunológicas severas • Altas dosis de corticoideoterapia (dosis > 2 mg/kg/ día de prednisona o equivalente por más de 15 días) • Embarazo o posibilidad de embarazo dentro del mes • Dentro de los 3 meses posteriores a radioterapia • Tratamiento con salicilatos c) Aciclovir: Es efectivo durante la 2ª viremia a partir del 7º al 9º día de la exposición a una dosis de 20 mg/ kg/dosis cada 6 horas u 80 mg/kg/día (máx. 800 mg dosis) durante 6 días. Evaluar cada caso en particular. Indicaciones de tratamiento para varicela: Indicaciones de tratamiento inmunocompetentes con riesgo incrementado (aciclovir oral dentro de las 24 hs del comienzo) • Personas mayores de 12 años de edad • Personas con enfermedades cutáneas o pulmonares crónicas • Personas que reciben salicilatos en forma crónica • Personas que reciben corticoides en cursos cortos, intermitentes o aerosoles • Casos secundarios intrafamiliares • En embarazadas en 2º y 3º trimestre (oral) y con serias complicaciones (EV). Esta es una publicación de la Dirección Provincial de Bioquímica, Farmacia y D.C. Para cualquier sugerencia o contacto referirse a comisiondemedicamentos@santafe.gov.ar o a los tel. 0342-4573710/13. Bv Galvez 1563 CP 3000 Página 4