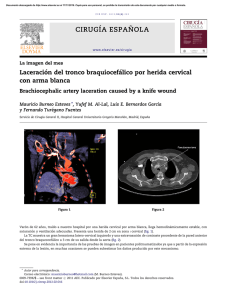
Revista del - Asociación Española de Biopatología Médica
Anuncio

Revista del Laboratorio Clínico ISSN:1888-4008 Revista del Laboratorio Clínico Asociación Española de Biopatología Médica Asociación Española de Farmacéuticos Analistas Sociedad Española de Bioquímica Clínica y Patología Molecular Volumen 4 Número Volumen 4 Número 1 Enero-Marzo 2011 • Págs: 1–62 LABCLI OFC 4(1).indd 1 1 Enero-Marzo 2011 www.elsevier.es/LabClin 3/8/11 2:24:15 PM Revista del Órgano oficial de expresión científica y profesional de la Asociación Española de Biopatología Médica, de la Asociación Española de Farmacéuticos Analistas y de la Sociedad Española de Bioquímica Clínica y Patología Molecular Comité editorial Director Felip Antoja Ribó (Badalona, España) Clara Martínez Gaite (Madrid, España) Editoras María Dolores Ortega de Heredia (Madrid, España) Roser Ferrer Costa (Barcelona, España) Consejo editorial J.M. González-Buitrago (Salamanca, España) J.M. Guardiola Vicente (Majadahonda, España) V. Peg Rodríguez (Zaragoza, España) M. González Estecha (Madrid, España) B. Prieto García (Oviedo, España) J.C. Vella Ramírez (Burgos, España) J.A. Aguilar Doreste M. Esteban Salán R. Molina Porto (Las Palmas de Gran Canaria, España) (Galdakao, España) (Barcelona, España) N. Nogués Gálvez Comité asesor I. Alarcón Torres R. Galimany Solé (Las Palmas de Gran Canaria, España) (Valls, España) (Barcelona, España) F. Bandrés Moya J.A. Gómez Gerique J.M. Queraltó Compañó (Barcelona, España) (Madrid, España) (Santander, España) B. Barceló Martín B. Gouget V. Palicka (Palma de Mallorca, España) (París, Francia) (Hradec Králové, República Checa) G. Beastall E. Guallar J.J. Picazo de la Garza (Glasgow, Reino Unido) (Baltimore, EEUU) (Madrid, España) P. Bermejo Barrera A.R. Horvath M. Plebani (Santiago de Compostela, España) (Sydney, Australia) (Padua, Italia) E. Boquet Jiménez M. Klouche C. Ricós Aguilá (Manresa, España) (Bremen. Alemania) (Barcelona, España) L.A. Borque Larrea F. Marques A. San Miguel Hernández (Logroño, España) (Oporto, Portugal) (Valladolid, España) C.A. Burtis P. Martínez Hernández F. Sánchez Madrid (Oak Ridge, EEUU) (Murcia, España) (Madrid, España) J.A. Castilla Alcalá D. Mazziotta J. Villar Hernández (Granada, España) (Buenos Aires, Argentina) (Las Palmas de Gran Canaria, España) Asociación Española de Biopatología Médica (AEBM) Presidente Miguel García Montes Asociación Española de Farmacéuticos Analistas (AEFA) Presidente Santiago Martínez del Olmo Sociedad Española de Bioquímica Clínica y Patología Molecular (SEQC) Presidente Francisco Vicente Álvarez Menéndez Travessera de Gràcia, 17-21 Tel.: 932 000 711 08021 Barcelona José Abascal, 45 Tel.: 914 021 212 28003 Madrid Tarifa de suscripción anual Profesiones 111,02 € Instituciones 281,07 € MIR y esdudiantes 66,05 € (IVA incluido. Precios válidos sólo para España) Publicación trimestral (4 números al año). © Copyright 2011 Asociación Española de Biopatología Médica, Asociación Española de Farmacéuticos y Analistas y Sociedad Española de Bioquímica Clínica y Patología Molecular Reservados todos los derechos. El contenido de la presente publicación no puede ser reproducido, ni transmitido por ningún procedimiento electrónico o mecánico, incluyendo fotocopia, grabación magnética, ni registrado por ningún sistema de recuperación de información, en ninguna forma, ni por ningún medio, sin la previa autorización por escrito del titular de los derechos de explotación de la misma. ELSEVIER ESPAÑA, a los efectos previstos en el artículo 32.1 párrafo segundo del vigente TRLPI, se opone de forma expresa al uso parcial o total de las páginas de REVISTA DEL LABORATORIO CLÍNICO con el propósito de elaborar resúmenes de prensa con fines comerciales. Cualquier forma de reproducción, distribución, comunicación pública o transformación de esta obra sólo puede ser realizada con la autorización de sus titulares, salvo excepción prevista por la ley. Diríjase a CEDRO (Centro Español de Derechos Reprográficos, www.cedro.org) si necesita fotocopiar o escanear algún fragmento de esta obra. REVISTA DEL LABORATORIO CLÍNICO se distribuye exclusivamente entre los profesionales de la salud. Fotografía de portada: Nuria Insa Disponible en internet: www.elsevier.es/LabClin Suscripciones y atención al cliente: Elsevier España, S.L. Travessera de Gràcia, 17-21 • 08021 Barcelona. Tel.: 902 888 740 Correo electrónico: suscripciones@elsevier.com Protección de datos: Elsevier España, S.L., declara cumplir lo dispuesto por la Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal Papel ecológico libre de cloro. Esta publicación se imprime en papel no ácido. This publication is printed in acid-free paper. Correo electrónico: lclinico@elsevier.com Impreso en España Depósito legal: B-1407-2008 ISSN: 1888-4008 Vol. 4 Núm. 1 Enero-Marzo 2011 Editorial Investigación entre pacientes y análisis 1 J. Ignacio Monreal Originales Estudio comparativo de la morfología de sangre periférica analizada mediante el microscopio y el CellaVision DM96 en enfermedades hematológicas y no hematológicas 3 A. Merino, R. Brugués, R. García, M. Kinder, F. Torres y G. Escolar Utilidad del recuento e inmunofenotipaje de los linfocitos intraepiteliales de la mucosa intestinal en el diagnóstico de la enfermedad celiaca 15 J. Melero Ruiz, M. García Cerrada, M.L. Vargas Pérez, J.J. Fernández de Mera, M.I. Muñoz Sanjuán, C. González Roíz y E. Doblaré Castellano Proteína C reactiva, procalcitonina y proadrenomedulina en la evolución de neumonías hospitalizadas 23 E. Bereciartua Urbieta, C. Mar Medina, A. Capelastegui Sáiz, P.P. España Yandiola, I. Ajuria Morentín y K. Vrotsou Concentraciones séricas de vitaminas liposolubles y de zinc en pacientes sometidos a cirugía bariátrica 30 M. Ortiz Espejo, M.D. Fernández González, R. Batanero Maguregui, J.M. Morán López, M.T. García Unzueta y J.A. Gómez Gerique Notas técnicas Análisis mutacional de GNPTAB para el diagnóstico molecular de mucolipidosis tipo II (I-cell disease). Descripción de dos nuevas mutaciones sin sentido asociadas con la enfermedad 37 V. Latorre y T. Levade Prevalencia de parasitosis intestinales en niños de acogida saharauis 42 G. Seseña Del Olmo, M.J. Rodríguez Escudero, M.C. Martínez Medina y J.A. Pérez Molina Mujer de 18 años con metahemoglobinemia tras utilización de crema anestésica tópica 45 L. Román, A. Buño Soto, M.J. Alcaide Martín, P. Fernández Calle y P. Oliver Sáez Revisión Cistatina C en la evaluación de la función renal M. Fernández García, E. Coll, S. Ventura Pedret, C. Bermudo Guitarte, M.C. Cárdenas Fernández, M. Cortés Rius, M. García Montes, C. Martínez-Brú, D. Pérez Surribas, T. Rodríguez González, C. Valldecabres Ortiz, J.A. Viedma Contreras y E. Zapico Muñiz 50 Vol. 4 Num. 1 January-March 2011 Editorial Research between patients and analysis 1 J. Ignacio Monreal Original articles Comparative study of peripheral blood morphology in manual microscopy and the CellaVision DM96® in hematological and non-hematological diseases 3 A. Merino, R. Brugués, R. García, M. Kinder, F. Torres and G. Escolar Usefulness of intraepithelial lymphocytes immunophenotyping in intestinal mucosa for the diagnosis of coeliac disease 15 J. Melero Ruiz, M. García Cerrada, M.L. Vargas Pérez, J.J. Fernández de Mera, M.I. Muñoz Sanjuán, C. González Roíz and E. Doblaré Castellano C reactive protein, procalcitonin and proadrenomedullin in the outcome of hospitalized pneumonia patients 23 E. Bereciartua Urbieta, C. Mar Medina, A. Capelastegui Sáiz, P.P. España Yandiola, I. Ajuria Morentín and K. Vrotsou Serum concentrations of fat-soluble vitamins, zinc and other biochemical markers in patients after gastric or biliopancreatic bypass 30 M. Ortiz Espejo, M.D. Fernández González, R. Batanero Maguregui, J.M. Morán López, M.T. García Unzueta and J.A. Gómez Gerique Technical notes GNPTAB mutational analysis for the molecular diagnosis of mucolipidosis type II (I-cell disease). Description of two novel nonsense disease-associated mutations 37 V. Latorre and T. Levade Prevalence of intestinal parasite infestation in foster children from the Sahara 42 G. Seseña Del Olmo, M.J. Rodríguez Escudero, M.C. Martínez Medina and J.A. Pérez Molina An 18 year old female with methaemoglinaemia after using EMLA® topical anaesthetic cream 45 L. Román, A. Buño Soto, M.J. Alcaide Martín, P. Fernández Calle and P. Oliver Sáez Review article Assessment of renal function using cystatin C M. Fernández García, E. Coll, S. Ventura Pedret, C. Bermudo Guitarte, M.C. Cárdenas Fernández, M. Cortés Rius, M. García Montes, C. Martínez-Brú, D. Pérez Surribas, T. Rodríguez González, C. Valldecabres Ortiz, J.A. Viedma Contreras and E. Zapico Muñiz 50 Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Rev Lab Clin. 2011;4(1):1—2 Revista del Laboratorio Clínico www.elsevier.es/LabClin EDITORIAL Investigación entre pacientes y análisis Research between patients and analysis La producción científica española del ámbito de la salud se acerca al 3% del total mundial, a partes iguales en biomedicina y en medicina clínica. Los hospitales universitarios participan en el 26%, la Universidad en el 60%, y los centros del CSIC en el 19%. Sin embargo, las empresas intervienen solo en el 4%1 . Según las bases de datos de ISI Web of Knowledge, en los últimos diez años, podemos estimar que los laboratorios clínicos españoles han aportado el 2% de la producción científica mundial en materias del laboratorio y el 6% en microbiología clínica. El ambiente del laboratorio clínico ofrece una oportunidad singular para nuevos investigadores. El microclima, marcado por el deseo de saber, la interacción con los clínicos, el planteamiento de hipótesis, etc., es la matriz en la que aplicar el método científico, y permite integrar las capacidades particulares en la dinámica de los laboratorios. Acercar los servicios básicos a la Universidad, promover el tercer ciclo entre los residentes y completar su formación con una estancia posdoctoral en un centro de referencia pueden dar impulso a la actividad investigadora. La labor sacrificada y vocacional de una mente inquieta, creativa y reflexiva debidamente formada pasará a ser el principal agente de una asistencia mejorada, gracias a su espíritu investigador. Esta orientación es un reto del sistema docente de pregrado, así como de las especialidades clínicas. Pocos estudiantes del área de Ciencias se orientan a hacer carrera investigadora (el 6% en nuestro medio), debido a su dureza y al riesgo de fracaso. Pocos residentes continúan su carrera en esta línea. El laboratorio presenta grandes oportunidades que se deben aprovechar: 1. La dotación técnica es alta, particularmente en los centros hospitalarios. El parque de recursos tecnológicos es similar al de la mayor parte de los laboratorios de centros de I + D y, desde luego, muy superior al de las facultades. 2. El laboratorio clínico es un espacio con elevado presupuesto, que maneja gran cantidad de muestras biológicas correspondientes a momentos clínicos definidos, lo que da gran valor a sus serotecas. 3. La cercanía al enfermo y al clínico es fuente de información para el planteamiento experimental dirigido a la asistencia. 4. El laboratorio dispone de varios niveles de implicación con la investigación, como la definición de paneles de pruebas en proyectos, trabajo analítico y nuevos procedimientos, asesoramiento estadístico o recogida y almacenamiento de especímenes anonimizados en condiciones acordes con la legalidad y la seguridad. 5. El carácter central del laboratorio le confiere la capacidad para establecer alianzas con departamentos clínicos. 6. Existen, además, profesionales líderes con visión asistencial, docente, investigadora y de gestión capaces de pilotar la inversión económica. Son híbridos escasos y muy valiosos que pueden formar equipo cualificado y acometer programas pactados con los responsables del centro. Con este respaldo, ¿cómo no hacer investigación? Los recursos económicos son necesarios para cualquier iniciativa de este tipo. Si se cree en el valor de la investigación y en sus beneficios, no debería ser tan difícil redirigir algunos de los recursos técnicos, económicos y humanos de nuestros laboratorios en esa dirección. El espacio de la investigación La investigación sanitaria básica de Universidades y centros específicos se orienta a ampliar el conocimiento científico, se mide por su impacto en publicaciones y patentes y está respaldada por fondos públicos. La investigación clínica está constituida principalmente por los ensayos clínicos, de centros hospitalarios de tercer nivel. Su traducción a indicaciones aprobadas determina su éxito y se financia principalmente con fondos privados de la industria farmacéutica, que dedica a I + D el 9,4% del total de ventas, principalmente en biotecnología. Entre ambas líneas, la investigación traslacional hace propia la inspiración de D. Carlos Jiménez Díaz, se orienta al paso del descubrimiento a la aplicación clínica y no puede llevarla a cabo un centro de investigación básica por sí solo, de manera que se han constituido consorcios con Universidades y Hospitales que integran equipos de clínicos, epidemiólogos, estadísticos e investigadores básicos. El sistema parece más eficaz al vencer las dificultades de transferencia de conocimiento entre estamentos básicos y clínicos. Diversas entidades se han preguntado cómo mejorar la investigación para que sea transformante de la salud 1888-4008/$ – see front matter © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2010.11.009 Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 2 humana: en EE. UU., lo hicieron los Institutos Nacionales de la Salud (NIH)2,3 o la American Society for Clinical Laboratory Science4 ; en España, fue paradigmático el cambio del Hospital Clínic de Barcelona5 y, desde estamentos públicos, se promueven Redes y Consorcios de apoyo a la investigación biomédica que aglutinan 40 Hospitales y Fundaciones, constituyendo la urdimbre para la investigación sanitaria. Al igual que la normativa de ensayos clínicos ha dado cauce a la investigación clínica, la ley de Investigación Biomédica 14/2007 puede ser el marco para la puesta en valor de los laboratorios clínicos, a través de los análisis genéticos, del uso investigador de muestras biológicas y de la constitución de los biobancos. También la Industria del diagnóstico in vitro y los laboratorios clínicos deben engranar colaborativamente su cadena de cualificación, verificación, validación y optimización de marcadores para hacerla eficiente6,7 . La industria tiene necesidades genéricas como el conocimiento del sustrato biológico y mecanismos de acción, acceso a muestras humanas y cohortes de pacientes, así como a modelos de enfermedad. Los centros académicos necesitan aplicar a gran escala su conocimiento y dotarse de infraestructura y recursos. Mejor juntos. Según el «Objetivo de Lisboa» (Consejo Europeo de Lisboa, 2000) la Unión Europea se debía convertir en «la economía basada en el conocimiento más competitiva y dinámica del mundo» para el año 2010, dedicando el 3% del PIB europeo a I + D + I. Esto no es así, seguimos por debajo del 2%, pero expresa el ánimo comunitario. El VII Programa Marco ha triplicado su dotación económica respecto al anterior y en el programa de Cooperación dedica a Salud casi el 20% del presupuesto total. El retorno Toda inversión debe evaluar el retorno que produce8,9 en forma de conocimiento, medido bibliométricamente, beneficios económicos, mejores prestaciones, explotación comercial o patentes, así como atracción de titulados, programas de doctorado y beneficios para la salud. La propia reputación asistencial hospitalaria está en consonancia con la dinámica investigadora de cada Centro y Servicio10 , al dotarles de visibilidad externa. El camino entre la inversión en investigación y el retorno como mejora de la práctica clínica es realmente complejo y a veces ineficaz11,12 por la cantidad de actores que intervienen13 . En la industria farmacéutica supone entre 12 y 15 años. En las ciencias básicas, sucede así con la biotecnología, han surgido numerosas microempresas suministradoras de productos innovadores. Su colaboración con centros académicos se considera coste efectiva para su expansión a la investigación de grandes compañías. Los laboratorios recuerdan en cierta manera a la Atención Primaria, segmento con destacadas oportunidades para la investigación, que representa un tercio del personal, el 50% del gasto sanitario, el 60% del gasto farmacéutico y resuelve el 80-90% de los problemas de salud14 . Sin embargo, su producción científica es el 0,4% de la base bibliométrica del FIS15 . En los laboratorios clínicos, el retorno no se evalúa porque se sabe que es información y asistencia clínica. Si no medimos el valor de nuestros resultados, difícilmente podremos orientar la inversión para acometer programas de investigación. EDITORIAL La formación de equipos de investigación y su sostenibilidad económica son arriesgadas. En el laboratorio clínico siempre se ha contemplado la oportunidad de desarrollar proyectos de investigación, si bien la asistencia, la docencia y la gestión económica han actuado como distractores, junto al estado estacionario de la ambición profesional. Ha sido necesaria la formación de una nueva generación de especialistas para que la investigación entre en el portafolio de algunos laboratorios, otra etapa de una metamorfosis evolutiva de la profesión que dura ya más de dos décadas. Un número significativo de laboratorios clínicos españoles principalmente universitarios han demostrado su vitalidad dando este paso, por lo que el camino de la investigación entre pacientes y análisis en algunos Centros está abierto. Bibliografía 1. De Pablo F, Arenas J. Introducción al Plan Nacional de Investigación. Desarrollo e Innovación 2008-2011: la acción estratégica en salud. Med Clin (Barc). 2008;130:223—7. 2. Zerhouni EA. Translational and clinical science. Time for a new vision. N Engl J Med. 2005;353:1621—3. 3. Lenfant C. Clinical research to clinical practice. Lost in translation? N Engl J Med. 2003;349:868—74. 4. Mundt L, Shanahan K. ASCLS members perceptions regarding research. Clin Lab Sci. 2009;22:170—5. 5. Rodés J. La experiencia del Hospital Clínic de Barcelona: integración Facultad de Medicina-IDIBAPS-Hospital Universitario. Educ Med. 2007;10:202—8. 6. Plebani M. The changing scenario in laboratory medicine and the role of laboratory professionals in translational medicine. Clin Chim Acta. 2008;393:23—6. 7. Schwartz K, Vilquin JT. Building the translational highway: toward new partnerships between academia and the private sector. Nature Medicine. 2003;9:493—5. 8. Buxton MJ, Hanney S. Desarrollo y aplicación del modelo Payback para la evaluación del impacto socioeconómico de la investigación en salud. Med Clin (Barc). 2008;131 Suppl 5:36—41. 9. Font D, Gomis R, Trilla A, Bigorra J, Piqué JM, Rodés J. Organización y modelo de funcionamiento de las estructuras de investigación biomédica. Situación y retos de futuro. Med Clin (Barc). 2008;130:510—6. 10. Asenjo MA, Bertrán MJ, Guinovart C, Llach M, Prat A, Trilla A. Análisis de la reputación de los hospitales españoles: relación con su producción científica en cuatro especialidades. Med Clin (Barc). 2006;126:768—70. 11. Escudero-Gómez C, Estrada-Lorenzo JM, Lázaro P. El impacto de la investigación en la práctica clínica. Med Clin (Barc). 2008;131:25—9. 12. Jones TH, Hanney S, Buxton MJ. The information sources and journals consulted or read by UK paediatricians to inform their clinical practice and those which they consider important: a questionnaire survey. BMC Pediatrics. 2007;7:1. 13. Lewison G. Beneficios de la investigación médica para la sociedad. Med Clin (Barc). 2008;131:42—7. 14. Violán C, Bolibar B. Investigación biomédica. Papel de la atención primaria. Med Clin (Barc). 2006;126:614—5. 15. Balagué M, Valderas JM, Bolibar B. Oportunidades y aspectos organizativos de la investigación en atención primaria. Med Clin (Barc). 2007;128:711—4. José Ignacio Monreal Servicio de Bioquímica Clínica, Clínica Universidad de Navarra, Pamplona, España Correo electrónico: jimonreal@unav.es Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Rev Lab Clin. 2011;4(1):3—14 Revista del Laboratorio Clínico www.elsevier.es/LabClin ORIGINAL Estudio comparativo de la morfología de sangre periférica analizada mediante el microscopio y el CellaVision DM96 en enfermedades hematológicas y no hematológicas Anna Merino a,∗ , Rosa Brugués a , Rosario García b , Marta Kinder b , Ferrán Torres c y Ginés Escolar d a Laboratori Core, Servei d’Hemoteràpia-Hemostàsia, CDB, Hospital Clínic de Barcelona, IDIBAPS, Barcelona, España Laboratori Core, CDB, Hospital Clínic de Barcelona, Barcelona, España c UASP, Hospital Clínic de Barcelona, IDIBAPS, Barcelona, España d Servei d’Hemoteràpia-Hemostàsia, Hospital Clínic de Barcelona, IDIBAPS, Barcelona, España b Recibido el 12 de julio de 2010; aceptado el 23 de octubre de 2010 Disponible en Internet el 20 de febrero de 2011 PALABRAS CLAVE Morfología de sangre periférica; CellaVision DM96 ∗ Resumen Introducción: La revisión de la citología de sangre periférica es un punto de partida imprescindible para el diagnóstico de la mayoría de las enfermedades hematológicas, e incluso no hematológicas. Objetivo: Evaluar la concordancia entre los resultados obtenidos al realizar el recuento diferencial leucocitario mediante el sistema de análisis digital CellaVision DM96 (DM96) y el microscopio óptico convencional. Material y métodos: Se analizaron 234 extensiones de sangre periférica, de pacientes del Hospital Clínic de Barcelona con cifras de leucocitos entre 1,12 y 282 × 109 /L. 177 preparaciones correspondieron a pacientes con enfermedades hematológicas. Se compararon los porcentajes de neutrófilos, bandas, eosinófilos, basófilos, linfocitos, monocitos, células linfoides reactivas, metamielocitos, mielocitos, promielocitos, blastos, células plasmáticas y eritroblastos PRE y POST obtenidos con el DM96 y al microscopio. Resultados: La correlación de los resultados del DM96 PRE con respecto al microscopio fue excelente para neutrófilos, linfocitos, monocitos, y blastos (r > 0,87 < 0,94 y p < 0,0001) y aceptable para bandas, eosinófilos, basófilos y células plasmáticas (r > 0,74 < 0,81 y p < 0,0001). Después de la reclasificación celular, los coeficientes de concordancia fueron excelentes (> 0,7) para promielocitos y mielocitos, intermedios para células linfoides reactivas y eritroblastos (> 0,5 y < 0,7), y bajos (< 0,5) para los metamielocitos. No se observaron falsos negativos en la detección de blastos por el DM96 (97 casos). Con excepción de las células linfoides reactivas y blastos linfoides, el equipo no preclasificó otras células linfoides atípicas, que debieron ser identificadas por el citólogo. Autor para correspondencia. Correo electrónico: amerino@clinic.ub.es (A. Merino). 1888-4008/$ – see front matter © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2010.10.002 Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 4 A. Merino et al Conclusiones: El análisis morfológico de sangre periférica mediante el equipo CellaVision DM96 muestra una buena concordancia con respecto al microscopio, y representa un avance tecnológico para el laboratorio de Hematología con un número elevado de muestras. Tiene ventajas adicionales, tales como mejorar las condiciones ergonómicas, mayor rapidez, asegurar la trazabilidad y facilitar la docencia. © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. KEYWORDS Peripheral blood morphology; CellaVision DM96 Comparative study of peripheral blood morphology in manual microscopy and the CellaVision DM96® in hematological and non-hematological diseases Abstract Introduction: Differential leukocyte counts of peripheral blood cells are an important diagnostic tool. Objective: We evaluated the CellaVision DM96 (CellaVision AB, Lund, Sweden), an automated system for digital peripheral blood cell analysis. Material and methods: We analysed 234 blood films in which leukocyte values were from 1.12 to 282 × 109 /L. A total of 177 blood films were from patients with hematological diseases. Results: Correlation coefficients between results obtained from the CellaVision DM96 preclassification and by conventional direct microscopy were excellent for segmented neutrophils, lymphocytes, monocytes and blasts (r > 0.87 < 0.94 and P < .0001) and good for band neutrophils, eosinophils, basophils and plasma cells (r > 0.74 < 0.81 and P < .0001). After the reclassification of the cells, very good concordance coefficients were observed for promyelocytes and myelocytes (> 0.7), intermediate for reactive lymphocytes and erythroblasts (>0.5 and < 0.7) and low (<0.5) for metamyelocytes. Whatever the pathology and the number of blasts on the films, all 97 patients were positive for blast detection on the DM96. Pathological cells such as prolymphocytes, large granular lymphocytes, hairy cells, Sézary cells and other atypical lymphocytes were reclassified by the user. Conclusions: Advantages of the CellaVision DM96 over direct microscopy include, requires less time than manual differentiation, is a good tool for educational purposes, improve the traceability of the results, and can have an important role in a modern Hematology Laboratory. © 2010 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción La sangre periférica (SP) es un fluido orgánico fácilmente accesible, por lo que su estudio representa el eslabón analítico inicial en el diagnóstico de muchas enfermedades1—3 . Aunque con el desarrollo de los sofisticados autoanalizadores hematológicos basados en la citometría de flujo la proporción de muestras sanguíneas que requieren un recuento diferencial manual oscila en torno a un 15%, el examen minucioso de los elementos formes de la sangre constituye, en la actualidad, una herramienta fundamental en el diagnóstico. El análisis de la citología de SP es crucial para el diagnóstico de determinadas infecciones (mononucleosis infecciosa), parasitosis (paludismo), así como para el diagnóstico diferencial de anemias y trombocitopenias, y para la identificación y caracterización de diferentes hemopatías malignas. La solicitud de un examen citológico de SP puede obedecer a la observación de determinados signos de alarma en el hemograma. Constituyen signos de alarma en el hemograma el hallazgo de leucocitosis junto a plaquetopenia y/o anemia (posible enfermedad hematológica), leucocitosis y trombocitosis (probable síndrome mieloproliferativo crónico) o leucopenia aislada (descartar una leucemia aguda o un síndrome mielodisplásico). La positividad de determinadas alarmas de los autoanalizadores hematológicos por células atípicas o blastos obligan, asimismo, a la realización de la revisión morfológica del frotis. Por otra parte, es de interés resaltar la estrecha colaboración durante los últimos años entre matemáticos, ingenieros y citólogos, fruto de la cual ha sido la puesta a punto de técnicas automatizadas para el procesado de imágenes de las células sanguíneas normales4—6 . A partir de una técnica automatizada de procesamiento de imágenes mediante una red neuronal artificial, y aplicada a la diferenciación de los leucocitos de SP, se ha desarrollado el equipo CellaVisionTM DM96 (DM96) o sistema automatizado de análisis de imagen (CellaVision AB, Lun, Suecia), que realiza una preclasificación de las células nucleadas de SP, así como una valoración morfológica automatizada de la serie roja. El presente trabajo tiene como objetivos evaluar la correlación y concordancia entre los resultados obtenidos al realizar la fórmula o recuento diferencial leucocitario (RDL) de SP mediante el sistema de análisis digital DM96 y el microscopio óptico convencional, así como analizar las posibles ventajas o inconvenientes de su utilización en la práctica asistencial diaria del laboratorio de Hematología. Material y métodos Se analizaron 234 extensiones de SP, correspondientes a pacientes del Hospital Clínic de Barcelona (130 hombres y 104 mujeres entre 16 y 90 años), teñidas con May Grünwald Giemsa (MGG) y con cifras de leucocitos entre 1,12 y 282 × 109 /L. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Estudio comparativo de la morfología de sangre periférica 5 Tabla 1 Distribución de los diagnósticos hematológicos en 177 pacientes. Tabla 2 Distribución de los diagnósticos no hematológicos en 57 pacientes. Diagnósticos hematológicos N Otros diagnósticos N Gammapatía monoclonal de significado incierto Mieloma múltiple Leucemia linfática crónica Tricoleucemia Linfoma del manto Linfoma de Hodgkin Leucemia prolinfocítica T Síndrome de Sézary Otras neoplasias linfoides Leucemia aguda Leucemia mieloide crónica Mielofibrosis Síndrome mielodisplásico Leucemia mielomonocítica crónica Leucemia aguda en remisión Policitemia vera Púrpura trombopénica idiopática Hemoglobinuria paroxística nocturna Drepanocitosis Total 2 21 23 3 1 2 2 6 23 33 11 2 18 6 19 1 1 2 1 177 Amiloidosis Anemia en estudio Malaria Neoplasia VIH Linfocitosis Hepatitis Cirrosis hepática Colitis ulcerosa Pancreatitis Ancylostoma duodenal Quiste hidatídico Coledocolitiasis Shock séptico Sarcoidosis Cardiopatía Fiebre origen desconocido Trasplante hepático Trasplante páncreas Trasplante renal Infección post cirugía Enfermedad de Wilson Artroplastia de cadera Wernicke-Korsakoff Porfiria eritropoyética congénita Desconocido Total 2 5 2 9 5 1 3 3 1 2 1 1 1 1 1 2 2 1 1 1 1 1 1 1 1 7 57 N equivale al número de casos. Del total de preparaciones, 177 correspondieron a pacientes con las siguientes enfermedades hematológicas: neoplasias linfoides: 83, leucemias agudas (LA): 52 (19 de ellas en remisión), síndromes mieloproliferativos crónicos (SMPC): 20, síndromes mielodisplásicos (SMD): 18, hemoglobinuria paroxística nocturna: 2, drepanocitosis: 1 y púrpura trombopénica idiopática: 1 (tabla 1). Cincuenta y siete preparaciones correspondieron a pacientes con enfermedades no hematológicas procedentes de diferentes salas y consultas externas del hospital (tabla 2). Las muestras de sangre recogidas en EDTA-K3 se analizaron en el equipo Advia 2120 (Siemens Healthcare Diagnostics SL), y aquellas que presentaron criterios para la realización del análisis del frotis o RDL fueron procesadas en el extensor teñidor Cell-Dyn SMS (Abbott Científica SA). Se efectuó la fórmula leucocitaria a 100 elementos utilizando el microscopio y el DM96. Este equipo consta de una unidad para escanear las extensiones de SP previamente teñidas con MGG mediante un microscopio motorizado (BX50W1, Olympus Europe, Hamburgo, Alemania) con tres objetivos (× 10, × 50 y × 100), una cámara y un software (CellaVisionTM , Lund, Suecia) para la adquisición y clasificación de las células. El DM96 admite al mismo tiempo hasta 8 soportes con 12 frotis cada uno. De forma automática el equipo deposita aceite de inmersión sobre las extensiones, y lee el código de barras identificativo de cada una de ellas. El DM96 localiza la monocapa de hematíes, realiza fotografías de los leucocitos que en ella encuentra con el objetivo de 100 aumentos, y presenta las imágenes en pantalla realizando una preclasificación de los mismos (PRE). El citólogo experto verificó la preclasificación sugerida por el analizador y, de una manera fácil y rápida, la modificó cuando fue necesario (reclasificación o POST). Las imágenes del equipo N equivale al número de casos. permitieron asimismo realizar la valoración de la morfología eritrocitaria y de las plaquetas. En el presente estudio se compararon los porcentajes de neutrófilos, bandas, eosinófilos, basófilos, linfocitos, monocitos, células linfoides reactivas (CLR), metamielocitos, mielocitos, promielocitos, blastos, células plasmáticas y eritroblastos PRE y POST obtenidos mediante el DM96 y al microscopio. Asimismo se valoró la preclasificación por el DM96 de las plaquetas gigantes, agregación plaquetaria y «smudge cells» (incluye las sombras nucleares de Gumprecht y las células rotas), así como la detección de alteraciones morfológicas eritrocitarias. El análisis estadístico de los resultados se realizó utilizando regresión lineal y los test de concordancia de Bland-Altman y Lin7—10 . Resultados En primer lugar es preciso señalar que fue muy importante la obtención de preparaciones adecuadas, tanto por el grosor como por la tinción, para que la observación de los elementos sanguíneos se realizara en las condiciones más idóneas mediante el microscopio y con el DM96. Las imágenes digitales obtenidas fueron de muy buena calidad, y permitieron la detección de las diferentes anomalías observadas al microscopio en las tres series hematopoyéticas, tales como signos displásicos, inclusiones o Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 6 A. Merino et al Tabla 3 Coeficientes de correlación de Pearson (CorPearson), y de concordancia de Lin (Concord Lin) entre los valores de la preclasificación de los subtipos celulares de sangre periférica realizada por el CellaVision DM96 (DM96PRE) y de la reclasificación realizada por el facultativo (DM96POST) en relación a los obtenidos al microscopio. Subtipo celular MICRO-DM 96PRE CorPearson MICRO-DM 96POST CorPearson MICRO-DM 96PRE Concord Lin MICRO-DM 96POST Concord Lin MICRO-DM 96PRE IC 95%* MICRO-DM 96POST IC 95%* Neutrófilos Bandas Eosinófilos Basófilos Linfocitos Monocitos Metamielocitos Mielocitos Promielocitos Blastos Plasmáticas CLR Eritroblastos 0,93 0,75 0,796 0,742 0,922 0,872 0,591 0,661 0,444 0,94 0,81 0,452 0,377 0,942 0,851 0,908 0,779 0,941 0,902 0,487 0,836 0,818 0,988 0,942 0,531 0,613 0,92 0,748 0,729 0,729 0,92 0,868 0,393 0,637 0,388 0,898 0,711 0,363 0,292 0,942 0,84 0,907 0,773 0,939 0,898 0,378 0,833 0,778 0,988 0,884 0,514 0,598 0,910-0,946 0,684-0,800 0,674-0,777 0,663-0,784 0,898-0,938 0,832-0,896 0,323-0,458 0,557-0,706 0,289-0,480 0,876-0,915 0,660-0,755 0,273-0,447 0,198-0,381 0,925-0,955 0,799-0,874 0,882-0,928 0,716-0,820 0,922-0,953 0,871-0,920 0,293-0,457 0,789-0,869 0,729-0,819 0,984-0,991 0,863-0,902 0,417-0,599 0,512-0,673 En negrita se resaltan los valores DM96POST con una alta concordancia (> 0,71). IC: intervalo de confianza; *IC Lin < 0,5: concordancia baja; *IC Lin 0,50001-0,7: concordancia intermedia; *IC Lin 0,70001-1: concordancia alta. parásitos. El tiempo medio para la lectura de cada una de las preparaciones fue de alrededor de 90 segundos, llegando a ser de hasta tres minutos para aquellas extensiones con recuentos leucocitarios cercanos a 1 × 109 /L. Los RDL fueron patológicos en 120 casos y normales en 114. nes con recuentos de blastos en SP mediante microscopio. Sin embargo, en los casos de LA linfoides los porcentajes de blastos obtenidos mediante el microscopio óptico convencional fueron siempre superiores a los del DM96, debido a que algunos de estos elementos blásticos fueron preclasificados por el analizador como linfocitos. DM96 PRE y POST La correlación de los resultados del DM96 PRE con respecto al microscopio fue excelente para neutrófilos (r = 0,93), linfocitos (r = 0,922), monocitos (r = 0,872) y blastos (r = 0,94) (p < 0,0001), y aceptable para bandas, eosinófilos, basófilos y células plasmáticas (r > 0,74 < 0,81 y p < 0,0001). Los coeficientes de concordancia fueron superiores a 0,7 (alta concordancia), aunque el intervalo de confianza fue inferior (entre 0,6 y 0,8) para bandas, eosinófilos, basófilos y células plasmáticas. Los coeficientes de Pearson y de concordancia de Lin fueron más altos, es decir, mejores, al comparar los valores del recuento diferencial leucocitario DM96 POST respecto al microscopio, que al comparar la preclasificación o DM96 PRE en todas las subpoblaciones leucocitarias mencionadas (figuras 1 a 16). Con respecto a los porcentajes del DM96 POST del resto de los subtipos leucocitarios analizados, los coeficientes de concordancia fueron excelentes (> 0,7) para promielocitos y mielocitos, intermedios para células linfoides reactivas y eritroblastos (> 0,5 y < 0,7), y bajos (< 0,5) para metamielocitos (tabla 3). DM96 en síndromes mieloproliferativos y mielodisplásicos Como se ha señalado anteriormente, con excepción de los metamielocitos, los porcentajes de serie blanca inmadura preclasificados por el DM96 mostraron una buena concordancia respecto a los obtenidos al microscopio. Así, en los SMPC la presencia de mielemia fue detectada en todos los casos por el DM96, que también preclasificó a los elementos blásticos cuando se hallaron presentes en el frotis. Asimismo, el DM96 detectó la existencia de plaquetas gigantes o de agregados plaquetarios cuando se visualizaron al microscopio. En las imágenes digitales correspondientes a los pacientes con SMD se pudo objetivar la presencia de signos displásicos en la serie blanca (desgranulación de los neutrófilos, cuerpos de Döhle o seudo Pelger), serie roja (eritroblastos binucleados, puentes internucleares o intercitoplasmáticos) y serie megacariocítica (plaquetas gigantes, con seudonúcleo, desgranuladas, micromegacariocitos). Los basófilos parcial o completamente desgranulados también fueron bien preclasificados como basófilos por el analizador. DM96 en síndromes linfoproliferativos crónicos DM96 en leucemias agudas No se observaron falsos negativos en la detección de blastos por el DM96 (97 casos). Es decir, que el DM96 preclasificó un determinado porcentaje de blastos en todas las preparacio- Con excepción de las CLR, las células plasmáticas normales o atípicas y los blastos linfoides, el DM96 no preclasifica otras células linfoides atípicas. El citólogo clasificó en todos los casos las imágenes correspondientes a prolinfocitos, cen- Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Estudio comparativo de la morfología de sangre periférica 7 r = 0,93 y = 1x + 0 100 Neutr_DM96pre 80 60 40 20 0 0 20 60 40 80 100 Neutr_micro Figura 1 Correlación entre los porcentajes de neutrófilos segmentados (Neutr) obtenidos en el CellaVision DM96 (DM96PRE) en relación con los contados en el microscopio (micro). trocitos, centroblastos, células de Sézary, tricoleucocitos, u otros linfocitos vellosos, linfocitos binucleados, linfocitos grandes granulares y linfocitos atípicos. El analizador realizó una perfecta preclasificación de las sombras nucleares de Gumprecht, lo que permitió su rápida cuantificación. DM96 e inclusiones leucocitarias Las imágenes digitales del DM96 permitieron de una forma rápida orientar el diagnóstico de una crioglobulinemia (múltiples inclusiones globulosas en el interior de los neutrófilos, linfocitos y monocitos), así como detectar eritrofagocitosis en monocitos o neutrófilos, y visualizar las astillas características de la LA promielocítica, o de granulación primaria o bastones de Auer en blastos mieloides. DM96 y alteraciones de la morfología eritrocitaria El analizador solo fue capaz de mostrar cuatro grados de alarmas para determinadas alteraciones de la morfología eritrocitaria, tales como anisocitosis, poiquilocitosis, microcitosis, macrocitosis o policromasia. Por el contrario, el resto de las anomalías fueron informadas por el citólogo utilizando las imágenes del equipo, siendo posible tanto el desplazamiento por una zona seleccionada de la extensión como la variación de los aumentos. A resaltar la facilidad con la que se apreció la presencia de hematíes en pilas de moneda, o de formas eritrocitarias anómalas, como por ejemplo los drepanocitos. En los casos de infecciones por parásitos intraeritrocitarios del tipo Plasmodium vivax (P. vivax), los gametocitos r = 0,942 y = 1x + 0 100 Neutr_DM96post 80 60 40 20 0 0 20 60 40 80 100 Neutr_micro Figura 2 Correlación entre los porcentajes de neutrófilos segmentados (Neutr) obtenidos por la reclasificación realizada por el facultativo (DM96POST) en relación con los contados en el microscopio (micro). Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 8 A. Merino et al r = 0,748 y = 1x + 0 50 Bandas_pre 40 30 20 10 0 0 10 20 30 40 50 Bandas_micro Figura 3 Correlación entre los porcentajes de bandas obtenidos en el CellaVision DM96 (DM96PRE) en relación con los contados en el microscopio (micro). fueron clasificados como plaquetas gigantes o macrotrombocitos. Las imágenes del DM96 mostraron con claridad los hematíes parasitados por P. vivax o falciparum. Las inclusiones eritrocitarias, tales como cuerpos de Howell-Jolly, cuerpos de Pappenheimer o cristales de porfirinas, fueron fácilmente identificadas mediante las imágenes proporcionadas por el equipo. DM96 y alteraciones de la morfología plaquetaria El DM96 mostró y preclasificó las imágenes de los agregados plaquetarios, así como de los macrotrombocitos y plaquetas gigantes, por lo que fue posible la detección de anomalías morfológicas en esta serie. Discusión La correcta interpretación de las alteraciones morfológicas de las tres series hematopoyéticas de SP es crucial para el diagnóstico de enfermedades hematológicas y no hematológicas. En la actualidad, además del análisis citológico de las células sanguíneas, se dispone de otras metodologías, tales como la citometría de flujo o las técnicas de biología molecular y citogenética, que son fundamentales para la clasificación diagnóstica definitiva de las enfermedades hematológicas. Sin embargo, la aplicación de los métodos mencionados tiene siempre como punto de partida la SP. La automatización en el laboratorio es una meta por conseguir para todas aquellas técnicas que puedan beneficiarse de los avances tecnológicos que lo permitan. r = 0,851 y = 1x + 0 50 Bandas_post 40 30 20 10 0 0 10 20 30 40 50 Bandas_micro Figura 4 Correlación entre los porcentajes de bandas obtenidos por la reclasificación realizada por el facultativo (DM96POST) en relación con los contados en el microscopio (micro). Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Estudio comparativo de la morfología de sangre periférica 9 r = 0,796 y = 0,8x + 0 esosinofilos_pre 40 30 20 10 0 0 10 30 20 40 50 esosinofilos_micro Figura 5 Correlación entre los porcentajes de eosinófilos obtenidos en el CellaVision DM96 (DM96PRE) en relación con los contados en el microscopio (micro). r = 0,908 y = 1,2x + 0 60 esosinofilos_post 50 40 30 20 10 0 0 10 30 20 40 50 esosinofilos_micro Figura 6 Correlación entre los porcentajes de eosinófilos obtenidos por la reclasificación realizada por el facultativo (DM96POST) en relación con los contados en el microscopio (micro). r = 0,742 y = 1x + 0 20 basofilos_pre 15 10 5 0 0 5 10 15 20 basofilos_micro Figura 7 Correlación entre los porcentajes de basófilos obtenidos en el CellaVision DM96 (DM96PRE) en relación con los contados en el microscopio (micro). Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 10 A. Merino et al r = 0,779 y = 1x + 0 20 basofilos_pre 15 10 5 0 0 5 15 10 20 basofilos_micro Figura 8 Correlación entre los porcentajes de basófilos obtenidos por la reclasificación realizada por el facultativo (DM96POST) en relación con los contados en el microscopio (micro). r = 0,922 y = 1x + 0 linfocitos_DM96pre 100 80 60 40 20 0 0 20 40 60 80 100 linfocitos_micro Figura 9 Correlación entre los porcentajes de linfocitos obtenidos en el CellaVision DM96 (DM96PRE) en relación con los contados en el microscopio (micro). r = 0,941 y = 1x + 0 linfocitos_DM96post 100 80 60 40 20 0 0 20 40 60 80 100 linfocitos_micro Figura 10 Correlación entre los porcentajes de linfocitos obtenidos por la reclasificación realizada por el facultativo (DM96POST) en relación con los contados en el microscopio (micro). Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Estudio comparativo de la morfología de sangre periférica 11 r = 0,872 y = 1x + 0 monocitos_DM96pre 80 60 40 20 0 0 40 20 60 80 monocitos_micro Figura 11 Correlación entre los porcentajes de monocitos obtenidos en el CellaVision DM96 (DM96PRE) en relación con los contados en el microscopio (micro). El DM96 es un nuevo equipo para el análisis automatizado de imágenes digitales de SP. Para ello, el analizador escanea previamente los frotis, identifica los diferentes subtipos de leucocitos, preclasifica las células mediante una red neuronal artificial (basada en características morfológicas de alrededor de 37.000 células), y las muestra en pantalla para que el facultativo las confirme o reclasifique. Para realizar la preclasificación de una célula determinada, el equipo DM96 previamente la analiza utilizando un algoritmo de segmentación11 , y teniendo en cuenta cientos de cálculos a partir de más de 100 aspectos morfológicos tales como coloración, tamaño, forma y textura de las células entre otros12 . En el presente trabajo se analizan las posibles ventajas y limitaciones de la utilización del DM96 para la cuantificación diferencial de las células de SP, y nuestros resultados, de acuerdo con los obtenidos por otros autores13—16 , demuestran una muy buena concordancia de las diferentes subpoblaciones leucocitarias normales de SP preclasificadas por el analizador, en relación con las obtenidas mediante el microscopio óptico convencional. En la publicación realizada por Cornet E et al15 , los monocitos preclasificados por el DM96 presentaron una peor correlación con respecto al microscopio, lo que podría deberse a la distribución heterogénea de estos elementos en las preparaciones. Según nuestros resultados las subpoblaciones normales de SP que muestran un menor coeficiente e intervalo de confianza en la concordancia entre ambos métodos son las bandas, los eosinófilos y los basófilos. En el caso de los eosinófilos, es crucial una correcta tinción, ya que si la característica coloración anaranjada de los gránulos no es lo suficientemente intensa, serán preclasificados como neutrófilos por el DM96. Es conocida la dificultad en la reproducción de los contajes de bandas por diferentes observadores17 y, r = 0,902 y = 1x + 0 monocitos_DM96post 80 60 40 20 0 0 20 40 60 80 monocitos_micro Figura 12 Correlación entre los porcentajes de monocitos obtenidos por la reclasificación realizada por el facultativo (DM96POST) en relación con los contados en el microscopio (micro). Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 12 A. Merino et al r = 0,81 y = 0,6x + 0 12 plasmáticas_pre 10 8 Escala 250 200 150 100 50 0 6 4 2 0 0 5 10 15 20 plasmáticas_micro Figura 13 Correlación entre los porcentajes de células plasmáticas obtenidos en el CellaVision DM96 (DM96PRE), en relación con los contados en el microscopio (micro). debido a ello, no es de extrañar que el intervalo de confianza de la concordancia entre ambos métodos no sea tan alto para este subtipo celular. Con respecto a los granulocitos más inmaduros, la concordancia fue mayor para los promielocitos y mielocitos que para los metamielocitos, debido a que un porcentaje considerable de estos fueron clasificados como bandas. La menor concordancia para los eritroblastos se relacionó con el hecho de que algunas células en apoptosis, o bien determinados artefactos, fueron clasificados por el analizador en este subtipo celular. Un aspecto importante que resaltar es que el DM96 fue capaz de detectar blastos en todos los frotis de SP que los presentaron al microscopio, independientemente de su mayor o menor número en el recuento, o del diagnóstico del paciente (LA, SMPC o SMD). No obstante, algunos de los blastos linfoides fueron preclasificados como linfocitos. Aunque el DM96 no es capaz de clasificar la mayoría de las células linfoides atípicas, facilita la tarea al citólogo en su identificación, ya que este puede observar en la pantalla los elementos patológicos agrupados, a diferencia de lo que ocurre cuando se realiza el recuento al microscopio, con un menor número de células patológicas por campo. El equipo permite también realizar con facilidad el seguimiento de la presencia y características morfológicas de las células patológicas en un paciente determinado, así como el archivo de células anormales típicas de determinadas patologías. Ello facilita la docencia del personal en formación del laboratorio de Hematología. r = 0,942 y = 0,6x + 0 12 plasmáticas_post 10 8 Escala 250 200 150 100 50 0 6 4 2 0 0 5 10 15 20 plasmáticas_micro Figura 14 Correlación entre los porcentajes de células plasmáticas obtenidos por la reclasificación realizada por el facultativo (DM96POST) en relación con los contados en el microscopio (micro). Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Estudio comparativo de la morfología de sangre periférica 13 r = 0,94 y = 1x + 0 100 blastos_DM96pre 80 60 40 20 0 0 20 40 60 80 100 blastos_micro Figura 15 Correlación entre los porcentajes de blastos obtenidos en el CellaVision DM96 (DM96PRE), en relación con los contados en el microscopio (micro). r = 0,988 y = 1x + 0 100 blastos_DM96post 80 60 40 20 0 0 20 40 60 80 100 blastos_micro Figura 16 Correlación entre los porcentajes de blastos obtenidos por la reclasificación realizada por el facultativo (DM96POST) en relación con los contados en el microscopio (micro). Asimismo, el analizador realiza el recuento porcentual de las sombras nucleares de Gumprecht, características de la leucemia linfática crónica (LLC). Una reciente publicación destaca el valor pronóstico, como valor independiente, del porcentaje de sombras nucleares de SP en la predicción de la supervivencia de los pacientes con LLC18 . El interés de la determinación de este parámetro es su fácil cuantificación frente a otros factores de riesgo, tales como el estado mutacional de la cadena pesada de las inmunoglobulinas, expresión de CD38 y Zap 70, y anomalías citogenéticas19 . Por otra parte, la utilización del DM96 en el recuento diferencial de las células sanguíneas mejora el flujo de trabajo en el laboratorio, ya que reduce el tiempo necesario para su realización, especialmente en los frotis sanguíneos de pacientes con leucopenia, y mejora las condiciones ergonómicas de los usuarios con respecto al microscopio óptico. Algunas de las limitaciones del archivo de las extensiones de SP, tales como el espacio necesario, o el deterioro de su calidad, desaparecen con el empleo del DM96. Posibilita la revisión de las células informadas independientemente del tiempo transcurrido desde su análisis, asegurando la trazabilidad de los resultados de la muestra desde su extracción hasta su informe, y disminuyendo determinados errores preanalíticos. Se concluye que el análisis de sangre periférica automatizado mediante el equipo CellaVision DM96 muestra una buena correlación y concordancia en relación con el método tradicional con el microscopio, requiere la validación de los resultados por un facultativo experto y representa un avance tecnológico de gran interés para los laboratorios clínicos Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 14 con un número elevado de muestras, ya que aporta numerosos beneficios tanto asistenciales como de trazabilidad, docentes, y también económicos. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografía 1. Merino A. Manual de citología de sangre periférica. Madrid: Acción Médica; 2005. 2. Woessner S, Florensa L. La citología óptica en el diagnóstico hematológico. FEHH. Madrid: Acción Médica; 2006. 3. Bain BJ. Diagnosis from the Blood Smear. N Engl J Med. 2005;353:498—507. 4. Angulo J, Flandrin G. Automated detection of working area of peripheral blood smears using mathematical morphology. Anal Cell Pathol. 2003;25:37—49. 5. Shitong W, Min W. A new detection algorithm (NDA) based on fuzzy cellular neural networks for white blood cell detection. IEEE Trans Inf Technol Biomed. 2006;10:5—10. 6. Sadeghian F, Seman Z, Ramli AR, Abdul Kahar BH, Saripan MI. A framework for white blood cell segmentation in microscopic blood images using digital image processing. Biol Proced Online. 2009;11:196—205. 7. Lin L. A concordance correlation coefficient to evaluate reproductibility. Biometrics. 1989;45:255—68. 8. Lin L. Assay validation using the concordance correlation coefficient. Biometrics. 1992;48:599—604. 9. Altman DG, Bland JM. Measurement in medicine: the analysis of method comparison studies. Statistician. 1983;32:307—17. A. Merino et al 10. Carrasco JL, Jover Ll. Métodos estadísticos para evaluar la concordancia. Med Clin (Barc). 2004;122 Suppl 1:28-34. 11. Jähne B, Haussecker H, Geisser P, editores. Handbook of Computer Vision and Applications. San Diego, CA, EE. UU.: Academic Press; 1999. 12. Castleman KR. Digital Image Processing. New Jersey, USA: Prentice Hall; 1996. 13. Kratz A, Bengtsson HI, Cassey JE, Keefe JM, Beatrice GH, Grzybek H, et al. Performance evaluation of the CellaVision DM96 system. Am J Clin Pathol. 2005;124:770—81. 14. Ceelie H, Dinkelaar RB, Van Gelder W. Examination of peripheral blood films using automated microscopy; evaluation of Diffmaster Octavia and Cellavision DM96. J Clin Pathol. 2006;60:72—9. 15. Cornet E, Perol JP, Troussard X. Performance evaluation and relevance of the CellaVision DM96 system in routine analysis and in patients with malignant hematological diseases. Int J LabHematol. 2007;30:536—42. 16. Briggs C, Longhair I, Slavik M, Thwaite K, Mills R, Thavaraja V, et al. Can automate blood film analysis replace the manual differential? An evaluation of the CellaVision DM96 automated image analysis system. Int J Lab Hematol. 2007;31: 48—60. 17. Vives Corrons JL, Jou JM, Aymerich M, Rozman M, Villamor N, Aguilar JL, et al. Evaluation of the Coulter MAXM, Differential leukocyte count and left shift alarm. Sangre. 1997;42:31—7. 18. Nowakowski GS, Hoyer JD, Shanafelt TD, Zent CS, Call TG, Bone ND, et al. Percentage of smudge cells on routine blood smear predicts survival in chronic lymphocytic leukaemia. J Clin Oncol. 2009;27:1844—9. 19. Shanafelt TD, Geyer SM, Kay NE. Prognosis at diagnosis: Integrating molecular biologic insights into clinical practice for patients with LLC. Blood. 2004;103:1002—4. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Rev Lab Clin. 2011;4(1):15—22 Revista del Laboratorio Clínico www.elsevier.es/LabClin ORIGINAL Utilidad del recuento e inmunofenotipaje de los linfocitos intraepiteliales de la mucosa intestinal en el diagnóstico de la enfermedad celiaca夽 Josefa Melero Ruiz ∗ , Montserrat García Cerrada, María Luisa Vargas Pérez, José Juan Fernández de Mera, María Isabel Muñoz Sanjuán, Cristina González Roíz y Emilio Doblaré Castellano Servicio de Inmunología y Genética, Hospital Infanta Cristina, Complejo Hospitalario Universitario de Badajoz, Badajoz, España Recibido el 14 de junio de 2010; aceptado el 24 de noviembre de 2010 Disponible en Internet el 20 de febrero de 2011 PALABRAS CLAVE Enfermedad celiaca; Linfocitos intraepiteliales TCR␥␦; Linfocitos intraepiteliales NK-like; Citometría de flujo Resumen Introducción: Se han observado cambios característicos en las poblaciones de linfocitos intraepiteliales (LIE) de la mucosa intestinal en pacientes celiacos infantiles y adultos. Objetivos: Determinar el rango normal de las poblaciones de LIE por citometría de flujo y establecer su rentabilidad diagnóstica en la enfermedad celiaca (EC). Material y métodos: Estudio retrospectivo de 246 niños y 461 adultos con sospecha de EC a los que se había realizado estudio de poblaciones de LIE. El grupo de EC (221 niños y 98 adultos) lo forman individuos con serología celiaca positiva e histología con lesión grado Marsh 1 o mayor. El grupo control (25 niños y 363 adultos) lo constituyen individuos sin lesión intestinal y serología celiaca negativa a los que también se había realizado inmunofenotipo de LIE por citometría de flujo. Resultados: En el grupo de pacientes celiacos se observa un aumento significativo de LIE totales y LIE TCR␥␦ y un descenso significativo de LIE NK-like en comparación con los grupos control. En función de las curvas ROC, los puntos de corte en la población infantil fueron: %LIE > 14,2%, %LIE TCR␥␦ > 16,5% y %LIE NK-like < 10,1%. Los puntos de corte en la población adulta fueron: %LIE > 14,2%, %LIE TCR␥␦ > 16,1% y %LIE NK-like < 4,4%. En ambas poblaciones se obtienen una especificidad y VPP cercano o igual al 100%, con unos CP+ > 5 y CP− < 2 o próximos. Conclusiones: En el presente trabajo se han establecido los valores de corte para los tres parámetros analizados de los LIE. Estos parámetros permiten diagnosticar con una especificidad cercana al 100% la EC en el niño y en el adulto. Los valores de CP+ y CP− obtenidos muestran 夽 Este trabajo corresponde a una comunicación científica presentada y premiada en el III Congreso Nacional del Laboratorio Clínico celebrado en Valencia del 14 al 16 de octubre de 2009. ∗ Autor para correspondencia. Correo electrónico: jmelero@unex.es (J. Melero Ruiz). 1888-4008/$ – see front matter © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2010.11.003 Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 16 J. Melero Ruiz et al que estos parámetros son muy útiles en el diagnóstico de EC activa infantil y del adulto. Por lo tanto, el análisis de las poblaciones de LIE por medio de la citometría de flujo es una nueva herramienta diagnóstica de la EC que complementa el estudio anatomopatológico clásico aumentando su especificidad. © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. KEYWORDS Celiac disease; TCR␥␦ intraepithelial lymphocytes; NK-like cell count; Flow cytometry Usefulness of intraepithelial lymphocytes immunophenotyping in intestinal mucosa for the diagnosis of coeliac disease Abstract Introduction: The intestinal mucosa of children and adult with coeliac disease shows characteristic changes in intraepithelial lymphocyte (IEL) populations. Objectives: Determination of the normal range of IEL populations by flow cytometry and its diagnostic usefulness in coeliac disease (CD). Methods: A retrospective study of 246 children and 461 adults with suspected CD with IEL immunophenotype results. The CD group (221 children and 98 adults) are individuals with positive coeliac serology and a histology lesion Marsh grade 1 or greater. The control group included 25 children and 363 adults without bowel lesion, negative serology and with IEL immunophenotype results. Results: The group of coeliac patients, adults and children, shows a significant increase in total IEL and TCR␥␦ IEL, and a significant decrease in NK-like IEL compared with control groups. Based on ROC curves, the cut-off in coeliac children was: %IEL >14.2%, %TCR␦␥ IEL>16.5% and %NK-like IEL<10.1%. The cut-off in the adult coeliac population was: %IEL >14.2%, %TCR␦␥ IEL>16.1% and %NK-like IEL<4.4%. In both populations the specificity and PPV are close or equal to 100%, a CP+ >5 and a CP− <2 or near. Conclusions: The cut-off values of the LIE population analysed has been established in this study. The values of CP+ and CP− show that these parameters are very useful for the diagnosis of celiac disease in children and adults, with a specificity of approximately 100%. The immunophenotyping of LIE is a very useful technique in the diagnosis of CD, and complements the classical pathological study, thus increasing the specificity. © 2010 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción La enfermedad celiaca (EC) es una intolerancia permanente a los componentes del gluten que causa una enteropatía crónica en individuos genéticamente predispuestos1 . En la patogénesis de la enfermedad intervienen factores ambientales (gluten) y genéticos (HLA-DQ2 y HLA-DQ8) y está mediada por mecanismos inmunológicos (respuesta linfocitaria T intestinal)2 . Es una enfermedad muy prevalente, con frecuencia asintomática, por lo que aún hoy existen muchos casos sin diagnosticar y otros muchos que se diagnostican en edades muy avanzadas. Según los criterios modificados de la ESPGHAN3 , para la confirmación del diagnóstico de la EC se requiere, al menos, una biopsia intestinal en la que se demuestre la presencia de la lesión histológica característica de EC. Esta varía desde una lesión infiltrativa con incremento de los linfocitos intraepiteliales (LIE) hasta la atrofia vellositaria total con hiperplasia criptal, aumentando gradualmente según la severidad de la afectación4 . Algunos autores5,6 proponen que la presencia de cambios histológicos leves, sin atrofia, pueden considerarse como las etapas tempranas de la EC, y el incremento en el número de LIE, por tanto, un hallazgo histopatológico característico de la EC4 . Diversos estudios han demostrado el aumento de LIE en pacientes celiacos por métodos histológicos7-9 . Mediante estudios inmunohistoquí- micos se describió el predominio de linfocitos T con receptor TCR␥␦10-17 . Los estudios acerca de la población de LIE en pacientes con EC, por lo general, se han realizado en un número relativamente pequeño de pacientes, casi siempre en niños, y con métodos inmunohistoquímicos en la mayoría de los casos. La citometría de flujo es una técnica más rápida, sensible, cuantitativa y objetiva que las técnicas histológicas e inmunohistoquímicas; la introducción de marcadores específicos de LIE como la integrina CD103 permite diferenciar esta población de los linfocitos de lámina propia18 . En recientes estudios con citometría de flujo, además de demostrar el aumento de la población de LIE con receptor TCR␥␦10 , se describió una nueva subpoblación de LIE de naturaleza natural killer (LIE NK-like con fenotipo CD45+CD3-CD7+)19 que disminuye drásticamente en los pacientes con EC activa20—22 . Nos planteamos como objetivo evaluar la utilidad diagnóstica del estudio de los LIE en la EC infantil y del adulto. Para ello, se cuantificó la población de LIE y las subpoblaciones de estos (LIE TCR(␦ y LIE NK-like) por citometría de flujo en una serie amplia de pacientes con criterios diagnósticos de EC y en grupos control de edades similares. Se establecieron unos puntos de corte para cada grupo de edad y se analizó la especificidad, sensibilidad, CR+, CR−, VPP y VPN de cada parámetro aislado y en conjunto. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Utilidad del recuento e inmunofenotipaje de los linfocitos intraepiteliales de la mucosa intestinal Tabla 1 17 Datos demográficos y síntomas iniciales. Niños Adultos Controles Casos Controles Casos N. de pacientes Edad en años; media (rango) Mujeres, n (%) 25 6 (1-14) 9 (36) 221 4 (1-14) 135 (61) 363 43 (15-84) 254 (70) 98 40 (15-78) 66 (67) Síntomas iniciales (%) Manifestaciones GI Anemia Screening en enfermedades asociadasa Screening en familiares de primer grado de EC Otrosb 55 8 2 3 32 58 21 4 4 13 23 13 7 13 44 37 19 10 12 22 ◦ a Diabetes mellitus insulino-dependiente, tiroiditis, déficit de IgA, síndrome de Down, síndrome de Turner. Trastornos alimenticios, del crecimiento, patología hepática, pancreática, renales, dérmicas, neurológicas, alteraciones hematológicas no anémicas, alergia alimentaria, infecciones víricas. b Material y métodos Pacientes Se incluyeron 319 pacientes con diagnóstico final de EC, llegados al Hospital Infanta Cristina de Badajoz entre enero del 2002 y octubre del 2008, a los que se realizó estudio histológico de biopsia duodenal, serología de EC, genotipado de los alelos HLA-DQA1* y HLA-DQB1* y estudio inmunofenotípico de los LIE por citometría de flujo. De las historias clínicas y las bases de datos del hospital se recogieron los datos demográficos y clínicos que completan la información de cada paciente. Se diferenciaron por grupos de edad, grupo infantil, hasta 14 años (procedentes todos de la consulta de Gastroenterología infantil), y el grupo de adultos, mayores de 14 años. Para cada grupo de edad se seleccionó un grupo control al que se había realizado el mismo estudio para despistaje de EC (estudio histológico, serología celiaca y estudio inmunofenotípico de los LIE por citometría de flujo) y en los que se había descartado el diagnóstico de EC. - Grupo de pacientes celiacos: 221 niños y 98 adultos con positividad para anticuerpos anti-gliadina (AGA) y/o antitransglutaminasa tisular (ATGT) y/o anti-endomisio (EMA) y lesión histológica en mucosa duodenal grado 1 de Marsh o mayor. - Grupo control: 25 niños y 363 adultos, sin alteraciones histológicas en la biopsia intestinal, serología celiaca negativa y un diagnóstico final distinto al de EC. Los datos demográficos y síntomas iniciales de cada grupo se recogen en la tabla 1. tiva con arquitectura normal y aumento de linfocitos en la mucosa (Marsh 1), hiperplasia criptal (Marsh 2) y la atrofia vellositaria de distintos grados (parcial o Marsh 3a, subtotal o Marsh 3b y total o Marsh 3c). Las muestras de biopsia para el estudio del inmunofenotipaje de LIE se procesan antes de transcurrir dos horas de su extracción (para evitar la desepitelización espontánea) siguiendo, con ligeras modificaciones, el protocolo descrito por Madrigal23 . Las muestras se incuban, a temperatura ambiente, durante una hora y con agitación suave en un medio RPMI enriquecido con un 5% de FCS (Fetal calf serum), al que se añade EDTA 1 mM y DDT 1 mM que provocan la rotura de las uniones intercelulares y la liberación de los LIE y los enterocitos. La suspensión celular resultante se recoge por centrifugación, se lava con suero salino y se incuba 30 minutos a 4 ◦ C con un panel de anticuerpos monoclonales conjugados a distintos fluorocromos para marcar los distintos tipos de linfocitos: anti-CD103-FITC, anti-CD45PerCP-Cy5.5, anti-TCR␥␦-PE y anti-CD3-APC, todos ellos de Becton-Dickinson (San José, California, EE. UU.). Se analizan mediante el software CellQuest en un citómetro de flujo modelo Facscalibur, de Becton-Dickinson (San José, California, EE. UU.), con capacidad para detectar cuatro fluorescencias. Se adquirieron en cada caso el número de eventos totales necesarios para conseguir 6.000 eventos en la ventana de linfocitos realizada el histograma de CD45 frente a SSC (Side Scatter Characteristics). Se selecciona la población de LIE por la coexpresión de CD45 y CD103 y se determina la proporción de estos que coexpresan CD3 y TCR␥␦ (población LIE TCR(␦) y los negativos para CD3 (población LIE NK-like). Análisis estadístico Métodos Las muestras de biopsia del intestino delgado se obtuvieron en los niños mediante cápsula de Watson y en los adultos mediante endoscopia digestiva alta. En el momento de la realización de la biopsia todos los casos permanecían sin restricción dietética. Los resultados del estudio histológico fueron clasificados según los criterios modificados de Marsh4 en 4 tipos: sin lesión intestinal (Marsh 0), lesión infiltra- Para el análisis estadístico se utilizó el paquete estadístico SPSS 12.0. Las diferencias de distribución en las poblacionales de LIE entre los grupos control y celiacos se determinaron mediante las pruebas no paramétricas de U de MannWhitney. El valor de significación empleado fue p ≤ 0,05. Para la obtención de los puntos de corte en las diferentes poblaciones de LIE se utilizaron las curvas ROC. Se eligieron los puntos de corte que mostraban un mayor equilibrio entre Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 18 J. Melero Ruiz et al Tabla 2 Medias, desviación estándar, IC 95% y percentiles 10 y 90. Controles Media ± DS IC 95% Niños LIE totalesa LIE NK-likeb LIE TCR␥␦b 8,5 ± 4,1 30,5 ± 20,5 11,5 ± 6,8 6,8-10,2 22-39 8,7-14,3 Adultos LIE totalesa LIE NK-likeb LIE TCR␥␦b 9,7 ± 5,5 19,7 ± 14,9 8,5 ± 7,8 9,1-10,3 18,1-21,2 7,6-9,3 c P90 Media ± DS 2,8 10,1 1,9 14,5 60,9 20,7 24,3 ± 10,1c 4,7 ± 9,3c 29,3 ± 13,2c 3,8 5 1,5 16,9 41,3 18 22,7 ± 10,4c 2,1 ± 2,6c 26,9 ± 13,0c P10 especificidad y sensibilidad, y a partir de ellos se determinaron la sensibilidad, especificidad, valor predictivo positivo y negativo y el coeficiente de probabilidad positivo y negativo para cada uno de los valores de LIE por separado y de los tres parámetros en su conjunto. Resultados En la tabla 2 se resumen los parámetros estadísticos analizados para los valores de LIE totales, LIE TCR␥␦ y LIE NK-like en cada grupo en estudio. El porcentaje de LIE totales se calculó respecto al número total de células extraídas del epitelio (mayoritariamente células epiteliales) y el porcentaje de LIE TCR␥␦ y LIE NK-like se calcularon con respecto a estos LIE. Linfocitos intraepiteliales totales En la figura 1 se muestra la densidad de esta población celular en los distintos grupos de estudio. Los pacientes con 70 LIE totales (% sobre el total celular) IC 95% P10 P90 22,9-25,6 3,5-6 27,5-31 12,9 0,6 13,6 38 11,5 48,1 20,6-24,8 1,6-2,6 24,2-29,5 11,2 0,3 9,39 38,3 5,2 46,4 % sobre el total de células epiteliales. % sobre el total de LIE. Significación estadística (p < 0,0001) respecto a los controles. EC presentan unos valores medios en población infantil y en población adulta significativamente más altos que en el grupo control de edad similar (p < 0,0001), como se detalla en la tabla 2. Sin embargo, se observan variaciones individuales en cada grupo con superposición en algunos casos entre pacientes celiacos y el grupo control tanto en niños como en adultos (fig. 1). Linfocitos intraepiteliales TCR␥␦ Como muestra la figura 2, los valores medios de la densidad de los LIE TCR␥␦, que se detallan en la tabla 2, fueron significativamente más elevados en los pacientes celiacos que en los controles en ambas poblaciones de edad (p < 0,0001). La media del porcentaje de LIE TCR␥␦ fue de 11,5% (mediana 11,5%) en el grupo control infantil y de 8,5% (mediana 6,2%) en el grupo control adulto. Como ocurre con los LIE totales, se observa cierto solapamiento entre los grupos de celiacos y sus respectivos grupos control de ambas poblaciones de edad. 80 EC EC Controles 60 50 * 40 30 20 10 LIE TCRgd (% sobre LIE totales) a b Casos Controles 60 * 40 ** * 20 0 0 Niños (<14) Adultos (>14) Niños (<14) Figura 1 Medianas, rangos e intercuartiles de los porcentajes de los linfocitos intraepiteliales (LIE) totales con respecto al total de células epiteliales en los pacientes con enfermedad celiaca (EC) y los controles no EC tanto en población infantil como adulta. Adultos (>14) Figura 2 Medianas, rangos e intercuartiles de los porcentajes de los LIE TCR␥␦ con respecto al porcentaje de LIE totales en los pacientes con enfermedad celiaca (EC) y los controles no celiacos tanto en población infantil como adulta. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. LIE TCR␥␦b 0,61 0,99 0,96 0,94 204,5 0,4 16,1 0,80 0,89 0,52 0,97 7,27 0,23 0,903 [0,872-0,934] 4,4 0,87 0,91 0,59 0,98 9,64 0,15 0,96 [0,942-0,977] 14,2 0,82 0,83 0,42 0,97 4,81 0,22 0,887 [0,848-0,927] CP+: coeficiente de probabilidad positivo; CP−: coeficiente de probabilidad negativo; IC: intervalo de confianza; VPN: valor predictivo negativo; VPP: valor predictivo positivo. a % sobre el total de células epiteliales. b % sobre el total de LIE. c No se puede calcular el valor real (1/0). Para establecer los puntos de corte para LIE totales, LIE TCR␥␦ y LIE NK-like que mejor discriminan a los pacientes celiacos de los controles, se estimó la curva ROC. El punto de corte elegido fue aquel que presentaba una mayor especificidad sin perder sensibilidad. Este valor para los LIE totales es del 14,2%, tanto en niños como en adultos, para los LIE NK-like de 10,1% y 4,4% en niños y adultos respectivamente, y para los LIE TCR␥␦, 16,5% en niños y 16,1% en adultos. En la tabla 3 se muestran los valores de corte elegidos y sus variables estadísticas para ambas poblaciones de edad; como puede observarse los valores de especificidad y sensibilidad son altos y los valores de CP+ muy próximos o claramente superiores a 5 y los de CP− muy próximos o 14,2 0,87 0,89 0,96 0,67 7,81 0,15 0,946 [0,916-0,976] Rentabilidad diagnóstica Cut-off (%) Sensibilidad Especificidad VPP VPN CP+ CP− Curva COR (área bajo la curva) [IC 95%] Los alelos HLA-DQA1 y HLA-DQB1 expresados se determinaron por PCR-SSP en 85 niños con EC, en 77 de ellos (90,6%) se detectó el heterodímero HLA-DQA1*05/HLA-DQB1*02 y, de los negativos para este dímero, 5 (5,9%) presentaban el alelo HLA-DQB1*03:02 (DQ8 serológico). De los 63 adultos con EC genotipados, 55 (87,3%) expresaban el heterodímero HLA-DQA1*05/HLA-DQB1*02 y 4 (6,3%) de los negativos eran positivos para el alelo HLA-DQB1*03:02 (DQ8 serológico). Niños Tipificación de alelos HLA-DQ Tabla 3 Como muestra la figura 3, los enfermos celiacos tenían valores medios (4,74 ± 9,25% en niños y 2,08 ± 2,62% en adultos) significativamente menores (p < 0,0001) que sus grupos control. La figura 3 muestra la existencia de superposición de la densidad de LIE-NK like entre los enfermos celiacos y sus respectivos grupos control, como sucedía con las otras dos poblaciones de LIE. Rendimiento estadístico de los cut-off propuestos en población infantil y en adultos. Linfocitos intraepiteliales NK-like 0,3 Linfograma Figura 3 Medianas, rangos e intercuartiles de los porcentajes de los LIE NK-like con respecto al porcentaje de LIE totales en los pacientes con enfermedad celiaca (EC) y los controles no celiacos tanto en población infantil como adulta. 0,66 1 1 0,46 Adultos (>14) LIE totalesa Niños (<14) 16,5 0,84 0,83 0,94 0,59 4,79c 0,20 0,898 [0,852-0,945] 0 10,1 0,89 0,92 0,98 0,71 11,23 0,12 0,944 [0,915-0,973] * ** LIE NK-likeb 20 LIE totalesa 40 * * * * * * ** ** * ** * 19 Parámetro 60 LIE TCR␥␦b * 80 LIE NK-likeb EC Controles Adultos LIE NK-like (% sobre LIE totales) 100 Linfograma Utilidad del recuento e inmunofenotipaje de los linfocitos intraepiteliales de la mucosa intestinal Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 20 inferiores a 0,2. El parámetro aislado, que en función de los resultados de los CP+ y CP−, resulta ser más útil para el diagnóstico de la EC a cualquier edad es el descenso de los LIE NK-like, siendo 11,23 y 9,64 veces más probable que un valor de LIE NK-like por debajo de 10,1 y 4,4% corresponda a un niño o adulto con enfermedad celiaca activa, respectivamente. En los niños el VPP fue alto, y el VPN fue más bajo en los tres parámetros, mientras que en el caso de los adultos, el VPN es superior a 96% en los tres test y el VPP es bajo; lo que es consecuencia del relativamente alto número de falsos negativos en el caso de los niños y de falsos positivos en el caso de los adultos (tabla 3). Al combinar los tres parámetros como una única prueba, la sensibilidad fue menor, 66% en niños y 61% en adultos, pero con una especificidad y VPP del 100% o muy próximas en ambas poblaciones; el VPN fue alto en adultos, 94,6%, pero bajo en los niños, 46,7%. Los tres parámetros combinados mostraban unos valores de CP+ muy elevados y por tanto muy útiles para confirmar la presencia de EC; los valores de CP− eran de 0,3 y 0,4 en la población infantil y adulta, respectivamente (tabla 3). Utilizando estos puntos de corte, 72 de los 221 niños celiacos (32,6%) tenían valores normales de alguno o algunos de los parámetros LIE. Solo tres de ellos (1,4%) presentaron valores normales de los tres parámetros en conjunto. Casi el 80% de estos falsos negativos son debidos a un único parámetro no alterado, mayoritariamente son falsos negativos de LIE TCR␥␦ (un 50% de los FN). Por otra parte, 11 de los 25 niños no celiacos (44%) tienen uno de los tres parámetros con valores fuera del punto de corte (6 con valores de LIE TCR␥␦ superiores a 16,5% y tres con valores de LIE NKlike < 10,1). No hay ningún niño con falsos positivos en los tres parámetros. En el caso de los adultos, 38 de los 98 celiacos (38,8%) presentan valores normales de alguno o algunos de los tres parámetros según los puntos de corte establecidos. Casi el 70% de estos son debidos a un único parámetro no alterado, en su mayoría, también los LIE TCR␥␦ (52% de los falsos negativos). Solo un adulto celiaco presentó los tres parámetros normales. Del grupo control de adultos no celiacos, 105 (28,9%) presentaban algunos de los valores del linfograma fuera del rango normal. En la mayoría de los casos solo uno de los parámetros estaba alterado, y en este caso, mayoritariamente por causa de los LIE totales con un 56,2% de falsos positivos. Solo dos adultos del grupo control presentaron todas las poblaciones de LIE alterados con LIE totales y LIE TCR␥␦ superiores al punto de corte establecido y valores de LIE NK like < 4,4%. Discusión La demostración de la lesión de la mucosa intestinal sigue siendo una condición imprescindible («gold standard») en el diagnóstico de la EC3 . Sin embargo, la lesión histológica no es totalmente característica de la EC24 ; por otra parte, la afectación parcheada de la mucosa se ha reconocido como causa de falsos negativos de la histología25 . En el presente trabajo se aborda la utilidad del estudio de los linfocitos de la mucosa intestinal por citometría de flujo como herramienta diagnóstica de la EC, estudiando retrospectivamente J. Melero Ruiz et al una serie amplia de casos de pacientes pediátricos y adultos con EC activa. Ya en 1971, Ferguson et al7 mostraron que en la afectación de la mucosa intestinal de la EC se produce un aumento del número de LIE; posteriormente se ha demostrado por distintos métodos, sobre todo inmunohistoquímicos, un aumento de los LIE TCR␥␦ en los pacientes celiacos10-14 , y más recientemente, ha cobrado interés una población de linfocitos de fenotipo NK-like (CD45+, CD3−, CD56+−, CD7+)26 , definida por citometría de flujo, presentes, normalmente, en la mucosa intestinal y que disminuye en los pacientes celiacos. Nuestros resultados confirman estos hallazgos empleando la citometría de flujo de cuatro fluorescencias como método de cuantificación, técnica que permite el análisis simultáneo de seis características celulares y el análisis de un número elevado de células, además de rapidez, sensibilidad, objetividad y reproducibilidad de los resultados. Nuestro estudio, además del método, aporta el que se realiza sobre una muestra muy amplia y homogénea de pacientes celiacos activos, que incluye la EC infantil y las formas del adulto. Nuestros resultados demuestran que el linfograma intraepitelial (LIE totales, LIE TCR␥␦ y LIE NK-like) está alterado de forma muy característica en la enfermedad celiaca activa con un aumento de los LIE totales y LIE TCR␥␦ y una depleción de la densidad de LIE NK-like, y que esto es así tanto en la EC infantil, como ya demostraron otros autores22 , como en una amplia muestra de pacientes adultos con EC, población sobre la que recientemente también se ha publicado un trabajo27 . Se observó solapamiento entre los valores del linfograma entre los grupos control y de pacientes con EC. Los puntos de corte que mejor sensibilidad y especificidad ofrecían a partir de la curva ROC fueron, en la población celiaca infantil, > 14,2%, > 16,5% y < 10,1% para los LIE totales, LIE TCR␥␦ y LIE NK-like, respectivamente. Para los adultos con EC estos puntos de corte fueron: LIE > 14,2%, LIE TCR␥␦ > 16,1% y LIE NK-like < 4,4%, puntos similares a los obtenidos por Olivencia et al27 . Algunos falsos negativos de los LIE totales pueden explicarse por la pérdida de células en el proceso de extracción a causa de problemas preanalíticos (más de dos horas de su extracción). El solapamiento de algunos valores por la presencia de falsos positivos podría estar relacionado con la selección de los grupos control que incluye individuos con sintomatología digestiva. Se sabe que la infiltración de la mucosa intestinal por linfocitos no es un hecho específico de la EC26 , sino común a otras alteraciones inflamatorias de la mucosa. Además, la elevación de la proporción de linfocitos T con receptor TCR␥␦ también se ha descrito en otras patologías distintas como intolerancia a proteínas de la leche y otras alergias alimentarias28,29 y enfermedad de Crohn12 ; en cambio, la disminución de la población de LIE NK-like solo se ha visto en la EC, hasta el momento27 . De los 25 niños no celiacos, 11 tuvieron algún falso positivo para alguno de los parámetros del linfograma; tres de ellos debido a los valores de LIE NK-like (4,6, 9,7 y 10,0%), todos mayores de tres años. Según el estudio de Camarero y colaboradores30 , en los niños sanos mayores de tres años la densidad de LIE NKlike es significativamente más baja que los menores de tres años y similar a la de los adultos; si se aplica el mismo punto de corte de los adultos sanos (> 4,4%), estos tres niños tendrían valores de LIE NK-like normales. El tamaño de nuestra muestra control infantil y su distribución por edades no nos permitió realizar este análisis. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Utilidad del recuento e inmunofenotipaje de los linfocitos intraepiteliales de la mucosa intestinal En la mayoría de los estudios, el diagnóstico de EC se establece cuando la lesión es de grado Marsh 3 y el EMA es positivo27 , mientras que en nuestro estudio se han incluido como EC a los pacientes genéticamente predispuestos que presentaban desde una lesión de grado Marsh 1 con clínica sugestiva y algún marcador serológico positivo (AGA-IgA y/o ATGT-IgA y/o EMA-IgA)5 considerados por otros autores como formas latentes o potenciales o simplemente una sensibilización al gluten9,18 . Los resultados presentados permiten confirmar que la cuantificación de las poblaciones de LIE analizadas definen un linfograma característico de la EC activa. Analizando los tres parámetros en conjunto la especificidad y el VPP son del 100% o cercanos al 100%; ningún niño del grupo control presentó los tres parámetros con valores patológicos y solo dos adultos no celiacos resultaron falsos positivos a todo el linfograma. Estos podrían tratarse de EC latentes o potenciales, pero no se les pudo hacer un seguimiento para comprobar esta hipótesis, hecho este que sería muy interesante confirmar en trabajos futuros. Las alteraciones en el linfograma de los LIE al diagnóstico parecen ser extensivas a otras etapas o formas (DSG, EC latentes o potenciales, dermatitis herpetiforme) de la enfermedad18 , en las que los marcadores serológicos y la alteración histológica se normalizan. Aunque no mostrado en este trabajo, la caracterización fenotípica de los LIE por citometría de flujo permite detectar fenotipos aberrantes asociados a la EC refractaria tipo II31 y diagnosticar precozmente la trasformación a linfoma T asociado a enteropatía (caso no publicado). En el presente trabajo se han establecido los valores de corte para los tres parámetros analizados del linfograma intraepitelial que permiten diagnosticar con una especificidad y cercana al 100% la EC en el niño y en el adulto. Los valores de CP+ y CP− obtenidos muestran a estos parámetros como muy útiles en el diagnóstico de EC activa infantil y del adulto, destacando el valor de los LIE NK-like como parámetro aislado. Por lo tanto, el análisis de las poblaciones de LIE por medio de la citometría de flujo es una nueva herramienta muy útil en el diagnóstico en la EC. Este análisis complementa al estudio histológico clásico aportándole mayor especificidad; particularmente útil en el diagnóstico diferencial con otras enteropatías que cursan con atrofia vellositaria y en aquellos casos en los que la biopsia es dudosa o falsamente negativa por la afectación parcheada de la mucosa. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. 19. Bibliografía 20. 1. Marsh MN. Gluten, major histocompatibility complex, and the small intestine. A molecular and inmunobiologic approach to the spectrum of gluten sensitivity (‘‘Celiac Sprue’’). Gastroenterology. 1992;102:330—54. 2. Hill PG, McMillan SA. Anti-tissue transglutaminase antibodies and their role in the investigation of coeliac disease. Ann Clin Biochem. 2006;43:105—17. 3. Walter-Smith JA, Guandalini S, Schmitz J, Schmerling DH, Visakorpi JK, Report of Working Group of European Society of Pediatric Gastroenterology and Nutrition. Revised cri- 21. 22. 21 teria for diagnosis of celiac disease. Arch Dis Childhood. 1990;65:909—11. Oberhuber G, Granditsch G, Vogelsang H. The histopathology of celiac disease: time for a standardized report scheme for pathologists. Eur J Gastroenterol Hepatol. 1999;11:1185—94. Kaukinen K, Markku M, Partanen J, Sievanen H, Collin P. Celiac disease without atrophy: Revision of criteria called for. Dig Dis SCi. 2001;46:879—87. Collin P, Wahab PJ, Murray JA. Intraepithelial lymphocytes and celiac disease. Best Pract Res Clin Gastroenterol. 2005;19:341—50. Ferguson A, Murray D. Quantitation of intraepithelial lymphocytes in human jejunum. Gut. 1971;17:600—3. Corazza GR, Frazzoni M, Gasbarrini G. Jejunal intraepithelial lymphocytes in coeliac disease: are they increased or decreased? Gut. 1984;25:158—62. Cabanne A, Vázquez H, Argoz J, Moreno ML, Nachman F, Niveloni S, et al. Clinical utility of counting intraepithelial lymphocytes in celiac disease intestinal mucosa. Acta Gastroenterol Latinoam. 2007;37:20—8. Halstensen TS, Scott H, Brandtzaeg P. Intraepithelial T cells of the TcR gamma/delta+ CD8- and V delta 1/J delta 1+ phenotypes are increased in coeliac disease. Scand J Immunol. 1989;30:665—72. Savilahti E, Arato A, Verkasalo M. Intestinal gamma/delta receptor-bearing T lymphocytes in celiac disease and inflammatory bowel diseases in children. Constant increase in celiac disease. Pediatr Res. 1990;28:579—81. Spenser J, Isaacson PG, Macdonaldt TT, Thomas AJ, WalkerSmith JA. Gamma/delta T cells and the diagnosis of coeliac disease. Clin Exp Immunol. 1991;85:109—13. Rust C, Kooy Y, Pena S, Mearin ML, Kluin P, Koning F. Phenotypical and functional characterization of small intestinal TcR gamma delta + T cells in coeliac disease. Scand J Immunol. 1992;35:459—68. Javinën TT, Kaukinen K, Laurila K, Kyrönpalo S, Rasmussen M, Mäki M, et al. Intraepithelial lymphocytes in celiac disease. Am J Gastroenterol. 2003;98:1332—7. Ferguson A, Arranz E, O’Mahony S. Clinical and pathological spectrum of celiac disease- active, silent, latent, potencial. Gut. 1993;34:150—1. Kutlu T, Brousse N, Rambaud C, Le Deist F, Schmitz J, CerfBensussan N. Numbers of T cell receptor (TCR) alpha beta+ but not of TcR gamma delta+ intraepithelial lymphocytes correlate with the grade of villous atrophy in coeliac patients on a long term normal diet. Gut. 1993;34:208—14. Arranz E, Bode J, Kingstone K, Ferguson A. Intestinal antibody pattern of coeliac disease: association with y/I T cell receptor expression by intraepithelial lymphocytes, and other indices of potential coeliac disease. Gut. 1994;35:476—82. Eiras P, León F, Camarero C, Roy G. Los linfócitos intraepiteliales en el diagnóstico de la enfermedad celíaca latente-potencial. Rev Clin Esp. 2002;202:497—9. Eiras P, Roldán E, Camarero C, Olivares F, Bootello A, Roy G. Flow cytometry description of a novel CD3-CD7+ intraepithelial subset in human duodenal biopsies: Potencial diagnostic value in coeliac disease. Cytometry. 1998;34:95—102. Eiras P, León F, Camarero C, Lombardia M, Roldán E, Bootello A, et al. Intestinal Intraepithelial Lymphocytes contain a CD3-CD7+ subset expressing natural killer markers and a singular pattern of adhesion molecules. Scand J Immunol. 2000;52: 1—6. León F, Eiras P, Camarero C, Roldán E, Sánchez L, R-Pena R, et al. Avances en el diagnóstico de la enfermedad celíaca: anticuerpos antitransglutaminasa y linfocitos intraepiteliales intestinales. Gastroenterol Hepatol. 2002;25:416—22. Camarero C, Eiras P, Asensio A, León F, Olivares F, Escobar H, et al. Intraepithelial lymphocytes and coeliac disease: per- Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 22 23. 24. 25. 26. 27. J. Melero Ruiz et al manent changes in CD3-/CD7+ and T cell receptor ␥␦ subsets studied by flor cytometry. Acta Paediatr. 2000;89:285—90. Madrigal L, Lynch S, Feighery C, Weir D, Lelleher D, O’Farrelly CJ. Flor cytometry analysus of surface major histocompatibility complex class II expresión on human epithelial cells prepared from small intestinal biopsias. Immunol Meth. 1993;158:207—14. Branski D, Troncone R. Celiac disease: A reappraisal. J Pediatr. 1998;133:181—7. Achkar E, Carey WD, Petras R, Sivak MV, Revta R. Comparison of sunction capsula and endoscopy biopsy of small bowel mucosa. Gastrointestinal endosc. 1986;32:278—81. Mavromichalis J, Brueton MJ, McNeish AS, Anderson CM. Evaluation of the intraepithelial lymphocyte count in the jejunum in childhood enteropathies. Gut. 1976;17:600—3. Olivencia P, Cano A, Martín MA, León F, Roy G, Redondo C. Enfermedad celiaca del adulto y linfocitos intraepiteliales. 28. 29. 30. 31. ¿Nuevas opciones para el diagnóstico? Gastroenterol Hepatol. 2008;31:555—9. Kokkonen J, Hola K, Karttunen TJ, Maki M. Children with untreated food allergy Express a relative increment in the density of duodenal gammadelta+ T cells. Scand J Gastroenterol. 2000;35:1137—42. Phillips AD, Rice SJ, France NE, Walter-Smith JA. Small intestinal intraepithelial lymphocytes levels in cow’s milk protein intolerance. Gut. 1979;20:509—12. Camarero C, León F, Sánchez L, Asensio A, Roy G. Age-related variation of Intraepithelial lymphocytes subsets in normal human duodenal mucosa. Dig Dis Sci. 2007;52:685—91. Spencer JO, Macdonal TT, Diss TC, Walter-Smith JA, Ciclitira PJ, Isaacson PG. Changes in intraepithelial lymphocytes subpopulations in coeliac disease and enteropaty associates T cell lymphoma (malignat histiocytosis of the intestine). Gut. 1989;30:339—46. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Rev Lab Clin. 2011;4(1):23—29 Revista del Laboratorio Clínico www.elsevier.es/LabClin ORIGINAL Proteína C reactiva, procalcitonina y proadrenomedulina en la evolución de neumonías hospitalizadas夽 Edurne Bereciartua Urbieta a,∗ , Carmen Mar Medina a , Alberto Capelastegui Sáiz b , Pedro Pablo España Yandiola b , Iratxe Ajuria Morentín a y Kalliopi Vrotsou c a Servicio de Análisis Clínicos, Hospital Galdakao-Usansolo, Galdakao, Vizcaya, España Servicio de Neumología, Hospital Galdakao-Usansolo, Galdakao, Vizcaya, España c Unidad de Investigación, Hospital Basurto, Basurto, Vizcaya, España b Recibido el 3 de agosto de 2010; aceptado el 29 de noviembre de 2010 Disponible en Internet el 20 de febrero de 2011 PALABRAS CLAVE Neumonía adquirida en la comunidad; NAC; PCR; Procalcitonina; Proadrenomedulina Resumen Introducción: La neumonía adquirida en la comunidad (NAC) sigue siendo un problema sanitario importante. Para establecer su gravedad existen una serie de escalas de severidad, pero tienen sus limitaciones. Se han propuesto diferentes biomarcadores que podrían resultar de ayuda. Objetivo: Evaluar el valor pronóstico de proteína C reactiva (PCR), procalcitonina (PCT) y proadrenomedulina (PADM) para predecir mala evolución intrahospitalaria en NAC. Material y métodos: Se incluyeron todos los pacientes diagnosticados de NAC que quedaron ingresados durante un periodo de 13 meses. Se congeló a −80 ◦ C suero y plasma EDTA obtenidos en el Servicio de Urgencias del Hospital para la determinación de los biomarcadores. Se dividió a los pacientes en dos grupos: los que evolucionaron favorablemente y los que tuvieron mala evolución. Los datos clínicos de los pacientes fueron recopilados por revisión de la historia clínica. Resultados: Las diferencias de las medianas de los tres biomarcadores para los dos grupos adquirieron significación estadística. Las áreas bajo la curva de las curvas ROC correspondientes fueron: 0,67 para PCT, 0,62 para PCR y 0,74 para PADM. Los puntos de corte seleccionados con sus respectivos datos de sensibilidad y especificidad fueron: para PCT 0,5 ng/mL (S: 0,67/E: 0,61), para PCR 150 mg/L (S: 0,67/E: 0,47) y para PADM 1,2 nmol/L (S: 0,80/E: 0,53). Conclusiones: Los resultados sugieren un posible valor pronóstico de estos biomarcadores en relación con la evolución intrahospitalaria que presentarán los pacientes con NAC, destacando entre ellos la PADM. © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. 夽 Este trabajo corresponde a una comunicación científica presentada y premiada en el III Congreso Nacional del Laboratorio Clínico celebrado en Valencia del 14 al 16 de octubre de 2009. ∗ Autor para correspondencia. Correo electrónico: edurne.bereciartuaurbieta@osakidetza.net (E. Bereciartua Urbieta). 1888-4008/$ – see front matter © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2010.11.008 Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 24 E. Bereciartua Urbieta et al KEYWORDS Community-acquired pneumonia; CAP; CRP; Procalcitonin; Proadrenomedullin C reactive protein, procalcitonin and proadrenomedullin in the outcome of hospitalized pneumonia patients Abstract Introduction: Community-acquired pneumonia (CAP) continues to be a major health problem. There are several scoring systems to predict its severity, but they have limitations. Different biomarkers have been proposed to be of assistance. Objective: To evaluate C reactive protein (CRP), procalcitonin (PCT) and proadrenomedullin (PADM) as prognostic factors to predict the outcome in CAP. Material and methods: All patients diagnosed with CAP and admitted to hospital during a period of 13 months were included in our study. Serum and EDTA plasma samples from the Emergency Unit were collected and frozen at -80 ◦ C for biomarkers determination. Patients were divided into two groups: those who developed favorably and those with an unfavorable outcome. Clinical data for these patients were collected by reviewing their medical records. Results: The median values between both groups were found to be statistically significantly different for all three biomarkers. Areas under the ROC curve for each biomarker were: 0.67 for PCT, 0.62 for CRP and 0.74 for PADM. Selected cut-off for each biomarker with their corresponding sensitivity and specificity values were: 0.5 ng/mL (Se: 0.67/Sp: 0.61) for PCT, 150 mg/L (Se: 0.67/Sp: 0.47) for CRP and 1.2 nmol/L (Se: 0.8/Sp: 0.53) for PADM. Conclusions: The results indicate that these biomarkers could help in predicting the outcome of patients with CAP during hospitalization, with PADM being a potentially better predictor. © 2010 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción La neumonía adquirida en la comunidad (NAC) es una enfermedad grave. Las cifras de incidencia anual de la NAC en adultos varían según los diferentes países entre 511 casos/1.000 habitantes, y también el porcentaje de pacientes ingresados, que se ha calculado en 6, 22 y 63% según el país1—5 . Esto se debe a que no es fácil calcular la incidencia exacta de una enfermedad que puede cursar de forma leve y ser diagnosticada y tratada en medicina primaria, o cursar de forma grave y requerir hospitalización incluso en el Servicio de Cuidados Intensivos. En un estudio a nivel estatal en España se calculó una incidencia de 1,6 casos/1.000 adultos/año, de los cuales el 61,4% requirió ingreso2 . Existen y se utilizan en la clínica diaria diferentes escalas que estratifican a los pacientes con NAC según su gravedad (PSI, CURB-65, SCAP, SMART-COP, . . .)6—9 , empleadas en la toma de decisión en cuanto a ingreso o tratamiento ambulatorio del paciente. Sin embargo todas ellas tienen sus ventajas y sus limitaciones10,11 . Durante los últimos años se han propuesto distintos parámetros como biomarcadores que ayuden a establecer el pronóstico de procesos agudos. La proteína C reactiva (PCR) es un reactante de fase aguda producida por el hígado, que se eleva cuando existe un proceso inflamatorio en el organismo, es decir, su elevación es muy inespecífica. Aun así ha sido estudiada para el diagnóstico y monitorización de diversos procesos inflamatorios, y se ha establecido cierta relación con la gravedad de la NAC12—15 , relacionándose su disminución con la supervivencia de pacientes con neumonía asociada a ventilador16 . Kofoed et al17 , estudiando diversos biomarcadores para el diagnóstico de infecciones bacterianas adquiridas en la comunidad, obtienen mejores resultados para PCR que para la procalcitonina (PCT) (biomarcador, a priori, más específico). La PCT es la pro-proteína precursora de la calcitonina, secretada por las células C de tiroides. En condiciones normales la PCT se fragmenta intracelularmente siendo la proteína procesada la que se libera a sangre, por lo que no se detectan niveles medibles de PCT en el organismo. Pero en diferentes situaciones infecciosas e inflamatorias, los niveles circulantes de PCT se elevan hasta miles de veces, principalmente por su producción en tejido no tiroideo. Esta elevación es mayor en infecciones bacterianas18 . Ha sido referido como un marcador sensible de gravedad de la infección bacteriana y sepsis, así como predictor de gravedad19 y guía para ajustar el tratamiento antibiótico en pacientes con NAC12,20—22 . La proadrenomedulina (PADM) es el biomarcador más novedoso en estudio. Es la pro-proteína precursora de la adrenomedulina, proteína de la familia de los genes de la calcitonina que se expresa en presencia de una infección. Se la ha relacionado como marcador pronóstico en pacientes con sepsis, y como marcador útil en la estratificación de riesgo de pacientes con NAC23 . Incluso mejora los resultados de PCR y PCT en estos pacientes24 . Aunque existen estudios que relacionan la presencia y evolución de estos biomarcadores inflamatorios con la evolución clínica de ciertos procesos infecciosos (entre ellos la neumonía), su utilidad para el diagnóstico y pronóstico de la NAC está por confirmar. Objetivo Evaluar la capacidad de las concentraciones en sangre de distintos biomarcadores (PCR, proadrenomedulina y procalcitonina), obtenidos en el Servicio de Urgencias previos al Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Proteína C reactiva, procalcitonina y proadrenomedulina en la evolución de neumonías hospitalizadas ingreso, para predecir la mala evolución intrahospitalaria de pacientes ingresados por NAC. Material y métodos Procedimiento Estudio observacional prospectivo. Se incluyeron de forma consecutiva todos los pacientes adultos (≥ 18 años) que acudieron al Servicio de Urgencias del Hospital GaldakaoUsansolo y que fueron ingresados con diagnóstico confirmado de NAC durante 13 meses (1 de julio 2008-31 de julio 2009). Se consideró como neumonía todo infiltrado pulmonar en la radiografía de tórax, que no se conociese como antiguo y que presentó síntomas indicativos de neumonía, tales como tos, disnea, fiebre y/o dolor pleural. Todos fueron revisados por el Servicio de Neumología. Criterios de mala evolución intrahospitalaria: muerte intrahospitalaria, shock, necesidad de ventilación mecánica (invasiva o no) o duración de la estancia hospitalaria superior a 5 días (media de estancia hospitalaria por neumonía en nuestro hospital).Se excluyeron del estudio los pacientes inmunodeprimidos (aquellos pacientes transplantados de víscera sólida, esplenectomizados, tratados con corticosteroides durante más de 30 días, tratados con otros agentes inmunosupresores o que causen neutropenia con < 1 × 109 neutrófilos/L o infectados por el virus de la inmunodeficiencia humana) y los pacientes hospitalizados en los 14 días previos. La cohorte total de pacientes obtenida fue de 250. La concentración de PCR se midió con el resto de los parámetros del protocolo de sospecha de neumonía del Servicio de Urgencias. El suero restante y el plasma EDTA (obtenido tras centrifugación de sangre total) se congelaron en alícuotas a −80 ◦ C para su posterior análisis. Los biomarcadores se analizaron en series de 100 muestras, de forma ciega, e identificadas únicamente por el número de petición sin conocer los datos clínicos evolutivos del paciente. Todos los participantes (o sus familiares en caso de pacientes que no presentaron el grado de consciencia necesario) firmaron un consentimiento informado tras haber sido informados por los investigadores de los objetivos, riesgos y beneficios potenciales del estudio. El proyecto cuenta con la aprobación del Comité de Ética e Investigación Clínica del Hospital. Instrumentación analítica La PCR y la PCT se analizaron en suero en un Cobas 6000 de Roche Diagnostics® . La PCR se cuantificó por inmunoturbidimetría con una sensibilidad analítica de 1 mg/L. La PCT se midió por electroquimioluminiscencia con una sensibilidad analítica de 0,02 ng/mL. Por otra parte, la PADM se analizó en plasma EDTA por inmunoensayo tipo sándwich mediante tecnología TRACE (time-resolved amplified cryptate emission) en un Kriptor de Brahms AG® , con una sensibilidad analítica del 0,05 nmol/L. Las técnicas analíticas utilizadas no presentan interferencias significativas hasta 500 mg/dL de hemoglobina y 60 mg/dL de bilirrubina para PCR, 900 mg/dL de hemoglobina y 25 mg/dL de bilirrubina para PCT y 500 mg/dL de hemoglobina y 40 mg/dL de bilirrubina para PADM. 25 Análisis estadístico Los tres biomarcadores se presentan como mediana (Q1, Q3: rango intercuartílico) debido a que su distribución no fue normal. Las comparaciones de los valores de los analitos entre pacientes de evolución favorable vs. pacientes de mala evolución se realizaron con la prueba de la mediana. La significación estadística se estableció para un valor de p < 0,05. Se calculó la edad media de los pacientes y su desviación típica, comparándose los dos grupos de evolución mediante el t test. La distribución por sexos de los pacientes se presenta como porcentaje, y se comparó mediante la prueba de la mediana. La capacidad de discriminación de cada biomarcador se examinó mediante curvas ROC (Receiver Operating Characteristic). Para los puntos de corte sugeridos se presentan los valores de sensibilidad, especificidad, valor pronóstico positivo (VPP), valor pronóstico negativo (VPN) y odds ratio (OR) con sus respectivos 95% intervalos de confianza (95% IC). Todos los análisis fueron realizados con el software PASW Statistics 18. Resultados De los 495 pacientes diagnosticados de NAC, 245 fueron dados de alta y tratados ambulatoriamente. Se estudiaron los 250 pacientes (171 hombres/79 mujeres) que quedaron ingresados en el hospital desde julio 2008 a julio 2009. Se dividieron en dos grupos según la evolución intrahospitalaria. De todos ellos, 167 evolucionaron favorablemente y 83 presentaron mala evolución por alguno de los motivos: 20 murieron durante el ingreso, 17 presentaron shock, 5 necesitaron ventilación y 64 pacientes permanecieron hospitalizados más de 5 días (algunos pacientes tuvieron más de una razón para considerarlos de mala evolución: 1 evolucionó a shock y murió; 5 estuvieron ingresados más de 5 días y murieron; 5 evolucionaron a shock y su estancia duró más de 5 días; 1 evolucionó a shock, necesitó ventilación y murió; 1 evolucionó a shock, precisó ventilación y su ingreso se alargó más de 5 días; 1 necesitó ventilación, su ingreso se prolongó más de 5 días y murió; 2 pacientes cumplieron los 4 criterios de mala evolución). La media de edad de los pacientes es de 70,8 años para los pacientes de evolución favorable y 71,8 para los pacientes de mala evolución. En cuanto al porcentaje de hombres en cada grupo, suponen el 70,7% en los pacientes que evolucionan favorablemente y el 63,9% de los pacientes con mala evolución. Ninguna de las dos variables adquirió significación estadística, por lo que podemos considerarlos grupos homogéneos en cuanto a edad y sexo. Por diferentes motivos, no se han podido obtener todos los biomarcadores de todos los pacientes. Las causas más frecuentes han sido la muestra insuficiente o la muestra no recibida. Un resultado de PADM no se pudo obtener por interferencia de la hemoglobina. De los 250 pacientes el total de muestras analizadas ha sido de 219 PCT, 247 PCR y 229 PADM. Las medianas obtenidas para cada biomarcador fueron: PCT de 0,30 ng/mL para el grupo de evolución favorable, y 1,44 ng/mL para el grupo de mala evolución (p = 0,001); la PCR de los que evolucionaron favorablemente fue de Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 26 Tabla 1 E. Bereciartua Urbieta et al Edad, sexo, PCT, PCR y PADM para toda la muestra y en los dos grupos de evolución. Edad (años) Sexo H M PCT (ng/mL) PCR (mg/L) PADM (nmol/L) Toda la muestra (n = 250) Evolución Favorable (n = 167) Mala Evolución (n = 83) Significación 71,1 (17,0) 70,8 (17,0) 71,8 (17,0) t = −0,429 p = 0,668 171 (68,4) 79 (31,6) 118 (70,7) 49 (29,3) 53 (63,9) 30 (36,1) 12 = 1,2 p = 0,276 0,30 (0,09-1,73) [150] 1,44 (0,25-5,12) [69] 12 = 11,5 p = 0,001 157 (52-265) [165] 231 (119-388) [82] 12 = 6,1 p = 0,013 1,18 (0,85-1,69) [154] 1,92 (1,32-3,06) [75] 12 = 24,7 p < 0,0001 0,43 (0,14-2,75) 181 (77-298) 1,35 (0,93-2,05) La edad se presenta como media (desviación típica), y el sexo como número de casos (%). Los valores de los tres biomarcadores son mediana (rango intercuartílico). En el caso de datos perdidos el número de datos válidos aparece entre corchetes. t: t-test; 12 : chi-cuadrado con un grado de libertad. 157 mg/L, y 231 mg/L la de los de mala evolución (p = 0,013); la PADM en evolución favorable fue de 1,18 nmol/L, mientras que la del grupo de mala evolución, 1,92 nmol/L (p < 0,0001) (tabla 1). Se calcularon las curvas ROC correspondientes a cada biomarcador (fig. 1). Para la PCT, el área bajo la curva fue de 0,67 (IC 95%: 0,59-0,74). Esta estimación se obtuvo con datos de 69 pacientes de mala evolución y 150 de evolución favorable. Para la PCR, el área bajo la curva fue de 0,62 (IC 95%: 0,54-0,69). En este caso la estimación fue basada en 82 sujetos de mala evolución y 165 de evolución favorable. Finalmente para la PADM, el área bajo la curva fue de 0,74 (IC 95%: 0,67-0,81), según los datos de 75 sujetos de mala evolución y 154 de evolución favorable. Según los resultados de las curvas ROC, se sugieren tres puntos de corte, uno para cada biomarcador. A continuación se presentan los valores de sensibilidad, especificidad, VPP, VPN y OR con sus respectivos 95% IC para cada punto de corte. Para la PCT se eligió un punto de corte de 0,50 ng/mL, obteniéndose una sensibilidad de 0,67 (IC 95%: 0,56-0,78), una especificidad de 0,61 (IC 95%: 0,54-0,69), un VPP de 0,44 (IC 95%: 0,35-0,54) y un VPN de 0,80 (IC 95%: 0,73-0,87) con un OR de 3,2 (IC 95%: 1,7-5,8). Para la PCR el punto de corte de 150 mg/L resultó en una sensibilidad de 0,67 (IC 95%: 0,57-0,77), una especificidad de 0,47 (IC 95%: 0,39-0,54), un VPP de 0,38 (IC 95%: 0,30-0,46) y un VPN de 0,74 (IC 95%: 0,66-0,82) con un OR correspondiente de 1,8 (IC 95%: 1,0-3,1). Tabla 2 Tablas de contingencia y valores de sensibilidad, especificidad, VPP, VPN y OR con sus respectivos intervalos de confianza del 95% (95% IC) para los puntos de corte seleccionados para PCT, PCR y PADM. Evolución Sensibilidad (IC 95%) Especificidad (IC 95%) VPP (IC 95%) VPN (IC 95%) OR (IC 95%) Mala Buena PCT ≥ 0,50 ng/mL < 0,50 ng/mL Total 46 23 69 58 92 150 0,67 (0,56-0,78) 0,61 (0,54-0,69) 0,44 (0,35-0,54) 0,80 (0,73-0,87) 3,2 (1,7-5,8) PCR ≥ 150 mg/L < 150 mg/L Total 55 27 82 88 77 165 0,67 (0,57-0,77) 0,47 (0,39-0,54) 0,38 (0,30-0,46) 0,74 (0,66-0,82) 1,8 (1,0-3,1) PADM ≥ 1,20 nmol/L < 1,20 nmol/L Total 60 15 75 72 82 154 0,80 (0,71-0,89) 0,53 (0,45-0,61) 0,45 (0,37-0,54) 0,85 (0,77-0,92) 4,6 (2,4-8,7) VPN: valor predictivo negativo; VPP: valor predictivo positivo. En negrita se resalta el número de casos en los que coinciden el biomarcador y el tipo de evolución. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Proteína C reactiva, procalcitonina y proadrenomedulina en la evolución de neumonías hospitalizadas A Para la PADM un punto de corte de 1,2 nmoL/L obtuvo una sensibilidad del 0,80 (IC 95%: 0,71-0,89), una especificidad del 0,53 (IC 95%: 0,45-0,61), un VPP de 0,45 (IC 95%: 0,370,54) y un VPN de 0,85 (IC 95%: 0,77-0,92). Su OR fue de 4,6 (IC 95%: 2,4-8,7). Estos datos, junto con las tablas de contingencia correspondientes a cada punto de corte, se presentan en la tabla 2. Curva COR 1,0 0,8 Susceptibilidad 27 0,6 0,4 Discusión 0,2 0,0 0,0 0,2 0,4 0,6 0,8 1,0 0,8 1,0 0,8 1,0 1 - Especificidad B Curva COR 1,0 Susceptibilidad 0,8 0,6 0,4 0,2 0,0 0,0 0,2 0,4 0,6 1 - Especificidad C Curva COR 1,0 Susceptibilidad 0,8 0,6 0,4 0,2 0,0 0,0 0,2 0,4 0,6 1 - Especificidad Figura 1 Curvas ROC para PCT, PCR y PADM. (A) PCT; área bajo la curva (95% IC): 0,67 (0,59; 0,74); (B) PCR; área bajo la curva (95% IC): 0,62 (0,54; 0,69); (C) PADM; área bajo la curva (95% IC): 0,74 (0,67; 0,81). Aunque la medicina avanza a pasos agigantados y se descubren día a día nuevos tratamientos y curas para distintas enfermedades, la neumonía adquirida en la comunidad sigue siendo uno de los problemas sanitarios más importantes tanto por su incidencia global, como por las graves consecuencias en algunos enfermos. En la actualidad se está estudiando el valor de diversos biomarcadores en el diagnóstico, pronóstico y seguimiento de la NAC con notables diferencias entre los distintos grupos25,26 . Nuestros resultados sugieren un posible valor pronóstico de PCR, PCT y PADM en relación con la evolución intrahospitalaria que presentarán los pacientes ingresados diagnosticados de NAC, aportando información a priori a los clínicos de cara a intensificar el seguimiento en aquellos con niveles más altos. La PADM destaca y se muestra como el biomarcador con mayor capacidad para discriminar entre los pacientes con mala evolución y los de evolución favorable. El área bajo la curva de la PADM ha sido el mayor de todos, y el punto de corte sugerido ha alcanzado una alta sensibilidad (0,80), aunque su especificidad ha sido relativamente baja (0,53). Los pacientes con una PADM superior a 1,2 nmoL/L parecen tener mayor probabilidad de mala evolución intrahospitalaria que aquellos con un valor más bajo, con un OR de 4,6. Salvo la especificidad de la PCT, el resto de los valores diagnósticos de PCR y PCT sugieren una menor capacidad discriminatoria de estos biomarcadores. La PADM ha sido analizada en diversos estudios como predictora de mal pronóstico en infecciones respiratorias y NAC, y los resultados han sido prometedores23,27 . Ambos estudios tienen la ventaja de ser multicéntricos y con gran número de pacientes respecto del nuestro. En cuanto a la PCT, aunque en un análisis preliminar con 81 pacientes no llegaba a adquirir significación estadística, al aumentar la cohorte sí que la ha alcanzado. En un estudio multicéntrico con una cohorte de más de 1.600 pacientes20 , se observó que la PCT tenía valor pronóstico, relacionándose niveles altos de PCT con mayor probabilidad de muerte a los 30 días, y los niveles bajos con menos días de ingreso y mejor pronóstico a 30 días. En algunos estudios se ha postulado un punto de corte 0,25 g/L por debajo del cual sería poco probable una NAC grave22 . Este dato concuerda perfectamente con los datos que hemos obtenido tal y como se puede ver en la tabla 1. De todas formas, las utilidades principales de la PCT como biomarcador son, por un lado, la de distinguir entre la etiología de la infección (vírica o bacteriana)21,25 , y por otro, en el seguimiento de la eficacia del tratamiento26 , ninguna de ellas estudiadas en el presente estudio. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 28 Respecto a la PCR los resultados son parecidos a los obtenidos para la PCT. A pesar de ser un reactante de fase aguda, no específico, tiene valor pronóstico de mala evolución intrahospitalaria. Chalmers et al28 también encontraron valor pronóstico para la PCR, y su conclusión principal fue que los pacientes con una PCR < 100 mg/L tenían riesgo menor de mala evolución, datos que hemos podido corroborar. Con la intención de dar una explicación a las diferencias en las publicaciones respecto de la PCR, Cabezas et al han publicado recientemente que la edad puede influir en su producción29 . Esto no se ha tenido en cuenta en ninguno de los estudios mencionados, y tampoco en el nuestro. Los VPNs obtenidos para nuestros puntos de corte de los tres biomarcadores nos indican que diferencian bien qué pacientes tienen menos probabilidades de evolucionar desfavorablemente, con lo que ayudarían en la práctica clínica a diferenciar los pacientes ingresados que no necesitan un seguimiento tan exhaustivo. Lo que diferencia nuestro estudio del resto es que los datos son referidos únicamente al mal pronóstico intrahospitalario, y no se han encontrado datos para comparar al respecto. Los estudios mencionados tienen en cuenta el mal pronóstico a plazos más largos, la mayoría 30 días. Una limitación que tener en cuenta es que es un estudio unicéntrico. A pesar de ser una desventaja en muchos aspectos, también ha permitido utilizar criterios concretos ya estudiados y adaptados a nuestra población, como la estancia intrahospitalaria media de 5 días, más baja de lo habitual en pacientes con NAC. Nuestros resultados son novedosos y prometedores porque tienen en cuenta el riesgo de mal pronóstico intrahospitalario, a muy corto plazo, destacando sobre todo la PADM. Los niveles de biomarcadores podrían resultar de ayuda al clínico en urgencias a la hora de decidir qué pacientes necesitan un seguimiento más exhaustivo. Para ello convendría confirmar estos resultados en futuros estudios, y realizar estudios prospectivos teniendo en cuenta los biomarcadores en la estratificación de riesgo de los pacientes con NAC para comprobar su utilidad real. Financiación Este estudio ha recibido la ayuda del Áccesit Beca Brahms de la Fundación José Luis Castaño 2008. Los reactivos necesarios para las determinaciones de PCT y PADM fueron donados sin cargo por Roche Diagnostics® y Brahms AG® respectivamente. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografía 1. Llorens P, Murcia J, Laghzaoui F, Martínez-Beloqui E, Pastor R, Marquina V, et al. Epidemiologic study of community-acquired pneumonia treated at a tertiary-care hospital: Does Fine’s pneumonia severity index influence decision-making in the emergency department? Emergencias. 2009;21:247—54. E. Bereciartua Urbieta et al 2. Almirall J, Bolibar I, Vidal J, Sauca G, Coll P, Niklason B, et al. Epidemiology of community acquired pneumonia in adults: a population based study. Eur Respir J. 2000;15:757— 63. 3. Santos de Unamuno C, Llorente MA, Carandell E, Gutiérrez M, Riera J, Ramírez A, et al. Lugar de atención, etiología y tratamiento de las neumonías adquiridas en la comunidad de Palma de Mallorca. Med Clin (Barc). 1998;110:290—4. 4. Murrie M, Hueto J. Epidemiología de las neumonías adquiridas en la comunidad en el área de Salud I de Navarra. Med Clin (Barc). 1991;97:50—2. 5. Suchyta MR, Dean NC, Narus S, Hadlock CJ. Effects of a practice guideline for community-acquired pneumonia in an outpatient setting. Am J Med. 2001;110:306—9. 6. Fine MJ, Auble TE, Yealy DM, Hanusa BH, Weissfeld LA, Singer DE, et al. A prediction rule to identify low risk patients with community-acquired pneumonia. N Engl J Med. 1997;336:243—50. 7. Lim WS, van der Eerden MM, Laing R, Boersma WG, Karalus N, Town GI, et al. Defining community-acquired pneumonia severity on presentation to hospital: an international derivation and validation study. Thorax. 2003;58:377—82. 8. España PP, Capelastegui A, Gorordo I, Esteban C, Oribe M, Ortega M, et al. Development and validation of a clinical prediction rule for severe community-acquired pneumonia. Am J Respir Crit Care Med. 2006;174:1249—56. 9. Charles PGP, Wolfe R, Whitby M, Fine MJ, Fuller AJ, Stirling R, et al. SMART-COP: a tool for predicting the need for intensive respiratory or vasopressor support in community-acquired pneumonia. Clin Infect Diseases. 2008;47:375—84. 10. Torres A, Rello J. Update in community-acquired and nosocomial pneumonia 2009. Am J Respir Crit Care Med. 2010;181:782—7. 11. Niederman MS. Making sense of scoring systems in community acquired pneumonia. Respirology. 2009;14:327—35. 12. Mira JP, Max A, Burgel PR. The role of biomarkers in communityacquired pneumonia: predicting mortality and response to adjunctive therapy. Critical Care. 2008;12 Suppl 6:S5. 13. Povoa P, Coelho L, Almeida F, Fernandes A, Mealha R, Moreira P, et al. C-reactive protein as a marker of ventilatorassociated pneumonia resolution: a pilot study. Eur Respir J. 2005;25:804—12. 14. Almirall J, Bolibar I, Toran P, Pera G, Boquet X, Balanzo X, et al. Contribution of C-reactive protein to the diagnosis and assessment of severity of community acquired pneumonia. Chest. 2004;125:1335—42. 15. Hohenthal U, Hurme S, Helenius H, Heiro M, Meurman O, Nikoskelainen J, et al. Utility of C-reactive protein in assessing the disease severity and complications of community acquired pneumonia. Clin Microbiol Infect. 2009;15:1026—32. 16. Seligman R, Meisner M, Lisboa TC, Hertz FT, Filippin TB, Fachel JMG, et al. Decreases in procalcitonin and C-reactive protein are strong predictors of survival in ventilator-associated pneumonia. Crit Care. 2006;10:R125. 17. Kofoed K, Andersen O, Kronborg G, Tvede M, Petersen J, EugenOlsen J, et al. Use of plasma C-reactive protein, procalcitonin, neutrophils, macrophage migration inhibitory factor, soluble urokinase-type plasminogen activator receptor, and soluble triggering receptor expressed on myeloid cells-1 in combination to diagnose infections: a prospective study. Crit Care. 2007;11:R38. 18. Joyce CD, Fiscus RR, Wang X, Dries DJ, Morris RC, Prinz RA. Calcitonin gene-related peptide levels are elevated in patients with sepsis. Surgery. 1990;108:1097—101. 19. Kruger S, Ewig S, Marre R, Papassotiriou J, Richter K, von Baum H, et al. Procalcitonin predicts patients at low risk of death from community-acquired pneumonia across all CRB-65 classes. Eur Respir J. 2008;31:349—55. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Proteína C reactiva, procalcitonina y proadrenomedulina en la evolución de neumonías hospitalizadas 20. Huang DT, Weissfeld LA, Kellum JA, Yealy DM, Kong L, Martino M, et al. Risk Prediction With Procalcitonin and Clinical Rules in Community-Acquired Pneumonia. Ann Emerg Med. 2008;52:48—58. 21. Masía M, Gutiérrez F, Shum C, Padilla S, Navarro JC, Flores E, et al. Usefulness of Procalcitonin Levels in Community-Acquired Pneumonia According to the Patients Outcome Research Team Pneumonia Severity Index. Chest. 2005;128:2223—9. 22. Christ-Crain M, Stolz D, Bingisser R, Muller C, Mielinger D, Huber PR, et al. Procalcitonin-Guidance of Antibiotic Therapy in Communiy-Acquired Pneumonia — A Randomized Trial. Am J Respir Crit Care Med. 2006;174:84—93. 23. Huang DT, Angus DC, Kellum JA, Pugh NA, Weissfeld LA, Struck J, et al. Midregional Proadrenomedullin as a Prognostic Tool in Community-Acquired Pneumonia. Chest. 2009;136:823—31. 24. Christ-Crain M, Morgenthaler NG, Stolz D, Müller C, Bingisser R, Harbarth S, et al. Pro-adrenomedullin to predict severity 25. 26. 27. 28. 29. 29 and outcome in community-acquired pneumonia. Crit Care. 2006;10:R96. Christ-Crain M, Opal SM. Clinical review: the role of biomarkers in the diagnosis and management of community acquired pneumonia. Critical Care. 2010;14:203. Summah H, Qu JM. Biomarkers: a definite plus in pneumonia. Mediators of Inflammation. 2009:1—9. Article ID 675753. Schuetz P, Wolbers M, Christ-Crain M, Thomann R, Falconnier C, Widmer I, et al. Prohormones for prediction of adverse medical outcome in community-acquired pneumonia and lower respiratory tract infections. Critical Care. 2010;14:R106. Chalmers JD, Singanayagam A, Hill AT. C-reactive protein is an independent predictor of severity in community-acquired pneumonia. Am J Med. 2008;121:219—25. Cabezas P, Ruiz-González A, Falguera M. Factores que modifican la producción de proteína C-reactiva en pacientes con neumonía adquirida en la comunidad. Arch Bronconeumol. 2010;46:47—51. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Rev Lab Clin. 2011;4(1):30—36 Revista del Laboratorio Clínico www.elsevier.es/LabClin ORIGINAL Concentraciones séricas de vitaminas liposolubles, de zinc y de otros marcadores bioquímicos en pacientes intervenidos de bypass gástrico y biliopancreático夽 María Ortiz Espejo a,∗ , María Dolores Fernández González a , Ricardo Batanero Maguregui b , Jesús Manuel Morán López b , María Teresa García Unzueta a y Juan Antonio Gómez Gerique a a b Servicio de Análisis Clínicos, Hospital Universitario Marqués de Valdecilla, Santander, España Servicio de Endocrinología y Nutrición, Hospital Universitario Marqués de Valdecilla, Santander, España Recibido el 25 de junio de 2010; aceptado el 9 de noviembre de 2010 Disponible en Internet el 5 de marzo de 2011 PALABRAS CLAVE Cirugía bariátrica; Vitaminas liposolubles; Obesidad; bypass gástrico; bypass biliopancreático Resumen Introducción: Las vitaminas liposolubles y el zinc son micronutrientes que deben ser aportados con la dieta. Los bypass gástricos y biliopancreáticos son considerados intervenciones malabsortivas, pudiendo provocar importantes déficits carenciales. Material y métodos: Se compararon las concentraciones de vitaminas A y E, zinc y otros marcadores bioquímicos de 35 controles y 32 pacientes sometidos a cirugía bariátrica en distintos tiempos tras la intervención (tras seis meses, al año y transcurridos más de cinco años). Las determinaciones de las vitaminas y del zinc se realizaron mediante HPLC y por espectroscopia de absorción atómica por llama de aire-acetileno, respectivamente. Resultados: Para la vitamina A se obtuvieron medias de 2,15 mol/L en los controles. Los pacientes en los distintos tiempos tras la intervención mostraron valores decrecientes de vitamina A hasta alcanzar concentraciones de 0,63 mol/L tras más de cinco años de la cirugía (p < 0,002). En el caso de la vitamina E se encontraron medias de 28,6 nmol/L para los controles y valores entre 11,7-15,6 nmol/L para los pacientes en las distintas etapas (p < 0,001). En el caso del zinc se observaron medias de 11,6, 10,7 y 9,94 mol/L para los pacientes en los distintos tiempos, encontrándose diferencias significativas con los controles (p < 0,001). Además, se observó significación estadística en las concentraciones de calcio, hierro y folato. Conclusiones: Los pacientes intervenidos de cirugía bariátrica presentan problemas absortivos con déficits notables de nutrientes por lo que este hecho debería ser considerado a efectos de evitar posibles patologías derivadas de estas carencias. © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. 夽 Este trabajo corresponde a una comunicación científica presentada y premiada en el III Congreso Nacional del Laboratorio Clínico celebrado en Valencia del 14 al 16 de octubre de 2009. ∗ Autor para correspondencia. Correo electrónico: tweetinna@hotmail.com (M. Ortiz Espejo). 1888-4008/$ – see front matter © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2010.11.005 Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Concentraciones séricas de vitaminas liposolubles y de zinc en pacientes sometidos a cirugía bariátrica KEYWORDS Bariatric surgery; Fat-soluble vitamins; Obesity; Gastric bypass; Biliopancreatic bypass 31 Serum concentrations of fat-soluble vitamins, zinc and other biochemical markers in patients after gastric or biliopancreatic bypass Abstract Introduction: Fat-soluble vitamins and zinc are substances not synthesized in the body. Consequently intake of those micronutrients is required. Gastric and biliopancreatic bypass considered malabsorption interventions that can lead to nutritional deficiencies. Material and methods: We compared levels of vitamins A and E, zinc and others biochemical markers of 35 controls and 32 patients submitted to bariatric surgery at different times after the operation (after six months, after one year and after more than five years). Vitamins and zinc were determined by HPLC and air-acetylene flame atomic absorption, respectively. Results: A mean of 2.15 mol/L was obtained for controls. In the different times after the surgery, the patients showed decreasing values of vitamin A up to concentrations of 0.63 mol/L after more than five years after the intervention (P < .002). For vitamin E, a mean 28.6 nmol/L was obtained for controls, and values between 11.7-15.6 nmol/L for patients at the different times after the surgery (P < -001). Means of 11.6, 10.7 and 9.9 mol/L of zinc were observed in patients at the different times, being significantly different from the control group (P < .001). In addition, we found statistical significance in the concentration of calcium, iron and folic acid. Conclusions: Patients after bariatric surgery show absorption problems with a marked lack of nutrients. This fact should be taken into consideration to reduce effects of possible pathologies derived from these deficiencies. © 2010 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción La obesidad es una enfermedad multifactorial en la que el exceso de grasa se relaciona con la predisposición genética y con los factores ambientales1 . Está asociada a múltiples complicaciones y comorbilidades como hipertensión (HTA), diabetes mellitus (DM), dislipemia y apnea del sueño obstructiva (SAOS)1,2 . La primera línea de la terapia (cambio en el estilo de vida: dieta, ejercicio, cambios de conducta y medicación), suele ser inefectiva, ya que la pérdida de peso suele ser baja y además, parece que el 90% de estos pacientes lo recuperan3—5 . La cirugía bariátrica ha probado ser el tratamiento más efectivo, reduciendo además comorbilidades y aumentando la calidad de vida de los pacientes1—3,6—10 . Se considera apropiada para pacientes adultos con índice de masa corporal (IMC) mayor de cuarenta, o entre treinta y cinco y cuarenta, con otras comorbilidades1,5,7,10 . El bypass gástrico (BPG) y la derivación biliopancreática (DBP) se consideran procedimientos mixtos (restrictivos por limitar la ingesta calórica y malabsortivos por disminuir la longitud intestinal afectando a la absorción de nutrientes, fundamentalmente grasas y compuestos liposolubles). La mayor pérdida de peso se consigue con la DBP, ya que mayoritariamente es malabsortiva4,5,7,10,11 . Los déficits nutricionales que aparecen después de estas intervenciones dependen significativamente del tipo de cirugía y serían proporcionales a la longitud del área de absorción, por lo que las deficiencias nutricionales suelen ser más frecuentes tras los procesos malabsortivos que tras los restrictivos1 . Frecuentemente los sujetos intervenidos sufren deficiencias nutricionales, especialmente de vitaminas liposolubles, ácido fólico y zinc, estando también documentadas las de vitamina B12, tiamina, folato, calcio, vitamina D, hierro y cationes divalentes. La alimentación de estos pacientes debería ser vigilada regularmente por un equipo multidisciplinar en los períodos pre y post intervención y sería conveniente que recibiesen asesoramiento puesto que tienen un aporte inadecuado de nutrientes y con frecuencia es necesario la suplementación tras la intervención para la corrección de las deficiencias5,12,13 . Las vitaminas A y E son micronutrientes liposolubles que deben ser incorporados por la dieta14 . Se absorben en el intestino mediante mecanismos similares a las grasas, por lo que la disminución de la absorción de las mismas alterara significativamente su absorción. El zinc es un oligoelemento esencial que se incorpora por la alimentación. Se absorbe a nivel duodenal según el nivel de zinc en sangre (que depende de la concentración intracelular y de la albúmina disponible). En los pacientes intervenidos de cirugía bariátrica parece que esta regulación esta interferida y que el estatus nutricional esta alterado, ya que los niveles de zinc suelen encontrarse bajos en plasma y en eritrocitos, donde además se observa una mayor excreción15 . En función de lo anterior, se decidió determinar los valores séricos de los parámetros bioquímicos vitamina A, vitamina E y zinc, en pacientes intervenidos de cirugía bariátrica, puesto que estos marcadores bioquímicos podrían encontrarse disminuidos en pacientes intervenidos de obesidad mórbida y así poder valorar las posibles deficiencias de los mismos y la necesidad de instaurar o incrementar la suplementación. Además se evaluaron los valores séricos de calcio, magnesio, hierro, ferritina, vitamina B12 y ácido fólico, por si estos marcadores también podrían encontrarse reducidos tras la intervención. Se realizó un seguimiento para valorar la evolución temporal de los distintos marcadores, realizando analíticas a los seis meses de la intervención, al año y tras más de cinco años de la cirugía. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 32 Material y métodos Diseño del estudio Retrospectivo y observacional. Se realizó un seguimiento de distintos parámetros (sexo, edad, peso, talla, IMC, comorbilidades e ingesta de suplementos) a 32 pacientes que habían sido intervenidos de obesidad mórbida. Se compararon los datos de las determinaciones séricas de distintos marcadores bioquímicos (vitamina A, vitamina E, zinc, calcio, magnesio, hierro, ferritina, vitamina B12 y ácido fólico) de los pacientes intervenidos de cirugía bariátrica (DBP y BPG) en distintos tiempos tras la intervención (a los seis meses, al año y más de cinco años) con las obtenidas en 35 individuos control procedentes de revisiones rutinarias, tomados al azar y que no habían sido intervenidos ni eran obesos. Los pacientes se seleccionaron entre enero y mayo de 2009 con el criterio de inclusión de haber sido sometidos a cirugía bariátrica entre los años 2000-2009 (por ello el último tiempo de realización de la analítica agrupa a los pacientes cuando han transcurrido una media de más de cinco años tras la cirugía). Métodos analíticos La determinación de vitaminas liposolubles se realizó mediante cromatografía líquida de alta resolución (HPLC) (Bio- Rad Laboratories® ) con detección en el UV a 340295 nm en un Hewlett-Packard® con columna de fase reversa C8 DI 90 mm por 3,2 mm y fase móvil agua:metanol. Las determinaciones cuantitativas se realizan con ayuda de un estándar interno y la validación en referencia a estándares añadidos16 . Las determinaciones de zinc se cuantificaron mediante espectroscopia de absorción atómica por llama de aire-acetileno en un espectrofotómetro Analyst 100 de Perkin- Elmer® (longitud de onda 213 nm, apertura de rendija 0,7 nm y dilución de la muestra ½ con agua ultrapura). Calibración con estándar acuoso (Merck® ) 1.000 ppm. Presenta un coeficiente de variación intradía de 4,5% e interdía de 7%17,18 . Se cuantificaron los marcadores calcio, magnesio y hierro en un Advia Chemistry System 2400® (Siemens Healthcare Diagnostics). El calcio mediante el método de la cresolftaleína complexona automatizada (los iones forman un complejo violeta con la cresoftaleína en un medio alcalino) que está normalizado con respecto a un método de referencia de absorción atómica que utiliza materiales de referencia de NIST (r = 0,996). El hierro se determinó con el método basado en ferrocina (éste se libera de la transferrina en condiciones de acidez y se reduce a su estado ferroso para cambiarlo con un cromógeno a fin de medirlo por colorimetría), conforme al método de referencia propuesto por la AACC (r = 0,999). El magnesio se cuantifica por el método colorimétrico con azul de xilidio como colorante (los iones magnesio reaccionan con el colorante en un medio alcalino para formar un complejo hidrosoluble. El aumento de absorbancia del mismo es proporcional a la concentración), conforme a un método de referencia de absorción atómica que utiliza materiales de referencia de NIST por medio de una correlación de muestras, r = 0,993. M. Ortiz Espejo et al La ferritina, vitamina B12 y ácido fólico se cuantificaron en un Advia Centaur® Immunoassay System (Siemens Healthcare Diagnostics) mediante quimioluminiscencia directa. La ferritina mediante un inmunoensayo tipo sándwich de dos puntos (normalización conforme al segundo patrón internacional de la OMS, r = 0,999). La vitamina B12 y el folato mediante inmunoensayo competitivo (el ensayo es conforme a un estándar interno fabricado con material de calidad USP y material altamente purificado, respectivamente). Todos los marcadores estuvieron sometidos a tres controles sistemáticos internos diarios de dos niveles, las vitaminas A y E de Bio-Rad Laboratories® , el zinc Qualitrol HS N de Merck® y el resto de Siemens Healthcare Diagnostics® . Estos últimos también sometidos a un control quincenal externo; programa EQAS (External Quality Assurance Services. N◦ Lab: 1877 CA, USA) de Bio-Rad Laboratories® . Tratamiento estadístico Los datos se analizaron con el paquete estadístico SPSS 12.0® . Se realizaron análisis descriptivos básicos y tablas de contingencia para cada magnitud bioquímica cuantificada en controles y pacientes en los distintos tiempos del estudio (a los seis meses de la intervención, al año y tras más de cinco años de la cirugía) para evaluar las diferencias en los mismos con la evolución temporal desde la cirugía y ver si existían diferencias entre ellos y con los controles; se utilizó el test de ANOVA intergrupos para cada magnitud bioquímica cuantificada obteniendo, si la había, significación estadística en cada caso, comparaciones múltiples ‘‘post-HOC’’ Bonferroni y estadístico de pruebas relacionadas para la evaluación de las diferencias entre los controles y los pacientes en cada tiempo tras la cirugía. Resultados La mayoría de los sujetos incluidos en el estudio fueron mujeres, tanto en el grupo control como en el grupo de pacientes intervenidos. La edad media de los controles fue de 48 años (54 en el caso de los hombres y 45 en el de las mujeres) y de 41 años para los pacientes intervenidos (43 para los hombres y 40 para las mujeres). Antes de la intervención los pacientes presentaron un peso medio de 121 kg (135 para hombres y 118 para mujeres) y un IMC medio de 46 kg/m2 (45 para los hombres y 46 para las mujeres). Ningún paciente se encontraba tomando suplementos antes de la cirugía. Las comorbilidades más frecuentes fueron HTA y DM. A los seis meses y al año de la cirugía se observaron en los pacientes pesos medios de 94 y de 86 kg e IMC medios de 36 y 32 kg/m2 , respectivamente. Se obtuvieron diferencias de 27 kg entre la pre-cirugía y a los seis meses tras la intervención que resultó significativo y diferencias de 34 kg entre la pre-cirugía y el año. Por lo que la mayor pérdida de peso de los pacientes se produciría en los seis primeros meses. Tras más de cinco años de la intervención se obtuvieron medias de 83 kg de peso y 31 kg/m2 de IMC y diferencias de 37 kg con la pre-cirugía lo que podría indicar una estabilización del peso perdido a lo largo del tiempo tras el año de la cirugía en nuestra población a estudio. El 20% de los pacientes presentaron HTA, el 11% DM y el 4% hiperlipemia y Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Concentraciones séricas de vitaminas liposolubles y de zinc en pacientes sometidos a cirugía bariátrica 33 Tabla 1 Concentraciones séricas de vitamina A, vitamina E, zinc, calcio, magnesio, hierro, ferritina, vitamina B12 y folato del grupo control, pacientes a los seis meses de la intervención, pacientes al año de la intervención y pacientes tras una media de más de 5 años de la intervención Número de sujetos Sexo femenino Vitamina A (mol/L) Vitamina E (nmol/L) Zinc (mol/L) Calcio (mmol/L) Magnesio (mmol/L) Hierro (mol/L) Ferritina (g/L) Vitamina B12 (pmol/L) Folato (nmol/L) Grupo control A los 6 meses Al año Más de 5 años 35 26 (75) 2,15 (1,8-2,4) 28,6 (26-31,16) 13,4 (12,4-14,5) 2,35 (2,3-2,37) 0,86 (0,82-0,9) 14,39 (11,8-17) 64,8 (39-91) 282 (207,4-357,2) 24 (15,2-32,2) 32 27 (85) 1,78 (0,94-2,6) 13,18 (7,47-18,86)a 11,63 (10,25-13)a 2,27 (2,2-2,32) 0,78 (0,74-0,86)a 10,02 (7,34-10,9) 140,8 (1,4-280) 335 (284,1-387,4) 15,4 (12,23-18,6) 32 27 (85) 1,62 (0,87-2,37)a 15,66 (11-20,29)a 10,77 (9,8-11,78)a 2,22 (2,17-2,3)a 0,78 (0,74-0,82)a 9,16 (7,7-10,74)a 100,9 (12-189) 441,7 (228,8-662) 26 (20-32,4) 32 27 (85) 0,63 (0,56-0,7)a 11,72 (9,87-13,6)a 9,94 (9,33-10,56)a 2,17 (2,15-2,25)a 0,78 (0,74-0,82)a 10,16 (8,23-12,17)a 117,7 (39-196) 314,4 (256-377,2) 27,2 (21,8-32,6) El sexo femenino se expresa como número de sujetos (porcentaje); Los valores de vitaminas, zinc, calcio, magnesio, hierro, ferritina y folato se expresan como media (intervalo de confianza 95%). a diferencias significativas con el grupo control (p < 0,05). SAOS. Todos los sujetos fueron suplementados como mínimo con un multivitamínico, calcio y hierro, según necesidades y tolerancia. Se analizó la evolución de los marcadores bioquímicos en los distintos tiempos y se compararon con las concentraciones obtenidas para el grupo control obteniéndose diferencias significativas intergrupos para vitaminas A y E, zinc, calcio, hierro y ácido fólico. La vitamina A presentó medias de 2,1 mol/L para los controles. Los pacientes mostraron valores de 1,8, 1,6 y 0,6 mol/L a los seis meses, al año y tras más de cinco años de la intervención, respectivamente, observándose un descenso gradual en la concentración que se haría más acusado con el paso del tiempo (tabla 1). Se obtuvieron diferencias significativas entre este último grupo y todos los demás. También entre el grupo control y los pacientes al año (p < 0,02) (gráfica 1). La vitamina E muestra valores medios de 28 nmol/L para los controles, y valores medios de 13, 15 y 11 nmol/L para los pacientes en los distintos tiempos tras la intervención, respectivamente (tabla 1) (gráfica 2). Se encontraron diferencias significativas entre el grupo control y el resto de los grupos (p < 0,001) pudiendo ser debidas a una disminución en los niveles de vitamina E, aunque dentro de los rangos de normalidad, tras la intervención que se estabilizaría a lo largo del tiempo, pero que no permite alcanzar concentraciones similares a los controles. Se obtuvieron medias de 11,6, 10,7 y 9,9 mol/L en las concentraciones de zinc para los pacientes a los seis meses, al año y tras una media de más de cinco años de la cirugía observándose una reducción gradual con el tiempo dentro de los rangos de referencia. Los controles presentaron concentraciones de 13,4 mol/L mostrando diferencias significativas con los pacientes al año y tras más de cinco años de la cirugía. (p < 0,001) (tabla 1) (gráfica 3). Los valores de calcio presentaron medias de 2,35 mmol/L para controles, 2,27 mmol/L para pacientes a los seis meses de la cirugía, 2,22 mmol/L al año y 2,17 mmol/L tras más de cinco años de la intervención, obteniéndose resultados Vitamina E 30 Vitamina A 2,5 25 2 20 1,5 15 1 10 0,5 0 5 Controles 6 meses 1 año Más de 5 años Figura 1 Niveles de vitamina A, representados como media (mol/L), obtenidos mediante descriptivos y tablas de contingencia para controles, pacientes a los 6 meses de ser intervenidos, pacientes al año de dicha intervención y pacientes tras una media de más de cinco años después de la cirugía. Controles 6 meses 1 año Más de 5 años Figura 2 Niveles de vitamina E, representados como media (nmol/L), obtenidos mediante descriptivos y tablas de contingencia para controles, pacientes a los 6 meses de ser intervenidos, pacientes al año de dicha intervención y pacientes tras una media de más de cinco años después de la cirugía. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 34 M. Ortiz Espejo et al Hierro Zinc 14 15 12,5 13,5 11 12 9,5 10,5 9 8 Controles 6 meses 1 año Más de 5 años Controles 6 meses 1 año Más de 5 años Figura 3 Niveles de zinc, representados como media (mol/L), obtenidos mediante decriptivos y tablas de contingencia para controles, pacientes a los 6 meses de ser intervenidos, pacientes al año de dicha intervención y pacientes tras una media de más de cinco años después de la cirugía. Figura 5 Niveles de hierro, representados como media (mol/L), obtenidos mediante decriptivos y tablas de contingencia para controles, pacientes a los 6 meses de ser intervenidos, pacientes al año de dicha intervención y pacientes tras una media de más de cinco años después de la cirugía. similares al caso del zinc (p < 0,02) (gráfica 4). Para el hierro se obtuvieron medias de 14,39 mol/L para los controles, y medias de 10, 9 y 10 mol/L para los pacientes a lo largo de las distintas etapas viéndose una disminución de las concentraciones con respecto al grupo control siendo significativa entre los controles y pacientes al año de ser intervenidos (p = 0,01) (tabla 1) (gráfica 5). Los niveles de ácido fólico presentaron medias de 24 nmol/L para controles, y de 15, 26 y 27 nmol/L para pacientes a los seis meses, al año y tras más de cinco años de la intervención, respectivamente. Se observó un descenso en la concentración a los seis meses que luego se recupera y se iguala a la concentración sérica de los controles. Existen diferencias significativas entre los seis meses y el último grupo (p = 0,023). Las concentraciones de magnesio, ferritina y vitamina B12 no mostraron diferencias significativas entre los grupos (tabla 1). Tampoco se encontraron diferencias en las concentraciones de los distintos marcadores entre los pacientes que tomaron suplementos y los que no lo hicieron. Calcio 2,4 2,32 2,24 2,16 2,08 Controles 6 meses 1 año Más de 5 años Figura 4 Niveles de calcio, representados como media (mmol/L), obtenidos mediante decriptivos y tablas de contingencia para controles, pacientes a los 6 meses de ser intervenidos, pacientes al año de dicha intervención y pacientes tras una media de más de cinco años después de la cirugía. Discusión Domínguez et al realizaron un estudio en pacientes intervenidos de DBP en el que incluyeron un 82% mujeres y un 18% varones. Partieron de un peso medio de 132 kg, y de un IMC de 51,23 kg/m2 . La mayor pérdida de peso la encontraron el primer año tras la intervención, fundamentalmente en los seis primeros meses y, tras cinco años las comorbilidades desaparecieron en más del 95% de los casos11 . Nuestra población presentó una distribución similar entre sexos, aunque unos valores pre-cirugía medios de peso y de IMC menores. La mayor pérdida de peso en nuestro estudio fue también en los seis primeros meses y encontramos un mayor porcentaje de comorbilidades asociadas. Parece que el BPG es el más extensamente utilizado. Con esta técnica se ha conseguido la mejor relación entre resultados y complicaciones con mejoría en las comorbilidades. Aunque los déficits metabólico-nutricionales suelen ser leves con los suplementos habituales, los más frecuentes serían de hierro y vitamina B1219,20 . En nuestra población fueron significativas las deficiencias de vitamina A y las concentraciones disminuidas aunque dentro de la normalidad de la vitamina E, zinc, calcio y hierro y no se encontraron deficiencias de vitamina B12. Tras la DBP los déficits de proteínas y vitaminas liposolubles son más frecuentes que tras el BPG ya que después de un año tras la intervención una gran parte de los pacientes sometidos a DBP desarrollan anemia o deficiencias de vitaminas liposolubles. Además, muchos de estos pacientes intervenidos serían hospitalizados para el tratamiento de esta malnutrición. Estos autores apuntan que los nutrientes más afectados tras la cirugía serían las proteínas, vitamina B12, folato, hierro, calcio y tiamina1 . Algunos autores afirman que la mayoría de los pacientes que toman suplementos de vitaminas E y B6 y de folato en el rango de las recomendaciones de la US RDA Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Concentraciones séricas de vitaminas liposolubles y de zinc en pacientes sometidos a cirugía bariátrica mantendrían un estatus normal de dichos nutrientes, existiendo una correlación significativa entre los niveles de suplementos y la concentración plasmática de los mismos21 . Sin embargo, nuestros pacientes no alcanzaron niveles de vitamina E en el rango de concentraciones de los controles y en el caso del folato si habría concordancia con lo descrito por estos autores. Los principales factores identificados que contribuyen a la aparición y/o agravante del déficit de vitamina A para estos autores en el pre y post intervención de BPG serían el estrés oxidativo, el déficit de otros nutrientes, la malabsorción de lípidos en el periodo post-intervención, la ingesta insuficiente de grasas y la presencia de hígado graso no alcohólico22 . Otros, señalan que hay evidencias de una posible asociación de la deficiencia de vitamina A con la cirugía bariátrica, ya que la suplementación oral no presenta el impacto esperado, y que habría que enfatizar la determinación de la misma antes y después de la cirugía. La alta prevalencia de déficit de dicha vitamina tanto pre como postcirugía, incluso en pacientes suplementados, podría ser debida a su bioconversión a retinol debido a la mayor demanda a la que están expuestos estos individuos23 . Se ha visto que hay una gran prevalencia de deficiencias nutricionales en los pacientes candidatos a cirugía por lo que dichos niveles también deberían ser evaluados antes de la intervención para impedir, retardar o minimizar las complicaciones del período posquirúrgico1,24 . Sin embargo, en nuestro estudio no se pudo disponer de las concentraciones pre-cirugía de los distintos marcadores. La monitorización de las concentraciones séricas de los distintos parámetros bioquímicos en intervalos regulares sería esencial en el seguimiento de los pacientes intervenidos de cirugía bariátrica para poder paliar las deficiencias a corto y a largo plazo y así prevenir la malnutrición1,5,8,9 . En nuestra población no se encontraron diferencias entre los pacientes suplementados y los que no, lo que podría indicar que sería insuficiente o que podría haber un gran porcentaje de abandono (que sería difícil de cuantificar) además del derivado de la mala tolerancia por las complicaciones de la cirugía. Todo esto podría ser la causa de las distintas deficiencias encontradas por los diferentes autores. En conclusión, aunque la cirugía bariátrica es efectiva para la reducción de peso y de comorbilidades en los pacientes que sufren obesidad mórbida, dicha pérdida de peso suele ser debida a la disminución de la absorción de calorías secundaria a la malabsorción de las grasas o bien a la restricción oral, por lo tanto podría causar, entre otras, deficiencias de vitaminas liposolubles y alterar el metabolismo del zinc, del calcio y de otros nutrientes pudiendo tener consecuencias clínicas severas por lo que sería necesaria la monitorización nutricional después de una intervención malabsortiva de obesidad mórbida5,12,25,26 . En nuestro estudio se encontraron deficicits de vitamina A y niveles disminuidos, aunque dentro de los rangos de referencia, de vitamina E, zinc, calcio y hierro en los pacientes intervenidos de cirugía bariátrica. Dichas deficiencias suelen persistir a largo plazo por lo que sería de gran importancia la cuantificación de dichos parámetros y el seguimiento de los pacientes para minimizar las posibles complicaciones derivadas de dichas carencias. 35 Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografía 1. Álvarez-Leite JI. Nutrient deficiencies secondary to bariatric surgery. Curr Opin Clin Nutr Metab Care. 2004;7:569—75. 2. Batsis JA, López-Jiménez F, Collazo-Clavell ML, Clark MM, Somers VK, Sarr MG. Quality of life after bariatric surgery: a population-based cohort study. Am J Med. 2009;122:1055.e1—10. 3. Korenkov M. Bariatric surgery. En: Wolf G, editor. Obesity and the Kidney. Contrib Nephrol, 151. Basel: Karger; 2006. p. 243—53, doi:10.1159/000095334. 4. Fisher BL, Schauer P. Medical and surgical options in the treatment of severe obesity. Am J Surg. 2002;184:9S—16S. 5. Malone M. Recommended nutritional supplements for bariatric surgery patients. Ann Pharmacother. 2008;42:1851—8. 6. Scheiwiller A, Sykora M. Obesity surgery, useful knowledge in indication and follow up. Praxis (Bern 1994). 2009;98:1155—60, 7. 7. Korenkov M, Sauerland S, Junginger T. Surgery for obesity. Curr Opin Gastroenterol. 2005;21:679—83. 8. Pournaras DJ, Roux CW. After bariatric surgery, what vitamins should be measured and what supplements should be given? Clin Endocrinol (Oxf). 2009;71:322—5. 9. Bavaresco M, Paganini S, Lima TP, Salgado W, Ceneviva R, Dos Santos JE, et al. Nutritional Course of patients submitted to bariatric surgery. Obes Surg. 2008;18:870—6. 10. Pories WJ. Bariatric surgery: risks and rewards. J Clin Endocrinol Metab. 2008;93:89—96. 11. Domínguez-Díez A, Olmedo-Mendicoague F, Ingelmo-Setién A, Gómez-Fleitas M, Fernández-Escalante C. By-pass biliopancreático. Cir Esp. 2004;75:251—8. 12. Folope V, Coeffier M, Dechelotte P. Nutritional deficiencies associated with bariatric surgery. Gastroenterol Clin Biol. 2007;31:369—77. 13. Bloomberg RD, Fleishman A, Nalle JE, Herron DM, Kini S. Nutritional deficiencies following bariatric surgery: what have we learned? Obes Surg. 2005;15:145—54. 14. Chae T, Foroozan R. Vitamin A deficiency in patients with a remote history of intestinal surgery. Br J Ophthalmol. 2006;90:955—6. 15. Cominetti C, Garrido AB, Cozzolino SM. Zinc nutritional status of morbidly obese patients before and after Roux-en-Y gastric bypass: a preliminary report. Obes Surg. 2006;16:448— 53. 16. Arnaud J, Fortis I, Blachier S, Kia P, Favier A. Simultaneus determination of retinal, alpha tocopherol and beta carotene in serum by isocratic high-performance liquid chromatography. J Chromatogr. 1991;572:103—16, 6. 17. Monreal JI, Cocho JA, Seijas MV, Deulofeu R, Navajo JA, González C, et al. Determinación de las concentraciones de Cobre y Zinc: Estudio multicéntrico.Comisión de elementos Traza de la SEQC. Química Clínica. 1994;13:60—7. 18. Perry D. Flame atomic absorption spectrometric determination of serum zinc: Collaborative study. Assoc Off Anal Chem. 1990;73:619—21. 19. Carrasco Sánchez FJ, Díaz Alcaide F, Marín Fernández Y, Chaparro Moreno I, Pujol de la Llave E. Prevalencia de obesidad en pacientes médicos hospitalizados. An Med Interna (Madrid). [revista en Internet]. 2002 Sep [citado 5/09/2010], 19:19-22. Disponible en: http://scielo.isciii.es/scielo.php? script=sci arttext&pid=S0212-71992002000900004&lng=es. doi: 10.4321/S0212-71992002000900004. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 36 20. Díez del Val I, Martínez-Blázquez C, Valencia-Cortejoso J, Sierra-Esteban V, Vitores-López JM. By pass gástrico. Cir Esp. 2004;75:244—50. 21. Boylan LM, Sugerman HJ, Driskell JA. Vitamin E, vitamin B6, vitamin B-12, and folate status of gastric bypass surgery patients. J Am Diet Assoc. 1988;88:579—85. 22. Chaves GV, Pereira SE, Saboya CJ, Ramalho A. Nutritional status o vitamin A in morbid obesity before and after Roux-en-Y gastric bypass. Obes Surg. 2007;17:970—6. 23. Pereira S, Saboya C, Chaves G, Ramalho A. Class III obesity and its relationship with the nutritional status of vitamin A in pre- M. Ortiz Espejo et al and postoperative gastric bypass. Obes Surg. 2009;19:738— 44. 24. Schweiger C, Weiss R, Berry E, Keidar A. Nutritional deficiencies in bariatric surgery candidates. Obes Surg. 2010;20:193—7. 25. Slater GH, Ren CJ, Siegel N, Williams T, Barr D, Wolfe B, et al. Serum fat-soluble vitamin deficiency and abnormal calcium metabolism after malabsortive bariatric surgery. J Gastrointest Surg. 2004;8:48—55, discussion 54—5. 26. Madan AK, Orth WS, Tichansky DS, Ternovits CA. Vitamin and trace levels after laparoscopic gastric bypass. Obes Surg. 2006;16:603—6. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Rev Lab Clin. 2011;4(1):37—41 Revista del Laboratorio Clínico www.elsevier.es/LabClin NOTA TÉCNICA Análisis mutacional de GNPTAB para el diagnóstico molecular de mucolipidosis tipo II (I-cell disease). Descripción de dos nuevas mutaciones sin sentido asociadas con la enfermedad夽 Violeta Latorre a y Thierry Levade b,∗ a b Laboratorio de Bioquímica Clínica, HCU Lozano Blesa, SALUD, Zaragoza, España Laboratorio de Bioquímica ‘Maladies Métaboliques’, Institut Fédératif de Biologie, CHU Purpan, Toulouse, Francia Recibido el 29 de junio de 2010; aceptado el 2 de noviembre de 2010 Disponible en Internet el 20 de febrero de 2011 PALABRAS CLAVE Mucolipidosis tipo II; I-cell disease; N-acetilglucosaminil 1-fosfotransferasa; GNPTAB; Análisis mutacional Resumen Introducción: La mucolipidosis tipo II alfa/beta, también conocida como I-cell disease (MIM 252500), es una enfermedad metabólica consistente en una alteración en el tráfico de las hidrolasas lisosomales, causada por la actividad deficiente de la N-acetilglucosaminil 1-fosfo (NAcGlc-1-P) transferasa, responsable del paso inicial en la generación del marcador molecular manosa-6-fosfato. NAcGlc-1-P-transferasa es una enzima multimérica compuesta de tres subunidades polipeptídicas codificadas por dos genes diferentes (␣,  y ␥), el gen que codifica las subunidades ␣ y  (GNPTAB), localizado en el cromosoma 12q23.3, se encuentra alterado en MLII. Hasta la fecha, han sido descritas al menos 20 mutaciones missense/nonsense en GNPTAB relacionadas con esta enfermedad autosómica recesiva. En este estudio, caracterizamos las alteraciones moleculares de un nuevo caso de mucolipidosis II, que presentaba importantes defectos esqueléticos. Materiales y métodos: Determinación de la actividad de las hidrolasas lisosomales en fibroblastos del paciente, plasma y medio de cultivo de los fibroblastos, mediante los correspondientes sustratos fluorogénicos. Secuenciación de todos los exones y de las regiones intrón-exón del gen GNPTAB, tras la amplificación del DNA genómico del paciente. Además, se analizó el exón 11 de todos los familiares por enzimas de restricción. Resultados: La actividad residual hallada de las hidrolasas lisosomales en los fibroblastos del paciente fue de aproximadamente 14% frente a los controles, mientras que la actividad de estas enzimas se multiplicó por 32 en plasma y por 9 en el líquido extra celular de los fibroblastos en cultivo del paciente, con respecto a los valores normales. Se identificaron dos nuevas mutaciones nonsense en GNPTAB asociadas con MLII, c.1383C>A (p.Cys461X) y c.3410T>A (p.Leu1136X), para las que el paciente fue heterocigoto compuesto. 夽 Este trabajo corresponde a una comunicación científica presentada y premiada en el III Congreso Nacional del Laboratorio Clínico celebrado en Valencia del 14 al 16 de octubre de 2009. ∗ Autor para correspondencia.. Correo electrónico: levade.t@chu-toulouse.fr (T. Levade). 1888-4008/$ – see front matter © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2010.11.004 Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 38 V. Latorre, T. Levade Conclusiones: Caracterización de los defectos moleculares de GNPTAB en un nuevo caso de MLII y la identificación de dos mutaciones noveles sin sentido, que facilitarán el diagnóstico prenatal de la enfermedad en la familia del paciente. © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. KEYWORDS Mucolipidosis type II; I-cell disease; Nacetylglucosaminyl; GNPTAB; Mutational analysis GNPTAB mutational analysis for the molecular diagnosis of mucolipidosis type II (I-cell disease). Description of two novel nonsense disease-associated mutations Abstract Introduction: Mucolipidosis type II alpha/beta (MLII or I-cell disease) (MIM 252500) is a rare inborn lysosomal hydrolase trafficking disorder caused by the deficient activity of Nacetylglucosaminyl 1-phospho (NAcGlc-1-P) transferase, the enzyme responsible for the initial step in the generation of the mannose 6-phosphate recognition marker. NAcGlc-1-P-transferase is a multimeric enzyme composed of 3 polypeptide subunits (␣,  and ␥) encoded by 2 different genes. The gene encoding for the ␣/ subunits (GNPTAB), located on chromosome 12q23.3, is altered in MLII. To date, at least 20 missense/nonsense GNPTAB mutations have been described and incriminated in this autosomal recessive disorder. In this study, we characterized the molecular defect of a new case of MLII, presenting important skeletal abnormalities. Material and methods: The activity of lysosomal hydrolases in the patient’s fibroblasts, plasma and cell culture medium was determined using appropriate fluorogenic substrates. All exons, as well as exon-intron boundaries, of the GNPTAB gene were sequenced after PCR amplification of the patient’s genomic DNA. GNPTAB exon 11 was also studied by enzyme restriction analysis in the whole family. Results: In the patient’s fibroblasts, a residual activity of lysosomal hydrolases averaging 14% of control values was found, while a 32 and 9-fold increase in the activity of these enzymes was detected in plasma and the fibroblast culture medium, respectively. Two novel nonsense disease-associated GNPTAB mutations, c.1383C > A (p.Cys461X) and c.3410T > A (p.Leu1136X) were identified, the patient being a compound heterozygote. Conclusions: Characterization of the GNPTAB molecular defects in a new case of MLII and the identification of two novel nonsense mutations facilitated the prenatal diagnosis of this disease in the patient’s family. © 2010 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción La mucolipidosis tipo II (I-cell disease) (OMIM 252500) es una enfermedad metabólica autosómica recesiva consistente en una alteración en el tráfico de las hidrolasas lisosomales, debido a la actividad deficiente de la enzima N-acetilglucosaminil 1-fosfotransferasa (NAcGlc-1P-transferasa [IUBMB accession number EC 2.7.8.17]), una proteína multimérica compuesta por tres subunidades polipeptídicas (␣,  y ␥) responsable del paso inicial en la generación del marcador molecular manosa-6-fosfato1,2 . Esta enfermedad se caracteriza por la presencia de numerosos cuerpos de inclusión en diferentes tipos celulares, ausencia de mucopolisacariduria, incremento de la actividad de las enzimas lisosomales en plasma, mientras que estas enzimas son deficientes en los fibroblastos3,4 . Entre sus manifestaciones clínicas, destacan importantes alteraciones esqueléticas, retraso en el crecimiento y afectación del músculo cardiaco3,5 . La esperanza media de vida de estos pacientes se sitúa entre los 5 y los 8 años de vida6 . Hasta la fecha, han sido descritas al menos 20 mutaciones missense/nonsense en GNPTAB3−5,7—11 relacionadas con esta enfermedad autosómica recesiva. Actualmente, como herramienta bioquímica para el diagnóstico se utiliza la determinación de la actividad de múltiples hidrolasas lisosomales en fibroblastos y suero, y a nivel mundial se realiza en muy pocos laboratorios, el análisis mutacional de GNPTAB para el diagnóstico molecular. En este estudio, presentamos un nuevo caso de MLII en un neonato prematuro con importantes deformidades óseas en extremidades, cuerpos de inclusión en linfocitos y elevaciones de la parathormona, diagnosticado de esta enfermedad por sus manifestaciones clínicas y determinación de la actividad de las hidrolasas lisosomales. Tras el exitus del paciente y el deseo de los padres de un nuevo embarazo, se caracterizaron las alteraciones moleculares en el gen GNPTAB en el paciente y en los padres, con el objetivo de posibilitar en un futuro el diagnóstico prenatal en esta familia. Material y métodos Paciente a estudio En el CHU de Poitiers (Francia) se realizó el seguimiento ecográfico del feto de una madre primípara, se detectó exceso de líquido amniótico y longitudes disminuidas en fémur y húmero. El cariotipo realizado al líquido amniótico no presentaba alteraciones (46,XY). En la semana 32 presentó amenaza de parto prematuro, que finalmente tuvo Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Análisis mutacional de GNPTAB para el diagnóstico molecular de mucolipidosis tipo II (I-cell disease) lugar a las 33 semanas y dos días por cesárea. El neonato requirió ventilación mecánica, presentó hipertrofia gingival, extremidades cortas, tórax más pequeño de lo habitual e hipoplasia pulmonar. Se observaron cuerpos de inclusión en los linfocitos del paciente y concentración elevada de parathormona en suero. El paciente falleció con 15 días de vida. Análisis enzimático En el laboratorio de «Maladies Métaboliques» Institut Fédératif de Biologie, CHU Purpan, Toulouse (Francia), se determinó la actividad de las enzimas de lipidosis (-hexosaminidasa total, -hexosaminidasa A, hexosaminidasa A [con sustrato específico], -galactosidasa, -glucocerebrosidasa, ␣-galactosidasa A y arilsulfatasa A), enzimas de mucolipidosis y oligosacaridosis (␣-manosidasa, ␣-L-fucosidasa, -manosidasa) y enzimas de mucopolisacaridosis (-glucuronidasa y arilsulfatasa B) en leucocitos y fibroblastos en cultivo, y -hexosaminidasa total, ␣-manosidasa, -glucuronidasa en plasma y líquido extracelular de fibroblastos en cultivo del paciente y de un grupo control negativo para MLII. Las actividades enzimáticas se determinaron usando los correspondientes sustratos fluorogénicos o cromogénicos12 . Análisis molecular En el laboratorio de «Maladies Métaboliques» Institut Fédératif de Biologie, CHU Purpan, Toulouse (Francia), en colaboración con el Servicio de Bioquímica Clínica del HCU Lozano Blesa, Zaragoza (España), tras el exitus del paciente y con el objetivo de poder realizar en el futuro un diagnóstico prenatal en la familia, se llevó a cabo la implantación del análisis molecular de GNPTAB y el estudio de las alteraciones de este gen en el probando y sus progenitores. En el caso del paciente, se aisló DNA genómico de fibroblastos en cultivo (Wizard Genomic DNA Purification Kit, Promega). Se amplificaron individualmente los exones 1 al 21 del gen GNPTAB del paciente, incluyendo las uniones intrón-exón, en ambas direcciones usando los primers descritos en la tabla 1 1,13,14 y las condiciones especificadas en la tabla 2. La purificación directa del producto de PCR se realizó con el kit Nucleospin Extract II (Macherey-Nagel, Alemania) para todos los exones, con la excepción del exón 3 que se purificó con QIAquick Gel Extraction kit (250) (Qiagen). El DNA se secuenció usando un secuenciador ABI3100 Applied Biosystems Automatic. En el caso de los padres, se aisló DNA genómico a partir de muestras de sangre EDTA, se amplificaron, purificaron y secuenciaron los exones 11 y 18 del modo anteriormente descrito. Para el análisis por enzimas de restricción del exón 11 del probando y sus padres, los productos de PCR se incubaron con Dde I (Roche Diagnostics, Alemania), y se analizaron en un gel de agarosa al 4%. Para la evaluación de las secuencias se utilizaron los programas Multalin, Bioinformatic Reverse Complement y Chromas. Resultados Análisis enzimático En leucocitos de sangre periférica del paciente se hallaron actividades casi normales frente al grupo control de las Tabla 1 39 Secuencias de los primers usados. Primer Secuencia del oligonucleótido 5’ 3’ 1F 1087 1R 1088 1F 1233 1R 1349 2F 2R 3F 1078 3R 1082 3R 1162 4F 4R 5F 5R 6F 6R 7F 7R 8F 8R 9F 9R 10F 10R 11F 11R 12F 12R 13F 1163 13R 1164 13F 1125 13F 1126 13R 1128 14F 14R 15F 1132 15R 1134 16F 16R 17F 17R 18F 18R 19F 19R 20F 20R 21F 1219 21R 1257 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ 5’ CGT CCG TCG CCG GAG CTG CAA TG 3 GGC AAA ACC CCG TCT CTA ATA ATG 3’ GGC GGT GAA GGG GTG ATG CTG TTC 3’ ACA TAC TGT ATC GGG GCA TC 3’ GAA AGT TAT ATA CTC TTA GTC 3’ TGC TAA AGT GAA CAC ATC AGA 3’ CATAATCTCTGGGTTTAAACCCTGTG 3’ AACCCTCCCCAGTGCAGTGAAGC 3’ GGGATTACAGGTGTGAGCCACC 3’ TAC AGT GGG AGG TAT AGT AGC 3’ CTA TGC ACT CAG CAC TGC AAA 3’ AGC TTC TTG CTG ATT AAA 3’ TCA AAC ATC CAA TGA TAA CAT 3’ CAG ACA CCA TAG TTG AGT ATT 3’ CTT GAA TCC ACA GTC ATT AAT 3’ TCA GCT GTA GGT TTT CAC CAG 3’ GTA AGG AGT GAG GCT CTT CTG 3’ GGA ATT TAA AGG TGC TTC ATC 3’ CTT ACA CAT TTT TAA CAT CTT 3’ GAC AAA GAG GAG GAG GTA TGA 3’ GAA GGC AAT GAA GAG CTA GAG 3’ ACC CAA ACA GCT CTC ATT CA 3’ GCT AAG TGA CTT CCA CGC TAG 3’ TGT ATC AGA AGC CAG AAG TCA 3’ TAG CAC ATG TTC AAT AAT GAT 3’ ACT GTC TTT CAA AAT TGT AAT 3’ TCT CTC TAC CTG TCA AGG ATG 3’ TGC CTA CTT CAG CAG CAC ATA TAC 3’ CCT GAG CAT GAG AAA GAA TGA GG 3’ CAA GTG GAA AAC CAT CCA CC 3’ TCC AAG TCA GCC TTG CTG AG 3’ CTT CCT GGG CTC TCC TTG TTG 3’ GTA CAC TTG TGC ACT AAA CAT 3’ GGT AAA TAT GCA CAT TTC AAG 3’ GTT TGC TTG TGT TCA GAA CTA AGG 3’ TGT GAG CCA CTG CGC CTG ACC AG 3’ CAC AGT CAT TAC TTA CAA TGC 3’ AAA GAC ATA TAA AAC CAT AGA 3’ GGA CTA AAT TGC CCT AGT TTC 3’ CCA GAC CTT TGT GAT TAC TCT 3’ GTG GAT GTT GAG TCC ACT ACG 3’ CTA CTC CCT TCT TTC CAG TCC 3’ AGG TCA GGA TTA TCC ATA TGT 3’ GCT AAG TGA CTT CCA CGC TAG 3’ CCA TAT ACA GAA GTA CAT AGT 3’ CTA GTA TAC CAA GAA ATA CCA 3’ GGC TCT TAG AAA GTT TGA TGC AC 3’ GCA TCA CAT CAC AAA GAC ATC TC 3’ Tomado de Kudo M1 , Tiede S13 y Tiede S14 . enzimas de lipidosis, mucopolisacaridosis, oligosacaridosis y actividades marcadamente elevadas de las hidrolasas lisosomales del probando en plasma (aprox. 3.200%). Se observó una actividad residual (14,7%) de todas las hidrolasas lisosomales (con la excepción de la beta-glucocerebrosidasa, cuyo transporte lisosomal es independiente del sistema de reconocimiento de la manosa-6-fosfato) en muestras de Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 40 V. Latorre, T. Levade Tabla 2 Condiciones de PCR. EXÓN Primers de amplificación (Primers de secuenciación) Temperatura de hibridación (◦ C) Tiempo de elongación (s) Exón 1 1F 1087, 1R 1088 (1F 1233, 1R 1349) 2F, 2R 3F 1078, 3R 1082 (3R 1162) 4F, 4R 5F, 5R 6F, 6R 7F, 7R 8F, 8R 9F, 9R 10F, 10R 11F, 11R 12F, 12R 13F 1163, 13R 1164 (13R 1128, 13F 1125, 13F 1126) 14F, 14R 15F 1132, 15R 1134 16F, 16R 17F, 17R 18F, 18R 19F, 19R 20F, 20R 21F 1219, 21R 1257 60,0 ◦ C (DMSO) 90 s 53,2 ◦ C 60,6 ◦ C 45 s 90 s Exón 2 Exón 3 Exón Exón Exón Exón Exón Exón Exón Exón Exón Exón 4 5 6 7 8 9 10 11 12 13 Exón Exón Exón Exón Exón Exón Exón Exón 14 15 16 17 18 19 20 21 58,0 ◦ C 58,0 ◦ C 51,9 ◦ C 58,0 ◦ C 58,0 ◦ C 58,0 ◦ C 58,0 ◦ C 58,0 ◦ C 58,0 ◦ C 62,5 ◦ C (DMSO) (DMSO) (DMSO) (DMSO) 58,0 ◦ C 60,5 ◦ C 58,0 ◦ C 58,0 ◦ C (DMSO) 58,0 ◦ C (DMSO) 58,0 ◦ C 51,9 ◦ C 60,0 ◦ C (DMSO) 45 45 45 45 45 45 45 45 45 90 s s s s s s s s s s 45 45 45 45 45 45 45 90 s s s s s s s s Análisis mutacional 267 234 124,123 104 89 80 248 148 100 GNPTAB EXÓN 11 Mutación c.1383C>A 0 1 2 (p.Cys461X) Enzima de restricción Ddel Figura 1 La mutación c.1383C>A GNPTAB en estado heterocigoto en el probando y su madre. El análisis por enzima de restricción del exón 11 en el paciente (1) y su madre (2). Los productos de amplificación del exón 11 (fragmento de 248 pb) se incubaron con el enzima DdeI y fueron analizados por electroforesis en gel de agarosa. Tras la digestión con DdeI del exón 11 en el probando (1) y su madre (2), se observaron tres fragmentos en ambos casos, fragmento de 248 pb (exón 11), y fragmentos de 148 pb y 100 pb (tras digestión del exón 11 con DdeI). (0): Marcador molecular. fibroblastos en cultivo, con la consiguiente elevación (951%) de su actividad en el líquido extracelular de fibroblastos. Estas determinaciones bioquímicas, junto con el estudio clínico del paciente, condujeron al diagnóstico de MLII. La secuenciación de los 21 exones y las correspondientes uniones intrón-exón del gen GNPTAB mostraron que el probando era heterocigoto compuesto para las mutaciones noveles: c.1383C>A (p.Cys461X) en el exón 11 y c.3410T>A (p.Leu1136X) en el exón 18. La madre del probando resultó ser heterocigoto para la mutación c.1383C>A (p.Cys461X) del exón 11, sin alteraciones en el exón 18, y el padre heterocigoto para la mutación c.3410T>A (p.Leu1136X) del exón 18, sin alteraciones en el exón 11. El status genético de la familia se confirmó por el enzima de restricción Dde I para la mutación del exón 11 (fig. 1). Además de las mutaciones citadas, el paciente presentaba la sustitución c.1932A>G (p.Thr644Thr) en el exón 13 en estado heterocigoto, y la deleción del-42 -40CGG común en la población control y no asociada con MLII. Ambas alteraciones también se encontraron en el padre en estado heterocigoto. Ni el probando ni sus progenitores presentaron ninguna otra mutación asociada a MLII que hubiera sido descrita con anterioridad. Discusión y conclusiones Hasta hace poco, el diagnóstico de MLII se basaba solamente en la determinación de las actividades de hidrolasas lisosomales en suero, mostrando una marcada elevación; o en muestras de fibroblastos (extraídos de la piel) en cultivo, donde se observaba una actividad deficiente de la mayor parte de estas enzimas. Sin embargo, este método no solo requiere una muestra no siempre disponible, como es el Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Análisis mutacional de GNPTAB para el diagnóstico molecular de mucolipidosis tipo II (I-cell disease) cultivo de fibroblastos extraídos por biopsia cutánea, sino que, además, con este método enzimático no es posible diferenciar entre la mucolipidosis tipo II y la mucolipidosis tipo III; por estos motivos el análisis mutacional de GNPTAB se ha convertido en el «gold standard» para el diagnóstico definitivo de MLII. De ahí la importancia de la implantación en nuestro laboratorio de enfermedades metabólicas, del diagnóstico molecular de MLII, mediante el análisis mutacional de GNPTAB, disponible en muy pocos laboratorios en el mundo. Se realizó la caracterización molecular de un nuevo caso de MLII con características fenotípicas muy severas, se describieron en el probando dos mutaciones de codón de parada en heterocigosis compuesta, c.1383C>A (p.Cys461X) en el exón 11 y c.3410T>A (p.Leu1136X) en el exón 18, noveles y concordantes con las actividades de hidrolasas lisosomales halladas en el paciente. Puesto que las mutaciones halladas en el paciente son de tipo nonsense cabe esperar que las proteínas sintetizadas a partir de este DNA están truncadas, y que, por otro lado, sea posible que el mRNA correspondiente esté degradado por el proceso de «Nonsense-mediated mRNA Decay», así que por estos motivos cabría esperar un fenotipo de gran severidad, como es el caso del paciente presentado que fallece a los pocos días de vida. Tras el posterior estudio de los padres, heterocigotos ambos, la madre para la mutación c.1383C>A (p.Cys461X) del exón 11 y el padre para la mutación c.3410T>A (p.Leu1136X) del exón 18, y puesto que ningún miembro de la familia presentó ninguna otra de las mutaciones asociadas a la enfermedad que hubieran sido descritas anteriormente, se infiere la implicación de estas dos nuevas mutaciones en MLII, lo que consideramos relevante en el conocimiento molecular de esta patología, debido al bajo número de mutaciones caracterizadas hasta el momento. Además, este estudio facilitará el diagnóstico prenatal de MLII en un futuro embarazo de la madre del paciente; lo que consideramos de gran importancia por la gravedad de las manifestaciones clínicas y la corta esperanza de vida en pacientes afectos de esta enfermedad. Conflicto de intereses 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. Los autores declaran no tener ningún conflicto de intereses. Bibliografía 1. Kudo M, Brem MS, Canfield WM. Mucolipidosis II (I-Cell Disease) and Mucolipidosis IIIA (Classical Pseudo-Hurler Polydystrophy) 14. 41 are caused by Mutations in the GlcNAc-Phosphotransferase a/bSubunits Precursor Gene. Am J Hum Genet. 2006;78:451—63. Bargal R, Zeigler M, Abu-Libdeh B. When Mucolipidosis III meets Mucolipidosis II: GNPTAB gene mutations in 24 patients. I Mol Gen Metabol. 2006;88:359—63. Paik KH, Song SM, Ki CS. Identification of Mutations in the GNPTA (MGC4170) Gene Coding for GlcNAc-Phosphotransferase ␣/ Subunits in Korean Patients with Mucolipidosis Type II or Type III A. Hum Mut. 2005;26:308—14. Bao M, Elmendorf BJ, Booth JL. Bovine UDP-Nacetylglucosamine: lysosomal-enzyme N-acetyl-glucosamine1-phosphotransferase. II. Enzymatic characterization and identification of the catalitic subunit. J Biol Chem. 1996;271:31446—51. Bocca G, Noordam C, Wevers RA. I-cell disease presenting with severe hypophosphatemia and cardiomyopathy. Neuropediatrics. 2000;31:49—50. Patriquin HB, Kaplan P, Kind HP. Neonatal mucolipidosis II (Icell disease): clinical and radiologic features in three cases. AJR Am J Roentgenol. 1977;129:37. Encarnaçao M, Lacerda L, Costa R, Prata MJ, Coutinho MF, Ribeiro H. Molecular analysis of the GNPTAB and GNPTG genes in 13 patientes with mucolipidosis type II or type IIIidentification of eight novel mutations. Clin Genet. 2009;76: 76—84. Otomo T, Muramatsu T, Yorifuji T, Okuyama T, Nakabayashi H. Mucolipidosis II and III alpha/beta: a study of 61 probands. J Hum Genet. 2009;54:145—51. Tappino B, Chuzhanova NA, Regis S, Dardis A, Corsolini F, Stroppiano M. Molecular characterization of 22 novel UDP-N-acetylglucosamine-1-phosphate transferase alpha-andbeta-subunit (GNPTAB) gene mutations causing mucolipidosis types II alpha/beta and III alpha/beta in 46 patients. Hum Mutat. 2009;30:E956—73. Zarghooni M, Dittakavi SS. Molecular analysis of cell lines from patients with mucolipidosis II and mucolipidosis III. Am J Med Genet A. 2009;149A:2753—61. Cathey SS, Leroy JG, Wood T, Eaves K, Simensen RJ, Kudo M. Phenotype and genotype in mucolipidosis II and III alpha/beta: a study of 61 probands. J Med Genet. 2010;47:38—48. Epub 2009 Jul 16. Wenger DA, Williams C. En: Hommes FA, editor. Screening for Lysosomal Disorders. Techniques in Diagnostic Human Biochemical Genetics: a Laboratory Manual. Nueva York: Wiley-Liss; 1991. p. 587—617. Tiede S, Muschol N, Reutter G, Cantz M, Ullrich K, Braulke T. Missense mutations in N-acetylglucosamine-1phosphotransferase alpha/beta subunit gene in a patient with mucolipidosis III and a mild clinical phenotype. Am J Med Genet A. 2005;137A:235—40. Tiede S, Storch S, Lübke T. Mucolipidosis II is caused by mutations in GNPTA encoding the a/b GlcNAc-1-phosphotransferase. Nat Med. 2005;11:1109—12. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Rev Lab Clin. 2011;4(1):42—44 Revista del Laboratorio Clínico www.elsevier.es/LabClin NOTA TÉCNICA Prevalencia de parasitosis intestinales en niños de acogida saharauis Germán Seseña Del Olmo a,∗ , María José Rodríguez Escudero a , Mari Carmen Martínez Medina a y José Antonio Pérez Molina b a b Servicio de Microbiología, Hospital Virgen de la Luz, Cuenca, España Unidad de Medicina Tropical, Hospital Ramón y Cajal, Madrid, España Recibido el 15 de julio de 2010; aceptado el 2 de octubre de 2010 Disponible en Internet el 12 de noviembre de 2010 PALABRAS CLAVE Parásitos; Intestinales; Niños saharauis Resumen El artículo es un estudio retrospectivo para conocer la prevalencia de parasitaciones intestinales en niños de acogida saharauis en la provincia de Cuenca (España). Se incluyeron un total de 157 muestras de 90 pacientes durante un período de cinco años. Encontramos que los pacientes presentaban un porcentaje de parasitación del 37,37%. Sería conveniente realizar un protocolo para el diagnóstico y tratamiento de las parasitaciones intestinales en estos niños. © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. KEYWORDS Prevalence of intestinal parasite infestation in foster children from the Sahara Parasites; Intestinal; Children from Sahara Abstract We performed a retrospective study to find out the prevalence of intestinal parasite infestation in foster children from the Sahara in Cuenca (Spain). We included 157 samples from 90 patients over a five-year period. It was found that 37.37% of the children were infected with pathological parasites. It would be advisable to develop a protocol for the diagnosis and treatment of intestinal parasite infestation in these children. © 2010 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción Durante los últimos años en nuestro país se ha ido extendiendo la altruista labor de acoger a niños de regiones desfavorecidas. Esta acogida se realiza habitualmente durante la época estival. En nuestra región uno de los pro- ∗ Autor para correspondencia. Correo electrónico: germancoslada@yahoo.es (G. Seseña Del Olmo). gramas más destacados es el que se desarrolla para los niños procedentes del Sáhara, que viene haciéndose ininterrumpidamente desde 1992 y del que se benefician cada año aproximadamente 100 niños en Castilla-La Mancha de los que 25 son acogidos en la provincia de Cuenca. Las edades de estos niños están comprendidas entre los 5 y los 14 años. Las condiciones sociosanitarias en que viven suelen ser muy precarias; ausencia de agua corriente, hacinamiento, ausencia de alcantarillado, etc., circunstancias que hacen que la población sea especialmente susceptible a múltiples infecciones entre las que destacan las parasitosis 1888-4008/$ – see front matter © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2010.10.001 Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Prevalencia de parasitosis intestinales en niños de acogida saharauis 43 En los 37 casos con parásitos patógenos, la distribución de los mismos fue la siguiente: en 16 se observaron quistes de Giardia lamblia, en 14 se observaron huevos de Hymenolepis nana, en 5 pacientes se observó la parasitación conjunta por G. lamblia y H. nana y en dos casos se observaron quistes de Entamoeba histolytica/dispar. De los 9 niños que visitaron nuestro país en dos ocasiones, cuatro de ellos, que no eran portadores de parásitos patógenos en su primera visita, sí estaban infectados en la segunda, tres por H. nana y uno por G. lamblia. Además uno de ellos que estaba infectado por G. lamblia el primer año, en su visita al año siguiente vino parasitado por H. nana. Discusión Figura 1 por año. Distribución de los pacientes y número de muestras intestinales. Estas parasitaciones provocan una alta morbilidad en la población que las padece y además pueden ser un foco de infección para las familias de acogida. Parece adecuado profundizar en el conocimiento de estas enfermedades para conocer cuál es la situación actual, ya que hasta la fecha disponemos de pocos estudios que nos den datos sobre la magnitud del problema1,2 . Material y métodos El objetivo fue determinar la presencia de parasitosis intestinales en los niños saharauis de acogida en la provincia de Cuenca. Para ello realizamos un estudio retrospectivo en el que incluimos todas las muestras de heces remitidas a nuestro laboratorio para determinar la presencia de parásitos en los niños saharauis acogidos en la provincia de Cuenca durante un período de 5 años (2003—2007). Para el análisis de datos se utilizó el programa informático Access (Microsoft, Washington, EE.UU.). Las heces se procesaron mediante fijación de la muestra con acetato de sodio (SAF) y posterior concentración de la misma por el método de centrifugación de formol-éter, para ser observadas finalmente al microscopio óptico. Resultados Se incluyeron un total de 90 pacientes de los cuales 9 repitieron envío de muestras en dos años distintos, lo que supone un total de 99 episodios durante el estudio. Se procesaron un total de 157 muestras de heces durante los cinco años. El rango de edad de los pacientes fue de 5 a 14 años. La distribución por sexos fue de 40 niñas por 50 niños. La distribución de pacientes y muestras por años se presenta en la figura 1. De los 99 episodios contabilizados, en 37 casos se observó la presencia de algún parásito intestinal patógeno, lo que supone un 37,37% de parasitosis intestinales. Solo en 17 casos no se encontraron parásitos en las heces, y en el resto de los 45 casos se observaron uno o más parásitos comensales o cuya patogenicidad es dudosa (Blastocystis hominis, Entamoeba hartmanii o Entamoeba coli). Hemos de señalar que los pacientes en el momento del estudio se encontraban asintomáticos o pauciasintomáticos y que en la mayoría de los pacientes los hallazgos se tratan de analíticas de control. Esta ausencia de síntomas en pacientes con parasitosis intestinales está bien descrita en la literatura3 . En muchos casos, las muestras aportadas por los pacientes fueron de una o dos heces, lo que sugiere que un mayor número de muestras hubiera aumentado el número de diagnósticos, según indican algunos autores, debido a la eliminación intermitente de los parásitos en heces4 . El estado de portadores crónicos parasitarios de estos niños puede hacer que la cantidad de parásitos eliminados por las heces sea menor que en otro tipo de pacientes y que el diagnóstico en un número menor de muestras sea más complicado. Hubiera sido interesante haber hecho un estudio molecular de los dos casos en los que se observaron E. hystolitica/dispar para poder diferenciar entre ambas especies, indistinguibles desde el punto de vista morfológico. Aunque en nuestra opinión, y si no se dispone de las herramientas de una manera inmediata, esto puede suponer un retraso en el diagnóstico y aumentar la probabilidad de un hipotético contagio. En vista de los resultados obtenidos, parece aconsejable establecer protocolos para que estos niños sean valorados lo más pronto posible a su llegada a España, para poner en marcha las medidas correctoras cuanto antes y mejorar la salud de los chicos5,6 al mismo tiempo que evitamos una posible cadena infectiva en las familias de acogida7,8 . Para ello es necesario transmitir a las propias familias la importancia de cumplir estos estudios. Además hemos de tener en cuenta el favorable rango coste/beneficio que estas pruebas tienen si contamos con la alta prevalencia de parásitos encontrados con respecto al coste de la técnica9 . Hemos visto casos en los que los niños se han reinfectado tras una primera estancia en España. Este dato constata las condiciones sociosanitarias tan precarias en las que viven. Además esto nos debe poner en guardia para repetir el examen parasitológico cada año que el niño visite nuestro país. De los resultados se desprende la necesidad de realizar estudios a todos los niños, ya que no se puede afirmar que la totalidad deba recibir tratamiento, además de tener que ser este, un tratamiento dirigido en función de los resultados obtenidos del estudio. Podría ser útil realizar un estudio epidemiológico que investigara la transmisión parasitaria en familias de acogida, Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 44 con especial atención a parásitos no autóctonos (H. nana, E. hystolitica) aunque es probable que las medidas higiénicas habituales, unidas a la escasa carga parasitaria de estos pacientes hagan esta transmisión poco probable. Bibliografía 1. Huerga H, López-Vélez R. Infectious diseases in sub-Saharan African immigrant children in Madrid, Spain. Pediatr Infect Dis J. 2002;21:830—4. 2. Tena D, Gimeno C, Lizarraga C, Teresa P, González—Praetorius A, Rodríguez E, et al. Hallazgo parasitológico en una niña saharaui. Enferm Infecc Microbiol Clin. 2001;19:275—6. 3. López-Vélez R, Huerga H, Turrientes MC. Am J Trop Med Hyg. 2003;69:115—21. 4. Atlas of human parasitology. Ash. 5th Edition. American Society for Clinical Pathology. 2007: 416. G. Seseña Del Olmo et al 5. Hjelt K, Paerregaard A, Krasilnikoff PA. Giardiasis causing chronic diarrhoea in suburban Copenhagen: Incidente, phsical growth, clinical symtoms and small intestinal abnormality. Acta Paediatr. 1992;81:881—6. 6. Newman RD, Moore SR, Lima AA, Nataro JP, Guerrant RL, Sears CL. A longitudinal study of Giardia lamblia infection in north-east Brazilian childrem. Trop Med Int Health. 2001;6: 624—34. 7. Dennis DT, Smith RP, Welch JJ, Chute CG, Anderson B, Herndon JL, et al. Endemic giardiasis in New Hampshire: A case-control study of environmental risks. J Infect Dis. 1993;167(6):1391—5. 8. Overturf GD, editor. Endemic giardiasis in the United States: Role of the day care center (Editorial). Clin Infect Dis. 1994;18:764—5. 9. Turrientes MC, Huerga H, López-Vélez R. Coste económico y carga asistencial en el laboratorio de parasitología derivados de la atención al inmigrante. Enferm Infecc Microbiol Clin. 2003;21:188—92. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Rev Lab Clin. 2011;4(1):45—49 Revista del Laboratorio Clínico www.elsevier.es/LabClin NOTA TÉCNICA Mujer de 18 años con metahemoglobinemia tras utilización de crema anestésica tópica夽 L. Román ∗ , A. Buño Soto, M.J. Alcaide Martín, P. Fernández Calle y P. Oliver Sáez Laboratorio de Urgencias, Servicio de Análisis Clínicos, Hospital Universitario La Paz, Madrid, España Recibido el 30 de junio de 2010; aceptado el 8 de noviembre de 2010 Disponible en Internet el 26 de febrero de 2011 PALABRAS CLAVE Metahemoglobinemia; Metahemoglobina; Análisis de gases en sangre; Lidocaína; Prilocaína KEYWORDS Methaemoglobinaemia; Methaemoglobin; Blood gas analysis; Lidocaine; Prilocain Resumen La metahemoglobinemia es una entidad poco frecuente, cuyo diagnóstico se basa en la aparición de niveles elevados de metahemoglobina en sangre, tanto en adultos como en niños. Es una de las causas importantes de cianosis, y en ocasiones la severidad de su presentación puede requerir el ingreso en Unidades de Cuidado Intensivo. Las causas pueden ser adquiridas o congénitas, siendo ésta última debida a mutación en el gen de la hemoglobina reductasa dependiente de NADPH. La forma adquirida o metahemoglobinemia tóxica se produce cuando los hematíes son expuestos a sustancias químicas oxidantes que aumentan la producción de metahemoglobina, sobrepasando los mecanismos reductores de protección que actúan normalmente. Se presenta el caso de una mujer de 18 años, con cuadro de cianosis de aparición súbita diagnosticada de metahemoglobinemia tóxica tras utilización de crema anestésica tópica EMLA® (mezcla de anestésicos locales, lidocaína y prilocaína). © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. An 18 year old female with methaemoglinaemia after using EMLA® topical anaesthetic cream Abstract Methaemoglobinaemia is a very uncommon disorder, with its diagnosis being based on the appearance of high levels of methaemoglobin in the blood, both in adults and children. It is an important cause of cyanosis, and occasionally its severity of its presentation may require admission to an Intensive Care Unit. It may be acquired or hereditary; the latter being due to a mutation of the NADPH-dependent haemoglobin reductase gene. The acquired form or toxic methaemoglobinaemia is produced when red cells are exposed to oxidising chemicals that increase methaemoglobin production, overwhelming the regulatory mechanisms that function normally. 夽 Este trabajo corresponde a una comunicación científica presentada y premiada en el III Congreso Nacional del Laboratorio Clínico celebrado en Valencia del 14 al 16 de octubre de 2009. ∗ Autor para correspondencia. Correo electrónico: rleone25@yahoo.com, leonard.mihaita.roman@gmail.com (L. Román). 1888-4008/$ – see front matter © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2010.11.006 Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 46 L. Román et al A case is presented of an 18 year old woman with clinical picture of the sudden appearance of cyanosis, diagnosed as toxic methaemoglobinaemia after using EMLA® topical anaesthetic cream (mixture of local anaesthetics, lidocaine and prilocaine). © 2010 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción La metahemoglobinemia se produce cuando el grado de oxidación del hierro contenido en el grupo hemo de la molécula de hemoglobina supera los mecanismos compensadores de los hematíes, y pasa al estado férrico, siendo funcionalmente incapaz de transportar oxígeno y dióxido de carbono1 . La oxidación del hierro de su estado ferroso (Fe2+ ) a su forma férrica (Fe3+ ) ocurre de manera constante en el organismo; sin embargo, esta reacción se puede revertir gracias a la acción de diversos mecanismos compensadores como el sistema enzimático directo de reducción compuesto por el citocromo b5 y la NADPH-MHb reductasa, y el sistema endógeno indirecto que también interviene en la reducción e incluye sistemas enzimáticos, ácido ascórbico y el ciclo del glutatión. Al oxidarse el hierro de la hemoglobina, ésta se convierte en metahemoglobina (MetHb). En condiciones normales, representa menos del 1,3% de la hemoglobina total1 . Cuando este valor supera el 2% es posible establecer el diagnóstico de metahemoglobinemia1—4 . La oxidación inhabilita a la hemoglobina para el transporte eficaz de oxígeno, ya que disminuye su afinidad, tanto por éste como por el CO2 , lo que se traduce a nivel celular en hipoxia tisular2,5 . La metahemoglobinemia puede ser congénita como consecuencia de una mutación genética que produce una hemoglobina anormal (hemoglobina M) o por deficiencia de alguna de las enzimas del sistema directo de reducción (herencia autosómica recesiva), o adquirida por oxidación inducida por agentes externos6 . Las principales causas de metahemoglobinemia adquirida se presentan en la tabla 1. Las manifestaciones clínicas que ocurren al elevarse la MetHb en los eritrocitos son debidas a la hipoxia tisular1 . La cianosis es el signo característico y se presenta cuando los niveles de MetHb superan el 10-15% de la hemoglobina total3 . La hipoxia desencadena una reacción simpática caracterizada por ansiedad, irritabilidad y taquicardia. En una etapa avanzada se puede encontrar disnea, confusión, alteración en el estado de alerta, fallo cardiopulmonar, crisis convulsivas y coma7 . La gravedad de los síntomas generalmente se correlaciona con los niveles medidos de metahemoglobina, sin embargo, esta relación se modifica en presencia de cardiopatía, neuropatía y/o anemia (tabla 2). Si el nivel de MetHb excede del 70% de la hemoglobina total, se puede presentar colapso vascular, estado de coma, e incluso muerte8,9 . El diagnóstico de presunción de la metahemoglobinemia es clínico y se debe sospechar cuando la cianosis aparece de forma súbita y la saturación de oxígeno no mejora a pesar de administrar oxígeno al 100%. El color de la sangre de estos pacientes es «achocolatada» y se mantiene tras la exposición al oxígeno8,9 . La confirmación diagnóstica se realiza mediante estudios de laboratorio, siendo el método recomendado la medición en sangre arterial de las distintas fracciones de hemoglobina mediante cooximetría2,10 . En cuanto al tratamiento, deben distinguirse dos fases, la primera de soporte y estabilización y una segunda fase de identificación de la causa y desintoxicación1,2,14 . Se debe evitar el contacto con la fuente de la intoxicación lo antes posible6 . Si se trata de un fármaco por vía oral, para dismi- Tabla 1 Factores predisponentes de metahemoglobinemia adquirida. Fármacos: • Anestésicos locales: benzocaína (cetacaína), lidocaína, prilocaína, EMLA (lidocaína 2,5%, prilocaína 2,5%) • Antimicrobianos: cloroquina, dapsona, primaquina • Sulfonamidas (sulfasalazina, sulfanilamida, sulfatiazida, sulfapiridina, sulfametoxazol) • Analgésicos: fenazopiridina, fenacetina • Nitritos y nitratos: óxido nítrico, nitroglicerina, nitroprusiato, nitrousóxido, nitrato de plata, nitrato de sodio, nitrito de isobutilo • Otros fármacos: flutamida, fenobarbital, quinina, metoclopramida, riluzol, azul de metileno Condiciones médicas: • Sepsis • Anemia falciforme (crisis) • Insuficiencia cardiaca • Déficit genético de glucosa-6-fosfato dehidrogenasa • Déficit genético de adenin-dinucleótido metahemoglobinreductasa Diversos: • Edad inferior a 3 años • Infección gastrointestinal • Aminofenoles, azul de metileno, cloruro de potasio, bismuto, bromatos, cloratos, productos químicos industriales (nitrobenceno, nitroetano, herbicidas), espinacas, zanahorias y berros mal cocidos o contaminados Tomado de Ash-Bernal R2 , Baraka AS8 , Wright RO10 y Patel PB11 . Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Mujer de 18 años con metahemoglobinemia tras utilización de crema anestésica tópica Tabla 2 47 Manifestaciones clínicas según concentración de metahemoglobina. Concentración de MetHb (g/dL) % sobre Hb totala Síntomasb < 1,5 1,5-3,0 3,0-4,5 4,5-7,5 < 10 10-20 20-30 30-50 7,5-10,5 > 10,5 50-70 > 70 Ninguno Cianosis Ansiedad, cefalea, taquicardia Fatiga, estado mental confuso, mareo, taquipnea e incremento de la taquicardia Coma, crisis convulsivas, arritmias y acidosis Muerte Tomado de Salamat A5 , Wright RO10 , Hay WW12 y Gold NA13 . a Asumiendo hemoglobina 15 g/dL. Pacientes que presentan concentraciones menores de hemoglobina pueden presentar síntomas más severos con otros porcentajes de metahemoglobinemia. b Pacientes con enfermedades preexistentes, como alteraciones cardiacas, pulmonares o hematológicas, pueden presentar síntomas más severos con otros porcentajes de metahemoglobinemia. nuir la absorción del medicamento ingerido se puede utilizar carbón activado, en dosis de 1 g/kg/dosis vía oral o por sonda nasogástrica y repitiendo la dosis cada seis horas, según la evolución15 . La mayor parte de los casos leves y moderados requieren solamente descontaminación y apoyo con oxígeno al 100%. El azul de metileno es el antídoto específico, y se emplea a dosis de 1-2 mg/kg/dosis en una dilución al 1 o 2% por vía intravenosa en infusión durante 5 minutos, y sus efectos deben observarse dentro de la primera hora de administración1,11,13 . Cuando la MetHb supera el 50% de la hemoglobina total, se recomienda usar 2-4 mg/kg/dosis, hasta un máximo de 7 mg/kg/dosis8,9 . Aunque no existen estudios clínicos controlados que sustenten la eficacia del azul de metileno, la experiencia clínica sugiere que este medicamento incrementa la tasa de reducción de hemoglobina hasta seis veces13 . Su uso se recomienda cuando el paciente presenta síntomas y niveles de MetHb por encima del 20%, o cuando el paciente presenta compromiso en el transporte de oxígeno por alguna otra patología concomitante como la presencia de anemia, neumonía e insuficiencia cardiaca8,9 . La mejoría clínica generalmente se presenta en los primeros 30 minutos, y una segunda dosis de azul de metileno se utiliza sólo en los casos graves, en los que todavía se encuentra evidencia de formación de MetHb. El azul de metileno es poco efectivo en pacientes con deficiencia de glucosa-6-fosfato deshidrogenasa, ya que su acción depende de la nicotinamida-adenina dinucleótido fosfato (NADP+ ). Su eficacia es mayor en eritrocitos intactos y disminuye en presencia de hemólisis13 . Otros antioxidantes como el ácido ascórbico (vitamina C), N-acetilcisteína y tocoferol (vitamina E) también se han utilizado, aunque son menos útiles en casos agudos ya que son de acción más lenta8,9,13 . En el manejo de pacientes con hemólisis grave o deficiencia de glucosa-6-fosfato deshidrogenasa, se recomienda realizar una transfusión por recambio, con las complicaciones que ésta conlleva; en estos casos, no debe emplearse azul de metileno ya que resulta ineficaz13 . En casos extremos puede plantearse como opción terapéutica el uso de oxigenoterapia en cámara hiperbárica, con objeto de incrementar la cantidad de oxígeno disponible. Caso clínico Mujer de 18 años, sin antecedentes personales patológicos conocidos de interés que, al ingreso en el servicio de Urgencias, presenta sensación de mareo con cefalea pulsátil, cianosis central y periférica de aparición súbita inicialmente en cara y dos horas posteriores también en palmas y plantas, después de utilizar hacía dos horas una crema anestésica (lidocaína 2,5%, prilocaína 2,5%) en el 51% de la superficie corporal (piernas, brazos, axilas) 30 minutos antes de una sesión de fotodepilación. En el examen clínico destaca la existencia de cianosis central y periférica, taquicardia sinusal (112 lpm) y aumento de la frecuencia respiratoria (32 rpm), siendo el resto de la exploración normal. En las pruebas complementarias del estudio cardiopulmonar (placa de tórax y electrocardiograma) no se evidenciaron hallazgos patológicos. En los análisis de urgencias se obtienen los siguientes resultados (entre paréntesis se muestra el intervalo de referencia): • Hemograma: hemoglobina 13,4 g/dL (11,5-15,3); hematocrito 40,2% (33,7-45,4); leucocitos 13,6 x 103 /L (3,7-11,6); neutrófilos 83,9% (41-74); linfocitos 8,7% (1848); monocitos 5,5% (3,5-11,6). • Gasometría arterial: pH 7,45 (7,35-7,45); pO2 68,1 mmHg (80,0-95,0); StO2 94,9% (95,0-98,0); concentración total O2 14,6 Vol/dL (16,0-21,5); pCO2 33,7 mmHg (35,045,0); fracción de MetHb 18% (0,4-1,5); bicarbonato 22,7 mmol/L (21,0-26,0); exceso de bases −0,6 mmol/L (−2,03,0). • Bioquímica: glucosa 79,0 mg/dL (70-110); Na 137,5 mmol/L (135-145); K 4,3 mmol/L (3,5-5,1); calcio total 9,68 mg/dL (8,5-10,1); creatinina 94,2 mol/L (44-106); urea 14 mmol/L (6,4-17); ALT 0,6 kat/L (0,5-1,1); AST 0,3 kat/L (0,3-0,6); LDH 182 UI/L (100-190). Tras la administración de oxigenoterapia durante una hora empeoran los síntomas de la paciente, manteniéndose la cianosis y los síntomas adrenérgicos. En la exploración física se evidenció un aumento de la taquicardia y de la taquipnea. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 48 Tabla 3 L. Román et al Resultados de magnitudes de cooximetría y su evolución en el tiempo. Hb (total) g/dL Saturación O2 (%) Deoxi Hb (%) Oxi Hb (%) Carboxi Hb (%) Met Hb (%) Ingreso 1 hora después del ingreso 6 horas posttratamiento 14 horas posttratamiento 13,5 94,9 4,1 76,9 1 18 12,6 96,3 2,7 69,7 0,5 27,1 12,6 96,3 2,3 85,2 1,2 11,3 12,8 97,4 1,1 94,7 1,9 2,3 En una nueva gasometría arterial una hora después de instaurar la oxigenoterapia se observa un aumento de la presión parcial de oxígeno (76,1 mmHg), con normalización de la presión parcial de anhídrido carbónico (36,0 mmHg), manteniéndose la saturación arterial de oxígeno dentro de la normalidad (96,3%). En el resultado de la cooximetría destaca un resultado de la fracción de MetHb muy elevado de 27,1% (hemoglobina 12,6 mg/dL). Siguiendo los procedimientos del laboratorio para comunicación de avisos críticos, el facultativo del laboratorio contactó con el facultativo responsable de la paciente para la comunicación del resultado de la MetHb contribuyéndose además a interpretar el mismo en el contexto clínico de la paciente. En la tabla 3 se muestran los resultados de magnitudes de cooximetría y su evolución en el tiempo. Ante estos resultados, se replantea el diagnóstico diferencial de la cianosis siendo razonable descartar aquellas causas que provocan una baja presión arterial del oxígeno, así como variantes de hemoglobina con baja afinidad por oxígeno. Quedaría pues como causa de la misma la existencia de una metahemoglobinemia probablemente adquirida secundaria a tóxicos. Tras una anamnesis más exhaustiva, la paciente menciona la utilización, una hora antes de una sesión de fotodepilación, de una crema anestésica tópica (EMLA® ), a dosis de 30 g, aplicada con film transparente en forma de vendaje oclusivo, para aumentar su absorción, en el 51% de la superficie corporal (piernas, brazos, axilas e ingles). Esta crema contiene dos anestésicos locales: lidocaína y prilocaína. Su uso es ampliamente reconocido como anestésico local en la piel y mucosas a una dosis máxima recomendada de 10 g, estando descrita como reacción adversa rara (menos del 0,1%) de casos la metahemoglobinemia en niños pero no en adultos4,16,17 . Por lo tanto se llega al diagnóstico definitivo de metahemoglobinemia secundaria a la administración de EMLA® . La paciente respondió favorablemente al tratamiento con oxígeno (8 lpm) y un agente antioxidante - ácido ascórbico (1 g/8 horas iv.), manteniéndose en observación durante 18 horas trascurridas las cuales se le da el alta hospitalaria tras evolución clínica favorable. Discusión La metahemoglobinemia es un cuadro agudo, con frecuencia con un único signo clínico (la cianosis) que desaparece espontáneamente en varios minutos, o la mayoría de las veces en pocas horas. Puede aparecer como consecuencia de un contacto con sustancias oxidantes o por situaciones diversas como causas alimentarias, genéticas o incluso idiopáticas, por lo que es necesaria una adecuada sospecha clínica para realizar un diagnóstico y tratamiento correctos. El principal signo clínico es la cianosis rápida y progresiva, a veces con distribución en placas, más visible en las mucosas, la cara y las extremidades, que en la infancia se acentúa con el llanto. En ocasiones presenta repercusión hemodinámica con taquicardia y taquipnea. Los pacientes más graves pueden presentar acidosis metabólica, arritmias cardíacas y sintomatología neurológica como disminución del nivel de conciencia, coma y convulsiones generalizadas3,4,17—20 . Un dato clave para la sospecha clínica es la discrepancia entre la saturación de oxígeno medida por pulsioximetría y la presión parcial de oxígeno medidas en la gasometría arterial3,4,17,21,22 . Los pacientes generalmente aparentan estar menos graves de lo que se esperaría en función del grado de cianosis que presentan13 , y la saturación de oxígeno medida por pulsioximetría no mejora con oxígeno a 100%. La crema anestésica EMLA® al 5%, mezcla de lidocaína (25 mg/ml) y prilocaína (25 mg/ml), es un anestésico tópico usado para disminuir el dolor de procedimientos cutáneos6,10,12 . EMLA® se emplea sobre la piel, en la mucosa genital y en las úlceras de piernas para causar la insensibilidad o pérdida de la sensibilidad temporales en el área sobre la que se aplica. Los efectos adversos son mínimos y se limitan a reacciones locales de la piel como palidez y enrojecimiento cutáneo, si bien existe un potencial riesgo de metahemoglobinemia derivado de la capacidad de los metabolitos de la prilocaína de oxidar la hemoglobina. La metahemoglobinemia secundaria a la administración de EMLA® no está descrita como reacción adversa en adultos en la ficha técnica de la Agencia Española del Medicamento, aunque sí se menciona en niños como efecto secundario raro16 . La dosis recomendada en niños y adultos es de 12 g aplicados bajo un apósito oclusivo aproximadamente una hora antes del procedimiento. El efecto analgésico del EMLA® varía con la duración de la aplicación y con el intervalo entre la aplicación de la crema y el inicio del procedimiento20 . Como particularidad del caso clínico destaca la alta dosis de crema utilizada y la superficie corporal empleada (51% de la superficie corporal) con vendaje oclusivo para aumentar la eficacia del producto lo que pudo provocar una mayor absorción de anestésico. En los analizadores de gases del laboratorio de urgencias se dispone de cooxímetro y en todas las gasometrías realizadas se realiza una cooximetría con objeto de informar la saturación de oxígeno medida y el resultado de la cooximetría si se solicita. En este caso, el estudio de cooximetría Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Mujer de 18 años con metahemoglobinemia tras utilización de crema anestésica tópica no fue solicitado por el facultativo de urgencias, pero ante la existencia de un resultado tan patológico desde el laboratorio se decide informar y avisar como resultado crítico. Ello fue decisivo para el correcto diagnóstico y tratamiento de la paciente. El posterior seguimiento de la paciente se realizó con la monitorización de los resultados de la fracción de MetHb. En general, el pronóstico de esta patología es bueno, aunque dependerá del nivel de MetHb en el momento del diagnóstico y del estado basal de salud del paciente así como de las posibles patologías concomitantes que presente. El pronóstico también puede modificarse cuando el paciente no responde a la administración de azul de metileno. En conclusión, ante la presencia en un paciente adulto de un cuadro de cianosis de aparición brusca que no mejora tras oxigenoterapia inicial, se debe sospechar la existencia de una metahemoglobinemia de posible origen tóxico. Para confirmarlo, debe solicitarse al laboratorio un análisis con gasometría arterial y cooximetría. Por otra parte, el laboratorio debe considerar un resultado elevado de la fracción de MetHb como un resultado crítico de forma que pueda contribuir a un rápido diagnóstico y evolución del paciente. 9. 10. 11. 12. 13. 14. 15. 16. Bibliografía 17. 1. Barone MA.The Harriet Lane Handbook, The Johns Hopkins Hospital. 14.a ed. Mosby Editors; 1996. p. 121, 575. 2. Ash-Bernal R, Wise R, Wright SM. Acquired Methemoglobinemia: A retrospective series of 138 Cases at 2 Teaching Hospitals. Medicine. 2004;83:265—73. 3. Curry S, Methemoglobinemia. Ann Emerg Physiol. 1982;11:214. 4. Guay J. Methemoglobinemia related to local anesthetics: a summary of 242 episodes. Anesth Analg. 2009;108:837—45. 5. Salamat A, Watson HG. Drug-induced methaemoglobinaemia presenting with angina following the use of dapsone. Clin Lab Haematol. 2003;25:327—8. 6. Percy MJ, McFerran NV, Lappin TR. Disorders of oxidized haemoglobin. Blood Rev. 2005;19:61—8. 7. Olson Kent R. Poisoning and drug overdose. En: Blanc PD, editor. Methemoglobinemia. 3.a ed. Appleton and Lange Editors; 1999. p. 220—2. 8. Baraka AS, Ayoub CM, Yazbeck-Karam V, Kaddoum RN, Gerges FJ, Hadi UM, et al. Prophylactic methylene blue in a 18. 19. 20. 21. 22. 49 patient with congenital methemoglobinemia. Can J Anaesth. 2005;52:258—61. Clifton J2nd, Leikin JB. Methylene blue. Am J Ther. 2003;10:289—91. Wright RO, Lewander WJ, Woolf AD. Methemoglobinemia: etiology, pharmacology, and clinical management. Ann Emerg Med. 1999;34:646—56. Patel PB, Logan GW, Karnad AB, Byrd Jr RP, Roy TM. Acquired methemoglobinemia: a rare but serious complication. Tenn Med. 2003;96:373—6. Hay WW, Hayward AR, Levin MJ, Sondheimer JM. Current pediatric diagnosis and treatment. In: Lane PA, Nuss R, Ambruso DR, editores. Hematologic Disorders, Methemoglobinemia. 16.a ed. McGraw Hill, Lange International Edition; 2003. p. 860—1. Gold NA, Bithoney WG. Methemoglobinemia due to ingestion of at most three pills of pyridium in a 2-year-old: case report and review. J Emerg Med. 2003;25:143—8. Herranz M, Cleriqué N. Poisoning in children. Methaemoglobinemia. An Sist Sanit Navar. 2003;26 Suppl 1:209—23. Bradberry SM. Occupational methaemoglobinaemia. Mechanisms of production, features, diagnosis and management including the use of methylene blue. Toxicol Rev. 2003;22:13—27. AGEMED - Ficha técnica EMLA, Disponible en: http://sinaem4. agemed.es/consaem/especialidad.do?metodo=verFichaWord Pdf&codigo=61096&formato=pdf&formulario=PROSPECTOS. Accedido el 15/06/2010. Ash-Bernal R, Wise R, Wright SM. Acquired methemoglobinemia: a retrospective series of 138 cases at 2 teaching hospitals. Med (Baltimore). 2004;83:265—73. Herranz M, Clerigué N. Intoxicación en niños. Metahemoglobinemia. Anales Sis San Navarra. 2003;26 Suppl 1:218—23. Alonso Vega L, Gutiérrez Conde ML, Canduela Martínez V, Hernández Herrero M, Tazón Varela M, Pérez Mier LA. Metahemoglobinemia en una lactante por consumo de puré vegetal Emergencias. 2007;19:283—5. Hahn IH, Hoffman RS, Nelson LS. EMLA-induced methemoglobinemia and systemic topical anesthetic toxicity. J Emerg Med. 2004;26:85—8. Sánchez-Echaniz J, Benito-Fernández J, Mintegui-Raso S. Methemoglobinemia and Consumption of Vegetables in Infants. Pediatrics. 2001;107:1024—8. Murone AJ, Stucki P, Roback MG, Gehri M. Severe methemoglobinemia due to food intoxication in infants. Pediatr Emerg Care. 2005;21:536—8. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Rev Lab Clin. 2011;4(1):50—62 Revista del Laboratorio Clínico www.elsevier.es/LabClin REVISIÓN Cistatina C en la evaluación de la función renal María Fernández García a,b,∗ , Elisabeth Coll c , Salvador Ventura Pedret d,e , Carmen Bermudo Guitarte a,f , María Cruz Cárdenas Fernández a,g , Mariano Cortés Rius a,h , Miguel García Montes a,i , Cecília Martínez-Brú a,h , David Pérez Surribas a,j , Teresa Rodríguez González a,k , Carmen Valldecabres Ortiz a,l , José Antonio Viedma Contreras a,m y Edgar Zapico Muñiz a,h a Comisión de Proteínas de la Sociedad Española de Bioquímica Clínica y Patología Molecular, España Servicio de Análisis Clínicos, Hospital Santiago Apóstol, Miranda de Ebro, Burgos, España c Servicio de Nefrología, Fundació Puigvert de Barcelona, Barcelona, España d Comisión de Función Renal de la Sociedad Española de Bioquímica Clínica y Patología Molecular, España e Laboratori Clinic Metropolitana Sud, Bellvitge-Hospitalet de Llobregat, Barcelona, España f Servicio de Análisis Clínicos, Hospital Virgen de la Macarena, Sevilla, España g Servicio de Análisis Clínicos, Hospital Clínico San Carlos, Madrid, España h Servicio de Bioquímica, Hospital de la Santa Creu i Sant Pau, Barcelona, España i Servicio de Laboratorio, Clínica Moncloa, Madrid, España j Laboratori Pasteur, Andorra la Vella, Andorra k Servicio de Análisis Clínicos, Hospital Universitario Doctor Negrín, Las Palmas de Gran Canaria, Las Palmas, España l Servicio de Bioquímica, Hospital Universitario de la Ribera, Alzira, Valencia, España m Servicio de Análisis Clínicos, Hospital General y Universitario, Elche, Alicante, España b Recibido el 28 de mayo de 2010; aceptado el 9 de noviembre de 2010 Disponible en Internet el 26 de febrero de 2011 PALABRAS CLAVE Cistatina C; Creatinina; Función renal; Filtrado glomerular ∗ Resumen La medición del filtrado glomerular es el mejor índice de valoración de la función renal. La creatinina sérica es el marcador de filtrado glomerular más utilizado, a pesar de estar sometido a diferentes fuentes de variabilidad. La cistatina C es una proteína de bajo peso molecular propuesta como marcador de función renal más sensible que la creatinina al detectar de forma precoz alteraciones en la función renal. La medida de cistatina C en suero en determinados grupos de pacientes como ancianos, niños o diabéticos parece aportar mayor información que la creatinina. Sin embargo, presenta alteraciones en su concentración sérica por factores diferentes al filtrado glomerular. Actualmente no hay evidencia científica suficiente que justifique el cambio de las ecuaciones de estimación del filtrado glomerular basadas en la concentración sérica de creatinina por la medida de la concentración sérica de cistatina C en la evaluación de la función renal. © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. Autor para correspondencia. Correo electrónico: mariafg76@hotmail.com (M. Fernández García). 1888-4008/$ – see front matter © 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2010.11.002 Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Cistatina C en la evaluación de la función renal KEYWORDS Cystatin C; Creatinine; Renal function; Glomerular filtration rate 51 Assessment of renal function using cystatin C Abstract Glomerular filtration is the best index for assessing renal function. Despite being subjected to several sources of variability, serum creatinine is the most common glomerular filtration marker in use. Cystatin C is a low molecular weight protein which is more sensitive than creatinine, particularly for the identification of initial small decreases in renal function. The use of cystatin C in certain groups of patients such as elderly, children or diabetics appears to provide more information than creatinine. However, serum cystatin C can be influenced by non-renal factors. Currently, there is not enough scientific evidence to recommend the use of cystatin C to assess renal function instead of creatinine and creatinine equations. © 2010 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción La medición del filtrado glomerular (FG) constituye el mejor índice de valoración de función renal tanto en individuos sanos como en enfermos1 . Idealmente, la valoración del FG con una sustancia endógena requiere que dicha sustancia mantenga una producción y concentración constante en plasma, libre de unión a proteínas plasmáticas, baja variación biológica intraindividual, filtrado libre a nivel glomerular, sin reabsorción ni secreción tubular y sin aclaramiento extrarrenal2 . En la práctica clínica se han utilizado tanto marcadores endógenos como exógenos para la valoración del FG. Entre los marcadores exógenos destacan la inulina, reconocida como el patrón áureo, marcadores isotópicos como el 51 Cr-EDTA, 125 I-iodotalamato, y marcadores no isotópicos como el iohexol, entre otros. Estos marcadores tienen un uso limitado en la práctica clínica habitual, ya que son métodos costosos, incómodos para el paciente y con un consumo de tiempo elevado. Por estas razones, su uso queda relegado a situaciones en las que el FG estimado (ver más adelante) es poco fiable: pacientes con masa muscular alterada (amputados, parálisis), índice de masa corporal extremo (IMC < 18,5 ó > 35 kg/m2 ), situaciones que requieren un alto grado de exactitud en la medida del FG, como posibles donantes de riñón, dosificación de fármacos tóxicos excretados por vía renal y en investigación2—4 . La creatinina es el marcador endógeno de FG más utilizado a pesar de estar sometido a diferentes fuentes de variabilidad (edad, dieta, sexo y masa muscular), interferencias analíticas; con relación a la estandarización del procedimiento de medida, actualmente se está avanzando en el uso de la creatinina sérica estandarizada y de los procedimientos de medida con trazabilidad frente al método de referencia espectrometría de masas por dilución isotópica (IMDS)2,5 . La sensibilidad diagnóstica de la concentración sérica de creatinina para identificar estadios tempranos de disfunción renal es insuficiente, ya que su concentración en suero no se eleva hasta que el FG no está por debajo del 50% del límite superior de referencia3 . Por otra parte, el aclaramiento de creatinina calculado a partir de la concentración sérica de creatinina y su excreción en orina de 24 horas es el procedimiento mayoritariamente utilizado para la medida del FG. Sin embargo, presenta inconvenientes tales como errores en la recogida de orina de 24 horas y la sobreestimación del FG debido a la secreción tubular de creatinina2 . Teniendo en cuenta estas limitaciones, se han desarrollado ecuaciones para la estimación del FG a partir de la concentración de creatinina sérica y de variables demográficas y antropométricas. Las más conocidas y validadas en distintos grupos de población son la de Cockcroft-Gault (C-G)6 y la del estudio Modification of Diet in Renal Disease con 4 variables (MDRD-4)3 para la población adulta, y la de Schwartz7,8 y la de Counahan-Barratt9 para la población infantil. La mayoría de las sociedades científicas recomiendan en la población adulta la utilización de la ecuación MDRD-4 o, si el método de medida de la concentración sérica de creatinina presenta trazabilidad respecto al método de referencia IDMS, se aconseja el uso de la ecuación MDRD-IDMS y Schwartz-IDMS para la población infantil3,5 . Las ecuaciones de estimación del FG presentan mayor exactitud diagnóstica para valores entre 15 y 60 ml/min/1,73 m2 , especialmente la MDRD. En pacientes con nefropatía incipiente o en pacientes sanos con FG superiores o iguales a 90 ml/min/1,73 m2 , las ecuaciones infraestiman el valor real del FG3 . Por lo tanto, la ausencia de un marcador endógeno de FG preciso, exacto y no invasivo continúa siendo un factor limitante en la evaluación de la función renal. En este sentido, se han propuesto proteínas de bajo peso molecular, como la ß2 microglobulina, la proteína ß-traza, la ␣1 -microglobulina y la proteína transportadora de retinol para la valoración del FG10—13 . Sin embargo, dichas proteínas no cumplen todos los criterios de un marcador endógeno de FG, ya que su producción no es constante, presentan aclaramiento extrarrenal y están afectadas por desórdenes inmunológicos, vitamínicos y tumorales, entre otros12,13 . Por ello la cistatina C, la cual a priori no presenta estas limitaciones, es la proteína de bajo peso molecular que mayor interés ha despertado entre diferentes grupos de trabajo2 . Objetivo El objetivo de esta revisón es proporcionar una visión general de los conocimientos actuales de la cistatina C como marcador de función renal. Para ello se realizó una búsqueda bibliográfica en la base de datos MEDLINE durante el periodo de tiempo noviembre de 2008 — julio de 2010. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 52 M. Fernández García et al Tabla 1 Concentración de cistatina C en los fluidos biológicos. Fluido biológico Concentración cistatina C (mg/L) Plasma sanguíneo Orina Semen Líquido cefalorraquídeo Lágrimas Saliva Leche Líquido sinovial Líquido amniótico 0,57-1,79 0,03-0,29 41,2-61,8 3,2-12,5 1,3-7,4 0,36-4,8 2,2-3,9 ∼2,0 0,8-1,4 Tabla adaptada de Newman DJ, et al12 ; Grubb AO14 . Características La cistatina C es descrita por primera vez en 1961 en líquido cefalorraquídeo y denominada proteína ␥-traza. Es una proteína no glucosilada con un peso molecular de 13,3 kDa, constituida por una sola cadena de 120 aminoácidos con dos puentes disulfuro. Es el producto de un gen de mantenimiento, localizado en el cromosoma 20, lo cual explica su síntesis de forma constante en todas las células nucleadas del organismo y su amplia distribución tisular (tabla 1). Pertenece a la familia 2 de la superfamilia de inhibidores de cisteína-proteasas constituida por 11 miembros, de los cuales la cistatina C es el inhibidor endógeno de cisteína proteasa más importante (tabla 2)14 . La cistatina C desempeña una función protectora mediante la inhibición de las catepsinas (B, H, L y S) que intervienen en el metabolismo intracelular de proteínas, catabolismo del colágeno y degradación de la matriz celular12,14,15 . Además, se le ha atribuido un papel defensivo en infecciones bacterianas y víricas16 . Debido a su pequeño tamaño y a que su punto isoeléctrico de 9,3 le confiere una carga positiva a pH fisiológico, la cistatina C se filtra libremente por el glomérulo y se reabsorbe en el túbulo proximal donde es catabolizada completamente por las células tubulares por lo que no retorna hacia el torrente sanguíneo. Por consiguiente, en ausencia de daño tubular, su concentración en orina es muy baja, de 0,03 - 0,3 mg/L14,16 . La diferencia entre concentración sérica y plasmática de cistatina C no es clínicamente significativa, por lo que a lo Tabla 2 Superfamilia de las cistatinas humanas. Familia 1 Familia 2 Cistatina A Cistatina B Cistatina Cistatina Cistatina Cistatina Cistatina Cistatina Cistatina Tabla adaptada de Grubb AO14 . Familia 3 C D E F S SA SN Quininógenos baja masa molecular Quininógenos alta masa molecular largo de la revisión se hará referencia a concentración sérica de cistatina C14 . Debido a sus características fisiológicas y a que su concentración sérica no se afecta significativamente por cambios en la masa muscular, edad, sexo y dieta, la cistatina C se ha propuesto como marcador de FG desde 19852 . Además, diversos estudios así como un metaanálisis sugieren su superioridad frente a la creatinina en la estimación del FG2,17 . Factores que afectan a la concentración sérica de cistatina C Del mismo modo que ocurre con la concentración sérica de creatinina, la de cistatina C se ve alterada en estados de disfunción tiroidea. Se han descrito concentraciones elevadas de cistatina C en pacientes con hipertiroidismo y disminuidas en pacientes con hipotiroidismo, respecto al estado eutiroideo, a la inversa de lo que sucede con la creatinina18—20 . Esta alteración en la producción de la cistatina C se explicaría como una consecuencia del recambio celular y metabólico presente en la disfunción tiroidea. Por tanto, la función tiroidea debe ser considerada en la interpretación de resultados de la medida de cistatina C20 . Diversos estudios recogen que la concentración de cistatina C se puede elevar en diferentes tumores como el melanoma metastático, mieloma múltiple y el cáncer colorrectal21,22 . No obstante es necesario la realización de más estudios en este campo para poder discernir si el aumento de la concentración sérica de cistatina C es debido al proceso tumoral en sí o al deterioro de la función renal15 . Aunque inicialmente se consideró que los estados de inflamación no afectaban a la concentración sérica de cistatina C, en los últimos años diversos estudios muestran una relación entre la inflamación y la concentración de cistatina C. En el estudio de Singh et al23 se indica que la relación entre la cistatina C y los marcadores de inflamación como la proteína C reactiva (PCR) y el fibrinógeno no es independiente de la función renal. Knight et al24 reflejan en su estudio cómo la edad avanzada, el sexo, el sobrepeso, el tabaco y la concentración de PCR están asociados con una concentración de cistatina C elevada independientemente de la función renal. Sin embargo otros autores no encuentran asociación entre el tabaco y la concentración de cistatina C25 . Asimismo, se ha descrito una relación entre la interleuquina 6, la PCR o el factor de necrosis tumoral con la cistatina C y el riesgo cardiovascular15 . La discrepancia existente entre los diferentes estudios podría explicarse en parte por la heterogeneidad de los mismos (diferencias de tamaño y grupo población estudiada, método de medida del FG). Se han descrito alteraciones en la concentración de cistatina C con el uso de corticosteroides y ciclosporina A en pacientes que han recibido un transplante15,26 . Consideraciones analíticas Estabilidad La cistatina C presenta una estabilidad en suero de 2 días a temperatura ambiente, 1 semana a 4 ◦ C, 1-2 meses a -20 ◦ C y al menos 6 meses a -80 ◦ C. Los ciclos de congelación y descongelación no parecen afectar a su estabilidad12,15,27 . No Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Cistatina C en la evaluación de la función renal existe uniformidad de conceptos respecto a la estabilidad de la cistatina C en orina. Por un lado se indica que la estabilidad no es buena debido a su degradación por enzimas proteolíticas14 . Otros autores afirman que la cistatina C es estable en orina y no requiere la adición de conservantes28 . Métodos de medida El primer método de medida de cistatina C en fluidos biológicos, desarrollado por Löfberg y Grubb en 1979, estaba basado en una inmunodifusión radial simple con un límite de detección de 0,3 mg/L y un coeficiente de variación intraensayo del 11%29 . Entre 1979 y 1993 se desarrollaron diferentes métodos de medida basados en enzimoinmunoanálisis, radioinmunoanálisis y fluoroinmunoanálisis, que mejoraban la sensibilidad analítica. En 1994 se desarrollan los primeros métodos de medida de cistatina C automatizados. Son inmunoanálisis basados en una aglutinación en fase líquida de partículas de látex o poliestireno uniformes, unidas covalentemente a anticuerpos policlonales frente a cistatina C. Los principios de medida se denominan PETIA (particle-enhanced turbidimetric immunoassay) y PENIA (particle-enhanced nephelometric immunoassay), basados en turbidimetría y nefelometría, respectivamente. La evolución técnica ha permitido alcanzar una mayor rapidez y precisión en estos métodos respecto a los primeros12 . La mayor parte de los laboratorios disponen en la actualidad de analizadores de bioquímica en los que puede adaptarse la tecnología PETIA fácilmente. En cambio los procedimientos basados en PENIA solo pueden ser desarrollados en un nefelómetro12,15 . Los procedimientos de medida disponibles utilizan anticuerpos distintos (tabla 3). Existen dos tipos: un anticuerpo policlonal de conejo y un anticuerpo policlonal de ave, recientemente introducido15 . Dicho anticuerpo presenta la ventaja de no establecer reacciones cruzadas con el factor reumatoide, debido a la distancia filogenética entre aves y mamíferos30 . Los calibradores empleados hasta ahora son de naturaleza distinta y están constituidos bien por cistatina C humana purificada urinaria, bien por cistatina C humana recombinante producida por E. coli. Desde 1997 el método PENIA ha sido el más evaluado y frente a él se han comparado la mayoría de los métodos de medida de cistatina C, por lo que es considerado como el método de elección15,26,32 . Además, es el único aprobado por la Food and Drug Administration33 . En la literatura se recogen estudios de evaluación de los diferentes métodos de medida. Se ha descrito que los procedimientos basados en PENIA son ligeramente superiores a los PETIA, en cuanto a imprecisión, interferencias y límite de detección12 . Las diferencias existentes entre los métodos podrían estar más relacionadas con la heterogeneidad de los anticuerpos, concretamente diferencias de afinidad y especificidad de los epítopos, que con el procedimiento de medida (PENIA o PETIA)15,34 . Estandarización Es necesaria la utilización de un material de referencia consensuado internacionalmente para asegurar la correlación entre métodos y la transferibilidad de los resultados. La Federación Internacional de Química Clínica (IFCC) y el Instituto de Referencia de Materiales y Medidas (IRMM) 53 impulsaron la creación de un grupo de trabajo para la estandarización de la cistatina C (WG-SCC 8.3.37). Se elaboró una preparación primaria de referencia con cistatina C humana recombinante pura y homogénea con una concentración de 5200 mg/L. Posteriormente se elaboró un material secundario de referencia con una concentración de cistatina C entre 5-6 mg/L. La matriz de este material está constituida por una mezcla de sueros humanos preparada de la misma forma que el material certificado de referencia ERM-DA 470, utilizado para la medición inmunoquímica de proteínas humanas en suero35 . Finalmente la caracterización del material, denominado ERM-DA471/IFCC, se realizó mediante inmunonefelometría, inmunoturbidimetría e inmunodifusión radial. Dicho material de referencia certificado contiene una concentración de cistatina C de 5,48 mg/L con una incertidumbre de medida de 0,15 mg/L36 . Variación biológica La prueba ideal, desde el punto de vista de la variación biológica, debe tener una variación intraindividual pequeña y una individualidad baja para que los valores de referencia poblacionales sean útiles37 . La creatinina posee una variación biológica intraindividual (CVI ) menor que la variación biológica interindividual (CVG ), de un 5,3% y de un 14,2% respectivamente, y por tanto una marcada individualidad38 . Presenta un índice de individualidad (I.I.) bajo (menor de 0,6) lo que supone que los valores de referencia poblacionales no son lo suficientemente sensibles para discriminar entre un estado de salud y de enfermedad. La estratificación en función del sexo y la edad incrementa el I.I. y aumenta la utilidad de los valores de referencia en el diagnóstico y seguimiento. Existen discrepancias respecto a la CVI y al I.I. publicado para la cistatina C (tabla 4). Por un lado, Keevil et al39 recogen una CVI del 13,3% y un I.I. de 1,64 para la cistatina C, por lo que los valores de referencia basados en la población son útiles y no es necesaria la estratificación. Según los datos de este estudio, si se tienen en cuenta los I.I. de la creatinina y de la cistatina C, ésta última presenta mejores cualidades como marcador de cribado, mientras que la creatinina es mejor parámetro para el seguimiento de cambios en el individuo con enfermedad renal confirmada. Sin embargo, estudios recientes describen que la cistatina C presenta un I.I. bajo, así la cistatina C parece ser al menos igual de útil que la creatinina en el seguimiento de la función renal41,43,44 . Estas diferencias entre estudios pueden ser explicadas, en parte, por los distintos métodos de medida de cistatina C empleados. Valores de referencia Existe publicado un amplio rango de valores de referencia según la edad y el sexo (tabla 5)45,46 . Las diferencias entre los mismos se deben fundamentalmente al método de medida, tipo de anticuerpo, calibrador y población seleccionada. Por ejemplo, los valores de referencia obtenidos con PETIA son de un 20 a un 30% más altos que los obtenidos con PENIA12,15,26 . 54 Tabla 3 Métodos de medida de cistatina C. Método Instrumento Calibrador Anticuerpo Limite detección (mg/L) CV (%) Intraensayo CV (%) Interensayo Tiempo medida (minutos) Interferencias no detectadas por debajo de PENIA Cistatina C humana purificada urinaria Policlonal conejo 0,23 mg/L <3,3% <4,5% 6 B: 488 mol/L 7 Hb: 8 g/L TG: 23 mmol/L FR:2000 kU/L B: 150 mol/L 10 Hb: 1,2 g/L TG: 9,4 mmol/L FR: 323 kU/L B: A: 718 mol/L BNA100 PETIA Siemens Cistatina C humana recombinante producida por E. coli Cobas Fara PETIA Architect ci8200 Modular P Policlonal conejo 0,15 mg/L <2% <2,2% DakoCytomation Cistatina C humana recombinante producida por E.coli Policlonal ave A y MP MP: 1,2-2,2% MP: 0,8-3,5% Gentian AS <0,33 mg/L A: ND A: ND M. Fernández García et al A: Architect ci8200; B:bilirrubina; CV: coeficiente de variación; FR: factor reumatoide; Hb: hemoglobina; MP: Modular P; ND: no determinado; TG: triglicéridos. Tabla adaptada de Seronie-Vivien S, et al15 ; Finney H, et al27 ; Sunde K, et al30 ; Kyhse-Andersen, et al31 . MP: 1368 mol/L Hb: A: 8 g/L, MP: 7 g/L TG: A:18 mmol/L MP: 16 mmol/L FR: No detecta Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Cistatina C en la evaluación de la función renal Tabla 4 55 Variación biológica de cistatina C y creatinina. Creatinina Cistatina C Ref. Media concentración (mol/L) CVA (%) CVI (%) CVG (%) I.I. Media concentración (mg/L) CVA (%) CVI (%) CVG (%) I.I. 86 81 82 71 77 49,4 3,1 NC 2,3 2,5 1,6 2,5 4,9 5,8 6,1 5,8 4,7 6,4 18,2 NC 17,4 NC 14,4 28,4 0,27 NC 0,35 NC 0,32 0,25 0,65 0,69 0,77 0,67 0,70 0,85 8,9 NC 2,5 1,29 2 1,7 13,3 5,4 4,5 4,5 8,6 6,4 8,1 NC 13 NC 15,1 11,1 1,64 NC 0,35 NC 0,57 0,65 39 40 41 42 43 44 CVA : coeficiente de variación analítica; CVG : coeficiente de variación biológica interindividual; CVI : coeficiente de variación biológica intraindividual; I.I.: índice de individualidad; NC: no consta; Ref: referencia. En recién nacidos la concentración sérica de cistatina C se encuentra significativamente elevada debido al grado de inmadurez de las nefronas en cuanto a su capacidad de filtración glomerular (la cistatina C no atraviesa la placenta)47 . Dicha concentración disminuye progresivamente, alcanzando los valores de adulto en el primer año de vida; por lo tanto, se puede utilizar en niños mayores de un año el mismo rango de referencia que en adultos48 . Un estudio reciente describe un incremento de la concentración sérica de cistatina C con la edad, alcanzando valores superiores al 50% después de los 80 años en ambos sexos y en todos los grupos étnicos estudiados49 . A pesar de encontrar en la literatura valores de referencia ligeramente diferentes según la edad y el sexo, la mayoría de los autores recomiendan utilizar un único rango de referencia para Tabla 5 Método PENIA PENIA PENIA PETIA PETIA PETIA PETIA EIA edades comprendidas entre 1-50 años, y estratificados por edad en menores de 1 año y en mayores de 50 años45,50,51 . Eficacia diagnóstica J.F.Roos et al56 recogen en un metaanálisis una mayor sensibilidad (81%) y similar especificidad (88%) diagnóstica en la detección de daños en la función renal para la cistatina C comparada con la creatinina en suero (69 y 88%, respectivamente). Dharnidharka et al17 muestran en otro metaanálisis una correlación con los métodos de referencia de estimación del FG superior para el recíproco de la cistatina C respecto al recíproco de la creatinina (r = 0,816 y r = 0,742 respectivamente) y una mayor área bajo la curva de rendimiento diagnóstico para la cistatina C de 0,926 (IC del 95%: 0,892- Valores de referencia de cistatina C. N.◦ de individuos 246 216 172 92 398 258 51 58 50 65 72 162 258 242 270 33 33 Edad (años) 4-19 H 20-59 M 20-59 H y M >60 60-79 >80 19-49 50-67 Prematuros Neonatos <1 año 1-3 3-16 1-18 20-50 >50 20-65 24 - 63 H 19 - 61 M Rango de referencia (mg/L) 0,58-0,92 0,54-0,94 0,48-0,82 0,63-1,03 0,93-2,68 1,07-3,35 0,53-0,92 0,58-1,02 1,34-2,57 1,36-2,23 0,75-1,87 0,68-1,60 0,51-1,31 0,7-1,38 0,70-1,21 0,84-1,55 0,54-1,21 1,53-2,75 1,27-2,29 Ref. 45 52 50 53 54 51 55 46 H: hombres; M: mujeres; PENIA: particle-enhanced nephelometric immunoassay; PETIA: particle-enhanced turbidimetric immunoassay; Ref: referencia. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 56 Tabla 6 M. Fernández García et al Ecuaciones de estimación del FG basadas sólo en la cistatina C y combinadas con creatinina y variables demográficas. Ecuación Población Tamaño muestra Medida FG Método cistatina C Ref. FG = 127,7 x cistatina C−1,17 x edad−0,13 x 0,91(si mujer)x 1,06 (si raza negra) FG = 177,6 x creatinina−0,65 x cistatina C−0,57 x edad−0,20 x 0,82 (si mujer) x 1,11 (si raza negra) logFG = 1,962 + [1,123 x log (1/cistatina C)] ERC 3418 125 PENIA 63 PENIA 59 FG = (84,6/cistatina C) -3,2 FG = 80,35/cistatina C - 4,32 FG = 77,24 x cistatina C−1,2623 FG = 78/cistatina C + 4 FG = 84,69 x cistatina C−1,680 x 1,384 (si< 14 años) FG = 87,62 x cistatina C−1,693 x 1,376 (si< 14 años) x 0,94 (si mujer) FG = 99,43 x cistatina C−1,5837 FG = 79,901 x cistatina C−1,4389 51 Pediátrica con patología renal Diabética Adulta Pediátrica y adulta Trasplantados Adulta y pediátrica Pediátrica y adulta FG reducido I-iodotalamato Cr-EDTA 536 99m 125 123 100 25 536 99m Tc-DTPA I-iodotalamato Iohexol 51 Cr-EDTA Iohexol PENIA PENIA PENIA PENIA PETIA 66 100 94 Iohexol Iohexol PETIA PETIA 64 Tc-DTPA 125 65 64 67 58 68 DTPA: dietileno triamino-penta-ácido acético; EDTA: ácido dietilendiaminotetracético; ERC: enfermedad renal crónica; FG: filtrado glomerular; PENIA: particle-enhanced nephelometric immunoassay; PETIA: particle-enhanced turbidimetric immunoassay; Ref: referencia. Cistatina expresada en mg/L, creatinina en mg/L y edad en años. Tabla adaptada de Seronie, et al15 . 0,960) respecto a 0,837 (IC del 95%: 0,796-0,878) para la creatinina. Ecuaciones de estimación del filtrado glomerular basadas en la cistatina C En los últimos años se han desarrollado múltiples ecuaciones matemáticas basadas en la medida de la cistatina C para la estimación del FG. Diversos estudios comparan estas ecuaciones con las de MDRD, C-G y Schwartz57—60 . Muchos de ellos muestran su superioridad frente a las basadas en la medición de creatinina y mejor correlación con el método de referencia utilizado para la medida del FG32,58,61 . Por el contrario, otros estudios no encuentran diferencias entre el uso de ecuaciones basadas en la medida de cistatina C y de creatinina61 . A pesar de que las ecuaciones de estimación del FG basadas en la medida de cistatina C parecen tener una ventaja limitada frente a las de MDRD, ya que están desarrolladas en poblaciones con un número reducido de casos, pacientes con patologías muy especificas y distintos procedimientos de medida del FG15,61 , sí podrían tener utilidad en pacientes trasplantados y pediátricos15,32 . En este sentido, Filler et al59 recomiendan el uso de las ecuaciones basadas en la cistatina C para la estimación del FG en niños, en lugar del uso de la ecuación de Schwartz que sobreestima el FG en pacientes con un FG bajo (< 20 ml/min/1,73 m2 ). Recientemente se ha propuesto el uso de ecuaciones basadas en la medida conjunta de creatinina, cistatina C y variables como la edad, el sexo y laraza, ya que aumentan la exactitud y precisión en la estimación del FG62,63 . Actualmente no existe un acuerdo sobre qué ecuación basada en la medida de cistatina C es la más adecuada para la estimación del FG, debido en parte a la falta de estandarización del método de medida de la cistatina C y a la heterogeneidad de los estudios realizados. En la tabla 6 se muestran ecuaciones de estimación del FG basadas en la medida de la cistatina C junto al tamaño y tipo población estudiada, método de medida de cistatina C y método de referencia utilizado para la medida del FG. Utilidad clínica de la cistatina C Insuficiencia renal aguda en pacientes críticos La cistatina C es capaz de detectar el fracaso renal agudo más precozmente que la creatinina, puesto que su concentración sérica se eleva entre 36 y 48 horas antes de que lo haga la concentración de creatinina sérica69,70 . La explicación a esta anticipación diagnóstica se halla en las características fisiológicas de la cistatina C: una vida media más corta que la creatinina y una menor distribución a nivel corporal (la cistatina C se ubica sólo en el volumen extracelular mientras que la creatinina se distribuye por el agua corporal total). Los pacientes que se hallan en una Unidad de Cuidados Intensivos presentan una gran morbi-mortalidad, por ello es imperativo un diagnóstico precoz del fracaso renal agudo de cara a instaurar precozmente el tratamiento más adecuado. Estudios recientes han demostrado que en los pacientes críticos, la cistatina C sérica, además de marcador precoz de insuficiencia renal aguda69,71 , también es un predictor de mortalidad, independientemente de la función renal medida por creatinina sérica72 . Además, muchos de los pacientes críticos afectos de insuficiencia renal aguda, precisan de terapias sustitutivas continuas; en dichos pacientes el nivel de función renal Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Cistatina C en la evaluación de la función renal Tabla 7 crónica. Clasificación de los estadios de enfermedad renal Estadio Descripción Filtrado glomerular (mL/min/1,73 m2 ) 1 Lesión renal con FG normal o aumentado Lesión renal con disminución leve del FG Disminución moderada del FG Disminución severa del FG Fallo renal o diálisis ≥ 90 2 3 4 5 60-89 30-59 15-29 <15 FG: filtrado glomerular. Tabla adaptada de la guía K/DOQI 2002 de la National Kidney Foundation1 . residual tiene una gran importancia en su seguimiento. Las membranas de alta permeabilidad usadas en estas técnicas eliminan la creatinina sérica pero solo son capaces de eliminar menos de un 30% de la cistatina C. Por lo tanto, la cistatina C correlaciona mejor con el nivel de función renal residual que la creatinina y con el nivel de diuresis, y podría ser útil en la monitorización de los pacientes críticos con insuficiencia renal aguda sometidos a terapias depurativas continuas73,74 . Enfermedad renal crónica en estadios precoces (FG estimado >60 ml/min/1,73m2 ) En los estadios iniciales de la insuficiencia renal, las ecuaciones basadas en la creatinina sérica tienden a infraestimar el FG, por ello no son útiles en el diagnóstico de la enfermedad renal incipiente. En cambio, el potencial de la cistatina C se encuentra en el diagnóstico de la enfermedad renal crónica (ERC) en su segundo estadio (tabla 7). Una proporción pequeña de enfermos con ERC evolucionan hacia enfermedad renal terminal con requerimiento de tratamiento renal sustitutivo. Asimismo, suele asociarse a enfermedad cardiovascular y a una mayor mortalidad, que es más patente a medida que la función renal se halla más deteriorada75,76 . El hecho de diagnosticar la ERC en estadios incipientes permite al clínico iniciar de forma precoz toda una serie de medidas encaminadas a frenar o estabilizar la progresión de dicha enfermedad así como tratar a conciencia los factores de riesgo cardiovascular que puedan coexistir en estos pacientes para prevenir los eventos cardiovasculares. De gran interés es el uso de la cistatina C en pacientes con hipertensión arterial77 y con diabetes (tipo 1 y 2)78,79 para un diagnóstico precoz de la enfermedad renal y evitar en lo posible su progresión y su comorbilidad. En el campo de la diabetes mellitus, recientemente se han publicado varios artículos que correlacionan la cistatina C con la albumina en orina y objetivan que ambos marcadores se hallan involucrados independientemente, pero de forma aditiva, en la mortalidad de los pacientes adultos afectos de diabetes mellitus tipo 280 . Además, se ha visto que la correlación entre la concentración de cistatina C sérica y la de albúmina en orina ya se detecta aunque la concentración de albúmina en orina no se encuentre alterada 57 o se haya normalizado con tratamiento con fármacos inhibidores del sistema renina-angiotensina-aldosterona, con lo que pequeños cambios en el FG detectados por elevaciones de la concentración sérica de cistatina C nos permiten diagnosticar la afección renal de la diabetes mellitus tipo 2 en fase todavía más incipiente81,82 . Finalmente, los pacientes con diabetes mellitus tipo 2 pasan previamente por un periodo de pre-diabetes, en el que pueden presentar ligeras alteraciones de la función renal no detectables por los métodos tradicionales. En el Western New York Study realizado en 1.455 pacientes no diabéticos ni pre-diabéticos con una edad media de 56 años y seguidos durante una media de 2 años, se objetivó que los pacientes que presentaban concentraciones séricas de cistatina C más elevadas en el análisis basal tenían un riesgo 3 veces superior de progresar a pre-diabetes (mientras que la creatinina sérica o la albumina en orina no eran capaces de detectar este deterioro incipiente de la función renal que presagia o se desarrolla en paralelo con la condición de pre-diabetes)83 . Recientemente se han publicado diversos trabajos que demuestran que los pacientes mayores de 65 años y con concentraciones de cistatina C elevadas (con creatinina sérica normal y FG estimado por encima de 60 ml/min/1.73m2 ) a largo plazo presentan mayor morbimortalidad cardiovascular que los pacientes con concentraciones de cistatina C dentro del rango de la normalidad84 . Dicho hallazgo ha hecho plantear si existe un enlace fisiopatológico directo entre la cistatina C y la enfermedad cardiovascular; aunque lo más probable es que todo esté relacionado con la detección precoz de la enfermedad renal y las consecuencias cardiovasculares que dicha patología conlleva. Pacientes pediátricos La estimación del FG basado en la medida de la creatinina sérica y la talla es un procedimiento generalizado en la evaluación de la función renal en la población infantil85 . Sin embargo, está sometido a las limitaciones de la creatinina descritas a lo largo de la revisión. La concentración sérica de cistatina C no se afecta significativamente por los cambios en la masa muscular, lo cual es una ventaja frente a la creatinina en la valoración de la función renal en la población pediátrica86 . La creatinina se halla muy elevada en el neonato debido a la inmadurez renal, disminuye sus valores hasta el año de vida y posteriormente se incrementa hasta la edad adulta, siendo más difícil detectar un deterioro en la función renal con la creatinina que con la cistatina C54 . Diversos estudios recogen la utilidad de la cistatina C en diferentes situaciones clínicas: en el seguimiento de la progresión del fallo renal en ERC, en fases iniciales del fracaso renal agudo y en pacientes con baja masa muscular85,87 . Pacientes con edad avanzada El envejecimiento deteriora progresivamente la función renal aunque esto no se acompañe de un incremento simultáneo de la concentración sérica de creatinina, mientras que sí existe un aumento de la concentración sérica de cistatina C88 . Por ello, en pacientes de edad avanzada estaría indicado usar ecuaciones para estimar el FG basadas en la Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 58 creatinina sérica (puesto que incluyen la edad en su estimación y compensaría el discreto aumento de la concentración de creatinina) o ecuaciones basadas en la cistatina C para evaluar el grado de disfunción renal. Insuficiencia hepática En los pacientes con insuficiencia hepática la creatinina sérica (o las ecuaciones basadas en ella) es un mal indicador para el diagnóstico de insuficiencia renal debido a la malnutrición, baja ingesta proteica, baja masa muscular y falta de conversión de la creatina muscular a creatinina que presentan estos pacientes. Varios trabajos han demostrado la superioridad de la cistatina C respecto a la creatinina (o las ecuaciones basadas en ella) en las poblaciones de pacientes afectos de insuficiencia hepática89,90 . Trasplante renal En los pacientes sometidos a trasplante renal la medida de la cistatina C podría ser de utilidad en las siguientes situaciones: - En el pos-trasplante renal inmediato: pasados los primeros 8 días se ha visto que es más eficiente la cistatina C que la creatinina para la detección de un retraso en la función del injerto (en los primeros días post-trasplante la cistatina C no sería útil debido a las altas dosis de corticoesteroides administradas)91,92 . - En el diagnóstico de un rechazo agudo: por su precocidad en la detección de la insuficiencia renal aguda. - En la detección precoz de la nefropatía crónica del injerto; aunque en este punto hay controversia puesto que se han publicado artículos que demuestran su superioridad respecto a la creatinina o a las ecuaciones basadas en ésta93,94 mientras que algún otro artículo no encuentra ventajas respecto a la creatinina sérica95 . Pacientes en diálisis En los pacientes sometidos a hemodiálisis convencional de bajo flujo la cistatina C aumenta durante la sesión de diálisis, lo cual puede ser debido al paso de esta proteína desde el compartimiento intersticial al plasmático debido a la hemoconcentración y a que no es dializable (a diferencia de la urea y de la creatinina que tienen un peso molecular menor). Por esto, a diferencia de la creatinina sérica, la cistatina C sérica refleja la función renal residual incluso después de la hemodiálisis en los pacientes con insuficiencia renal crónica terminal96 . Las técnicas de hemodiálisis que utilizan membranas de alta permeabilidad y se basan sobre todo en el transporte convectivo, como la hemofiltración on-line, permiten una mayor eliminación de la cistatina C97 . En los pacientes en diálisis peritoneal se ha objetivado que mientras la urea se elimina del plasma principalmente a través de la membrana peritoneal, la cistatina C se elimina principalmente por aclaramiento renal en pacientes con función renal residual98 . En este sentido, Hoek et al describieron una ecuación simple obtenida a partir de la concentración de cistatina C sérica para estimar la función renal residual en los pacientes en hemodiálisis y en diálisis peritoneal que era más exacta y precisa que la ecuación de MDRD y sugirieron que podría M. Fernández García et al ser útil cuando la recolección de orina de 24 horas no fuera posible o fuera dificultosa99 . Pacientes oncológicos En los pacientes afectos de neoplasias sólidas o cáncer hematológico, la función renal debe monitorizarse estrechamente para reconocer la insuficiencia renal lo antes posible de cara a evitar el acúmulo de los agentes quimioterápicos y sus metabolitos. Además, los pacientes con cáncer presentan una disminución de la ingesta proteica y una pérdida de la masa muscular que pueden provocar una concentración sérica de creatinina dentro del rango normal a pesar de la disminución de la función renal. Se han realizado diferentes estudios para evaluar la utilidad de la cistatina C en los pacientes neoplásicos y conseguir una valoración más exacta de la función renal, sin embargo los resultados obtenidos son controvertidos. Hay estudios que demuestran que la cistatina C sérica es mejor marcador de función renal que la creatinina sérica en pacientes neoplásicos y que no se afecta por la progresión tumoral (presencia o no de metástasis) ni por las distintas estrategias quimioterápicas usadas100,101 . Otros estudios no hallan una mayor sensibilidad y especificidad de la cistatina C respecto a las ecuaciones basadas en creatinina sérica en pacientes neoplásicos, aunque como crítica a estos estudios destacar que no usan un método de referencia para estimar simultáneamente el FG (como la inulina o radioisótopos) sino que usan ecuaciones basadas en la creatinina o en el aclaramiento de creatinina102 . En los pacientes pediátricos con cáncer la concentración sérica de la cistatina C es mucho más exacta y precisa para diagnosticar un deterioro de la función renal que la creatinina sérica o las ecuaciones basadas en ella103 . Tabla 8 Uso de la cistatina C según el filtrado glomerular. Filtrado glomerular Marcador Indicación FG 60-90 ml/min/1,73m2 Cistatina C FG 20-60 ml/min/1,73m2 MDRD Pacientes de edad avanzada, hipertensos, DM tipo 1 y 2, VIH Adultos Schwartz Cistatina C FG <20 ml/min/1,73m2 Insuficiencia renal aguda Niños Pesos extremos, síndrome nefrótico, amputados, enfermedades neuromusculares, insuficiencia hepática, ERCA Cl creatinina + Cl urea/2 Cistatina C Cl: aclaramiento; DM: diabetes mellitus; ERCA: enfermedad renal crónica agudizada; FG: fitrado glomerular; VIH: virus de la inmunodeficiencia humana. Tabla adaptada de Herget-Rossental, et al61 . Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Cistatina C en la evaluación de la función renal Otras situaciones clínicas donde las ecuaciones de filtrado glomerular basadas en la creatinina sérica no son útiles Actualmente se están realizando muchos trabajos en grupos poblacionales donde las ecuaciones basadas en la creatinina sérica no son fiables. En este sentido, la cistatina C ha demostrado su superioridad sobre las ecuaciones basadas en la creatinina en pacientes con pesos extremos (en anorexia y obesidad)104,105 , en amputados y en pacientes con enfermedades neuromusculares106 , y en el embarazo107 . También es útil en la detección precoz de la insuficiencia renal en los pacientes afectos del virus de la inmunodeficienca humana (VIH)108 . En la tabla 8, adaptada de Herget-Rossental61 , se exponen aquellas situaciones y grupos de pacientes en los que la cistatina C realmente aporta un valor añadido en el diagnóstico de la insuficiencia renal. 59 4. 5. 6. 7. 8. Conclusiones A pesar de que la cistatina C no contribuye todavía a la estratificación de la ERC, la medida de su concentración sérica por sí sola proporciona una estimación del FG al menos tan exacta como la de la creatinina ajustada por edad, sexo y raza en la población con ERC63 . Constituye una herramienta diagnóstica superior a la creatinina en la detección de una alteración precoz de la función renal (FG 60-90 mL/min/1,73m2 )17,56,61 . La medida de la cistatina C añade información de interés en pacientes con valores de FG entre 20 y 60 mL/min/1,73m2 donde el uso de la ecuación MDRD es inadecuado (individuos con alteraciones en la masa muscular, síndrome nefrótico, insuficiencia hepática y enfermedad renal crónica agudizada)61 . Además, parece aportar información útil en individuos de edad avanzada, pacientes diabéticos y portadores del VIH. La cistatina C proporciona ciertas ventajas respecto a la creatinina y a las ecuaciones de estimación de FG basadas en ella en la población pediátrica. Asimismo, es un marcador precoz en la detección de la insuficiencia renal aguda. Entre las limitaciones de su uso cabe destacar la alteración de su concentración por factores distintos al FG como la disfunción tiroidea, cáncer y tratamientos farmacológicos. Actualmente no existe evidencia científica suficiente que justifique la sustitución de la creatinina y sus ecuaciones de estimación del FG por la cistatina C en la evaluación de la función renal. Es necesaria la realización de estudios multicéntricos y de coste-eficacia para optimizar el uso de la cistatina C y proporcionar estimaciones más exactas del FG2 . Bibliografía 1. Clinical practice guidelines for chronic kidney disease: evaluation, classification and stratification. Kidney Disease Outcome Quality Initiative. Am J Kidney Dis. 2002; 39 Suppl 1:S1-S266. 2. The CARI Guidelines. Chronic Kidney Disease. Evaluation of renal function guidelines 2005. [Citado el 28 de Julio de 2010]. Disponible en: http://www.cari.org.au/ ckd evaluation function list.php/. 3. Gracia S, Montañés R, Bover J, Cases A, Deulofeu R, De Francisco Hernández ALM, et al. Documento consenso Sociedad Española de Nefrología y Sociedad Española de Bioquímica 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. Clínica y Patología Molecular: Recomendaciones sobre la utilización de ecuaciones para la estimación del filtrado glomerular. Química Clínica. 2006;25:423—30. Myers GL, Miller WG, Coresh J, Fleming J, Greenberg N, Greene T, et al. Recommendations for improving serum creatinine measurement: A report from the Laboratory Working Group of the National Kidney Disease Education Program. Clin Chem. 2006;52:5—18. National Kidney Disease Education Program. Laboratory Professionals: Publications and Presentations. Estimating and reporting GFR. Equations and GFR calculator. [Citado el 28 de Julio de 2010] Disponible en: http://www.nkdep.nih.gov/ labprofessionals/equations and GFR.htm. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron. 1976;16:31—41. Schwartz GJ, Haycock GB, Edelmann CM, Spitzer A. Simple estimate of glomerular filtration rate in children derived from body length and plasma creatinine. Pediatrics. 1976;58:259—63. Schwartz GJ, Brion LP, Spitzer A. The use of plasma creatinine concentration for estimating glomerular filtration rate in infants, children, and adolescents. Pediatr Clin North Am. 1987;34:571—90. Counahan R, Chantler C, Ghazali S, Kirkwood B, Rose F, Barratt TM. Estimation of glomerular filtration rate from plasma creatinine concentration in children. Arch Dis Child. 1976;51:875—87. Filler G, Priem F, Lepage N, Pranav S, Vollmer I, Clark H, et al. -Trace protein, Cystatin C, 2 -microglobulin, and creatinine compared for detecting impaired glomerular filtration rates in children. Clin Chem. 2002;48:729—36. Woitas RP, Stoffel-Wagner B, Poege U, Schiedermaier P, Spengler U, Sauerbruch T. Low-molecular weight proteins as markers for glomerular filtration rate. Clin Chem. 2001;47:2179—80. Newman JD. Cystatin C. Ann Clin Biochem. 2002;39:89—104. Ayatse JOI, Kwan JTC. Relative sensitivity of serum and urinary retinol binding protein and alpha-1 microglobulin in the assessment of renal function. Ann Clin Biochem. 1991;28:514—6. Grubb AO. Cystatin C Properties and use as diagnostic marker. Adv Clin Chem. 2001;35:63—98. Séronie-Vivien S, Delanaye P, Piéroni L, Mariat C, Froissart M, Cristol JP. Cystatin C: current position and future prospects. Clin Chem Lab Med. 2008;46:1664—86. Randers E, Erlandsen EJ. Serum cystatin C as an endogenous marker of renal function- a Review. Clin Chem Lab Med. 1999;37:389—95. Dharnidharka VR, Kwon C, Stevens G. Serum cystatin C is superior to serum creatinine as a marker of kidney function: A meta-analysis. Am J Kidney Dis. 2002;40:221—6. Jayagopal V, Keevil BG, Atkin SL, Jennings PE, Kilpatrick ES. Paradoxical changes in cystatin C and serum creatinine in patients with hypo and hyperthyroidism. Clin Chem. 2003;49:680—1. Den Hollander JG, Wulkan RW, Mantel MJ, Berghout A. Is cystatin C a marker of glomerular filtration rate in thyroid dysfunction. Clin Chem. 2003;49:1558—9. Fricker M, Wiesli P, Brändle M, Schwegler B, Schmid C. Impact of thyroid dysfunction on serum cystatin C. Kidney Int. 2003;63:1944—7. Kos J, Stabuc B, Cimerman N, Brünner N. Serum cystatin C, a new marker of glomerular filtration rate, is increased during malignant progression. Clin Chem. 1998;44:2556—7. Terpos E, Katodritou E, Tsiftsakis E, Kastritis E, Christoulas D, Pouli A, et al. Cystatin C is an independent prognostic factor for survival in multiple myeloma and is reduced by bortezomib administration. Haematologica. 2009;94:372—9. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 60 23. Singh D, Whooley MA, Ix JH, Ali S, Shlipak MG. Association of cystatin C estimated GFR with inflammatory biomarkers: the Heart and Soul Study. Nephrol Dial Transplant. 2007;22:1087—92. 24. Knight EL, Verhave JC, Spiegelman D, Hillege HL, De Zeeuw D, Curhan GC, et al. Factors influencing serum cystatin C levels other than renal function and the impact on renal function measurement. Kidney Int. 2004;65:1416—21. 25. Cepeda J, Tranche Iparraguirre S, Marín Iranzo R, Fernández Rodríguez E, Riesgo García A, García Casas J, et al. Cistatina C y riesgo cardiovascular en población general. Rev Esp Cardiol. 2010;63:415—22. 26. Laterza OF, Price CP, Scott MG, Cystatin C. An improved estimator of glomerular filtration rate? Clin Chem. 2002;48:699—707. 27. Finney H, Newman DJ, Gruber W, Merle P, Price CP. Initial evaluation of cystatin C measurement by particle-enhanced immunophelometry on the Behring nephelometer systems (BNA, BN II). Clin Chem. 1997;43:1016—22. 28. Herget-Rosenthal S, Feldkamp T, Volbracht L, Kribben A. Measurement of urinary cystatin C by particle-enhanced nephelometric immunoassay: precision, interferentes, stability and reference range. Ann Clin Biochem. 2004;41:111—8. 29. Löfberg H, Grubb AO. Quantitation of gamma trace in human biological fluids: indications for production in the central nervous system. Scand J Clin Lab Invest. 1979;39:619—26. 30. Sunde K, Nilsen T, Flodin M. Performance characteristics of a cystatin C immunoassay with avian antibodies. Upsala J Med Sci. 2007;112:21—37. 31. Kyhse-Andersen J, Schmidt C, Nordin G, Anderssin B, NilssonEhle P, Lindstrom V, et al. Serum cystatin C, determined by a rapid, automated particle-enhanced turbidimetric method, is a better marker than serum creatinine for glomerular filtration rate. Clin Chem. 1994;40:1921—6. 32. Chew JSC, Saleem M, Florkowski CM, George PM. Cystatin C- A paradigm of evidence based laboratory medicine. Clin Biochem Rev. 2008;29:47—62. 33. Food and Drug Administration. N latex cystatin C test kit K003503. [Citado el 28 de Julio de 2010]. Disponible en: http://www.accessdata.fda.gov/cdrh docs/pdf/k003503.pdf. 34. Flodin M, Hansson LO, Larsson A. Variations in assay protocol for the Dako cystatin C method may change patient results by 50% without changing the results for controls. Clin Chem Lab Med. 2006;44:1481—5. 35. Blirup-Jensen S, Grubb A, Lindström V, Schmidt C, Althaus H. Standardization of cystatin C: Development of primary and secondary reference preparations. Scand J Clin Lab Invest. 2008;68(S241):67—70. 36. Certification of cystatin C in the human serum reference material ERM® -DA471/IFCC. Certified reference material ERM® -DA471/IFCC. European Commission Joint Research Centre Institute for Reference Materials and Measurements B-2440 Geel, Bélgica. [Citado el 28 de Julio de 2010]. Disponible en: http://irmm.jrc.ec.europa.eu/html/reference materials catalogue/catalogue/attachements/ERMDA471 report.pdf. 37. Fraser CG. Variación biológica: de la teoría a la práctica.(Traducido por la Comisión de la Calidad Analítica. Dirigido por Carmen Ricós. Comité de Publicaciones de la Sociedad Española de Bioquímica Clínica y Patología Molecular. 2003. 38. Base de datos de variación biológica de la Sociedad Española de Bioquímica Clínica y Patología Molecular. [Citado el 28 de Julio de 2010]. Disponible en: http://www.seqc.es/es/ Sociedad/7/51/102/Base de datos de Variacion biologica. 39. Keevil BG, Kilpatrick ES, Nichols SP, Maylor PW. Biological variation of cystatin C: implications for the assessment of glomerular filtration rate. Clin Chem. 1998;44:1535—9. M. Fernández García et al 40. Toffaletti JG, McDonnell EH. Variation of serum creatinine, cystatin C and creatinine clearance tests in persons with normal renal function. Clin Chim Acta. 2008;395: 115—9. 41. Bandaranayake N, Ankrah-Tetteh T, Wijeratne S, Swaminathan R. Intra-individual variation in creatinine and cystatin C. Clin Chem Lab Med. 2007;45:1237—9. 42. Delanaye P, Cavalier E, Depas G, Chapelle JP, Krzesinski JM. New data on the intraindividual variation of cystatin C. Nephron Clin Pract. 2008;108:246—8. 43. Reinhard M, Erlandsen EJ, Randers E. Biological variation of cystatin C and creatinine. Scand J Clin Lab Invest. 2009;69:831—6. 44. Andersen TB, Erlandsen EJ, Frokiaer J, Eskild-Jensen A, Brochner-Mortensen J. Comparison of within-and betweensubject variation of serum cystatin C and serum creatinine in children aged 2—13 years. Scand J Clin Lab Invest. 2010;70:54—9. 45. Galteau MM, Guyon M, Gueguen R, Siest G. Determination of serum cystatin C: Biological variation and reference values. Clin Chem Lab Med. 2001;39:850—7. 46. Pergande M, Jung K. Sandwich enzyme immunoassay of cystatin C in serum with commercially available antibodies. Clin Chem. 1993;39:1885—90. 47. Filler G, Bökenkamp A, Hofmann W, Le Bricon T, Martínez-Brú C, Grubb A. Cystatin C as a marker of GFR: history, indications, and future research. Clin Biochem. 2005;38:1—8. 48. Finney H, Newman DJ, Thakkar H, Fell JME, Price CP. Reference ranges for plasma cystatin C and creatinine measurements in premature infants, neonatos and older children. Arch Dis Child. 2000;82:71—5. 49. Köttgen A, Selvin E, Stevens LA, Levey AS, Van Lente F, Coresh J. Serum cystatin C in the United States: The Third National Health and Nutrition Examination Survey (NHANES III). Am J Kidney Dis. 2008;51:385—94. 50. Finney H, Newman DJ, Price CP. Adult reference ranges for serum cystatin C, creatinine and predicted creatinine clearance. Ann Clin Biochem. 2000;37:49—59. 51. Norlund L, Fex G, Lanke J, Von Schenck H, Nilsson JE, Leksell H, Grubb A. Reference intervals for the glomerular filtration rate and cell-proliferation markers: serum cystatin C and serum 2-microglobulin/cystatin C-ratio. Scand J Clin Invest. 1997;57:463—70. 52. Finney H, Bates CJ, Price CP. Plasma cystatin C determinations in a healthy elderly population. Arch Gerotonl Geriatr. 1999;29:75—94. 53. Harmoinen A, Ylinen E, Ala-Houhala M, Janas M, Kaila M, Kouri T. Reference intervals for cystatin C in pre- and full-term infants and children. Pediatr Nephrol. 2000;15:105—8. 54. Bökenkamp A, Domanetzki M, Zinck R, Schumann G, Brodehl J. Reference values for cystatin C serum concentrations in children. Pediatr Nephrol. 1998;12:125—9. 55. Erlandsen EJ, Randers E, Kristensen JH. Reference intervals for serum cystatin C and serum creatinine in adults. Clin Chem Lab Med. 1998;36:393—7. 56. Roos JF, Doust J, Tett SE, Kirkpatrick CMJ. Diagnostic accuracy of cystatin C compared to serum creatinine for the estimation of renal dysfunction in adults and children- A meta-analysis. Clin Biochem. 2007;40:383—91. 57. Sterner G, Björk J, Carlson J, Grubb A, Nyman U. Validation of a new plasma cystatin C-based formula and the Modification of Diet in Renal Disease creatinine-based formula for determination of glomerular filtration rate. Scand J Urol Nephrol. 2009:1—8. 58. Grubb A, Nyman U, Björk J, Lindström V, Rippe B, Sterner G, et al. Simple cystatin C based prediction equations for glomerular filtration rate compared with the Modification of Diet in Renal Disease Prediction equation for adults and the Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Cistatina C en la evaluación de la función renal 59. 60. 61. 62. 63. 64. 65. 66. 67. 68. 69. 70. 71. 72. 73. 74. 75. Schwartz and the Counahan—Barratt prediction equations for children. Clin Chem. 2005;51:1420—31. Filler G, Lepage N. Should the Schwartz formula for estimation of GFR be repleaced by cystatin C formula? Pedriatr Nephrol. 2003;18:981—5. MacIsaac RJ, Tsalamandris C, Thomas MC, Premaratne E, Panagiotopoulos S, Smith TJ, et al. The accuracy of cystatin C and commonly used creatinine based methods for detecting moderate and mild chronic kidney disease in diabetes. Diabet Med. 2007;24:443—8. Herget-Rosenthal S, Bökenkamp A, Hofmann W. How to estimate GFR-serum creatinine, serum cystatin C or equations? Clin Biochem. 2007;40:153—61. Bouvet Y, Bouissou F, Coulais Y, Séronie-Vivien S, Tafani M, Decramer S, et al. GFR is better estimated by considering both serum cystatin C and creatinine levels. Pediatr Nephrol. 2006;21:1299—306. Stevens LA, Coresh J, Schmid CH, Feldman HI, Froissart M, Kusek J, et al. Estimating GFR using serum cystatin C alone and in combination with serum creatinine: A pooled analysis of 3,418 individuals with CKD. Am J Kidney Dis. 2008;51:395—406. Larsson A, Malm J, Grubb A, Hansson O. Calculation of glomerular filtration rate expressed in mL/min from plasma cistatina C values in mg/L. Scand J Clin Invest. 2004;64:25—30. Hoek FJ, Kemperman FAW, Krediet RT. A comparison between cystatin C, plasma creatinine and the Cockroft and Gault formula for the estimation of glomerular filtration rate. Nephrol Dial Transplant. 2003;18:2024—31. MacIsaac RJ, Tsalamandris C, Thomas MC, Premaratne E, Panagiotopoulos S, Smith TJ, et al. Estimating glomerular filtration rate in diabetes: a comparison of cystatin C and creatinine based methods. Diab. 2006;49:1686—9. Le Bricon T, Thervet E, Froissart M, Benlakehal M, Bousquet B, Legendre C, et al. Plasma cystatin C is superior to 24-h creatinine clearance and plasma creatinine for estimation of glomerular filtration rate 3 months after kidney transplantation. Clin Chem. 2000;46:1206—7. Jonsson AS, Flodin M, Hansson LO, Larsson A. Estimated glomerular filtration rate (eGFRcystC ) from serum cystatin C shows strong agreement with iohexol clearance in patients with low GFR. Scand J Clin Invest. 2007;67:801—9. Herget-Rosenthal S, Marggarf G, Hüsing J, Göring F, Pietruck F, Janssen O, et al. Early detection of acute renal failure by serum cystatin C. Kidney Int. 2004;66:1115—22. Haase-Fielitz A, Bellomo R, Devarajan P, Story D, Matalanis G, Dragun D, et al. Novel and conventional serum biomarkers predicting acute kidney injury in adult cardiac surgeryA prospective cohort study. Crit Care Med. 2009;37:553—60. Villa P, Jiménez M, Soriano MC, Manzanares J, Casasnovas P. Serum cystatin C concentration as a marker of acute renal dysfunction in critically ill patients. Crit Care. 2005;9:R139—43. Bell M, Granath F, Martensson J, Löfberg E, Ekbom A, Martling CR. Cystatin C is correlated with mortality in patients with and withouth acute kidney injury. Nephrol Dial Transplant. 2009;24:3096—102. Baas MC, Bouman CS, Hoek FJ, Krediet RT, Schultz MJ. Cystatin C in critically ill patients treated with continuous venous hemofiltration. Hemodial Int. 2006;10:S33—7. Balik M, Jabor A, Wadauf P, Kolár M, Pavlisová M, Brest’an D, et al. Cystatin C as a marker of residual function during continuos hemodiafiltration. Kidney Blood Press Res. 2005;28:14—9. Keith DS, Nichols GA, Gullion CM, Brown JB, Smith DH. Longitudinal Follow-up and outcomes among a population with chronic kidney disease in a large managed care organization. Arch Intern Med. 2004;164:659—63. 61 76. Go AS, Chertow GM, Fan D, Mc Culloch CE, Hsu CY. Chronic kidney disease and the risks of death, cardiovascular events and hospitalization. N Engl J Med. 2004;351:1296— 305. 77. Ozer BA, Darsun B, Baykal A, Gultekin M, Suleymalar G. Can cystatin C be a better marker for the early detection of renal damage in primary hypertensive patients? Ren Fail. 2005;27:247—53. 78. Mussap M, Dalla Vestra M, Fioretto P, Saller A, Vanagnolo M, Nosadini R, et al. Cystatin C is a more sensitive marker than creatinine for the estimation of GFR in type 2 diabetic patients. Kidney Int. 2002;61:1453—61. 79. Tang GD, Lewis AV, James TJ, Altmann P, Taylor RP, Levy JC. Clinical usefulness of cystatin C for the estimation of glomerular filtration rate in type 1 diabetes. Diabetes Care. 2002;25:2004—9. 80. De Boer IH, Katz R, Cao JJ, Fried LF, Kestenbaum B, Mukamal K, et al. Cystatin C, albuminuria and mortality among older adults with diabetes. Diabetes Care. 2009;32:1833—8. 81. Kravaritou M, Thanopoulou A, Karamanos B, Kofinis A, Noutsou M, Spanou E, et al. Evidence than even normal albuminuria may denote incipient glomerular filtration rate reduction in patients with type 2 diabetes mellitus. Diabetes Res Clin Pract. 2009;85:317—21. 82. McNamara NV, Chen R, Janu MR, Bwititi P, Car G, Seibel M, et al. Early renal failure detection by cystatin C in type 2 diabetes mellitus: varying patterns of renal analyte expression. Pathology. 2009;41:269—75. 83. Donahue RP, Stranges S, Rejman K, Rafalson LB, Dmochowski J, Trevisan M, et al. Elevated cystatin C concentration and progression to pre-diabetes. Diabetes Care. 2007;30:1724—9. 84. Shlipak MG, Katz R, Sarnak MJ, Freíd LF, Newman AB, Stchman-Breen C, et al. Cystatin C and prognosis for cardiovascular and kidney outcomes in elderly persons without chronic kidney disease. Ann Intern Med. 2006;145:237—46. 85. Alonso A, Melgosa M. La cistatina C para la valoración de la función renal en pediatría. An Pediatr Contin. 2005;3:239—43. 86. Sharma AP, Kathiravelu A, Nadarajah R, Yasin A, Filler G. Body mass does not have a clinically relevant effect on cystatin C eGFR in children. Nephrol Dial Transplant. 2009;24:470—4. 87. Andersen TB, Eskild-Jensen A, Frokiaer J, BrochnerMortensen J. Measuring glomerular filtration rate in children; can cystatin C replace established methods? A review. Pediatr Nephrol. 2009;24:929—41. 88. Fliser D, Ritz E. Serum cystatin C concentration as a marker of renal dysfunction in the elderly. Am J Kidney Dis. 2001;37:79—83. 89. Woitas RP, Stoffel-Wagner B, Flommersfeld S, Poege U, Schiedermaier P, Klehr HU, et al. Correlation of serum concentrations of cystatin C and creatinine to inulin clearance in liver cirrhosis. Clin Chem. 2000;46:712—5. 90. Orlando R, Mussap M, Plebani M, Piccoli P, De Martin S, Floreani M, et al. Diagnostic value of plasma cystatin C as a glomerular filtration marker in descompensated liver cirrhosis. Clin Chem. 2002;48:850—8. 91. Lebkowska U, Malyszko J, Lebkowska A, Koc-Zorawska E, Lebkowski W, Malyszko JS, et al. Neutrophil gelatinaseassociated lipocain and cystatin C could predict renal outcome in patients undergoing allograft transplantation: a prospective study. Transplant Proc. 2009;41:154—7. 92. Bokenkamp A, Ozden N, Dieterich C, Schumann G, Ehrich JH, Brodehl J, et al. Cystatin C and creatinine after successful kidney transplantation in children. Clin Nephrol. 1999;52:371—6. 93. White CH, Akbari A, Hussain A, Dinh L, Filler G, Lepage N, et al. Estimating glomerular filtration rate in kidney transplantation: a comparison between serum creatinine and cystatin C-based methods. J Am Soc Nephrol. 2005;17:3763— 70. Documento descargado de http://www.elsevier.es el 13/07/2011. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 62 94. Xu H, Lu Y, Teng D, Wang J, Wang L, Li Y. Assessment of glomerular filtration rate in renal transplant patients using serum cystatin C. Transplant Proc. 2006;38:200—6. 95. Ortiz F, Harmoinen A, Paavonen T, Koskinen P, GrönhagenRiska C, Honkanen E, et al. Is cystatin C more sensitive than creatinine in detecting early chronic allograft nephropathy? Clin Nephrol. 2008;70:18—25. 96. Thysell H, Grubb A, Linholm T, Ljunggren L, Mårtensson L. Cystatin C: a new marker of biocompatibility or a good marker for the redistribution of LMW proteins during hemodialysis? ASAIO Trans. 1988;34:202—4. 97. Krieter DH, Falkenhain S, Chalabi L, Collins G, Lemke HD, Canaud B. Clinical cross-over comparison of mid-dilution hemodiafiltration using a novel dialyzer concept and postdilution. Kidney Int. 2005;67:349—56. 98. Montini G, Amici G, Milan S, Mussap M, Naturale M, Rätsch IM, et al. Middle molecule and small protein removal in children on peritoneal dialysis. Kidney Int. 2002;61:1153—9. 99. Hoek FJ, Korevaar JC, Kekker FW, Boeschoten EW, Krediet RT. Estimation of residual glomerular filtration rate in dialysis patients from the plasma cystatin C level. Nephrol Dial Transplant. 2007;22:1633—8. 100. Stabuc B, Wrhovec L, Stabuc-Silih M, Cizej TE. Improved prediction of decreased creatinine clearance by serum cystatin C: use in cancer patients before and during chemotherapy. Clin Chem. 2000;46:193—7. 101. Benonr P, Grenz A, Hartmann JT, Müller GA, Blaschke S. Cystatin C- a marker for assessment of the glomerular filtration rate in patients with cysplatin chemotherapy. Kidney Blood Press Res. 2006;29:32—5. M. Fernández García et al 102. Nakai K, Kikuchi M, Fujimoto K, Kaneko Y, Omori S, Nakai K, et al. Serum levels of cystatin C in patients with malignancy. Clin Exp Nephrol. 2008;12:132— 9. 103. Lankisch P, Wessalowski R, Maisonneuve P, Haghgu M, Hermsen D, Kramm CM. Serum cystatin C is a suitable marker for routine monitoring of renal function in pediatric cancer patients, especially of very young age. Pediatr Blood Cancer. 2006;46:767—72. 104. Delanaye P, Cavalier E, Radermecker RP, Paquot N, Depas G, Chapelle JP, et al. Cystatin C or creatinine for detection of stage 3 chronic kidney disease in anorexia nervosa. Nephron Clin Pract. 2008;110:c158—63. 105. Schück O, Teplan V, Stollova M, Skibova J. Estimation of glomerular filtration rate in obese patients with chronic renal impairment based on cystatin C levels. Clin Nephrol. 2004;62:92—6. 106. Viollet L, Gailey S, Thornton DJ, Friedman NR, Flanigan KM, Mahan JD, et al. Utility of cystatin C to monitor renal function in Duchenne muscular dystrophy. Muscle Nerve. 2009;40:438—42. 107. Babay Z, Al-Wakeel J, Addar M, Mittwalli A, tariff N, Hamma D, et al. Serum cystatin C in pregnant women: reference values, reliable and superior diagnostic accuracy. Clin Exp Obstet Gynecol. 2005;32:175— 9. 108. Odden MC, scherzer R, Bacchetti P, Szczech LA, Sidney S, Grunfeld C, et al. Cystatin C level as a marker of kidney function in human immunodeficiency virus infection. Arch Intern Med. 2007;167:2213—9. Normas Laboratorio Clinico.qxd 8/5/08 11:28 Página 2 INFORMACIÓN PARA LOS AUTORES REVISTA DEL LABORATORIO CLÍNICO es el órgano oficial de expresión de la Asociación Española de Biopatología Médica (AEBM), la Asociación Española de Farmacéuticos Analistas (AEFA) y la Sociedad Española de Bioquímica Clínica y Patología Molecular (SEQC). La revista publica artículos científicos relacionados con las llamadas Ciencias del Laboratorio Clínico. Se adhiere a los “Requisitos de uniformidad para manuscritos presentados para publicación en revistas biomédicas” elaborados por el Comité Internacional de Editores de Revistas Médicas (http://www.icmje.org), por lo que los manuscritos deben elaborarse siguiendo sus recomendaciones. SECCIONES Artículos originales. Trabajos de investigación en el ámbito de las Ciencias del Laboratorio Clínico. El texto no debe superar las 3.500 palabras excluyendo el resumen ni incluir más de 30 referencias bibliográficas. El texto del artículo estará estructurado como se indica en la preparación de manuscritos. La extensión del resumen será de 250 palabras y tendrá los siguientes apartados: Introducción, Material y métodos, Resultados y Conclusiones Es aconsejable que el número de firmantes no sea superior a seis. Notas técnicas. Sirven para publicar manuscritos de menor extensión (1.500 palabras máximo) que aborden aspectos eminentemente prácticos, temas muy concretos o estudios o aspectos meramente descriptivos. Artículos de revisión y editoriales. Habitualmente realizados ambos por encargo específico. La extensión del texto no excederá las 4.000 palabras para las revisiones y 1.500 para los editoriales. Las revisiones incluirán un resumen no estructurado de unas 150 palabras. Cartas al Director. Se publicarán, preferentemente, aquellas que hagan referencia a trabajos publicados en los últimos números de la revista y que aporten opiniones, observaciones o experiencias susceptibles de ser resumidas en un texto breve (750 palabras como máximo, más una tabla o una figura, y hasta diez referencias bibliográficas). El número de autores firmantes no deberá exceder de tres. Otras secciones. El Comité Editorial podrá acordar la publicación de otras secciones distintas de las mencionadas por acuerdo con las sociedades representadas en la revista. INFORMACIÓN GENERAL Envío de manuscritos. Los manuscritos deben remitirse a través de la siguiente dirección: http://ees.elsevier.com/labclin/ Todas las contribuciones originales, además de las que considere el Comité Editorial, serán evaluadas antes de ser aceptadas por revisión externa y anónima por pares (peer review). El envío de un artículo a la REVISTA DEL LABORATORIO CLÍNICO implica que es original y que no ha sido previamente total o parcialmente publicado ni está siendo evaluado para su publicación en otra revista. No se aceptará material previamente publicado. Los autores son responsables de obtener los oportunos permisos para reproducir parcialmente material (texto, tablas o figuras). Los originales deberán ir acompañados de un escrito, firmado por todos los autores, en el que se especifiquen estos extremos. Proceso editorial. La redacción de REVISTA DEL LABORATORIO CLÍNICO acusará recibo de los trabajos recibidos indicando la referencia correspondiente a cada envío, e informará acerca de su aceptación. Cuando el Comité Editorial sugiera efectuar modificaciones en los artículos, los autores deberán enviar de nuevo el artículo con las modificaciones realizadas, además de un documen- to especificando las modificaciones efectuadas (tanto sugeridas por el Comité Editorial como por los evaluadores). En todas las comunicaciones deberá indicarse la referencia asignada por la redacción. El Comité Editorial se reserva recomendar la modificación del trabajo para incluirlo en una sección diferente a la inicialmente considerada por los autores. Antes de la publicación del artículo, el autor indicado para la correspondencia en la primera página del manuscrito recibirá una prueba de composición del artículo. El autor deberá responder en 48 h dando su visto bueno para la impresión o indicando las correcciones necesarias, si fuera preciso. Las correcciones deben limitarse a los errores de imprenta, nunca serán adiciones o cambios del original. Derechos de autor. La presentación de originales implica que, en caso de ser aceptado para su publicación, se solicitará a los autores que transfieran los derechos de copyright a REVISTA DEL LABORATORIO CLÍNICO, que pasarán a ser propiedad permanente de REVISTA DEL LABORATORIO CLÍNICO y no podrán ser reproducidos en parte o totalmente sin su autorización expresa. Autoría. En la lista de autores deben figurar únicamente las personas que cumplan cada uno de los siguientes requisitos: – Haber participado en la concepción y realización del trabajo que ha dado como resultado el artículo en cuestión. – Haber participado en la redacción del texto y en sus posibles revisiones del mismo. – Haber aprobado la versión que finalmente va a ser publicada. Conflictos de intereses. Los autores deben indicar cualquier relación financiera que pudiera dar lugar a un conflicto de intereses en relación con el artículo publicado. Incluso si los autores consideran que no los hay, deberán indicarlo. Responsabilidades éticas. Cuando se describen experimentos que se han realizado en seres humanos, se debe indicar si los procedimientos seguidos son conformes a las normas éticas del comité de experimentación humana responsable (institucional o regional), y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki (http://www.wma.net/s/ethicsunit/helsinki.htm). No se deben utilizar nombres, iniciales o números de hospital, sobre todo en las figuras. Cuando se describen experimentos en animales, se debe indicar si se han seguido las pautas de una institución o consejo de investigación internacional, o una ley nacional reguladora del cuidado y la utilización de animales de laboratorio. En todo caso, deberá acompañarse una declaración escrita en tal sentido. Consentimiento informado. Los autores deben mencionar en la sección de métodos que los procedimientos utilizados en los pacientes y controles han sido realizados tras la obtención del consentimiento informado. Si se reproducen fotografías o datos de pacientes, los autores son responsables de la obtención del consentimiento por escrito, autorizando su publicación, reproducción y divulgación en soporte papel e internet. PREPARACIÓN DE MANUSCRITOS La presentación de los trabajos se hará en hojas DIN A4 (210 × 297 mm) escritas a doble espacio (30 líneas por página), con tipo de letra Arial de tamaño 12. Las hojas irán numeradas correlativamente en la parte inferior central. Cada parte del manuscrito empezará una página en el siguiente orden: 1. Primera página. Incluirá, en el orden que se cita, los siguientes datos: título completo del artículo (en castellano y en inglés), nombre completo y apellidos de los autores, nombre completo y dirección del centro Normas Laboratorio Clinico.qxd 8/5/08 11:28 Página 3 de trabajo, dirección postal, telefax, dirección de correo electrónico, y título abreviado del artículo. Junto a la carta de presentación de cada envío de originales se aportará la dirección postal y correo electrónico del autor principal para correspondencia. 2. Resumen y palabras clave. Se incluirá un resumen según la sección a la que pertenece el trabajo (léase apartado secciones), redactado en castellano e inglés. En la parte inferior del resumen se incluirán de 3 a 5 palabras o frases cortas, en castellano e inglés, que facilitarán la inclusión del trabajo en índices. Se recomienda que las palabras clave estén incluidas en la lista del Medical Subject Headings (MeSH) del Index Medicus (http://www.ncbi.nlm.nih.gov/entrez/meshbrowser.cgi) 3. Texto. Se recomienda la redacción del texto en estilo impersonal. Los trabajos deben dividirse en apartados, con arreglo al siguiente esquema general: a) Introducción. Será breve y debe expresar el contexto o los antecedentes del estudio y enunciar el objetivo de la investigación. b) Material y métodos. En general debe indicarse el centro donde se ha realizado el trabajo, su duración y características, el criterio de selección empleado y las técnicas utilizadas, proporcionando los detalles suficientes para que una experiencia determinada pueda repetirse sobre la base de esta información. Se han de describir con detalle los métodos estadísticos. c) Resultados. Se expondrán de forma concisa. Estos datos se expondrán en el texto pudiendo complementarse con tablas y figuras, para mayor claridad. d) Discusión. Destaca los aspectos más novedosos e importantes del estudio y las conclusiones que de ellos se deducen. e) Agradecimientos. Se incluirán al final del texto. 4. Referencias bibliográficas. Seguirán el orden consecutivo en que aparezcan en el texto con la correspondiente numeración correlativa en números arábigos entre paréntesis y en cursiva, según los «Requisitos de uniformidad para manuscritos presentados para publicación en revistas biomédicas» antes citados (http:// www.icmje.org/). Los nombres de las revistas deben abreviarse de acuerdo con el estilo usado en el Index Medicus/Medline: «List of Journals Indexed» que se incluye todos los años en el número de enero del Index Medicus, también disponible en http://www.ncbi.nlm.nih.gov/entrez/jrbrowser.cgi No se deben incluir citas difícilmente asequibles o verificables, como resúmenes de congresos o comunicaciones personales. Los autores son responsables de la exactitud y adecuada presentación de las referencias bibliográficas, que seguirán el estilo recomendado por el Comité Internacional de Editores de Revistas Biomédicas, que se puede consultar en: http://www.nlm.nih.gov/bsd/uniform_requirements.html Seguidamente se dan unos ejemplos de formatos correctos de citas bibliográficas: 1. Artículos de revistas 25. Halpern SD, Ubel PA, Caplan AL. Solid-organ transplantation in HIV-infected patients. N Engl J Med. 2002;347:284-7. Artículo con más de 6 autores: 26. Rose ME, Huerbin MB, Melick J, Marion DW, Palmer AM, Schiding JK, et al. Regulation of interstitial excitatory amino acid concentrations after cortical contusion injury. Brain Res. 2002;935:40-6. Artículo corporativo: 27. Diabetes Prevention Program Research Group. Hypertension, insulin, and proinsulin in participants with impaired glucose tolerance. Hypertension. 2002;40:679-86. Suplemento de un volumen: 28. Geraud G, Spierings EL, Keywood C. Tolerability and safety of frovatriptan with short- and long-term use for treatment of migraine and in comparison with sumatriptan. Headache. 2002;42 Suppl 2:S93-9. 2. Libros y capítulos de libros 29. Murray PR, Rosenthal KS, Kobayashi GS, Pfaller MA. Medical microbiology. 4.a ed. St. Louis: Mosby; 2002. 30. Gilstrap LC 3rd, Cunningham FG, VanDorsten JP, editors. Operative obstetrics. 2.a ed. Nueva York: McGraw-Hill; 2002. Capítulo de libro: 31. Meltzer PS, Kallioniemi A, Trent JM. Chromosome alterations in human solid tumors. En: Vogelstein B, Kinzler KW, editores. The genetic basis of human cancer. Nueva York: McGraw-Hill; 2002. p. 93-113. 3. Artículo de revista en Internet 32. Abood S. Quality improvement initiative in nursing homes: the ANA acts in an advisory role. Am J Nurs [serie en internet]. 2002 Jun [citado 12 Ago 2002];102(6):[aprox 3 p.]. Disponible en: http://www.nursing world.org/AJN/2002/june/Wawatch.htm 4. Página principal de un sitio web 33. Cancer-Pain.org [homepage on the Internet]. New York: Association of Cancer Online Resources, Inc.; c2000-01 [actualizado 16 May 2002; citado 9 Jul 2002]. Disponible en: http://www.cancer-pain.org/. 5. Tablas. Las tablas se presentarán preferiblemente en los formatos electrónicos habituales, para imprimir en hojas aparte que incluirán: a) numeración de la tabla con números arábigos; b) enunciado (título) correspondiente, y c) una sola tabla por hoja. Las siglas y abreviaturas se acompañarán siempre de una nota explicativa al pie y en orden alfabético. En el caso de reproducir datos de otra publicación, el autor deberá obtener el permiso escrito y hará constar referencia del original. El contenido es autoexplicativo y los datos que incluyen no figuran en el texto ni en las figuras. 6. Figuras (gráficos, esquemas o imágenes). No se aceptarán las imágenes fotográficas o microscópicas de calidad insatisfactoria o de insuficiente valor demostrativo. Es recomendable utilizar los formatos jpg o tiff, de resolución no inferior a 300 puntos por pulgada (dpi). El tamaño ha de ser también de 9 × 12 cm, en un número no superior a 6. No será aceptado cualquier tipo de material iconográfico presentado en color. Las figuras se numerarán con números arábigos, de acuerdo con su orden de aparición en el texto. Las leyendas de las figuras se incluirán en hoja aparte al final del manuscrito, identificadas con números arábigos. Deben identificarse las abreviaturas empleadas por orden alfabético. La leyenda correspondiente a cada figura irá mecanografiada a doble espacio, en una página aparte, para cada figura. Deberá ser clara y concisa y contendrá la explicación de cada abreviatura o símbolo utilizado. En el caso de reproducir figuras de otra publicación, el autor deberá obtener el permiso escrito y hará constar referencia del original. Las fotografías de personas deben realizarse de manera que no sean identificables o se adjuntará el consentimiento de su uso por parte de la persona fotografiada. 7. Símbolos estadísticos, matemáticos y bioquímicos. Los símbolos estadísticos y matemáticos utilizados en el texto, las tablas y las figuras deben ser los recomendados por la Organización Internacional de Normalización (ISO). Se recomienda la utilización de las unidades del Sistema Internacional de Unidades, aunque eventualmente se aceptarán las unidades convencionales, y se indicará la nomenclatura oficial de los constituyentes biológicos. No se debe utilizar en el texto símbolos no estandarizados y se restringirá su uso en ecuaciones, tablas y figuras. No obstante, cuando excepcionalmente la estructura del texto aconseje su utilización, deberá incluirse el símbolo entre paréntesis a continuación del término sin abreviar la primera vez que sea utilizado en el texto.