Cinética enzimática
Anuncio

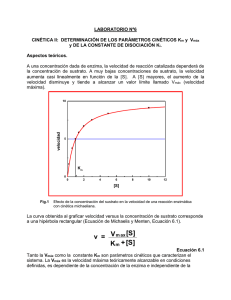
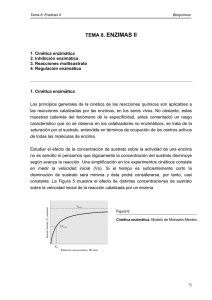
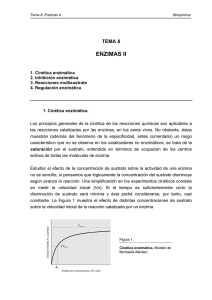
Cinética enzimática Los principios generales de la cinética de las reacciones químicas son aplicables a las reacciones catalizadas por enzimas, pero con la salvedad de que las enzimas se saturan con el sustrato, donde la velocidad de reacción llega a ser independiente de la concentración del sustrato y se hace constante. Teoría de Michaelis y Menten. Desarrollada en 1913 explica la acción y cinética de las enzimas. Supone que la enzima se combina con el sustrato (S), para formar el complejo E-S; el cual se escinde para formar la enzima libre y producto (P). La ecuación de Michaelis y Menten, es la ecuación de velocidad para las reacciones catalizadas por enzimas frente a un sustrato. Cuando la velocidad inicial es exactamente igual a la mitad de la velocidad máxima, se deduce que la concentración de sustrato es igual a la constante Km. Constante de Michaelis y Menten (Km). Se define como la concentración de sustrato en la que la velocidad inicial de la reacción es la mitad de la velocidad máxima. El valor aproximado de Km se obtiene gráficamente al representar la velocidad inicial frente a la concentración de sustrato inicial; se obtiene una hipérbole rectangular. Características de Km. 1:- Km no tiene un valor fijo, sino que varia con la estructura del sustrato, con el pH y la temperatura. 2:- Para las enzimas que poseen más de un sustrato, cada uno de estos exhibe una Km característica. 3:- En condiciones intracelulares, las enzimas no se hallan saturadas por los sustratos. 4:- Este parámetro es característico para la descripción matemática de la cinética enzimática, la determinación cuantitativa de la actividad enzimática. Velocidad máxima. 1:- La velocidad máxima (Vmax) es igual a K+2 (S) y que varia ampliamente de una enzima a otra para una concentración de enzima determinada. 2:- La Vmax varia con la estructura del sustrato, con el pH y la temperatura. Km y constante del sustrato (Ks). Km es una magnitud determinada experimentalmente y definida operativamente como, la concentración de sustrato a la cual la velocidad de reacción es equivalente a la 1/2 de Vmax. Km = K-1 + K+2 K+1 En algunas reacciones K-1 es muy grande, respecto de K+2, en este caso K+2 se hace despreciable y Km equivale aproximadamente a la constante de disociación del complejo ES (Ks). Representación de Lineweaver-Burk. Es una transformación algebraica de la ecuación de velocidad de Michaelis-Menten. La más utilizada es la que considera los recíprocos de ambos miembros de la ecuación de velocidad. Esta representación de doble recíproco, permite una determinación más exacta del valor de Vmax de las obtenidas de los gráficos de velocidad de Michaelis-Menten. Además proporciona información acerca de la inhibición enzimática. Representación de Eadie-Hofstee. Se obtiene multiplicando ambos miembros de la ecuación de Lineweaver-Burk por Vmax. Esta representación entrega valores de Vmax y de Km en forma sencilla y amplía las desviaciones del carácter lineal que pueden no aparecer en una representación doble recíproca. Efecto del pH sobre actividad enzimática. Cada enzima posee un pH característico en el cual su actividad es máxima. La relación entre el pH y la actividad de cualquier enzima depende del comportamiento ácido - base de la enzima y del sustrato. La forma de la curva de actividad-pH, varía con la concentración del sustrato, ya que el valor Km de muchas enzimas cambia con el pH. Efecto de la temperatura sobre actividad enzimática. 1:- La velocidad de reacción catalizada por enzimas se incrementa con aumento de la temperatura, en un intervalo en que la enzima es estable y permanece activa. 2:- La velocidad en muchas enzimas se duplica por cada 10ºC de aumento de temperatura (Q10 = 2). 3:- El Q10, varía de una enzima a otra según la energía de activación de la reacción catalizada. Efecto de la temperatura sobre reacciones enzimáticas. 4:- La temperatura óptima de la enzima , representada por un pico de actividad catalítica, es la resultante de dos procesos: a) El incremento de la velocidad de reacción con la temperatura. b) El incremento de la velocidad de desnaturalización térmica de la enzima al sobrepasar una temperatura crítica. 5:- La mayor parte de las enzimas se inactivan entre los 56 60ºC. Sin embargo, algunas bacterias son estables. Ej: bacterias termofílicas.