TEMA 13: EL AGUA
Anuncio

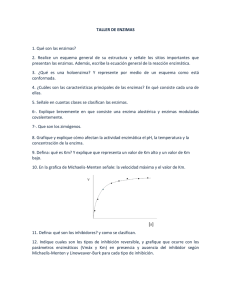
Tema 8. Enzimas II Bioquímica TEMA 8. ENZIMAS II 1. Cinética enzimática 2. Inhibición enzimática 3. Reacciones multisustrato 4. Regulación enzimática 1. Cinética enzimática. Los principios generales de la cinética de las reacciones químicas son aplicables a las reacciones catalizadas por las enzimas, en los seres vivos. No obstante, estas muestran (además del fenómeno de la especificidad, antes comentado) un rasgo característico que no se observa en los catalizadores no enzimáticos, se trata de la saturación por el sustrato, entendida en términos de ocupación de los centros activos de todas las moléculas de enzima. Estudiar el efecto de la concentración de sustrato sobre la actividad de una enzima no es sencillo si pensamos que lógicamente la concentración del sustrato disminuye según avanza la reacción. Una simplificación en los experimentos cinéticos consiste en medir la velocidad inicial (Vo). Si el tiempo es suficientemente corto la disminución de sustrato será mínima y ésta podrá considerarse, por tanto, casi constante. La Figura 5 muestra el efecto de distintas concentraciones de sustrato sobre la velocidad inicial de la reacción catalizada por un enzima. Figura 6. Cinética enzimática. Modelo de Michaelis-Menten. 72 Tema 8. Enzimas II Bioquímica En la cinética enzimática de la Figura 6 se distinguen tres fases: • Para una concentración baja de sustrato, la velocidad de la reacción es directamente proporcional a la concentración del sustrato (relación lineal), la cinética es de primer orden. • Para una concentración alta de sustrato, la velocidad de la reacción se hace prácticamente constante e independiente de la concentración de sustrato, la cinética se considera de orden cero. • Para concentraciones de sustrato intermedias la velocidad del proceso deja de ser lineal, y a esta zona se la denomina de cinética mixta. Este comportamiento es característico de la mayoría de las enzimas y fue estudiado por Michaelis y Menten en 1913. La velocidad de una reacción catalizada nos indica la cantidad de sustrato consumido, o producto formado, por unidad de tiempo. En el Sistema Internacional se designa por “U” (unidad de actividad enzimática) y corresponde a los µmoles de sustrato consumidos en 1 min, o bien a los µmoles de producto formado en 1 min. 1 U ≡ µmol S/min ≡ µmol P/min La curva que expresa la relación entre la concentración de sustrato y la velocidad inicial tiene la misma forma para la mayoría de las enzimas; se trata de una hipérbola rectangular, cuya expresión algebraica viene dada por la Ec. MichaelisMenten. Los términos Vmax (velocidad máxima) y Km (constante de Michaelis) son dos parámetros cinéticos característicos de cada enzima, que pueden determinarse 73 Tema 8. Enzimas II Bioquímica experimentalmente. La velocidad máxima se obtiene cuando la velocidad de reacción se hace independiente de la concentración de sustrato. Este valor depende de la cantidad de enzima que tengamos. La Km nos indica la concentración de sustrato a la cuál la velocidad de reacción es la mitad de la velocidad máxima, este parámetro es independiente de la concentración de enzima, y es característico de cada enzima según el sustrato utilizado (si tiene varios). La Km también indica la afinidad que posee la enzima por el sustrato, siendo ésta mayor, cuanto menor es la Km. Cuanto menor sea la Km menor será la cantidad de sustrato necesaria para alcanzar la mitad de la velocidad máxima, por lo que mayor será la afinidad del enzima hacia ese sustrato. La ecuación de Michaelis-Menten puede deducirse matemáticamente haciendo la aproximación del estado estacionario, según esta aproximación la concentración del complejo ES es constante en el estado estacionario y por lo tanto las velocidades de formación y destrucción del complejo ES son iguales. Además, asumimos que el paso limitante de la reacción es el segundo y por lo tanto la velocidad de la reacción es: Vo=K2 [ES]. Velocidad formación del complejo ES = Velocidad destrucción del complejo ES K1[E][S]= K-1 [ES] + K2[ES] K1[E][S]= (K-1 + K2 ) [ES] La concentración de enzima libre será igual a la concentración total de enzima menos lo que está unido al sustrato. [E]=[ Et ]-[ES], así que: K1[ Et ][S]- K1[ ES ][S] = (K-1 + K2 ) [ES] K1[ Et ][S]= (K-1 + K2 + K1[S]) [ES] Despejando [ES] se obtiene un término constante formado por las tres constantes e igual a la constante de Michaelis (Km). El término K1[ Et ] será precisamente la V (velocidad máxima) cuando todo el enzima esté unido al sustrato formado un complejo ES, o sea, cuando la enzima esté saturada por el sustrato, es decir: K1[ Et ]=Vmax. 74 Tema 8. Enzimas II Bioquímica De modo que la forma final de la ecuación de Michaelis-Menten es: A partir de esta ecuación podemos explicar matemáticamente las tres fases de la curva de Michaelis. • A baja [S] (es decir, si Km >>> [S]) el término Km+[S] podemos aproximarlo a la Km, quedando un expresión del tipo: V = k’ [S] Esta es una cinética de primer orden, que se caracteriza por una variación lineal de la V respecto al tiempo. • A altas [S] (es decir, Km<<<<[S]) despreciaríamos Km frente a [S], con lo que V = Vmax (que sería constante); la cinética es de orden cero y se habría alcanzado la saturación por sustrato. • El tramo intermedio, en el que la [S] ≈ Km correspondiente a una cinética de orden mixto y se ajusta a la ecuación de Michaelis. En muchos casos es de vital importancia conocer estos parámetros cinéticos. En principio, podrían obtenerse de forma poco rigurosa a partir de la curva de Michaelis Menten, pero existen métodos gráficos más fiables que facilitan el cálculo preciso de la Km y la Vmax. Los cálculos se hacen en base a transformaciones matemáticas de la ecuación de Michaelis; una de las expresiones más utilizadas es la representación de Lineweaver-Burk, también conocida como de dobles inversos (Figura 7). En esta forma de cálculo se representa 1/V frente a 1/S, obteniéndose una recta cuya intersección con el eje X es –1/Km y con el eje Y es 1/Vmax, siendo la pendiente Km/Vmax. Figura 7. Cinética enzimática. Representación de Lineweaver-Burk. 75 Tema 8. Enzimas II Bioquímica 2. Inhibición enzimática Existen sustancias que pueden impedir que la enzima desarrolle su actividad catalítica, ralentizando o paralizando la reacción enzimática. A estas sustancias se las denomina inhibidores enzimáticos. Teniendo en cuenta que las reacciones químicas en la célula están catalizadas por enzimas, es fácil intuir el papel de muchos inhibidores enzimáticos que actúan como fármacos, antibióticos o conservantes; otros pueden ser tóxicos, potentes venenos. Por ejemplo, la aspirina (acetilsalicilato) inhibe la enzima que cataliza el primer paso en la síntesis de prostaglandinas, implicadas en la producción del dolor. Se conocen dos tipos principales de inhibición: la reversible y a la irreversible. La primera implica una unión “no covalente” del inhibidor y, por lo tanto, siempre puede revertirse. En la inhibición irreversible, el inhibidor se une al enzima de forma “covalente” y permanente. En la inhibición irreversible, el inhibidor se une covalentemente a la enzima y la inactiva de manera irreversible. Casi todos los inhibidores irreversibles son sustancias tóxicas naturales o sintéticas. Se trata de sustancias que reaccionan con algún grupo funcional importante para la catálisis, bloqueándolo e impidiendo que la enzima desarrolle su actividad. En muchos casos la interacción se produce a través del sitio activo, impidiendo de manera irreversible que el sustrato ocupe su lugar; tal es el caso del gas Sarín, que inhibe irreversiblemente enzimas implicadas en la transmisión del impulso nervioso y su inhalación causa parálisis rápida de las funciones vitales. E+S K1 ES K2 E+P K-1 E+I EI En la inhibición irreversible se observaría una disminución de la Vmax es como si hubiera menos enzima. Si bien el proceso sería completamente irreversible por sustrato, incapaz éste de desplazar al inhibidor del sitio activo. La inhibición enzimática por modificación covalente constituye además una importante forma de regulación metabólica, como veremos en próximos apartados. 76 Tema 8. Enzimas II Bioquímica Inhibición reversible: los distintos modelos de inhibición reversible implican todos la unión no covalente del inhibidor con la enzima, pero difieren en los mecanismos por medio de los cuales reducen la actividad enzimática y en la forma en que afectan a la cinética de la reacción. Entre ellos están la inhibición competitiva, la acompetitiva y la no competitiva. • El inhibidor competitivo, es una sustancia similar en estructura al sustrato, con quien compite por el sitio activo de la enzima. E+S K1 K2 ES E+P K-1 ES+I Como consecuencia, Ki EIS aunque la velocidad máxima no se altera, para alcanzarla sería necesario poner más cantidad de sustrato en el medio de reacción, lo que se refleja en la correspondiente curva de Michaelis como un aparente aumento de la Km (la enzima en presencia del inhibidor perdería afinidad por el sustrato). La representación de dobles inversos (Figura 7) permite observar la variación de la Km. Figura 7. Inhibición competitiva. Cálculo de parámetros cinéticos mediante la representación de dobles inversos. La eficacia de un inhibidor competitivo depende de su concentración respecto a la del sustrato. Si hay un exceso de inhibidor éste bloqueará los centros activos de las moléculas de enzima, resultando una inhibición total. No obstante, el proceso es reversible si se procura exceso de sustrato, que desplazaría totalmente al inhibidor. 77 Tema 8. Enzimas II • Bioquímica El inhibidor acompetitivo reacciona con la enzima en un punto distinto al centro activo, pero sólo en el caso de que ésta esté unida al sustrato formando el complejo ES; de esta forma impide que la enzima desarrolle su actividad catalítica. E+S K1 ES K2 E+P K-1 ES+I Ki EIS Tanto la Vmax como la Km se alteran en la misma proporción, lo que se manifiesta en la representación de dobles inversos como rectas paralelas y por lo tanto con la misma pendiente (Figura 8). Se observa cómo se produce, aparentemente, una disminución tanto de la Vmax como de la Km. Figura 8. Inhibición acompetitiva. Cálculo de parámetros cinéticos mediante la representación de dobles inversos. • El inhibidor mixto puede combinarse tanto con la enzima libre como con el complejo enzima-sustrato, sin afectar al sitio activo de la enzima. E+S K1 ES K2 E+P K-1 E+I ES+I Ki Ki2 EI EIS La ecuación de Michaelis-Menten en el caso de un inhibidor mixto 78 Tema 8. Enzimas II Vmax Vo = α αi αi ⋅ [S ] K m + [S ] Bioquímica α ´= 1 + [I ] Ki [I ] α i = 1 + K i . Si Ki1 es distinto de Ki2, es una inhibición mixta simple en que tanto Vmax como Km se alteran. Si Ki1 y Ki2 tienen el mismo valor, ambas reacciones de inhibición están igual de favorecidos, en este caso particular decimos que se trata de una inhibición no competitiva. En este caso la Km no se altera y la Vmax disminuye, como puede observarse en la representación de dobles inversos (Figura 9). Inhibición no competitiva Con I 1/V Sin I 1/V ’max Figura 9. Inhibición no competitiva. Cálculo de parámetros cinéticos mediante la representación de dobles inversos. 1/Vmax - 1/Km 0 1/[S] 3. Reacciones multisustrato En este capítulo hemos estudiado reacciones del tipo S-P, un mecanismo relativamente simple con un solo sustrato que podría ajustarse a reacciones catalizadas por algunas enzimas (isomerasas, hidrolasas, algunas liasas) pero es importante tener en cuenta que la gran mayoría de las reacciones son multisustrato y suelen dar varios productos. Cuando una enzima une dos o más sustratos y libera múltiples productos, el orden de los pasos para a ser una característica importante del mecanismo de reacción. Hay distintos mecanismos que explican este tipo de reacciones. Las reacciones mutlisubstrato puden denominarse según el número de substratos y productos como Uni-Uni, Uni-Bi, Bi-Bi 79 Tema 8. Enzimas II Bioquímica Centrándonos en el estudio de las reacciones bisustrato (Bi-Bi), podemos clasificarlas en dos tipos principales de mecanismos: - Mecanismos secuenciales o de desplazamiento simple. En las que los dos sustratos se unen al centro activo antes de que se libere cualquiera de los productos. A menudo, resulta indiferente qué sustrato se una primero al centro activo (reacciones secuenciales al azar), aunque también se dan casos en los que la formación del complejo ternario EAB debe producirse en un orden determinado para que el complejo sea productivo desde el punto de vista catalítico (reacciones secuenciales ordenadas). - Mecanismo “ping-pong” o de doble desplazamiento: tras la unión del primer sustrato se libera uno de los productos, en una reacción parcial en la que se genera una forma modificada de la enzima. Esta forma une al siguiente sustrato, catalizando la formación del segundo producto con regeneración de la forma nativa de la enzima. Este tipo de mecanismo, es muy común en las reacciones en las que un grupo químico se transfiere desde el sustrato A al B. Muchas deshidrogenasas, como la alcohol deshidrogenasa, siguen un mecanismso Bi-BI secuencial ordenado en el que el cofactor NAD+ o NADP+ actúa como substrato inicial. Otras deshidorogenasas y muchas kinasas siguen un mecanismo secuencial al azar. Muchas enzimas reaccionan mediante mecanismos tipo Ping-Pong, incluyendo la quimiotripsina, que cataliza la hidrólisis de peptidos. En este caso el grupo peptido entra, es fragmentado (gracias a la Ser de la enzima) y se libera el extremo carboxilo del peptido. Luego entra el H2O y se libera el resto del peptido. 4. Regulación enzimática En el metabolismo celular hay grupos de enzimas que funcionan conjuntamente en rutas secuenciales para realizar un proceso metabólico denterminado. En estos sistemas el producto de reacción de la primera enzima se convierte en el substrato del segundo, además muchos intermediarios participan en varias rutas metablicas diferentes (encrucijadas metabólicas) . Evidentemente y al igual que ocurre en una 80 Tema 8. Enzimas II Bioquímica cadena de montaje industrial es fundamental que haya una coordinación y regulación para que no se acumulen intermediarios innecesarios o falte materia prima para alguna ruta importante. Una característica que diferencia a las enzimas de los catalizadores convencionales es su capacidad para regular su actividad. Una enzima puede ser más o menos activa gracias a la existencia de distintos niveles de regulación: • Nivel de síntesis: que haya más o menos moléculas de la enzima (ya lo veremos). • Nivel de actividad: que las moléculas de enzima existentes estén más o menos activas. Puede llevarse a cabo por factores extrínsecos a la enzima, pH, Tª, [S], [I], o por factores intrínsecos a la propia enzima; en este caso hablamos de enzimas reguladoras, enzimas que por su propia naturaleza tienen mecanismos especiales de regulación. Están especializadas en regularse respondiendo de forma muy sensible a señales externas. En la célula las enzimas operan en grupo, en rutas constituidas por varios pasos enzimáticos. En cada ruta hay al menos una enzima reguladora que determina la velocidad de toda la ruta. La modulación de las enzimas reguladoras ocurre mediante diferentes mecanismos: • • • • Enzimas alostéricas. Funcionan mediante la unión reversible no covalente de compuestos regulatorios llamados moduladores. El modulador puede ser una activador (modulación positiva) o un inhibidor (modulador negativo) y ser el propio sustrato de la reacción (alosterismo homotrópico) o ser otra sustancia (alsoterismos heterotrópico). Normalmente se trata de enzimas multiméricas y normalmente el sito activo y el regulatorio se encuentran en distintas subunidades. Enzimas interconvertibles Por modificación covalente reversible, como por ejemplo por fosforilación/defosforilación o modificación redox. Mediante proteínas reguladoras que se unen a la enzima. Mediante la eliminación proteolítica de pequeños segmentos peptídicos (esto es irreversible). 81