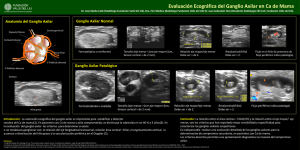
Avances y controversias
Anuncio

nº 29 Nov 2012 Avances y controversias en el manejo de la enfermedad ganglionar en cáncer de mama precoz www.geicam.org 12 Con el patrocinio de: Coordinadores científicos: Dr. José Enrique Alés, Hospital Ruber Internacional, Madrid. Dra. Lourdes Calvo, Complejo Hospitalario Universitario, A Coruña. Dr. Manuel Ramos, Centro Oncológico de Galicia, A Coruña. Dr. Pedro Sánchez Rovira, Complejo Hospitalario de Jaén, Jaén. RAGMA VIRTUAL es un curso de formación on-line que surge de la necesidad de poner al alcance de todos los profesionales de la salud que no puedan participar de la Revisión Anual GEICAM de Avances en Cáncer de Mama (RAGMA), la información recopilada durante este evento presencial. Está dirigido a médicos y residentes, tanto de oncología como de otras especialidades implicadas en el diagnóstico y tratamiento del cáncer de mama, médicos de la industria farmacéutica y gestores de la salud. Contenido: En RAGMA VIRTUAL dispondrás de: - Vídeos de las intervenciones de los ponentes de RAGMA. - Diapositivas de las presentaciones. - Resumen de las ponencias y bibliografía comentada. - Entrevistas a los ponentes y otros médicos especialistas. - C uestionario de evaluación para obtener la acreditación de formación médica continuada. - Descarga on-line de certificado de acreditación. Superado con un 70% de respuesta acertada el cuestionario de evaluación obtendrá 6,4 créditos otorgados por la agencia de acreditación Laín Entralgo y 6 puntos categoría 1 del programa ESMO-MORA de formación médica continuada. Precio: 150 euros Inscripción GRATUITA para los asistentes a RAGMA 12. Control con código de acceso personalizado. Inscripciones y mayor información a través de: www.ragmavirtual.com nº 29 Nov 2012 Boletín BOLETÍN TRIMESTRAL DEL GRUPO ESPAÑOL DE INVESTIGACIÓN EN CÁNCER DE MAMA COMITÉ EDITORIAL Dra. Isabel Álvarez Hospital Donostia, San Sebastián Dra. encarna aDrover Complejo Hospitalario Albacete Dra. Montserrat Muñoz Hospital Clinic, Barcelona Dra. sonIa GonzÁlez Hospital Mutua Terrassa Dr. PeDro sÁnchez rovIra Complejo Hospitalario de Jaén Dr. Manuel raMos Centro Oncológico de Galicia Dra. laura Gª estévez Centro Integral Oncológico Clara Campal, Madrid DISEÑO Y MAQUETACIÓN COMUNILAND, SL DEPOSITO LEGAL M-40619-2009 Sumario Carta de presentación .................................................................4 Dr. Carlos Vázquez Albaladejo – Presidente de SESPM Temas de revisión ..................................................................... 8 Un paso más allá del ganglio centinela SABCS 2011 Dra. Encarna Adrover – Complejo Hospitalario Universitario de Albacete Desde pGEICAM .................................................................... 12 Estudio del ganglio centinela y OSNA Dra. Laia Bernet – Hospital de la Ribera Desde qGEICAM .................................................................... 17 Avances y controversias en el manejo de la enfermedad ganglionar en el cáncer de mama precoz Dra. Mª Dolors Sabadell Mercadal, Dra. Mª del Mar Vernet Tomás y Dr. Ramón Carreras Collado – Hospital del Mar Universitat Autónoma de Barcelona Desde rGEICAM ..................................................................... 24 Controversias en el manejo de la axila en el cáncer de mama precoz. Visión del oncólogo radioterápico Dra. Arantxa Eraso y Dr. Ferrán Guedea Edo – Instituto Catalán de Oncología Desde dGEICAM .................................................................... 30 Técnicas de diagnóstico por imagen en el manejo de la afectación ganglionar axilar Dr. Joaquín Mosquera y Dr. José Ramón Varela Romero – Hospital Abente y Lago. CHUAC Seguimos animando a todos los lectores del Boletín para que participen con temas sobre los que deseen expresar su opinión. Envíe su contribución para esta sección por correo a la dirección: Caso clínico ............................................................................... 34 Dra. María del Mar Muñoz Sánchez – Hospital Virgen de La Luz Aportaciones científicas: Publicaciones y Comunicaciones .................................... 39 GEICAM Avenida de los Pirineos 7, Oficina 1 – 14, 28703 San Sebastián de los Reyes (Madrid), Noticias ....................................................................................... 42 o por correo electrónico a la dirección geicam@geicam.org Membresías................................................................................ 48 CARTA DE PRESENTACIÓN Carta de presentación Problemática de la valoración de la enfermedad axilar El tratamiento del cáncer de mama ha sido históricamente quirúrgico y ha estado basado de acuerdo a los conocimientos científicos tradicionales, en dos supuestos: eliminación de la enfermedad local y la resección de aquellas áreas ganglionares a las que supuestamente pudiera haber diseminado el tumor. Con ello, incluso mucho antes de la época de la confirmación de emigración tumoral por vía canalicular, se practicaban las mastectomías, en base a estos conceptos. Todavía, y como modelo en la estrategia quirúrgica, se sigue practicando en el abordaje de muchos tumores. En la medida en que otros tratamientos han demostrado su eficacia, especialmente la radioterapia que colabora de forma significativa en el control local, la amplitud de la extirpación ha sido menor(1). A ello contribuyeron los primeros estudios cooperativos internacionales, que demostraron que a igual estadio tumoral, sea cual fuere la técnica quirúrgica empleada, la supervivencia era la misma. De la exéresis de mama, junto a los gan- glios axilares y mamarios internos, se ha pasado en veinte años al tratamiento conservador y a la biopsia selectiva del ganglio centinela. De las grandes resecciones por tumores locamente avanzados, con el uso de los tratamientos sistémicos pre-quirúrgicos se practican resecciones limitadas, en muchos casos preservando la mama. Y además de los resultados oncológicos satisfactorios, se han logrado mejoras de tipo estético muy apreciables, por la implantación de las técnicas oncoplásticas y reconstructoras. Todos estos cambios han conducido, en lo que supone el control local de la enfermedad, a que el porcentaje de curabilidad que la cirugía aporta se mantenga, pero disminuyendo notablemente la morbilidad, las secuelas postquirúrgicas y mejorando la cosmesis, un aspecto que siempre había estado en segundo lugar(2). La introducción de la biopsia selectiva del ganglio centinela (BSGC), en un primer momento diseñada para el cáncer de pene y aplicada posteriormente para el melanoma, fue utilizada posteriormente para el cáncer de mama(3-4), lo que ha supuesto un avance extraordinario que sigue la misma línea de aminorar la agresión quirúrgica. El concepto de la posible diseminación tumoral hacia lo que sería la primera estación ganglionar, primer supuesto de la teoría mecanicista de Halsted, fue posteriormente rebatido y sustituido por el elaborado por los hermanos Fisher. De la consideración de lo que podía ser la diseminación ganglionar escalonada del cáncer de mama, a la de que el cáncer de mama es una enfermedad sistémica de inicio. De la primera se deduce que la cirugía debía seguir ese camino de resección amplia, y de la segunda que los tratamientos locales deben ser los adecuados y deben ser complementados con tratamientos sistémicos, que puedan entre todos eliminar la enfermedad local y a distancia. Aunque sean subgrupos pequeños, quedan por explicar las largas supervivencias de pacientes con tumores grandes y axilas con alta afectación ganglionar tratadas sólo con cirugía y radioterapia. Para que no se extirparan tejidos sanos de manera precautoria, la cirugía dejó de resecar la musculatura “La introducción de la BSGC, en un primer momento diseñada para el cáncer de pene y aplicada posteriormente para el melanoma, fue utilizada posteriormente para el cáncer de mama, lo que ha supuesto un avance extraordinario que sigue la misma línea de aminorar la agresión quirúrgica” 4 BOLETÍN GEICAM | NOV 2012 Dr. Carlos Vázquez Albaladejo Presidente de SESPM. pectoral en la mastectomía y buscó márgenes libres de enfermedad en la tumorectomía ampliada del tratamiento conservador(5). Aunque sabemos que la vía hemática es altamente prevalente, la práctica de la BSCG supone no tanto la aceptación del halstedianismo como mecanismo único de diseminación de la enfermedad, sino una emigración escalonada del tumor por la vía linfática. Este hecho está corroborado por la propia técnica de localización del ganglio centinela, ya sea por el método isotópico o colorimétrico; los contrastes emigran ordenadamente hacia lo que es el primer escalón ganglionar, mayoritaria pero no exclusivamente a la axila. En este sentido, recientemente lo estamos viviendo con la problemática de la rotura de los implantes mamarios de gel de silicona cohesivos PIP, donde la propagación de la silicona se produce mayoritariamente a los ganglios axilares, en ocasiones a los de la cadena mamaria interna y en algún caso en el que la paciente había sido sometida previamente a linfadenectomía axilar, a los ganglios supraclaviculares y cervicales. Este mecanismo de difusión es el que aceptamos para la búsqueda del ganglio centinela. Posiblemente, la emigración celular tumoral de esta forma no tiene nada que ver con la colonización tumoral del ganglio. La infiltración del mismo, tras la llegada de células tumorales, es un mecanismo en el que intervienen factores todavía desconocidos, posiblemente algunos de tipo inmunológico. De hecho, esta circunstan- cia es la que tiene más potencia en el pronóstico de la enfermedad. Por ello, la técnica de la BSCG ha sido totalmente aceptada por la comunidad quirúrgica con el fin del estudio ganglionar regional. Está ampliamente aceptado que la ausencia de enfermedad en la axila debe evitar la linfadenectomía(6). Es excepcional la skip metástasis y tanto la exploración clínica como la ecografía con punción pre-quirúrgicas pueden descartar su presencia. El paradigma basado en la eliminación de áreas ganglionares posiblemente afectas ha cambiado por el de resección ganglionar sólo en el caso de que un ganglio de la cadena, el ganglio centinela, esté infiltrado por el tumor. Dado que en el 75% de los casos es sólo el ganglio centinela el infiltrado por el tumor, y con la finalidad de conocer el estado del resto de los ganglios y evitar su innecesaria extirpación (con la seguridad de eliminar los presumiblemente afectos), se diseñaron nomogramas por diversos grupos de trabajo, pero su aplicación no ha resultado totalmente útil. Siendo la vigencia de la BSGC en la actualidad totalmente absoluta, algunas aportaciones recientes hacen pensar que el paradigma de la cirugía de eliminar toda la enfermedad locorregional no sea imprescindible(7). Pero con la información actual, en estos estudios hay que contemplar que existe la posibilidad de no resecar hasta el 30% de enfermedad axilar, aunque parece que no impacte sobre el pronóstico el que la posible infiltración axilar se deduzca por la simple palpación, que existan hasta el 20% de pacientes perdidas en el seguimiento y que la supervivencia con ganglios afectos sea de 92%, superior a la publicada en otros estudios con ganglios negativos; estos datos merecen una lectura más sosegada(8). Para que los profesionales del ámbito quirúrgico, que son los últimos responsables frente a la paciente, puedan disponer de una normativa acerca de qué hacer en cada momento, las sociedades médicas dictan protocolos, guías y consensos que contienen la información adecuada. Es obvio que estos documentos no están redactados en base a las últimas publicaciones, pero tienen la información asentada en un buen nivel de evidencia, por ello, su valor científico y, sobre todo, legal es muy alto. No hay que olvidar que el National Cancer Institute admitió la práctica del tratamiento conservador(9). La BSGC ha supuesto en los últimos años no sólo un avance en lo que es el segundo escalón de la cirugía conservadora, la preservación de la axila, sino un mejor conocimiento de biología tumoral en lo que supone su diseminación. La descripción de la presencia de células tumorales aisladas, las micro o macrometástasis con las dudas sobre su capacidad de desarrollo local y la predicción de la existencia de más enfermedad axilar son datos y cuestiones absolutamente nuevas a las que nos enfrentamos. Pero el desarrollo continúa y hemos tenido recientemente la posibilidad 5 BOLETÍN GEICAM | NOV 2012 CARTA DE PRESENTACIÓN “Los aportes de nuevos sistemas de detección preoperatoria del GC en estadios tempranos mediante RM con nuevos contrastes, la búsqueda intraoperatoria del GC con verde indocianina conjugada con albúmina humana, y la combinación de técnicas combinadas para tumor y ganglio son el fruto de la colaboración traslacional entre la imagen y la cirugía” de validar la técnica de detección de carga tumoral mediante métodos moleculares, con resultados cuantitativos. Los aportes de nuevos sistemas de detección preoperatoria del GC en estadios tempranos mediante RM con nuevos contrastes(10), la búsqueda intraoperatoria del GC con verde indocianina conjugada con albúmina humana(11), y la combinación de técnicas combinadas para tumor y ganglio(12) son el fruto de la colaboración traslacional entre la imagen y la cirugía. Algunas situaciones no están totalmente definidas, como son, en- 6 BOLETÍN GEICAM | NOV 2012 tre otras: el realizar la BSGC antes o después de los tratamientos neoadyuvantes(13), la recidiva axilar en pacientes con la BSGC negativa(14), la necesidad de practicarla en mujeres mayores de 70 años o en mujeres embarazadas con cáncer de mama(15). No cabe duda de que la publicación de los resultados del estudio Z0011 de la ACOSOG, y otros como el reciente estudio del IBCSG 23-01 (www. medscape.com) han supuesto un reto en la nueva forma de enfrentarse a la enfermedad axilar, no sólo por parte de los quirúrgicos, sino de todo el mundo oncológico. Es obvio que una nueva etapa se está abriendo en el tratamiento quirúrgico del cáncer de mama, pero este camino hay que recorrerlo con cautela. No se pretende en modo alguno frenar las mejoras en el conocimiento. Ya vivimos hace veinte años las trabas al tratamiento conservador que algunos lideramos, pero que se centraba en la certeza de la eliminación total de la enfermedad, circunstancia que no parece darse con este problema. Con ello no sólo estamos trabajando por el beneficio de las pacientes, sino por la responsabilidad científica e incluso legal que entraña para el quirúrgico que realiza su trabajo. Bibliografía 1. Veronesi U., Saccozzi R., del Vecchio M., Banfi A., Clemente C., de Lena M., et al. Comparing mastectomy, axilary dissection and radiotherapy in patients with small cancers of the breast. N Engl, J Med 1961;305:6-11. 2. Wesley P. Francis, M.D., Pamella Abghari, B.A., Wei Du, Ph.D, Christine Rymal, M.S.N., Moheen Suna, M.D., Mary A. Kosir, M.D., F.A.C.S. Improving surgical outcomes: standardizing the reporting of incidence and severity of acute lymphedema after sentinel lymph node biopsy and axillary lymph node dissection. Amer J Surg. 2006; 192:636-639. 3. Morton D.L., Wen D.R., Wong J.H., Economou J.S., et al. Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg 1992;127:392-399. 4. Giulano A.E., Kirgan D.M., Guenter J.M., Morton D.L. Lymphatic mapping and sentinel lymphadenectomy for breast cancer. Ann Surg 1994;3:398-401. 5. Vázquez Albaladejo C., Llombart Bosch A. Problemática clínico-patológica del tratamiento conservador. Rev Senología Patol Mam 1989;2:100-107. 6. Krag D.N., Andersoin S.J., Julian T.B., et al. Technical outcomes of sentinel-lymph-node resection and conventional axillary-lymph-node dissection in patiens with clinically node-negative breast cancer: results from the NSABP B-32 randomised phase III trial. Lancet Oncology 2007;8:881-888. 7. Giuliano A.E., Hunt K.K., Ballman K.V., Beitsch P.D., Whitworth P.W., et al. Axillary disection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis. A randomized clinical trial. JAMA 2011;6:569-575. 8. Cabañas Navarro L., Cabañas Montero L.J., Ortega Pérez G., Rioja Martín M.E. ¿Podemos obviar la linfadenectomía axilar en el cáncer infiltrante de mama? Avancemos pero con rigor. Rev Senología Patol Mam. 2011;3:81-83. 9. US National Cancer Institute (NCI). Surgery choices for women with early-stage breast cancer 2009; http// www.cancer.gov/cancertopics/brast-cancer-surgery-choices. 10. Harnan S.E., Cooper K.L., Meng, Ward S.E., et al. Magnetic resonance for assessment of axillary lymph node status in early breast cancer: A systematic review and meta-analysis. EJSO 2011;37:928-936. 11. Polom K., Murawa D., Nowaczyk P., Rho Y.S., Murawa P. Breast cancer sentinel lymph node mapping using near infrared guided indocianine green and indocyanine green human serum albumin in comparison with gamma emitting radioactive colloid tracer. EJSO 2012;38:137-142. 12. Veronesi U., de Cicco C., Galimberti V.E., et al. A comparative study on the value of FDG-PET and sentinel node biopsy to identify ocult axillary metastasis. Ann Oncol.2007;18:473-478. 13. Dixon J.M., Cody III H.S. Role of sentinel node niopsy inpatients having neoadjuvant chemotherapy. EJSO 2010;36:511-513. 14. Gauthier T., Mollard J., Fermeaux V., Kapella M., Aubard Y. Axillary recurrence after negative sentinel lymph node biopsy under local anesthesia in breast cancer. EJSO 2008;34:1277-1284. 15. Gentilini O., Cremonesi M., Trifiro G., et al. Safety of sentinel node biopsy in pregnant patients with breast cancer. Ann Oncol 2004; 15:1348-1351. 7 BOLETÍN GEICAM | NOV 2012 TEMAS DE REVISIÓN Temas de Revisión Un paso más allá del ganglio centinela SABCS 2011 “En un futuro muy cercano, con una biopsia del tumor primario tendremos información más que suficiente para tratar a las pacientes con cáncer de mama, independientemente del tamaño o de la afectación ganglionar”. Estas palabras del Dr. Casado me han acompañado desde los inicios de mi residencia en el H. Clínico de Madrid, y bien sabe Dios que dicha premonición está a punto de cumplirse: en estos 20 años he visto cómo cambiábamos el abordaje integral de las pacientes, incorporando la neoadyuvancia en tumores con fenotipos agresivos y estadios iniciales porque la respuesta patológica completa se asociaba a mayor supervivencia; conservar una mama con una buena respuesta al tratamiento médico aplicado no es cuestionable hoy en día; además hemos cambiado los criterios de “riesgo”, de tal manera que las indicaciones actuales de quimioterapia –incluido el tipo de quimioterapia a administrar– vienen asociadas a los fenotipos de mayor riesgo (triple negativos y HER-2), por encima del tamaño y la afectación ganglionar. Por su parte, las plataformas genómicas nos permiten identificar a aquellas pacientes con tumores de mejor pronóstico (luminales A), candidatas exclusivamente a tratamientos con hormonoterapia, incluso con ganglios afectos. Por tanto, tenía que llegar el momento de plantear cuál debe ser el abordaje quirúrgico de la axila en cáncer de mama. Barbara Smith, del Massachusetts General Hospital, fue la encargada de revisar este tema en SABCS 2011, os recomiendo su exposición. La linfadenectomía axilar (LA) ha sido durante décadas la técnica estándar para estadificar y tratar la axila, punto todavía imprescindible para los casos cN+: la afectación ganglionar junto con el fenotipo tumoral constituyen los dos principales factores pronósticos del cáncer de mama inicial y el número de ganglios afectos tiene per se un valor pronóstico añadido; además, la LA terapéutica puede evitar las complicaciones locales del crecimiento tumoral en una región compleja funcionalmente (infiltración del plexo braquial, trombosis/edema). En estos últimos diez años, hemos visto como el éxito del tratamiento conservador de la mama se ha extendido ampliamente al manejo de los ganglios axilares, tanto para estadificación (técnica del ganglio centinela GC) como tratamiento en casos de poca carga ganglionar (N0(i+), N1mi, N1a). Dos ensayos, el Z0011 y IBCSG 23-01, han sido los artífices de este hecho, a pesar del cierre prematuro por falta de reclutamiento por cuestiones éticas de los propios cirujanos y rechazo de las pacientes a la LA. Los programas de cribado han facilitado que un porcentaje cada vez mayor de las mujeres que tratamos en nuestras unidades se presente sin o con mínima (micrometástasis) afectación ganglionar: en estos casos, un manejo conservador como es la técnica de ganglio centinela nos aporta toda la información pronóstica necesaria con el mínimo impacto en la calidad de vida de las pacientes. Reflejo fiel de todos estos cambios es la reciente clasificación TNM de la AJCC (7ª Ed, revisada, 2010). No obstante, aún quedan varias cuestiones candentes por resolver: ¿En qué casos puedo obviar una LA terapéutica en cN0 y GC positivo? O lo que es lo mismo: ¿en cuántos casos estoy sobretratando la axila, irradiando la mama +/cadenas ganglionares, tras una LA? Sabemos que con la irradiación de la mama con campos tangenciales, > 50% de los ganglios del nivel I y 30% del nivel axilar II, reciben el 95% de la dosis planificada. La quimioterapia, por su parte, consigue erradicar la afectación ganglionar en un 25% de las pacientes, a lo que hay que añadir el beneficio de una hormonoterapia prolongada. ¿Importan más los criterios clásicos de edad y tamaño tumoral, o en realidad es el fenotipo tumoral el que debe condicionar el manejo de la axila? No tenemos datos suficientes “El ensayo NSABP-B04: demostró que tanto LA como radioterapia conseguían un excelente control local” 8 BOLETÍN GEICAM | NOV 2012 Dra. Encarna Adrover Servicio de Oncología. Complejo Hospitalario Universitario de Albacete. para obviar la LA en tumores HER-2 +/triple negativos N1. ¿Cómo han de cambiar los criterios de planificación radioterápica si dejamos de hacer LAs en N+? Veamos algunos de los datos publicados que pueden ayudarnos a contestar estas preguntas (figura 1). Manejo quirúrgico mínimo de la axila N+ El manejo no quirúrgico de la axila no es nada nuevo en la historia del cáncer de mama, comienza en 1970 con el ensayo NSABP-B04: además del abandono de la mastectomía tipo Halsted, este ensayo demostró que tanto la LA como la radioterapia conseguían un excelente control local (recaídas axilares < 5%), pero sin modificar las recaídas a distancia ni la supervivencia de las pacientes, y eso que un 40% de las mismas tenían ganglios positivos. Aparecieron recaídas axilares en menos de la mitad (18.6%) de las pacientes cN0 que no recibieron radioterapia ni LA; una nueva teoría aparece en escena: no todas las metástasis ganglionares –aunque existentes– se hacen evidentes con 25 años de seguimiento, avalando la hipótesis de que muchas de esas LAs fueron innecesarias. Los años 90 supusieron el espaldarazo a la cirugía conservadora actual y la implantación generalizada de los tratamientos médicos y radioterápicos adyuvantes, con el consiguiente aumento global en la supervivencia, así como el apoyo a la implantación del estudio del ganglio centinela. Descrito por Giuliano en 1994, esta técnica ha demostrado sobradamente su eficacia en la estadificación de la axila en cáncer de mama, con tasas de detección del GC cercanas al 97%, falsos negativos < 10% y recaídas posteriores axilares < 1%, de nuevo sin impacto en la supervivencia y manteniendo una mejor calidad de vida por su menor morbididad en lo que respecta a linfedema, disfunción del hombro y pérdida de sensibilidad. Con más de 10 años de seguimiento, los resultados del NSABP-32 (GC vs LA en pacientes cN0) han corroborado estos datos y más: al efecto, que las metástasis ocultas (no detectadas) presentes en un 15.9% de los casos al aplicar técnicas de inmunohistoquímica (IHQ) tienen escaso valor pronóstico, con diferencias en supervivencia a 5 años del 1.2% (94.6% vs. 95.8%), sin beneficio clínico adicional, por lo que no se recomienda en los consensos actuales su aplicación en el estudio del GC negativo fuera de ensayos clínicos. Otro dato interesante a este respecto fue encontrar estas micrometástasis, en mayor número, asociadas a tumores con RE positivos y fenotipo de mejor pronóstico, y que el tratamiento con tamoxifeno disminuyera su riesgo de muerte en un 53%. Si la búsqueda exhaustiva de estas pequeñas metástasis no está justificada, tampoco lo estaría la práctica de LA. Un ensayo que avala la no realización de LA cuando el GC tiene micrometástasis es el IBCSG: 23-01. Iniciado en el Figura 1. Evolución del tratamiento locorregional del cáncer de mama. 9 BOLETÍN GEICAM | NOV 2012 TEMAS DE REVISIÓN año 2000, ha publicado sus resultados en SABCS 2011. V. Galimberti presentó los datos de 934 pacientes con tumores T1-T2, cN0: un 90% recibieron cirugía conservadora y radioterapia, y todas ellas, tratamiento médico. El 89% de los tumores expresaban RE y un 70% de las micrometastásis eran < 1mm. Con 5 años de seguimiento, las recaídas axilares en el grupo de GC fueron del 1%, sin diferencias en supervivencia libre de enfermedad (88%) ni global (98%). Giuliano por su parte presentó en ASCO 2010 los resultados de un ensayo similar, el ACSOG Z0011: GC vs. LA en pacientes con macrometástasis en 1-2 ganglios centinela y axila cN0: son pacientes muy similares al ensayo anterior, tumores T1-T2, cN0 tratadas todas ellas con cirugía conservadora, radioterapia completa de la mama (no axila) y quimio/hormonoterapia adyuvantes. Se excluyen los casos de extensión extranodal macroscópica y ganglios palpables no captantes tras extraer GC. Un 27.4% de las pacientes que completaron la LA tenían otros ganglios afectos y un 84% de los tumores eran RE positivos. Con una mediana de seguimiento de 6 años, las recaídas axilares en el grupo de GC fueron del 0.9% y la supervivencia global del 92%. Los autores concluyen que los tratamientos médicos y radioterápicos aplicados a las pacientes son los responsables del control local, y que en pacientes con similares características a las del ensayo, la LA no estaría justificada. Sabemos además que las recaídas axilares suelen ocurrir mayoritariamente en los primeros 15-20 meses, por lo que ni con un seguimiento mayor encontraríamos diferencias significativas a favor del brazo de la LA. Otros dos ensayos, el ALMANAC y AMAROS, confirman los hallazgos del Z0011, aunque con ramas control de radioterapia. En cuanto al beneficio de los tratamientos médicos en el control local, Fiedler (2010) y Galimberti (2011) tampoco han encontrado más recaídas axilares tras GC + (itc/N1mi) en pacientes que o bien no recibieron radioterapia, o sólo fue una irradiación parcial/intraoperatoria; eso sí, todas las pacientes recibieron tratamiento médico adyuvante. El consenso de St. Gallen de 2011 y las guías NCCN no han tardado en aceptar los resultados de este ensayo. Manejo con radioterapia de la axila N+ Otra opción de tratar la axila N1 es con radioterapia: el ensayo NSABP-B04: demostró que tanto LA como radioterapia conseguían un excelente control local. Gadd en SABCS 2006 presentó los datos de un ensayo con 77 pacientes con macrometástasis, tratadas con tumorectomía, GC y radioterapia (mama y campos axilar-supraclavicular). Todas ellas recibieron tratamiento médico adyuvante, y con 8 años de seguimiento, sólo hubo una recaída axilar en una paciente con un tumor HER-2 positivo que no recibió trastuzumab; la morbididad asociada a la radioterapia axilar fue escasa, al igual que la reportada por el AMAROS. En ASCO 2011 se han presentado los resultados del ensayo NCIC-CTG MA.20: 1832 pacientes con tumores N1-3 ganglios/N0 de alto riesgo tratadas con cirugía conservadora más LA. Todas recibieron tratamiento médico (91% QT, 71% HT) y radioterapia ampliada (mama, axila alta, supraclavicular y mamaria interna). Con 5 años de seguimiento, demuestran un significativo mayor control locorregional y a distancia, y una tendencia a mayor supervivencia, confirmando los datos del meta-análisis de Oxford: las pacientes con poca carga axilar y tumores RE+ son las que mayor beneficio obtienen en supervivencia al prevenir recaídas locorregionales. Queda por aclarar cuál es el beneficio de la LA en estos casos, la morbididad a largo plazo (todas recibieron LA + RT axilar) y el cuestionable valor de irradiar la mamaria interna sin afectación confirmada. Otro grupo de pacientes que precisaría un manejo particular son aquellas con N1 en GC y tributarias a radioterapia local tras mastectomía: quizá en estos casos ampliar la radioterapia hasta la axila en vez de LA podría ser una opción; esperaremos a futuros ensayos clínicos que contesten esta cuestión. Manejo sin estudio de la axila en cN0 ¿Podríamos avanzar aun más y obviar la estadificación axilar en algún grupo de pacientes? Parece claro que sí, al menos en 2 situaciones: Pacientes con CDIS o CDIS con microinvasión, sometidas a cirugía conservadora: la posibilidad de encontrar un ganglio con macrometástasis capaz de cambiar el manejo terapéutico médico de la paciente es mínima y, para metástasis menores, la radioterapia de la mama con campos tangenciales cubre sobradamente los niveles axilares I y II. Se admite la realización de GC en los casos de mastectomía por CDIS, dada la dificultad de hallar el ganglio centinela en estos casos. Pacientes añosas con tumores luminales cT1N0. Tres ensayos clínicos, CALGB 9343, IBCSG 10-93 y el reportado por Martelli; todos han reportado excelentes controles locales, con recaídas axilares del 2% sin repercusión en la supervivencia. Expuestos estos datos, y después de leer toda la información que encontraréis en este boletín, sólo queda preguntarnos: ¿estamos preparados para afrontar todos estos cambios en nuestras unidades?, ¿por qué no hemos de ser capaces de obtener esos mismos resultados? Quizá nos falte el arrojo para dejar a nuestras pacientes la elección del tratamiento de la axila: el día que lo planteemos sin reparos, no habrá duda de que ganará por mayoría el ganglio centinela. “Quizá nos falte el arrojo para dejar a nuestras pacientes la elección del tratamiento de la axila: el día que lo planteemos sin reparos, no habrá duda de que ganará por mayoría el ganglio centinela” 10 BOLETÍN GEICAM | NOV 2012 Bibliografía 1. Fisher B., Jeong J.H., Anderson S., et al. Twenty-five-year follow-up of a randomized trial comparing radical mastectomy, total mastectomy, and total mastectomy followed by irradiation. N Engl J Med 2002; 347: 567-75. 2. Veronesi U., Paganelli G., Viale G., et al. A randomized comparison of sentinel-node biopsy with routine axillary dissection in breast cancer. N Engl J Med 2003; 349: 546-53. 3. Hughes K.S., Schnaper L.A., Berry D., et al. Lumpectomy plus tamoxifen with or without irradiation in women 70 years of age or older with early breast cancer. N Engl J Med 2004; 351: 971-77. 4. Martelli G., Boracchi P., de Palo M., et al. A randomized trial comparing axillary diseection to no axillary disecction in older patients with T1N0 breast cancer. Results after 5 years of follow-up. Ann Surg 2005; 242: 1-6. 5. Weaver D.L., Krag D.N., Manna E., et al. Detection of occult sentinel lymph node micrometastases by immunohistochemistry in breast cancer. Cancer 2006; 107: 661-7. 6. Mansel R.E., Fallowfield L., Kissin M., et al. Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: the ALMANAC trial. J Natl Cancer Inst 2006; 98: 599-609. 7. International Breast Cancer Study Group. Randomized trial comparing axillary clearance versus no axillary clearance in older patients with breast cancer: first results of IBCSG 10-93. J Clin Oncol 2006; 24: 337-44. 8. Straver M.E., Meijnen P., Van Tienhoven G., et al. Sentinel node identification rate and nodal involvement in the EORTC 10981-22023 AMAROS trial. Ann Surg Oncol 2010; 17: 1854-61. 9. Fiedler A.G., Covarrubias F.D.; Kim E., et al. Risk of axillary recurrence after a negative sentinel node biopsy without radiation: implication for partial-breast irradiation. ASCO Breast 2010. 10. Giuliano A.E., McCall L., Beitsch P., et al. Locoregional recurrence after sentinel lymph node dissection with or without axillary dissection in patients with sentinel lymph node metastases. Ann Surg 2010; 252: 426-33. 11. Weaver D.L., Ashikaga T., Krag D.N., et al. Effect of occult metastases on survival in node-negative breast cancer. N Engl J Med 2011; 364: 412-21. 12. Whelan T.J. NCIC-CTG MA.20: local-regional adjuvant radiotherapy after breast-conserving surgery. J Clin Oncol 2011; 29: 779 s, abstract LBA 1003. 13. Galimberti V. IBCSG 23-01: Sentinel lymph node biopsy alone vs axillary dissection for N1micrometastasis. SABCS 2011. 14. Goldhirsch A., Wood W.C., Coates A.S., et al. Strategies for subtypes-dealing with the diversity of breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol 2011; 22: 1736-47. 15. Early Breast Cancer Trialists´Collaborative Group. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10801 women in 17 randomized trials. Lancet 2011; 378: 1707-16. 16. Galimberti V., Botteri E., Chifu C., et al. Can we avoid axillary dissection in the micrometastatic sentinel node in breast cancer? Breast Cancer Res T, 2012; 131 819-25. 17. NCCN Guidelines Breast Cancer. Version 1.2012, 01/20/12 © National Comprehensive Cancer Network, Inc. 2012. 11 BOLETÍN GEICAM | NOV 2012 DESDE pGEICAM Desde pGEICAM Estudio del ganglio centinela y OSNA Introducción El objetivo del ganglio centinela (GC) en carcinoma de mama es identificar las pacientes cuyos ganglios linfáticos axilares están libres de metástasis y que, por tanto, no se beneficiarán de la linfadenectomía axilar (LA). El diagnóstico del GC constituye, en este contexto, un reto importante para los patólogos, ya que establece la base para la toma de decisiones terapéuticas sobre la axila. Perspectiva histórica Desde una perspectiva histórica, la estadificación axilar en carcinoma de mama ha planteado diferentes retos a lo largo del tiempo. En los años 90, con la implementación del procedimiento del GC en la práctica clínica, se propusieron varios protocolos diagnósticos, generalmente basados en el estudio de múltiples cortes histológicos a diferentes niveles sobre el bloque de parafina con o sin técnicas inmunohistoquímicas complementarias, en función de las posibilidades de cada servicio y generalmente para citoqueratina AE1/AE3 o CAM 5.2. El diagnóstico del GC era siempre diferido, lo que resultó en una elevada tasa de segundas intervenciones, correspondientes a linfadenectomías axilares (LA) por GC metastásico. La exhaustividad del estudio del GC dio lugar a una mayor frecuencia diagnóstica de metástasis de pe12 BOLETÍN GEICAM | NOV 2012 queño volumen, generalmente definidas como aquéllas cuyo diámetro mayor es ≤ 2 mm. Su significado pronóstico, es decir, su impacto en la supervivencia global (SG) e intervalo libre de enfermedad (ILE) en ausencia de tratamiento son, aún en la actualidad, tema de controversia, aunque algunos estudios establecieron diferencias pronósticas entre los distintos tipos de metástasis(1). En consecuencia, el sistema de estadificación TNM - 6ª edición(2) incluyó nuevas definiciones para metástasis con distinto significado pronóstico: células tumorales aisladas (CTAs) para las metástasis menores de 0.2 mm, micrometástasis para aquéllas cuyo diámetro máximo estaba entre 0.2 y 2 mm, y macrometástasis para aquéllas mayores de 2 mm. Sin embargo, los puntos de corte para las distintas definiciones fueron hasta cierto punto arbitrarios y escasamente basados en la evidencia científica. Además, las dificultades intrínsecas a la medición de la metástasis sobre la laminilla, es decir, sobre dos ejes, junto a la falta de reproducibilidad de tales medidas, dificultaron la obtención de conclusiones acerca de la validez de dichos puntos de corte. Este período corresponde, desde una perspectiva histórica, a la llamada “primera generación del GC” caracterizada por una estadificación más exhaustiva que la basada en la LA, pero por una elevada tasa de segundas intervenciones con el consiguiente impacto tanto físico como psicológico para la paciente. También con un impacto económico para el sistema de salud. El reto de la siguiente década fue, por tanto, evitar las segundas intervenciones y conseguir que tanto la cirugía mamaria como la cirugía sobre la axila pudieran realizarse en un solo tiempo quirúrgico. El esfuerzo de los patólogos por conseguir la máxima sensibilidad y especificidad diagnósticas basándose en métodos de estudio asumibles por los servicios asistenciales y en tiempo intra-operatorio fue lo que definió este segundo período (“segunda generación”) en la historia del GC de carcinoma de mama. Se propusieron gran variedad de protocolos diagnósticos intraoperatorios, aunque, en la mayoría de los casos, el diagnóstico intra-operatorio seguía siendo provisional y condicionado al diagnóstico definitivo, emitido en un segundo tiempo sobre el tejido restante, ya fijado en formol e incluido en parafina. En una encuesta realizada por el European Working Group for Breast Screening Pathology (EGWBSP) (3) , en la que participaron 240 servicios de anatomía patológica, se evidenció la existencia de más de 123 protocolos de estudio citológico o histológico diferentes, basándose generalmente, bien en el estudio citológico por impronta de una o más superficies de corte del/los GC, bien en el estudio por congelación de una o varias secciones del ganglio con o sin técnicas inmunohistoquímicas Dra. Laia Bernet Servicio de Anatomía Patológica. Hospital de la Ribera. complementarias, intraoperatorias o diferidas. El protocolo más frecuente consistía en el estudio de 6 cortes histológicos separados entre sí por 150µ. La clasificación de las metástasis fue, en esta época, muy patólogodependiente, especialmente en el caso de las micrometástasis y las células tumorales aisladas (CTAs), por ser las definiciones poco claras y difíciles de aplicar. Además, los criterios americanos y europeos no fueron totalmente coincidentes(4). Todo ello dificultó la obtención de conclusiones sobre la validez de los puntos de corte establecidos en el TNM - 6ª edición para los distintos tipos de metástasis y acerca de las diferencias pronósticas, ya que la reproducibilidad diagnóstica entre hospitales fue baja. El patólogo seguía sin resolver cuál era el protocolo diagnóstico más eficiente o cuál era el impacto de la micrometástasis y de las CTAs sobre el intervalo libre de enfermedad (ILE) y la supervivencia global (SG). Sin embargo, en este período se obtuvo una reducción de aproximadamente el 50% de las linfadenectomías diferidas respecto al período anterior, a pesar de que se estaba todavía lejos de conseguir una buena estandarización diagnóstica. A fin de proporcionar nuevas y mejores herramientas diagnósticas, la 7ª edición del sistema TNM de es- tadificación(5) introdujo una nueva definición para las CTAs, consideradas “agregados” de células de no más de 0,2 mm de máximo diámetro o la presencia de menos de 200 células en una sola superficie de corte histológico. Ello dio lugar a una nueva serie de publicaciones con el objetivo de definir el comportamiento biológico de las metástasis de pequeño volumen, entendidas como CTAs y micrometástasis. Simultáneamente, la aparición de una nueva técnica molecular, “One step Nucleic Acid Amplification” (OSNA), marcaba el inicio de la “tercera generación” en la historia del ganglio centinela en cáncer de mama. La gran aportación del OSNA consistió en estandarizar el estudio del GC en su totalidad, sin pérdida de tejido y en tiempo intraoperatorio. La técnica OSNA (One-Step-Nucleic-Acid-Amplification) se basa en una reacción de amplificación mediada por “bucles” (RT-LAMP) del ARNm de la CK19 (ARNmCK19) en tiempo real, a temperatura isoterma (65ºC) y en 16 min. La reacción de amplificación tiene lugar en un detector de amplificación génica RD-100i (Sysmex™). El pirofosfato de magnesio producido en la reacción de amplificación precipita cuando su concentración alcanza la saturación y permite la monitorización de la amplificación de ARNm-CK19, basada en la turbidez producida por la reacción, medida cada 6 segundos. Se eligió el ARNm-CK19 como marcador después de comparar su sensibilidad y especificidad con la de otros marcadores tales como FOXA 1, SPDEF, CEA, MGB1, TAQSTD2 and MUC1, correlacionándose el número de células tumorales con el número de copias de ARNm-CK19 y discriminando los casos positivos de los negativos. Se estudiaron secciones alternantes de ganglio linfático normal y metastásico para determinar los puntos de corte, observándose las siguientes correlaciones: El punto de corte más bajo (L) fue determinado por análisis estadístico del número de copias obtenido del estudio OSNA de ganglios linfáticos histológicamente negativos de pacientes N0. El punto de corte para las macrometástasis (H) se estableció a partir del número de copias de ARNm-CK19 expresado en un foco tumoral de 2 mm3. Valores de expresión inferiores a L (250 copias de ARNm-CK19) fueron considerados negativos a efectos de estadificación (pN0). Valores comprendidos entre L y H, es decir, entre 250 y 5.000 copias de ARNm-CK19 corresponden a micrometástasis y se expresan como “+” en la valoración semicuantitativa. Valores superiores a las 5.000 copias se expresan como “++” y corresponden a macrometástasis. El método OSNA tiene, como todas las técnicas diagnósticas, algunas limitaciones. La más importante de 13 BOLETÍN GEICAM | NOV 2012 DESDE pGEICAM ellas se relaciona con los carcinomas de mama que no expresan la CK19 y cuyas metástasis podrían no ser detectadas por la reacción de amplificación de la CK19. La tasa publicada de carcinomas de mama CK19 negativos es aproximadamente del 2%(6). Sin embargo, Alvarenga y cols (7) demuestran, en un estudio basado en técnicas de matrices de tejido y posterior estudio de secciones histológicas, que son muy pocos los carcinomas de mama que no expresan ARNmCK19, si bien pueden ser algunos más los que no expresan la proteína correspondiente. Según Alvarenga, los falsos negativos OSNA estarían únicamente en el grupo de los carcinomas metaplásicos, por lo que la ausencia de expresión de la proteína podría no ser una limitación para el estudio OSNA, salvo en ese grupo de tumores. Alvarenga atribuye la ausencia de positividad inmunohistoquímica de ciertos tumores a la heterogeneidad inherente de las células neoplásicas, que pueden ser negativas en la biopsia con aguja gruesa (BAG) pero positivas en otras áreas del tumor, sin ser, necesariamente, causa de falso negativo en el diagnóstico del GC. Se ha publicado que las inclusiones epiteliales benignas pueden ser causa de diagnósticos OSNA, falsos positivos. A pesar de que conceptualmente ésta es una idea posible, en la práctica, las inclusiones epiteliales benignas constituyen una patología muy poco frecuente, consistiendo la mayoría de las veces en acúmulos de células epiteliales muy pequeños que no alcanzan el tamaño suficiente para sobrepasar en número de copias el rango de las micrometástasis y no constituyendo, por tanto, indicación de ningún gesto quirúrgico añadido. Otra limitación posible es la inviabilidad de realizar un estudio histológico del ganglio, lo que puede conllevar pérdida de información en algunos casos al no poder evaluar, por ejemplo, la infiltración capsular, parámetro al que algunos autores han atribuido valor pronós14 BOLETÍN GEICAM | NOV 2012 tico, el número de focos metastásicos o la localización de los mismos. La inclusión en parafina de la grasa peri-ganglionar, sin embargo, tras la disección macroscópica del GC, permite la evaluación de la posible infiltración metastásica extracapsular. Un cambio de paradigma La introducción del OSNA ha supuesto un cambio de paradigma para los patólogos, cuyo diagnóstico se basa ya no en la morfología de las células tumorales o el diámetro de la metástasis, sino en el número de copias de CK19 del homogeneizado de tejido. A pesar de que inicialmente existieron ciertas reticencias entre patólogos respecto a la incorporación de ciertos tests moleculares al diagnóstico de rutina, la sencillez del método OSNA, su alta sensibilidad y especificidad y su reproducibilidad, así como la posibilidad de congelar alícuotas del homogeneizado del ganglio a -80ºC para posibles futuros estudios han acabado imponiéndose y consolidándolo como procedimiento de elección para el estudio patológico del GC(8). Aplicación clínica de los tests moleculares La recomendación del OSNA para el estudio del GC en carcinoma de mama se apoya en dos hechos fundamentales: En primer lugar, el test muestra un alto grado de correlación diagnóstica con los métodos histológicos e inmunohistoquímicos exhaustivos y existen estudios que han validado la técnica y justifican su aplicabilidad clínica. El alto nivel de estandarización que aporta el método OSNA constituye otro argumento importante para su recomendación(9). Existen numerosos estudios multicéntricos que demuestran que OSNA es un método altamente sensible y específico que discrimina mejor los distintos tipos de metástasis que el método histológico(10). Bernet y cols compararon, en un estudio retrospectivo-prospectivo, dos series consecutivas de GC intraoperatorio, una de ellas basada en la seriación intra-operatoria del GC en su totalidad con técnicas inmunohistoquímicas para citoqueratina AE1/AE3 y la otra basada en el método OSNA. No se observaron diferencias significativas en términos de benigno/maligno entre los porcentajes de ambas series, aunque sí un mayor porcentaje de micrometástasis en la serie OSNA respecto a la histológica a expensas, fundamentalmente, del grupo de las macrometástasis (tabla 1 y 2). Dichas diferencias pueden tener especial importancia no sólo por las diferencias pronósticas existentes entre micro y macrometástasis, sino también por las posibles implicaciones terapéuticas, dada la controversia existente acerca de las indicaciones de la linfadenectomía axilar(11). Controversias y futuro Una vez conseguida la estandarización diagnóstica del GC es posible diseñar estudios que permitan dar respuesta a cuestiones controvertidas, como el valor terapéutico de la linfadenectomía axilar. La LA ha formado parte durante años del tratamiento conservador del cáncer de mama. A partir de los resultados del NSABP-32(12) se demuestra que evitar la LA en los casos con GC negativo es un procedimiento seguro, iniciándose así el camino de la cirugía conservadora sobre la axila. El NSABP-32 es un ensayo randomizado cuyo objetivo fue demostrar si la omisión de la LA en pacientes GC negativas ofrecía tasas de control regional y supervivencia similares a las obtenidas en pacientes sometidas a la LA. Las pacientes fueron estratificadas por edad, diámetro tumoral y tipo de cirugía. En ambos grupos se realizó un diagnóstico intraoperatorio provisional del GC y un diagnóstico definitivo post-operatorio. La hipótesis del ensayo fue que en los casos en que el GC fuera negativo para metástasis, el resto TABLA 1: también que el 80% de los casos diagnosticados como micrometástasis en el estudio histológico convencional superaron el rango de las 5.000 copias de ARNm-CK19 en el estudio OSNA (macrometástasis). El dato parece especialmente significativo a la luz de del porcentaje de pacientes diagnosticadas de carcinoma de mama con peor pronóstico del esperado, cifra que podría estar en relación con la infra-estadificación de algunas pacientes. GANGLIOS CENTINELA METASTÁSICOS Y NO METASTÁSICOS. ESTUDIO HISTOLÓGICO VS OSNA 100% 80% 60% Por tanto, aun en el caso de que la indicación de la linfadenectomía axilar fuera meramente de estadificación, la omisión de la misma podría dejar cargas tumorales superiores a las esperadas, impidiendo, además, la individualización de la estrategia terapéutica, especialmente en el ámbito de la radioterapia. 40% 20% 0% Histology Positive de los ganglios de la LA serían también negativos. La LA ofreció un control regional de la enfermedad cercano al 100%, mientras que en el brazo observacional se evidenció una tasa de recidiva muy similar(12). Un objetivo secundario fue determinar el impacto de las metástasis ocultas en el intervalo libre de enfermedad (ILE) y en la supervivencia global (SG), entendiendo por metástasis ocultas aquéllas que no fueron diagnosticadas en el estudio seriado de cortes de 2-3 mm del GC con H&E, pero sí fueron demostradas en el estudio diferido con inmunohistoquímica, lo que ocurrió en aproximadamente el 20% de los casos. Ahora el reto es establecer las indicaciones de la LA en caso de GC positivo. Artículos recientes(11) defienden la seguridad de omitir la LA en pacientes seleccionadas de carcinoma de mama de bajo riesgo con metástasis en el GC y con un seguimiento de 36 meses. Otros estudios(13-14) muestran que las tasas de positividad en linfadenectomías axilares procedentes de OSNA Negative GC metastásico oscilan alrededor del 53%. Bernet y cols demuestran Por otra parte, las posibles indicaciones terapéuticas de la linfadenectomía axilar exceden el objetivo de este manuscrito y no son objeto de esta revisión. TABLA 2: DISTRIBUCIÓN PORCENTUAL DE LOS DISTINTOS TIPOS DE METÁSTASIS. ESTUDIO HISTOLÓGICO VS OSNA 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% OSNA Histology Macro Micro 15 ITC BOLETÍN GEICAM | NOV 2012 Bibliografía 1. De Boer M., van Deurzen C.H., van Dijck J.A., et al. Micrometastases or isolated tumor cells and the outcome of breast cancer N Engl J Med. 2009 Aug 13; 361(7): 653-6. 2. TNM Classification of Malignant Tumors, 6th ed. In: Sobin L.H. Wittekind C., eds. New York: Wiley-Liss; 2002. 3. Cserni G., Amendoeira I., Apostolikas N., et al. Discrepancies in current practice of pathological evaluation of sentinel lymph nodes in breast cancer. Results of a questionnaire based survey by the European Working Group for Breast Screening Pathology. J Clin Pathol. 2004 Jul; (7): 695-701. 4. Cserni G., Bianchi S., Vezzosi V., et al. Variations in sentinel node isolated tumour cells/micrometastasis and non-sentinel node involvement rates according to different interpretations of the TNM definitions. European J of Cancer 2008; 44(15): 2185-2191. 5. TNM 7ª ed AJCC Cancer Staging Manual. 2010. Edge, S.B.; Byrd, D.R.; Compton, C.C.; Fritz, A.G.; Greene, F.L.; Trotti, A. (Eds.). 6. Chu P.G., Weiss L.M. Keratin expression in human tissues and neoplasms. Histopathology 2001; 40:403-39. 7. Alvarenga C.A., Paravidino P.I., Alvarenga M., et al. Expression of CK19 in invasive breast carcinomas of special histological types: implications for the use of one-step nucleic acid amplification. J Clin Pathol. 2011 Jun; 64(6): 493-7. Epub 2011 Mar 22. 8. Bernet L., Piñero A., Vidal-Sicart S., et al. Actualización del consenso sobre la biopsia selectiva del ganglio centinela en el cáncer de mama. Sociedad Española de Senología y Patología Mamaria. Rev Senología Patol Mam 2010; 23(5): 201-208. 9. Bernet Vegué Laia, Martínez Benaclocha Marcos, Cano Muñoz Refael, et al. Molecular Diagnosis of Sentinel Lymph Nodes for Breast Cancer: One Step Ahead for Standardization. Diagn Mol Pathol 2011; 20(1): 18–21. 10. Bernet L., Cano R., Martínez M., et al. Diagnosis of the sentinel lymph node in breast cancer: a reproducible molecular method: a multicentric Spanish study. Histopathology 2011; 58(6): 863–869. 11. Giuliano A.E., McCall L., Beitsch P., et al. Locoregional recurrence after sentinel lymph node dissection with or without axillary dissection in patients with sentinel lymph node metastases: the American College of Surgeons Oncology Group Z0011 randomized trial. Ann Surg. 2010; 252(3): 426-32. 12. Krag D.N., Julian TB, Harlow S.P., et al. NSABP-32: Phase III, Randomized Trial Comparing Axillary Resection with Sentinal Lymph Node Dissection: A Description of the Trial. Ann Surgical Oncol 2004 March;11(3 Suppl): 208S-210S. 13. Kim T., Giuliano A.E., Lyman G.H. Lymphatic mapping and sentinel lymph node biopsy in early-stage breast carcinoma: a metaanalysis. Cancer 2006; 106: 4-169. 14. Bernet L., Rojo F., Hardisson D., et al. Comparison of Molecular Analysis and Histopathology for Axillary Lymph Node Staging in Primary Breast Cancer: Results of the B-CLOSER-I. Diagn Mol Pathol. In Press. 16 BOLETÍN GEICAM | NOV 2012 Avances y controversias en el manejo de la enfermedad ganglionar en el cáncer de mama precoz Introducción La cirugía del cáncer de mama ha ido modificándose según los avances médicos y el mejor conocimiento de la enfermedad. En un principio se creía que era una afección local y más tarde loco-regional, por lo que la cirugía era el tratamiento principal y más eficaz, siendo lo más amplia posible. El conocimiento de que en un porcentaje considerable de pacientes es probablemente una enfermedad sistémica, ya en el momento del diagnóstico, no ha hecho que el tratamiento quirúrgico haya dejado de efectuarse en estas pacientes, pero sí que ha contribuido en que cada vez se haya ido reduciendo su extensión. En la cirugía del cáncer mama debemos considerar dos campos: el de la propia mama y el de su drenaje linfático. La intencionalidad debe ser radical: efectiva, es decir conseguir la extirpación de la enfermedad local, y el resultado debe ser estético y sin morbilidad añadida. El tratamiento quirúrgico no tiene porque ser el único, ni tampoco forzosamente el primero. Recuerdo histórico Durante muchos años se aceptó que la mastectomía radical, propuesta en 1882 por William Halsted, era la cirugía idónea para el tratamiento del cáncer de mama. En 1948 aparecen modificaciones de esta técnica con conservación del músculo pectoral mayor (Merola-Patey, 1948) y de ambos pectorales (Madden y Auchincloss 1965). En 1951 Urban y Margotini preconizan que además de la extirpación de la mama, la fascia pectoral y el tejido ganglionar axilar debe extirparse también la cadena de la mamaria interna; en 1967 Veronesi propone además extirpar los ganglios mediastínicos y supraclaviculares. Paralelamente a las modificaciones de la cirugía radical aparece el tratamiento conservador sobre la mama. Los pioneros son: Keynes 1924, Peters 1939, Baclese 1949, Spitelier y Amalrich 1960. En 1972 Charles Marie Gros organiza en Estrasburgo el I Simposio Internacional sobre terapéuticas no mutiladoras del seno, siendo a partir de aquí aceptada esta técnica para el tratamiento del cáncer de mama. Los trabajos de Veronesi de 1981 y Fischer en 1985 corroboran la utilidad de la cirugía conservadora de la mama, como un tratamiento quirúrgico idóneo para el cáncer de mama inicial. Los avances más recientes en el diagnóstico de la enfermedad por métodos de imagen y cito-patológicos han contribuido enormemente a que se diagnostiquen cada vez más casos en estadios precoces. En los últimos años la cirugía del cáncer de mama no sólo ha estado orientada hacia el tratamiento conservador de la mama, sino también del tejido ganglionar y especialmente del axilar. Desde la descripción por Cabanas en 1992 del método de la BSGC para el cáncer de pene, esta técnica ha tenido una gran expansión en su aplicación al cáncer de mama, contribuyendo a minimizar la cirugía axilar. En 1994 Giuliano publica la técnica de BSGC en el cáncer de mama, pero es en 1993 cuando Krag incorpora la inyección de un radiotrazador para mejorar su localización, además de los colorantes vitales. En el cáncer de mama el ganglio centinela es aquél que recibiría el drenaje linfático de la lesión mamaria, aunque todavía hay controversias sobre si es el drenaje de la lesión de la mama o de toda la mama. Habitualmente son uno o dos ganglios, aunque ocasionalmente pueden identificarse algunos más en la linfogammagrafía. Valoración del estado ganglionar El estado axilar puede valorarse por la exploración clínica (no es el mejor método), por resonancia magnética, por PET-CT (especificidad de más del 95%, pero baja sensibilidad), y mediante ultrasonidos (alta sensibilidad, “En 1972 Charles Marie Gros organiza en Estrasburgo el I Simposio Internacional sobre terapéuticas no mutiladoras del seno, siendo a partir de aquí aceptada esta técnica para el tratamiento del cáncer de mama” 17 BOLETÍN GEICAM | NOV 2012 DESDE qGEICAM Desde qGEICAM Dra. Mª del Mar Vernet Tomás Dr. Ramón Carreras Collado Médico adjunto, Ginecología. Hospital del Mar. Universitat Autònoma de Barcelona. Jefe de Sección, Ginecología. Hospital del Mar. Universitat Autònoma de Barcelona. Jefe de Servicio, Ginecología. Hospital del Mar. Universitat Autònoma de Barcelona. simple, barato, es el más utilizado). En ganglios axilares no palpables los ultrasonidos serán un buen método, con una sensibilidad del 56-72% y una especificidad entre el 70-90%. La punción con aguja fina (PAAF) es la técnica más utilizada para su estudio, aunque la biopsia con aguja gruesa (BAG)(1) puede ser también una buena técnica. ganglios positivos en la clasificación “pN”, pero deben ser incluidos en el número total de ganglios evaluados. Las micrometástasis ganglionares se definen como lesiones superiores a 0’2 mm y/o más de 200 células aisladas, pero no superiores a 2 mm de diámetro. linfadenectomía. En el caso de concurrir los dos tratamientos, la posibilidad de linfedema está alrededor de un 40%(2). DESDE qGEICAM Dra. Mª Dolors Sabadell Mercadal Otras técnicas de medicina nuclear que pueden contribuir a detectar multicentricidad, multifocalidad, lesiones metabólicas ocultas en la mama y metástasis ganglionares axilares son el PET-FDG y 99mTc-MIBI. Clasificación TNM La séptima clasificación TNM, la última de 2010, presenta diferencias respecto a la edición anterior, tanto la de la UICC (TNMUICC) como la edición de la AJCC (TNMAJCC), respecto a la valoración de los ganglios regionales. En la clasificación “N” para considerar un vaciamiento axilar se debe incluir al menos el nivel I de Berg, debiendo valorarse como mínimo seis ganglios. Si estos seis o más ganglios han sido extirpados mediante técnica de BSGC se debe omitir el modificador “sn”. La clasificación de las células tumorales aisladas (ITC) es más estricta. Son pequeños grupos no mayores de 0’2 mm o no confluentes o cercanos, de menos de 200 células en una muestra simple histológica del ganglio, detectables por inmunohistoquímica (IHQ) o tinción convencional. Los ganglios que sólo contienen ITC se excluyen del total de la cuenta de 18 BOLETÍN GEICAM | NOV 2012 El estadio I ha sido subdividido en IA y IB. El IB engloba aquellas lesiones T0 y T1 (incluyendo el T1mi) que presentan micrometástasis en ganglio linfático (Nmi). La constante evolución de la biología molecular y de los factores pronóstico, los progresos tecnológicos en el diagnóstico anátomo-patológico y por métodos de imagen, y la respuesta a nuevas drogas y dianas terapéuticas han hecho replantearse la clasificación de la TNMUICC y TNMAJCC. En el Instituto Europeo de Oncología (IEO) se planteó en 2009 la necesidad de ampliar la información del TNM, surgiendo la clasificación TNMIEO, en la que además de todos los valores anteriores hace un estadiaje exhaustivo de las características biológicas tumorales y de dianas terapéuticas. Manejo de la axila positiva en el diagnóstico La linfadenectomía axilar sigue siendo el tratamiento estándar en los casos con ganglios clínicamente palpables o no palpables positivos confirmados por PAAF. La incidencia de linfedema después de una linfadenectomía axilar es de 3-5%, igual que en los casos en que se realiza una radioterapia axilar sin Manejo de la axila negativa en el diagnóstico. Biopsia Selectiva del Ganglio Centinela (BSGC) En el Manual de la EORTC-2000 se valida el concepto de ganglio centinela en el cáncer de mama, considerándolo como un procedimiento de estadificación análogo al de la linfadenectomía axilar. Se introduce así la BSGC como una opción para poder estadiar el drenaje linfático del cáncer de mama en estadios iniciales sin tener que realizar la linfadenectomía axilar, en aquellos casos en que su estudio sea negativo. La conferencia consenso de Philadelphia en 2002 confirmó la eficacia de la BSGC en cáncer de mama inicial. Hay varias recomendaciones básicas de la BSGC en estadios iniciales de la American Society of Clinical Oncology (ASCO) de 2005(3): las pacientes deben ser seleccionadas, el estudio por métodos de imagen de la axila debe ser negativo y debe incluir en caso de sospecha de ganglio positivo una PAAF, la localización del ganglio centinela puede hacerse mediante colorante, radiocoloide o ambos y se precisa un equipo multidisciplinar entrenado (cirujano, patólogo y médico nuclear), para reducir el número de linfadenectomias sin asociar morbilidad. En España, en 2001, la Asociación Española de Cirujanos y la Sociedad “Según el consenso de ASCO de 2005 debe realizarse una linfadenectomía axilar en los casos en que el ganglio centinela es positivo, incluyendo las macrometástasis, micrometástasis y las ITC, siendo indiferente el método de detección (H&E o IHQ)” Española de Oncología Quirúrgica realizaron consensos sobre la BSGC en Salamanca y Valencia. El último consenso para actualizar ésta técnica por la Sociedad Española de Senología y Patología Mamaria fue en 2006 y 2010. En las guías de la NCCN-2012, National Comprehensive Cancer Network, la utilización de la inmunohistoquímica (IHQ) para la valoración del ganglio centinela de forma rutinaria es controvertida y no se recomienda, aconsejándola sólo en aquellos casos dificultosos por hematoxilina-eosina (H&E). En el estudio ACOSOGZ0010 se demuestra que no tiene impacto su diagnóstico sobre la supervivencia global. Indicaciones actuales En 2010, en el consenso internacional de expertos sobre las recomendaciones actuales del tratamiento locoregional en cáncer de mama(4), hace mención a la evaluación de los ganglios linfáticos axilares: La BSGC es el tratamiento estándar para la evaluación axilar en pacientes con axila clínicamente negativa. En ganglios palpables o de sospecha por ultrasonidos, la PAAF ecoguiada es la técnica más utilizada. Está absolutamente contraindicada en caso de cáncer inflamatorio. No se recomienda esta técnica en T4. La gestación no es una contraindicación para su realización mediante radiotrazador. Manejo del ganglio centinela negativo Actualmente, demostrada ya la validez de la BSGC, se considera el tratamiento estándar para los estadios I y II. En el estudio ALMANAC de 2006, que randomiza a las pacientes a realizar linfadenectomía vs solo BSGC, se observa menor morbilidad en éste segundo grupo y la recurrencia local y supervivencia es similar en ambos. Los resultados presentados por el NSABP B-32 y U. Veronesi demuestran que en la BSGC hay una tasa de ganglios positivos similar a la de la linfadenectomía, una disminución significativa de la morbilidad y unas tasas de recidiva ganglionar a los 5 años semejantes. Las tasas de falsos negativos son superiores en lesiones de grado 3 y en los casos en que el ganglio centinela es único, comparado con los casos en que es múltiple. Los resultados del NSABP B-32(5) sobre supervivencia son significativos, la supervivencia libre de enfermedad, la supervivencia global y el control local de la enfermedad, en el caso de ganglio centinela negativo, son estadísticamente equivalentes, tanto si se realiza como si no se realiza una linfadenectomía axilar posterior. El beneficio de la linfadenectomía axilar es discutible según los estudios. En pacientes postmenopáusicas, con lesiones iniciales no palpables de 1 cm, axila clínicamente negativa y receptores estrogénicos positivos, según un estudio costebeneficio de 1999, no tendría beneficio realizar la linfadenectomía axilar. La decisión debería tomarse según la edad de la paciente, el tamaño tumoral, si recibirán quimioterapia adyuvante, factores pronóstico del tumor y preferencias de la paciente. En 2009, en el consenso internacional de expertos del 11TH Sant Gallen(6) se aceptó que en los casos de BSGC negativa puede obviarse la realización de una linfadenectomía axilar. También se aprobó en la guía práctica de la NCCN-2010. Micrometástasis y células tumorales aisladas (ITC) Las ITC tienen una incidencia alrededor de un 20% y el 9% se detecta sólo por IHQ. Según la clasificación TNM se considera N0. En un estudio de cohortes entre 1977 y 2008, la presencia vs la ausencia de micrometástasis o ITC en ganglios axilares se asocia a un peor periodo libre de enfermedad y supervivencia. El posible significado de las ITC o micrometástasis ocultas en el ganglio centinela fue estudiado por el NSABP B-32. Se revisaron todas las muestras parafinadas de ganglio centinela negativo por H&E, con IHQ, observándose en un 15’9% metástasis ocultas. La diferencia absoluta en la supervivencia global a los 5 años fue del 1’2%, no considerándose un beneficio clínico significativo el estudio sistemático por IHQ. Tanto en micrometástasis como en ITC, en el estudio MIRROR [33], el tratamiento sistémico adyuvante aumentó la supervivencia libre de enfermedad en mujeres en estadios iniciales de cáncer de mama. Según el consenso de ASCO de 2005(3) debe realizarse una linfadenectomía axilar en los casos en que el ganglio centinela es positivo, incluyendo las macrometástasis, micrometástasis y las ITC, siendo indiferente el método de detección (H&E o IHQ). En un cuestionario remitido a miembros de ASCO en 2009 con carácter multidisciplinar que realizaba unas recomendaciones en caso de micrometástasis en ganglio centinela, el 89% estuvieron de acuerdo en que debe hacerse tratamiento adyuvante sistémico, pero hubo discordancias entre realizar una linfadenectomía versus radioterapia axilar. 19 BOLETÍN GEICAM | NOV 2012 DESDE qGEICAM En 2009 en el consenso internacional de expertos del 11TH Sant Gallen(6) se aceptó que en algunos casos de micrometástasis y de ITC puede obviarse la realización de una linfadenectomía axilar. En el 33rd Annual San Antonio Breast Cancer Symposium de 2010, los resultados del NSBP B-32 revelan que las pacientes con micro o macrometástasis en el ganglio centinela que han recibido tratamiento sistémico presentan una reducción del 78% de la mortalidad y un aumento en el periodo libre de enfermedad del 76%(7). Los primeros resultados del estudio ACOSOG-Z0011 en pacientes que presentan micrometástasis o ITC fueron publicados en 2010. La conclusión es que la BSGC ofrece una información suficiente para el tratamiento adyuvante y un excelente control regional en pacientes con cáncer de mama inicial a las que no se les ha practicado linfadenectomía axilar, siendo la tasa de recurrencias baja a los 2-3 años de seguimiento. Este estudio cuestiona la necesidad de realizar una linfadenectomía en los casos de micrometástasis en el ganglio centinela. Galimberti y cols presentaron en el 34rd Annual San Antonio Breast Cancer Symposium de 2011 el resultado del Trial 23-01 del International Breast Cancer Study Group, que compara disección axilar o no en pacientes con T1 y T2 y ganglios clínicamente negativos, con micrometástasis en el ganglio centinela (abstract S3-1). Es un estudio multicéntrico, cuyo objetivo principal es la supervivencia libre de enfermedad. Ninguna paciente recibió radioterapia en axila. Con un seguimiento de 60 meses y una supervivencia global del 98% a los 5 años, la recidiva loco-regional fue de 0’2% en el grupo de linfadenectomía (un caso axilar) y del 1’1% en el grupo de no linfadenectomía (dos casos axilares). Según estos resultados en pacientes con micrometástasis con lesiones inferiores a 5 cm, no es necesario realizar linfadenectomía axilar. Macrometástasis en el ganglio centinela Las dudas sobre la necesidad de realizar la linfadenectomía axilar dependiendo de la carga tumoral del ganglio centinela (macrometástasis, micrometástasis o ITC) originaron varios estudios, en los que se vieron que cuando la carga tumoral era baja en el 80% de los casos el ganglio centinela era el único afecto. Los normogramas publicados (MSKCC, MD Anderson, Stamford, Cambridge) con la intención de predecir la presencia de ganglios no centinelas positivos según el patrón histológico e IHQ de la lesión mamaria no han sido concluyentes. Los nuevos resultados del NSABPB32, presentados en el Consenso de Sant Gallen de 2011(5), corroboraron la seguridad de omitir la disección axilar no sólo en pacientes con BSGC negativa, sino también en aquellas pacientes con ganglios axilares clínicamente negativos pero con afectación macroscópica patológica de uno o dos ganglios centinelas, siempre dentro de un contexto de cirugía conservadora con radioterapia de campo tangencial. Todo ello para conseguir una mínima cirugía, pero con la máxima eficacia. En el estudio AMAROS(8) cerrado en 2010, que compara estadios iniciales con axila clínicamente negativa pero con BSGC positiva, se demuestra que las recidivas axilares no son inferiores en los casos de radioterapia axilar que en los casos de linfadenectomía, siendo la morbilidad semejante. En febrero de 2011 se publica en JAMA el artículo de Giuliano y cols., el ACOSOG Z0011(9) de la American Society of Clinical Oncology Group, para determinar los efectos de la linfadenectomía sobre la supervivencia global y libre de enfermedad en pacientes con BSGC positiva. Es un estudio multicéntrico en pacientes T1 y T2 con cáncer de mama invasivo, con axila clínicamente negativa, a las que se les ha realizado un tratamiento conservador sobre la mama. En la BSGC se identificaron uno o dos ganglios positivos en estudio por hematoxilina-eosina, siendo randomizadas a realizar linfadenectomía o ningún tratamiento axilar. Todas las pacientes recibieron tratamiento adyuvante sistémico (hormonal o quimioterápico) y radioterapia sobre la mama. Se excluyeron del estudio aquellas pacientes con tres o más ganglios positivos y aquéllas que habían recibido tratamiento neoadyuvante. Se definió la recurrencia loco-regional como aquélla que se presentara en la mama, sub o supraclavicular, en cadena mamaria interna o ganglios axilares. Con una tasa de seguimiento de 6’3 años, a los 5 años no hubo diferencias significativas en la supervivencia global, la supervivencia libre de enfermedad y las recurrencias loco-regionales. Estos resultados son semejantes a los del estudio ALMANAC. Las recurrencias axilares suelen ser un evento temprano, en éste estudio, el grupo de solo ganglio centinela a los 5 años es del 0’9%, frente al 0’5% en el grupo con linfadenectomía axilar. Según los autores es poco probable que un mayor seguimiento diera lugar a recidivas adicionales suficientes para generar una diferencia en la supervivencia que fuera significativa entre los grupos. La diferencia absoluta en la supervivencia global a los 5 años entre los dos grupos de “La BSGC ofrece una información suficiente para el tratamiento adyuvante y un excelente control regional en pacientes con cáncer de mama inicial a las que no se les ha practicado linfadenectomía axilar, siendo la tasa de recurrencias baja a los 2-3 años de seguimiento” 20 BOLETÍN GEICAM | NOV 2012 tratamiento es del 0’7%, numéricamente a favor del grupo SLNB solo. Los autores concluyen que no hay beneficio en añadir linfadenectomía axilar en términos de control local, supervivencia libre de enfermedad o supervivencia global. Según las pautas de tratamiento del consenso de Sant Gallen-2011(5), el tratamiento sistémico adyuvante no hace diferencias según el número de ganglios afectos, por lo que la información aportada por la linfadenectomía no dará lugar a cambios en la pauta de tratamiento en estas pacientes, salvo en algunos subgrupos seleccionados. En el protocolo de ESMO, European Society for Medical Oncology de 2011, se aceptan todos estos avances(3). También en 2011 se publican los resultados del NCT00210236(10). Es un estudio multicéntrico en postmenopáusicas con lesiones de 10 mm o menos, que se randomizan a linfadenectomía vs no tratamiento axilar. Todas las pacientes tienen tratamiento adyuvante con radioterapia en cirugía conservadora, tratamiento hormonal con tamoxifén si los receptores hormonales son positivos o quimioterapia si son negativos. A pesar de una tasa de recidivas axilares baja en el grupo de no linfadenectomía, a los 5 años hay una menor supervivencia y periodo libre de enfermedad. En la guía práctica de la NCCN-2012, el estadiaje quirúrgico axilar para los estadios I, IIA, IIB y IIIA (T3 N1 M0) con un nivel de evidencia 2A especifica: BSGC negativa: no realizar más cirugía. BSGC positiva: no realizar más cirugía si T1 ó T2, 1 ó 2 ganglios centinelas positivos, tratamiento conservador, si se realizará radioterapia adyuvante y si no se ha realizado tratamiento neoadyuvante. Linfadenectomía si no se cumplen todos los condicionantes anteriores. BSGC no identificado: linfadenectomía axilar, niveles I y II de Berg. La linfadenectomía axilar debe considerarse opcional en aquellas pacientes con lesiones de pronóstico favorable, a las que se les administrará tratamiento adyuvante sistémico. Casos especiales El diagnóstico de las lesiones mamarias se efectúa habitualmente mediante BAG, pero hay algunos casos en que se ha realizado una extirpación previa de la lesión (por ser de baja sospecha, por BAG no concluyente). Actualmente se acepta la realización de la BSGC en estos casos, recomendando que el tiempo transcurrido entre las dos cirugías no supere los 30 días. Un estudio danés compara la incidencia de la presencia de micrometástasis o ITC en pacientes con extirpación previa del tumor primario, frente a pacientes con punción biopsia con aguja gruesa, observando un incremento en el desplazamiento yatrogénico de células epiteliales, con un aumento en el diagnóstico de ITC en el ganglio centinela. En los casos de mamoplastia de aumento o reducción el panel de expertos de ASCO en 2005 no puede recomendar la BSGC por datos insuficientes, pero actualmente no hay evidencia para contraindicarlo. La realización de la BSGC antes o después de un tratamiento sistémico primario sigue siendo controvertida, tiene ventajas y desventajas en cada caso. Antes de la quimioterapia ofrece mayor seguridad de estadiaje y mayor información al radioterapeuta sobre la afectación ganglionar, pero requiere dos cirugías y puede retrasar el inicio del tratamiento. Después de la quimioterapia primaria puede valorarse la respuesta a nivel ganglionar y obtener así una mayor información sobre el resultado del tratamiento, pero puede dar lugar a una infravaloración del estadio inicial. En el consenso internacional de expertos del 11TH Sant Gallen de 2009 se presentaron resultados de BSGC después de tratamiento neoadyuvante, pero con poca evidencia. En la Conferencia de Consenso Internacional sobre el Estado actual y futuro de la terapia sistémica neoadyuvante en el cáncer de mama primario de 2011(11), la recomendación es realizar la BSGC después de la terapia neoadyuvante en aquellos casos con axila negativa previa al tratamiento, y PAAF en los casos en que se sospecha una repuesta axilar incompleta. En cambio, la NCCN-2012 considera que la BSGC debe hacerse antes del tratamiento sistémico neoadyuvante, y que en el caso de ganglio centinela negativo puede no realizarse la linfadenectomía axilar, tanto en los casos en que se precise una mastectomía como si el tratamiento sobre la mama es conservador. La disección ganglionar de la cadena de la mamaria interna dejó de efectuarse hace años, pero con la aparición de la BSGC ha vuelto a estar presente en la clasificación TNM, en su 6ª edición desde enero de 2003. La presencia de metástasis en la cadena mamaria interna se asocia a peor pronóstico, pero a pesar de ello en el 76% de los casos no hay afectación metastásica. En el tratamiento loco-regional de la afectación de la cadena mamaria interna debemos considerar el protocolo EORTC 22922, cerrado en 2004, en el que parece que se obtienen beneficios sobre la supervivencia global y libre de enfermedad al efectuar irradiación paraesternal, aunque ésta no está libre de riesgos sobre pulmón y corazón(12). Los resultados sobre supervivencia a los 10 años están todavía pendientes. La extirpación de ganglios de la cadena mamaria interna puede ser dificultosa y en tratamientos conservadores requiere habitualmente hacer una incisión más, además del riesgo de neumotórax y sangrado. Un 8-10% de los casos con axila negativa presentan “El tratamiento del cáncer de mama se basa en un trípode hoy por hoy indisoluble: cirugía, tratamiento sistémico y radioterapia” 21 BOLETÍN GEICAM | NOV 2012 DESDE qGEICAM “La presencia de metástasis en la cadena mamaria interna se asocia a peor pronóstico, pero a pesar de ello en el 76% de los casos no hay afectación metastásica” metástasis en la cadena mamaria interna. El diagnóstico de infiltración de estos ganglios condicionará un tratamiento sistémico adyuvante. No hay consenso en la extirpación de estos ganglios, sigue siendo un tema controvertido y podría considerarse de investigación. La presencia de ganglios centinelas intramamarios oscila entre 0,7 y 14% en la linfogammagrafía, pudiendo explicarse estas diferencias según la técnica de inyección del trazador. Puede presentarse junto con ganglios axilares o no. En el estudio realizado en el European Institute of Oncology se identifican asociados a ganglios centinelas axilares en un 0,2% de los casos. Las metástasis de ganglios intramamarios no necesariamente se asocian a ganglios positivos axilares, aunque el drenaje en ambas localizaciones obliga a biopsiar ambas. Si solamente hay drenaje intramamario y es positivo, la decisión de linfadenectomía debe individualizarse. En enfermedad multicéntrica, en un estudio del Instituto Europeo de Oncología de Milán, entendiendo la multicentricidad como la presencia de dos lesiones infiltrantes demostradas mediante biopsia en dos cuadrantes diferentes de la mama o en el mismo cuadrante pero separadas 5 cm, recomienda la BSGC frente a la linfadenectomía axilar, siendo la recidiva axilar en éstos casos a los 5 años de un 2’5%. En un estudio sobre 142 pacientes, la tasa de falsos negativos fue del 4%. ASCO recomienda la BSGC en estos casos(3). Las metástasis ganglionares en el carcinoma ductal in situ (CDIS) puro son muy raras, siendo su detección según los autores entre un 0,39%-1,9%. En la revisión del Nacional Cancer Database sobre 10,946 pacientes con DCIS a las 22 BOLETÍN GEICAM | NOV 2012 que se sometió a una linfadenectomía, sólo el 3,6% presentaron metástasis axilares(13). Se recomienda para tener la máxima información del estadiaje axilar la BSGC, pero no en todos los casos. Su realización tiene desventajas: sobrediagnóstico, mayor cirugía y aumento de tiempo en los tratamientos. Es aconsejable en: lesiones CDIS diagnosticadas por punción con aguja gruesa o mamotomo, que son clínicamente palpables (con mayor frecuencia se asocian a lesiones infiltrantes), CDIS de alto grado, o en los casos que por su extensión la indicación quirúrgica es de mastectomía(14). En la 7ª European Breast Cancer Conference de 2010 se valoró que a pesar de tener el ganglio centinela axilar positivo, no debía realizarse una linfadenectomía, tan solo en aquellos casos en que en la pieza quirúrgica mamaria se demuestre una zona de invasión o microinvasión. En el protocolo de la NCCN-2012 sólo se contempla la realización de la BSGC en los casos en que se realice una mastectomía o cuando la extirpación de la lesión al llevar a cabo un tratamiento conservador, por su localización, comprometa la realización de una BSGC posterior. En lesiones localmente avanzadas o carcinoma inflamatorio, el consenso internacional de expertos sobre las recomendaciones actuales del tratamiento locorregional en cáncer de mama de 2010 considera contraindicada la BSGC, y recomienda realizar linfadenectomía. En pacientes gestantes con lesión inicial no está contraindicada la realización de la BSGC, ya que la radiación que recibe el feto es baja con radiocoloide(15), pero no deben usarse colorantes, como isosulfan blue dye. Comentarios El reconocimiento de la biología tumoral ha cambiado el tratamiento del cáncer de mama, la recomendación de administrar un tratamiento sistémico se ve influida por los factores relacionados con el propio paciente y el tumor, no siendo el estado de los ganglios linfáticos el único condicionante para su elección. El diagnóstico en una fase más precoz, debido al cribado habitual, ha dado lugar a lesiones cada vez más iniciales, a las que se les ha podido ofrecer un tratamiento conservador sobre la mama y que presentaban menos ganglios afectados. El estudio ACOSOG-Z0011 ha tenido una gran repercusión mediática y puede condicionar futuros tratamientos, pero también ha suscitado comentarios a favor, y otros con recelo para aceptar las conclusiones de los autores. Tras un análisis crítico hay autores que constatan la existencia de puntos débiles y limitaciones en la aleatorización de los dos grupos e incluso sesgos que pueden afectar a las conclusiones finales, así como su cierre prematuro. Se necesita más tiempo de seguimiento de estas pacientes. Por todo ello, debemos seguir progresando con rigor en la investigación en grupos de pacientes con enfermedad inicial. El tratamiento del cáncer de mama se basa en un trípode hoy por hoy indisoluble: cirugía, tratamiento sistémico y radioterapia. El peso y protagonismo que cada una de estas ramas de tratamiento tiene en la curación de los distintos subtipos de cáncer de mama está todavía por dilucidar, por lo que es imprescindible seguir realizando estudios rigurosos en los tres campos para poder avanzar. Debemos ser minuciosos a la hora de precisar en qué grupo de pacientes puede ser admisible el obviar tratamientos estándar aceptados hasta la actualidad. Bibliografía 1. Abe H., Schmidt R.A., Kulkami K., et al. Axillary lymph nodes suspicious for breast cancer metastasis: sampling with US-guided 14-gauge core-needle biopsy. Clinical experience in 100 patients. Radiology 2009; 1:41-9. 2. S. Aebi, T. Davidson, G. Gruber, F. Cardoso. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2011; (Supplement 6): 12-24. 3. G.H. Lyman, A.E. Giuliano, M.R. Somerfield, et al. American Society of Clinical Oncology Guideline. Recommendations for sentinel lymph node biopsy in early-stage breast cancer. J Clin Oncol 2005; 23: 7703-20. 4. Manfred Kaufmann, Monica Morrow, Gunter von Minckwitz, Jay R. Harris, and The Biedenkopf Expert Panel Members. Locoregional Treatment of Primary Breast Cancer. Cancer. 2010 Mar 1;116(5):1184-91. 5. Krag D.N., Anderson S.J., Julian T.B., et al. Sentinel-lymph-node resection compared with convention axillarylymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from NSABP B-32 randomised phase 3 trial. Lancet Oncol 2010; 20: 927-33. 6. A Goldhirsch, J.N. Ingle, R.D. Gelber, et al. Thresholds for therapies: highlights of the St Gallen International expert consensus on the primary therapy of early breast cancer 2009. Ann Oncol 2009; 20: 1219-29. 7. Julian T.B., Anderson S.J., Golesorkhi N., Fourchotte V., Mamounas E.P., Wolmark N. Prospective outcomes for patients with micro-metastases and macrometastases in sentinel nodes: NSABP B-32 sentinel node trial. Cancer Res 2010; 70 (24 suppl) 88s (S5-1). 8. Marieke E. Straver, Philip Meijnen, Geertjan van Tienhoven, Cornelis J. H. van de Velde, et al. Sentinel Node Identification Rate and Nodal Involvement in the EORTC 10981-22023 AMAROS Trial. Ann Surg Oncol (2010) 17:1854-1861. 9. A.E. Giuliano, K.K. Hunt, K.V. Ballman, P.D. Beitsch. Axillary Dissection vs No Axillary Dissection in Women With Invasive Breast Cancer and Sentinel Node Metastasis. A Randomized Clinical Trial ACOSOG-Z0011. JAMA 2011;305: 569-575. 10. A. Avril, G. Le Bouëdec, G. Lorimier, J.M. Classe, et al. Phase III randomized equivalence trial of early breast cancer treatments with or without axillary clearance in post-menopausal patients results after 5 years of follow-up. Eur J Surg Oncol. 2011 Jul;37(7):563-70. 11. Manfred Kaufmann, Gunter von Minckwitz, Elefhterios P. Mamounas, David Cameron, et al. Recommendations from an International Consensus Conference on the Current Status and Future of Neoadjuvant Systemic Therapy in Primary Breast Cancer. Ann Surg Oncol. 2011 Dec 23 [Epub ahead of print]. 12. O. Matzinger, I. Heimsoth, P. Poortmans, L. Collette, H. Struikmans, W. van den Bogaert, A. Fourquet, H. Bartelink, F. Ataman, A. Gulyban, M. Pierart, G. van Tienhoven, for the EORTC radiation oncology & breast cancer groups. Acta Oncol 2010; 49: 24-34. 13. D’Eredità G., Giardina C., Napoli A., Ingravallo G., Troilo V.L., Fischetti F., Berardi T. Sentinel lymph node biopsy in patients with pure and high ductal carcinoma in situ of the breast. Tumori 2009; 95: 706-11. 14. Schneider C., Trocha S., Mckinley B., Shaw J., Bielby S., Blackhurst, Jones Y., Cornett W. The use of sentinel node biopsy in ductal carcinoma in situ. Am Surg 2010; 76:943-6. 15. Gentilini O., Cremonesi M., Toesca A., et al. Sentinel lymph node biopsy in pregnant patients with breast cancer. Eur J Nucl Med Mol Imaging 2010; 37:78. 23 BOLETÍN GEICAM | NOV 2012 DESDE rGEICAM Desde rGEICAM Controversias en el manejo de la axila en el cáncer de mama precoz. Visión del oncólogo radioterápico Introducción Hasta la actualidad, el tratamiento estándar del cáncer de mama, tanto en las pacientes con afectación ganglionar confirmada por PAAF eco-guiada, como en las pacientes sin afectación ganglionar clínica que realizan biopsia selectiva del ganglio centinela positivo, era la linfadenectomía. Ésta nos permitía conocer el número de ganglios linfáticos axilares afectos, que es uno de los factores pronósticos más importantes en mujeres con cáncer de mama en estadio precoz. Las pacientes con afectación ganglionar tienen un alto riesgo de recurrencia locorregional y a distancia. Este riesgo esta relacionado con el número de ganglios afectos y aumenta a medida que asciende dicho número. El conocimiento del número de ganglios afectos es un factor pronóstico importante para la indicación de radioterapia a la hora de decidir si se irradiaba o no la axila, y a la definición de las áreas ganglionares que había que irradiar. Tras la obtención de toda esta información estaba claro que aquellas pacientes con cuatro o mas ganglios afectos realizaban tratamiento con radioterapia, tanto de la mama o pared torácica, como de las áreas ganglionares. Los últimos consensos internacionales consideraban que en pacientes con afectación de 1 a 3 ganglios no había evidencia suficiente que justificara su irradiación, aunque en los últimos años en este grupo de pacientes se individualizaba el tratamiento. Durante el año 2011 dos importantes publicaciones estaban haciendo variar lo que hasta ahora se había considerado el tratamiento estándar del cáncer de mama. Estos estudios son el MA20(16) y Giuliano(7). Estas dos publicaciones pueden ayudarnos en la toma decisiones. Cuando hablamos de irradiación ganglionar, ¿qué queremos decir? Descripción anatómica de la axila La axila es un espacio triangular, limitado por la pared torácica, el subescapular, el músculo dorsal y los músculos pectorales mayores y menores. En una sección coronal, el contenido axilar se divide en tres niveles respecto a su posición con el músculo pectoral menor: el nivel I se extiende lateral, el nivel II se extiende por detrás y el nivel III divide a dicho músculo (figura 1). Los volúmenes a irradiar tras la linfadenectomía quirúrgica cuando está indicado incluyen, de forma estándar, los ganglios supraclaviculares y el nivel III axilar, quedando los niveles I, II y los ganglios de la cadena mamaria interna para casos especiales, como enfermedad voluminosa axilar, linfadenectomía insuficiente o afectación histológica demostrada de la cadena mamaria interna. ¿Se puede evitar linfadenectomía tras ganglio centinela positivo? Debido a la morbilidad que provoca la linfadenectomía, sobre todo por riesgo de linfedema, y con el concepto de que el vaciamiento ganglionar es un factor pronóstico más que curativo, múltiples estudios han intentado encontrar una cohorte de pacientes con afectación de ganglio centinela que presentaran bajo riesgo de afectación de ganglios no centinela tras la linfadenectomía, con el fin de evitar dicha cirugía. Sin embargo, no se ha podido identificar dicho grupo(1-2-3-4-5-6). Recientemente se ha publicado ACOSOG Z0011(7). Es un estudio randomizado fase III multicéntrico de no inferioridad que “El ensayo British Columbia demostró que en pacientes con afectación ganglionar, premenopáusicas que recibían quimioterapia, la realización de radioterapia adyuvante sobre pared torácica y cadenas ganglionares axilares disminuían las recidivas locales en el grupo de radioterapia (10% vs. 28%) y mejoraban la supervivencia local” 24 BOLETÍN GEICAM | NOV 2012 Dra. Arantxa Eraso Dr. Ferrán Guedea Edo Servicio de Oncología Radioterápica. Instituto Catalán de Oncología. Servicio de Oncología Radioterápica. Instituto Catalán de Oncología. compara linfadenectomía vs. no linfadenectomía en pacientes con afectación de ganglio centinela (menos de tres ganglios centinelas positivos), en pacientes con tumores T1 ó T2, que fueron clínicamente ganglios negativos tras tratamiento conservador, radioterapia y tratamiento sistémico. Con una mediana de seguimiento de 6-3 años no hubo diferencias significativas en la recidiva locorregional, ni supervivencia libre de enfermedad, ni supervivencia global. El número de pacientes incluidas fue de 1.900. La supervivencia global a cinco años fue similar en ambos grupos: de 91,8 (95% intervalo de confianza [CI], 89.1%-94.5%) en el grupo de linfadenectomía (ALND) y de 92,5% (95% CI, 90.0%-95.1%) en el grupo de ganglio centinela (SLND). La HR no ajustada que comparaba supervivencia global entre brazo de SLND-solo y brazo de ALND fue de 0.79 (90% CI, 0.56-1.10). La supervivencia libre de enfermedad a 5 años fue de 82.2% (95% CI, 78.3%86.3%) con ALND y 83.9% (95% CI, 80.2%-87.9%) con SLND-solo. La recurrencia locorregional fue de 4,1% en el grupo de linfadenectomía, frente a 2.8% en el grupo de ganglio centinela. En base a estos resultados las guías de la NCCN v1.2112(8) recomiendan en pacientes T1 ó T2, con 1 ó 2 ganglios centinelas positivos, no tratados con quimioterapia neadyuvante, que han recibido tratamiento conservador, no realizar más cirugía de la axila. ¿Qué hay que irradiar en estos casos? La linfadenectomía ha sido el tratamiento estándar en pacientes con afectación del ganglio centinela. Este tratamiento consigue un excelente control locorregional y proporciona información que permite decidir el tratamiento oncológico. En la indicación del tratamiento sistémico del cáncer de mama se tienen en cuenta el tamaño del tumor, el grado tumoral, si existe afectación ganglionar o no, el estatus de los receptores hormonales, el Ki 67, el HER-2 y una variedad de perfiles moleculares. El número de ganglios afectos tiene una menor importancia en la indicación de quimioterapia. Sin embargo, el resultado de la linfadenectomía tiene mucha importancia para el oncólogo radioterápico en la indicación del tratamiento y en la definición de los volúmenes a tratar. El número de adenopatías positivas nos indica qué riesgo hay de afectación de la cadena supraclavicular y nivel III axilar. Cuando este riesgo es clínicamente relevante se realiza irradiación a dicho nivel. Hasta la actualidad, la irradiación se realiza en pacientes con cuatro o más ganglios positivos y las pacientes seleccionadas con uno a tres ganglios positivos, aunque luego comentaremos los cambios respecto a este tema tras la publicación de Whelan (MA20). Figura 1. Niveles axilares I, II y III, en reacción con el músculo pectoral menor A raíz de la publicación del ensayo ACOSOG Z0011 nos encontraremos un grupo de pacientes no sometidas a linfadenectomía pero con ganglio centinela positivo, en dicho estudio no queda claro qué volúmenes de tratamiento deben incluirse en los campos de irradiación. Haffty(9) considera que es necesario plantearse qué 25 BOLETÍN GEICAM | NOV 2012 DESDE rGEICAM pacientes deben recibir irradiación nodal total y, para ello, hay que considerar las razones por las que la tasa de recurrencia regional es menor al 1%, a pesar de que se estima que el 27% de las pacientes tenían más ganglios positivos no resecados. En esto juega un papel importante el tratamiento sistémico que habían recibido la mayoría de las pacientes. Se ha visto en estudios con afectación ganglionar y quimioterapia neadyuvante(10- 11) que la quimioterapia consigue una tasa de respuesta completa patológica ganglionar del 25% de las pacientes. Asimismo, el uso de hormonoterapia también puede contribuir a dichos resultados. Haffty considera que en esta baja tasa de recidivas juega un papel primordial el hecho de que con los campos tangenciales se puede irradiar parte de los niveles axilares I y II(12) (figura 1). El estudio no describe si la axila baja (niveles I y II) recibe dosis que podemos considerar terapéuticas, aunque esto está en vías de análisis. Actualmente no hay estudios que nos digan cuáles son las indicaciones de radioterapia para pacientes con afectación de ganglio centinela sin linfadenectomía. Esto dependerá del riesgo de que queden ganglios afectos no centinelas en la axila en la que no se realiza vaciamiento. En el Instituto Catalán de Oncología hemos seleccionado a las siguientes pacientes, que no se realizarán linfadenectomía a pesar del ganglio centinela positivo: RH-negativos o Grado histològic III se consideran grupo de alto riesgo y se irradiarán todas las cadenas ganglionares (niveles I, II, III y área supraclavicular ipsilateral). En las pacientes con afectación microscópica del ganglio centinela (pN1(mic)) no realizamos ni linfadenectomía ni irradiación de niveles I y II (figura 2 y tabla 1). Indicación de irradiación en pacientes con afectación de 1 a 3 ganglios Hasta la publicación en 2005 en Lancet Oncology del metanálisis de Oxford(13),que demostró beneficio en supervivencia de la irradiación del área supraclavicular en todas las pacientes con afectación ganglionar, la indicación de irradiación de cadenas ganglionares supraclaviculares y nivel III axilar era para aquellas pacientes con 4 o más ganglios afectos tras la linfadenectomía. Posteriormente, varios ensayos han estudiado la eficacia de añadir radioterapia adyuvante en pacientes tratadas con cirugía y tratamiento sistémico. Las contribuciones más importantes han venido del Grupo Cooperativo Danish de Cáncer de mama y la Agencia de Cáncer de Bri- tish Columbia. El ensayo British Columbia(14) demostró que en pacientes con afectación ganglionar, premenopáusicas que recibían quimioterapia, la realización de radioterapia adyuvante sobre pared torácica y cadenas ganglionares axilares disminuían las recidivas locales en el grupo de radioterapia (10% vs. 28%) y mejoraban la supervivencia local en dicho grupo (47% vs. 37% a 20 años). El otro estudio randomizado que trataba de responder a dicha pregunta era Danisch 82b(15), que randomizaba radioterapia de pared torácica y áreas ganglionares vs. observación en pacientes con ganglios positivos, premenopáusicas tratadas con mastectomía y quimioterapia adyuvante (CMF), demostrando que la radioterapia disminuía las recidivas locales en el grupo de radioterapia (9% vs. 32%) y mejoraba la supervivencia libre de enfermedad (48% vs. 35% a los 10 años), y la supervivencia global (54% vs. 45% en 10 años) en el grupo de radioterapia. En el ensayo 82c las pacientes menores de 70 años posmenopáusicas con cáncer de mama de alto riesgo fueron randomizadas después de mastectomía radical y tamoxifeno al recibir radioterapia adyuvante sobre 1. Pacientes pT1, pT2, con 1 ó 2 ganglios centinelas afectos. 2. No afectación microscópica de la grasa periganglionar. 3. Cirugía conservadora de mama. 4. Radioterapia convencional adyuvante sobre mama. 5. Tratamiento sistémico adyuvante. Dentro de este grupo hemos definido una serie de factores pronósticos que condicionarán el tipo de radioterapia a realizar, aquellas pacientes de más de 50 años, con receptores hormonales positivos y grado histológico I-II, se realizarán tratamientos con radioterapia y tangenciales altos. Si son pacientes de 50 años o menores, 26 BOLETÍN GEICAM | NOV 2012 Figura 2. Radiografía Digital Reconstruida que muestra un campo tangencial que asegura la irradiación de niveles I y II axilares, no es lo mismo que los campos tangenciales altos en los que dicha parte de la axila no recibe dosis terapéuticas. pared torácica y cadenas axilares. Se reclutaron 1.375 pacientes entre 1982 y 1990 que fueron seguidas durante una media de tiempo de 10 años. El grupo de pacientes que recibieron radioterapia demostró menos recidivas locorregionales (8% vs. 35%), mejor supervivencia libre de enfermedad (36% vs. 24%), y mejor supervivencia global (45% vs. 36%). De estos dos ensayos randomizados, el publicado por Ragaz demostró que la irradiación aportaba beneficio en supervivencia, tanto para las pacientes de 1 a 3 ganglios positivos, como si tenían 4 o más. Sin embargo, en el estudio de Overgaard los resultados a este respecto fueron puestos en duda, debido a que el vaciamiento en muchos casos ahora se considera insuficiente. La media de ganglios de la linfadenectomía fue de 7 y en muchos pacientes el muestreo fue de 4. Debido a esto, las guías internacionales no consideraban que hubiera evidencia suficiente para que en pacientes con 1-3 ganglios afectos se irradiaran las áreas ganglionares. Hasta ahora los consensos y guías de práctica clínica recomendaban irradiar en pacientes con 4 o más ganglios y no administrar radioterapia en las pacientes con afectación de 1 a 3 ganglios axilares, basándose en que, aunque se puede conseguir una reducción de la recidiva locorregional, esto no afectaría a la supervivencia de las pacientes. El meta-análisis del Early Breast Cancer Trialists’ Collaborative Group (EBCCG) (EBCTCG metaanálisis. Lancet 2005; 366: 2087-2106), en uno de los subgrupos analizados incluyó más de 8.500 pacientes sometidas a mastectomía y linfadenectomía axilar, con afectación de los ganglios axilares, encontrándose una reducción absoluta del riesgo de recidiva local a los 15 años de 21,4% a favor del grupo tratado con RT (29,2% sin RT vs. 7,8% con RT). Asimismo, la reducción absoluta del riesgo de muerte por cáncer a los 15 años fue de 5,4% (54,7% con RT vs. 60,1% sin RT, 2p=0,0002). Cuando se analizó la reducción del riesgo de recidiva local por subgrupos, encontraron que en todos los casos donde el tratamiento locorregional reduce la recidiva local en más de un 10% se produce una disminución de la mortalidad por cáncer superior al 5%, de modo que en este grupo de pacientes por cada 4 recidivas locales evitadas se impedirá una muerte por cáncer de mama. Concretamente, en el caso de las pacientes con 1-3 ganglios positivos la reducción absoluta TABLA 1: INDICACIONES DE NO LINFADENECTOMÍA (LA) AUNQUE EL GANGLIO CENTINELA SEA POSITIVO SERÁ NECESARIO QUE SE CUMPLAN TODAS LAS CONDICIONES SIGUIENTES: • TAMAÑO: PT1, PT2. • ≤ 2 GANGLIOS CENTINELAS AFECTOS. • SIN AFECTACIÓN MACROSCÓPICA DE LA GRASA PERIGANGLIONAR. • IQ CONSERVADORA MAMA. • RDT CONVENCIONAL ADYUVANTE SOBRE MAMA. • TTO. SISTÉMICO ADYUVANTE (HT Y/O QMT). NO QUIMIOTERAPIA NEOADYUVANTE. INDICACIÓN DE NO LINFADENECTOMÍA Y NO RADIOTERAPIA NIVELES I Y II: • EDAD > 50 AÑOS. • RH POSITIVOS. • GRADO HISTOLÓGICO I-II. • AFECTACIÓN MICROSCÓPICA DEL GANGLIO CENTINELA (PN1(MIC)). INDICACIONES DE NO LA, PERO SI RADIOTERAPIA DE CADENAS* (NIVELES I, II, III Y SUPRACLAVICULAR). ALGUNAS DE LAS CONDICIONES SON: • EDAD ≤ 50 AÑOS. • RH-NEGATIVOS. • GRADO HISTOLÓGICO III. • INDIVIDUALIZAR EN CASOS EN COMITÉ. • VALORAR APLICAR NOMOGRAMAS. del riesgo de recurrencia local con radioterapia postmastectomía fue de 12% (4% vs. 16%) y en aquéllas con 4 o más ganglios positivos fue de 14% (12 vs. 26%). A raíz de esta publicación que demostraba beneficio en recurrencia local y supervivencia global en el grupo de 1 a 3 ganglios afectos, Overgaard(16) realizó un análisis retrospectivo en un subgrupo de 1.152 de pacientes del Danish Breast Cancer Cooperative Group 82 (DBCG82 b y c), donde analizaba sólo aquéllas con vaciamiento suficiente, que consideró con 8 o más ganglios axilares extirpados. Al comparar las pacientes que recibieron RT con las que no en aquéllas que tenían de 1 a 3 ganglios afectos se obtuvo menor tasa de recidiva a los 15 años en las pacientes que fueron tratadas con radioterapia frente a las que no (4% vs. 27%), respectivamente, y esta diferencia fue estadísticamente significativa (p<0.001). Asimismo, hubo diferencias importantes (p=0.03) en supervivencia global (57% en el grupo de radioterapia frente al 46% en el grupo de no radioterapia). En base a estos resultados ya se consideraba la posibilidad de realizar radioterapia de la cadena supraclavicular en pacientes de 1 a 3 ganglios afectos con algún factor de riesgo asociado, en nuestro centro se irradiaba cuando eran pacientes < 50 años, tumores de más de 5 cm (T3N1 o T4 N1) o cuando el porcentaje de afectación ganglionar era > 20% respecto al total de ganglios extirpados. Actualmente hay en marcha dos ensayos aleatorizados, el estudio SUPREMO (Selective Use of Postopera-tive Radiotherapy after Mastectomy) y el estudio MA20 (National Cancer Institute of Canada Clinical Trials), que pretenden aclarar el papel de la radioterapia en pacientes de riesgo intermedio sometidas a mastectomía radical (pT2 N0, grado 3 y/o invasión vascular linfática y 1-3 ganglios positivos). En ASCO 2011 Whelan presentó los resultados del estudio MA20(17), considerados por la American Society of Clinical Oncology (ASCO)(18) como 27 BOLETÍN GEICAM | NOV 2012 DESDE rGEICAM “Actualmente hay en marcha dos ensayos aleatorizados, el estudio SUPREMO y el estudio MA20, que pretenden aclarar el papel de la radioterapia en pacientes de riesgo intermedio sometidas a mastectomía radical” uno de los avances más significativos en la lucha contra el cáncer que han tenido lugar en 2011. Se trata de un estudio randomizado fase III, multicéntrico que randomiza a pacientes con cáncer de mama precoz con 1 a 3 ganglios linfáticos positivos (o de alto riesgo, con ganglios negativos en cáncer de mama) a recibir radioterapia o no del área supraclavicular, nivel III y cadena mamaria interna, que demuestra que la irradiación ganglionar regional disminuye la recidiva local y a distancia en pacientes con cáncer de mama con afectación de 1 a 3 ganglios. En el estudio participaron 1.832 pacientes, pN1 la mayoría de ellas (85%), mientras que un 10% fueron pN0 pero con factores de alto riesgo de recidiva. En todos los casos se realizó una cirugía conservadora con quimioterapia y/u hormono- terapia adyuvante. Los resultados a 5 años mostraron una tasa de control locorregional del 90% en las pacientes del brazo de irradiación de la mama y de las áreas ganglionares, frente a un 84% en el brazo de irradiación exclusiva de la mama (p=0,02). Del mismo modo, la tasa de recidiva a distancia en el grupo de irradiación de la mama y cadenas ganglionares fue significativamente menor que en el brazo de irradiación mamaria exclusiva (5% vs. 8%, p=0,002). Las pacientes del grupo de irradiación exclusiva de la mama presentaron menores tasas de toxicidad post-radioterapia, principalmente neumonitis 0,2% vs. 1,3% (p=0,01) y linfedema 4,1% vs. 7,3% (p=0,004). La conclusión de los autores es que estos datos deben servir a los oncólogos para considerar seriamente ampliar los volúmenes de irradiación en cáncer de mama en estadios iniciales con objeto de mejorar el control local y, muy probablemente, la supervivencia a largo plazo. Conclusión Estamos en un momento donde el tratamiento locorregional del cáncer de mama está realizando grandes cambios. Con la reciente publicación del estudio de Guiliano y la comunicación en ASCO del ensayo de Whelan nos encontramos dos estudios cuyos criterios de inclusión son similares, aunque parece que en el MA-20 las pacientes tienen mayor carga tumoral. En ambos estudios faltan datos de los campos de radioterapia y debemos esperar a la publicación del artículo de Whelan y a tener los resultados del estudio SUPREMO para decidir si todas las pacientes N1 deben irradiarse la cadena supraclavicular y nivel III. Bibliografía 1. Validation of a nomogram to predict the risk of nonsentinel lymph node metastases in breast cancer patients with a positive sentinel node biopsy: validation of the MSKCC breast nomogram. Van la Parra R.F., Ernst M.F., Bevilacqua J.L., Mol S.J., Van Zee K.J., Broekman J.M., Bosscha K. Ann Surg Oncol. 2009 May;16(5):1128-35. Epub 2009 Feb 28. 2. Nonsentinel node metastasis in breast cancer patients: assessment of an existing and a new predictive nomogram. Degnim A.C., Reynolds C., Pantvaidya G., Zakaria S., Hoskin T., Barnes S., Roberts M.V., Lucas P.C., Oh K., Koker M., Sabel M.S., Newman L.A. Am J. Surg. 2005 Oct;190(4):543-50. 3. Assessment of the performance of the Stanford Online Calculator for the prediction of nonsentinel lymph node metastasis in sentinel lymph node-positive breast cancer patients. Scow J.S., Degnim A.C., Hoskin T.L., Reynolds C., Boughey J.C. Cancer. 2009 Sep 15;115(18):4064-70. 4. Nomogram for the prediction of having four or more involved nodes for sentinel lymph node-positive breast cancer. Katz A., Smith B.L., Golshan M., Niemierko A., Kobayashi W., Raad R.A., Kelada A., Rizk L., Wong J.S., Bellon J.R., Gadd M., Specht M., Taghian A.G. 5. A nomogram predictive of non-sentinel lymph node involvement in breast cancer patients with a sentinel lymph node micrometastasis. Houvenaeghel G., Nos C., Giard S., Mignotte H., Esterni B., Jacquemier J., Buttarelli M., Classe J.M., Cohen M., Rouanet P., Penault Llorca F., Bonnier P., Marchal F., Garbay J.R., Fraisse J., Martel P., Fondrinier E., Tunon de Lara C., Rodier J.F. Eur J Surg Oncol. 2009 Jul;35(7):690-5. Epub 2008 Nov 28. 28 BOLETÍN GEICAM | NOV 2012 6. Prospective multicenter comparison of models to predict four or more involved axillary lymph nodes in patients with breast cancer with one to three metastatic sentinel lymph nodes. Werkoff G., Lambaudie E., Fondrinier E., Levêque J., Marchal F., Uzan M., Barranger E., Guillemin F., Darai E., Uzan S., Houvenaeghel G., Rouzier R., Coutant C., J. Clin Oncol. 2009 Dec 1;27(34):5707-12. Epub 2009 Oct 13. 7. Armando E. Giuliano. Axillary Dissection vs. No Axillary Dissection in Women With Invasive Breast Cancer and Sentinel Node Metastasis. A Randomized Clinical Trial. JAMA, February 9, 2011—Vol 305, No. 6. 8. http://www.nccn.org/professionals/physician_gls/pdf/breast.pdf 9. Bruce G. Haffty. Positive Sentinel Nodes Without Axillary Dissection: Implications for the Radiation Oncologist. Journal of Clinical Oncology, Vol 29, No 34 (December 1), 2011: pp 4479-4481. 10. Gralow J.R., Burstein H.J., Wood W., et al. Preoperative therapy in invasive breast cancer: Pathologic assessment and systemic therapy issues in operable disease. J. Clin Oncol 26:814-819, 2008. 11. Gralow J.R., Zujewski J.A., Winer E.: Preoperative therapy in invasive breast cancer: Reviewing the state of the science and exploring new research directions. J. Clin Oncol (26:696-697, 2008). 12. G Alço. Coverage of axillary lymph nodes with high tangential fields in breast radiotherapy. Br. J. Radiol, December (2010 83:1072-1076). 13. Clarke M. (2005), Early Breast Cancer ‘Trialists’ Collaborative Group (EBCTCG). Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials. Lancet. 2005 Dec 17;366(9503):2087-106. Review. 14. Ragaz J., Olivotto I.A., Spinelli J.J., Phillips N., Jackson S.M. (2005). Locoregional radiation therapy in patients with high-risk breast cancer receiving adjuvant chemotherapy: 20-year results of the British Columbia randomized trial. J Natl Cancer Inst, 97 (2): 116–126. 15. Overgaard M., Hansen P.S., Overgaard J., et al. Postoperative radiotherapy in high-risk premenopausal women with breast cancer who receive adjuvant chemotherapy. Danish Breast Cancer Cooperative Group 82b Trial. N Engl J Med 337 (14): 949-55, 1997. 16. Overgaard M., Nielsen H.M., Overgaard J. (2007) Is the benefit of postmastectomy irradiation limited to patients with four or more positive nodes, as recommended in international consensus reports? A subgroup analysis of the DBCG 82 b&c randomized trials. Radiother Oncol. 2007 Mar;82(3):247-53. Epub 2007 Feb 15). 17. (Whelan, NCIC-CTG MA.20: An intergroup trial of regional nodal irradiation in early breast cancer. Journal of Clinical Oncology. Volume 29, 15S; Part I ( 2011 ASCO Annual Meeting Proceedings). 18. Clinical Cancer Advances 2011: Annual Report on Progress Against Cancer From the American Society of Clinical Oncology, Nicholas J. Vogelzang, J. Clin Oncol 30:88-109, 2011. 29 BOLETÍN GEICAM | NOV 2012 DESDE dGEICAM Desde dGEICAM Técnicas de diagnóstico por imagen en el manejo de la afectación ganglionar axilar Introducción La afectación ganglionar axilar es, con el tamaño tumoral, el factor pronóstico mas importante en las pacientes diagnosticadas de cáncer de mama. El estudio de la axila en pacientes con cáncer de mama es importante para establecer el estadio y el pronóstico, y elegir el mejor tratamiento para controlar la enfermedad. La biopsia selectiva del ganglio centinela (BSGC) es un procedimiento validado y ampliamente extendido en el manejo del cáncer de mama, sin evidencia prequirúrgica de afectación ganglionar(1). La confirmación preoperatoria de afectación axilar descartaría la BSGC. Cabe destacar la importancia del estudio ecográfico en ganglios, especialmente de pequeño tamaño, con infiltración masiva, que por bloqueo linfático podrían no marcarse como ganglios al no llegarles el isótopo, mientras ecográficamente serían fácilmente detectables. Diversas técnicas de diagnóstico por imagen y sus hallazgos Se han evaluado diversas técnicas de imagen para este fin(2-3-4), siendo la ecografía la técnica que mejores resultados aporta(5-6-7) y facilitando además la punción eco-guiada de los ganglios sospechosos, bien con aguja fina (PAAF), bien con aguja gruesa (BAG)(8). El estudio ecográfico de la axila se ha de realizar con la paciente en decúbito supino, discretamente ladeada sobre el lado contrario a la axila a estudiar. Deberá usarse una sonda de alta frecuencia, preferentemente 10 Mh o más. Se evaluarán los tres niveles de la axila (nivel I, II y III de Berg). También se evaluarán las mamas en busca de ganglios intramamarios. La presencia de ganglios intramamarios normales en piezas de mastectomía se ha descrito hasta en un 30% de los casos, siendo visibles en aproximadamente un 5% de las mamografías(9). Cuando detectamos ecográficamente un ganglio intramamario sospechoso debe biopsiarse, pues su afectación indicaría un estadio ganglionar N1, aunque su manejo posterior esté controvertido(10). Así, hoy en día, hay una corriente de opinión que afirma que para hacer linfadenectomía debemos guiarnos por la afectación o no del ganglio centinela de la axila, obviando la afectación del ganglio intramamario y otra que propugna linfadenectomía en caso de afectación del ganglio intramamario, independiente del estado de la axila(11). Existe una gran disparidad en las cifras, pero en general es aceptado que la sensibilidad de la exploración clínica está entre el 30-40% para la detección de adenopatías. La sensibilidad de la ecografía es superior, situándose según los distintos estudios entre el 60-70%. Los hallazgos clásicos a valorar en el estudio ecográfico de los ganglios son: tamaño, forma del ganglio, estructura (relación hilio/cortical) y comportamiento con la señal Doppler. En cuanto al tamaño, actualmente no es un criterio en uso, pues es sabido que ganglios de gran tamaño pueden verse en la axila, normalmente con un hilio graso y con una cortical normal. Este tipo de ganglios contribuyen a los falsos positivos en la palpación. La forma del ganglio es uno de los hallazgos de más alto valor predictivo. El ganglio normal es elongado, de manera que cuanto más disminuye su eje longitudinal a favor del trasversal, pasando a tener una relación eje longitudinal/eje trasversal de 1,5 o menor, más sugestivo es de afectación metastásica. “Es aceptado que la sensibilidad de la exploración clínica está entre el 30-40% para la detección de adenopatías. La sensibilidad de la ecografía es superior, situándose según los distintos estudios entre el 60-70%” 30 BOLETÍN GEICAM | NOV 2012 Dr. Joaquín Mosquera Dr. José Ramón Varela Romero Unidad de Mama Hospital Abente y Lago. CHUAC, La Coruña. Unidad de Mama Hospital Abente y Lago. CHUAC, La Coruña. Figura 1. Figura 1. Ganglio con características ecográficas benignas: elongado, hilio graso central ecogénico y cortical delgada y homogénea. Figura 2a. Figura 2 (a y b). Ganglios patológicos: forma redondeada, cortical engrosada y ausencia de hilio central. Figura 2b. La relación hilio/cortical es otro de los hallazgos ecográficos de más valor. Son criterios de benignidad la relación hilio/cortical conservada y el engrosamiento cortical homogéneo, no debiendo exceder el grosor cortical mas de 3 mm. El estudio Doppler del ganglio sospechoso puede ser de ayuda, ya que se ha descrito por varios autores(12) el predominio de flujo periférico en los ganglios afectados de metástasis frente al flujo central de los ganglios no afectados, si bien este criterio no es aplicable a los ganglios menores de 1 cm, no se Figura 3. Ganglio patológico: hilio excéntrico y adelgazado con cortical engrosada. Figura 3. trata de un criterio fiable y se ha visto también flujo de predominio periférico en ganglios reactivos. También se han descrito diferencias entre los ganglios palpables y no palpables. Un punto controvertido en cuanto a qué ganglios biopsiar surge de un reciente artículo(13) que concluye que un tercio de los pacientes con ganglios ecográficamente normales fueron positivos para metástasis, aunque esta afectación suele ser por micrometástasis y, por lo tanto, podría no influir en el vaciamiento ganglionar de la axila. Como ya se ha referido, otras técnicas de imagen como TAC, RM y PET no tienen la misma sensibilidad y, sobre todo, no permiten la inmediatez de la biopsia del ganglio sospechoso. Conclusión Ante una sospecha de lesión maligna en mama siempre se hará estadiaje axilar ecográfico, primordialmente en la axila ipsilateral, pero si es posible también en la contralateral y en el área mamaria interna. Asimismo, se hará biopsia del ganglio más sospechoso, simultáneamente a la biopsia mamaria. 31 BOLETÍN GEICAM | NOV 2012 Bibliografía 1. Giuliano A., Dale P., Turner R., Morton D.L., Evans S.W., Krasne D.L. Improved axillary staging of breast cancer with sentinel lymphadenectomy. Ann Sur, 1995;222394-401. DESDE dGEICAM 2. Lovrics P.J., Chen V., Coates G., Cornacchi S.D., Goldsmith C.H., Law C., et al. A prospective evaluation of positron tomography scanning, sentinel lymph node biopsy and standard axillary dissection for axillary staging in patients with early stage breast cancer. Ann Surg Oncol. 2004;11:846-53. 3. Murray A.D., Staff Rt, Redpath T.W., Gilbert F.J., Ah-See A.K., Brookes J.A., et al. Dynamic contrast enhanced MRI of the axilla in woman with breast cancer: comparison with pathology of excised nodes. Br J Radiol. 2002;75:220-8. 4. Ohta M., Tokuda Y., Saitoh Y., Suzuki Y., Okumura A., Kubota M., et al. Comparative efficacy of positrón emission tomography and ultrasonography in preoperative evaluation of axillary lymph node matastases in breast cancer. Breast Cancer 2000;7:99-103. 5. De Freitas Jr. R., Costa M.V., Schneider S.V., Nicolau M.A., Marussi E. Accyracy of ultrasound and clinical examination in the diagnosis of axillary lymph node metastases in breast cancer. Eur J Surg Oncol. 19917:240-4. 6. Deurtoo E.E., Tanis P.J., Gilhuijs K.G., Muller S.H., Kroger R., Peterse J.L., et al. Reduction in the number of sentinel lymph node procedures by preoperative ultrasonography of the axilla in breast cancer. Eur J Cancer. 2003; 39:1068-107. 7. Bedrosian I., Bedi D., Kuerer H.M., Fornage B.D., Harker L., Ross M.I., et al. Impact of clinicopatholigical factor on sensitivity nodal metastases in patients with breast cancer. Ann Surg Oncol. 2003;101025-30. 8. Abe H., Schmidt R.A., Kulkami K., Semmentt Ca, Mueller J.S., Newtead G.M. Axillary lymph nodes suspicious for breast cancer metastasis: sampling with US-guided 14- gauge coreneedle biopsy. Clinical experience in 100 patients. Radiology. 2009;250:41-9. 9. Shen J., Hunt K.K., Mirza N.Q., et al. Intramammary lymph node metastases are an independent predictor of poor outcome in patients with breast carcinoma. Cancer 2004:29:6-8. 10. Tytler L., Hayes A., Kissin M. Intramammary sentinel nodes in carly breast cancer: can we find them and do they matter? Eur J Surg Oncol. 11. Spillane A.J., Donnellan M., Mathews A.R. Clinical significance of intramammary lymph nodes. Breast 1999; 8:143-6. 12. Hiroyuki Abe, M.D. US-guided Core Needle Biopsy of Axillary Lumph Nodes in Patients with Breast Cancer: Why and How to do It, et al. Radiographics 2007;27:S91-S99. 13. Brintton P.D., Gouz A., Godward S. et al. Use of ultrasound axillary node core biopsy in staging early breast cancer. Eur Radiol (2009) 19:561-569. 32 BOLETÍN GEICAM | NOV 2012 ¿Podemos estadiar pacientes de cáncer de mama sin necesidad de linfadenectomía? OSNA: información imprescindible para la toma de decisiones clínicas Sysmex España S.L. C/ Frederic Mompou, 4B • 08960 Sant Just Desvern T. 934 236 231 www.sysmex-lifescience.com CASO CLÍNICO Caso clínico Biopsia selectiva de ganglio centinela localizado en la cadena mamaria interna Mujer de 50 años con antecedentes personales de hipersensibilidad a AINES, Metamizol y Paracetamol; hipotiroidismo autoinmune en control por endocrinología, apendicetomía; G: 2 A: 0 V: 2; lactancia materna; menarquia a los 13 años, primer embarazo a los 26 años, ACO durante 4 años, FM 4/26-28; premenopáusica. Sin otros antecedentes médicos de interés. Antecedentes familiares: padre fumador fallecido por carcinoma de pulmón a los 70 años. de tejido parenquimatoso y alguna imagen pseudonodular en relación con mastopatía difusa, sin cambios significativos respecto al estudio previo (figura 1). Ecografía mamaria: lesiones quísticas bilaterales de pequeño y mediano tamaño, nódulo sólido en CIE en mama derecha, que ha aumentado de tamaño respecto a ecografía previa desde 0,8 cm a 1,3 cm, hipereco- génico de contornos lobulados; no adenopatías sospechosas (figura 2). PAAF ecoguiada: citología constituida por células ductales con atipia ocasional, sospechosa de malignidad; coágulo hemático, incluyendo pequeñas estructuras ductales con alguna imagen cribiforme-pseudocribiforme, con presencia ocasional de material necrótico. Sospechosa de malignidad (figura 3). Se encontraba en seguimiento desde abril-05 por el Servicio de Cirugía General por mamografía de cribado con nódulos mamarios bilaterales con criterios radiológicos de benignidad sugestivos de mastopatía fibroquística; con PAAF sobre nódulo en mama derecha: fibroadenoma. En junio-08 consulta al notar a la autopalpación nódulo en mama derecha, sin dolor, ni telorrea, ni telorragia. A la exploración física se objetiva nódulo duro, móvil, contornos nítidos, no doloroso de 1 cm en LIC externa de mama derecha, no adherido a piel ni a planos profundos, resto de exploración sin hallazgos. Se realizan: Mamografía: mamas de alta densidad con distribución heterogénea Figura 1. Mamografía de MD (junio 2008) “La importancia de la BSGC reside en su alto valor predictivo positivo sobre el estado ganglionar axilar, siendo un método mínimamente invasivo y con escasa morbilidad, de modo que ha reemplazado a la linfadenectomía axilar (LA)” 34 BOLETÍN GEICAM | NOV 2012 Mª José Molina Garrido1, Mª José Cantero Ayllón2, Ana Castro García2, Francisco Martín Ordóñez3, Jesús Razquín Murillo4, Carolina Ortega Ruipérez1, Amaya Olaverri Hernández1, Laura Haro Martínez5, Mª Yolanda Bernisz6 y José Antonio Santiago Crespo1 Dra. María del Mar Muñoz Sánchez1 Sección de Oncología Médica1. Servicio de Cirugía General2. S. Medicina Nuclear3. S. Anatomía Patológica4. Hospital General Virgen de la Luz. Unidad de Psicología AECC5. Servicio de Radioterapia IVO6. Cuenca superior e inferior a 1 cm, CDIS con comedocarcinoma, cambios fibroquísticos, moderada reacción desmoplásica. Biopsia de ganglio centinela (cadena mamaria interna) (HE) negativa. IHQ: RE: 90%, RP: 80%, HER2: +++, Ki 67: 40%, p53: negativo, E-cadherina: positivo. Figura 2. Ecografía mamaria derecha (junio 2008) La paciente es intervenida quirúrgicamente el 08-07-2008, realizándose previamente la administración intratumoral del radiofármaco (bajo control ecográfico), se lleva a cabo tumorectomía de lesión profunda con incisión elíptica en la piel de LIC externa de mama derecha, se comprueba la inclusión de la lesión en la pieza, se obtiene resultado de biopsia intraoperatoria positiva para malignidad (carcinoma ductal infiltrante con componente intraductal de 1,2 x 0,7 x 0,5 cm borde quirúrgico profundo a 0,3 cm), continuando con la ampliación de márgenes y cierre en 2 planos. Se procede a realizar biopsia selectiva de ganglio centinela que se localiza en cadena mamaria interna intercostal: incisión transversa paraesternal derecha, localización del ganglio centinela, asistida por gammacámara, de 2-3 mm con exéresis del mismo. Se marca lecho profundo con 3 hemoclips para facilitar localización de cara a ulterior boost. Sin complicaciones post-quirúrgicas. Anatomía patológica: carcinoma ductal infiltrante GH II (SBR 1+2+3) de 1,2 x 0,7 x 0,5 cm con bordes posterior a 0,23 cm, anterior a 0,2 cm, En agosto de 2008 la paciente nos es remitida para valoración de tratamiento adyuvante con excelente recuperación postquirúrgica. En Comité de Tumores de Mama, dado el resultado histológico, se aconseja ampliar bordes quirúrgicos. Se re-interviene quirúrgicamente, llevándose a cabo ampliación de bordes de resección, incluyendo cicatriz previa y llegando a fascia pectoral el día 30-07-08 con resultado anatomo-patológico: pequeño foco de carcinoma intraductal de patrón sólido-cribiforme de bajo grado de 3,5 x 1,8 mm, que se encuentra a 0,2 mm, de borde quirúrgico superior, resto de bordes quirúrgicos de resección sin afectación, parénquima mamario con cambios fibroquísticos (hiperplasia ductal, papilomatosis, dilatación ductal Figura 3. SNOLL LIC ext mama derecha (julio 2008) 35 BOLETÍN GEICAM | NOV 2012 CASO CLÍNICO “Además de un tamaño tumoral pequeño, ciertos tipos histológicos favorables (coloide, tubular, papilar, cribiforme y adenoideo quístico), un grado nuclear e histológico bajos y una edad mayor de 65 años parecen disminuir la posibilidad de afectación ganglionar axilar” quística, metaplasia aprocrina, atrofia lobulillar y fibrosis). Con el juicio clínico de CDI grado histológico II + CDIS comedocarcinoma estadio pT1c pN0 (SN) M0; RE y RP positivos, Her2-2: +++; se informa a la paciente y a la familia sobre diagnóstico, pronóstico y posibilidades de tratamiento. Se realizó un estudio de extensión negativo para MTS. Recibe quimioterapia secuencial según esquema ACx4, seguido de DocetaxelTrastuzumab x4 entre ago-2008 y ene-2009 con buena tolerancia clínica y hematológica, pero presenta un síndrome de ansiedad secundario al diagnóstico, por lo que requirió intervención psicológica y tratamiento con benzodiacepinas. Posteriormente recibe tratamiento adyuvante con Trastuzumab durante 1 año. FEVI-MUGA mantenida. Completa tratamiento con radioterapia externa sobre la glándula mamaria en el IVO de Cuenca, entre enero y febrero de 2009, alcanzando los 50 Gy; posteriormente recibe braquiterapia de alta tasa en el IVO de Valencia. Dado que se trataba de una paciente premenopáusica al diagnóstico, con amenorrea reciente tras la quimioterapia, se inició tratamiento con hormonoterapia con Tamoxifeno en febrero de 2009 hasta febrero de 2011, cambiándose posteriormente a tratamiento con Letrozol (que deberá continuar hasta cumplir 5 años en el 2014). Durante el seguimiento se ha mantenido asintomática y en remisión completa. Discusión Uno de los factores pronósticos más importantes en el cáncer de mama temprano continúa siendo el estadio ganglionar. Se define como ganglio centinela el primer ganglio que recibe el drenaje linfático de un tumor primario y que por tanto recogerá las células tumorales diseminadas por el 36 BOLETÍN GEICAM | NOV 2012 sistema linfático. El concepto de ganglio centinela en el cáncer de mama se basa, siguiendo los principios de la teoría de Halsted, en que las células tumorales se diseminan ordenadamente a través del sistema linfático y, de esta forma, la afectación de los ganglios linfáticos se rige por un orden mecánico determinado por el flujo linfático entre el tumor y su primera estación ganglionar. En 1994 Giuliano publica una primera serie en pacientes con cáncer de mama y, posteriormente, describe la posibilidad de reestadificar gracias a la detección de una frecuencia considerable de micrometástasis en el ganglio centinela. Actualmente, la biopsia selectiva del ganglio centinela (BSGC) es una técnica comprobada que tiene por objetivo la identificación de este ganglio por medio de la inyección de un colorante y/o un coloide radioactivo y su exéresis para el estudio anatomopatológico. Su importancia reside en su alto valor predictivo positivo sobre el estado ganglionar axilar, siendo un método mínimamente invasivo y con escasa morbilidad, de modo que ha reemplazado a la linfadenectomía axilar (LA), como procedimiento de elección en la evaluación y estadiaje del cáncer de mama en estadios iniciales y axila clínicamente negativa. El factor que más se relaciona con la presencia de metástasis axilares es el tamaño tumoral. Así, en general, la posibilidad de afectación ganglionar según tumor primario es de aproximadamente 5% en T1a; para tumores T1b se sitúa en el 16%; para tumores T1c alrededor del 28%; en tumores T2 alcanza el 47%, en tumores T3 puede ser del 68% y en T4 llega al 86%. Además de un tamaño tumoral pequeño, ciertos tipos histológicos favorables (coloide, tubular, papilar, cribiforme y adenoideo quístico), un grado nuclear e histológico bajos y una edad mayor de 65 años parecen disminuir la posibilidad de afectación ganglionar axilar. Existen gran variedad de técnicas para la realización de la BSGC, tanto en cuanto a la tinción, el lugar de inyección, como en otros aspectos. La identificación del GC se puede efectuar con la inyección de un colorante para linfografía (azul de metileno, azul patente, azul de isosulfan, sulfuro coloide, albumina coloide, verde indocianin) y/o mediante la inyección de radioisótopos (los trazadores isotópicos recomendables marcados con 99 m tecnecio son: nanocoloide de albúmina, coloides de estaño y sulfuro de renio). Según la guía de la Sociedad Americana de Oncología Clínica, la combinación de tinción y radioisótopos alcanza los más altos rangos de identificación, y los menores índices de falsos negativos, e identifica los sitios de drenaje linfático axilar y extra-axilar. En la Actualización 2010 del Consenso sobre BSGC de la Sociedad Española de Senología y Patología Mamaria se incluye como técnica imprescindible el uso de radiotrazador como marcador del ganglio, comentando que es aceptable utilizar la técnica mixta (radiotrazador más colorante) en periodo de aprendizaje y en casos con dificultad en la visualización en la linfogammagrafía preoperatoria, desaconsejándose el uso exclusivo de colorante. La inyección del radiotrazador debería ser preferiblemente intratumoral o peritumoral. Otras opciones son inyección intradérmica o subdérmica suprayacente al tumor, subareolar y periareolar, de acuerdo con las características de cada paciente y los procedimientos establecidos en cada centro. Se aconseja la realización de linfogammagrafía prequirúrgica, que permite localizar el GC preoperativamente dentro y fuera de la cadena axilar. Los ganglios centinela extirpados son examinados de forma intraoperatoria, en aquellos casos en los que este estudio hubiera sido positivo para metástasis se procede a su inclusión en parafina y al estudio rutinario del mismo, y en aquellos casos en que el estudio hubiera sido negativo se procede a su inclusión en parafina y al estudio del mismo mediante un estricto protocolo que, entre otras cosas, conlleva la realización de cortes multi-seriados y su tinción con hematoxilina-eosina; en el supuesto de que el resultado fuera negativo se procede al estudio seriado adicional del ganglio mediante técnicas de inmunohistoquímica (citoqueratina AE1-AE3). Actualmente se recomienda para el estudio intraoperatorio del ganglio centinela una técnica cuantitativa de la citoqueratina 19 (CK19) mediante el análisis por amplificación del mRNA, denominada OSNA (One Step Nucleic Acid Amplification). En la actualidad, la realización de BSGC es posible en la mayoría de los escenarios clínicos de pacientes con cáncer de mama sin afectación clínica de ganglios axilares, recomendándose en carcinomas T1 y T2, siempre que la axila sea clínica y ecográficamente negativa y en CDIS extensos y de alto grado y/o con comedonecrosis y/o que vayan a tratarse con mastectomía. Los criterios de exclusión para su realización son la existencia de carcinoma inflamatorio y la existencia de afectación ganglionar. Existen muchos aspectos controvertidos, sobre todo la elección de la vía óptima de inyección, el tipo de radiotrazador, la intervención de cadenas linfáticas extra-axilares, la inclusión de pacientes con cirugía mamaria previa, su realización tras tratamiento neoadyuvante, la necesidad de realizar LA según la afectación del GC, etc. Respecto a nuestro caso con localización en la gammagrafía del ganglio centinela en cadena extra-axilar, hay varios aspectos reseñables. En general los tumores mediales tienen mayor tasa de metástasis ganglionares en la cadena mamaria interna (MI), frente a los laterales (7,6 vs 2,9%). La existencia de metástasis ganglionares en MI sin otra afectación ganglionar es infrecuente; lo habitual es que también exista afectación axilar. En un estudio retrospectivo de más de 7.000 casos en los que se examinaron ganglios axilares y de la cadena mamaria interna, se detectaban 22% de afectación en MI, pero sólo de manera exclusiva en el 4,9%. Siguiendo los resultados de los ensayos clínicos randomizados, en que no se observaba beneficio en supervivencia de mastectomía radical ampliada (que incluía disección ganglionar de MI) en comparación con mastectomía radical modificada, se desestimó la disección rutinaria de los ganglios de MI. Posteriormente, la implementación de la BSGC ha permitido identificar y localizar con cierta frecuencia dichos ganglios. En un trabajo retrospectivo con 374 pacientes se encontró una tasa de detección de GC en MI del 15%; en el 81,8% dicho GC fue negativo y en un 18,2% positivo, de estas 8 pacientes en 2 casos la única localización de GC fue en la cadena mamaria interna, otras 2 presentaron GC axilar negativo y las 4 restantes tenían GC axilar positivo. En el 29% de los casos dicho GC no pudo ser extirpado por dificultades técnicas. En un estudio prospectivo de BSGC con 256 pacientes se encontró un 95% de GC en territorio axilar y un 25% de GC en MI. Se pudieron localizar y extirpar los GC axilares en un 97% de los casos y los GC mamarios en un 63%. Existía afectación de GC MI en el 26,8%, en el 7,3% la afectación ganglionar era exclusivamente en MI y no en axila. La tasa de complicaciones asociada fue baja. El manejo de los ganglios de MI es controvertido: la BSGC permite identificarlos con cierta frecuencia, pero la capacidad de su localización y extirpación, aunque puede cambiar la estadificación TNM (AJCC), no implica que conlleve beneficio clínico. No obstante, más recientemente, los resultados de los ensayos clínicos aleatorizados que evalúan la radioterapia post-mastectomía (que incluye cadena MI) y el metanaálisis del EBCTCG proporcionan una alta evidencia de que el control locorregional se asocia a beneficio en la supervivencia a largo plazo, por lo que se ha reabierto la controversia sobre cuál es el manejo apropiado para estas pacientes. Ante la ausencia de datos de evidencias suficientes, en la Actualización 2010 del Consenso sobre BSGC de la Sociedad Española de Senología y Patología Mamaria aconsejan: 1) Ante la afectación del GC en MI sin daño del GC axilar se recomienda tratamiento adyuvante de la cadena mamaria interna con radioterapia. 2) Ante la afectación única del GC de MI sin que exista drenaje axilar se recomienda la posibilidad de seguimiento clínico y con técnicas de imagen, sin cirugía axilar. Preguntas... 1) ¿Cuál de los siguientes criterios no contraindica la realización de la técnica de BSGC? 2) ¿Con qué porcentaje aproximado se localiza en la linfogammagrafía un GC en territorio extra-axilar? a. Carcinoma multifocal. b. Carcinoma inflamatorio. c. Afectación ganglionar clínica confirmada ecográfica y citohistológicamente. a. <1%. b. 2%. c. Aproximadamente 20%. d. 50%. Respuestas en el siguiente boletín “En general los tumores mediales tienen mayor tasa de metástasis ganglionares en la cadena mamaria interna (MI), frente a los laterales (7,6 vs 2,9%)” 37 BOLETÍN GEICAM | NOV 2012 Bibliografía 1. Actualización del consenso sobre la biopsia selectiva del ganglio centinela en el cáncer de mama 2010. Sociedad Española de Senología y Patología Mamaria. Rev Senología Patol Mam 2010; 23 (5), PP. 201-208. CASO CLÍNICO 2. American Society of Clinical Oncology guideline recommendations for sentinel lymph node biopsy in earlystage breast cancer. Lyman G.H., Giuliano A.E., Somerfield M.R., Benson A.B., Bodurka D.C., Burstein H.J., Cochran A.J., Cody H.S., Edge S.B., Galper S., Hayman J.A., Kim T.Y., Perkins C.L., Podoloff D.A., Sivasubramaniam V.H., Turner R.R., Wahl R., Weaver D.L., Wolff A.C., W. University of Rochester School of Medicine and Dentistry, Rochester, NY, USA. guidelines@asco.org. J Clin Oncol. 2005 Oct 20;23(30):7703-20. Epub 2005 Sep 12. 3. Clinical practice guidelines for the care and treatment of breast cancer: 13. Sentinel lymph node biopsy. Cantin J., Scarth H., Levine M., Hugi M. University of Montreal. CMAJ. 2001 Jul 24;165(2):1. 4. Motomura K., Egawa C., Komoike Y., Kataoka T., Nagumo S., Koyama H., Inaji H. Sentinel Node Biopsy for Breast Cancer: Technical Aspects and Controversies. Breast Cancer 2007;14:25-30. 5. Relación entre el riesgo de metástasis en el ganglio centinela y los receptores estrogénicos en pacientes pre y postmenopáusicas con cáncer de mama. Rev Esp Med Nucl. 2010 Nov-Dec;29(6):289-92. Epub 2010 Sep 15. Bajen M.T., Benítez A.M., Domenech A., Ricart Y., Mora J., Notta P., Ramal D., Urruticoechea A., Soler T., Martín-Comín. 6. El análisis molecular intraoperatorio (one-step nucleic acid amplification) del ganglio centinela como alternativa al estudio histopatológico diferido en el cáncer de mama: análisis coste-beneficio. Cir Esp. 2011 AugSep;89(7):456-62. Epub 2011 Jun 12. Guillén-Paredes M.P., Carrasco-González L., Chaves-Benito A., Campillo-Soto A., Carrillo A., Aguayo-Albasini. 7. Evaluación de la calidad del procedimiento de biopsia selectiva de ganglio centinela en pacientes con cáncer de mama. Rev Esp Med Nucl. 2010 Sep-Oct;29(5):236-40. Epub 2010 Jul 16. Pajares M., Freire J.M., Moreno P., Utor A., Tocino A., Alonso E. 8. Aplicación de la técnica OSNA en el análisis intraoperatorio del ganglio centinela en el cáncer de mama. Cir Esp. 2011 Apr;89(4):261-2. Epub 2011 Feb 15. Guillén-Paredes M.P., Carrasco-González L., Chávez-Benito A., Aguayo-Albasini. 9. Meier P., Ferguson D.J., Karrison T. A controlled trial of extended radical versus radical mastectomy. Ten-year results. Cancer 1989; 63:188. 10. Lacour J., Le M., Cáceres E., et al. Radical mastectomy versus radical mastectomy plus internal mammary dissection. Ten year results of an international cooperative trial in breast cancer. Cancer 1983; 51:1941. 11. Morimoto T., Monden Y., Takashima S., et al. Five-year results of a randomized clinical trial comparing modified radical mastectomy and extended radical mastectomy for stage II breast cancer. Surg Today 1994; 24:210. 12. Veronesi U., Marubini E., Mariani L., et al. The dissection of internal mammary nodes does not improve the survival of breast cancer patients. 30-year results of a randomised trial. Eur J Cancer 1999; 35:1320. 13. Clarke M., Collins R., Darby S., et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials. Lancet 2005; 366:2087. 14. Liévano P., Baringo T., de la Cueva L et al. Internal mammary sentinel node biosy for breast cáncer. Alasbimn Journal year 12, mumbar 46, october 2009. 15. Van der Ent FWC, Kengen RAM, Van der Pol HAG et al. Halsted Revisited: Internal Mammary Sentinel Node Biopsy in Breast Cancer. Anals of Surgery. Vol 234, no 1, 79:84. 38 BOLETÍN GEICAM | NOV 2012 Aportaciones científicas: Publicaciones y Comunicaciones (marzo a octubre 2012) GEICAM/2002-01 Sánchez-Rovira P., Antón A., Barnadas A., Velasco A., Lomas M., Rodríguez-Pinilla S.M., Ramírez J.L., Ramírez C., Ríos M.J., Castellá E., García-Andrade C., B. San Antonio, Carrasco E., Palacios J.L. Classical markers like ER and ki-67, but also surviving and pERK are predictive of the pathological response to Gemcitabine, Adriamycin and Paclitaxel (GAT) in locally advanced breast cancer patients: results from the GEICAM 2002-01phase II study. Clin Transl Oncol. 2012 Jun;14(6):430-6. GEICAM/2006-03 Alba E., Calvo L., Albanell J., De la Haba J.R., Arcusa Lanza A., Chacón J.I., Sánchez Rovira P., Plazaola A., López García-Asenjo J.A., Bermejo B., Carrasco E., Lluch A, on behalf of GEICAM. Chemotherapy (CT) and hormonotherapy (HT) as neoadjuvant treatment in luminal breast cancer patients. Results from the GEICAM/2006-03, a multicenter, randomized phase II study. Ann Oncol. 2012. Epub 2012 June 6. GEICAM/9906 Bastein R.L., Rodríguez-Lescure A., Ebbert M.T.W., Prat A., Munárriz B., Rowe L., Miller P, Ruiz-Borrego M., Anderson D., Lyons B, Álvarez I., Dowell T., Wall D., Seguí M.A., Barley L., Boucher K.M., Alba E., Pappas L., Davis C.A., Aranda I., Fauron C., Stijleman I.J., Palacios J., Antón A., Carrasco E., Caballero R., Ellis J.M., Nielsen T.O., Perou C.M., Astill M., Bernard P.S., Martín M. PAM50 Breast Cancer Subtyping by RT-qPCR and Agreement with Standard Clinical Molecular Scoring. BMC Med Genomics. 2012 Oct 4;5(1):44. GEICAM/2006-03 Alba E. Chacón J.I., Lluch A., Antón A., Estévez L., Cirauqui B., Carrasco E., Calvo L., Seguí M.A., Álvarez R., Sánchez-Muñoz A., Sánchez R., López García-Asenjo J.A., Rodríguez- Martín C., Escudero M.J., Albanell J. on behalf of GEICAM. A randomized phase II trial of platinum salts in basal-like breast cancer patients in the neoadjuvant setting. Results from the GEICAM/2006-03, multicenter study. Breast Cancer Res Treat. November 2012, Volume 136, Issue 2, pp 487-493. TransGEICAM/2010-01 Albanell J., González A., Ruiz-Borrego M., Alba E., García-Sáenz J.A., Corominas J.M., Burgues O., Furio V., Rojo A., Palacios J., Bermejo B., Martínez-García M., Limon M.L., Muñoz A.S., Martín M., Tusquests I., Rojo F., Colomer R., Faull I., Lluch A. Prospective trasnGEICAM study of the impact of the 21-gene Recurrence Score assay and traditional clinicopathological factors on adjuvant clinical decision making in women with estrogen receptor-positive (ER+) node-negative breast cancer. Ann Oncol. 2012; Mar; 23(3): 625-31. Epub 2011 Jun 6. Artículos aceptados para publicación GEICAM/9906 Prat A., Cheang M.C., Martin M., Carrasco E., Caballero R., Tyldesley S., Gelmon K., Bernard P.S., Nielsen T.O., Perou C.M. Prognostic Significance of Progesterone Receptor-Positive Tumor Cells within Immunohistochemically-defined Luminal A Breast Cancer. Aceptado para su publicación en JCO. Pendiente de publicación en noviembre 2012. Presentación de comunicaciones y póster: 8th European Breast Cancer Conference. Marzo 2012 GEICAM/2003-11/CIBOMA/2004-01 Lluch A., Ruiz-Borrego M., Barrios CH., Bines J., Torrecillas L., Segalla J.G., Ruiz A., García-Sáenz J.A., Torres R. and Martín M. On behalf of Coalición Iberoamericana de Investigación en Oncología Mamaria (CIBOMA) and Grupo Español de Investigación en Cáncer de Mama (GEICAM). Final safety data from a randomised phase III trial (CIBOMA/2004-01_GEICAM/2003-11) assessing adjuvant capecitabine maintenance therapy after standard chemotherapy for triple-negative early breast cancer. Póster y póster discusión. 39 BOLETÍN GEICAM | NOV 2012 APORTACIONES CIENTÍFICAS: PUBLICACIONES Y COMUNICACIONES Últimas publicaciones revistas indexadas APORTACIONES CIENTÍFICAS: PUBLICACIONES Y COMUNICACIONES 4th Impakt Breast Cancer Conference. Mayo 2012 GEICAM/9906 Prat A., Cheang M.C., Martín M., Carrasco E., Caballero R., Tyldesley S., Gelmon K., Bernard P.S., Nielsen T.O., Perou CM. Prognostic Significance of Progesterone Receptor-Positive Tumor Cells within Immunohistochemically-defined Luminal A Breast Cancer. Comunicación oral. 48th American Society Clinical Oncology Annual Meeting. Junio 2012 GEICAM/9906 Cheang M.C., Martín M., Nielsen T.O., Prat A., Rodríguez-Lescure A., Ruiz A., Chia S.K.L., Shepherd L.E., Voduc D., Bernard P.S., Ellis M.J., Perou C.M., Di Leo A., Carey L.A., on behalf of Breast International Group - North American Breast Cancer Group. Quantitative hormone receptors, triple negative breast cancer (TNBC), and molecular subtypes: A collaborative effort of the BIG-NCI NABCG. Comunicación oral. GEICAM/2003-02 Martín M., Lluch A., Ruiz A., Ruiz M., Barnadas A., González S., Calvo L., Margelí M., Antón A., Rodríguez-Lescure A., Seguí M.A., Muñoz M., Dorca J., López Vega J.M., Mendiola C., Andrés R., Plazaola A., Rodríguez-Martín C., Casas M., Carrasco E.. Spanish Breast Cancer Research Group GEICAM. Randomized phase III study of adjuvant chemotherapy for high-risk, node-negative breast cancer (BC) comparing FAC with FAC followed by weekly paclitaxel: First efficacy analysis of the GEICAM/2003-02 trial. Comunicación oral. GEICAM/2006-03 Prat A., Lluch A., Albanell J., Fang C., Chacón López-Muñiz J.I., Parker J.S., Calvo L., Plazaola A., Arcusa Lanza A., Seguí-Palmer M.A., Burgues O., Vicioso L., Sánchez-Simón R., Bermejo B., Ribelles N., Meléndez Asensio B., Caballero R., Carrasco E.M., Perou C.M., Alba E. Spanish Breast Cancer Research Group GEICAM. Gene expression-based predictors of chemotherapy response in basal-like breast cancer. Comunicación oral. GEICAM/2006-03 y GEICAM/2006-14 Alba E., Albanell J., Chacón López-Muñiz J.I., Calvo L., De la Haba-Rodríguez J., Sánchez Rovira P., Plazaola A., Barnadas A., Seguí-Palmer M.A., Arcusa Lanza A., Ramos Vázquez M., Rojo F., Burgues O., Pajares B., Bermejo B., Sánchez-Muñoz A., Casas M.I., Caballero R., Carrasco E.M., Lluch A. Spanish Breast Cancer Research Group GEICAM. Role of proliferation in response to neoadjuvant chemotherapy in GEICAM/2006-03 and GEICAM/2006-14 breast cancer patients. Comunicación oral. 37th ESMO Congress. Septiembre-Octubre 2012 GEICAM/2006-11 Loibl S., De la Haba J., Von Minckwitz G., Morales S., Crespo C., Antón A., Carrasco E., Aktas B., Mehta K., Martín M. Phase III trial evaluating the addition of bevacizumab to endocrine therapy as first-line treatment for advanced breast cancer - Safety Analysis LEA study. Póster. 2º Simposio Nacional SEOM. Octubre 2012 GEICAM/2006-03, GEICAM/2006-14 y GEICAM/2002-01 Alba E., Albanell J., Sánchez-Rovira P., Calvo L., Antón A., Chacón López-Muñiz J.I., De la Haba-Rodríguez J., Margelí M., Carrasco E., Lluch A. Papel de la proliferación en la respuesta a quimioterapia neoadyuvante en pacientes con cáncer de mama, en los estudios GEICAM/2006-03, GEICAM/2006-14 y GEICAM/2002-01. Comunicación oral. 40 BOLETÍN GEICAM | NOV 2012 GEICAM/2003-02 Martín M., Lluch A., Ruiz Borrego M., Ruiz A., Barnadas A., González S., Calvo L., Margelí M., Antón A., Rodríguez-Lescure A. Ensayo clínico multicéntrico fase III, randomizado comparando 6 ciclos de régimen FAC con 4 ciclos de régimen FAC seguido de 8 administraciones de paclitaxel semanal (Ps) en régimen secuencial, como tratamiento adyuvante de pacientes (pacs) con cáncer de mama (CM) operados de alto riesgo y ganglios negativos (GN). GEICAM/2003-02. Comunicación oral. CIBOMA/2004-01_GEICAM/2003-11 Lluch A., Ruiz-Borrego M., Barrios C.E., Bines J., Torrecillas L., Martins J.G., Ruiz A., García-Sáenz J.A., Torres R., Martín M. Análisis final de seguridad de un ensayo clínico randomizado fase III (CIBOMA/2004-01_ GEICAM/2003-11) que evalúa la terapia de mantenimiento adyuvante con capecitabina después de quimioterapia estándar en pacientes con cáncer de mama triple negativo en estadio precoz. Póster. GEICAM 2006-14 Lluch A., Albanell J., De la Haba J., Barnadas A., Calvo L., Sánchez P., Ramos M., Rojo F., Carrasco E., Alba E. Miembros de GEICAM (Grupo Español de Investigación en Cáncer de Mama). Lapatinib o Trastuzumab en combinación con quimioterapia (QT) estándar con EC Docetaxel, en el tratamiento neoadyuvante (NA) de pacientes con cáncer de mama (CM) HER2+. Resultados del estudio fase II randomizado. GEICAM 200614. Póster. GEICAM/2006-11/GBG 051 De la Haba J., Martín M., Morales S., Crespo C., Antón A., Guerrero A., Muñoz M., García-Sáenz J.A., Gil M., Ramos M. Datos intermedios de Seguridad del Estudio aleatorizado, Fase III, que evalúa la adición de Bevacizumab a la terapia endocrina como tratamiento de primera línea en cáncer de mama avanzado. Estudio LEA (GEICAM/2006-11/GBG 051). Póster. Próximos Congresos: 35th Annual San Antonio Breast Cancer Symposium. Diciembre 2012 GEICAM/9906 Martín M., Brase J.C., Ruiz-Borrego M., Krappmann K., Munárriz B., Fisch K., Ruiz A., Weber K.E., Crespo C., Petry C., Rodríguez C.A., Kronenwett R., Calvo L., Alba E., Carrasco E., Casas M., Caballero R., RodríguezLescure Á. Prognostic performance of the EndoPredict score in node-positive chemotherapy-treated ER+/ HER2 - breast cancer patients: results from the GEICAM/9906 trial. Abstract enviado a: 35th Annual San Antonio Breast Cancer Symposium. 4-8 Diciembre 2012. San Antonio. USA. Aceptado como póster. GEICAM/2006-11 Martín M., Loibl S., Minckwitz von G., Morales S., Crespo C., Antón A., Guerrero A., Aktas B., Schoenegg W., Muñoz M., García-Sáenz J.A., Gil M., Ramos M., Carrasco E., Liedtke C., Wachsmann G., Mehta K., De la Haba J.R. Phase III trial evaluating the addition of Bevacizumab to endocrine therapy as first-line treatment for advanced breast cancer - First efficacy results from the LEA study. Abstract enviado a: 35th Annual San Antonio Breast Cancer Symposium. 4-8 Diciembre 2012. San Antonio. USA. Comunicación oral. GEICAM/2002-04/BIG Trial 1-02. IBCSG Trial 27-02 Aebi S., Gelber S., Láng I., Anderson S.J., Robidoux A., Martín M., Nortier J.W.R., Mamounas E.P., Geyer C.E., Wolmark N., Maibach R., Gelber R.D., Wapnir I.L. Adjuvant Chemotherapy (C) for Completely Resected Isolated Local or Regional Recurrence (ILRR) of Breast Cancer (BC). IBCSG 27-02, NSABP B-37, BIG 1-02. Abstract enviado a: 35th Annual San Antonio Breast Cancer Symposium. 4-8 Diciembre 2012. San Antonio. USA. Comunicación oral y póster. 41 BOLETÍN GEICAM | NOV 2012 NOTICIAS Noticias RAGMA 12 RAGMA 12, la 5ª revisión anual GEICAM de avances en cáncer de mama, volvió a congregar a una nutrida representación de todos los profesionales interesados en los progresos realizados en el conocimiento, tratamiento y prevención de dicha enfermedad. La sede, las instalaciones de la Fundación Rafael del Pino, colgó el cartel de aforo completo, reflejando el interés que suscita esta reunión anual de avances en cáncer de mama, promovida y organizada por el Grupo Español de Investigación en Cáncer de Mama. Este año han tenido gran repercusión los descubrimientos realizados en la caracterización molecular del cáncer de mama. Por una parte, los esfuerzos del consorcio anglocanadiense analizando cerca de 2.000 muestras de tumores diferentes han permitido ampliar hasta 10, por ahora, los subtipos de cáncer de mama, principalmente a expensas de los tumores que expresan receptores hormonales. La variante triple negativa también ha visto como se profundizaba en sus características y subdivisiones. Estos hallazgos, y otros muchos que se describieron en la reunión, y que ahora se pueden encontrar pormenorizados en RAGMA Virtual, describen un camino acelerado hacia la verdadera individualización del cáncer de mama desde el punto de vista diagnóstico, pronóstico, terapéutico y preventivo. Por el momento nos tenemos que conformar con la aparición de agrupaciones de tumores que comparten un número común significativo y diferencial de mutaciones somáticas y su correspondiente expresión en el transcriptoma. Es posible que alguien acuñe el término de tribu o subespecie para describir estas nuevas entidades que, sin duda, se subdividirán en otras conforme se incrementen los descubrimientos en el área. RAGMA es una reunión multidisciplinar como corresponde a la propia natu42 BOLETÍN GEICAM | NOV 2012 Dr. José Enrique Alés Martínez Coordinador RAGMA raleza del grupo y al abordaje eficaz y óptimo del cáncer de mama. Este año ha habido en el simposio un especial interés por las aportaciones de la radioterapia moderna a la mejor supervivencia y menor morbilidad asociada a los resultados a largo plazo en el cáncer de mama. El tema despertó una gran atención dada la aparente paradoja que suponen los resultados del estudio ACOSOG Z0011 (igual resultado en cuanto a supervivencia y recaídas locales tanto si se hace disección axilar completa o solo biopsia selectiva del ganglio centinela cuando solo dos o menos ganglios centinelas son positivos para tumor) por una parte y los del estudio canadiense NCIC-CTG MA.20 en el que la irradiación de los ganglios regionales, en pacientes con afectación de 1 a 3 ganglios, mejoró no solo la tasa de recaída local sino, más aun, la frecuencia de metástasis a distancia y posiblemente también la supervivencia global de las pacientes con irradiación más extensa. Thomas Buchholz, del MD Anderson, participó como ponente de este tema y activo participante en la ronda de preguntas posterior de la sesión de manejo multidisciplinar del cáncer de mama. Quedan muchos puntos por aclarar, pero sin duda la radioterapia va a seguir jugando un papel decisivo durante mucho tiempo en el manejo de nuestras pacientes. La administración de quimioterapia como primera maniobra terapéutica (“neoadyuvancia”) ha producido interesantes resultados en los últimos años. Por ejemplo, la consecución de una respuesta completa se asocia a un pronóstico excelente a largo plazo. En los tumores HER-2/Neu + ha servido para demostrar de forma fehaciente la superioridad del doble bloqueo sobre la mera utilización de Trastuzumab asociado a quimioterapia. De todo ello se ha hecho eco la FDA que un par de semanas antes de RAGMA publicó en el New England Journal of Medicine una nueva postura de este organismo, por el que admitirán para aprobación acelerada estudios en los que se use la respuesta patológica completa como criterio de valoración principal en pacientes con cáncer de mama, exceptuando aquellos tumores de bajo grado con expresión de receptores hormonales. Michael Untch, uno de los autores principales de los sucesivos estudios del grupo alemán de mama (GBG), desarrolló las principales contribuciones de su grupo a la relación entre respuesta patológica completa y supervivencia. Como en otros años, uno de los momentos más interesantes de la reunión es la recapitulación de las contribuciones propias de GEICAM al avance en el cáncer de mama. Este año Miguel Martín resumió nada más y nada menos que 5 publicaciones originales (incluyendo una en el New England) y 18 comunicaciones a Congresos. En el apartado de estudios con medicamentos que se han incorporado recientemente a nuestro armamentarium destacan los realizados con everolimus, pertuzumab (recientemente aprobados) y T-DM1, que sin duda lo será próximamente. El éxito de la reunión ha sido posible gracias al esfuerzo de muchas personas. Los excelentes ponentes y moderadores hacen, con su magnífico trabajo, que el evento sea un “objeto de deseo” dentro del calendario formativo anual en relación con el cáncer de mama. El trabajo del personal de la sede de GEICAM es imprescindible, junto con la buena coordinación de la Secretaría Técnica a cargo de Doctaforum, para que el programa fluya puntualmente. Por último, nada de esto sería posible sin el apoyo de financiación sin contrapartidas que año tras año reciben GEICAM y RAGMA por parte de todos nuestros patrocinadores. En el Comité Organizador estamos trabajando ya para la próxima edición que esperamos mantenga o supere el nivel de las ediciones anteriores, a pesar del desfavorable entorno económico. Estamos convencidos de que los resultados justifican con creces el esfuerzo dedicado. 1. De izda. a dcha: Dr. de las Heras, Dr. Buchholz, Dra. Adrover, Dr. Alés, Ana Valderas y Dr. Sánchez Rovira. 2. El Dr. Alés y el Dr. Martín en la inauguración de RAGMA 12. 3. Imagen de los ponentes de la primera sesión sobre el abordaje multidisciplinar del cáncer de mama. 4. Imagen de la mesa que conformó la segunda sesión sobre epidemiología, biología y prevención del cáncer de mama. 5. Ponentes de la tercera sesión de los modelos preclínicos a los supervivientes a largo plazo. 6. Sesión IV sobre el abordaje individualizado del cáncer de mama. 43 BOLETÍN GEICAM | NOV 2012 NOTICIAS Renovación de la Junta Directiva del Grupo Español de Investigación en Cáncer de Mama (GEICAM) El pasado 15 de junio, en el marco de RAGMA 12, y atendiendo a lo que los Estatutos de GEICAM establecen sobre la renovación de la Junta Directiva cada 3 años, tuvo lugar la convocatoria de Asamblea General y Electoral del Grupo. La elección de los miembros de la Junta Directiva atiende a criterios de excelencia clínica. De los 29 expertos que actualmente integran la Junta, 6 representan a los grupos de trabajo pertenecientes al Grupo, 5 a las comisiones multidisciplinares, 12 son investigadores oncólogos procedentes de los doce centros que más contribuyen a los estudios GEICAM, en términos de reclutamiento, y los restantes corresponden a los miembros que presentaron candidatura y fueron votados durante la citada Asamblea. Foto de familia de la nueva Junta Directiva. 44 BOLETÍN GEICAM | NOV 2012 Junta Directiva 2012-2015 Presidente Dr. Miguel Martín Jiménez Vicepresidente Dr. Agustí Barnadas Molins Tesorero Dr. José E. Alés Martínez (Quimioprevención) Secretario Dr. Álvaro Rodríguez Lescure (Adyuvancia) Vocales: Dr. Emilio Alba Conejo Dr. José M. Baena Cañada Dr. José Ángel García Sáenz Dra. Lourdes Calvo Martínez Dr. Juan de la Haba Rodríguez Dra. Noelia Martínez Jáñez Dra. Ana Lluch Hernández Dr. Serafín Morales Murillo Dr. José Ignacio Chacón López-Muñiz Dra. Montserrat Muñoz Mateu Dr. Manuel Ramos Vázquez Dra. Isabel Álvarez López Dra. Amparo Ruiz Simón Dr. Manuel Ruiz Borrego Dr. Pedro Sánchez Rovira Dr. Miguel A. Seguí Palmer (Neoadyuvancia) Dr. Ignacio Tusquets Trías de Bes Dr. Manel Algara López (r-GEICAM) Dr. Federico Rojo Todo (p-GEICAM) Dra. Marina Pollán Santamaría (Epidemiología) Dr. Melcior Sentís i Crivellé (d-GEICAM) Dra. Julia Giménez Climent (q-GEICAM) Dr. Ander Urruticoechea Ribate (net-GEICAM) Dr. Antonio Antón Torres (Metastásica) Dr. Joan Albanell Mestres (TransGEICAM) Rueda de prensa con motivo del Día Internacional del Cáncer de Mama El pasado 15 de octubre se celebró la tradicional rueda de prensa que en conmemoración del Día Internacional de la patología (19 de octubre), organiza la Federación Española de Cáncer de Mama (FECMA), con el apoyo de SEOM, GEICAM y SOLTI. En esta ocasión su actual presidenta, Roswitha Britz, recordó que la tasa de supervivencia del cáncer de mama aumenta gracias al diagnóstico precoz y a los tratamientos. FECMA lleva más de una década apoyando los programas de cribado y, un año más, lo hizo con motivo del Día Internacional del Cáncer de Mama. Con el lema “Mientras una mujer sufra de cáncer de mama, no pararemos”, se quiso hacer énfasis en recordar que si se detecta a tiempo se puede curar y que, como federación de asociaciones de pacientes, debe velar por los derechos de todas las mujeres que están pasando por el difícil trance de ser diagnosticadas de cáncer de mama y de aquellas que en un futuro lo serán. El refuerzo de los programas de detección precoz del cáncer de mama a través de los programas de screening es uno de los principales reclamos de FECMA, puesto que han desempeñado un papel fundamental en el aumento de cifras de largos supervivientes (pacientes curados que ya no reciben tratamiento, pasado al menos un periodo de cinco años desde el diagnóstico). En palabras del doctor Juan Jesús Cruz, presidente de la SEOM, “la supervivencia de los pacientes con cáncer es el indicador más importante de la eficacia del sistema asistencial en la lucha contra esta enfermedad. El incremento de la supervivencia y de la calidad de vida en las pacientes con cáncer de mama experimentado en los últimos años ha sido muy significativo y se ha debido a la detección precoz y a la innovación científica y tecnológica en Oncología que nos ha permitido disponer de tratamientos más eficaces”. La presidenta de FECMA, Roswitha Britz, y los doctores Chacón, Llombart y Cruz al inicio de la rueda de prensa. Avances en tiempos de crisis y apuesta por la investigación oncológica La actual situación de crisis económica pone en jaque la sostenibilidad del sistema, lo que hace que los pacientes teman que los ajustes puedan llegar a afectar a la calidad asistencial; el presidente de la SEOM confía, no obstante, “en que eso no llegue a ocurrir y se mantengan los estándares de calidad con los que actualmente cuenta nuestro país”. Otro de los mensajes que fueron lanzados durante la rueda de prensa fue la apuesta por la investigación como pilar para el avance de la enfermedad. FECMA considera que la crisis no debe afectar a este área. Y es que, precisamente el principal reto en la investigación en cáncer de mama, según el Grupo Español de Investigación en Cáncer de Mama (GEICAM), “tiene que ver con la crisis y cómo está afectando a la investigación clínica”. En este sentido el doctor Ignacio Chacón, vocal de la Junta Directiva de GEICAM, afirmó: “España es un país con una medicina excelente que está entre las mejores del mundo y con una investigación clínica muy buena, que es el motor de la medicina. Por ello, debemos trabajar de forma coordinada todos los actores que formamos parte del entramado científico-asistencial para que se investigue con la misma intensidad y que la crisis no afecte al avance en los tratamientos oncológicos y en la calidad de la asistencia a las mujeres que en el futuro serán diagnosticadas de cáncer de mama”. En esta línea, el doctor Antonio Llombart, coordinador del Comité Científico de SOLTI, incidió en la indiscutible calidad de los ensayos clínicos en España, a la par que solicitó un mayor reconocimiento. A su juicio, “la ardua investigación en cáncer de mama y los importantes avances en medicina personalizada han sido los responsables del incremento progresivo en la supervivencia global de las pacientes con este tumor”. Además, aseveró: “la investigación oncológica en España es del más alto nivel y desafía a la crisis, pero existe la necesidad primordial de consolidarla mediante un mayor reconocimiento”. La rueda de prensa concluyó con la presentación del Manifiesto de FECMA 2012, en el que se recogen además otras reivindicaciones de la Federación en las que las mujeres con cáncer de mama quieren hacer hincapié: atención a los problemas laborales y sociales, a la asistencia psico-social, a una gestión más eficaz de las listas de espera, al control de los efectos adversos de las mujeres afectadas por la enfermedad y la necesidad de desarrollar registros poblacionales homogéneos y actualizados de cáncer, entre otras. 45 BOLETÍN GEICAM | NOV 2012 NOTICIAS 2º Simposio Nacional SEOM El pasado 25 de octubre en la cena oficial del 2º Simposio Nacional SEOM, que se celebró en el Real Café Bernabéu de Madrid, se hizo entrega de los Premios a las mejores comunicaciones orales y posters del Simposio. La premiada como mejor comunicación oral fue la presentada por el Dr. Miguel Martín, titulada: “Ensayo clínico multicéntrico fase III, randomizado comparando 6 ciclos de régimen FAC con 4 ciclos de régimen FAC seguido de 8 administraciones de paclitaxel semanal (Ps) en régimen secuencial, como tratamiento adyuvante de pacientes (pacs) con cáncer de mama (CM) operado de alto riesgo y ganglios negativos (GN). GEICAM/2003-02”. Manifiesto en defensa de la investigación en cáncer de mama El pasado 19 de octubre, coincidiendo con el Día internacional de esta enfermedad, se difundió a los medios de comunicación un Manifiesto en defensa de la investigación en cáncer de mama. En este contexto, GEICAM, solicita a la Administración el reconocimiento legal de los grupos cooperativos de investigación académica independiente. Considera necesario contar con una acreditación equiparable a la de otros centros científicos públicos y que se incentive la puesta en marcha de más programas de investigación clínica. Como resultado de esta labor de estudio, el doctor Miguel Martín apuntó: “hoy podemos hablar de largos supervivientes y decir que la supervivencia actual a los cinco años es del 86%. Este dato es superior a la media Europea, que se sitúa en el 79,4%, y próxima a la de países como Francia o Suecia”. Y es que según estudios recientes, más de un 80% del incremento de la esperanza de vida en la población occidental en los últimos años se debe a las lecciones derivadas de ensayos clínicos. Teniendo en cuenta que el 46 BOLETÍN GEICAM | NOV 2012 Los doctores Juan Jesús Cruz, César Rodríguez, Philippe Meyer (Roche) y Álvaro Rodríguez Lescure. cáncer de mama está aumentando su incidencia en los países desarrollados, prosigue, “el apoyo a la investigación y el trabajo que realizamos en los grupos de investigación clínica independiente son las únicas vías para seguir avanzando en la curación y manejo de esta enfermedad, creando un clima favorable a la financiación de proyectos y fomentando el mecenazgo científico en el sector privado”. A medida que se tienen más conocimientos sobre el cáncer, surgen nuevos interrogantes que sólo encontrarán respuesta en la investigación clínica. “Nuestra labor como grupo investigador –explicó el doctor Martín– es continuar haciendo estudios con dos objetivos fundamentales: seguir aumentando las tasas de curación y, a medida que aumenta el número de mujeres que sobrevive a este tumor, lograr que reciban únicamente aquello que les beneficia. Es preciso que pensemos en la paciente y no sólo en su tratamiento; tenemos que plantearnos cuál va a ser su calidad de vida a los quince o veinte años”. Informar a la población Para GEICAM, otro de los retos en la lucha contra esta enfermedad es la adecuada información que se les debe facilitar en España a las mujeres sanas, y esta tiene que ver con tomar conciencia de la importancia del autocuidado y de la vigilancia de su propia salud. Un millón y medio ha sobrevivido a la enfermedad, pero una de cada diez lo padecerá y no existe una sola persona que no tenga un familiar o amiga que haya padecido este tumor. “La investigación avanza a pasos agigantados, pero no podemos dejarlo todo en manos de la Ciencia. Tan importante es investigar como que las mujeres sepan que cuanto antes se diagnostique el tumor, mayor será la probabilidad de supervivencia”, concluye el doctor Martín. Foro de la Fundación ECO El pasado mes de septiembre tuvo lugar en la Real Academia Nacional de Medicina, en Madrid, el Foro “Por una atención oncológica de calidad. El valor de la innovación”, organizado por la Fundación ECO. El programa del Foro tuvo como eje central la innovación oncológica y se estructuró en tres grandes bloques: el primero enfocado a la asistencia sanitaria, el segundo a la política sanitaria y un tercero sobre pacientes e innovación. Decisores políticos, gestores sanitarios, clínicos y pacientes pudieron compartir preocupaciones al respecto de los ajustes económicos que las administraciones sanitarias están realizando, al acceso a los avances terapéuticos y tecnológicos de la práctica clínica diaria y a la necesidad de promover la investigación clínica y traslacional como garante de la calidad asistencial y de la mejora de las tasas de supervivencia. El Dr. Agustí Barnadas, que participó en este Foro en calidad de vicepresidente del Grupo, hizo un repaso a la evolución del abordaje del cáncer de mama. Hace más de cuatro décadas se observó que la administración de un tratamiento sistémico complementario a una cirugía, bien con quimioterapia o con hormonoterapia, o bien con una combinación de ambas, era capaz de reducir el riesgo de recaída del cáncer de mama con una mejoría de la supervivencia. “No obstante, no todas las enfermas se beneficiaban de igual manera de este tipo de proceder”, explicó el doctor Barnadas. En el año 2000, dos grupos de investigación publicaron sus resultados sobre el papel de la expresión de diferentes genes asociados a la proliferación celular en grupos de enfermas tratadas únicamente con cirugía y que, según dicha expresión, los tumores tenían un curso evolutivo diferente con un mayor o menor riesgo de presentar metástasis a distancia y de mortalidad. “Estas observaciones –añadió el doctor Barnadas– sirvieron como fundamento para el desarrollo de diferentes herramientas, conocidas como plataformas genéticas, para identificar con mayor precisión a aquellas mujeres que se benefician de recibir una quimioterapia asociada a una terapia hormonal cuando estaba aumentada la expresión de determinados genes de proliferación celular”. Por otra parte, la identificación de diferentes receptores de membrana, cuya estimulación activa el crecimiento y división celular, permitió desarrollar la síntesis de diferentes fármacos con una acción dirigida contra estos receptores. De igual modo y, de forma algo más reciente, el doctor Barnadas explicó: “se han identificado diferentes puntos críticos de la maquinaria celular que han permitido desarrollar fármacos que interrumpen distintas secuencias de activación del crecimiento celular. También se han identificado diversas alteraciones genéticas que se relacionan con un mayor riesgo de toxicidad a determinados medicamentos”. Finalmente, el reconocimiento de la existencia de mutaciones en los genes BRCA1 y BRCA2 ha facilitado, en palabras de este experto, “explicar la presencia de una pequeña proporción de casos con cáncer de mama y ovario familiar hereditario”. En definitiva, resaltó que la innovación obtenida a través de estudios de investigación básica, clínica y traslacional, “ha permitido poder ofrecer a las pacientes un mejor tratamiento, en especial en algunos grupos de enfermas, como son aquellas con tumores con receptores hormonales o aquellas con amplificación del gen HER-2, cambiando de forma importante el curso evolutivo de las mismas e incrementando su expectativa de vida”. Los ponentes que participaron en el Foro de la Fundación ECO. 47 BOLETÍN GEICAM | NOV 2012 MEMBRESÍAS NUESTRA BIENVENIDA A LOS NUEVOS MIEMBROS QUE SE INCORPORAN AL GRUPO GEICAM MEMBRESÍAS ONCOLOGÍA Dra. Mª José Juan Fita - Instituto Valenciano de Oncología Dr. Luis Manuel Manso Sánchez - Hospital 12 de Octubre Dr. Juan Fernando Cueva Bañuelos - Hospital C.U. Santiago Dra. Bella Isabel Pajares Hachero - Hospital C.U. Virgen de la Victoria Dr. Juan Luis García Llano - C. Hospitalario de Ávila Dra. Yolanda Jerez Gilarranz - Hospital G.U. Gregorio Marañón Dra. Beatriz Peláez Lorenzo - Hospital C. de Valladolid Dra. Cristina Churruca Galaz - Hospital Donostia Dra. Nerea Ancizar Lizárraga - Hospital Donostia Dra. Paloma Martín Martorell - Hospital C.U. de Valencia Dra. María Martín Martín - Hospital C.U. de Valencia Dra. Josefa Ferreiro Quintana - Hospital de Galdakao-Usansolo Dra. Ana Isabel Ballesteros García - Hospital U. La Princesa Dr. Juan José Ruiz Medina - Fundación IVO Dr. Juan Ignacio Delgado Mingorance - Hospital Infanta Cristina Dr. Gonzalo Tapia Rico - Hospital G.U. Gregorio Marañón Dra. Sandra Rubio Díez - ICO - Hospital Josep Trueta RADIODIAGNÓSTICO Dr. Estanislao Arana Fernández de Moya - Fundación IVO CIRUGÍA Dr. Ignacio Blanco Guillermo - Instituto Catalán de Oncología Dr. José Mª Gubern Nogués - Hospital de Mataró PATOLOGÍA Dra. Conxi Lázaro García - Instituto Catalán de Oncología Dr. Fernando Ortíz Martínez - Hospital G.U. de Alicante Dra. Ariadna Pérez Balaguer - Hospital G.U. de Alicante Dr. Jesús Alba Losada - CENBIMO 48 BOLETÍN GEICAM | NOV 2012 Apellidos ______________________________________Nombre __________________________________________ Titulación ________________________________________________________________________________________ Dirección ______________________________________Localidad _________________________________________ Provincia ______________________________________Código Postal _____________________________________ Teléfono ____________________ Tel. directo __________________________ Móvil ________________________ Fax _________________________ Correo Electrónico __________________________________________________ DNI _________________________ Especialidad _______________________________________________________ Miembros de GEICAM que le avalan: _________________________________________________________________ Nombre y apellidos _________________________________________________________________________________ Firma Fecha Nombre y apellidos _________________________________________________________________________________ Firma Fecha SOLICITO ser admitido como miembro del Grupo Español de Investigación en Cáncer de Mama (GEICAM), aceptando los Estatutos del mismo. Firma Fecha Formación del interesado ___________________________________________________________________________ Actividad profesional ______________________________________________________________________________ Lugar de trabajo actual ______________________________________________________________________________ Dirección ________________________________________________________________________________________ Teléfono ______________________________________Fax ______________________________________________ Correo electrónico ________________________________________________________________________________ ¿Dónde desea recibir la correspondencia? En el hospital En el domicilio particular Enviar este impreso cumplimentado y firmado por correo a la siguiente dirección, adjuntando el Curriculum Vitae actualizado y una fotocopia del título de su especialidad a: GEICAM (Grupo Español de Investigación en cáncer de Mama) Avenida de los Pirineos 7, Oficina 1 - 14 28703 San Sebastián de los Reyes (Madrid) Tel. 91 659 28 70 - Fax. 91 651 04 06 Mediante la cumplimentación de este formulario autoriza a la ASOCIACIÓN GRUPO ESPAÑOL DE INVESTIGACIÓN EN CÁNCER DE MAMA Y A LA FUNDACIÓN GRUPO ESPAÑOL DE INVESTIGACIÓN EN CÁNCER DE MAMA (GEICAM) a incluir sus datos de carácter personal en un fichero que tiene por finalidad tramitar las solicitudes de membresía y gestionar las relaciones de GEICAM con los socios. Asimismo, autoriza a que sus datos puedan ser cedidos a terceros relacionados con la profesión para el envío de documentación que pueda resultar de su interés. Le comunicamos que sus datos serán tratados con la confidencialidad exigida en la normativa en materia de protección de datos y con las medidas de seguridad exigidas en la misma. Podrá ejercer sus derechos de acceso, rectificación, cancelación y oposición dirigiéndose a la sede de GEICAM, sita en la Avenida de los Pirineos nº 7, 1ª planta, oficina 1. 14, 28703 de San Sebastián de los Reyes (Madrid). IMPRESO IMPRESO PARA SOLICITUD DE MEMBRESÍA A GEICAM www.geicam.org FORMACIÓN MÉDICA CONTINUADA Programa de formación MULTIDISCIPLINAR CÁNCER DE MAMA en 7 º curso fmc GEICAM 22 noviembre 23 2012 Ilustre Colegio Oficial de Médicos de Madrid Organizado por: CON LA COLABORACIÓN DE: Con el Auspicio de: