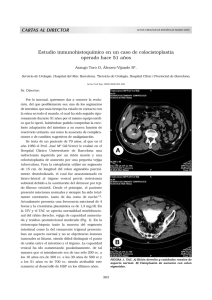
Mayo – Junio - revista mexicana de urología
Anuncio

Volumen 67, Número 3. Mayo-Junio 2007 ÓRGANO OFICIAL DE DIFUSIÓN DE LA SOCIEDAD MEXICANA DE UROLOGÍA Volumen 67, mayo-junio de 2007, Número 3 ISSN-0185-4542 Editorial Desde Nuremberg hasta Helsinki Dr. José Guzmán Esquivel / Co-Editor 133 REVISTA MEXICANA DE UROLOGÍA Artículos originales Asociación de p53, BCL-2 y virus del papiloma humano con cáncer de pene Fernández Carreño A.J. y cols. 135 Distribución y estado de maduración de células dendríticas y activación de linfocitos CD4+ en adenocarcinoma prostático 140 Torres Salazar J.J. y cols. Desarrollo de modelos biológicos inanimados en urología Márquez Heine J.C. y cols. 147 Neurofisiología del tracto urinario inferior y de la continencia urinaria Leñero E. y cols. 154 Casos clínicos Leiomiosarcoma adrenal primario. Presentación de un caso y revisión de la literatura 160 Camarena H. y cols. Necrosis escrotal y gangrena de Fournier en un paciente con leucemia aguda. Presentación de un caso y revisión de la literatura 165 Flores Terrazas J.E. y cols. Complicaciones urológicas en niños con leucemia. Presentación de un caso y revisión de la literatura Flores Terrazas J.E. y cols. 170 Liposarcoma mixoide retroperitoneal gigante. Reporte de un caso Molina-Polo L.D. y cols. 175 3 Litiasis coraliforme izquierda y pielonefritis xantogranulomatosa asociada con carcinoma epidermoide de vejiga. Presentación de un caso y revisión de la literatura Calderón Ferro F. y cols. Caso inusual de un dispositivo intrauterino migrado a vejiga con cistolitiasis secundaria Ceballos González S. y cols. 180 184 ISSN-0185-4542 * ARTEMISA * SSALUD * LILACS * IMLA * PERIODICA-UNAM * ISSSN * IMBIOMED * LATINDEX LVIII CONGRESO NACIONAL DE LA SOCIEDAD MEXICANA DE UROLOGÍA Cancún, Quintana Roo, Nov. 9-14, 2007 ÓRGANO OFICIAL DE DIFUSIÓN DE LA SOCIEDAD MEXICANA DE UROLOGÍA Fundada en 1943 REVISTA MEXICANA DE UROLOGÍA FUNDADOR Dr. Aquilino Villanueva Arreola EDITOR Dr. Luis R. Beas Sandoval Maestro en Ciencias Médicas CO-EDITOR Dr. José Guzmán Esquivel Maestro en Ciencias Médicas COMITÉ EDITORIAL Dr. Anel R. Aragón Tovar Dr. Guillermo Feria Bernal Dr. Carlos García Irigoyen Dr. Jorge Gutiérrez Aceves Dr. Hugo A. Manzanilla García Dr. Carlos Pacheco Gabhler Dr. Miguel Rodríguez Esqueda Dr. Julio C. Querol Suñé Dr. Javier Torres Salazar Dr. Elías Zonana Farca COMITÉ DE ASESORES CIENTÍFICOS Maestro en Ciencias Médicas Doctor en Ciencias de la Salud Doctor en Bioquímica y Biofísica Doctor en Ciencias Médicas Doctor en Ciencias Fisiológicas Doctor en Ciencias Médicas Maestro en Ciencias de la Salud Cuauhtémoc Acoltzin Vidal Víctor Figueroa Granados Elizabeth Langley McCarron Benjamín Trujillo Hernández Clemente Vásquez Jiménez Oscar Uribarren Berrueta Antonio R. Villa Romero COMITÉ EDITORIAL INTERNACIONAL Dr. Paul A. Escovar Díaz Dr. Shlomo Raz Dr. Thayne Larson Dr. Anthony Atala Dra. Tania González León La Revista Mexicana de Urología (ISSN-Q-18J-45-4542) es el Órgano Oficial de Difusión de la Sociedad Mexicana de Urología. Se editan seis números al año. Las opiniones expresadas en los artículos y sus fotografías son responsabilidad exclusiva de los autores. Los artículos publicados serán propiedad literaria de la Revista y su reproducción, parcial o total, sólo podrá hacerse previa autorización del Editor. Está indizada en: Base de datos sobre Literatura Latinoamericana en Ciencias de la Salud (LILACS), lndex Medicus Latinoamericano (IMLA), Periódica-Índice de Revistas Latinoamericanas en Ciencias CICH-UNAM. En INTERNET, compilada en el índice Mexicano de Revistas Biomédicas (IMBIOMED): www.imbiomed.com.mx Sociedad Mexicana de Urología: Edificio World Trade Center. Montecito Núm. 38, piso 25, Col. Nápoles, 03810, México, D.F. Tel. 5488-3385. La Revista Mexicana de Urología es una publicación bimestral. Certificados de Licitud de Título, de Contenido y Núm. de Reserva al Título en Derechos de Autor, en trámite. Editada por: Director General: Director Comercial: Producción: Tiraje útil: MASSON DOYMA MÉXICO, SA. Av. Insurgentes Sur 1388, Piso 8, Col. Actipan Del. Benito Juárez, 03230, México, D.F. Tels.: 5534-7086, 5524-4920, 5534-8559. Alejandro González Peña María del Carmen Solórzano Martha García Lomelí 1,500 ejemplares por número. ÓRGANO OFICIAL DE DIFUSIÓN DE LA SOCIEDAD MEXICANA DE UROLOGÍA Fundada en 1943 SOCIEDAD MEXICANA DE UROLOGÍA, A.C. MESA DIRECTIVA 2006-2007 Presidente Secretario de Educación Dr. Carlos Pacheco Gahbler Editor Dr. Luis R. Beas Sandoval Vicepresidente Secretario de Actas Dr. Guillermo Tavera Ramírez Co-Editor Dr. José Guzmán Esquivel Dr. Carlos Murphy Sánchez Dr. Héctor Ulises Chávez Ceballos Secretario Dr. Jesús Javier Torres Salazar Dr. Jorge Gustavo Saucedo Molina Primer Vocal Coordinación de Residentes Dr. Sergio Durán Ortíz Tesorero Dr. Ernesto Jamaica Verduzco Segundo Vocal Dr. Jorge Alberto Sánchez Montiel Página de Internet Dr. Jesús Alejandro Rueda Loaiza Dr. Rafael F. Velázquez Macías Tercer Vocal Dr. Miguel Angel Reyes Gutiérrez CAPíTULOS Endourología y Laparoscopía Dr. Raúl Salgueiro Ergueta Andrología, Sexualidad Humana y Disfunción Eréctil Oncología Dr. Hugo Arturo Manzanilla García Dr. Mario E. Solares Sánchez Urología Pediátrica Dr. Juan Cuevas Alpuche Dr. Luis Fernando Quinzaños Sordo Dr. Salvador Gállego Sales Neurourología y Uroginecología Dr. Víctor V. Kibanov Solomonov Dr. León Ovadía Rosenfeld Trasplante Dr. Anel Rogelio Aragón Tovar Dr. Martín Cruz Rodríguez Historia y Filosof ía Dr. Jesús Torres Aguilar VOCALES Dr. Juan R. Nevárez Muñoz Sección Norte Sección Centro Norte Dr. Luis Carlos Contreras Villanueva Sección Noroeste Dr. Marco Antonio Rodríguez Zamudio Sección Golfo de Cortés Dr. Jorge Alberto Balderas Ariza Sección Noreste Dr. Gilberto Castillo Chavira Sección Occidente Dr. José Luis Tapia Cerda Dr. Francisco García Espinoza Sección Bajío Dr. Juan Emilio Rama González Dr. Raúl Sigfrido Rocha Anaya Sección Oriente Dr. Abel Salas Foglia Sección Sur Dr. Alfonso De Silva Gutiérrez Dr. Alfredo Villar Pinto COMITÉ DE CONGRESO Dr. Pedro A. Patrón Sansor Dr. Alfredo Medina Ocampo Dr. Miguel A. Erguera Rivera Dr. Eliseo U. Colín García EDITORES PRECEDENTES Arturo Lara Rivas Jaime Woolrich Domínguez † Antonio Aparicio Sánchez-Covisa † Xavier Ibarra Esparza David Jiménez Velasco † Juan Maldonado Hernández Elías Zonana Farca Gilberto Lozano Lozano † Francisco Castañeda Pérez † José Antonio Medina Rodríguez Sergio Martín del Campo Martínez Enrique Shalkow Polakevitz † Álvaro Alias Álvarez Carlos Pacheco Gabhler Porfirio C. Estrada Arras Carlos Murphy Sánchezv CONTENTS CONTENIDO Editorial Desde Nuremberg hasta Helsinki EDITORIAL 133 From Nurember to Helsinki Dr. José Guzmán Esquivel / Co-Editor Dr. José Guzmán Esquivel / Co-Editor Artículos originales ORIGINAL ARTICLES Asociación de p53, BCL-2 y virus del papiloma humano con cáncer de pene 135 P53, BCL-2 and human papilloma virus in association with penis cancer 133 135 Fernández Carreño A.J. y cols. Fernández Carreño A.J., et al. Distribución y estado de maduración de células dendríticas y activación de linfocitos CD4+ en adenocarcinoma prostático 140 Distribution and maturation state of dendritic cells and activation of CD4+ linfocite in prostatic adenocarcinoma 140 Torres Salazar J.J. y cols. Desarrollo de modelos biológicos inanimados en urología 147 Torres Salazar J.J., et al. Development of inanimate biological models in urology Márquez Heine J.C. y cols. Márquez Heine J.C., et al. Neurofisiología del tracto urinario inferior y de la continencia urinaria 154 Lower urinary tract and urinary continence neurophysiology 147 154 Leñero E. y cols. Leñero E., et al. Casos clínicos CLINICAL CASES Leiomiosarcoma adrenal primario. Presentación de un caso y revisión de la literatura 160 Primary adrenal leiomiosarcoma. Presentation of a case and literature revision 160 Camarena H. y cols. Camarena H., et al. Necrosis escrotal y gangrena de Fournier en un paciente con leucemia aguda. Presentación de un caso y revisión de la literatura 165 Escrotal necrosis and Fournier gangrene in a patient with acute leukemia. Presentation of a case and literature revision 165 Flores Terrazas J.E. y cols. Flores Terrazas J.E., et al. Complicaciones urológicas en niños con leucemia. Presentación de un caso y revisión de la literatura Urologic complications in children with leukemia. Presentation of a case and literature revision 170 Flores Terrazas J.E. y cols. Flores Terrazas J.E., et al. Liposarcoma mixoide retroperitoneal gigante. Reporte de un caso 175 Retroperitoneal giant mixoid liposarcoma. Case report Molina-Polo L.D. y cols Molina-Polo L.D., et al. Litiasis coraliforme izquierda y pielonefritis xantogranulomatosa asociada con carcinoma epidermoide de vejiga. Presentación de un caso y revisión de la literatura 180 Association of left coraliform renal lithiasis and xanthogranulomathous pyelonephritis with epidermoid carcinoma of the bladder. Presentation of a case and literature revision Calderón Ferro F. y cols. Calderón Ferro F.., et al. Caso inusual de un dispositivo intrauterino migrado a vejiga con cistolitiasis secundaria Ceballos González S. y cols. 184 Unusual case with moved intrauterine device with secondary cistolitiasis Ceballos González S., et al. 170 175 180 184 Editorial Desde Nuremberg hasta Helsinki Los estudios preclínicos de investigación en diversos animales tienen gran valor, debido a la aportación indiscutible de información de respuestas biológicas a las intervenciones que hacen los investigadores; sin embargo, el paso siempre crítico al humano, limitado por diferentes características particulares del mismo, hace muy probable la presentación de reacciones adversas, que incluso tienen el riesgo de muerte. Los hechos históricos referentes a la investigación han dejado una cicatriz imborrable y en otras ocasiones, acontecimientos muy lamentables que dejan a un lado toda ética médica. La alocución latina de Hipócrates de Cos (460-377 a.C.) Primum non nocere (ante todo no hacer daño o lo primero no es hacer daño) es tan actual, que aunque pasen décadas de su declaración, el médico se encuentra regidos bajo dicho principio fundamental. En algún tiempo y algún lugar, tal pareciera que esta declaración queda arrinconada en el desván para dar paso a las malas prácticas, tanto en el campo clínico como en la investigación. Algo tenía que suceder para la creación de códigos de ética que protegieran la vida y la salud de los humanos. Después del enjuiciamiento de los criminales de la guerra nazi, en los que se incluían a médicos que experimentaban en humanos, y de los que se supo de sus atrocidades cometidas en los prisioneros a finales de la Segunda Guerra Mundial. En 1947, el Tribunal Militar Internacional estableció las normas para realizar experimentos en humanos, poniendo particular énfasis en el consentimiento informado en el llamado “Código Nüremberg”, un decálogo que da inició a Dr. José Guzmán Esquivel. M en C. Urólogo. Coeditor Rev Mex Urol. Zaragoza 377, Centro, CP 28000, Colima, Col. Correo electrónico: enicetoeto@yahoo.com.mx. los principios fundamentales de ética en la investigación. Algunos de sus puntos importantes son: a) Es absolutamente esencial el consentimiento informado voluntario del sujeto humano. (Capacidad de dar consentimiento, ausencia de coacción y comprensión de los riesgos y beneficios). b) Reducción del riesgo y daño al mínimo. c) Libertad del participante a retirarse del estudio cuando así lo desee. Durante este tiempo y en otros lugares ya se estaban realizando otros experimentos, que aunque no reflejaban la crueldad llevada a cabo en los campos de concentración nazi, tenían pisoteado el principio hipocrático. Así es como en 1972 la población mundial se entera de un estudio realizado en Tuskegee, al sur de Estados Unidos, entre 1932 y 1972, en donde se dejó de dar tratamiento médico a casi 400 individuos de una sífilis latente, teniendo ya conocimiento de algunos antibióticos específicos. Crítica mayor fue al conocer que era una población marginada afroamericana. Como secuela de este hecho, se creó la Comisión Nacional para la Protección de Sujetos Humanos en la Investigación Médica y Conductual. En 1978, esta comisión presenta su informe titulado “Informe Belmont”. Este informe establece los principios éticos de la investigación en seres humanos, y es así como se plasman con claridad los tres principios éticos básicos, que incluyen: Respeto a las personas, beneficencia y justicia. Retrocediendo unos años, en junio de 1964, en la 18va Asamblea Médica Mundial, celebrada en Helsinki Finlandia, se creó la “Declaración de Helsinki de la Asociación Médica Mundial y sus principios éticos para las investigaciones médicas en seres humanos”, la cual ha sido enmendada en varias ocasiones, la más reciente fue en Edimburgo, Escocia, en octubre de 2000. Sería extenso mencionar cada Rev Mex Urol 2007; 67(3): 133-134 133 Editorial. Desde Nuremberg hasta Helsinki. uno de los puntos señalados en esta declaración; sin embargo, se dejan claras las observaciones pertinentes para la protección y el beneficio de los sujetos a investigación, con el fin de reducir al mínimo las probabilidades riegos y daños. No sólo los ensayos clínicos son los únicos estudios que deben estar sujetos a estrictos controles de calidad y regidos por los principios éticos fundamentales en la investigación de sujetos, sino también otros quehaceres cotidianos en la práctica médica deberán estar regidos por códigos y normas que garanticen la buena práctica en todo sentido. Al realizar algún estudio de investigación en humanos o, por simple y llano que parezca el 134 Rev Mex Urol 2007; 67(3): 133-134 comentario, para tener un buen desempeño como médicos en la práctica cotidiana, debemos tener conocimientos básicos de los principios éticos y normas internacionales. Sigamos esforzándonos por no perder la máxima hipocrática y ahondemos más en los principios fundamentales de la ética médica. La vida es breve, el arte largo, la ocasión fugaz, vacilante la experiencia y el juicio difícil. Hipócrates de Cos (460-377 a.C.) Dr. José Guzmán Esquivel Co-Editor ARTÍCULO ORIGINAL Asociación de p53, BCL-2 y virus del papiloma humano con cáncer de pene Fernández Carreño A.J.,1 Lamm Wiechers L.,2 Andrade Platas D.,1 Morales Montor G.,3 Parraguirre S.,4 Calderón Ferro F.5 RESUMEN SUMMARY Antecedentes: Se diagnostican 297 casos al año de cáncer de pene que representan 0.6 pacientes por cada 100 000 habitantes. La gran mayoría son de células escamosas, que se presentan con mayor frecuencia en el glande (48%); el gen supresor de tumores p53 está involucrado en la apoptosis celular y sus mutaciones están asociadas con una correlación con la infección del virus del papiloma humano. Objetivo: Identificar la relación entre el virus del papiloma humano, mutación del gen p53 y BCL-2 con cáncer de pene. Material y métodos: Estudio transversal, analítico. Se incluyeron pacientes de los últimos 15 años. Se analizó edad, estadio patológico, inmunohistoquímica para p53, BCL-2 y virus del papiloma humano. El análisis estadístico se realizó con estadística descriptiva, curvas de Kaplan-Meier y χ2. Resultados: Se estudiaron 20 pacientes; a la inmunohistoquímica p53, 13 fueron positivos (65%), y virus del papiloma humano, dos positivos (10%); Background: Every year there are 297 cases of penile cancer that represent 0.6 patients per 100,000 habitants. The great majority are of the squamous cell type presenting more frequently in the gland (48%); the tumor suppressor gene p53 is involved in cellular apoptosis and its mutations are associated with a correlation with an infection of human papilloma virus. Objective: To identify the relationship between human papilloma virus, p53 and BCL-2 mutations in the prognosis of penile cancer. Material and methods: We realize a sectional cross study; there were included patients from the last 15 years. Age, pathologic stage and immunohystochemistry for p53, BCL-2 and human papilloma virus were analyzed. The statistics analysis was made with descriptive statistics, Kaplan-Meier charts and χ2. Results: 20 patients were studied; to p53 immunohystochemistry there were 13 positive (65%), and for human papilloma virus two positives (10%), one of them also for p53; the overall survival rate was of 44.8 months, while for the p53 positives was of 34.4 months. 1 Residente de tercer año de Urología, Hospital General “Dr. Manuel Gea González”. 2 Residente de cuarto año de Urología, Hospital General “Dr. Manuel Gea González”. 3 Adscrito al servicio de Urología, Hospital General “Dr. Manuel Gea González”. 4 Jefe de Servicio de Patología, Hospital General “Dr. Manuel Gea González”. 5 Jefe de Servicio de Urología, Hospital General “Dr. Manuel Gea González”. Correspondencia: Servicio de Urología, Hospital General “Dr. Manuel Gea González”. Calzada de Tlalpan 4800. Teléfono y fax: 5665-7681. Rev Mex Urol 2007; 67(3): 135-140 135 Fernández CAJ y cols. Asociación de p53, BCL-2 y virus del papiloma humano con cáncer de pene. uno lo fue también para p53; la sobrevida global fue de 44.8 meses, mientras que para los p53 positivos fue de 34.4 meses. Conclusiones: No existió asociación entre el virus del papiloma humano, p53 y BCL-2 con el cáncer de pene. Conclusions: There were no relation between human papilloma virus, p53 and BCL-2 with penile cancer. Key words: P53, BCL-2, penile cancer.. Palabras clave: Gen p53, BCL-2, cáncer de pene.. INTRODUCCIÓN El cáncer de pene es una patología maligna poco frecuente, con una incidencia de 0.6 casos por cada 100 000 habitantes. En Europa, la incidencia es de 0.1 por cada 100 000 habitantes y en Estados Unidos, de 0.7 por cada 100 000. En algunas áreas de Asia, África y América del Sur, la incidencia es bastante mayor, ya que afecta a 19 personas por cada 100 000 habitantes;1 en estos países, el cáncer de pene representa de 10 a 20% de los cánceres en el hombre. La estirpe histológica más frecuente es el de células escamosas y el tumor primario está localizado en el glande en 48% de los casos, prepucio en 21%, en ambos en 9%, en el surco balano-prepucial en 6% y en el cuerpo del pene en menos de 2%.2,3 La presencia de ganglios palpables es detectada al momento del diagnóstico en 58% de los pacientes, de éstos, 45% tienen metástasis ganglionares, mientras que el resto de los pacientes tienen patología inflamatoria secundaria a una infección del tumor primario.4 La diseminación metastásica se realiza de una manera predecible, ya que la diseminación linfática inguinal ocurre primero, seguida por metástasis pélvicas y finalmente metástasis a distancia; en consecuencia, es extremadamente raro observar pacientes con ganglios pélvicos positivos o metástasis a distancia sin involucro linfático inguinal. Aproximadamente 20% de los pacientes con ganglios no palpables albergan micrometástasis ganglionares.5 La fimosis y la inflamación crónica asociados con hábitos higiénicos pobres están estrechamente relacionados con este tumor, mientras que la circuncisión neonatal otorga protección contra la enfermedad.6 136 Rev Mex Urol 2007; 67(3): 135-140 Existe fuerte evidencia de que el virus del papiloma humano, tipos 16 y 18, están asociados con cáncer de pene en aproximadamente la mitad de los casos.7 Asimismo, existen marcadores moleculares bajo investigación como factores pronóstico, pero su empleo clínico es muy limitado. Los resultados más prometedores se han reportado con la sobreexpresión de p53.8 El mecanismo mediante el cual el p53 decide realizar o no la apoptosis no está bien comprendido del todo, pero el daño en el DNA dispara su activación. La apoptosis inducida por p53 está mediada por activación transcripcional de genes que inician la cascada apoptótica y la inhibición de genes que bloquean esa cascada. La apoptosis inducida por p53 es mediada por los grupos proapoptoicos y antiapoptoicos de BCL-2, por lo que las mutaciones del gen p53 y la desrregulación de las vías apoptoticas de BCL-2 tienen una relevancia directa en la etiología del cáncer.9-11 MATERIAL Y MÉTODOS Se realizó un estudio transversal analítico. Se incluyeron pacientes de los últimos 15 años con diagnóstico y tratamiento para cáncer de pene. Se analizaron edad, tamaño tumoral, estadio patológico, inmunohistoquímica para p53, BCL-2 y virus del papiloma humano, recurrencia y progresión. La inmunohistoquímica se llevó a cabo por el mismo técnico e interpretada por el mismo patólogo; se revisaron las laminillas de cada paciente y la más representativa fue seleccionada; se desparafinaron Fernández CAJ y cols. Asociación de p53, BCL-2 y virus del papiloma humano con cáncer de pene. Cuadro 1. Relación de pacientes con p53 positivo/negativo y características de ganglios Adenopatía unilateral Adenopatía bilateral 2-4 >4 Tamaño Linfadenectomía Ganglios positivos p53 (+) 15.3% 38.4% 38.4% 15.3% 0.9 cms 38.4% 15.3% p53 (-) 14.2% 57.1% 57.1% 14.2% 0.4 cms 14.2% 0 los cortes a no más de 60°C; se removió el resto de parafina en xilol. Posteriormente se hidrató pasando los cortes por etanol absoluto, etanol de 96°, agua corriente y agua destilada. Se inhibió la peroxidasa endógena durante 10 minutos y se enjuagó con agua destilada; se efectuó la recuperación antigénica en “baño María” en pH de 9 por 20 minutos y en pH de 6 durante 10 minutos en microondas y se enfrió a temperatura ambiente; se enjuagó con agua destilada y se incubó con PBS por 10 minutos; se colocó anticuerpo primario anti-human BCL-2 oncoprotein DAKO 1:50, antihuman p53 protein DAKO 1:50, y anti-bovine papillomavirus DAKO 1:200 según el caso y se incubó en cámara húmeda dentro de un refrigerador a 4°C durante toda la noche; se detuvo la reacción con agua corriente y se contrastó con hematoxilina de Harris por 5 segundos; se aclaró en xilol y se montaron los cortes en resina sintética. Se realizó la medición de áreas focales de la siguiente manera: de 5 a 10 células a 40x (+), de 10 a 20 células a 40x (++), 20 células o más a 40x (+++). La medición del análisis estadístico se realizó utilizando el producto límite o estimador de Kaplan Meier y de χ2. RESULTADOS Se estudiaron 25 casos, de los cuales 23 fueron carcinomas epidermoides; un melanoma y un sarcoma fueron excluidos; tres pacientes más fueron eliminados por no disponer del material histológico. Ningún paciente había sido circuncidado. De los 20 pacientes seleccionados, la edad promedio fue de 50 años, con un rango de 25 a 90; el tiempo de evolución desde el inicio de la lesión a la consulta fue de 11.3 meses, con un rango de 2 a 36; 14 pacientes (70%) presentaron lesiones ulcerosas, 5 (25%) con lesiones verrugosas y un carcinoma in situ (5%); 10 pacientes (50%) presentaron lesión en el glande, 2 (10%) en el prepucio, 6 (30%) en el prepucio y en el glande y 2 (10%) sólo en la vaina. Se realizaron falectomías parciales a 17 pacientes (85%), sólo circuncisión a 2 (10%) y falectomía total a 1 (5%); el estadio clínico fue carcinoma in situ en 2 (10%), T1 en 3 (15%), T2 en 10 (50%), T3 en 5 (25%) y ningún T4. Al momento del diagnóstico presentaron adenopatía unilateral en 3 (15%), bilateral en 8 (40%) y sin adenopatía en 9 (45%); 8 pacientes (40%) presentaron ganglios de 2 a 4 centímetros de diámetro y 3 (15%) de más de 4 centímetros. Se practicó linfadenectomía pélvica bilateral a 6 (30%) de los cuales resultaron positivos 2 pacientes (10%). De los positivos a p53, 2 presentaron adenopatía unilateral (15.3%) y 5 bilateral (38.4%), de los cuales 5 (38.4%) fueron de entre 2 y 4 centímetros de diámetro y 2 (15.3%) mayores de 4. El tamaño promedio de los ganglios fue de 0.9 centímetros; se realizó linfadenectomía bilateral en 5 (38.4%) de los cuales resultaron positivos 2 (15.3%). De los negativos a p53, 1 presentó adenopatía unilateral (14.2%) y 4 bilateral (57.1%), de los cuales 4 (57.1%) fueron de entre 2 y 4 centímetros de diámetro y 1 (14.2%) mayores de 4; el tamaño promedio de los ganglios fue de 0.4 centímetros, se realizó linfadenectomía bilateral en 1 (14.2%) la cual fue negativa (Cuadro 1). Rev Mex Urol 2007; 67(3): 135-140 137 Fernández CAJ y cols. Asociación de p53, BCL-2 y virus del papiloma humano con cáncer de pene. Cuadro 2. Relación de pacientes por estadio de cáncer de pene, expresión de p53 y sobrevida. Núm. de casos Evolución* p53 positivo Sobrevida* § T in situ 2 13.5 1 47.6 T1 4 10 2 44 T2 8 11 4 24.6 T3 6 10.3 6 21 T4 0 0 0 0 * meses; §Kaplan Meier: p=0.17 Respecto a la inmunohistoquímica para p53, 13 fueron positivos (64%), BCL-2 ninguno y para el virus de papiloma humano 2 positivos (10%). La sobrevida en el grupo negativo a p53 fue de 44.8 meses, mientras en el grupo positivo fue de 34.4, con un valor estadístico de p= 0.17 (Cuadro 2). El análisis para ver la asociación de virus del papiloma humano, mutación del gen p53 y BCL-2 con cáncer de pene, mediante Chi 2 no fue estadísticamente significativa. Lo anterior se traduce en que si un paciente resulta positivo para p53, es más probable que presente adenopatía inguinal al momento del diagnóstico y que estos ganglios sean más grandes. Asimismo, es más probable que sean sometidos a una linfadenectomía pélvica bilateral y que estos ganglios sean positivos, y lo más importante, que tengan una expectativa de vida menor al grupo negativo a p53. DISCUSIÓN Además de los factores de riesgo ya identificados y aceptados para su uso clínico, como las malas prácticas higiénicas y la infección por Mycobacterium smegmatis, la presencia de alteraciones en el oncogen p53 son factores negativos para la sobrevida del paciente, ya que esta empeora el pronóstico de manera importante. No se demostró asociación entre la presencia del virus del papiloma humano y el cáncer de pene en este grupo, al contrario de lo descrito en la literatura internacional, en donde se identifica una alta relación de casos de cáncer de pene con la presencia de infección por el mismo.11-14 Por otra parte, en nuestra serie el porcentaje de 138 Rev Mex Urol 2007; 67(3): 135-140 pacientes que expresan mutaciones en el encogen p53 es mayor que el descrito en otras series, mientras que la asociación entre este y la infección por virus del papiloma humano es mucho menor.15,16 Los mejores factores pronósticos relacionados con la sobrevida siguen siendo la presencia de ganglios linfáticos positivos, el número y el sitio de ganglios positivos y el involucro extracapsular ganglionar,17-20 mientras que los factores predictivos para la presencia de metástasis ganglionares son la localización, el tamaño del tumor, el grado, la invasión a los cuerpos cavernosos y la asociación existente entre estos factores.21,22 CONCLUSIÓN Aunque el p53 se encontró en un porcentaje elevado, no existió asociación significativa entre el virus del papiloma humano, el p53 y el BCL-2 con el cáncer de pene, por lo que consideramos que no es un marcador pronóstico independiente para la agresividad y la sobrevida. Si bien en la mayoría de estudios sobre este tema se asocia la presencia de infección por virus del papiloma humano y con la presencia de mutaciones de p53 con el cáncer de pene,16 los resultados globales deben de ser validados de manera prospectiva antes de que sean incorporados a la práctica clínica. El valor estadístico asignado a la sobrevida de los pacientes en nuestro grupo (p= 0.17) no resulta ser significativo, por lo que es necesario ampliar el universo de pacientes tanto positivos como negativos a p53 para incrementar la sensibilidad de esta prueba (Figura 1). Fernández CAJ y cols. Asociación de p53, BCL-2 y virus del papiloma humano con cáncer de pene. 9. May P, May E. Twenty years of p53 research: Strucutral and functional aspects of the p53 protein. Oncogene. 1999;18:7621-36. 1.00 p53 negativo 0.75 10. Adams JM, Cory S. The BCL-2 protein family: Arbitres of cell survival. Science. 1998;281:1322-6. 0.50 11. Hollstein M, Sidransky D, Vogelstein B, Harris CC. p53 mutations in human cancers. Science. 1991;253: 49-53. p53 positivo 0.25 12. Sabed S, Keehn CA, Khalil FK, Morgan FB. Immunohistochemical expresión of Bax and BCL-2 in penile carcinoma. Ann Clin Lab Sci. 2005;35:91-6. 0.00 0 50 100 150 200 Análisis de tiempo (meses) Figura 1. Expresión de p53 y sobrevida. BIBLIOGRAFÍA 1. Mobilio G, Ficarra V. Genital treatment of penile carcinoma. Curr Opin Urol. 2001;11:299-304. 2. Cubilla AL, Reuter V, Velásquez E, Piris A, Saito S, Young RH. Histologic classification of penile carcinoma and ist relation to outcome in 61 patients with primary resection. Int J Surg Pathol. 2001;9:111-20. 3. Ornellas AA, Seixas ALC, Marota A, Wisnescky A, Campos F, de Morales JR. Surgical treatment of invasive squamous cell carcinoma of the penis:retrospective análisis of 350 cases. J Urol. 1994;151:1244-9. 4. Pizzocaro G, Piva L, Nicolai N. Treatment of lymphatic metastases of squamous cell carcinoma of the penis at the National Tumor Institute of Milan. Archa Ital Urol Androl. 1996;68:169-72. 5. Ficarra V, Martignoni G, Maffei N, Cerutto MA, Novara G, Cavalleri S, Artibani W. Predictive pathological factors of lymph nodes involvement in the squamous cell carcinoma of the penis. Int Urol Nephrol. 2002;34:245-50. 6. Burgers JK, Badalament RA, Drago JR. Penile Cancer. Clinical presentation, diagnosis and staging. Urol Clin North Am. 1992;19:247-56. 7. Becerra AL, Lopes A, Landman G, Alentar GN, Torloni H, Villa LL. Clinicopathologic features and human papillomavirus DNA prevalence of warty and squamous cell carcinoma of the penis. Am J Surg Pathol. 2001;25:673-8. 8. Martins AC, Faria SM, Cologna AJ, Suaid HJ, Tucci S Jr. Immunoexpression of p53 protein and proliferating cell nuclear antigen in penile carcinoma. J Urol. 2002;167:89-92. 13. Gentile V, Vicini P, Giacomelli L, Cardillo MR, Pierangeli A, Degener AM. Detecting of human papillomavirus DNA, p53 and ki67 expression in penile carcinomas. Int J Immunopathol Pharmacol. 2006;19:209-15. 14. Humbey O, Cairey-Remonnay S, Guerrini JS, Algros MP, Mougin C, Bittard H, Aubin F. Detection of the human papillomavirus and análisis of the p53 polymorphism of exon 4 at codon 72 in penile squamous cell carcinomas. Eur J Cancer. 2003;39:684-90. 15. Levi JE, Rahal P, Sarkis AS, Villa L. Human papillomavirus DNA and p53 status in penile carcinomas. Int J Cancer. 1998;76:779-83. 16. Zhang XH, Sun GQ, Yang Y, Zhang TH. Human papillomavirus and p53 protein immunoreactivity in condylomata acuminatum and squamous cell carcinoma of the penis. J Urol. 2001;3:75-7. 17. Ravi R. Correlation between the extent of nodal involvement and survival following groin dissection for carcinoma of the penis. Br J Urol. 2003;72:817-9. 18. Ricos Torrent JV, Ramon Borja JC, Iborra Juan I, Monros lliso JL, Dumont Martinez R, Solsona Nabor E. Locoregional treatment of carcinoma of the penis. Arch Esp Urol. 1991;44:667-82. 19. Srinivas V, Morse M, Herr E, Sogani P, Whitmore W Jr. Penile cancer: relation of extent of nodal metastases to survival. J Urol. 1998;137:880-2. 20. Sarin R, Norman AR, Steel GG, Horwich A. Treatment results and prognostic factors in 101 men treated for squamous carcinoma of the penis. BJU Intl. 1999;38:713-22. 21. Soria JC. Squamous cell carcinoma of the penis: multivariate analysis prognostic factors and natural history in monocentric study with a conservative policy. Ann Oncol. 1997;8:1089-98. 22. Horenblas S. Lymphadenectomy for squamous cell carcinoma of the penis. BJU Intl. 2001;88:473-83. Rev Mex Urol 2007; 67(3): 135-140 139 ARTÍCULO ORIGINAL Distribución y estado de maduración de células dendríticas y activación de linfocitos CD4+ en adenocarcinoma prostático Torres Salazar J.J.,1 Sánchez González D.J.,2 López Rivera M.G.,3 Corona Perezgrovas M.A.3 RESUMEN SUMMARY Introducción: La inmunidad celular juega un papel muy importante en la respuesta antitumoral, y las células dendríticas son las encargadas de iniciar esta respuesta mediante activación de linfocitos. No se conoce la relación que existe entre la distribución y estado de maduración de células dendríticas y el estado de activación de los linfocitos CD4+ en el adenocarcinoma prostático. Objetivos: Establecer relación entre distribución y estado de maduración de células dendríticas y cantidad de linfocitos CD4+ en adenocarcinoma prostático e hiperplasia prostática benigna (HPB). Metodología: Se utilizaron 20 tejidos prostáticos incluidos en parafina del 2000 al 2002: 15 con adenocarcinoma de próstata y 5 con HPB como grupo control. Se procesaron mediante inmunohistoquímica indirecta de dos pasos, utilizando anticuerpos contra CD1a, CD83, CD4 y DC-SIGN. Resultados: Existe aumento en la expresión intratumoral de CD1a y DC-SIGN (p< 0.001) al comparar Gleason 8-9 con 5-6. Existe aumento en la expresión intratumoral de DC-SIGN (p< 0.01) al comparar Gleason 8-9 con 2-4. Se observó mayor Introduction: The cellular immunity plays a very important role in the antitumorlike answer and the dendritic cells are the ones in charge to initiate this answer by means of activation of lymphocytes. The relation is not known that exists between the distribution and state of maturation of dendritic cells and the state of activation of lymphocytes CD4+ in adenocarcinoma prostate. Objectives: To establish the relation between distribution and mature state of dendritic cells and CD4+ lymphocytes in prostatic adenocarcinoma and benign prostatic hyperplasia (BPH). Material and methods: We used 20 paraffin embedded prostatic tissues since 2000 until 2002: 15 were prostatic adenocarcinomas and 5 BPH as control group. They were processed by two steps indirect immunohistochemistry, using antibodies against CD1a, DC-SIGN, CD83 and CD4. Results: There was an increased intratumoral expression of CD1a and DC-SIGN (p< 0.001) in the comparison between Gleason 8-9 versus 5-6. There was an increased intratumoral expression of DCSIGN (p< 0.01) in the comparison between Gleason 8-9 versus 2-4. An increased intratumoral 1 Jefe del Departamento de Urología, Hospital Central Militar. 2 Jefe del Laboratorio de Histología y profesor titular del curso de Histología, Escuela Médico Militar. 3 Residente Rotatorio de segundo año, Hospital Central Militar. Correspondencia: Miguel Corona Perezgrovas. Presa Salinillas UH Loma Hermosa, edif. 10-A, depto. 304, Col. Loma Hermosa, Delegación Miguel Hidalgo, México, DF. Tel.: 5557-0750; celular: 044(55) 1948-3348. Correo electrónico: gualori@hotmail.com. 140 Rev Mex Urol 2007; 67(3): 140-146 Torres SJJ y cols. Distribución y estado de maduración de células dendríticas. expresión intratumoral que peritumoral de CD1a y DC-SIGN en Gleason 8-9 (p< 0.05). No se encontró marca específica para CD83. Se encontró marca específica para CD4 en 5 laminillas (p< 0.05). Conclusiones: La expresión de CD1a y DC-SIGN no aumenta de manera progresiva en relación con el grado histológico del adenocarcinoma prostático. Se demostró la coexpresión de CD1a y DC-SIGN. No se observó relación entre células dendríticas y linfocitos CD4. No es suficiente el uso de CD1a y DC-SIGN como únicos criterios para identificar células dendríticas. CD1a and DC-SIGN expression was observed at 89 Gleason in comparison with peritumoral areas (p< 0.05). There was no expression found with CD83. It was found expression of CD4 in 5 slides. Conclusions: The CD1a and DC-SIGN expression does not increase progressively in relation of prostatic adenocarcinoma histologic grade. It was demonstrated the co-expression of CD1a and DC-SIGN. There was not observed any relation between dendritic cells and CD4 lymphocytes. It’s not enough to use CD1a and DC-SIGN as unique criteria to identify dendritic cells. Palabras clave: células dendríticas, cáncer de próstata, hiperplasia prostática benigna, inmunohistoquímica, CD1a, DC-SIGN, CD83, CD4. Key words: dendritic cells, prostatic cancer, benign prostatic hyperplasia, immunohistochemistry, CD1a, CD83, DC-SIGN, CD4. INTRODUCCIÓN La próstata es la glándula sexual más grande del hombre, pesa 20 gramos y carece de cápsula bien definida, lo que facilita la diseminación del cáncer. El cáncer de próstata es predominantemente una neoplasia que se presenta en hombres de edad avanzada. En México, este tipo de cáncer ocupa el segundo lugar de frecuencia en hombres después del cáncer de piel y la segunda causa de muerte.1,2 El adenocarcinoma acinar conforma 95% del total de casos y el 5% restante corresponde a diversos tipos como: ductal, carcinosarcoma, mucinoso, de células escamosas y de células transicionales;2 75% de los pacientes con enfermedad localizada en la glándula desarrollarán extensión local en el curso de diez años y 65% de ellos muere por esta causa; 50% de los pacientes con enfermedad metastásica fallece por la enfermedad antes de tres años. Por lo general, las células tumorales expresan moléculas alteradas o que normalmente no se expresan; estas moléculas pueden funcionar como antígenos tumorales que son reconocidos por el sistema inmune. Las células dendríticas son las más potentes células presentadoras de antígenos (CPAs) descritas a la fecha; están distribuidas ampliamente en diferentes órganos y tejidos y juegan un papel clave en la respuesta inmune, ya que son las únicas CPAs especializadas en estimular a los linfocitos T vírgenes (linfocitos encargados de la inmunidad celular), en una respuesta primaria, debido a su capacidad de expresión de moléculas del complejo mayor de histocompatibilidad tipo I y II; moléculas coestimuladoras y de adhesión (CD40, CD80, CD83, CD54, CD58, CD209, entre otras), así como la producción de citocinas (IL-12, IL-1, TNF-alfa, etcétera).3-6 Las células dendríticas constituyen un complejo sistema de células hábiles para inducir respuestas primarias inmunes. Las células madres de estas células en la médula ósea dan vida a precursores sanguíneos que llegan a los tejidos, donde se establecen como células inmaduras con gran capacidad fagocítica. Cuando se enfrentan por primera vez a antígenos extraños, estas células se activan y procesan dicho antígeno para presentárselo a los linfocitos T, los cuales a su vez inician una respuesta inmunológica en contra de dicho antígeno.7-12 Las moléculas de superficie celular (proteínas que se encuentran ancladas a la membrana celular) que se estudiaron en esta investigación fueron: CD1a, estructuralmente similar al complejo mayor de histocompatibilidad tipo 1 (MHC 1), se expresa Rev Mex Urol 2007; 67(3): 140-146 141 Torres SJJ y cols. Distribución y estado de maduración de células dendríticas. OBJETIVOS Y JUSTIFICACIÓN Establecer la relación entre la distribución y estado de maduración de las células dendríticas, así como la cantidad de linfocitos CD4+ en los diferentes estadios del adenocarcinoma prostático, ya que la inmunidad celular representa un factor clave en la respuesta antitumoral y las células dendríticas son las encargadas de iniciar esta respuesta mediante la activación de linfocitos. No se conoce la relación que existe entre la distribución y el estado de maduración de las células dendríticas y la cantidad de linfocitos CD4+ en el cáncer de próstata, por lo que, para investigar dicha relación, diseñamos un estudio de expresión génica en su segundo nivel (traducción de la proteína), mediante inmunohistoquímica. METODOLOGÍA Se tomaron del archivo de Patología del Hospital Central Militar todos lo tejidos prostáticos incluidos en parafina del 2000 al 2002, obtenidos mediante prostatectomía radical con los diagnósticos histopatológicos de cáncer de próstata e hiperplasia prostática benigna (HPB), corroborados por dos patólogos. Para la selección de la muestra se formó el grupo de casos de 15 bloques con el diagnóstico de cáncer de próstata: cinco bien diferenciados, cinco moderadamente diferenciados y cinco mal diferenciados, así como un grupo control con HPB. El procesamiento de las muestras se llevó a cabo mediante inmunohistoquímica sencilla indirecta de dos pasos, en el laboratorio de la Escuela Médico Militar, utilizando los anticuerpos contra las proteínas CD1a, CD83, CD4 y DC-SIGN. 142 Rev Mex Urol 2007; 67(3): 140-146 RESULTADOS Expresión de CD1a y DC-SIGN Se procesaron las muestras con técnica de inmunohistoquímica indirecta de dos pasos y en todas las muestras se encontró un patrón similar para la expresión de CD1a y DC-SIGN intratumoral. Para CD1a, el porcentaje de superficie marcada por campo microscópico 20x, para el grupo de Gleason 2-4, varió de un mínimo de 18.42% a un máximo de 57.82%, con una media de 28.2% y un promedio de 31.72%. Para el Gleason 5-6, varió la expresión de un mínimo de 10.33% a un máximo de 40.02%, con una media de 26.66% y un promedio de 24.17%. Para el Gleason 8-9, varió la expresión de un mínimo de 21.98% a un máximo de 69.54%, con una media de 47.28% y un promedio de 47.28% (Gráfica 1). Los valores encontrados para DC-SIGN fueron: para el grupo de Gleason 2-4, varió de un mínimo de 2.37% a un máximo de 33.07%, con una media de 16.39% y un promedio de 16.86%. Para el Gleason 5-6, varió la expresión de un mínimo de 0.11% a un máximo de 34.33%, con una media de 2.12% y un promedio de 8.26%. Para el Gleason 8-9, varió la expresión de un mínimo de 10.27% a un máximo de 83.93%, con una media de 36.30% y un promedio de 41.87% (Gráfica 2). 50 % SUPERFICIE / CAMPO MICROSCÓPICO en timocitos CD4+, CD8+ (linfocitos inmaduros) y células dendríticas inmaduras. DC-SIGN (CD 209), que es un receptor de manosa que pertenece a la superfamilia de las lectinas tipo C y sirve de unión a las células endoteliales; su expresión es exclusiva de células dendríticas. CD83 (HB15) pertenece a la familia de las inmunoglobulinas y se expresa en células dendríticas activadas o maduras. CD4 es un marcador de superficie de linfocitos T colaboradores.13-15,17,18 40 30 20 10 0 HPB Ca. 2-4 Ca. 5-6 Ca. 8-9 HPB vs Ca P>0.05 Ca 2-4 vs Ca 5-6 P>0.05 Ca 2-4 vs Ca 8-9 P<0.01 Ca 5-6 vs Ca 8-9 P<0.001 Gráfica 1. Porcentaje de superficie con marca específica para CD1a por campo microscópico (200x), comparando los diferentes estadios del adenocarcinoma prostático y el grupo control con hiperplasia prostática benigna. % SUPERFICIE / CAMPO MICROSCÓPICO Torres SJJ y cols. Distribución y estado de maduración de células dendríticas. 50 de 60.64%, con una media de 41.72% y un promedio de 34.31%. Con el anticuerpo para DC-SIGN se encontró un valor mínimo de 8.32 y un valor máximo de 56.93%, con media de 32.03% y promedio de 30.85%. 40 30 20 10 0 HPB Ca. 2-4 Ca. 5-6 Ca. 8-9 HPB vs Ca P>0.05 Ca 2-4 vs Ca 5-6 P>0.05 Ca 2-4 vs Ca 8-9 P<0.01 Ca 5-6 vs Ca 8-9 P<0.001 Gráfica 2. Porcentaje de superficie con marca específica para DC-SIGN por campo microscópico (200x), comparando los diferentes estadios del adenocarcinoma prostático y el grupo control con hiperplasia prostática benigna. De igual forma, se encontró marca específica tanto para CD1a como para DC-SIGN en tejido peritumoral, con distribuciones similares orientadas hacia la luz de los conductos glandulares y con morfología epitelial. El porcentaje de superficie marcada para CD1a en el tejido peritumoral para el grupo de Gleason 2-4, varió de un mínimo de 23.13% a un máximo de 58.47%, con una media de 35.96% y un promedio de 37.23%. Para el Gleason 5-6, varió la expresión de un mínimo de 19.76% a un máximo de 55.65%, con una media de 32.40% y un promedio de 33.58%. Para el Gleason 8-9, varió la expresión de un mínimo de 12.81% a un máximo de 61.11%, con una media de 29.77% y un promedio de 31.67%. El porcentaje de superficie marcada para DCSIGN en el tejido peritumoral arrojó los siguientes resultados: para el grupo de Gleason 2-4, varió de un mínimo de 0.76% a un máximo de 61.07%, con una media de 43.12% y un promedio de 36.46%. Para el Gleason 5-6, varió la expresión de un mínimo de 0.39% a un máximo de 27.62%, con una media de 7.23% y un promedio de 9.18%. Para el Gleason 8-9, varió la expresión de un mínimo de 0.02% a un máximo de 28.94%, con una media de 1.23% y un promedio de 5.87% (Figuras 1 y 2). El grupo de hiperplasia prostática benigna también presentó marca específica en todas las laminillas, tanto para CD1a como para DC-SIGN. Se encontró para CD1a un valor mínimo de 1.61% y un valor máximo Expresión de CD83 Nuestra siguiente búsqueda fue para determinar si existen células dendríticas maduras, ya sea infiltrando el tumor o en la periferia. Se estableció que una célula dendrítica es madura cuando expresa la proteína CD83. No se encontró la expresión de CD83 en ningún caso ni intra ni peritumoral, como tampoco se encontró marca en el grupo control de hiperplasia prostática benigna. Expresión de CD4 Se buscó la expresión de CD4 y se encontró marca específica en cinco laminillas de los 15 casos, de las cuales tres corresponden al grupo de Gleason 8-9, con un valor mínimo de 3.35% y un valor máximo de 16.23%, una media de 7.55% y un promedio de 10.14%. Una sola laminilla de los casos de Gleason 5-6 resultó positiva al marcaje para CD4 y se obtuvo un valor mínimo de 2.13%, un valor máximo de 5.84%, media de 3.98% y promedio de 3.98%. Una laminilla resultó positiva dentro del estadio Gleason 2-4, con un valor mínimo de 2.21%, máximo de 2.4%, media de 2.3% y un promedio de 2.3%. No se encontró marca específica en los controles de hiperplasia prostática benigna (Figura 3). DISCUSIÓN De acuerdo con los resultados obtenidos, se pudo observar un aumento significativo en la expresión de CD1a (p< 0.001) y DC-SING (p< 0.001) dentro del adenocarcinoma prostático con Gleason 8-9 en relación con el grupo de Gleason 5-6. En la comparación de las áreas intratumorales de los Gleason 2-4 y 8-9 se observó un aumento significativo en este último (p< 0.01) de la expresión de DC-SING. La expresión de ambos anticuerpos nos podría sugerir la presencia de células dendríticas inmaduras; sin embargo, la marca se observa distribuida en las células tumorales que se encuentran orientadas hacia la luz de los conductos glandulares, con morfología epitelial. Esta marca se observa en los estadios de Gleason bien y moderadamente Rev Mex Urol 2007; 67(3): 140-146 143 Torres SJJ y cols. Distribución y estado de maduración de células dendríticas. Figura 1. Microfotografía de adenocarcinoma prostático, donde se observa el epitelio glandular intensamente positivo para CD1a de color café tabaco. En esta imagen no se observan células dendríticas con su morfología clásica estrellada con prolongaciones citoplásmicas. El resto del tejido está contrateñido con hematoxilina en color azul-morado (200x). Figura 3. Microfotografía de adenocarcinoma prostático Gleason 8-9, donde se observa la presencia de marcaje específico para CD4, en color café tabaco, en células con morfología de linfocitos, en la región peritumoral. El resto del tejido contrateñido con hematoxilina en azul-morado (200x). Figura 2. Microfotografía de adenocarcinoma de próstata, donde se observa el epitelio glandular positivo para DC-SIGN de color rojizo de menor intensidad en relación con CD1a, lo que se traduce en menor cantidad de proteínas presentes; sin embargo, el patrón de expresión en ambas proteínas es similar con ausencia de células dendríticas de morfología clásica. El resto del tejido está contrateñido con hematoxilina en color azul-morado (200x). diferenciados, así como en la hiperplasia prostática benigna, mientras que en el Gleason poco diferenciado se encontró una distribución más heterogénea debido a la pérdida estructural del tejido. 144 Rev Mex Urol 2007; 67(3): 140-146 Al comparar los nidos de adenocarcinoma contra las áreas peritumorales dentro del grupo de Gleason 8-9, también se observó un aumento en relación con estas últimas que fue estadísticamente significativo para la expresión de ambos anticuerpos con una p< 0.05 para CD1a y una p< 0.001 para DC-SING. De existir una morfología de células dendríticas, con este resultado podríamos pensar en un aumento en el reclutamiento e infiltración tumoral de células dendríticas maduras, pero la morfología epitelial y la marca especifica en estas células neoplásicas nos sugiere de manera más importante que dicho aumento pueda deberse al mayor número de células neoplásicas que normalmente se observa en este estadio. En el resto de las comparaciones, en la expresión de CD1a y DC-SING no se encontró diferencia estadísticamente significativa entre las áreas peritumorales e intratumorales de los estadios de Gleason 2-4 y 5-6 ni en la comparación del grupo control de HPB con las áreas intratumorales de los estadios de Gleason 2-4, 5-6 y 8-9. Torres SJJ y cols. Distribución y estado de maduración de células dendríticas. Expresión de CD83 Por medio de inmunohistoquímica indirecta de dos pasos se buscó la expresión de CD83, que se considera un marcador específico para células dendríticas; se utilizaron como control positivo cortes de ganglio linfático. No se encontró marca específica en ninguna laminilla tanto de cáncer como de HPB; sin embargo, en el control positivo de ganglio linfático se encontró marca específica para este anticuerpo (Figura 3), lo cual nos confirma que la técnica inmunohistoquímica fue adecuada y que en realidad no existen células dendríticas maduras dentro del tejido prostático estudiado. • Por medio de la técnica de inmunohistoquímica indirecta de dos pasos con doble tinción se demostró la coexpresión de Cd1a y DC-SING. • No se pudo observar la relación entre células dendríticas y linfocitos CD4. • No es suficiente el uso de CD1a y DC-SIGN como únicos criterios para identificar células dendríticas. Expresión de CD4 Se determinó la expresión de CD4 por medio de inmunohistoquímica indirecta de dos pasos. De las 20 muestras analizadas (una por paciente) se encontró marca específica en cinco de ellas, de las cuales tres correspondieron al grupo de Gleason 8-9, una laminilla para el grupo de Gleason 5-6 y una para el grupo de Gleason 2-4. Las diferencias no fueron estadísticamente significativas debido, tal vez, al pequeño tamaño de la muestra en el que se encontró marca. Dicha marca se encontró en el tejido peritumoral en áreas pequeñas bien definidas, formadas por células que morfológicamente parecen corresponder a linfocitos. Esto nos sugiere la presencia de linfocitos T CD4 infiltrando el tejido peritumoral. 2. Tanagho EA, McAninch JW. Urología General de Smith. 12ª ed., Manual Moderno, 2001:399-420. CONCLUSIONES Con base en nuestros objetivos y con los resultados obtenidos, podemos concluir que en nuestro estudio: • La expresión de CD1a es mayor en el tejido tumoral con Gleason 8-9 respecto al resto de los estadios e hiperplasia prostática benigna. • La expresión de CD1a no aumenta de manera progresiva en relación con el grado histológico del adenocarcinoma prostático. • La expresión de DC-SING es mayor en el tejido tumoral en Gleason 8-9 respecto al resto de los estadios e hiperplasia prostática benigna. • La expresión de DC-SING no aumenta de manera progresiva en relación con el grado histológico del adenocarcinoma prostático. BIBLIOGRAFÍA 1. Herrera GA. Manual de Oncología: Procedimientos Médico-Quirúrgicos 2a ed., Mc Graw-Hill Interamericana, 2003:584-6. 3. Stites DP, Abba IT, Parslow TG. Inmunología básica y clínica 9ª ed., Manual Moderno, 1998:725-36. 4. Belz GT, Heath WR, Carbone FR. The role of dendritic cell subsets in selection between tolerance and immunity. Immunol Cell Biol. 2002;80:463-8. 5. Steinbrink K, Wolfl M, Jonuleit H, Knop J, Enk AH. Induction of Tolerance by IL-10-Treated Dendritic Cells. J Inmunol. 1997;159(10):4772-80. 6. Pardoll D. T cells and tumors. Nature. 2001;411:1010-2. 7. Peralta-Zaragoza O, Lagunas M, Madrid V. Factor de crecimiento transformante beta-1: estructura, función y mecanismos de regulación en cáncer. Salud Pública de México. 2001;43:340-50. 8. Nouri-Shirazi M, Banchereau J, Bell D, et al. Dendritic Cells Capture Killed Tumor Cells and Present Their Antigens to Elicit Tumor Specific Immune Responses. J Immunol. 2000;165:3797-803. 9. Kumamoto T, Huang EK, Paek HJ. Induction of Tumor-specific protective immunity by in situ Langerhans cell vaccine. Nat Biotechnol. 2002;20(1):64-9. 10. Ávila MF, Sánchez TC. Alteración en la diferenciación de células dendríticas inmaduras humanas por adenocarcinomas pulmonares. Rev Inst Nal Enf Resp Mex. 2002;15:135-142. 11. Banchereau J, Steinman R. Dendritic cells and the control of immunity. Nature. 1998;392:245-52. 12. Park SH, Bendelac A. CD1-restricted T-cell responses and microbial infection. Nature. 2000;406:788-92. 13. Levings MK, Sangregorio R, Roncarolo MG. Human CD25 CD4 T Regulatory Cells Suppress Naïve and Memory T Cell Proliferation and Be Expanded In Vitro withut Loss of Function. J Exp Med. 2001;193:1295-1301. Rev Mex Urol 2007; 67(3): 140-146 145 Torres SJJ y cols. Distribución y estado de maduración de células dendríticas. 14. Kazuo Sugamura T. Proteins Reviews CD25. Blood 2002;96:4272-82. 15. Liyanage UK, Moore TT, Joo HG, Tanaka Y, Herrmann V, Doherty G, Drebin JA et al. Prevalence of Regulatory T Cells is increased in peripheral blood and tumor microenvironment of patients with pancreas or breast adenocarcinoma. J Immunol. 2002;169:2756-61. 16. Coventry BJ, Lee PL, Gibbs D, Hart DN. Dendritic cell density and activation status in human breast 146 Rev Mex Urol 2007; 67(3): 140-146 cancer CD1a, CMRF-44, and CD83 expression. British Journal of Cancer. 2002;86:546-51. 17. Tjoa BA, Murphy G. Progress in active Specific Immunotherapy of Prostate Cancer. Semin Surg Oncol. 2000;18:80-7. 18. Boenisch T. Manual de métodos inmunohistoquímicos de coloración. DAKO Corporation, 3ra ed. 2002:20-30. ARTÍCULO ORIGINAL Desarrollo de modelos biológicos inanimados en urología Márquez Heine J.C.,1 Vázquez Ortega L.,1 Ramírez Solís E.,2 Morales Montor G.,1 Pacheco Gahbler C.,1 Calderón Ferro F.1 RESUMEN SUMMARY Antecedentes: El método de ensayo y error ha sido el modelo clásico de enseñanza; sin embargo, y por desgracia, al menos en Estados Unidos de América, alrededor de 98 mil muertes, y en nuestro país alrededor del 15% de las complicaciones son atribuibles a un error médico por este tipo de enseñanza. Objetivo: Lograr un método de enseñanza que permita desarrollar destrezas quirúrgicas que sean de bajo costo, fácilmente reproductibles e imiten lo más fehacientemente posible las características humanas. Material y método: Para simular de manera adecuada los procedimientos se utilizó un maniquí hueco fabricado en fibra de vidrio. Se colocó una cubierta de poliuretano de alta densidad y se le adaptaron placas luminosas en total de 60 leads, y se complementó con una lente de laparoscopio Simulap® de 0 grados. Resultados: Se logró simular la anatomía humana, con características técnicas y quirúrgicas para poder realizar el desarrollo de habilidades necesarias para la adecuada práctica y proceso Background: The heuristic teaching method has been the classical training program. Unfortunately in the United States at least 98 thousand deaths and in our country 15% of the complications can be attached to this training program. Objective: To develop a low cost, reproducible human-like teaching program that can help to develop urological surgical abilities. Materials and methods: A hollow torso made of fiberglass was covered with high density polyurethane. Under this cover 60 light leads, using a Simulap® 0 degree laparoscopic lens. Results: The technical and surgical characteristics were simulated for the appropriate development of the surgical abilities. Conclusions: The combined use of plastic simulators with biological models gives the medical student the ability to diminish the learning curve developed in human beings. 1 Laboratorio de Innovación en Investigación Médica, Hospital General “Dr. Manuel Gea González”, México, D.F. 2 División de Urología, Hospital General “Dr. Manuel Gea González”, México, D.F. Correspondencia: Dr. Juan Carlos Márquez. Calzada de Tlalpan 4800, Col. Toriello Guerra, CP 1400, Tlalpan, D.F. Tel.: 5665-3511 ext. 173. Correo electrónico: jcmhz@yahoo.com. Key words: teaching models, biological simulators, learning curve, laparoscopy, endourology, educational economic costs. Rev Mex Urol 2007; 67(3): 147-153 147 Márquez HJC y cols. Desarrollo de modelos biológicos inanimados en urología. médico invasivo tanto para laparoscopia como para procedimientos endourológicos. Conclusiones: El uso combinado de simuladores plásticos con modelos biológicos ex mortem, permite el desarrollo de destrezas básicas y favorece reducir la curva de aprendizaje desarrollada en seres humanos. Palabras clave: modelos de enseñanza, simuladores biológicos, curva de aprendizaje, laparoscopia, endourología, costos económicos de la enseñanza. ANTECEDENTES La práctica médica siempre ha estada apoyada por la ética profesional que supone, en primer término, el beneficio al paciente y la premisa de no dañar. Esto formula un problema respecto al desarrollo de destrezas quirúrgicas ya que, como toda labor manual, requiere habilidad adquirirlas conforme se van realizando ensayos y por supuesto, cometiendo errores. Esta condición plantea la necesidad de encontrar un modelo altamente representativo y que simule realizar procedimientos o habilidades quirúrgicas específicas. El método de ensayo y error ha sido el clásico de enseñanza; sin embargo, por desgracia, cuando menos en Estados Unidos de América, alrededor de 98 mil muertes, y en nuestro país 15% de las complicaciones, son atribuibles a dicha falla médica.1,2 El ámbito quirúrgico-invasivo es el que principalmente se ve afectado por este modelo educativo, ya que las destrezas dependen de las habilidades propias del médico en formación y de las características del medio en el que se desarrollan estas destrezas.3,4 Pese a contar con importantes modelos y simuladores electrónicos (Simbionix®), estos no se encuentran al alcance de la enseñanza en nuestro país por su alto costo, además de que han demostrado varias desventajas al no permitir la sensación física y tridimensional de un modelo anatómico real.5,6 Las habilidades o destrezas quirúrgicas son difíciles de evaluar aunque existen intentos de estandarizar con escalas análogas.7,8 Hasta donde se han podido investigar los estudios que se han llevado a cabo para estandarizar la competencia técnica en urología, estos no se han validado de manera óptima,9,10 lo cual enfatiza la necesidad de contar con un número determinado de procedimientos para demostrar la progresión de la capacidad resolutiva y destreza en un alto grado de 148 Rev Mex Urol 2007; 67(3): 147-153 seguridad para avalar la competencia del futuro cirujano en el ámbito médico y legal.8-10 El adecuado entrenamiento de los residentes, subespecialistas y estudiantes depende de condiciones específicas como la organización local de cada programa de entrenamiento, de los principios éticos y riesgos legales del aprendizaje en pacientes, así como de la posibilidad de una instrucción básica y un supervisor en caso de que se presenten dudas o dificultades.11-16 Es fundamental innovar y tener un modelo de entrenamiento que nos permita reproducir la anatomía normal, la anatomopatológica y los procedimientos adecuados para corregirla para disminuir la curva de aprendizaje en humanos.17-20 OBJETIVO GENERAL Demostrar la utilidad de un modelo biológico inanimado (MBI) desarrollado en nuestra institución, para el entrenamiento endourológico básico y avanzado, que reproduzca de manera óptima las características anatómicas humanas5-7,14 y permita que los médicos en formación puedan desarrollar las destrezas y habilidades indispensables para realizar procedimientos específicos, y de esta manera logren la curva de aprendizaje ideal sin interponer al ser humano en su preparación; además, se busca que este modelo sea accesible, reproducible y que se pueda realizar sin la coordinación con otros servicios ni la necesidad de personal auxiliar a un bajo costo. OBJETIVOS ESPECÍFICOS • Reproducir anatomía quirúrgica tanto para procedimientos laparoscópicos como endourológicos (ureteroscopia, cistoscopia, etcétera). Márquez HJC y cols. Desarrollo de modelos biológicos inanimados en urología. • Comparar costos con los modelos biológicos y simuladores ya existentes. • Disminuir la necesidad de procedimientos de entrenamiento en humanos. • Determinar la utilidad real en el entrenamiento para residentes de urología. MATERIAL Y MÉTODO Se buscó un modelo que pudiera imitar las características anatómicas del humano (Dumitru-Mazilu, et al.) y que su manejo fuera sencillo, por lo que bajo esa premisa se decidió fabricar el siguiente modelo: En un maniquí hueco hecho de fibra de vidrio (47 x 38 x 49 cm), con un peso aproximado de 7 kg y recubrimiento plástico, se colocó una base de poliuretano de baja densidad. La cavidad útil para la colocación de los órganos quedó dividida en dos: la parte superior para la colocación de las vísceras provenientes de la cavidad torácica de aproximadamente 10 cm de alto por 45 cm de ancho y 20 cm de profundidad, separada de la cavidad abdominal por un diafragma de fibra de vidrio rígida; la zona inferior para la cavidad abdominal midió 30 cm de alto x 45 cm de ancho y 20 cm de profundidad. La tapa se realizó con las siguientes medidas: 45 cm de ancho, 40 cm de alto y 5 cm de espesor, hecha de poliuretano de alta densidad (por su semejanza a la piel, tejido celular subcutáneo y músculo). A esta cubierta por la cara inferior se le colocaron placas compuestas de 6 focos luminosos de luz blanca de 5 v para formar 30 de cada lado y un total de 60; además se utilizó una lente de laparoscopio Simulap® de 0 grados. El costo total de este modelo fue de 21 mil pesos, que fueron aportados por el laboratorio de investigación e innovación médica. Las vísceras se obtuvieron de animales destinados a consumo humano provenientes del rastro, haciendo énfasis en las siguientes características: animales porcinos aptos para el consumo humano menores de un año de edad, cuyas vísceras fueran obtenidas de manera legal y recubiertos casi en su totalidad por el peritoneo. Vísceras que no tuvieran más de cinco horas en refrigeración y que se encontraran completas e íntegras. El costo total aproximado de este material fue de 100 pesos por modelo obtenido. Una vez obtenidas, éstas fueron colocadas en la cavidad. El recubrimiento peritoneal fue fijado con hilo de cáñamo a las paredes de poliuretano y estas a su vez fueron fijadas a la cara externa del maniquí. Una vez armado el modelo biológico inanimado (MBI), se colocó la tapa de poliuretano de alta densidad y se fijó la misma al resto del maniquí. Se conectó el laparoscopio a un proyector de pared y se dio inicio al procedimiento quirúrgico planeado (Figura 1). Se introdujo un trocar Johnson® de 10 mm en el sitio de la cicatriz umbilical y dos más (uno de 10 mm y otro de 5 mm) en la zona de la línea alba a 3 cm por arriba de la cicatriz umbilical. Los trocares fueron introducidos de la manera habitual, observándose una similitud importante con las características normales de un paciente adulto endomórfico (Figura 2). Se realizaron diez nefrectomías laparoscópicas, con un tiempo promedio de 60 minutos (45-90 min) por lado; diez nefroureterectomías con rodete vesical, con un tiempo promedio de 75 minutos (60 a 120 min); y diez ligaduras laparoscópicas de venas gonadales. Cabe mencionar que se observaron las mismas dificultades técnicas que las identificadas en pacientes humanos; sin embargo, no fue necesario el uso de algún tipo de medicamentos y el tiempo quirúrgico no se alteró por recursos económicos. Cada tipo de procedimiento ocasionó un gasto aproximado de 1000 pesos y un total de inversión de aproximadamente 32 mil pesos. Una vez realizados los diez procedimientos de estas características, se decidió continuar con entrenamiento endourológico, por lo que al diseñador del maniquí se le solicitó realizar un hueco en la región de los genitales (Figura 3). Por cuestiones de logística se decidió iniciar con modelos que semejan a la anatomía femenina. Se solicitó que las vísceras fueran de porcinos hembras mayores de cinco meses para tener acceso a la vejiga y uréteres, los cuales son ampliamente similares a los del ser humano. La vagina del cerdo se anastomosó a la región genital del maniquí con hilo de cáñamo, intentando la mayor aproximación a la uretra plástica de una mujer. Se introdujo el cistoscopio Olympus® de 12 grados con una camisa 21 fr, logrando realizar de manera óptima una cistoscopia. Se observó la totalidad de la vagina que imita a la uretra femenina, así como el meato, y se decide canalizar con guía metálica Boston Scientific®. Se verifica de manera directa la presencia de la guía Rev Mex Urol 2007; 67(3): 147-153 149 Márquez HJC y cols. Desarrollo de modelos biológicos inanimados en urología. MODELO BIOLÓGICO INANIMADO PARA ENDOUROLOGÍA Peritoneo fijado a la Poliuretano de Baja Densidad Poliuretano de baja densidad Laparoscopio Simulap® Tapa de Poliuretano de Alta Densidad Vísceras de Modelo Porcino Leads de 5 Volts Figura 1. en el uréter destapando el maniquí y se procede a colocar el ureteroscopio semirígido ACMI® 6.9 fr logrando realizar una ureteroscopia derecha hasta pelvis renal y posteriormente una contralateral con un tiempo promedio de 22 minutos, con una mínima de 16 minutos y una máxima de 30 minutos. No se identificaron lesiones incidentales. El total de procedimientos realizados hasta la elaboración de este artículo han sido numerosos. El costo final fue de 1000 pesos por procedimiento y un total de 10 mil pesos por todos ellos. El gasto adicional del nuevo maniquí fue de 32 mil pesos, por lo que el costo final fue de 42 mil pesos. Los costos fueron absorbidos por el Laboratorio de Innovación en Investigación Médica. RESULTADOS Los resultados se muestran a través de los siguientes cuadros respecto a los costos comparativos por 150 Rev Mex Urol 2007; 67(3): 147-153 tipo de procedimiento, tiempo de solicitud de tiempo quirúrgico, número de procedimiento por evento y el comparativo de tiempo quirúrgico por tipo de procedimiento. CONCLUSIONES El uso de nuevas técnicas de enseñanza a menor costo es fundamental tanto para el desarrollo de material humano como para el desarrollo de destrezas quirúrgicas y es de vital importancia para disminuir la curva de aprendizaje en pacientes y con la consecuente disminución de errores médicos. Esto deriva en un aumento en la calidad de atención y habilidad en el tratamiento de los pacientes. En la actualidad, una de las principales causas de falta de destreza en el médico es asimismo la falta de oportunidades para ejecutarlas. Aunado al alto costo que significa el uso de simuladores o técnicas Márquez HJC y cols. Desarrollo de modelos biológicos inanimados en urología. Trocar de 10 mm Trocar de 5 mm Tapa de Poliuretano de alta densidad Figura 2. Modelo con acceso perineal Cámara y Fuente Simulap® Figura 3. Rev Mex Urol 2007; 67(3): 147-153 151 Márquez HJC y cols. Desarrollo de modelos biológicos inanimados en urología. Cuadro 1. Costos comparativos por tipo de procedimiento. Costos Modelo Biológico Inanimado Modelo Biológico Vivo Simulador Inversión inicial (dólares) 3500 1200* 50 1200* 25000** 2000*** 2000**** 150 000 Costo por procedimiento 10 100 ND *Costo de trocares y pinzas laparoscópicas; **costo del equipo de laparoscopia; ***costo del equipo anestésico; ****costo de sitio de almacenaje; ND: no disponible (Datos del Hospital General “Dr. Manuel Gea González”). Cuadro 2. Tipos de procedimientos, tiempo de solicitud de tiempo quirúrgico y número de procedimiento por evento. Acceso procedimiento quirurgico Disponibilidad Días de disponibilidad Número de procedimientos por modelo Modelo Biológico Inanimado Modelo biológico Simulador Un día de anticipación Una semana de aniticipación ND 5/7 1/7 ND Hasta 4* 2* ND *Nefrectomía laparoscópica bilateral, neovejiga, ureteroscopia y cistoscopia, nefroureterectomía con rodete vesical. Cuadro 3. Comparativo de tiempo quirúrgico por tipo de procedimiento. Tiempos Modelo Biológico Inanimado Modelo biológico simulador Preparacion del procedimiento 30 min +/- 12 min 60 min +/- 22 min nd Cirugía laparoscopica 45 min +/- 20 min 45 min +/- 20 min nd Cistoscopia y ureteroscopia 20 min +/- 10 min 35 min +/- 10 min nd de estimulo de destrezas, esto ha ocasionado que día a día sea menor la practica de enseñanza en los hospitales escuela, lo cual se transforma en un incremento en el número de iatropatogenias cometidas. Las bondades que este método ofrece son alternativas para el desarrollo de habilidades con un mínimo costo, similitudes anatómicas absolutas y permite que los modelos biológicos sean utilizados para procedimientos de la más alta especialidad. 152 Rev Mex Urol 2007; 67(3): 147-153 Ventajas del Modelo Biológico Inanimado: 1. Anatomía y localización idéntica. 2. Costo menor del procedimiento. 3. Uso mínimo de equipo adicional. 4. Uso sin límite de tiempo anestésico. 5. Reutilización del maniquí. Márquez HJC y cols. Desarrollo de modelos biológicos inanimados en urología. Desventajas del Modelo Biológico Inanimado: 1. Menor calidad en la visión laparoscópica, el cual es corregible con nueva lente. 2. Falta de sangrado activo, el cual se corrige con la aplicación de una bomba de infusión. Características en favor del Modelo Biológico: 1. Modelos anatómicos similares. 2. Complicaciones y manejo de las mismas en tiempo real. Características en contra del modelo biológico: 1. Costo de los modelos biológicos. 2. Necesidad de veterinarios. 3. Necesidad de espacio físico de contención. 4. Alimento del modelo biológico. 5. Equipo requerido para el procedimiento laparoscópico. 6. Equipo anestésico. 7. Manejo posterior del modelo biológico. 8. Cuestionamiento ético. La principal desventaja del simulador fue su costo y la falta de accesibilidad a este. BIBLIOGRAFÍA 1. Grober ED, Hamstra SJ, Wanzel KR, et al. The educational impact of Bench model fidelity on the acquisition of technical Skill: the use of clinically relevant outcome measures. Ann Surg. 2004;240 (2):374-81. 2. Adamsen S. Simulators and gastrointestinal endoscopy training. Endoscopy. 2000;32(11):895-7. 3. Bar-Meir S. A New endoscopic simulator. Endoscopy. 2000;32(11):898-900. 4. Williams CB, Saunders BP, Bladen JS. Development of colonoscopy teaching simulation. Endoscopy. 2000;32(11):901-5. 5. Neumann M, Mayer G, Ell C, Felzmann T, et al. The Erlangen endo-trainer: Life-like simulation for diagnostic and interventional endoscopic retrograde cholangiography. Endoscopy. 2000;32(11):906-10. 6. Aabakken L. et al. Performance of a colonoscopic simulator: experience from a hands-on endoscopy course. Endoscopy. 2000;32(11):911-913. 7. Conio M, Sorbi D, Batts KP, Gostout CJ. Endoscopic circumferential esophageal mucosectomy in a porcine model : An Assessment of a technical feasibi-lity, safety and outcome. Endoscopy. 2000;32(11):966-970. 8. Teague R H. Can we teach colonoscopic skills? Gastrointest Endosc. 2000;51:112-114. 9. Cass O W, Freeman ML, Peine CJ, et al. Objective evaluation of endoscopy skills during training. Ann Intern Med. 1993;118:40-4. 10. Bowles CJ, et al. Intercollegiate British Society of Gastroenterology national colonoscopy (ISBN) audit: are colonoscopies supervised during their initial training? Gastrointest Endosc. 2000;51:AB-73. 11. British Society of Gastroenterology. Recommendations for training in Gastrointestinal Endoscopy. http://www. Bsg.org.uk/training/jag99.html,1999. 12. Laguna, M. Pilar A, Hatzinger, Martin B, Rassweiler, Jens B. Simulators and endourological training. Urological surgery, surgical techniques, technology. Current Opinionin Urology. 2002;12(3):209-215. 13. Abstracts from Engineering and Urology Society. San Antonio, Texas. Journal of Endourology. 2005; 19(7):899-921. 14. Dumitru M, Alexandru P, Lucian G. Synthetic Torso for Training in and Evaluation of Urologic Laparoscopic Skills. Journal of Endourology. 2006;20(5):340-345. 15. Dauster B, Steinberg AP, Vassiliou BC, Bergman S, et al. Validity of the MISTELS Simulator for Laparoscopy Training in Urology. J Endourol. 2005;19(5):541-5. 16. Clark JA, Volchok JA, Hazey JW, Sadighi PJ, Fanelli Ranelli RD. Initial experience using an endoscopic simulator to train surgical residents in flexible endoscopy in a community medical center residency program. Curr Surg. 2005;62(1):59-63. 17. Watterson JD, Beiko DT, Kuan JK, Denstedt JD. Randomized prospective blinded study validating acquisition of ureteroscopy skills using computer based virtual reality endourological simulator. J Urol. 2002;168(5):1928-32. 18. Knoll T, Trojan L, Haecker A, Alken P, Michel MS. Validation of computer-based training in ureterorenoscopy. BJU Int. 2005;95(9):1276-9. 19. Wilhelm DM, Ogan K, Roehrborn CG, Cadeddu JA, Pearle MS. Assessment of basic endoscopic performance using a virtual reality simulator. J Am Coll Surg. 2002;195(5):675-81. 20. Lehmann KS, Ritz JP, Maass H, Cakmak HK, Kuehnapfel UG, Germer CT. A prospective randomized study to test the transfer of basic psychomotor skills from virtual reality to physical reality in a comparable training setting. Ann Surg. 2005;241(3):442. Rev Mex Urol 2007; 67(3): 147-153 153 ARTÍCULO ORIGINAL Neurofisiología del tracto urinario inferior y de la continencia urinaria Leñero E.,1 Castro R.,2 Viktrup L.,3 Bump R.C.4 RESUMEN SUMMARY La incontinencia urinaria es un problema de salud de alta prevalencia que puede alterar significativamente la calidad de vida. A pesar de ello, los pacientes con incontinencia de orina suelen aceptar sus síntomas durante años antes de consultar con su médico. Un porcentaje desproporcionadamente alto de aquellos que consultan es remitido al especialista. Aunque la fisiopatología de la incontinencia urinaria sea compleja, al poseer conocimientos básicos sobre la anatomía y fisiología del tracto urinario inferior, ésta puede ser eficazmente tratada en el marco de la asistencia primaria. En esta revisión se describen los recientes hallazgos sobre la neurofisiología del tracto urinario inferior (TUI), con especial atención en el papel del sistema nervioso central y del sistema nervioso periférico autónomo y somático durante el llenado y vaciamiento vesical. The urinary incontinence is a problem of health of high prevalence that can alter the quality of life significantly. In spite of it, the patients with urin incontinence usually accept their symptoms during years before consulting with their doctor. An very out of proportion high percentage of that they consult is sent to the specialist. Although the pathophysiology of the urinary incontinence is complex, when having basic knowledge on the anatomy and physiology of the lower urinary tract, this one can effectively be dealed with the primary attendance within the framework. In this revision the recent findings are described on the lower urinary tract physiology, with special attention in the rol of the central nervous system and the independent and somatic peripheral system nervous during the filling and vesical evacuating. Key words: neurophysiology, incontinence, urinary. Palabras clave: neurofisiología, incontinencia, urinaria. NOTA: Este artículo es una traducción y adaptación del artículo Simplified Neurophisiology of the lower urinary tract publicado en Prim Care Update Ob/Gyns. 2003;10:261-264. ©2003 Elsevier Inc. Esta traducción y adaptación ha sido autorizada por los autores y el editor de la revista. 1 MD. Urólogo. Hospital Médica Sur. Clínical Research Physician. Eli Lily and Company. México D.F. México. 2 MD. Urólogo. 154 Rev Mex Urol 2007; 67(3): 154-159 Médico de Familia. Corporate Medical Advisor Urology. Boehringer Ingelheim GmbH. Ingelheim am Rhein. Germany. 3 MD. Médico de Familia. Clinical Research Physician. Lilly Research Laboratories. Indianápolis. Indiana. USA. 4 MD. Uroginecólogo. Senior Medical Fellow. Lilly Research Laboratories. Indianápolis. Indiana.USA Leñero E y cols. Neurofisiología del tracto urinario inferior y de la continencia urinaria. INTRODUCCIÓN Los síntomas del tracto urinario inferior (STUI) y, en especial la incontinencia urinaria, alteran la calidad de vida de muchas mujeres y hombres; sin embargo, los pacientes incontinentes parecen aceptar sus síntomas durante años antes de consultar con su médico.1 Un porcentaje innecesariamente alto de los que acuden a su médico es remitido al especialista para su evaluación y tratamiento.2 Esta circunstancia no es la ideal, ya que con los conocimientos básicos del tracto urinario inferior, la incontinencia urinaria puede ser tratada en el marco de la asistencia primaria. Para mantener la continencia urinaria se precisa la integridad anatómica de las estructuras de la uretra y periuretrales, una correcta posición del cuello vesical, así como una inervación intacta del tracto urinario inferior. Los sistemas nerviosos central y periférico autónomo y somático coordinan el llenado y el vaciado vesical mediante acciones inhibidoras y facilitadoras. Ciertos neurotransmisores juegan un papel destacado en esta función. Actualmente, se están investigando nuevas alternativas farmacológicas para el tratamiento de la incontinencia urinaria de urgencia (IUU) y para el de la incontinencia urinaria de esfuerzo (IUE).3,4 Para comprender el mecanismo de acción de estos fármacos es fundamental disponer de conocimientos básicos de la anatomía y fisiología del tracto urinario inferior. El objetivo de este artículo es revisar en forma sencilla y actualizada la neurofisiología del tracto urinario inferior y de la continencia. TRACTO URINARIO INFERIOR: LA VEJIGA, LA URETRA Y LOS MÚSCULOS URETRALES El tracto urinario inferior (TUI) es una unidad funcional compuesta por la vejiga y la uretra, responsable del almacenamiento y el vaciamiento urinario. La vejiga urinaria es un órgano muscular hueco compuesto de fibras musculares lisas (músculo detrusor) que se extienden en diversas direcciones, lo que le permite distenderse durante el llenado vesical y contraerse durante el vaciado. La capa muscular lisa se extiende desde el detrusor hacia el cuello vesical, finalizando en la parte proximal de la uretra. La uretra es un tubo fibromuscular de longitud variable según el sexo y cuyas funciones principales son, entre otras, conducir la orina desde la vejiga hasta el meato externo y participar en la continencia urinaria. La pared uretral está formada por una capa muscular interna de fibras lisas, una capa externa de fibras musculares estriadas, que constituyen el denominado rabdoesfínter –también llamado esfínter estriado uretral o esfínter uretral externo– (Figura 1) y otros elementos no musculares como la mucosa, los vasos submucosos y el tejido conectivo. Los músculos lisos uretrales son principalmente longitudinales y con su actividad pueden aumentar o disminuir la luz uretral durante el vaciado voluntario. Asimismo, existe una vaina muscular lisa exterior, circular y más delgada que proporciona un cierto tono basal durante el llenado.5 El músculo liso uretral se prolonga en sentido descendente (caudal) ocupando casi toda la longitud uretral. El músculo estriado de la uretra o rabdoesfínter alcanza su máximo grosor en los dos tercios centrales de la uretra, mientras que en sentido distal y proximal adopta forma de herradura y se entremezcla en la parte posterior con tejido conjuntivo de la pared anterior de la vagina.6 Además de las estructuras musculares mencionadas, la mucosa uretral, el plexo vascular submucoso y el tejido conjuntivo colágeno y elástico uretral también contribuyen a mantener la continencia. Los músculos del suelo pélvico, fundamentalmente el elevador del ano y el coccígeo, juegan también un destacado papel en la continencia. Estos músculos forman una especie de “hamaca”, entre el pubis en la parte anterior de la pelvis y el cóccix en la parte posterior, que soporta y mantiene la posición de los órganos pélvicos. Por delante se unen a la pared vaginal anterior, permitiendo así, al contraerse, comprimir la uretra contra la pared vaginal y evitar la pérdida de orina. El suelo pélvico ayuda a contrarrestar la tendencia del cuello vesical a desplazarse hacia abajo cuando determinadas actividades físicas como correr, saltar, toser o estornudar producen un incremento brusco de la presión abdominal. La contracción consciente de estos músculos ayuda a elevar y estabilizar la pared vaginal anterior y la uretra. Rev Mex Urol 2007; 67(3): 154-159 155 Leñero E y cols. Neurofisiología del tracto urinario inferior y de la continencia urinaria. Uréteres Corteza cerebral Vejiga urinaria Cuerpo Trígono Cuello Esfínter estriado uretral Suelo pélvico Músculo liso uretral Centro de micción protuberancial Región dorsal Simpático Vejiga (músculo detrusor) Fibras nervio hipogástrico Músculo liso uretral Parasimpático Figura 1. Los tipos de músculo en la vejiga, uretra y el suelo pélvico. Vejiga (músculo detrusor) Región lumbar Cuando la presión de cierre uretral, ejercida fundamentalmente por el esfínter uretral externo, es insuficiente o va acompañada de un exceso de movilidad del cuello vesical; por ejemplo, secundaria a la debilidad del suelo pélvico, un incremento súbito de la presión abdominal provocado por actividades como correr, toser, estornudar o incluso reír, pueden desencadenar la pérdida de orina, denominándose así como incontinencia urinaria de esfuerzo (IUE). EL SISTEMA NERVIOSO CENTRAL Varios centros en el cerebro, como la corteza cerebral y el centro miccional pontino, así como la médula espinal, están involucrados en la fisiología de la micción. La corteza es el área del cerebro que interviene en la conciencia y el pensamiento y participa tanto en la percepción consciente de la necesidad de orinar como en la decisión final de posponer o iniciar el vaciado al regular la actividad del centro miccional pontino y estimulando la contracción voluntaria del rabdoesfínter uretral y del músculo elevador del ano. El centro de la micción protuberancial o pontino coordina la contracción del músculo detrusor y la relajación del esfínter estriado de la uretra durante el vaciado vesical y funciona de modo autónomo desde el nacimiento hasta la infancia temprana, cuando el desarrollo cortical permite suprimir voluntariamente la actividad del detrusor. 156 Rev Mex Urol 2007; 67(3): 154-159 Región sacra Fibras nervio pélvico Somático Fibras nervio pudendo Fibras nervio sacro Esfínter uretral estriado Músculo estriado del suelo pélvico Figura 2. La inervación de la vejiga, uretra y del suelo pélvico. Todos los impulsos que llegan a la vejiga se transmiten a través de nervios que se originan en el segmento simpático dorsolumbar y los segmentos parasimpáticos y somáticos sacros de la médula espinal (Figura 2). La médula sirve también como estación procesadora de la información sensitiva de la vejiga, la uretra y el suelo pélvico. EL SISTEMA NERVIOSO PERIFÉRICO El sistema nervioso periférico está formado por los sistemas simpático, parasimpático y somático. El sistema simpático inerva el músculo detrusor de la vejiga, el cuello vesical y la musculatura uretral lisa a través del nervio hipogástrico con la noradrenalina como neurotransmisor. El sistema parasimpático también inerva el músculo detrusor por el nervio pélvico utilizando la acetilcolina como neurotransmisor (Figura 2). Por su parte, el sistema somático inerva el esfínter estriado uretral a través del nervio pudendo, mientras Leñero E y cols. Neurofisiología del tracto urinario inferior y de la continencia urinaria. que fibras sacras directas inervan el músculo elevador del ano con la acetilcolina como neurotransmisor implicado en ambos casos (Figura 2).7 Los sistemas simpático y somático favorecen el llenado vesical, mientras que el parasimpático favorece el vaciado. Estos mismos nervios simpáticos, parasimpáticos o somáticos que inervan la zona con fibras eferentes también funcionan como aferentes sensitivos, llevando a la médula espinal la información de las áreas inervadas. Los estímulos sensitivos incluyen receptores de dilatación, tensión, fricción, proprioceptivos y nociceptivos. La lesión de las fibras proprioceptivas del suelo pélvico puede ser responsable de que algunas mujeres sean incapaces de realizar un entrenamiento correcto de los músculos del suelo pélvico.8 LLENADO VESICAL Cuando la vejiga empieza a llenarse de orina, los receptores de presión localizados en la pared vesical generan impulsos nerviosos que se transmiten por fibras sensitivas al sistema nervioso central (SNC). Estos impulsos aferentes provocan una activación refleja del núcleo simpático, un conjunto de neuronas localizadas en la médula lumbar superior, el cual envía impulsos a través del nervio hipogástrico a la vejiga y a la uretra donde libera el neurotransmisor noradrenalina. En la vejiga, la noradrenalina estimula los receptores betaadrenérgicos del músculo detrusor, provocando una relajación del mismo y facilitando por tanto el llenado vesical sin incrementar la presión. En el músculo liso uretral, la noradrenalina estimula los receptores alfa1-adrenérgicos, provocando su contracción; además, durante el llenado vesical, existe una actividad tónica del rabdoesfínter uretral. Esta actividad puede incrementarse mediante la contracción voluntaria o conciente del rabdoesfínter. En resumen, si el músculo detrusor se relaja y los músculos lisos y estriados uretrales se contraen, la presión uretral se mantiene por encima de la presión vesical, facilitando así el llenado vesical y evitando la pérdida de orina. Un exceso de actividad no controlado del músculo detrusor durante la fase de llenado –detrusor hiperactivo–, es el responsable de la incontinencia urinaria de urgencia (IUU). Varios medicamentos que inhiben el efecto de la acetilcolina sobre los receptores muscarínicos del músculo detrusor de la vejiga se han mostrado eficaces en el tratamiento de la IUU. VACIAMIENTO VESICAL El vaciamiento vesical normal es el resultado de una actividad nerviosa voluntaria e involuntaria. Cuando la vejiga alcanza un determinado volumen, esta información se transmite a la médula espinal, al centro miccional pontino y a la corteza cerebral. Si la situación es la adecuada y conscientemente se decide iniciar el vaciamiento, el centro miccional pontino activa el núcleo parasimpático medular sacro el cual, a través del nervio pélvico, induce la contracción del músculo detrusor mediante la liberación de acetilcolina que estimula los receptores muscarínicos vesicales. El centro miccional pontino también envía impulsos al núcleo motor pudendo, inhibiendo la actividad del nervio pudendo y relajando el rabdoesfínter uretral. Ambas acciones (la contracción del detrusor y la relajación del esfínter uretral), ocurren en forma coordinada. Asimismo, los impulsos protuberanciales inhiben la actividad simpática en la vejiga y la uretra. El efecto neto es que la presión vesical aumenta debido a la contracción del músculo detrusor, mientras que la presión uretral disminuye debido a la relajación del rabdoesfínter, lo que permite el vaciado. En caso de que se decida voluntariamente posponer el vaciado vesical, la corteza cerebral actúa de la siguiente forma: 1) enviando señales al tracto urinario inferior para contraer el rabdoesfínter y el elevador del ano y evitar así la micción y la pérdida de orina; y 2) inhibiendo los impulsos facilitadores parasimpáticos del centro miccional pontino que normalmente provocan la micción. Si bien por lo general se puede posponer temporalmente la necesidad imperiosa de orinar, a medida que se acumula más orina, la sensación de micción imperiosa se vuelve irresistible y se produce la micción. Tras el vaciamiento, un nuevo ciclo miccional comienza con la acumulación progresiva de orina en la vejiga. Rev Mex Urol 2007; 67(3): 154-159 157 Leñero E y cols. Neurofisiología del tracto urinario inferior y de la continencia urinaria. NEUROFISIOLOGÍA DE LA CONTINENCIA Como hemos apuntado anteriormente, la continencia urinaria es el resultado de una adecuada coordinación en las funciones de llenado y vaciado del tracto urinario inferior. Las principales estructuras involucradas en la continencia son el músculo detrusor de la vejiga, los músculos liso y, fundamentalmente el estriado o radboesfínter de la uretra y los músculos del suelo pélvico. A continuación explicaremos en forma más detallada la neurofisiología de la continencia. CONTRACCIÓN DEL RABDOESFÍNTER URETRAL El rabdoesfínter uretral y el esfínter anal externo son inervados por el nervio pudendo. El nervio pudendo estimula la contracción de estos músculos a través del neurotransmisor acetilcolina que estimula receptores nicotínicos. Las fibras motoras del nervio pudendo surgen de una pequeña zona situada en el área ventral de la médula espinal sacra denominada núcleo de Onuf. En este núcleo hacen también sinapsis tractos nerviosos procedentes de centros superiores del sistema nervioso central (médula y locus ceruleus) los cuales utilizan a la serotonina y a la noradrenalina como neurotransmisores. Existe además otro neurotransmisor, el glutamato, cuyo papel se considera crucial en el inicio de la actividad del nervio pudendo a nivel del núcleo de Onuf. Por lo tanto, son tres los neurotransmisores liberados en el núcleo de Onuf: serotonina, noradrenalina y glutamato; así como un cuarto neurotransmisor: la acetilcolina, que es liberada por el nervio pudendo a nivel distal y estimula los receptores nicotínicos del rabdoesfínter uretral y el esfínter anal externo, provocando su contracción. ¿Cómo interactúan estos neurotransmisores? En primer lugar, la presencia de glutamato es obligatoria para iniciar la activación del nervio pudendo. En presencia de glutamato, la serotonina y la noradrenalina, actuando a nivel del extremo proximal del nervio pudendo mediante la estimulación de los cuerpos celulares de las motoneuronas, amplifican la señal generada. Finalmente, la acetilcolina actúa a nivel del extremo distal del nervio pudendo donde su liberación provoca la contracción del rabdoesfínter. Al aumentar la actividad pudenda en el núcleo de Onuf y provocar de esta manera una contracción 158 Rev Mex Urol 2007; 67(3): 154-159 más intensa del rabdoesfínter uretral, se puede evitar la IUE. Se cree que el aumento de los neurotransmisores noradrenalina y serotonina a nivel del núcleo de Onuf, potencia la actividad pudenda y, por lo tanto, favorecen la continencia. En la actualidad, se están estudiando nuevos medicamentos con este mecanismo de acción para tratar a mujeres con IUE. Los resultados son prometedores.9-13 CONTRACCIÓN DEL SUELO PÉLVICO El músculo elevador del ano recibe inervación directa de los nervios sacros, los cuales, a través de la acetilcolina estimulan los receptores nicotínicos del músculo, produciendo su contracción.4 Una debilidad o contracción insuficiente del suelo pélvico es un factor importante involucrado en la incontinencia urinaria de esfuerzo. INHIBICIÓN DE LA ACTIVIDAD PARASIMPÁTICA Para mantener la continencia, al mismo tiempo que el rabdoesfínter y el elevador del ano reciben estímulos que provocan su contracción, impulsos inhibidores son transmitidos por el nervio hipogástrico para inhibir la contracción del músculo detrusor. El efecto neto de esta actividad neural es un aumento de la presión uretral con la contracción del rabdoesfínter uretral y del elevador del ano, al tiempo que disminuye la presión vesical con la relajación del músculo detrusor. Esto evita la salida de orina de la vejiga y, por lo tanto, mantiene la continencia. BIBLIOGRAFÍA 1. Toozs-Hobson P, Cardozo L. Family Doctor Guide to Urinary Incontinence in Women. London: Dorling Kindersley Limited, 1990. 2. Lose G, Jacobsen AT, Madsen H, Thorsen P, Tibaek S, Johansen B. Alment praktiserende laegers vide nom og holdninger til undersogelse og behandling af kvinder med urininkontinens. (General practitioner’s knowledge about and attitudes towards assessment and treatment of women with urinary incontinence). Ugerskr Laeger. 2001;163:5183-8. 3. De Groat WC, Yoshimura N. Pharmacology of the lower urinary tract. Ann Rev Pharmacol Toxicol. 2001;41:691-721. Leñero E y cols. Neurofisiología del tracto urinario inferior y de la continencia urinaria. 4. Yoshimura N, De groat WC. Neural control of the lower urinary tract. Int J Urol. 1997;4:111-25. function in the chloralose-anesthetized female cat. J Pharmacol Exp Ther. 1995:274:1014-24. 5. Lose G. Simultaneous recording of the pressure and cross sectional area in the female urethra: a study of urethral closure function in healthy and stress urinary incontinent women. Neurol Urodyn. 1992;11: 5589. 10. Peggy A Norton, Norman R Zinner, Ilker Yalcin, Richard Bump. Duloxetine versus placebo in the treatment of stress urinary incontinence. Am J Obstet Gynecol. 2002;187:40-8. 6. Thind P. The significance of smooth and striated muscles in the sphincter function of the urethra in healthy women. Neurol Urodyn 1995;14:585-618. 7. Barber MD, Bremer RE, Thor KB, Dolber PC, Kuehl TJ, Coates KW. Innervation of the female levator ani muscles. Am J Obstert Gynecol. 2002:2-29. 8. Viktrup L. The risk of lower urinary tract symptoms 5 years after the first delivery. Neurourol Urodyn. 2002; 21:2-29. 9. Thor KB, Katofiasc MA. Effects of Duloxetine, a combined serotonin and norepinephrine reuptake inhibitor on central neural control of lower urinary tract 11. Van Kerrebroeck P, Abrams P, Lange R, Slack M, Wyndaele J.J, Yalcin I, Bump R. Duloxetine versus placebo in the treatment of European and Canadian women with stress urinary incontinence. BJOG. 2004;111:249-57. 12. Millard RJ, Moore K, Rencken R, Yalcin I, Bump R. Duloxetine versus placebo in the treatment of stress urinary incontinence: a four continent randomized clinical trial. BJU Int. 2004;93:311-8. 13. Dmochowski R, Miklos JR, Norton P, Zinner N R, Yalcin I, Bump R. Duloxetine versus placebo for the treatment of North American women with stress Urinary Incontinence. J Urol. 2003;170:1259-63. Rev Mex Urol 2007; 67(3): 154-159 159 CASO CLÍNICO Leiomiosarcoma adrenal primario. Presentación de un caso y revisión de la literatura Camarena H.,1 Cantellano M.,1 Reyes M.,1 Shuck C.,1 Leos C.A.,1 Vázquez L.S.,1 Morales J.G.,1 Pacheco C.G.,1 Calderón F.1 RESUMEN SUMMARY Existen pocos casos de leiomiosarcomas adrenales confirmados como primarios reportados en la literatura mundial. Reportamos el caso de un paciente femenino de 65 años, con hipertensión arterial de difícil control y dolor abdominal en flanco izquierdo, a quien se le diagnosticó un tumor adrenal confirmado por ultrasonido, tomografía y resonancia. Se le realizó adrenalectomía abierta izquierda, así como resección del tumor. El estudio histopatológico reportó leiomiosarcoma adrenal primario de alto grado de malignidad. El leiomiosarcoma adrenal primario es un tumor poco frecuente, por lo general asintomático y hallazgo radiológico incidental. Su diagnóstico definitivo es histopatológico. En general no existe un tratamiento internacionalmente aceptado por su baja incidencia; sin embargo, lo más recomendado es la resección total de la neoplasia y un seguimiento estricto de los pacientes. Very few adrenal leimyosarcomas had been described in literature, and confirmed as primary tumors. We report a case of a 65 year-old woman, with systemic hypertension, and abdominal pain in the left flank, with diagnosis of adrenal mass confirmed by abdominal ultrasound, tomography and magnetic resonance. She was treated with open adrenalectomy. The pathologic report revealed a highly grade primary adrenal leimyosarcoma. This is very rare tumor, generally asymptomatic, and a radiological finding. Usually the final diagnosis is pathological. Since no treatment has been internationally accepted, we recommend total resection of the tumor and a strict follow up of the patients. Palabras clave: leiomiosarcorma adrenal primario, tumor de la glándula suprarrenal. 1 Divisiones de Urología y Patología del Hospital General “Dr. Manuel Gea González”, México, D.F. Correspondencia: División de Urología, Hospital General “Dr. Manuel Gea González”, Secretaría de Salud, México D.F. Calzada de Tlalpan 4800, Col. Toriello Guerra, Delegación Tlalpan, C.P. 14000 Tel.: 5665-3511; fax: 5665-7681. 160 Rev Mex Urol 2007; 67(3): 160-164 Key words: primary adrenal leiomiosarcoma, tumor of the adrenal gland. Camarena H y cols. Leiomiosarcoma adrenal primario. OBJETIVO Presentar un caso de leiomiosarcoma suprarrenal de alto grado de malignidad y revisar la literatura respecto al tema. INTRODUCCIÓN Los tumores de tejidos blandos son proliferaciones mesenquimatosas, extraesqueléticas, en tejidos no epiteliales, excluyendo a vísceras, meninges y sistema linforeticular. Se clasifican según el tejido que afectan (músculo, grasa, tejido fibroso, vasos sanguíneos o nervios).1 Se presentan en 40% en extremidades inferiores, 20% en extremidades superiores, 10% en cabeza y cuello, y 30% en tórax y retroperitoneo. Su incidencia es difícil de determinar, ya que muchas lesiones benignas nunca se operan. Se estima que la relación entre lesiones benignas y malignas es de 100:1. En Estados Unidos se diagnostican aproximadamente 8000 sarcomas por año (0.8% de neoplasias invasivas) causando 2% de todas las muertes por cáncer.1 El comportamiento tumoral dependerá del grado de diferenciación, número de mitosis, celularidad, pleomorfismo, extensión de necrosis tumoral, tamaño, profundidad y etapa tumoral.2-4 Los sarcomas de alto grado tienen un riesgo de enfermedad metastásica de 80% cuando el tumor mide más de 20 cm y de 30% cuando mide más de 5 cm, siendo los sitios más frecuentes hígado, pulmón y hueso. En general, la sobrevida reportada a 10 años es de 40%.1,3,4 PRESENTACIÓN DEL CASO Paciente femenino de 65 años, originaria y residente de Oaxaca, con antecedente de hipertensión arterial de un año de evolución de difícil control. Inicia su padecimiento cuatro meses previos a su ingreso al presentar dolor abdominal tipo cólico, de intensidad progresiva hasta 10/10 en flanco izquierdo, sin irradiaciones con náusea y vómito asociado. A la exploración física se observa giordano izquierdo, sin masas ni visceromegalias palpables. A su ingreso el examen general de orina reporta leucocituria. El ultrasonido renal con masa hipoecoica de 3.71 cm, medial al polo superior izquierdo (Figura 1). La tomografía abdominal muestra lesión dependiente de la suprarrenal izquierda, homogénea e hipercaptante de 3.6 x 5 cm (Figura 2). La resonancia magnética confirma masa hiperintensa en T2 (Figura 3). No involucra estructuras adyacentes. Se realizan perfiles hormonales y estudios especiales en sangre y orina descartando tumor funcional. Se realiza adrenalectomía por lumbotomía izquierda, con control vascular adrenal y disección de estructuras adyacentes. Sin complicaciones transoperatorias o postoperatorias. El estudio histopatológico reporta leiomiosarcoma adrenal primario de alto grado de malignidad (Figuras 4-7). CASUÍSTICA Las neoplasias primarias del mesénquima adrenal pueden ser benignas, entre las que se encuentran los hemangiomas cavernosos, hemangiomas capilares, lipomas, neurofibromas, tumores adenomatoides y leiomiomas de venas adrenales, o malignas como los sarcomas.2,3 Entre los sarcomas que se originan en la glándula suprarrenal se han descrito: angiosarcomas, leiomiosarcomas y tumores malignos de vaina nerviosa periférica. Los leiomiosarcomas adrenales son poco frecuentes y existen pocos casos reportados en la literatura mundial, de los cuales tres se han asociado con el síndrome de inmunodeficiencia adquirida.2,5-8 En la literatura revisada no se encontró ningún otro factor etiológico común entre los casos. COMENTARIO El rango de edad de los pacientes varía de 29 a 68 años, sin una predilección por el género. El tamaño tumoral reportado en los diversos casos va de 0.8 a 25 cm., tampoco existe predominio de lado afectado.5 En el actual caso, la edad de la paciente era de 65 años, el leiomiosarcoma dependía de la suprarrenal izquierda y media 5.5 cm en su diámetro mayor, con un peso de 75 g. Por lo general, la presentación clínica se caracteriza por masas firmes, de grandes dimensiones, asintomáticas. Cuando llegan a causar síntomas, éstos son secundarios a compresión, siendo el más frecuente el dolor (10 a 60%).9-11 En los casos reportados, sólo uno presentó hemorragia espontánea.12 Comúnmente son hallazgos radiológicos incidentales. Rev Mex Urol 2007; 67(3): 160-164 161 Camarena H y cols. Leiomiosarcoma adrenal primario. Figura 3. La resonancia magnética confirma masa hiperintensa en T2. No involucra estructuras adyacentes. Figura 1. US renal masa hipoecóica de 3.71 cm, medial al polo superior del riñón izquierdo. Figura 4. Superficie externa del tumor, multilobulado, bien delimitado, que comprime la glándula suprarrenal. Figura 2. TAC simple y contrasta muestra de lesión dependiente de la suprarrenal izquierda, homogénea e hipercaptante de 3.6 x 5 cm. Figura 5. Haces de células fusiformes con varias mitosis (40x). 162 Rev Mex Urol 2007; 67(3): 160-164 Camarena H y cols. Leiomiosarcoma adrenal primario. Figura 6. Células de leiomiosarcoma con atipia y pleomorfismo (40x). Figura 7. Células neoplásicas intensamente positivas para actina alfa de músculo liso. DISCUSIÓN El diagnóstico diferencial de estos tumores se lleva a cabo con otras neoplasias de células fusiformes como carcinoma metastásico, histiocitoma fibroso maligno, carcinoma renal sarcomatoide, melanoma maligno, tumores del estroma gastrointestinal, rabdomiosarcoma pleomórfico, fibrosarcoma y leiomiosarcoma retroperitoneal.10 El diagnóstico definitivo es patológico, la mayoría de los casos muestran una proliferación de haces entrecruzados de células fusiformes, con pleomorfismo nuclear de moderado a intenso (en forma de cigarro) e índice mitótico que varia de 5 a 15 mitosis por 10 campos de gran aumento.5 Se ha llegado a reportar necrosis y hemorragia.12 En relación con inmunohistoquímica se han reportado anticuerpos a vimentina, actina, actina alfa de músculo liso y desmina.1 En el caso de nuestra paciente se observaron haces de células fusiformes con múltiples mitosis, atipia y pleomorfismo, intensamente positivas para actina alfa de músculo liso, lo que nos sugiere un origen vascular de la neoplasia. El origen de los leiomiosarcomas primarios adrenales no se ha determinado. En la literatura mundial se ha propuesto que éstos se originan del músculo liso de las paredes de los vasos, en específico con las venas adrenales.10,13,14 Algunos casos se han asociado con infección por virus de Epstein Barr en pacientes inmuno- comprometidos. Para su estatificación se ha utilizado el TNM para sarcomas.15 La base del tratamiento es quirúrgica con la completa resección del tumor. Se ha reportado la utilización de quimioterapia (antraciclina, ifosfamida, y doxorrubicina).3,8,9,11 En dos casos se reportó la utilización de cirugía y radioterapia.5,11 En general, la evolución de los pacientes es mala con una mortalidad aproximada de 50%. Nuestra paciente ha evolucionado satisfactoriamente a 12 meses de seguimiento, sin datos de actividad tumoral clínico radiológica. CONCLUSIONES El leiomiosarcoma adrenal primario es un tumor poco frecuente, por lo general asintomático y hallazgo radiológico incidental. Su diagnóstico definitivo es histopatológico. Asimismo, no existe un tratamiento internacionalmente aceptado por su baja incidencia; sin embargo, lo más recomendado es la resección total de la neoplasia y un seguimiento estricto de los pacientes. BIBLIOGRAFÍA 1. Angervall L, Kindblom LG. Principles for pathologicanatomic diagnosis and classification of soft-tissue sarcomas. Clin Orthop Relat Rest. 1993;289:9-18. Rev Mex Urol 2007; 67(3): 160-164 163 Camarena H y cols. Leiomiosarcoma adrenal primario. 2. Zetler PJ, Filipenko JD, Bilbey JH, Schmidt N. Primary adrenal leiomyosarcoma in a man with acquired immunodeficiency syndrome (AIDS). Arch Pathol Lab Med. 1996;120(9):797-8. 3. Lack EE, Graham CE, Azumi N, Bitterman P, et al. Primary leiomyosarcoma of adrenal gland. Case report with immunohistochemical and ultrastructural study. Am J Surg Pathol. 1991;15(9)899-905. 4. Oliveira AM, Nascimento AG. Grading in soft tissue tumors: principles and problems. Skeletal Radiol. 2001;30:543-59. 5. Chablé FC, González MA, García MA, Onofre E. Leiomiosarcoma primario de la glándula suprarenal. Informe de un caso y revisión de la literatura. Patología. 2005;43(2):89-92. 6. Boman F, Gultekin H, Dickman PS. Latent Epstein-Barr virus infection demonstrated in low-grade leiomyosarcomas of adults with acquired immunodeficiency syndrome, but not in adjacent Kaposi´s lesion or smooth muscle tumors in immunocompetent patients. Arch Pathol Lab Med. 1997;121(8):834-8. 7. Balarezo FS, Joshi VV. Proliferative and neoplastic disorders in children with acquired immunodeficiency syndrome. Adv Anat Pathol. 2002;9(6): 360-70. 8. Lujan MG, Hoang MP. Pleomorphic leiomyosarcoma of the adrenal gland. Arch Pathol Lab Med. 2003;127(1):32-5. 164 Rev Mex Urol 2007; 67(3): 160-164 9. Thamboo TP, Liew LC, Rahu GC. Adrenal leiomyosarcoma: a case report and literature review. Pathology. 2003;35(1):47-9. 10. Choi SH, Liu K. Leiomyosarcoma of the adrenal gland and its angiographic features: a case report. J Surg Oncol. 1981;16(2):145-8. 11. Fernández JM, Huéscar AM, Ablanedo P, Rabade CJ, Pérez García FJ, Rodríguez Martínez JJ, Escaf S. Primary leiomyosarcoma: A rare tumor of the adrenal gland. Arch Esp Urol. 1998;51(10):1029-31. 12. Nakaishi M, Iseda T, Nishio S, et al. Spontaneous retroperitoneal hemorrhage from an adrenal leiomyisarcoma. Nishinihon. J Urol. 1999;61:466-7. 13. Matsui Y, Fujikawa K, Oka H, Fukuzawa S, Takeuchi H. Adrenal leiomyosarcoma extending into right atrium. Int J Urol. 2002;9(1):54-6. 14. Kato T, Kato T, Sakamoto S, Kobayashi T, Ikeda R, Nakamura T, Akakura K, Hikage T, Inoue T. Primary adrenal leiomyosarcoma with inferior vena cava thrombosis. Int J Clin Oncol. 2004;9(3):189-92. 15. Cesari S, Avventi P, et al. A case of adrenal vein leiomyosarcoma: Role of percutaneous biopsy. Radiol Med. 1992;84(4):481-3. CASO CLÍNICO Necrosis escrotal y gangrena de Fournier en un paciente con leucemia aguda. Presentación de un caso y revisión de la literatura Flores Terrazas J.E.,1 Varela Hernández P.E.,1 Ovilla Martínez R.1 RESUMEN SUMMARY Antecedentes: La gangrena de Fournier es una enfermedad que, para disminuir su mortalidad, requiere de un diagnóstico oportuno y una terapéutica multidisciplinaria rápida y agresiva. Objetivo: Informar de un caso de necrosis escrotal en un paciente con leucemia mieloblástica aguda (LMA) que recibió trasplante de medula ósea. Material y métodos (informe del caso): Paciente obeso con leucemia mieloblástica aguda postrasplantado de medula ósea que cursa con necrosis escrotal con hemocultivo positivo a Pseudomona aeruginosa, recibe antibióticos de amplio espectro y se realiza desbridación quirúrgica más dos limpiezas quirúrgicas posteriores, un cierre secundario y aplicación de un injerto libre de piel en herida de la base del pene. Resultados: Durante la debridación no se observó pus, presentó vasos subcutáneos trombosados y tejido resecado estéril, evolucionó con herida quirúrgica limpia que ameritó la rotación de colgajos mediante un cierre secundario y después un tercer cierre de una herida de la raíz del pene. El paciente evoluciona con depresión, desarrolla encefalopatía y fallece. Background: Fournier’s gangrene requires an early diagnosis and an aggressive treatment in order to reduce its mortality. Objective: We inform a case of Fournier’s gangrene in a patient with acute myeloblastic leukemia. Matherial and methods: We present the case of a post bone marrow transplanted patient due to acute myeloblastic leukemia that presented with scrotal necrosis. Results: Surgical debridment of the scrotal necrosis was performed with secondary closure with a flap rotation and free graft. The patient developed encephalopathy and died. Discussion: Fournier’s gangrene is a disease with a high mortality rate. Conclusion: Fournier’s gangrene requires early diagnosis, wide spread antibiotic treatment and early surgery. Key words: Fournier’s gangrene, scrotal necrosis. 1 Centro Hospitalario del Estado Mayor Presidencial; Hospital Ángeles Lomas. Rev Mex Urol 2007; 67(3): 165-169 165 Flores TJE y cols. Necrosis escrotal y gangrena de Fournier en un paciente con leucemia aguda. Discusión: La gangrena de Fournier es una enfermedad con una alta tasa de mortalidad. Conclusiones: La gangrena de Fournier requiere de un diagnóstico oportuno y un abordaje quirúrgico rápido, así como el empleo de antibióticos de amplio espectro. Palabras clave: gangrena de Fournier, necrosis escrotal. INTRODUCCIÓN La gangrena de Fournier es una enfermedad conocida por el epónimo acreditado a un dermatólogo y venereólogo, el profesor Jean-Alfred Fournier (18321914);1 sin embargo, hasta el momento su definición continúa siendo controversial debido a que el proceso patológico básico es la fascitis necrotizante, por lo que también es conocido como fascitis necrotizante de las regiones perineal, genital o perianal o como infección necrotizante de tejidos blandos y flegmón periuretral, entre otros.2-5 Las principales fuentes de sepsis son la piel, colon, ano y recto y el tracto urinario bajo; las fuentes colo-ano-rectales son las que ofrecen un peor pronóstico. La gangrena de Fournier se presenta con mayor frecuencia en hombres con una relación 10:1.6 Asimismo, las lesiones asociadas del tracto urinario con gangrena de Fournier incluyen abscesos renales, cálculos uretrales y estenosis uretral. Las lesiones intestinales son el foco más común e incluyen apendicitis perforada, carcinoma del colon y diverticulitis;7 la distribución por las fuentes de sepsis en diversas series reportan los siguientes porcentajes: dermatológico 24%, colorectal 21%, urológicas 19% e idiopática 36%.8,9 Entre 10 y 60% de los casos se pueden observar enfermedades asociadas como la diabetes mellitus, alcoholismo, leucemias, inmunodeficiencia humana por virus del VIH, en donde el común denominador es la inmunodepresión. La enfermedad clásica se confirma con cultivos bacterianos positivos –que por lo general son polimicrobianos aerobios y anaerobios con comensales que se encuentran por debajo del diafragma pélvico en el perineo y genitales–, los cuales incluyen clostridios, klebsiella, estreptococos, coliformes, estafilococos, bacteroides y corinebacterias. Su actividad oportunista y sinérgica es devastadora en la fascitis necrotizante, donde se producen exotoxinas que resultan en necrosis y síntesis de gases que produce la crepitación patognomónica de una infección anaeróbica ocasionando una grave infección bacteriana supura166 Rev Mex Urol 2007; 67(3): 165-169 tiva del área genital, perineal o perirectal, lo cual a su vez provoca trombosis de los pequeños vasos subcutáneos y el desarrollo de gangrena en la piel, derivando en mionecrósis en una extensión más profunda.1,9 Cuando existe bacteriemia monomicrobiana, el pronóstico de esta enfermedad es sombrío. La presentación original de la gangrena de Fournier es agudo; sin embargo, se cree que puede ser insidiosa. Cuando afecta al escroto, la piel, el tejido subcutáneo la fascia y el dartos se convierten en una gran masa purulenta y fétida, aunque por lo general, los testículos no son afectados. El diagnóstico es clínico y el tratamiento incluye una resucitación urgente con líquidos parenterales. Se puede requerir transfusión sanguínea y antibióticos en triple esquema; la penicilina es recomendada para estreptococo y clostridios, mientras que para anaerobios se recomienda metronidazol, y para coliformes y estafilococos se sugiere una cefalosporina de tercera generación. Asimismo, se recomienda alimentación artificial pero sobre todo una desbridación amplia del tejido necrótico, removiendo todo el tejido no viable;5,10 se deben realizar las limpiezas y debridaciones quirúrgicas necesarias para evitar la continuación de la necrosis y favorecer la granulación adecuada del tejido.1 El oxígeno hiperbárico puede ser un tratamiento adyuvante.5,11 Por su parte, las complicaciones de la gangrena de Fournier pueden incluir abscesos testiculares, pérdida del tejido peneano, cetoacidosis (que puede complicar la diabetes mellitus y afectar la fertilidad y la libido), se puede presentar un tétanos fatal, existe la posibilidad de ocurrir un carcinoma de células escamosas en la cicatriz y por último, la situación cosmética se ve afectada. La mortalidad de esta enfermedad varía entre 3 y 45%.12 Un pronóstico pobre se asocia con pacientes de mayor edad, inmunosupresión, diabetes mellitus, alcoholismo, pacientes con colostomía y retraso en el tratamiento. Flores TJE y cols. Necrosis escrotal y gangrena de Fournier en un paciente con leucemia aguda. Figura 1. Escroto con edema y cambios en la coloración de la piel. Figura 2. Necrosis escrotal. Figura 3. Desbridación de necrosis escrotal: 1) trombosis de vasos subcutáneos. REPORTE DEL CASO Se trata de un paciente masculino de 38 años de edad, obeso, con antecedente de haber estado en contacto con insecticidas; desarrolló leucemia mieloblástica aguda y recibió trasplante alogénico de células progenitoras hematopoyéticas, previa inmunosupresión con base en irradiación corporal total 1300 cgy más ciclofosfamida 120 mg/kg, más globulina anti-timocito 30mg/kg por tres días, y como profilaxis inmunosupresora recibió ciclosporina y metilprednisolona. Como antecedentes presentó: serologia positiva para citomegalovirus IgG, virus de la hepatitis a y virus Epstein Barr. Posterior al régimen de acondicionamiento fue trasplantado con células progenitoras hematopoyéticas histocompatibles provenientes de su hermano. Inicia con hiperglicemias recibiendo manejo bajo esquema de insulina, evoluciona con edema de extremidades inferiores, alteración de las pruebas de función hepática leves, fiebre de 38°C, diez días después del trasplante desarrolla edema escrotal con eritema (Figura 1). Se suspende ofloxacina e inicia tratamiento con imipenem más vancomicina; además, se realiza ultrasonido testicular sin evidencia de gas ni colecciones escrotales; un hemocultivo fue positivo a Pseudomona aeruginosa sensible a imipenem ya instalado, evolucionando la piel del escroto en 24 horas con cambios en la coloración y descamación tornándose rojo-violácea. Posteriormente se reduce el dolor y el edema y aparece necrosis en la piel escrotal (Figura 2). El paciente continúa con pancitopenia recibiendo concentrados plaquetarios y eritrocitarios, se realiza desbridación amplia del tejido necrótico (Figura 3) y después de dos limpiezas quirúrgicas se aprecia herida limpia y granulando (Figura 4). Posteriormente es valorado por cirugía plástica quien le realiza un cierre secundario de la herida escrotal mediante la rotación de colgajos (Figura 5), dejando una herida abierta en la porción dorsal de la base del pene, misma que sepués se maneja con la colocación de un injerto libre de piel. Se reporta un cultivo de piel escrotal positivo a Pseudomona y E. coli sensible a meropenem, mismo que se inicia y el paciente evoluciona hacia la mejoría, retirándose sonda de foley transuretral y se reducen los requerimientos transfusionales. El paciente egresa del hospital por mejoría a los 60 días postrasplante, manteniéndose como externo con antimicrobianos, con herida dorsal de la base del pene abierta y limpia. Reingresa para cierre definitivo de dicha herida a 80 días postrasplante y 70 días de la necrosis. Posteriormente inicia con fiebre e inflamación en el área de injerto con pérdida parcial del mismo. Un cultivo de la secreción revela Pseudomona aeruginosa y E. coli, se mantiene con curaciones constantes del sitio quirúrgico y manejo antimicrobiano, hasta el día +99 postrasplante cuando inicia con insomnio y posteriormente con hemiplejia derecha, una tomografía de cráneo evidencia infartos sépticos. El paciente fallece por septicemia con hemocultivos positivos para Pseudomona aeruginosa al día 101 postrasplante. Rev Mex Urol 2007; 67(3): 165-169 167 Flores TJE y cols. Necrosis escrotal y gangrena de Fournier en un paciente con leucemia aguda. Figura 4. Se observa herida limpia en fase de granulación. RESULTADOS Durante la desbridación quirúrgica del escroto no se observó secreción purulenta, la piel necrótica no era fétida y se visualizaron los vasos subcutáneos trombosados (Figura 3); el cultivo del tejido resecado se reportó sin desarrollo bacteriano. El paciente evolucionó con herida limpia después de las dos limpiezas quirúrgicas realizadas, pero con sangrados intermitentes debido a la trombocitopenia que ameritó la aplicación de vendajes compresivos posterior al cierre secundario con la rotación de colgajos, el paciente presentó un hematoma subcutáneo cultivándose Pseudomona aeruginosa y E. coli, sensible a imipenem, por lo que se le inició inmediatamente, observando una franca mejoría en la evolución de la herida y del paciente a tal grado que permitió retirar la insulina y a reiniciar la ciclosporina. El paciente reingresa para cierre definitivo de la herida con colocación de injerto, pero subsistió la infección por Pseudomona multirresistente y posteriormente evoluciona a septicemia por el mismo germen que lo conduce a la muerte. DISCUSIÓN A pesar de las controversias por la definición de la enfermedad y de los conceptos clásicos de la gangrena de Fournier, los padecimientos que culminan con la aparición de necrosis tisular tienden a desarrollar una fascitis inflamatoria previa. Llama la atención que a diferencia de los aspectos clásicos descritos en la gangrena de Fournier, en este 168 Rev Mex Urol 2007; 67(3): 165-169 Figura 5. Cierre secundario de herida escrotal con rotación de colgajos. paciente no se observó una necrosis purulenta y fétida; por el contrario, se trató de una necrosis seca, estéril e no fétida, pero con la presencia de vasos subcutáneos trombosados que también son observados en procesos sépticos. Este paciente sujeto a inmunosupresión por la leucemia y su tratamiento representó un gran reto en su manejo, debido a la facilidad con la cual pueden ser infectados hasta con microbios comensales. Por otro lado, la trombocitopenia puede ocasionar sangrados que muchas veces pueden ser fatales a pesar de las múltiples transfusiones de concentrados plaquetarios y eritrocitarios, ya que estos pueden consumirse rápidamente. En nuestro paciente se detecta un hemocultivo positivo monomicrobiano con Pseudomona aeruginosa, situación que pone en desventaja el Flores TJE y cols. Necrosis escrotal y gangrena de Fournier en un paciente con leucemia aguda. pronóstico. Posteriormente se presenta un proceso inflamatorio escrotal con la necrosis resultante. En ningún momento se identificó el foco séptico real, ya que nunca presentó problemas ano-colo-rectales ni genitourinarios, por lo que creemos que la piel escrotal pudo ser el inicio de este proceso. A pesar del diagnóstico oportuno y el manejo rápido y agresivo multidisciplinario en donde participaron las especialidades de hematología, cirugía plástica y urología, la evolución de nuestro paciente fue en lo general favorable, pero la persistencia y posterior multirresistencia de la Pseudomona fue el factor fatal. Con tristeza vimos que este caso pasó a formar parte de las estadísticas de mortalidad de los pacientes con gangrena de Fournier, la cual se describe hasta en 45%, pero debemos continuar atentos para establecer diagnósticos oportunos e iniciar rápidamente tratamientos agresivos. CONCLUSIONES La gangrena de Fournier es una enfermedad rara, pero con una tasa alta de mortalidad y se asocia con pacientes inmunodeprimidos. El diagnóstico oportuno y el establecimiento de un tratamiento rápido y agresivo disminuyen su mortalidad. No todos los casos de fascitis necrotizante se presentan con secreción purulenta y gas. BIBLIOGRAFÍA 1 Eke N. Fournier´s gangrene: A review of 1726 cases. B J Surgery. 2000;87(6):718-28. 2 Wilson B. Necrotizing fascitis. Am Surg. 1952;18:416-31. 3 Bubrick MP, Hitchcock CR. Necrotizing anorectal and perineal infections. Surgery. 1979;86:655-62. 4 Enríquez JM, Moreno S, Devesa M, Morales V, Platas A, Vicente E. Fournier´s syndrome of urogenital and anorectal origin. A retrospective, comparative study. Dis Colon Rectum. 1987;30:33-7. 5 Morpurgo E, Galandiuk S. Fournier´s gangrene. Surgical Clinics of North America. 2002;82(6):1213-24. 6 Stephens BJ, Lathrop JC, Rice WT, Gruenberg JC. Fournier´s gangrene: Historic (1764-1978) versus contemporary (1979-1988) differences in etiology and clinical importance. Am Surg. 1993;59:149-54. 7 Gerber GS, Guss SP, Pielet RW. Fournier´s gangrene secondary to intra-abdominal processes. Urology. 1994;44:779-82. 8 Salvino C, Harford FJ, Dobrin PB. Necrotizing infections of the perineum. South Med J. 1993;86:908-11. 9 Scott SD, Dawes RFH, Tate JJT, Royle GT, Karran SJ. The practical management of Fournier´s gangrene. Ann R Coll Surg Engl. 1988;70:16-20. 10 Schaeffer AJ. Infections of the urinary tract. En: Campbell´s Urology, Philadelphia: WB Saunders Co, eight edition 2002:p 590-591. 11 Hollabaugh RS Jr, Dmochowski RR, Hickerson WL, Cox CE. Fournier´s gangrene: therapeutic impact of hyperbaric oxygen. Olast Reconstr Surg. 1998;101:94-100. 12 Hegase MJ, Simonin JE, Bihrle R, Coogan CL. Genital Fournier´s gangrene: Experience with 38 patients. Urology. 1996;47:734-9. Rev Mex Urol 2007; 67(3): 165-169 169 CASO CLÍNICO Complicaciones urológicas en niños con leucemia. Presentación de un caso y revisión de la literatura Flores Terrazas J.E.,1,2 Varela Hernández P.E.,2 Ovilla Martínez R.,2 Zonana Farca E.2 RESUMEN SUMMARY Antecedentes: Se han observado afecciones genitourinarias en 57% de las autopsias de pacientes con leucemia. Objetivo: Informar de las complicaciones urológicas presentadas en un niño de 12 años con leucemia linfoblástica aguda (LLA) y revisión de la literatura. Material y métodos: Se presenta el caso de un niño de 12 años de edad con leucemia (LLA) postrasplantado de medula ósea con células madre del cordón, que presenta hematuria crónica, cólico renoureteral izquierdo e insuficiencia renal aguda. Resultados: Se maneja con líquidos parenterales, antibióticoterapia, sonda transuretral con lavados vesicales, cistoscopia, cateterización de uréteres y cistostomía percutánea. El ultrasonido renal mostró dilatación del sistema colector izquierdo y durante la colocación de un catéter ureteral se observó la salida de cristales mejorando la función renal. Después de múltiples cistoscopias y transfusiones de concentrados plaquetarios y globulares, se decide colocar cistotomía percutánea con 2200 plaquetas, mejorando la hematuria. Background: Autopsy reports have shown genitourinary disorders in 57% of patients with leukemia. Objectives: Inform about the urologic complications in a 12 year-old child with acute lymphoblastic leukemia after a bone marrow transplant. Results: The child occurred with macroscopic hematuria, left renal pain, acute renal failure and left renouretheral lithiasis. Discussion: Hemorrhagic cystitis is the main urological complication in patients with leukemia. Conclusion: Percutaneous cystostomy for bladder irrigation and transurethral catheter are key elements in the treatment of hemorrhagic cystitis. 1 Centro Hospitalario del Estado Mayor Presidencial; 2 Hospital Ángeles Lomas. 170 Rev Mex Urol 2007; 67(3): 170-174 Key words: leukemia, urologic complications. Flores TJE y cols. Complicaciones urológicas en niños con leucemia. Discusión: La cistitis hemorrágica es la principal complicación en pacientes con leucemia. Por lo general, la litiasis urinaria es observada por la administración de agentes citotóxicos que producen hiperuricemia e hiperfosfatemia. Conclusiones: La cistostomía con irrigación y sonda transuretral es clave en el manejo de la cistitis hemorrágica. Palabras clave: leucemia, complicaciones urológicas. INTRODUCCIÓN La leucemia es una enfermedad clonal, maligna, caracterizada por un desarrollo y proliferación anormal de los leucocitos, que pierden su capacidad de maduración y diferenciación y conservan su capacidad proliferativa. Las complicaciones urológicas de los pacientes con leucemia pueden ser consecuencia de la enfermedad misma o de su tratamiento. Se han observado afecciones genitourinarias hasta en 57% en autopsias de pacientes con leucemia.1 Las principales complicaciones urológicas observadas en estos pacientes son el priapismo, urolitiasis, compresión extrínseca e infiltración leucémica en cualquier punto del tracto urinario, cistitis hemorrágica, disfunción testicular2 y el riesgo de carcinoma urotelial.3 El priapismo se ha observado en pacientes con leucemia en 5% de la población adulta y es raro en los pediátricos; más de la mitad está asociado con leucemia mieloide crónica.4 Los pacientes con leucemia tienen un elevado riesgo de desarrollar hiperuricemia e hiperfosfatemia. Por su parte, la quimioterapia ocasiona un rápido cambio celular al liberar grandes cantidades de ácidos nucleicos y proteínas celulares. El ácido úrico y el fosfato son producto de la degradación celular, lo que ocasiona un incremento en su excreción por la orina y la formación de cálculos de ácido úrico.3 El riñón es el órgano que con mayor frecuencia sufre infiltración leucémica; por lo general es asintomático y sólo 13.5% de los pacientes presenta dolor en el flanco y hematuria. La próstata es el segundo órgano urológico afectado, ya que la infiltración testicular es un sitio extramedular común de recidiva en niños con leucemia linfocítica aguda.5 Otros sitios de infiltración incluyen el uréter, la vejiga y ocasionalmente el pene. La compresión extrínseca del sistema urinario ocasiona obstrucción y en los pacientes con leucemia, el sitio más común es el uréter como consecuencia de la formación de nódulos con infiltración leucémica. Los tumores reportados que generan esta condición son el sarcoma granulocítico que puede presentarse como una gran masa retroperitoneal y los tumores mielógenos. Se ha reportado hemorragia asociada con infiltración vesical y ureteral, que puede ser refractaria al manejo médico. La cistitis hemorrágica es una causa importante de morbilidad y ocasionalmente es fatal en pacientes trasplantados de médula ósea y se presenta hasta en 25% de los pacientes que son sometidos a trasplante de células progenitoras hematopoyéticas alogénicas. La severidad de la hematuria varía de moderada a severa, la cual puede poner en riesgo la vida de los pacientes y ocasionar uropatía obstructiva e insuficiencia renal. Puede ser causada por infección del tracto urinario tanto por bacterias como por virus6,7 o por ciertos medicamentos como la ciclofosfamida,8 citarabina e incluso la radioterapia. En el caso de la ciclofosfamida, al metabolizarse, se genera un metabolito llamado acroleina, que es un tóxico al urotelio y una de las causas mayores de cistitis hemorrágica, situación que se contrarresta con el uso de mesna intravenosa; sin embargo, en algunos pacientes es insuficiente.9,10 El Instituto Nacional del Cáncer de Estados Unidos define los criterios de acuerdo con la severidad de la cistitis hemorrágica de grados 2 a 4. El grado 2 se define como una hematuria sin coágulos tratada con hidratación y diuréticos, el grado 3 cuando se trata de un sangrado persistente con coágulos que requieren de transfusión o cauterización y el grado 4, cuando se requiere de cirugía. Además de la severidad, la cistitis hemorrágica se clasifica en temprana cuando el inicio es antes de los 60 días después del trasplante de medula ósea y en tardía cuando supera los 60 días.9 Rev Mex Urol 2007; 67(3): 170-174 171 Flores TJE y cols. Complicaciones urológicas en niños con leucemia. Se recomienda realizar exámenes de orina diarios durante la administración de ciclofosfamida y urocultivos para bacterias y virus cada semana. El manejo inicial en estos pacientes consiste en la administración de líquidos parenterales de 3l/ m2/día y diuréticos, transfusión de concentrados plaquetarios y eritrocitarios cuando existe trombocitopenia y anemia, realizar ultrasonido renal, y vesical cuando existe hematuria microscópica. De persistir la hematuria, debe iniciarse una irrigación vesical con solución salina o glicina. Si a pesar de estas medidas la hematuria continúa, está indicado realizar cistoscopias con evacuación de coágulos y cauterización de sitios de sangrado focales. De persistir, se recomienda la aplicación de instilaciones progresivas con aluminio, nitrato de plata o formalina siempre y cuando no exista reflujo vesico-ureteral.9 La cistotomía percutánea, bajo visión directa en niños, está indicada siempre y cuando las condiciones hematológicas lo permitan y pueda utilizarse como vía para la irrigación vesical continua. La embolización o la cirugía mediante cistectomía son procedimientos utilizados como último recurso. La duración de la hematuria es variable y ha sido reportada en niños con leucemia de 5 a 619 días con un promedio de 73 días, y no está directamente relacionada con la mortalidad. PRESENTACIÓN DEL CASO Se presenta el caso de un niño que a los 2 años y medio de edad, se le diagnosticó leucemia linfoblástica aguda tipo pre B calla negativa. A los 12 años presenta una recaída de medula ósea, lográndose remisión completa. Se inicio régimen de acondicionamiento para realizar trasplante de células progenitoras hematopoyéticas, iniciando con nueve sesiones de irradiación corporal total 1300 cgy, más ciclofosfamida a 120 mg/kg, globulina anti-timocito a 30 mg/kg y como profilaxis inmunosupresora metilprednisolona 2 mg/kg/día, más ciclosporina 3 mg/kg/día. Se realizó la infusión de células progenitoras hematopoyéticas procedentes de cordón umbilical con un volumen total de 118.5 ml y cuenta celular de 24500 x 10-6 de células mononucleares con viabilidad de 98% de origen femenino; grupo sanguíneo “A” Rh positivo. 172 Rev Mex Urol 2007; 67(3): 170-174 Cursó con vómito, diarrea y estado depresivo durante el acondicionamiento y evolucionó con mucositis grado 1 e hipertensión arterial que ameritó antihipertensivos y ajuste de la dósis de ciclosporina. El soporte transfusional fue de acuerdo con sus citopenias con base en concentrados eritrocitarios y plaquetarios. Se apoyó con factor estimulante de colonias granulocíticas por la neutropenia, pero sin evidencia de foco infeccioso; evolucionó con pico febril iniciando antibióticos de amplio espectro, previa toma de cultivos. No se documentó citomegalovirus. Al décimo día postrasplante inicia con disuria y hematuria y la depuración de creatinina se reporta baja, a pesar de mantener las dosis farmacológicas de ciclosporina. Evoluciona con taquicardia e hipertensión arterial, debido a la persistencia de la hematuria se inicia con ácido epsilon amino caproico sin mejoría. Se realiza ultrasonido renal y vesical, encontrando únicamente pielocaliectasia izquierda, continuó con neutropenia y trombocitopenia, se decide realizar cistoscopia, corroborando el diagnóstico de cistitis hemorrágica y evidencia de sangrado por ambos meatos ureterales. Se procede a evacuar coágulos; se coloca sonda de foley transuretral número 12 fr, más un catéter ureteral por vía transuretral junto con la sonda de foley para iniciar irrigación vesical. Posteriormente desarrolla insuficiencia renal aguda; dos días después se realiza nueva cistoscopia con evacuación de coágulos y la colocación de catéteres ureterales en forma bilateral, mejorando la insuficiencia renal, pero persistiendo la hematuria, hipertensión arterial y fiebre, manejándose con antihipertensivos y antibióticos de amplio espectro, así como con antimicóticos. Se reporta estafilococo epidermidis en faringe y se observa neutropenia grave y estado depresivo. Inicia con cólico renoureteral izquierdo que requiere de sedición y lavados ureterales. Se requirió aumento de la terapia de soporte de fracciones sanguíneas; a pesar de ello, cursa con varios episodios de epistaxis que son manejados mediante taponamientos; se agregan crisis convulsivas, descartándose hemorragia del sistema nervioso central mediante tomografía de cráneo; persiste la pancitopenia sin infección. La hipertensión y la hematuria se agudiza de manera severa lo cual obliga a retirar los catéteres ureterales Flores TJE y cols. Complicaciones urológicas en niños con leucemia. ante la ausencia de uropatía obstructiva evaluada por pielograma ascendente bilateral. Evoluciona con rectorragia, documentándose un sangrado arterial a 5 cm del margen anal en un lecho ulceroso, manejándose inicialmente con taponamiento y posteriormente con fulguración y aplicación de adrenalina hasta llegar a colocar puntos hemostáticos. Se suspendió la vía oral e inició nutrición parenteral total; continuó la hematuria y se realiza control de medula ósea, encontrando escasas células poco valorables para recuperación. Posteriormente desarrolló derrame pericardico leve, continuó la expulsión de coágulos por uretra de manera persistente; se realizó biopsia de hueso reportando aplasia medular, se aprecia cardiomegalia, y en colonoscopia de control se aprecian pérdida de las suturas hemostáticas con bordes de la úlcera rectal friable sin datos de cicatrización. Al día 74 postrasplante se reportan 500 neutrofilos y evoluciona con retención aguda de orina por coágulos, realizando lavado vesical con evacuación de los mismos, reinstalando la sonda vesical. Se realiza panendoscopia y se encuentra úlcera esofágica en tercio inferior cubierta con fibrina sin evidencia de sangrado. Continúa con crisis convulsivas y se documenta bacteriemia con cultivos positivos a cocos gram positivos, recurre la rectorragia y se colocan nuevamente puntos hemostáticos. El electroencefalograma reporta cambios sugestivos de epilepsia, persiste la hematuria y se realiza citoscopia con evacuación de coágulos observando sangrado en capa, cursa con disminución de la agudeza visual observándose en fondo de ojo lesiones algodonosas sugestivas de secuelas por hipertensión arterial, ante la hematuria persistente se utilizó factor VII activado con mínima respuesta. En el día 92 se aplica factor estimulante de colonias-granulocito macrófago intravesical con remisión aparente de la hematuria. Cinco días después se repite cistoscopia reactivándose la hematuria teniendo una cuenta plaquetaria de < 30 000/mc, por lo que se decide evacuar coágulos y colocar una cistostomía percutánea bajo visión directa para irrigación continua, evoluciona el paciente favorablemente sin hematuria en el día 134 postrasplante decidiendo retirar sonda de talla y transuretral al día 150, evolucionando satisfactoriamente, motivo por el cual se egresa para continuar manejo como externo. RESULTADOS Con el manejo inicial de la hematuria con base en líquidos parenterales no se observó una respuesta favorable. La colocación de la sonda transuretral con lavados vesicales fue un procedimiento frecuente que ocasionó múltiples molestias y sin obtener resultados satisfactorios, durante la colocación de los catéteres ureterales se observó la salida de múltiples cristales ureterales no observados en la radiografía simple, mejorando la función renal al resolver la uropatía obstructiva disminuyendo la dilatación de los sistemas colectores. La aplicación del ácido epsilon amino caproico y el factor VII activado intravenoso no disminuyeron la hematuria. El intento por colocar la irrigación con un catéter ureteral por vía transuretral funcionó parcialmente durante poco tiempo. Con las cistoscopias y evacuación de coágulos, la hematuria disminuyó parcialmente, pero siempre recidivó. Mediante la aplicación de factor estimulante de colonias-granulocito macrófago intravesical se observó una remisión parcial de la hematuria. Los coágulos intravesicales observados eran duros y difíciles de evacuar. Después de la aplicación de la cistostomía con irrigación, la mejoría de la hematuria fue evidente. DISCUSIÓN Las complicaciones urológicas en este paciente fueron la cistitis hemorrágica, uropatía obstructiva, insuficiencia renal aguda y litiasis urinaria. La cistitis hemorrágica fue el reto más grande en el manejo urológico del paciente con persistencia de la hematuria de 130 días, por lo que la dificultad del caso se centró en el control de la hematuria. El caso fue de un niño con trombocitopenia que ocasionó sangrados asimismo en otros sitios como el recto y la nariz. Uno de los obstáculos en su manejo fue la incapacidad de colocar una sonda de tres vías con irrigación vesical debido a que en niños no existen, por lo que a pesar del intento improvisado y desesperado de colocar irrigación vesical a través de un catéter ureteral transuretral, el resultado no fue satisfactorio. Era inminente el riesgo de colocar una cistostomía percutánea debido a la trombocitopenia y la posibilidad de ocasionar un sangrado en Rev Mex Urol 2007; 67(3): 170-174 173 Flores TJE y cols. Complicaciones urológicas en niños con leucemia. el tracto de la pared abdominal que podía ser catastrófico. Una vez que el paciente fue estabilizado hemáticamente, el resultado de la cistostomía con irrigación continua y las cistoscopias con evacuación de coágulos con el manejo de la sonda transuretral a permanencia fue satisfactorio. Este paciente presentó cistitis hemorrágica temprana grado 3. La insuficiencia renal aguda como consecuencia de la uropatía obstructiva se resolvió adecuadamente mediante la colocación de los catéteres ureterales. Es importante conocer la evolución y manejo de todos estos casos difíciles de pacientes con leucemia y sus complicaciones urológicas para poder definir el manejo más apropiado de manera individual, teniendo en cuenta que las complicaciones urológicas son diversas. La hematuria persistente en niños puede desesperar a cualquier urólogo, sobre todo sabiendo que con un cistoscopio pediátrico es demasiado difícil evacuar coágulos duros y grandes. Por fortuna, la duración de la hematuria no está en relación directa con la mortalidad, siempre y cuando el paciente se mantenga estable, siendo hemotransfundido cuando se requiera. Decidimos no instilar de manera intravesical nitrato de plata ni formalina ante la sospecha inicial de que la dilatación de sistemas colectores podía ser consecuencia de un reflujo vesico-ureteral asociado con los frecuentes eventos de retención urinaria por coágulos intravesicales y, posteriormente, debido a la colocación de los catéteres ureterales. CONCLUSIONES Las complicaciones urológicas de los pacientes con leucemia incluyen priapismo, cistitis hemorrágica, urolitiasis, compresión extrínseca del tracto urinario, infiltración leucémica en órganos urogenitales, disfunción testicular y carcinoma urotelial. Estas complicaciones urológicas observadas en pacientes con leucemia pueden deberse a la misma enfermedad o a su tratamiento. El manejo de la cistitis hemorrágica incluye la aplicación de líquidos intravenosos y diuréticos, la colocación de sonda transuretral con lavados vesicales, cistoscopia con evacuación de coágulos y cauterización focal, cistostomía, instilación intravesical de aluminio, nitrato de plata y/o formalina, 174 Rev Mex Urol 2007; 67(3): 170-174 embolización y cistectomia. Ante la sospecha de reflujo vesico-ureteral, no debe aplicarse la instilación intravesical de aluminio, nitrato de plata o formalina. El control hemodinámico del paciente y la cuenta hemática permiten establecer el momento de la colocación de la cistotomía percutánea, que se recomienda siempre bajo visión directa. Por su parte, la administración de ácido epsilon amino caproico, factor VII activado y factor estimulante de colonias-granulocito macrófago para el control de la hematuria requieren de mayor estudio. BIBLIOGRAFÍA 1 Watson EM, Saber HR, Sadugar MC. Manifestations of the limphoblastomas in the genito-urinary tract. J Urol. 1949;61(3):626-42. 2 Hensle TW, Burbique KA, Shephard BR, et al. Chemotherapy and its effect on testicular morphology in children. J Urol. 1984;131(6):1142-4. 3 Molitierno JA jr, Carson CC 3rd. Urologic manifestations of hematology disease sickle cell, leukemia, and thromboembolic disease. Urol Clin North Am. 2003;30(1):49-61. 4 Steinhardt GF, Steinhardt E. Priapism in Children with leukemia. Urology. 1981;18(6):604-6. 5 Persky L, Newman AJ, Tucker AS. Urologic manifestations of childhood leukemia. J Urol. 1972;107(6): 1073-7. 6 Seber A, Shu XO, Defor T, et al. Risk factors for severe hemorrhagic cystitis following BMT. Bone Marrow Transplant 1999;23(1):35-40. 7 Trotman J, Nivison-Smith I, Dodds A. Haemorragic cystitis: Incidence and risk facors ina a transplant population using hyperhidratation. Bone Marrow Transplant. 1999;23:797-801. 8 Talar-Williams C, Higazi YM, Walther MM, et al. Cyclophosphamide –induced cystitis and bladder cancer in patients with Wegener granulomatosis. Ann Intern Med. 1996;124(5):477-84. 9 Hale GA, Rochester RF, Heslop HE, Kance RA, et al. Hemorrhagic cystitis after allogeneic bone marrow transplantation in children: clinical characteristics and outcome. Biol Blood Marrow Transplant. 2003;9(11):698-705. 10 Hongeng S, Kance RA, Bowman LC, et al. Outcomes of transplantation with matched sibling and unrelated-donor bone marrow in children with leukemia. Lancet. 1997;350(9080):767-71. CASO CLÍNICO Liposarcoma mixoide retroperitoneal gigante. Reporte de un caso Molina-Polo L.D.,1 Aragón C.M.,1 Casasola G.J.,1 Castillo H.J.1 RESUMEN SUMMARY Los liposarcomas son neoplasias pleomorfas poco frecuentes. De todos ellos, sólo 19% se localizan en retroperitoneo, la mayoría carece de etiología clara y su comportamiento clínico varía tanto como su histología. De ahí el interés de reportar el caso de un paciente de 42 años que presenta aumento de volumen de cuadrantes derechos del abdomen, al que se le realizan estudios de extensión, encontrando una gran masa retroperitoneal derecha, con exámenes de laboratorio dentro de parámetros normales. Se realiza resección quirúrgica de la masa retroperitoneal con resultado histopatológico de liposarcoma mixoide de bajo grado. Este tipo de tumoraciones tienen mejor pronóstico que el resto de los sarcomas retroperitoneales. El tratamiento de elección para esta patología sigue siendo la exéresis quirúrgica completa, vigilancia periódica, así como evaluar la necesidad de terapia adyuvante, según el caso. Liposarcomas are pleomorphic neoplasm with low incidence, only 19% arise from retroperitoneum, most of are not etiologically clear and their clinical behavior, as their histological pattern are complex; that is the reason of our interest to report this clinic case. Male of 42 years old with a giant retroperitoneal mass in the right side and normal laboratory tests. The patient underwent surgical resection of retroperitoneal mass and the pathology report was low grade myxoid lyposarcoma. These kind of tumors presents a better prognosis than other retroperitoneal sarcomas. The gold standard treatment for this pathology is the complete surgical resection, periodical overview and the right evaluation of adjuvant therapy in each case. Key words: myxoid lyposarcoma, retroperitoneum. Palabras clave: liposarcoma retroperitoneal. INTRODUCCIÓN 1 Hospital Ángeles Mocel. Correspondencia: Dr. Dagoberto Javier Molina Polo López de Cárdenas. Hospital Ángeles Mocel. Ignacio Esteva # 107-204, Col. San Miguel Chapultepec, 11850, México, D.F. Tel.: 52782614. Los sarcomas de tejidos blandos son tumores raros y representan 1% de todos los tumores sólidos del adulto. Sólo entre 10 y el 20% de estos tumores se localizan en el retroperitoneo.1 Entre la variedad de sarcomas, los liposarcomas se encuentran entre las neoplasias más pleomorfas, y en comparación con otros tumores, son muy poco frecuentes (15%), 25% Rev Mex Urol 2007; 67(3): 175-179 175 Molina-Polo LD y cols. Liposarcoma mixoide retroperitoneal gigante. de ellos son leiomiosarcomas y 19% se localizan en el retroperitoneo.2 Es excepcional que se presenten en la infancia. En general, los liposarcomas se originan en tejidos blandos profundos del organismo, principalmente en miembros pélvicos, retroperitoneo, hombro, axila y mesenterio. En ocasiones alcanzan dimensiones enormes y una gran cantidad de kilogramos de peso invadiendo tejidos, órganos adyacentes y rodeando vasos sanguíneos. Con frecuencia se observan muchas áreas de reblandecimiento quístico, hemorragia y necrosis.3 Muchos de ellos adquieren aspecto gelatinoso mixoide. Histológicamente, se clasifican en cuatro grupos: a) Bien diferenciado b) Mixoides c) De células redondas d) Pleomórficos3 La mayoría de los sarcomas retroperitoneales no tienen una etiología clara; sin embargo, se han descrito factores predisponentes como radiación ionizante, exposición a químicos que contienen cloro o arsénico y a mutaciones genéticas en los genes RB-1 y p53 y a las traslocaciones entre los genes CHOP y FUS detectados en sarcomas.4-6 El comportamiento clínico de los sarcomas varía tanto como su histología. Los bien diferenciados y mixoides suelen invadir localmente, con frecuencia recurrentes, pero rara vez derivan a metástasis. En cambio, los de células redondas y pleomórficos son muy agresivos con alto potencial metastásico y recurrencia local. La supervivencia a cinco años para éste ultimo grupo es inferior a 20%.3 El liposarcoma mixoide representa entre 40 y 50% de todos los liposarcomas y se caracteriza por la presencia de células fusiformes o estrelladas con un solo núcleo o multinucleadas con numerosas atipias. Se caracteriza también por tener bajo potencial para desarrollar metástasis y presentar crecimiento local, alcanzando grandes dimensiones, dando como consecuencia clínica de desplazamiento visceral y síndrome constitucional.3 El diagnóstico se integra con el cuadro clínico apoyado con tomografía axial computarizada o con resonancia magnética, lo cual también ayuda en la estadificación del tumor. En contadas ocasiones se recurre a la biopsia percutánea guiada por tomografía para descartar recurrencia tumoral y/o 176 Rev Mex Urol 2007; 67(3): 175-179 corroborar que se trata de un sarcoma primario y no de metástasis de otro sitio.7 La cirugía constituye el tratamiento de elección y la supervivencia se reporta cercana a 90% para esta variedad histológica, si la resección ha sido completa.5,8 La quimioterapia y radioterapia se reservan para las variedades malignas, o bien, como método coadyuvante ante la presencia de recurrencias o como paliativo, ya que en la actualidad, la única alternativa potencialmente curativa para este tipo de tumores sigue siendo la exéresis total del tumor.8-10 Los factores pronósticos se relacionan directamente con el tamaño del tumor, con su localización, con la invasión por contigüidad, con las estructuras vitales comprometidas,11 con el grado del tumor12 y con los márgenes negativos posquirúrgicos.3,8 Autores como Shmookler y Lauer han observado que puede existir una relación entre el tamaño del tumor con su propio potencial metastático, es decir, si un tumor retroperitoneal de músculo liso mide por lo menos 7.5 cm en su eje mayor y tiene por lo menos 1 mitosis/10 HPF, es potencialmente metastatizante.13 Storm sostiene que la supervivencia relacionada con el grado histológico G1 fue de 74% a 5 años, con G3 fue de 24% a 5 años, mientras que Karakousis en otras series reporta una sobreviva relacionada con el grado tumoral que oscila entre 60 y 85% con G1 y en 48% con G3.14 PRESENTACIÓN DEL CASO Paciente masculino de 42 años de edad con antecedente de tabaquismo desde los 20 años de edad consumiendo cinco cigarrillos por semana y resección de pterigion bilateral a los 17 años de edad. Actualmente presenta masa abdominal que abarca hipocondrio y flanco derecho, la cual ha ido incrementando de volumen de cuatro meses a la fecha de consulta, acompañada de sintomatología digestiva inespecífica y ataque al estado general. El paciente había sido manejado con antiparasitarios, reguladores de motilidad intestinal y antiespasmódicos sin observar mejoría, motivo por el cual solicita atención especializada en un hospital de tercer nivel. A la EF se encuentra masa sólida que abarca hipocondrio y flanco derecho, fija a planos profundos Molina-Polo LD y cols. Liposarcoma mixoide retroperitoneal gigante. que no desciende a la maniobra de Montenegro, no dolorosa y silencio abdominal derecho. Se palpa claramente el contorno del riñón derecho sobre la línea media en epigastrio. Peristalsis presente en hemiabdomen izquierdo. Los exámenes de laboratorio reportaron: Hb 17.6; Hto 51.4; leucocitos 5.77; plaquetas 289; glucosa 94; Cr 1.1; urea 27; colesterol 256; triglicéridos 359; TP 12’’ 100%; TPT 29.3’’ INR 1.0. EGO sin alteraciones; PFH sin alteraciones. Los estudios de gabinete mostraron: • USG abdominal: Masa heterogénea que abarca hemiabdomen derecho aparentemente dependiente de hígado; ambos riñones sin alteraciones. • Urografía excretora: Masa que abarca hemiabdomen derecho desde la cúpula diafragmática hasta el hueco pélvico, riñón derecho desplazado hacia la línea media sin alteraciones y riñón izquierdo normal (Figura 1). • TAC: Masa retroperitoneal derecha, moderadamente vascularizada que oscila entre -22.01 a 62.53 UH en sus diferentes segmentos, no se aprecian ganglios ni invasión por contigüidad. El riñón derecho y el contenido abdominal se encuentran desplazados hacia el hemiabdomen izquierdo (Figuras 2 y 3). Con lo anterior se integra el diagnóstico de tumor retroperitoneal, estatificándose según el sistema TNM como T2b NX y se programa para resolución quirúrgica. Se realizó exéresis total de la tumoración sin incidentes ni accidentes, registrando una hemorragia calculada en 300 cc. Como hallazgo transoperatorio se encontró tumoración de gran tamaño, multilobulada que abarcaba todo el espacio retroperitoneal derecho, desde la cúpula diafragmática hasta el hueco pélvico sin invasión por contigüidad a ningún órgano y que desplazaba todo el contenido retro e intraperitoneal hacia el hemiabdomen contralateral, adyacente a la vena cava y sin adenopatías aparentes (Figura 4). El paciente evoluciona favorablemente, egresando en buenas condiciones generales a las 72 horas del evento quirúrgico. El paciente es evaluado cada tres meses con TAC abdominal de control, encontrando ésta dentro de parámetros normales sin recidiva tumoral hasta el momento. Figura 1. Urografía excretora. Figura 2. Tomografía axial computarizada con contraste oral. El estudio patológico observa tumoración retroperitoneal multilobulada de 4 kg que corresponde a liposarcoma mixoide bien diferenciado de bajo grado con zonas de hemorragia y fibrosis central. Por lo tanto, se clasifica en forma definitiva como T2b N0 G1. Rev Mex Urol 2007; 67(3): 175-179 177 Molina-Polo LD y cols. Liposarcoma mixoide retroperitoneal gigante. Figura 4. Pieza quirúrgica. Figura 3. Tomografía axial computarizada con contraste intravenoso. Detalle del desplazamiento medial del riñón derecho. DISCUSIÓN De acuerdo con los hallazgos quirúrgicos y el reporte de patología de este caso, se trata de un liposarcoma mixoide retroperitoneal que como se encuentra documentado en la literatura universal son tumores de gran tamaño y peso con zonas de reblandecimiento quístico, fibrosis, necrosis y hemorragia. Es importante resaltar que los exámenes de laboratorio de este paciente se encontraban en parámetros normales, corroborando así que en los sujetos portadores de tumores retroperitoneales no constituye una condición indispensable la alteración de los mismos. La resección total con márgenes quirúrgicos negativos es el único tratamiento potencialmente efectivo y curativo; sin embargo, debido al gran tamaño que estos sarcomas alcanzan, es frecuente encontrar tumores con márgenes quirúrgicos microscópicamente positivos. De aquí la necesidad del programa de vigilancia permanente (cada tres meses). A pesar de que en este paciente se logró la remoción completa del tumor, es indispensable mantenerlo en vigilancia estrecha periódica debido a su 178 Rev Mex Urol 2007; 67(3): 175-179 potencial recurrente. Este tumor se ha comportado típicamente conforme a su tipo histológico (mixoide) y presentar bajo grado de malignidad. Por lo tanto, tiene bajo potencial metastático y representa mucho mejor pronóstico que otro tipo de sarcomas retroperitoneales. CONCLUSIÓN Los liposarcomas retroperitoneales de la variedad histológica mixoide tienen mejor pronóstico que el resto de los sarcomas retroperitoneales debido a su bajo potencial para desarrollar metástasis. En la actualidad, el tratamiento de elección para esta patología sigue siendo la resección quirúrgica total8 (bordes quirúrgicos libres) con la subsecuente vigilancia periódica, evaluando los factores pronósticos y la necesidad de manejo adyuvante en caso necesario.15,16 BIBLIOGRAFÍA 1. Erzen D, Sencar M, Novak J. Retroperitoneal sarcoma: 25 years of experience with aggressive surgical treatment at the Institute of Oncology, Ljubljana. J Surg Oncol. 2005;91(1):1-9. 2. Barake H, Heymans O, Poortmans M, Alle JL. Retroperitoneal leiomyosarcoma. Case report and literature review. Rev Med Brux. 1996;17(6):384-8. Molina-Polo LD y cols. Liposarcoma mixoide retroperitoneal gigante. 3. Robbins SL, Cotran RS. Patología Estructural y Funcional. Ed. Interamericana. 3ª Edición. México D.F. 1987. 4. Cavenne WK. Chromosomal mechanisms in the initiation of human familial mixed cancers. Princess Takamatsu Symp. 1986;17:171-9. 5. Ottaiano A, De Chiara A, Fazioli F, Talamanca AA, Mori S, Botti G, Milano A, Apice G. Biological prognostic factors in adult soft tissue sarcomas. Anticancer Res. 2005;25(6c):4519-26. 6. Sandberg AA. Updates on the cytogenetics and molecular genetics of bone and soft tissue tumors. Liposarcoma. Cancer Genet Cytogenet. 2004;155(1):1-24. 7. Weiss SW. Lipomatous tumors. Monogr Pathol. 1996; 38:207-39. 8. Raut CP, Pisters PW. Retroperitoneal sarcomas. Combined-modality treatment approaches. J Surg Oncol. 2006;94(1):81-7. 9. Giovinetto R, Benfatto G, D’Antoni S, Licari V, Fancello R, Cannata I, Amore E, Giovinetto A. Retroperitoneal leiomyosarcoma. A case report. G Chir. 2004; 25(5):187-90. 10. Nincheri Kunz N, Evaristi L, Pera M, Cozzani R, Bacigalupo B. A case of retroperitoneal leiomyosarcoma. Considerations. Minerva Chir. 1992;47(11):1037-42. 11. Tan GY, Chong YL, Ramesh K, Walford NQ, Tan JK. Giant mixed-type perinephric liposarcoma. Int Urol Nephrol. 2004;36(3):319-22. 12. Ben Moualli S, Mnif A, Ben Amna M, Ben Hassine L, Chebil M, et al. Giant retroperitoneal liposarcoma: report of a case. Ann Urol. 2002;36(6):372-5. 13. Shmookler BM, Lauer DH. Retroperitoneal leiomyosarcoma. A clinicopathologic analysis of 36 cases. Am J Surg Pathol. 1983;7(3):269-80. 14. Karakousis CP, Velez AF, Gerstenbluth R. Resectability and survival in retroperitoneal sarcomas. Ann Surg Oncol. 1996;3(2):150-8. 15. Romero Perez P, Rafie Mazketli W, Amat Cecilia M, et al. Adipose retroperitoneal tumors. Apropos a giant myxoid liposarcoma. Actas Urol Esp. 1996;20(1):79-84. 16. Eilber FC, Eilber KS, Eilber FR. Retroperitoneal sarcomas. Curr Treat Options Oncol. 2000;1(3):274-8. Rev Mex Urol 2007; 67(3): 175-179 179 CASO CLÍNICO Litiasis coraliforme izquierda y pielonefritis xantogranulomatosa asociada con carcinoma epidermoide de vejiga. Presentación de un caso y revisión de la literatura Calderón Ferro F.,1 Fernández Carreño A.J.,1 Morales Montor G.,1 Andrade Platas D.,1 Reyes M.1 RESUMEN SUMMARY Se presenta el caso de un paciente masculino de 43 años con hematuria macroscópica de 5 meses de evolución, que posteriormente presenta sintomatología obstructiva y lituria hasta caer en retención aguda de orina, lo cual fue manejado con sonda transuretral; se realiza urografía excretora que revela la presencia de defecto de llenado vesical y exclusión renal izquierda; se lleva a cabo resección transuretral de masa vesical, reportando carcinoma epidermoide moderadamente diferenciado con invasión a lámina propia. El gammograma óseo fue negativo. Después de la nefrectomía izquierda más cistoprostatectomia se reportó carcinoma epidermoide moderadamente diferenciado con invasión de toda la pared, riñón con lito coraliforme y pielonefritis xantogranulomatosa. Se envió a radioterapia (24 Gy. en cuatro sesiones). We present a 43 year old male case with a 5month macroscopic hematuria with obstructive symptoms that evolves to acute urinary retention and lithuria, an excretory urogram is performed that reveals the presence of a bladder filling defect and left renal exclusion, a trans urethral bladder resection results in a squamous cell carcinoma of the bladder with moderate differentiation with invasion to the lamina propria; bone scintigraphy results negative. Left nephrectomy plus cistoprostatectomy reports a squamous cell carcinoma of the bladder with moderate differentiation with complete invasion of the muscular wall, left kidney with a staghorn calculi and xanthogranulomatous pyelonephritis, the patient is sent to radiotherapy (24 Gy. in 4 sessions). Palabras clave: litiasis coraliforme, pielonefritis xantogranulomatosa, carcinoma epidermoide. Key words: staghorn calculi, xantogranulomatous pyelonephritis, squamous cell carcinoma. INTRODUCCIÓN 1 División de Urología del Hospital General “Dr. Manuel Gea González”. Correspondencia: Hospital General “Dr. Manuel Gea González”. División de Urología. Calzada de Tlalpan 4800, Colonia Toriello Guerra, Delegación Tlalpan, México, D.F. Teléfono: 5665-7681. 180 Rev Mex Urol 2007; 67(3): 180-183 El espectro de tumores vesicales es amplio e incluye carcinomas de células transicionales, adenocarcinomas, leiomiomas y carcinoma de células escamosas.1-3 El cáncer de células transicionales es el tumor que se presenta con mayor frecuencia, por lo que ha Calderón FF y cols. Litiasis coraliforme izquierda y pielonefritis xantogranulomatosa. sido descrito ampliamente, mientras que el carcinoma de células escamosas constituye un porcentaje menor (1.6%) de todos los tumores vesicales en áreas donde no se presentan infecciones por Schistosoma haematobium.4 Estos tumores están asociados con antecedentes de infecciones crónicas, cálculos vesicales o el empleo crónico de sondas vesicales, así como de infecciones crónicas asociadas con tabaquismo representan un factor de riesgo importante.5 Histológicamente consisten de un solo tipo celular y muestran las características “perlas” o “nidos” escamosos y células poligonales con puentes intercelulares,3,6 con islas queratinizadas que contienen agregados excéntricos de las llamadas perlas. Por lo general, al momento del diagnóstico se encuentran pobremente diferenciados.7 Al igual que los carcinomas uroteliales, los carcinomas escamosos expresan con frecuencia anormalidades en los genes p16 y p53, aunque los mecanismos de alteraciones genéticas difieren en los dos tipos de tumores;8 además, expresan factores de crecimiento transformador, factor de crecimiento epidermoide, citoqueratina 14 y psoriasina, lo que pone en evidencia la presencia de una vía secundaria oncogénica y se relacionan con tumores con menor diferenciación.1,9,10 Respecto a los fenómenos paraneoplásicos, se ha descrito el síndrome de Sweet, que consiste en fiebre, leucocitosis y lesiones eritematosas distribuidas principalmente en las extremidades superiores.11 lámina propia; el gammograma óseo fue negativo. Se llevó a cabo cistoprostatectomía con nefrectomía izquierda (Figura 5) con reporte histopatológico de carcinoma epidermoide moderadamente diferenciado, con invasión a toda la pared hasta tejidos blandos perivesicales (Figura 6); los márgenes quirúrgicos se observaron libres de tumor, y ganglios negativos. Se envió a radioterapia, recibiendo 24 Gy. en cuatro sesiones. DISCUSIÓN Las neoplasias vesicales no uroteliales son patologías raras en el continente americano, son ampliamente superadas por tumores uroteliales y juntos representan menos del 5% de todos los tumores vesicales combinados; en segundo lugar en frecuencia después del carcinoma de células transicionales se encuentra el carcinoma epidermoide que representa 1 al 3% de las neoplasias vesicales en el hemisferio occidental. El carcinoma epidermoide MATERIAL Y MÉTODOS Este es un caso descriptivo de un paciente masculino de 43 años de edad que presentó hematuria macroscópica en tres ocasiones en un lapso de cinco meses, a lo que se agrega sintomatología obstructiva y lituria hasta mostrar retención aguda de orina, manejada con sonda transuretral. Se realizó urografía excretora que reveló la presencia de un defecto de llenado vesical, litiasis coraliforme izquierda y exclusión renal (Figuras 1 y 2). Asimismo, después de practicar TAC abdominal se observó presencia de litiasis coraliforme izquierda y defecto de llenado vesical de 50% (Figuras 3 y 4), por lo que se realizó resección transuretral de masa vesical, que reportó carcinoma epidermoide vesical moderadamente diferenciado con invasión a Figura 1. Placa simple de abdomen con imagen de litiasis coraliforme en riñón izquierdo. Rev Mex Urol 2007; 67(3): 180-183 181 Calderón FF y cols. Litiasis coraliforme izquierda y pielonefritis xantogranulomatosa. Figura 4. Tomografía axial computada. Se evidencia litiasis coraliforme izquierda. Figura 2. Urografía excretora. Se observa defecto de llenado de vejiga. Figura 3. Tomografía axial computada. Se aprecia defecto de llenado vesical y masa en pared lateral izquierda. 182 Rev Mex Urol 2007; 67(3): 180-183 Figura 5. Pieza quirúrgica, riñón izquierdo, vejiga y próstata. Calderón FF y cols. Litiasis coraliforme izquierda y pielonefritis xantogranulomatosa. fragmentos de manera distal hacia la vejiga lo que explica el citado mecanismo; es de llamar la atención la ausencia de metástasis ganglionares o a distancia; una particularidad de éste caso es que a pesar de que en la mayoría de los reportes éstos tumores son de bajo grado, en nuestro caso fue moderadamente diferenciado. La asociación con pielonefritis xantogranulomatosa no fue encontrada en las revisiones previas de la literatura. BIBLIOGRAFÍA Figura 6. Imagen histopatológica del tumor vesical. de la vejiga en su forma pura es un hallazgo raro y debe ser distinguido del cáncer de células transicionales con diferenciación escamosa parcial, un hallazgo relativamente común en piezas de cistectomía radical.10 Los pacientes que presentan carcinoma epidermoide no relacionadas a infecciones por S. haematobium tienen un pronóstico desfavorable, en gran medida por la presencia de enfermedad localmente avanzada al momento de la presentación.11 El caso presentado corresponde a tres patologías diferentes, una causante de las otras dos, ya que la litiasis predispone a la presencia de pielonefritis xantogranulomatosa, y principalmente a la presencia de carcinoma vesical epidermoide mediante mecanismos irritativos crónicos al liberar fragmentos hacia la vejiga. A pesar de representar la minoría de las estirpes histológicas encontradas en el hemisferio occidental, su identificación se debió a la presencia de un defecto de llenado encontrado en la urografía excretora, lo que orientó hacia la realización de una resección transuretral de vejiga haciendo posible la identificación histológica. CONCLUSIONES El carcinoma epidermoide de vejiga se relaciona con la presencia de factores irritativos crónicos, como la presencia de litiasis vesical, infecciones crónicas o la presencia de catéteres vesicales a largo plazo; en nuestro caso dicho factor se hace presente por la presencia de un lito coraliforme el cual libera 1. Celis JE, Rasmussen HH, Forum H, Madsen P, Honores B, Wolf H, Orntoft TF. Bladder Squamous cell carcinoma express psoriasin and externalize it to the urine. J Urol. 1996;155(6): 2105-12. 2. Bryan GT, Cohen SM. The pathology of bladder cancer. CRC Press vols I and II, 1983. 3. Olsen S. Tumors of the kidney and urinary tract: Textbook. Copenhagen: Munksgaard, 1984. 4. Lefevre M, Crouzet T, Bouissou H. Critical study of several histoprognostic factors concerning epidermoid type transitional cell carcinomas and vesical epidermoid carcinomas. Appropos of 107 cases. Arch Anat Cytol Pathol. 1977;25(4):277-82. 5. Porter M, Voigt LF, Penson DF, Weiss NS. Racial variation in the incidence of squamous cell carcinoma of the bladder in the United States. J Urol. 2002;168(5):1960-3. 6. Koss LG. Tumors of the urinary bladder: Atlas of tumor pathology. Armed forces Institute of pathology. 2005; Fasc 11. 7. Shokeir AA. Squamous cell carcinoma of the bladder: pathology, diagnosis and treatment. BJU Intl. 2004;93(2):216-20. 8. Girgin C, Sezer A, Rusen UC, Ermete M, Ozckan U. Outcome of treatment of invasive non-transitional cell carcinoma. Int J Urol. 2003;10(10):525-9. 9. Tungekar MF, Linehan J. Patterns of expressions of transforming growth factor and epidermal growth factor receptor in squamous cell lesions of the urinary bladder. J Clin Pathol. 1998;51(8):583-7. 10. Chu PG, Lyda MH, Weiss LM. Cytokeratin 14 expression in epithelial neoplasms: a survey of 435 cases with emphasis on its value in differentiating squamous cell carcinomas from other epithelial tumors. Histopathology. 2001;39(1); 9-16. 11. Syed S, Furman J, Nalesnik JG, Basler J. Sweet´s syndrome associated with squamous cell carcinoma of the bladder. J Urol. 2003;170(1):180-1. Rev Mex Urol 2007; 67(3): 180-183 183 CASO CLÍNICO Caso inusual de un dispositivo intrauterino migrado a vejiga con cistolitiasis secundaria Ceballos González S.,1 Sotelo Virgen P.,2 RESUMEN SUMMARY La perforación del útero por un dispositivo intrauterino (DIU) (con migración hacia la cavidad vesical y generando de manera secundaria la formación de litiasis), ha sido motivo de diversos reportes en la literatura.1-4 En este reporte se describe la historia y el curso clínico de un caso inusual (por su tiempo de evolución: 20 años) de otra paciente, con ausencia prácticamente de síntomas urinarios y su hallazgo incidental. El manejo fue mediante cistolitotripsia neumática, extracción endoscópica del DIU y salpingoclasia bilateral. The perforation of the uterus by an intrauterine device (DIU), with migration towards the vesical cavity and generating a secondary way to litiasis formation had been reason for diverse reports in literature.1-4 In this report we described the history and clinical course of an unusual case of another due their time to evolution (20 years), the absence of urinary symptoms and its incidental finding. The management was by means of cistolitotripsia pneumatic, endoscopic extraction of the bilateral DIU and salpingoclasia. Palabras clave: litiasis vesical, dispositivo intrauterino, litotripsia intracorporea, perforación vesical. Key words: vesical litiasis, intracorporea intrauterine device, litotripsia, vesical perforation. INTRODUCCIÓN 1 Departamento de Urología del Hospital General de Zona con Medicina Familiar Núm. 1 “Dr. Leonel Ramírez García, IMSS, Colima. 2 Departamento de Ginecología del Hospital General de Zona con Medicina Familiar Núm. 1 “Dr. Leonel Ramírez García, IMSS, Colima. Correspondencia: Dr. Sergio Ceballos González. Calle Gorrión 18, Col. Lomas Verdes, Colima, Col., México. CP 28020 Tel.: (01) 3313-8338. Correo electrónico: seceba@prodigy.net. 184 Rev Mex Urol 2007; 67(3): 184-187 Los dispositivos intrauterinos son métodos anticonceptivos y unos verdaderos cuerpos extraños, de los cuales, por su diferente forma, por el material con que han sido fabricados o por el agregado de metales o sustancias hormonoides, existen en la actualidad más de 65 modelos.5 Su mecanismo de acción se activa al provocar una respuesta inflamatoria de bajo grado en el endometrio. El medio ambiente intrauterino alterado interfiere con la implantación de los ovocitos fertilizados.6 Respecto Ceballos GS y col. Caso inusual de un dispositivo intrauterino migrado a vejiga con cistolitiasis secundaria. a su inserción, se han descrito varias complicaciones: dolor pélvico, inflamación y hemorragias genitales, embarazos ectópicos, abortos espontáneos, perforación uterina y migración a órganos adyacentes.7 Los dispositivos intrauterinos migrados se han sido encontrado en mayor proporción en la cavidad abdominal, mientras que es menos común en vejiga y ha sido reportado sólo un caso en vena ilíaca (Tabla 1).8 Se reporta un caso de un DIU Tcu380 migrado a vejiga con formación subsecuente de litiasis y con la peculiaridad de tener un tiempo de evolución prolongado (20 años), de manifestar escasos síntomas y de ser diagnosticado de manera fortuita. Tabla 1. Sitios de migración de dispositivo intrauterino en una casuística de 165 pacientes en los últimos 18 años. Sitio Omentum Rectosigmiodes Peritoneo Vejiga Apéndice Intestino delgado Anexo Vena ilíaca Número 45 44 41 23 8 2 1 1 PRESENTACIÓN DEL CASO Paciente femenina de 42 años de edad, originaria y residente de la ciudad de Colima. Gesta X, Para VI, Abortos IV, Menarca a los l5 años con ritmo de 30 x 3. Inicio de vida sexual activa a los l7 años de edad. Fecha del último parto: agosto de 1998. Método anticonceptivo empleado: hormonales orales desde hace 11 años. En Junio de 1980 le fue colocado un DIU Tcu330 en el posparto inmediato, en la ciudad de Tuxtla Gutiérrez, Chiapas, por un médico particular. Refiere que posterior a la inserción del DIU presentó dolor intenso en bajo vientre, náusea y pérdida del estado conciente momentáneo. En su revisión a las dos semanas siguientes por el mismo médico, se comprobó la situación normal de las fimbrias del DIU. Posteriormente presentó dos ciclos menstruales normales, embarazándose seguidamente. Después de resolverse el embarazo, no se localizó el dispositivo intrauterino, concluyendo que posiblemente fue expulsado de manera espontánea y sin ser percibido por la paciente. A los cuatro años siguientes, manifestó un cuadro de irritación urinaria baja, acompañado de hematuria macroscópica, el cual fue resuelto mediante antibiótico y analgésico urinario. Los años siguientes permaneció asintomática de las vías urinarias y sin molestias dolorosas pélvicas. Se embarazó nuevamente a los ocho años del penúltimo embarazo. En noviembre de 1999 sufre un accidente automovilístico, por lo que en el servicio de urgencias se le solicita una placa simple de abdomen, aprecián- Figura 1. Placa simple de abdomen que muestra la imagen del DIU en cavidad pélvica horizontalizado y con un halo radiopaco que corresponde a la formación litiásica. Figura 2. Ultrasonido pélvico. En la cavidad vesical se aprecia imagen hiperecoica, delimitándose la silueta del DIU en su interior. Rev Mex Urol 2007; 67(3): 184-187 185 Ceballos GS y col. Caso inusual de un dispositivo intrauterino migrado a vejiga con cistolitiasis secundaria. Figura 3. En la fase de llenado vesical del urograma excretor, el DIU se visualiza dentro del contorno de la cavidad vesical. Figura 4. El lito multifragmentado y el DIU íntegro como piezas quirúrgicas. dose la presencia del DIU (Figura 1). Acto seguido se realizó exploración vaginal con espéculo sin encontrar filamentos del DIU. El estudio ultrasonográfico mostró la morfología del DIU en cavidad vesical, rodeado de una imagen hiperecogénica de 3 cm con sombra sónica posterior, la cual se desplazaba con los cambios de posición de la paciente (Figura 2). Una urografía excretora evidenció un tracto urinario superior normal y el histograma de llenado mostró el DIU en topografía vesical (Figura 3). La paciente fue sometida a una exploración endoscópica bajo anestesia peridural, comprobando en la revisión cistoscópica la formación calculosa compacta libre en la cavidad vesical que cubría por completo al DIU. Se realizó cistolitotripsia neumática, lo que permitió descubrir el DIU extrayéndolo por vía endoscópica con una pinza de cuerpo extraño (Figura 4). Se realizó salpingoclasia bilateral. La paciente fue dada de alta a las 24 horas siguientes sin mayor complicación. consenso de que, para que migre un DIU, debe existir una perforación uterina parcial o completa al momento de su inserción.11 No es común la migración a vejiga12 y suele ser resultado de una perforación uterina a nivel cervical, la cual suele ser asintomática; sin embargo, en nuestro caso, la paciente manifestó dolor agudo en el momento de la inserción, lo que aumenta la sospecha clínica de lesión uterina. Por lo general, las pacientes se presentan con síntomas urinarios irritativos bajos, infecciones recurrentes del tracto urinario, hematuria y/o dolor sordo abdominal.13 Estos síntomas pueden desarrollarse muchos años después de que el DIU es insertado. En la mayoría de los casos reportados en la literatura, los síntomas fueron evidentes entre los tres meses a cinco años posteriores a la inserción y el intervalo entre la inserción y la remoción del DIU varía entre seis meses a 16 años.14 Llama la atención la escasa sintomatología presentada en la paciente del presente caso, pasando el problema prácticamente silente. El intervalo de tiempo entre su inserción y remoción corresponde a la duración mas prolongada reportada hasta la fecha.15 Con el caso expuesto se insiste en la necesidad de un conocimiento anatómico preciso del área genital femenina y de una pericia adecuada para la realización de este procedimiento con el menor riesgo. Los dispositivos intrauterinos ya insertados requieren de una vigilancia periódica y no debe darse por expulsado un DIU sin tener la certeza de ello, ya que la naturaleza humana es caprichosa. DISCUSIÓN La inserción de un DIU es una práctica común no exenta de riesgos. La complicación más seria de este método de contracepción es la perforación del útero con una incidencia que varía de 0.4 a 6.7 por 1000 inserciones.9 Las variables que inciden en esta complicación están relacionadas con el tiempo de la inserción, la experiencia y habilidad del operador y posiblemente con la forma del útero.10 Existe el 186 Rev Mex Urol 2007; 67(3): 184-187 Ceballos GS y col. Caso inusual de un dispositivo intrauterino migrado a vejiga con cistolitiasis secundaria. BIBLIOGRAFÍA 1. Saronwala KC, Singh R, Dass H. Lippes loop perforation of the uterus and urinary bladder with stone formation. Obst Gynec. 1974;44:727. 2. Junceda Avello E, González Torga L, Laceras Villanueva J, González Bernaldo de Quiros A. Perforación uterina y migración vesical de un dispositivo intrauterino observación casuística. Acta Ginecol. 1977; 30:79. 3. Cumming GP, Bramwell SP, Lees DAR. An unusual case of cystolithiasis: a urologic lesson for gynecologist. Br J Obstet Gynecol. 1997;104:117. 4. Mahazan P.: Secondary vesical calculus following translocated iucd in urinary bladder. J Indian Med Assoc. 1995;93(8):326. 5. Calatroni Ruiz. Terapéutica Ginecológica. Ed. Panamericana. 1ra edición.1988. 6. Copeland. Ginecología. Ed. Médica Panamericana, 2ª edición, 2002. 7. González MJ. Ginecología 6ta edición Barcelona; Masson-Salvat. Ediciones científicas y técnicas, S.A. 1993:584-8. 8. Kassas B, Audra P. The migrating intrauterine device. Case report and review of the literature. Contracept Fertil Sex. 1999;27(10):696-700. 9. Levinson CJ. Laparoscopic removal of perforated IUDs. J Reprod Med. 1973;10:169. 10. Tatum HJ. Clinical aspects of intrauterine contraception: -circumspection- 1976 Fertil Steril 1977;28(1): 3-28. 11. Reyes-Acevedo J, Bustamante-Sarabia J. Perforación uterina y localización vesical de un dispositivo intrauterino y cistolitiasis. Comunicación de un caso y revisión de la literatura. Ginecología y Obstetricia de México. 1995;63:407-9. 12. Rosenfield AG, Castador RG. Early postpartum and immediate postabortion intrauterine contraceptive device insertion. Amer J Obstet Gynecol. 1974; 118(8): 1104-14. 13. Weekes LR. Complications of intrauterine contraceptive devices. J Natl Med Ass. 1975;67:1. 14. Dietrick D, Muta I. Intravesical migration of intrauterine device. J Urol. 1992;147:1232-4. 15. Ndoye A, BA M. Migration of an intrauterine device to the bladder. Prog Urol. 2000;10(2):295-7. Rev Mex Urol 2007; 67(3): 184-187 187 INSTRUCCIONES PARA AUTORES REVISTA MEXICANA DE UROLOGIA publica trabajos originales, artículos de revisión, casos clínicos, cartas al director y otros artículos especiales que describan nuevos datos de particular significado referentes a todos los aspectos de la Urología. Los manuscritos deben elaborarse siguiendo las recomendaciones del Comité Internacional de Editores de Revistas Médicas (N Engl J Med. 1997;336:309-15), también disponibles en: http://www.icmje.org, que se ajustan a las siguientes normas: Remisión de trabajos Enviar el manuscrito de acuerdo con las instrucciones, con tres copias en un sobre a: Sociedad Mexicana de Urología. Montecito 38, piso 25, oficina 37. Col. Nápoles, 03810, México, D.F. Tels.: (55) 5488-3385, 5488-3386; y al mismo tiempo también por correo electrónico a las siguientes direcciones: revmexurol@yahoo.com. mx, smu@wtcmexico.com.mx y mgarcia@massondoyma.com.mx incluyendo: • Carta de presentación. • Listado de comprobaciones formales del trabajo. • Formulario anexo de declaración de autoría y cesión de derechos. • Disquete informático con el texto, especificando nombre del archivo y programa utilizado; las fotografías, gráficos y cuadros deben venir en archivo electrónico en jpg o tiff en alta resolución o en su defecto las fotografías originales (ya que esto se debe manipular para darle tamaño y posición en el texto). Carta de presentación En ella el autor explicará, en 3-4 líneas, cuál es la aportación original del trabajo que presenta. Tipos de artículos • Originales. Podrán referirse a trabajos de investigación básica o clínica o cualquier otra contribución original en algunos de los aspectos de la Urología. Se recomienda que el número de autores firmantes no supere los 6. Las secciones se ordenan como sigue: página del título, resumen (summary), introducción, métodos, resultados, discusión o comentario, bibliografía, cuadros, pies de figura y figuras. • Trabajos de Formación Continuada-Revisiones. Se refiere a puestas al día de temas concretos de la especialidad o bien a revisiones de tema a propósito de una casuística. La extensión será aproximadamente de 15 páginas de texto con un máximo de10 figuras, cuadros, fotografías o gráficas. El número de firmantes no será superior a seis. Las secciones se ordenan como sigue: página del título, resumen, introducción, casuística, discusión o comentario, bibliografía, cuadros, pies de figura y figuras. • Notas clínicas. Referidas a la descripción de casos clínicos infrecuentes cuya presentación aporte datos al conocimiento del tema. La extensión aproximada será de cinco páginas y no más de tres figuras o cuadros. El número de autores firmantes no superará los cinco. Las secciones se ordenan como sigue: página del título, resumen, introducción, casuística, discusión o comentario, bibliografía, cuadros, pies de figura y figuras. • Noticias. Se podrán remitir todas aquellas informaciones, anuncios, comentarios, etc., que puedan ser de interés para los miembros de la sociedad. Manuscrito • El autor debe enviar tres juegos completos del manuscrito, mecanografiados a doble espacio en todas sus secciones (incluidas citas bibliográficas, cuadros y pies de figura). Se emplearán páginas tamaño carta, dejando márgenes laterales, superior e inferior de 2.5 centímetros. • Todas las páginas irán numeradas consecutivamente, empezando por la del título. • Abreviaciones: éstas deben ser evitadas, exceptuando las unidades de medida. Evitar abreviaciones en el título y en el resumen. El nombre completo al que sustituye la abreviación debe proceder el empleo de ésta, a menos que sea una unidad de medida estándar. Las unidades de medida se expresarán preferentemente en Unidades del Sistema Internacional (Unidades SI). Las unidades químicas, físicas, biológicas y clínicas deberán ser siempre definidas estrictamente. Página del título • Figurará el título conciso, pero informativo, un título abreviado, los nombres y apellidos de los autores, nombre de (los) departamento (s) y la (s) institución (es) a las que el trabajo debe ser atribuido y el reconocimiento de cualquier beca o apoyo financiero. • Incluir el nombre completo, número de teléfono (fax y e-mail) y la dirección postal completa del autor responsable de la correspondencia y el material. Estos datos deben figurar en el cuadrante inferior derecho de esta primera página. Resumen y palabras clave • Deberán aparecer en la segunda página. Se recomienda que el resumen de los artículos originales sea estructurado, es decir, que contenga los siguientes encabezados e información: Objetivo, Métodos, Resultados y conclusiones con no más de 200 palabras. • En la misma hoja debe aparecer una relación con las palabras clave. Las palabras clave (de tres a diez en total) complementan el título y ayudan a identificar el trabajo en las bases de datos. Se deben emplear términos obtenidos de la lista de encabezados de materias médicas (MeSH) del Index Medicus de la NLM de Estados Unidos. Disponible en: http:// www.ncbi.nih.nih.gov/entrez/meshbrowser.cgi Abstract y key words • Es una traducción correcta del resumen al inglés. Se escribirá en una hoja aparte, donde también figure el título del trabajo y las key words, ambos igualmente en inglés. Introducción • Debe mencionarse claramente los objetivos del trabajo y resumir el fundamento del mismo sin revisar extensivamente el tema. Citar sólo aquellas referencias estrictamente necesarias. Sujetos y métodos • Debe describir la selección de los sujetos estudiados detallando los métodos, aparatos y procedimientos con suficiente detalle como para permitir reproducir el estudio a otros investigadores. Alguna información detallada de gran interés puede incluirse como anexo. • Las normas éticas seguidas por los investigadores tanto en estudios en humanos como en animales se describirán brevemente. Los estudios en humanos deben contar con la aprobación expresa del comité local de ética y de ensayos clínicos, y así debe figurar en el manuscrito. • Exponer los métodos estadísticos empleados. Los estudios contarán con los correspondientes experimentos o grupos control; caso contrario se explicarán las medidas utilizadas para evitar los sesgos y se comentará su posible efecto sobre las conclusiones del estudio. Resultados • Los resultados deben ser concisos y claros, e incluirán el mínimo necesario de cuadros y figuras. Se presentarán de modo que no exista duplicación y repetición de datos en el texto y en las figuras y cuadros. Discusión o comentario • Enfatizar los aspectos nuevos e importantes del trabajo y sus conclusiones. No debe repetirse con detalles los resultados del apartado anterior. Instrucciones para autores Debe señalarse las implicaciones de los resultados y sus limitaciones, relacionándolas con otros estudios importantes. El contenido de esta sección ha de basarse en los resultados del trabajo y deben evitarse conclusiones que no estén totalmente apoyadas por los mismos. Se comentarán los datos propios con relación a otros trabajos previos, así como las diferencias entre los resultados propios y los de otros autores. • La hipótesis y las frases especulativas deben ser claramente identificadas. Agradecimientos • Podrán reconocerse: a) contribuciones que necesitan agradecimiento pero no autoría; b) agradecimiento por ayuda técnica; c) agradecimiento de apoyo material o financiero, especificando la naturaleza de dicho apoyo, y d) relaciones financieras que pueden causar conflicto de intereses. Bibliograf ía • Las citas bibliográficas se identificarán en el texto con la correspondiente numeración correlativa mediante números arábigos, en superíndice, inmediatamente después de la puntuación o última palabra de la palabra. • Se escribirán a doble espacio y se numerarán consecutivamente en el orden de aparición en el texto. • Las comunicaciones personales y los datos no publicados no deben aparecer en la bibliografía (se pueden citar entre paréntesis en el texto). • Las abreviaturas de las revistas se ajustarán a las que utiliza el Index Medicus de la National Library of Medicine. • Disponible en: http://www.ncbi.nih.gov/entrez/jrbrowser.cgi Ejemplo de citas correctas Revistas: 1. Artículo normal (citar los autores cuando sean seis o menos; si son siete o más, citar los seis primeros y añadir “et al”): Cañas R, Kilboume E. Oil ingestion and the Toxic-Oil syndrome: results of a survey of residents of the Orcasur neighbourhood in Madrid, Spain. Int J Epidemiol 1987;1:3-6 2. Suplemento de revista: Mastri Ar, Neuropathy of diabetic neurogenic bladder. Ann Intern Med 1980;92 (suppl 2):316-8 3. Fascículo sin volumen: Baumeister AA. Origins and control of stereotyped movements. Monogr Am Assoc Ment Defici 1978;(3):353-84. Libros y otras monografías: 4. Autor (es): McDowell Y, Newell C. Measuring health: a guide to rating scales and questionnaires. New York: Oxford University Press, 1987. 5. Capítulo de un libro: Abramson JH. Cross-sectional studies. En: Holland WW, Detels R, Knox G, Directors. Oxford textbook of public health, volumen 3: Investigative methods in public health. Oxford: Oxford University Press, 1985;89-100. 6. Tesis doctorales o conferencias publicadas: Youssef NM. School adjustment of children with congenital Heart disease [tesis doctoral]. Pittsburgh: Universidad de Pittsburgh, 1988. Cuadros • Irán numeradas de manera correlativa. Escritas a doble espacio, en hojas separadas, se identifican con un número arábigo y un título en la parte superior. Deben contener las pertinentes notas explicativas al pie. Figuras, fotograf ías, gráficas, dibujos y otras ilustraciones • Deberán ser seleccionadas cuidadosamente, de modo que contribuyan a la mayor comprensión del texto. El tamaño será de 10 x12 y 10 x18 cm, con la calidad necesaria para su reproducción y en número adecuado según las normas de la introducción. • Si se presentan microfotografías deberán incluirse el método de tinción y los aumentos empleados. • Las fotografías en tamaño postal irán numeradas al dorso mediante etiqueta adhesiva con el nombre del primer autor y título del trabajo e indicaciones de la parte superior de la misma mediante una flecha. • Las fotografías digitales vendrán en formato jpg/jpeg en disco o CD y por correo electrónico junto al trabajo en cuestión. • Las figuras no repetirán datos y escritos en el texto. • Los pies de figura se escribirán a doble espacio y las figuras se identificarán con números arábigos que coincidan con su orden de aparición en el texto. El pie contendrá la información necesaria para interpretar correctamente la figura sin recurrir al texto. RESPONSABILIDADES ÉTICAS • Cuando se describen experimentos que se han realizado en seres humanos se debe indicar si los procedimientos seguidos se conforman a las normas éticas del comité de experimentación humana responsable (institucional o regional) y a la Declaración de Helsinki de 1975, revisada en 1983. Disponible en: http//www.wma.net/s/policy/17-c_s.html. No se deben utilizar nombres, iniciales o números de hospital, sobre todo en las figuras. Cuando se describen experimentos en animales se debe indicar si se han seguido las pautas de una institución o consejo de investigación internacional, o una ley nacional reguladora del cuidado y la utilización de animales de laboratorio. • Permiso de publicación por parte de la institución que ha financiado la investigación. • Conflicto de intereses. La revista espera que los autores declaren cualquier asociación comercial que pueda suponer un conflicto de intereses en conexión con el artículo remitido. • Autoría. En la lista de autores deben figurar únicamente aquellas personas que han contribuido intelectualmente al desarrollo del trabajo. Haber ayudado en la colección de datos o haber participado en alguna técnica no son por sí mismos criterios suficientes para figurar como autor. En general, para figurar como autor se deben cumplir los siguientes requisitos: 1. Haber participado en la concepción y realización del trabajo que ha dado como resultado al artículo en cuestión. 2. Haber participado en la redacción del texto y en las posibles revisiones del mismo. 3. Haber aprobado la versión que finalmente será publicada. La Revista Mexicana de Urología declina cualquier responsabilidad sobre posibles conflictos derivados de la autoría de los trabajos que se publican en ella. CONSENTIMIENTO INFORMADO Los autores deben mencionar en la sección de métodos que los procedimientos utilizados en los pacientes y controles han sido tras la obtención de un consentimiento informado. TRANSMISIÓN DE LOS DERECHOS DE AUTOR Se incluirá con el manuscrito el anexo a estas normas firmado por todos los autores. PROCESO EDITORIAL Una vez evaluado en primera instancia por el Comité Editorial, todo manuscrito recibido es enviado a evaluadores externos, a los autores se le notificará su aceptación, rechazo o necesidad de cambios. La valoración seguirá un protocolo establecido a tal efecto y será anónima. La Revista Mexicana de Urología se reserva el derecho de realizar cambios o introducir modificaciones en el estudio, en aras de una mejor comprensión del mismo, sin que de ello se derive un cambio en su contenido. Los manuscritos que sean aceptados para publicación en la revista quedarán en poder permanente del Comité Editorial y no podrán ser reproducidos total ni parcialmente sin su permiso. INFORMACIÓN ADICIONAL 1. La Revista Mexicana de Urología da acuse de recibo de los trabajos remitidos. 2. Corrección de pruebas. Se enviará una prueba de composición del artículo al autor responsable de la correspondencia. La prueba se revisará cuidadosamente y se marcarán los posibles errores, devolviendo las pruebas corregidas a la redacción de la revista en un plazo de 48 horas. El Comité de Redacción se reserva el derecho de admitir o no las correcciones efectuadas por el autor en la prueba de impresión. 3. Política editorial. Los juicios y opiniones expresados en los artículos y comunicaciones publicados en Revista Mexicana de Urología son del autor(es), y no necesariamente aquéllos del Comité Editorial. Tanto el Comité Editorial como la empresa editora declinan cualquier responsabilidad sobre dicho material. Ni el Comité Editorial ni la empresa garantizan o apoyan ningún producto que se anuncie en la revista, ni garantizan las afirmaciones realizadas por el fabricante sobre dicho producto o servicio. 4. Para mayor información visite la página electrónica de la Revista Mexicana de Urología en: http://www.smu.org.mx.