Salud y Producción Avícola
Anuncio

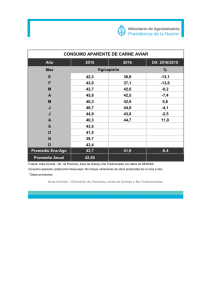
LA INOCUIDAD EN EL SECTOR AVICOLA ZACATECAS, 04 NOVIEMBRE DE 2015 ¿La inocuidad un requisito o un derecho? La confianza de que un alimento este producido con inocuidad, se vuelve un derecho para los consumidores y un requisito para el productor. El resultado del crecimiento de la población, de la economía mundial, de los tratados de libre comercio (alimentos), el aumento del consumo, los avances de la ciencia y la tecnología, propicia una mayor demanda en la producción mundial de alimentos. Los principales riesgos de contaminación que han tomado importancia, se han identificado principalmente los de origen microbiológico (E.coli y Salmonella), químico (plaguicidas), así como el uso inadecuado de aditivos y antibióticos. ¿Cual es el entorno económico del sector avícola mundial ? Los cuatro países de mayor producción de pollo de engorda en América (millones de toneladas) Estatus de la producción nacional avícola En nuestro país existen entidades que destacan por su producción como Jalisco, Puebla y Sonora con el 75 % de la producción de huevo en el país, y a la Región Lagunera, Querétaro, Veracruz, Aguascalientes, Jalisco y Puebla con el 60% 75% HUEVO de la producción de pollo. 60% POLLO Entorno comercial del sector avícola nacional 2012-2013 CARNE EN CANAL DE AVE IMPORTACIONES EXPORTACIONES VOLUMEN (MILES DE TONELADAS) 574 1 VALOR (MILLONES DE DÓLARES) 573 2 2012-2013 HUEVO PARA PLATO VOLUMEN (TONELADAS) VALOR (MILES DE DÓLARES) IMPORTACIONES EXPORTACIONES 47 065 9 71 330 186 ATLAS AGROALIMENTARIO 2014 SAGARPA-SIAP ESTATUS DE LA INOCUIDAD DEL SECTOR AVICOLA PROGRAMA NACIONAL DE CONTROL Y MONITOREO DE RESIDUOS TOXICOS EN BIENES DE ORIGEN ANIMAL Tamaño de Muestra Histórico del PNMCRTyC (2008 – 2014) ESPECIE 2008 2009 2010 2011 2012 2013 2014 Bovinos 300 300 300 300 300 388 400 Porcinos 300 300 300 300 300 296 300 Equinos 242 280 300 350 425 425 460 Ave 100 100 100 100 100 98 100 Miel 300 300 300 300 300 311 300 Camarón 300 300 300 300 300 250 300 Huevo 30 30 30 30 200 198 200 Leche 0 0 0 30 0 0 0 Caprino -- -- -- -- 26 30 30 Ovino -- -- -- -- 4 30 30 2015 Información obtenida del PNMCRT 2013, Criterios: (1) Codex alimentarius (2) Directiva 96/23/EC y Decisión 97/747/EC Datos de producción nacional SIAP Tamaño de Muestra Histórico del PNMCRTyC (2006 – 2015) 2006 2007 2008 2009 2010 2011 2012 2013 2014 2015 Ave 100 100 100 100 100 100 100 98 100 100 Huevo 200 30 30 30 30 30 200 200 200 200 Resultados del Monitoreo. Casos Positivos Reportados por Año. Ave Huevo 2008 12 0 2009 8 0 2010 23 0 2011 12 0 2012 8 2 2013 7 0 2014 2 0 2015* 1 0 *Información obtenida hasta el mes de mayo del 2015. Información obtenida del PNMCRT 2013, Criterios: (1) Codex alimentarius (2) Directiva 96/23/EC y Decisión 97/747/EC Datos de producción nacional SIAP AVES Total de muestras en el periodo 2009-2014 598 Total de muestras positivas en el periodo 61 Porcentaje 10.2 % Total de compuestos monitoreados 101 Total de compuestos encontrados 10 Porcentaje 9.9 % Se presenta una incidencia nacional del 29 % en el monitoreo de residuos, encontrando 10 estados con reportes de casos positivos en el periodo. De los 101 compuestos monitoreados solo se ha detectado la presencia de 10 de ellos durante el periodo comprendido del año 2009 al 2014. Reportando el metabolito de Furaltadona ( AMOZ) como el principal compuesto encontrado, con una incidencia del 40 % , seguido del metabolito de Furazolidona (AOZ) con una incidencia del 23 %. Resumen de Comportamiento de Casos Positivos por Año y Especie. BUENAS PRACTICAS PECUARIAS UNIDADES CON CERTIFICACIÓN EN BUENAS PRÁCTICAS DE PRODUCCIÓN DE POLLO DE ENGORDA 18 Unidades de CHIHUAHUA (5) producción Pavo para Engorda certificadas 5.5% Granjas certificadas con inocuidad HIDALGO (1) Pavo de Engorda JALISCO (2) Huevo para plato MICHOACÁN (10) Pollo para engorda Granjas avícolas de pollo: 160 Granjas avícolas de huevo: 165 ¿QUE VALOR TIENE EL CERTIFICARSE EN BUENAS PRACTICAS PECUARIAS? • El ofrecer productos con garantía inocua. • El reducir los riesgos de contaminación. • El tener un marco competitivo. • El asegurar la producción con inocuidad. • Desarrollar un potencial en la comercialización hacia mercados interesados en productos avícolas. ¿CUAL ES EL RETO PARA EL SECTOR AVICOLA NACIONAL? Integrar a la producción primaria los principios de seguridad y calidad y en establecimientos de manejo y envasado de bienes de origen avícola. Desarrollar un potencial en la comercialización hacia mercados interesados en productos avícolas. GRACIAS POR SU ATENCIÓN El Uso de Antibióticos en la Avicultura y la Inocuidad Héctor M. Cervantes MVZ, MSc, DACPV, Hon. MAM 23a REUNION ANUAL DEL CONASA Palacio de Convenciones Cd. Argentum Zacatecas, Zac. MEXICO LA ERA DE LOS ANTIBIOTICOS Estreptomicina Virginiamicina Gentamicina Fosfomicina Clorotetraciclina Cloranfenicol Eritromicina Neomicina Espiramicina Lincomicina Linezolid Avoparcina 1944 1947 1948 1949 1952 1954 1955 1956 1963 1963 1969 2000 Cronología del Descubrimiento de Antibióticos 1929 1945 1947 1948 1950 1954 1955 1956 1961 1962 Novobiocina Penicilina Bacitracina Cefalosporina Oleandomicina Polimixina Oxitetraciclina 1963 1999 Quinolonas Espectinomicina Imipenem Vancomicina Quinupristin Dalfopristin USOS DE ANTIBIOTICOS EN AVICULTURA • Terapéutico. • Control/metáfilactico • Preventivo/profiláctico. • Promoción del crecimiento y mejora del índice de conversión alimenticia. DEFINICIONES • Terapéutico: Cuando se administra un antibiótico a una parvada en la que las aves ya exhiben signos clínicos de la enfermedad. DEFINICIONES • Control (metafilaxis): La administración de un antibiótico a una parvada en cuanto la morbilidad o mortalidad han excedido el porcentaje normal. • Prevención (profilaxis): La administración de un antibiótico a una parvada de aves sanas pero con riesgo de exposición a una enfermedad de la cual no se ha aislado el agente etiológico. USOS DE ANTIBIOTICOS EN AVICULTURA Métodos de Administración • In-ovo. • Oral (en el agua de bebida o el alimento). • Parenteral (IM o SQ). • Tópica. • Respiratoria (aerosol). Clases de Antimicrobianos usados en la Producción Animal en Estados Unidos (US) Europa (EU), Australia (AU), Nueva Zelanda (NZ) y Latinoamérica (LA) ß-Lactamicos: Aminoglucosidos: Aminociclitol: Macrolidos: Tetraciclinas: Lincosamidas: Pleuromutilinas: Sulfonamidas: Quinolonas Fluoroquinolonas: Polipeptidos: Glucopeptidos: Estreptograminos Ionoforos Quinoxalinas Otros: Penicilinas Cefalosporinas US Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y avilamicina florfenicol flavofosfolipol Nitroimidazoles Nitrofuranos Roxarsona Y Y Y EU Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y AU Y Y Y Y Y Y Y Y Y NZ Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y LA Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y Y IMPORTANTE RECORDAR • Todos los antibióticos aprobados por la FDA han demostrado: – Eficacia en la especie animal contra el organismo o enfermedad indicada en la etiqueta. – Inocuidad en la especie de animal en que se van a utilizar. – Inocuidad en el medio ambiente. – Potencial para la creación de resistencia (desde el año 2003). EN QUE CONSISTE LA CONTROVERSIA/DEBATE • El uso de antibióticos en animales o humanos genera resistencia. • En el caso de los animales de producción la resistencia puede transmitirse a los humanos vía la cadena alimenticia y causar fallas terapéuticas. BARRERAS CONTRA LA TRANSFERENCIA Desarrollo de una cepa bacteriana resistente en el animal La bacteria sobrevive el procesamiento en el rastro La bacteria sobrevive el cocinado La bacteria resiste el HCl estomacal La bacteria coloniza al humano Causa enfermedad Falla terapéutica ? Obstáculos para la transferencia Obstáculos para la transferencia Uso del antibiótico en animales EN QUE CONSISTE LA CONTROVERSIA/DEBATE • Dos grupos opuestos: 1. Los que están a favor del principio precautorio y recomiendan restringir y disminuir el uso de antibióticos en animales de producción aunque la evidencia científica no sea conclusiva. 2. Los que están a favor de evaluar los riesgos (y los beneficios!) mediante análisis de riesgo antibiótico por antibiótico y proceder de acuerdo al riesgo de cada uno. EL PRINCIPIO PRECAUTORIO Rio Declaration on Environment and Development, Stockholm, Sweden, United Nations 1992 Publication E.73.II.A.14 Principle 15 In order to protect the environment, the precautionary approach shall be widely applied by States according to their capabilities. Where there are threats of serious or irreversible damage, lack of full scientific certainty shall not be used as a reason for postponing costeffective measures to prevent environmental degradation. EL PRINCIPIO PRECAUTORIO El problema con el principio precautorio no es que nos conduce en la dirección equivocada, sino que – si se toma en todo su valor – no nos conduce a ningún lado! The Paralyzing Principle BY CASS R. SUNSTEIN University of Chicago REGULATION WINTER 2002-2003 Componentes de un Análisis de Riesgo Aves de Producción Liberación Productos Ovo‐ cárnicos Exposición Humanos Consecuencia Componentes de un Análisis de Riesgo Aves de Producción Liberación Exposición Consecuencia COMO LLEGAMOS AQUI? • Durante décadas organizaciones como la WHO y los gobiernos de varios países escandinavos han venido ejerciendo presión para restringir y disminuir el uso y consumo de antibióticos en animales de producción. • El primer país que unilateralmente prohibió el uso de los APCs fue Suecia en 1986. • Otros países escandinavos siguieron hasta que finalmente la UE prohibió el uso de todos los APCS a partir del año 2006. COMO LLEGAMOS AQUI? • Desde entonces la UE y la WHO han puesto presión en otros países para que eliminen el uso de los APCs. • Estas presiones han resultado en la prohibición del uso de los APCs en otros países no miembros. • En los EU la FDA esta finalizando el proceso que eliminara todas las indicaciones y usos de los APCs de importancia medica. Comparación Anual de Consumo de Antibióticos (U.S.A.) 98 100 90 80 70 60 mg/kg 50 40 30 20 10 0 Humanos/mas. Anim. Prod. 9.7 Consumo de Abs D.A. Barber, JAVMA, Vol. 218, No. 10, pp. 1560-1561, May 15, 2001 ENFOQUE A LA PRODUCCION ANIMAL Resistencia Bacteriana • Los Abs son substancias producidas normalmente en la naturaleza. • Los hongos producen Abs como una medida de defensa natural y para competir favorablemente con otros organismos. • Los Abs existían en la naturaleza desde antes de que se fabricaran de manera comercial. • Las bacterias resistentes a los Abs existían mucho antes de que los Abs se usaran. More Clues that AR is a Very Complex and Ancient Phenomenon Resistencia Bacteriana • No todas las bacterias son susceptibles a todos los antibióticos: Algunas son naturalmente resistentes. Otras se tornan resistentes debido a mutaciones genéticas. • El uso de antibióticos en la mayoría de los casos generara AMR. • El mal uso y abuso de los Abs, ya sea en la medicina humana o veterinaria, incrementara y acelerara el desarrollo de AMR. INOCUIDAD Reducción de Patógenos Comparación de Prevalencia de Infección por Campylobacter Parvadas Orgánicas vs. Convencionales Infectada Orgánicas No infectada Convencionales O.E. Heuer, et.al., Letters in Applied Microbiology 2001, 33:269-274 Prevalencia de Campylobacter en Pollos criados en Sistema Orgánico vs. Convencional Referencia Origen Orgánico Conv. Significancia estadística Huer et. al., 2001 Granja 100 37 Si, P<0.001 Kramer et. al., 2003 Expendio 49 43 No Van der Zee, et. al., 2003 Expendio 36 26 Si, P<0.01 Van der Zee, et. al., 2004 Expendio 44 29 Si, P<0.01 Cui et. al., 2005 Expendio 76 74 N.D. Van Oberbeke, et. al., 2006 Granja 67 27 Si, <0.024 Luangtongkum, et. al., 2006 Granja 89 66 Si, P<0.05 Casos de Intoxicaciones Alimenticias por 100,000 Habitantes Estados Unidos Campylobacter 13 Salmonella 15 MMWR/April16, 2010/Vol. 59/No. 14/p. 419 DANMAP 2009 Dinamarca 61 39 ANTIBIOTICOS Prevención/Control of Aerosaculitis Lotes de pollos con aerosaculitis: • Peso corporal. • Contaminación fecal. • Errores de procesado. • Concentraciones de campylobacter. S.R. Russell, Poultry Sci., 82:1326-1331 Prevalencia de Salmonella spp. en Pavas Suplementadas con Varios Aditivos Tratamiento No. Pos./No. Cultivado* Sin aditivos 13/25a Monensina (79 ppm) 3/25b Virginiamicina (22 ppm) 5/25b Bambermicina (2.2 ppm) 2/25b Bacitracina (55 ppm) 13/25a * Promedio de 5 periodos de muestreo. Medias con diferente superscrito son significativamente diferentes (P<0.05) a,b Fuente: N.A. Cox, et.al., 2003. J. Appl. Poult. Res. (12): 32-36 Prevalencia de Patógenos en Porcinos Criados Sin Antibióticos o Convencionalmente Sin Antibióticos Convencionales Salmonella spp. 52% 39% Toxoplasma gondii 6.8% 1.1% Trichinella spiralis 2/616 0/616 W. Gebreyes, et al., 2008 INOCUIDAD Residuos Ovo-cárnicos IMPORTANTE RECORDAR • Actualmente no existe evidencia documentada científicamente de que los residuos ovo‐cárnicos a las concentraciones consideradas como seguras (tolerancias o MRLs) en los productos de origen animal afecten de manera adversa la salud humana. CAUSAS DE RESIDUOS Los fármacos son sin lugar a dudas la causa mas común de residuos en los productos de origen animal, especialmente los antibióticos. Uso de fármacos en animales de producción Potencial para residuos de fármacos en los tejidos Cumplimiento de los periodos de retiro Estrategias para prevenir residuos de fármacos MANEJO DE RESIDUOS EN LOS E.U.A. • Fármacos, químicos y pesticidas en los alimentos de origen animal – La FDA‐CVM es responsable de aprobar los fármacos para uso veterinario, establecer periodos de retiro y concentraciones máximas de residuos. – El Programa Nacional de Residuos (NRP) comenzó en los años 50s. – El Depto. De Agricultura (USDA) por medio del Servicio de Seguridad e Inspección de los Alimentos (FSIS) es responsable de muestrear y verificar que los residuos no excedan las tolerancias. PROGRAMAS PARA VERIFICAR RESIDUOS • Programa nacional de los E.U. – Administrado por el USDA y el FSIS. – Identifica, categoriza y analiza residuos de químicos o fármacos que pudieran contaminar los productos ovo‐cárnicos. – Incluye fármacos veterinarios aprobados y no aprobados, pesticidas y contaminantes del medio ambiente. • Cuando se detectan violaciones el FSIS decomisa las canales – Si el producto ha sido distribuido comercialmente se ordena su retiro de puestos de venta. MANEJO DE RESIDUOS EN LOS E.U.A. • Cuando los fármacos se administran de acuerdo con las indicaciones de la etiqueta la prevalencia de violaciones de residuos no superara el 1% • Desde los años 60s la prevalencia de violaciones de residuos se ha reducido significativamente. • Sin embargo, todavía existen algunos problemas pero en la avicultura. MANEJO DE RESIDUOS EN LOS E.U.A. REPORTES (RED BOOK) RED BOOK RESULTADOS ‐ POLLOS Categoría No. de No. de positivas No. de muestras (pero por abajo del violaciones nivel de violación) Porcentaje de violaciones Antibióticos 298 1 0 0.00 Pesticidas 255 0 0 0.00 Cloranfenicol 25 0 0 0.00 Nitroimidazol 288 0 0 0.00 TOTAL 866 1 0 0.00 USDA‐FSIS Red Book, 2011 RESULTADOS ‐ PAVOS Categoría No. de No. de positivas No. de muestras (pero por abajo del violaciones nivel de violación) Porcentaje de violaciones Antibióticos 239 16 0 0.00 Arsénico ‐ Maduros 258 3 0 0.00 Arsénico ‐ Inmaduros 308 3 0 0.00 TOTAL 805 22 0 0.00 USDA‐FSIS Red Book, 2011 SOLO SIRVEN CARNE DE ANIMALES CRIADOS SIN ANTIBIOTICOS (ABF) CONCLUSIONES • > 60 años de uso efectivo y seguro de Abs, sin efecto adverso para la salud humana y con grandes beneficios para la salud animal y la población mundial. • Función esencial para el mantenimiento de la salud y el bienestar animal (indirectamente la humana). • Mal uso y abuso de Abs generara AMR (medicina humana o veterinaria). • Uso de Abs en humanos es el principal generador de resistencia para humanos. UK Five Year Antimicrobial Resistance Strategy 2013 to 2018 CONCLUSIONES • Espectro de actividad de APCs = Gram + Bacterias importantes para la salud publica = Gram – • Explicación de la falta de resultados en la UE? • Entorno mas político que científico (se ignora a las mascotas). • Reducciones impresionantes en AMR sin resultados en humanos (genes de la resistencia inmutables). CONCLUSIONES • Experiencia Danesa ha demostrado que después de las prohibiciones de los APCs los problemas de AMR en humanos no han disminuido. La prohibición de los APCs no ha disminuido los casos de MRSA Año de la prohibición PREDICCION FINAL • Las mayores restricciones en el uso de APCs y Abs en general en animales de producción no tendrán un efecto positivo sobre los problemas de AMR en la medicina humana. Se Acuerdan de la Enrofloxacina? (Baytril®) % Resistencia Pollos FQ prohibida en aves 12/9/05 70 70 60 60 50 50 40 40 Humanos 30 30 20 20 10 10 0 0 Ciprofloxacina Fuente: NARMS, 2009. Ciprofloxacina Fuentes Potenciales de AMR para los Humanos Este…… Un riesgo mayor que…... Este??? GRACIAS POR SU ATENCION PREGUNTAS??? Influenza aviar Situación Sanitaria Nacional MVZ Joaquín Braulio Delgadillo Álvarez Dirección General de Salud Animal Seguridad sanitaria de los alimentos • • Directrices para la inactivación de virus de influenza aviar: Código Sanitario para los Animales Terrestres (capítulo 10.4.25) Avian Influenza: food safety issues: World Health Organization Acerca de la influenza aviar Enfermedad vírica altamente contagiosa que afecta a varias especies de aves productoras de alimentos (pollos, pavos, codornices, pintada, etc.), así como a aves de compañía y aves silvestres. Según su capacidad para causar la enfermedad (patogenicidad). • Virus de la influenza aviar altamente patógena, que se propaga rápidamente, puede ocasionar una enfermedad grave y producir altas tasas de mortalidad (hasta el 100% en 48 horas • Virus de la influenza aviar de baja patogenicidad, que puede causar una enfermedad leve, a menudo desapercibida o sin ningún síntoma en algunas especies de aves. La estrategia más eficaz para hacer frente a la influenza aviar: • Detección y alerta temprana • Confirmación rápida de los casos sospechosos • Notificación rápida y transparente • Respuesta rápida (incluido el confinamiento, la gestión del desplazamiento de las aves de corral, la zonificación y la compartimentación, el sacrificio sanitario humanitario y la vacunación, de ser apropiado). Los Servicios Veterinarios constituyen el centro del sistema de prevención y control de las enfermedades animales y cumplen una función primordial en cada país como garantes de la sanidad animal y en lo referente a las cuestiones asociadas de salud pública. Serán conformes a las normas internacionales en términos de gobernanza, organización y funcionamiento a fin de potenciar su eficiencia y capacidad de detección de los focos de enfermedades animales y de respuesta rápida para controlar la enfermedad. • • La gobernanza como medida de lucha contra los enfermedades animales emergentes y reemergentes: Ayudar a los servicios veterinarios de los paîses en desarrollo a cumplir las normas internacionales de calidad de la OIE Septiembre, 2007 Herramienta de la OIE para la evaluación de los Servicios Veterinarios (2010) Reconocimiento Seguridad Nacional TLCAN Coordinación Ejecutiva de Inspección Fitozoosanitaria Internacional Comisión de Parasitología Agrícola Ley que Ley de Sanidad crea el Sistema Fitopecuaria TIF Oficina de Sanidad Animal Leyes Federales de Sanidad Animal y Sanidad Vegetal NOM´s Reglamentos, Normas y Lineamientos Acuerdo sobre la aplicación de MSF Nuevas Ley de atribuciones: Desarrollo OGM’s y Rural Productos Sustentable Orgánicos Reingeniería del SENASICA COLABORACIÓN INTERSECTORIAL Organización Mundial de la Salud (OMS) (OPS) Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) Organización Mundial de Sanidad Animal (OIE) Organismo Internaciona l Regional de Sanidad Agropecuari a (OIRSA) Organización Mundial de Comercio (OMC) Instituto Interamericano de Cooperación para la Agricultura (IICA) CODEX ALIMENTARIUS COOPERACIÓN TRINACIONAL Plan de América del Norte para la Influenza Animal y Pandémica (NAPAPI, por sus siglas en inglés). • Vinculación técnica • Líneas de investigación • Intercambio de información • Intercambio de materiales y biológicos • Homologación de técnicas diagnósticas Bioseguridad Las medidas de bioseguridad (incluido el control de desplazamientos, la utilización de las fronteras naturales y artificiales, la gestión comercial y las prácticas agrícolas) son un factor importante para la determinación y mantenimiento del estatus sanitario de una zona o compartimento. Se pone un énfasis particular en la elaboración de recomendaciones adecuadas de bioseguridad relativas a las parvadas de traspatio. Bioseguridad y prevención de enfermedades Medidas de bioseguridad aplicables a la producción avícola: Código Sanitario para los Animales Terrestres (Capitulo 6.4) Vigilancia zoosanitaria Es esencial para la detección y alerta tempranas de la influenza aviar Tener en cuenta variables como la especie avícola en riesgo, los diferentes niveles de bioseguridad y sistemas de producción y la frecuencia de contactos de las aves de corral con las aves silvestres Directrices generales para la vigilancia zoosanitaria: Código Sanitario para los Animales Terrestres (capítulo 1.4) Directrices para la vigilancia de la influenza aviar: Código Sanitario para los Animales Terrestres (Articulo 10.4.27) CANADÁ: Columbia Británica, Ontario H5N2, H5N1 EUA RUTA MIGRATORIA DEL PACIFICO: Washington, Oregón, Idaho, California, Nevada, Utah H5N1, H5N2, H5N8 EUA RUTA MIGRATORIA CENTRAL: Kansas, Dakota del Sur, Dakota del Norte, Montana, Wyoming, Nuevo México, Nebraska H5N2 EUA RUTA MIGRATORIA DEL MISSISSIPI: Minnesota, Missouri , Arkansas, Indiana, Wisconsin, Iowa, Kentucky H5N2, H5N8 EUA RUTA MIGRATORIA DEL ATLÁNTICO: Sin casos La colaboración entre avicultores, autoridades, médicos veterinarios privados y oficiales, es la mejor opción para hacer frente a las amenazas de enfermedades trasfronterizas Confirmación rápida de casos sospechosos Muestras y diagnóstico La confirmación rápida de casos sospechosos y el diagnóstico de influenza aviar está basado en criterios oficiales. Respuesta rápida Para hacer frente a la influenza aviar, una enfermedad que puede propagarse rápidamente mediante las poblaciones de aves independientemente de las fronteras, se impone una respuesta rápida. Planes de emergencia La capacidad de un País Miembro de implementar una respuesta eficaz ante un foco de influenza aviar puede incrementarse gracias a los planes de emergencia. Planes de emergencia para el control de enfermedades: Código Sanitario para los Animales Terrestres (artículo 7.6.2) Contingency Manual RED DE LABORATORIOS LBS 3-CPA Zonificación y compartimentación Procedimientos puestos en práctica por un país para definir las subpoblaciones de distinto estatus zosanitario en el seno de su territorio al efecto del control de enfermedades y/o del comercio internacional. Lista de datos básicos para la aplicación práctica de la compartimentación en el caso de la influenza aviar y la enfermedad de Newcastle es/sanidad-animal-en-el-mundo/web-portalsobre-la-influenza-aviar/comunicaciones/cronologia-h5n1.html Zonificación y compartimentación: Código Sanitario para los Animales Terrestres (capítulo 4.3) Sacrifico sanitario El sacrificio sanitario, como medio de lucha contra un foco de influenza aviar, deberá efectuarse en condiciones humanitarias y tomando en cuenta los principios de bienestar animal. • • Directrices para el sacrificio de animales con fines profilácticos: Código Sanitario para los Animales Terrestres (capitulo 7.6) Directrices para el sacrificio de animales: Código Sanitario para los Animales Terrestres (capitulo 7.5) Descontaminación y eliminación Las estrategias para la eliminación de aves muertas deben preverse con suficiente antelación antes de la aparición de cualquier foco. Entre los principales factores a considerar cabe mencionar el número de aves implicadas, el desplazamiento de los animales infectados o expuestos, así como también de las personas y de los equipos, las cuestiones ambientales, etc. • • Directrices generales para la eliminación de animales muertos: Código Sanitario para los Animales Terrestres (capítulo 4.12) Recomendaciones generales relativas a la desinfección y desinfestación: (capítulo 4.13) Vacunación estratégica El objetivo es proteger a las aves susceptibles de una eventual infección reduciendo la incidencia o la gravedad de la enfermedad. Las estrategias de vacunación pueden resultar útiles en situaciones de emergencia ante un foco o como medida de rutina en zonas endémicas. La vacunación exige una reflexión previa y el respeto estricto de las recomendaciones de la OIE sobre la vacunación y las vacunas. Todas las políticas de vacunación deberían contener una estrategia de fin de vacunación. • • • • Documento de información de la OIE sobre la vacunación contra la influenza aviar - Recomendaciones de Verona, marzo 2007 en_factoids_H5N1_Timeline.htm Influenza aviar: Manual de Pruebas de Diagnóstico y Vacunas para los Animales Terrestres (capítulo 2.7.12) Avian Influenza Prevention and Control Strategies Including the Use of Vaccination, Presentation at 4th International Conference on Avian Influenza, December 6-8, 2006, Bamako, Mali Factors to Consider in Using Vaccination as an aid for Control and Eradication of Avian Influenza Alternativas para una eventual vacunación Búsqueda de bancos internacionales de vacuna o concentrado antigénico y/o la importación de vacuna comercial Elaboración de la vacuna en México: Laboratorio oficial (inactivada y emulsionada). Con el apoyo de laboratorios privados en la producción industrial. NORMA Oficial Mexicana NOM-055-ZOO-1995, Requisitos mínimos para la elaboración de vacunas emulsionadas inactivadas contra la influenza aviar subtipo H5N2. Animales salvajes Las estrategias para proteger a las aves de corral de la influenza aviar pueden reforzarse si se entiende mejor el comportamiento del virus en las aves silvestres, que constituyen un importante vector de transmisión del virus a través de las fronteras. Se exhorta a los Países Miembros a investigar y notificar los casos de influenza aviar en las aves silvestres. La divulgación rápida y extensa de los datos de la influenza aviar en las aves silvestres será de utilidad para todos los países. Recommendations from the FAO/OIE International Scientific Conference on Avian Influenza and Wild Birds, May 30-31, 2--6, Rome, Italy Wetlands International Riesgos de dispersión de plagas y enfermedades Consideraciones sobre la importación/exportación Las medidas de prevención y control como la vigilancia y notificación de casos de influenza aviar en aves silvestres y la vacunación de las aves de corral no deben conducir a restricciones comerciales injustificadas. • • Obligaciones generales: Código Sanitario para los Animales Terrestres (capítulo 5.1) Procedimientos de importación y exportación: (capítulo 5.2) Indemización La compensación financiera para los productores a quienes se les destruyen los animales infectados o en contacto es un factor clave para la transparencia en la notificación de los casos de influenza aviar. VINCULACIÓN TECNICA E INVESTIGACIÓN Comisión Auxiliar de Sanidad Avícola Evaluación de la vacuna H7N3 • Demostrar que los anticuerpos vacunales tienen la capacidad de neutralizar el virus de campo. • Determinar sus posibles efectos colaterales. • Establecer las características fisicoquímicas y de inmunogenicidad. • Estimar niveles de anticuerpos maternos transferidos. • Realizar estudios epidemiológicos de cartografía antigénica y de secuenciación de HA para conocer cambios antigénicos y mutaciones. El SENASICA ha puesto en marcha una serie de acuerdos y programas para impulsar la modernización y acometividad de la industria avícola a nivel nacional y regional. ACUERDO BINACIONAL MEX-EUA ACUERDO DE ENTENDIMIENTO DE SANIDAD AVÍCOLA MEX-CAN-EUA (Establecer un marco de referencia técnico y científico que promueva la cooperación operativa y el intercambio de información) (Proteger la sanidad avícola en la Región y atender situaciones de carácter comercial con fundamento técnicocientífico y la participación de las asociaciones de productores de los tres países) ACUERDO DE DISTANCIAS ENTRE LAS UNIDADES DE PRODUCCIÓN AVÍCOLA PROGRAMA NACIONAL DE SANIDAD Y PRODUCCIÓN AVÍCOLA (Propiciar la reubicación y la reingeniería de la industria avícola en beneficio de las buenas prácticas de producción y bioseguridad) (Establecer los objetivos, las estrategias y líneas de acción para una nueva y moderna política de sanidad y producción en la industria para mejorar su situación sanitaria y la competitividad) Influenza aviar notificable Dr. Assad Heneidi Zeckua Epidemiólogo cer8ificado y Analista de Riesgo ! Es una enfermedad de las aves causada por virus de influenza 4po “A” que puede afectar a varias especies de aves domés4cas, aves de compañía y silvestres. ! Se han aislado virus de influenza aviar en algunas especies de mamíferos: ratas, ratones, comadrejas, hurones, cerdos, gatos, 4gres, perros, caballos así como en los humanos. ! La IA puede clasificarse en dos categorías según la gravedad de la enfermedad en las aves: ! Influenza causada por virus de baja patogenicidad: produce pocos o ningún signo clínico ! Influenza de alta patogenicidad: produce varios signos clínicos graves y altas tasas de mortalidad ! Animales vivos infectados (en periodo de incubación) ! Huevo fér4l contaminado ! Productos cárnicos contaminados ! ! ! ! ! ! ! ! ! Prevalencia de la enfermedad en la region Zonificación/compar4mentacion Tipo de vigilancia y muestreo epidemiologico Can4dad y 4po de muestras obtenidas Técnicas diagnós4cas realizadas Periodicidad del muestreo Trazabilidad de mercancías avícolas Cer4ficación oficial Tipo y forma de traslado de mercancías ! Can4dad de mercancía que se prevé importar ! Probabilidad de infección o contaminación por el agente biológico ! Efecto de los procedimientos de transformación, almacenamiento y transporte ! Uso de la mercancía en des4no ! Riesgo de exposición ! Población suscep4ble y expuesta ! Medidas de mi4gación aplicadas en origen y des4no ! Otros ! Huevo fér4l ! Pollito y pollita recién nacidos ! Productos cárnicos Ar$culo 10.4.8. Para las aves de corral de un día vivas: ! Las autoridades veterinarias deberán exigir la presentación de un cer.ficado veterinario internacional que acredite que las aves de corral: ! Permanecieron en un país, una zona o un compar.mento libres de infección por los virus de la influenza aviar de alta patogenicidad desde su nacimiento; ! Descienden de parvadas parentales que permanecieron en una explotación libre de influenza aviar durante, por lo menos, los 21 días anteriores a la recolección de los huevos y durante la recolección; ! Se transportan en contenedores nuevos o debidamente desinfectados. ! Si las aves de corral o las parvadas parentales se vacunaron contra la influenza aviar, deberá adjuntarse al cer.ficado la documentación que especifique la naturaleza de la vacuna empleada y la fecha de la vacunación. OIE Ar$culo 10.4.9. ! Independientemente del estatus sanitario del país de origen, se deberá exigir la presentación de un cer.ficado veterinario internacional que acredite que: ! Las aves no manifestaron ningún signo clínico de infección viral que pudiera considerarse influenza aviar de las aves de corral el día del embarque; ! Las aves permanecieron desde su nacimiento en condiciones de aislamiento aprobadas por los Servicios Veterinarios; ! Las aves de la parvada parental se some4eron, en el momento de la recolección de los huevos, a una prueba de diagnós4co para demostrar la ausencia de infección viral que pudiera considerarse influenza aviar de las aves de corral; ! Las aves se transportan en contenedores nuevos o debidamente desinfectados. ! Si las aves o las parvadas parentales se vacunaron contra la influenza aviar, deberá adjuntarse al cer.ficado la documentación que especifique la naturaleza de la vacuna empleada y la fecha de la vacunación. Ar]culo 10.4.19. ! Para las carnes frescas de aves de corral ! Las autoridades veterinarias deberán exigir la presentación de un cer.ficado veterinario internacional que acredite que toda la remesa de carnes frescas procede de aves de corral que: ! permanecieron en un país, una zona o un compar.mento libres de infección por los virus de la influenza aviar de alta patogenicidad en aves de corral desde su nacimiento o durante, por lo menos, los 21 úl4mos días; ! se sacrificaron en un matadero autorizado situado en un país, una zona o un compar.mento libres de infección por los virus de la influenza aviar de alta patogenicidad en aves de corral y se some4eron, de acuerdo con el Capítulo 6.2., a inspecciones antemortem y postmortem en las que fueron reconocidas libres de signos que pudieran achacarse a la influenza aviar. ! México es un país dependiente de pie de cría y de algunos productos y subproductos avícolas ! La concentración y hacinamiento de unidades de producción es variada ! Los riesgos sanitarios son diversos conforme a los riesgos de introducción, exposición y a sus consecuencias sanitarias, económicas, comerciales, sociales, culturales, polí4cas y en su caso de salud pública ! Las medidas de mi4gación aplicables pueden ser diversas ! Iden4ficar los factores de riesgo sanitario por 4po de mercancía avícola a importar ! Establecer la probabilidad de difusión y exposición del virus de influenza aviar ! Emi4r el dictamen sobre la evaluación del riesgo ! Comunicación del riesgo iden4ficado ! Establecer las medidas de mi4gación, según sea el caso ! Vigilar las medidas de mi4gación implementadas aheneidi@gmail.com Salud y Producción Avícola Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México Nov. 2015 1 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México Antecedentes sobre Influenza Aviar en Norte América: • En 1984: rotes causados por el virus Tipo A, Subtipo H5N2 de Alta Patogenicidad en los estados de Pennsylvania, Nueva Jersey y a la Península del Delmarva. • Entre 1994 y 1995: Otro virus de H5N2 afectó la avicultura de México. • En 2002, un virus de Alta Patogenicidad (IAAP) A/H7N3 azotó a Chile. • Entre 2012 y 2013, un orthomyxovirus A/H7N3 de IAAP, afectó de nuevo a avicultura mexicana. • En Diciembre pasado, en Canadá se reportó a la OIE, la presencia de un virus A/H5N2 de Alta Patogenicidad, en la Provincia de Columbia Británica. Nov. 2015 2 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México Antecedentes sobre Influenza Aviar en Norte América: • Diez días después, se comunica la presencia del subtipo H5N8 en Oregon. • Un día después se reportaron otros aislamientos virales A/H5N8 y A/H5N2 en el Condado en el Estado de Washington • En Enero de este año se comunica la presencia de otro virus A/H5N8 de Alta Patogenicidad cerca de Modesto, California. • En Belice se reportó serología positiva, pero no aislamiento viral, del tipo A/H5N2 de Baja Patogenicidad. • Para julio de este año el virus H5N2 de Alta Patogenicidad, ha causado la muerte y/o sacrificio de casi 50 millones de aves en 20 estados de la Unión Americana con cientos de millones de dólares de perdidas. Nov. 2015 3 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México Nov. 2015 Situación de la Influenza Aviar de Alta Patogenicidad Julio, 2015 Sistema de Información de la Organización Mundial para la Salud Animal WAHID-OIE Fotografías y mapa: Dr. Miguel Angel Márquez 4 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México • • Actualmente sigue vigente la NOM 055: Requisitos mínimos para la elaboración de vacunas emulsionadas inactivadas contra la influenza aviar subtipo H5N2. Publicada: 29 de junio de 1998 – 1ª semilla: A/CHICKEN/MEXICO/232/94/CPA, avirulenta. – Procedencia: Comisión México - Estados Unidos para la Prevención de Fiebre Aftosa y otras Enfermedades Exóticas. – El título de virus de influenza aviar será de: 10E8.7- 10E9.0 DIEP 50%/ml y/o un mínimo de 32 U HA. – La vacuna inactivada de influenza aviar podrá combinarse únicamente con fluido viral inactivado de virus de la enfermedad de Newcastle. Nov. 2015 5 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México Situación actual reuniones Comité IA DGSA-INFARVET Dr. Joaquín Delgadillo.• El tema de la IA es vigente por su alto impacto en la producción pecuaria y potencial de zoonosis en salud pública. • Se requiere la colaboración de la industria farmacéutica veterinaria para contar con mejores vacunas. • En los trabajos realizados con CASA se menciona que: • Es necesario la actualización de la semilla vacunal H5N2. • Afirmó que se aceptarán para constatación, vacunas que contengan la secuencia del virus aislado en el 2015 (A/chicken/Guanajuato/07437-15/2015 (H7N3) segmento 4, gen HA). Nov. 2015 6 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México (A/chicken/Guanajuato/07437-15/2015 (H7N3) segmento 4, gen HA) Nov. 2015 7 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México Presentación Lic. Jorge García de la Cadena. • Se requiere trabajo conjunto entre la Industria Farmacéutica Veterinaria, SAGARPA/SENASICA y los productores para tener éxito en la estrategia sanitaria. • Contar cada año con una vacuna actualizada en cuanto sus cepas. Nov. 2015 8 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México Resumen de la Mesa Redonda sobre Influenza Aviar realizada el jueves 8 de octubre de 2015. Comentarios Dr. Víctor Rodríguez. • Se ha trabajado de forma expedita para desarrollar alternativas de vacunas para las cepas de H7N3 de acuerdo a los lineamientos oficiales. • Hay 4 empresas que han entregado propuestas de vacunas de nueva generación. Comentarios Dr. Eduardo Lucio. • La Industria Farmacéutica Veterinaria ha transitado 20 años básicamente con con el mismo marco regulatorio respecto a vacunas . • El marco normativo actual impide la actualización de las semillas cada año, como se realiza con la vacuna humana • Los laboratorios de la industria coadyuvan en los esfuerzos sanitarios de la SAGARPA/SENASICA para el adecuado control y eventual erradicación de la IA. Nov. 2015 9 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México Vacunas H5 N2 (IA y IA + NC) H7N3 (IA) Total dosis estimadas % INCREMENTO 2010 1,695 1,695 Dosis estimadas ´000,000 2011 2012 2013 1,819 1,997 2,244 560 1,819 1,997 2,805 7% 10% 40% Da tos es ti ma dos Dr. Mi ra ndé Nov. 2015 2014 3,338 535 3,874 38% Proyeccci ón Dr. Mi ra ndé + MVM 10 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México Tecnología actual de vacunas: • Inactivadas con el virus completo: (Embrión de Pollo o Cultivos Celulares). • In vitro, expresando HA u otras proteínas. • Cultivos de células eucarióticas: • Plantas. • Levaduras. • Bacterias. • In vivo, expresando HA u otras proteínas: • Virus: Viruela, Vaccinia, Laringo, Marek, Newcastle. • Bacterias: Salmonella. • Ácidos nucleicos desnudos. Harrisvaccines Nov. 2015 David E. Swayne and David L. Suarez 11 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México Aspectos positivos de la aplicación de las vacunas: • • • • • • Aumentan la resistencia a las infecciones por IA. Previenen los signos clínicos y la mortalidad. Reducen la dispersión del virus de campo. Previenen la transmisión por contacto. Proporcionan protección por un tiempo razonable. Protegen contra el virus de desafío, pero esta protección es por un tiempo finito. Aspectos negativos: • Infecciones silenciosas. • Se requieren métodos y procedimientos de vigilancia (virológicos y serológicos). David E. Swayne and David L. Suarez Nov. 2015 12 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México Necesidades para mejorar las vacunas: • Métodos de inmunización masiva. • Agua. • Alimento. • Aerosol. • In Ovo. • Usar la biotecnología para direccionar las derivaciones genéticas y el contenido antigénico de las vacunas. • Vacunas combinadas. • Mejora de adyuvantes. • Incremento de la inmunidad con menos vacunaciones. • Calidad consistente de las vacunas inactivadas actualizando las cepas. David E. Swayne and David L. Suarez Nov. 2015 13 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México • CAPÍTULO VII • DE LA ELABORACIÓN Y APLICACIÓN DE VACUNAS • ARTÍCULO 37. • Los laboratorios autorizados podrán solicitar la autorización de: – Vacunas derivadas de la biotecnología. • Como requisito: – Deben controlar la infección y excreción viral. – Evaluar el cambio de la cepa vacunal: – Evidencias técnicas y científicas que justifiquen el cambio. » Realizados por parte de los laboratorios oficiales de diagnóstico. » Cambios antigénicos de los aislamientos. Nov. 2015 14 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México • Artículo 38: • En zonas de escasa prevalencia se podrán aplicar: – Vacunas emulsionadas y derivadas de la biotecnología. • En zonas sin circulación viral y vacunación preventiva: – Únicamente vacunas derivadas de la biotecnología: • A partir de información genética de cepas de baja patogenicidad circulantes en el país. • Con una similitud mínima del 97% en la hemoaglutinina. • A la constatación de la vacuna hay que demostrar que hay tasas bajas de infección y disminución de la excreción del virus de baja patogenicidad. Nov. 2015 15 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México • Artículo 39: • Prohibida la producción, comercialización, importación y aplicación de vacunas con virus vivo. • ARTÍCULO 40. • Protocolos de fabricación con Buenas Prácticas de Manufactura aprobados por el SENASICA. • Contar con infraestructura, procedimientos, áreas y medidas de bioseguridad para el manejo del virus de IA de baja patogenicidad . • Contar con procedimientos de fabricación que aseguren: – La inactivación, correcta eliminación y disposición sanitaria de embriones de pollo y todos los materiales de fabricación contaminados con el virus de IA. Nov. 2015 16 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México • Artículo 40: • • Protocolos de fabricación aprobados por el SENASICA. Para el caso de la vacuna del tipo H7N3: – Volumen mínimo del 20% de masa antigénica, con un título viral de 109 DIEP50/mL antes de la inactivación y un contenido de 512 UHA/dosis (en un volumen de 0.2 a 0.5 ml dependiendo la presentación de 1,000 o 2,500 dosis). – Protocolos de inactivación. – Formulación de emulsiones . – Pruebas de control de calidad. – H5N2: De acuerdo con NOM 055. • • Cumplir con las pruebas de inocuidad y desafío. (protocolos oficiales de constatación) Vacuna H7N3: Solo registro temporal. Nov. 2015 17 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México • Artículo 40: • El registro será para un producto de venta controlada en México. • La Secretaría evaluará los casos en que haya interés de registros para exportación. • Capacidad instalada para la producción de dicho producto biológico. • El uso de la vacuna estará bajo estricto control oficial. • Artículo 41: • Exportación: – SENASICA aportará aislamientos y semillas maestras a partir de las cepas vacunales oficiales. – SENASICA podrá autorizar a los laboratorios a elaborar sus propias semillas maestras a partir de un aislamiento o una semilla maestra entregada por SENASICA. Nov. 2015 18 Mesa Redonda: Influenza Aviar: Herramientas biológicas para su control en México ARTÍCULO 47. • Vacunas importadas: • Deberán registrarse. • Elaborarse con una cepa inactiva de baja patogenicidad. • Derivada de una semilla oficial: • Que no interfiera en las actividades de vigilancia epidemiológica. • Que proteja a las aves contra la IA. • Demostrar que aumenta la resistencia a la infección . • Demostrar que reduce la excreción viral. Nov. 2015 19 !GRACIAS¡ Nov. 2015 20