Mecanismos de Resistencia a Antibióticos
Anuncio

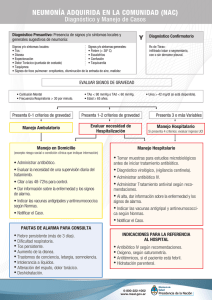
Mecanismos de Resistencia a los Antibióticos ß-lactámicos y Glicopéptidos Dra Daniela Centrón UBA/CONICET Mecanismos de resistencia a antibióticos, 2016 *Eflujo del antibiótico *Impermeabilidad al antibiótico *Inactivación enzimática *Protección del blanco *Modificación del blanco *Vía alternativa del antibiótico *Formación del biofilm *PUEDEN SER ADQUIRIDAS POR TRANSFERENCIA HORIZONTAL DE GENES (HGT) TIPOS DE RESISTENCIA NATURAL: propia del microorganismo. ADQUIRIDA: es aquel tipo de resistencia que determinada especie ha adquirido a lo largo del tiempo. TIENE MAYOR IMPACTO A NIVEL CLÍNICO Se habla de resistencia en tres niveles Mecanismo de resistencia: codificado por la célula bacteriana Resistencia poblacional Resistencia de una población que está produciendo una infección 1-Mecanismo de resistencia Mecanismo molecular utilizado por la célula bacteriana para resistir la acción de los antimicrobianos. *Eflujo del antibiótico *Impermeabilidad al antibiótico *Inactivación enzimática *Protección del blanco *Modificación del blanco *Vía alternativa del antibiótico *Formación del biofilm 2-Resistencia poblacional Capacidad de una cepa de resistir a la acción de una concentración dada de un antibiótico en un medio de cultivo. 3-Resistencia de una población que está produciendo una infección Eficacia Terapéutica Problemática de la resistencia a antibióticos Multirresistencia y evolución a la extrema resistencia Alta frecuencia de aislamientos multirresistentes a nivel mundial Mayor porcentaje de cepas multirresistentes en nuestro país Cepas “pan-resistentes” en nuestros hospitales SOLUCIONES Vigilancia epidemiológica y el control de infecciones en nuestro país USO RACIONAL DE ANTIBIOTICOS Resistencia a los -lactámicos Características de los -Lactámicos Todos tienen igual blanco de acción: la inhibición de las PBPs lleva a la inhibición de la síntesis del peptidoglicano Mecanismo de acción de Antibióticos -lactámicos Canal de Porina Abierto Lipopolisacárido Proteína de Transp Pared Celular Lipoproteína -Lactámico Espacio Periplásmico Βeta-Lactamasas Peptidoglicano Membrana Celular Proteína de Unión a Penicilina Proteína de Membr -Lactámico Pared bacteriana Membrana Citoplasmática Citoplasma PBPs L-Ala racemasa Péptido glicano de S. aureus D-Ala + PBPs ligasa Ddl PBPs D-Ala-D-Ala UDP carboxipeptidasa transpeptidasa transglicosilasa MurF tripéptido L-Ala-D-Glu-L-Lys PBPs UDP Carrier de lípidos glicopéptido pentapéptido acido N-acetilmuramico N-acetilglucosamina Membrana Citoplasmática Pared bacteriana Citoplasma PBPs L-Ala D-Ala + PBPs D-Ala-D-Ala PBPs carboxipeptidasa transpeptidasa transglicosilasa glicopéptido PBPs UDP pentapéptido -lactámicos acilan el sitio activo de la serina de las PBPs, inhibiendo la formación del péptido glicano. (a) penicilina a) Estructura de la penicilina (R es variable). b) La conformación tridimensional de D-Ala-D-Ala es similar a la de la penicilina. Penicilinas Naturales (penicilina G, penicilina VK) Penicilinas Resistentes a las Penicilinasas (nafcilina, oxacilina, meticilina) Aminopenicilinas (ampicilina, amoxicilina) Carboxipenicilinas (carbenicilina, ticarcilina) Ureidopenicilinas (piperacilina, azlocilina) Primera Generación de Cefalosporinas (Cefazolina, Cefalotina (parenteral) Cefalexina (oral)) Segunda Generación de Cefalosporinas (Cefaclor, Cefuroxima (Orales), Cefamandole, Cefuroxima, Cefotetan (Parenterales), Cefoxitina) Tercera Generación de Cefalosporinas (Cefixima (Oral), Cefotaxima,Ceftazidima,Cefoperazona, Ceftriaxona) Cuarta Generación de Cefalosporinas (Cefepime) Carbapenemes (Imipenem, Meropenem) Monobactamos (Aztreonam) Efecto Terapéutico Bactericida Penicilina Activa frente a Cocos Gram Positivos Aerobios y Anaerobios También es activa frente a Cocos Gram Negativos Aerobios, como por ejemplo Neisseria spp. Cefalosporinas Aislada en 1948 en la costa de Cerdeña a partir de Cephalosporium acremonium Relacionado con las penicilinas por su estructura y mecanismo de acción Más resistente a las β-lactamasas Clasificación de las Cefalosporinas Primera generación Segunda generación Tercera generación Cuarta generación Quinta generación Al aumentar la generación, se incrementa la susceptibilidad a bacterias Gram -, se incrementa la resistencia a las β-lactamasas y disminuye la eficacia frente a las Gram +. Primera Generación Cocos Gram +, bacilos Gram -, anaerobios de la cavidad bucal Staphylococcus aureus MS, Proteus mirabilis, E. coli, Klebsiella pneumoniae Cefazolina, Cefalotina (parenteral) Cefalexina (oral) Segunda Generación Menos activa contra Gram+ y más contra Gram Haemophilus influenzae, Enterobacter aerogenes, Neisseria spp. Cefaclor, Cefuroxima (Oral) Cefamandole, Cefuroxima, Cefotetan, (Parenteral) Cefoxitina- Bacteroides fragilis Utilizada con aminoglucósidos en infecciones Gram - Tercera Generación Más bacilos Gram –, Serratia marcescens Cefixima (Oral) Cefotaxima Ceftazidima Cefoperazona Ceftriaxona Cuarta Generación Espectro similar a las cefalosporinas de tercera generación Más resistente a las β-lactamasas Cefepime Carbapenemes β-lactámico sintético Difiere de las penicilinas en un átomo azufre en el anillo tiazolidina Imipenem Amplia el espectro de los β- lactámicos frente a los Gram+ y – productores de penicilinasas, anaerobios y Pseudomonas spp.. Mayor resistencia a la hidrólisis de las β-lactamasas. Meropenem Ertapenem Monobactamos Pequeño espectro: Enterobacteriaceae, Pseudomonas; inactivo frente a Gram + o bacterias anaeróbicas Resistente a β-lactamasas Aztreonam TODOS los ATB -lactámicos Mecanismos de resistencia producción de β-lactamasas más importante y más común Hidroliza el anillo beta-lactámico causando inactivación alteración en las PBPs que lleva a baja afinidad por el antibiótico -lactámico alteración de la membrana externa llevando a disminución de la entrada del antibiótico -lactámico eflujo del ATB vía alternativa para el antibiótico -lactámico producción de biofilm Mecanismo de acción de las β-lactamasas PBP β-lactámico PBP H2O + Enzima PBP serin β-lactamasas Antibiótico β-lactámico inactivo pentapéptido Aumento de -lactamasas según Bush y Jacoby GES-1, CTX-M-2 KPC-2 OXA-23, OXA-48, OXA-51, OXA-58 CMY-2 SPM-1, VIM-2, VIM-11, IMP-8, IMP-13 (Bush K and Jacoby G, AAC, 2010) Inhibidores de las β-lactamasas Una alternativa para resolver el problema de la resistencia a los antibióticos ß-lactámicos consiste en diseñar inhibidores enzimáticos para que puedan administrarse en combinación con un antibiótico. Acido clavulánico, Sulbactam y Tazobactam (unión irreversible de la enzima por eso « inhibidores suicidas »). Inhibidores de las β-lactamasas El espectro antimicrobiano de los Inhibidores de ß-lactamasas, varía de acuerdo al ß-lactámico con el que ha sido combinado. Número de Bacterias Viables Control (SIN drogas) Acido clavulánico Amoxicilina Acido clavulánico + Amoxicilina Tiempo Frecuencia de especies aisladas en H1 Problemática de la resistencia a Antibióticos -lactámicos en las Enterobacterias (Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Serratia marcescens, etc.) Lipopolisacárido Pared Celular Producción de -lactamasas Proteína de Transp Canal de Porina Abierto Canal de Porina Cerrado Lipoproteína -Lactámico Espacio Periplásmico --Lactamasas Peptidoglicano Membrana Celular Proteína de Unión a Penicilina Proteína de Membr -Lactámico La familia de ß-lactamasas TEM & SHV en evolución en repuestaa la introducciónde los antibióticos semisintéticos ß-lactámicos Ingeniería Genética "Natural" desde 1960 Resistencia a antibióticos ß-lactámicos y a los inhibidores de ß-lactamasas Cefotaximasas CTX-M-grupo 1 ISEcp1 IS26 ISEcp1 IS Ecp1 Kluyvera cryocrescens CTX-M-grupo 9 Orf 513 ISEcp1 Orf 513 Kluyvera ascorbata CTX-M-grupo 2 CTX-M-grupo 25 CTX-M-grupo 8 Kluyvera georgiana Las β-lactamasas adquiridas se localizan en Integrones y en Transposones Sistema Integrón/Cassettes Pc attI intI Pc attI intI Integrones de clase 1 intI1 blaVIM-2 VR1 qacEΔ1 sul1 orf5 Invasión de transposones en los integrones de clase 1 intI ISCR1 blaCTX-M-2 VR2 Movilización y Asociación de elementos móviles (Arduino et al., 2002, Arduino et al., 2002, Quiroga et al., 2007) Enterobacterias 1982-1989 Selección con Antibióticos aac(6´)-Ib aac(6´)-Ib blaOXA-2 orfD Selección con Antibióticos aac(6´)-Ib blaOXA-2 orfD 2015 ISCR1 blaCTX-M-2 orf3 Orígenes de blaCTX-M-2 ...... aac(6´)-Ib blaOXA-2 orfD ISCR1 blaCTX-M-2 orf3 3000 pb Gen ubicuo de Kluviera ascorbata TRANSFERENCIA HORIZONTAL DE GENES Plataforma genética de blaCTX-M-2 de Argentina aac(6´)-Ib blaOXA-2 orfD Tn21 Tn5036 rhsD IS4321 tnpA tnpR IRi qacEΔ1sul1 ISCR1 blaCTX-M-2 qacEΔ1sul1 orf5 tnpA tnpR blaTEM-1 aacC2 catA2 ΔtniB tniA IRt merE merD AHORA Emergencia de resistencia a carbapenemes en enterobacterias..... 1986-2008 aac(6´)-Ib blaOXA-2 orfD aac(6´)-Ib blaOXA-9 aac(6´)-Ib-cr blaOXA-2 aadB catB3 aac(6´)-Ib blaIMP-13aac(6´)-Ib OCTUBRE 2008 (Pasterán F, 2008) 2008!!!Emergencia de blaKPC RESISTENCIA A TODOS LOS ANTIBIÓTICOS ß-LACTÁMICOS!!!!! Localizada en un transposón (Pasterán F, et al., 2008) Perfil de susceptibilidad de cepas de K. pneumoniae productoras de blaKPC-2. Antibiótico Antibiótico Amikacina I Cloranfenicol R Amox/clav R Ciprofloxacina R Ampicilina R Ertapenem R Aztreonam R Gentamicina R Cefazolin R Imipenem R Cefpodoxima R Meropenem R Cefotaxima R Pipercilina/Tazo R Cetotetan R Tobramicina R Cefoxitina R Trimet/Sulfa R Ceftazidima R Polymyxin B MIC >24mg/ml Ceftriaxona R Colistin MIC >24mg/ml Cefepime R Tigeciclina S K. pneumoniae en H1 58 60 CTXM-2 50 50 porcentaje de resistencia 50 40 CTXM-2,CTXM-1 ,AmpC Plasm. KPC EXTREMA RESISTENCIA Cefs 3º y 4º Ciprofloxacina Imipenem Colistin 30 20 11 8 10 0 1996-1998 1999-2000 2001-2002 2003-2004 años 2005-2006 2007-2008 2009-2010 Del fenotipo al genotipo en las enterobacterias K. pneumoniae productora de PER-2 CTX 2,5 a 3cm. CAZ AMC K. pneumoniae productora de CTX-M-2 CTX CTX- CLAV CONFIRMACIÓN POR PCR Del fenotipo al genotipo en las enterobacterias IMI EDTA, 1uM IMI MERO IMI + EDTA blaVIM Detección de las BLEE en el laboratorio...... K. productora de CTX-M-2 K. pneumoniae productora de PER-2 CTX ATB por difusión E-Test 2,5 a 3cm. CAZ AMC CTX 6mm CTX- CLAV De RUTINA en el laboratorio de Bacteriología Problemática de la resistencia a Antibióticos -lactámicos en Acinetobacter baumannii Resistencia a Carbapenemes en Acinetobacter baumannii Cepas de Acinetobacter spp. Resistentes a los carbapenemes en el mundo. Los integrones y transposones que poseen los genes que codifican para las -lactamasas se localiza en la isla genómica AbaR de A. baumannii Transformación Chicos!! Al agua!! El último es un Staphylococcus!!!! Puede adquirir ADN exógeno por Transformación ya que es transformante natural (100 veces mas competente que Staphylococcus spp.) A. baumannii en H1 100 93 90 Imipenem 80 Minociclina Clones endémicos I, III, IV OXA-23, OXA-58 70 60 % de resistencia 50 40 30 27 57 Heteroresistencia a colistin. Casos Clínicos Aislamientos resistentes a doxiciclina 38 20 10 0 19961998 19992000 20012002 20032004 20052006 20072008 20092010 Problemática de la resistencia a Antibióticos -lactámicos en Pseudomonas aeruginosa. Resistencia natural en Pseudomonas aeruginosa No ß-lactámicos Cloranfenicol Tetraciclinas Macrolidos Glicopeptidos CoTrimetoxazol Viejas quinolonas (acido nalidixico) ß-lactámicos Aminopenicilinas (ampi, amoxi) Aminop. + inhibidores Cefalosporinas 1ra y2da (cefalotina, cefuroxima) Cefotaxima* Cefoxitina Ticarcilina-clavulánico* * Sensibilidad in vitro, Resistencia in vivo www.pseudomonas.com Mecanismos de la Resistencia natural PERMEABILIDAD ALTERADA INACTIVACIÓN ENZIMÁTICA B-LACTAMASAS CROMOSOMICAS, etc, etc Resistencia adquirida a -lactámicos MODIFICACION ENZIMATICA EFLUJO IMPERMEABILIDAD MODIFICACION ENZIMATICA Hay más de 50 -lactamasas descriptas en P.aeruginosa localizadas en transposones e integrones que a su vez se encuentran en plásmidos conjugativos. EFLUJO RESISTENCIA ADQUIRIDA A AMINOGLICOSIDOS, MEROPENEM, NUEVAS QUINOLONAS -LACTAMICOS, EN FORMA CONJUNTA (Nikaido H., Current Opin. Microbiol. 1; 516-523: 1998) Comparación de BIC y MIC de aislamientos de P. aeruginosa (µg/ml) BIC50 Amicacina (90) Azitromicina (90) BIC90 Rango MIC50 MIC90 Rango 32 256 4->256 16 128 0.5->128 2 32 0.5->32 NA NA NA Aztreonam (85) >128 >128 2->128 4 32 2->64 Ceftazidima (88) 128 >128 2->128 2 16 0.5-512 <0.25->16 1 4 0.25-16 Ciprofloxacina (90) 0.5 4 Claritromicina (90) 32 >32 0.5->32 NA NA NA Doxiciclina (86) >64 >64 1->64 16 32 1->32 Gentamicina (90) 16 >64 1->64 8 >32 1->32 Meropenem (87) 4 64 1->64 1 8 1-16 256 >512 16->512 4 128 1-1,024 512 >512 16->512 16 256 2->4,096 4 32 1->64 2 32 0.25->512 Piperacilina-ta zobactam (85) Ticarcilina-cla vulanico (72) Tobramicina (92) (Moskowitz SM, J Clin Microbiol. 2004) Cepas “Mutators” en P. aeruginosa Existe una variable presencia de “mutators”: < 1% en las poblaciones naturales 1% en infecciones crónicas o en bacterias colonizantes 10% de clones epidémicos de N. meningitidis Serogrupo A 25% de pacientes dispépticos portadores de H. pylori 30% de P. aeruginosa en pacientes con fibrosis quística “Mutators” débiles mantienen la resistencia antibiótica La transferencia horizontal de genes y la recombinación más eficientes en estas cepas Problemática de la resistencia a Antibióticos -lactámicos en Streptococcus pneumoniae . Incidencia de la Resistencia a la penicilina en Streptococcus pneumoniae : FRANCIA: 36% ESPANA: 29% ARGENTINA: 21% HUNGRIA, USA: 12% PORTUGAL: 6.9% ALEMANIA: 1.5% SUECIA: 1.5% La resistencia de S. pneumoniae a penicilina (CIM>2mg/l) se correlaciona con sensibilidad intermedia a amoxicilina, cefuroxima, cefotaxima y a ceftriaxona Modificación del blanco de acción Estructura mosaico del gen de la PBP2b de aislamientos resistentes a β-latámicos. PBP 2B Czechoslovakia (1987) South Africa (1978) USA (1983) S. pneumoniae = Streptococcus ? (Science 1994;264:388-393) ALTERACIONES EN PBPs SENSIBILIDAD (CIM ug/ml) SENSIBLE (<0.1) PBP 1A,2X PBP 1A,2X,2B PBP 1A,2X,2B,2A Disco de oxacilina buen predictor de la S a PEN INTERMEDIA (0.1-1) ALTA RESISTENCIA ( >=2) OXA>20 mm CIM ≤ 0.06 ug/ml S. pneumoniae aislado en pacientes con meningitis en H2 35% 31.5% N=19 30 25 20 Penicilina C3G 15 10 5.2% 5 0 Penicilina C3G De marzo 1997 a marzo 2003. Problemática de la resistencia a Antibióticos -lactámicos en Staphylococcus aureus. . Línea temporal de eventos S. aureus 90% mortalidad Resistencia por -lactamasa Resistencia a meticilina 2015 1900 1928 Descubrimiento 1940 Penicilina de la Penicilina comienza a comercializarse, sintesis de cefalosporinas 1959 Meticilina 50% de los aislamientos clínicos resistentes a la meticilina Mecanismo de la vía alternativa del antibiótico Gen mecA Generalmente ligada a resistencia antibiótica acompañante: PBP 2a aminoglucósidos, macrólidos, quinolonas, cloranfenicol, tetraciclina, TMS. R a TODOS los β-lactámicos Meticilino-Resistencia Transducción ADN del fago Cromosoma bacteriano Bacteria lisogénica Lisis SAMR no solo se aisla en pacientes hospitalarios, sino que es importante agente etiológico de la comunidad. Es llamado SAMR-CA Estudio del comportamiento epidemiológico de SAMR-CA 1999, reporte de 4 muertes pediátricas debidas a CA-MRSA 2004, reporte de 15 muertes en Uruguay 1993, pacientes de comunidades remotas del oeste de Australia S. aureus en H1 80 76 74 68 68 68 68 70 Porcentaje de aislamientos 60 50 SAMR-AC h-VISA 40 Prevalencia Oxacilina Gentamicina 30 20 17,5 16,4 9 10 0 1996-1998 1999-2000 2001-2002 2003-2004 años 2005-2006 2007-2008 2009-2010 Resistencia a los glicopéptidos Resistencia natural del género Enterococcus spp. Propia de Género ß-lactámicos TMS Aminoglucósidos Viejas Quinolonas Propia de especie E. faecium IMI AKN E. faecalis CLIN E. gallinarum E. casseliflavus E. flavescens VAN Problemática de la multirresistencia adquirida EVR 1990 1993 Enterococcus spp. multiresistente es declarado patógeno emergente por el CDC EVR aislado en pacientes de la comunidad 2002 Primer aislamiento de Staphylococcus aureus resistente a la vancomicina portador del determinante de resistencia de los EVR El origen de la resistencia a glucopéptidos en enterococos EVR Uso de avoparcina como aditivo de la alimentación de aves 1990 1993 2002 No se halla resistencia a la vancomicina en Suecia porque no se administran glucopéptidos con propósitos no médicos (Endtz H, et al., J Clin Microb, 1997) Fenotipos de Resistencia a los Glicopéptidos • Fenotipos: EL ALFABETO VAN VAN A VAN B VAN C VAN D VAN E VAN G VAN F •Argentina: Se reportan más casos de Enterococcus faecium VanA VAN A VAN B (Casellas JM, 1997; Corso A, 2001; Courvalin, 2006; Lopardo HA, 2000; Lopreto C, 2002; Marín, E, 1998; Podestá OS, 1997; Targa L, 1997) Mecanismo de Acción de la Vancomicina Pared celular Membrana Citoplasma L-Ala carboxipeptidasa racemasa D-Ala transpeptidasa transglicosilasa + ligasa Ddl D-Ala-D-Ala UDP MurF L-Ala-D-Glu-L-Lys tripéptido UDP Carrier de lípidos vancomicina pentapéptido acido N-acetilmuramico N-acetilglucosamina Varios genes involucrados en la Resistencia a la Vancomicina vanR vanS sensor regulador regulación vanH VanA vanX ligasa dehidrogenasa dipeptidasa vanY vanZ carboxipeptidasa genes requeridos para la proteínas resistencia a accesorias glicopéptidos Operón de Resistencia a la vancomicina Mecanismo de Resistencia a la Vancomicina piruvato G M G M vanH vanA + D-Lac D-Ala + ddl vanX Vancomicina no puede unirse al D-Ala-D-Lac Mecanismo de Resistencia a la Vancomicina G El dipéptido D-Ala-D-Lac sirve de sustrato par la síntesis de la pared bacteriana Pared celular M G M Mecanismo de la Resistencia inducible a la vancomicina VanS Membrana P-VanS Citoplasma ATP ADP VanR P-VanR Van R Activación PR vanR vanS PH vanH vanA vanX Mecanismo de diseminación de los genes de resistencia a la vancomicina ORF1 IRL orf2 vanR sensor resolvasa transposasa transposición vanS regulador regulación vanH VanA vanX ligasa dehidrogenasa dipeptidasa vanY vanZ IRR carboxipeptidasa desconocido genes requeridos para la proteínas resistencia a accesorias glicopéptidos Estructura de Tn1546 - Primer reporte de VRSA en 2002. - Mecanismo de resistencia: S. aureus con Tn1546 en el plásmido pLW1043 de 53kb Conjugación entre cocos Gram-Positivos (Weigel, L.M., et al., Science, 2003) Además......enterococos dependientes de la vancomicina!! Mutaciones que inactivan la síntesis del dipéptido D-alanina-Dalanina en cepas con fenotipo VanA o VanB Estos mutantes sólo serán viables cuando, en presencia de vancomicina, se induzca la síntesis del dipéptido alternativo Dalanina-D-lactato. (Endtz H, et al., J Clin Microb, 1997) Enterococcus spp. en H1 35 31 30 25 porcentajes de aislamiento 25 Primer aislamiento E. faecalis vancomicina resistente Primer aislamiento E. faecium vancomicina resistente 20 EVR Otros E.faecium 15 E.faecalis 10 5 0 1996-1998 1999-2000 2001-2002 2003-2004 años 2005-2006 2007-2008 2009-2010 En nuestras manos, las medidas de control de infecciones…. MUCHAS GRACIAS!!! dcentron@gmail.com