practica 01
Anuncio

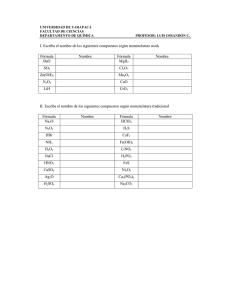
4º eso D TEORÍA Y EJERCICIOS DE FORMULACIÓN QUÍMICA INORGÁNICA COMPUESTOS BINARIOS COMPUESTOS BINARIOS CON OXÍGENO OXÍGENO + METAL-- ÓXIDOS BÁSICOS OXÍGENO + NO METAL ÓXIDOS ÁCIDOS El oxígeno se combina con todos los elementos excepto con los gases nobles. En estos compuestos el oxígeno actúa con valencia -2 Existen tres tipos de nomenclatura: 1. Sistemática: Se nombra con la palabra óxido precedida de los prefijos griegos mono-, di-, tri-, tetra-, penta-, hexa-…según el número de átomos de oxígeno que existan e indicando de la misma forma, a continuación, la proporción del segundo elemento. Ejm. 2. Stock: La valencia o número de oxidación del metal se indica con números romanos entre paréntesis inmediatamente después del nombre. Si el elemento que se combina con el oxígeno posee valencia única no es necesario indicarla. Ejm. 3. Tradicional: Utilizando los prefijos y sufijos: Hipo-……-oso ………….-oso ………….-ico Per-……..-ico Si el elemento presenta cuatro posibles valencias, la menor de ellas se indica con el prefijo hipo- y la terminación –oso; las dos valencias intermedias con el sufijo –oso la menor de las dos y con el sufijo –ico la mayor de las dos; y la mayor de las cuatro con el prefijo per- y el sufijo –ico. Ejm. Si el elemento presenta dos valencias, se utilizan las terminaciones –oso e –ico para indicar si se refiere a la menor o a la mayor valencia del metal respectivamente. Ejm. 1 4º eso D 1º) Nombra los compuestos siguientes por las tres nomenclaturas: SISTEMÁTICA STOCK TRADICIONAL BaO Cu2O Na2O CoO FeO Fe2O3 CrO Cr2O3 HgO Hg2O Cl2O Cl2O3 Cl2O5 Cl2O7 SO SO2 SO3 Br2O Br2O3 Br2O7 SeO CO2 SiO2 TeO2 SeO I2 O TeO I2O5 N2O P2 O SeO3 As2O3 SO2 SO Br2O3 Cl2O7 Br2O3 I2 O CO N2O5 N2O3 I2O5 2 4º eso D 2º) Formular los compuestos que se indican: Para formular el óxido se escribe a la derecha el oxígeno. Como subíndice del oxígeno se pone la valencia del otro elemento y viceversa; es decir, se intercambian las valencias. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. Dióxido de carbono Pentaóxido de dinitrógeno Trióxido de difósforo Heptaóxido de dibromo Monóxido de nitrógeno Oxido de azufre (IV) Oxido de fósforo (V) Oxido de nitrógeno (V) Oxido de cloro (I) Pentaóxido de dicloro Oxido de selenio (VI) Oxido de yodo (III) COMBINACIONES BINARIAS CON HIDRÓGENO HIDRÓGENO+METALES El hidrógeno actúa con valencia -1 Se nombran con la palabra genérica HIDRURO seguida del nombre del metal correspondiente. El hidrógeno se coloca a la derecha de la fórmula. 3º) Completa la tabla: SISTEMÁTICA LiH CuH CuH2 AuH3 CrH3 CrH2 ZnH2 AlH3 MgH2 CoH3 CoH2 BeH2 CdH2 STOCK 4º) Escribir los compuestos que se nombran: 1. 2. 3. 4. 5. Hidruro de potasio Hidruro de hierro (II) Hidruro de aluminio Hidruro de plata Hidruro de calcio 3 4º eso D 6. 7. 8. 9. 10. 11. 12. Hidruro de magnesio Hidruro de estaño (IV) Hidruro de sodio Hidruro de bario Hidruro de platino (IV) Hidruro de plomo (II) Hidruro de mercurio (I) HIDRÓGENO + NO METALES El hidrógeno actúa en estos compuestos con valencia +1 y los no metales con su correspondiente valencia negativa. Los haluros de hidrógeno en solución acuosa dan disoluciones ácidas y reciben el nombre de ÁCIDOS HIDRÁCIDOS. 5º) Formular y nombrar los compuestos que se indican: 1. 2. 3. 4. 5. 6. Sulfuro de hidrógeno Bromuro de hidrógeno Telururo de hidrógeno Fluoruro de hidrógeno Cloruro de hidrógeno Yoduro de hidrógeno 1. HF Fluoruro de hidrógeno (gas) 2. HCl 3. HBr 4. HI 5. H2Se 6. H2Te La mayoría de estas sustancias, en estado puro, son gases a temperatura ambiente y solubles en agua. Cuando se disuelven en ella, las soluciones acuosas resultantes tienen carácter ácido, y deben nombrarse como ácidos: son los HIDRÁCIDOS. La fórmula del hidrácido es la misma que la del hidruro correspondiente. Para distinguir el ácido del mismo compuesto en estado gaseoso, se suele añadir al primero el subíndice (aq), que quiere decir acuoso o solución acuosa. Se nombran con la palabra ácido seguida de la raíz del nombre del elemento no metálico acabado en –hídrico. HF (Aq) Ácido fluorhídrico HCl (Aq) Ácido clorhídrico HBr (Aq) HI (Aq) H2S (Aq) H2Se (Aq) H2Te (Aq) 4 4º eso D OTRAS COMBINACIONES BINARIAS SALES NEUTRAS: METAL+ NO METAL NO METAL + NO METAL El no metal actúa siempre con su valencia negativa y se sitúa a la derecha, nombrándose primero el sufijo –uro. 6º) Nombrar los compuestos que se indican a continuación: Sistemática Stock Tradicional FeCl2 MnS Cu2Te AlF3 Fe2S3 CuI LiF CaF2 CuBr2 CuBr 7º) Formula los compuestos que se indican: 1. 2. 3. 4. 5. 6. 7. 8. 9. Fluoruro de cobre (II) Sulfuro de cromo (III) Tricloruro de hierro Dibromuro de cobre Tetrafluoruro de silicio Cloruro de hierro (II) Bromuro sódico Fluoruro cálcico Cloruro de aluminio COMPUESTOS TERNARIOS - ÁCIDOS OXOÁCIDOS: ÓXIDOS NO METÁLICOS+AGUA - HIDRÓXIDOS O BASES: ÓXIDOS METÁLICOS+AGUA - SALES NEUTRAS TERNARIAS (OXISALES) ÁCIDOS OXOÁCIDOS: Ácido hipo…..-oso Ácido ……….-oso Ácido ……….-ico Ácido per……-ico Óxidos no metálicos + agua Formados por oxígeno, hidrógeno y un no metal. HaXbOc En ocasiones pueden formarlos algún metal de transición, como Mg o Cr. Principales elementos que forman OXOÁCIDOS: B, C, Si, N, P, As, S, Se, Te, Cl, Br, I. Según la nomenclatura tradicional, si un elemento presenta un solo estado de oxidación, el nombre del oxoácido correspondiente termina siempre en –ico. Ejm. H2CO3 Ácido carbónico 5 4º eso D 8º) Nombra los compuestos que se indican: 1. HBrO 2. HBrO2 3. HBrO3 4. HBrO4 5. HIO 6. HIO2 7. HIO3 8. HIO4 9. HNO2 10. HNO3 11. H2SeO2 12. H2SO3 13. H2TeO2 14. H2SO4 15. H2TeO3 16. H2TeO4 17. HClO 18. HClO2 19. HClO3 20. HClO4 9º) Formula los siguientes compuestos: Ácido hipoyodoso Ácido nítrico Ácido selénico Ácido sulfúrico Ácido telúrico Ácido cloroso Ácido perclórico Ácido hipocloroso Ácido clórico HIDRÓXIDOS: ÓXIDOS BÁSICOS (oxígeno + metal)+ AGUA Se caracterizan por tener el grupo OH-, llamado hidróxido, de valencia -1, unido a un metal. Se nombran, según la IUPAC, con la palabra genérica hidróxido seguida del metal correspondiente. Si el metal necesita especificar la valencia, se utiliza la notación de Stock. El grupo hidróxido se coloca siempre a la derecha. 10º) Nombra los siguientes compuestos: 1. CuOH 2. Pt (OH)2 dihidróxido de platino 3. LiOH 4. Mg (OH)2 5. NaOH 6. Co (OH)2 7. Fe (OH)3 hidróxido de hierro (III). 8. AgOH 9. Al(OH)3 10. Cr (OH)3 11. Sn (OH)4 6 4º eso D 11º) Formula los siguientes compuestos: 1. 2. 3. 4. 5. 6. Hidróxido de plomo (IV) Hidróxido de berilio Hidróxido de Zinc Hidróxido de plomo (II) Hidróxido de platino (IV) Hidróxido de cadmio SALES NEUTRAS (OXISALES) Compuestos ternarios formados por un no metal, oxígeno y un metal. Se obtienen por neutralización total de un hidróxido y un ácido oxácido. La reacción que tiene lugar es: ÁCIDO OXOÁCIDO + BASE (HIDRÓXIDO)-------- SAL + AGUA H2SO4 + 2NaOH --------------------------------------------Na2SO4 + 2H2O Para nombrar estas sales se acepta la nomenclatura tradicional utilizando los siguientes prefijos y sufijos: Hipo- -ito -ito -ato Per- ato EJEMPLOS: Fe2(CO3)3 El hierro tiene valencias 2 y 3. Aquí está actuando con la 3, luego terminación –ico porque de las dos, es la mayor. 1. Conocer el ácido oxoácido del que proviene la sal: En este ejemplo viene del ácido carbónico: H2CO3 2. Sustituímos la terminación –ico del ácido por la terminación –ato y nombramos la sal: carbonato de hierro (III). KNO2 1. El ácido del que proviene es el HNO2 (Ácido nitroso). 2. Nitrito de potasio. KNO3 Nitrato de potasio Na2SO4 Sulfato de sodio Ca3(PO4)2 Fosfato de calcio 12º) Escribe el nombre de estas sales: LiNO2 Ba(NO3)2 7 4º eso D K2CO3 CaCO3 Cu(ClO)2 Zn(IO2)2 Ni(BrO3)3 NaClO4 FeSO3 Al2(SO4)3 Hg3(PO4)2 13º) Formular: Dióxido de silicio Ácido selenioso Hidróxido de plomo (II) Sulfato de cromo (III) Cloruro de plata Ácido clórico Nitrato de cobre (II) Carbonato de estaño (IV) Ácido selénico Sulfuro de alumnio Ácido selenhídrico Fluoruro hidrógeno de Tetracloruro carbono de Hidróxido de plomo (II) Ácido nítrico Seleniuro hidrógeno de Ácido sulfúrico Ácido bromhídrico Ácido perclórico Telururo de hidrógeno 8