TALLER DE FÍSICO-QUÍMICA N° 4 3P1Q Docente: Dr. Jorge Vélez
Anuncio
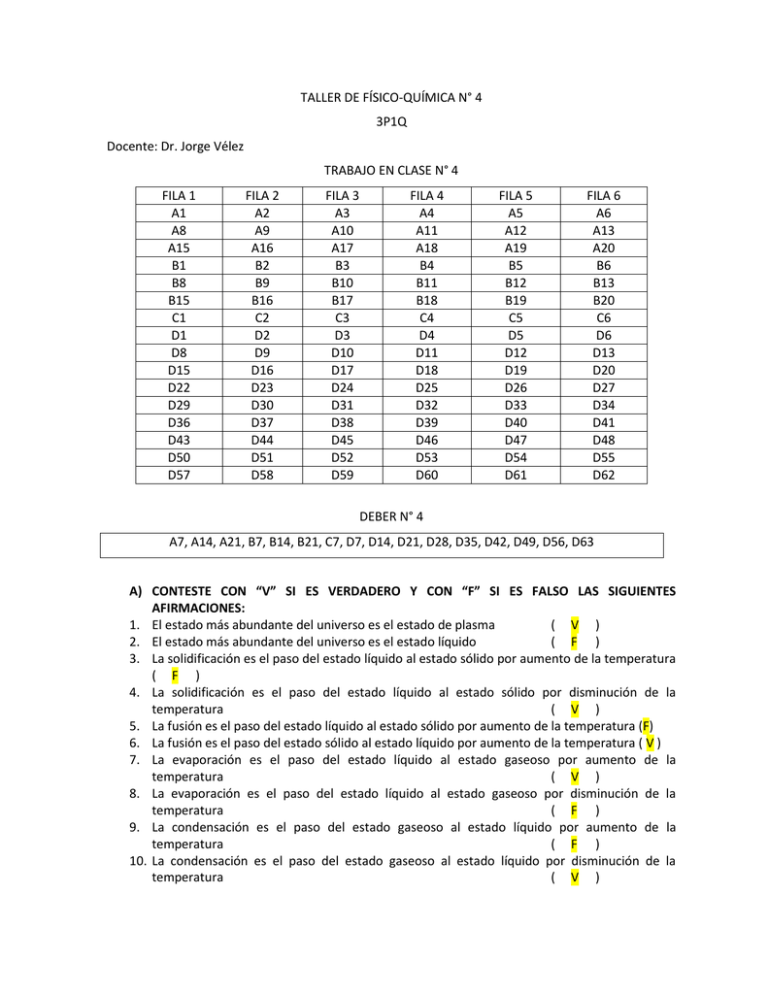
TALLER DE FÍSICO-QUÍMICA N° 4 3P1Q Docente: Dr. Jorge Vélez TRABAJO EN CLASE N° 4 FILA 1 A1 A8 A15 B1 B8 B15 C1 D1 D8 D15 D22 D29 D36 D43 D50 D57 FILA 2 A2 A9 A16 B2 B9 B16 C2 D2 D9 D16 D23 D30 D37 D44 D51 D58 FILA 3 A3 A10 A17 B3 B10 B17 C3 D3 D10 D17 D24 D31 D38 D45 D52 D59 FILA 4 A4 A11 A18 B4 B11 B18 C4 D4 D11 D18 D25 D32 D39 D46 D53 D60 FILA 5 A5 A12 A19 B5 B12 B19 C5 D5 D12 D19 D26 D33 D40 D47 D54 D61 FILA 6 A6 A13 A20 B6 B13 B20 C6 D6 D13 D20 D27 D34 D41 D48 D55 D62 DEBER N° 4 A7, A14, A21, B7, B14, B21, C7, D7, D14, D21, D28, D35, D42, D49, D56, D63 A) CONTESTE CON “V” SI ES VERDADERO Y CON “F” SI ES FALSO LAS SIGUIENTES AFIRMACIONES: 1. El estado más abundante del universo es el estado de plasma ( V ) 2. El estado más abundante del universo es el estado líquido ( F ) 3. La solidificación es el paso del estado líquido al estado sólido por aumento de la temperatura ( F ) 4. La solidificación es el paso del estado líquido al estado sólido por disminución de la temperatura ( V ) 5. La fusión es el paso del estado líquido al estado sólido por aumento de la temperatura (F) 6. La fusión es el paso del estado sólido al estado líquido por aumento de la temperatura ( V ) 7. La evaporación es el paso del estado líquido al estado gaseoso por aumento de la temperatura ( V ) 8. La evaporación es el paso del estado líquido al estado gaseoso por disminución de la temperatura ( F ) 9. La condensación es el paso del estado gaseoso al estado líquido por aumento de la temperatura ( F ) 10. La condensación es el paso del estado gaseoso al estado líquido por disminución de la temperatura ( V ) 11. La sublimación es el paso del estado sólido al estado gaseoso por la disminución de la temperatura ( F ) 12. La sublimación es el paso del estado sólido al estado gaseoso por el aumento de la temperatura ( V ) 13. La sublimación regresiva es el paso del estado gaseoso al estado sólido por la disminución de la temperatura ( V ) 14. La sublimación regresiva es el paso del estado gaseoso al estado sólido por el aumento de la temperatura ( F ) 15. Las moléculas de un gas están ampliamente separadas unas de otras ( V ) 16. Las moléculas de un gas se mueven de manera deslizante y al azar ( F ) 17. Las moléculas de un gas aumentan la velocidad si aumenta la temperatura ( V ) 18. Las moléculas de un gas pierden poca energía en sus choques ( F ) 19. Las moléculas de un gas son muy pequeñas, de tal forma que el volumen en conjunto es insignificante en comparación con el volumen que ocupa el gas ( V ) 20. La presión es la fuerza por unidad de área o superficie ( V ) 21. El aparato que mide la presión atmosférica es el barómetro ( V ) B) 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. COMPLETE LOS SIGUIENTES ENUCIADOS CON LAS PALABRAS CORRECTAS: En los sólidos la forma es CONSTANTE Los estados que tienen un volumen constante son el SÓLIDO y el LIQUIDO En Los estados líquido y gaseoso la forma depende del RECIPIENTE que lo contiene Las moléculas del estado sólido tienen movimiento VIBRATORIO Las moléculas del estado LÍQUIDO tienen movimiento deslizante La fuerza de COHESIÓN es la predominante en el estado sólido La fuerza de expansión es la predominante en el estado GASEOSO Los estados SÓLIDO y LÍQUIDO no se comprimen al aumentar la presión La EVAPORACIÓN es el paso del estado líquido al estado gaseoso por aumento de la temperatura La fusión es el paso del estado sólido al estado LÍQUIDO por aumento de la temperatura La EVAPORACIÓN es el paso del estado líquido por estado gaseoso por AUMENTO de la temperatura La CONDENSACIÓN es el paso del estado gaseoso al estado líquido por disminución de la temperatura La sublimación es el paso del estado SÓLIDO al estado GASEOSO por aumento de la temperatura La SUBLIMACIÓN REGRESIVA es el paso del estado gaseoso al estado sólido por disminución de la temperatura La PRESIÓN es la fuerza por unidad de área o superficie La ley de Boyle y Mariotte se conoce como ISOTÉRMICA La ley de CHARLES es conocida como isobárica La ley de Gay-Lussac es conocida como ISOVOLUMÉTRICA La ley COMBINADA DE LOS GASES toma en cuenta las tres variables: presión, volumen y temperatura El valor de volumen en condiciones normales es de 22,4 L El valor de la temperatura en condiciones normales es de 273 K C) ELIJA LA RESPUESTA CORRECTA: 1. La altura de una columna de mercurio de 1 cm de diámetro al nivel del mar es de 760 mm. Si el diámetro se duplica, la altura del mercurio será: a. ( ) 760mm c. ( ) 1520mm b. ( ) 380mm d. ( ) depende de la temperatura. 2. Se tienen 100 mL de un gas en un cilindro y se pasan a otro recipiente de 500 mL. El volumen del gas será entonces: a.( ) 100mL c. ( ) 500mL b.( ) 600 mL d. ( ) 500/100 mL 3. El volumen ocupado por 0,1 mole de un gas ideal a 0,25 atm y 0ºC es: a.( ) 0,448litros. c. ( ) 4,48litros. b.( ) 22,4 litros. d. ( ) 8,96litros. 4. Un torr es equivalente a: a. ( ) 1 mmHg b.( ) 1cmHg 5. c. ( ) 1 atm d. ( ) 1 g/cm 2 La energía cinética promedia de las moléculas de un gas es directamente proporcional a: a. ( b.( c. ( d.( ) el tamaño de las moléculas. ) el volumen del gas. ) la presión que ejerce el gas. ) la temperatura del gas. 6. Una atmósfera de presión existe en: a. ( b.( c. ( d.( 7. La presión atmosférica se mide con a. ( b.( c. ( d.( D. 1. 2. 3. 4. 5. 6. 7. 8. ) a nivel del mar ) en la sierra ) en todas partes del planeta ) ninguna de estas ) el termómetro ) el barómetro ) el manómetro ) el presiómetro RESUELVA LOS SIGUIENTES EJERCICIOS: 3 atm en lb/plg2 R= 44,1 lb/plg2 896 torr en atm R= 1,18 atm 6 3,5x10 pasc en mmHg R= 26232,74 mmHg 28 lb/plg2 en torr R= 312816 torr 2,2 atm en mmHg R= 1672 mmHg 776 mmHg en atm R= 1,02 atm 1,2 atm en pasc R= 121560 pasc Un gas en condiciones normales de presión y temperatura ocupan un volumen de 200 L. Qué volumen ocuparán si la presión varía a 2,3 atm y la temperatura cambia a 37°C R= 98,74 L 9. Un gas en condiciones normales de presión y temperatura ocupan un volumen de 350 L. Qué volumen ocuparán si la presión varía a 1,4 atm y la temperatura cambia a 27°C R= 274,73 L 10. Un gas en condiciones normales de presión y temperatura ocupan un volumen de 100 L. Qué volumen ocuparán si la presión varía a 3,5 atm y la temperatura cambia a 31°C R= 31,82 L 11. Un gas en condiciones normales de presión y temperatura ocupan un volumen de 700 L. Qué volumen ocuparán si la presión varía a 4,5 atm y la temperatura cambia a 22°C R= 168,09 L 12. Un gas en condiciones normales de presión y temperatura ocupan un volumen de 150 L. Qué volumen ocuparán si la presión varía a 2 atm y la temperatura cambia a 39°C R= 85,71 L 13. Un gas en condiciones normales de presión y temperatura ocupan un volumen de 180 L. Qué volumen ocuparán si la presión varía a 5,4 atm y la temperatura cambia a 42°C R= 38,46 L 14. Un gas en condiciones normales de presión y temperatura ocupan un volumen de 190 L. Qué volumen ocuparán si la presión varía a 3 atm y la temperatura cambia a 40°C R= 72,61 L 15. Una masa de gas a temperatura constante ejerce una presión de 16,8 lb/plg2 y ocupa un volumen de 5 L. Cuál será su presión si su volumen es de 3400 cc R = 1,68 atm 16. Una masa de gas a temperatura constante ejerce una presión de 19,8 lb/plg2 y ocupa un volumen de 3 L. Cuál será su presión si su volumen es de 5400 cc R = 0,75 atm 17. Una masa de gas a temperatura constante ejerce una presión de 23,1 lb/plg2 y ocupa un volumen de 8 L. Cuál será su presión si su volumen es de 5000 cc R = 2,51 atm 18. Una masa de gas a temperatura constante ejerce una presión de 17,5 lb/plg2 y ocupa un volumen de 6 L. Cuál será su presión si su volumen es de 4000 cc R = 1,79 atm 19. Una masa de gas a temperatura constante ejerce una presión de 20,6 lb/plg2 y ocupa un volumen de 7 L. Cuál será su presión si su volumen es de 5700 cc R = 1,72 atm 20. Una masa de gas a temperatura constante ejerce una presión de 19,2 lb/plg2 y ocupa un volumen de 8 L. Cuál será su presión si su volumen es de 6000 cc R = 1,74 atm 21. Una masa de gas a temperatura constante ejerce una presión de 19,8 lb/plg2 y ocupa un volumen de 9 L. Cuál será su presión si su volumen es de 8000 cc R = 1,51 atm 22. A presión constante y 80 °F de temperatura un gas ocupa un volumen de 17 L. Cuál será su temperatura si su volumen es de 30 L R = 528,82 K 23. A presión constante y 90 °F de temperatura un gas ocupa un volumen de 19 L. Cuál será su temperatura si su volumen es de 50 L R = 803,22 K 24. A presión constante y 60 °F de temperatura un gas ocupa un volumen de 20 L. Cuál será su temperatura si su volumen es de 40 L R = 577,11 K 25. A presión constante y 99 °F de temperatura un gas ocupa un volumen de 18 L. Cuál será su temperatura si su volumen es de 60 L R =1034,07 K 26. A presión constante y 85 °F de temperatura un gas ocupa un volumen de 22 L. Cuál será su temperatura si su volumen es de 45 L R = 618,64 K 27. A presión constante y 95 °F de temperatura un gas ocupa un volumen de 14 L. Cuál será su temperatura si su volumen es de 28 L R = 616 K 28. A presión constante y 75 °F de temperatura un gas ocupa un volumen de 15 L. Cuál será su temperatura si su volumen es de 35 L R = 692,74 K 29. Una masa de gas a 20 °C ejerce una presión de 2,93x105 pasc. Cuál será su presión si la temperatura varía a 500 K R = 4,94 atm 30. Una masa de gas a 25 °C ejerce una presión de 1,63x105 pasc. Cuál será su presión si la temperatura varía a 450 K R = 2,43 atm 31. Una masa de gas a 28 °C ejerce una presión de 2,5x105 pasc. Cuál será su presión si la temperatura varía a 320 K R = 2,62 atm 32. Una masa de gas a 35 °C ejerce una presión de 1,93x105 pasc. Cuál será su presión si la temperatura varía a 470 K R = 2,91 atm 33. Una masa de gas a 44 °C ejerce una presión de 3,2x105 pasc. Cuál será su presión si la temperatura varía a 470 K R = 4,68 atm 34. Una masa de gas a 34 °C ejerce una presión de 1,65x105 pasc. Cuál será su presión si la temperatura varía a 650 K R = 3,45 atm 35. Una masa de gas a 35 °C ejerce una presión de 2,44x105 pasc. Cuál será su presión si la temperatura varía a 390 K R = 3,05 atm 36. Qué volumen ocuparán 1,2 moles de anhídrido carbónico a 20 °C y 800 torr R = 27,39 L 37. Qué volumen ocuparán 2,3 moles de anhídrido carbónico a 15 °C y 900 torr R = 46,03 L 38. Qué volumen ocuparán 3,1 moles de anhídrido carbónico a 18 °C y 760 torr R = 73,97 L 39. Qué volumen ocuparán 3,3 moles de anhídrido carbónico a 19 °C y 830 torr R = 72,31 L 40. Qué volumen ocuparán 2,1 moles de anhídrido carbónico a 28 °C y 970 torr R = 40,49 L 41. Qué volumen ocuparán 3 moles de anhídrido carbónico a 30 °C y 600 torr R = 94,41 L 42. Qué volumen ocuparán 2,7 moles de anhídrido carbónico a 26 °C y 840 torr R = 59,64 L 43. Cuál será la presión que ejercerá 60 g de metano (CH4), con un volumen de 22 L a 100 °F R = 4,34 atm 44. Cuál será la presión que ejercerá 80 g de metano (CH4), con un volumen de 30 L a 120 °F R = 4,40 atm 45. Cuál será la presión que ejercerá 70 g de metano (CH4), con un volumen de 33 L a 180 °F R = 3,86 atm 46. Cuál será la presión que ejercerá 50 g de metano (CH4), con un volumen de 28 L a 110 °F R = 2,90 atm 47. Cuál será la presión que ejercerá 85 g de metano (CH4), con un volumen de 35 L a 125 °F R = 4,04 atm 48. Cuál será la presión que ejercerá 90 g de metano (CH4), con un volumen de 35 L a 180 °F R = 4,68 atm 49. Cuál será la presión que ejercerá 77 g de metano (CH4), con un volumen de 16 L a 90 °F R = 7,53 atm 50. En un recipiente existen 3 gases: A(350 torr), B(370 torr) y C(450 torr). Cuál es la PT R = 1170 torr 51. En un recipiente existen 3 gases: A(300 torr), B(400 torr) y C(150 torr). Cuál es la PT R = 850 torr 52. En un recipiente existen 3 gases: A(500 torr), B(420 torr) y C(650 torr). Cuál es la PT R = 1570 torr 53. En un recipiente existen 3 gases: A(720 torr), B(800 torr) y C(300 torr). Cuál es la PT R = 1820 torr 54. En un recipiente existen 3 gases: A(650 torr), B(600 torr) y C(400 torr). Cuál es la PT R = 1650 torr 55. En un recipiente existen 3 gases: A(750 torr), B(170 torr) y C(220 torr). Cuál es la PT R = 1140 torr 56. En un recipiente existen 3 gases: A(480 torr), B(240 torr) y C(380 torr). Cuál es la PT R = 1100 torr 57. Una mezcla gaseosa tiene una presión total de 800 torr, si de esta mezcla el 20% es del gas A, el 30% del gas B y el 50% del gas C. ¿Qué presión ejerce cada gas? R = A= 160 torr, B = 240 torr, C = 400 torr 58. Una mezcla gaseosa tiene una presión total de 1000 torr, si de esta mezcla el 20% es del gas A, el 30% del gas B y el 50% del gas C. ¿Qué presión ejerce cada gas? R = A= 200 torr, B = 300 torr, C = 500 torr 59. Una mezcla gaseosa tiene una presión total de 1300 torr, si de esta mezcla el 20% es del gas A, el 30% del gas B y el 50% del gas C. ¿Qué presión ejerce cada gas? R = A= 260 torr, B = 390 torr, C = 650 torr 60. Una mezcla gaseosa tiene una presión total de 780 torr, si de esta mezcla el 20% es del gas A, el 30% del gas B y el 50% del gas C. ¿Qué presión ejerce cada gas? R = A= 156 torr, B = 234 torr, C = 390 torr 61. Una mezcla gaseosa tiene una presión total de 950 torr, si de esta mezcla el 20% es del gas A, el 30% del gas B y el 50% del gas C. ¿Qué presión ejerce cada gas? R = A= 190 torr, B = 285 torr, C = 475 torr 62. Una mezcla gaseosa tiene una presión total de 880 torr, si de esta mezcla el 20% es del gas A, el 30% del gas B y el 50% del gas C. ¿Qué presión ejerce cada gas? R = A= 176 torr, B = 264 torr, C = 440 torr 63. Una mezcla gaseosa tiene una presión total de 970 torr, si de esta mezcla el 20% es del gas A, el 30% del gas B y el 50% del gas C. ¿Qué presión ejerce cada gas? R = A= 194 torr, B = 291 torr, C = 485 torr


