Bonificación 1 - Colegio Salesiano El Sufragio
Anuncio

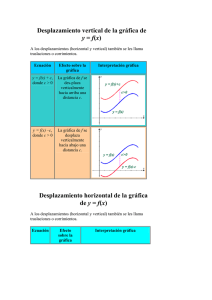
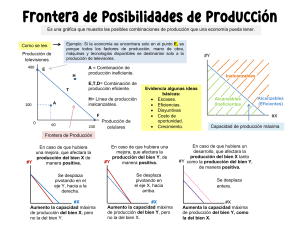
COLEGIO SALESIANO EL SUFRAGIO PERIODO 3 Estudiante: _____________________________________________________________________________Grado: 10 Asignatura: Química Fecha: 07 -09-15 Docente: Adrián Ramírez López Actividad de Bonificación 1 Indicadores de Evaluación: Identifica y aplica conceptos básicos relacionados con el estudio de la cinética y equilibrio químico 1. Al iniciar una reacción hay 0,28 moles de N2, 3,2 x 10-2 de H2 y 6,42 x10-4 de NH3 en un recipiente de 3,5 litros a 37C, si la constante de equilibrio para la reacción es 0,547 a esta temperatura a. Escribe la ecuación balanceada para la ecuación b. Determina en cual dirección se está desplazando la reacción. Explica tu respuesta 2. En un Beaker de 2 litros se tiene 1 mol de yodo molecular y 1 mol de Hidrogeno molecular a una temperatura de 230 C. Calcula las concentraciones tanto de los reactivos como los productos cuando se ha alcanzado el equilibrio, teniendo en cuenta que el valor de la Ke= 50,8 3. En la reacción H2 + Cl2 2HCl, ¿Qué sucede si se aumenta la presión en el sistema? ¿Hacia dónde se desplaza el equilibrio? 4. Plantea lo que sucede con el rendimiento de la reacción en equilibrio, cuando se aumenta la temperatura 2SO2 + O2 2SO3 + 198 kJ 5. Prediga si el equilibrio de la reacción de la fotosíntesis descrita en la siguiente reacción 6CO2 + 6H2O C6H12O6 + 6O2 H = 2801,69 Kj/mol Se desplaza hacia la derecha, se desplaza hacia la izquierda o permanece igual si a. Disminuyera CO2 b. Se retirara la mitad de Glucosa c. Disminuyera la presión total d. Aumentará la temperatura e. Se le agregara un catalizador