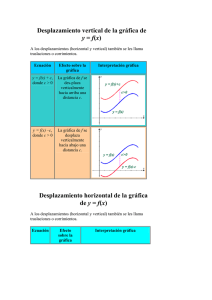
Problemas de Equilibrios en fase gas – Principio de Le Chatelier 1
Anuncio

Problemas de Equilibrios en fase gas – Principio de Le Chatelier Química General 1) Indicar el efecto que tendrá un descenso de la temperatura en el siguiente equilibrio: 2H 2 O (g) 2H 2(g) + O 2(g) DH = 484 kJ Solución: Se desplaza hacia los reactivos (izquierda). Se favorece la reacción exotérmica. 2) En la siguiente reacción, determinar el efecto que tendrá una disminución de presión sobre el equilibrio. SO 2 Cl 2(g) SO 2(g) + Cl 2(g) Solución: Se desplaza hacia los reactivos (izquierda). Aumentan los moles de gases. 3) Determinar el efecto que tendrá una disminución de la concentración de Cl 2(g) en el equilibrio siguiente: SO 2(g) + Cl 2(g) SO 2 Cl 2(g) Solución: Se desplaza hacia los reactivos (izquierda). Aumenta la concentración de Cl 2(g) . 4) Para la reacción siguiente: N 2(g) + O 2(g) DH = –180,7 kJ 2NO (g) Determinar el efecto que tendrá en el equilibrio las siguientes acciones: a) Una disminución de la temperatura. b) Un incremento de la presión. c) Un descenso de la concentración de N 2(g) . Solución: a) Se desplaza hacia los productos (derecha). Se favorece la reacción exotérmica. b) La presión no afecta al equilibrio. c) Se desplaza hacia los productos (derecha). Aumenta la concentración de N 2(g) . 5) Para la reacción siguiente: 2NO (g) + Cl 2(g) 2NOCl (g) DH = –77,4 kJ Determinar las condiciones de temperatura y presión que favorezcan la formación de productos. Solución: Temperatura baja, presión alta. www.academiasanclaudio.info



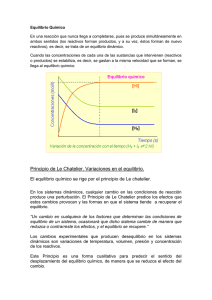


![Material Complementario- PRÁCTICO 6 Kc = [C]c [D]d … [A]a [B]b](http://s2.studylib.es/store/data/005642464_1-49307596d309ea8acaa86e7521a6bd97-300x300.png)