19 ENFERMEDAD TROFOBLASTICA GESTACIONAL
Anuncio

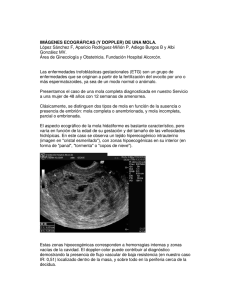
19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 146 19 -Enfermedad Trofoblastica Gestacional (Julio 2004) DEFINICION “Tumores originados en el tejido placentario, de poca frecuencia , con capacidad de invasión local y diseminación a distancia ,y con alta tasa de curación”. La enfermedad trofoblástica gestacional ( ETG ) es una entidad descripta por Hipócrates 400 AC, y su pronóstico era bastante sombrío hasta el año 1956 en que Li y colaboradores comunicaron la remisión de un coriocarcinoma con quimioterapia. Las enfermedades clínicas que se incluyen dentro del espectro de la neoplasia trofoblástica gestacional ( NTG) presentan una variedad de potenciales neoplásicos que enfrentan al clínico con varios desafíos diagnósticos y terapéuticos . Aunque las características histológicas permiten la clasificación dentro de una de las entidades patológicas - MOLA HIDATIFORME, ENFERMEDAD PERSISTENTE/ INVASIVA DEL TROFOBLASTO PLACENTARIO (MOLA INVASORA), TUMOR TROFOBLASTICO DEL SITIO PLACENTARIO (TTSP) y CORIOCARCINOMA - el diagnostico , y el manejo deben basarse, en los antecedentes , en la cuantificación de HCG, y en la búsqueda de metástasis .(1) CARACTERISTICAS COMUNES •Grupo Heterogéneo. COMPORTAMIENTO BENIGNO: - No MTS. Respuesta TTO. remisión MOLA PARCIAL MOLA COMPLETA COMPORTAMIENTO AGRESIVO: - MTS. Resistencia TTO QMT MOLA INVASORA CORIOCARCINOMA TTSP 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 147 •Implica un evento de fertilización aberrante. •Generalmente buen Pronostico. A diferencia de otras enfermedades malignas que afectan a mujeres, la ETG es curable en un 85 - 100 % con apropiado tratamiento y seguimiento. EPIDEMIOLOGIA La incidencia exacta es difícil de definir . Aunque suele aceptarse que la frecuencia del embarazo molar es mayor en el Lejano Oriente, esto puede deberse al sesgo de los informes de los trabajos que se realizan en los hospitales , mas que los estudios que se basan en la población. .(1) Los informes del Sudoeste Asiático y de América Latina suelen realizarse sobre trabajos basados en hospitales y , dado que muchos partos vaginales ocurren en las casas , este tipo de trabajo genera un sesgo en la sobrestimación de la incidencia real de la ETG. Estos factores pueden explicar la razón por la cual la mola hidatiforme parece tener una gran variabilidad geográfica , ya que en Indonesia seria tan frecuente como de 1 en 85 embarazos y en Estados Unidos 1 en 1000 a 1 en 1500 embarazos en forma aproximada.(1) Universalmente su frecuencia e estima 1/1500 partos, siendo esta 7 a 10 veces mas alto en el Sudoeste Asiático que en Occidente. En maternidades publicas de algunas ciudades de América Latina su frecuencia es de alrededor 1/2000 partos. En Chile es de alrededor 1/1000 partos. (2) MOLA HIDATIFORME FACTORES DE RIESGO • Gran cantidad de factores clínicos parecen correlacionarse con la ocurrencia del embarazo molar. (3-4-5-6) Edad (extremos e las edades reproductivas), menor a 15 años o mayor de 40 años. Antecedentes de mola hidatiforme anterior. Antecedente de aborto espontáneo anterior. Dieta pobre en vitamina A. Uso prolongado de anticonceptivos. Edad paterna superior a los 45 años, RR 3 A 5. (7) • Entre los factores de riesgo no confirmados se incluyen: Tipo de sangre Rh + 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 148 La consanguinidad Inseminación artificial Nuliparidad Ocupación profesional. • Los factores clínicos que parecen reducir el riego son: .(8) Embarazo de término previo sin aborto espontáneo. Dieta adecuada en vitamina A Son infrecuentes las gestaciones múltiples complicadas con molas. Inducción e la ovulación. CARACTERÍSTICAS CLÍNICAS Aunque se estableció que solo 50% de las molas hidatiformes se diagnostican antes de expulsar las vesículas típicas con forma de uvas, es probable que entre 80 y 90% se diagnostiquen en la actualidad ya sea antes de la aparición de los síntomas o antes de que se expulsen las vesículas. En los países desarrollados, el uso difundido de la ecografía para evaluar el embarazo temprano y la hemorragia en un embarazo temprano contribuyó con el diagnóstico más puntual del embarazo molar. Como consecuencia de esto ahora se diagnostican muchos embarazos molares en gestaciones muy tempranas, antes de que se presenten los signos y los síntomas usuales. La presentación clínica mas frecuente es la de una amenaza de aborto con hemorragia vaginal indolora. Luego, pueden aparecer contracciones dolorosas y puede ocurrir la eliminación e tejido molar. (1-2) Gracias al diagnóstico ecográfico temprano, hoy día es menos común el hallazgo de signos de marcada proliferación trofoblástica, que incluye el tamaño uterino exagerado, los quistes tecoluteínicos y la toxemia. Sin embargo, otras características clínicas que despiertan la sospecha de que se trata de un embarazo molar incluyen : Útero aumentado de tamaño con respecto a la edad gestacional 50%. Hiperémesis Gravídica 15 a 25 %. Preeclampsia 5 a 10 % antes de las 20 semanas de gestación. Hipertiroidismo 2 a 7 %. Insuficiencia cardiaca. Edema agudo de pulmón. Insuficiencia respiratoria ( IC o embolia de tej. Trofoblástico). 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 149 DIFERENCIAS ENTRE MOLA COMPLETA Y MOLA PARCIAL En los casos de molas hidatiformes completas , todos los cromosomas son de origen paterno .(9).Alrededor de 95 % de las gestaciones molares completas tienen un patrón de cromosomas 46 XX. La androgenesis explica este patrón y consiste en el desarrollo de un huevo bajo la influencia de un núcleo de origen espermático cuando el núcleo del oocito esta ausente o inactivo. Se propuso que el caso raro de la mola hidatiforme con un cariotipo 46 XY proviene de una fertilización dispérmica.(10) En cambio, la etiología de la mola hidatiforme parcial no se comprende con claridad. Las anomalías cromosómicas son mas frecuentes dado que la mayor parte de las molas hidatiformes parciales presentan un cariotipo triploide, que incorpora un complemento cromosómico paterno(11). El siguiente cariotipo mas frecuente es la trisomía, mas comúnmente la 16. Una minoría de las molas parciales presente un cariotipo diploide normal (buscar gestación gemelar). (12) A diferencia de la mola completa, en la mola parcial parecería que no existe una asociación entre la edad materna y la paterna. Clínicamente el crecimiento uterino excesivo se observa en el 4 a 11% de las molas parciales. Algunas diferencias a destacar: CARACTERISTICAS COMPLETA PARCIAL FRECUENCIA 80 A 90 % 10 A 20 % ANOMALIAS CROMOSOMICAS CARIOTIPO MENOS FRECUENTE MAS FRECUENTES 46 XX 90 % 46 XY 10 % DIFUSA TRIPLOIDE 90 A 95 % FOCAL DIFUSA FOCAL AUSENTE PRESENTE DIFUSO, ATIPIAS TEMPRANA FOCAL MAS TARDIA AUMENTADO 50 % NO MAS SIMPLE AUMENTADO 11% SI MAS COMPLEJO VELLOSIDADES HIDROPICAS HIPERPLASIA TROFOBLASTO VELLOSIDADES CORIONICAS TROFOBLASTO PRESENTACIÓN CLINICA TAMAÑO UTERINO EMBRIÓN TRATAMIENTO 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 150 DIAGNOSTICO Y EVALUACIÓN: El método diagnostico de elección para confirmar el diagnóico de mola hidatiforme en una paciente que presenta características clínicas de sospecha, es la ECOGRAFÍA. El patrón característico en “tormenta de nieve” en general es fácil identificar en un útero cuyo tamaño corresponde a una gestación de mas de 14 semanas. Los hallazgos ecográficos pueden ser similares a los de un aborto fallido o incompleto.(13) Entre otras entidades clínicas que pueden confundir el diagnóstico se incluyen los miomas uterinos, el hidramnios y la hiperplacentosis (en especial en gestaciones múltiples). En las situaciones clínicas en que los hallazgos ecográficos no son convincentes, las determinaciones seriadas de HCG pueden apoyar el diagnóstico de embarazo molar.(14) Si la ecografía y las pruebas seriadas de HCG presentan dudas para el diagnóstico puede considerarse la realización de una amniografía. Se realiza una amniocentesis y, si se obtiene liquido amniótico, se presume que el embarazo es normal. En la mayor parte de los centros, se abandono la amniografía debido a la precisión de la ecografía en la actualidad. Se utiliza también en la actualidad, la resonancia magnética nuclear, sin embargo, existen diversos autores que lo consideran un estudio costoso y no decisivo para el manejo de la enfermedad no metastásica.(15) Este grupo de Kohorn y col., realizando una revisión en todas las publicaciones inglesas y alemanas, observaron que las lesiones evaluables por resonancia presentaban valores de HCG que obligaban a la utilización de un quimioterápico posterior, por lo que la imagen no cambiaba la conducta. Y por otro lado con valores de HCG < a 700 mlU/ml las lesiones intramiometrales podían no ser visualizadas por el método. Expresaron así, una sensibilidad del método no mejor del 70% y una especificidad aún menor, por lo que confirmaban el valor confiable y definitivo para el manejo terapéutico de las determinaciones con HCG. Sin embargo, no negaban el valor de la RMN en la enfermedad metastásica para su estadificación y manejo. Antes del tratamiento, se debe realizar una cantidad de estudios de base. La radiografía de tórax puede revelar enfermedad metastásica, edema pulmonar o embolia trofoblástica. Pueden aparecer anormalidades o trastornos cardiacos secundarios al hipertiroidismo o a la hipertensión severa inducida por el embarazo. Las pacientes con taquicardia supraventricular pueden beneficiarse mediante el tratamiento con un agente B-bloqueante antes de la evacuación quirúrgica. Antes de la evacuación, también debe evaluarse si existen problemas en la coagulación. El tratamiento de reposición de sangre puede indicarse sobre la base de hallazgos clínicos y debido a la presencia de anemia. Los quistes tecaluteínicos ocurren en alrededor del 25% al 60% de las pacientes con mola hidatiforme y la rotura y la hemorragia pueden requerir manejo quirúrgico. Estos quistes teca-luteínicos se deben a los niveles elevados de HCG que producen una respuesta fisiológica exagerada en el ovario. Estos quistes pueden experimentar regresión en forma lenta luego del descenso de la HCG, y no son necesarias su remoción ni su descompresión en el momento de la histerectomía (16-17). TRATAMIENTO La urgencia de la evacuación uterina depende del entorno clínico. Las pacientes que presentan hemorragia y evidencia de contracciones uterinas deben evacuarse con rapidez, 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 151 siempre que la paciente este estable. Las pacientes sintomáticas en las cuales se realiza el diagnostico mediante una ecografía prenatal de rutina, pueden evacuarse dentro de las 24 a 48 horas. El método de evacuación de elección es la succión con raspado. Si el sangrado uterino es nulo o es leve, no se administra oxitócica intravenosa hasta que se inicio el procedimiento de succión y raspado. Si la paciente presenta hemorragia vaginal severa, puede ser necesario comenzar con la oxitócica antes de la evacuación quirúrgica. Aunque la oxitócica puede disminuir la hemorragia, también puede aumentar el riego de embolia trofoblástica, en especial si la paciente presenta el útero de tamaño aumentado. La técnica de succión y raspado debería ser especifica para la mola hidatiforme. Luego de dilatar el cuello para permitir la inserción de una cánula de succión de 10 a 12 mm a través del orificio cervical interno, se inicia la succión y se evacua el contenido uterino por medio de la rotación suave de la cureta sin introducirla mas. Esta técnica limita el riesgo de perforación uterina. Existe un riesgo significativo de perforación uterina en las pacientes con mola hidatidiforme, en especial si existe un foco de enfermedad molar invasora. Debe comenzarse con una infusión de oxitócica al mismo tiempo que se realiza el procedimiento de succión. Luego de completar la evacuación mediante succión, puede usarse una cureta grande para remover en forma suave cualquier remanente de tejido molar. La evacuación de una mola hidatidiforme sin el uso de una cureta de succión es potencialmente problemática. La evacuación de un embarazo molar muy grande con una cureta tradicional puede arriesgar a una paciente muy joven a presentar una lesión uterina seria y a una histerectomía. Este riesgo existe debido a la posibilidad de que la enfermedad molar haya invadido el miometrio, potencialmente en toda su extensión. Sobre la base de este riesgo, ante la falta de un aparato de succión, se recomienda la histerectomía para evacuar un útero grande (con un tamaño mayor que el correspondiente a 14 semanas de gestación). En las pacientes que son buenas candidatas para la cirugía y que no desean mas hijos, se debe considerar la realización de una histerectomía primaria para la terminación de un embarazo molar. Aunque las pacientes presentan el riego de NTG persistente, este es significativamente menor con respecto a las pacientes que se someten a evacuación. Además, si luego se indica quimioterapia, se requieren menos ciclos para el tratamiento exitoso (18). . Se sugirió quimioterapia profiláctica (administración de quimioterapia con un solo agente inmediatamente antes o inmediatamente después de la evacuación de la mola hidatidiforme). Este tratamiento reduce el riesgo de secuelas neoplásicas (desde 15 al 20 hasta el 1 al 2%). Estas pacientes requerirán determinaciones seriadas de HCG. En otras palabras, la quimioterapia profiláctica no sustituye en forma apropiada el seguimiento postevacuatorio. Sin embargo, debería considerarse la quimioterapia profiláctica en las pacientes que se consideran en riesgo de mal cumplimiento, en especial si existen factores de alto riesgo para recurrencias. (19) 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 152 Además, existe la preocupación acerca de la posibilidad de inducción de resistencia a la quimioterapia en las pacientes que desarrollan un coriocarcinoma (20). . Con respecto a las situaciones de fetos gemelares con molas coexistentes, puede ser útil realizar una ecografía obstétrica completa para evaluar malformaciones fetales y para caracterizar la placenta. Debe evitarse el manejo apresurado de los embarazos gemelares que coexisten con una mola completa hasta que se evalúen por completo, debido a que el diagnostico diferencial con una enfermedad molar parcial puede ser difícil. Un porcentaje significativo de las gestaciones múltiples con feto/mola puede generar un feto viable y, aunque es mas frecuente la enfermedad maligna posmolar, se comunico una respuesta excelente a la quimioterapia (8). . SEGUIMIENTO POSTRATAMIENTO Luego de evacuar el tejido molar, las pacientes requieren determinaciones semanales de HCG hasta que este título este dentro de los límites normales durante 3 semanas. Luego se controlan los títulos en forma mensual durante 6 a 12 meses. Dentro de las primeras 8 semanas del seguimiento, entre 65 y 70% de las pacientes deberían haber comenzado la regresión espontánea. De las pacientes restantes, entre 10 y 15% seguirán con títulos en descenso, mientras que entre 15 y 20% mostraran una meseta o un aumento. (21) Este ultimo grupo requiere quimioterapia. Luego de la evaluación, las pacientes requieren anticoncepción efectiva. Si no existe una contraindicación para el uso de anticonceptivos orales, se prefiere este método. En los primeros trabajos retrospectivos, se incriminó a los anticonceptivos orales como causantes de aumentar la posibilidad de una NTG persistente(22-23-24).. Informes retrospectivos posteriores en los inicios de la década de 1980 dejaron de apoyar la relación entre anticonceptivos orales y enfermedad molar persistente (25-26). . El Gynecologic Oncology Group (GOG) condujo un estudio aleatorizado prospectivo que no revelo asociación alguna entre el uso de anticonceptivos orales y el riesgo mayor de requerir quimioterapia. (27) Un informe mas reciente sugiere que puede existir una ventaja en el resultado en las pacientes que utilizan anticonceptivos orales luego de la evacuación (28). Varias características clínicas del embarazo molar parecen relacionarse con una mayor probabilidad de enfermedad molar persistente. Se detallan en el cuadro siguiente: (1). 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 153 CARACTERÍSTICAS CLINICAS DEL EMBARAZO MOLAR Y RIESGO ESTIMADO DE ENFERMEDAD TROFOBLASTICA PERSISTENTE (PORCENTAJE)* CARACTERÍSTICA CLINICA Eclampsia Hemorragia tardía Insuficiencia pulmonar aguda Quiste teca-luteínicos > 5 cm Útero con un tamaño > 20 semanas Feto gemelar coexistente Útero grande para la edad gestacional Gonadotrofina coriónica humana sérica >100.000 mUI/mL Útero con un tamaño > 16 semanas Edad materna > 40 años PORCENTAJE 90 75 60 55 55 55 45 45 35 25 En total, alrededor del 20% de todas las pacientes con embarazos molares desarrollan enfermedad gestacional persistente y requieren quimioterapia. Las gestaciones múltiples que se complican con una mola también tienen mayor probabilidad de desarrollar enfermedad metastásica que las molas a partir de embarazos únicos. (8-29) La figura que se expone abajo representa un algoritmo para el seguimiento posmolar: (1) 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 154 Embarazo molar • • • • • Radiografía de tórax (RxT) ecografía pelviana / abdominal para evaluar los quistes teca-luteínicos T3/T4 si el pulso > 100 o existen signos o síntomas de tirotoxicosis CBC, recuento diferencial, formula plaquetas, TP, KPTT Tipo y grupo sanguíneo (Dar RhoGam si es Rh negativa y no hay anticuerpos) Evacuar (eventual histerectomía) RxT post-evacuatoria metástasis HCG sérica semanal :ANTICONCEPCIÓN Remisión: descenso estable de la HCG hasta la normalidad en 3 evaluaciones Titulo en meseta x 3 semanas titulo en aumento (descartar un nuevo embarazo oculto) Títulos mensuales x 6 luego cada 2-3 meses durante 6 meses estadificación * Basal * TC de Abd. y pelvis * TC de cerebro Sin metástasis metástasis quimioterapia con un solo agente En un embarazo posterior confirma la ausencia de una mola hidatidiforme mediante una ecografía precoz Histerectomía Seguimiento con HCG Luego del parto, repetir HCG a las 6 semanas. Riesgo de acuerdo con el puntaje pronostico de la OMS y TTO acorde 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 155 MOLA INVASORA Entre el 5 al 10% de todos los embarazos molares, contienen invasión miometrial. Luego de una evacuación molar se observa invasión en el 15% de las molas completas y solo un 4% presenta metástasis a distancia. El sitio más frecuente de metástasis es el pulmón, el diagnóstico se debe basar en la inexplicable aparición de sintomatología sistémica y pulmonar en paciente en edad reproductiva. Las metástasis vaginales se presentan en el 30% de las pacientes con enfermedad metastásica, son lesiones altamente vascularizadas que pueden provocar un sangrado profuso al biopsiarlas. Las metástasis hepáticas y cerebrales ocurren en el 10% de los casos, pero generalmente estas localizaciones son posteriores a un coriocarcinoma, y generalmente estas localizaciones son posteriores o concomitantes a un compromiso pulmonar o vaginal.(30) CARACTERÍSTICAS CLINICAS La característica clínica distintiva es la hemorragia. Al igual que el tejido Trofoblástico , esta tiene la propensión a buscar y a romper las arteriolas maternas , provocando sangrado vaginal o hemorragia peritoneal. Son mas frecuentes las MTS. Pueden sufrir remisión completa sin TTO. DIAGNOSTICO Y EVALUACIÓN Como la mola invasora no suele dar síntomas , el diagnóstico a menudo es incidental, luego de la Histerectomía, debido a complicaciones hemorrágicas. Si no existe enfermedad metastásica , las pacientes requieren seguimiento posquirúrgico, y un TTO similar a las molas completa y parcial. TUMOR TROFOBLASTICO DEL SITIO PLACENTARIO El STP solo representa el 1% de las neoplasias trofoblática gestacional. Este tumor tiene potencial maligno, ya que el 10 a 20 % desarrollan MTS, y la mayor parte muere como causa de ésta. CARACTERÍSTICAS CLINICAS Las pacientes con TTSP suelen presentar hemorragia vaginal anormal. En la mayor parte de las pacientes , esta enfermedad se manifiesta luego de un embarazo de término, aunque también puede ser secuela de un embarazo molar o un aborto. Durante el período postparto la paciente suele tener : 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC - 156 Útero mas grande que lo esperado. Hemorragia persistente. HCG algo elevado (no suele reflejar la progresión de la enfermedad). Síndrome nefrótico. Virilización. Las MTS suelen ocurrir en forma tardía debido a que es un tumor maligno bien diferenciado. DIAGNOSTICO El alto índice de sospecha puede basarse en la presentación clínica característica. El diagnostico histológico puede obtenerse mediante raspado uterino. También puede obtenerse por medio de la histeroscopía. Pero generalmente se obtiene de histerectomía. Cuando se sospecha esta patología deberían buscarse MTS y realizar HCG seriada. La ECO TV no muestra patrón específico. TRATAMIENTO Y SEGUIMIENTO El raspado uterino o la resección endometrial selectiva mediante histeroscopía pueden ser curativos en pacientes con proliferaciones focales del sitio placentario. Dado que esta enfermedad suele dar MTS tardía, tiende a ser de algún modo resistente a la QMT, se recomienda la cirugía ( histerectomía). Las pacientes que tienen deseos de fertilidad , el TTO es mas difícil. En estas se puede realizar QMT, raspado; en cambio las pacientes con MTS, la histerectomía puede ofrecer poco o nada de mejoría en la supervivencia a largo plazo. El seguimiento , se debe realizar a 5 años. CORIOCARCINOMA El coriocarcinoma se desarrolla en uno de cada 20000 a 40000 embarazos de término, en cambio, se desarrolla en alrededor de 3 a 5 % de las pacientes con enfermedad molar. - 50% se desarrollan luego de una mola. 15% se desarrollan luego de un embarazo de término. 25% se desarrollan luego de un aborto. CARACTERÍSTICAS CLINICAS La evolución natural de un coriocarcinoma es una progresión y diseminación rápida, y la muerte ocurre dentro de unas pocas semanas hasta unos pocos meses después de la presentación clínica. La causa inmediata de la muerte suele relacionarse con la hemorragia. 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 157 El coriocarcinoma se conoce bien por su tendencia a enmascararse como otras enfermedades, esto es debido a que produce rápidamente MTS hemorrágicas, y da síntomas tales como: hematuria , hemoptisis, hematoquesia, infarto cerebral y hemorragia vaginal. DIAGNOSTICO Debe considerarse toda mujer en edad reproductiva, que presenta enfermedad metastásica a partir de un tumor 1° desconocido o mal documentado. El diagnostico de coriocarcinoma suele basarse en la evolución , los estudios por imágenes, y las determinaciones de HCG. Aunque a veces es posible la confirmación histológica, no es necesaria , debido a dos grandes complicaciones : 1- Riesgo de sangrado profuso en el sitio de la biopsia. 2- Muchas veces el material es insuficiente (hemorragia y necrosis) , lo que demora el diagnóstico. TRATAMIENTO La QMT es la piedra angular del TTO de NTG metastásica, los resultados óptimos , pueden depender del agregado de cirugía y de irradiación. La actualización con respecto a los criterios diagnósticos, estadificación, y pronóstico: CRITERIOS DIAGNOSTICOS DE NTG ( FIGO 2000 ) (31). 4 valores meseta (o aumentados de HCG durante 3 semanas, días 1, 7, 14, 21). Aumento del 10% o más del valor HCG, por 3 valores durante 2 semanas. Dx histológico de Coriocarcinoma Persistencia de HCG por 6 meses, luego de evacuación de mola) 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 158 NUEVA ESTADIFICACION DE ETG FIGO 2000 SISTEMA DE ESTADIFICACION ANATOMICA PARA ETG FIGO + PUNTAJE POR FACTOR DE RIESGO ( OMS ) ESTADIFICACION DE ETG La nueva estadificación anatómica de FIGO quita el A,B, C, pero combina con puntaje de la OMS modificado. ESTADIO I II III IV DESCRIPCIÓN Limitado al cuerpo el útero Se extiende a los anexos, fuera el útero, pero se limita a las estructuras genitales Se extiende a los pulmones con compromiso del aparato genital o sin él Todos los otros sitios e metástasis Subestadios asignados para cada estadio como sigue: A. sin factores de riesgo presentes B. Un factor de riesgo C. Ambos factores de riesgo Factores de riesgo se usan para asignar los subestadios : 1. HCG sérica pretratamiento > 100.000 mUI/mL 2. Duración de la enfermedad > 6 meses Informe del comité oncológico de la FIGO,1992 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 159 SISTEMA DE PUNTAJES PRONOSTICO DE LA OMS PUNTAJE* FACTOR PRONÓSTICO Edad (años) Antecedentes de embarazo 0 <39 Mola hidatidiforme Intervalo (meses) de TTO HCG inicial (mUI/mL) Grupo sanguíneo Tumor mas grande (cm) Ubicación de las metástasis N° de metástasis Previo (tratamiento <4 3 <10 <3 Pulmón - 1 >39 Aborto, embarazo ectópico 4-6 3 4 10 -10 OxA 3-5 Bazo, riñón 1-4 - 2 Embarazo de termino 7-12 4 5 10 -10 B o AB >5 Tracto GI, hígado 4-8 Droga unica 4 >12 5 >10 Cerebro 8 2 o más *Bajo riesgo = 4 o menos; riego mediano 5-7; alto riesgo 8 o más. Abreviaturas: GI, gastrointestinal: HCG, gonadotrofina coriónica humana. Modificado del Scientific Group on Gestational Trophoblastic Disease de la Organización Mundial de la Salud Technical Report Series N°692). Ginebra: Organización Mundial de las Salud, 1983, con autorización. CAMBIOS DE LA NUEVA ESTADIFICACION GRUPOS DE RIESGO(31) Grupo de alto riesgo de NTG : Grupo de bajo riesgo: >o=7 <o=6 Fue eliminado el grupo de riesgo intermedio. TTSP debe clasificarse como entidad independiente de otras NTG. No hay estadio 0 de NTG. Controversia ABO fue eliminado MTS hepáticas tienen puntaje máximo TRATAMIENTO Estadio Grupo de riesgo QUIRURGICO QUIMIOPROFILAXIS Grupo de especialistas QUIMIOTERAPIA Deseos de fertilidad Respuesta de la paciente Capacidad de seguimiento PROPIO DE MTS 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 160 INDICACIONES DE HISTERECTOMIA Fertilidad cumplida 1º opción terapéutica TTSP (cualquier estadio) Persistencia de foco residual uterino resistente a la quimioterapia. Control complicaciones (hemorragia y necrosis tumoral). Enfermedad extrauterina con pobre o mala respuesta a quimioterapia. Tumor extendido y Enfermedad diseminada. INDICACIONES DE QUIMIOPROFILAXIS(32) Pacientes clasificadas de alto riesgo, ya que reduce la NTG persistente. NO debe indicarse en pacientes de bajo riesgo: Coriocarcinoma QUIMIOTERAPIA MONODROGA(32) Metotrexate (MTX) (0.1 mg/kg IM x 8 días) dia 1, 3, 5, 7 + LEUCOVORINA ( 0.1 mg/Kg 24 hs post c/dosis) dias 2, 4, 6, 8 ACTINOMICINA D 0.5 mg/día x 5 días ó 1.25 mg/m2 iv cada dos semanas QUIMIOTERAPIA COMBINADA(32) EMA/ CO Etoposido: 100mg/m2 ev dia 1y2 Mtx: 300mg/n2 Ev 12 hs post dia 1 Actinomicina 0.5 mg ev bolo dia 1 y 2 Leucovorina:15 mg vo 2 veces por dia 2 y 3 Ciclofosfamida : 600mg/m2 Ev en dia 8 Vincristina : 1 mg /m2 ev en dia 8 A modo de resumen, se puede establecer que el tratamiento de la Enfermedad Trofoblastica Gestacional va a depender de que una paciente sea de bajo riesgo o alto riesgo . 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 161 (33) BAJO RIESGO - I , II , III con Score menor de 7. Con metástasis de bajo riesgo. Sin metástasis - 2~intento con monodroga. Terapia combinada Monodroga con o sin HT 80% de remisión (34) ALTO RIESGO - II , III , IV con Score mayor de 7 Metástasis. Alta chance de resistencia a la QMT. Refractaria a Tto con monodroga EMA / CO Quimioterapia de salvataje - EMA / EP. Cisplatino y Bleomisina 80% remisión 20% resistencia BIBLIOGRAFÍA 1- Copeland L, Jarrell J, Tratado de Ginecología. 2 ° edición. 2002. Editorial Panamericana. Enero 2002. Impreso en Argentina. 1518 – 1519. 2- Pérez Sánchez A. , Donoso E. Obstetricia . 3° edición. Editorial Mediterráneo. Impreso en Chile. 462- 464. 3- Yen S, Mac Mahon B. Epidemiology Features of trophoblastic desease. AM J Obstetric Gynecol 1968. 101-126. 4- Palmer JR. Advances in the epidemiology of gestational trophoblastic desease. J Reprod Med 1994 . 39 – 155. 5- Palmer JR y col. Oral contraceptive use and rik of gestational trophoblastic Tumors. J Natl Cáncer 1999. 97- 635. 6- Parasen F, y col. Reproductive patterns and the risk of gestational trophoblastic disease. Am J Obstetric Gynecol 1985. 152-866. 19-Enfermedad Trofoblastica Gestacional Servicio de Ginecología – Ambulatorios OSECAC 162 7- Parasen F, y col . Parental age and risk of complete and partial hydatidiform mole. Br J Obstetric Gynecol 1986. 93-582. 8- Stellar y col. Natural history of twin pregnancy with complete hydatidiform mole and coexistent fetus. Obstetric Gynecol 1994. 35. 9- Kajii T y col. Androgenetic origin of hydatidiform mole. Nature 1977, 268:633. 10- Surti U y col. Dispermic origin and clinical outcome of trhee complete hydatidiform mole with 46 XY Karyo-Type. Am J Obstetric Gynecol 1982,144:84. 11- Szulman y col. Trophoblastic disease: clinical pathology of hydatidiform mole. Obstetric Gynecol Clin North Am 1988, 15:433. 12- Miller y col. Complete hydatidiform mole coexistent with a twin live fetus: complete cytogenetic analysis. Gynecol Oncol. 1993, 50:119. 13- Woodward RM y col. Firt trimestrer molar pregnancy : nonspecific ultrasonographic appearance. Obstetric Gynecol 1980, 55:1. 14- Romero R, Horgan JG y col. New criteria for the diagnosis of gestational trophoblastic disease. Obstet Gynecol 1985; 66(4):553-8. 15- Kohorn EI y col. Nonmetastatic gestational trophoblastic neoplasia. Role of ultrasonography and magnetic resonance imaging. J Reprod. Med. 1998; 43(1):14 –20. 16- Montz FJ y col. The natural history of thecalutein cysts. obstet Gynecol 1988;72:247. 17- Williams y col. Obstetricia 20° edición. Argentina 1998 18- Hammond CB y col. The role of operation in the current therapy of gestational trophoblastic desease. Am J Obstet Gynecol 1980;136:844. 19- Ratnam SS y col. Methotrexate for prophylaxis of choriocarcinoma. Am J Obstet Gynecol 1971;111:1021. 20- Kim DS y col. Effects of prophylactic chemotherapy for persistent trophoblastic desease in patients with complete hy hydatidiform mole. Obstet Ginecol 1986;67:690. 21- Brewer JI y col. Hydatidiform mole: a follow-up regimen for identification of invasive mole and choriocarcinoma and for selection of patients for treatment. Am J Obstet Gynecol 1968;101:557. 22- Cheung AN y col. The significance of Stone M y col. Relationship of oral contracepcion to development of trophoblasctic tumor after evacuation of a hydatidiform mole. Br J Obstet Gynecol 1976; 83:913. 23- Brewer y col. Gestational trophoblastic disease: selected clinical aspects and chorionic gonadotropin test methods. Curr prob Cancer 1979;3:1. 24- Ho Yuen B, Burch P: relationship of oral contraceptives and the intrauterine contraceptive devices to the regression of concentrations of the beta subunit of human chorionic gonadotropin and invasive complications after molar pregnancy. Am J Obstet Gynecol 1983;145:214. 25- Berkowitz RS y col. Oral contraceptives and postmolar trophoblastic disease. Obstet Gynecol 1981;58:474. 26- Morrow CP y col. The influence of oral contraceptives on the postmolar human chorionic gonadotropin regression curve. Am J Obstet Gynecol 1985;151:906. 27- Curry SL y col. Hormonal contraception and trophoblastic sequelae after hydatidiform mole: a Gynecologic Oncology Group study. Am J Obstet Gynecol 1989b;160:805. 28- Deicas RE y col. The roles of contreception in the development of postmolar gestational trophoblastic tumor. Obstet Gynecol 1991;78:221. 29- Fishman DA y col. Management of twin pregnancies consisting of a complete hydatidiform mole and normal fetus. Obstet Gynecol 1998;91:546 30- Cancer Medicine. Section 31. Neoplasms of the Female Reproductive Organs. 116 Gestational Trophoblastic Disease (web) 31- Kohorn EI, The new FIGO 2000 staging anad risk factor scoring system for gestational trophoblastic disease. It J Gynecol Cancer,2001. 32- Berkowitz R, Goldstein DP. Management of complete molar pregnancy. J Reprod. Med, 1987. 33- Mc Neish IA, Strickland S, Holden L y col. Low- risk persistent gestational trophoblastic disease: Outcome after initial treatment with low-dose Methotrexate and Folinic Acid from 1992 to 2000. J Clin Oncol 2002; 20(7):1838 – 44. 34- Escobar PF, Lurain JR. Treatment of high-risk gestational trophoblastic neoplasia with etoposide, methotrexate, actinomycin D, cyclophosphamide, and vincristine chemotherapy. Gynecol Oncol 2003; 91(3):552 – 7.