UNIDAD DIDACTICA Aminas - QUIMICA
Anuncio

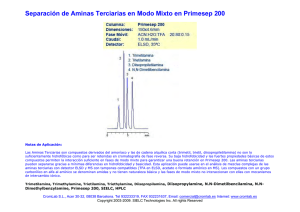
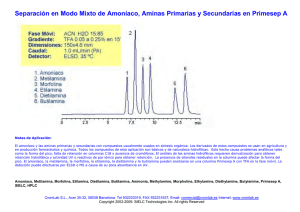
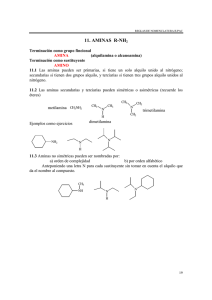
UNIDAD DIDACTICA Aminas Las aminas son compuestos químicos orgánicos que se consideran como derivados del amoníaco y resultan de la sustitución de los hidrógenos de la molécula por los radicales alquilo. Según se sustituyan uno, dos o tres hidrógenos, las aminas serán primarios, secundarios o terciarios, respectivamente. Amoníaco Amina primaria Amina secundaria Amina terciaria Ejemplos Aminas primarias: anilina Aminas secundarias: dietilamina, isopropilamina Aminas terciarias: dimetilbencilamina Las aminas son simples cuando los grupos alquilo son iguales y mixtas si estos son diferentes. Las aminas son compuestos muy polares. Las aminas primarias y secundarias pueden formar puentes de hidrógeno. Las aminas terciarias puras no pueden formar puentes de hidrógeno, sin embargo pueden aceptar enlaces de hidrógeno con moléculas que tengan enlaces O-H o N-H. Como el nitrógeno es menos electronegativo que el oxígeno, el enlace N-H es menos polar que el enlace O-H. Por lo tanto, las aminas forman puentes de hidrógeno más débiles que los alcoholes de pesos moleculares semejantes. Las aminas primarias y secundarias tienen puntos de ebullición menores que los de los alcoholes, pero mayores que los de los éteres de peso molecular semejante. Las aminas terciarias, sin puentes de hidrógeno, tienen puntos de ebullición más bajos que las aminas primarias y secundarias de pesos moleculares semejantes. Caracteristicas de las aminas Las aminas son compuestos muy polares. Las aminas primarias y secundarias pueden formar puentes de hidrógeno. Las aminas terciarias puras no pueden formar puentes de hidrógeno, sin embargo pueden aceptar enlaces de hidrógeno . Las aminas primarias y secundarias tienen puntos de ebullición menores que los de los alcoholes, pero mayores que los de los éteres de peso molecular semejante. Las aminas terciarias, sin puentes de hidrógeno, tienen puntos de ebullición más bajos que las aminas primarias y secundarias de pesos moleculares semejantes. PROPIEDADES FISICAS Las aminas son compuestos incoloros que se oxidan con facilidad lo que permite que se encuentren como compuestos coloreados. Los primeros miembros de esta serie son gases con olor similar al amoníaco. A medida que aumenta el número de átomos de carbono en la molécula, el olor se hace similar al del pescado. Las aminas aromáticas son muy tóxicas se absorben a través de la piel. SOLUBILIDAD Las aminas primarias y secundarias son compuestos polares, capaces de formar puentes de hidrógeno entre sí y con el agua, esto las hace solubles en ella. La solubilidad disminuye en las moléculas con más de 6 átomos de carbono y en las que poseen el anillo aromático. Nomenclaturas Las aminas se clasifican de acuerdo con el número de átomos de hidrógeno del amoniaco que se sustituyen por grupos orgánicos. Los que tienen un solo grupo se llaman aminas primarias, los que tienen dos se llaman aminas secundarias y los que tienen tres, aminas terciarias. Cuando se usan los prefijos di, tri, se indica si es una amina secundaria y terciaria, respectivamente, con grupos o radicales iguales. Cuando se trata de grupos diferentes a estos se nombran empezando por los más pequeños y terminando con el mayor al que se le agrega la terminación amina. Algunas veces se indica el prefijo amino indicando la posición, más el nombre del hidrocarburo. Ejemplos Compuesto Nombres CH3-NH2 Metilamina o aminometano. CH3-NH-CH3 Dimetilamina o metilaminometano. CH3-CH2-NH-CH2CH2-CH3 Etilpropilamina o etilaminopropano. CH3 | N-CH3 | CH3 Trimetilamina o dimetilaminometano. CH3 | N-CH2-CH2-CH3 | CH2-CH3 Etilmetilpropilamina o metiletilaminopropano. Netil,N-metilpropanoamina