uso de anticonvulsivantes
Anuncio

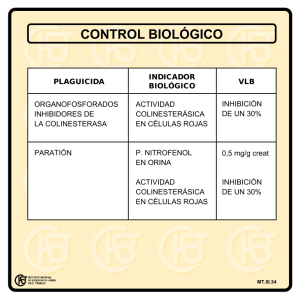
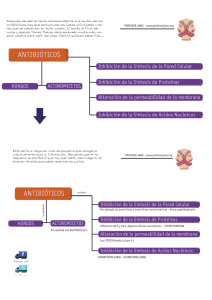
USO DE ANTICONVULSIVANTES Dr. Estrada La epilepsia es una patología compleja con una incidencia y prevalencia en aumento principalmente en países en vías de desarrollo. Y la importancia de saber el manejo de esta enfermedad es que esta patología aumenta la mortalidad de las personas que la padecen comparado con personas que no son epilépticas. Esta mortalidad está asociada a diferentes complicaciones como neumonía por broncoaspiración, trauma por la crisis convulsiva, entre otros. Con respecto a las causas, en CR una de las más comunes en pacientes mayores de 60 años (la gran mayoría de los usuarios de servicios de salud) es la ECV. En EUA existe un premio que se entrega anualmente y se llama como este señor, el premio “Alfred Hauptmann”, él fue un alemán de descendencia judía que trabajaba en una universidad al sur de Berlín alrededor de los años 1910-­‐1920, cuando él trabaja en una unidad psiquiátrica y utilizaba fenobarbital en los pacientes alterados o ansiosos, notó que los que antes convulsionaban dejaron de hacerlo y gracias a esto es que comenzó el desarrollo de la farmacología para la epilepsia, a pesar de que fue solo un hallazgo incidental. Posterior a esto en 1935 sucedió algo muy triste, se instauró la ley del “cuidadano del reino” y tuvo como consecuencia que los judíos no fueran bienvenidos entre la población alemana, por lo que el Dr. Hauptman tuvo que huir a EUA donde continuó trabajando y finalmente falleció. De lo anterior lo importante es que sepamos que tenemos en realidad muy poco tiempo, menos de 100 años, tratando pacientes con epilepsia, y que en este tiempo los mecanismos blanco de la farmacología no hay cambiado mucho. EPILEPSIA Dos definiciones: “Aquella crisis que genera síntomas o signos con una anormal y excesiva sincrónica actividad cerebral en un sitio específico del cerebro” à NO útil en la clínica “Dos crisis presenciadas con al menos 1 día entre ellas” à Se dice que un paciente que convulsiona una primera vez tiene un riesgo de recurrencia relativamente bajo, alrededor de un 40%, sin embargo aquellos pacientes que tengan riesgo de recurrencia elevado por alguna característica particular, aunque sea solo una crisis se le manejara como epilépticos. Y por último están los síndromes epilépticos que por lo general aparecen desde la infancia y que se deben tratar con mas cuidado y como epilépticos desde la primer crisis. (no dijo nada mas) Los factores de riesgo que elevan el riesgo de recurrencia en un paciente que convulsiona una vez son: è Hoy llamadas crisis focales, y estas SIEMPRE se deben manejar como una epilepsia (sugiere lesión)) Especialmente si la anormalidad esta en periodos interictales è è è Babinsky, un par craneal… Una masa, zona de atrofia, zona de isquemia Y esto es lo que se examina en un paciente que convulsiona por primera vez: HC, TAC, EEG y Examinación neurológica para evaluar el riesgo de recurrencia, si todo está normal se maneja por consulta externa de neurología. FISIOPATOLOGÍAà Aquí radica la base de la farmacología En el sitio de cualquier sinapsis, sea cortical, talámica… hay un balance entre los NT exitatorios y los inhibitorios. En un paciente epiléptico podemos ver sobreactivación por efecto de la actividad aumentada en las sinapsis exitatorias y una disminución en la contraparte inhibitoria (desbalance). En la imagen podemos ver como se dan exitaciones e inhibiciones en serie. En la primera se ve como hay una neurona inhibitoria que actúa sobre una exitatoria que produciría crisis, entonces si se pierde la inhibición de la primera, se sobreactiva la segunda y da una crisis. Por otro lado, si yo tengo una neurona que me inhiba la neurona inhibitoria de la neurona exitatoria (segunda línea), la neurona exitatoria no tendrá inhibición y se dará la crisis. PEROOO no es tan fácil, normalmente las dos vías anteriores se combinan (línea 3). En general las vías que se combinan y producen la crisis son vías cortico-­‐talámicas, esto explica porque si hay neuronas exitatorias a nivel cortical se dan movimientos de miembros superiores por ejemplo, el detalle es que todos los movimientos tienen que pasar por un relevo talámico donde se le “aplica” cierta inhibición, esta inhibición es la que puede estar disminuida cuando se da la crisis y es donde algunos fármacos buscan actuar. Lo anterior se puede ver también en esta imagen, arriba en el cuadrado gris esta la corteza y abajo el circulo celeste es el tálamo. La corteza lo que tiene son neuronas exitatorias, es decir, estimulan el potencial de acción (recordemos que el potencial de membrana en reposo es mantenido por canales de potasio – Importancia farmacológica). Los canales HCN son los encargados de la corriente Funny, que es una corriente de potasio y se estimula por tres cosas: Hiperpolarización, nucleóticos cíclicos (como AMPc) y el frío. Las neuronas que tienen HCN son neuronas entonces que funcionan como un marcapaso, con esto se refiere a que no tienen potenciales de acción tan rápidos pues dependen eventualmente más de la corriente de calcio que la de sodio. Los canales T channels, son canales de calcio tipo L y están involucrados en la espina de descarga tálamo cortical. Y finalmente también hay sitios de descarga mediados por canales de sodio pero estos son más importantes en la neurona post-­‐sináptica. En resumen, los efectores mencionados hasta el momento son: § Canales de potasio, no son los más importantes para farmacoterápia § § § HCN Canales de Calcio Canales de Sodio Los potenciales inhibitorios que se ven en la imagen, están dados por GABA y esto es lo que a nivel talámico da el balance de estímulos corticales, inhibición por GABA y esta es la balanza que si se ve alterada lleva a la crisis convulsiva. Un ejemplo de esto es que en modelos animales se ha estudiado que post-­‐trauma hay una regulación deficiente de los HCN en estados pre-­‐crisis entonces no hay un marcapaso que logre mantener la actividad normal. En otros casos la alteración de estos canales es de tipo genética como por ejemplo: § § § Perdida de función de canales de Cl-­‐ que son los que median la hiperpolarización Ganancia de función de los canales de Na+ Ganancia de función en canales de calcio. Y al final todo lleva a un aumento en la excitación y una disminución en la inhibición. Clasificación de las Crisis Recordar que se tienen dos grandes grupos de crisis: → GENERALIZADAS à significa que abarca los dos hemisferios. Ejemplos: o Tónico-­‐clónicas: hay que tener cuidado en las historias clínicas, todo mundo pone crisis tónico-­‐clónicas es como una muletilla pero como vamos a ver en los otros ejemplos hay pacientes que solo hagan tónicas, solo clónicas, atónicas o mioclonias y esto es importante porque significa diferencias en el tratamiento no es lo mismo tratar una crisis mioclónica que una crisis tónico-­‐clónica generalizada; el tratamiento que sirve en la primera exacerba la segunda. o Tónico o Clónico o Atónicas o Mioclónicas o Ausencias: con estas se debe tener mucho cuidado, se consideran generalizadas, y hay varios tipos. → FOCALES à Solamente un hemisferio, ya no se llaman parciales. Las diferencias se hacen con respecto a las características que tiene cada una, como auras, manifestaciones autonómicas, motoras, etc. Algunas focales pueden terminar haciendo una generalizada y en el momento que suceda esto, el tratamiento será como una generalizada. Drogas antiepilépticas La teoría actual dice que lo que hay es una pérdida del balance entre neuronas excitatorias vs inhibitorias cortico-­‐talámicas, puede darse una disfunción hacia uno de los dos extremos. Vamos a ver ambos extremos de la regulación, primero la sinapsis excitatoria: 1 3 2 4a 4b A manera de ejemplo esto podría tratarse de una sinapsis cortico-­‐talámica y se ilustran los efectores de donde podremos entender el uso de cada medicamento que de alguna manera buscan limitar la liberación o función de glutamato en distintos puntos; la mayoría de estos fármacos los tiene la CCSS: 1. Un canal de Na voltaje dependiente: si se bloquea este canal no se va a despolarizar; con lo que el potencial de membrana no llegara al punto en que se active el canal de calcio. Fármacos que hagan esto: § Fenitoina. § Carbamacepina y oxcarbacepina. § acido valproico: Ojo con este porque sale en todo lado. § Lamotrigina. § Lacosamida: este curiosamente lo que hace es que impide la inactivación tardía por lo que prolonga el periodo refractario absoluto, de manera que no se pueda generar otro potencial. § Topiramato OJO pregunta de medicamentos que modulan canales de sodio; en la imagen vienen más que no menciono. 2. Un canal de calcio tipo L, específicamente la subunidad alfa2beta: el bloqueo directo de este impide la liberación de vesículas. § Gabapentina (Neurontin) § Pregabalina (Lyrica) 3. Vesículas donde se guarda el neurotransmisor excitatorio: en este caso en específico vemos una vesícula de sinapsis excitatoria la SV2A. Un fármaco que lo bloquea y es bastante nuevo. § Levetiracetam (Keppra) 4. Efectores para glutamato: 4A: NDMA: Felbamato; no le dio mucha importancia. 4B: activación del canal Kainato: de Topiramato OJO que lo vimos en los canales de sodio también. La otra parte sería el balance inhibitorio, donde lo que buscaríamos seria aumentar la inhibición, de nuevo la imagen ilustra los puntos donde se puede atacar. § 3 2 1 1. Receptores de GABA: aumentan la hiperpolarización. § Barbitúricos § Benzodiacepinas § Topiramato: OJO tercer mecanismo que podemos ver. EXAMEN 2. Recaptura de GABA en la neurona presinaptica a través del GAT1: si se recaptura habrá menos GABA y por lo tanto menos estímulo a su receptor disminuyendo la hiperpolarización; si se bloquea se aumenta la disposición de GABA. § Tiagabina 3. Metabolismo de GABA (su transaminación): el metabolismo disminuye la cantidad del mismo disponible. § Vigabatrina: se utiliza mucho en niños. en esta tabla se resume los mecanismos de la mayoría de medicamentos. OJO este medicamento que interviene con canales de potasio: Favoreciendo que no haya tanta corriente positiva en reposo Retigabina Farmacoterapia de la epilepsia Conociendo las herramientas en cuanto a drogas que acabamos de ver ya podemos ir viendo específicamente el manejo en cada tipo de crisis; actualmente se cuenta con gran cantidad de medicamentos algo que no sucedía antes de 1990 en esa época casi que la única molécula era Valproato de sodio. En relación a este medicamento algunos textos lo mencionan como un fármaco antiepiléptico de amplio espectro sin embargo el profesor aclara que es mejor verlo como un medicamento que puede generar efecto en varios sitios y que es muy útil en varios tipos de condiciones epilépticas; por lo tanto ese amplio espectro es porque funciona modulando vario de los puntos efectores y mas que esto lo importante es que en los estudios de comparación valproato vs “otra droga” siempre les va mejor con valproato. ¿A quienes tratamos? Cuadro resumen del tratamiento según tipo de crisis Crisis generalizadas Aquellas donde el px tiene movimientos tónico-­‐clónicos. Los fármacos de primera línea están orientados a la modulación de canal de sodio y son: • • • • Carbamazepina Lamotrigina (lamictal) Topiramato Valproato de Sodio **Segunda línea: Oxcarabacepina Comparados entre ellos el mejor es valproato!!, el problema son los efectos adversos CUIDADO à Si se usan fármacos que aumentan la inhibición (se sobreinhibe), se puede exacerbar las crisis. Algunos de estos son: • • Tiagabina Bigabatrina Implicados en la recaptura de GABA Ausencias El fármaco por elección: • • • Etusuximida à Primera línea Valproato de sodio à Segunda Línea Lamotrigina à Tercera línea CUIDADO à También hay medicamentos que pueden exacerbar estas crisis y son: • • • Carbamacepina Gabapentina Oxcarbazepina Crisis Mioclónicas • • Valproato Topiramato (topamax) Tónica o Atónica • • • Valproato Lamotrigina NO USAR CARBAMACEPINA Entonces… En que paciente se utiliza carbamacepina? Crisis generalizadas y que se esté seguro que no son ausencias, Mioclónicas ni tónicas o atónicas. A pesar de que la lamotrigina tiene el mismo mecanismo, esta actúa en otros sitios y modula la respuesta. Casos especiales: Crisis focales y generalizan à Se manejan como generalizadas Fenitoína à Otra droga aparte, ni siquiera segunda línea. La fenitoína no debería ser un fármaco de mantenimiento en pacientes que sufren epilepsia pues hay unos de mejor espectro. Es bueno en el agudo pero no en el crónico! Síndromes epilépticos à Generalmente siguen el mismo esquema de Valproato y lamotrigina; el único que utiliza valproato y topiramato es alguno que curse con crisis Mioclónicas pues en este no se debe utilizar lamictal. Se manejan según el tipo de crisis con las que cursen. Focales Que anteriormente se llamaban parciales, pueden manejarse con el mismo esquema de las crisis generalizadas Elección del medicamento à Según el perfil de seguridad del fármaco el Dr. Estrada no paso este cuadro, por lo que se lleno con el audio las dosis que no menciono por lo tanto se colocan según un resumen que se hace de medscape, para ver los esquemas más detallados revisar la aplicación. Fármaco Carbamacepina Lamictal Keppra (Levetiracetam) Oxcarbamacepina Fenitoína Fenobarbital Tiagabina Topiramato Dosis Dosis de mantenimiento: 800-­‐ 1200 mg/day V.O en dosis dividida. Dosis máxima recomendada 1600mg/día Rango terapéutico: 4-­‐ 12mg/L APRENDERSELA Efectos adversos Agranulocitosis Anemia Aplásica Steven Johnson Hiponatremia (el más común) 25 mg con dosis tope de Steven Johnson 100 mg Rash Casi 2 gramos por día 300 mg/día cada 12 horas, luego se puede aumentar de 600-­‐1200mg/día. Y hasta 2400mg si es monoterapia. Iguales a carbamacepina Dosis meta: 200-­‐300mg Bloqueos cardiacos Steven Johnson 1-­‐3mg/kg/día IV o VO dividido en 2 dosis Steven Johnson En Tx con AED que sea inductor enzimático: Iniciar con 4mg/día la primera semana luego titular 4-­‐8mg más por semana sin exceder los 56 mg dividido en dosis cada 8 o 12 horas. En Tx con AED que NO sea inductor enzimático: 12-­‐22mg/día dividir en dosis cada 8-­‐12 horas. Alteraciones cognitivas 25 mg/cada 12 horas Pierden peso Alteración de la función hepática Acido Valproico 2 gramos Subir de peso Poliquistosis ovárica Hirsutismo IMPORTANTE à Casi todos los moduladores de Sodio alteran función hepática, sin embargo estos no se deben suspender a menos que eleven los marcadores mas allá de dos veces el nivel base, menos de eso no es que sea normal pero es “tolerable”. Interacciones medicamentosas Los pacientes no solo son epilépticos, por lo general también son diabéticos, hipertensos, dislipidémicos… por esto es que hay que tener cuidado cuando hay algún grado de polifarmacia y elegir de manera adecuada el medicamento. Los principales inductores enzimáticos son (aumentar aclaramiento): • • • Carbamazepina Fenobarbital Fenitoína Cuidado con: • • • • • Estatinas Warfarina Amiodarona Inhibidores de proteasas Otros antiepilépticos en terapia combinada** **Esto hace que mantener los niveles de antiepilépticos en niveles terapéuticos cuando se está utilizando terapia combinada puede ser muy complejo. Los principales inhibidores enzimáticos son (disminuye aclaramiento): • Acido Valproico à Mucho cuidado con benzodiacepinas pues puede aumentar considerablemente el nivel de sedación y con calcio antagonistas. RESUMEN: Antiepilépticos en embarazo: (PREGUNTA DE EXAMEN) Muchos de estos fármacos no están recomendados en embarazo especialmente en el primer trimestre, es por esto que debemos tener cuidado con el potencial inductor o inhibidor enzimático de anticonceptivos orales para evitar un embarazo no deseado. Sigue el mismo concepto anterior: • • Carbamacepina à Es un inductor enzimático, por lo que aumentará el aclaramiento de ACO disminuyendo su eficacia. (los encerrados en rojo también APRENDERSELOS!!) Excepción à Los ACO también influyen en el metabolismo hepático y disminuye las concentraciónes de valproato (EXAMEN!!) NUEVOS CONCEPTOS: Esto viene a explicar aspectos extras a solo excitación y inhibición neuronal: Vías Inflamatorias à ¿Porqué el paciente con meningitis convulsiona? Se sabe que cuando esta está mediada especialmente inmunidad celular, Th1, se activan mecanismos que me alteran la permeabilidad de la BHE como: • • • Se exponen receptores de IL-­‐1 (beta) Se exponen receptores Toll Lipoproteínas de adhesión celular Y que cuando estos se activan modulan la propensión a convulsión de un paciente en un estado inflamatorio. Esto se ha demostrado gracias al uso de ciertos fármacos que modulan o bloquean estos receptores como el anakinra, lo que resulta en la “disminución” de la suceptibilidad a desarrollar una convulsión. En la actualidad están en estudio los receptores tipo Toll para encontrar un blanco terapéutico que pueda ir más allá del simple modelo de excitación-­‐inhibición. Otras vías inflamatorias estudiadas son: • • • TGF beta Vía del mTOR à Vía de síntesis proteica en la que están involucrados los neutrófilos y sobre la que actúa la rapamicina y el everolimus. Su uso como antiepiléptico se ha descrito más en pacientes con esclerosis tuberosa (epilepsia asociada a una lesión tumoral). Vía REST à Esta está involucrada en la respuesta nuclear que generalmente es inhibitoria (silencia la expresión de genes), entonces se ha estudiado que en un paciente que convulsiona por alguna razón perdieron esta inhibición (diferente a la GABA). Los genes que están fallando en ser silenciados tienen como objetivo final algo relacionado con la síntesis de canales de calcio lo que aumenta la espiga y por ende la excitación neuronal. Sistema Monoaminérgicoà El paciente epiléptico puede tener depresión, lo que también influye en la elección del fármaco LO IDEAL… Poderle dar a un paciente lo que ocupa (estamos a muchos años de eso) • • Tiene esclerosis tuberosa à EVEROLIMUS Crisis de Ausencia à Tratar solo receptores talámicos (aunque ya se sabe que no es talámica es subcortical) Y finalmente el quiere que sepamos que las nuevas moléculas son modificaciones de las ya existentes • • • Retigabina que aun no esta aprobado Brivaracetam à Modificación del levetiracetam Eslicarbamacemina à Modificación de la oxcarbacepina Entonces a pesar de que se sabe que hay nuevas vías involucradas, las casa farmacéuticas siguen investigando en lo mismo de hace 100 años y en ocasiones hasta devolverse a cosas que ya no se usan.