Practica 2. Medición de Volúmenes. Introducción: En el laboratorio
Anuncio

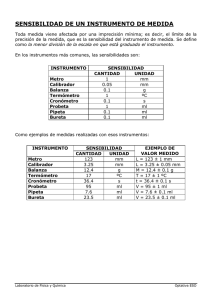
Practica 2. Medición de Volúmenes. Introducción: En el laboratorio se emplean una variedad de implementos para la realización de las experiencias, algunos de ellos son denominados volumétricos, ya que se usan para medir volúmenes de fluidos, ya sean líquidos o gases. Entre los aparatos volumétricos más usados tenemos: Probetas, Pipetas, Buretas, Vasos de precipitado, tubos de ensayo, entre otros. En algunos aparatos el líquido se mide adicionándolo en el interior de este, mientras que en otros como en el caso de las pipetas el liquido se mide llenando esta mediante succión (o vacío) con perillas de caucho. Una alternativa poco recomendable es hacerlo por succión por la boca y poniendo el dedo índice sobre la parte superior de la pipeta para evitar la salida de liquido, pero cuando se trabaja con líquidos corrosivos o venenosos esto puede desembocar en quemaduras o envenenamiento. Al medir un líquido con el uso de pipetas se debe tener la precaución de que la punta inferior quede muy por debajo de la superficie del líquido, ya que de lo contrario absorberá aire, el cual impulsara el líquido hasta hacer contacto con la boca o con la perilla. Fundamento: La medición de volúmenes es de importancia esencial en los laboratorios. Antes que nada, el usuario tiene que aclarar con qué exactitud han de efectuarse las mediciones individuales. Después, partiendo de esta base, puede elegir el tipo de aparato a utilizar en el caso concreto de medición. Mediciones exactas exigen aparatos de medición exactos y un manejo correcto. El material volumétrico está exactamente ajustado y sirve para la medición exacta de volúmenes definidos. (Vasos, matraces Erlenmeyer, embudos de goteo etc. no forman parte del material volumétrico. Estos aparatos no están exactamente ajustados, la escala sirve sólo para orientación rápida. Un prerrequisito para la medición exacta de volúmenes es el ajuste exacto del menisco. Objetivo de aprendizaje: Comprender la importancia de una medición exacta, y ser capaz de realizar diferentes mediciones en una variedad de materiales con precisión y exactitud. Material.· Vaso de Precipitado de 250 ml · Matráz Erlenmeyer de 250 ml. · Probeta de 50 o 100 ml · Bureta de 50 ml · Pipeta Graduada 5 y 10 ml · Pipetas Aforadas 1, 10 y 25 ml · Matráz aforado de 50 y 250 ml · Pizeta · Embudo de filtración de talle corto · Soporte universal · Pinza para bureta. Metodología.1. Los materiales deben estar completamente limpios, por lo que deben lavarse perfectamente para no alterar los resultados. 2. Medimos en los diferentes materiales, volúmenes determinados con la ayuda de pipetas y embudo. a. En un vaso de precipitados colocamos 50 ml de agua destilada y la vaciamos a un matraz aforado. Observamos y anotamos si el volumen obtenido es exacto. b. Enseguida medimos el volumen, con una bureta de 50 ml, y anotamos si hubo diferencia. c. Medimos 100 ml de agua con una probeta graduada y la trasvasamos a un Erlenmeyer, observamos y anotamos los resultados. d. Con la ayuda de una pipeta graduada de 10 ml, medimos 50 ml de agua en una probeta y observamos el volumen final. e. Colocamos 100 ml de agua en un Erlenmeyer, para después vaciarlo en una bureta de la misma capacidad. f. Repetimos la misma operación que en d y e, solo que ahora midiendo con una pipeta volumétrica de 10 y luego con una de 25 ml. 1. Presenta tus observaciones y resultados. 2. Elabora un esquema, de manera que los materiales se encuentren ordenados de mayor a menor precisión. 3. Presenta conclusiones de su práctica. Practica No. 3. Preparación de Soluciones Molares. Introducción: La composición de una solución se debe medir en términos de volumen y masa, por lo tanto es indispensable conocer la cantidad de soluto disuelto por unidad de volumen o masa de disolvente, es decir su concentración. Durante cualquier trabajo experimental, el uso de soluciones se hace indispensable, por lo que es necesario conocer los procedimientos para su elaboración. En la presente práctica se realizarán soluciones utilizando como concentración la molaridad. Fundamento: Una solución molar es una mezcla homogénea de dos o más sustancias. La especie que se encuentra en menor cantidad se denomina soluto y la que está en mayor proporción se denomina solvente. Un mol es el número de Avogadro de moléculas. La masa atómica de un elemento es el número de gramos que contienen el No. de Avogadro de átomos. El peso molecular de un compuesto es la suma de las masas atómicas de los átomos que hay en una molécula, es el número de gramos que contienen el no. de Avogadro de moléculas. Molaridad es el número de moles de una sustancia por litro de solución Objetivo de aprendizaje: Realizar los cálculos necesarios para preparar soluciones molares de diferentes compuestos. Ejercicios previos.• ¿Cuál es la molaridad de 2 litros de solución que contienen 180 g de CuSO 4? • Cuántas milimoles están contenidas en 27 ml de una solución 0.1760M? • El agua de mar contiene normalmente 2.7 gramos de sal (NaCl) por 100 ml de agua ¿cuál es la molaridad del océano? Material y Reactivos: Vasos de precipitados Reactivos: Sal, azúcar, cal, Espátula. Yeso, bicarbonato de sodio, alcohol, Agitadores. Acetona. ( Yo llevaré para todos) Matráz aforado de 100 ml Balanza granataria. Probeta. Pipetas graduadas y volumétricas de 10 ml. Metodología: 1. Realizar los cálculos necesarios para preparar una solución 0.1 M, 0.1 m y 0.1 F, en 100 ml de la sustancia que les corresponda por equipo. 2. Pesar la cantidad calculada anteriormente, y disolverla en poco agua. 3. Vaciarla al matráz aforado, con cuidado para no obtener pérdidas. 4. Completar con agua hasta el aforo, homogenizar. 5. Vaciar a un frasco y etiquetar Presenta tus observaciones y resultados. Presenta conclusiones de su práctica.