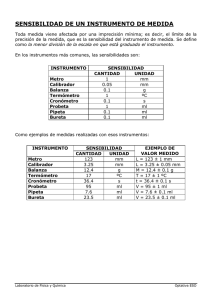
Manual de Laboratorio de Química General 2013 EXPERIMENTO 1 MANEJO DEL EQUIPO BÁSICO DE LABORATORIO Y MEDICIONES. I. OBJETIVOS Los objetivos de este experimento, es que usted: 1. Manipule correctamente el equipo básico de laboratorio. 2. Practique las técnicas de separación por centrifugación, decantación y filtración. 3. Calcule y exprese con el número correcto de cifras significativas, la densidad de un sólido y de un líquido a partir de resultados experimentales. 4. Establezca la diferencia entre los conceptos exactitud y precisión. II. MATERIALES Y REACTIVOS Tubo de ensayo, centrífuga, papel filtro, embudo, cápsula de porcelana, vidrio reloj, agitador de vidrio, trípode o soporte con arco, vaso químico de 250 mL, probeta de 25 y 10 mL, balanza granataria, pipeta 10 mL y bureta 50 mL. NaCl 0.5 mol/L, AgNO3 0.1 mol/L, HCl 6 mol/L, mezcla ABC, agua destilada, H2O y alcohol etílico. III. MARCO TEÓRICO La observación es parte fundamental del quehacer científico y para un buen desempeño del trabajo experimental es necesario desarrollar la capacidad de observación del individuo. La observación puede ser cualitativa o cuantitativa. Es cualitativa cuando se da una descripción de sus características, sus propiedades o el cambio de ellas; por ejemplo, describir el color, olor, sabor, estado, un cambio de color, un cambio de estado (de gas a líquido, etc.). Este tipo de observación no se hace referencia a ninguna medición. Por otro lado, en la observación cuantitativa, se describe un objeto o fenómeno tomando como bases mediciones obtenidas a través de instrumentos y técnicas especificas, por ejemplo: la temperatura de ebullición del agua es de 100ºC a 1 atm de presión. El nivel de complejidad de los instrumentos y las técnicas varían de acuerdo con la naturaleza del estudio. Preparado por: Doris De León y Omar Chacón Página 1 Manual de Laboratorio de Química General 2013 La observación cuantitativa y la interpretación de los resultados de la medición son la base del trabajo científico. El investigador debe controlar una gran cantidad de variables en su trabajo: temperatura, volumen, masa, concentración de las sustancias, etc., que intervienen en el estudio, de modo que el trabajo debe realizarse no sólo con un especial cuidado, sino que también debe seguirse un método específico y con un equipo que garantice seguridad en los resultados. Todas las mediciones poseen un grado de error producto del equipo utilizado, del método empleado y de la destreza de la persona que realiza la medición. Este error se conoce con el nombre de INCERTIDUMBRE. El cuidado al trabajar, el dominio de las técnicas apropiadas y el uso correcto de los instrumentos son fundamentales para lograr resultados con porcentajes de error bajos. El porcentaje de error de una medición se obtiene por comparación entre el valor experimental obtenido y el valor dado como verdadero para una característica o propiedad en particular. A continuación se presenta la ecuación para el cálculo del porcentaje de error: Al hablar de errores en la medición, no puede dejarse de lado los conceptos de exactitud y precisión, vinculados con ellos. La exactitud indica en grado de proximidad entre el valor medido o experimental y el valor verdadero o teórico. La precisión se refiere a la concordancia entre los resultados de mediciones individuales, resultados que han sido obtenidos por procedimientos iguales. Idealmente todas las mediciones deben ser exactas y precisas pero en la realidad podemos tener mediciones muy precisas pero muy inexactas. Para mejorar la precisión y la exactitud es necesario repetir las mediciones. Se aconseja hacerlas por duplicado o triplicado. Los resultados de las mediciones se deben reportar en forma numérica, considerando el número de cifras significativas apropiado para cada uno de ellos. Se entiende por cifras significativas todos aquellos dígitos ciertos más el primer dígito incierto de un número. La definición de estas cifras está determinada por la incertidumbre del instrumento utilizado para la medición. En la mayoría de los casos, los instrumentos traen indicado este valor, si no, se considera como la mitad de la división más pequeña. Por ejemplo, la incertidumbre de la balanza Preparado por: Doris De León y Omar Chacón Página 2 Manual de Laboratorio de Química General 2013 granataria, que usted usará es de ± 0,01; por lo tanto un valor como 2,080; posee como cifras ciertas el 2, el 0 y como cifra incierta el 8, el 0 sobra; por lo que el valor debe ser reportado como 2,08 ± 0,01. DENSIDAD Las sustancias puras (elementos y compuestos) poseen una serie de propiedades que las caracteriza y permiten su identificación. Una de estas propiedades es conocida con el nombre de DENSIDAD. Se define densidad como el volumen que ocupa una determinada masa, a temperatura y presión definida. Generalmente este valor se reporta en condiciones normales, es decir a 20ºC y 1 atm de precisión. La fórmula para calcular densidad es Se expresa en g/mL, g/cm3, para líquidos y sólidos y g/L para los gases. La determinación experimental de la densidad, implica realizar dos tipos de mediciones diferentes para una sustancia, su masa y su volumen. La masa se mide con la balanza y el volumen puede medirse con una probeta, una pipeta o una bureta. En el caso de sólidos, el volumen puede medirse por desplazamiento de agua, y en los sólidos regulares (por ejemplo cubos) se puede utilizar la fórmula matemática definida para tal efecto. TÉCNICAS DE SEPARACIÓN: DECANTACIÓN, FILTRACIÓN, CENTRIFUGACIÓN En la naturaleza, la mayoría de las sustancias se encuentran formando mezclas. En algunas ocasiones es necesario trabajar con uno o más de sus componentes por lo que se requiere realizar una separación de ellos. Para esta separación, se puede utilizar las propiedades físicas de las sustancias, por ejemplo: la solubilidad, el punto de ebullición, etc. Y se han desarrollado algunas técnicas que facilitan este proceso de separación. Entre las técnicas de separación que comúnmente se utilizan en el laboratorio se pueden citar las siguientes: decantación, filtración, centrifugación, cristalización fraccionada, destilación (simple y fraccionada), cromatografía y la evaporación; de ellas la decantación, la filtración, la centrifugación y la evaporación serán las empleadas en esta primera experiencia de laboratorio. Preparado por: Doris De León y Omar Chacón Página 3 Manual de Laboratorio de Química General Se presenta un cuadro 2013 en el cual usted puede encontrar valores de densidad para diferentes sustancias en diferentes estados. CUADRO COMPARATVO DE DENSIDADES DE SÓLIDOS, LÍQUIDOS Y GASES SÓLIDOS g/cm3 LÍQUIDOS g/cm3 GASES g/L Aluminio 2,70 Mercurio 13,59 Cloro 3,214 Hierro 7,86 Agua 1,00 Flúor 1,81 Plomo 11,34 Diclorometano 1,325 Hidrógeno 0,089 Zinc 7,13 Glicerina Dióxido 1,261 de 1,9 Carbono Cobre 8,92 Alcohol etílico 0,789 Helio 0,178 *Fuente: Whitten, G. 1995. Química General. México. Mc Graw Hill. IV. FASE EXPERIMENTAL A. DETERMINACIÓN DE LA DENSIDAD DE UN LÍQUIDO 1. En una probeta mida de 10 a 15 mL de alcohol etílico. Anote ese dato e incluya la incertidumbre en la medición. 2. Pese un vaso químico de 250 mL, limpio y seco y anote el valor obtenido con el número correcto de cifras significativas y la correspondiente incertidumbre. 3. Trasvase con mucho cuidado el líquido de la probeta al vaso químico recién pesado. Garantice que la mayor cantidad de líquido ha sido trasvasada. 4. Pese el vaso químico y su contenido. Anote el dato obtenido con el número apropiado de cifras significativas y con su respectiva incertidumbre. 5. Calcule el peso del líquido por diferencia de los valores obtenidos en los puntos 2 y 4. 6. Determine la densidad del líquido y repórtela con el número correcto de cifras significativas. 7. Compare el resultado con el valor verdadero y determine el % de error. 8. Repita el procedimiento anterior dos veces más y anote los resultados. B. MEDICIÓN DE VOLÚMENES. Nota: Verifique el procedimiento para usar adecuadamente la pipeta y la bureta previa a su ingreso en el laboratorio. Preparado por: Doris De León y Omar Chacón Página 4 Manual de Laboratorio de Química General 2013 B. 1. Uso de la bureta. 1. Lave con agua jabonosa una bureta de 50 mL y realice luego dos enjuagues con agua destilada. 2. Afore la bureta con agua destilada. (Lo que implica que la bureta deberá contener 50 mL de agua destilada). 3. Vierta de 30 a 40 mL del líquido en una probeta de 50 mL, limpia y seca. Anote el volumen de agua que vertió y que puede leer en la bureta. Además anote el volumen de agua que se marca en la probeta. Compare ambas medidas ¿Existe diferencia entre ambas medidas? En caso afirmativo, ¿explique por qué? B. 2. Uso de la pipeta. 1. Lave con agua jabonosa una pipeta de 10 mL y realice dos enjuagues con agua destilada. 2. Llene hasta la mitad un vaso químico de 250 mL con agua destilada, e introduzca en él la pipeta. 3. Mida un volumen de 10 mL y viértalo en una probeta de 25 mL. ¿Existe diferencia entre ambas medidas? En caso afirmativo ¿Explique por qué? 4. De acuerdo con los resultados obtenidos, ¿cuál de los instrumentos (probeta, bureta y pipeta) usados para medir volúmenes, diría usted que es el más exacto? Explique por qué. C. TÉCNICAS DE SEPARACIÓN C.1. Centrifugación y decantación 1. Coloque en un tubo de ensayo pequeño 2 mL de nitrato de plata. 2. Agregue 1 mL de ácido clorhídrico (HCl) 6 mol/L. Agite. Anote sus observaciones. ¿Qué cree usted que ha ocurrido? 3. Separe por centrifugación el precipitado del líquido supernadante. Elimine posteriormente el líquido supernadante por medio de decantación y deséchelo. 4. Agregue 5 mL de agua destilada al sólido contenido en el tubo de ensayo, caliente en baño maría de 3 a 5 minutos. Cuente el tiempo a partir del momento en el que el agua del vaso químico de 250 mL inicia la ebullición. Observe. ¿Qué cree usted que ha ocurrido? Preparado por: Doris De León y Omar Chacón Página 5 Manual de Laboratorio de Química General 2013 5. Agregue 15 gotas de HNO3 0,5 mol/L. anote sus observaciones. ¿Qué cree usted que ha ocurrido? 6. Centrifugue y observe. C. 2. Decantación, filtración y evaporación. 1. Mida un volumen entre 15 y 20 mL de la mezcla ABC. 2. Prepare el sistema de filtración, según las instrucciones dadas por su profesor de laboratorio. 3. Separe por decantación y filtración los componentes de esta mezcla recibiendo el filtrado en un vaso químico de 250 mL. 4. Lave el sólido son dos pequeñas porciones de agua destilada. ¿Qué importancia tiene este proceso? 5. Mida de 5 a 8 mL del filtrado y trasváselo a una cápsula de porcelana. 6. Evapore lentamente el filtrado hasta sequedad, antes de iniciar el calentamiento debe tapar con un vidrio de reloj la cápsula para evitar salpicaduras. ¿Qué observa? ¿Podría calcularse la cantidad de sólido que se obtiene en la cápsula? Explique. V. CUESTIONARIO 1. Describa los usos de la cristalería del laboratorio de química. 2. ¿Se garantiza con la probeta de 25 mL un menor margen de error al hacer mediciones de volúmenes superiores a 50 mL? Explique. 3. Si fuese necesario medir un volumen de alcohol etílico de 10 mL ¿qué recomendaría usar, una probeta de 10 mL o una de 25 mL? Justifique su respuesta. 4. Explique en qué consiste la técnica de separación denominadas: destilación y Preparado por: Doris De León y Omar Chacón cromatografía. Página 6 Manual de Laboratorio de Química General 2013 EXPERIMENTO 2 MEDICIÓN: PRECISIÓN Y EXACTITUD I. OBJETIVOS 1. Diferenciar los conceptos de exactitud y precisión. 2. Expresar correctamente una medición. 3. Calcular la incertidumbre de una medición. II. MATERIALES Y REACTIVOS 4 centavos de antes de 1981, 4 centavos después de 1983, regla de 30 cm y clips grandes (para agarrar papeles) III. MARCO TEÓRICO La ciencia depende grandemente de la información cuantitativa (mediciones). El resultado de estas mediciones nos lleva a realizar conclusiones, por ello la calidad de estas mediciones es fundamental. Exactitud: Es el grado de concordancia entre el valor medido y el valor verdadero. Precisión: Es el grado de reproducibilidad de una medida. La precisión se da en términos de incertidumbre. Esta depende del observador no así la exactitud que depende del instrumento. Las limitaciones en la precisión y la exactitud contribuirán a la incertidumbre en la medida. Los errores pueden ser de dos tipos: sistemáticos y aleatorios. La dispersión de los resultados o sea el grado de precisión se expresa por la desviación estándar (s): X S 1 X 2 n 1 Entonces la desviación promedio será S1 = Preparado por: Doris De León y Omar Chacón X 1 X n 2 , si n 3 Página 7 Manual de Laboratorio de Química General 2013 Como calcular la desviación estándar (S) si se dan los siguientes valores: n Desviación X 1 X Valor medido Cuadrado X 1 X 1 4,28 -0,01 0,0010 2 4,21 -0,08 0,0064 3 4,30 0,01 0,0001 4 4,36 0,07 0,0049 5 4,26 -0,03 0,0009 6 4,33 0,04 0,0016 = 25,74 = 0,00 X X1/ n = (25,74) / (6) = 4,29 S= de la desviación 2 = 0,0149 0,0149 /6 1 = 0,053 Entonces la mejor expresión del valor medio es: (4,29 0,05) g. PRECISIÓN EN LAS MEDICIONES DE LABORATORIO La precisión asociada con varios instrumentos que se usan en el laboratorio, está dada en el siguiente cuadro: INSTRUMENTO INCERTIDUMBRE Balanza electrónica ± 0,001 g Balanza granataria ± 0,01 g Balanza analítica ± 0,0001 g Probeta de 100 mL ± 0,2 mL Probeta de 10 mL ± 0,1 mL Bureta de 50 mL ± 0,02 mL Pipeta de 25 mL ± 0,02 mL Pipeta de 10 mL ± 0,01 mL Termómetro de (10 ºC – 110 ºC) ± 0,2 ºC Regla de mm ± 0,05mm Preparado por: Doris De León y Omar Chacón Página 8 Manual de Laboratorio de Química General 2013 IV. FASE EXPERIMENTAL A. DETERMINACIÓN DE LA MASA PROMEDIO Y DESVIACIÓN ESTANDAR. 1. Pesar individualmente los cuatro centavos antes de 1981. Anotar fecha al lado de la masa. 2. Calcule: x para la masa de todos los centavos. 3. Repetir las mediciones para los centavos después de 1983. ¿Habrá diferencias significativas entre la masa promedio de ambos grupos de centavos? 4. Pesar todos juntos los centavos antes de 1981. Anotar peso. 5. Pesar todos juntos los 4 centavos que son después de 1983. Anotar. Después de calculada la masa promedio, calcule la desviación promedio, el cuadrado de la desviación y la desviación estándar y según los resultados qué grupo de centavos están mejor fabricados. B. DETERMINACIÓN DE LA PRECISIÓN. 1. Medir con una probeta exactamente 5,0 mL de H2O. 2. Usando una pipeta extraer 1 mL de agua y contar cuantas gotas hay en el. Anotar. 3. Extraer otro mL y contar nuevamente el número de gotas. 4. Repetir una vez más. Anotar. 5. Sacar un promedio del número de gotas. 6. Determinar precisión a través del cálculo de desviación. Ejemplo: Cantidad de mediciones (n) Resultados 1 19 gotas 2 20 gotas 3 19 gotas = 20 -19/3 Preparado por: Doris De León y Omar Chacón Página 9 Manual de Laboratorio de Química General 2013 C. CALCULAR EL % DE ERROR EN LA DETERMINACIÓN DE LA DENSIDAD DE LOS LÍQUIDOS. 1. Pesa un vaso químico limpio y seco. 2. Mida con una probeta cierta cantidad de agua. 3. Transfiere el líquido al vaso químico y péselo nuevamente. 4. Determina la densidad del agua. 5. Repite el mismo procedimiento pero ahora agrégale el agua una pequeña cantidad de NaCl. ¿Cambia la densidad del agua? 6. Compara la densidad teórica del agua sola y la del agua salada con tus resultados obtenidos. D. CALCULANDO FACTOR DE CONVERSIÓN Y EL % DE ERROR. 1. Medir el tamaño de un clip en centímetros (cada miembro del grupo de trabajo deberá hacer una medición). Anotar las medidas obtenidas. 2. Repetir la medición pero ahora en pulgadas. 3. Calcular los valores promedio para ambas mediciones. 4. Calcular el factor de conversión. Ejemplo: clip = 4.52 cm y 3.31 pulgada. Entonces 1.0 pulgada = 4.52/1.31 pulg = 3.45 cm. El valor verdadero es 1.0 pulgada = 2.54 cm. 5. Si después de hacer los cálculos el factor de conversión no es igual o muy cercano al valor verdadero, entonces determine el % de error. 6. Si el % de error es mayor de 5% hay que repetir las mediciones. V. CUESTIONARIO. 1. Cuál es la diferencia entre masa y peso? 2. Cuál es la diferencia entre densidad y peso específico?. 3. Mencione posibles causas de error que hayan afectado cada parte del laboratorio. Preparado por: Doris De León y Omar Chacón Página 10