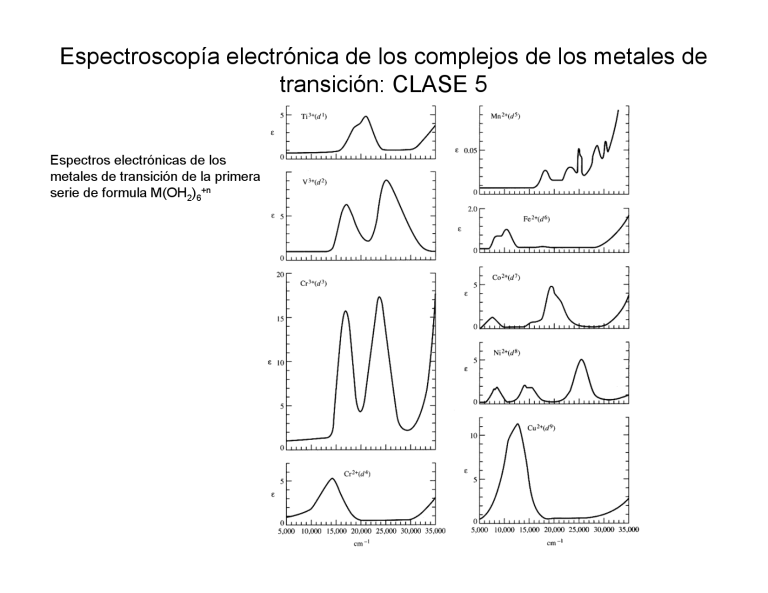
Espectroscopía electrónica de los complejos de los metales de transición: CLASE 5 Espectros electrónicas de los metales de transición de la primera serie de formula M(OH2)6+n entre orbitales de los ligandos → TOM transiciones d-d complejos centro-simétricos, e.g. Oh (complejos no centro-simétricos Td ε ~ 250) Estados involucrados en transiciones d-d de campo débil de complejos octaédricos Esquema de desdoblamiento de los términos de mayor multiplicidad de spin para complejos Oh y Td E T1g Eg T2g T1g T1g A2g T2g D P dn igual d5+n inverso d10-n F T2g T2g 1 6 d , d Oct d4, d9 Tet Eg 4 9 d , d Oct d1, d6 Tet 1 transición permitida por spin T1g Desdoblamientos: A2g d3, d8 Oct d2, d7 Oct d2, d7 Tet d3, d8 Tet 3 transiciones permitidas por spin Oh inverso Td d1, d9 (2D) d2, d8 (3F, 3P) d3, d7 (4F, 4P) d4, d6 (5D) [Ti(OH2)6]3+ A 10 000 20 000 30 000 ν- / cm-1 d1 ≡ d6 d4 ≡ d9 Diagrama de Orgel para d1, d4, d6, d9 Energía Eg o E T2g o T2 D T2g o T2 Eg o E Δ d1, d6 tetraédrico d4, d9 octaédrico 0 d1, d6 octaédrico d4, d9 tetraédrico fuerza del campo ligando Δ A ν3 [Co(H2O)6]2+ ν2 ν1 v / cm-1 25 000 20 000 15 000 10 000 A 10 14 000 [Ni(H2O)6]2+, d8 25 000 50 000 ν- / cm-1 Diagrama de Orgel para iones d2, d3, d7, d8 Interacción de configuraciones Energía A2 o A2g T1 o T1g T1 o T1g P T1 o T1g T2 o T2g F T2 o T2g T1 o T1g A2 o A2g d2, d7 tetraédrico 0 d2, d7 octaédrico d3, d8 tetraédrico d3, d8 octaédrico Fuerza del campo ligando (Δ) d5 complejo octaédrico ε [Mn(H2O)6]2+ 4E (G) g 6A 1g 4A (G) 1g 0.03 4T (D) 2g 0.02 4E (D) g 4T (G) 1g 4T (G) 2g 0.01 v / cm-1 20 000 25 000 30 000 Las transiciones son doblemente prohibidas bandas de absorción múltiples intensidad muy débil Diagrama de Orgel d5 oct y tet 4T 2(g) 50 000 4T 1(g) 4F 4A 2(g) 40 000 Energía (cm-1) 4T 1(g) 4D 4P 4E (g) 4T 2(g) 4G 4E , 4A (g) 1(g) 30 000 20 000 4T 2(g) 10 000 4T 1(g) 6S 6A 1(g) 500 1000 Fuerza del campo ligando, Δ (cm-1) Diagrama de correlación: No es fácil describir cuantos niveles ni cual será su multiplicidad de spin y degeneración en el caso del campo intenso ν2 = 25 200 cm-1 diagrama de Tanabe-Sugano para iones d2 (B = 860 cm-1) 10 ν1 = 17 100 cm-1 ε [V(H2O)6]3+: tres transiciones permitidas por spin 5 30 000 20 000 10 000 − ν / cm-1 ν3 = se solapa con transición de TC en UV ν1 = 25 200 53.8 ν2 Δ/B 38.6 E/B = = 1.48 17 100 = 27.5 25.8 B’ = 17100cm-1/ 25.8 = 663 cm-1 25.8 Δ= 27.5 x B’ = 18 600 cm-1 ν1 ν2 ν3 ν3 = 53.8 x B’ = 35 670 cm-1 β = B’/B = 663/860 = 0.77 serie nefeleuxética 27.5 Indica el grado de covalencia del enlace metal-ligando: F− < H2O < NH3 < en < C2O4−2 < NCS− < Cl− < CN− < Br− < I− Aumenta el grado de covalencia, disminuye β Intensidad de las bandas: Reglas de selección Regla de selección de Laporte g ÅÆ u Regla de selección de spin Debe haber un cambio de paridad durante una transición electrónica (se aplica a sistemas que tienen centro de inversión) Δl=±1 El momento angular de los fotones es 1 o -1 por lo que solo lo pueden cambiar por este valor (s→p, p→d, d→f permitidas, d→d prohibidas). ΔS = 0 Los fotones no tienen spin entonces no pueden cambiar el spin de los estados involucrados en la transición electrónica. Las reglas de selección determinan la intensidad de las transiciones electrónicas Transición ε complejos Spin prohibida Laporte prohibida 10-3 – 1 muchos complejos d5 Oh [Mn(OH2)6]2+ Spin permitida Laporte prohibida 1 – 10 muchos complejos Oh, e.g. [Ni(OH2)6]2+ 10 – 100 Algunos complejos cuadrados plano, e.g. [PdCl4]2- 100 – 1000 complejos de baja simetría con coordinación 6, muchos complejos cuadrados plano particularmente con ligandos orgánicos 102 – 103 Algunas bandas de transferencia de carga metalligando en complejos con ligandos insaturados 103 – 106 muchas bandas de transferencia de carga, transiciones en especies orgánicas Spin permitida Laporte permitida Relajación de la regla de seleccción de Laporte en complejos Octaédricos Durante las vibraciones antisimétricas con respecto al centro de inversión el complejo adopta configuraciones en las cuales no existe un centro de simetría, entonces las transiciones d-d pasan a ser parcialmente permitidas debido a lo que se llama una transición vibrónica. La transición electrónica se debe a interacción de la moléculas con el vector dipolo-eléctrico y ocurre cuando la molécula está vibrando y está momentáneamente en una configuración en la que no existe el centro de inversión. Las transiciones electrónicas ocurren debido a las vibraciones antisimétricas (transiciones vibrónicas) Relajación de la regla de selección de Laporte para complejos tetraédricos Complejo Octaédrico centro de inversión aplica la regla de Laporte Complejo tetraédrico no posee centro de inversión relaja la regla de Laporte inversion centre Interacción de Orbitales: Oh complejo d Æ eg and t2g p Æ t1u Td complejo d Æ e and t2 p Æ t2 En complejos tetraédricos los orbitales d tienen algún carácter p (transición d Ædp) Relajación de la regla de seleccción de Spin La regla de selección de spin conserva su importancia en tanto S conserve su significado y la función de onda total pueda separarse en dos partes: orbital y de spin; pero si el acoplamiento del momento angular orbital y angular de spin es importante, la regla de selección de spin tiene cada vez menos importancia. La regla de selección de spin se relaja cuando el acoplamiento spin-orbita es significativo (metales pesados) Relajación de las reglas de selección Complejos Tetraédricos: no poseen centro de inversión relaja la regla de Laporte la regla Δl=+/-1 se relaja por mezcla de orbitales Complejos Octaédricos: poseen centro de inversión la regla de Laporte se relaja por acoplamiento vibrónico d5 complexes: acoplamiento vibrónico y acoplamiento Spin-orbita Iones d0 y d10 Iones d0 y d10 no tienen transiciones d-d TiBr4 d0 ion naranja TiI4 d0 ion marrón oscuro [MnO4]- Mn(VII) d0 ion violeta fuerte [Cr2O7]- Cr(VI) d0 ion Las transiciones de transferencia de carga están permitidas por las dos reglas de selección y por lo tanto son más intensas que las transiciones d-d. naranja brillante [Cu(MeCN)4]+ Cu(I) d10 ion incoloro [Cu(phen)2]+ Cu(I) d10 ion naranja oscuro Transiciones de transferencia de carga Transiciones de Transferencia de Carga Además de las transiciones entre estados que son esencialmente estados basados en los orbitales d del metal (transiciones d-d) también se observan transiciones que involucran orbitales del ligando y del metal. Estas transiciones son llamadas transiciones de transferencia de carga porque involucran la transferencia entre orbitales del metal al ligando o viceversa. Transferencias de carga del ligando al metal (TCLM) son responsables por los colores de especies d0. La energía de estas bandas depende de la diferencia de energía entre los orbitales del metal (aceptor) y del ligando (donor), esto es una función de las electronegatividades del metal y ligando. Complejos que tienen ligandos con orbitales p* de baja energía tienen transiciones de transferencia de carga metal ligando (TCML). Estas son muy comunes en complejos que involucran bipy y phen. [CrCl(NH3)5]+2 Transiciones de transferencia de carga Transferencia de carga del metal al ligando Tranferencia de carga del ligando al metal transiciones TCML TCLM transitions metal rico en e- , baja carga, Cu(I), d10 ión ligando π-aceptor con orbitales π* de baja energía ligando rico en e-: O2-, Cl-, Br-, Imetal con pocos e- y alta carga Cr(III), d3 ión, Mn(VII), d0 ión eg* transiciones d-d Lπ∗ t2g* Md Lπ Lσ Teorema de Jahn-Teller: "for a non-linear molecule in an electronically degenerate state, distortion must occur to lower the symmetry, remove the degeneracy, and lower the energy"(Jahn andTeller, Proc. Roy. Soc., 1937, A161, 220) Estado electrónico fundamental degenerado: T o E Estado fundamental no degenerado: A o B JT estático: distorsión tetragonal permanente, alargamiento o acortamiento de las distancias a los ligandos en el eje z. JT dinámico: la energía de interconversión entre una forma y la otra (la forma tetragonal larga y la corta) es muy baja y ambas formas se interconvierten rápidamente. • repulsión interelectrónica existencia de los estados electrónicos • Acoplamiento de Russel-Saunders Los microestados se juntan en los Términos Reglas de Hund • efecto del campo ligando en los términos de los iones libres Diagrama de Orgel para iones d1, d4, d6, d9 [Ti(OH2)6]3+ Diagrama de Orgel para iones d2, d3, d7, d8 [Ni(OH2)6]2+ Diagrama de Orgel para iones d5 [Mn(OH2)6]2+ •Diagramas de Tanabe-Sugano Complejos Oh de campo fuerte y débil para iones d2, d3, d4, d5, d6, d7, d8 • Reglas de Selección Reglas de selección para complejos Oh y Td Relajación de las reglas de selección •Transiciones de transferencia de carga TOM: metal-ligando, ligando-metal •Distorción de simetría Teorema de Jahn-Teller








