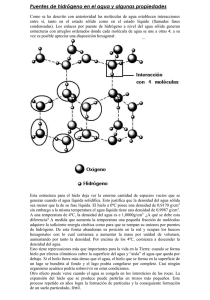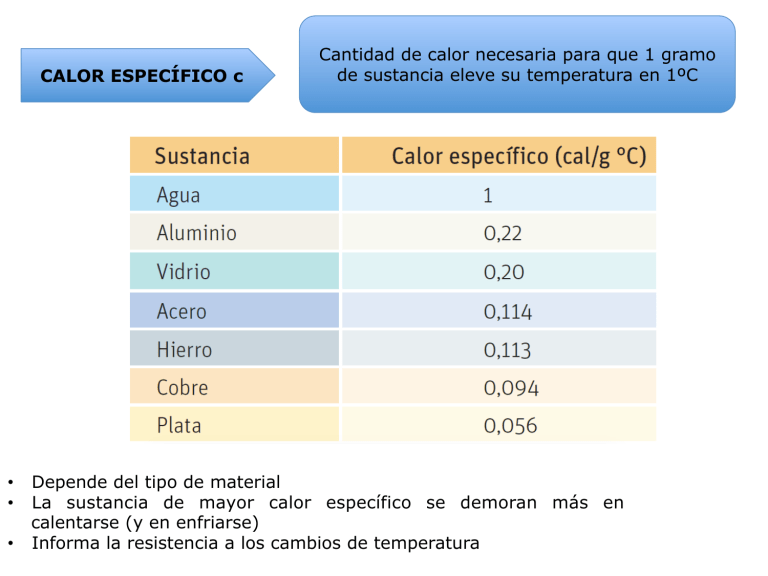
CALOR ESPECÍFICO c • • • Cantidad de calor necesaria para que 1 gramo de sustancia eleve su temperatura en 1ºC Depende del tipo de material La sustancia de mayor calor específico se demoran más en calentarse (y en enfriarse) Informa la resistencia a los cambios de temperatura PREGUNTAS 1) Dos cuerpos idénticos, A de aluminio y B de cobre, reciben la misma cantidad de calor. ¿Qué cuerpo experimenta el mayor cambio de temperatura? A B 2) Es probable que en un día soleado en la playa hayas notado que la temperatura de la arena es mucho mayor que la temperatura del agua. ¿Por qué ocurre esto, si la arena y el agua del mar han recibido la misma cantidad de energía del Sol durante el día? 3) ¿Por qué en las ciudades costeras los cambios de temperatura entre el día y la noche NO son tan “bruscos”? CAMBIOS DE ESTADO ABSORBE ENERGÍA EBULLICIÓN FUSIÓN VAPORIZACIÓN SOLIDIFICACIÓN CONDENSACIÓN CEDE ENERGÍA EVAPORACIÓN VAPORIZACIÓN EVAPORACIÓN • • Pa r t i c i p a n l a s p a r t í c u l a s d e l a • superficie del líquido adquieren energía cinética suficiente para cambiar a estado gaseoso • Ocurre a cualquier temperatura EBULLICIÓN Participan todas las partículas del líquido Ocurre a una temperatura específica, por ejemplo la Tº de ebullición del agua es 100ºC LEYES GENERALES DE LOS CAMBIOS DE ESTADO Líquido Sólido Hielo a -10ºC Hielo a 0ºC Agua a 0ºC Tº de fusión Para que una sustancia cambia de estado debe alcanzar una temperatura específica Cuando la sustancia cambia de estado, mantiene su temperatura constante El calor necesario para que se produzca el cambio de estado, se denomina calor latente Gaseoso Agua a 100ºC Vapor a 100ºC Tº de ebullición Punto de fusión del agua: 0ºC Punto de ebullición del agua: 100ºC Temperatura Sustancia Fusión (ºC) Ebullición (ºC) Agua 0 100 Cobre 1083 2567 Oro 1063 2660 Mercurio -39 357 Aluminio 660 2467 Plomo 327 1750 Tungsteno 3410 5660 Oxigeno -218 -183 Helio -272 -260 Temperatura de Ebullición Temperatura de Fusión Sólido Líquido Vapor T [ºC] Vaporización Vapor 100º Agua Hielo Fusión 0º [1] -10º 80 cal [2] 100 cal [3] 540 cal [4] Q [cal] Respondan las siguientes preguntas: a. ¿Cuáles son las magnitudes trabajadas en el gráfico? b. ¿En qué sector del gráfico se representan los momentos en que la temperatura? del agua sube al absorber calor? Márquenlos. c. ¿Cuánta energía absorbe el hielo para fundirse?, ¿cambia de temperatura en ese proceso? d. ¿Qué creen que representan las líneas horizontales en el gráfico?