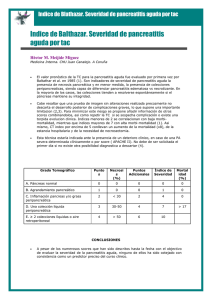
ACTUALIZACIÓN Pancreatitis aguda F. Alberca de las Parras*, E. Sánchez Velasco y F. Carballo Álvarez Unidad de Gestión Clínica de Digestivo. IMIB Arrixaca. Hospital Clínico Universitario Virgen de la Arrixaca. Murcia. España. Palabras Clave: Resumen - Dolor - Hiperamilasemia Concepto. Es la inflamación en la glándula pancreática que cursa con epigastralgia y elevación de enzimas pancreáticas (amilasa y lipasa). - Colelitiasis Epidemiología. La incidencia en España es de 15.000 casos/año. - Alcohol Etiopatogenia. La colelitiasis y el alcohol son las causas más frecuentes. - Pseudoquistes Manifestaciones clínicas. La epigastralgia es el síntoma predominante. Un 80-90% de los casos presentan náuseas y vómitos y puede asociarse a ictericia y a fallo multiorgánico. - Necrosis Diagnóstico. La clínica y la elevación de enzimas pancreáticas llevan al diagnóstico. Las técnicas de imagen (ecografía y TAC abdominal) pueden ayudar. La TAC permite evaluar la gravedad y las complicaciones. Tratamiento. Son clave el ayuno, la estabilidad hemodinámica y eliminar el agente etiológico. Las técnicas endoscópicas están adquiriendo protagonismo en el tratamiento de las complicaciones. Pronóstico. Los reactantes de inflamación (proteína C reactiva) pueden ser útiles para la predicción de la gravedad. Existen escalas pronósticas que ayudan en la toma de decisiones. Keywords: Abstract - Pain Acute pancreatitis - Hyperamylasemia - Cholelithiasis - Alcohol - Pseudocysts - Necrosis Concept. Pancreatitis is the inflammation of pancreatic gland in which the patient presents epigastric pain an elevation of pancreatic enzymes (amylase and lipase). Epidemiology. The incidence in Spain is 15.000 cases per year. Clinical symptoms. The most frecuent sympstom is epigastric pain. 80-90% of patients present nausea and vomits, and ictericia or multiorganic failure can be present. Diagnosis. It is achieved by clinical manifestations and elevation of pancreatic enzymes. Ultrasonography and abdominal Computarized Tomography are usefull, and the last one enables the evaluation of severity and complications. Treatment. Absolut diet, hemodynamic stability and delete the etiological agent are imperative. Endoscopic procedures are improving its role in the management of complications. Prognosis. Acute phase reactants (as Reactive C Protein) could support in the prediction of gravity. There are prognostic scales that can help in the management of patients. *Correspondencia Correo electrónico: f_alberca@yahoo.es Medicine. 2016;12(8):407-420 407 ENFERMEDADES DEL APARATO DIGESTIVO (VIII) Concepto La pancreatitis aguda (PA) es una entidad caracterizada por cursar con una inflamación en la glándula pancreática, que clínicamente se caracteriza por dolor abdominal de comienzo agudo acompañado de elevación de enzimas líticas pancreáticas en suero y, de forma consiguiente, en orina. Los episodios de PA pueden ser únicos o recurrentes, pudiendo en este último caso deberse a la misma causa que originó el primer cuadro o a haber desarrollado una pancreatitis crónica. Aunque el mecanismo exacto por el que se desencadena esta patología no está completamente dilucidado, sí se conocen bien sus principales causas etiológicas, entre las que destacan la litiasis biliar y la ingesta crónica y elevada de alcohol como las más frecuentes. Con independencia del agente etiológico, en este cuadro clínico se produce una respuesta inflamatoria tanto a nivel local como sistémico, siendo la intensidad de dicha inflamación la que determinará la gravedad del cuadro clínico. En la mayor parte de los casos cursa sin complicaciones, el páncreas presenta un edema que revierte y se produce una recuperación completa con alivio sintomático rápido. Sin embargo, alrededor de un 20% de los casos son graves, presentando complicaciones que pueden ser locales o sistémicas. La más frecuente e importante es la necrosis pancreática, y se sabe desde hace tiempo que su extensión se correlaciona bien con la mortalidad1. En 1992 se celebró en Atlanta un simposio que se ocupó de la definición de la PA de acuerdo con la existencia o no de complicaciones2. Estas fueron descritas de forma concisa pero inequívoca, tal como puede consultarse en la tabla 1. En dicha clasificación se incluyó el pseudoquiste pancreático como complicación de gravedad, aunque desde hace algunos años se considera que el pseudoquiste, cuyo tamaño suele condicionar su repercusión clínica en la mayoría de pacientes, no es tan definitorio a la hora de marcar un peor pronóstico clínico, comparado con otras complicaciones como la necrosis (pancreática o extrapancreática) o la presencia de gas. Sería por tanto más recomendable que los radiólogos describieran la presencia de necrosis pancreática, necrosis extrapancreática, presencia de gas, etc.3. En el año 2012 se han redefinido estos criterios y se han incluido conceptos importantes desde el punto de vista pronóstico-terapéutico como la Wall-off necrosis4. Epidemiología Entre el 0,15 y el 1,5% de los diagnósticos de los pacientes atendidos en los Servicios de Urgencias de un hospital corresponden, a PA. Un clásico estudio multicéntrico internacional realizado sobre la base de 6.000 episodios de dolor abdominal agudo, estableció que el 2,3% de los mismos son debidos a enfermedad pancreática aguda5. Es importante tener en cuenta que un cierto número de PA, estimado entre el 3,5 y el 19% según las series, cursa sin dolor y, sobre todo, que entre el 13 y el 42% de los casos son diagnosticados solo en la necropsia, sin que se haya constatado previamente el diagnóstico6. El impacto de la PA en España puede establecerse en al menos unos 15.000 casos anuales, asumiendo una incidencia media algo superior a 350 casos al año por cada 100.000 habitantes. Apro-ximadamente, la mitad de las muertes que se producen en el curso de la PA ocurren en las dos primeras semanas y son debidas a fallo multiorgánico. Las restantes suceden más tardíamente a causa de complicaciones asociadas con pancreatitis necrótica. La PA sigue siendo responsable en la ac- TABLA 1 Clasificación de la pancreatitis aguda Propuestas de definición del Simposio Internacional sobre pancreatitis aguda celebrado en Atlanta en 1992 Clasificación de la pancreatitis aguda 2012: revisión de la clasificación de Atlanta Pancreatitis aguda (PA) Proceso inflamatorio agudo del páncreas con variable afectación de otros tejidos regionales o sistemas orgánicos remotos PA grave PA edematosa intersticial PA asociada a fallo multiorgánico y/o complicaciones locales como necrosis, absceso o pseudoquiste Inflamación aguda parenquimatosa y peripancreática sin necrosis PA leve PA necrotizante PA con mínima disfunción orgánica, en la que existe recuperación completa y ausencia de los hallazgos que caracterizan a la pancreatitis grave Inflamación con necrosis parenquimatosa y/o peripancreática necrosis Colecciones líquidas agudas Colecciones líquidas peripancreáticas agudas (APFC) Aparecen tempranamente en la evolución de la PA, se localizan cerca del páncreas y siempre carecen de pared de granulación o tejido fibroso Líquido peripancreático asociado a PA edematosa intersticial sin necrosis peripancreática. Solo aplicable a colecciones peripancreáticas en las primeras 4 semanas tras una PA edematosa y sin características de pseudoquiste Necrosis pancreática Pseudoquiste pancreático Áreas difusas o localizadas de parénquima pancreático no viable, típicamente asociadas a necrosis grasa peripancreática Colección encapsulada con pared bien definida, fuera del páncreas y sin o con mínima necrosis. Se produce más de 4 semanas después de la pancreatitis edematosa intersticial Pseudoquiste agudo Colección necrótica aguda (ANC) Colección de jugo pancreático encapsulada mediante una pared de tejido fibroso o de granulación que aparece como consecuencia de una pancreatitis aguda, un traumatismo pancreático o una pancreatitis crónica Colección con fluido y necrosis asociada a pancreatitis necrotizante; la necrosis puede afectar al parénquima y/o al tejido peripancreático Absceso pancreático Necrosis externa (WON-walled-off necrosis–) Colección de pus circunscrita a la cavidad abdominal, generalmente próxima al páncreas, que contiene poco o nulo tejido necrótico, y que es consecuencia de pancreatitis aguda o traumatismo pancreático Colección madura, encapsulada de necrosis pancreática y/o peripancreática con una pared inflamatoria bien definida. Ocurre más de 4 semanas después de una PA necrotizante 408 Medicine. 2016;12(8):407-420 PANCREATITIS AGUDA tualidad, a pesar de las mejoras diagnósticas y terapéuticas, del 1% de la mortalidad hospitalaria. En España puede calcularse que anualmente mueren por PA más de 750 personas, cifra nada despreciable para un proceso agudo. Respecto a la distribución por sexos, la relación entre varones y mujeres oscila entre 1:0,3 y 1:5,6 en función de las series estudiadas, según predomine el alcoholismo o la litiasis biliar como la etiología más frecuente. En España esta relación se sitúa globalmente al 50% para ambos sexos. En cuanto a la edad de presentación, puede incidir en cualquier época de la vida, oscilando normalmente entre los 30 y 70 años, siendo la media alrededor de los 55 años. Antes de los 50 años la incidencia es mayor en varones, en relación con la etiología alcohólica, mientras que a partir de los 50 años se presenta con mayor frecuencia en mujeres, sobre todo debido a litiasis biliar. La enfermedad es infrecuente en la infancia, y cuando aparece en los dos primeros años de vida es habitualmente debida a anomalías congénitas del sistema biliopancreático. Hoy en día tiende a reconocerse que la causa más frecuente de PA recidivante en los niños es la pancreatitis hereditaria7. Etiopatogenia Existen múltiples factores que pueden ser causantes de PA (tabla 2). Las dos causas más frecuentes son las enfermedades de la vía biliar y el consumo de alcohol, responsables de cerca de un tercio de los casos cada una, con cifras que oscilan según las series. Un 10% se debe a causas raras, y en un porcentaje de entre un 10-30% no se llega a identificar la causa, al menos en la aproximación inicial, por lo que estos casos tienden a ser etiquetados como PA idiopática, aunque se cree que muchas de estas realmente tienen un origen biliar. TABLA 2 Etiología de la pancreatitis aguda Tóxicas y metabólicas Alcohol Hipertrigliceridemia Hipercalcemia Fármacos Veneno de escorpión Mecánicas Litiasis o barro biliar Obstrucción de la papila Obstrucción pancreática Disfunción del esfínter de Oddi Páncreas divisum Traumatismo Malformaciones congénitas Otras Isquemia Infección Hereditaria Post-CPRE Autoinmune Fibrosis quística Pancreatitis biliar La patología de la vía biliar en forma de barro biliar o colelitiasis, con paso de cálculos a través de la ampolla de Vater, es la primera causa de PA en España. Aunque entre el 35 y el 50% de las PA tienen su etiología en la litiasis biliar, solo el 3-7% de los pacientes con cálculos biliares desarrolla pancreatitis8, pero la relación causa-efecto está claramente apoyada, ya que la colecistectomía y la liberación de los cálculos del colédoco previenen la reaparición de pancreatitis. La PA de origen biliar es más frecuente en las mujeres, ya que la prevalencia de litiasis biliar en ellas es superior a la de los varones; sin embargo, el riesgo de desarrollar PA en pacientes con litiasis biliar es mayor en los varones9. Los pacientes ingresados por pancreatitis biliar suelen presentar los cálculos en la vesícula biliar, siendo mucho más rara la coledocolitiasis. De hecho, la frecuencia de litiasis impactada en el conducto colédoco distal, una vez ya diagnosticada la pancreatitis, es solo del 3-5%. Los cálculos de menor tamaño, y la microlitiasis o barro biliar, son la causa más común de obstrucción inicial de la ampolla. El barro biliar o microlitiasis puede describirse como una suspensión viscosa en la bilis de la vesícula biliar, que puede contener pequeños cálculos menores de 5 mm de diámetro10. La microlitiasis cursa de forma asintomática en la mayoría de los pacientes. El análisis microscópico de la bilis en los pacientes con barro biliar a menudo muestra cristales de colesterol monohidratado, gránulos de bilirrubinato cálcico y otras sales de calcio, lo que permite el diagnóstico de microlitiasis mediante sonda duodenal, aun en los casos en que el diagnóstico ecográfico no sea claro11. Aunque la asociación entre barro biliar y PA no está objetivamente demostrada de forma directa, los datos relativos a la disminución de recidivas tras colecistectomía o después del tratamiento con ácidos biliares en pacientes con microlitiasis son altamente sugerentes de esta relación10-13. La asociación de colelitiasis y PA es consistente desde el punto de vista epidemiológico, pero también es evidente que solo la simple presencia de cálculos en la vesícula no es capaz de desencadenar el episodio. La existencia demostrada de cálculos biliares en las heces tras episodios de PA, que no aparecen tras simples cólicos biliares, apoya la convicción de que para que aparezca la pancreatitis es necesario el paso de cálculos a través de la papila duodenal. También se sabe que hay una relación inversamente proporcional entre el tamaño de los cálculos vesiculares y la frecuencia de pancreatitis, lo que añade la sospecha de que los cálculos que pueden desencadenar el episodio son aquellos que por su menor tamaño migran más fácilmente desde la vesícula. Estos cálculos pueden atravesar la papila rápidamente o impactar en ella de forma transitoria o permanente, favoreciendo así el inicio de la PA. Existen otras causas menos frecuentes que provocan PA a través de la obstrucción biliar, como ascaridiasis, cuerpos extraños, tumores duodenales o pancreáticos, divertículos periampulares, estenosis duodenal por retracción fibrosa de una úlcera péptica, fibrosis del esfínter de Oddi, páncreas anular, síndrome de la arteria mesentérica superior, o «pinza aorto-mesentérica», quistes coledocianos, obstrucción de asa aferente desMedicine. 2016;12(8):407-420 409 ENFERMEDADES DEL APARATO DIGESTIVO (VIII) pués de gastrectomía o enfermedad de Crohn. La obstrucción relativa del flujo pancreático a través de un conducto accesorio de Santorini demasiado angosto en el contexto de un páncreas divisum es también una potencial causa de PA. De hecho, en estos casos la intervención sobre la papila menor mediante esfinterotomía, esfinteroplastia, colocación de stent o inyección de toxina botulínica se acompaña de una clara disminución de los episodios recurrentes de PA14. Pancreatitis alcohólica El consumo de bebidas que contienen etanol es la causa de aproximadamente un tercio de los casos de PA. Aunque hace décadas se consideraba que en los pacientes con alcoholismo que desarrollaban clínica de PA subyacía siempre una enfermedad crónica pancreática, se ha descrito en estudios de seguimiento de pacientes con PA inducida por alcohol que una minoría no progresa a pancreatitis crónica, incluso con abuso continuado del tóxico15. La frecuencia de presentación de la pancreatitis alcohólica varía según las áreas geográficas, según el sexo (más frecuente en los varones) y según la edad de los pacientes, siendo los individuos habitualmente más jóvenes respecto de los que sufren PA de origen biliar. Suelen transcurrir al menos 5 años de consumo abusivo de alcohol antes del primer episodio de PA, aunque generalmente la pancreatitis aparece después de 10-20 años de ingesta continuada. El grado de consumo de alcohol es siempre alto, y es excepcional que la pancreatitis se dé en bebedores ocasionales. El alcohol influye sobre la secreción pancreática, favoreciendo la aparición de tapones proteicos que desempeñan un importante papel en la patogénesis de la pancreatitis crónica. Además, es capaz de producir toxicidad directa sobre la célula acinar pancreática, así como de inducir cambios en la motilidad en el duodeno, relajar el esfínter de Oddi y alterar la dinámica de los propios conductos pancreáticos, de tal forma que favorece la dificultad al flujo desde los conductos pancreáticos y el reflujo desde el duodeno y el conducto biliar. Pancreatitis poscolangiopancreatografía retrógrada endoscópica Durante la realización de la colangiopancreatografía retrógrada endoscópica (CPRE), especialmente si se practica esfinterotomía endoscópica, el páncreas se ve sometido a múltiples daños potenciales de tipo mecánico, químico, hidrostático, enzimático, microbiológico, alérgico e incluso térmico, susceptibles de provocar PA, llegando a producirse en el 3-5% de CPRE según algunas series. El riesgo es especialmente alto en mujeres jóvenes con disfunción del esfínter de Oddi. Recientes metaanálisis han demostrado que la profilaxis con indometacina rectal antes de la realización de la prueba disminuye el riesgo de pancreatitis post-CPRE en pacientes de alto riesgo16. La manometría del esfínter de Oddi es un procedimiento ligado a un riesgo de PA incluso superior al de la CPRE. También se puede producir PA grave al realizar biopsias del páncreas con aguja fina. 410 Medicine. 2016;12(8):407-420 Pancreatitis posquirúrgica La PA puede producirse como complicación tras múltiples tipos de intervenciones quirúrgicas como cirugía de la vía biliar, gastrectomías, colectomías, esplenectomías, reparación de hernias de la línea media, cirugía de la obesidad o cirugía vascular abdominal. La pancreatitis posoperatoria implica una mortalidad más elevada que otros tipos de pancreatitis, ya que a veces existe demora en el diagnóstico porque el dolor abdminal se interpreta como el propio del posoperatorio. Después del trasplante hepático o renal, la pancreatitis puede aparecer tanto en relación con el procedimiento quirúrgico como con la terapia inmunosupresora, las infecciones oportunistas o la aparición de vasculitis. La cirugía cardiaca, incluyendo el trasplante cardiaco, también es un procedimiento de riesgo para la aparición de PA. Trastornos metabólicos Se ha observado que los pacientes con niveles elevados de triglicéridos tienen mayor tendencia a presentar PA, estando presente en una proporción que varía entre el 1,3 y el 3,8% de los pacientes dados de alta con diagnóstico de PA, mientras que en la población general menos de 1 de cada 5.000 individuos presenta concentraciones séricas de triglicéridos superiores a 1.000 mg/dl, niveles a partir de los cuales se considera que existe riesgo de desarrollar un episodios de PA. Aunque se trata de una causa poco frecuente, la hipercalcemia, independientemente de su etiología, también puede ser causa de PA. En cuanto a la obesidad, aunque su prevalencia en los pacientes con PA puede alcanzar el 57%, no se ha establecido claramente que el sobrepeso sea un factor etiológico en el desarrollo de un episodio agudo, pero sí se ha observado que la obesidad puede modificar el pronóstico hacia una mayor gravedad en la pancreatitis ya establecida, siendo la obesidad troncular la variante clínica relacionada con peor pronóstico. Pancreatitis infecciosa En muchas ocasiones resulta complejo demostrar que un microorganismo concreto sea causante de una pancreatitis, y más aún teniendo en cuenta que en muchas ocasiones no se han excluido completamente otras causas de PA. Aplicando criterios objetivos, Parenti et al. han realizado una excelente revisión bibliográfica de casos previamente descritos17. Los virus que en esta revisión cumplen criterios definitivos para que en algún caso se acepte como agente causal de la pancreatitis son el virus de la parotiditis (el que acumula la mayor evidencia), hepatitis B, citomegalovirus, varicela-zoster y herpes simple; y se considera probable pero dudosa la relación con el virus ECHO, hepatitis A, rubéola y virus de la inmunodeficiencia humana (VIH). Entre las bacterias encuentra una asociación definitiva con Mycoplasma, Legionella, Leptospira y Salmonella, y solo probable con Campylobacter y micobacterias. Entre los hongos cumple criterios definitivos Aspergillus y probables Candida albicans y el criptococo. De entre los parásitos, Toxoplasma, Cryptosporidium y PANCREATITIS AGUDA Ascaris han demostrado que pueden ser agente causal, siendo probables agentes etiológicos Fasciolia y Schistosoma mansoni. Pancreatitis en el paciente infectado por el VIH En los pacientes infectados por el VIH se pueden producir episodios de PA con relativa frecuencia, llegando a alcanzar una frecuencia del 4,6 al 14% entre los pacientes ingresados. Entre las diversas etiologías se encuentra el propio virus del VIH17, a efectos secundarios del tratamiento antirretrovírico, a infecciones oportunistas secundarias al estado inmunosupresor de los pacientes con infección por el VIH en estadios avanzados, o consecuencia directa de la diseminación de citomegalovirus, criptococo, micobacterias, criptosporidios, o Pneumocystis jiroveccii. Otra posible causa es la afectación por neoplasias asociadas al VIH tipo linfoma no Hodgkin, linfoma de Burkitt o sarcoma de Kaposi, o como efecto secundario de los tratamientos oncológicos utilizados para su tratamiento. Pancreatitis por fármacos Es poco frecuente que una PA sea consecuencia de un tratamiento farmacológico (aproximadamente un 1,5% del total de episodios de pancreatitis), representando un 0,3% del total de reacciones adversas a fármacos. Son muchísimos los fármacos que se han descrito como agentes provocadores de un episodio de PA, pero siguiendo criterios causales estrictos y minuciosos a la hora de excluir otras posibles causas puede reducirse el número. Así, entre los antimicrobianos cabría señalar metronidazol, tetraciclinas, sulfonamidas, pentamidina, estibogluconato y didanosina; entre los diuréticos, tiazidas y furosemida; entre los inmunosupresores, azatioprina y L-asparaginasa; en el campo de los antiinflamatorios, sulindac, salicilatos, sulfasalazina y 5-ASA y en el grupo misceláneo, ácido valproico, calcio, estrógenos y tamoxifen. La relación sería solo probable para ácido etacrínico, glucocorticoides, fenformina, procainamida, amiodarona metildopa, zalcitabina, 6-mercaptopurina, arabinósido-C, octreótido y con una relación etiológica posible para colestiramina, ciproheptadina, propoxifeno, opiáceos, anfetaminas, diazóxido, histamina, indometacina, salicilatos, isoniacida, rifampicina, cimetidina e inhibidores de la tirosinquinasa como sunitinib, sorafenib, pazopanib18. También se ha asociado la intoxicación por paracetamol a un riesgo incrementado de presentar PA19, pero son necesarios más estudios para confirmarlo. Pancreatitis en las colagenosis-vasculitis De entre las patologías sistémicas autoinmunes, se ha descrito pancreatitis en casos de lupus eritematoso sistémico, panarteritis nodosa, enfermedad de Kawasaki, sarcoidosis, púrpura trombótica trombocitopénica, la enfermedad de Schönlein-Henoch, en casos de hemolisis aguda masiva de diversa etiología, y en casos de hipotermia aguda. Pancreatitis traumática Los traumatismos de alta energía, ya sean contusos o penetrantes (armas de fuego, heridas punzantes), pueden dañar el páncreas, aunque esas lesiones son poco frecuentes debido a la localización retroperitoneal de la glándula. Además de las lesiones penetrantes y anteriores, los traumatismos no penetrantes de la pared posterior del abdomen pueden afectar la porción transversa del duodeno y la porción superior de la aorta abdominal, así como el páncreas, generalmente por flexión forzada de estas tres estructuras sobre la columna vertebral. Esta lesión puede conllevar ruptura del conducto pancreático y el desarrollo de ascitis pancreática. La regeneración de las lesiones del conducto pancreático puede originar cicatrización y estenosis del conducto de Wirsung, conllevando una pancreatitis obstructiva. El diagnóstico de pancreatitis de origen traumático es difícil y requiere un alto grado de sospecha clínica. Se detectan niveles elevados de amilasa y lipasa de forma persistente en un 17% y clínica de PA hasta en un 5% de los traumatismos abdominales. En cuanto a las quemaduras, cerca del 40% de los pacientes que sufren lesiones extensas desarrollan hiperamilasemia e hiperlipasemia, presentando la mayoría de ellos síntomas de PA. Pancreatitis hereditaria La pancreatitis hereditaria se define como una pancreatitis recurrente que se presenta con predisposición familiar y cuya frecuencia se sitúa entre el 0,6 y el 1,5%. Debe sospecharse cuando al menos dos miembros de la familia tienen pancreatitis de inicio en la infancia. El origen de la mayoría de las pancreatitis hereditarias reside en un trastorno autonómico dominante con penetrancia variable, en el que las mutaciones del gen catiónico del tripsinógeno son conocidas como R117 y N211. La fibrosis quística es la enfermedad hereditaria más frecuente que afecta al páncreas exocrino. La PA aparece en el 0,5% de los pacientes con fibrosis quística. Pancreatitis aguda idiopática En muchos pacientes, llegando incluso al 30% en algunas series, no se llega a esclarecer la causa que ha provocado el episodio de PA. La forma idiopática supone la tercera causa de PA en frecuencia tras la colelitiasis y el alcohol, aunque según muchos estudios, la mayor parte de las pancreatitis idiopáticas tienen su origen realmente en microlitiasis o barro biliar. Además se ha visto que los pacientes con PA idiopática sometidos a una esfinterotomía endoscópica, colecistectomía o tratamiento con ácidos biliares no presentan nueva recurrencia de PA11,12,20. Fisiopatología Cuando se presenta una PA, independientemente de su origen, se desencadena una activación intrapancreática (y por Medicine. 2016;12(8):407-420 411 ENFERMEDADES DEL APARATO DIGESTIVO (VIII) tanto inadecuada en su localización) de enzimas líticas, produciéndose una autodigestión por las propias enzimas pancreáticas. No está claramente establecida la causa por la que se produce esta activación precoz e inadecuada de enzimas líticas, aunque la presencia de contenido biliar y duodenal en los ductos pancreáticos es considerada como el más probable desencadenante inicial. Algunos agentes causales como la bilis o el alcohol inhiben la exocitosis de los gránulos de zimógenos que darán lugar a las enzimas líticas, llevando a una acumulación intracitoplásmica de los mismos. Al fusionarse dichos gránulos con lisosomas, portadores de abundantes enzimas hidrolíticas, se produce la activación de enzimas en cascada y un fenómeno de retroalimentación por lesión-activación. En este contexto, la tripsina va a actuar como catalizador enzimático en el paso de quimotripsinógeno a quimotripsina, procarboxipeptidasa a carboxipeptidasa, proelastasa a elastasa, profosfolipasa a lipasa y calicreinógeno a calicreína, con la consiguiente activación de todas estas enzimas, que comenzarán a actuar: la elastasa produce lesión vascular, favoreciendo la hemorragia; la calicreína produce dolor y aumenta la permeabilidad vascular participando activamente en la generación de shock. La fosfolipasa activada favorece el paso de lecitina a lisolecitina, que a su vez es capaz de escindir los fosfolípidos generando necrosis por coagulación. En la PA grave se produce disbalance proteasas-antiproteasas con activación del complemento y del sistema de las quininas. Además, el insulto pancreático va a provocar liberación de radicales libres de O2, activando la quimiotaxis y, por tanto, la llegada de leucocitos polimorfonucleares y de macrófagos, que van a incrementar la liberación de metabolitos oxigenados como ClOH, o de enzimas proteolíticas como la elastasa leucocitaria, incrementando aún más el proceso inflamatorio. Todo ello va a conllevar la liberación de citoquinas proinflamatorias como el factor de necrosis tumoral alfa, o las interleucinas 1, 6 y 8, metabolitos del ácido araquidónico como prostaglandinas y leucotrienos, incrementando las lesiones microcirculatorias, aumentan la permeabilidad vascular, lo que induce hemorragia, trombosis y necrosis pancreática. En condiciones normales no existe translocación bacteriana intestinal hacia la circulación sistémica debido a una barrera histológica, inmunológica y microbiológica. Sin embargo, durante una PA esta barrera se rompe, probablemente debido a la isquemia intestinal secundaria a la hipovolemia y a los shunts arteriovenosos inducidos por la PA en el intestino, rompiéndose esta barrera y pudiendo provocar una infección local o sistémica. Algunos pacientes con una PA grave presentan complicaciones sistémicas secundarias a la gran activación proinflamatoria que se produce, pudiendo llegar a producirse fiebre, insuficiencia renal, shock, complicaciones metabólicas, un síndrome de distrés respiratorio del adulto o un síndrome de respuesta inflamatoria sistémica que es relativamente frecuente. 412 Medicine. 2016;12(8):407-420 Manifestaciones clínicas La presentación clínica de la PA es similar a otros procesos abdominales agudos. El síntoma más frecuente y que debe hacernos sospechar el cuadro es el dolor abdominal, que suele estar presente desde el comienzo del cuadro, aunque su ritmo puede ser variable. Es agudo, progresivo, constante y de intensidad moderada a muy intenso. Suele localizarse en todo el hemiabdomen superior en la profundidad del epigastrio, aunque puede ser mesoepigástrico, situarse en el cuadrante superior derecho, o en algunas ocasiones en el izquierdo. En la mitad de los pacientes se produce una irradiación «en cinturón» hacia la espalda. El dolor que se produce en una PA es consecuencia de la dilatación de la cápsula pancreática debido al edema. Cerca del 80-90% de los pacientes presenta náuseas y vómitos. En ocasiones son continuos y no alivian el dolor. Pueden ser alimentarios, biliosos, seromucosos o incluso hemáticos por presentar lesiones agudas de mucosa gástrica o por desarrollar un síndrome de Mallory-Weiss. Es relativamente frecuente que el paciente presente distensión abdominal por hipomotilidad secundaria a la PA, pudiendo llegar a presentar un íleo completo, aunque más frecuentemente el íleo es solo regional. En ocasiones el paciente refiere disnea o taquipnea secundaria a la gravedad del proceso inflamatorio o al dolor. Con cierta frecuencia el paciente presenta subictericia conjuntival o incluso ictericia franca secundaria a un proceso biliar como agente etiológico de la PA. En un 25% de los casos aparece fiebre, que en las etapas iniciales puede ser secundaria al proceso inflamatorio, sin que sea necesariamente secundario a una infección. En la exploración física, casi todos los pacientes presentan dolor a la palpación en hemiabdomen superior, que habitualmente presenta reacción de defensa, pero no es habitual que presenten rigidez abdominal, más propia de peritonitis difusa. Los ruidos intestinales están disminuidos o ausentes. La posición antiálgica que suele adoptar el paciente es en reposo y flexión ventral (posición fetal). En el reconocimiento podemos encontrar equimosis en flancos (signo de Grey Turner) o en el área periumbilical (signo de Cullen) por extravasación del exudado hemorrágico y son indicativas de pancreatitis grave. En el tórax podemos auscultar hipoventilación basal secundaria a derrame pleural, estertores basales de despegamiento por hipoventilación o disminución del murmullo vesicular por atelectasias. Diagnóstico La sospecha de PA se establece por un cuadro clínico compatible: dolor brusco en abdomen superior o generalizado y antecedentes personales sugerentes (alcoholismo, colelitiasis o episodios previos). Si no se establece esta sospecha no se solicitarán las pruebas complementarias y no podrá ser diagnosticada inicialmente. Si se sospecha, la probabilidad de que se compruebe el diagnóstico es del 50%. PANCREATITIS AGUDA Pruebas de laboratorio Papel de la amilasa y la lipasa Para el diagnóstico de la PA se suelen considerar niveles de amilasemia o lipasemia superiores en dos o tres veces el límite normal. Cada laboratorio establece sus niveles de normalidad, pero una aproximación puede ser considerar cifras normales entre 0 y 137 U/l de amilasa y entre 12 y 70 U/l de lipasa. La amilasa es más utilizada, aunque la lipasa se considera la más específica21. Se han utilizado también la amilasuria, la isoamilasa pancreática y la tripsina sérica, aunque con menor impacto clínico a nivel asistencial. La amilasa forma una curva de niveles séricos en las PA, con un aumento en las primeras 24 horas que se mantiene durante 1 a 3 días y luego empieza a descender, salvo si se presentan complicaciones como la necrosis pancreática o la formación de seudoquistes. A partir del tercer día, la sensibilidad disminuye al 30%22. Es importante tener en cuenta que los valores de amilasa no se correlacionan con la gravedad ni con el pronóstico. Pueden producir falsos negativos las siguientes situaciones23: 1. Al obtener sangre pasados más de 3 días desde el comienzo del cuadro. 2. En pancreatitis crónicas reagudizadas, en donde los niveles son menores. 3. Cuando hay una hipertrigliceridemia asociada. 4. En alcohólicos con antecedentes de pancreatitis alcohólica Por otro lado también existe la posibilidad de falsos positivos en las siguientes situaciones: 1. Episodios de abdomen agudo de otro origen (perforaciones, úlceras penetradas, isquemia mesentérica, etc.). 2. Elevación de amilasas por patología de las glándulas salivares. 3. Macroamilasemia: en este caso de forma peculiar existe una elevación de la amilasemia con amilasuria normal. La sensibilidad de la lipasa se sitúa en torno a un 92%24. Otras determinaciones Son las siguientes: 1. Leucocitosis: es habitual inicialmente y no tiene por qué asociarse a infección. 2. Elevación moderada del perfil hepático (transaminasas, fosfatasa alcalina y bilirrubina): es más típica en las pancreatitis de origen biliar. 3. Suele haber hemoconcentración inicialmente, aunque en los casos de mal pronóstico es frecuente una anemización posterior rápida sin signos evidentes de sangrado. 4. Hipocalcemia y elevación de la lactatodeshidrogenasa: también son marcadores de gravedad pues se elevan cuando hay necrosis. 5. Alteración renal: es posible, sobre todo en pacientes graves, la alteración de la misma con aumento de urea y creatinina. 6. Proteína C reactiva (PCR): se utiliza como marcador de gravedad y los niveles son muy específicos de cada laboratorio. Pruebas de imagen La ecografía y la tomografía computadorizada (TC) tienen una doble función (fig. 1): ayudar a hacer el diagnóstico de pancrea- Sospecha clínica de PA Amilasa/lipasa > x3 Dudas No ¿Situaciones especiales? Descartar falsos positivos Reconsiderar diagnóstico Descartar falsos negativos Sí Ecografía y/o TC Clasificación etiológica y de gravedad Fig. 1. Proceso diagnóstico de la pancreatitis aguda. PA: pancreatitis aguda; TC: tomografía computadorizada. titis en casos con normalidad o duda de las pruebas analíticas o, en su caso, a descartarlo y establecer criterios de gravedad. Ecografía abdominal Cuando existen dudas diagnósticas, la detección de un aumento del tamaño de la glándula pancreática, un contorno irregular de la misma o la existencia de colecciones peripancreáticas son hallazgos que apoyan el diagnóstico de PA. Ante situaciones en las que ya tenemos el diagnóstico de pancreatitis es un método ideal para identificar la causa, sobre todo en el origen biliar, pues es el mejor método para diagnosticar la colelitiasis y es muy valioso en el diagnóstico de la coledocolitiasis. Tomografía computadorizada abdominal Lo ideal es realizarla siempre con contraste, pues es la forma de realzar mejor la glándula y permite identificar áreas de necrosis, lo que tiene implicaciones pronósticas y terapéuticas. Sin embargo, la limitación del mismo es la posibilidad de desencadenar o empeorar una insuficiencia renal, por lo que debemos preverlo con una adecuada hidratación. La TC puede identificar otras causas de elevación de amilasas diferentes a la PA, además de plantear diagnósticos etiológicos como la existencia de algunos tipos de neoplasias que afectan a los conductos pancreáticos (el tumor papilar mucinoso intaductal). Cuando el diagnóstico de PA ya ha sido establecido y no hay parámetros iniciales de gravedad, es un buen criterio retrasar 48-72 horas la realización de una TC, pues es un período suficiente para detectar las áreas necróticas. La sospecha de infección intraabdominal puede realizarse a partir de la aparición de gas extraintestinal. Resonancia magnética Es tan eficaz como la TC para detectar necrosis y mejor para evaluar una colelitiasis o una coledocolitiasis. Para algunos autores, la resonancia magnética (RM) de páncreas y vía biliar es una técnica tan buena como la TC en el diagnóstico Medicine. 2016;12(8):407-420 413 ENFERMEDADES DEL APARATO DIGESTIVO (VIII) de necrosis pancreática y, por tanto, en la evaluación de gravedad de la PA25, por lo que es un buen método si está disponible en Urgencias21. La TC es superior solo en la detección de burbujas de gas y calcificaciones, mientras que la RM lo es en el diagnóstico de litiasis biliar y la caracterización de las colecciones pancreáticas. Ecoendoscopia Es la técnica ideal para detectar una coledocolitiasis, tumores y complicaciones locales, pero su uso en fase aguda está algo limitado por el carácter intervencionista de la técnica y su disponibilidad. Sin embargo, en la evolución y planteamiento etiológico de las PA va afianzándose como una técnica esencial previa a la realización de CPRE urgente, sobre todo si hay dudas diagnósticas. Hoy en día es además la técnica de elección para realizar tratamientos con drenajes internos mediante punción y colocación de prótesis, en las colecciones líquidas pancreáticas. TABLA 3 Clasificación de Ranson Clasificación de Ranson Edad Clasificación de la gravedad y criterios pronósticos En el curso de una PA resulta crucial la predicción precoz de la gravedad para prevenir y reducir las posibles complicaciones e iniciar el tratamiento requerido26. Para ello se cuenta con algunos sistemas de puntuación, entre los que destacan los signos de Ranson, la puntuación APACHE-II y la escala SOFA. Escalas pronósticas Ranson En 1974 Ranson et al.27,28 describieron un primer sistema de clasificación pronóstica basado en una puntuación de gravedad obtenida mediante la valoración de 11 signos objetivos durante las primeras 48 horas de evolución (tabla 3). Las puntuaciones de Ranson altas predicen gravedad. En la pancreatitis leve la puntuación de Ranson promedio es 1,6; en la grave 2,4 y en la mortal 5,6. La presencia de más de 6 signos de Ranson pronostica alta incidencia de complicaciones como necrosis. Este sistema, al igual que sus modificaciones posteriores descritas tanto por el propio Ranson como por el grupo de trabajo de Imrie en Glasgow, presenta en el diagnóstico de gravedad una aceptable sensibilidad y especificidad (70-85%), pero su valor predictivo positivo no pasa del 50-60%. 414 Medicine. 2016;12(8):407-420 PA biliar (2) > 55 años > 70 años Leucocitos > 16.000/mm3 > 18.000/mm3 Glucemia > 200 mg/dl > 220 mg/dl LDH > 350 U/l > 400 U/l AST > 250 U/l 250 U/l > 10% > 10% > 5 mg/dl > 2 mg/dl A las 48 horas Descenso de hematocrito Aumento del BUN Calcemia pO2 Déficit de bases Secuestro estimado de líquidos Otros métodos de imagen Siempre debe realizarse una radiografía de tórax y otra de abdomen. La primera permite detectar derrames pleurales, sobre todo izquierdo, atelectasias laminares basales o distrés respiratorio (alteraciones alveolointersticiales). En la radiografía simple de abdomen pueden apreciarse calcificaciones (si existe una pancreatitis crónica), signos de íleo generalizado o local (asa centinela) y el signo del colon cortado (amputación del luminograma colónico a nivel del ángulo esplénico) por afectación de la serosa del colon. PA alcohólica (1) Al ingreso < 8 mg/dl < 8 mg/dl < 60 mm Hg – > 4 mEq/l > 5 mEq/l >6l >4l 0-2 criterios: predice enfermedad leve; > 3 criterios: predice enfermedad grave. APACHE II Los sistemas de puntuación de gravedad general de las enfermedades agudas, siendo el más utilizado hoy en día el APACHE II (Acute Physiology And Chronic Health Evaluation)29, se aplican también en la evaluación pronóstica de la PA (tabla 4). Asigna puntos a 12 variables fisiológicas, a la edad y al nivel de salud crónico y genera una puntuación total. Las puntuaciones APACHE II en el momento del ingreso y a las 48 horas ayudan a distinguir la gravedad de la PA. Aunque tiene la ventaja de poder ser aplicado desde el momento del ingreso hospitalario, así como la de su casi universal aplicación en la Unidad de Cuidados Intensivos (UCI), su eficacia en el diagnóstico de gravedad de la PA no supera la de sistemas clásicos como el de Ranson30. Puntuación por enfermedad crónica: si el paciente tiene historia de insuficiencia orgánica sistémica o está inmunocomprometido, le corresponde 5 puntos en caso de posquirúrgicos urgentes o no quirúrgicos y 2 puntos en el caso de posquirúrgicos de cirugía electiva. Definiciones: debe existir evidencia de insuficiencia orgánica o inmunocompromiso previos al ingreso hospitalario y conforme a los siguientes criterios: 1. Hígado: cirrosis (con biopsia), hipertensión portal comprobada, antecedentes de hemorragia gastrointestinal alta debida a hipertensión portal o episodios previos de fallo hepático, encefalopatía hepática o coma. 2. Cardiovascular: clase IV de la New York Heart Asociation. 3. Respiratorio: enfermedad restrictiva, obstructiva o vascular que obligue a restringir el ejercicio como, por ejemplo, incapacidad para subir escaleras o realizar tareas domésticas o hipoxia crónica probada, hipercapnia, policitemia secundaria, hipertensión pulmonar severa (> 40 mm Hg) o dependencia respiratoria. 4. Renal: hemodializados. PANCREATITIS AGUDA TABLA 4 Índice APACHE II Variables fisiológicas Rango elevado Índice de APACHE-II Rango bajo +4 +3 Tª rectal (axial + 0,5ºC) ≥ 41 39-40,9 +2 +1 0 -1 -2 -3- -4 38,5-38,9 36-38,4 34-35,9 32-33,9 30-31,9 ≤ 29,9 TA media (mm Hg) ≥ 160 130-159 110-129 70-109 50-69 Frecuencia cardíaca ≥ 180 140-179 110-139 70-109 55-69 FR (no ventilado o ventilado) ≥ 50 35-49 ≥ 500 350-499 55-60 < 55 pH arterial (preferido) ≥ 7,7 7,6-7,69 7,5-7,59 7,33-7,49 7,25-7,32 7,15-7,24 < 7,15 HCO3 sérico (venoso mEq/l) ≥ 52 41-51,9 32-40,9 22-31,9 18-21,9 15-17,9 ≤ 15 Sodio sérico (mEq/l) ≥ 180 160-179 150-154 130-149 120-129 111-119 < 110 ≥7 6-6,9 5,5-5,9 3,5-5,4 Cr sérica (mg/dl) (x 2 si FRA) ≥ 3,5 2-3,4 Hematocrito (%) ≥ 60 50-59,9 Leucocitos (total/mm3 en miles) ≥ 40 20-39,9 25-34 12-24 10-11 ≤ 49 40-54 ≤ 39 6-9 ≤5 Oxigenación: elegir a o b a. Si FiO2 > 0,5 anotar PA-aO2 200-349 < 200 > 70 b. Si FiO2 < 0,5 anotar PaO2 Potasio sérico (mEq/l) 155-159 1,5-1,9 61-70 3-3,4 2,5-2,9 < 2,5 0,6-1,4 <0,6 46-49,9 30-45,9 20-29,9 < 20 15-19,9 3-14,9 1-2,9 <1 Escala de Glasgow APS (Acute Physiology Score) total: suma de las 12 variables individuales. Puntuación por edad (< 44 = 0 p.); 45-54 = 2 p.; 55-64 = 3 p.; 65-74 = 5 p.; > 75 = 6 p.). Puntuación por enfermedad crónica (ver más abajo). Puntuación APACHE II (suma de A + B + C). Cr: creatinina sérica; FC: frencuencia cardiaca; FiO2: fracción e inspiración de oxígeno; FR: frecuencia respiratoria; FRA: fracaso renal agudo; PA-a02: presión de oxígeno arterial menos alveolar; TA: tensión arterial; Tª: temperatura. 5. Inmunocomprometidos: que el paciente haya recibido terapia que suprima la resistencia a la infección (por ejemplo, inmunosupresión, quimioterapia, radiación, tratamiento crónico o altas dosis recientes de esteroides, o que padezca una enfermedad suficientemente avanzada como por ejemplo, leucemia, linfoma, sida). Sistema SOFA El sistema SOFA (Sequential Organ Failure Assessment) surgió en una reunión de la European Society of Intensive Care Medicine en 199431, siendo posteriormente revisado en 1996 (tabla 5). El SOFA es un sistema de medición diaria de fallo orgánico múltiple que analiza 6 funciones orgánicas. Cada órgano se puntúa de 0 (normal) a 4 (el más anormal), proporcio- nando una puntuación diaria de 0 a 24 puntos, y se trata de un score simple, fiable y continuo. El sistema SOFA es un buen indicador pronóstico durante los primeros días de ingreso en la UCI. Tanto la media, como el score más alto que alcanza el paciente son predictores útiles. Independiente de la puntuación inicial, un aumento en la puntuación SOFA en las primeras 48 horas en la UCI predice una tasa de mortalidad de al menos el 50%. Parámetros biológicos con valor pronóstico Existen varios parámetros medibles cuya elevación se asocia a un peor pronóstico. Entre ellos destacan la PCR, un reac- TABLA 5 Sistema SOFA Órgano Índice SOFA 0 1 2 3 4 Respiratorio (pO2/FiO2) > 400 ≤ 400 ≤ 300 ≤ 200 con soporte respiratorio ≤ 100 con soporte respiratorio Coagulación (plaquetas/μl x 103) > 150 ≤150 ≤ 100 ≤ 50 ≤ 20 Cardiovascular Sin hipotensión TAM < 70 mm Hg Dopamina < 5 o Dopamina > 5 o epinefrina < 0,1 o norepinefrina < 0,1 Dopamina > 15 o epinefrina > 0,1 o norepinefrina > 0,1 Dobutamina (cualquier dosis) Neurológico (escala de Glasgow) Renal Creatinina (μmol/l) o diuresis 15 13-14 10-12 6-9 <6 < 110 110-170 171-299 300-440 o < 500 ml/día > 440 o < 200 ml/día SOFA: Sequential Organ Invasive Assessment; TAM: tensión arterial media. La dosis de vasopresores se expresan en μg/kg/min. Medicine. 2016;12(8):407-420 415 ENFERMEDADES DEL APARATO DIGESTIVO (VIII) tante de fase aguda producido en el hígado que se encuentra elevado en la pancreatitis grave y aún más elevado (por encima de 120 mg/l) en la pancreatitis necrotizante. Sin embargo, requiere 48 horas para encontrarse significativamente elevada. Existen otros marcadores de gravedad como la elastasa de PMN, que es capaz de pronosticar pancreatitis de gravedad o mortal con un valor predictivo positivo cercano al 80%, el péptido activador del tripsinógeno, la IL-6, la IL8, la procalcitonina y la fosfolipasa A2, pero ninguno de estos se utiliza de forma habitual. Tomografía computadorizada y colangiopancreatografía por resonancia magnética A efectos pronósticos, la clasificación más extendida basada en la TC es la de Balthazar32. Siguiendo esta clasificación, los niveles D y E se correlacionan con alta morbimortalidad (tabla 6). Complicaciones Complicaciones locales Se sospechan si existe persistencia o recurrencia de dolor abdominal, si hay un aumento de las enzimas pancreáticas o de la disfunción orgánica o si se desarrollan signos de sepsis (fiebre, leucocitosis). La inflamación puede condicionar el desarrollo de las complicaciones que enumeramos a continuación. Colecciones líquidas La PA puede complicarse tanto a nivel local como sistémico. Complicaciones sistémicas Entre las complicaciones sistémicas podemos considerar: 1. La disfunción cardiovascular debida a un aumento del gasto cardiaco se presenta como shock, taquicardia y arritmias. 2. Alteraciones pulmonares con disnea, estertores, hipoxemia y distrés respiratorio del adulto por alteración del surfactante pulmonar. 3. Insuficiencia renal con oliguria. 4. Complicaciones metabólicas: hipocalcemia, acidosis e hipoalbuminemia. 5. Alteraciones neurológicas: irritabilidad, confusión o incluso signos de lesión focal. 6. Fallo multiorgánico: es la condición más grave y se define como la afectación de 3 órganos, el respiratorio, el cardiovascular y el renal y se cuantifica como un valor de 2 o mayor en el índice original de Marshall. Su desarrollo se ve TABLA 6 Clasificación de Balthazar de la pancreatitis aguda Clasificación de Balthazar A Normal B Aumento de la glándula, colecciones intrapancreáticas de pequeño tamaño C Alguno de los hallazgos del grado B, más inflamación peripancreática, con extensión de la necrosis pancreática inferior al 30% D Alguno de los hallazgos del grado C, más una única colección extrapancreática, con extensión de la necrosis pancreática entre 30 y 50% E Alguno de los hallazgos del grado D, más extensas colecciones extrapancreáticas, o absceso pancreático, con extensión de la necrosis superior al 50% 416 favorecido por la infección de colecciones líquidas abdominales. 7. Complicaciones hemorrágicas: pueden ser secundarias a coagulación intravascular diseminada secundaria. Las hemorragias graves se deben a hemorragia retroperitoneal por erosión de vasos sanguíneos o por rotura de un pseudoquiste en la cavidad abdominal, aunque también puede haber hemorragia gástrica por úlceras de estrés o por proceso inflamatorio de vecindad en el duodeno. 8. Las más habituales son la exacerbación de comorbilidades preexistentes como enfermedad coronaria o enfermedad pulmonar obstructiva crónica. Medicine. 2016;12(8):407-420 Entre las colecciones líquidas caben las siguientes posibilidades4. Colección líquida aguda peripancreática Es precoz en pancreatitis edematosas. Homogénea, única o múltiple, sin pared definida y confinada a los planos de la fascia normal del retroperitoneo. Permanecen estériles y se resuelven espontáneamente. Seudoquiste pancreático Lesión encapsulada y con una pared inflamatoria bien definida, fuera del páncreas, con mínima necrosis o sin ella. Su maduración ocurre después de 4 semanas desde el inicio de la pancreatitis. Puede ser debida a disrupción del Wirsung. Colección necrótica aguda Contiene cantidades variables de líquido y necrosis, asociada con una pancreatitis necrótica en las primeras 4 semanas. La necrosis puede abarcar parénquima y tejidos peripancreáticos. En la TC es heterogénea, con densidad no liquida y no tiene una cápsula definida. Puede ser estéril o infectada. Necrosis encapsulada (walled-off necrosis) Colección madura encapsulada de tejido pancreático y/o peripancreático necrótico que ha desarrollado una pared de tejido inflamatorio bien definida. Ocurre a partir de las 4 semanas del inicio de la pancreatitis necrotizante. En TC es heterogénea, con densidades líquidas y no liquidas con varios lóculos, pared bien definida y completamente encapsulada. Absceso Resultado de la infección y encapsulación de colecciones. PANCREATITIS AGUDA Pseudoaneurisma Afecta generalmente a la arteria gastroduodenal o esplénica. Obstrucción colónica o duodenal Originada por compresión o infiltración inflamatoria local. Trombosis esplenoportal Por afectación inflamatoria del eje esplenoportal. Tratamiento El tratamiento de la PA tiene los siguientes objetivos: mejora del confort del paciente, curación completa del episodio, prevención y tratamiento de las complicaciones y resolución de la causa originaria. Para conseguirlo, además de una evaluación cuidadosa del paciente, deben instaurarse medidas generales de soporte, conseguir el reposo pancreático, mantener una condición nutricional apropiada, prevenir el fracaso multiorgánico y tratarlo si aparece, manejar las complicaciones locales y plantear un tratamiento etiológico apropiado. Monitorización clínica inicial Las primeras 72 horas son vitales para la evolución posterior de la PA. Debe vigilarse estrechamente la tensión arterial, frecuencia cardiaca, diuresis y función pulmonar. Es aconsejable monitorizar la saturación de oxígeno mediante pulsioximetría. Siempre se hospitalizará al paciente. Medidas generales Soporte nutricional El ayuno para conseguir el reposo de la glándula pancreática es imprescindible, mientras el paciente tiene dolor o íleo paralítico, o mientras persistan las amilasas elevadas33. Si el episodio es leve, no se debe prolongar el ayuno más de 5 días, una vez normalizada la amilasemia/lipasemia y si los pacientes están oligosintomáticos. En los casos graves, es importante realizar un soporte nutricional, siendo la nutrición enteral precoz a través de catéteres yeyunales mejor que la nutrición parenteral34. La reintroducción de la nutrición oral pasará por la desaparición del dolor abdominal espontáneo y la palpación, amilasemia normal y resolución clínica de las complicaciones mayores. Se utiliza la llamada dieta por fases, iniciándose con líquidos acalóricos a un ritmo de 100-300 ml cada 4 horas, las primeras 24 horas. Si la tolerancia es buena, se pueden mantener el segundo día los mismos volúmenes ya con nutrientes, para pasar en los siguientes 4 días progresivamente a los alimen- tos sólidos. El contenido calórico inicial no debería sobrepasar las 150 Kcal por toma, hasta llegar a cifras entre 500 y 700 Kcal por comida, al final de la reintroducción. La contribución calórica de los hidratos de carbono debería ser siempre superior al 50% del aporte total. Sonda nasogástrica No tiene valor terapéutico por sí misma si no hay un íleo asociado con vómitos35. En pacientes graves muy sintomáticos, al tener que tratar con nutrición enteral por vía yeyunal, es útil el uso de sondas nasoyeyunales que además permiten realizar aspiración gástrica. La nutrición enteral es capaz de disminuir la intensidad de la respuesta inflamatoria, con reducción de complicaciones y sepsis36,37. Hidratación parenteral Las necesidades de hidratación difieren según la gravedad del cuadro y momento evolutivo38. Con frecuencia se precisan 3,5-6 litros de suero al día e incluso en casos leves debe tenerse especial atención de mantener una hidratación adecuada, ya que es el único aporte de los pacientes que mantienen condiciones de ayunas. En casos de déficit grave, debe iniciarse con perfusión de 500-100 ml/hora, pues estos pacientes tienen tendencia a presentar con un tercer espacio y síntomas de shock, siendo necesario habitualmente su uso con control de presión venosa central. Oxigenoterapia Si la saturación de oxígeno es menor del 95%, debe medirse la PaO2. La hipoxemia debe tratarse con oxigenoterapia intranasal o con mascarilla, pero debe valorarse la necesidad de ventilación asistida. Analgesia No hay una pauta claramente superior a otra, aunque se debe buscar el control continuo del dolor evitando la analgesia a demanda. Con frecuencia se asocian diferentes fármacos. Los fármacos más usados en orden de instauración según la intensidad del dolor serían: 1. Metamizol magnésico: puede ser usado en el dolor leve o moderado en dosis de 2 g en venoclisis lenta cada 6 horas. 2. Ketorolaco, en dosis de 30 mg por vía intravenosa también cada 6 horas. 3. Tramadol ClH, 100 mg por vía intravenosa cada 6 horas. 4. Clorhidrato de morfina: teóricamente puede producir un espasmo del esfínter de Oddi que podría empeorar el cuadro, pero este hecho no se ha podido demostrar en ningún estudio bien diseñado. 5. En casos graves puede plantearse la analgesia epidural. Alteraciones metabólicas La hiperglucemia puede precisar insulinoterapia de forma temporal, sobre todo si se instaura nutrición parenteral. La hipocalcemia suele ser secundaria a la hipoalbuminemia y solo debe corregirse si hay signos de tetania. A veces se asocia a depleción de magnesio. La PA hipertrigliceridémica puede tratarse con plasmaféresis si es persistente y con niveles de triglicéridos superiores a 1.000 mg/dl. Medicine. 2016;12(8):407-420 417 ENFERMEDADES DEL APARATO DIGESTIVO (VIII) Prevención del tromboembolismo pulmonar La administración de heparina de bajo peso molecular debe instaurarse de forma precoz. Tratamiento farmacológico específico Se han intentado diferentes pautas sin éxito, incluyendo fármacos antiproteasas (aprotina y gabexato-mesilato), inhibidores de la secreción pancreática (somatostatina y octreótido) y antagonistas de la respuesta inflamatoria sistémica (esteroides, lexipafant). Ingreso en la Unidad de Cuidados Intensivos Todos los pacientes con PA que evolucionan a fallo orgánico persistente deben se ingresados en la UCI. Las indicaciones específicas son las siguientes: hipoxemia persistente, hipotensión e insuficiencia renal refractaria a fluidos intravenosos, requerimientos perfusionales elevados (especialmente en ancianos y cardiópatas) y disnea. Las situaciones de hipotensión y rehidratación incorrecta pueden dar lugar a necrosis tubular renal e insuficiencia renal de mal pronóstico, por lo que el control de la reposición debe ser muy ajustado, y a las más sencillas medidas de sonda urinaria y vigilancia estricta de la diuresis se suma la implantación de vía central, con control de presiones, llegando si es preciso a la ubicación de un catéter de Swan-Ganz, el uso de fármacos vasoactivos, la ventilación mecánica y la diálisis. Colangiopancreatografía retrógrada endoscópica La indicación de CPRE urgente es la colangitis grave (dolor en hipocondrio derecho, fiebre en agujas e ictericia)42 con signos de shock y disfunción multiorgánica a pesar del tratamiento con antibioticoterapia y medidas de soporte hidroelectrolítico en unidades especializadas (UCI, reanimación, etc.). Se considera CPRE urgente a la no demorable en un plazo superior a 24 horas y de cuya no actuación se deriva una evolución rápidamente fatal para el enfermo. La CPRE permite realizar una esfinterotomía endoscópica y extraerlos de cálculos coledocales. Ante el fracaso de la CPRE una alternativa previa a la cirugía sería el uso de ecoendoscopia o radiología intervencionista. La colangitis leve o moderada no es indicación de CPRE urgente ni aun pudiendo realizarla en las primeras 24 horas, ya que la mayoría mejora con tratamiento antibiótico. En casos de PA biliar grave sin colangitis, la indicación es discutible43. Tratamiento etiológico Antes del alta debe identificarse la etiología. Si el paciente tiene una colelitiasis, debe colecistectomizarse, preferentemente antes del alta hospitalaria. Tratamiento de las complicaciones Se resume en la figura 2. Antibioterapia profiláctica Con necrosis de más del 50%, la mortalidad se aproxima también al 50%. Sin embargo, no hay pruebas suficientes para recomendar antibioterapia profiláctica en todos los casos de PA grave o necrótica39,40. La sospecha de necrosis pancreática infectada se basa en la presencia de fallo orgánico, fiebre y leucocitosis, y algunos autores recomiendan en este caso antibioterapia de amplio espectro con un carbapenem (imipenem, 0,5 g intravenoso cada 8 horas o meropenem, 1 g intravenoso cada 8 horas) durante 7 días cuando hay necrosis de más de un 30% de la glándula (asociado a fluconazol como profilaxis de sobreinfección fúngica). Si no hay respuesta, la técnica estándar es la punción de la necrosis dirigida por una técnica de imagen (TC o ecoendoscopia) y hacer un examen de Gram con cultivo de la muestra. Si es inicialmente negativo y persiste el cuadro clínico sugerente, la punción debe repetirse cada 5-7 días. En espera del cultivo, puede iniciarse (o seguir si la llevaba), la antibioterapia durante un total de 2 a 4 semanas. Si el Gram pone de manifiesto cocos grampositivos, una alternativa razonable es vancomicina. Frente a datos iniciales esperanzadores, no existen datos claros del beneficio en seres humanos de la decontaminación intestinal41. 418 Medicine. 2016;12(8):407-420 Tratamiento de la necrosis pancreática infectada Es indicación de tratamiento quirúrgico si el paciente presenta signos de sepsis. Sin embargo, si la situación clínica es estable, puede mantenerse una actitud conservadora, ajustando el tratamiento antibiótico a la sensibilidad del germen obtenido en el cultivo. La técnica a emplear, tanto en la necrosis pancreática infectada como en la estéril depende de las disponibilidades de cada centro. Las técnicas mínimamente invasivas de drenaje ecoendoscópico44, retroperitoneal45 o percutáneo están ocupando un lugar inicial previo a la cirugía, incluyendo la posibilidad de realizar necrosectomía. Tratamiento de la necrosis pancreática estéril Debe ser tratada de forma conservadora. Algunos enfermos presentan dolor e intolerancia digestiva por la presencia de dicha necrosis. En este caso, debe plantearse el tratamiento quirúrgico lo más tarde posible, a fin de que la necrosis esté bien delimitada, valorando la posibilidad de drenajes ecoendoscópicos46. Debe reservarse el tratamiento quirúrgico para casos seleccionados con disfunción multiorgánica y/o empeoramiento clínico, a pesar de tratamiento médico intensivo (elevación persistente del SOFA superior a 7, aumento del APACHE-II mayor de 16, aumento progresivo de la PCR, dependencia de vasopresores, procalcitonina persistentemente elevada). PANCREATITIS AGUDA el desarrollo de prótesis digestivas de colocación endoscópica con capacidad para ser extraídas se abre un campo de terapia menos invasiva. Pancreatitis aguda Colecciones líquidas < 4 semanas Asintomática Actitud expectante > 4 semanas Sintomática Trombosis esplenoportal Precisa la anticoagulación precoz. Asintomática < 6 cm Sintomática Drenaje ecoendoscópico o percutáneo Actitud expectante Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Con restos necróticos Sin restos necróticos Cirugía Necrosectomía ecoendoscópica o mixta Comunicación con Wirsung Drenaje ecoendoscópico endoscópico o percutáneo (CPRE) Drenaje ecoendoscópico o percutáneo No solucionado Fig. 2. Tratamiento de las complicaciones de la pancreatitis aguda. Abscesos Son una indicación quirúrgica clásica, aunque se han publicado algunos trabajos del tratamiento por endoscopia de la PA con éxito. Seudoaneurisma El tratamiento de elección es la radiología intervencionista, con embolización de la lesión. Disfunción de salida gástrica De forma clásica, la obstrucción duodenal era una indicación quirúrgica, con realización de gastroenteroanastomosis. Con Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales. Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes. Cirugía Pseudoquistes No tienen indicación quirúrgica las lesiones pequeñas (menores de 6 cm), no infectadas y asintomáticas. El pseudoquiste solo debe ser drenado cuando se haya consolidado adecuadamente, lo que no se produce hasta pasadas varias semanas desde el inicio del cuadro (en general 4 semanas). Si se decide drenar un pseudoquiste, las alternativas endoscópicas son la vía transgástrica y transduodenal (ambas con ecoendoscopia) y la vía transpapilar por CPRE, indicada cuando existe comunicación entre el pseudoquiste y el Wirsung. Responsabilidades éticas Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes. Bibliografía t Importante tt Muy importante ✔ Metaanálisis ✔ Artículo de revisión Ensayo clínico controlado ✔ ✔ Guía de práctica clínica ✔ Epidemiología 1. Teerenhovi O, Nordback I, Isolauri J. Ranson signs and necrosis of the pancreas in acute necrotising pancreatitis. Acta Chir Scand. 1988;154:3858. Bradley EL 3rd. A clinically based classification system for 2. acute pancreatitis. Summary of the International Symposium on Acute Pancreatitis, Atlanta, Ga, September 11 through 13, 1992. Arch Surg. 1993;128:586-90. 3. Besselink MG, van Snatvoort HC, Wittemen BJ, Gooszen HG; Dutch Acute Pancreatitis Study Group. Management of severe acute pancreatitis: it´s all about timing. Curr Opin Crit Care. 2007;13(2):200-6. Banks PA, Bolle LT, Dervenis C, Gooszen HG, Johnson CD, 4. Sarr MG, et al. Acute Pancreatitis Classification Working Group. Classification of acute pancreatitis—2012: revision of the Atlanta classification and definitions by international consensus. Gut. 2013;62:102-11. 5. De Dombal FT. Acute abdominal pain: an O.M.G.E. survey. Scand J Gastroenterol. 1979;56Suppl14:29-43. tt tt Medicine. 2016;12(8):407-420 419 ENFERMEDADES DEL APARATO DIGESTIVO (VIII) 6. Wilson C, Imrie CW. Deaths from acute pancreatitis: why do we miss the ✔ diagnosis so frequently? Int J Pancreatol. 1988;3:273-81. 29. Knaus WA, Draper EA, Wagner DP, Zimmerman JE. APACHE II: a seve✔ rity of disease classification system. Crit Care Med. 1985;13(10): 7. Uretsky G, Goldschmiedt M, James K. Childhood pancreatitis. Am Fam Physician. 1999;59:2507-12. 8. Moreau JA, Zinsmeister AR, Melton LJ 3rd, DiMagno EP. Gallstone pancreatitis and the effect of cholecystectomy: a population-based cohort study. Mayo Clin Proc. 1988;63:466-73. 9. Martínez de Pancorbo C, Carballo F, Horcajo P, Aldeguer M, de la Villa I, Nieto E, et al. Prevalence and associated factors for gallstone disease: results of a population survey in Spain. J Clin Epidemiol. 1997;50:134755. 10. Ko CW, Sekijima JH, Lee SP. Biliary sludge. Ann Intern Med. 1999;130: 301-11. 11. Ros E, Navarro S, Bru C, García-Puges A, Valderrama R. Occult microlithiasis in ‘idiopathic’ acute pancreatitis: prevention of relapses by cholecystectomy or ursodeoxycholic acid therapy. Gastroenterology. 1991;101:1701-9. 12. Lee SP, Nicholls JF, Park HZ. Biliary sludge as a cause of acute pancreatitis. N Engl J Med. 1992;326:589-93. 13. Shaffer EA. Gallbladder sludge: what is its clinical significance? Curr Gastroenterol Rep. 2001;3:166-73. 14. Lehman GA, Sherman S. Pancreas divisum. Diagnosis, clinical significance, and management alternatives. Gastrointest Endosc Clin N Am. 1995;5:145-70. 15. Ammann RW, Heitz PU, Kloppel G. Course of alcoholic chronic pancreatitis: a prospective clinicomorphological long-term study. Gastroenterology. 1996;111:224-31. 16. Lin-Lee Wong, Her-Hsin Tsai, Andrade-Dávila VF, Chávez-Tostado M, Dávalos-Cobián C, García-Correa J, et al. BMC Gastroenterol. 2015 Jul 21;15:85. 17. Parenti DM, Steinberg W, Kang P. Infectious causes of acute pancreatitis. Pancreas. 1996;13:356-7. 18. Kawakubo K, Hata H, Kawakami H, Kuwatani M, Kawahata S, Kubo K, el al. Pazopanib-Induced Severe Acute Pancreatitis. Case Rep Oncol. 2015;8(2):356-8. 19. Chen SJ, Lin CS, Hsu CW, Lin CL, Kao CH. Acetaminophen poisoning and risk of acute pancreatitis: a population-based cohort study.Medicine (Baltimore). 2015;94(29):e1195. 20. Testoni PA, Caporuscio S, Bagnolo F, Lella F. Idiopathic recurrent pancreatitis: long-term results after ERCP, endoscopic sphincterotomy, or ursodeoxycholic acid treatment. Am J Gastroenterol. 2000;95:1702-7. 21. Di Magno E, Chari S. Pancreatitis aguda. En: Feldman M, Friedman LS, Brandt JM, editors. Sleisenger and Fordtran´s Gastroinestinal and liver diseases. 7ª ed. Philadelphia: Elsevier; 2002. 22. Ausina V, Ballús C, Montserrat E, et al. En: Rozman C, Cardellach F, editores. Farreras-Rozman. Medicina interna. vol. 2. Madrid: Elsevier; 2004. p. 257-65. 23. Fauci A, Braunwald E, Isselbacher K. Principios de medicina interna de Harrison. vol. 2. Madrid: Mac Graw-Hill-Interamericana de España; 2003. p. 2089-97. 24. Domínguez-Muñoz JE. Diagnosis of acute pancreatitis: any news or still amylase? En: Buchler M, Uhl W, Friess H, Malfertheiner P, editors. Acute pancreatitis: novel concepts in biology and therapy. London: Blackwell Science; 1999. p. 171-80. 25. Ward J, Chalmers AG, Guthrie AJ, Larvin M, Robinson PJ. T2-weighted and dynamic enhanced MRI in acute pancreatitis: comparison with contrast enhanced CT. Clin Radiol. 1997;52:109-14. 26. Tenner S, Baillie J, DeWitt J, Vege SS; American College of Gastroenterology. American College of Gastroenterology guideline: management of acute pancreatitis. Am J Gastroenterol. 2013;108(9):1400-15. 27. Ranson JHC, Rifkind KM, Roses DF, Fink SD, Eng K, Spencer FC. Prognostics signs and the role of operative management in acute pancreatitis. Surg Gynecol Obstet. 1974;139:69-81. 28. Ranson JHC. The timing of biliary surgery in acute pancreatitis. Ann Surg. 1979;189:654-6. 30. Domínguez-Muñoz JE, Carballo F, García MJ, de Diego JM, Campos R, ✔ Yanguela J, et al. Evaluation of the clinical usefulness of APACHE II and 818-29. SAPS systems in the initial prognostic classification of acute pancreatitis: a multicenter study. Pancreas. 1993;8:682-6. Jones AE, Trzeciak S, Kline JA. The Sequential Organ Failure Assessment score for predicting outcome in patients with severe sepsis and evidence of hypoperfusion at the time of emergency department presentation. Crit Care Med. 2009;37(5):1649-54. Balthazar EJ, Robinson DL, Megibow AJ, Ranson JH. Acute pancreatitis: value of CT in establishing prognosis. Radiology. 1990;174:331-6. Mirtallo JM, Forbes A, McClave SA, Jensen GL, Waitzberg DL, Davies AR; International Consensus Guideline Committee Pancreatitis Task Force. International consensus guidelines for nutrition therapy in pancreatitis. JPEN J Parenter Enteral Nutr. 2012;36(3):284-91. Meier R, Ockenga J, Pertkiewicz M, Pap M, Milinic N, Macfie J, et al. ESPEN Guidelines on enteral nutrition: pancreas. Clin Nutr. 2006;25:275-84. Sarr MG, Sanfey H, Cameron JL. Prospective, randomized trial of nasogastric suction in patients with acute pancreatitis. Surgery. 1986;100:5004. Kalfarentzos F, Kehagias J, Mead N, Kokkinis K, Gogos CA. Enteral nutrition is superior to parenteral nutrition in severe acute pancreatitis: results of a randomized prospective trial. Br J Surg. 1997;84:1665-9. McClave SA, Chang WK, Dhaliwal R, Hayland DK. Nutrition support in acute pancreatitis: a systematic review of the literature. J Parenter Enteral Nutr. 2006;30:143-56. Working Group IAP/APA Acute Pancreatitis Guidelines. IAP/ APA evidence-based guidelines for the management of acute pancreatitis. Pancreatology. 2013;13(4)Suppl2:e1-15. Villatoro E, Bassi C, Larvin M. Tratamiento antibiótico para la profilaxis de la infección de la necrosis pancreática en la pancreatitis aguda. (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. Jafri NS, Mahid SS, Idstein S, Hornung CA, Galadiuk S. Antibiotic prophylaxis is not protective in severe acute pancreatitis: a systematic review and meta-analysis. Am J Surgery. 2009;197:80613. Tiong L, Jalleh R, Barreto SG. Selective digestive decontamination in severe acute pancreatitis. Astrocyte. 2014;1:93-9. Petrov MS, van Santvoort HC, Besselink MGH, van der Heijden GJMG, van Erpecum KJ, Gooszen HG. Early endoscopic retrograde cholanagiopancreatography versus conservative management in acute biliary pancreatitis without cholangitis. A Meta-analysis of randomized trials. Ann Surg. 2008;247:250-7. van Geenen EJ, van Santvoort HC, Besselink MG, van der Peet DL, van Erpecum KJ, Fockens P, et al. Lack of consensus on the role of endoscopic retrograde cholangiography in acute biliary pancreatitis in published meta-analyses and guidelines: a systematic review. Pancreas. 2013;42(5):774-80. Gardner TB. Endoscopic management of necrotizing pancreatitis. Gastrointest Endosc. 2012;76(6):1214-23. Castellanos G, Piñero A, Serrano A, Llamas C, Fuster M, Fernández JA, et al. Traslumbar retroperitoneal endoscopy. An alternativ in the followup and management of drained infected pancreatic necrosis. Arch Surg. 2005;140:952-5. Freeman ML, Werner J, van Santvoort HC, Baron TH, Besselink MG, Windsor JA, et al; and An International Multidisciplinary Panel of Speakers and Moderators. Interventions for Necrotizing Pancreatitis: Summary of a Multidisciplinary Consensus Conference. Pancreas. 2012;41(8):1176-94. ✔ 31. ✔ ✔ ✔t 32. tt ✔ ✔ ✔ ✔ 33. ✔ 34. ✔ 35. ✔ ✔t 36. ✔ ✔ 37. tt ✔ ✔ ✔ 38. tt ✔ ✔ ✔ ✔ tt ✔t ✔ tt ✔ ✔ ✔ ✔ tt ✔ 420 Medicine. 2016;12(8):407-420 39. ✔ 40. tt ✔ 41. t ✔ 42. ✔ 43. tt ✔ 44. ✔ 45. ✔ 46. tt ✔