Síntesis de p-nitroanilina: Reporte de Laboratorio de Química Orgánica
Anuncio

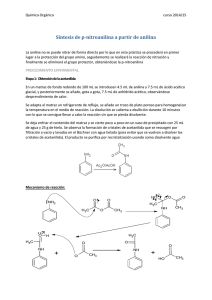
Universidad Nacional Autónoma de México Facultad De Estudios Superiores Cuautitlán Laboratorio De Química Orgánica II INGENIERÍA QUÍMICA Reporte 5 “p-nitroanilina” Profesores: Mtro. Rubén Sanabria Tzintzun Q. Aurora Karina Franco Francisco EQUIPO #7 Alumnos: González Vargas Yeremi Adonay Mendiola Román Hugo César Mendoza Linares Gaspar Fecha: 10/10/2014 Objetivos: Efectuar la reacción de nitración en el anillo de una amina aromática protegida como acetil derivado. Eliminar la protección por hidrólisis alcalina. Introducción Las aminas son sustancias orgánicas que se caracterizan por contener el grupo amino (NH2). Estas sustancias se clasifican en función de los hidrógenos sustituidos que tengan, siendo primarias aquellas que tengan un solo hidrógeno sustituido, secundarias las que tengan dos y terciarias tres. Estos sustituyentes pueden ser tanto de naturaleza alifática como aromática. Un gran número de compuestos médica y biológicamente importantes son aminas. Algunos ejemplos pueden ser la adrenalina, las anfetaminas, quinina, histamina, nicotina...Muchos de estos compuestos ejercen poderosos efectos fisiológicos y psicológicos. La serotonina, por ejemplo, es un compuesto muy interesante, ya que, al parecer, mantiene estables los procesos mentales. Otro uso industrial importante de lazarinas es en la industria del nylon, donde uno de sus componentes es hexametilendiamina. Diversas aminas aromáticas se emplean para preparar tintes orgánicos de gran aplicación en la sociedad industrial. En concreto, nuestro producto objeto de síntesis es bastante tóxico, ya que se puede absorber por la piel. Sus usos son como intermedio de colorantes, especialmente rojo de p-nitroanilina, intermedio para antioxidantes, inhibidores de goma de gasolina, inhibidor de corrosión. La preparación de la p -nitroanilina no puede llevarse a cabo por reacción de nitración directa de anilina (una reacción de sustitución electrófilo aromática), debido a que la gran reactividad de la anilina (inherente a la presencia del grupo –NH2) determina la formación, junto con el producto deseado, de diversos productos de oxidación y de sustitución en posiciones diferentes a la deseada. Estos problemas se evitan modificando la naturaleza del sustituyente de anillo aromático. Así, la transformación del grupo amino en un grupo acetamido, realizada mediante una reacción de N-acilación (una reacción de protección del grupo amino), conduce a la acetanilida (menos reactiva que la anilina aun cuando es también un sustrato aromático activado frente a una reacción de sustitución electrófilica aromática), la cual, por nitración, origina con buen rendimiento, el producto de sustitución en la posición deseada: p-nitroacetanilida. La desprotección del grupo amino (es decir, la transformación del grupo acetamido en grupo amino) se lleva a cabo por hidrólisis en medio ácido conduciendo finalmente a la p-nitroanilina. Diagrama ecológico Mecanismo de reacción Nitración Posteriormente con acetanilida Resultados Teórico Punto de fusión (°C) Masa (gramos) apariencia 146 1.3782 Polvo o cristales entre amarillo y naranja. Experimental 142 1.1 Polvo o cristales entre amarillo y naranja. Rendimiento Análisis de resultados Para proteger grupos funcionales en aminas primarias o secundarias es utilizada comúnmente la acetilación ya que las aminas acetiladas son menos susceptibles a la oxidación, menos reactivas en reacciones de sustituciones aromáticas y menos propensas a participar en muchas de las reacciones típicas de aminas libres, porque son menos básicas. El grupo amino puede ser regenerado fácilmente por hidrólisis en medio ácido o en básico. Conclusiones La nitración de la acetanilida es una reacción de sustitución electrófilica, donde se obtienen dos compuestos que tienen la misma formulamolecular pero que los sustituyentes varían de posición. Cuando se nitro la acetanilida se obtuvo la p-nitroacetanilida (color blanco) y el ortonitroacetanilida (color amarillo), ya que nuestroprecipitado fue de color amarillo claro. Para tener solo paranitroacetanilida en nuestro precipitado leagregamos alcohol etílico que arrastra al o-nitroacetanilida, debido a que éste es soluble en el alcohol, mas no lo es la p-nitroacetanilida. El rendimiento de la reacción como se observa no es del 100% debido a que no solo se forma p-nitroacetanilida. Existen sustancias activantes y desactivaste en una reacción, por eso obtenemos para u orto nitroacetanilida. Bibliografía Carey, Francis A. 1999. Química Orgánica. Mc. Graw-Hill Interamericana, 3ª Edición, p. 821. México. Morrison, R. T., Boyd, R. N. 1990. Química Orgánica. Pearson Addison Wesley, 5ª Edición, p. 951. México. Mc Murry, J. 2008. Química Orgánica. Thomson Paraninfo, 7ª Edición, p. 551-552. México. Solomons Graham, T. W. 2002. Química Orgánica. Editorial Limusa S. A. de C.V. 2ª Edición, p. 816. México. Wade, L. 2004. Química Orgánica. Pearson Prentice Hall, 5ª edición, p. 860. Madrid.